Abstract
Die Verwendung von Octenidin in der Darreichungsform als Lutschtablette wurde erst 2004 patentiert. Das antivirale, viruzide und vor allem antimikrobielle Wirkungsspektrum der Substanz ist vergleichsweise breit und für die Substanz in Monopräparaten noch wenig untersucht. Die bislang vorliegenden Daten unterstreichen jedoch die vielfältigen Möglichkeiten der prophylaktischen und therapeutischen Anwendung der Substanz und legen die Applikation als flankierende Maßnahme z. B. bei der Dekolonisation Antibiotika-resistenter (MRSA) Carrier nahe.
Octenidin gehört zu den Pyridinverbindungen (Abb. 1 ). Wegen ihres breiten Wirksamkeitsprofils und ihrer guten Verträglichkeit wird die Substanz bereits seit zwei Jahrzehnten zur Haut-, Schleimhaut- und Wundantiseptik angewendet. Octenidin dient unter anderem zur antiseptischen Behandlung von Verletzungen, oberflächlichen Wunden und zur Nahtversorgung. Als präoperatives Antiseptikum finden Octenidin-basierte Zubereitungen vor Operationen im Urogenitalbereich und im Rektalbereich, vor der Katheterisierung der Harnröhre und im Rahmen gynäkologischer Untersuchungen Anwendung [8], [10], [11], [13], [17].
Abb. 1.

Octenidindihydrochlorid (Octenidin).
Octenidin wird meist nicht allein, sondern in Kombination mit weiteren Wirkstoffen angewendet, oft mit Phenoxyethanol oder zusammen mit n-Propanol und iso-Propanol. Dies liegt vor allem auch daran, dass die Substanz allein nicht in Wasser löslich und deshalb auf ein Lösungsmittel oder einen Lösungsvermittler angewiesen ist. Dem entsprechend beziehen sich viele der bislang verfügbaren Daten zur Wirksamkeit auf Wirkstoffkombinationen und so gut wie nie auf den Wirkstoff allein.
Octenidin-basierte antiseptische Präparate werden in aller Regel als Flüssigkeit oder Gel (Wundgel) angewendet. Die Zusammensetzung der Präparate richtet sich dabei vor allem nach der Art ihrer Anwendung. Für die Behandlung von Hautoberflächen sind Kombinationen mit weiteren Wirkstoffen wie vor allem Alkohole vorteilhaft, für die Behandlung von Wunden eignen sich dagegen besonders Kombinationen mit Phenoxyethanol. Findet Octenidin jedoch in Schleimhautantiseptika Anwendung, so bieten sich Zubereitungen ohne weitere Wirkstoffe an. Dies gilt vor allem für den oralen Bereich. Bei flüssigen Darreichungsformen ist dies jedoch aus den oben genannten Gründen nicht möglich.
Im Jahre 2004 wurde daher die Verwendung von Octenidin als Lutschtablette zur Behandlung von Erkältungskrankheiten als Patent angemeldet [14]. In dieser Form kann die Substanz zum Beispiel 0,1%ig und mit Hilfsstoffen wie Geschmacksverbesserern, Süßstoffen und Säuerungsmitteln (Weinsäure) konfektioniert und ohne zusätzliche antiseptische Wirkstoffe im Mund angewendet werden. Bei bestimmungsgemäßem Gebrauch ist dies mit Kontaktzeiten zwischen 8 Minuten und mehr als 30 Minuten verbunden, die sich aus dem langsamen Zergehen einer Lutschtablette im Mund ergeben.
Octenidin wird nicht über die Haut oder Schleimhäute aufgenommen. Systemische Nebenwirkungen sind daher nicht zu erwarten. Die Resorptionsrate bei oraler Anwendung wird zwischen 0% bis maximal 6% angegeben [6].
Einige Anwendungen sind bei Octenidin jedoch kontraindiziert: Die Substanz darf zum Beispiel nicht in Augen gelangen. Gleiches gilt für die Behandlung tiefer Wunden, von Hohlorganen und intraperitonealen Spülungen. Auch das Auftragen auf mit Povidon-Iod vorbehandelten Hautoberflächen oder gar eine Kombination beider Antiseptika ist nicht gestattet [10].
Octenidin-basierte Antiseptika und deren Anwendungsprofile
Das Wirksamkeitsprofil der unterschiedlichen Antiseptika, und damit auch derjenigen von Octenidin, wird von der Art der Anwendung vorgegeben und ist für die jeweiligen Präparate in Tabelle 1 aufgeführt. Für Haut-, Schleimhaut- und Wundantiseptika muss grundsätzlich eine gute bakterizide Wirksamkeit sichergestellt sein. Eine tuberkulozide oder gar mykobakterizide Wirksamkeit ist dagegen in aller Regel nicht erforderlich. Gleiches gilt für eine breite fungizide Wirksamkeit insbesondere gegen Schimmelpilze. Eine Wirksamkeit gegen bakterielle Sporen wäre bisweilen nützlich (siehe Tabelle 1), sie ist bislang jedoch mit keinem Präparat realisierbar. Dies gilt ausnahmslos für alle antiseptischen Wirkstoffe und Zubereitungen.
Tabelle 1.
Anforderungsprofil an Antiseptika.
| Wirkungsspektrum | Hautantiseptikum |
Schleimhautantiseptikum |
Wundantiseptikum | ||
|---|---|---|---|---|---|
| Präoperativ oder therapeutisch | Postoperativ | Genitalbereich, präoperativ oder therapeutisch | Oralbereich, präoperativ oder therapeutisch | ||
| Bakterizidie | X | X | X | X | X |
| Tuberkulozidie | - | - | - | X* | - |
| Mykobakterizidie | - | - | - | (x) | - |
| Sporizidie | (-) | - | - | - | (-) |
| Fungizidie* | - | - | - | - | - |
| Levurozidie | X | X | X | X | - |
| Wirksamkeit gegen Dermatophyten | X* | - | X* | - | - |
| Begrenzte Viruzidie (gegen behüllte Viren) | X* | X* | X* | X* | (X) |
| Viruzidie gegen nackte und behüllte Viren | (X) | (X) | X* | X* | - |
= einschl. Schimmelpilze (A. brasiliensis / A. niger)
x = Basisanforderung
- = meist nicht erforderlich
x* = Wünschenswert
(x) = Nur in Ausnahmefällen erforderlich
(-) = Wünschenswert aber schwer realisierbar
Die Wirksamkeit gegen Hefen (levurozide Wirkung) gehört dagegen zum Standardprofil der meisten Präparategruppen [7] und wäre allenfalls bei Wundantiseptika zur Versorgung akuter Verletzungen verzichtbar, sofern diese nicht zur Katheterpflege Verwendung finden. Dermatophyten sind dagegen keine Seltenheit und stellen mit Trichophyton rubrum und Trichophyton mentagrophytes wichtige Erreger von Hautmykosen, einschließlich Fußpilz dar. Eine generelle Wirksamkeit von Hautantiseptika gegen Dermatophyten ist daher keine überflüssige Forderung. Hiervon sind lediglich Schleimhaut- und Wundantiseptika auszunehmen weil typische Dermatophyten keine Schleimhautmykosen verursachen. Die begrenzte Viruzidie gegen behüllte Viren ist überall dort von Bedeutung, wo man entweder mit exogenen Kontaminationen entsprechender Körperoberflächen oder Wunden zu rechnen hat, oder wenn es um die Minimierung der Ausstreuung von Viren über Schleimhautsekrete geht. Dies kann vor allem bei persistent infizierten Patienten vorkommen, insbesondere bei Trägen von HIV und HBV.
Anwendungsprofil Octenidin-basierter Antiseptika im Oralbereich
Das Wirkungsprofil einer Octenidin-basierten Lutschtablette wird von den im Oralbereich vorkommenden Erregern unter Berücksichtigung der speziellen Eigenarten dieser Erreger vorgegeben (s. auch Abb. 2 und Abb. 3 ). Grundsätzlich ist eine bakterizide, levurozide und begrenzt viruzide Wirksamkeit gegen behüllte Viren erforderlich, die insbesondere bei Viren um einige spezielle nackte Virusarten erweitert werden kann.
Abb. 2.

Residente und transiente Kolonisation der Haut / Schleimhäute durch Mikroorganismen. Die Zielrichtung einer bakteriellen Infektion erfolgt transkutan aus dem Umfeld in primär steriles Gewebe und kann durch Antiseptika wirksam bekämpft werden. Hefen und Dermatophyten finden sich dagegen lokal auf der Haut und vermögen in aller Regel nicht in tieferes Gewebe einzudringen.
Abb. 3.

Kontamination der Haut / Schleimhäute durch Viren. Die Zielrichtung einer Infektion erfolgt bei vielen Viren aus dem endogenen Bereich nach außen und kann durch Antiseptika oft nicht wirksam bekämpft werden. Eine Ausnahme bilden dagegen die Schleimhautoberflächen der Atemwege als Ziel exogener respiratorischer Viren.
Tabelle 2 gibt eine Übersicht der hier wichtigen Viren. Gelegentlich werden Schleimhautantiseptika auch als HBV-, HIV- oder HCV-wirksam ausgewiesen. Dies ist allerdings wenig sinnvoll, da derartige Viren bei keinem Patienten durch die Anwendung von Antiseptika nachhaltig bekämpft werden können und weil das Erregerreservoir primär im Blut und nicht auf Haut- und Schleimhautoberflächen zu suchen ist (Abb. 3). Allenfalls eine externe, d.h. akzidentelle Kontamination von Haut und Schleimhäuten mit erregerhaltigem Material wäre ein Motiv für die Anwendung HBV- oder HIV-wirksamer Antiseptika und vielleicht ein so erzielbares gewisses Maß der Reduktion der Ausstreuung aktiver Viren in das Umfeld.
Tabelle 2.
Virale Erreger respiratorischer Infektionen.
| Behülltes Virus | Unbehülltes Virus |
|---|---|
| Coronaviren | Rhinoviren |
| Respiratory Syncytial Virus (RSV) | Adenoviren |
| Parainfluenzaviren | |
| Influenzaviren |
Eine viruzide Wirksamkeit gegen respiratorische Viren wäre dagegen überall dort von Wichtigkeit, wo eine prophylaktische oder therapeutische Anwendung von Antiseptika im Vordergrund steht. Bei einem Präparat für die orale Anwendung gibt es eine Reihe von Viren, die als Erreger von Atemwegserkrankungen in Frage kommen. Sie sind in Tab. 2 aufgeführt. Werden Schleimhautantiseptika auch prophylaktisch im Oralbereich angewendet, so wäre eine viruzide Wirksamkeit vor allem gegen die dort genannten Erreger sinnvoll.
Bei prophylaktischer oder therapeutischer Anwendung gegenüber Mikroorganismen muss die Situation differenzierter betrachtet werden. Eine tuberkulozide / mykobakterizide oder gar sporizide Wirksamkeit ist auch hier in aller Regel unnötig. Dies erklärt sich aus den Besonderheiten der jeweiligen Erreger (Abb. 2). Einige Mikroorganismen, welche die Schleimhautoberflächen von Mund, Rachen und Atemwegen besiedeln, müssen als potenziell pathogen eingestuft werden. Sie werden oft erst im Zusammenspiel mit Virusinfektionen problematisch. Klassisches Beispiel ist eine Influenza A-Virusinfektion mit einer Superinfektion durch Haemophilus influenzae. Andere spezielle Arten von Mikroorganismen, deren Therapie durch ein Schleimhautantiseptikum unterstützt werden könnte, sind in Tab. 3 aufgeführt. Weitere Hinweise finden sich bei [16]. Bei allen von ihnen wäre die Anwendung Octenidin-basierter Lutschtabletten zur Unterstützung der Genesung und ggf. sogar als Alternative zur therapeutischen Anwendung von Antibiotika sinnvoll, aber auch für den prophylaktischen Einsatz. Die in Tabelle 3 gezeigte Auswahl macht aber auch deutlich, dass das bakterizide und levurozide Wirksamkeitsprofil ausreichend ist. Eine Wirksamkeit gegen alle anderen, sonst bei antimikrobiellen Substanzen benötigten Erregergruppen wäre kaum sinnvoll.
Tabelle 3.
Bakterielle Erreger respiratorischer Erkrankungen und deren Wirkungsweise auf Schleimhautoberflächen.
| Mikroorganismus | Wirkungsweise / Besonderheit |
|---|---|
| A-Streptokokken, | Adhäsion an intakte Mukosa |
| Pneumokokken | |
| Bordetella pertussis, | Adhäsion an Zilien |
| A-Streptokokken | |
| Corynebacterium diphtheriae, | Zerstörung der Schleimhaut |
| Pneumokokken | |
| Staphylococcus aureus | |
| Pneumokokken/A-Str., | Sekundär- und Superinfektion während oder nach Virusinfektionen |
| Haemophilus influenzae | |
| Pseudomonas aeruginosa | |
| Staphylococcus aureus | u. a. Cystische Fibrose |
| Haemophilus influenzae | Chronische Bronchitis |
| Candida spp. | Bei Immunschwäche, AIDS |
Potenzielle pathogene Standortflora und MRSA-Sanierung
Eine besondere Zielrichtung für die prophylaktische Anwendung Octenidin-haltiger Lutschtabletten kann sich auf Grund der Zusammensetzung der residenten Keimflora von Mund, Rachen und Atemwegen ergeben. Tab. 4 zeigt einige der hier vorkommenden Arten unter welchen sich auch manche der bereits genannten potenziell pathogenen Erreger befinden. Sie verursachen unter gewöhnlichen Umständen zwar keine Beschwerden, können jedoch unter bestimmten Voraussetzungen (z. B. bei Immunsuppression, schweren Grunderkrankungen u.ä.) zur Ursache hoch gefährlicher Infektionen werden.
Tabelle 4.
Normalflora des Mund- und Rachenraums und einiger bisweilen dort vorkommender potenziell pathogener Bakterienarten.
| Verteilung | Beispiel |
|---|---|
| Häufigkeit (> 30%) | Streptokokken spp. unter anderem |
| • S. viridans (u.a. Endocarditis) | |
| • S. mutans (Karies) | |
| • S. milleri (u.a. chronische Endokarditis nach Zahnextraktion) | |
| Haemophilus spp. | |
| • H. influenzae und andere | |
| Neisseria spp. | |
| Moraxella spp. | |
| Corynebacterium spp. | |
| Bacteroides spp. und andere Anaerobier | |
| Häufigkeit (10 - 30%) | Streptococcus pyogenes |
| Streptococcus pneumoniae | |
| Neisseria meningitidis | |
| Staphylokokken | |
| • insbesondere S. aureus und zunehmend auch MRSA | |
| Häufigkeit (< 10%) | Corynebacterium diphtheriae |
| Klebsiella pneumoniae u.a | |
| Pseudomonas spp. | |
Darüber hinaus kann sich aus der Problematik multiresistenter Erreger, wie vor allem bei MRSA-Kolonisierung, eine Indikation für die unterstützende Anwendung Octenidin-haltiger Schleimhautantiseptika und hier besonders für Lutschtabletten ergeben. So weisen die Empfehlungen der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut zur Kontrolle von MRSA in medizinischen Einrichtungen (2014) [15] darauf hin, dass es unter bestimmten Umständen zur Sanierung eines MRSA-Trägertums bei Patienten wie auch bei medizinischem Personal keine Alternativen gibt. Als besonders schwierig zeigt es sich, dabei den Nasenvorhof von MRSA-Trägern zu dekolonisieren. Dies darf nur über wenige Tage unter Anwendung von Muperocin (alterenativ auch Bacitracin, Fusidinsäure oder Neomycin als topische Antibiotika) erfolgen und muss sehr gezielt durchgeführt werden, um keine Resistenzentwicklungen gegen die Präparate zu fördern.
Als Alternative zur antibiotikabasierten Dekolonisation des Nasenvorhofs schlägt die KRINKO-Empfehlung deshalb die Verwendung von Octenidin-basierten Antiseptika und begleitend die orale Applikation des gleichen Wirkstoffs in Form von Schleimhautantiseptika vor. Andere für die Dekolonisierung des Nasenvorhofes empfohlene Antiseptika wie Triclosan oder Chlorhexidin kommen dagegen für eine Applikation als Lutschtablette nicht in Frage. Bei der Durchführung der klassischen Dekolonisationsmaßnahmen hat sich aber gezeigt, dass nur etwa 60% der Behandelten nachhaltig saniert werden konnten. Da bei kolonisierten Personen zudem der Rachenraum mit MRSA besiedelt / kontaminiert sein kann, wodurch oft eine Rekolonisation der Haut- und Schleimhautoberflächen sowie des Nasenvorhofes möglich ist, wird die zusätzliche Anwendung einer Octenidin-basierten Lutschtablette zur Dekolonisation des Rachenraums im Rahmen der Sanierung von Patienten wie auch von medizinischem Personal sinnvoll. Sie ist ganz sicherlich eine Ergänzung ggf. sogar eine Alternative zu kurzzeitigen antiseptischen Mundspülungen [1], [12], da der Wirkstoff so auch Areale erreicht, die einer Spüllösung schwerer zugänglich sind. Eine weitere mögliche Anwendung der Substanz könnte sogar in der prophylaktischen Behandlung von neutropenen und anderen Problempatienten bestehen.
Bakterizide Wirksamkeit von Octenidin basierten Lutschtabletten
Der Wirkungsumfang einer antiseptischen Formulierung ist vor allem durch deren antimikrobielle Substanzen vorgegeben. Er kann aber durch die ebenfalls benötigten Hilfsstoffe erheblich modifiziert werden. Weitere wichtige Einflussgrößen auf die Wirksamkeit sind neben der Anwendungskonzentration und der Einwirkungszeit, vor allem die Gegenwart von organischem Material (Eiweiß, Speichel, Schleim etc.) sowie die Anwendungstemperatur. Bei einer Lutschtablette zählen Geschmacksverbesserer, Anästhetika und Süßstoffe dagegen nicht zu denjenigen Substanzen, die bekanntermaßen die Wirkungsweise eines Wirkstoffes wie Octenidin wesentlich beeinflussen können. Eine Ausnahme bilden hier lediglich Weichpastillen, bei denen der Wirkstoff durch die Bonbonbasis festgehalten werden kann. Auf die in harten Lutschtabletten verwendete Bonbonbasis (Octenidin Lutschtablette) trifft dies allerdings nicht zu.
Die mikrobizide Wirksamkeit von Antiseptika kann entsprechend den Standardmethoden der DGHM bzw. des VAH seit langem gut in vitro ermittelt werden. Dies gestattet es die Zahl von in vivo Untersuchungen bzw. Probandenstudien zu reduzieren oder ganz zu vermeiden, ohne die Sicherheit der Präparate für den Anwender zu vernachlässigen. Untersuchungen zur Wirksamkeit von Antiseptika auf Schleimhautoberflächen oder Wunden sind anders kaum durchführbar und wären sonst auf umfangreiche Tierexperimente angewiesen.
Als Grenze für eine ausreichende bakterizide Wirksamkeit legen die DGHM- / VAH-Standardmethoden für Bakterien eine Keimreduktion um mindestens 5 log-Stufen fest. Tabelle 5 zeigt, dass Octenidin in der Zubereitungsform einer Lutschtablette in einer von uns durchgeführten Untersuchung gegen die von VAH / DGHM [3] als repräsentativ ermittelten Prüfkeime (S. aureus, E. hirae, Ps. aeruginosa sowie einigen typischen Keimen der Atemwege S. pyogenes, S. pneumoniae, H. influenzae) in einer Konzentration von 0,05% bis 0,01% hoch wirksam war und innerhalb der für eine Lutschtablette gegebenen Einwirkungszeit selbst in Anwesenheit einer Eiweiß-Blut-Belastung (0,3% RSA + 0,3% Schafserythrozyten) die genannten Mikroorganismen sehr wirksam abtötet. Gleiches gilt auch für Hefen, gemessen am Beispiel von Candida albicans. Hier wird bereits eine Keimreduktion von nur 4 log-Stufen (99,99%) von DGHM / VAH als ausreichend wirksam angesehen [3].
Tabelle 5.
Mikrobizide Wirksamkeit von Octenidin (Monopräparat) in Suspensionstest mit Eiweiß und Blutbelastung (0,3% Serumalbumin + 0,3% Schafserythrozyten). AWK = Anwendungskonzentration, EWZ = Einwirkungszeit.
| Kategorie | Prüfkeim | Anwendungsparameter AWK / EWZ | Reduktionsfaktor [log 10] |
|---|---|---|---|
| Bakterizid | Staphylococcus aureus | 0,08% / 1 min | 7,89 |
| 0,04% / 1 min | 4,41 | ||
| 0,04% / 5 min | 7,87 | ||
| 0,02% / 1 min | 3,89 | ||
| 0,02% / 5 min | 7,87 | ||
| 0,02% / 15 min | 7,84 | ||
| 0,01% / 15 min | 3,44 | ||
| Enterococcus hirae | 0,08% / 1 min | 7,41 | |
| 0,04% / 1 min | 5,67 | ||
| 0,04% / 5 min | 7,49 | ||
| 0,02% / 1 min | 3,68 | ||
| 0,02% / 5 min | 6,50 | ||
| 0,02% / 15 min | 7,40 | ||
| 0,01% / 15 min | 4,22 | ||
| Pseudomonas aeruginosa | 0,08% / 1 min | 7,34 | |
| 0,04% / 1 min | 4,91 | ||
| 0,04% / 5 min | 5,77 | ||
| 0,04% / 15 min | 7,34 | ||
| 0,02% / 15 min | 2,88 | ||
| 0,01% / 15 min | < 1,86 | ||
| Streptococcus pyogenes | 0,08% / 1 min | 6,15 | |
| 0,04% / 1 min | 3,98 | ||
| 0,04% / 5 min | 7,10 | ||
| 0,04% / 15 min | 6,97 | ||
| 0,02% / 15 min | 4,06 | ||
| 0,01% / 15 min | 3,98 | ||
| Streptococcus pneumoniae | 0,08% / 1 min | 5,94 | |
| 0,04% / 1 min | 5,94 | ||
| 0,04% / 5 min | 5,88 | ||
| 0,04% / 15 min | 6,00 | ||
| 0,02% / 15 min | 6,00 | ||
| 0,01% / 1 min | 2.07 | ||
| 0,01% / 5 min | 5,88 | ||
| 0,01% / 15 min | 6,00 | ||
| Haemophilus influenzae | 0,08% / 1 min | 6,67 | |
| 0,04% / 1 min | 5,77 | ||
| 0,04% / 5 min | 6,58 | ||
| 0,04% / 15 min | 6,67 | ||
| 0,02% / 1 min | 1,78 | ||
| 0,02% / 5 min | 5,98 | ||
| 0,02% / 15 min | 6,67 | ||
| 0,01% / 1 min | < 1,19 | ||
| 0,01% / 5 min | 2,66 | ||
| 0,01% / 15 min | 5,77 | ||
| Levurozid | Candida albicans | 0,08% / 1 min | 1,46 |
| 0,08% / 5 min | 4,08 | ||
| 0,08% / 15 min | 6,20 | ||
| 0,04% / 1 min | <0,84 | ||
| 0,04% / 5 min | 1,35 | ||
| 0,04% / 15 min | 2,58 | ||
| 0,02% / 15 min | 0,77 | ||
Wirksamkeit gegen Viren
Die Wirkung einer Substanz gegen Viren, insbesondere diejenige einer Octenidin-basierten Lutschtablette kann auf unterschiedlichen Prinzipien basieren. Generell sind 3 verschiedene Wirkungsmechanismen bekannt.
-
1.
Eine viruzide Wirksamkeit: Darunter versteht man die Inaktivierung von Viruspartikeln außerhalb von deren Wirtszellen. Dies geschieht im Allgemeinen durch Wechselwirkungen zwischen den Substanzen und den Viruspartikeln [19] und kann im Umfeld und bei der Anwendung einer Lutschtablette auf den Schleimhautoberflächen stattfinden. Abb. 4 vermittelt eine Vorstellung der Wirkungsweise viruzider Substanzen.
-
2.
Eine antivirale Wirksamkeit: Darunter versteht man die Verhinderung der Entstehung von Viruspartikeln in den Wirtszellen. Dies geschieht im Allgemeinen durch die Induktion von Interferonen, die die Wirtszellen in die Lage versetzen, den Replikationszyklus von Viren nach deren Penetration in die Wirtszellen mit Hilfe antiviraler Proteine abzubrechen [18]. Die Interferonwirkung wurde erstmalig von [9] beschrieben und basiert auf der Induktion und Freisetzung antiviraler Substanzen durch Körperzellen als Reaktion auf aktives oder inaktiviertes Virus oder anderer Substanzen. Die klassische Interferoninduktion ist in Abb. 5 . dargestellt. Die antivirale Wirksamkeit über Interferone ist daher eine spezielle Form vieler antiviraler Substanzen, die zu therapeutischen Zwecken verwendet werden.
Andere antivirale Substanzen greifen dagegen direkt in den Replikationszyklus der Viren ein (z. B. in die Phase der Penetration, des Uncoatings, der Synthese und ggf. auch der Zusammensetzung und Ausschleusung der Viruspartikel, s. Abb. 6 ). Hier ist die Bildung von Interferonen nicht der Wirksamkeitsbestimmende Schritt.
-
3.
Die Barrierefunktion: Sie beruht auf der Bildung eines Schutzfilms über den Zielzellen und verhindert oder erschwert so das Eindringen von Viren in die Wirtszellen.
Abb. 4.
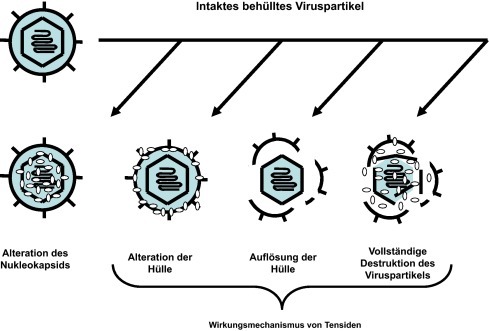
Unterschiedliche Wirkungsweisen viruzider Substanzen gegenüber behüllten Viren.
Abb. 5.

Interferoninduktion und Interferonwirkung nach Isaacs und Lindenmann (1957): Die Autoren inkubierten die Zellen einer Chorioallantoismembran zusammen mit hitze-inaktiviertem Influenzavirus in einer Nährlösung. Durch das inaktivierte Virus werden die Zellen zur Induktion und Sekretion von Interferonen in das Nährmedium stimuliert. Im nachfolgenden Experiment werden diese Interferone von den Zellen einer frischen Membran aufgenommen und schützen sie danach vor einer Infektion mit aktivem Influenzavirus.
Abb. 6.

Intrazelluläre Wirkungsweise antiviraler Substanzen. Je nach Wirkungsweise der jeweiligen Substanzen werden die verschiedenen Schritte des Replikationszyklus gestört (rote Pfeile). Die meisten antiviralen Substanzen behindern die Synthesephase der Virusreplikation.
Viruzide Wirksamkeit von Octenidin
Octenidin wirkt in unterschiedlichster Weise auf Viren. Die viruzide Wirksamkeit gegen behüllte Viren wurde vor allem am Beispiel von Herpesviren untersucht. Aussagen zur Hepatitis B Wirksamkeit, die sich in Verbindung mit der Schleimhautantisepsis finden, beruhen dagegen ausschließlich auf der Testung behüllter Surrogat-Viren und werden beim Vorliegen positiver Ergebnisse im Analogieschluss auf HBV übertragen. Keine antiseptische Substanz kann zur Zeit direkt auf ihre viruzide Wirksamkeit gegen HBV getestet werden, da es an geeigneten Messverfahren für den Nachweis von aktivem infektionstüchtigem Virus fehlt. HIV lässt sich zwar auf geeigneten Zellkultursystemen titrieren, so dass entsprechende Wirksamkeitsaussagen heute auch mit Hilfe von aktivem HIV getroffen werden könnten, da die Kultursysteme jedoch schwierig und störanfällig sind basieren Aussagen zur HIV-Wirksamkeit auch hier auf der Testung von Surrogat-Viren.
Zur viruziden Wirksamkeit von Octenidin-Monopräparaten gegenüber respiratorischen Viren liegen bislang so gut wie keine Untersuchungsergebnisse vor. Dies gilt insbesondere für nackte Viren, vor allem für Adenovirus. Lediglich für Zubereitungen Octenidin-haltiger Präparate mit Phenoxyethanol oder Alkoholen wurde bisher eine unzureichende Wirksamkeit gegen Adenovirus beschrieben. In eigenen Untersuchungen mit Octenidin-Lutschtabletten konnte dies dagegen nicht bestätigt werden. Diese wurden entsprechend der Methode der Leitlinie von DVV und RKI (2004 und 2008) [2], [4], [5] mit Hilfe von Suspensionstesten durchgeführt. Tabelle 6 zeigt, dass eine 0,09%ige Applikation der Wirkstofflösung bereits innerhalb von 2 Minuten Adenovirus komplett inaktiviert. Dies gilt auch für Versuchsansätze in Gegenwart von Eiweiß (Serumbelastung).
Tabelle 6.
Viruzide Wirksamkeit von Octenidin in Suspensionstest mit 10% Fötalem Kälberserum (FKS) und ohne Belastung gegenüber ausgesuchten behüllten und unbehüllten Viren; BVDV = Bovines Virusdiarrhö Virus.
| Kategorie | Belastung | Anwendungsparameter AWK / EWZ | Reduktionsfaktor [log 10] |
|---|---|---|---|
| Vacciniavirus | Ohne | 0,16% / 1 min | > 5,5 |
| Stamm Elstree | 10% FKS | 0,16% / 1 min | 3,5 |
| Ohne | 0,08% / 1 min | 3,5 | |
| 10% FKS | 0,08% / 1 min | 3,25 | |
| Ohne | 0,04% / 1 min | 3,75 | |
| 10% FKS | 0,04% / 1 min | 3,38 | |
| Ohne | 0,08% / 2 min | 4,37 | |
| 10% FKS | 0,08% / 2 min | 3,13 | |
| Ohne | 0,08% / 3 min | ≥ 6,00 | |
| 10% FKS | 0,08% / 3 min | 3,875 | |
| Ohne | 0,08% / 4 min | ≥ 6,00 | |
| 10% FKS | 0,08% / 4 min | 3,375 | |
| Ohne | 0,08% / 5 min | ≥ 6,00 | |
| 10% FKS | 0,08% / 5 min | 3,88 | |
| Ohne | 0,08% / 7 min | ≥ 6,00 | |
| 10% FKS | 0,08% / 7 min | 4,13 | |
| BVDV | Ohne | 0,16% / 1 min | > 3,0 |
| 10% FKS | 0,16% / 1 min | 3,0 | |
| Ohne | 0,08% / 1 min | 3,0 | |
| 10% FKS | 0,08% / 1 min | 2,0 | |
| Ohne | 0,04% / 1 min | 2,0 | |
| 10% FKS | 0,04% / 1 min | 1,9 | |
| Ohne | 0,08% / 2 min | 4,0 | |
| 10% FKS | 0,08% / 2 min | 3,0 | |
| Ohne | 0,08% / 3 min | ≥ 4,88 | |
| 10% FKS | 0,08% / 3 min | ≥ 3,13 | |
| Ohne | 0,08% / 4 min | ≥ 4,88 | |
| 10% FKS | 0,08% / 4 min | ≥ 3,50 | |
| Ohne | 0,08% / 5 min | ≥ 4,88 | |
| 10% FKS | 0,08% / 5 min | ≥ 3,63 | |
| Adenovirus | Ohne | 0,09% / 1 min | ≥ 3,75 |
| 10% FKS | 0,09% / 1 min | ≥ 3,54 | |
| Ohne | 0,09% / 2 min | ≥ 4,13 | |
| 10% FKS | 0,09% / 2 min | ≥ 3,71 | |
| Ohne | 0,08% / 1 min | 2,83 | |
| 10% FKS | 0,08% / 1 min | 2,88 | |
| Ohne | 0,08% / 2 min | 3,0 | |
| 10% FKS | 0,08% / 2 min | ≥ 3,46 | |
Weitere Untersuchungen haben gezeigt, dass bei Temperaturen, wie sie im Mund herrschen (36 °C) die viruzide Wirksamkeit von Octenidin noch erheblich verbessert werden kann. Unter diesen Bedingungen kann von einer Potenzierung der Wirksamkeit ausgegangen werden, insbesondere wenn man den Wirkstoff in Form einer Lutschtablette appliziert. Im Gegensatz zu der, dem Anwender vorgegebenen Anwendungsweise ist es in einem Suspensionsversuch nicht möglich die viruzide Wirksamkeit einer Tablette direkt zu untersuchen. Vielmehr muss diese zunächst in (10 ml) Wasser gelöst und die so entstandene Stammlösung anschließend in den Suspensionsversuch eingebracht werden. Dabei wird die Stammlösung noch einmal verdünnt (zum Beispiel auf 80% ihrer ursprünglichen Konzentration). Gegenüber der Applikation einer Tablette ergibt sich aus dieser Versuchsanordnung so eine Reduktion des Wirkstoffes in Testverfahren, weil dieser beim Lutschen einer Tablette sehr direkt an die Schleimhautoberfläche gebracht wird.
Antivirale Wirksamkeit
Neben der viruziden Wirksamkeit kann auch eine antivirale Wirkung von Octenidin nachgewiesen werden. Diese beruht ganz offensichtlich auf der Fähigkeit der Substanz in Zellen Interferone zu induzieren. Tab. 7 zeigt die Wirkung von Octenidin in der Zubereitung einer Lutschtablette als Interferon-induzierende Substanz. In einer Konzentration von 0,08% kommt es zu einer vollständigen Inhibierung der Virusreplikation, wenn die Substanz vor der Infektion mit Zellkulturen in Kontakt gebracht wird. Die Schutzwirkung wurde mit Hilfe von Coronaviren nachgewiesen und so mit Angehörigen einer Virusgruppe, die als meist harmlose Atemwegserkrankung in Erscheinung treten (jedoch nicht ausnahmslos, wie das Beispiel von SARS oder MERS zeigt).
Tabelle 7.
Untersuchung zur antiviralen Wirksamkeit von Octenidin 0,04%: Ergebnisse der Titration von Coronavirus nach einer 30 min. Vorinkubation von Octenidin auf PT-Zellen im Vergleich zu unbehandelten Zellkulturen. Dargestellt ist die Anzahl viruspositiver Zellkulturen zur Gesamtzahl infizierter Zellkulturen für die jeweiligen Verdünnungsstufen. Erfolgt eine Aussaat der Coronaviren 6 Tage nach Octenidinexposition, ist die Interferenzwirkung neutralisiert.
| Behandlung der Kulturzellen | Virusverdünnungen, ausgeimpft auf PT-Zellen (dargestellt: Anzahl positiver Kulturen zur Gesamtzahl infizierter Kulturen) |
Zellkontrolle | Virus-titer TCID50 / 100 μl [log] | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | 10-7 | 10-8 | |||
| Octenidin 0,04%, Vorinkubation der Kulturzellen | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 | vital | > 1,50 |
| Viruskontrolle: Kontrolltitration auf nicht vorbehandelten Zellen | 6/6 | 6/6 | 6/6 | 6/6 | 6/6 | 6/6 | 6/6 | 2/6 | vital | 7.83 |
| Octenidin 0.04%, Vorinkubation der Kulturzellen, danach weiter Kultivierung der Zellen über 6 Tage mit anschließender erneuter Virusexposition | 6/6 | 6/6 | 6/6 | 6/6 | 6/6 | 6/6 | 6/6 | 2/6 | vital | 7.83 |
Interferone schützen die erreichten Zellen aber nicht nur vor einer bestimmten, sondern vor jeder Virusinfektion. Dies geschieht allerdings nur dann, wenn sie vor dem Kontakt mit einem Virus appliziert oder induziert werden. Leider ist die Schutzwirkung zeitlich auf wenige Stunden begrenzt und eine Restimulation durch Octenidin ist erst wieder nach einer Refraktärzeit möglich. Trotzdem sollte man bei der Applikation der Substanz als Lutschtablette immer auch eine prophylaktische Wirksamkeit einkalkulieren, wenn man diese z. B. vor einer zu erwartenden Exposition appliziert.
Barrierewirkung und Remanenzwirkung
Für einige Schleimhautantiseptika ist eine Barrierewirkung belegt. Die Substanzen ziehen dabei auf die Zelloberflächen auf und verhindern so die Ansiedlung von Krankheitserregern. In wie weit dies bei Virusinfektionen zu einer Verhinderung der Penetration der Viren in die Wirtszellen führen kann wurde für Octenidin bislang noch nicht untersucht. Bei einer Substanz oder Zubereitung, die sowohl eine antivirale als auch eine viruzide Wirksamkeit zeigt, ist dies durch in vitro- wie in vivo-Versuche allerdings auch sehr schwierig zu belegen. Nach allen bisher bekannten Eigenschaften von Octenidin wäre hier Spielraum für weitere Untersuchungen, die helfen, den Wirkungsmechanismus dieser interessanten Substanz zu analysieren.
Literatur
- 1.Ammerlaan H., Kluytmans J., Wertheim H., Nouwen J.L., Bonten M.J. Eradication of methicillin-resistant Staphylococcus aureus carriage: a systematic review. Clin. Infect Dis. 2009;48:922–930. doi: 10.1086/597291. [DOI] [PubMed] [Google Scholar]
- 2.Arbeitskreis Viruzidie, Stellungnahme des Arbeitskreises Viruzidie beim Robert-Koch-Institut (RKI) sowie des Fachausschusses „Virusdesinfektion“ der Deutschen Vereinigung zur Bekämpfung der Viruskrankheiten (DVV) und der Desinfektionsmittelkommission der Deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM) Prüfung und Deklaration der Wirksamkeit von Desinfektionsmitteln gegen Viren. Bundesgesundheitsbl. Gesundheitsforsch. Gesundheitsschutz. 2004;47:62–66. doi: 10.1007/s00103-003-0754-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Deutsche Gesellschaft für Hygiene und Mikrobiologie . In: Standardmethoden der DGHM zur Prüfung chemischer Desinfektionsverfahren. Stand September 2001. Gebel J., Werner H.P., Kirsch-Altena A., Bansemir K., editors. mhp-Verlag Wiesbaden; 2001. [Google Scholar]
- 4.Deutsche Vereinigung zur Bekämpfung der Viruskrankheiten (DVV) Leitlinie der Deutschen Vereinigung zur Bekämpfung der Viruskrankheiten und des Robert Koch-Instituts (RKI) zur Prüfung chemischer Desinfektionsmittel auf Wirksamkeit gegen Viren in der Humanmedizin. Bundesgesundheitsb. Gesundheitsforsch. Gesundheitsschutz. 2008;51:937–945. doi: 10.1007/s00103-015-2131-8. [DOI] [PubMed] [Google Scholar]
- 5.Deutsche Vereinigung zur Bekämpfung der Viruskrankheiten (DVV) Leitlinie der Deutschen Vereinigung zur Bekämpfung der Viruskrankheiten (DVV) e.V. und des Robert Koch-Instituts (RKI) zur Prüfung von chemischen Desinfektionsmitteln auf Wirksamkeit gegen Viren in der Humanmedizin. Fassung vom 1. Dezember 2014. Bundesgesundheitsblatt. 2015;58:491–504. doi: 10.1007/s00103-015-2131-8. [DOI] [PubMed] [Google Scholar]
- 6.Ebel S., Binder K., Kramer A. Octenidinhydrochlorit. In: Blascheck, editor. Hagers Handbuch der Drogen und Arzneistoffe. Springerverlag; Würzburg: 2006. [Google Scholar]
- 7.Ghannoum M.A., Elteen K.A., Ellabib M., Whittaker P.A. Antimycotic effects of octenidine and pirtenidine. J Antimicrob Chem. 1990;25:237–245. doi: 10.1093/jac/25.2.237. [DOI] [PubMed] [Google Scholar]
- 8.Hübner N.O., Siebert J., Kramer A. Octenidine dihydrochloride, a modern antiseptic for skin, mucous membranes and wounds. Skin Pharmacol Physiol. 2010;23:244–258. doi: 10.1159/000314699. [DOI] [PubMed] [Google Scholar]
- 9.Isaace A., Lindenmann J. Virus interference. I. The interferon. Proc. Royal Soc. 1957;B147:268–273. [Google Scholar]
- 10.Koburger T., Hübner N.O., Braun M., Siebert J., Kramer A. Standardized comparison of antiseptic efficacy of triclosan. PVP-iodine, octenidine dihydrochloride, polyhexanide and chlorhexidine digluconate. J Antimicrob Chemother. 2010;65:1712–1719. doi: 10.1093/jac/dkq212. [DOI] [PubMed] [Google Scholar]
- 11.Kramer A., Müller G. Microbicidal efficacy, further biological activities, tolerance and biodegradation of octenidine-dihydrochlorid. GMS Krankenhaushygiene Interdisziplinär. 2007;2:1–5. [Google Scholar]
- 12.Krishna B.V., Gibb A.P. Use of octenidine dihydrochloride in meticillin-resistant Staphylococcus aureus decolonisation regimens: a literature review. J Hosp Infect. 2010;74:199–203. doi: 10.1016/j.jhin.2009.08.022. [DOI] [PubMed] [Google Scholar]
- 13.Mayr-Kanhäuser S., Kränke B., Aberer W. Efficacy of octenidine dihydrochloride and 2-phenoxyethanol in the topical treatment of inflammatory acne. Acta Dermatovenerol Alp Panonica Adriat. 2008;17:139–143. [PubMed] [Google Scholar]
- 14.H. Miething, Octenidinhaltige Lutschtabletten gegen entzündliche Erkrankungen des Mund- und Rachenraums. Bundesrepublik Deutschland, Deutsches Patent und Markenamt. Angemeldet am 28.10. 2004. Offenlegungsschrift DE 10 2004 052 308 A1 2006.04.013.
- 15.Robert Koch-Institut Empfehlungen der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut zur Kontrolle von MRSA in medizinischen Einrichtungen. Bundesgeshbl. 2014;57:696–732. [Google Scholar]
- 16.Schwarzkopf A. Support-Verlag; Aura: 2015. Tabellarium menschenpathogener Erreger. [Google Scholar]
- 17.Stahl J., Braun M., Siebert J., Kietzmann M. The effect of a combination of 0.1% octenidine dihydrochloride and 2% 2-phenoxyethanol (octenisept) on wound healing in pigs in vivo and its in vitro percutaneous permeation through intact and barrier disrupted porcine skin. Int Wound J. 2010;7(1):62–69. doi: 10.1111/j.1742-481X.2009.00648.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Stewart II W.E. Springer Verlag Wien; New York: 1979. The Interferon System. [Google Scholar]
- 19.v. Rheinbaben F., Wolff M.H. Springer-Verlag Berlin; Heidelberg, New York: 2002. Handbuch der viruswirksamen Desinfektion. [Google Scholar]


