Résumé
Objectifs
Décrire les caractéristiques épidémiologiques des infections nosocomiales virales (INV) et les principes de leur prévention.
Épidémiologie
De nombreux facteurs concourent à une sous-évaluation des INV : l’intrication des infections communautaires et nosocomiales pour les viroses saisonnières, la durée d’incubation entraînant une manifestation après la sortie du patient, les difficultés diagnostiques. Les populations les plus à risques d’INV sont les enfants, les personnes âgées et tous les immunodéprimés. Chez ces derniers, le risque de formes cliniques graves et/ou chroniques est important. Le réservoir principal des virus responsables d’INV est constitué des sujets infectés, symptomatiques ou non. Les porteurs asymptomatiques, notamment le personnel de soins, représentent un risque élevé de transmission. Les principales voies de transmission sont les voies digestive, respiratoire, cutanéomuqueuse et l’exposition au sang et produits biologiques. Une revue des principaux virus impliqués en fonction des modes de transmission est présentée.
Prévention
Les mesures préventives des INV sont capitales. Au premier plan, figure l’application rigoureuse des précautions standard d’hygiène et, dans certaines situations, des précautions d’isolement septique. En cas d’épidémie de grande ampleur, le regroupement des patients infectés pourra être instauré. La prévention spécifique repose principalement sur la vaccination, la chimioprophylaxie (varicelle-zona, herpès, grippe, accident d’exposition au sang) et la sélection clinique et biologique des donneurs de sang, d’organes, de tissus et de cellules.
Mots clés: Infections nosocomiales, Virus, Prévention, Mesures d’hygiène
Summary
Objectives
To describe epidemiological features of viral nosocomial infections (VNI) and their prevention principles.
Epidemiology
Many factors lead to underestimate VNI: difficulty to distinguish between community-acquired and nosocomial infections for seasonal viral diseases, incubation time leading to symptoms after patient discharge, difficulty for diagnosis. Population at high risks of VNI are the children, the elderly and the immunocompromized patients. The risk of severe diseases is high in this last population. The main reservoir of virus is infected symptomatic or asymptomatic individuals. Asymptomatic carriers, especially health care workers, are a major source of transmission. Main routes of transmission are the fecal–oral route, the respiratory route, cutaneous or mucous contact and blood and body fluids exposure. A review of the main virus involved in VNI is presented.
Prevention
Preventive measures, such as strict adherence to standard precautions and, in some instances, to isolation procedures, are critical to control VNI. In a major outbreak situation, it may be necessary to consider cohort isolation. Specific control measures rely on immunization, antiviral drug prophylaxis (varicella–zooster, herpes, influenza, exposure to blood) and clinical and biological screening of organ, blood, tissue and cell donors.
Keywords: Nosocomial infections, Virus, Prevention, Infection control procedure
Introduction
Les infections nosocomiales (IN) représentent aujourd’hui une préoccupation centrale des professionnels de santé. Contrairement aux infections bactériennes, peu de données précises sont disponibles sur l’implication des virus dans les IN. Dans des études déjà anciennes, environ 5 % d’entre elles étaient attribuées aux virus [1]. Les infections virales représentaient en France 12 % des IN et 3 % des signalements externes d’IN entre août 2001 et décembre 2005 [2]. Lors de la dernière enquête nationale de prévalence des IN en France conduite au printemps 2006, une origine virale a été diagnostiquée dans 0,2 % des cas. Comme nous le verrons ci-dessous, il faut considérer ces chiffres comme très largement sous-estimés. Comme pour les IN bactériennes ou fongiques, une infection virale est dite nosocomiale si elle est acquise à l’hôpital par un patient qui n’était ni en incubation, ni infecté à l’admission. Cette définition est très large. En effet, une réactivation virale chez un immunodéprimé, bien que d’origine endogène, sera considérée comme nosocomiale si elle survient lors d’une prise en charge médicale. Les infections survenant chez les visiteurs et chez le personnel dans le cadre de son activité professionnelle sont également considérées comme nosocomiales. Cette définition a été élargie en 2007 pour prendre en compte les infections acquises lors de soins délivrés hors des établissements de santé. On devrait donc parler maintenant d’infections associées aux soins [3].
Épidémiologie
Plusieurs facteurs concourent à la difficulté de reconnaissance des infections nosocomiales virales (INV). Les mêmes virus sont responsables des infections communautaires et nosocomiales, notamment pour les viroses saisonnières respiratoires et digestives qui sont responsables d’un nombre considérable d’hospitalisations pédiatriques chaque hiver [4]. Ainsi, les épidémies nosocomiales se superposent aux épidémies communautaires, l’introduction des virus dans les établissements de santé intervenant par l’intermédiaire des patients, mais aussi du personnel et des visiteurs. Certaines INV se manifestent après la sortie du patient (les diarrhées à rotavirus par exemple) ou parfois après une durée d’incubation très prolongée (hépatites), ce qui complique leur identification a posteriori. Enfin, une autre raison majeure de la sous-évaluation des INV est liée aux méthodes diagnostiques. En effet, les techniques disponibles pour mettre en évidence les infections virales ont longtemps été peu nombreuses, difficiles à mettre en œuvre pour de nombreux virus, voire inexistantes. De plus, le délai d’obtention des résultats a pu constituer un frein à la recherche de ces infections. Aujourd’hui, les progrès réalisés dans le domaine du diagnostic virologique direct grâce à l’apport des tests unitaires rapides de détection antigénique et de la biologie moléculaire doivent inciter à rechercher beaucoup plus largement les INV. Dans certaines situations, la mise en œuvre de techniques de comparaison des souches virales par phylogénie moléculaire permet l’investigation de cas groupés en traçant la transmission virale au sein d’un même service.
Les manifestations cliniques les plus fréquentes des INV (gastro-intestinales, respiratoires, hépatites…) se différencient nettement de celles des IN bactériennes dominées par les infections urinaires, les infections de sites opératoires, les infections sur cathéters. Les INV touchent toutes les populations réceptives et exposées, patient et personnel, mais les populations les plus à risques d’INV sont les enfants (en particulier les nouveau-nés), les personnes âgées et tous les immunodéprimés. Chez les patients les plus immunodéprimés, le risque de formes cliniques chroniques et/ou graves est augmenté et l’excrétion virale est souvent plus prolongée. Chez ces patients fragiles, les conséquences en termes de morbidité, voire de mortalité, doivent être redoutées. En termes de coût, les INV sont responsables d’une augmentation de la durée d’hospitalisation et certaines études ont montré que la réduction du nombre d’INV s’accompagne d’économies substantielles [5].
Le réservoir principal des virus responsables d’INV est constitué des sujets infectés, symptomatiques ou non. Il s’agit des patients bien sûr mais aussi du personnel, des visiteurs ou des bénévoles qui peuvent être des maillons importants de la chaîne de transmission. La période d’infectiosité est variable d’un virus à un autre, mais commence en règle générale avant l’apparition des signes cliniques et peut se poursuivre plusieurs jours, voire semaines, après le début des symptômes. La notion de portage asymptomatique est très importante dans l’épidémiologie des INV. En effet, la possibilité de portage intermittent, chronique ou prolongé lors d’infections symptomatiques ou souvent asymptomatiques (et donc méconnues) entraîne un risque de transmission élevé et difficile à prévenir. À la différence des bactéries, les virus sont incapables de se multiplier en dehors de cellules hôtes vivantes. Ils ne peuvent donc se multiplier dans l’environnement, mais ils peuvent y persister plus ou moins durablement en fonction de la température ambiante, du degré d’humidité, de la présence de matières organiques [6], de la charge virale et surtout de la présence ou non d’une enveloppe lipidique, les virus enveloppés étant les plus fragiles. Cette capacité de persistance influe directement sur l’importance de l’environnement hospitalier comme réservoir des différents virus et sur leur mode de transmission.
Les principales voies de transmission des virus à l’origine d’IN sont les voies digestive, respiratoire, cutanéomuqueuse et l’exposition au sang, à des liquides biologiques ou à des tissus infectés (Fig. 1 ). La transmission des virus respiratoires se fait par l’émission de gouttelettes fines (diamètre inférieur à 5 μm) ou plus grosses (> 5 μm) qui contiennent des particules infectieuses. Les gouttelettes fines peuvent être transmises sur des distances de plusieurs mètres alors que les plus grosses sont transmises uniquement lors des contacts rapprochés. La toux, les éternuements, la parole peuvent disperser des particules infectantes dans un large périmètre. La transmission aérienne concerne, certes, les virus respiratoires classiques (virus influenza, parainfluenza, virus respiratoire syncytial [VRS], etc.) mais aussi, ce qui est moins connu, le virus de la varicelle et du zona (VZV). Les mains jouent aussi un rôle important dans la transmission des virus respiratoires ainsi que les surfaces contaminées (tissus, mouchoirs…). Il peut s’agir soit d’auto-inoculation, par transfert du virus des mains souillées du patient vers ses muqueuses, soit d’un transfert de virus de patient à patient via les mains des soignants. Dans tous les cas, la contamination se produit par inoculation des muqueuses oculaires, nasales ou respiratoires d’un sujet réceptif. Les virus à transmission digestive empruntent la voie fécale–orale. La plupart d’entre eux sont dépourvus d’enveloppe, ce qui leur confère une survie prolongée dans le milieu extérieur et une certaine résistance aux désinfectants, mais plusieurs exemples (virus de l’hépatite B [VHB] notamment) montrent que la possession d’une enveloppe n’est pas synonyme de fragilité. L’infection humaine se développe après transmission croisée interhumaine par les mains sales, des objets, des instruments médicaux ou surfaces souillés ou encore à partir des réservoirs environnementaux (eau, aliments souillés). Certains virus, comme l’herpès simplex ou le VZV, sont transmissibles par contact immédiat avec la peau lésée et les muqueuses. La transmission par le sang et les liquides biologiques est un mécanisme impliqué pour de nombreux virus : le VHB, le virus de l’hépatite C (VHC), le virus de l’immunodéficience humaine (VIH), le cytomégalovirus (CMV), le parvovirus B19 mais aussi l’arbovirus (dengue, chikungunya…). Ce même mécanisme est à l’origine de la transmission de virus (CMV, virus Epstein-Barr, herpès virus humain de type 6…) par un greffon lors d’une greffe d’organe ou de tissus chez un receveur réceptif non immunisé. De façon anecdotique mais prouvée, citons la transmission du virus de la rage à partir de prélèvements chez des donneurs décédés. Ces infections sont d’autant plus graves qu’elles touchent le plus souvent des patients immunodéprimés.
Figure 1.
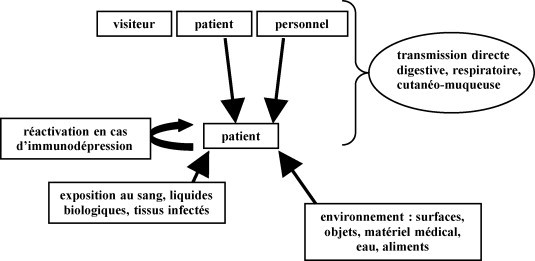
Schéma des différentes sources d’infections nosocomiales virales.
Schematic presentation of the different sources of viral nosocomial infections.
Principaux virus impliqués
Les virus transmis par la voie fécale–orale
Les virus à transmission digestive comprennent principalement les virus de gastroentérites, le virus de l’hépatite A et les entérovirus [7].
Le rotavirus humain
Le rotavirus est le principal agent des gastroentérites aiguës du nourrisson, responsable d’environ 50 % des hospitalisations pour diarrhées. Les infections à rotavirus sévissent par épidémies hivernales. Les conditions de survenue de la période épidémique (facteurs climatiques ou alimentaires…) ne sont pas connues. Environ 90 % des enfants entre un et trois ans acquièrent des anticorps contre ces virus. Les réinfections chez l’adulte sont souvent asymptomatiques, mais les rotavirus sont associés à des épidémies de gastroentérites en gériatrie. La survie du rotavirus sur les surfaces peut atteindre plusieurs semaines. La dose infectante très faible (environ 100 virions), l’élimination virale massive (jusqu’à 1012 virions par millilitre de selles), l’existence de nombreux porteurs asymptomatiques et la résistance du virus à certains désinfectants expliquent l’incidence élevée des IN à rotavirus, de 3 à 17 % dans les services de pédiatrie [8].
Les calicivirus humains
Les calicivirus humains sont des virus non enveloppés à ARN avec une grande variabilité génétique appartenant à la famille des Caliciviridae. Les virus des genres Norovirus et Sapovirus sont responsables de gastroentérites aiguës de l’enfant ou de l’adulte survenant sur un mode épidémique ou sporadique. Les diarrhées à calicivirus touchent toutes les classes d’âge avec un pic épidémique hivernal. Les gastroentérites nosocomiales à calicivirus sont souvent épidémiques et, de façon caractéristique, affectent presque autant le personnel hospitalier que les patients. Les vomissements, parfois prédominants dans le tableau clinique, sont une source de contamination très importante de l’environnement, notamment par aérosolisation.
Les autres virus
De nombreux autres virus, tels les astrovirus, les adénovirus, les coronavirus et les entérovirus, sont incriminés dans les gastroentérites nosocomiales avec une moins grande fréquence. Les entérovirus sont aussi régulièrement à l’origine d’épidémies d’IN, comme les méningites, particulièrement en néonatalogie [9]. Le virus de l’hépatite A peut être responsable d’épidémies dans des services hospitaliers comme dans des établissements non médicalisés accueillant des enfants ou des adultes handicapés [10].
Les virus transmis par voie respiratoire
Le virus respiratoire syncitial (VRS)
Le VRS est l’agent majeur des atteintes respiratoires basses du nourrisson (bronchiolites, pneumonie) sévissant sur un mode épidémique annuel hivernal. En période épidémique, il représente près de la moitié des admissions pour pathologies respiratoires des enfants de moins de deux ans. Dans certaines études, 20 à 40 % des enfants hospitalisés pour d’autres motifs pendant l’hiver acquièrent une INV à VRS. Les manifestations sont potentiellement sévères chez les enfants en bas âge, les immunodéprimés et les enfants porteurs de pathologies cardiaques ou pulmonaires chroniques. Les adultes peuvent également être infectés, le plus souvent sur un mode asymptomatique, contribuant ainsi à la diffusion du virus. La transmission est, d’une part, directe par les gouttelettes respiratoires de grande taille avec pour portes d’entrée les muqueuses oculaire et nasale mais, d’autre part, fréquemment indirecte car le VRS persiste jusqu’à six heures sur la peau et les surfaces de l’environnement. Le rôle du personnel hospitalier dans la diffusion du VRS est majeur, soit par transfert passif de patient à patient, soit par auto-inoculation à partir d’un patient infecté et diffusion secondaire. L’immunité conférée est incomplète et de courte durée expliquant les possibilités de réinfections.
Les virus influenza
Ces virus surviennent sous forme d’épidémie hivernale, parfois explosive. Toutes les populations et toutes les tranches d’âge sont concernées, mais les cas les plus graves surviennent chez les personnes âgées ou fragiles. La mortalité est non négligeable par détresse respiratoire aiguë primaire ou secondaire à une surinfection bactérienne. La transmission s’effectue par des aérosols de petite taille, expliquant l’intensité et la rapidité de la dissémination mais aussi de façon indirecte car le virus survit quelques heures sur les surfaces. L’incubation est brève, un à deux jours, et les symptômes durent environ une semaine.
Autres virus
Les virus parainfluenza et les rhinovirus représentent une part importante des virus responsables d’infections respiratoires banales et fréquentes, non diagnostiquées en pratique courante. Leur contagiosité importante explique qu’ils soient responsables d’INV. Pour ces deux virus, le portage asymptomatique est fréquent. La survie des rhinovirus dans l’environnement est longue et la transmission manu portée est non négligeable.
Les adénovirus, souvent responsables d’infections banales, voire asymptomatiques, chez le sujet immunocompétent, peuvent être impliqués dans des INV rares mais graves, en particulier dans les services de pédiatrie ou des services hébergeant des patients porteurs d’une pathologie respiratoire sous-jacente. Ces épidémies nosocomiales se caractérisent par un taux d’attaque élevé (entre 16 et 50 %) et des taux de morbidité et mortalité élevés [11].
La liste des autres virus impliqués dans les INV respiratoires, potentiellement graves, voire mortelles, chez le nouveau-né ou l’immunodéprimé, est longue [4] : l’entérovirus, le coronavirus, le VZV…
Virus à transmission cutanéomuqueuse
Les virus de la famille des Herpesviridae
La varicelle est habituellement bénigne, mais peut prendre des formes graves chez l’adulte, l’immunodéprimé et pendant la grossesse. Le VZV est le plus contagieux des virus de la famille des Herpesviridae. La transmission peut se faire après un contact étroit auprès d’une personne infectée, à partir des lésions cutanées très riches en virus, ou par inhalation de gouttelettes respiratoires projetées par la personne atteinte de varicelle. Elle peut également se faire par contact indirect, par l’intermédiaire des mains ou d’objets contaminés. Les patients varicelleux devraient être isolés (isolement de type aérien et contact) et pris en charge en dehors des services accueillant des immunodéprimés. L’infectiosité, par contact direct, est réduite des deux tiers en cas de zona. L’isolement des cas de zona est néanmoins préférable (isolement de contact).
Parmi les autres Herpesviridae, les virus herpès simplex sont également transmissibles par contact direct avec des lésions cutanées et, dans une moindre mesure, par aérosol. L’infection de la sphère orale est fréquente (séroprévalence de l’HSV-1 supérieure à 60 % dans la population adulte) et les formes asymptomatiques, qui s’accompagnent comme les formes symptomatiques d’une excrétion virale, posent le problème de leur diagnostic. Leur transmission aux patients immunodéprimés et aux nouveau-nés peut entraîner de redoutables formes graves et disséminées. Il est donc capital que le personnel soignant porteur d’infections herpétiques, notamment les fréquentes localisations labiales, ne soit pas en contact avec ces patients fragiles.
Autres virus
Des épidémies nosocomiales de kératoconjonctivites dans les services d’ophtalmologie, souvent massives et touchant aussi bien les patients que le personnel, sont provoquées par des adénovirus [12] ou des entérovirus [13]. Le rôle de la transmission croisée manu portée et des instruments insuffisamment désinfectés est majeur. L’usage d’appareils de prise de tension oculaire sans contact avec l’œil a toutefois diminué le risque de transmission de patient à patient.
Virus transmis par le sang, les liquides biologiques ou des tissus infectés
Le sang et les liquides biologiques doivent toujours être considérés comme à risque de transmission de maladies virales. Les virus majeurs impliqués dans cette transmission sont le VIH, le VHB et le VHC. Le risque infectieux dépendra principalement de trois facteurs : le stade de l’infection chez le patient source, le type d’exposition et le potentiel infectieux du virus en cause, d’autant plus élevé que la charge virale est importante et que le virus est résistant hors de l’organisme. Les populations à risque de transmission nosocomiale sont les polytransfusés et les hémophiles, les hémodialysés, les receveurs d’organes, de tissus et de cellules, les sujets ayant subi des soins médicochirurgicaux invasifs. Le personnel soignant est également une cible privilégiée de ces infections par l’intermédiaire des accidents d’exposition au sang (AES). L’épidémiologie ainsi que la prévention des AES, aujourd’hui bien codifiée, ne sera pas traitée ici (pour revue, voir : Surveillance des accidents exposant au sang chez les soignants : données du réseau AES-Raisin 2002. Site InVS.fr).
Le VIH, le VHB et le VHC
D’importants progrès ont été réalisés ces dernières années pour assurer la sécurité virale des produits dérivés du sang. Ainsi, sur la période 2003–2005, le risque de transmission par transfusion est estimé, à 1/1 700 000 pour le VHB, 1/2 600 000 pour le VIH, 1/6 500 000 pour le VHC et 1/8 000 000 pour le Human T-cell Leukemia Virus (HTLV) [14]. De même, la sélection clinique et biologique des donneurs d’organes ou de tissus, qui prévoit le dépistage de ces virus, a rendu ces infections exceptionnelles en transplantation d’organes. Dans les deux cas, le risque résiduel, aujourd’hui très faible, est lié à la fenêtre sérologique et génomique pendant laquelle le sujet donneur infecté ne présente encore aucun marqueur détectable d’infection. La transmission du VIH aux transfusés et aux hémophiles a été à l’origine d’une prise de conscience collective des risques viraux liés à une transmission iatrogène ou nosocomiale. Elle a largement contribué au renforcement des mesures d’hygiène et à la mise en place de précautions standard de prévention des infections virales transmises par le sang. Schématiquement, on estime qu’après une exposition percutanée, le risque de contamination est de 0,3 % pour le VIH, 3 % pour le VHC et 30 % pour le VHB [15]. Le risque de transmission de l’hépatite B a diminué grâce à la vaccination, dont la couverture dans la population générale est passée de 5,5 % en 1994 à 21,7 % en 2002 [16]. Cependant, compte tenu de la présence à un titre très élevé du VHB dans le sang et de sa résistance dans l’environnement, la contamination de patient à patient lors d’actes de soins, en particulier invasifs, est toujours possible, parfois sous formes de petites épidémies. La transmission par l’intermédiaire d’instruments contaminés résulte le plus souvent d’une gestion inadaptée du matériel de soins ou du non-respect des procédures d’hygiène.
On sait aujourd’hui que la transmission nosocomiale du VHC est responsable d’un nombre non négligeable d’infections dont l’étiologie est qualifiée d’inconnue (environ 20 % des hépatites chroniques C). Les voies de contamination, hors transfusion et don d’organes, sont nombreuses : les piqûres avec des aiguilles souillées, les soins dentaires, l’usage de flacons multidoses, l’hémodialyse… [17]. Malgré la prise de conscience de ce risque nosocomial et la généralisation des précautions standard, des cas sporadiques ou de petites épidémies peuvent toujours survenir, à la suite du non-respect accidentel des mesures d’hygiène ou de la contamination de machines dans des centres d’hémodialyse par exemple [18].
Autres virus
D’autres virus, comme le parvovirus B19 ou le cytomegalovirus (CMV), sont également transmissibles par voie transfusionnelle, mais ne font pas l’objet de dépistage systématique du fait du caractère souvent bénin de l’infection, hors personnes séronégatives les plus à risque de développer une infection grave (immunodéprimés, femmes enceintes, nouveau-nés). La prévalence estimée des dons virémiques pour le parvovirus B19 est comprise entre 1/625 et 1/50 000, selon la technique de détection utilisée et les pics épidémiques [19]. La déleucocytation des produits sanguins labiles depuis 1998 a résolu le problème de la transmission transfusionnelle des virus lymphotropes comme le CMV. La transmission par voie transfusionnelle de virus de l’hépatite A et E a été rapportée, mais reste exceptionnelle.
Après allogreffe de moelle et transplantation d’organes, l’infection à CMV est la première cause de morbidité et de mortalité. Elle est observée chez presque deux tiers des receveurs, quel que soit le type de greffe [20]. Il peut être transmis à un receveur séronégatif avant greffe par les organes ou les tissus du donneur. Chez le receveur séropositif, la réactivation ou la réinfection conduit souvent, du fait de la thérapeutique immunosuppressive, à une infection secondaire qui sera considérée comme nosocomiale. La transmission croisée à partir d’une personne excrétrice, entre patients ou du patient vers le personnel est également possible, mais beaucoup plus rare.
D’autres virus lymphotropes de la même famille, tel le virus Epstein-Barr ou le virus HHV-6, peuvent se transmettre de la même façon en transplantation d’organes, mais le nombre de cas documentés est très faible.
Enfin, des virus émergents ou liés à des zones géographiques particulières (arbovirus notamment) peuvent être transmis par transfusion ou greffes.
Moyens non spécifiques de prévention
Les mesures préventives des INV sont capitales en raison de leur caractère souvent asymptomatique et des possibilités thérapeutiques restreintes. L’application des précautions standard d’hygiène [21], qui ont d’ailleurs été initialement élaborées pour la prévention des virus transmissibles par le sang, constitue la pierre angulaire de la prévention des INV. En fonction du virus concerné, de son mode de transmission et du risque potentiel, des précautions complémentaires d’hygiène comprenant l’isolement septique en chambre individuelle devront être prescrites (Tableau 1 ). Cet isolement septique sera de type aérien, gouttelette ou contact [22]. Les patients porteurs du VHB, VHC ou VIH ne relèvent pas de l’isolement septique. Le diagnostic viral doit être précoce, de façon à instaurer le plus rapidement possible les mesures préventives appropriées. Ce diagnostic sera présomptif ou de plus en plus souvent pourra être formellement établi grâce aux méthodes virologiques (culture, test rapide de détection des antigènes viraux, biologie moléculaire) ou sérologiques. En situation épidémique, il est fréquent d’avoir à recourir au regroupement des patients infectés et non infectés dans deux secteurs géographiques distincts (cohorting). Chaque cohorte bénéficiera, autant que possible, de personnel et de matériel dédiés. Un troisième groupe peut être constitué des sujets contacts qui sont à risques de développer l’infection. Cette organisation optimale, exigeante en termes de locaux et de personnel, est cependant rarement appliquée dans les faits. En cas de cohorting, le recours à des tests rapides de diagnostic virologique, les plus sensibles et les plus spécifiques possibles, est indispensable car c’est le seul moyen permettant d’affecter un individu de façon certaine au groupe approprié. Ainsi, les stratégies de lutte contre le VRS lors des épidémies hivernales associent le dépistage dans les sécrétions nasopharyngées et les techniques d’isolement ou de cohorting. Toutes ces mesures ne peuvent être efficacement appliquées sans une formation et une information des personnels sur les précautions standard et complémentaires d’hygiène. Le personnel en contact avec les patients devra aussi être sensibilisé à cesser le travail jusqu’à disparition des symptômes en cas d’infection virale, respiratoire ou digestive notamment. Cette information sera étendue aux visiteurs qui seront alertés sur les risques potentiels pour les patients et qui seront interdits de visite en cas de symptômes évocateurs d’infection virale.
Tableau 1.
Principales voies de transmissions et recommandations d’isolements pour les principaux virus responsables d’infections nosocomiales.
Main ways for transmission and isolation recommendations for the most important viruses responsible for nosocomial infections.
| Virus | Transmission | Incubation | Durée contagiosité | Type d’isolementa |
|---|---|---|---|---|
| Adénovirus | ||||
| Respiratoire | Respiratoire, mains et objets souillés | Jusqu’à guérison clinique | Contact + gouttelette | |
| Entérique | Féco-orale, mains et objets souillés | Idem | Contact | |
| Oculaire | Cutanéomuqueuse, mains et objets souillés | Idem | Contact | |
| CMV | Cutanéomuqueuse, sang, greffes | Précautions standard | ||
| Entérovirus | Féco-orale, mains et objets souillés | Jusqu’à guérison clinique | Contact | |
| Grippe | Respiratoire, mains et objets souillés | 1 à 2 jours | 2 jours avant à 5 jours après l’apparition des symptômes | Contact + gouttelette |
| Herpès | Cutanéomuqueuse | Jusqu’à guérison clinique | Contact | |
| Rotavirus | Féco-orale, mains et objets souillés | 1 à 3 jours | 2 jours avant à 7 jours après les symptômes | Contact |
| Varicelle zona | Respiratoire, cutanéomuqueuse | 10 à 21 jours | 2 jours avant à 5 jours après l’éruption | Contact + aérien |
| Virus de l’hépatite A | Féco-orale, mains et objets souillés | 3 à 5 semaines | 1 semaine avant et après les symptômes | Contact |
| Virus de l’hépatite B | Muqueuse, sang, liquides biologiques, tissus | 3 à 6 mois | Jusqu’à apparition des Ac anti-HB | Précautions standard |
| Virus de l’hépatite C | Sang, liquides biologiques, tissus | 4 à 12 semaines | Durée du portage viral | Précautions standard |
| VIH | Sang, liquides biologiques, tissus | 2 semaines | Durée du portage viral | Précautions standard |
| VRS | Respiratoire, mains et objets souillés | 4 à 7 jours | De 2 jours avant à 7 jours après les signes cliniques | Contact + gouttelette |
CMV : cytomégalovirus ; VIH : virus de l’immunodéficience humaine ; VRS : virus respiratoire syncytial.
Les différents types d’isolement septique sont définis dans la référence [22].
Les mesures de prévention prises par les établissements de santé dans le cadre de leur préparation à une pandémie de grippe qui pourrait être occasionnée par un virus d’origine aviaire de type H5N1 ne sont pas traitées ici (cf. plan gouvernemental de lutte contre la pandémie grippale www.grippeaviaire.gouv.fr).
L’action virucide des antiseptiques et désinfectants est actuellement évaluée par la norme européenne EN 14476. En raison de la présence de lipides dans les enveloppes virales, facilement solubilisés par de nombreux agents chimiques, les virus enveloppés sont beaucoup plus sensibles aux antiseptiques et désinfectants que les virus non enveloppés. En pratique, un produit qui inactive rapidement les virus humains non enveloppés les plus résistants, comme les entérovirus, peut être qualifié de virucide à large spectre. Ce n’est pas le cas de l’éthanol, de l’isopropanol et donc des solutions hydroalcooliques (SHA), gold standard de l’hygiène des mains depuis quelques années, qui n’inactivent pas les virus nus, comme les adénovirus, les entérovirus ou le virus de l’hépatite A, avec des temps de contact courts représentatifs des conditions pratiques d’emploi [23]. En revanche, le pouvoir virucide expérimental des SHA sur les rotavirus ou les norovirus semble meilleur, mais reste très dépendant des produits utilisés et des conditions expérimentales [24], [25].
Dans un contexte épidémique, il est important de définir et de repérer la population exposée et celle susceptible de faire des formes graves. Les possibilités thérapeutiques et de prophylaxie après exposition devront être étudiées et lorsqu’une prévention vaccinale existe, elle devra être proposée au personnel et aux sujets exposés non protégés.
Moyens spécifiques de prévention
Ils complètent les moyens non spécifiques de prévention, mais ne les remplacent pas. Ils recouvrent la vaccination, la sérothérapie et la chimioprophylaxie. Le criblage des donneurs de sang et d’organes permet aussi de diminuer considérablement les risques liés aux virus à transmission parentérale.
Vaccination
La vaccination est un moyen de protection individuel très performant. Certains de ces vaccins font partie des vaccins de l’enfance en France, d’autres ont des indications plus restreintes et doivent être discutés au cas par cas.
La vaccination contre l’hépatite B constitue un moyen de protection très efficace des patients à risque et des professionnels de santé contre ce virus. Elle est obligatoire pour tous les personnels de santé. Les patients très exposés au risque (dialysés, polytransfusés, greffés…) doivent également être vaccinés. La vaccination du personnel soignant contre la grippe permet de protéger les soignants et de réduire la circulation du virus dans les établissements de santé et donc le risque pour les patients fragiles. Le rythme de ce vaccin est annuel et les personnels de santé doivent être fortement incités à se vacciner. Un vaccin vivant atténué contre la varicelle peut être proposé aux enfants porteurs d’une hémopathie maligne ou d’une tumeur solide et au personnel de soins séronégatif. Le vaccin contre l’hépatite A s’adresse aux patients hébergés dans des établissements où le péril fécal existe ainsi qu’aux personnels (soins, cuisines…) de ces établissements. En plus des mesures d’hygiène, la prévention vaccinale chez les patients et les soignants de ces établissements peut être utile pour enrayer la transmission lors d’une épidémie nosocomiale.
Enfin, plusieurs vaccins contre le rotavirus sont maintenant disponibles en France. Leur contribution pour réduire, à l’avenir, l’impact des épidémies nosocomiales hivernales dues à ces virus reste à déterminer.
Sérothérapie
La sérothérapie antivirale a peu d’indications dans le contexte nosocomial. En cas d’exposition au VZV, elle repose sur l’administration précoce d’immunoglobulines polyvalentes aux patients immunodéprimés séronégatifs. L’administration d’immunoglobulines spécifiques est proposée en cas d’exposition au VHB. L’efficacité de la sérothérapie est discutée pour d’autres virus.
Chimioprophylaxie
La chimioprophylaxie est possible pour certaines infections virales nosocomiales. L’arsenal est toutefois plus limité que pour l’antibiothérapie. La résistance aux antiviraux est actuellement moins problématique que la résistance aux antibiotiques en milieu hospitalier. Cependant, ce risque existe, particulièrement chez les sujets immunodéprimés susceptibles d’un portage viral très prolongé, et doit être mis en balance avec le bénéfice de la chimioprophylaxie antivirale. L’aciclovir et ses dérivés peuvent être utilisés en prévention des infections à virus herpès simplex et à VZV chez l’immunodéprimé. Le ganciclovir est couramment utilisé en prophylaxie des infections à CMV chez les patients greffés. La prévention du CMV repose également sur l’administration de produits sanguins sélectionnés pour les populations séronégatives les plus à risques. En cas d’AES, les antirétroviraux sont prescrits en fonction de la gravité du risque (statut sérologique du patient source, type d’exposition) pour réduire le risque de contamination par le VIH. La chimioprévention de la grippe repose sur l’utilisation d’antiviraux spécifiques, comme l’amantadine, active sur la grippe A, et les inhibiteurs de la neuraminidase actifs, sur les virus A et B. Dans le contexte nosocomial, les inhibiteurs de la neuraminidase peuvent être utilisés en traitement curatif et en prophylaxie postexposition. Leur rôle dans la maîtrise d’une épidémie nosocomiale n’est toutefois pas encore défini [26]. Pour le VRS, les traitements antiviraux, comme la ribarivine en aérosol, permettent de réduire les titres viraux des sécrétions respiratoires, mais leur efficacité sur la prévention de la transmission est débattue et leur indication est actuellement limitée aux infections chez l’immunodéprimé.
En conclusion, les INV, bien que largement sous-estimées dans les statistiques épidémiologiques, représentent pourtant un risque fréquent et parfois grave pour certains patients. Les INV sont les IN les plus fréquentes en pédiatrie. La prévention par les mesures d’hygiène de base, les techniques d’isolement septique et la prophylaxie vaccinale est au premier plan dans la prise en charge des INV. Enfin, la menace récurrente de virus émergents doit nous rappeler que le respect rigoureux des règles d’hygiène et des précautions d’isolement est le meilleur gage de protection contre les infections virales en milieu de soins.
Références
- 1.Valenti W.M., Menegus M.A., Hall C.B., Pincus P.H., Douglas R.G., Jr. Nosocomial viral infections: I. Epidemiology and significance. Infect Control. 1980;1:33–37. doi: 10.1017/s0195941700052371. [DOI] [PubMed] [Google Scholar]
- 2.Coignard B, Poujol I, Carbonne A, Bernet C, Sénéchal H, Dumartin C, et al. Le signalement des infections nosocomiales, France, 2001–2005. Bull Epidemiol Hebd 2006; 51–52:406–10.
- 3.Actualisation de la définition des infections nosocomiales. Paris: ministère de la Santé, de la Jeunesse et des Sports, comité technique des infections nosocomiales et des infections liées aux soins; 2007.
- 4.Aitken C., Jeffries D.J. Nosocomial spread of viral disease. Clin Microbiol Rev. 2001;14:528–546. doi: 10.1128/CMR.14.3.528-546.2001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Macartney K.K., Gorelick M.H., Manning M.L., Hodinka R.L., Bell L.M. Nosocomial respiratory syncytial virus infections: the cost-effectiveness and cost-benefit of infection control. Pediatrics. 2000;106:520–526. doi: 10.1542/peds.106.3.520. [DOI] [PubMed] [Google Scholar]
- 6.Mbithi J.N., Springthorpe V.S., Sattar S.A. Effect of relative humidity and air temperature on survival of hepatitis A virus on environmental surfaces. Appl Environ Microbiol. 1991;57:1394–1399. doi: 10.1128/aem.57.5.1394-1399.1991. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Traoré O., Laveran H. Virus à transmission entérique. In: Fabry J., editor. Maîtrise des infections nosocomiales de A à Z. Health and Co Editions; 2004. pp. 753–756. [Google Scholar]
- 8.Le Roux P., Marshall B., Toutain F., Mary J.F., Pinon G., Briquet E. Infections nosocomiales virales dans un service de pédiatrie : l’exemple des gastroentérites à rotavirus et des bronchiolites à VRS. Arch Pediatr. 2004;11:908–915. doi: 10.1016/j.arcped.2004.04.022. [DOI] [PubMed] [Google Scholar]
- 9.Bailly J.L., Béguet A., Chambon M., Henquell C., Peigue-Lafeuille H. Nosocomial transmission of echovirus 30: molecular evidence by phylogenetic analysis of the VP1 encoding sequence. J Clin Microbiol. 2000;38:2889–2892. doi: 10.1128/jcm.38.8.2889-2892.2000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Laurichesse H., Henquell C., Gourdon F., Grosjean I., Coulard J., Mabrut M. Hepatitis A and B in persons with learning disabilities living in institutions: the need for vaccination. Infection. 1998;26:133–134. doi: 10.1007/BF02767778. [DOI] [PubMed] [Google Scholar]
- 11.Lyn J., Vernon M.O., Jones R.C., Stewart A., Lu X., Zollar L.M. Outbreak of human adenovirus type 3 infection in a pediatric long-term care-facility – Illinois, 2005. Clin Infect Dis. 2007;45:416–420. doi: 10.1086/519938. [DOI] [PubMed] [Google Scholar]
- 12.Asencio-Duran M., Romero-Martin R., Garcia-Martinez J.R., Peralta-Calvo J.M., Perez-Blanco V., Garcia-Caballero J. Nosocomial outbreak of epidemic keratoconjunctivitis in a neonatal intensive care unit. Arch Soc Esp Oftalmol. 2007;82:73–80. doi: 10.4321/s0365-66912007000200004. [DOI] [PubMed] [Google Scholar]
- 13.Kimura H., Saitoh M., Miyakubo H., Yoshida H., Kato M., Nagai A. Keratoconjunctivitis caused by echovirus type 13 in Japanese children. Pediatr Infect Dis J. 2003;22:758–759. doi: 10.1097/01.inf.0000078351.59657.17. [DOI] [PubMed] [Google Scholar]
- 14.Pillonel J, Laperche S. Surveillance épidémiologique des donneurs de sang homologues et risque résiduel en France entre 2003 et 2005. Bull Epidemiol Hebd 2006;51–52:411–4. [DOI] [PubMed]
- 15.Gerberding J.L. Management of occupational exposures to blood-borne viruses. N Engl J Med. 1995;332:444–451. doi: 10.1056/NEJM199502163320707. [DOI] [PubMed] [Google Scholar]
- 16.Denis F., Aufrère A., Abitol V. La vaccination contre l’hépatite B en France. Enquête sur la couverture vaccinale en 2002. Bull Acad Med. 2004;188:115–124. [PubMed] [Google Scholar]
- 17.Alter M.J. Prevention of spread of hepatitis C. Hepatology. 2002;36:93–98. doi: 10.1053/jhep.2002.36389. [DOI] [PubMed] [Google Scholar]
- 18.Savey A., Simon F., Izopet J., Lepoutre A., Fabry J., Desenclos L.C. A large nosocomial outbreak of hepatitis C virus infections at a hemodialysis center. Infect Control Hosp Epidemiol. 2005;26:752–760. doi: 10.1086/502613. [DOI] [PubMed] [Google Scholar]
- 19.Lefrère J.J., Maniez-Montreuil M., Morel P., Defer C., Laperche S. Safety of blood products and B19 parvovirus. Transfus Clin Biol. 2006;13:235–241. doi: 10.1016/j.tracli.2006.03.016. [DOI] [PubMed] [Google Scholar]
- 20.Mazeron M.C. Cytomégalovirus. In: Pozzetto B., editor. Les infections nosocomiales virales et à agents transmissibles non conventionnels. Éditions John-Libbey Eurotext; Oxford: 2001. pp. 113–124. [Google Scholar]
- 21.Circulaire DGS/DH no 98/249 du 20 avril 1998 relative à la prévention de la transmission d’agents infectieux véhiculés par le sang ou les liquides biologiques lors des soins dans les établissements de santé.
- 22.Recommandations d’isolement septique en établissement de soin. Paris: ministère de l’Emploi et de la Solidarité, comité technique national des infections nosocomiales, Société française d’hygiène hospitalière; 1998.
- 23.Chambon M., Peigue-Lafeuille H. Antisepsie et désinfection chimiques appliquées aux virus. In: Pozzetto B., editor. Les infections nosocomiales virales et à agents transmissibles non conventionnels. Éditions John-Libbey Eurotext; Oxford: 2001. pp. 347–369. [Google Scholar]
- 24.Belliot G., Lavaux A., Souihel D., Agnello D., Pothier P. Use of murine norovirus as a surrogate to evaluate resistance of human norovirus to disinfectants. Appl Environ Microbiol. 2008;74:3315–3318. doi: 10.1128/AEM.02148-07. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Macinga D.R., Sattar S.A., Jaykus L.A., Arbogast J.W. Improved Inactivation of non-enveloped enteric viruses and their surrogates by a novel alcohol-based hand sanitizer. Appl Environ Microbiol. 2008;74:5047–5052. doi: 10.1128/AEM.00487-08. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Vu D., Peck A.J., Nichols W.G., Varley C., Englund J.A., Corey L. Safety and tolerability of oseltamivir prophylaxis in hematopoietic stem cell transplant recipients: a retrospective case-control study. Clin Infect Dis. 2007;45:187–193. doi: 10.1086/518985. [DOI] [PubMed] [Google Scholar]


