Résumé
Un chat adulte exprimant une forme nerveuse et entéritique de la panleucopénie féline développe des lésions cutanées purpuriques. L’analyse histopathologique de biopsies cutanées met en évidence des lésions de vascularite non leucocytoclasique à prédominance mononucléée. Les vascularites sont particulièrement rares chez le chat et souvent idiopathiques. La démarche diagnostique comprend l’éviction de plusieurs hypothèses, médicamenteuses ou virales (virus d’immunodéficience féline [FIV], virus leucémogène félin [FeLV], péritonite infectieuse féline [PIF]). Ce cas rappelle le purpura Henoch-Schönlein, cause la plus fréquente de vascularite chez les enfants, qui serait associé à diverses causes dont une infection par le parvovirus B19.
Mots clés: Chat, Panleucopénie, Dermatologie, Purpura, Vascularite
Summary
Purpuric cutaneous lesions occurred on an adult neutered cat diagnosed with a nervous and enteritic form of panleukopenia. Histopathology of cutaneous samples revealed predominant mononuclear non-leukocytoclasic vasculitis. Feline vasculitis has rarely been reported and etiological agents are difficult to identify. Differential diagnosis ruled out cutaneous drug reaction and several viral hypotheses such as FIV, FeLV and FIP. This case is similar to the children's most frequently vasculitis: the Henoch-Schönlein purpura, which is probably caused by the parvovirus B19.
Keywords: Cat, Panleukopenia, Dermatology, Purpura, Vasculitis
Introduction
Le virus de la panleucopénie féline [FPV] est un parvovirus responsable d’une infection systémique à transmission orofécale. La multiplication virale dans des villosités intestinales conduit au tableau clinique classique d’entérite mais sa distribution peut se faire virtuellement à tous les tissus. Deux expressions cliniques moins courantes ont été décrites : une immunodépression consécutive à une réplication virale dans les tissus lymphoïdes, voire de la moëlle osseuse [1], ainsi qu’une ataxie chez les chatons lors de l’atteinte du système nerveux central en cas d’infection périnatale ou intra-utérine [2]. Cet article décrit l’apparition de lésions cutanées associées à l’évolution d’une panleucopénie féline.
Observation
Examen clinique
Une chatte errante de type européen, âgée d’environ un an et demi, est présentée en consultation pour apathie subite et diarrhée.
Cet animal, habituellement inapprochable, est nourri depuis sa naissance avec une alimentation de grande surface. Il n’est ni vacciné, ni traité contre les parasites internes ou externes. Selon les « propriétaires », cette chatte n’a jamais nécessité de soins par le passé.
À la consultation, elle présente une hyperthermie (39,9 °C) associée à une importante altération de l’état général (apathie). Son poids de forme de 3,2 kg reflète le caractère aigu de la diarrhée. L’examen clinique général ne révèle aucune autre anomalie le jour de la réception de l’animal. Après 24 heures d’évolution, des troubles neurologiques associant un décubitus latéral, une contraction tonique permanente des membres antérieurs, puis des troubles convulsifs apparaissent.
L’examen dermatologique de l’animal révèle alors de multiples lésions tronculaires symétriques des faces latérales du thorax (des épaules à la dernière côte), ainsi que sur les racines des membres antérieurs. L’intensité des lésions semble accrue à droite (Figure 1, Figure 2 ).
Figure 1.

Vue d’ensemble latérale droite du tronc de l’animal (après tonte partielle). Noter l’extension jusqu’à l’épaule et l’absence de lésion caudalement à la dernière côte.
Figure 2.

Vue d’ensemble latérale gauche du tronc de l’animal (après tonte partielle). Noter la moindre densité lésionnelle.
Il s’agit d’un purpura siégeant sur un fond légèrement érythémateux. Quelques squames pityriasiformes sont également relevées (Fig. 3 ).
Figure 3.
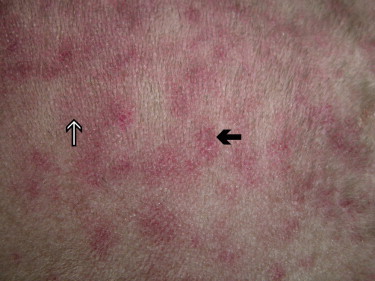
Vue rapprochée des lésions thoraciques droites. Noter le fond érythémateux ( ) et le purpura (
) et le purpura ( ).
).
Le tableau clinique est relativement fruste et se compose de diarrhées aiguës, d’une hyperthermie, compliquées en 24 heures de troubles neurologiques et de lésions purpuriques. Les cinq hypothèses diagnostiques correspondantes sont argumentées dans le tableau ci-après (Tableau 1 ).
Tableau 1.
Hypothèses diagnostiques argumentées et examens complémentaires.
| Hypothèses étiologiques | Arguments en faveur | Arguments en défaveur | Examens complémentaires |
|---|---|---|---|
| Péritonite infectieuse féline | Chat errant non vacciné Entérite, hyperthermie Purpura Troubles nerveux |
Électrophorèse des protéines PCR |
|
| Troubles de la coagulation (intoxication vitamine K, thrombopénie…) | Suffusions, purpura Chat errant Troubles nerveux |
Troubles digestifs non hémorragiques | Numération et formule sanguines Temps de coagulation Bilan biochimique Analyse d’urine Tests FeLV – FIV |
| Panleucopénie féline | Chat errant non vacciné Entérite, hyperthermie Purpura, troubles nerveux |
Adulte | Numération-formule sanguine PCR |
| Accident cutané médicamenteux | Purpura, hyperthermie | Animal non médicalisé Troubles nerveux |
Démarche d’imputabilité |
| Maladie auto-immune | Vascularite, hyperthermie | Topographie Troubles digestifs Troubles nerveux |
Histopathologie |
Examens complémentaires
La recherche antigénique du feline leucemogen virus (FeLV) et la sérologie feline immunodeficiency virus (FIV), par un test rapide sur gélose (Speed Duo FeLV/FIV®, Bio Veto Test), sont tous les deux négatifs.
Les résultats de la numération formule sanguine révèlent une faible diminution du nombre de leucocytes et de thrombocytes (Tableau 2 ). Un hémogramme confirme ces résultats et montre une importante souffrance érythrocytaire avec présence de très nombreux corps de Heinz (stress oxydatif).
Tableau 2.
Numération-formule sanguine.
| Paramètres | Résultats | Unités | Valeurs usuelles |
|---|---|---|---|
| Érythrocytes | 7,04.106 | GR/mm3 | 5–10 |
| Hémoglobine | 9,8 | g/dl | 8–15 |
| Hématocrite | 32,8 | % | 25–45 |
| Volume globulaire moyen | 47 | μm3 | 40–55 |
| Teneur corpusculaire moyenne en hémoglobine | 13,9 | pg | 13–17 |
| Concentration corpusculaire moyenne en hémoglobine | 29,8 | g/dl | 31–36 |
| Thrombocytes | 150.103 | Plq/mm3 | 180–550 |
| Leucocytes | 5,4.103 | Leuc/mm3 | 6–11 |
| Lymphocytes | 2,7.103 (51,6 %) | Lymph/mm3 | 1,2–3,2 |
| Monocytes | 0,8.103 (0 %) | Mono/mm3 | 0,3–0,8 |
| Granulocytes | 2,7.103 (47,6 %) | Gran/mm3 | 1,2–6,8 |
Les temps de coagulation (temps de Quick, temps de céphaline-kaolin, temps de thrombine), évalués par rapport à un témoin ne montrent pas de différence de plus de 20 %, nous permettant d’écarter l’hypothèse d’une intoxication aux anticoagulants.
Les analyses biochimiques sanguines sont conformes aux valeurs usuelles (urée, créatinine, glycémie, kaliémie, phosphatases alcalines, protéinémie et aminotransferasémie).
L’analyse des urines par bandelette urinaire révèle une importante hémoglobinurie ainsi qu’une bilirubinurie.
L’examen histopathologique des lésions cutanées montre un pattern de vascularite avec de nombreux foyers dermiques d’importante extravasation d’érythrocytes, parfois en périphérie de vaisseaux sanguins. Les capillaires superficiels ont parfois des parois aux cellules turgescentes et plus ou moins disjointes. Les vaisseaux sanguins de l’interface derme-hypoderme sont parfois normaux, parfois dilatés, avec des parois épaissies aux cellules turgescentes, ou, au contraire, aux parois très fines et au contenu granuleux ou finement fibrillaire, de couleur gris-bleu. Le derme superficiel est fortement congestif et œdémateux, siège d’un infiltrat inflammatoire discret, périvasculaire et périannexiel composé de cellules mononuclées (mastocytes, lymphocytes, plasmocytes et histiocytes). L’œdème et la congestion sont retrouvés autour des follicules pileux, particulièrement les follicules primaires centraux. Certaines sections nerveuses contiennent quelques cellules inflammatoires (Figure 4, Figure 5 ).
Figure 4.
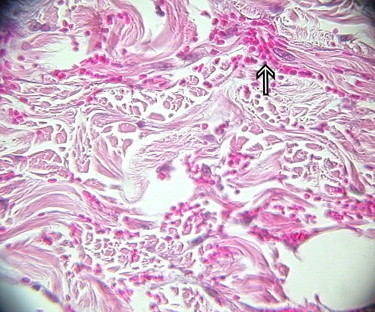
Observation microscopique d’une biopsie cutanée (HE ; X400). Noter l’importante extravasation d’érythrocytes ( ).
).
Figure 5.

Observation microscopique d’une biopsie cutanée (HE ; X400). Noter la dilatation des vaisseaux aux parois épaissies ( ).
).
Cet examen histopathologique montre des lésions modérées à graves des vaisseaux sanguins et des foyers hémorragiques.
Une recherche virale par la méthode polymerase chain reaction (PCR) sur un prélèvement de liquide céphalorachidien est négative au seuil de détection 111 pour les Coronavirus (hypothèse d’une péritonite infectieuse féline [PIF]), mais positive au seuil de détection 12 pour le Parvovirus.
Ces examens complémentaires permettent d’établir l’existence d’une vasculopathie associée à une forme digestive et nerveuse de panleucopénie féline. Le lien entre le Parvovirus félin et les lésions cutanées est fortement probable.
Un examen immunohistochimique des biopsies cutanées est réalisé afin de préciser les structures lésées (vasculaires et nerveuses). L’immunomarquage était positif au facteur VIII (marqueur des cellules endothéliales, épithéliales et mésenchymateuses) et négatif à la neurone specific enolase (marqueur exclusif des filets nerveux épidermiques) dans les zones dermiques lésées (Figure 6, Figure 7 ).
Figure 6.

Observation microscopique d’un immunomarquage (F VIII) d’une biopsie cutanée (X400). Noter le marquage des sections vasculaires lésées ( ).
).
Figure 7.

Observation microscopique d’un immunomarquage (énolase) d’une biopsie cutanée (X200). Noter le marquage des sections de nerfs extralésionnelles ( ).
).
L’examen dermatopathologique fait état d’une vascularite en stade cellulaire. Les complexes immuns ayant généralement disparu dans cette phase tardive, le marquage des chaînes lourdes ou légères des immunoglobulines n’est pas réalisé.
Discussion
Les vascularites constituent un ensemble d’affections polymorphes liées à un mécanisme immunologique responsable d’une nécrose fibrinoïde de la paroi vasculaire et d’une réaction inflammatoire périvasculaire [3]. Les causes des vascularites sont multiples, incluant des organismes infectieux (bactéries, mycobactéries, virus, rickettsies, agents fongiques, leishmaniose…), des agents exogènes (médicaments, vaccins, additifs alimentaires, toxines, froid…) ou endogènes (néoplasiques, allergiques ou secondaires à une maladie systémique tels le lupus ou la dermatomyosite…) (Tableau 3 ) [3], [4], [5], [6], [7]. Trente à 50 % des vascularites cutanées sont dites « idiopathiques » [3], [8].
Tableau 3.
Principales causes de vascularites canines et félines.
| Infectieuse | Bactériennes, virales (FIV, FeLV, PIF) |
| Parasitaire | Leishmaniose |
| Fongique | |
| Allergique | Hypersensibilité staphylococcique |
| Auto-immune | Lupus érythémateux |
| À mécanisme immunitaire | Toxidermie, vaccination antirabique |
| Environnementale | Cathéters intraveineux, froid (cryoglobulines) |
| Médicamenteuse | Carprofène, sulfadiazine, amoxycilline, énalapril, phénylbutazone, ivermectine, itraconazole, méloxicam… |
| Néoplasique | |
| Génodermatoses | Dermatomyosite, pyogranulome nasal, vascularite du Scottish Terrier, vascularite du Shar Peï |
| Idiopathique |
Dans l’espèce féline, quatre causes de vascularites sont décrites : les accidents cutanés médicamenteux, les vaccins (rage ou herpès/calicivirus/panleucopénie), les infections virales (FeLV, FIV, PIF) et les vascularites idiopathiques [5], [9].
Les cas rapportés de vascularite médicamenteuse sont associés à diverses molécules telles que le carprofène, la sulfadiazine, l’amoxycilline, l’énalapril, la phénylbutazone, l’ivermectine, l’itraconazole ou le meloxicam. Toutefois, les scores d’imputabilité variablement significatifs laissent planer un doute sur le rôle réel de ces molécules [8]. Dans le cas du chat étudié, la démarche d’imputabilité concernant l’enrofloxacine (administrée en injection intraveineuse unique à 5 mg/kg 12 à 18 heures avant l’observation des signes cutanés) a permis d’écarter son rôle éventuel.
Le statut sauvage de ce chat errant exclut l’hypothèse d’une vascularite par réaction vaccinale.
L’hypothèse d’une vascularite d’origine virale a été explorée et documentée.
En médecine humaine, de nombreux cas de vascularites cutanées sont décrits en relation avec l’intervention d’un virus [10]. Le virus de l’hépatite C (HCV) est décrit depuis les années 1990 comme responsable de vascularites associées aux maladies des agglutinines froides (cryoglobulinémies) [11], [12]. La production de ces cryoglobulines de type III (à immunoglobulines polyclonales) est le résultat de l’interaction entre l’hôte et le virus. Les anticorps produits contre le HCV (et/ou l’ARN viral) sont trouvés dans 96 % des patients atteints de cryoglobulinémie mixte. Des facteurs locaux, le refroidissement et une stase prédisposent à la formation des lésions. Ces vascularites par dépôts d’immuns complexes sont caractérisées histologiquement par la présence de thromboses vasculaires dermiques, une nécrose aiguë de l’épiderme et du derme et la présence dans les vaisseaux dermiques dilatés d’une substance amorphe éosinophile, positive à l’acide périodique de Schiff (PAS). L’infection par le virus d’immunodéficience humaine (VIH) a aussi été associée à la production de cryoglobulines et à l’apparition de vascularites [10].
D’autres vascularites d’origine virale sont décrites parmi lesquelles le virus de l’hépatite B (HBV) responsable de vascularites cutanées lors de polyartérite noueuse cutanée [10], [13], [14], [15], [16], [17], certains Paramyxovirus (virus Nipah) [18], des Arbovirus (virus Chikungunya) [19], d’autres herpès-virus (varicelle) ou des Cytomégalovirus [20], [21].
Toujours en médecine humaine, le purpura Henoch-Schönlein désigne une vascularite touchant principalement les petits vaisseaux et comprenant, parmi les manifestations les plus fréquentes, un purpura, une arthrite et une atteinte rénale. C’est la cause la plus fréquente de purpura non-thrombocytopénique et de vascularite chez les enfants.
La pathogenèse du purpura Henoch-Schönlein est actuellement inconnue, mais serait probablement due à une altération immunitaire associée à diverses causes (bactériennes, virales, médicamenteuses…) dont une infection par le Parvovirus B19 [22], [23]. Dans le purpura Henoch-Schönlein lié au Parvovirus B19, les lésions histologiques résulteraient du dépôt de complexes immuns formés d’antigènes viraux et d’anticorps responsables de l’activation de la voie classique du complément et du recrutement de polynucléaires neutrophiles [24]. Le Parvovirus B19 présenterait une affinité pour l’endothélium et les globules rouges et un effet cytotoxique médié par une protéine virale non structurale appelée NS-1, induisant l’apoptose des cellules par le TNF-α. Cet effet pourrait expliquer la sélectivité des dommages à la peau et aux reins caractéristiques des purpuras Henoch-Schönlein, et pourrait rendre les cellules plus sensibles aux dépôts d’IgA. Ce constat s’appuie sur des dosages sériques d’IgM, d’IgG3, de la présence d’ADN viral dans le sang périphérique, d’ARN viral dans les cellules endothéliales de la peau et les capillaires glomérulaires et la détection du gène de la NS-1 significativement plus importante chez les individus atteints [25], [26]. Les nombreuses études consacrées à l’association entre les lésions de vascularite et le Parvovirus B19 suggèrent le rôle direct du virus ciblant les cellules endothéliales et les cellules mononucléées environnantes [26], [27], [28], [29], [30].
On associe également d’autres type de vascularites au Parvovirus B19 selon la taille des vaisseaux sanguins affectés : un purpura Henoch-Schönlein ou une granulomatose de Wegener lors d’atteinte de petits vaisseaux, une périartérite noueuse pour des vaisseaux de taille moyenne et une artérite à cellules géantes pour les gros vaisseaux [22], [27].
En médecine vétérinaire, des descriptions de vascularites associées à des virus ont été rapportées dans plusieurs espèces. Toutefois, les lésions cutanées sont relativement rares et sont toujours associées à une atteinte systémique. Chez le porc, plusieurs études suggèrent un rôle direct du circovirus de type 2 dans le syndrome dermatite-néphropathie porcin. Dans cette affection, les lésions de vascularite nécrosante systémique à complexes immuns sont attribuées au circovirus grâce à l’immunomarquage positif de ce virus sur de nombreux organes atteints. Néanmoins, la preuve définitive de cette association au niveau cutané n’a pas encore pu être faite [31], [32], [33]. Comme chez l’homme, l’herpès virus est responsable de lésions de vascularite dans plusieurs espèces mais les formes cutanées sont extrêmement rares [34]. Un seul cas de vascularite cutanée associée à l’Herpès virus caprin type 2 a été rapporté chez le cerf [35].
Le rôle d’un Iridovirus appartenant aux Ranavirus a été suspecté chez des tortues présentant des lésions de vascularite fibrinoïde cutanée. Aucun corps d’inclusion n’a toutefois pu être mis en évidence en microscopie ou microscopie électronique des lésions [36]. Chez le chien, aucun cas de vascularite associée à un virus n’a été rapporté.
En médecine féline, des cas de vascularite cutanée associées à une affection virale ont été décrits chez le chat, mais uniquement en association avec le virus de la PIF [37], [38]. Le cas d’un chat Sphinx, décrit par Gross et al., était caractérisé histologiquement par une vascularite leucocytoclasique avec une inflammation granulomateuse dans laquelle des neutrophiles entourant, voire obstruant, des petits vaisseaux sanguins dermiques pouvaient être observés. Un examen immunohistochimique avait permis de révéler la présence d’antigènes du Coronavirus dans les macrophages [3]. Un autre cas a été rapporté sur un chat co-infecté par le virus de la PIF et le virus FIV. Des antigènes de coronavirus ont été mis en évidence dans les macrophages confirmant la pathogénèse viro-associée des lésions cutanées [39].
Dans le cas étudié ici, les tests antigéniques pour le virus FeLV et une sérologie FIV se sont révélés tous les deux négatifs, excluant une cause rétrovirale à la vascularite. Le résultat PCR négatif pour le virus de la PIF en présence d’une atteinte nerveuse discrédite l’hypothèse d’une PIF.
Toutefois, la présence d’ADN viral du Parvovirus en forte proportion dans le liquide céphalorachidien, associée aux manifestations cliniques digestives et nerveuses a permis l’établissement du diagnostic de panleucopénie féline. La panleucopénie féline est une affection virale dans laquelle la forme nerveuse (observée sur notre chat adulte) est relativement atypique et caractérise une évolution aiguë conduisant rapidement à la mort [2], [40], [41], [42], [43]. Cette forme clinique est plus fréquemment observée sur de jeunes chatons de trois à cinq mois [44]. Les autres symptômes associés regroupent une diarrhée et une leucopénie (non relevée ici). Des pétéchies et des ecchymoses peuvent rarement être relevées chez des animaux présentant des complications de type coagulation intravasculaire disséminée, ces signes hémorragiques restant très exceptionnels même sur des animaux à thrombocytopénie marquée [44].
À la lumière de l’anamnèse, des éléments cliniques et histopathologiques de ce cas, les lésions de vascularite cutanée sont très probablement associées au Parvovirus de la panleucopénie féline [FPV]. À la connaissance de l’auteur, ce cas constitue la première description de vascularite consécutive à une infection par ce virus.
Conflit d’intérêt
Aucun.
Source
Travaux personnels.
Remerciements
Remerciements pour leur collaboration au docteur Didier Pin, au docteur Marielle Servonnet (Merial) et au docteur Corine Boucraut-Baralon (Scanelis).
Footnotes
Crédits de formation continue. La lecture de cet article ouvre droit à 0,05 CFC. La déclaration de lecture, individuelle et volontaire, est à effectuer auprès du CNVFCC (cf. sommaire).
Références
- 1.Parrish C.R. Pathogenesis of feline panleukopenia virus and canine parvovirus. Baillieres Clin Haematol. 1995;8:57–71. doi: 10.1016/S0950-3536(05)80232-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kilham L., Margolis G., Colby E.D. Cerebellar ataxia and its congenital transmission in cats by feline panleukopenia virus. J Am Vet Med Assoc. 1971;158:888–901. [PubMed] [Google Scholar]
- 3.Sunderkötter C., Sindrilaru A. Clinical classification of vasculitis. Eur J Dermatol. 2006;16:114–124. [PubMed] [Google Scholar]
- 4.Gross TL, Ihrke P, Walder EJ, Affolter VK. Vascular diseases of the dermis. Skin diseases of the dog and cat. Oxford: Blackwell Science Ltd; 2006. p. 238–60.
- 5.Scott DW, Miller WH, Griffin CE. Viral, rickettsial and protozoal skin diseases. In: Scott DW, Miller WH, Griffin CE. (eds.), Muller and Kirk's Small Animal Dermatology. 6th Edition, Philadelphia: W.B. Saunders Company; 2001. p. 180–2, p. 517–28, p. 742–56.
- 6.Vitale G.M. Vaccine-induced ischemic dermatopathy in the dog. Vet Dermatol. 1999;10:131–142. doi: 10.1046/j.1365-3164.1999.00131.x. [DOI] [PubMed] [Google Scholar]
- 7.Parra-Sanchez A., Lugo J., Boothe D.M., Gaughan E.M., Hanson R.R., Duran S. Pharmacokinetics and pharmacodynamics of enrofloxacin and a low dose of amikacin administered via regional intravenous limb perfusion in standing horses. Am J Vet Res. 2006;67:1687–1695. doi: 10.2460/ajvr.67.10.1687. [DOI] [PubMed] [Google Scholar]
- 8.Nichols P.R., Morris D.O., Beale K.M. A retrospective study of canine and feline cutaneous vasculitis. Vet Dermatol. 2001;12:255–264. doi: 10.1046/j.0959-4493.2001.00268.x. [DOI] [PubMed] [Google Scholar]
- 9.Addie D., Belak S., Boucraut-Baralon C., Egberink H., Frymus T., Gruffydd-Jones T. Feline infectious peritonitis. ABCD guidelines on prevention and management. J Feline Med Surg. 2009;11:594–604. doi: 10.1016/j.jfms.2009.05.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Sharlala H., Adebajo A. Virus-induced vasculitis. Curr Rheumatol Rep. 2008;10:449–452. doi: 10.1007/s11926-008-0073-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Cacoub P., Saadoun D. Hepatitis C virus infection induced vasculitis. Clinic Rev Allerg Immunol. 2008;35:30–39. doi: 10.1007/s12016-007-8070-x. [DOI] [PubMed] [Google Scholar]
- 12.Ferri C. Mixed cryoglobulinemia. Orphanet J Rare Dis. 2008;3:1–17. doi: 10.1186/1750-1172-3-25. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Brownell I., Fangman W. Hepatitis C virus infection, type III cryoglobulinemia, and necrotizing vasculitis. Derm Online J. 2007;13(1):6. [PubMed] [Google Scholar]
- 14.Landau D.A., Rosenzwajg M., Saadoun D., Trebeden-Negre H., Klatzmann D., Cacou P. Correlation of clinical and virologic responses to antiviral treatment and regulatory T cell evolution in patients with hepatitis C virus-induced mixed cryoglobulinemia vasculitis. Arthritis Rheum. 2008;58:2897–2907. doi: 10.1002/art.23759. [DOI] [PubMed] [Google Scholar]
- 15.Poljacki M., Gajinov Z., Ivkov M., Matic M., Golusin Z. Skin diseases and hepatitis virus C infection. Med Pregl. 2000;53:141–145. [PubMed] [Google Scholar]
- 16.Tini G.M., Wuscher V., Jecker R. Hepatitis C infection with false negative serology in patient with mixed cryoglobulinemic vasculitis. Dtsch Med Wochenschr. 2007;132:616–618. doi: 10.1055/s-2007-970387. [DOI] [PubMed] [Google Scholar]
- 17.Della Rossa A., Baldini C., Tavoni A., Bombardieri S. How HCV has changed the approach to mixed cryoglobulinemia. Clin Exp Rheumatol. 2009;27:S115–S123. [PubMed] [Google Scholar]
- 18.Maisner A., Neufeld J., Weingartl H. Organ- and endotheliotropism of Nipah virus infections in vivo and in vitro. Thromb Haemost. 2009;102:1014–1023. doi: 10.1160/TH09-05-0310. [DOI] [PubMed] [Google Scholar]
- 19.Jaffar-Bandjee M.C., Das T., Hoarau J.J., Krejbich Trotot P., Denizot M., Ribera A. Chikungunya virus takes centre stage in virally induced arthritis: possible cellular and molecular mechanisms to pathogenesis. Microbes Infect. 2009;11:1206–1218. doi: 10.1016/j.micinf.2009.10.001. [DOI] [PubMed] [Google Scholar]
- 20.Lidar M., Lipschitz N., Langevitz P., Shoenfeld Y. The infectious etiology of vasculitis. Autoimmunity. 2009;42:432–438. doi: 10.1080/08916930802613210. [DOI] [PubMed] [Google Scholar]
- 21.Prose N.S. Cutaneous manifestations of pediatric HIV infection. Pediatr Clin. 1992;9:326–328. doi: 10.1111/j.1525-1470.1992.tb00618.x. [DOI] [PubMed] [Google Scholar]
- 22.Meyer O. Parvovirus B19 and auto-immune diseases. Joint Bone Spine. 2003;70:6–11. doi: 10.1016/s1297-319x(02)00004-0. [DOI] [PubMed] [Google Scholar]
- 23.Palumbo E., Sodini F., Boscarelli G., Nasca G., Branchi M., Pellegrini G. Immune thrombocytopenic purpura as a complication of Bartonella henselae infection. Infez Med. 2008;16:99–102. [PubMed] [Google Scholar]
- 24.Guilpain P., Servettaz A., Tamby M.C., Chanseaud Y., Le Guern V., Guillevin L. Pathogenesis of primary systemic vasculitides (II): ANCA-negative vasculitides. Presse Med. 2005;34:1023–1033. doi: 10.1016/s0755-4982(05)84105-3. [DOI] [PubMed] [Google Scholar]
- 25.Alonso-Ojembarrena A., Alvarez-Coca J., Perez-Garcia M.J., Martinez-Perez J., Rubio de Villanueva J.L. Henoch-Schönlein purpura due to Parvovirus B19. An Pediatr (Barc) 2006;65:641–642. doi: 10.1157/13096171. [DOI] [PubMed] [Google Scholar]
- 26.Magro C.M., Crowson A.N., Dawood M., Nuovo G.J. Parvoviral infection of endothelial cells and its possible role in vasculitis and auto-immune diseases. J Rheumatol. 2002;29:1227–1235. [PubMed] [Google Scholar]
- 27.Cioc A.M., Sedmak D.D., Nuovo G.J., Dawood M.R., Smart G., Magro C.M. Parvovirus B19 associated adult Henoch-Schönlein purpura. J Cutan Pathol. 2002;29:602–607. doi: 10.1034/j.1600-0560.2002.291006.x. [DOI] [PubMed] [Google Scholar]
- 28.Heegaard E.D., Taaning E.B. Parvovirus B19 and Parvovirus V9 are not associated with Henoch-Schönlein purpura in children. Pediatr Infect Dis J. 2002;21:31–34. doi: 10.1097/00006454-200201000-00007. [DOI] [PubMed] [Google Scholar]
- 29.Quemeneur T., Lambert M., Fauchais A.L., Queyrel V., Michon-Pasturel U., Hachulla E. Rheumatoid purpura in adults and Parvovirus B19 infection: fortuitous association or Parvovirus B19-induced vasculitis? Rev Med Interne. 2002;23:77–80. doi: 10.1016/s0248-8663(01)00516-1. [DOI] [PubMed] [Google Scholar]
- 30.Magro C.M., Dawood M.R., Crowson A.N. The cutaneous manifestations of human Parvovirus B19 infection. Hum Pathol. 2000;31:488–497. doi: 10.1053/hp.2000.6714. [DOI] [PubMed] [Google Scholar]
- 31.Krakowka S., Hartunian C., Hamberg A., Shoup D., Rings M., Zhang Y. Evaluation of induction of porcine dermatitis and nephropathy syndrome in gnotobiotic pigs with negative results for porcine Circovirus type 2. Am J Vet Res. 2008;69:1615–1622. doi: 10.2460/ajvr.69.12.1615. [DOI] [PubMed] [Google Scholar]
- 32.Langohr I.M., Stevenson G.W., Nelson E.A., Lenz S.D., HogenEsch H., Wei H. Vascular lesions in pigs experimentally infected with porcine circovirus type 2 serogroup B. Vet Pathol. 2010;47:140–147. doi: 10.1177/0300985809352793. [DOI] [PubMed] [Google Scholar]
- 33.Phaneuf L.R., Ceccarelli A., Laing J.R., Moloo B., Turner P.V. Porcine dermatitis and nephropathy syndrome associated with porcine Circovirus 2 infection in a Yorkshire pig. J Am Assoc Lab Anim Sci. 2007;46:68–72. [PubMed] [Google Scholar]
- 34.Alcaraz A., Warren A., Jackson C., Gold J., Mc Coy M., Sheong S.H. Naturally occurring sheep-associated malignant catarrhal fever in North American pigs. J Vet Diagn Invest. 2009;21:250–253. doi: 10.1177/104063870902100214. [DOI] [PubMed] [Google Scholar]
- 35.Keel M.K., Patterson J.G., Noon T.H., Bradley G.A., Collins J.K. Caprine Herpesvirus-2 in association with naturally occurring malignant catarrhal fever in captive sika deer (Cervus nippon) J Vet Diagn Invest. 2003;15:179–183. doi: 10.1177/104063870301500215. [DOI] [PubMed] [Google Scholar]
- 36.De Voe R., Geissler K., Elmore S., Rotstein D., Lewbart G., Guy J. Ranavirus-associated morbidity and mortality in a group of captive eastern box turtles (Terrapene carolina carolina) J Zoo Wildl Med. 2004;35:534–543. doi: 10.1638/03-037. [DOI] [PubMed] [Google Scholar]
- 37.Guaguere E., Declerq J. Dermatoses virales. In: Guaguere E., Prelaud P., editors. Vol. 7. Merial; Lyon: 1999. p. 2. (Guide pratique de dermatologie Féline). [Google Scholar]
- 38.Vellard H. Les lésions cutanées ou muqueuses induites par les virus chez le chat (thèse). Lyon: université Claude Bernard; 2008. p. 146.
- 39.Cannon M.J., Silkstone M.A., Kipar A.M. Cutaneous lesions associated with coronavirus-induced vasculitis in a cat with feline infectious peritonitis and concurrent feline immunodeficiency virus infection. J Feline Med Surg. 2005;7:233–236. doi: 10.1016/j.jfms.2004.12.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Csiza C.K., De Lahunta A., Scott F.W., Gillespie J.H. Pathogenesis of feline panleukopenia virus in susceptible newborn kitten II. Pathology and immunofluorescence. Infect Immun. 1971;3:838–846. doi: 10.1128/iai.3.6.838-846.1971. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Sharp N.J., Davis B.J., Guy J.S. Hydranencephaly and cerebellar hypoplasia in two kittens attributed to intrauterine Parvovirus infection. J Comp Pathol. 1999;121:39–53. doi: 10.1053/jcpa.1998.0298. [DOI] [PubMed] [Google Scholar]
- 42.Kilham L., Margolis G., Colby E.D. Cerebellar ataxia and it's congenital transmission in cats by feline panleukopenia virus. J Am Vet Assoc. 1971;158:888–901. [PubMed] [Google Scholar]
- 43.Parrish C.R. Pathogenesis of feline panleukopenia virus and canine Parvovirus, Parvoviruses. Bailliere's Clin Haem. 1995;8:57–71. doi: 10.1016/S0950-3536(05)80232-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Greene C.E., Addie D.D. Feline panleukopenia. In: Greene C.E., editor. Infectious diseases of the dog and cat. WB Saunders; Philadelphia: 2006. pp. 78–86. [Google Scholar]


