Abstract
Une chatte Exotic Shorthair de quatre ans est présentée en consultation pour une diarrhée associée à de l’hématochézie et du ténesme, évoluant depuis deux ans. L’exploration biologique et endoscopique a permis de mettre en évidence, après biopsies, une colite ulcérative et granulomateuse associée à une infection à Anaerobiospirillum spp. L’animal est traité avec une antibiothérapie (métronidazole) et une corticothérapie : les symptômes ont disparu et aucune rechute n’est notée après un an. Ce cas clinique discute du rôle pathogène d’Anaerobiospirillum spp. en médecine humaine et en médecine vétérinaire : la notion de portage asymptomatique est évoquée ; il illustre également la difficulté diagnostique de cette infection et le recours indispensable à des examens complémentaires, histologiques et coprologiques ; il discute de la prise en charge thérapeutique et la compare aux données de la littérature.
Mots clés: Colite, Chat, Anaerobiospirillum spp., Diarrhée
Abstract
A 4-year-old female, Exotic Shortair cat presented for diarrhea with hematochezia and tenesmus for 2 years. Further diagnostic (biology, endoscopy) revealed an ulcerative and granulomatous colitis with Anaerobiospirillum spp. infection. Medical treatment with antibiotics and corticosteroids was implemented: the symptoms resolved and no relapse was noted. This case report discuss the pathogenic role of Anaerobiospirillum spp. infection in human and veterinary medicines: the “asymptomatic carriage” concept in evoked; moreover, it shows that make a diagnosis of this infection is difficult in the dog and the need for it to resort to further diagnostic like histological and coprologic analyses; it focuses on the therapy and the data of the medical literature.
Keywords: Colitis, Cat, Anaerobiospirillum spp., Diarrhea
Introduction
La diarrhée et le ténesme, associés à de l’hématochézie, oriente vers une atteinte colique d’origine infectieuse, inflammatoire, obstructive ou fonctionnelle. Les agents infectieux, notamment parasitaires et bactériens, sont régulièrement décrits dans l’espèce féline comme étant à l’origine de colite mais nombreux de ces agents (bactériens surtout) restent des agents étiologiques « suspects » souvent par analogie et extension de la médecine humaine : leur rôle pathogène n’est pas clairement élucidé. Le diagnostic est donc parfois délicat, nécessite d’associer plusieurs techniques d’examens complémentaires et demande au clinicien de porter un regard critique sur les résultats obtenus. Le suivi de l’animal reste primordial dans ces pathologies à étiologie douteuse.
Observations
Commémoratifs, anamnèse
Une chatte Exotic Shorthair de quatre ans est présentée en consultation pour une diarrhée associée à de l’hématochézie et du ténesme, évoluant depuis deux ans, ne rétrocédant que temporairement au traitement symptomatique (sulfaguanidine, smectite, atropine, kaolin) et s’aggravant depuis un mois. L’animal est à jour de ses vaccinations (typhus, coryza, leucose) et vermifugé régulièrement (milbémycine-praziquantel). L’animal est resté en France métropolitaine.
Examen clinique
L’animal est alerte, en bon état d’entretien (2,9 kg) et normotherme (38,3 °C). Les constantes vitales cardiovasculaires et respiratoires ne montrent aucune anomalie. Les nœuds lymphatiques périphériques sont de taille normale. L’examen de la cavité buccale et de la sphère oto-rhino-laryngée ne montre pas d’anomalie. La palpation abdominale permet de mettre en évidence un épaississement et une induration du côlon. Du sang est visualisé aux berges de l’anus. Une atteinte digestive colique est suspectée à ce stade.
Démarche diagnostique et examens complémentaires
Un bilan hématologique, biochimique et endocrinien (T4) sanguin et une analyse urinaire ne montre aucune anomalie. Les recherches de rétrovirus (virus de l’immunodéficience féline et virus leucémogène félin) par immunochromatographie rapide sont négatives.
Des examens coproscopiques répétés sur selles fraîches, après enrichissement par flottaison (solution au nitrate de sodium 29,5 %) ne permettent pas d’isoler de parasite et une analyse polymerase chain reaction (PCR) de l’écouvillon rectal se révèle négatif pour la recherche de Giardia, Tritrichomonas, Cryptosporidium, parvovirus et coronavirus. Un traitement anti-parasitaire (fenbendazole : 50 mg/kg par jour pendant cinq jours) a néanmoins été mis en place sans entraîner de réelle amélioration.
Une échographie abdominale confirme les remaniements coliques suspectés à l’examen clinique : il est noté un épaississement de la paroi colique mais avec une stratification conservée, ainsi que des ganglions de drainage réactionnels.
À l’examen endoscopique colique, la paroi colique montre un aspect très remanié, œdémateux, congestif et ulcéré de la muqueuse (Fig. 1a et b). Aucune masse, ni bride, ni diverticule n’est mis en évidence. La dilatation de la paroi colique par insufflation d’air se révèle très difficile, rendant la lumière colique quasiment virtuelle à la jonction côlon descendant/côlon transverse (Fig. 2 ). Des biopsies de la paroi colique sont réalisées.
Figure 1.

a et b : aspect macroscopique de la muqueuse colique à l’examen endoscopique.
Figure 2.
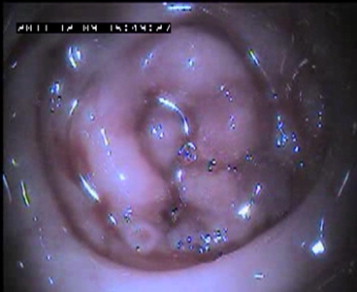
Lumière digestive très petite à la jonction colon descendant/transverse malgré l’insufflation d’air. Noter les saignements.
Diagnostic
L’examen histologique des biopsies coliques permet de conclure à une colite érosive, pyogranulomateuse, multifocale, d’intensité modérée avec colonisation intra-lésionnelle (parfois au sein des lumières glandulaires coliques) par des bacilles spiralés colorés au Warthin Starry évocateur d’une infection à Anaerobiospirillum spp. ou d’une campylobactériose (ou Campylobacter like-organisms) (Figure 3, Figure 4, Figure 5, Figure 6 ). Aucun élément parasitaire n’est objectivé y compris après un examen au Periodic Acid Shiff (PAS). Une coloration par le Fite Facaro (recherche de mycobactéries) est restée négative. Une culture de selles, sur milieu sélectif, se révèle négatif pour la recherche de Campylobacter spp.
Figure 3.
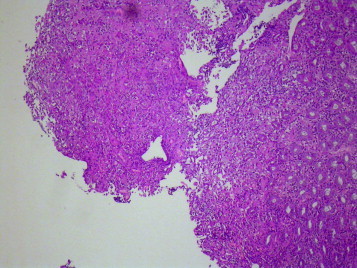
Histologie conventionnelle des biopsies coliques (Hémalun-Eosine, × 100) : aspect érodé et ulcéré du revêtement colique superficiel, soutenu par un chorion inflammatoire, infiltré de plasmocytes, neutrophiles, lymphocytes et de nombreux macrophages (laboratoire VET-HISTO).
Figure 4.
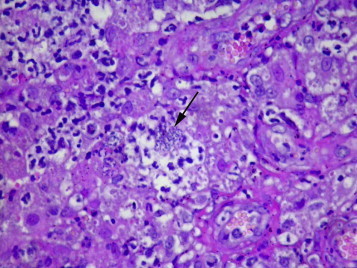
Histologie conventionnelle des biopsies coliques (Hémalun-Eosine, × 600) : territoire d’inflammation pyogranulomateuse contenant de volumineuses colonies (flèche) de bacilles de grande taille (laboratoire VET-HISTO).
Figure 5.
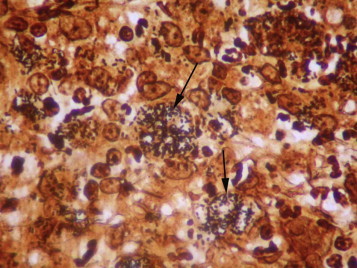
Coloration au Warthin Starry des biopsies coliques (× 600) : volumineuses colonies bacillaires (flèches) au sein du chorion (laboratoire VET-HISTO).
Figure 6.

Coloration au Warthin Starry des biopsies coliques (× 800) : prolifération bacillaire et colonisation des lumières glandulaires coliques (laboratoire VET-HISTO).
Un diagnostic de colite à Anaerobiospirillum spp. est suspecté.
Traitement – Évolution
Une antibiothérapie est mise en place (métronidazole : 20 mg/kg par 12 heures pendant deux mois) : la diarrhée hémorragique disparaît en trois jours et le ténesme s’estompe progressivement en deux semaines. Un contrôle endoscopique est réalisé au bout de dix semaines (Fig. 7a et b). Les lésions macroscopiques et histologiques se sont améliorées : il persiste encore de rares amas bacillaires au sein d’une population de lymphocytes, plasmocytes et rares macrophages : une corticothérapie est rajoutée (2 mg/kg par jour avec diminution progressive par palier de deux semaines) à l’administration de métronidazole. Au bout de trois mois, le traitement est arrêté : l’animal ne présente plus de symptômes. Aucune rechute n’est notée après un an.
Figure 7.

a et b : aspect macroscopique de la muqueuse colique à l’examen endoscopique dix semaines post-traitement.
Discussion
Anaerobiospirillum est un genre de petites bactéries mobiles, spiralées, gram-négatives et anaérobies [1] ; A. thomasii, A. succiniciproducens et autres « anaerobiospirillum-like organisms » sont rapportés comme étant des agents étiologiques de diarrhée, de vomissements et de bactériémie chez l’homme [2]. Ces bactéries ne sont pas isolées dans les selles d’hommes sains [1] mais ont été mises en culture à partir de selles de chiens et chats asymptomatiques ou diarrhéiques. Chez le chat et le chien sain, la prévalence respective du portage varie de 0 à 70 % (études à partir de 21 et dix chats en bonne santé) et de 8 à 30 % (études à partir de 52 et dix chiens en bonne santé) [2], [3]. La prévalence est respectivement d’environ 3 et 7 % chez le chat et le chien diarrhéique [3]. Peu d’études ont essayé d’établir un lien entre l’isolement d’Anaerobiospirillum dans les selles et l’existence de diarrhées chez le chat. Rossi et al., à partir d’une étude sur 84 chats, sains et diarrhéiques, rapportent qu’il n’existe pas de corrélation statistiquement significative entre l’isolement bactérien et les signes cliniques [3].
Néanmoins, De Cock et al. décrivent six chats présentant des lésions histologiques d’iléite et/ou colite associées à une visualisation microscopique de bactéries spiralées au sein du tissu intestinal et à un isolement d’Anaerobiospirillum spp. à partir des biopsies digestives grâce à des techniques moléculaires d’amplification génétique [4]. Les lésions histologiques décrites sont semblables au cas présenté : les amas bacillaires sont retrouvés également au sein du chorion et surtout au sein de la lumière des glandes coliques.
Parmi ces chats, cinq présentent un état d’immunodépression présumé, probablement secondaire à des pathologies concomitantes. En médecine humaine, l’immunodépression est démontrée comme étant un facteur de risque pour le développement d’une septicémie à Anaerobiospirillum spp. [5]. Dans le cas présenté ici, aucune pathologie associée n’a été détectée.
Misawa et al. ont également suspecté le rôle pathogène de cette bactérie chez un chiot de deux mois présentant une diarrhée hémorragique, et chez lequel une population importante d’Anaerobiospirillum (deux espèces), associée à des souches de Campylobacter et Helicobacter, a été isolée [6].
Bien que l’implication d’Anaerobiospirillum dans les diarrhées chez le chien et le chat n’a pas été clairement démontrée, plusieurs éléments suggèrent son rôle pathologique, notamment dans le cas présenté :
-
•
Anaerobiospirillum n’est pas une population majeure de la flore intestinale normale du chien et du chat sain [6] ; l’isoler chez un chat diarrhéique suggère un lien de cause à effet ;
-
•
la coexistence, chez un chat malade, d’une très grande quantité de bacilles au sein des cellules glandulaires coliques et de lésions histologiques inflammatoires, conforte ce lien ; tout comme l’amélioration de ces mêmes lésions, qui semble associée à une diminution de la charge bactérienne tissulaire ;
-
•
l’amélioration clinique et histologique notée après l’utilisation d’une antibiothérapie seule initiale évoque un contexte infectieux.
L’évolution clinique du cas présenté est satisfaisante avec une guérison clinique, sans rechute après un an. Cette observation est à confronter aux six cas présentés par De Cock et al. qui ont tous connus une évolution fatale : cela pourrait s’expliquer par une état clinique initial moins grave, une absence de pathologies concomitantes, une sensibilité des bactéries intra-pariétales à l’antibiotique utilisé ou encore une quantité de bactéries plus faible au sein du tube digestif. Une autre hypothèse pourrait être que certaines espèces d’Anaerobiospirillum spp. soient responsables uniquement de diarrhée, comme dans notre cas, et que d’autres, plus pathogènes, puissent compliquer le tableau clinique en étant à l’origine de bactériémie.
La sensibilité des Anaerobiospirillum spp. aux antibiotiques n’a pas été étudiée en médecine vétérinaire : il est décrit des thérapies anti-microbiennes traditionnelles (sulfasalzine, chloramphénicol, métronidazole, tylosine, enrofloxacine, amoxicilline/acide clavulanique, spiramycine) [7]. En médecine humaine, lors de bactériémie, il est décrit de nombreuses résistances à la clindamycine et au métronidazole : les céphalosporines, l’amoxicilline/acide clavulanique et les quinolones semblent être efficaces [8]. Dans notre cas, le métronidazole a permis d’obtenir une réponse clinique, probablement à cause de son spectre sur les germes anaérobies et aussi de son rôle immunomodulateur. L’emploi d’imidazolés peut se faire en première intention chez le chat présentant des colites ulcératives : des réponses favorables sont souvent obtenues en pratique. L’ajout d’une corticothérapie peut être discuté : l’infiltration inflammatoire de la muqueuse colique pourrait être un facteur favorisant de l’infection bactérienne (maladie inflammatoire chronique de l’intestin avec complication bactérienne) ou une conséquence de l’infection bactérienne.
Le diagnostic de certitude reste une difficulté, d’autant plus qu’il n’existe pas en France, en routine, de moyen diagnostique pour isoler Anaerobiospirillum spp. Les techniques décrites dans la littérature restent réservées à la recherche ou aux milieux hospitaliers : il peut s’agir de kit de réactions enzymatiques [2] ou de techniques d’amplifications moléculaires par polymérisation en chaînes de l’acide ribonucléique ribosomique 16S des bactéries [3], [4], [5], [6]. L’observation microscopique de bactéries spiralées au sein des biopsies manque clairement de spécificité rendant la confirmation du diagnostic délicate. L’implication d’Anaerobiospirillum spp. peut donc être à ce jour uniquement évoquée et suspectée.
Étant donné cette difficulté, le diagnostic différentiel doit se faire avec les autres maladies bactériennes du tube digestif et notamment avec la Campylobactériose, par mise en culture sur milieu sélectif ou par PCR sur selles [4], [6].
Déclaration d’intérêts
L’auteur déclare ne pas avoir de conflits d’intérêts en relation avec cet article.
Remerciements
Nous remercions le laboratoire VET-HISTO pour son aide au diagnostic et le Dr Villafranca pour sa participation à ce cas.
Footnotes
Crédits de formation continue. – La lecture de cet article ouvre droit à 0,05 CFC. La déclaration de lecture, individuelle et volontaire, est à effectuer auprès du CNVFCC (cf. sommaire).
Références
- 1.Greene C.E. Anaerobiospirillum infection. In: Greene C.E., editor. Infectious diseases of the dog and cat. 3rd ed. Elsevier; Saint Louis: 2006. pp. 354–355. [Google Scholar]
- 2.Malnick H., Williams K., Phil-Ebosie J., Levy A.S. Description of a medium for isolating Anaerobiospirillum spp., a possible cause of zoonotic disease, from diarrheal feces and blood of humans and use of the medium in a survey of human, canine and feline feces. J Clin Microbiol. 1990;28:1380–1384. doi: 10.1128/jcm.28.6.1380-1384.1990. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Rossi M., Hanninen M.L., Revez J., Hannula R., Zanoni R.G. Occurrence and species level diagnostics of Campylobacter spp., enteric Helicobacter spp. and Anaerobiospirillum spp. in healthy and diarrheic dogs and cats. Vet Microbiol. 2007;87:353–364. doi: 10.1016/j.vetmic.2007.11.014. [DOI] [PubMed] [Google Scholar]
- 4.De Cock H.E.V., Marks S.L., Stacy B.A., Zabka T.S., Burkitt J., Lu G. Ileocolitis associated with Anaerobiospirillum in cats. J Clin Microbiol. 2004;42:2752–2758. doi: 10.1128/JCM.42.6.2752-2758.2004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Rudensky B., Watchel D., Yinnon A.M., Raveh D., Schlesinger Y. Anaerobiospirillum succiniciproducens bacteremia in a young child. Pediatr Infect Dis. 2002;21:575–576. doi: 10.1097/00006454-200206000-00023. [DOI] [PubMed] [Google Scholar]
- 6.Misawa N., Kawashima K., Kondo F., Kushima E., Kushima K., Vandamme P. Isolation and characterization of Campylobacter, Helicobacter, and Anaerobiospirillum strains from a puppy with bloody diarrhea. Vet Microbiol. 2002;87:353–364. doi: 10.1016/s0378-1135(02)00086-x. [DOI] [PubMed] [Google Scholar]
- 7.Greene C.E. Gastrointestinal and intraabdominal infections. In: Greene C.E., editor. Infectious diseases of the dog and cat. 3rd ed. Elsevier; Saint Louis: 2006. pp. 883–912. [Google Scholar]
- 8.Kelesidis T., Bard J.D., Humphries R., Ward K., Lewinski M.A., Uslan D.Z. First report of treatment of Anaerobiospirillum succiniciproducens bloodstream infection with levofloxacin. J Clin Microbiol. 2010;48:1970–1993. doi: 10.1128/JCM.02478-09. [DOI] [PMC free article] [PubMed] [Google Scholar]


