27.1. Diagnosestrategie
Nationale Referenzzentren 26.29. Melde- und Erfassungspflicht nach IfSG 26.28.Virusinfektionen:Diagnosestrategie Virusinfektionen:Diagnosestrategie
27.1.1. Erreger viraler Syndrome
Die Reihenfolge der Viren in Tab. 27.1 entspricht ihrer Häufigkeit.
-
•Angeborene und perinatal erworbene Virusinfektionen:
-
–Virusinfektionen:angeborene/perinatal erworbene Pränatal: Röteln, CMV, VZV.
-
–Perinatal: HSV, Coxsackievirus B, VZV, CMV.
-
–Postnatal: HBV, HCV, HIV.
-
–
-
•Virale hämorrhagische Fieber:
-
–Flaviviren: Virale hämorrhagische FieberGelbfieber-, Dengue-, Omsk-Fieber-, Kyasanur-Hämorrhagisches Fieber:DDWaldkrankheit-Fieber, hämorrhagisches (Differenzialdiagnose)Viren.
-
–Arenaviren: Lassa-, Junin-, Machupo-Viren.
-
–Filoviren: Marburg-, Ebolaviren.
-
–Bunyaviren: Krim-Kongo-Fieber, Hantaan-, Rift-Valley-Viren.
-
–
Tab. 27.1.
Virale Viren:SyndromeViren:SyndromeRhinitis, DifferenzialdiagnoseRhinitis, DifferenzialdiagnosePneumonie:virale, DifferenzialdiagnosePneumonie:virale, DifferenzialdiagnosePharyngitis:DifferenzialdiagnosePharyngitis:DifferenzialdiagnoseNephropathie:DifferenzialdiagnoseNephropathie:DifferenzialdiagnoseMyokarditis:DifferenzialdiagnoseMyokarditis:DifferenzialdiagnoseMeningitis:DifferenzialdiagnoseMeningitis:DifferenzialdiagnoseLaryngotracheobronchitis:kindliche, DifferenzialdiagnoseLaryngotracheobronchitis:kindliche, DifferenzialdiagnoseKrupp-Syndrom, DifferenzialdiagnoseKrupp-Syndrom, DifferenzialdiagnoseHautausschläge, DifferenzialdiagnoseHautausschläge, DifferenzialdiagnoseGuillain-Barré-Syndrom:DifferenzialdiagnoseGuillain-Barré-Syndrom:DifferenzialdiagnoseGastroenteritis:DifferenzialdiagnoseGastroenteritis:DifferenzialdiagnoseEnzephalitis:DifferenzialdiagnoseEnzephalitis:DifferenzialdiagnoseBronchitis, DifferenzialdiagnoseBronchitis, DifferenzialdiagnoseBronchiolitis, kindliche (Differenzialdiagnose)Bronchiolitis, kindliche (Differenzialdiagnose)Syndrome
| Klinik | Erreger |
|---|---|
| Atemtrakt | |
| Rhinitis | Rhino-, Corona-, Entero- und Coxsackieviren Bei Kindern häufig auch Respiratory-Syncytial-Virus (RSV), Parainfluenza-, Adenoviren |
| Pharyngitis | Influenza-, Parainfluenza- und Rhinoviren Bei Kindern häufig auch RSV, Adeno- und Herpesviren |
| Kindliche Laryngotracheobronchitis (Krupp-Sy.) | Influenza-, Parainfluenzaviren (Typ 1 und 2), RSV |
| Bronchitis | Influenza-, Parainfluenzaviren, RSV |
| Kindliche Bronchiolitis | RSV, Influenza-, Parainfluenzaviren |
| Pneumonie |
|
| Gastrointestinaltrakt | |
| Gastroenteritis |
|
| ZNS | |
| Meningitis | Entero-, Mumps-, LCM-Viren, HSV |
| Lähmungen | Polioviren, Enterovirus 70/71, Coxsackievirus A7 |
| Enzephalitis | HSV, Mumps-, Toga-, Flavi-, Bunya-, Arenaviren, Tollwutvirus, Entero-, Adeno-, andere Herpesviren (selten) |
|
Nach Masern, Windpocken, Röteln, Mumps |
|
Nach Masern, Röteln |
|
JC-Viren |
|
Influenzaviren, VZV |
|
HIV |
|
CMV, EBV, HIV |
| Haut | |
| Makulopapulöse Hautausschläge | Masern, Röteln, Parvovirus B19, HHV-6 und -7, Echo- und Coxsackieviren, EBV, CMV, Dengue, Hepatitis B |
| Vesikuläre Hautausschläge | VZV, HSV, Coxsackie- und Enteroviren |
| Pustulöse Hautausschläge | Pockenviren |
| Noduläre Hautausschläge | Papillomaviren, Molluscum contagiosum, Melkerknoten, Orf, Tanapox |
| Urogenitaltrakt | |
| Genitale Infektionen | HSV, Papillomaviren, Adenovirus 37, Molluscum contagiosum |
| Urethritis | HSV, Adenovirus 37 |
| Akute hämorrhagische Zystitis | Adenovirus 11 |
| Glomerulonephritis | HBV |
| Nephropathie | CMV, Hantaanvirus |
| Herz | |
| Myokarditis | Coxsackieviren B u. a. Enteroviren, angeborene Röteln, Mumps |
27.1.2. Diagnostik viraler Syndrome
Klinik Viele Viruserkr. lassen sich klin. Virusinfektionen:Klinikdiagnostizieren (z. B. Herpes-simplex-Effloreszenz der Lippe, Windpocken bei Kindern) oder verlaufen ohne größere Beeinträchtigung des Allgemeinbefindens. Trotzdem ist es wichtig, die Verdachtsdiagnose mikrobiologisch bestätigen zu lassen, da:
-
•
Antivirale Chemotherapie zur Verfügung steht, die eingesetzt werden sollte (z. B. Infektionen durch VZV oder Influenzaviren).
-
•
Gefahr für Allgemeinheit oder bestimmte Bevölkerungsgruppen vermieden werden soll (z. B. Screening auf HIV und Hepatitisviren bei Blutspendern).
-
•
Über die Meldepflicht eine epidemiologische Überwachung möglich wird und Epidemien früh erkannt werden können.
-
•
Bei einigen Infektionen (z. B. bei Röteln oder genitalem Herpes in der Schwangerschaft) Behandlung und Prognose durch eine exakte Diagnose bestimmt werden.
-
!
Wichtig ist die Anamnese (Infektionsquelle?). Häufig Prodromalstadien vor Ausbruch der Erkr., schlechtes Ansprechen auf Antipyretika.
Labor Im Gegensatz zu bakt. Infektionen:
-
•
BSG: häufig Virusinfektionen:Laboruntersuchungennicht oder nur gering beschleunigt.
-
•Leukozyten:
-
–Anfänglich Leukozytopenie mit Lymphozytopenie.
-
–Später Lymphozytose und Monozytose.
-
–
-
•
CRP und PCT: nur geringer Anstieg.
Entscheidend ist der Nachweis virusspez. AK und/oder der Erregernachweis.
-
•Akute Primärinfektionen:
-
–AK-Nachweis/Serologie → Nachweis einer Serokonversion (4-facher Titeranstieg und/oder spez. IgM-Nachweis).
-
–Virusgenomnachweis mittels DNA-Hybridisierung oder PCR.
-
–Antigennachweis mittels ELISA oder dir. IFT.
-
–Erregernachweis durch Virusisolierung.
-
–
-
•Rekurrente Infektionen:
-
–Virusgenomnachweis mittels DNA-Hybridisierung oder PCR.
-
–AG-Nachweis mittels ELISA oder dir. IFT.
-
–Erregernachweis durch Virusisolierung kann bei produktiver Virusreplikation erfolgreich sein.
-
!AK-Nachweis/Serologie meist wenig hilfreich, da Titeranstieg oder IgM-AK meist nicht detektierbar sind. Bei einzelnen Virusarten ist der differenzierte AK-Nachweis gegen isolierte virale Antigene weiterführend (EBV, HIV).
-
–
-
•Feststellung des Immunstatus:
-
–Nach Hepatitisimpfung (Anti-HBs).
-
–Bei Blutspendern: CMV-Status.
-
–Schwangerenvorsorge: Rötelnimmunität.
-
–
 Merke
Merke
Auch bei klinisch („Kinderkrankheiten“) oder aufgrund einer gegebenen epidemiologischen Situation (z. B. Grippe) zu diagnostizierenden Virusinfektionen Material zur virologischen Diagnostik abnehmen, wenn:
-
•
Infektion atypisch oder mit Komplikationen verläuft.
-
•
Pat. einer Risikogruppe angehört: Immunsupprimierte, Grunderkr.
-
•
Erkr. nicht im typischen Alter auftritt: z. B. Mumps bei Erw.
27.1.3. Ansprechpartner bei Verdacht auf virales hämorrhagisches Fieber
Tab. 27.2.
Klinische Ansprechpartner bei Verdacht auf virales hämorrhagisches Fieber∗Virale hämorrhagische Fieber:Ansprechpartner, klinische
| Institution | Anschrift | Telefon, Fax, E-Mail |
|---|---|---|
| Bernhard-Nocht-Institut für Tropenmedizin | Bernhard-Nocht-Str. 74 20359 Hamburg |
T: 040–42 81 80 (24 h) F: 040–42 81 83 78 E: bni@bni.uni-hamburg.de |
| Medizinische Klinik mit Schwerpunkt Infektiologie, Campus Virchow-Klinikum | Augustenburger Platz 1 11353 Berlin |
T: 030–450 55 30 52 (7–16 Uhr); 030–450 50 (ab 16 Uhr) F: 030–450 55 39 06 E: infekt@charite.de |
| Städtisches Klinikum St. Georg, 2. Klinik für Innere Medizin | Delitzscher Str. 141 04129 Leipzig |
T: 0341–909 40 05 F: 0341–909 26 35 E: innere2@sanktgeorg.de |
| Städtisches Krankenhaus Schwabing | Kölner Platz 1 80804 München |
T: 089–30 68 26 20 (24 h) F: 089–30 68 38 68 |
| Kompetenzzentrum Gesundheitsamt Frankfurt und Universitätsklinikum Frankfurt | Theodor-Stern-Kai 7 60596 Frankfurt |
T: 069–44 10 33 (24 h) T: 069–63 01 74 10 F: 069–63 01 74 71 |
| Tropenmedizinische Abteilung Missionsärztliche Klinik | Salvatorstr. 7 97074 Würzburg |
T: 0931–7 91 28 21 (8–16 Uhr); 0931–79 10 (nach 16 Uhr) F: 0931–7 91 28 26 |
Aufgeführt sind nur Institutionen mit Isolierräumen für hochinfektiöse Pat. Auskünfte geben auch verschiedene tropenmedizinische Einrichtungen und Gesundheitsämter. Aus: Dt Ärztebl 2001; 98(41), Prof. Dr. Herbert Schmitz, Hamburg.
27.2. Nachweis von Viren
27.2.1. Direkte Nachweisverfahren
Indikationen
-
•
Nachweis Virusinfektionen:Nachweisverfahrenvon Virusinfektionen, bei denen die Serologie versagt oder nicht Viren:Nachweisverfahrenaussagekräftig ist (immunsupprimierte Pat., Infektionen durch Herpes- oder Adenoviren, seltener auch durch Picorna-, Toga-, Influenza- oder Parainfluenzaviren).
-
•
Beurteilung einer epidemiologischen Situation, z. B. Influenza.
Prinzip, Verfahren
-
•
PCR.
-
•
Molekulargenetische Diagnostik mit DNA-Sonden.
-
•
Dir. IFT, z. B. an Bläscheninhalt bei Herpes zoster.
-
•
Serologische Detektion von Virusantigenen (ELISA), z. B. HBsAg.
-
•Virusanzucht: teuer und zeitaufwendig! Wird zunehmend durch Viren:Anzuchtmolekularbiologische Methoden ersetzt.
-
–In Zellkulturen und im befruchteten Hühnerei.
-
–Im Versuchstier: Der Tierversuch (neugeborene Mäuse) ist die aufwendigste und zeitraubendste Methode und findet deshalb nur dann Anwendung, wenn andere Nachweismöglichkeiten versagen.
-
–
-
•
Elektronenmikroskopie: Der Elektronenmikroskopie, Virusnachweiselektronenmikroskopische Virusnachweis ist für die Routinediagnostik wenig geeignet und bleibt wissenschaftlichen Fragestellungen und Speziallabors vorbehalten.
27.2.2. Indirekte Nachweisverfahren
Indikationen Nachweis spez., gegen Viren Viren:Nachweisverfahrengerichteter AK (IgG, IgM, IgA) im Patientenserum.
Prinzip, Virusinfektionen:Nachweisverfahren Verfahren Die wichtigsten Verfahren zur AK-Titerbestimmung sind ELISA und IFT. Diese erlauben auch eine Titerbestimmung, VirenDifferenzierung in die Immunglobulinklassen IgG, IgM und IgA. Neutralisations- und Hämagglutinationshemmteste verlieren an Bedeutung. Dafür kommen immer häufiger Immunoblots und Aviditätsbestimmungen zur Anwendung.
Bewertung Ergebnisse kritisch beurteilen. Ein pos. Befund (insb. für IgG) erlaubt keine Aussage darüber, wie lange AK gegen das Virus bereits im Blut vorhanden sind.
Zur Beurteilung immer sog. gepaarte Seren Gepaarte Serenprüfen: Untersuchung zweier Serumproben, von Viren:gepaarte Serendenen die eine zu Krankheitsbeginn und die andere etwa 14 d später entnommen wurde. Die Titerdifferenz gibt Auskunft über die Immunantwort des Organismus auf das geprüfte Virus.
Eine Viruserkrankung ist sicher bei:
-
•
Mind. 4-fachem Titeranstieg in den ersten 10–14 d.
-
•
Mind. 4-fachem Titerabfall im späteren Krankheitsverlauf.
Wichtig ist die parallele Untersuchung des spez. IgM als Indikator einer frühen Infektion! Deshalb bereits im frühen Krankheitsstadium Serum abnehmen!
Störungen und Besonderheiten
Falsch pos. Ergebnisse bei:
-
•
Kreuzreaktionen mit Antigenen eines anderen, nicht ursächlichen Erregers.
-
•
Vorhandenen Impftitern.
Falsch neg. Ergebnisse bei:
-
•
Zu früher Serumentnahme: AK-Produktion hat noch nicht eingesetzt.
-
•
Unterdrückter AK-Produktion durch Immunsuppression.
27.2.3. Materialgewinnung
Entnahme Virusinfektionen:Materialgewinnung
-
•
Entnahmeort: Materialgewinnung:VirenUntersuchungsmaterial dort entnehmen, wo das Virus vermutet bzw. ausgeschieden wird. Übliche Proben sind Rachen-, Nasenspülwasser, Nasen-, Rachenabstriche und Körperflüssigkeiten wie Liquor, Urin, Tränenflüssigkeit, Sputum, Inhalt von Hautbläschen oder Stuhl.
-
•Entnahmezeitpunkt:
-
–Für den dir. Virusnachweis: So früh wie möglich entnehmen! Virussynthese und Virämie eilen oft den klin. Symptomen voraus. Außerdem kann der Wirtsorganismus rasch virusneutralisierende AK bilden, die zu einer Bindung der Viruspartikel führen und somit die Diagnostik beeinträchtigen.
-
–Für den indir. Erregernachweis (AK-Diagnostik): 2 Serumproben (→ Titerdifferenz) einsenden.
-
–Erste Serumprobe sofort bei Krankheitsbeginn.
-
–Zweite Serumprobe etwa 1–2 Wo. später entnehmen.
-
–
-
–Für die Bestimmung von virusspez. IgM: nur eine Serumprobe früh zu Krankheitsbeginn. Das Ergebnis wird durch den IgG-Titeranstieg in gepaarten Serumproben erhärtet.
-
–
Aufbewahrung, Transport
-
•
Der Transport von Untersuchungsmaterial für die Virusisolierung muss rasch und immer in Flüssigkeit (Gewebekulturmedium mit Breitspektrumantibiotika zur Unterdrückung von Bakterien- und Pilzwachstum sowie Proteinzusatz) bei 2–6 °C erfolgen. Untersuchungsmaterial zur Isolierung von Influenzaviren darf kein Protein zugesetzt werden. Die Proben dürfen außerdem nicht eingefroren werden (Ausnahmen!). Im Zweifelsfall erteilt das mikrobiologische Labor Auskunft über geeignete Transportmedien oder stellt diese zur Verfügung.
-
!
Wenn gleichzeitig eine bakteriologische Diagnostik erfolgen soll, müssen für diese andere Medien benützt werden.
-
•
Verpackung und Angaben fürs Labor (1.2.4).
-
!
Virologische Diagnostik, insb. die Virusisolierung, wird oft nur in wenigen Speziallaboratorien durchgeführt (z. T. Hochsicherheitslaboratorien für virale Infektionserreger der Risikogruppen 3 und 4 nötig!). Vor Abnahme des Untersuchungsmaterials mit dem mikrobiologischen Labor oder Speziallabor in Verbindung setzen und Details zum Prozedere erfragen.
27.2.4. Blut
Indikationen Virusinfektionen:Untersuchungsmaterial
-
•
Gewinnung von Serum Viren:Untersuchungsmaterialfür die Virusserologie.
-
•
Direktnachweis (evtl. auch Blut:VirusdiagnostikAnzucht) von Viren bei V. a. CMV-Infektion bei Antikörpernachweis:Virusdiagnostikimmunsupprimierten Pat., Infektion durch HIV, lymphozytäre Choriomeningitis, Eastern Encephalitis, Western Encephalitis, venezolanische Enzephalitis, Gelbfieber, Dengue-Fieber, Colorado-Tick-Fieber, hämorrhagisches Fieber und Enzephalitis.
Durchführung
-
•
Virusserologie: 1–2 ml Serum.
-
•
Virusisolierung: 10 ml Heparinblut.
-
•
Transport, Lagerung: kühl halten (2–6 °C) und schnell ins Labor bringen. Proben für Virusanzucht besonders schnell und schonend transportieren.
27.2.5. Rachenspülwasser, Rachenabstrich
Indikationen Direktnachweis von Viren bei V. a. Infektionen durch Adenoviren, RachenspülwasserInfluenza- und Parainfluenzaviren, Entero- und RachenabstrichCoxsackieviren, Masern-, Mumps-, Rötelnviren, hämorrhagische Fieberviren.
Durchführung
-
•
Pat. mit 10 ml physiologischer Kochsalz-Lsg. etwa 20 Sek. gurgeln lassen. Rachenabstrich mit sterilem Tupfer von Tonsillen und Rachenhinterwand.
-
•
Transport, Lagerung: Gurgelflüssigkeit in einem Becherglas auffangen und in ein Röhrchen mit Transportmedium umfüllen, Tupfer in Röhrchen mit Transportmedium einbringen.
27.2.6. Nasenspülwasser
Indikationen Nachweis von Rhinoviren und RSV.
Durchführung
-
•
Bei rückwärts Nasenspülwassergeneigtem Kopf ca. 1 ml physiologische Kochsalz-Lsg. in jedes Nasenloch tropfen, Pat. nach vorn neigen lassen und aus der Nase auslaufende Flüssigkeit in einem Becherglas auffangen.
-
•
Transport, Lagerung: in ein Röhrchen mit Transportmedium umfüllen und umgehend ins Labor bringen.
27.2.7. Nasopharyngealsekret
Indikationen V. a. Infektion durch Influenza- oder Parainfluenzaviren, RSV oder Adenoviren.
Durchführung
-
•
NasopharyngealsekretAbsaugen von Nasopharyngealsekret durch einen dünnen, in den unteren Nasengang eingelegten Schlauch (Absaugset).
-
•
Transport, Lagerung: Überführen der Absaugflüssigkeit in ein Röhrchen mit Transportmedium.
27.2.8. Liquor
Indikationen Nachweis von Enzephalitis oder Meningitis durch Mumpsviren, Enteroviren, lymphozytäre Liquor:VirusdiagnostikChoriomeningitisviren, Viren der Eastern/Western Encephalitis, venezolanische Enzephalitis.
Durchführung, Transport, Lagerung Lumbalpunktion (26.3.3). Etwa 2 ml ohne Zusätze, bei verzögertem Transport bei –70 °C (nicht –20 °C!) einfrieren!
27.2.9. Mittelstrahlurin
Indikationen Mittelstrahlurin:Virusdiagnostik
-
•
Nachweis von Urin:MSU, VirennachweisEmbryopathien durch CMV oder RötelnembryopathieRubellaviren.
-
•
Nachweis einer produktiven CMV-Rubella(viren)Infektion bei immunsupprimierten Pat.
-
•
Virusnachweis bei hämorrhagischem Fieber.
Durchführung, Transport, Lagerung Mittelstrahlurin (26.3.10). Urin direkt versenden (Lagerung möglichst bei 2–6 °C), nur bei verzögertem Transport 1 : 1 mit Transportmedium versetzen.
27.2.10. Tränenflüssigkeit
Indikationen V. a. Keratitis oder Konjunktivitis durch HSV, TränenflüssigkeitAdenoviren oder Coxsackie- und Enteroviren.
Durchführung
-
•
Abstrich von der unteren Konjunktiva mit sterilem Wattetupfer.
-
•
Transport, Lagerung: Wattetupfer in ein Röhrchen mit Transportmedium einbringen und ins Labor bringen.
27.2.11. Inhalt von Hautbläschen
Indikationen Virusnachweis bei V. a. Infektion durch VZV oder HSV.
Durchführung
-
•
Sekret aus Hautbläschen, Inhaltgeschlossenen Bläschen aspirieren, aus offenen Bläschen mit Tupfer abstreichen.
-
•
Transport, Lagerung: in ein Röhrchen mit Transportmedium überführen und möglichst schnell ins Labor bringen.
27.2.12. Stuhl
Indikationen Virusnachweis bei V. a. Infektion durch Rota-, Adeno-, Hepatitis-A-Viren, Entero-, Coxsackieviren.
Durchführung
-
•
Stuhlproben, VirusdiagnostikStuhl 26.3.16.
-
•
Transport, Lagerung: Stuhl ohne Zusatz, bei längerer Transportzeit in Röhrchen mit Transportmedium versenden.
27.2.13. Biopsie- und Autopsie-Untersuchungsmaterial
Indikationen Virusnachweis bei: Biopsie, Virusdiagnostik
-
•
V. a. Enzephalitis durch Autopsie, VirusdiagnostikHSV, Masernvirus einschl. SSPE, HIV, Rabies-, JC-Virus.
-
•
Zervixpolypen durch Papillomavirus-Infektion (→ DNA-Nachweis).
Durchführung
-
•
Abstrich, Biopsie- oder Autopsiematerial (1–2 g) steril entnehmen.
-
•
Transport, Lagerung: in Virustransportmedium aufnehmen und ins Labor bringen. Bei Transportdauer über 2 d bei –70 °C einfrieren.
27.3. Pockenviren
Klinik Unterschieden werden vier Untergruppen mit unterschiedlicher Klinik:
-
1.Pocken(viren) Orthopoxviren:
-
–Menschenpocken: OrthopoxvirenVariola major und Variola minor (Variola major/minorAlastrim) sind seit 1977 weltweit ausgerottet! Potenzielles Alastrimbioterroristisches Agens.
-
–Vaccinia-Virus: Virus des Pocken-Impfstoffs, kann bei Vaccinia-Virusimmunsupprimierten Impflingen generalisieren.
-
–Tierpockenerreger (Pocken(viren):ImpfstoffAffen-, Kuh-, Mäusepocken): geringe Übertragungsrate auf den Menschen, Affenpocken-Verlauf ähnlich wie echte Pocken,Tierpocken Letalität 15 %; andere Tierpockenarten weniger ausgeprägt und meist auf Hände und Arme beschränkt. Kuhpocken in Europa häufig durch Katzen übertragen.
-
–
-
2.Parapoxviren:
-
–ParapoxvirenMelkerknotenvirus: wird beim Melken auf den Menschen übertragen, Melkerknotenviruslokalisierte Bläscheneffloreszenz an der Hand.
-
–Orfvirus: lokalisierte pustulöse Hauterkr., die durch Schafe und OrfvirusZiegen übertragen wird.
-
–
-
3.
Tanapockenvirus: lokalisierte Hautveränderung, Übertragung Tanapockenvirusdurch afrikanische Affen.
-
4.
Molluscum contagiosum: benigne Hauttumoren, Infektion Molluscum contagiosumdurch engen Kontakt oder indirekt (z. B. Schwimmbäder). Meist Kinder betroffen. Multiple, bis zu 100 gutartige Knötchen besonders im Genital- und Analbereich.
![]() Affen-Pockenviren gehören zur Risikogruppe 3 → Sicherheitslabor! Die ausgerotteten Menschenpocken gehörten der Risikogruppe 4 an.
Affen-Pockenviren gehören zur Risikogruppe 3 → Sicherheitslabor! Die ausgerotteten Menschenpocken gehörten der Risikogruppe 4 an.
Untersuchungsmaterial
-
•Kultur und Direktnachweis:
-
–Bei frühem klin. Verdacht: Rachenspülwasser, 10 ml Citratblut.
-
–Später: Bläschen- und Pustelinhalt, Krusten.
-
–
-
•
Serologie: 1–2 ml Serum.
Mikrobiologische Diagnostik In Deutschland nur im Bernhard-Nocht-Institut Hamburg und im Institut für Mikrobiologie der Bundeswehr in München (Tab. 27.2).
-
•Direktnachweis:
-
–Nachweis von Einschlusskörperchen in epidermalen Zellen mittels Giemsa-Färbung.
-
–Elektronenmikroskopie (charakteristische Morphologie).
-
–Direktpräparat (IFT): hohe Kreuzreaktivität unter den Poxviridae!
-
–PCR zur Detektion von Orthopoxvirus spp.
-
–
-
•
Kultur: Anzucht auf vorbebrüteten Hühnereiern oder in Gewebekultur (Vero-, HeLa-Zellen) → Speziallabor! Identifizierung des Isolats durch PCR, die Methoden wie Agargeldiffusion, HAHT, IFT und Neutralisation (hohe Kreuzreaktivität unter den Poxviridae!) ablöst.
-
•
Serolog. AK-Nachweis: Nachweis von spez. AK mittels HAHT, IFT, ELISA, Western Blot, NT. Nach durchgeführter Schutzimpfung lange hoher AK-Titer → nur ein 4-facher Titeranstieg ist beweisend.
Immunisierungsmöglichkeit Immunisierung:PockenDie Pocken-Schutzimpfung wird nach Pocken(viren):SchutzimpfungAusrottung der Menschenpocken nicht mehr empfohlen. Aktuell Bevorratung für Impfungen der Bevölkerung im Fall bioterroristischer Anschläge mit Menschenpocken.
27.4. Herpesviren
Die wichtigsten humanpathogenen Vertreter sind:
-
•
Herpes-simplex-Virus (HSV) 1 und 2 = Herpesvirenhumanes Herpesvirus (HHV) 1 und 2.
-
•
Varicella-Zoster-Virus (VZV) = humanes Herpesvirus Typ 3 (HHV-3).
-
•
Epstein-Barr-Virus (EBV) = humanes Herpesvirus Typ 4 (HHV-4).
-
•
Zytomegalievirus (CMV) = humanes Herpesvirus Typ 5 (HHV-5).
-
•
Humanes Herpesvirus Typ 6 (HHV-6).
-
•
Humanes Herpesvirus Typ 7 (HHV-7).
-
•
Humanes Herpesvirus Typ 8 (HHV-8).
-
•
Herpes-B-Virus.
Herpesviren persistieren lebenslang nach der Primärinfektion im Körper: HSV und VZV in den sensorischen Ganglien, CMV wahrscheinlich in den Epithelzellen von Speicheldrüsen und in den Tubuluszellen der Nieren, EBV in den Epithelzellen der Mundschleimhaut. Bei einer Störung des Gleichgewichts zwischen latenter Virusinfektion und Abwehrlage kann es zu Rezidiven bzw. Reaktivierungen kommen. Solche Störungen sind z. B. Sonnenbestrahlung, hormonelle Veränderungen, Infektionen mit anderen Erregern und allg. Stressfaktoren.
27.4.1. Herpes-simplex-Virus (HSV)
Zwei Serotypen (1 und 2) sind humanpathogen.
Klinik
-
•
HSV-1: meist in der Herpes-simplex-Virus (HSV)Kindheit durch Schmierinfektion erworben (50–100 % der erw. Bevölkerung sind durchseucht): bläschenförmige Hautveränderungen im Orofazialbereich, selten Keratitis oder lebensbedrohliche nekrotisierende Enzephalitis.
-
•HSV-2:
-
–Sexuell übertragbare Infektion des Erwachsenenalters, Durchseuchungsrate je nach sexueller Promiskuität 20–80 %. Bläschenbildung auf der Schleimhaut des Genitalbereichs, Fieber und regionale Lymphknotenschwellung.
-
–Herpes neonatorum durch Infektion im Geburtskanal: Herpes-Sepsis mit Herpes:Sepsisgeneralisierter Haut-, Milz-, Leber- und Herpes:neonatorumHirnbeteiligung.
-
–
Untersuchungsmaterial
-
•Kultur und Direktnachweis:
-
–HSV-1: Rachenspülwasser, Bläschenflüssigkeit und zellhaltige Abstriche von Haut-/Schleimhautläsionen.
-
–HSV-2: Bläschenflüssigkeit und zellhaltige Abstriche von Haut-/Schleimhautläsionen. Wenn typ. Läsionen fehlen, eignen sich zur Untersuchung auch Speichel, Genitalsekrete und Urin. Trachealsekret und BAL bei V. a. Infektion der Atemwege, Liquor bei ZNS-Infektionen.
-
–
-
•
Serologie: 1–2 ml Serum.
 Herpes-Enzephalitis
Herpes-Enzephalitis
Herpes:Enzephalitis Therapie bereits bei Verdacht! Zur Bestätigung etwa 2 ml Liquor ohne Zusätze direkt ins Labor. Bei verzögertem Transport bei –70 °C (nicht –20 °C!) einfrieren!
-
•
Differenzialzellbild im Liquor (Lymphozytose).
-
•
Nachweis von spez. IgG- und IgM-AK im Liquor unter Ausschluss einer Schrankenstörung.
-
•
HSV-1-PCR im Liquor → Methode der Wahl!
-
•
Virusisolierung aus dem Liquor kaum möglich.
Mikrobiologische Diagnostik
-
•
Direktnachweis: Erregernachweis mittels PCR, dir. IFT an Ausstrichen, ELISA, DNA-Hybridisierung.
-
•
Kultur: Virusanzucht in Zellkulturen (humane embryonale Fibroblasten oder Vero-Zellen) und AG-Nachweis nach Kurzzeitkultur (1–2 d) bzw. nach Auftreten des typischen CPE. Isolatidentifizierung durch dir. IFT oder mittels ELISA mit typenspez. monoklonalen Antiseren.
-
•
Serolog. AK-Nachweis: Aufgrund des hohen Durchseuchungsgrades der Bevölkerung ist nur ein Anstieg des spez. IgM oder ein mindestens 4-facher IgG-Titeranstieg verwertbar. Dies geschieht aber meist nur in Fällen schwerer generalisierter Erkr. Starke Kreuzreaktivität zwischen HSV-1 und -2. Mit Western-Blot-Methode Differenzierung besser möglich.
Antibiotikaempfindlichkeit
-
•
Leichte Effloreszenzen: lokal Aciclovir.
-
•
Schwere Infektionen: systemisch Aciclovir, Valaciclovir, Penciclovir, Famciclovir, Brivudin (nur gegen HSV-1 wirksam). Foscarnet bei resistenten HSV.
27.4.2. Varicella-Zoster-Virus (VZV)
Klinik Bei Erstinfektion Manifestation als Varicella-Zoster-Virus (VZV)Windpocken. Die Viren persistieren lebenslang. Bei Rezidiv Zweitmanifestation als Herpes Zoster.
-
•
Windpocken: hochkontagiöse Tröpfcheninfektion → bei WindpockenKindern mild verlaufend, typisches zentripedales papulöses Exanthem auf Haut und Schleimhaut. Komplikationen bei Erw. und Immunsupprimierten: Bakt. Superinfektionen, Enzephalitis, Varizellenpneumonie. Bei schweren Immundefekten hämorrhagische Verlaufsformen (sowohl bei Primärinfektion als auch bei Reaktivierung). Präpartale Infektionen der Mutter sind selten und können in Ausnahmefällen Fehlbildungen des Kindes zur Folge haben (keine Interruptio-Indikation! ). Perinatale Infektionen können beim VarizellenembryopathieNeugeborenen generalisierte Windpocken verursachen, die durch Gabe von spez. Ig und Acycloguanosin behandelt werden müssen.
-
•
Herpes Zoster (Gürtelrose): Herpes ZosterZweitmanifestation des VZV: Effloreszenzen ähneln Gürtelrosedenen der Windpocken, folgen jedoch streng dem Innervationsgebiet der jeweils betroffenen Nervenwurzel, in dessen Spinalganglion das Herpesvirus persistiert. Der Zoster beginnt mit allg. Krankheitsgefühl und Schmerzen im Dermatom durch Entzündung der sensiblen Nervenwurzeln und Spinalganglien. Wichtigste Komplikation sind v. a. bei älteren Pat. persistierende Zosterschmerzen, die oft sehr hartnäckig sind. Gefürchtet ist ein Ausbreiten des Zosters auf den gesamten Körper (Zoster generalisatus) bei Immunschwäche oder schwerer Grunderkr.Zoster generalisatus
![]() Windpocken (Krankheitsverdacht, Erkrankung, Tod, Erregernachweis) sind meldepflichtig. In den deutschen Bundesländern Brandenburg und Sachsen ist zusätzlich der Herpes Zoster (Erkrankung, Tod) meldepflichtig.
Windpocken (Krankheitsverdacht, Erkrankung, Tod, Erregernachweis) sind meldepflichtig. In den deutschen Bundesländern Brandenburg und Sachsen ist zusätzlich der Herpes Zoster (Erkrankung, Tod) meldepflichtig.
Untersuchungsmaterial
-
•
Kultur und Direktnachweis: Bläschenflüssigkeit und zellhaltige Abstriche von den Hautläsionen, Liquor, EDTA-Blut, BAL, Fruchtwasser, Gewebeproben für Virusanzucht in Virustransportmedium transportieren.
-
•
Serologie: 1–2 ml Serum.
Mikrobiologische Diagnostik
-
•
Direktnachweis: dir. Erregernachweis mittels PCR (Methode der Wahl). Dir. IFT an Ausstrichen.
-
•
Kultur: in geeigneten Zellkulturen (humane embryonale Fibroblasten, prim. Affen-Nierenzellen) verzögerter CPE mit typischer Morphologie nach 3–8 d. Isolatidentifizierung durch dir. IFT mit monoklonalen Antiseren. Indiziert für Resistenzbestimmung und molekulare Charakterisierung von Virusisolaten.
-
•Serolog. AK-Nachweis:
-
–Primärinfektion: Nachweis von Anti-VZV-IgM und Titeranstieg im IgG-ELISA, häufig auch Anstieg des spez. IgA.
-
–Herpes Zoster: Nachweis und Anstieg von spez. IgG und IgA, spez. IgM nur in der Hälfte d. F. nachweisbar.
-
–Varizellenembryopathie: Persistenz des VZV-IgG beim Kind > 6 Mon.Varizellenembryopathie Selten IgM oder IgA nachweisbar.
-
–Immunstatus: durch IgG-ELISA oder Fluoreszenz-Antikörper-Membran-Antigen-Test (FAMA) → nur in Speziallabors.
-
–
Antibiotikaempfindlichkeit
-
•
Schwere Verläufe von Windpocken (immunsupprimierte Pat., perinatale Varizellen): Komb. von Virustatikum und Varicella-Zoster-Ig.
-
•
Zoster: frühzeitige systemische Therapie mit Aciclovir, Brivudin, Famciclovir oder Valaciclovir.
-
!
Das Reye-Syndrom (fettige Leberzelldegeneration mit akuter Reye-SyndromEnzephalopathie) bei Kindern mit Varizellen wird mit der Einnahme von Acetylsalicylsäure assoziiert.
Immunisierungsmöglichkeit Immunisierung:Varizella ZosterAktive Immunisierung Varizella-Zoster-Virus (VZV):Schutzimpfungmit Lebendimpfstoff als Indikationsimpfung nach den aktuellen STIKO-Empfehlungen.
27.4.3. Zytomegalievirus (CMV)
Klinik Das CMV persistiert nach Infektion Zytomegalievirus (CMV)lebenslänglich (Endothel, Knochenmark, Speicheldrüsen, Nierentubuluszellen → Virusausscheidung in CMVSpeichel und Urin). Etwa 50 % der Bevölkerung sind durchseucht. Man unterscheidet:
-
•Intrauterin erworbene Infektionen (Embryopathien): bei mütterlicher Primärinfektion oder Reaktivierung.
-
–Primärinfektionen im 1. und 2. Schwangerschaftstrimenon → schwerste Schädigungen des Kindes: Mikrozephalie, intrazerebrale Verkalkungen, Hörschäden, Optikusatrophie, Chorioretinitis, Ikterus, Hämolysen, Thrombozytopenie, Hepatosplenomegalie.
-
–Spätere oder durch Reaktivierung erworbene intrauterine Infektionen → keine oder nur geringgradige Schäden.
-
–
-
•Perinatale Infektionen: Infektion durch Kontakt mit dem Virus in Geburtskanal, Muttermilch, Transfusionen. Meist asymptomatische Klinik, aber langjährige CMV-Ausscheidung.
-
!Ausnahme: Frühgeborene mit unreifem Immunsystem (Pneumonitis).
-
!
-
•Postnatal erworbene Infektionen: Tröpfchen- oder Schmierinfektionen, seltener durch Transfusion übertragen. Krankheitsausprägung nach Immunstatus:
-
–Immunkompetente Personen: asymptomatisch oder „grippaler Infekt“ oder „Mononukleose“ mit Fieber, leichter Hepatitis und Lymphozytose (EBV-Serologie neg.). Selten interstitielle Viruspneumonie.
-
–Immunsupprimierte Pat.: Fieber, Leuko- und Thrombozytopenie, Enteritis durch Ulzerationen im Magen-Darm-Trakt, interstitielle Pneumonie, Hepatitis, Retinitis und Enzephalitis.
-
!Die CMV-Infektion verstärkt die Immunsuppression → die Pat. versterben z. T. an Superinfektionen mit Pilzen oder Bakterien.
-
–
Untersuchungsmaterial
-
•Kultur und Direktnachweis:
-
–Neugeborene: Urin und Speichel nur bei Neugeborenen Material der 1. Wahl, da das Virus auch bei asymptomatischen Trägern intermittierend in Speichel und Urin ausgeschieden wird.
-
–Alle anderen Pat.: Leukozyten zum Nachweis einer zellassoziierten Virämie, die mit einem invasiven Krankheitsverlauf korreliert. Ebenfalls brauchbar sind BAL-Flüssigkeit und Autopsieproben, Urin, Rachenspülungen, Liquor.
-
–Schwangere: Leukozyten, aber auch Zervixabstrich und Fruchtwasser, nach der Geburt auch Muttermilch.
-
–
-
•
Serolog. AK-Nachweis: 1–2 ml Serum.
Mikrobiologische Diagnostik
-
•
Direktnachweis: direkter Erregernachweis mittels PCR oder dir. IFT (z. B. pp65-Antigennachweis in peripheren Leukozyten). Bei Pat. mit Neutropenie ist der quantitative CMV-DNA-Nachweis im Blut mittels PCR zuverlässiger als der pp65-Antigen-Nachweis in Leukozyten. Ein pos. pp65-Antigen-Nachweis oder ein hoch pos. DNA-Nachweis (ab ca. 105 Kopien/ml) im Blut belegen eine aktive CMV-Infektion.
-
•Kultur:
-
–Anzüchtung in humanen Fibroblasten oder MRC-5-Zellen.
-
–Kurzzeitkultur: 24–48 h mit anschließendem Nachweis des early antigen durch IFT oder Immunperoxidasetechnik.
-
–Langzeitkultur: 2–10 Wo. mit anschließender Beurteilung des CPE. Identifizierung des Isolats durch dir. IFT mit monoklonalen Antiseren.
-
–
-
•Serolog. AK-Nachweis:
-
–Lebenslange Erregerpersistenz → ständige spez. IgG-AK-Produktion.
-
–Nachweis einer Primärinfektion: IgG-Serokonversion, IgM-/IgA-Nachweis. Nachweis niedrigavider IgG-AK bei Primärinfektion (zuverlässiger als Nachweis von IgM-AK), rekombinanter Immunoblot.
-
–Reaktivierung: IgM-/IgA-Nachweis. Nachweis von CMV-DNA (quantitativ) oder pp65-Antigen (s. o.) jedoch besser geeignet als Serologie.
-
–
![]() Bei 60 % der betroffenen Neugeborenen, die Virus ausscheiden, bleibt der IgM-Nachweis negativ → PCR und/oder Virusanzucht erforderlich!
Bei 60 % der betroffenen Neugeborenen, die Virus ausscheiden, bleibt der IgM-Nachweis negativ → PCR und/oder Virusanzucht erforderlich!
Antibiotikaempfindlichkeit Bei schweren Krankheitsverläufen (CMV-Pneumonie, Retinitis, Gastroenteritis, Hepatitis) Anti-CMV-Ig und Ganciclovir – allein oder als Kombinationstherapie. Erfolg gering. Bei Ganciclovir-Resistenz: Foscarnet oder Cidofovir. Therapiemonitoring: pp65-AG, PCR.
27.4.4. Epstein-Barr-Virus (EBV)
Das EBV persistiert lebenslang in B-Lymphozyten.
Klinik
Infektiöse Mononukleose: Epstein-Barr-Virus (EBV) Fieber, Angina, Milz- und Infektiöse MononukleoseLymphknotenschwellung, charakteristische Lymphozytose, z. T. Mononukleose, infektiösemorbilliformes Exanthem am gesamten Körper. Selten Beteiligung anderer Organe (u. a. Leber, Herz, Lunge, Hirn, Nerven oder Niere). Reaktivierungen verlaufen bei Immungesunden asymptomatisch.
Chron. aktive EBV-Infektionen kommen bei Immungesunden vor. Infektionen von Pat. mit zellulären Immundefekten führen zum „B-lymphoproliferativen Syndrom“, einer malignen Proliferation B-lymphoproliferatives Syndromimmortaler, EBV-transformierter B-Lymphozyten mit Lymphombildung.
EBV-assoziierte Malignome sind auch das Burkitt-Lymphom in holoendemischen afrikanischen Malariagebieten Burkitt-Lymphomsowie das Nasopharyngeal-Ca in China.
Nasopharyngealkarzinom, EBV-assoziiertes Untersuchungsmaterial und mikrobiologische Diagnostik
Serologie: 1–2 ml Serum. Nachweis unterschiedlicher Reaktionsmuster einzelner AK-Klassen gegen verschiedene EBV-Antigene (Tab. 27.3 ):
-
•
Viruskapsid-AG (VCA): Strukturproteine von Viruskapsid und -hülle, Bildung in der lytischen Phase nach Beginn der DNA-Replikation.
-
•
Frühantigen (EA): regulatorische Proteine, Bildung vor der DNA-Replikation von EBV. EA-D (diffuses EA-AG), EA-R (restringiertes AG).
-
•
EBV-spez. nukleäres Antigen (EBNA): Bildung in latent mit EBV infizierten Zellen, dient der Differenzierung frischer, stattgehabter oder reaktivierter Infektionen.
-
•
Nachweis heterophiler AK (gegen Schafserythrozyten) im Paul-Bunnell-Test.
-
•
Alternatives Testkonzept mit Paul-Bunnell-TestBestimmung der Avidität von IgG-AK gegen VCA und EBNA (Blot). Bei einer frühen Primärinfektion liegen niedrigavide IgG-AK vor, später entwickeln sich hochavide IgG-AK.
Tab. 27.3.
Antikörperspektrum von EBV-assoziierten Epstein-Barr-Virus (EBV):AntikörperspektrumErkrankungen
| Erkrankung | VCA-IgM | VCA-IgA | VCA-IgG | EA-D-IgA | EA-D-IgG | EA-R-IgG | Anti-EBNA | Het. AK |
|---|---|---|---|---|---|---|---|---|
| Akute infektiöse Mononukleose | + | (+) | + | – | + | – | – | + |
| Kürzlich durchgemachte infektiöse Mononukleose | – | – | + | – | + | +/− | +/− | +/− |
| Vor längerer Zeit durchgemachte infektiöse Mononukleose | – | – | + | – | – | – | + | – |
| Burkitt-Lymphom | – | – | + | – | – | + | + | – |
| Nasopharyngeal-Ca | – | + | + | + | + | – | + | – |
Direktnachweis (Speziallabor → nur bei Immunsupprimierten und Tumorpat.):
-
•
EDTA-Blut, respirator. Sekrete, Liquor, Gewebe von Nasopharyngeal-Ca und Burkitt-Lymphomen zum Nachweis von Virus-DNA (PCR, IFT und Hybridisierung nur noch selten angewandt).
-
•
Nachweis EBV-transformierter Lymphozyten in Heparinblut (DNA, EBNA-Nachweis).
-
!
Anzucht im lytischen Zellkultursystem ist nicht möglich! EBV kann in Nabelschnurlymphozyten angezüchtet und die Transformation der B-Lymphozyten mittels dir. IFT (EBNA-AG) nachgewiesen werden (Speziallabor).
Ergänzende Laborparameter:
-
•
Blutbild: Lymphozytose.
-
•
Leberenzyme (ALAT, ASAT): häufig ↑.
Antibiotikaempfindlichkeit Eine effektive Therapie von EBV-Infektionen ist bisher nicht bekannt.
27.4.5. Humane Herpesviren (HHV-6, -7 und -8, Herpes-B-Virus)
Klinik
-
•HHV-6 und -7:
-
–Herpesviren:humane (HHV) Erreger des Exanthema subitum, Syn.: Roseola Exanthema subituminfantum (folgenloses Drei-Tage-Roseola infantumFieber bei Kindern). Im Alter von 6 Mon. bis 1½ J. Drei-Tage-Fieberdurch HHV-6, im Alter von 1–3 J. durch HHV-7. Mononukleoseähnliche Krankheitsbilder bei älteren Kindern wurden beschrieben. Durchseuchung 60–80 %. Komplikationen: Fieberkrämpfe, Enzephalitis, Thrombozytopenie, Hepatitis.
-
!Nach KM-Transplantation können HHV-6- oder HHV-7-Infektionen letal enden!
-
–Bei Immunsuppression (KM- oder Organtransplantation, AIDS) Reaktivierung: Fieber, mononukleoseähnliches Krankheitsbild mit Exanthem, Hepatitis, Lymphadenopathie, Panzytopenie, auch Pneumonitis und Retinitis sowie Enzephalitis.
-
–Verursachung des Chronic-Fatigue-Sy., Induktion maligner lymphoproliferativer Erkr. bei Erw. mit zellulärer Immundefizienz sowie Bahnung von Autoaggressionserkr. werden derzeit diskutiert.
-
–
-
•
HHV-8: steht in enger Assoziation zum Kaposi-Sarkom und zu B-Zell-Lymphomen des Bauchraums (prim. Kaposi-SarkomErgusslymphome) bei AIDS-Pat. Durchseuchung der gesunden ErgusslymphomeBevölkerung in nichtendemischen Gebieten 1–20 %, in Endemiegebieten (Mittelmeerraum, Zentralafrika) und in Risikogruppen (HIV-Pos., Transplantierte, homosexuelle Männer) > 50 %.
-
•
Herpes-B-Virus (Syn.: Herpesvirus simiae): das Herpes-simplex-Virus der Affen. Übertragungen Herpes-B-Virusdurch Bisse, Kratzwunden, Zellkulturarbeiten führen zu schwerer Meningoenzephalomyelitis. AG-Verwandtschaft zu HSV.
Untersuchungsmaterial
Kultur und Direktnachweis:
-
•
HHV-6 und -7-Isolierung: EDTA-Blut, Liquor, Biopsiematerial.
-
•
HHV-8-Nachweis: Gewebebiopsien von Kaposi-Sarkomen oder Lymphomen, Speichel, EDTA-Blut.
-
•
Herpes-B-Virus-Nachweis: Bläschenflüssigkeit und Biopsiematerial, Liquor, Tränenflüssigkeit, respiratorische Sekrete, Urin, Stuhl.
Serologie: 1–2 ml Serum.
![]() Das Herpes-B-Virus gehört zur Risikogruppe 3 → Sicherheitslabor!
Das Herpes-B-Virus gehört zur Risikogruppe 3 → Sicherheitslabor!
Mikrobiologische Diagnostik
Direktnachweis:
-
•
HHV-6, -7 und Herpes-B-Virus: PCR aus Blut oder Liquor (bei ZNS-Beteiligung).
-
•
HHV-8: PCR aus Gewebebiopsien von Kaposi-Sarkomen oder Lymphomen, Speichel, EDTA-Blut. Differenzierung zwischen Latenz und aktiver Replikation mittels Viruslast-Bestimmung, Nachweis freier Viren im Plasma und mRNA-Nachweis mittels RT-PCR.
-
!
Ein pos. Nachweis von HHV-8-DNA im Blut von AIDS- und Transplantationspat. impliziert ein hohes Risiko für die Entwicklung eines Kaposi-Sarkoms.
Kultur (Speziallabor!):
-
•
HHV-6 und -7: Isolierung peripherer mononukleärer Zellen nach Sedimentation und Dichtegradientenzentrifugation mit nachfolgender Langzeitkultur unter PHA- und IL 2-Stimulation (z. T. in Cokultur mit Nabelschnurzellen). Nach 4–5 Wo. Auftreten eines CPE. Identifizierung des Isolats mittels dir. IFT.
-
•
Herpes-B-Virus: Anzucht in Vero-Zellen oder prim. Affen-Nierenzellen → CPE nach 7–10 d. Identifizierung mittels NT unter Verwendung von Antiseren gegen Herpes-B-Virus (gute Neutralisation) und HSV (schlechte Neutralisation).
Serolog. AK-Nachweis:
-
•
HHV-6, -7 und -8: indir. IFT, ELISA (IgM, IgG), Immunoblot, Aviditätsbestimmungen. Kreuzreaktivität zu CMV und EBV (HHV-6 und -7).
-
•
Herpes-B-Virus: KBR → mindestens 4-facher Titeranstieg nötig. Ausgeprägte Kreuzreaktion zu HSV! Auch ELISA, IFT und Immunoblot werden eingesetzt (hauptsächlich Forschung).
-
!
HHV-6-Infektionen sind für 12 % der EBV-neg. Fälle von heterophilen AK-Nachweisen verantwortlich!
-
!
Serokonversion ggü. HHV-8-Kapsidproteinen (ELISA) geht der klin. Manifestation eines Kaposi-Sarkoms bis zu 1 J. voraus!
Antibiotikaempfindlichkeit HHV-6 ist gegen Ganciclovir, Cidofovir und Foscarnet sensibel, aber relativ resistent ggü. Aciclovir. Für HHV-7 und -8 sind bisher keine spez. Therapiemaßnahmen bekannt. Eine antiretrovirale Therapie bei AIDS führt häufig zur Regression von Kaposi-Sarkomen (Verbesserung des Immunstatus). Herpes-B-Virus: Wundreinigung, Valaciclovir für 14 d (Postexpositionsprophylaxe). Bei manifester Erkr. Ganciclovir.
27.5. Hepatitis-Viren
27.5.1. Hepatitis A
Klinik RNA-Virus. Übertragung fäkal-oral durch Hepatitis Akontaminiertes Wasser oder verunreinigte Lebensmittel. Erkrankungen in Deutschland fast ausnahmslos durch Einschleppung aus Entwicklungsländern. Inkubationszeit 2–6 Wo.
Infektiöse Hepatitis: Bei Erw. z. T. ikterische Verläufe, bei Kindern oft asymptomatisch. Selten fulminante Verläufe mit tödlichem Ausgang (0,1 %). Keine Spätschäden. Lebenslange Immunität.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Nachweis des Hepatitis-A-Virus!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Nachweis des Hepatitis-A-Virus!
Untersuchungsmaterial
-
•
Direktnachweis: Stuhl → Virusausscheidung hauptsächlich in der Inkubationszeit! Erregernachweis in Stuhl und Serum im Krankheitsverlauf mit hochempfindlicher PCR-Technik lange möglich.
-
•
Serologie: 1–2 ml Serum.
Mikrobiologische Diagnostik
Direktnachweis:
-
•
PCR: Nachweis der Virus-RNA in Stuhl, EDTA-Blut oder Serum.
-
•
ELISA: AG-Nachweis im Stuhl (verliert zugunsten der PCR an Bedeutung).
Kultur: schwierig, niemals routinemäßig!
Serolog. AK-Nachweis (Abb. 27.1 ):
-
•
Anti-HAV-IgM: beweist frische Infektion (IgM vom Beginn der ersten Symptome an 3–6 Mon. lang nachweisbar).
-
•
Anti-HAV-IgG: ebenfalls ab Beginn der Krankheitssymptome nachweisbar und persistiert lebenslang. Später sichert es bestehende Immunität (ab 20 IU/l Anti-HAV).
Abb. 27.1.

Hepatitis A: serologischer Verlauf Hepatitis A:serologischer VErlauf
[L190]
Ergänzende Laborparameter Leberenzyme (GPT > GOT) ↑, Bili ↑, AP und GGT nur initial und bei Cholestase ↑, Serumeisen ↑, γ-Globuline ↑, Lebersyntheseparameter (CHE, Albumin, Quick-Wert) nur bei fulminantem Verlauf ↓.
Immunisierungsmöglichkeit
-
•
Indikationsimpfung für Immunisierung:HAVmedizinisches Personal, Kanalisations- und Klärwerksarbeiter, homosexuelle Männer und Heterosexuelle mit promiskuitivem Verhalten, Pat. mit Hämophilie und mit chron. Lebererkr.
-
•
Reiseimpfung in Regionen mit hoher Hepatitis-A-Prävalenz. Empfehlenswert: Kombinationsimpfstoff mit Hepatitis B.
27.5.2. Hepatitis B
Klinik DNA-Virus, weltweites Vorkommen. Übertragung durch Blut oder Blutprodukte (Risiko: 1 : 500.000), menschliche Sekrete wie Samen, Hepatitis BZervixsekret, Speichel, Tränenflüssigkeit, nicht ausreichend sterilisierte medizinische Instrumente. Inkubationszeit 2–6 Mon. Hepatitis häufig ikterisch.
-
•
Akuter Verlauf mit Ausheilung: 90–99 % d. F. bei Kindern und Erw., 5–20 % d. F. bei Neugeborenen und Säuglingen. Letalität infolge fulminanter Hepatitis ≤ 1 %.
-
•
Chron. aktive bzw. chron. persistierende Hepatitis: 1–10 % aller Fälle bei Kindern und Erw., 80–95 % aller Fälle bei Neugeborenen und Säuglingen. Folge kann eine Leberzirrhose oder ein prim. Leberzell-Ca sein.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Nachweis des Hepatitis-B-Virus.
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Nachweis des Hepatitis-B-Virus.
Die Hepatitis-B-Genotypen (Tab. 27.4 ) determinieren die Ansprechbarkeit auf eine Therapie mit Interferon (IFN). Die Hepatitis B:GenotypenGenotypen A und B sprechen besser auf IFN-α an als die Genotypen C und D. Genotypbestimmung mittels genotypspezif. DNA-Sonde oder Sequenzanalyse.
Tab. 27.4.
Vorkommen der Hepatitis-B-Hepatitis B:GenotypenGenotypen
| Genotyp | Vorkommen |
|---|---|
| A 1 | Afrika, Südasien |
| A 2 | Mitteleuropa, Weiße in den USA |
| B 1–B 4 | Ostasien/Südostasien |
| C 1 | Vietnam, Myanmar, Thailand |
| C 2 | Japan, Korea, China |
| C 3 | Neukaledonien, Polynesien |
| C 6 | Australien |
| C 5 | Philippinen |
| C 6 und C 7 | selten, Philippinen, West Papua |
| D 1–D 7 | Weltweit |
| E | Westafrika |
| G | Weltweit |
| F 1–F 4 | Indianische Bevölkerung Süd- und Mittelamerika |
| H |
Untersuchungsmaterial Serologie und PCR: 1–2 ml Serum. Nichtfixierte Leberbiopsie zum Nachweis intrahepatischer Virus-DNA.
Mikrobiologische Diagnostik
-
•Direktnachweis: HB s -AG (Virushüllen-AG)-Nachweis mittels ELISA.
-
–Nachweisbarkeit: Wo. vor bis Wo. nach der akuten Erkr.
-
!5–10 % aller Infektionen sind HBs-AG-neg. Deshalb gehört zur vollständigen Hepatitis-Diagnostik immer die Bestimmung des Anti-HBc-IgM, das zu Beginn der Infektion (vor dem Auftreten von Anti-HBs und Anti-HBc) hochpositiv ausfällt.
-
–Parameter für Verlauf: bei HBs-AG-Persistenz ≥ 6 Mon. chron. Hepatitis.
-
–
-
•
HBV-DNA: Nachweis mittels PCR aus dem Blut des Pat. zur Verlaufskontrolle bei antiviraler Therapie.
-
•
Kultur: entfällt.
-
•
Serolog. AK-Nachweis: s. Kasten; serolog. Verlauf Abb. 27.2 ; serolog. Marker Tab. 27.5 .
 Serologischer Antikörpernachweis
Serologischer Antikörpernachweis
Anti-HBs-AK (Antikörper gegen das HBs-AG):
-
•Nachweisbarkeit:
-
–Nach ausgeheilter Infektion zusammen mit Anti-HBc.
-
–Nach Impfung gegen Hepatitis B ohne Anti-HBc.
-
–
-
•
Parameter für Immunität: Schutz ab einem Titer von 10 U/l.
Anti-HBc-AK (Antikörper gegen das Core-Antigen des Virus):
-
•Nachweisbarkeit 3–5 Wo. nach dem Auftreten des HBs-AG und vor der klin. Manifestation. Persistenz:
-
–Anti-HBc-IgM bis zu 12 Mon.
-
–Anti-HBc-IgG lebenslang.
-
–
-
•
Parameter für DD: Beweis für Infektion, nach Impfung nicht nachweisbar.
HBe-AG (Abbauprodukt des HBc-AG):
-
•
Nachweisbarkeit zu Beginn der Erkrankung.
-
•Parameter für:
-
–Verlauf: bei Persistenz ≥ 11 Wo. chron. aktive Hepatitis.
-
–Infektiosität, da Marker für die aktive Virusreplikation.
-
–
Anti-HBe-AK (Antikörper gegen das HBe-AG):
-
•
Nachweisbarkeit nach Verschwinden des HBe-AG.
-
•
Parameter für Ausmaß der Virämie bei chron. HBsAg-Trägern: bei Nachweis geringe Virämie.
-
!
Unsicherer Parameter → besser den HBV-DNA-Nachweis (Hybridisierung, PCR) einsetzen.
Abb. 27.2.
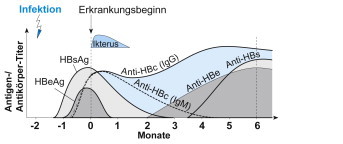
Hepatitis B: serologischer Verlauf Hepatitis B:serologischer Verlauf
[L157]
Tab. 27.5.
Serologische Marker der Hepatitis-B-Hepatitis B:serologische MarkerHepatitis B:serologische MarkerInfektion
| Krankheitsstadium | HBsAg | Anti-HBs | Anti-HBc-IgG | Anti-HBc-IgM | HBeAG | Anti-HBe | Virus-DNA (PCR) |
|---|---|---|---|---|---|---|---|
| Inkubationszeit | + | – | – | – | +/− | – | (+) |
| Akute Hepatitis → Rekonvaleszenz | + → − | − → + | − → + | + → − | + → − | − → + | + → − |
| Chron. aktive Hepatitis | + + | – | + | + | + | – | + |
| Chron. persistierende Hepatitis | + | – | + | – | – | +/− | (+) |
| Asymptomatische Träger | + | – | + | – | – | (+)/− | (+) |
| Immunität nach Infektion | – | + | + | – | – | + → − | – |
| Immunität nach Impfung | – | + | – | – | – | – | – |
+ positiv, ++ stark positiv, (+) schwach positiv, +/− nicht immer positiv; → − wird im Verlauf (Rekonvaleszenz) negativ, → + wird im Verlauf (Rekonvaleszenz) positiv, − negativ.
Bei folgenden Konstellationen besteht V. a. Escape-Mutanten:
-
•
HBV-DNA (PCR) pos., Escape-Mutanten, Hepatitis BHBS-AG neg.
-
•
HBS-AG pos., Anti-HBS pos.
Diese werden manchmal von Immunoassays nicht erkannt. Nachweis mittels Amplifikation und Sequenzierung des S-Gens.
Ergänzende Laborparameter Hepatitis A 27.5.1.
Antibiotikaempfindlichkeit Bei chron. Hepatitis B sind die Nukleosid- bzw. Nukleotidanaloga Lamivudin, Telbivudin, Adefovir, Tenofovir und Entecavir wirksam. Pegyliertes IFN-α ist besonders bei Pat. mit hoher Entzündungsaktivität (↑↑ Transaminasen) nützlich, hat aber auch schwerwiegende NW.
Therapieindikation ab 10.000 Kopien/ml (≙ 2.000 IU/ml). Bei Lamivudin-Resistenz Telbivudin.
Immunisierungsmöglichkeiten Aktivimpfung mit gentechnisch hergestelltem Hepatitis-B-Adsorbat-Impfstoff. Impfschema: 0–1–6 Mon. Immunisierung:HBV
Nach einer in der Hepatitis B:ImmunisierungsmöglichkeitenKindheit oder im Erwachsenenalter erfolgreich durchgeführten Grundimmunisierung (Erreichen eines Anti-HBs > 100 IE/l) ist keine Auffrischungsimpfung mehr nötig. Kontrolle des Impferfolges 4–8 Wo. nach der 3. Impfstoffdosis. Weitere Anti-HBs-Bestimmungen nicht erforderlich.Ausnahmen: Personen mit humoraler Immundefizienz (jährliche Anti-HBs-Kontrolle) und Personen mit besonders hohem individuellem Expositionsrisiko (Anti-HBs-Kontrolle alle 10 J.) → jeweils Auffrischungsimpfung bei Anti-HBs < 100 IE/l.
-
•
Empfohlene Impfung für alle Säuglinge und Kleinkinder (Bestandteil des regulären Impfkalenders).
-
•
Im Erwachsenenalter Indikationsimpfung (s. Kasten).
 STIKO-Indikationsgruppen (2013)
STIKO-Indikationsgruppen (2013)
-
•
Hepatitis B:IndikationsimpfungZu erwartender schwerer Verlauf einer Hepatitis-B-Erkr. bei bestehender oder zu erwartender Immundefizienz, Immunsuppression, schwerer Erkr. (z. B. HIV-Positive, Hepatitis-C-Positive, Dialysepat.).
-
•
Personen mit einem erhöhten nichtberuflichen Expositionsrisiko (z. B. Kontakt zu HBsAg-Trägern in Familie/Wohngemeinschaft, Sexualverhalten mit hohem Infektionsrisiko, i. v. Drogenkonsumenten, Gefängnisinsassen, ggf. Pat. psychiatrischer Einrichtungen).
-
•
Personen mit einem erhöhten beruflichen Expositionsrisiko, z. B. expositionsgefährdetes Personal in medizinischen Einrichtungen (einschl. Auszubildende, Labor- und Reinigungspersonal), Ersthelfer, Polizisten, Personal von Einrichtungen, in denen eine erhöhte Prävalenz von Hepatitis-B-Infizierten zu erwarten ist (z. B. Gefängnisse, Asylbewerberheime, Behinderteneinrichtungen).
-
•
Reiseindikation (individuelle Gefährdungsbeurteilung erforderlich).
HBV-Expositionsprophylaxe Tab. 27.6 .
Tab. 27.6.
Hepatitis-B-Prophylaxe nach Exposition (STIKO-Empfehlungen 2013) Hepatitis B:Expositionsprophylaxe
| Aktueller Anti-HBs-Wert | Erforderlich ist die Gabe von |
||
|---|---|---|---|
| HB-Impfstoff | HB-Immunglobulin | ||
| ≥ 100 IE/I | nein | nein | |
| 10–99 IE/I | Ja | nein | |
| < 10 IE/I oder nicht innerhalb von 48 h zu bestimmen | und Anti-HBs war ≥ 100 IE/l zu einem früheren Zeitpunkt | Ja | nein |
| und Anti-HBs war nie ≥ 100 IE/l oder unbekannt | Ja | ja | |
27.5.3. Hepatitis C
Das Hepatitis-C-Virus (HCV) ist ein RNA-Virus mit Hülle und gehört taxonomisch zu den Flaviviren. Es werden sechs Hepatitis C:Geno-/SubtypenGenotypen und mehr als 80 Subtypen unterschieden:
-
•
Genotyp 1a und 1b: USA und Westeuropa.
-
•
Genotyp 1b, 2a und 2b: Japan und Taiwan.
-
•
Genotyp 3: Thailand, Nordeuropa, Australien.
-
•
Genotyp 4: Mittlerer Osten, Afrika.
-
•
Genotyp 5: Südafrika.
-
•
Genotyp 6: Südostasien.
Klinik Vorkommen weltweit. Prävalenz unter Blutspendern in Deutschland 0,4–0,7 %. Leberzellzerstörung durch CD8-T-zellvermittelte Apoptose.
-
•Übertragung:
-
–In der Vergangenheit vorwiegend durch Bluttransfusionen (10–30 % aller posttransfusionellen Hepatitiden). In Deutschland wird jede Blutkonserve auf AK gegen HCV und mittels HCV-PCR getestet! Das Risiko einer HCV-Übertragung durch Transfusionen wird heute auf 1 : 15 Mio. Blutkonserven geschätzt.
-
–Erhöhte Prävalenz bei i. v. Drogenabhängigen, homosexuellen Männern (↑ Viruslast bei HIV-Coinfektion), nach Organtransplantationen, bei Hämodialysepat. sowie nach Tätowierungen und Nadelstichverletzungen.
-
–Vertikale Transmission von Mutter auf Kind (Risiko bei HCV-pos. Müttern: ≤ 10 %).
-
–Infektionsrisiko bei Stichverletzung durch HIV-kontaminierte Kanülen: 2–3 %.
-
–
-
•
Inkubationszeit: im Mittel 5–12 Wo. Inkubationszeiten bis zu mehreren Mon. wurden beschrieben.
-
•
Krankheitsverlauf: 75 % der akuten Infektionen verlaufen subklinisch. Zu 50–80 % chron. Verlaufsform, 20–30 % mit Zirrhoseentstehung. Teilweise Übergang in ein prim. Leberzell-Ca.
![]() Genotypen bestimmen Krankheitsverlauf und Ansprechen auf IFN-α-Therapie, z. B.
Genotypen bestimmen Krankheitsverlauf und Ansprechen auf IFN-α-Therapie, z. B.
-
•
Genotyp 1b: höhere Prävalenz von zirrhotischem Leberumbau und Leberzell-Ca, schlechtes Ansprechen auf IFN-α.
-
•
Genotyp 2a: minimale histolog. Veränderungen.
-
•
Genotyp 1a, 2 oder 3: gutes Ansprechen auf IFN-α.
-
•
Häufige Krankheitsassoziationen: gemischte Kryoglobulinämie, membranoproliferative Glomerulonephritis, Porphyria cutanea tarda, Sjögren-Sy., Polyarteriitis nodosa, transiente aplastische Anämien und Agranulozytosen, Hautkrankheiten (Lichen ruber planus, Erythema exsudativum multiforme).
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Erstnachweis des Hepatitis-C-Virus!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Erstnachweis des Hepatitis-C-Virus!
Untersuchungsmaterial Serologie: 1–2 ml Serum.
Mikrobiologische Diagnostik
Direktnachweis:
-
•
PCR zur Hepatitis C:NachweisAmplifikation von HCV-cDNA nach vorheriger reverser Transkription der HCV-RNA. Beweist aktive HCV-Infektion, wird etwa 20 d nach Infektion positiv. Kann jedoch bei geringer Virusreplikation oder Viruspersistenz außerhalb des Blutkompartiments falsch neg. ausfallen.
-
•
Quantifizierung der HCV-RNA mittels PCR zur Beurteilung eines Therapieeffekts und Festlegung der Therapiedauer.
-
•
HCV-Genotyp-Bestimmung (serologisch oder mittels PCR) zur Prognose eines Therapieeffekts und Festlegung der Therapiedauer.
Serolog. AK-Nachweis:
-
•
IgG-AK sind ab 4–6 Wo. nach Infektion mittels ELISA nachweisbar (diagn. Fenster!). Lebenslange Persistenz bei chron. Hepatitis C (Korrelation mit persistierender Virämie), bei Ausheilung nach Jahren keine IgG-AK mehr nachweisbar.Cave: Bei Pat. mit niedriger HCV-Virämie können Anti-HCV-AK im Serum fehlen!
-
•
Nachweis von spez. IgM engt das diagn. Fenster nur unwesentlich ein. Außerdem entwickeln Pat. mit mildem Verlauf einer akuten Hepatitis C nur selten IgM-AK, bei akuten Schüben einer chron. Hepatitis C sind nur bei 50 % der Pat. IgM-AK nachweisbar.
-
•
Bestätigungstest bei pos. ELISA mittels rekombinantem Immunoblot-Assay (RIBA): AK-Nachweis gegen Antigensequenzen des Core-Proteins sowie der Nichtstrukturproteine (NS) 3, 4 und 5: Mindestens 2 der AG-Bereiche müssen durch die AK im Patientenserum erkannt werden. Alternativ HCV-PCR.
Ergänzende Laborparameter Hepatitis A, 27.5.1.
Antibiotikaempfindlichkeit Pegyliertes IFN-α, möglichst in Komb. mit Ribavirin, führt bei etwa 40 % der Pat. mit Genotyp-1-Infektionen zur anhaltenden Viruselimination (Genotyp 2 und 3 bis zu 80 %). Triple-Therapie mit Proteaseinhibitoren (Boceprevir, Telaprevir, Simeprevir, Sofosbuvir) führt auch bei Infektionen mit HCV-Genotyp 1 zu dauerhaften Ansprechraten von bis zu 80 %. Begleitend immer HCV-Viruslast bestimmen, um Therapiealgorithmen bzw. Stoppregeln zu entsprechen.
 HCV-Exposition
HCV-Exposition
Hepatitis C:ExpositionEine Postexpositionsprophylaxe, z. B. nach Nadelstichverletzung, ist derzeit noch nicht möglich. Unmittelbar nach der Verletzung/Kontamination sollten beim Exponierten Anti-HCV und ALT/GPT bestimmt werden (Ausgangswerte). Im Verlauf sollte nach 2–4 Wo. eine HCV-Testung mittels PCR durchgeführt und, falls negativ, nach 6–8 Wo. wiederholt werden. Falls es zu einer HCV-Infektion gekommen ist, ergibt sich durch die Einleitung einer Frühtherapie eine hohe Wahrscheinlichkeit, eine Chronifizierung der Infektion zu vermeiden. Spätestens nach 12–26 Wo. sollten nochmals ALT/GPT und Anti-HCV wiederholt und bei path. Werten eine HCV-PCR angeschlossen werden.
27.5.4. Hepatitis D
Das Hepatitis-D-Virus (HDV) ist ein defektes Einzelstrang-RNA-Virus, das keine eigene Hülle besitzt. Es bekommt diese durch ein Hepatitis DHelfervirus (HBV) zur Verfügung gestellt. Es tritt somit nur als Co-Infektion mit Hepatitis B oder als Superinfektion eines HBV-Trägers auf.
Klinik Das Virus ist in Süditalien, Nordafrika und in den arabischen Ländern häufig. Bei Coinfektion Inkubationszeit und Klinik wie HBV. Bei Superinfektion eines HBV-Trägers mit HDV fulminante Hepatitis durch direkte Zytotoxizität des HDV.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Nachweis von Hepatitis-D-Virus!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Nachweis von Hepatitis-D-Virus!
Untersuchungsmaterial
Serologie: 1–2 ml Serum.
Mikrobiologische Diagnostik Diagnostik mittels serologischem AG- und AK-Nachweis durch ELISA, HDV-RNA mittels RT-PCR (Tab. 27.7 ). Ein immunhistologischer Nachweis in Leberbiopsiegewebe (Speziallabor!) ist möglich.
-
•Akutphase:
-
–HD-AG: Bei Superinfektion oft besser nachweisbar als bei Coinfektion, persistiert nur kurz! HDV-RNA-Nachweis ist zuverlässiger!
-
–Anti-HD-IgM: oft einziger Marker während des späten Akutstadiums, wenn HD-AG schon nicht mehr nachweisbar ist.
-
–
-
•
Chron. Verläufe: Anti-HD-IgG, HDV-RNA.
-
•
Ausheilung: Anti-HD-IgG persistiert nur kurz!
-
!
Zusätzlich vollständige serologische Diagnostik einer Hepatitis B.
Tab. 27.7.
Serologische Marker der Hepatitis-D-Hepatitis D:serologische MarkerInfektion
| Krankheitsstadium | HBV |
HDV |
||||
|---|---|---|---|---|---|---|
| HBsAg | Anti-HBc-IgM | HDV-RNA | HDAG | Anti-HD-IgM | Anti-HD-IgG | |
| Akute Hepatitis (HDV-/HBV-Coinfektion) | (+) | + | + | (+) | + | (+) |
| Akute Hepatitis (HDV-/HBV-Superinfektion) | + | – | + | (+) | + | (+) |
| Chron. Hepatitis (HDV/HBV) | + | – | + | – | (+)/− | + |
+ positiv, (+) schwach positiv, − negativ
Ergänzende Laborparameter Hepatitis A, 27.5.1.
Immunisierungsmöglichkeit Die Hepatitis-B-Impfung schützt aufgrund der Pathogenese auch vor Hepatitis D.
Antibiotikaempfindlichkeit Pegyliertes IFN-α.
27.5.5. Hepatitis E
Klinik Bisher hauptsächlich in Indien, Asien und Afrika Hepatitis Esowie Mittelamerika beobachtetes RNA-Virus. Dort Übertragung fäkal-oral durch kontaminiertes Trinkwasser. Inkubationszeit 5–6 Wo. Zunehmende Anzahl von HEV-Infektionen in Europa, durch Kontakt mit Tieren oder tierischen Lebensmitteln erworben. Die Übertragung durch Blutprodukte wird zurzeit diskutiert. Seroprävalenz in Deutschland ca. 17 %.
Verlauf gleicht einer Hepatitis A → subklin. oder leichte Verläufe. Ausnahme: bei Schwangeren oft fulminanter und tödlicher Verlauf (Letalität 10–25 %, ungeklärte Ursache). Chron. Hepatitis E (v. a. Genotyp 3) bei Immunsupprimierten.
Humanpathogene Genotypen:
-
1.
Asien, Afrika.
-
2.
Mexiko, Afrika.
-
3.
Weltweit.
-
4.
China, Taiwan, Japan, Vietnam.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Nachweis von Hepatitis-E-Virus!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an akuter Virushepatitis, Nachweis von Hepatitis-E-Virus!
Untersuchungsmaterial
-
•
Serologie: 1–2 ml Serum.
-
•
Direktnachweis: Stuhl.
Mikrobiologische Diagnostik
-
•
Ausschluss von Hepatitis A mittels IgM-Serologie und Hepatitis B (HBsAg, Anti-HBc-IgM).
-
•
Nachweis von HEV-spez. IgM- und IgG-AK im Serum (Immunoblot): IgM-AK weisen auf eine frische Infektion hin, IgG-AK persistieren meist lebenslang. Bei Immunsupprimierten nicht zuverlässig!
-
•
PCR: Nachweis von HEV-RNA im Blut oder Stuhl zur Frühdiagnostik vor klin. Manifestation und vor Nachweis von spez. AK.
-
•
Immunelektronenmikroskopie mit polyklonalen Antiseren zum Nachweis aggregierter Calicivirus-Partikel im Stuhl (Speziallabor!).
-
•
POCT: für den Einsatz in Entwicklungsländern als immunchromatografischer Test.
Ergänzende Laborparameter Hepatitis A, 27.5.1.
Antibiotikaempfindlichkeit Ribavirin bei schweren Verläufen und bei Immunsupprimierten.
27.5.6. Andere Hepatitisformen
Akute Virus-Hepatitiden sind von Hepatitis:Differenzialdiagnosenanderen Formen der infektiösen Hepatitis abzugrenzen:
-
•
Viral: EBV, CMV, HSV, VZV, Coxsackie-, Polio-, Gelbfieberviren.
-
•
Bakt.: Brucellen, Leptospiren, Rickettsien, Pneumokokken, Salmonellen.
-
•
Selten: Tbc, Lues, Aktinomyzeten, Amöbiasis, Schistosomiasis, Leishmaniose, Toxoplasmose, Malaria.
27.6. Adenoviren
Klinik DNA-Viren (6 humanpathogene Spezies A–F mit 51 AdenovirenSerotypen), die durch Tröpfchen- oder Schmierinfektion übertragen werden. Hohe Kontagiosität, Persistenz in Tonsillengewebe. Folgende Erkr. sind möglich:
-
•
Infektionen des oberen Respirationstrakts bei Kindern: Schnupfen, Pharyngitis, Tonsillitis.
-
•
Infektionen des unteren Respirationstrakts bei Kindern und Erw. mit Immundefekten: Bronchitis, Pneumonie. Husten kann pertussisähnlich sein. Vereinzelt Komplikationen: Meningoenzephalitis oder Hepatitis.
-
•
Pharyngokonjunktivales Fieber bei Kindern im Kindergarten- und Schulalter: „Schwimmbadfieber“ im Sommer → follikuläre Konjunktivitis mit SchwimmbadfieberFieber, Pharyngitis und Lymphknotenschwellungen.
-
•
Epidemische Konjunktivitis: nosokomiale Infektion in Konjunktivitis:epidemischeAugenkliniken und -praxen mit milder Beteiligung des oberen Respirationstrakts.
-
•
Akute hämorrhagische Infektionen der unteren Harnwege.
-
•
Gastroenteritis bei Kindern.
![]() Namentlich bei Direktnachweis von Adenoviren im Konjunktivalabstrich!
Namentlich bei Direktnachweis von Adenoviren im Konjunktivalabstrich!
Untersuchungsmaterial
-
•
Kultur und Direktnachweis: Rachenspülwasser, Nasopharyngealsekret, Trachealaspirat oder BAL, Konjunktivalsekret, Liquor, Stuhl, Urin.
-
•
Serologie: 1–2 ml Serum.
![]() Adenoviruserkr. sind hochkontagiös! Besondere Vorsicht im Umgang mit dem Untersuchungsmaterial!
Adenoviruserkr. sind hochkontagiös! Besondere Vorsicht im Umgang mit dem Untersuchungsmaterial!
Mikrobiologische Diagnostik
Direktnachweis:
-
•
Nachweis von Adenoviren im Stuhl oder im Nasopharyngealsekret mittels PCR, ELISA, dir. IFT. Quantitative PCR zur Ermittlung der Viruslast.
-
•
Schnellteste (Lateral Flow-Format) mit geringerer Sensitivität.
-
•
Elektronenmikroskopischer Nachweis von Viruspartikeln im Stuhl bei Gastroenteritis (Speziallabor!).
Kultur: humane embryonale Nierenzellen (HEK), aber auch HeLa oder HEp-2-Zellen:
-
•
CPE nach 1–4 Wo.
-
•
Genusspez. Typisierung mittels dir. IFT, ELISA oder Elektronenmikroskopie.
-
•
Typenbestimmung durch HAHT oder Neutralisation mit typenspez. Antiseren, zunehmend auch durch PCR.
Serolog. AK-Nachweis: geringe Bedeutung der Serologie für die Diagnose (hoher Durchseuchungsgrad, Typenvielfalt der Adenoviren). Nachweis von spez. IgM-/IgA- (Frühphase der Infektion) und IgG-AK.
27.7. Papillomaviren und Polyomaviren
Klinik Papillomaviren (HPV) sind DNA-Viren, die durch direkten Hautkontakt und Geschlechtsverkehr übertragen werden. Inkubationszeit 3 Mon. bis zu Papillomaviren2 J. Hautwarzen, anogenitale Warzen (Condyloma Papovavirenacuminata), orale Papillome, Atemwegspapillome, Haut-, Zervix-, Penis- und Blasen-, Tonsillen-Ca.
![]() Die Typisierung der HPV dient der Einteilung in Risikogruppen für die Entstehung von Karzinomen bei infizierten Pat.
Die Typisierung der HPV dient der Einteilung in Risikogruppen für die Entstehung von Karzinomen bei infizierten Pat.
Condyloma acuminataDie humanpathogenen Vertreter der Polyomaviren werden unterteilt in (Namen stehen für die Initialen der Pat., bei denen sie erstmals isoliert wurden):
-
•JC-Virus: Polyomavirenverursacht bei schweren Immundefekten (AIDS, Hodgkin-JC-VirusLymphom, Leukosen) eine progressive multifokale Leukenzephalopathie (PML) mit folgenden Symptomen:
-
–Früh → Leukenzephalopathie, multifokalemultifokal neurologisch, ähnlich einer multiplen Sklerose mit Mono- oder Hemiparese, Ataxie, Dysarthrie, Gedächtnisstörungen, Sprachstörungen, Rindenblindheit.
-
–Spät → oft Quadroplegie, schwere Demenz, komatöser Zustand. Rasch progredienter Verlauf, nach Auftreten erster Symptome innerhalb von 2–4 Mon. tödlich.
-
!60–75 % der gesunden Weltbevölkerung sind seropositiv (Infektion im Kindesalter, Viruspersistenz in der Niere) → Krankheitsausbruch vermutlich durch Reaktivierung des latenten Virus.
-
–
-
•
BK-Virus: Infektion im Kindesalter, Viruspersistenz in der Niere. BK-VirusHämorrhagische Zystitiden nach Nieren- und KM-Transplantation. Cave: 75 % der Weltbevölkerung sind seropositiv, vermutlich ebenfalls Reaktivierung bei Immunsuppression.
Untersuchungsmaterial
Papillomaviren: Biopsie oder zellhaltige Abstriche von verdächtigen Arealen, hauptsächlich des Genitaltrakts.
Polyomaviren:
-
•
JCV: Liquor, Hirnbiopsien, Urin, Autopsie-Untersuchungsmaterial.
-
•
BKV: Urin.
Mikrobiologische Diagnostik
Direktnachweis:
-
•
Papillomaviren: Virus-DNA-Nachweis mittels PCR (Consensus Primer) mit anschließender DNA-Hybridisierung (typenspez. Sonden). Alternativ Hybridisierung ohne vorherige Amplifikation, direkte In-situ-Hybridisierung. Synchrone Detektion der 17 relevantesten HPV-Typen durch neuen DNA-Chip. HPV-Viruslast durch Realtime-PCR.
-
•Polyomaviren:
-
–JCV: PCR im Liquor (im Frühstadium z. T. noch negativ!), Virusnachweis in den Zellkernen der betroffenen Oligodendrozyten immunhistochemisch, durch IFT, mittels DNA-Hybridisierung, PCR oder direkt elektronenmikroskopisch.
-
–BKV: im Urinsediment durch PCR oder Elektronenmikroskopie.
-
–
Kultur (nur Speziallabor!):
-
•
JCV: aus Urin oder Hirnbiopsie in humanen fetalen Gliazellen.
-
•
BKV: aus Urin in humanen diploiden Fibroblasten.
Differenzierung mittels HAHT.
Serologie: entfällt.
![]() Nachweis von BKV im Urin auch bei Immunsupprimierten ohne Erkrankung!
Nachweis von BKV im Urin auch bei Immunsupprimierten ohne Erkrankung!
Immunisierung Seit März 2007 empfohlene Impfung (bivalent HPV 16, 18, tetravalent Immunisierung:HPV-InfektionHPV 6, 11, 16, 18, monovalent HPV 6, 11, 16, 18, 31, 33, 45, 52 und 58 im Zulassungsverfahren) für Mädchen zwischen dem 12. und 17. Lj.
27.8. Parvoviren
Der einzige humanpathogene Vertreter dieser Parvovirus B19kleinen DNA-Viren ist das Parvovirus B19.
Klinik Tröpfcheninfektion mit Erstinfektion meist schon im Kindesalter → Ringelröteln (Erythema infectiosumRingelröteln): rötelnähnlicher Ausschlag, zuerst im Erythema infectiosumGesicht, dann an Extremitäten und Rumpf. Erstinfektionen bei Erw. variieren zwischen unspez. Fieber („grippaler Infekt“) und Arthropathien ähnlich einer rheumatischen Erkr. (häufig junge Frauen). Parvovirus B19 kann gelegentlich auch über Blutkonserven und Blutprodukte übertragen werden.
-
•Komplikationen:
-
–Transiente aplastische Krisen bei Sichelzellanämie, Thalassämie oder hereditärer Sphärozytose. Häufig kein begleitender Hautausschlag! Kann lebensgefährlich sein → Transfusionen notwendig!
-
–Hämolytische Anämien besonders bei Immundefekten.
-
–
-
•
Embryopathie: bei intrauteriner Infektion in 20 % Fruchttod oder Hydrops fetalis.
Untersuchungsmaterial
-
•
Serologie: 1–2 ml Serum.
-
•
Direktnachweis: Rachensekret, EDTA-Blut, Liquor, Gelenkpunktat, fetales Gewebe, Fruchtwasser, Nabelschnurblut bei V. a. Embryopathie.
Mikrobiologische Diagnostik
-
•
Direktnachweis: Virusnachweis in Serum und Rachensekret mittels PCR.
-
•
Kultur: Parvovirus B19 kann in humanen Knochenmarkzellen oder fetalen Leberzellen in Anwesenheit von Interleukin-3 und Erythropoetin oder in MB-02-Zellen (immortale Megakaryozyten-Leukämiezellen) unter Zusatz von GM-CSF und Erythropoetin kultiviert werden. Diese aufwendige Methode bleibt aber meist nur wissenschaftlichen Fragestellungen vorbehalten.
-
•
Serolog. AK-Nachweis: Diagnose beruht auf IgM-Nachweis (IgG nur bei Serokonversion innerhalb von zwei Blutabnahmen beweisend!) mittels ELISA. Zusätzlich IgG-Aviditätsbestimmung. Bestätigung mittels Western Blot. Cave: Bei Schwangeren nicht auf neg. IgM-Nachweis verlassen → PCR aus mütterlichem (und kindlichem) Material!
Ergänzende Laborparameter Hb → bis ↓, Retikulozyten ↓↓, (erythrozytäre Vorläuferzellen im KM ↓↓).
![]() Die Verwendung von Parvovirus-B19-PCR-getesteten Blutkonserven verhindert die transfusionsassoziierte Übertragung des Virus.
Die Verwendung von Parvovirus-B19-PCR-getesteten Blutkonserven verhindert die transfusionsassoziierte Übertragung des Virus.
27.9. Reoviren
Die Bezeichnung Reoviren stellt eine Abkürzung für Reoviren Respiratory Enteric Orphan Viruses dar. Die Respiratory Enteric Orphan Viruses\t \"Siehe Reovirenwichtigsten Gattungen sind die Orbiviren, Reoviren und Rotaviren.
27.9.1. Orbiviren
Klinik
Colorado Tick Fever Orbiviren : im Südwesten der USA, durch Zecken Colorado Tick Feverübertragen, Inkubationszeit 3–6 d, meist milder Verlauf mit biphasischem Fieberanstieg, Myalgien, Abgeschlagenheit, Zephalgien, Konjunktivitis, abdominalen Beschwerden. Krankheitserscheinungen für 7–10 d. In 5 % d. F. Komplikationen durch Meningoenzephalitis oder hämorrhagisches Fieber.
In Osteuropa verursachen die durch Holzböcke übertragenen Kemerow- und Tribecy-Viren Kemerow-Viren ähnliche Krankheitserscheinungen.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischem Fieber, Nachweis von Erregern hämorrhagischen Fiebers!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischem Fieber, Nachweis von Erregern hämorrhagischen Fiebers!
Tribecy-Viren Untersuchungsmaterial
-
•
Serologie: 1–2 ml Serum.
-
•
Kultur und Direktnachweis: 10 ml Heparin- oder Citratblut.
Mikrobiologische Diagnostik
-
•Direktnachweis:
-
–RT-PCR als Goldstandard.
-
–AG-Nachweis in Erythrozyten mittels dir. IFT (Sensitivität geringer als Kultur oder PCR).
-
–
-
•
Kultur: Virusisolierung in der Zellkultur (Speziallabor!) besonders zur Frühdiagnose geeignet (erste Krankheitstage).
-
•
Serolog. AK-Nachweis: ELISA, Western Blot, indir. IFT. Nachweis von spez. IgM für akute Infektion beweisend. AK-Anstieg oft erst sehr spät.
27.9.2. Rotaviren
7 Antigengruppen (A–G); Gruppe A am häufigsten im klin. Untersuchungsgut.
Klinik Schmierinfektion (Virusausscheidung Rotavirenweitgehend über den Darm), seltener auch Tröpfcheninfektion. Bevorzugt Kinder zwischen 6 Mon. bis 2. Lj. Infektion der Enterozyten des Dünndarms → osmotische Diarrhö mit Elektrolyt- und Wasserverlust, teilweise Erbrechen. Subklin. Infektionen (etwa 50 % gesunde Ausscheider bei Kleinkindern) bis zur tödlichen Exsikkose möglich.
![]() Gestillte Babys sind durch das spez. IgA in der Muttermilch (besonders hohe Konz. im Kolostrum!) in den ersten Lebenstagen gegen Rotavirusinfektionen geschützt!
Gestillte Babys sind durch das spez. IgA in der Muttermilch (besonders hohe Konz. im Kolostrum!) in den ersten Lebenstagen gegen Rotavirusinfektionen geschützt!
![]() Namentlich bei Nachweis von Rotaviren!
Namentlich bei Nachweis von Rotaviren!
Untersuchungsmaterial
Kultur und Direktnachweis: Stuhl.
Mikrobiologische Diagnostik
-
•Direktnachweis:
-
–AG-Nachweis relativ einfach mittels ELISA oder Latexagglutinationstest mit mono- oder polyklonalen AK (Gruppe-A-Rotaviren), Dot-Hybridisierung oder RT-PCR.
-
–Membran-ELISA als POC-Diagnostikum verfügbar, etwa 20 Min. bis zum Ablesen erforderlich.
-
–
-
•
Kultur: in prim. Affen-Nierenzellen (MA104) oder humanen Kolonkarzinomzellen (CaCo-2) → kein CPE! Differenzierung der Isolate mittels dir. IFT und Serotypisierung mittels NT. Nicht routinemäßig durchgeführt (Speziallabor!).
-
•
Serologie: entfällt, da fast 100 % Durchseuchung.
Differenzialdiagnostisch abgegrenzt werden müssen Rotaviren:DD Astroviren, die nach den Rotaviren zu den häufigsten AstrovirenVerursachern von Gastroenteritiden bei kleinen Kindern zählen (Anteil: 3–9 %). Die Schwere der Erkr. ist jedoch geringer als bei Rotaviren. Nachweis im Stuhl mittels RT-PCR, Antigen-ELISA oder Anzucht in CaCO-2- oder LLC-MK2-Zellen (nicht routinemäßig). In Speziallabor auch Elektronenmikroskopie.
Immunisierungsmöglichkeit STIKO-Empfehlung für die allg. Rotavirus-Schluckimpfung für Säuglinge seit 2013. Die Impfserie Rotaviren:Schluckimpfungsollte im Alter von 6–12 Wo. begonnen und je nach Impfstoff bis zur vollendeten 24. oder 32. Lebenswo. beendet sein.
27.10. Togaviren
Die Gruppe der Togaviren unterteilt sich in Rubella- und Alphaviren (ehemals TogavirenArboviren Gruppe A). RNA-Einzelstrang-Viren mit Hülle. Die ehemalige Gruppe B der Arboviren wurde in der neuen Nomenklatur zu Flaviviren umbenannt (27.11). Die Erreger der übrigen durch Arthropoden übertragenen Virusinfektionen wurden der Familie der Bunyaviren (27.12) zugeordnet.
27.10.1. Rubellavirus
Klinik Rötelnerkrankung. Die RNA-Viren werden sowohl durch Tröpfchen- alsRubella(viren) auch Schmierinfektionen übertragen.
-
•
Postnatale Infektion: nach InkubationszeitRöteln von 2–3 Wo. leichte Infektion des oberen Respirationstrakts, gefolgt von einem makulopapulösen Exanthem und zervikal-nuchalen Lymphknotenschwellungen. Seltene Komplikationen: Arthritis, Otitis, Enzephalitis, Endomyokarditis. 50 % der Infektionen verlaufen subklinisch und ohne Exanthem! Lebenslange Immunität.
-
•Intrauterine Infektion bei Infektion der Mutter: Rötelnembryopathie
-
–In den ersten 3–4 RötelnembryopathieSchwangerschaftsmon. → Abort oder schwere Embryopathie mit Mikrozephalie, Kataraktbildung, Mikrophthalmie, angeborenen Herzfehlern, Taubheit, Hepatosplenomegalie mit Ikterus, Thrombozytopenie und hämolytischer Anämie.
-
–In den späteren Schwangerschaftsmon. → diskrete, oft erst später bemerkte Sprach- und Hörstörung möglich.
-
–
![]() Namentliche Meldung von Röteln einschl. Rötelnembryopathie. Namentliche Meldung bei Nachweis von Rubellavirus.
Namentliche Meldung von Röteln einschl. Rötelnembryopathie. Namentliche Meldung bei Nachweis von Rubellavirus.
Untersuchungsmaterial
-
•
Serologie: 1–2 ml Serum.
-
•Kultur und Direktnachweis: nur für pränatale Diagnostik und bei Kindern mit V. a. Rötelnembryopathie → Speziallabor!
-
–Pränatal: Zervikalsekret der Mutter, Chorionzottenbiopsiematerial, Fruchtwasser, Nabelschnurblut.
-
–Postnatal: Rachensekret, Heparinblut, Liquor, Urin vom Kind.
-
–
Mikrobiologische Diagnostik Serologie:
-
•
V. a. akute Röteln-Infektion: IgM- und IgG-AK (Immunoassay). IgM-AK sind ab Tag 2–4 nach Exanthemausbruch für 1–6 Mon., selten auch länger, nachweisbar.
-
•
Röteln-Screening i. R. der Schwangerenvorsorge: Immunität kann angenommen werden nach zwei dokumentierten Röteln-Impfungen oder wenn spez. AK vor Eintritt der Schwangerschaft nachgewiesen wurden. Liegen entsprechende Befunde nicht vor, so ist der Immunstatus der Schwangeren zu bestimmen (IgG-AK). Bei unklaren Befunden ggf. Aviditätsbestimmung der IgG-AK und Immunoblot (AK gegen Glykoprotein E1 und C-Protein werden in der Frühphase der Infektion, AK gegen Glykoprotein E2 ab 4. Mon. nach Infektion gebildet). Bei fehlender Immunität serologische Kontrolle bis SSW 17 empfohlen.
-
•
Immunitätsabklärung nach Impfung: Nachweis von IgG-AK.
-
•V. a. Rötelnembryopathie:
-
–Pränatal:
-
–Rötelnembryopathie Serologie mit dem mütterlichen Serum wie bei akuter Infektion. Im Zweifelsfall Nachweis rötelnspez. IgM-AK im Fetalblut (Nabelschnurvene) zwischen SSW 22 und 23.
-
–Direktnachweis: Nachweis von Rötelnvirus (PCR) aus Chorion-Biopsiematerial oder Amnionflüssigkeit (pränatale Frühdiagnostik) sowie ab SSW 22 zusätzlich Untersuchung von Fetalblut (IgM-Test, PCR).
-
–Kultur: Anzucht in Zellkultur und Identifizierung des Isolats (dir. IFT, Nested-RT-PCR) nur noch im Speziallabor für wissenschaftliche Fragestellungen.
-
–
-
–Postnatal:
-
–Serologie: Nachweis von IgM-AK im IgM-ELISA (μ-Capture-Assay). IgM-AK sind bei Geburt sowie in den ersten 3 Lebensmon. bei 95 % d. F. einer intrauterinen Infektion nachweisbar. In den ersten 6 Lebensmon. ist der alleinige IgG-Nachweis kein Beweis. IgG sind plazentagängig und können von der Mutter stammen.
-
–Virusnachweis zur Diagnosesicherung aus Rachensekret, Urin, Liquor und Buffy-Coat des Kindes mittels → Nested-RT-PCR bei ca. 80 % der infizierten Kinder bis zum 3. Lebensmon. positiv.
-
–
-
–
-
•
V. a. Röteln-Meningoenzephalitis: Bestimmung von IgG-AK im SerumRöteln-Meningoenzephalitis und Liquor und Errechnung der spez. AK-Indizes.
-
•
HAHT und NT werden nur noch in Speziallaboratorien durchgeführt.
Immunisierungsmöglichkeit
-
•Aktive Rötelnimpfung: empfohlen im Alter von 12–15 Mon. in Komb. mit Masern- und Mumpsimpfung. Wiederholung im 5.–6. Lj.
-
!Immunisierung:RötelnImpfschutzprüfung vor jeder Schwangerschaft.
-
!
-
•
Passive Impfung: Röteln-Ig (nur IgG, kaum IgM) bei rötelnexponierten seroneg. Schwangeren in der Frühgravidität bis zu 7 d nach Exposition. Diese Therapie stört serologisch kaum. Weiterhin serologische Überwachung, um den Erfolg der Gammaglobulingabe zu kontrollieren.
27.10.2. Alphaviren
Klinik Verursachen fieberhafte, z. T. mit MeningoenzephalitisAlphaviren oder Polyarthritis einhergehende Erkr. von Mensch und Tier. Übertragung durch Moskitos.
Hauptverbreitungsgebiete:
-
•
USA: Eastern Encephalitis, Western Encephalitis. Eastern Encephalitis
-
•
Südamerika: venezolanische Western EncephalitisEnzephalitis, Mayaro-FieberVenezolanische Enzephalitis.
-
•
Afrika: O'nyong-nyong-MayarofieberFieber, Chikungunya-FieberO‘nyong-nyong-Fieber, Semliki-Forest-FieberChikungunya-Fieber.
-
•
Südostasien: Chikungunya-Semliki-Forest-FieberFieber, Semliki-Forest-Fieber.
-
•
Australien: Ross-River-Fieber, Barmah-Forest-FieberRoss-River-Fieber.
-
•
In Afrika, Australien, Barmah-Forest-FieberAsien und Nordosteuropa kommen Sindbis-Virusinfektionen vor (Fieber, Arthralgien, Myalgien, Sindbis-VirusinfektionenExantheme).
Chikungunya-Fieber trat im Sommer 2007 erstmalig in Norditalien (Emilia-Romagna, Provinz Ravenna) auf. Es erkrankten 151 Personen.
![]() Diagnostik ist Speziallaboratorien vorbehalten (Sicherheitsstufe 3–4!).
Diagnostik ist Speziallaboratorien vorbehalten (Sicherheitsstufe 3–4!).
Untersuchungsmaterial, mikrobiologische Diagnostik
-
•
Serologie: 1–2 ml Serum, 1 ml Liquor → AK-Nachweis (ELISA IgG, IgM).
-
•
Direktnachweis mittels PCR oder serologische AG-Detektion (dir. IFT).
-
•
Kultur: Virusnachweis aus Blut, Liquor oder Hirngewebe (Anzucht in Vero- oder Moskitozellen → Differenzierung mittels dir. IFT, HAHT oder ELISA).
27.11. Flaviviren
Ehemals Gruppe B der Arboviren. RNA-Einzelstrangviren mit Hülle.
Klinik Folgende Erkr. werden durch Flaviviren Flavivirenausgelöst:
-
•Dengue-Fieber: Vorkommen: Europa (Mittelmeerländer), Dengue-FieberOstasien (v. a. Thailand), Nordafrika, Süd- und Mittelamerika sowie Indien. Übertragung durch Stechmücken. Inkubationszeit 2–7 d. Starke Zunahme der Fallzahlen in den letzten Jahren.
-
–Bei Erstinfektion: Fieber, Schüttelfrost, Kopfschmerzen, erythematöse Schwellung im Gesicht und Gelenkschmerzen, gefolgt von einem makulopapulösen Exanthem.
-
–Bei Zweitinfektion mit einem anderen Serotyp: Schock, da die bereits bestehenden AK kreuzreaktiv, aber nicht neutralisierend sind. → Immunkomplexe aktivieren das Komplement- und Kininsystem.
-
–
-
•Gelbfieber: Vorkommen: tropisches Mittel- und Südamerika, Gelbfieberin Afrika südlich der Sahara. Übertragung durch Stechmücken der Gattungen Aedes spp. und Haemagogus spp. Inkubationszeit 3–6 d. Zweiphasiger Krankheitsverlauf:
-
–Virämie → allg. Symptome wie Fieber, Kopfschmerzen, Schüttelfrost und Übelkeit.
-
–Organmanifestation sehr vielschichtig, da das Virus viszerotrop ist: Gelbsucht, Albuminurie, Oligurie, Koma, Blutungen, Muskel- und Gelenkschmerzen.
-
!Letalität bei Organmanifestation: ∼50 %.
-
–
-
•FSME (europäische Frühsommer-Meningoenzephalitis): Vorkommen: v. a. in Frühsommer-Meningoenzephalitis (FSME)Osteuropa, Süddeutschland und Österreich. Übertragung durch den Biss der Zecke Ixodes ricinus („Holzbock“). Inkubationszeit 1–2 Wo.
-
–Primär uncharakteristische grippeähnliche Prodromi, denen ein symptomloses Intervall von 1–20 d folgt.
-
–Danach erneuter Fieberanstieg mit variablen meningitischen oder meningoenzephalitischen Symptomen (Kopfschmerzen, Bewusstseinsstörungen, psychische Alteration, Paresen insb. der oberen Extremitäten und des Schultergürtels, Sensibilitätsstörungen). Die Lähmungserscheinungen sind klin. nicht von einer Poliomyelitis zu unterscheiden. Letalität in Europa etwa 1 %. Bleibende Folgen in Form von Lähmungen oder psychischen Veränderungen sind möglich.
-
–
-
•
Hämorrhagisches Fieber und Enzephalitis: In Afrika, Asien und Amerika wurden weitere Flaviviren beschrieben, die von Moskitos oder Zecken übertragen werden und hämorrhagisches Fieber oder Hämorrhagisches Fieber:FlavivirenEnzephalitis auslösen können: West-Nil-Fieber (seit Enzephalitis:Flaviviren1999 in Nordamerika nachweisbar), japanische Enzephalitis, St.-Louis-Enzephalitis, Murray-Valley-Enzephalitis, Rocio-Enzephalitis, Omsker hämorrhagisches Fieber, Kyasanur-Waldkrankheit.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischem Fieber, Nachweis von FSME-Virus, Nachweis von Gelbfiebervirus, Nachweis von anderen Erregern hämorrhagischen Fiebers!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischem Fieber, Nachweis von FSME-Virus, Nachweis von Gelbfiebervirus, Nachweis von anderen Erregern hämorrhagischen Fiebers!
Untersuchungsmaterial, mikrobiologische Diagnostik
Dengue-Fieber:
-
•
Serologie: 1–2 ml Serum, ELISA zur Differenzierung von spez. IgM und IgG. IgM-AK sind ca. 3–5 d, IgG-AK ca. 8–14 d nach Beginn der Krankheitssymptome nachweisbar. IgM-AK können bis zu 3 Mon. persistieren. Bei Re-Infektionen meist keine IgM-AK, aber Anstieg der IgG-AK. Western Blot zum Nachweis von AK gegen Nichtstrukturproteine bei Zweitinfektion.
-
•
Nachweis von Denguevirus-NS1-Antigen (Non-structural Protein 1) im Serum (ELISA): Dieser Frühmarker einer akuten Infektion (ab 1. Krankheitstag) ist bereits vor Auftreten von IgM- und IgG-AK nachweisbar und wird innerhalb von 1–2 Wo. wieder negativ. Der NS1-Assay eignet sich wegen seiner Spezifität auch zur Differenzierung zwischen den verschiedenen Flaviviren.
-
•
Kultur: 10 ml Heparin- oder Vollblut in der ersten Fieberphase. Virusanzucht (Mückenzellen, Vero-Zellen) und anschließende Identifizierung des Isolats mittels dir. IFT.
-
•
PCR zum Virusnachweis im Serum.
Gelbfieber:
-
•
Serologie: 1–2 ml Serum. IgG-/IgM-AK-Nachweis mittels ELISA, ind. IFT, HAHT oder NT (mindestens 4-facher Titeranstieg). IgM-AK persistieren nach Erkr. und Impfung sehr lange. Kreuzreaktionen mit anderen Flaviviren!
-
•
AG-Nachweis i. S. mittels ELISA oder dir. IFT.
-
•
Kultur: 10 ml Heparin- oder Vollblut in den ersten Krankheitstagen → Virusisolation in Zellkultur (Vero- oder Mückenzellkultur, oft kein CPE) mit anschließender Identifizierung des Isolates mittels dir. IFT oder PCR (Speziallabor!).
-
•
PCR zum Nachweis von Gelbfiebervirus i. S. (Methode der Wahl), ggf. mit nachfolgender Sequenzierung der amplifizierten Nukleinsäure.
FSME:
-
•
Serologie: 1–2 ml Serum. Nachweis von IgM-AK mittels μ-Capture-ELISA oder mindestens 4-facher Titeranstieg im indir. IFT bzw. im IgG-ELISA. Nach aktiver Immunisierung persistieren IgM-AK oft länger. Bei FSME können trotz zurückliegender Immunisierung die IgM-AK fehlen (Kontrolle nach 10 d empfehlenswert).
-
•
Liquoruntersuchung: 1–2 ml Liquor → Pleozytose bis zu 5.000/3 Zellen bei geringer Eiweißerhöhung, spez. Ig-Synthese im Liquor (15.5.5).
-
•
Kultur: Virusisolation aus Blut (nur im uncharakteristischen Prodromalstadium möglich), Liquor (unzuverlässig) und postmortal aus Hirnautopsieproben. Anzucht in Vero-Zellen, embryonierten Hühnereiern oder Babymäusen → Typisierung mittels dir. IFT, NT oder HAHT.
-
•
PCR zum Virusnachweis im Serum oder Liquor: nur zu Beginn der Erkr. sinnvoll, da die Virämie kurzzeitig ist.
Andere Flavivirusinfektionen: analog, nur in Speziallaboratorien.
![]() Isolation von Flaviviren nur in Labors der Sicherheitsstufe 3!
Isolation von Flaviviren nur in Labors der Sicherheitsstufe 3!
Immunisierungsmöglichkeit
-
•
Gelbfieber: Schutzimpfung mit einem Immunisierung:GelbfieberLebendimpfstoff für Reisen in Endemiegebiete empfohlen, teils vorgeschrieben. Seit Mai 2013 wird von der WHO keine Auffrischung einer Gelbfieberimpfung mehr empfohlen (bisher Wiederholungsimpfung nach 10 J.)!
-
•
FSME: Risikopersonen (Waldarbeiter, Förster)Immunisierung:FSME sowie die Bevölkerung in Endemiegebieten sollten mit einem Totimpfstoff immunisiert werden, dessen Schutz 2–3 J. anhält. In Endemiegebieten (Auskunft im Gesundheitsamt) sollten alle von Zecken gebissenen nicht immunisierten Personen (Touristen aus unbelasteten Gebieten) innerhalb von 4 d nach dem Zeckenbiss eine passive Immuntherapie erhalten.
27.12. Bunyaviren
27.12.1. Hantaviren
BunyavirenEinzelstrang-RNA-Viren. Klinisch am wichtigsten sind Hantavirendas Hantaanvirus und das Puumalavirus Hantaan-Virus . Das Erregerreservoir bilden Mäuse und Puumala-VirusRatten. Der Mensch infiziert sich durch Inhalation getrockneter Mäuseexkremente, welche die Viren enthalten.
Klinik
-
•V. a. Hantavirusinfektion beim gemeinsamen Auftreten folgender Symptome (RKI) :
-
–Akuter Hantaviren:VerdachtssymptomeKrankheitsbeginn mit Fieber > 38,5 °C.
-
–Rücken- und/oder Kopf- und/oder Abdominalschmerz.
-
–Proteinurie und/oder Hämaturie.
-
–Serumkreatinin ↑.
-
–Thrombozytopenie.
-
–Oligurie bzw. nachfolgend Polyurie.
-
–
 RKI-Falldefinition für Hantavirusinfektionen
RKI-Falldefinition für Hantavirusinfektionen
Hantaviren:Falldefinition nach RKIKlin. Bild einer akuten Hantavirus-Erkr., definiert als mind. eines der drei folgenden Kriterien:
-
1.
Fieber.
-
2.
Nierenfunktionsstörung.
-
3.Mind. zwei der neun folgenden Kriterien:
-
–Kopfschmerzen.
-
–Muskel-, Glieder- oder Rückenschmerzen.
-
–Übelkeit ODER Erbrechen.
-
–Durchfall.
-
–Vorübergehende Myopie (Verschwommensehen).
-
–Husten.
-
–Dyspnoe (Atemstörung).
-
–Lungeninfiltrate.
-
–Herzversagen.
-
–
-
•Hämorrhagisches Fieber mit renalem Syndrom (HFRS): Hämorrhagisches Fieber:mit renalem Syndrom (HFRS)schwere Erkr. mit hohem Fieber, Hypotonie, Nierenversagen und Blutungen. Mortalitätsrate: 3–15 %. Verursacht durch:
-
–Puumalavirus: Europa. In Deutschland meist in Süd- und Westdeutschland.
-
–Tulavirus: Europa.
-
–Hantaanvirus: Südostasien, China, Griechenland und Frankreich.
-
–Dobravavirus: Balkan, Südrussland, Mittel- u. Osteuropa, in Deutschland meist in Nord- und Ostdeutschland.
-
–Seoulvirus: weltweite Verbreitung.In Deutschland sind Puumala- und Dobravavirus am häufigsten. Eher milde Verläufe (Nephropathia epidemica).
-
–
-
•
Kardiopulmonales Nephropathia epidemica Hantavirus-Syndrom (HCPS): interstitielle Hantavirus-Syndrom, kardiopulmonalesPneumonie, in 60 % d. F. durch Entwicklung eines Schocks und kardiale Arrhythmie, seltener durch ARDS tödlich. Verursacht durch SinNombre-, Black-Creek-Canal-, New-York-, Bayou-Virus in den USA, Andes-Virus und weitere Viren in Zentral- und Südamerika.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischem Fieber, Nachweis von Hantaviren!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischem Fieber, Nachweis von Hantaviren!
Untersuchungsmaterial und mikrobiologische Diagnostik 1–2 ml Serum:
-
•
AK-Nachweis (IgM, 4-Nephropathia epidemicafacher IgG-Titeranstieg) im ELISA. Starke Kreuzreaktivität unter den Hantaviren, daher sind unter Verwendung von Puumala- und Dobrava-AG fast alle Hantavirusinfektionen detektierbar. Western Blot für IgG- und IgM-AK Nachweis. IgM-AK können meist schon während der ersten Krankheitstage nachgewiesen und bis zu 3 Mon. nach Krankheitsbeginn detektiert werden, in Einzelfällen aber auch mehrere Jahre. IgG-AK persistieren wahrscheinlich lebenslang.
-
•
PCR inkl. molekulargenetischer Typisierung zum Virusnachweis (nur in der frühen virämischen Krankheitsphase erfolgversprechend).
Antibiotikaempfindlichkeit Frühe Gabe von Ribavirin kann den Krankheitsverlauf lindern, aber nicht unterbrechen.
27.12.2. Bunyaviren
Epidemiologisch bedeutsame Bunyavirus-Erkr. sind die kalifornische Enzephalitis (USA) sowie das Rift-Valley-Fieber (BunyavirenOst- und Südafrika) und das Rift-Valley-Fieber hämorrhagische Krim-Kongo-Fieber (Enzephalitis:kalifornischeSüdrussland, Balkan, Westafrika), die Krim-Kongo-Fieberhauptsächlich durch Moskitos oder Zecken übertragen werden. Diagnostik: AK-Nachweis mittels ELISA, NT, KBR oder HAHT. Virusanzucht aus Blut oder Serum in Vero-Zellen ist möglich. Für Krim-Kongo-Fieber wurde eine zuverlässige RT-PCR entwickelt.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an hämorrhagischem Fieber, Nachweis von Erregern hämorrhagischen Fiebers!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an hämorrhagischem Fieber, Nachweis von Erregern hämorrhagischen Fiebers!
27.12.3. Sandfliegenfiebervirus
Das Sandfliegenfiebervirus gehört zur SandfliegenfiebervirusGattung Phlebovirus der Bunyaviridae. Drei Serotypen sind im Mittelmeerraum von humanmedizinischer Bedeutung: Serotyp Toscana, Serotyp Sicilian und Serotyp Naples. Weitere Verbreitungsgebiete sind der vordere Orient und Bangladesh.
Klinik Übertragung durch den Stich der Sandfliege, Inkubationszeit 2–6 d. Die Krankheit beginnt mit hohem Fieber bis 41 °C, Kopfschmerzen mit Sehstörungen, Übelkeit, Erbrechen, Diarrhöen, Gelenk- und Gliederschmerzen. Typisch ist eine bilaterale Konjunktivitis (Pick-Zeichen). Nach einer Remissionsphase können neurologische Symptome (Meningitis, Enzephalitis, epileptische Anfälle, Aphasien, transiente Hirnnervenparesen, Hörsturz) auftreten (v. a. bei Serotyp Toscana), die sich aber alle wieder zurückbilden. Todesfälle wurden bisher nicht berichtet. Ein Krankheitsverdacht besteht bei aseptischer Meningoenzephalitis von Einwohnern oder Reiserückkehrern aus Südeuropa (Italien: Toskana-Fieber, Spanien, Türkei).
Untersuchungsmaterial
-
•
Toskana-Fieber Direktnachweis: 1–2 ml Liquor.
-
•
Serologie: venöses Blut ohne Zusätze (mind. 5 ml).
Mikrobiologische Diagnostik
-
•
Direktnachweis: PCR zum Nachweis des Serotyps Toscana im Liquor.
-
•
Kultur: Virusanzucht aus Liquor auf Vero-Zellkulturen → CPE nach 3–6 d (Speziallabor). Aufgrund der kurzen Virämiephase ist die Virusanzucht aus Blut selten erfolgreich.
-
•
Serologische AK-Nachweis: mittels indir. IFT, ELISA, HAHT, NT sowie im Immunoblot.
Antibiotikaempfindlichkeit Bisher steht keine spez. antivirale Substanz zur Verfügung. Ribavirin ist partiell wirksam.
Immunisierungsmöglichkeit Bisher nicht vorhanden.
27.13. Paramyxoviren
27.13.1. Parainfluenzavirus
Bekannt sind vier serologische Typen. Sie sind mit Paramyxovirenanderen Mitgliedern der Paramyxoviren z. T. antigenverwandt, was zu Parainfluenzavirenkreuzreagierender AK-Bildung führen kann.
Klinik Wichtigstes Virus im Säuglings- und Kindesalter. Erw. entwickeln nach Infektion nur leichte Katarrhe des oberen Respirationstrakts. Paramyxoviren verursachen v. a. Infekte der oberen Atemwege:
-
•
Typ 1 und 2: bei Kindern zwischen dem 2. und 4. Lj. Laryngotracheobronchitiden. Der Gipfel der Erkrankungshäufigkeit ist bei zyklischem Auftreten alle 2 J. im Herbst und Winter.
-
•
Typ 3: bei Kindern < 1 J. und bei Immunsupprimierten Bronchiolitis und Pneumonie.
-
•
Typ 4: milde Erkr. der oberen Atemwege im gesamten Kindesalter.
Untersuchungsmaterial
-
•
Direktnachweis und Kultur: Nasenrachen-Absaugsekret, Rachenspülwasser, Rachenabstriche.
-
•
Serologie: 1–2 ml Serum.
Mikrobiologische Diagnostik
-
•
Direktnachweis: AG-Nachweis im Nasopharyngealsekret mittels RT-PCR (Methode der Wahl), dir. IFT oder ELISA.
-
•
Kultur: Virusanzucht in prim. oder sek. Affen-Nierenzellen, Vero-Zellen (häufig Synzytien-CPE, tritt aber nicht in jeder erfolgreichen Kultur ein). Virusnachweis durch Prüfung verschiedener Eigenschaften wie Hämadsorption, Hämagglutination, Hämolyse. Identifizierung des Isolats mittels Hämadsorptionshemmung, HAHT, dir. IFT oder ELISA (Speziallabor, nur für wissenschaftliche Fragestellungen).
-
•
Serolog. AK-Nachweis: mittels ELISA oder NT (mindestens 4-facher Titeranstieg). Wenig geeignet zur Akutdiagnostik und aufgrund der hohen Durchseuchung von begrenztem Wert. Die AK-Nachweismethoden werden außerdem durch die AG-Verwandtschaft der verschiedenen Paramyxoviren beeinträchtigt!
27.13.2. Mumpsvirus
Klinik Übertragung: Tröpfcheninfektion. Inkubationszeit 14Mumps(virus)–21 d → „Ziegenpeter“: typische Kinderkrankheit mit bds. Parotitis und Ziegenpeterleichtem Fieber. Komplikationen bei Mumpsinfektionen nach Beginn der Pubertät: Befall von Pankreas (in sehr seltenen Fällen Entwicklung eines Diab. mell.), Meningen (seröse Meningitis) oder Hoden (Hodenatrophie und Sterilität). Seltener wird eine Meningoenzephalitis (meist gutartiger Verlauf, sehr selten Taubheit bei Infektion im Erwachsenenalter) beobachtet.
![]() Mumps (Verdacht, Erkrankung, Tod, labordiagn. Nachweis) ist meldepflichtig!
Mumps (Verdacht, Erkrankung, Tod, labordiagn. Nachweis) ist meldepflichtig!
Untersuchungsmaterial Meist klin. Diagnose → mikrobiologische Diagnostik bei atypischen Verläufen und Meningoenzephalitis.
-
•
Serologie: 1–2 ml Serum.
-
•
Direktnachweis und Kultur: Virusnachweis in Speichel, Rachenabstrich bzw. -spülwasser, Blut, Urin und Liquor.
Mikrobiologische Diagnostik
-
•
Direktnachweis: AG-Nachweis im Untersuchungsmaterial mittels RT-PCR. Da ein nicht nachweisbares spez. IgM oder ein ausbleibender IgG-Titer-Anstieg bei geimpften Personen eine Mumps-Infektion nicht sicher ausschließen, sollte bei diesen Pat. neben der Serologie unbedingt eine RT-PCR veranlasst werden.
-
•
Kultur: Virusanzucht in Zellkultur → Synzytien-CPE. Virusnachweis durch Hämadsorption mit Meerschweinchenerythrozyten. Identifizierung mittels dir. IFT, HAHT, NT (Speziallabor!).
-
•
Serolog. AK-Nachweis: IgM-Nachweis im μ-Capture-Assay. IgM-AK sind bereits in den ersten Tagen der Erkr. nachweisbar, erreichen ihr Max. etwa 1 Wo. nach Symptomenbeginn und bleiben über Wochen erhöht. Bei Mumps-Virusmeningitis/-enzephalitis sind bei bis zu 90 % der Pat. spez. IgG-AK im Liquor nachweisbar.
Immunisierungsmöglichkeit Impfung mit attenuierten Lebendvakzinen → langfristiger Schutz (mind. 20 J., evtl.. lebenslang). Meist zusammen mit Masern- undImmunisierung:Mumps Röteln-Impfstoff im 15. Lebensmon. verabreicht und im 6. Lj. wiederholt.
27.13.3. Masernvirus
Klinik Übertragung aerogen durch Tröpfcheninfektion. Masern(virus)Inkubationszeit 9–12 d.
-
•
Prodromalstadium: Bild einer respiratorischen Infektion durch Virusvermehrung in den Mukosazellen des oberen Respirationstrakts.
-
•
Virämie → nach 14 d makulopapulöses Exanthem auf dem gesamten Körper, Konjunktivitis und mäßiges Fieber.
-
•
Vorübergehende Abwehrschwäche durch Virusvermehrung in T-Lymphozyten kann Sekundärinfektionen bahnen.
50 % der Pat. zeigen EEG-Veränderungen, die sich aber nur selten in Form einer Postinfektionsenzephalomyelitis (Inzidenz: 1 : 1.000–2.000 Masernfälle) oder einer subakuten sklerosierenden Panenzephalitis (SSPE; Latenz bis zu 10Subakute sklerosierende Panenzephalitis (SSPE) J. nach der Infektion, Inzidenz: 1–5 Fälle pro 1 Mio. Erkrankte) manifestieren. Mögliche Komplikation, besonders bei Pat. mit zellulären Immundefekten: Bronchitis oder Bronchopneumonie.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an Masern, Nachweis von Masernvirus!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an Masern, Nachweis von Masernvirus!
Untersuchungsmaterial
-
•
Serologie: 1–2 ml Serum.
-
•
Direktnachweis: Nasen-Rachen-Sekret, Konjunktivalflüssigkeit, Urin und Blut.
Mikrobiologische Diagnostik
-
•Direktnachweis:
-
–AG-Nachweis mittels dir. IFT (auch im Urinsediment).
-
–PCR in allen genannten Materialien (auch Differenzierung zwischen Wild- und Impfstämmen möglich).
-
–
-
•
Kultur: Virusanzucht in prim. Kulturen aus menschlichen oder Affen-Nierenzellen, auch Vero-Zellen sind geeignet. CPE mit multinukleärer Riesenzellbildung nach 2–14 d. Identifizierung des Isolats durch dir. IFT (Speziallabor!).
-
•
Serolog. AK-Nachweis: IgM-Nachweis im μ-Capture-Assay (Persistenz bis zu 6 Wo., in Einzelfällen auch länger). Bis zu 30 % der Pat. können am 1.–3. Exanthemtag noch IgM-negativ sein kann (Untersuchung wiederholen). Bei geimpften Personen mit Masern-Re-Infektion kann das spez. IgM fehlen. Hier ist der Nachweis von spez. IgG-AK im ELISA (signifikanter Anstieg in zweiter Serumprobe im Abstand von 10–14 d!) wegweisend. Pat. mit SSPE zeigen abnorm erhöhte IgG-Titer!
Immunisierungsmöglichkeit
-
•
Aktive Immunisierung: Immunisierung:Masernattenuierter Lebendimpfstoff. Vermutlich lebenslange Immunität. Impfung meist zusammen mit Röteln und Mumps im Alter von 15 Mon. und im 6. Lj.
-
•
Passive Immunisierung für Schwangere, Kleinkinder < 3 J., Tuberkulosekranke, immungeschwächte Personen: Bis 6 d nach Exposition können Masern verhindert oder zumindest ein abgeschwächter Verlauf erreicht werden.
27.13.4. Respiratory-Syncytial-Virus (RSV)
Klinik RSV ist die häufigste Ursache Respiratory-Syncytial-Virus (RSV)für Pneumonien und Bronchiolitiden im Säuglingsalter. Erw. erkranken an Schnupfen, bei Immunsuppression und in hohem Alter aber auch an schweren Atemwegsinfektionen. Der Erkrankungsgipfel ist jährlich im Winter zu beobachten. RSV-Infektionen hinterlassen keinen vollständigen Immunschutz. Serotypen A (höhere Pathogenität) und B.
Untersuchungsmaterial
-
•
Serologie: 1–2 ml Serum.
-
•
Direktnachweis: Nasopharyngealaspirat, Nasen-Rachen-Sekret oder Bürstenabstriche der Nasenschleimhaut.
Mikrobiologische Diagnostik Methode der Wahl: Virusdirektnachweis.
-
•
Direktnachweis: PCR (hohe Sensitivität und Spezifität) als Methode der Wahl, v. a. außerhalb der Saison. Schnellnachweise mittels Immunchromatografie sind verfügbar (geringere Sensitivität und Spezifität). AG-Nachweis im Untersuchungsmaterial mittels dir. IFT oder ELISA.
-
•
Kultur: Virusanzucht in HeLa- oder HEp-2-Zellen (schwierig, gelingt nicht immer, bei erfolgreicher Kultur CPE mit Synzytien, keine Hämadsorption). Identifizierung des Isolats mittels dir. IFT oder ELISA (Speziallabor).
-
•
Serolog. AK-Nachweis: bei akuten Infektionen wenig sinnvoll. IgM-AK werden kaum gebildet, nicht immer findet sich ein signifikanter Titeranstieg. AK gegen spezielle RSV-Proteine können mittels Western Blot detektiert werden.
![]() 2001 wurde das humane
Metapneumovirus, humanes
Humanes Metapneumovirus
Metapneumovirus (Paramyxoviridae) neu entdeckt. Es verursacht Atemwegsinfektionen, insb. akute Bronchitiden, v.
Metapneumovirus, humanesa. bei Kindern (ähnlich RSV). Infektionen sind auch bei Erw. möglich (insb. bei alten oder immunsupprimierten Personen). Die meisten Infektionen treten zwischen Dezember und April auf. Die Infektion hinterlässt keine bleibende Immunität. Metapneumoviren sind nach RSV die häufigsten Erreger von Infektionen der unteren Atemwege. Bei ca. 12 % der Betroffenen kommt das Virus als Krankheitsauslöser in Betracht. Nachweismöglichkeiten nur mittels RT-PCR. Eine antivirale Therapie ist nicht verfügbar.
2001 wurde das humane
Metapneumovirus, humanes
Humanes Metapneumovirus
Metapneumovirus (Paramyxoviridae) neu entdeckt. Es verursacht Atemwegsinfektionen, insb. akute Bronchitiden, v.
Metapneumovirus, humanesa. bei Kindern (ähnlich RSV). Infektionen sind auch bei Erw. möglich (insb. bei alten oder immunsupprimierten Personen). Die meisten Infektionen treten zwischen Dezember und April auf. Die Infektion hinterlässt keine bleibende Immunität. Metapneumoviren sind nach RSV die häufigsten Erreger von Infektionen der unteren Atemwege. Bei ca. 12 % der Betroffenen kommt das Virus als Krankheitsauslöser in Betracht. Nachweismöglichkeiten nur mittels RT-PCR. Eine antivirale Therapie ist nicht verfügbar.
27.14. Orthomyxoviren – Influenzaviren
InfluenzavirenOrthomyxoviren besitzen eine Lipidhülle, in der sich Influenza(viren)Hämagglutinin- und Neuraminidase-Glykoproteine befinden. Hämagglutinin dient zur Bindung an die Wirtszelle. Die Neuraminidaseaktivität ist nötig, damit die neu gebildeten Viren die Zelle verlassen können. AK gegen Hämagglutinin (H-AG) sind der entscheidende Faktor der Immunität gegenüber Influenzaviren. AK gegen Neuraminidase (N-AG) beeinträchtigen die Ausbreitung des Virus von Zelle zu Zelle.
Einteilung der Influenzaviren Zuordnung zu den Typen A, B und C aufgrund der antigenen Eigenschaften des Nukleoproteins (NP).
-
•
Influenza-A-Viren Influenza(viren):Einteilungwerden nach ihrem H- und N-AG in Subtypen klassifiziert. Zurzeit kennt man 3 verschiedene humanpathogene H-(H1-H3, wobei H1 aus 3 Untergruppen besteht) und 2 humanpathogene N-(N1, N2)Antigene. Einzelne Stämme der Subtypen werden zusätzlich mit dem Ort, der Isolierungsnummer und dem Jahr der ersten Isolierung bezeichnet, z. B. A/Texas/1/77/H3N2. Die Isolierungsnummer wird z. T. weggelassen.
-
•
Das die Pandemie 2009 auslösende Virus des Subtyps A (H1N1) wird als (pandemisches) Influenzavirus A (H1N1) 2009 bezeichnet (sog. „Schweinegrippe“). Bzgl. Pathogenese und Krankheitsverlauf Schweinegrippebestehen große Gemeinsamkeiten mit der saisonalen Grippe.
-
•
Bei Influenza B und C werden keine Subtypen gebildet, weil sich bei ihnen keine so ausgeprägten Antigenvariationen finden. Von manchen Autoren werden sie in Gruppen, die sich nach dem Zeitpunkt der ersten Isolierung gliedern, eingeteilt. Beispiel: B/Hong Kong/68.
 Aviäre Influenza („Vogelgrippe“)
Aviäre Influenza („Vogelgrippe“)
Vogelgrippe Influenza(viren):aviäre Aviäre InfluenzaSeit 1997 humane Infektionen durch aviäre Influenzaviren („VogelgrippeVogelgrippe“) mit den Subtypen H5N1, H7N3, H7N7 und H7N9.
Falldefinition des RKI
Klin. Bild: Pat. mit akuten respiratorischen Symptomen (mit oder ohne Fieber [≥ 38 °C]) und mit oder ohne Husten, bei denen basierend auf klin. oder radiologischen Hinweisen der V. a. ein entzündliches Infiltrat besteht (z. B. Pneumonie oder akutes Atemnotsyndrom).Verdachtsfall:
-
1.
Pat. mit erfülltem klin. Bild UND vorherigem Aufenthalt in Risikogebieten.
-
2.
Pat. mit akuten respiratorischen Symptomen unabhängig von deren Schwere UND vorherigem Tierkontakt in einem Risikogebiet ODER vorherigem Patientenkontakt (mit einem bestätigten Fall).
Bestätigter Fall: Person mit labordiagn. Nachweis des Influenzavirus A (H7N9).
Epidemiologie
-
•
Influenza-Episoden: Influenza(viren):Epidemiologie jährlich in unterschiedlichem Ausmaß und Schwere in den Wintermonaten.
-
•Größere Epidemien mit schwereren Krankheitsverläufen durch Punktmutationen im Gen für Hämagglutinin bzw. für Neuraminidase (Antigendrift):
-
–Influenza-A-Virus in 2- bis 3-jährigen Intervallen.
-
–Influenza-B-Virus alle 3–6 J. Eine Influenza-A-Epidemie beginnt plötzlich, erreicht ihren Höhepunkt nach 2–3 Wo., dauert 2–3 Mon. und verschwindet dann plötzlich. Die Erkrankungswahrscheinlichkeit der betroffenen Population beträgt zwischen 10 und 50 %.
-
–
-
•
Pandemien: In 10- bis 20-jährigen Abständen mit hoher Letalität. Durch homologe Rekombination von korrespondierenden RNA-Segmenten bei Coinfektion mit humanen und tierischen Influenzaviren im Schwein. Es entsteht ein neues Virus, gegen das noch keine AK in einer Population gebildet wurden (Antigenshift).
Klinik Nach aerogener Infektion plötzlich schweres Krankheitsgefühl, Fieber, Kopf- und Gliederschmerzen, Tracheitis/Bronchitis/Pneumonie. Komplikationen: Myokarditis, Meningitis, Enzephalitis, bakt. Superinfektionen.
![]() Namentlich bei Direktnachweis von Influenzaviren! Namentlich bei Krankheitsverdacht, Erkrankung und Tod durch aviäre Influenza.
Namentlich bei Direktnachweis von Influenzaviren! Namentlich bei Krankheitsverdacht, Erkrankung und Tod durch aviäre Influenza.
Untersuchungsmaterial
-
•
Serologie: 1–2 ml Serum.
-
•
Direktnachweis: Nasopharyngealaspirat, Rachenabstrich, Rachenspülwasser. Abstriche und Aspirate aus der Nase haben eine höhere Sensitivität als Proben aus dem Rachenraum.
Mikrobiologische Diagnostik
-
•
Direktnachweis: Influenza(viren):Nachweis Schnellteste mit deutlich geringerer Sensitivität als PCR (20–80 %), bei Influenza-B-Viren und pandemischen Influenzaviren A (H1N1) 2009 noch schlechter. Nach dem 3. Krankheitstag völlig unzuverlässig (Antigen-Ausscheidung nimmt stark ab). Ein pos. Test hat vor dem Hintergrund einer eindeutigen epidemiologischen Situation (Influenzawelle) eine hohe Aussagekraft, jedoch schließen neg. Tests eine Influenza nicht aus. AG-Nachweise im Untersuchungsmaterial mittels dir. IFT oder ELISA sind in ihrer Sensitivität mit den Schnelltesten vergleichbar.
-
•
PCR: Methode der Wahl, während der ersten Krankheitswoche zuverlässig positiv.
-
•
Kultur: Virusanzucht in MDCK-Zellen (permanente Hunde-Nierenzellen) oder im bebrüteten Hühnerei. Virusdetektion durch Hämadsorption. Identifizierung des Isolats mittels Hämadsorptionshemmung, dir. IFT oder ELISA (Speziallabor).
-
•
Serolog. AK-Nachweis: vor allem i. R. epidemiologischer Studien von Bedeutung. AK-Nachweis mittels ELISA, indir. IFT, HAHT (IgM- oder IgA-Nachweis bzw. 4-facher Titeranstieg in gepaarten Seren sprechen für eine akute Infektion). Serolog. AK-Nachweis insgesamt problematisch, da häufig Re-Infektionen bzw. verzögerter AK-Anstieg.
 Aviäre Influenza
Aviäre Influenza
Labordiagnostische Sicherung durch:
-
•
Virusisolierung und Vogelgrippe Influenza(viren):aviäre Aviäre InfluenzaTypisierung (PCR, serologisch).
-
•
H5-, H7-PCR.
-
•
AK-Nachweis (NT, Plaque-NT).
-
!
Ergebnis im Nationalen Referenzzentrum (NRZ) bestätigen lassen! Pandemieplan und Informationen zum infektionshygienischen Management unter www.rki.de.
Immunisierungsmöglichkeit Totimpfstoff mit antigenen Bestandteilen der in der Vorsaison zirkulierenden Influenza-A- und -B-Viren. Attenuierter Lebendimpfstoff für Kinder und Jugendliche von 2–17 J. (nasale Applikation).
Antibiotikaempfindlichkeit Influenza(viren):Immunisierung
-
•
Influenza(viren):AntibiotikaempfindlichkeitZanamivir, Oseltamivir: Inhibitoren der Virus-Neuraminidase, ther. gegen Influenza A und B. Im Krankheitsfall so früh wie möglich, spätestens 48 h nach Auftreten der Symptome, einsetzen! Die zunehmend auftretenden Resistenzen verbieten einen prophylaktischen Einsatz von Neuraminidase-Inhibitoren (Ausnahmen: Pandemiesituationen, Pat. mit KI gegen Grippeschutzimpfung).
-
•
Bei bakt. Superinfektionen: Antibiotika nach Antibiogramm.
27.15. Rhabdoviren
Bekanntester humanpathogener Vertreter ist das Rhabdoviren Tollwutvirus (Rabiesvirus Tollwut(virus) ).
Klinik Infektion meist durch Biss eines Rabies(virus)infizierten Säugetiers (Fuchs, Hund, Katze, Marder, Dachs, Reh, Haus- und Nutztiere, Fledermäuse). Bei verletzter Haut oder Schleimhaut auch nur durch infektiösen Speichel.
-
•
Prim. Virusvermehrung in Muskelzellen → Brennen und Jucken der Bisswunde, uncharakteristische Allgemeinsymptome, leichtes Fieber.
-
•
Eindringen entlang der peripheren Nerven in Hirn und Rückenmark. Dort nochmalige Vermehrung. Anschließend Befall von Pankreas und Speicheldrüsen → Viren werden massiv mit dem Speichel ausgeschieden.
-
•
Nach 20–90 d Zerstörung von ZNS-Strukturen → Krämpfe der Schluckmuskulatur (Hydrophobie), motorische Unruhe und psychische Veränderungen (Aggression, Depression). Präfinal Lähmungen der gesamten Muskulatur.
-
!
Tollwuterkrankungen sind immer tödlich!
![]() Pflegepersonal von an Tollwut erkrankten Pat. muss wegen der starken Virusausscheidung mit dem Speichel Mund-/Nasen- und Augenschutz sowie Handschuhe tragen. Die Pat. müssen isoliert und alle Ausscheidungen desinfiziert werden. Laborarbeiten dürfen nur in Sicherheitslabors unter strengsten Schutzvorkehrungen von geimpftem Personal durchgeführt werden.
Pflegepersonal von an Tollwut erkrankten Pat. muss wegen der starken Virusausscheidung mit dem Speichel Mund-/Nasen- und Augenschutz sowie Handschuhe tragen. Die Pat. müssen isoliert und alle Ausscheidungen desinfiziert werden. Laborarbeiten dürfen nur in Sicherheitslabors unter strengsten Schutzvorkehrungen von geimpftem Personal durchgeführt werden.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an Tollwut, Nachweis von Rabiesvirus! Jede Verletzung durch tollwütiges oder tollwutverdächtiges Tier und selbst die Berührung solcher Tiere oder Tierkadaver muss gemeldet werden!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an Tollwut, Nachweis von Rabiesvirus! Jede Verletzung durch tollwütiges oder tollwutverdächtiges Tier und selbst die Berührung solcher Tiere oder Tierkadaver muss gemeldet werden!
Untersuchungsmaterial
-
•
Virusnachweis beim Beißtier: wenn möglich, Beißtier 7–10 d lang auf Anzeichen von Tollwut beobachten. Bei Tötung Virusnachweis im Hirngewebe, In-vivo-Virusnachweis in Kornea-Abdruck, Speichel und nuchalen Hautbiopsien des Tieres.
-
•
Virusnachweis beim Pat.: Speichel, Liquor, Trachealsekret, Kornea-Abdruck (Objektträger), nuchale Hautbiopsien.
-
•
Serologie: 1–2 ml Serum. Nachweis von spez. AK meist erst mit Beginn der Krankheitssymptome → für die Diagnose nach Tierbissen ungeeignet. AK-Nachweis deshalb nur für Effektivitätsüberprüfung einer präexpositionellen Impfung nützlich.
![]() Immer Rücksprache mit der örtlichen Tollwutschutzstelle!
Immer Rücksprache mit der örtlichen Tollwutschutzstelle!
Mikrobiologische Diagnostik
-
•
Direktnachweis: AG-Tollwut(virus):NachweisNachweis im Abdruckpräparat oder in Gewebeschnitten durch dir. IFT. RT-PCR aus Hirngewebe, Hautbiopsien, Kornea-Abdruck oder Speichel. Da bei Tollwutinfektionen die Virusausscheidung intermittiert oder ganz fehlt, sind alle am lebenden Pat. eingesetzten Nachweismethoden nicht absolut zuverlässig. Neg. Resultate stellen keine Ausschlusskriterien dar!
-
•
Kultur: Virusanzucht in Maus-Neuroblastomzellen, Hühnerembryo- oder Hamster-Nierenzellen → tägliche Kontrolle mittels dir. IFT.
-
•
Serolog. AK-Nachweis: Nachweis von spez. AK mittels Rapid Fluorescent Focus Inhibition Test (RFFIT) oder EIA (geringere Sensitivität als RFFIT). Nicht geeignet zum Infektionsnachweis, sondern lediglich zur Beurteilung eines Immunschutzes nach Impfung!
Immunisierungsmöglichkeit Tollwut(virus):Immunisierung
-
•
Präexpositionell ( Immunisierung:Tollwut Prophylaxe): aktive Impfung für Risikopersonen (Förster, Tierärzte, Jäger, Reisende in Risikogebiete). 4 Impfungen an den Tagen 0, 7, 21 oder 28 (oder nach Angaben des Herstellers) erzielen einen vollständigen Impfschutz. Wiederholung bei weiter bestehendem Expositionsrisiko jährlich.
-
•Postexpositionell: Innerhalb von 4 d nach dem Biss ist eine parallele passiv-aktive Immunisierung möglich (Tab. 27.8 ):
-
–Passive Immunisierung: 20 IE/kg KG in und um die Wunde spritzen.
-
–Aktive Immunisierung (s. präexpositionelle Impfung). Auch wenn der Biss länger als 4 d alt ist, wird noch versucht, den Krankheitsverlauf durch passiv-aktive Immunisierung zu beeinflussen, im Infektionsfall leider meist nicht erfolgreich.
-
–
Tab. 27.8.
Richtlinien zur postexpositionellen Tollwut(virus):PostexpositionsprophylaxeTollwutprophylaxe (Quelle: Aktuelle Impfempfehlungen der STIKO)
| Grad der Exposition | Art der Exposition |
Immunprophylaxe | |
|---|---|---|---|
| Tollwutverdächtiges oder tollwütiges Wild- oder Haustier | Tollwut-Impfstoffköder | ||
| I | Berühren/Füttern von Tieren, Belecken der intakten Haut | Berühren des Impfstoffköders bei intakter Haut | Keine Impfung |
| II | Knabbern an unbedeckter Haut, oberflächliche, nicht blutende Kratzer durch ein Tier, Belecken nicht intakter Haut | Kontakt mit der Impfflüssigkeit eines beschädigten Impfstoffköders mit nicht intakter Haut | Impfung |
| III | Jegliche Bissverletzung oder Kratzwunden, Kontamination von Schleimhäuten mit Speichel (z. B. durch Lecken, Spritzer) | Kontamination von Schleimhäuten und frischen Hautverletzungen mit der Impfflüssigkeit eines beschädigten Impfstoffköders | Impfung und simultan mit der 1. Impfung passive Immunisierung mit Tollwut-Immunglobulin (20 IE/kg KG) |
27.16. Filoviren
Zur Familie der Filoviren gehören das Marburg- und das Ebolavirus. Sie sind Filovirenmorphologisch identisch, zeigen jedoch keine Antigenverwandtschaft. Das Genom besteht aus RNA. Das Marburgvirus wurde 1967 bei Erkr. von Laborpersonal in Marburg, MarburgvirusFrankfurt und Belgrad, die Organe von Affen aus Uganda experimentell verarbeitet hatten, identifiziert. Es wird in Uganda, Kongo, Nordangola nachgewiesen. Das Ebolavirus, nach einem Fluss in der Demokratischen EbolavirusRepublik Kongo (ehemals Zaire) benannt, löst regelmäßig Epidemien in Nordzaire, Gabun, Kongo, Uganda und Sudan aus. Im März 2014 Ausbruch im westafrikanischen Guinea mit Ausweitung auf die Nachbarstaaten → bislang größter jemals erfasster Ausbruch des Ebola-Fiebers. Man unterscheidet fünf Spezies entsprechend dem Ort ihres ersten Auftretens: Zaire mit 6 Subtypen, Sudan mit 3 Subtypen, Bundibugyo, Côte d'Ivoire (Syn. Tai Forest) mit 1 Subtyp und Reston mit 4 Subtypen, Ebolaviren aus den Philippinen scheinen weniger virulent zu sein als afrikanische Stämme.
Klinik Identische Klinik: hämorrhagisches Fieber.
Hämorrhagisches Fieber:Ebola-/MarburgvirusInkubationszeit 3–9 d. Beginn mit Fieber um 40 °C, Kopf- und Halsschmerzen, Konjunktivitis, Myalgien. Später Durchfall und Erbrechen. Danach makulopapulöses Exanthem und Blutungen aus Magen-Darm-Trakt, Nase, Konjunktiven und Vagina. Bei Blutungen → meist DIC, Schock, z. T. Enzephalitis. Tod nach 7–10 d. Letalität beim Marburgvirus 20–30 %, beim Ebolavirus 50–90 %.
 RKI-Falldefinition Ebola-Fieber
RKI-Falldefinition Ebola-Fieber
Ebola-Fieber:RKI-FalldefinitionPatient mit Fieber (> 38,5 °C) oder erhöhter Temperatur mit Begleitsymptomen (z. B. Durchfall, Übelkeit, Erbrechen, Hämorrhagien),
-
•
der in den 21 Tagen vor Erkrankungsbeginn Kontakt mit einem an Ebola-Fieber Erkrankten oder -Krankheitsverdächtigen oder -Verstorbenen hatte
oder
-
•
der in den 21 Tagen vor Erkrankungsbeginn im In- oder Ausland in einem Labor oder in einer sonstigen Einrichtung gearbeitet hat, in der ein Umgang mit Ebolaviren, erregerhaltigem Material, mit dem Ebolavirus infizierten Tieren oder an Ebola-Fieber erkrankten oder verstorbenen Personen stattgefunden hat,
oder
-
•
der sich bis zu 21 Tagen vor Erkrankungsbeginn in einem bekannten Endemiegebiet (Land, in dem in der Vergangenheit Fälle beschrieben wurden) oder in einem Gebiet aufgehalten hat, in dem in den vorausgegangenen 2 Monaten bestätigte oder vermutete Fälle von Ebola-Fieber aufgetreten sind,
und
-
•
dort Kontakt zu Flughunden, Fledermäusen, Primaten (z. B. bushmeat, dir. Kontakt mit Tieren oder deren Ausscheidungen) hatte.
Differenzierung von Personen nach Expositionsrisiko
Hohes Expositionsrisiko
Eine Person, die in den Ebola-Fieber:Expositionsrisikenletzten 21 Tagen
-
•
perkutane, z. B. Nadelstich oder Schleimhautexposition ggü. viruskontaminierten Körperflüssigkeiten eines an Ebola-Fieber Erkrankten oder Verstorbenen hatte,
-
•
direkten ungeschützten Kontakt mit Blut oder anderen Körperflüssigkeiten eines an Ebola-Fieber Erkrankten oder Krankheitsverdächtigen oder Verstorbenen hatte,
-
•
in einem Endemiegebiet (s. Vorkommen) ohne angemessene Schutzkleidung dir. Kontakt zu einem Verstorbenen hatte, z. B. während einer Beerdigungszeremonie.
Niedriges Expositionsrisiko
Eine Person, die keine hohe Risikoexposition hatte, die aber in den letzten 21 Tagen
-
•
einen fiebrigen, aber noch nicht schwer an Ebola-Fieber Erkrankten oder Krankheitsverdächtigen medizinisch versorgt, gepflegt, körperlich untersucht, Fieber oder Blutdruck gemessen hat,
-
•
Kontakt (< 1 m) mit einem an Ebola-Fieber Erkrankten bzw. Verstorbenen oder begründeten Verdachtsfall (inkl. Haushaltskontakte) ohne wissentlichen Kontakt zu Körperflüssigkeiten hatte,
-
•
Flugpassagiere, die in unmittelbarer Nachbarschaft zum Indexfall gesessen haben (1 Sitz in alle Richtungen, auch über den Gang), sowie den Patienten betreuende Crewmitglieder.
-
•
Kontakt zu möglicherweise mit dem Ebolavirus kontaminierter Kleidung/Gegenständen hatte,
-
•
in einem afrikanischen Krankenhaus war, in dem Patienten mit Ebola-Fieber betreut wurden.
![]() Pat. strikt isolieren und die Ausscheidungen entsprechend entsorgen. Das betreuende Personal muss Schutzkleidung tragen.
Pat. strikt isolieren und die Ausscheidungen entsprechend entsorgen. Das betreuende Personal muss Schutzkleidung tragen.
Differenzialdiagnosen Malaria, andere Erreger viral Ebola-Fieber:Differenzialdiagnosenhämorrhagischer Fieber (z. B. Gelbfiebervirus, Lassavirus, Denguevirus, Vertreter von Hantaviren, Krim-Kongo-Virus), Hepatitis A, Typhus, Pest, Rickettsiosen, Meningokokken-Sepsis o. a. Sepsisformen, Leptospirose, hämorrhagische Formen des Rückfallfiebers, bakt. Ruhr, Vergiftungen.
Untersuchungsmaterial
-
•
Direktnachweis und Kultur: Rachen- und Rektalabstriche, Konjunktivalabstriche, Urin, Heparin- oder Citratblut, Gewebebiopsien.
-
•
Serologie: 1–2 ml Serum.
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischen Fieber, Nachweis von Ebolavirus, Nachweis von Marburgvirus!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischen Fieber, Nachweis von Ebolavirus, Nachweis von Marburgvirus!
Mikrobiologische Diagnostik
![]() Die mikrobiologische Diagnostik bei V. a. Marburg- oder Ebolavirus-Infektion darf nur in Hochsicherheitslaboratorien für Erreger der Risikogruppe 4 durchgeführt werden!
Die mikrobiologische Diagnostik bei V. a. Marburg- oder Ebolavirus-Infektion darf nur in Hochsicherheitslaboratorien für Erreger der Risikogruppe 4 durchgeführt werden!
Pat. müssen auf Sonderisolierstationen in Behandlungszentren für hochkontagiöse und lebensbedrohliche Erkr. verbracht werden.
-
•
Direktnachweis: AG-Direktnachweis mittels Realtime-PCR (Goldstandard). Antigen-Capture-ELISA. Dir. IFT im Vergleich zu ELISA und PCR nicht sensitiv.
-
•
Kultur: Virusanzucht in Vero-Zellen oder prim. Affen-Nierenzellen → Virusdetektion mittels dir. IFT.
-
•
Serolog. AK-Nachweis: mittels ELISA und IFT. Ein Immunoblot-Verfahren steht zur Verfügung.
 Konsiliarlabor für Filoviren
Konsiliarlabor für Filoviren
Filoviren:KonsiliarlaborKlinikum der Philipps-Universität Marburg
Institut für Virologie
Hans-Meerwein-Str. 2
35043 Marburg
Ansprechpartner: Prof. Dr. S. Becker, Herr Dr. Eickmann
T: 06421–28 66 254; 06421–28–64 315
F: 06421–28–68 962
E: becker@staff.uni-marburg.de; eickmann@staff.uni-marburg.de
Nationales Referenzzentrum für tropische Infektionserreger
Bernhard-Nocht-Institut für Tropenmedizin
Bernhard-Nocht-Str. 74
20359 Hamburg
Leitung: Prof. Dr. B. Fleischer
T: 040–42 818–401; 040–42 818–0 (Zentrale)
F: 040–42 818–400
Mikrobiologische Zentraldiagnostik
T: 040–42 818–211
E: Labordiagnostik@bni-hamburg.de
Fragen zur Therapie
Ambulanz der Klinischen Abteilung
T: 040–31 28 51
27.17. Arenaviren
Arenaviren sind RNA-Einzelstrangviren mit Hülle. ArenavirenHumanpathogene Bedeutung haben das LCM-Virus (lymphozytäre Choriomeningitis) und das Lassavirus (Lassa-Lymphozytäre Choriomeningitis (LCM)Fieber). Andere sind Erreger von südamerikanischen Lassa-Fieberhämorrhagischen Fiebern: Juninvirus (argentinisches hämorrhagisches Fieber), Guanaritovirus (Hämorrhagisches Fieber:Arenavirenvenezolanisches hämorrhagisches Fieber), Sabiavirus (brasilianisches hämorrhagisches Fieber) und Machupovirus (bolivianisches hämorrhagisches Fieber).
Klinik
-
•
Lymphozytäre Choriomeningitis: Vorkommen weltweit. Lymphozytäre Choriomeningitis (LCM)Infektionsweg: Inhalation eingetrockneter Exkremente infizierter Mäuse und Hamster oder direkter Kontakt mit den Tieren. Inkubationszeit 5–10 d. Grippeähnliche Symptomatik mit Fieber (38–40 °C), Kopf- und Gliederschmerzen, Schüttelfrost. Selten zusätzlich Fotophobie, Nausea, Dysästhesien. Manchmal biphasischer Verlauf mit aseptischer Meningitis oder Enzephalitis. 1–3 Wo. nach Beginn können Arthralgien, einseitige Orchitis, Parotitis und Alopezie auftreten. Die Erkr. heilt meist folgenlos ab, nur im Fall einer Enzephalitis in etwa 30 % neurologische Residuen.
-
•Lassa-Fieber: Vorkommen: Westafrika. Infektionsweg: Lassa-FieberInhalation oder Schmierinfektion des Urins infizierter Mäuse bzw. direkter Kontakt mit den Tieren. In wenigen Fällen scheint auch die Tröpfchen- oder Schmierinfektion von Mensch zu Mensch möglich zu sein. Inkubationszeit 1–24 d.
-
–Beginn mit Fieber, Schüttelfrost, Kopfschmerzen, allg. Krankheitsgefühl und Myalgien. Später Gesichtsrötung und Pharyngitis, z. T. mit Exsudationen und Pseudomembranbildung. In 50 % d. F. Mundschleimhautulzerationen und generalisierte, nicht schmerzhafte Lymphknotenschwellungen, Gesichtsödem.
-
–In der 2. Wo. schweres unstillbares Erbrechen und Abdominalschmerzen (Nephritis, Hepatitis). Pat., die überleben, entfiebern. Bei den anderen kommt es zu Bewusstseinstrübung, Krampfanfällen, Capillary-Leak-Sy. und Schock. Die Letalität beträgt etwa 20 %.
-
!Beim Lassa-Fieber auf strikte Isolierung achten. Kontaktpersonen überwachen.
-
–
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischem Fieber, Nachweis von Lassavirus, Nachweis von Erregern hämorrhagischen Fiebers!
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an virusbedingtem hämorrhagischem Fieber, Nachweis von Lassavirus, Nachweis von Erregern hämorrhagischen Fiebers!
Untersuchungsmaterial
-
•
Kultur: 10 ml Heparinblut/-plasma (Citrat- oder Oxalatblut toxisch für die Viren!), Rachenabstriche, Liquor, Urin.
-
•
Serologie: 1–2 ml Serum.
-
•
Andere Laborparameter: Die Höhe der GOT i. S. zu Beginn der Symptome korreliert mit der Schwere der Erkrankung im weiteren Verlauf!
![]() Arenaviren gehören zu den Krankheitserregern der Risikogruppe 4 und dürfen nur in Hochsicherheitslaboratorien untersucht werden. Ausnahme: LCM-Virus gehört zur Risikoklasse 3 → Sicherheitslabor!
Arenaviren gehören zu den Krankheitserregern der Risikogruppe 4 und dürfen nur in Hochsicherheitslaboratorien untersucht werden. Ausnahme: LCM-Virus gehört zur Risikoklasse 3 → Sicherheitslabor!
Mikrobiologische Diagnostik
-
•
Direktnachweis: RT-PCR aus allen Materialien.
-
•
Kultur: Virusanzucht in geeigneten Zellkulturen oder Anreicherung im Mäuseversuch (intrazerebrale Injektion homogenisierten Untersuchungsmaterials in junge Mäuse).
-
•
Serolog. AK-Nachweis: IgM- und IgG-Nachweis mittels ELISA oder indir. IFT sowie Dotblot-Verfahren mit rekombinanten Nukleopeptid-AG. Der Stellenwert der Serologie liegt im Nachweis einer inapparenten, milden oder abgelaufenen Infektion.
Antibiotikaempfindlichkeit Lassa-Fieber: Ribavirin.
27.18. Retroviren
Bisher bekannte humanpathogene Retroviren sind die RetrovirenErreger von AIDS (humanes Immundefizienz-Virus 1 und 2) sowie die Leukämie-Viren HTLV (Human T-Cell Leukemia Virus 1 Leukämie-Viren (HTLV 1/2und 2). HTLV 1 kommt v. a. in Japan und Afrika vor, wird parenteral übertragen und verursacht T-Zell-Leukämien und -Lymphome sowie Demyelinisierungen motorischer Neurone im Rückenmark, die in spastische Parese münden. HTLV 2 ist in Süd-, weniger in Nordamerika und Teilen Afrikas verbreitet. Ob es als Auslöser der Haarzell-Leukämie angesehen werden kann, ist noch fraglich. Es mehren sich jedoch Hinweise auf eine Assoziation zu spastischen Paresen, jedoch mit einem geringeren Risiko als bei HTLV-1-Infektionen.
Humanes Immundefizienz-Virus (HIV)
Humanes Immundefizienz-Virus (HIV)\t \"Siehe HIV(-Infektion)Die beiden Serotypen HIV 1 HIV (humanes Immundefizienz-Virus)und HIV 2 unterscheiden sich v. a. in ihrer Verbreitung. HIV 1 kommt weltweit vor und ist bei uns für die Mehrzahl der Infektionen verantwortlich. HIV 2 findet man hauptsächlich in Westafrika, jedoch auch in Westeuropa und Nordamerika mit zunehmender Häufigkeit.
Klinik Infektion durch Blut und Blutprodukte, unsterile i. v. Kanülen (Drogenabhängige) sowie ungeschützten Geschlechtsverkehr. Target der Viren sind das CD4-Molekül und die Chemokinrezeptoren 4 und 5 von Helferlymphozyten und Makrophagen:
-
•
HIV (humanes Immundefizienz-Virus):InfektionsverlaufZeitpunkt der Infektion: asymptomatisch oder unspez. „grippale“ Beschwerden (akutes retrovirales Sy.).
-
•
Nach 6 Mon. bis zu 10 J. Lymphadenopathie-Stadium: Abfall der CD4-Lymphozyten, generalisierte Lymphknotenschwellungen. Fieberschübe, Nachtschweiß, Durchfälle, Gewichtsabnahme, Haarausfall und Soor.
-
•
Übergang in das Vollbild AIDS: opportunistische Infektionen und/oder Kaposi-AIDSSarkom.
![]() Nicht namentliche Meldung des Nachweises von HIV!
Nicht namentliche Meldung des Nachweises von HIV!
Kaposi-Sarkom Untersuchungsmaterial und mikrobiologische Diagnostik
-
•HIV (humanes Immundefizienz-Virus):Nachweis Serolog. AK-Nachweis: Die AK-Produktion beginnt 2–10 Wo. nach der Infektion.
-
–Suchtest: ELISA. Die aktuellen HIV-Suchtests der 4. Generation entdecken sowohl HIV-1- und HIV-2-AK als auch p24-Antigen (s. Direktnachweis). Ein pos. Testergebnis sollte reproduzierbar sein.
-
–Bestätigungstest bei pos. Ergebnissen im Western Blot. Die gleichzeitige Erkennung von mind. zwei der folgenden Banden durch die patienteneigenen AK wird als spez. angesehen: gp 160, gp120 = Hüllenglykoprotein, gp 41 = Transmembrankomponente, p55, p24, p17 = inneres Core-Protein, p66, p51 = reverse Transkriptase, p32 = Endonuklease.
-
!Unbedingt Einverständnis des Pat. einholen.
-
–Immer eine zweite Blutprobe testen, bevor dem Pat. ein pos. Ergebnis mitgeteilt wird!
-
–
-
•Direktnachweis:
-
–PCR und andere Nukleinsäure-Amplifikationsverfahren.
-
–AG-Direktnachweis (p24) im Serum oder Liquor mittels ELISA. Als Marker für die Virämie kann das p24-AG einige Tage früher als die AK i. S. nachweisbar sein: i. d. R. verschwindet es mit dem Erscheinen von spez. AK.
-
–Bestimmung der Viruslast für die Therapieüberwachung: Anzahl der Virus-RNA-Kopien pro Milliliter Plasma mittels PCR.
-
–
-
•
Kultur: stimulierte Lymphozyten-Cokulturen (aufwendig, schwierig, insb. bei Frühstadien der Infektion nicht immer erfolgreich – experimentelle Fragestellung). Nachweis des Isolats im Kulturüberstand durch Antigen-ELISA. In der Routinediagnostik heute besser durch PCR ersetzt.
-
•
Resistenztestung: bei Anstieg der Viruslast und/oder Sinken der CD4-T-Zellzahl unter Therapie. Genotypisch nach PCR mittels Hybridisierung oder Sequenzierung (Mutationsnachweis) oder phänotypisch nach Virusisolation (s. Kultur) oder im rekombinanten Virusassay (Inkubation mit Virustatika in verschiedenen Konzentrationen).
Ergänzende Laborparameter Überwachung der CD4-Lymphozytenzahl (Normwert: 950 ± 300/μl) und Infektionskontrolle hinsichtlich opportunistischer Erreger.
Antibiotikaempfindlichkeit Durchführung einer HAART (hochaktive HIV (humanes Immundefizienz-Virus):HAARTantiretrovirale Therapie) unter Einbeziehung von Enzyminhibitoren (Inhibitoren der reversen Transkriptase, Nukleosidanaloga und nichtnukleosidische Hemmstoffe), Fusionsinhibitoren, CCR5-Rezeptorenblocker, Protease-Inhibitoren und Integrase-Inhibitoren. Die Therapie gehört in die Hand von Spezialisten (HIV-Schwerpunktpraxen).
 Therapieempfehlungen der Deutschen AIDS-Gesellschaft
Therapieempfehlungen der Deutschen AIDS-Gesellschaft
Ein Behandlungsbeginn wird bei sonst symptomenfreien Pat. derzeit bei einer T-Helferzellzahl von < 350 Zellen/μl empfohlen. Bei höherem Alter (> 50 J.) und chron. Coinfektionen (HBV, HCV) sollte bereits früher (ab 500 Zellen/μl) mit der Therapie begonnen werden.
Als Therapieerfolg gilt das Absinken der Plasmavirämie unter 50 HIV-RNA-Kopien pro ml. Dieses Ziel sollte nach etwa 3–4 Mon., bei initial sehr hoher Plasmavirämie spätestens nach 6 Mon. erreicht werden. Bei virologischem Therapieversagen sollte eine genotypische Resistenzanalyse aller für die Therapieentscheidung relevanten viralen Genomabschnitte erfolgen.
Postexpositionsprophylaxe Gemäß den Deutsch-Österreichischen Leitlinien zur Postexpositionellen Prophylaxe (PEP) der HIV-Infektion (Stand Juni 2013, AWMF-Register-Nr. 055/004; Abb. 27.3 ; Tab. 27.9 ; Tab. 27.10 ; Tab. 27.11 ).
Abb. 27.3.

Sofortmaßnahmen bei beruflicher Exposition (aus: Deutsche AIDS-Gesellschaft [DAIG], Österreichische AIDS-Gesellschaft. Deutsch-Österreichische Leitlinien zur Postexpositionellen Prophylaxe [PEP] der HIV-Infektion. Stand Juni 2013, AWMF-Register-Nr. 055/004) HIV (humanes Immundefizienz-Virus):Postexpositionsprophylaxe
[L157]
Tab. 27.9.
Basis- und KontrolluntersuchungenHIV (humanes Immundefizienz-Virus):Postexpositionsprophylaxe
| Indexperson |
||||||
|---|---|---|---|---|---|---|
| AU | 2 Wo. | 6 Wo. | 3 Mon. | 6 Mon. | ||
| HIV-Antikörper | X | X | X | X | (X) | |
| HBsAg | X | X | ||||
| Anti-HBc- und Anti-HBs-AK | X | X∗ | X∗ | X∗ | ||
| HCV-AK | X | X | X∗ | X∗ | X∗ | |
| Weitere STDs | X∗ | X∗ | X∗ | X∗ | ||
| Ärztliche Untersuchung | X | X | X | |||
| Medikamentenanamnese | X1 | X2 | X2 | |||
| Blutbild | X | X | X | |||
| Transaminasen/aP/γ-GT | X | X | X | X∗∗ | X∗∗ | |
| Krea/Harnstoff | X | X | X | |||
| Blutzucker | X | X | X | |||
AU = Ausgangsuntersuchung
Falls indiziert/falls Exposition vorlag
Kontrollen, falls gleichzeitig eine HCV-Exposition vorlag
Behandlungsanamnese mit antiretroviralen Medikamenten (Abschätzung der Resistenzsituation)
Einnahme anderer Medikamente? (cave! Wechselwirkungen) Verträglichkeit der PEP?
Tab. 27.10.
Indikation zur HIV-PEP bei beruflicher HIV-Exposition (Indexperson HIV-positiv) HIV (humanes Immundefizienz-Virus):berufliche ExpositionHIV (humanes Immundefizienz-Virus):Postexpositionsprophylaxe
| Expositionsereignis | VL bei Indexperson > 50 Kopien/ml oder unbekannt | VL bei Indexperson < 50 Kopien/ml |
|---|---|---|
| Massive Inokulation (> 1 ml) von Blut oder anderer (Körper-)Flüssigkeit mit (potenziell) hoher Viruskonzentration | Empfehlen | Empfehlen |
| (Blutende) Perkutane Stichverletzung mit Injektionsnadel oder anderer Hohlraumnadel; Schnittverletzung mit kontaminiertem Skalpell, Messer o. Ä. | Empfehlen | Anbieten |
|
Anbieten | Nicht indiziert |
|
Nicht indiziert | Nicht indiziert |
Tab. 27.11.
Indikation zur HIV-PEP bei nichtberuflichen HIV-HIV (humanes Immundefizienz-Virus):nichtberufliche ExpositionExpositionenHIV (humanes Immundefizienz-Virus):Postexpositionsprophylaxe
| Parenterale Exposition | |
|---|---|
| Expositionsereignis | PEP-Indikation |
| Versehentliche Transfusion von HIV-haltigen Blutkonserven oder Erhalt von mit hoher Wahrscheinlichkeit HIV-haltigen Blutprodukten oder Organen | PEP empfehlen |
| Nutzung eines HIV-kontaminierten Injektionsbestecks durch mehrere Drogengebrauchende gemeinsam | PEP empfehlen |
| Verletzung an altem, weggeworfenem Spritzenbesteck (z. B. bei spielenden Kindern) | Keine PEP-Indikation |
| Sexuelle Exposition | |
| Ungeschützter insertiver oder rezeptiver vaginaler oder analer Geschlechtsverkehr (z. B. infolge eines geplatzten Kondoms) mit einer bekannt HIV-infizierten Person |
PEP empfehlen
|
PEP anbieten
| |
Keine PEP-Indikation
| |
| Sexuelle Exposition bei unbekanntem HIV-Status der Indexperson | |
| Ungeschützter Analverkehr zwischen Männern |
PEP anbieten Wenn ungeschützter Analverkehr wiederholt erfolgt (Anamnese!), sollte zusätzlich eine Präventionsberatung empfohlen werden |
Ungeschützter heterosexueller Vaginal- oder Analverkehr
|
PEP anbieten |
|
Keine Einigkeit bzgl. PEP-Indikation |
| Ungeschützter heterosexueller Vaginal- oder Analverkehr (auch mit Sexarbeiterin) | Keine PEP-Indikation |
| Oralverkehr (ungeschützter oraler Geschlechtsverkehr mit der Aufnahme von Sperma eines sicher oder wahrscheinlich HIV-infizierten Partners in den Mund) |
Keine PEP-Indikation |
| Küssen Kontakt mit HIV von Haut |
Keine PEP-Indikation |
HIV (humanes Immundefizienz-Virus):Postexpositionsprophylaxe Risiko der HIV-Übertragung durch Transfusion 1 : 16 Mio. (bezogen auf zelluläre Blutpräparate).
27.19. Picornaviren
Außerordentlich kleine RNA-Viren. Die Bezeichnung „PicornavirenPicorna“ setzt sich zusammen aus den beiden Worten Pico (= sehr klein) und RNA. Drei Gruppen:
-
•
Enteroviren: Poliomyelitisviren, Coxsackie-Viren, ECHO-Viren, Enteroviren.
-
•
Rhinoviren.
-
•
Hepatitis-A-Virus (27.5.1).
27.19.1. Poliomyelitisviren
Von den menschlichen Poliomyelitisviren sind 3 verschiedene Serotypen bekannt:
-
•
Typ 1 = Stamm Brunhilde (höchste Pathogenität, 85 % der Epidemien).
-
•
Poliomyelitis(viren)Typ 2 = Stamm Lansing (sporadische Fälle).
-
•
Typ 3 = Stamm Leon (lokale Epidemien in 3 %).
Sie hinterlassen nach überstandener Infektion keine Kreuzimmunität.
Klinik Übertragungsweg fäkal-oral von Mensch zu Mensch oder durch Tröpfcheninfektion (seltener). Inkubationszeit 1–2, max. 4 Wo. Das Virus vermehrt sich in der Rachen- und Darmschleimhaut, später auch in Darmlymphknoten und Peyer-Plaques. Nach einer virämischen Phase infiziert es die motorischen Vorderhornzellen des Rückenmarks und vermehrt sich dort, was zur Zerstörung dieser Zellen führen kann. Sehr unterschiedliche Verläufe (Tab. 27.12 ):
-
!
Erkrankungen durch Polio-Wildviren gegenwärtig nur noch in Afrika und Südostasien (Indien!).
![]() Namentlich bei Krankheitsverdacht, Erkrankung und Tod an Poliomyelitis (als Verdacht gilt jede akute schlaffe Lähmung, außer traumatisch bedingt), Nachweis von Poliovirus.
Namentlich bei Krankheitsverdacht, Erkrankung und Tod an Poliomyelitis (als Verdacht gilt jede akute schlaffe Lähmung, außer traumatisch bedingt), Nachweis von Poliovirus.
Tab. 27.12.
Verlaufsformen der Poliomyelitis-Poliomyelitis(viren):VerlaufsformenInfektion
| Häufigkeit (%) | Verlauf |
|---|---|
| 90–95 | Völlig inapparent |
| 4–8 | Minor illness: katarrhalische Erkrankungen |
| 0,5–1 | Meningitische Verlaufsform: lymphozytäre Meningitis ohne Lähmungen |
| 0,1 | Paralytische Verlaufsformen:
|
Untersuchungsmaterial
Direktnachweis und Kultur:
-
•
In der 1. Wo. Rachenabstriche und -spülwasser.
-
•
Später aus Stuhl und Rektalabstrichen.
Serologie: 1–2 ml Serum.
Mikrobiologische Diagnostik
-
•
Direktnachweis: AG-Poliomyelitis(viren):NachweisDirektnachweis mittels PCR oder dir. IFT (Speziallabor).
-
•
Kultur: Virusanzucht in permanenten Fibroblastenzelllinien (MRC-5), HeLa- oder HEp-2-Zellen, aber auch in prim. humanen embryonalen Haut- und Lungenfibroblasten oder in Vero-Zellen → 2–21 d bis zur Ausbildung eines charakteristischen CPE. Identifizierung des Isolats mittels NT oder PCR (Speziallabor).
-
•
Serolog. AK-Nachweis: mittels NT oder ELISA (gepaarte Seren, 4-facher Titeranstieg oder Einzeltiter > 64 oder Nachweis von spez. IgM).
-
•
Identifikation als Impf- oder Wildvirus (Speziallabor) mittels intratypischer Serodifferenzierung oder PCR + Hybridisierung oder Sequenzierung.
Immunisierungsmöglichkeit Bis 1997 Poliomyelitis(viren):SchluckimpfungSchluckimpfung mit attenuiertem Lebendimpfstoff. Immunisierung:Poliomyelitis NW: selten Entwicklung vakzineassoziierter paralytischer Poliomyelitiden (12 Fälle seit 1991, nur 2 Fälle von Polioinfektionen durch den Wildstamm, die importiert waren). Seit 1998 deshalb Impfung mit Totimpfstoff → identische Wirksamkeit, keine vakzineassoziierte paralytische Poliomyelitis, keine Ausscheidung mit dem Stuhl und damit keine Gefährdung immunsupprimierter Menschen in der Umgebung der Impflinge, auch Personen mit Immunschwäche können geimpft werden.
27.19.2. Enteroviren
Vorkommen weltweit. Epidemiologie und Enteroviren:SerotypenPathogenese ähnlich wie beim Poliovirus, jedoch viel höhere Affinität zu den Meningen.
Die Enteroviren teilt man in die Gruppen A, B, C und D ein. Gruppe A besteht aus 12, Gruppe B aus 36, Gruppe C aus 11 und Gruppe D aus 2 Serotypen.
-
•Humanes Enterovirus A:
-
–Coxsackievirus A2, A3, A5, A7, A8,Coxsackievirus A10, A12, A14, A16.
-
–Enterovirus 71.
-
–
-
•Humanes Enterovirus B:
-
–Coxsackievirus A9, B1–B6.
-
–Echovirus 1–7, 9, 11–21, 24–27 und 29–33.
-
–Enterovirus 69.
-
–
-
•
Echovirus Humanes Enterovirus C: Coxsackievirus A1, A11, A13, A15, A17–22, A24.
-
•
Humanes Enterovirus D: Enterovirus 68 und 70.
-
•
Serotypen ohne Speziesbezug: Coxsackievirus A4 und A6.
Klinik Infektionsweg fäkal-oral sowie Tröpfcheninfektion. Inkubationszeit 1–2 Wo.
-
•
Etwa 60 % der Infektionen verlaufen inapparent.
-
•
Fieberhafte Infekte: Rachenentzündungen, Schnupfen, Pharyngitis, Konjunktivitis, Sommergrippe, Herpangina.
-
•
Pleurodynie (Bornholm-Krankheit), Meningitiden, Enzephalitis, Myokarditis und vesikuläre Exantheme (Hand-Fuß-Mund-Erkr.).
![]() Erkrankung und Tod an virusbedingter Meningoenzephalitis.
Erkrankung und Tod an virusbedingter Meningoenzephalitis.
Untersuchungsmaterial
-
•
Direktnachweis und Kultur: In Frühphase Rachenabstriche und -spülwasser, später Stuhl und Rektalabstriche, Liquor, Urin.
-
•
Serologie: 1–2 ml Serum.
Mikrobiologische Diagnostik Enteroviren:Nachweis
-
•
Direktnachweis: AG-Coxsackievirus:NachweisDirektnachweis mittels PCR. Universelle und speziesspez. PCR für klin. Fragestellungen, Stamm- bzw. Serotypen-PCR für epidemiologische Fragestellungen.
-
•
Kultur: Virusanzucht in permanenten Fibroblastenzelllinien (MRC-5), HeLa- oder HEp-2-Zellen, aber auch in prim. humanen embryonalen Haut- und Lungenfibroblasten oder in Vero-Zellen → 2–21 d bis zur Ausbildung eines charakteristischen CPE. Identifizierung des Isolats mittels NT, PCR, dir. IFT oder HAHT (nur bei Isolaten möglich, die Hämagglutinationseigenschaft besitzen). In der Zellkultur nicht anzüchtbare Coxsackievirus-Typen (A1, A19, A22) lassen sich in jungen Mäusen isolieren (Speziallabor).
-
•
Serolog. AK-Nachweis: NT, IgM-ELISA → signifikanter Titeranstieg im NT oder Nachweis eines spez. IgM beweist eine frische Infektion.
Antibiotikaempfindlichkeit In Phase-3-Studien effektiv: Pleconaril (Canyon-Blocker, hemmt Rezeptorbindung des Virus und Freisetzung der viralen Nukleinsäure).
27.19.3. Rhinoviren
Rhinoviren sind die häufigsten Erreger des Rhinoviren Schnupfens. Von ihnen sind mehr als 110 Serotypen bekannt; Schnupfendie humanen Typen sind weltweit in der Bevölkerung verbreitet.
Klinik Tröpfcheninfektion. Inkubationszeit rund 24 h. Die Viren vermehren sich im Epithel des oberen Respirationstrakts → Rhinorrhö, Stockschnupfen, Heiserkeit, z. T. Husten. Eine Rhinovirusinfektion kann Wegbereiter einer bakt. Besiedelung sein (Sinusitis, Otitis media) oder die Exazerbation einer chron. Bronchitis bzw. eines Asthma bronchiale verursachen. Unkomplizierte Verläufe klingen meist in < 1 Wo. ab.
Untersuchungsmaterial und mikrobiologische Diagnostik Aufgrund der Banalität der Erkr. meist keine Diagnostik. AG-Direktnachweis mittels dir. IFT an Ausstrichen von Nasopharyngealsekret, EIA und PCR-Methode existiert. Virus kann aus Nasensekret auf humanen embryonalen Fibroblasten angezüchtet werden. Serologische Nachweismethoden sind epidemiologischen Untersuchungen vorbehalten.
Antibiotikaempfindlichkeit Lösliches ICAM-1 intranasal → Hemmung der Virusbindung an die Wirtszellen. Präparat: Tremacamra. In Phase-III-Studien effektiv: Pleconaril. In der Entwicklung: Inhibitoren der Rhinovirus-Protease 3C.
27.20. Coronaviren
Klinik Man unterscheidet humanpathogene Coronaviren, die Coronavirenausschließlich respiratorische Erkr. verursachen (zweithäufigste Ursache des Schnupfens nach den Rhinoviren) von solchen, die Enteritis verursachen.
Untersuchungsmaterial und mikrobiologische Diagnostik Keine Routinediagnostik, nur bei epidemiologischer Fragestellung.
-
•
Direktnachweis: AG-Direktnachweis mittels RT-PCR (Methode der Wahl) aus Nasopharyngealaspirat, Sputum, Rachenabstrichen und -spülwasser, Stuhl- und Rektalabstrichen, Blut. Elektronenmikroskopie, RIVA-RNA-Hybridisierung oder dir. IFT (Speziallabor).
-
•
Serolog. AK-Nachweis: indir. IFT, passive Hämagglutination und IgG-ELISA (gepaarte Seren, 4-facher Titeranstieg oder Einzeltiter > 64). Durchseuchung > 90 % ab 5. Lj.
Schweres akutes respiratorisches Syndrom (SARS)
Klinik SARSAnfang Schweres akutes respiratorisches Syndrom\t \"Siehe SARS2003 neu aufgetretenes, durch das Middle East Respiratory Syndrome Coronavirus (MERS-CoV) ausgelöstes Krankheitsbild mit hohem Fieber (> 38 °C), Husten, Atemnot SARSund Kurzatmigkeit, später Entwicklung von Pneumonie und ARDS. Übertragung vermutlich durch Tröpfcheninfektion, Inkubationszeit etwas 2–7 d.
Hauptsächlich betroffene Länder: Kanada (Toronto), China, Singapur, Vietnam.
 RKI-Falldefinition (Stand August 2013)
RKI-Falldefinition (Stand August 2013)
SARS:RKI-Falldefinition Klin. Bild: Pat. mit einem akuten respiratorischen Sy. (mit oder ohne Fieber und mit oder ohne Husten), bei dem, basierend auf klin., radiologischen oder histopath. Hinweisen auf ein entzündliches Infiltrat der Verdacht besteht, dass die unteren Atemwege betroffen sind (z. B. Pneumonie oder akutes Atemnotsy.).
Identifikation von Pat. zur weiteren diagn. Abklärung:
-
•
Pat. mit respiratorischen Symptomen unabhängig von deren Schwere UND Kontakt mit einem bestätigten oder wahrscheinlichen SARS-Fall.
-
•
Pat. mit erfülltem klin. Bild UND Aufenthalt in einem Risikogebiet. Diese Pat. müssen mithilfe eines geeigneten labordiagn. Verfahrens abgeklärt und einer der u. g. vier Falldefinitionskategorien zugeordnet werden:
Kategorien der Falldefinition:
-
1.
Bestätigter Fall: Person mit labordiagn. Nachweis des MERS-CoV.
-
2.
Wahrscheinlicher Fall: Pat., bei dem kein Nachweis von MERS-CoV durch ein geeignetes labordiagn. Verfahren durchgeführt wurde, aber mit erfülltem klin. Bild UND Kontakt zu einem bestätigten Fall.
-
3.
Ungeklärter Fall: Pat. unter weiterer diagn. Abklärung, bei dem kein geeignetes labordiagn. Verfahren zum Nachweis von MERS-CoV durchgeführt wurde und der die Kriterien eines wahrscheinlichen Falls nicht erfüllt.
-
4.
Ausgeschlossener Fall: Pat. mit nur neg. Ergebnissen bei Einsatz eines geeigneten labordiagn. Verfahrens.
Diagnose
Ausschluss anderer Ursachen der Pneumonie: neben Thoraxröntgen und BGA Ausschluss anderer Pneumonieerreger mittels Blutkulturen, Sputum-Direktpräparaten, bakteriologischer Sputumkultur, Virusnachweis (v. a. Influenza A und B, RSV), Legionella-AG-Nachweis (Urin).
![]() Wahrscheinliche und bestätigte SARS-Fälle müssen binnen 24 h namentlich an das Gesundheitsamt gemeldet werden.
Wahrscheinliche und bestätigte SARS-Fälle müssen binnen 24 h namentlich an das Gesundheitsamt gemeldet werden.
Untersuchungsmaterial
-
•
Virusnachweis: mind. 1 Probe aus SARS:Nachweisdem unteren Atemwegstrakt (nach Anweisung produziertes bzw. induziertes Sputum, endotracheales Aspirat oder BAL) oder mind. 2 konsekutive Proben im Abstand von mind. 1 d aus dem oberen Atemwegstrakt (Rachenspülwasser, Nasopharynxaspirat, Rachenabstrich – in physiologischer Kochsalz-Lsg. oder Medium für die Virusdiagnostik). Proben der unteren Atemwege sind geeigneter als Proben der oberen Atemwege, da im unteren Respirationstrakt höhere Konz. des Virus. Nachweis ist auch in Blut, Urin und Stuhl möglich, allerdings in wesentlich geringeren Konz. (Sensitivität dieser Materialien geringer).
-
•
Serologie: 1–2 ml Serum, am besten gepaarte Serumproben (1. und 4. Wo. nach Symptombeginn).
Alle Materialien sollten bis zur endgültigen Festlegung der Diagnose sowie für epidemiologische Untersuchungen (RKI) aufgehoben werden.
Mikrobiologische Diagnostik
-
•
Virusdirektnachweis mittels RT-PCR: Primer für den PCR-Nachweis von SARS-assoziierten Coronaviren sind publiziert (www.who.int/csr/sars/primers/en/), PCR-Kits bereits kommerziell erhältlich. Es wird aber trotzdem empfohlen, die Proben parallel an ein WHO-Netzwerklaboratorium (www.who.int/csr/sars/project/en/) zu versenden.
 Ansprechpartner für SARS-Fälle und -Diagnostik
Ansprechpartner für SARS-Fälle und -Diagnostik
SARS:AnsprechpartnerKonsiliarlabor für Coronaviren des Universitätsklinikums Bonn
Institut für Virologie
Sigmund-Freud-Str. 25
53127 Bonn
Ansprechpartner:
Herr Prof. Dr. C. Drosten
T: 0228–28 71 58 81
F: 0228–28 71 44 3
Homepage: www.virology-bonn.de/index.php?id=49
-
•
Serolog. AK-Nachweis: IFT zum Nachweis von IgM- und IgG-AK gegen SARS-Coronaviren, wird ca. 10 d nach Beginn der Symptome positiv. IFT mit Spike-Proteinen zur Differenzierung des Virustyps. Bestätigung durch NT.
Antibiotikaempfindlichkeit Bisher keine wirksamen Antibiotika bekannt, Therapie rein symptomatisch.
Quarantäne Strikte Isolierung in Infektionspflegeeinheiten SARS:Quarantänemit Unterdruck und eigener Belüftungsanlage. Kein Kontakt zu anderen Pat.; Schutz für medizinisches Personal (Schutzkittel, Einweghandschuhe, Kopfhaube, dicht anliegende Atemschutzmaske [Schutzstufe FFP2 bzw. FFP3; FFP3 oder Respirator bei ausgeprägter Exposition bzw. Aerosolexposition, z. B. bei Bronchoskopie] sowie geeignete Schutzbrille und wasserdichte Einwegschürze) bei entsprechenden pflegerischen, diagn. oder ther. Tätigkeiten am Pat.
27.21. Noroviren
Noroviren gehören zur Familie der NorovirenCaliciviren. Sie sind für einen Großteil der nicht bakt. Calicivirenverursachten Gastroenteritiden von Kindern und Erw. verantwortlich. Gastroenteritis:NorovirenEs existieren 6 Genogruppen, von denen 3 (GI, GII und GIV) mit mehr als 24 Genotypen humanpathogen sind. Varianten des GII.4-Genotyps sind die häufigste Ursache von Infektionen beim Menschen. Seit 2002 in Deutschland erhebliche Zunahme der Norovirusausbrüche (Gipfel Okt.–März). Besonders betroffen: Krankenhäuser, Alten- und Pflegeheime u. a. Gemeinschaftseinrichtungen. Besonders gefährdet: Kinder < 5 J. und alte Menschen. Übertragung erfolgt durch fäkal-orale Schmierinfektion oder durch orale Aufnahme von virushaltigen Aerosolen während des Erbrechens. Auch kontaminiertes Wasser oder kontaminierte Lebensmittel haben Bedeutung. Die minimale Infektionsdosis beträgt 10–100 Viruspartikel, die Inkubationszeit 6–50 h. Das Virus wird 7–14 d, z. T. aber auch noch Wo. nach der Infektion ausgeschieden.
Klinik Akut beginnende Gastroenteritiden mit schwallartigem Erbrechen und starker Diarrhö, in seltenen Fällen auch nur Erbrechen oder nur Diarrhö. Schnelle Entwicklung eines Flüssigkeitsdefizits (cave: kleine Kinder und sehr alte Menschen!). Ausgeprägtes Krankheitsgefühl mit Bauch- und Kopfschmerzen, Myalgien und Erschöpfungsgefühl. Mäßiges Fieber. Sistieren der Symptomatik nach 12–48 h.
![]() Krankheitsverdacht und Erkrankung an akuter infektiöser Gastroenteritis bei Personen, die im Lebensmittelbereich tätig sind, oder bei Erkrankungshäufung im epidemischen Zusammenhang, Nachweis von Noroviren.
Krankheitsverdacht und Erkrankung an akuter infektiöser Gastroenteritis bei Personen, die im Lebensmittelbereich tätig sind, oder bei Erkrankungshäufung im epidemischen Zusammenhang, Nachweis von Noroviren.
Untersuchungsmaterial
Direktnachweis: ca. 1 ml möglichst flüssiger Stuhl, alternativ Rektalabstriche (geringere Sensitivität).
Mikrobiologische Diagnostik
-
•
Direktnachweis: RT-PCR zum Virusnachweis, Antigen-ELISA (geringere Sensitivität und Spezifität). In Referenzlaboratorien auch Elektronenmikroskopie oder Immunelektronenmikroskopie. Bei größeren Ausbrüchen genügt Virusnachweis bei max. 5 Betroffenen im gleichen Umfeld.
-
•
Immunchromatografische Schnellteste mit deutlich geringerer Sensitivität als PCR.
-
•
Kultur und serolog. AK-Nachweis sind für die Routinediagnostik nicht etabliert.
Hygienemaßnahmen Betroffene Pat. isolieren (Kohortenisolierung ist möglich). Handschuhe, Schutzkittel, Atemschutz, Hände- und Flächendesinfektion mit viroziden Desinfektionsmitteln. Sperre für den Kindergartenbesuch sowie für im Lebensmittelbereich tätige Personen bis 2 d nach Abklingen der klin. Symptome. In den folgenden 4–6 Wo. intensive Händehygiene. Details im Epidemiologischen Bulletin Nr. 4 vom 26.1.2009, S. 28 (www.rki.de).
27.22. Prionerkrankungen
Prionerkrankungen sind übertragbare neurodegenerative PrionerkrankungenKrankheiten, die zu einer spongiformen Enzephalopathie führen. Bekannteste Vertreter sind:
-
•
Enzephalopathie:spongiformeBeim Schaf: Scrapie.
-
•
Beim Rind: BSE. Scrapie
-
•Beim Menschen:
-
–Kuru-BSEKrankheit.
-
–Creutzfeldt-Jakob-Krankheit (Kuru-KrankheitCJK), sowohl sporadische als auch Creutzfeldt-Jakob-Krankheithereditäre Formen.
-
–Neue Variante der Creutzfeldt-Jakob-Krankheit (vCJK).
-
–
Pathogenese „Infektionen“ durch Eiweißmoleküle, Prionen (PrPSc für Scrapie-Prion-Protein = Amyloid). In der Folge denaturiert und vCJK6aggregiert ein körpereigenes Protein der Nervenzellmembran (PrPc für normales zelluläres Prionprotein = Präamyloid) im Hirn und ändert seine Konformation: Das lösliche Präamyloid mit 43 % α-Helix und nur 3 % β-Faltblattstruktur denaturiert zu unlöslichem Amyloid mit 43 % β-Faltblattstruktur und kann seinerseits nun weitere Konformationsänderungen hervorrufen. Das Vorhandensein des PrPc im Hirn ist für die Infektiosität essenziell: Knockout-Mäuse, denen das Präamyloidgen entfernt wurde, werden im Gegensatz zu den das Präamyloidgen besitzenden Mäusen des gleichen Stammes nach Infektion mit PrPSc nicht krank.
Die Struktur des PrPc bestimmt auch die Speziesbarriere für den Erreger: Je ähnlicher sich das Präamyloid des Wirtes und das Amyloid des Erregers sind, desto niedriger ist die Speziesbarriere. Für die Erstinfektion einer neuen Spezies werden höhere Erregermengen als für den alten Wirt benötigt. In der neuen Spezies erfolgt dann die Anpassung des Erregers, in deren Folge sich für die neue Spezies die Inkubationszeit verkürzt, die erforderliche Infektionsdosis verringert und auch das vom alten Wirt bekannte Krankheitsbild verändert. Die Aufdeckung dieses Mechanismus hat Befürchtungen geweckt, dass z. B. BSE durch Rindfleischkonsum auch auf den Menschen übertragbar sein könnte (neue Variante der CJK).
Klinik Klin. Verdachtszeichen sind eine schnell fortschreitende Demenz und typische EEG-Veränderungen ( Demenz, Prionerkrankungen periodic sharp wave complexes), Myoklonien, zerebelläre und visuelle Störungen, pyramidale und extrapyramidale Dysfunktionen und akinetischer Mutismus.
![]() Namentlich bei humaner spongiformer Enzephalopathie (außer familiär-hereditäre Formen)!
Namentlich bei humaner spongiformer Enzephalopathie (außer familiär-hereditäre Formen)!
Diagnostik Die Diagnose von Prionerkrankungen ist schwierig. Neben einer verdächtigen Klinik, der Durchführung eines EEG und einer gezielten Familienanamnese kann der Nachweis von neuronenspezifischer Enolase (NSE > 35 ng/ml, 4.3.2), des Tau-Proteins (> 1.400 pg/ml) sowie des chaperonähnlichen 14-3-3-Proteins (Western Blot) aus dem Liquorpunktat weiterhelfen. Eine persistierende Erhöhung des kalziumbindenden S-100-Proteins (> 4,2 ng/ml) i. S. bedeutet ebenfalls einen Anhaltspunkt für CJK. Alle diese Proteine sind aber auch bei anderen ZNS-Erkr. erhöht und daher nicht spezifisch.
Beim Schaf (Scrapie) ist das PrPSc in vivo in Tonsillengewebe nachweisbar,Scrapie bei Menschen sind auch immunhistochem. Nachweismethoden etabliert. Nur bei hereditären CJK-Fällen lassen sich Mutationen des PrP-Gens in der DNA peripherer Lymphozyten nachweisen.
Die postmortale histologische Untersuchung des Hirngewebes ergibt charakteristische schwammartige Veränderungen durch die Bildung von Mikrovesikeln, Vermehrung von Gliazellen und Astrozyten sowie apoptotische Degeneration von Nervenzellen. Nachweis von PrPsc im Hirngewebe (Immunoblot, Immunhistochemie).
Therapie Zurzeit keine Behandlungsmöglichkeit. Theoretische Ansatzpunkte sind eine Hemmung der Präamyloidsynthese durch Antisense-Oligonukleotide oder der medikamentöse Schutz der mit dem Amyloid reagierenden Aminosäuren des Präamyloids.
27.22.1. Kuru
Bisher nur bei Eingeborenen in Neuguinea, die sichKuru-Krankheit durch Kannibalismus (ritueller Verzehr des Gehirns Verstorbener) infizierten. Inkubationszeit 1–20 J. → subakute spongiöse Enzephalopathie mit Ataxie, Lähmung, Tremor und Demenz. Nach 3–12 Mon. tritt zumeist der Tod ein. Nachdem dieser Totenkult nicht oder kaum noch durchgeführt wird, haben sich die Kuru-Fälle in Neuguinea drastisch reduziert.
27.22.2. Creutzfeldt-Jakob-Krankheit (CJK) und neue Variante (vCJK)
Diese auch als Creutzfeldt-Jakob-Krankheit:neue Variante Pseudosklerose bezeichnete ZNS-Erkrankung betrifft vorwiegend PseudoskleroseErw. höheren, bei vCJK auch des jüngeren Lebensalters. Die meisten Pat. zeigen bereits nachPseudosklerose 6 Mon. eine schwere Demenz und sterben nach < 1 J., meist an Demenz:Prionerkrankungeninterkurrenten Infektionen. Inzidenz in Europa ca. 0,5–1 Fall pro 1 Mio. Einwohner. Seit 1996 in England auch CJK-Fälle bei Pat. jüngeren Alters (Durchschnitt: 28 J.). mit stärker protrahiertem Verlauf (2 J. statt 6 Mon.), zu Beginn eher psychischen Veränderungen, ohne typischen EEG-Befund und später als bei der klassischen CJK eintretender Demenz (neue CJK-Variante). Das Muster des Amyloids im Western Blot bei der neuen CJK-Variante unterscheidet sich von dem bei der klassischen CJK, gleicht aber dem des BSE-Erregers → Zusammenhang mit BSE wurde postuliert.
Man unterscheidet diese sporadische von familiären Formen der CJK, die 5–15 % aller Fälle ausmachen und autosomal-dominant vererbt werden. Typisch für die familiären Formen sind Mutationen oder Insertionen im Amyloidgen. Auch die erblichen Formen sind übertragbar.
Der Übertragungsmodus ist nicht genau bekannt. Gesichert sind Infektionen über infizierte Hirnelektroden sowie durch gepooltes menschliches Wachstumshormon, das aus den Hypophysen der an CJK Verstorbenen gewonnen worden war. Die Erreger sind gegen UV-Strahlen, Formalin, Hitze und Röntgenstrahlen sehr resistent.


