Plus de 50 % des malades hospitalisés en réanimation souffrent, d'emblée ou en cours d'évolution, d'une atteinte respiratoire.
Si l'on excepte l'embolie pulmonaire et les pathologies neuromusculaires, cette atteinte respiratoire a pratiquement toujours une traduction en radiologie standard sous forme d'opacités thoraciques dont il n'est pas toujours aisé de faire la part de l'origine parenchymateuse, pleurale ou médiastinale.
Lorsque ces opacités s'accompagnent de fièvre, le clinicien évoque de principe leur origine pneumonique, tout en sachant :
-
–
qu'une infection extrapulmonaire peut être indirectement source d'opacités pulmonaires, qu'il s'agisse d'oedème hémodynamique par endocardite gauche, d'infarctus septique par endocardite droite ou thrombophlébite suppurée, ou bien de syndrome de détresse respiratoire aiguë (SDRA) (oedème par atteinte diffuse de la membrane alvéolocapillaire) par choc infectieux ;
-
–
que des pathologies non infectieuses, immunologiques notamment, peuvent aussi être à l'origine d'opacités pulmonaires fébriles ;
-
–
que les opacités observées peuvent être partiellement ou totalement préexistantes, risquant alors d'égarer le clinicien s'il ne met pas tout en oeuvre pour récupérer d'éventuels documents d'imagerie thoracique antérieurs.
Dans ce contexte, la demande de tomodensitométrie thoracique n'a pas lieu d'être systématique. Elle n'est d'ailleurs pas mentionnée dans les recommandations de prise en charge des pneumonies communautaires de l'adulte sain.
Lorsqu'elle est formulée, cette demande du clinicien peut avoir trois objectifs.
-
–
Objectif sémiologique. Les opacités observées en radiographie thoracique standard sont difficilement interprétables ou atypiques pour une pneumonie bactérienne usuelle. La tomodensitométrie est infiniment plus performante pour préciser les composantes ou caractéristiques de ces opacités, souvent superposées dans ce contexte d'insuffisance respiratoire aiguë. Elle seule objective précisément les zones de condensation alvéolaire, les zones de verre dépoli, les zones de collection purulente hypodenses ou déjà excavées, les épanchements pleuraux, les adénopathies médiastinales, les nodules ou une éventuelle rétraction.
-
–
Objectif diagnostique. La pneumonie survient chez un adulte immunodéprimé ou ayant une ou plusieurs comorbidité(s), et le champ des hypothèses étiologiques est considérablement élargi. À côté des circonstances de survenue, de la rapidité de constitution, de la sémiologie physique respiratoire et extrarespiratoire, la sémiologie radiologique est un des piliers de la discussion diagnostique. Dans ce cadre, la tomodensitométrie thoracique précise cette sémiologie. De plus, elle optimise les prélèvements invasifs (ponction pleurale, endoscopie bronchique), de règle dans cette situation, dans la mesure où elle précise au mieux le site de chaque lésion à prélever.
-
–Objectif thérapeutique :
-
•l'évolution défavorable d'une pneumonie, en dépit d'un traitement anti-infectieux adéquat, peut résulter de la formation d'une collection purulente, parenchymateuse, pleurale ou péricardique. Ici encore, la tomodensitométrie thoracique précise au mieux la sémiologie. Elle seule permet un inventaire précis et une localisation de toutes les collections purulentes à drainer. Elle est enfin le guide indispensable pour effectuer le ou les drainage(s) nécessaire(s) avec le minimum de risques et le maximum d'efficacité (diagnostic différentiel entre abcès et empyèmes, placement du drain sous contrôle de la vue) ;
-
•l'évolution défavorable d'une pneumonie, en dépit d'un traitement anti-infectieux adéquat, peut également résulter d'une érosion vasculaire, avec le risque inhérent d'hémoptysie massive. En présence d'une hémoptysie de faible abondance survenant dans un contexte infectieux, la tomodensitométrie thoracique peut mettre en évidence une anomalie vasculaire pulmonaire (anévrisme mycotique par exemple) dans, ou contiguë à, un infiltrat tuberculeux, un abcès ou une lésion aspergillaire. Elle contribue alors à la discussion thérapeutique. Chez l'aplasique, la simple constatation d'une grande proximité entre vaisseau artériel pulmonaire et lésion aspergillaire expansive peut même conduire à une chirurgie préventive.
-
•
En pratique, la demande du clinicien et l'apport de la tomodensitométrie thoracique diffèrent considérablement selon qu'il s'agit d'un malade immunocompétent ou d'un malade immunodéprimé.
Malade immunocompétent, au stade de l'admission
Absence de comorbidité
En l'absence de comorbidité, la démarche est relativement codifiée lorsque le tableau clinicoradiologique est typique de pneumonie bactérienne usuelle :
-
–
début brutal ;
-
–
fièvre élevée ;
-
–
syndrome physique de condensation alvéolaire, notamment râles crépitants en foyer(s) ;
-
–
syndrome radiologique de condensation alvéolaire : opacité(s) alvéolaire(s), unique ou multiples, en foyer(s), systématisée(s) ou non, récemment apparue(s) ;
-
–
hyperleucocytose ou leucopénie ;
-
–
élévation de la CRP (C reactive protein) et/ou de la procalcitonine (si dosages effectués) ;
-
–
signe(s) de gravité (fréquence respiratoire > 30/min, fréquence cardiaque > 120/min, pression artérielle systolique < 90 mmHg, température < 35° C ou > 40° C, trouble de la conscience) ; ces signes sont toujours présents dans les formes sévères, justifiant la réanimation.
Dans cette situation, les hypothèses étiologiques sont limitées (tableau 1 ).
Tableau 1.
Causes de pneumonie infectieuse sévère se traduisant par des opacités en foyer(s) et survenant chez un malade immunocompétent
|
De ce fait, les algorithmes de prise en charge n'incluent pas la tomodensitométrie thoracique. À côté des hémocultures et de la recherche dans les urines d'antigènes spécifiques (légionnelle +++ pneumocoque), des prélèvements respiratoires invasifs en vue d'une documentation microbiologique ne sont conseillés que par le seul fait, ici, de la sévérité du tableau clinique, ne souffrant aucune impasse thérapeutique.
Si, pour une raison particulière, une tomodensitométrie thoracique était néanmoins demandée, elle montrerait le plus souvent, et en absence de complication :
-
–
un foyer de condensation alvéolaire, dense, homogène, avec bronchogramme, aérien, occupant plusieurs segments adjacents d'un même lobe, volontiers systématisé lorsque Streptococcus pneumoniae est impliqué (figure 1 ) ;
-
–
un ou plusieurs foyer(s) de condensation alvéolaire lorsque Legionella pneumophila sérogroupe 1 est en cause (figures 2A,B ) ;
-
–
un ou plusieurs foyer(s) de condensation alvéolaire, de forme lobulaire (pneumonie), associé(s) à des zones de petites opacités nodulaires et/ou linéaires branchées centrolobulaires (bronchiolite) lorsque Chlamydia pneumoniae, Chlamydia psittaci, Coxiella burnetii ou Mycoplasma pneumoniae amènent le malade en réanimation, ce qui est loin d'être la règle ;
-
–
en contexte épidémique, certains virus émergents comme le Coronavirus du syndrome respiratoire aigu sévère (SRAS) ou le virus H5N1 de la forme humaine de la grippe aviaire peuvent parfaitement revêtir cet aspect « pneumonique » initial.
Figure 1.

Coupe TDM, avec injection de produit de contraste, en fenêtre médiastinale. Foyers alvéolaires lobaire inférieur droit et lobaire inférieur gauche avec bronchogramme aérien et vasculogramme sur pneumopathie à pneumocoque.
Figure 2.

Coupe TDM, en fenêtre parenchymateuse. A : Foyer alvéolaire bibasal. B : Foyer alvéolaire lobaire supérieur droit avec bronchogramme aérien et quelques alvéologrammes. Il s'agit dans les deux cas d'une pneumopathie à Legionella pneumophila.
Présence de comorbidité
En cas de comorbidité, la démarche diffère, surtout si le tableau clinique évoque d'emblée une pneumonie causée par une bactérie favorisant un évolution nécrosante :
-
–
comorbidité(s) ;
-
–
début brutal, ou insidieux (lors d'un traitement antibiotique inadapté ou sous-dosé, ou bien d'un traitement anti-inflammatoire) ;
-
–
fièvre élevée ou modérée ;
-
–
expectoration purulente voire fétide ;
-
–
excavation(s) unique ou multiples, au sein d'un foyer de condensation alvéolaire (abcès ou pneumonie nécrosante), ou au sein d'opacités arrondies multiples (abcès hématogènes ou bronchopneumonie abcédée);
-
–
hyperleucocytose ;
-
–
élévation de la CRP et/ou de la procalcitonine lorsqu'elles sont dosées.
Dans de tels cas, Streptococcus pneumoniae, Legionella pneumophila sérogroupe 1, Chlamydia pneumoniae, Mycoplasma pneumoniae sont pratiquement hors de cause.
Les bactéries responsables diffèrent (tableau 2 ).
Tableau 2.
Causes de pneumonie infectieuse sévère, se traduisant sous forme d'opacité(s) excavée(s) chez un adulte avec comorbidité
|
À noter qu'avant d'aboutir à la nécrose et à l'excavation, les infections causées par ces bactéries peuvent être à l'origine, à un stade initial, d'un foyer de condensation alvéolaire unique (pneumonie), ou de condensations multifocales et bilatérales associées à des nodules et à des opacités linéaires branchées centrolobulaires (bronchopneumonie).
Chez ces malades ayant une ou plusieurs comorbidité(s) et suspects d'infection à bactérie nécrosante, les algorithmes incluent volontiers la tomodensitométrie thoracique et les prélèvements respiratoires invasifs nécessaires à une documentation microbiologique.
Dans de tels cas, la tomodensitométrie thoracique, réalisée avec injection intraveineuse de produit de contraste, peut :
-
–
confirmer le caractère nécrosant de l'infection si elle objective un abcès, au stade précavitaire (figure 3 ) (plages d'opacité de densité liquidienne, sans rehaussement après injection, et sans vaisseau pulmonaire ou bronche visible au sein de l'opacité) ou au stade cavitaire (figure 4 ) (cavité avec : limites internes, lisses et régulières ; contenu hydroaérique avec niveau horizontal, ou aérique avec présence d'éventuels débris nécrotiques ; limites externes en partie masquées par l'opacité de l'exsudat alvéolaire qui l'entoure) ;
-
–
visualiser, à l'inverse, ce qui n'est pas une excavation mais une pneumonie sur poumon emphysémateux (figure 5A ) ou avec alvéologramme restant (figure 5B) ;
-
–
préciser le nombre, la situation géographique et l'aspect arrondi ou non de la ou des opacité(s), abcédée(s) ou en voie d'abcédation ;
-
–
révéler l'existence d'épanchement pleural associé, uni- ou bilatéral, souvent déjà cloisonné avec collection(s) intrapleurale(s) purulente(s) ou empyème (figure 6 ) ; parfois, l'examen tomodensitométrique peut montrer la rupture de l'abcès dans la plèvre (figure 7 ) ;
-
–
révéler l'existence d'une lésion sous-jacente, bronchique (figure 8 ; cancer, dilatation des bronches) ou pulmonaire (emphysème, séquestration), rendant compte de la pneumonie et de son caractère nécrosant.
Figure 3.

Coupe TDM, en fenêtre médiastinale, avec injection, montrant une zone nécrotique ne prenant pas le contraste au sein d'un foyer du segment dorsal du lobe supérieur droit en rapport avec une pneumopathie abcédée à pyocyanique sauvage. Présence de quelques bulles d'air au sein de la zone de nécrose.
Figure 4.
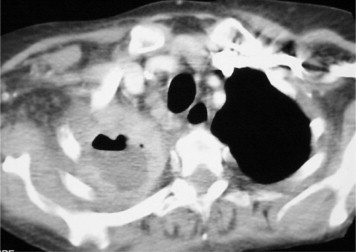
Coupe TDM, avec injection, en fenêtre médiastinale. Présence d'un niveau hydroaérique au sein d'une image abcédée avec zone de nécrose et liquidienne sous-jacente à ce niveau (stade cavitaire).
Figure 5.

A : Coupe TDM, en fenêtre parenchymateuse, montrant un foyer de condensation lobaire supérieur droit, siège de nombreuses clartés qui, manifestement, au regard du poumon controlatéral, correspondent à des zones d'emphysème non atteintes par la pneumopathie. B : Coupe TDM, en fenêtre parenchymateuse. Présence d'une clarté au sein de la lésion basithoracique gauche correspondant à du poumon normal non atteint par la pneumopathie.
Figure 6.
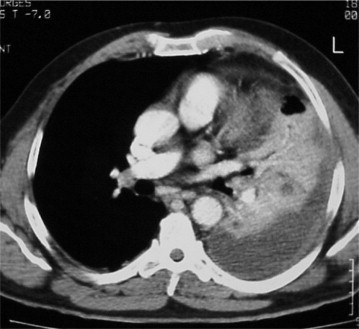
Coupe TDM, avec injection, en fenêtre médiastinale, montrant le foyer de condensation avec, en son centre, quelques images nécrotiques hypodenses. Épanchement pleural avec épaississement pleural régulier prenant le contraste témoignant d'un épanchement pleural purulent.
Figure 7.

Coupe TDM, avec injection, en fenêtre médiastinale. Visualisation de la rupture de la zone intraparenchymateuse hypodense, dans la plèvre, siège de niveaux hydroaériques témoins d'un pyopneumothorax.
Figure 8.

Coupes TDM, chez le même patient, avec injection, montrant une image hydrique à l'intérieur du tronc intermédiaire témoignant d'une inhalation (A) ; la pneumopathie rétractile sousjacente (B).
Lorsqu'elle est réalisée, la tomodensitométrie thoracique montre plus volontiers, mais cela n'a rien d'exclusif :
-
–
un foyer de condensation alvéolaire, systématisé ou non, siège de plusieurs zones nécrotiques, excavées ou en voie d'excavation (pneumonie nécrosante), si Klebsiella pneumoniae ou des bactéries anaérobies sont en cause ;
-
–
de multiples plages de condensation alvéolaire et de multiples nodules, de taille différente, dispersés de façon hétérogène, évoluant à des stades de nécrose différents (bronchopneumonie) (figure 9 ), quand les autres entérobactéries ou Pseudomonas aeruginosa sont responsables de l'infection ;
-
–
des opacités multiples, bilatérales, prédominant aux bases, volontiers périphériques et sous-pleurales, de forme arrondie ou triangulaire à sommet tronqué et à large base d'implantation pleurale (figure 10 ), lorsque Staphylococcus aureus ou une autre bactérie sont responsables d'une dissémination hématogène.
Figure 9.

Coupe TDM, en fenêtre parenchymateuse, montrant des opacités nodulaires centrolobulaires à prédominance basithoracique gauche, quelques épaississements septaux avec bulles sous-pleurales à droite témoignant d'une bronchopneumopathie chronique obstructive (BPCO) de même que les épaississements bronchiques visibles à droite. Aspect de bronchopneumonie sur BPCO.
Figure 10.

Coupe TDM, en fenêtre parenchymateuse, montrant des opacités nodulaires disséminées et une opacité triangulaire sous-pleurale du lobe supérieur droit en rapport avec une pneumopathie à staphylocoque.
C'est chez ces patients que l'on observe plus volontiers les pleurésies purulentes avec cloisonnements intrapleuraux (figure 11 ) et constitution d'empyèmes relevant d'un drainage thoracique. Ici, la tomodensitométrie thoracique joue un double rôle.
Figure 11.
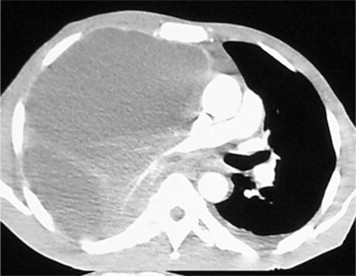
Coupe TDM, en fenêtre médiastinale, avec injection, montrant un volumineux épanchement pleural cloisonné et compressif en rapport avec une pleurésie à pyocyanique.
D'une part, elle permet la distinction entre abcès pulmonaire et empyème. En effet, les critères radiographiques standard proposés (pour l'abcès : forme sphérique, angles aigus de raccordement avec la paroi, même longueur du niveau liquide sur deux incidences orthogonales ; pour l'empyème : forme lenticulaire, angles de raccordement en pente douce, grande différence de longueur des niveaux liquides sur deux incidences orthogonales) peuvent faire défaut, notamment quand la collection est volumineuse. La tomodensitométrie thoracique avec injection de produit de contraste devient alors indispensable pour apporter des critères décisifs. Outre les angles de raccordement avec la paroi déjà évoqués, l'abcès a des limites internes irrégulières et des limites externes floues. L'épaisseur de ses parois est irrégulière et les vaisseaux et bronches du parenchyme pulmonaire voisin s'interrompent brutalement en regard (figure 12 ). À l'inverse, l'empyème est cloisonné entre les deux feuillets pleuraux épaissis de manière régulière (figure 13A ), de densité rehaussée après injection, et les vaisseaux et bronches du parenchyme pulmonaire voisin sont ici refoulés et étirés par l'empyème (figure 13B).
Figure 12.

Coupe TDM, en fenêtre médiastinale, avec injection. Foyer alvéolaire du lobe inférieur droit avec zones de nécrose centrale. On voit les artères s'arrêter net sur la zone de nécrose.
Figure 13.

A : Coupe TDM, en fenêtre médiastinale, avec injection. Visualisation d'un empyème avec plèvre épaissie prenant le contraste et régulière. B : Même technique. Image d'empyème avec refoulement du parenchyme qui s'évase de part et d'autre de l'image.
D'autre part, la tomodensitométrie thoracique permet de drainer les empyèmes avec le maximum de sécurité : diagnostic sémiologique différentiel avec un abcès, drainage guidé par la méthode de Sedlinger (figure 14 ).
Figure 14.

Coupe TDM, réalisée en décubitus ventral, sans injection de produit de contraste. Empyème pararachidien droit. Le drain a été mis en place sous TDM par voie postérieure, par méthode de Sedlinger.
Par ailleurs, au cours des ces pneumonies abcédées, une hémoptysie peut révéler une lésion vasculaire pulmonaire en voie de fissuration (figure 15 ), justifiant alors une vaso-occlusion ou une intervention chirurgicale.
Figure 15.

Reconstruction MIP, en fenêtre médiastinale, montrant au sein de la condensation rétractile du poumon gauche, un faux anévrisme de Rasmusen rattaché à l'artère pulmonaire gauche. Tuberculose.
Opacités diffuses fébriles
La démarche est enfin de complexité maximale en cas d'opacités diffuses fébriles.
Ici, la cause peut être d'origine infectieuse mais aussi toxique ou immunologique (tableau 3 ). La tomodensitométrie, indispensable dans cette situation une fois l'insuffisance cardiaque écartée, n'est qu'un élément de la discussion étiologique à côté des circonstances de survenue (exposition allergénique, microbienne ou médicamenteuse ; contexte viral endémique ou épidémique), de la sémiologie extrarespiratoire (symptômes ou signes de sida ignoré jusque-là, de collagénose ou de vascularite) et des données du lavage bronchoalvéolaire (LBA), qui s'impose dans tous les cas.
Tableau 3.
Causes d'opacités diffuses s'accompagnant de fièvre, chez l'adulte sans comorbidité connue
| Pneumocystose (révélant un sida) | Pneumopathie médicamenteuse |
| Tuberculose (miliaire) | Pneumopathie d'hypersensibilité |
| Virose (classique ou émergente) | Collagénose |
| Leptospirose | Vascularite |
| Staphylococcus aureus (sécréteur de la toxine de Panton et Valentine) | Pneumopathie du toxicomane Fibrose pulmonaire aiguë |
| Chlamydia pneumoniæ Mycoplasma pneumoniæ | Parasitose autochtone (larva migrans) ou mycose tropicale (primo-infection explosive) |
En fait, la tomodensitométrie thoracique est ici rarement décisive.
Des opacités diffuses et bilatérales en verre dépoli évoquent une pneumocystose révélant un sida ; toutefois, elles peuvent parfois épargner certains lobules sains ou s'associer à des zones de condensation alvéolaire (figure 16 ).
Figure 16.

Coupe TDM, en fenêtre parenchymateuse. Aspect en verre dépoli diffus avec légère traction sur les bronches. Image d'emphysème médiastinal. Aspect en rapport avec une pneumocystose chez un patient atteint de sida.
Une miliaire caractérisée par une multitude de petits nodules (1–3 mm) distribués dans toutes les zones pulmonaires évoque avant tout une tuberculose (figure 17 ) et, dans un contexte endémique, une histoplasmose, une coccidioïmycose ou une filariose. Cet aspect peut précéder un SDRA, d'où l'intérêt de toujours revenir aux documents initiaux.
Figure 17.
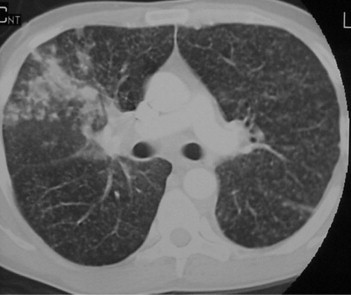
Coupe TDM, en fenêtre parenchymateuse, montrant des images micronodulaires de 3 mm de diamètre, régulières, disposées at random dans l'ensemble du poumon en rapport avec une miliaire tuberculeuse. On note de plus, au niveau du lobe supérieur droit, dans son segment ventral, des opacités nodulaires floues centrolobulaires correspondant à une dissémination bronchogène.
L'inventaire précis des anomalies associées aux opacités diffuses fournit parfois des éléments d'appoint :
-
–
un épanchement pleural bilatéral (avant la mise sous ventilation mécanique invasive) est en faveur d'une insuffisance cardiaque et doit faire évoquer un oedème pulmonaire hémodynamique résultant d'une myocardite ou d'une endocardite gauche ;
-
–
des adénopathies médiastinales, surtout si elles sont le siège d'une hypodensité centrale avec rehaussement annulaire périphérique (figure 18 ), suggèrent une origine tuberculeuse plus que fongique tropicale ou qu'une infection à Mycoplasma pneumoniae. Elles peuvent également correspondre à un cancer, notamment lymphome, facteur de risque d'une pneumonie associée ;
-
–
des nodules centrolobulaires, de taille différente, mesurant de 5 à 10 mm, groupés dans un territoire ou répartis de façon hétérogène, doivent faire rechercher une tuberculose (voir figure 17).
Figure 18.

Coupe TDM, en fenêtre médiastinale, avec injection. Visualisation, en prétrachéal droit, d'une image ganglionnaire à centre hypodense, avec prise de constraste périphérique en rapport avec une tuberculose ganglionnaire chez un patient nord-africain.
Malade immunocompétent, au cours de l'évolution
Lorsque le tableau clinique initial revêt toutes les caractéristiques clinicoradiologiques d'une pneumonie bactérienne usuelle, une évolution non résolutive soulève un certain nombre d'hypothèses :
-
–
mauvais contrôle ou non-contrôle de l'infection initiale, rarement du fait d'une antibiothérapie inadéquate, plus souvent du fait d'une collection purulente secondaire relevant d'un drainage mécanique (empyème +++ péricardite voire sinusite) ;
-
–
survenue d'une complication liée au contexte de réanimation : pneumonie nosocomiale, oedème pulmonaire, embolie pulmonaire ;
-
–
erreur diagnostique initiale, la « pneumonie » n'étant ni bactérienne usuelle (germe nécrosant et/ou à croissance lente et/ou d'origine tropicale), ni même d'origine infectieuse (pneumonie organisée ; hémorragie intra-alvéolaire ; pneumopathie infiltrante, immunologique, toxique et/ou médicamenteuse).
Dans ce contexte, la tomodensitométrie thoracique s'impose mais, là encore, elle ne constitue qu'un élément du trépied de la discussion diagnostique, avec la reprise des données cliniques et les résultats du bilan microbiologique et immunologique. Son apport diffère selon qu'elle objective :
-
–
la constitution d'épanchement(s) pleural(aux) et/ou péricardique(s), d'origine bactérienne ou hémodynamique, surajouté(s) ;
-
–
l'excavation du foyer de condensation alvéolaire initial révélant le caractère en fait nécrosant du germe en cause ;
-
–
la diffusion homogène à l'ensemble du parenchyme pulmonaire de l'opacité qui paraissait localisée sur la radiographie thoracique initiale, relançant la discussion diagnostique (hémorragie intra-alvéolaire, pneumopathie infiltrante, oedème surajouté) ;
-
–
l'apparition de nouvelles opacités parenchymateuses localisées : foyers de condensation alvéolaires ou nodules, résultant de l'infection initiale, d'une erreur diagnostique initiale (pneumonie organisée, vascularite) ou d'une complication surajoutée (pneumonie nosocomiale, infarctus pulmonaire).
Surtout, la tomodensitométrie thoracique joue ici un rôle majeur dans la détermination et la localisation des opacités, justifiant un prélèvement diagnostique invasif. Elle peut également visualiser, du fait de l'injection, d'éventuelles embolies pulmonaires, cruoriques ou septiques.
Malade immunodéprimé
Il est logique d'envisager trois situations d'immunodépression différant entre elles par l'épidémiologie des infections en cause, la fréquence et la diversité des diagnostics alternatifs non infectieux, le rapport bénéfices/risques des investigations invasives, le caractère rationnel ou, au contraire, irrationnel d'un traitement probabiliste.
Malade aplasique
Le fait majeur est l'absence de polynucléaires neutrophiles. De fait, la bactérie ne peut générer ici de pneumonie franche et, moins encore, d'abcès.
Ainsi, les opacités observées chez l'aplasique admis en réanimation sont habituellement diffuses, hétérogènes dans leur aspect et leur répartition, et aspécifiques. Elles peuvent tout aussi bien traduire : une pneumonie, due à un bacille Gram négatif, à Staphylococcus aureus, à Streptococcus sp. ; ou bien un SDRA par choc infectieux, une hémorragie intra-alvéolaire ou une pneumopathie médicamenteuse.
Dans cette situation, où le déplacement du malade en dehors d'une éventuelle atmosphère stérile doit être réfléchi, la tomodensitométrie thoracique n'est pas indiquée en première intention. Néanmoins, en cas d'échec de l'antibiothérapie probabiliste habituellement instituée, elle se justifie si l'aplasie se cumule avec une autre immunodépression préexistante et/ou si l'on approche le fatidique 9e jour d'aplasie qui voit l'émergence des mycoses pulmonaires.
Si elle révèle la présence d'opacités arrondies, associées ou non à des plages de condensation alvéolaire, la tomodensitométrie thoracique suggère alors une mycose pulmonaire invasive (aspergillose ou mucormycose), à l'origine de zones nécrotiques et hémorragiques par envahissement vasculaire et thrombose. Si, à un stade précoce, ces opacités sont des nodules denses cernés d'un halo de verre dépoli (signe du halo), ou que, à un stade tardif, ces opacités s'excavent avec un croissant aérique entourant une petite opacité plus ou moins ronde en position excentrée (signe du croissant), l'aspect est quasi pathognomonique de mycose invasive (figures 19 et 20 ).
Figure 19.

Coupe TDM, en fenêtre parenchymateuse. Image nodulaire avec signe du halo très évocateur d'aspergillose aiguë invasive.
Figure 20.

Coupe TDM en fenêtre médiastinale, sans injection de produit de contraste, chez une patiente en aplasie, montrant un volumineux foyer lobaire inférieur droit, siège d'une excavation linéaire arciforme signant l'aspergillose aiguë invasive. Noter le contact potentiel avec l'artère pulmonaire intermédiaire et l'épanchement pleural sous-jacent.
Dans la situation où l'aspergillose pulmonaire invasive est microbiologiquement confirmée, la tomodensitométrie thoracique participe également à la discussion thérapeutique. Elle alerte le clinicien d'une menace d'hémoptysie massive lorsqu'elle objective une grande proximité de la lésion aspergillaire et des gros vaisseaux pulmonaires (figure 20). Elle participe alors à la discussion chirurgicale en précisant si la lésion est unique ou multiple, si elle est localisée à un lobe ou si elle le déborde.
Malade atteint du sida
L'immunodépression est ici d'abord cellulaire mais aussi humorale. Ainsi, à côté des germes opportunistes (y compris herpèsvirus humain 8 [HHV-8] à l'origine du sarcome de Kaposi, et virus d'Epstein-Barr à l'origine de prolifération lymphomateuses de type B), des bactéries encapsulées comme Streptococcus pneumoniae ou Haemophilus influenzae peuvent également être responsables de pneumonie, et ce à un stade très précoce de la maladie.
En pratique, le réanimateur peut être confronté ici à quatre grandes situations.
Situation 1
-
–
Séropositivité VIH connue ou ignorée.
-
–
Absence de prophylaxie par Cotrimoxazole®.
-
–
Taux sanguin de lymphocytes T CD4 > 200/mm3.
-
–
Début brutal de la pneumonie.
-
–
Fièvre élevée.
-
–
Syndrome de condensation alvéolaire, avec ou sans excavation, sur la radiographie standard.
Les deux diagnostics à évoquer sont une pneumonie bactérienne, notamment à Streptococcus pneumoniae ou Haemophilus influenzae, ou une tuberculose.
La stratégie de prise en charge privilégie en première ligne la mise en route d'une antibiothérapie probabiliste et la recherche de bacilles acido-alcoolo-resistants (BAAR) dans les prélèvements respiratoires.
La tomodensitométrie thoracique ne se justifie qu'en cas d'échec de l'antibiothérapie probabiliste et de négativité des recherches de BAAR, pour préciser la sémiologie radiologique et guider les prélèvements diagnostiques invasifs.
Situation 2
-
–
Séropositivité VIH connue ou ignorée.
-
–
Absence de prophylaxie par Cotrimoxazole®.
-
–
Taux sanguin de lymphocytes T CD4 < 200/mm3.
-
–
Fièvre élevée sans signe extrarespiratoire.
-
–
Opacités diffuses, d'aspect et de répartition relativement homogènes sur la radiographie standard.
-
–
Survenue progressive (21 jours) de l'insuffisance respiratoire.
Le diagnostic à évoquer est une pneumocystose.
La stratégie de prise en charge privilégie en première ligne la mise en route d'un traitement associant Cotrimoxazole® et stéroïdes ainsi que la recherche de Pneumocystis jirovecii dans les produits recueillis au cours du LBA.
La tomodensitométrie thoracique qui montrerait des opacités en verre dépoli diffuses, épargnant ou non certains lobules, associées ou non à des zones de condensation alvéolaire (figure 21 ), n'a pas d'indication en première intention. Elle est en revanche justifiée en cas d'évolution défavorable pour la recherche de complications de la pneumocystose (cavités à paroi fine [figure 22 ], pneumothorax [figure 23 ], évolution fibrosante [figure 24 ]), ou d'anomalies ne pouvant être attribuées à la pneumocystose et soulevant l'hypothèse d'une co-infection. Ainsi, la présence d'adénopathies médiastinales, de nodules, de pleurésie, de péricardite est, dans ce contexte, hautement suggestive de tuberculose ou de mycose associée à la pneumocystose.
Figure 21.

Coupe TDM, en fenêtre parenchymateuse, montrant des opacités en verre dépoli à prédominance péribronchovasculaire ainsi qu'une image nodulaire excavée. Il s'agissait d'une pneumocystose chez un patient atteint de sida.
Figure 22.

Coupe TDM, en fenêtre parenchymateuse, montrant des lésions en verre dépoli diffuses mais, surtout, une image cavitaire à parois fines évoquant un pneumatocèle et correspondant à un patient atteint de sida ayant une pneumocystose. Une telle lésion proche de la plèvre doit faire craindre l'apparition d'un pneumothorax.
Figure 23.
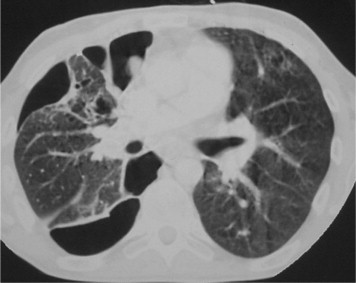
Coupe TDM, en fenêtre parenchymateuse. Visualisation d'un pneumothorax cloisonné droit en rapport avec des ruptures de cavités « kystiques » de pneumocystose chez un malade atteint de sida.
Figure 24.

Coupe TDM, en fenêtre parenchymateuse. Aspect en verre dépoli avec signe de rétraction et bronchectasies de traction évoquant une évolution fibrosante de la pneumocystose chez un patient atteint de sida.
Situation 3
-
–
Séropositivité VIH connue.
-
–
Prophylaxie par Cotrimoxazole®.
-
–
Trithérapie antirétrovirale (ARV) administrée mais en échec.
-
–
Taux sanguin de lymphocytes T CD4 < 100/mm3.
-
–
Fièvre élevée ± signes extrarespiratoires.
-
–
Opacités diffuses mais d'aspect et de répartition inhomogènes sur la radiographie standard.
-
–
Survenue rapide (3 à 8 jours) de l'insuffisance respiratoire.
Les diagnostics à évoquer sont ceux d'infections opportunistes autres que la pneumocystose : tuberculose, cryptococcose, toxoplasmose, histoplasmose ou coccidioïdomycose réactivée, voire hémorragie intra-alvéolaire d'origine cytomégalique.
La stratégie de prise en charge privilégie en urgence la tomodensitométrie thoracique et les prélèvements respiratoires invasifs à côté d'éventuels prélèvements extrarespiratoires dictés par les hypothèses diagnostiques.
Ici encore, la tomodensitométrie thoracique précise le type et la localisation des opacités qui apparaissent comme diffuses sur la radiographie standard, à savoir, outre les zones de verre dépoli et/ou de condensation alvéolaire : des adénopathies médiastinales et hilaires nécrotiques, des nodules, une pleurésie, une péricardite évoquant une tuberculose ou une mycose ; des macronodules ou des masses pouvant traduire une tuberculose mais aussi une toxoplasmose, un lymphome ou un sarcome de Kaposi ; une miliaire correspondant habituellement à une tuberculose et, exceptionnellement, à une mycose (figure 25 ).
Figure 25.

Coupe TDM, en fenêtre parenchymateuse, montrant de nombreuses images nodulaires à contours flous, alvéolaires, en rapport avec une toxoplasmose chez un patient atteint de sida.
Situation 4
-
–
Séropositivité VIH connue.
-
–
Prophylaxie par Cotrimoxazole®.
-
–
Trithérapie ARV récemment débutée (1 à 3 mois).
-
–
Correction rapide de l'immunodépression locale (remontée spectaculaire des lymphocytes T CD4 en 1 à 3 mois).
-
–
Apparition rapide de nouvelles opacités ou majoration rapide d'opacités présentes au début de la trithérapie.
Le diagnostic à évoquer est celui de réaction paradoxale : majoration lésionnelle d'une infection pulmonaire, connue ou ignorée lors de la mise sous trithérapie.
La stratégie de prise en charge inclut systématiquement une tomodensitométrie thoracique. Celle-ci aide parfois le clinicien, lorsque l'imagerie initiale était anormale, à opter soit pour la majoration de l'infection connue, soit pour l'extériorisation d'une co-infection ignorée. Dans tous les cas, elle localise la ou les lésions à prélever.
Malade immunodéprimé sans aplasie ni sida
Ce dernier paragraphe concerne en fait des immunodépressions, cellulaires et/ou humorales, de type et d'intensité très variables selon les maladies en cause, les traitements administrés, et pour une même maladie, les stades évolutifs.
Ici encore et très schématiquement, le réanimateur peut être confronté à trois grandes situations.
Situation 1
-
–
Début rapide (1 à 8 jours) de la pneumonie.
-
–
Absence de prophylaxie par Cotrimoxazole®.
-
–
Fièvre élevée sans signe extrarespiratoire.
-
–
Opacités diffuses d'aspect et de répartition relativement homogènes sur la radiographie thoracique.
Les diagnostics à évoquer sont une pneumonie à germe opportuniste – pneumocystose ; virose (cytomégalovirus [CMV], virus varicelle-zona [VZV], virus respiratoire syncitial, adénovirus), tuberculose, toxoplasmose, etc. –, ou une pneumopathie médicamenteuse (méthotrexate, gemcitabine, etc.).
L'examen clé est le LBA.
La tomodensitométrie thoracique peut avoir un intérêt avant la pratique du LBA, qu'elle ne doit jamais retarder si elle révèle des anomalies inattendues (notamment des nodules), et localise alors des zones à prélever préférentiellement.
Elle est systématique après le LBA si celui-ci n'est pas ou reste peu contributif. Dans cette situation, son apport diagnostique reste très variable, faute d'aspects spécifiques (figures 26 et 27 ).
Figure 26.

Coupe TDM, en fenêtre parenchymateuse, montrant un aspect en verre dépoli diffus en rapport avec une pneumocystose chez un patient greffé d'organe.
Figure 27.

Coupe TDM, en fenêtre parenchymateuse, montrant un syndrome alvéolaire bilatéral diffus en rapport avec une cytomégalovirose chez un patient greffé rénal.
Situation 2
-
–
Début brutal.
-
–
Fièvre élevée.
-
–
Possible choc associé.
-
–
Syndrome de condensation alvéolaire retrouvé à l'examen physique et à l'examen radiographique standard.
Le diagnostic à évoquer est une pneumonie bactérienne, à bactérie encapsulée, ou à Legionella sp. notamment.
La stratégie diagnostique privilégie les hémocultures, la recherche urinaire des antigènes spécifiques et l'administration en urgence d'un traitement antibiotique probabiliste.
La tomodensitométrie thoracique est indiquée en seconde intention si l'évolution n'est pas favorable et si l'enquête microbiologique reste négative. Lorsqu'elle révèle l'existence d'un ou de plusieurs foyer(s) de condensation alvéolaire, il peut s'agir : de pneumonie à Streptococcus pneumoniae (figure 28 ), Haemophilus influenzae ou Legionella sp. (figure 29 ), lentement résolutive ; il peut s'agir également de pneumonie liée à une bactérie ayant un potentiel nécrosant, parfois favorisée par des dilatations des bronches sous-jacentes, comme c'est le cas au cours de la leucémie lymphoïde chronique ou de certaines collagénoses. Enfin, il faudra évoquer : une pneumonie due à un germe à croissance lente comme un champignon (Aspergillus fumigatus), une bactérie (Nocardia sp., Rhodococcus equi) ou une mycobactérie (tuberculose ou pneumonie à mycobactérie atypique), comme c'est le cas au cours des leucémies à tricholeucocytes (mais dans cette éventualité, l'insuffisance respiratoire est le plus souvent progressive) ; une pneumonie organisée ou un lymphome mais, là encore, l'insuffisance respiratoire y est habituellement progressive.
Figure 28.

Coupe TDM, en fenêtre parenchymateuse, montrant trois foyers alvéolaires, un du segment ventral du lobe inférieur gauche, un du segment postérobasal droit, un du lobe moyen, en rapport avec une infection à pneumocoque chez un patient drépanocytaire asplénique.
Figure 29.
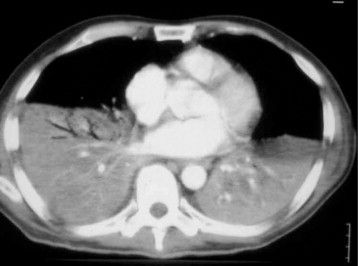
Coupe TDM, en fenêtre médiastinale, avec injection, montrant des foyers alvéolaires bibasaux en rapport avec une légionellose chez un patient atteint de leucémie à tricholeucocytes.
Situation 3
-
–
Début rapide.
-
–
Fièvre ± élevée.
-
–
Possible choc associé.
-
–
Nodules ou foyers de condensation alvéolaire arrondis évoluant vers la bilatéralisation et l'excavation.
Le diagnostic à évoquer est celui de mycose opportuniste, notamment l'aspergillose. Cependant, des foyers de condensation alvéolaire arrondis, y compris excavés, peuvent également résulter d'infection bactérienne, à Staphylococcus aureus ou à Legionella sp. D'autres germes à potentiel nécrosant d'origine nosocomiale peuvent aussi être en cause, notamment lorsque le malade bénéficie d'un dispositif implantable pour chimiothérapie. Plus rarement, ces nodules peuvent traduire des infarctus pulmonaires (en cas de syndrome des antiphospholipides notamment), des pneumonies organisées d'aspect arrondi, des localisations tumorales (lymphome, choriocarcinome métastasé, entre autres).
Compte tenu des difficultés diagnostiques, la tomodensitométrie thoracique est systématique. Son principal mérite est de localiser les lésions, de déterminer les sites de prélèvements et d'aider le clinicien à choisir les modalités optimales de ces prélèvements : bronchofibroscopie avec aspiration et LBA ; biopsie pulmonaire à thorax ouvert ; médiastinoscopie ; voire biopsie pulmonaire par voie transbronchique ou par thoracoscopie, de réalisation toujours délicate et discutée en cas d'insuffisance respiratoire aiguë.
Conclusion
La tomodensitométrie thoracique peut aider le clinicien dans le diagnostic et le traitement de certaines pneumonies, notamment chez l'immunodéprimé.
Elle ne doit cependant pas être systématique. Sa demande doit être légitimée par une question précise, et il convient de toujours prendre en compte le rapport bénéfices/risques attendus. Sa réalisation suppose enfin que toutes les mesures de sécurité soient prises tant pendant le transport du malade que pendant la réalisation de l'examen.
Bibliographie
- 1.Vasile N., Brun-Buisson C., Brochard L. Pneumopathies, abcès pulmonaires et empyèmes. In: Frija J., Schlemmer B., Brochard L., editors. Scanner et IRM du thorax. Collection d'anesthésiologie et de réanimation n° 39. Masson; Paris: 1995. pp. 76–86. [Google Scholar]
- 2.Tocino I. Chest imaging in the intensive care unit. Eur J Radiology. 1996;23:46–57. doi: 10.1016/0720-048x(96)88279-9. [DOI] [PubMed] [Google Scholar]
- 3.Miller W., Tino G., Friedburg J., Thoracic C.T. in the intensive care unit: Assessment of clinical usefulness. Radiology. 1998;209:491–498. doi: 10.1148/radiology.209.2.9807579. [DOI] [PubMed] [Google Scholar]
- 4.Trotman-Dickenson B. Radiology in the intensive care unit. J Intensive Care Med. Part 1. 2003;18:198–210. doi: 10.1177/0885066603251897. Part 2. 2003; 18: 239-52. [DOI] [PubMed] [Google Scholar]
- 5.Carette M.F. Parrot A, Mayaud C. Pneumopathies infectieuses bactériennes. In: Jeanbourquin D., editor. Imagerie thoracique de l'adulte. Masson; Paris: 2004. pp. 287–299. [Google Scholar]
- 6.Franquet T. Imaging of pulmonary infections: trends and algorithms. Eur Respir Mon. 2004;30:51–75. [Google Scholar]
- 7.Grenier P., Cordeau M.P., Samson L., Mouelhi M. Infections pulmonaires. In: Grenier P., editor. Imagerie thoracique de l'adulte. Médecine-Sciences Flammarion; Paris: 2006. pp. 297–345. [Google Scholar]
- 8.Carette M.F., Mayaud C., Bigot J.M. Imaging of AIDS. B.C. Decker; Philadelphia: 1988. Pulmonary and Mediastinal involvement in AIDS; pp. 25–56. [Google Scholar]
- 9.Carette M.F., Mayaud C. Pneumopathies de l'immunodéprimé. In: Frija J., Schlemmer B., Brochard L., editors. Scanner et IRM du thorax. Collection d'anesthésiologie et de réanimation n° 39. Masson; Paris: 1995. pp. 87–106. [Google Scholar]
- 10.Mayaud C., Cadranel J. A persistent challenge: the diagnosis of respiratory disease in the non-AIDS immunocompromised host. Thorax. 2000;55:511–517. doi: 10.1136/thorax.55.6.511. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Mayaud C., Cadranel J. AIDS and the lung in a changing world. Thorax. 2001;56:423–426. doi: 10.1136/thorax.56.6.423. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Fartoukh M., Mayaud C. Atteintes respiratoires aiguës en onco-hématologie. In: Blot F., Conti G., editors. Réanimation en onco-hématologie. Elsevier; Paris: 2004. pp. 513–518. [Google Scholar]
- 13.Carette M.F., Fartoukh M., Khalil A. Infections pulmonaires chez l'immunodéprimé. In: Grenier P., editor. Imagerie thoracique de l'adulte. Médecine-Sciences Flammarion; Paris: 2006. pp. 346–365. [Google Scholar]


