Introducción
Las infecciones respiratorias agudas (IRA) representan la primera causa de morbilidad en el entorno familiar. Se estima que en los países desarrollados más de la mitad de las infecciones agudas producidas por virus son de tipo respiratorio, siendo las de mayor incidencia el resfriado común y la gripe. Esta patología puede afectar a todo el tracto respiratorio, desde la nasofaringe hasta los alvéolos pulmonares, aunque cada virus respiratorio presenta mayor tropismo por regiones anatómicas concretas. La mayoría son procesos benignos, salvo en pacientes en edades extremas de la vida o inmunocomprometidos, que pueden evolucionar a cuadros graves o mortales. Los virus que no producen inmunidad protectora duradera (virus respiratorio sincitial [VRS], virus parainfluenza, metaneumovirus) suelen afectar más al tracto respiratorio inferior y la afección es más grave cuanto menor es la edad. Otros virus, como el del herpes simple en inmunodeprimidos y algunos enterovirus pueden producir cuadros respiratorios, aunque no de forma habitual (Tabla 1, Tabla 2 ).
Tabla 1.
Características biológicas de los principales virus respiratorios
| Virus | Ácido nucleico | Tamaño | Envoltura | Tipos y subtipos, grupos, serotipos |
|---|---|---|---|---|
| Virus de la gripe | ARNmc (8 segmentos) | 100-120 nm pleomórfico | Sí | A (H3N2 y H1N1) y B (múltiples variantes menores) |
| Virus respiratorio sincitial | ARNmc | 150-300 nm pleomórfico | Sí | Grupos A y B (distintos subtipos) |
| Virus parainfluenza | ARNmc | 150-250 nm pleomórfico | Sí | Tipos 1, 2, 3, 4A y 4B |
| Metaneumovirus | ARNmc | 150-500 nmpleomórfico | Sí | Linajes genéticos A (A1-A2) y B (B1-B2) |
| Coronavirus | ARNmc | 80-220 nm pleomórfico | Sí | 229E, OC43, SARSCoV, NL63CoV, HKU1CoV |
| Rhinovirus | ARNmc | 22-27 nm | Sí | ≥ 100 serotipos |
| Adenovirus | ADNbc | 70-80 nm | No | Grupos A al G (> 50 serotipos |
| Enterovirus | ARNmc | 22-27 nm | No | Coxackie A (10, 21, 24) y B2, ECHO (varios serotipos) |
| Virus del herpes simple | ADNbc | 150-220 nm pleomórfico | Sí | Tipo 1 y 2 |
| Bocavirus humano | ADNmc | 18-26 nm | No | |
| Polyomavirus | ADNbc | 40–50 nm | No | KI y WU |
Tabla 2.
Etiología de los principales síndromes respiratorios víricos en la población infantil y adulta
| Población | Síndrome | Frecuente | Ocasional |
|---|---|---|---|
| Infantil | Catarro, rinitis, faringitis | Rinovirus Coronavirus Parainfluenza 4A y 4B (> 7 años) Adenovirus 1, 2, 3 y 5 VRS A y B (> 5 años) Bocavirus |
Parainfluenza 2 Enterovirus Virus de la gripe B |
| Fiebre faringoconjuntival | Adenovirus 3 y 7 | Adenovirus 1,2 y 5 | |
| Faringoamigdalitis | Virus de la gripe A y B | ||
| Laringotraqueitis, croup | Parainfluenza 1, 2 | Virus de la gripe A enterovirus | |
| Bronquitis | Parainfluenza 1, 3 VRS Gripe A y B |
Rinovirus | |
| Bronquiolitis | VRS Parainfluenza 3 Bocavirus |
Metaneumovirus | |
| Neumonía | VRS Parainfluenza 3 |
Adenovirus 1, 3, 7 Enterovirus Virus de la gripe A y B |
|
| Adulta | Catarro, rinitis, faringitis | Rinovirus Coronavirus Gripe A y B |
Parainfluenza 1, 3 VRS A y B Metaneumovirus |
| Faringoamigdalitis | Adenovirus 3, 4, 7, 14 y 21 | Virus del herpes simple | |
| Bronquitis | Rinovirus Gripe A y B |
Parainfluenza 1, 3 VRS A y B |
|
| Neumonia | Gripe A | Adenovirus 4 y 7 |
VRS: virus respiratoriosincitial.
Todos los virus respiratorios se eliminan en concentraciones altas por la nasofaringe, durante varios días, lo que facilita su transmisión horizontal. Estos virus se propagan fácilmente por gotitas de Pflügge y núcleos goticulares de Wells formados al hablar, toser y estornudar. En algunos virus, también contribuyen a propagar la infección los fómites y superficies recientemente contaminados por secreciones respiratorias.
Casi todos ellos tienen una distribución mundial y una marcada estacionalidad circunscrita a los meses fríos del año, incluidos el otoño y el inicio de la primavera. La coincidencia estacional de muchos de ellos (gripe, VRS, metaneumovirus, virus parainfluenza y rinovirus) unido a la diversidad de cuadros clínicos que pueden ser producidos por un mismo virus hace difícil el diagnóstico etiológico basado exclusivamente en el cuadro clínico (tabla 2).
PUNTOS CLAVE
Gripe. Los géneros Influenzavirus A y B son los más importantes a nivel clínico y epidemiológico. Las variaciones en sus antígenos superficiales (hemaglutinina y neuraminidasa) son las responsables de las variaciones genéticas mayores (recombinación genómica) y menores (mutaciones puntuales). Las variantes mayores son las responsables de las pandemias humanas. La morbilidad es más elevada en niños y adolescentes, mientras que la mortalidad afecta fundamentalmente a sujetos ancianos con patología de base. Para la profilaxis se emplean vacunas con virus inactivados. En el año 2009 se declaró una pandemia producida por un nuevo virus H1N1 de origen porcino con una constelación genética única y nueva en la especie humana.
Rinovirus. Son los principales agentes responsables del catarro común. Hay más de 100 serotipos diferentes y su infección no produce generalmente inmunidad duradera.
Coronavirus. Son la segunda causa de catarro común. El tipo CoV es el responsable del síndrome respiratorio agudo (SARS).
Virus respiratorio sincitial. Es el principal patógeno respiratorio en niños y la primera causa de bronquiolitis aguda en lactantes.
Virus parainfluenza. Es la causa más frecuente de crup en niños.
Adenovirus. Además de cuadros respiratorios afecta también a las mucosas. Son la causa más frecuente de la faringoamigdalitis vírica.
Diagnóstico de laboratorio. Se deben emplear métodos directos (cultivo, detección antigénica o molecular). El diagnóstico de elección lo constituyen los métodos directos.
Terapia antivírica. En la gripe se pueden usar fármacos que actúan sobre la proteína M2 (amantadita y rimantadina) e inhibidores de la neuraminidasa (zanamivir y oseltamivir). La ribavirina se ha usado en algunas infecciones por el virus respiratorio sincitial. Peramivir es un nuevo inhibidor de la neuraminidasa que ha mostrado una elevada eficacia en estudios in vitro frente a la mayoría de los virus gripales.
Gripe
La familia Orthomyxoviridae está constituida por virus con simetría helicoidal y una membrana fosfolipídica en la que hay espículas glucoproteicas de hemaglutinina (HA) y neuraminidasa (NA) (Fig. 1, Fig. 2, Fig. 3 ) Los géneros Influenzavirus A y B son los más importantes, el género Influenzavirus C incluye virus con características biológicas diferentes y menor importancia clínica1., 2..
Fig. 1.
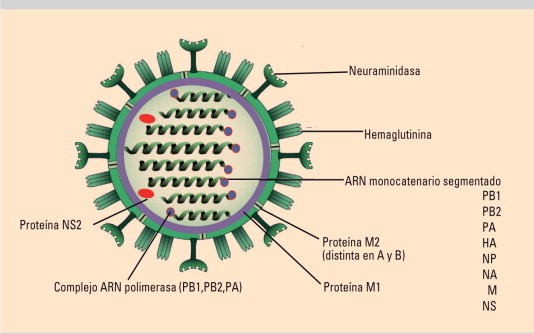
Estructura de los virus de la gripe.
Fig. 2.
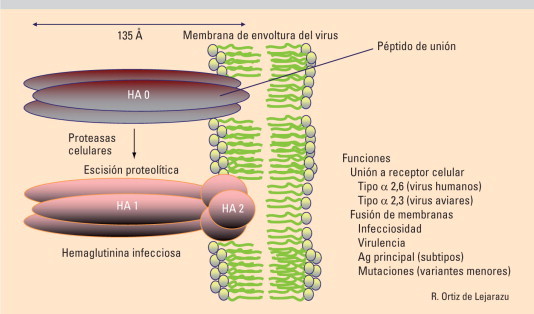
Hemaglutinina (HA) del virus de la gripe.
Fig. 3.
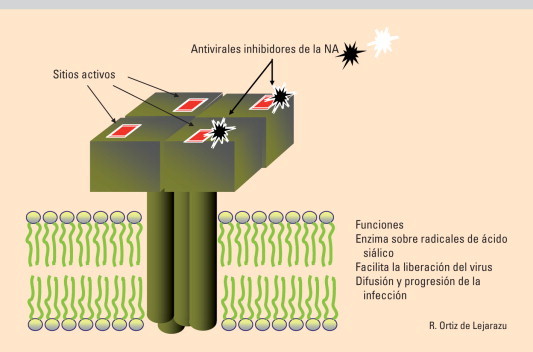
Neuraminidasa del virus de la gripe. HA: hemaglutinina; NA: neuraminidasa.
El género Influenzavirus A incluye todos los subtipos humanos y animales de los virus de la gripe A (variantes mayores) y las múltiples variantes menores derivadas de aquellos. Los subtipos son las combinaciones de los 16 tipos de HA (H1-H16) y los 9 de la NA (N1-N9), todos ellos descritos en aves (fig. 4 ). Los virus de la gripe B no tienen subtipos ni reservorio animal, su deriva antigénica es menor y son solo responsables de brotes estacionales, circulando en la actualidad dos linajes distintos (B/ Hong Kong y B/Victoria). Los virus gripales C no causan epidemias ni pandemias, la deriva antigénica es mínima y existen variantes que cocirculan3., 4., 5..
Fig. 4.
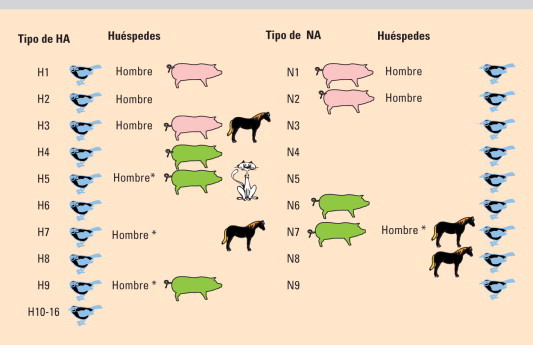
Ecología antigénica de los virus de la gripe A. *Sin transmisión interhumana.
La existencia de los virus de la Gripe A en la naturaleza está ligada a tres factores: un amplio reservorio aviar, fenómenos de variabilidad por reordenamiento genético y mutaciones y la posibilidad de salto de especie6. La variabilidad genética en los virus gripales afecta a las 10 proteínas codificadas por sus 8 genes, siendo las más importantes las de la HA7. Las variaciones mayores (nuevo subtipo) son responsables de las pandemias y aparecen por salto directo de especie o por mezcla de genes y reordenamiento genético entre virus animales o humanos al infectar a un mismo huésped8. Las mutaciones puntuales a partir del subtipo circulante como consecuencia de la presión inmune al difundir año tras año en la población humana (presión selectiva positiva) originan las variantes menores y son la causa de las epidemias estacionales de gripe5., 9..
Desde 1933 sólo tres subtipos han establecido linajes estables en seres humanos (H1N1 gripe española, H2N2 gripe asiática y H3N2 gripe Hong Kong), circulando actualmente sólo variantes menores de los subtipos H3N2 y H1N1 (desde 1968 y 1977 respectivamente). En el año 2009 se produjo la aparición pandémica de un nuevo subtipo H1N1 de origen porcino. Este linaje, aunque posee una HA subtipo H1 es muy diferente del linaje humano H1 que circulaba desde 1977 y está sustituyendo al linaje H1 antiguo.
Patogenia y determinantes de patogenicidad
Los virus de la gripe humana tienen afinidad por los receptores mucoproteicos de las células del epitelio columnar respiratorio. El virus se difunde desde la faringe por contigüidad ocasionando un proceso inflamatorio con necrosis del epitelio ciliado del tracto respiratorio superior; pudiendo afectar a bronquios, bronquiolos y alvéolos. La replicación es intensa en las 48- 72 horas siguientes y hasta 9 días en niños, alcanzándose dosis infectantes50 de 103., 4., 5., 6., 7./ml. En el curso del proceso se produce una estimulación de diversas citocinas e interferones que tienen un papel importante en el curso y evolución de la infección gripal10., 11., 12., 13., 14., 15..
La HA es el principal determinante de virulencia y precisa activarse para ser capaz de infectar a las células diana. La activación proteolítica de la HA tiene lugar en el curso de la maduración del virus (proteolisis postraslacional) (fig. 2). La elevada virulencia de algunas cepas aviares (H5 y H7) está asociada a la inserción de múltiples aminoácidos básicos próximos al sitio de hidrólisis proteica de la HA. dicha característica facilita la escisión por enzimas de distinta ubicuidad, dotando al virus de patogenicidad para tejidos distintos al respiratorio (riñón, corazón, sistema nervioso central [SNC]) lo que ayuda a explicar su mayor virulencia11., 12.. La capacidad de franquear la barrera interespecie está ligada a la afinidad por receptores tipo Neu 2,3 (virus aviares) o Neu 2,6 (virus humanos) localizados respectivamente en los epitelios digestivo y respiratorio de aves y seres humanos8. Por otra parte, la eficaz replicación del virus en las células de origen aviar o mamífero se asocia a la mutación 627Lys en la proteína PB213. En los subtipos H5N1 aviares se ha observado una resistencia a los mecanismos de inmunidad innata asociada a la presencia de ácido glutámico en la posición 92 de la proteína NS114., 15., 16..
Los determinantes señalados no son suficientes para explicar el complejo problema de la patogenicidad de los virus gripales que dependen de los ocho segmentos genómicos del virus. En el subtipo H1N1 actual se observa una respuesta inmune modificada en los casos graves17.
Manifestaciones clínicas
El síndrome gripal es el cuadro más frecuente producido por los virus gripales A y B. El virus C produce cuadros banales de vías altas4., 10.. Los síntomas básicos de la gripe son: fiebre, cefalea, quebrantamiento general y manifestaciones respiratorias. Estos pueden cambiar en función de la edad, los hábitos de la persona, los procesos gripales previos, la virulencia de la cepa y las condiciones subyacentes como el tabaquismo. La infección gripal puede producir también formas leves semejantes al resfriado común, bronquitis aguda, faringitis e infecciones subclínicas. La gripe es una enfermedad que afecta fundamentalmente a niños o adultos jóvenes y mata a ancianos y personas con patología crónica subyacente.
Gripe en adultos
La gripe se caracteriza por un comienzo brusco tras un periodo de incubación de 24–72 horas que permite a menudo "identificar" la fuente de contagio entre los contactos. El enfermo presenta una sensación distérmica importante y escalofríos. La fiebre puede alcanzar los 38–39,5° C y dura alrededor de 3,5 días (rango entre 1 y 8 días), observándose a veces una curva bifásica febril tras una breve remisión. La cefalea es posterior al inicio de la fiebre y las mialgias afectan principalmente a la espalda y las extremidades. La tos no suele ser productiva y un 10% de los pacientes presentan roncus y sibilancias.
En los ancianos el catarro es la forma de presentación en el 80% de los casos, acompañado de postración y gran astenia con pérdida de hasta un 5% de la masa muscular18. La fiebre es rara.
Las manifestaciones digestivas aparecen en el 2-3% de los casos, siendo frecuentes los vómitos. Otros síntomas son: sensación de quemazón ocular, dolor retroorbital, lagrimeo y fotofobia. En el 10-15% de los casos se palpan ganglios cervicales pequeños, rodaderos y blandos. El cuadro es generalmente autolimitado y la máxima intensidad de los síntomas sistémicos y los síntomas mayores duran entre 3 y 5 días, aunque la astenia y la tos pueden persistir hasta dos semanas. Las cepas más virulentas son las A(H3N2) seguidas de las B, siendo las A(H1N1) las menos virulentas para los adultos mayores.
Gripe en niños
La gripe en niños y adolescentes ocasiona a una fiebre más alta que en los adultos. Los neonatos a menudo presentan síntomas inespecíficos con apnea y rechazo del alimento y cuadros respiratorios semejantes al croup y la bronquiolitis. Casi la mitad de los niños menores de 4 años revelan un grado importante de somnolencia y letargia. En el 20% de los niños hospitalizados menores de 4 años se pueden observar cuadros convulsivos y una mayor incidencia de otitis media (4-5%). En lactantes menores de 6 meses se dan abdominalgias, vómitos y diarrea. El síndrome sistémico gripal puede ser especialmente intenso y postrante en niños pequeños, encontrándose la creatinfosfocinasa (CPK) elevada y la transaminasa glutamicoxalacética (GOT) discretamente elevada a consecuencia de la afectación muscular.
Gripe en grupos de riesgo
La gripe en pacientes con enfermedades de base produce descompensaciones y un incremento de la mortalidad. En enfermos cardiopulmonares la gripe se asocia a cuadros isquémicos cardíacos y es un factor de riesgo para el infarto de miocardio. En los períodos epidémicos las muertes de pacientes con enfermedad pulmonar obstructiva crónica (EPOC) pueden aumentar hasta un 50%. En los diabéticos el riesgo de neumonía asociada a gripe es 1,7 veces mayor que en la población general. La combinación de neumonía gripal y diabetes es especialmente grave, y la mortalidad muy importante. La exacerbación del asma y el agravamiento de la fibrosis quística son aspectos a tener en cuenta. La gripe puede ser causa de infecciones nosocomiales y en instituciones cerradas. La edad y la institucionalización son factores determinantes, siendo los internados en residencias geriátricas un grupo especialmente vulnerable, y en menor medida los de centros de internamiento psiquiátrico, hospicios y cuarteles4., 18., 19..
Los pacientes inmunodeprimidos tienen una mayor persistencia y excreción del virus gripal y sufren con mayor frecuencia neumonía primaria viral. En pacientes trasplantados la mortalidad se asocia con el grado de neutropenia. No se ha demostrado un mayor riesgo de rechazo en receptores de transplante sólido. En pacientes con sida o infección por el virus de la inmunodeficiencia humana (VIH) avanzada se ha comunicado una mayor duración del proceso, una afectación respiratoria más evidente y un curso más prolongado. En mujeres embarazadas se ha comprobado una mayor incidencia de las complicaciones entre el segundo y el tercer trimestre de la gestación, pero no se ha probado un riesgo añadido de malformaciones congénitas.
Complicaciones de la gripe
Las complicaciones de la gripe se presentan en todas las edades, pero son más frecuentes en personas con patologías crónicas subyacentes, inmunosupresión o edad avanzada. Algunas, como el síndrome de Reye es exclusivo de niños y jóvenes. Las complicaciones más frecuentes son las respiratorias, y entre las no respiratorias se incluyen manifestaciones cardiovasculares, musculares, nerviosas, renales, endocrinas, gastrointestinales y hemáticas. Las más frecuentes en niños son: la otitis media, la traqueobronquitis, la laringotraqueitis y la bronquiolitis19., 20..
La bronquitis aguda es la complicación respiratoria más frecuente y está asociada a pacientes naive para el virus gripal y edad avanzada. La más grave es la neumonía primaria viral, más frecuente con los virus A. La radiografía de tórax muestra infiltrados bilaterales difusos de localización peribronquial sin consolidación. El deterioro de la función pulmonar y del enfermo es rápido, la mortalidad muy elevada y la media de supervivencia inferior a la semana. La neumonía secundaria bacteriana se debe a la sobreinfección por 5. pneumoniae, H. influenzae o 5. aureus de la lesión pulmonar producida por el virus gripal y ocurre tras una aparente remisión de la sintomatología, 11–14 días después del inicio del síndrome gripal. La forma bronconeumónica es la más frecuente y grave y ha sido responsable de más del 80% de las muertes ocurridas durante las pandemias. A veces se producen neumonías mixtas víricas y bacterianas y se han descrito cuadros de empiema, absceso pulmonar, neumotórax y enfisemas secundarios a gripe con una incidencia inferior al 0,1%.
El síndrome de Reye es una encefalopatía con degeneración hepática grasa que ocurre en la infancia (2 a 18 años) y cursa con una alta mortalidad (10-40%). Asociado a diversas infecciones víricas, sobre todo a la varicela, se presenta como una complicación de la gripe B y, en menor medida, de la gripe A. Su incidencia se estima en el 0,3-0,8 por 100.000 casos en menores de 18 años; existiendo formas leves más frecuentes. Otras complicaciones raras son la encefalitis, la encefalopatía, el síndrome de Guillain-Barré, la miositis, el fracaso renal, el síndrome de coagulación intravascular y el síndrome hemofagocítico.
Profilaxis de la gripe y otras viriasis respiratorias
A excepción de los virus de la gripe, para los demás virus no existe una vacuna, y las especiales características de los virus implicados o su patogenia hacen difícil o lejana la posibilidad de disponer de una vacuna. La profilaxis de exposición es poco eficaz, ya que resulta muy difícil evitar el contagio y la difusión de estas infecciones. No obstante, se pueden tomar ciertas medidas, principalmente en instituciones cerradas (uso de mascarillas, aislamiento aéreo de casos, restricción de la circulación de personas, etc.) que disminuyen la influencia del factor de agregación durante las epidemias de gripe y otras viriasis respiratorias especialmente graves (síndrome respiratorio agudo grave [SARS], gripe aviar, etc.).
Tipos de vacunas de la gripe
Las vacunas antigripales más utilizadas se hacen con virus inactivados. Hay vacunas inactivadas con virus enteros, con virus fraccionados (contienen HA, NA, parte de nucleoproteína (NP) y proteína M) y vacunas de subunidades de HA y NA (fraccionadas y purificadas). Asimismo, se dispone de vacunas inactivadas con adyuvante (MF59 y AS03) que potencian la respuesta inmune, especialmente en la población anciana e institucionalizada21 y vacunas virosomales. Las normas internacionales establecen que la vacuna debe contener al menos 15 ^g de la HA de cada uno de los virus incluidos en ella20.
Las vacunas con virus atenuados constituyen una perspectiva más prometedora, ya que pueden mejorar los resultados obtenidos con virus inactivados: su administración provoca una infección inaparente o subclínica que induce una inmunidad semejante a la natural; la administración por vía nasal induce una inmunidad sistémica y local con producción de inmunoglobulina (Ig) secretoria, esencial en la gripe. Por último, la dosis necesaria puede ser pequeña y su administración muy cómoda. No deben administrarse vacunas estacionales y pandémicas atenuadas de forma simultánea.
La composición de las vacunas de la gripe tiene que adaptarse forzosamente a la variación del virus. Existe una red de 130 centros de gripe repartidos en 101 países para poder anticipar de forma racional la variación antigénica del virus; aspecto fundamental para la fabricación de vacunas que tardan en elaborarse entre 6 y 8 meses. La aparición de un virus pandémico con una variación genética importante al inicio de la onda hace que los métodos de genética inversa, la sustitución de células por huevos y el uso de adyuvantes deban ser tenidos en cuenta para agilizar los procesos de producción de la vacuna21.
Estrategias e indicaciones de vacunación
La vacunación anual con vacuna trivalente inactivada (AH3, AH1 y B) antes de la temporada gripal es la estrategia habitual. En el caso de una pandemia de gripe la estrategia comporta el uso de una vacuna inactivada monovalente (cepa pandémica) y una vacunación amplia de la población si se dispone de dosis suficientes o la asunción de prioridades basadas en criterios sanitarios y sociales.
Las indicaciones de vacunación antigripal figuran en la tabla 3 . La recomendación de vacunar a mayores de 50 años se basa en el hallazgo de una patología no reconocida en dicho grupo etario, también se ha recomendado la vacunación de niños mayores de 6 meses y sus convivientes para reducir la difusión intrafamiliar. Los episodios de gripe aviar y animal ocurridos han aconsejado la vacunación gripal de cuidadores y veterinarios para prevenir la gripe estacional y evitar la emergencia de subtipos nuevos por infecciones dobles.
Tabla 3.
Indicaciones principales de vacunación frente a la gripe
| Personas con elevado riesgo de padecer complicaciones |
|---|
| Adultos y niños de más de 6 meses con patología cardiorrespiratoria (incluidos niños con asma) |
| Adultos y niños que precisan tratamiento regular u hospitalización en el año anterior por enfermedades metabólicas (diabetes mellitus), disfunción renal, hemoglobinopatías o inmunosupresión (incluida por medicamentos) |
| Niños y jóvenes (de 6 meses a 18 años) en tratamiento prolongado con ácido acetilsalicílico y riesgo de desarrollar un síndrome de Reye tras un proceso gripal |
| Personas ≥ 50 años |
| Personas que pueden transmitir la gripe a otras personas con riesgo elevado de padecer complicaciones |
|---|
| Médicos y personal sanitario de hospitales y ambulatorios, especialmente los de unidades de críticos o inmunodeprimidos |
| Empleados que prestan atención a pacientes o residentes de instituciones geriátricas o de crónicos |
| Personal que cuida a personas de alto riesgo (personal sanitario, trabajadores sociales, trabajadores voluntarios) |
| Miembros del núcleo familiar (incluidos niños mayores de 6 meses) que convivan con personas de alto riego |
La eficacia de la vacunación gripal depende fundamentalmente de la homología entre las cepas de vacunación y las epidémicas y de la edad e inmunocompetencia de los vacunados. En adultos sanos se cifra entre el 80-90% y cifras variables pero menores en ancianos. La vacunación en los grupos de riesgo reduce la hospitalización, las complicaciones y especialmente la neumonía y la mortalidad asociada22.
Administración y contraindicaciones
En los adultos se recomienda una sola dosis de 0,5 ml por vía intramuscular o subcutánea profunda. En la primovacunación de niños de 6 meses a 8 años se recomiendan 2 dosis por vía intramuscular, separadas por un intervalo de 4 semanas, que en los niños de 6 a 35 meses deben ser de 0,25 ml. Se requieren tres semanas para estar protegido. Las contraindicaciones son las de aplicación general para cualquier vacuna además de la hipersensibilidad a las proteínas del huevo. El síndrome de Guillain-Barré es la única complicación grave tras la administración de la vacuna antigripal. En EE. UU., en 1976, durante el programa de inmunización frente a la gripe porcina (vacuna monovalente A/ New Jersey/ 76 Hsw1N1), se observó un exceso de casos de Guillain-Barré entre los 45 millones de personas vacunadas, estimándose el riesgo en 1/100.000 vacunaciones que no ha sido observado después con las vacunas actuales.
Rinovirus
Son virus de la familia Picornaviridae. Se replican solo a 33-34° C, factor que limita su patogenia a la rinofaringe. Los más de 100 tipos antigénicos no producen inmunidad cruzada entre ellos (tabla 1). La infección puede transmitirse por los dedos contaminados de secreciones nasales y el contacto con superficies y fómites debido a la resistencia del virus. Los rinovirus son los principales responsables del resfriado común (15-40%), cuadro benigno pero de gran repercusión económica y social. La mayor afectación se produce en lactantes y niños pequeños, aunque los adultos pueden sufrir hasta 6 episodios al año (tabla 2).
El catarro común puede observarse durante todo el año, pero es más frecuente en los meses de transición del verano al otoño (septiembre) y de la primavera al verano (mayo).
El período de incubación de la infección por rinovirus es de 1–4 días, coincidiendo el inicio de los síntomas con la eliminación del virus. El catarro común comienza con rinorrea y estornudos acompañados de congestión nasal. Es frecuente el dolor de garganta, siendo en algunos casos el primer síntoma. Son raros el malestar general, la cefalea y la fiebre. La secreción nasal se va haciendo purulenta, no significando esto forzosamente un signo de infección bacteriana secundaria. El cuadro se resuelve espontáneamente en 4–9 días sin secuelas, ocasionalmente se pueden afectar las vías respiratorias bajas. Las complicaciones más importantes incluyen otitis o sinusitis bacterianas secundarias o la reactivación de procesos crónicos (bronquitis, asma, EPOC etc.).
En general, circulan varios serotipos simultáneamente sin que predominen unos sobre otros. La mayoría de los adultos tienen anticuerpos neutralizantes frente a varios serotipos que no producen siempre inmunidad duradera, por lo que no es excepcional la reinfección por el mismo serotipo. Las medidas preventivas más eficaces para evitar la transmisión son el lavado de manos y la desinfección de superficies.
Coronavirus
Los virus de la familia Coronaviridae poseen una envoltura provista de proyecciones en palillo de tambor que les confiere un aspecto de "corona solar". Son la segunda causa (10-20%) de catarro común tras los rinovirus. Las infecciones son frecuentes a finales del otoño, en invierno y al comienzo de la primavera, cuando los rinovirus son menos frecuentes.
La sintomatología es similar a la producida por los rinovirus, aunque el período de incubación es más largo y la duración de los síntomas más corta. Se ha documentado la presencia de neumonía en lactantes, casos de infección respiratoria aguda (IRA) en reclutas y agravamiento de la bronquitis crónica. Se han descubierto tres nuevos tipos de coronavirus: CoV en el año 2003 asociado al SARS, CoV-NL63 en el año 2004 y CoV-HKU1 en el año 2005 (tabla 1).
El SARS apareció a finales del año 2002 en distintas regiones de China como consecuencia del salto desde un reservorio animal (civetas). Posteriormente se extendió desde Hong Kong a Vietnam, Singapur, Canadá y algunos otros países, desapareciendo el virus a partir del año 2004.
El SARS se presenta como un síndrome gripal acompañado de rigidez, tos no productiva, disnea y diarrea acuosa con sangre y moco. La mayoría de los casos de SRAS se describieron en personas adultas, con un período de incubación de 2–10 días y una mortalidad global del 10% sobre más de 8.000 casos23.
Virus respiratorio sincitial
Es un virus de la familia Paramyxoviridae, subfamilia Pneumovirinae, género Pneumovirus, cuya replicación da lugar a la fusión de las células infectadas, formándose grandes sincitios multinucleados. Se han caracterizado dos subtipos VRS A y VRS B sin diferencias patogénicas (tabla 1). Su distribución es mundial, dando lugar a epidemias anuales que aparecen a final del otoño, en el invierno y en la primavera. Se transmite principalmente por manos sucias o fómites. El virus se multiplica en las células epiteliales de la mucosa nasal, faríngea y a veces laríngea, pudiendo lesionar la tráquea, los bronquios, los bronquiolos y los alvéolos.
Es el principal patógeno respiratorio en lactantes y niños pequeños y la primera causa de bronquiolitis aguda en lactantes. Se observa un pico de incidencia entre los 2–3 meses de edad, sobre todo en guarderías, y es responsable de entre el 25-40% de los ingresos hospitalarios por infecciones respiratorias bajas en dicha población. El espectro de infecciones respiratorias causadas por el VRS es amplio.
En lactantes el 25-40% de las infecciones afectan a las vías respiratorias inferiores y consiste en neumonía, bronquiolitis y traqueobronquitis (tabla 2). La infección respiratoria de las vías altas suele preceder a la aparición de la bronquiolitis aguda. Los síntomas principales son fiebre y disnea que progresa con rapidez debido a la obstrucción de los bronquiolos, produciendo tiraje, retracción intercostal y supraesternal, con hipoxia y cianosis asociada. Una complicación es la otitis media con derrame. Existe una relación entre los antecedentes de infección y los cuadros agudos de reactivación bronquial y asma. La exploración radiológica muestra una gran variedad de imágenes, hiperinsuflación pulmonar, infiltrados intersticiales y menos frecuentemente consolidación.
En el adulto, los síntomas más habituales de la infección por el VRS son los del catarro común. También pueden exacerbarse procesos asmáticos, bronquitis crónicas y EPOC. En personas de edad avanzada o con factores de riesgo puede ser la causa de neumonía con importante morbimortalidad en pacientes inmunodeprimidos y su diagnóstico debe ser activamente sospechado y buscado24., 25..
Virus parainfluenza
Existen cuatro serotipos del virus parainfluenza dentro de los géneros Respirovirus (parainfluenza 1 y 3) y Rubulavirus (2, 4A y 4B) (tabla 1). Los serotipos 1 y 2 tienden a alternarse anualmente, produciendo epidemias en otoño. El serotipo 3 suele ser prevalente a lo largo de todo el año, destacando su capacidad para producir brotes en instituciones. Los serotipos 4A y 4B son menos frecuentes.
La infección se produce en la infancia, ya que el 90% de los niños de 7–8 años poseen anticuerpos frente a los serotipos 1, 2 y 3 como consecuencia de infecciones previas. Los virus parainfluenza ocupan el segundo lugar, tras el VRS en la etiología de infecciones respiratorias bajas en niños pequeños. En adultos representan menos del 5% de las infecciones respiratorias siendo generalmente leves.
El virus parainfluenza 1 es la causa más frecuente de laringotraqueobronquitis o croup en niños. El serotipo 2 produce por lo general una enfermedad similar pero menos grave. El serotipo 3 es causa importante de bronquiolitis y neumonía en el lactante (tabla 2), mientras que la enfermedad por el tipo 4 suele ser leve. Aparece una tos metálica o perruna que evoluciona hasta un estridor franco. Frecuentemente puede progresar y aparecer una obstrucción progresiva de las vías respiratorias con hipoxia. Si desarrolla bronquiolitis o neumonía puede aparecer tos progresiva acompañada de sibilancias, taquipnea y tiraje intercostal, aumentando la expectoración. En inmunodeprimidos la infección es más grave y prolongada. Al igual que en la infección por otros paramyxovirus, las reinfecciones son frecuentes y su gravedad disminuye según aumenta la edad de las personas.
Adenovirus
En el género Mastadenovirus existen grupos de la A a la F con 51 serotipos que tienen una considerable estabilidad ambiental, lo que facilita su transmisión. Los más comunes son del 1 al 8, el 11, 21, 35, 37 y 40; pudiendo causar brotes el 3, 4, 7, 14 y 21. Poseen especial afinidad por la faringe, siendo los responsables más frecuentes de faringoamigdalitis vírica. Afectan a todos los grupos de edad y a lo largo de todo el año, aunque en niños en edad escolar el 50% de las infecciones son asintomáticas, la máxima incidencia se da entre los 6–12 meses. El periodo de incubación es amplio (2–14 días). Causan brotes localizados de IRA en invierno y primavera, y brotes de fiebre faringoconjuntival en verano asociados a piscinas (serotipos 3, 4, 5, 6, 7 y 14). También en su forma epidémica (tabla 2) se les ha relacionado con IRA en reclutas (serotipos 4 y 7). La infección respiratoria alta cursa con faringitis, fiebre, amigdalitis y diarrea, sobre todo en niños pequeños. En los cuadros respiratorios bajos aparece fiebre, afectación de las vías altas, bronquitis, bronquiolitis y neumonía, que puede ser más grave en niños que en adultos y frecuentemente por el serotipo 3.
Metaneumovirus humano (MNVh)
Existe un nuevo virus del género Metapneumovirus descrito en el año 2002, del que se han identificado dos linajes genéticos A y B, subdividiéndose cada uno de ellos en dos grupos (A1-A2 y B1-B2). Es un virus de distribución mundial26.
El metaneumovirus es un virus que puede causar desde una infección respiratoria alta inespecífica autolimitada en niños y adultos sanos, hasta cuadros de bronquiolitis y traqueobronquitis en niños de corta edad, así como bronquitis y neumonía potencialmente grave en mayores de 65 años e inmunodeprimidos. Los síntomas son similares a los producidos por el VRS, tos no productiva, congestión nasal, otitis media, bronquiolitis y neumonía (tabla 2). Produce infecciones respiratorias tanto de las vías respiratorias altas como de las bajas en todas las edades, pero los grupos más afectados son los niños menores de 5 años, existiendo reinfecciones. Hay una asociación entre espasticidad bronquial e infección por metaneumovirus.
Bocavirus humano (HBoV)
Este único parvovirus del género Bocavirus fue identificado por primera vez en el año 2005 en muestras de aspirado nasofaríngeo procedentes de niños con infección respiratoria27., 28.. Estudios posteriores han confirmado que HBoV es el responsable de un porcentaje importante de bronquiolitis y sibilancias recurrentes en niños de corta edad, circula a lo largo de todo el año, como ocurre con rinovirus o adenovirus, con picos de incidencia en los meses de noviembre y diciembre.
Además de infecciones respiratorias, se ha demostrado mediante detección en muestras de suero de pacientes con sibilancias que HBoV es capaz de inducir infección sistémica como ocurre con otros parvovirus. Por otro lado, HBoV también podría ser el responsable de un pequeño porcentaje de gastroenteritis.
Polyomavirus
Dos nuevos miembros pertenecientes a la familia Polyomaviridae llamados provisionalmente KI y WU (Karolinska Institutet virus y Washington University virus), se han descrito en 200729. Estos nuevos polyomavirus han sido identificados mediante técnicas de biología molecular en secreciones respiratorias de seres humanos. Los estudios publicados no aclaran el papel patógeno de estos virus en las enfermedades del tracto respiratorio, por ello son necesarios otros estudios que demuestren su relevancia clínica.
Diagnóstico de laboratorio de la gripe y otras viriasis respiratorias
El síndrome gripal puede no requerir ser diagnosticado por el laboratorio cuando existe una evidencia epidémica confirmada virológicamente. Sin embargo, el diagnóstico etiológico de un cuadro respiratorio se debe hacer extensivo para el resto de los virus respiratorios, sobre todo en los casos graves o complicados, en pacientes hospitalizados o inmunodeprimidos y porque en ocasiones puede haber coinfecciones.
El diagnóstico de elección es el directo. Entre los métodos de diagnóstico directo cabe distinguir aquellos que permiten la recuperación posterior viable del virus (cultivo) y otros que no permiten su recuperación (detección antigénica o molecular). Una combinación de ambos que se adapte al laboratorio y la clínica es la mejor opción.
Recogida de muestras
Las muestras deben recogerse preferentemente en los tres primeros días desde el inicio de los síntomas (virus de la gripe). En otras viriasis y en los niños pueden recogerse muestras durante la primera semana. Se recomiendan frotis faríngeos o nasofaríngeos, aspirados nasofaríngeos y lavados nasales, estos últimos de especial utilidad en los niños. Los lavados broncoalveolares y los aspirados traqueales se realizarán preferentemente en los procesos de las vías bajas de los adultos. El transporte de las muestras debe hacerse utilizando cualquier medio de calidad utilizado en virología. Los frotis pueden conservarse a 4° C hasta 24 horas en la mayoría de los casos.
Diagnóstico directo
Para el aislamiento vírico se emplea el cultivo celular clásico o el cultivo rápido por centrifugación/cultivo (shell vial). Este último permite el aislamiento en 24–48 horas con una ligera merma de sensibilidad. El cultivo mixto de células (MDCK, Vero; Hep2) permite el crecimiento de varios virus respiratorios ampliando el repertorio diagnóstico a un coste aceptable.
Las técnicas de inmunofluorescencia, enzimoinmunoanálisis e inmunocromatografía capilar son métodos rápidos de diagnóstico. Algunos permiten el diagnóstico a la cabecera del enfermo y sirven para instaurar un tratamiento precoz o medidas de profilaxis urgentes. Pueden constituir una primera línea de diagnóstico, pero no sustituir al cultivo. La calidad de la muestra influye decisivamente en la sensibilidad (65-80%) de los métodos rápidos; sobre todo para la inmunofluorescencia que precisa de células morfológicamente conservadas. Por ello, es más adecuado el lavado nasofaríngeo que el frotis. Las técnicas de amplificación genómica (reacción de la cadena de polimerasa en transcripción reversa (RT-PCR) ofrecen distintas alternativas. Se han ensayado PCR múltiplex que permiten el diagnóstico de virus gripales y otros virus respiratorios con adaptaciones a la metodología en tiempo real26.
Diagnóstico indirecto (serológico)
Es de escasa utilidad para el diagnóstico y cuidado clínico de pacientes con gripe y viriasis respiratorias. La fijación de complemento es poco sensible sobre todo en las seroconversiones especialmente en menores de 4 meses y la IgM rara y difícilmente demostrable. Sin embargo, la inhibición de la hemaglutinación es específica para subtipos y variantes del virus de la gripe, utilizándose principalmente en seroepidemiología y respuesta a la vacuna.
Tratamiento de la gripe y viriasis respiratorias
En la gripe y las viriasis respiratorias altas no complicadas es suficiente el reposo y la administración de antitérmicos y analgésicos en la mayoría de los casos.
En las bronquiolitis por VRS de los lactantes es eficaz la terapia con aerosol de ribavirina durante 3–6 días, pero la necesidad de dispositivos especiales complican su uso en la práctica clínica rutinaria. El tratamiento de la gripe con antivirales requiere un inicio muy precoz (menos de 36 horas desde el inicio de los síntomas).
Amantadina y rimantadina
Son aminas cíclicas sintéticas que bloquean el canal iónico de la M2 (fig. 1) de los virus gripales. Sólo son activas frente a los virus A, ya que los B poseen una proteína distinta. Su uso está limitado por los efectos secundarios y la aparición de resistencias recientes (más del 90% en H3 y del 100% en H1N1 de linaje humano en 2008). La pauta en los adultos sanos es de 100 mg al día durante 3–5 días. Hay descritos efectos secundarios sobre el SNC y emergencia de resistencias cruzadas para ambos antivirales en el curso del tratamiento.
Zanamivir y oseltamivir
Son inhibidores de la NA (INA) activos frente a los virus gripales A y B, incluidos virus aviares. Inhiben y bloquean específicamente los sitios activos de la NA impidiendo la liberación y difusión de nuevos virus desde la célula infectada. El zanamivir se administra inhalado y la pauta son dos inhalaciones diarias durante 5 días. En la profilaxis se recomienda una inhalación diaria. Dada su nula absorción no hay necesidad de reducción de dosis en enfermos renales. Su uso está indicado en adultos con buen nivel de conciencia y adolescentes mayores de 12 años. Reduce las complicaciones y el período de estado de la gripe entre 1–3 días. El oseltamivir se administra por vía oral y tras su absorción se metaboliza a oseltamivir-carboxilato. Se elimina por filtrado glomerular y secreción tubular con una biodisponibilidad del 80%. La pauta es de 75 mg dos veces al día durante 5 días que puede aumentarse a 150 mg en casos graves y como profilaxis una dosis diaria. Hay que ajustar la dosis en pacientes con aclaramientos de creatinina inferiores a 30 ml/minuto. Ninguno de los INA tiene acción sobre el citocromo p450 y no hay descritas interacciones con otros antivirales.
Peramivir
Es un nuevo inhibidor de la NA que ha mostrado una elevada eficacia frente a la mayoría de los virus gripales en estudios in vitro, en animales y en seres humanos30. Este fármaco perteneciente a una segunda generación de inhibidores podría utilizarse en un futuro para la profilaxis y el tratamiento de la gripe epidémica y pandémica dada la ausencia de reactividad cruzada exhibida entre los inhibidores de la NA.
Además la profilaxis con antivíricos puede ser una alternativa a la vacunación en las personas con contraindicación para la vacunación, intensa inmunodeficiencia, importantes factores de riesgo o en instituciones cerradas sin una adecuada cobertura para la vacunación31. Asimismo, podrían utilizarse en pacientes con un elevado riesgo de padecer gripe y recientemente vacunados hasta que se complete su inmunización. Pueden ser la única alternativa al inicio de una onda pandémica.
Potencial pandémico del virus H1N1 NV
Las características que definen la aparición de un virus de la gripe con potencial pandémico son: emergencia de un subtipo nuevo (H distinta), capacidad para infectar a los seres humanos y capacidad de transmisión eficaz y continua de persona a persona. En el salto de especie de un virus animal de la gripe A a los seres humanos intervienen distintos factores. Los virus de linajes humanos muestran generalmente afinidad por receptores de tipo Neu,2,6 mientras que los de linajes aviares por Neu,2,3 y su localización anatómica es distinta. Sin embargo, por sí solos no explican la aparente dificultad de salto de barrera genética. Otros genes internos del complejo polimerasa (PB1, PB2, PA) intervienen en la eficaz replicación del virus en células no aviares13. La gripe española (H1N1) causó una mortalidad muy elevada en jóvenes durante la primera onda epidémica; no suficientemente explicada por las características del virus o la exagerada respuesta inflamatoria de los afectados y dicho virus poseía toda su constelación genómica de origen aviar3., 7., 13.. En 1997 ocurrió en Hong Kong un brote de gripe aviar por un subtipo de gripe A H5N1 del que se registraron 18 casos en seres humanos, seis de ellos mortales, saldándose aquel episodio con el sacrificio masivo de aves de corral del mercado de Hong Kong tras exhaustivos estudios epidemiológicos32. Desde su reemergencia en 2003 hasta el momento actual continúan produciéndose casos esporádicos en seres humanos con una mortalidad cercana al 70%, sin demostrarse una transmisión eficaz interhumana33.
En abril de 2009 se declaró la fase 4 de alerta pandémica por la aparición de casos producidos por un nuevo virus H1N1 de origen porcino. En el plazo de algo más de un mes se declaró la fase pandémica 6, dado que se daban las condiciones de difusión internacionalmente aceptadas.
A partir de dicha fecha se produjeron simultáneamente casos de la enfermedad en más de 210 países de todo el mundo, sin asociación estacional. El nuevo virus virus H1N1 tiene una constelación genética única y nueva en la especie humana, con genes de origen porcino de dos linajes distintos; el clásico americano (PB1, PA, NA y NP) y el euroasiático (M, NA) y algunos de origen aviar y humano (PB2). Se ha cifrado la mortalidad sobre casos diagnosticados en un 0,1%. El virus responsable similar a la cepa A/California/7/2009 está sustituyendo eficazmente al antiguo subtipo H1N1 estacional, pero no al tipo B ni al H3. Es resistente de forma natural a adamantanos y sensible a INA, las escasas resistencias encontradas se deben a la mutación H274Y, pero continúan siendo sensibles al zanamivir inhalado.
Se han desarrollado vacunas inactivadas para Europa con distintas modalidades de elaboración. En huevo, cultivo celular, adyuvadas, utilizando virus inactivados o salvajes, que han mostrado su eficacia inmunógena con una reactogenicidad similar a las vacunas estacionales clásicas de la gripe.
La extensión epizoótica del subtipo H5N1 junto a la situación epidemiológica actual del nuevo H1N1 ha hecho que la Organización Mundial de la Salud (OMS) exprese la necesidad de continuar la vigilancia del H5N1 aviar ante la situación epidemiológica que podría originarse si se produjera un reordenamiento entre ambos virus con capacidad de transmisión interhumana34., 35..
Bibliografía
- 1.Cox N.J., Fuller F., Kaverin N. Orthomyxoviridae. In: Van Regenmortel M.H.V., Fauquet C.M., Bishop D.H., Carstens E.B., Estes M.K., Lemon S.M., editors. Virus taxonomy: Seventh Report of the International Commitee on Taxonomy of Viruses. San Diego. Academic Press; California: 2000. pp. 585–597. [Google Scholar]
- 2.Ziegler T., Cox N. Influenza viruses. In: Murray P.R., Baron E.J., Jorgensen J.H., Pfaller M.A., Yolken RH., editors. Manual of Clinical Microbiology. 8th ed. American Society of Microbiology; Washington DC USA: 2003. pp. 1360–1367. [Google Scholar]
- 3.Palese P. Influenza: old and new threats. Nat Med. 2004;10(Supl):82–88. doi: 10.1038/nm1141. [DOI] [PubMed] [Google Scholar]
- 4.Nicholson K.G., Webster R.G., Hay A.J., editors. Textbook of Influenza. Blackwell Science Ltd; London UK: 1998. p. 578. [Google Scholar]
- 5.Palese P., Young J.F. Variation of influenza A, B and C viruses. Science. 1982;92:1468–1474. doi: 10.1126/science.7038875. [DOI] [PubMed] [Google Scholar]
- 6.Webster R.G. The importance of animal influenza for human disease. Vaccine. 2002;20(Supl2):16–20. doi: 10.1016/s0264-410x(02)00123-8. [DOI] [PubMed] [Google Scholar]
- 7.Reid A.H., Fanning T.G., Hultin J.V., Taubenberger J.K. Origin and evolution of the 1918 “Spanish” influenza virus hemagglutinin gene. Proc Natl Acad Sci USA. 1999;96:1651–1656. doi: 10.1073/pnas.96.4.1651. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Webby R., Hoffmann E., Webster R. Molecular constraints to interspecies transmission of viral pathogens. Nat Med. 2004;10(Supl):77–81. doi: 10.1038/nm1151. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Webby R.J., Webster R.G. Emergence of influenza viruses. Phil Trans R Soc Lond B. 2001;356:1817–1828. doi: 10.1098/rstb.2001.0997. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Nicholson K.G., Wood J.M., Zambon M. Influenza. Lancet. 2003;362:1733–1745. doi: 10.1016/S0140-6736(03)14854-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Chen J., Lee K.H., Steinhauer D.A., Stevens D.J., Skehel J.J., Wiley D.C. Structure of the hemmagglutinin precursor cleavage site, a determinant of influenza pathogenicity and the origin of the labile conformation. Cell. 1998;95:409–417. doi: 10.1016/s0092-8674(00)81771-7. [DOI] [PubMed] [Google Scholar]
- 12.Steinhauer D.A. Role of hemagglutinin cleavage for the pathogenicity of influenza virus. Virology. 1999;258:1–20. doi: 10.1006/viro.1999.9716. [DOI] [PubMed] [Google Scholar]
- 13.Taubenberger J.K., Reid A.H., Lourens R.M., Wang R., Guozhong J., Fanning T.G. Characterization of the 1918 influenza virus polymerase genes. Nature. 2005;437:889–893. doi: 10.1038/nature04230. [DOI] [PubMed] [Google Scholar]
- 14.Geiss G.K., Salvatore M., Tumpey T.M., Carter V.S., Wang X., Basler C.F. Cellular transcriptional profiling in Influenza A virus-infected lung epithelial cells: the role of nonstructural NS1 protein in the evasion of the host innate defense and its potential contribution to pandemic influenza. Proc Nat Acad Sci USA. 2002;99:10736–10741. doi: 10.1073/pnas.112338099. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Seo S.H., Hoffmann E., Webster R.G. The NS1 gene of H5N1 influenza viruses circumvents the host anti-viral cytokine responses. Virus Res. 2004;103:107–113. doi: 10.1016/j.virusres.2004.02.022. [DOI] [PubMed] [Google Scholar]
- 16.Talon J., Horwath C.M., Polley R., Basler C.F., Muster T., Palese P. Activation of interferon regulatory factor 3 is inhibited by the influenza A virus NS1 protein. J Virol. 2000;74:7989–7996. doi: 10.1128/jvi.74.17.7989-7996.2000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Bermejo-Martín J.F., Ortiz de Lejarazu R., Pumarola T., Rello J., Almansa R., Ramírez P. Th1 and Th17 hypercytokinemia as early host response signature in severe pandemia influenza. Crit Care. 2009;13:R201. doi: 10.1186/cc8208. doi: 10.1186/cc 8208. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.McElhaney J.E. The unmet need in the elderly: designing new influenza vaccines for older adults. Vaccine. 2005;23(S1):10–25. doi: 10.1016/j.vaccine.2005.04.019. [DOI] [PubMed] [Google Scholar]
- 19.Treanor T.J. Influenza virus. In: Mandell G.L., Bennett J.E., Dolin R., editors. Principles and practice of infectious diseases. 5th ed. Ed Churchill Livingstone; Philadelphia: 2000. pp. 1823–1848. [Google Scholar]
- 20.Rodríguez Torres A., Castrodeza J., Ortiz de Lejarazu R. Vacuna antigripal. In: Salleras Sanmartí L., editor. Vacunaciones preventivas. Principios y aplicaciones. Masson SA; Barcelona: 2003. pp. 331–362. [Google Scholar]
- 21.Job A., Brianti G., Zamparo E., Gallo T. Evidence of increased clinical protection of an MF59-adjuvant influenza vaccine compared to a non- adjuvant vaccine among elderly residents of long-term care facilities in Italy. Epidemiol Infect. 2005;133:687–693. doi: 10.1017/s0950268805003936. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Fedson D. Pandemic influenza and the global vaccine supply. Clin Infect Dis. 2003;36:1552–1561. doi: 10.1086/375056. [DOI] [PubMed] [Google Scholar]
- 23.Peiris J.SM., Guan Y., Yuen K.Y. Severe acute respiratory syndrome. Nat Med. 2004;10(Supl):88–97. doi: 10.1038/nm1143. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Falsey A.R., Hennessey P.A., Formica M.A., Cox C., Walsh E.E. Respiratory sincytial virus infection in elderly and high-risk adults. N Engl J Med. 2005;352:1749–1759. doi: 10.1056/NEJMoa043951. [DOI] [PubMed] [Google Scholar]
- 25.Sethi S., Murphy T.F. RSV infection. Not for kids only. N Engl J Med. 2005;352:1810–1812. doi: 10.1056/NEJMe058036. [DOI] [PubMed] [Google Scholar]
- 26.Maertzdorf J., Wang C.K., Brown J.B., Quinto J.D., Chu M., de Graaf M. Real-time reverse transcriptase PCR assay for detection of human metapneumovirus from all know genetic lineages. J Clin Microbiol. 2004;42:981–986. doi: 10.1128/JCM.42.3.981-986.2004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Allender T., Jartti T., Gupta S., Niesters H.G., Lehtinen P., Osterback R. Human bocavirus and acute wheezing in children. Clin Infect Dis. 2007;44:904–910. doi: 10.1086/512196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Schildgen O., Müller A., Allander T., Mackay I.M., Völz S., Kupfer B. Human bocavirus: passenger or pathogen in acute respiratory tract infections? Clin Microbiol Rev. 2008;21:291–304. doi: 10.1128/CMR.00030-07. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Allander T., Andreason K., Gupta S., Bjerkner A., Bogdanovic G., Persson M.AA. Identification of a third polyomavirus. J Virol. 2007;81:4130–4136. doi: 10.1128/JVI.00028-07. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Reina J. Peramivir un nuevo y potente inhibidor de la neuroaminidasa para el tratamiento de las infecciones gripales. Rev Esp Quimioterap. 2006;19:317–322. [PubMed] [Google Scholar]
- 31.Hayden F.G., Belse R., Villanueva C., Lanno R., Hughes C., Small I. Management of influenza in households: a prospective, randomized comparison of oseltamivir treatment with or without postexposure prohylaxis. J Infect Dis. 2004;189:440–449. doi: 10.1086/381128. [DOI] [PubMed] [Google Scholar]
- 32.Subbarao K., Klimov A., Katz J., Regnery H., Lin W., Hall H. Characterization of an avian influenza A (H5N1) virus isolated from a child with a fatal respiratory illness. Science. 1998;279:393–396. doi: 10.1126/science.279.5349.393. [DOI] [PubMed] [Google Scholar]
- 33.Ungchusak K., Auewarakul P., Dowell S.F., Kitphati R., Auwanit W., Puthavathana P. Probable person-to-person transmission of avian influenza A (H5N1) N Eng J Med. 2005;352:333–340. doi: 10.1056/NEJMoa044021. [DOI] [PubMed] [Google Scholar]
- 34.The World Health Organization Global Influenza Program Surveillance Network Evolution of H5N1 avian influenza viruses in Asia. Emerg Infect Dis. 2005;11:1515–1521. doi: 10.3201/eid1110.050644. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Osterholm M.T. Preparing for the next pandemic. N Engl J Med. 2005;352:1839–1842. doi: 10.1056/NEJMp058068. [DOI] [PubMed] [Google Scholar]


