B3.1. Schnupfen
1. Vorbemerkungen
1.1. Definition
Der Schnupfen ist eine eigenständige, akute, durch Viren verursachte ansteckende Erkrankung der Schleimhaut von Nase, Nasennebenhöhlen, Nasenrachen und Tuben oder frühes Symptom anderer Infektionskrankheiten wie Keuchhusten, Epiglottitis, Masern und Diphtherie oder Ausdruck nicht infektionsbedingter Störungen (z.B. bei allergischer oder vasomotorischer Rhinitis).
1.2. Epidemiologie
Der Schnupfen ist eine der häufigsten Infektionskrankheiten des Menschen. Kinder erkranken durchschnittlich 3-bis 8-mal pro Jahr, Erwachsene 1-bis 3-mal. Kleine Kinder sind häufiger betroffen als große, Jungen öfter als Mädchen. Die Ausbreitung erfolgt im Kindergarten und in der Schule, vorzugsweise im Herbst und Winter (Cherry 1992).
2. Erregerspektrum
Die akute Rhinitis wird durch viele verschiedene Viren verursacht, die zu den folgenden Virusfamilien, Subfamilien und Genera gehören:
-
•
Picornaviren (Rhinoviren, mehr als 110 antigenetisch verschiedene Typen nachgewiesen)
-
•
(Para-)Myxoviren (Influenzaviren, Parainfluenzaviren, Respiratory-syncytial-Viren [RSV])
-
•
Adenoviren (mehr als 40 verschiedene Typen bekannt)
-
•
Coronaviren.
30–40% aller Infektionen werden durch Rhinoviren hervorgerufen, 10–15% durch RS-, Influenza-, Parainfluenza -und Adenoviren und 10% durch Coronaviren (Wald 1996).
3. Klinik
Der typische Schnupfen beginnt mit einem 1–2 Tage dauern den Vorstadium mit Kitzeln und Brennen in der Nase sowie Trockenheitsgefühl in Nase und Rachen. Kopfschmerzen und subfebrile Temperaturen sind möglich.
Nach 1–3 Tagen kommt es zum katarrhalischen Stadium. Die Nasenschleimhaut ist gerötet und geschwollen, es besteht eine zunächst wässrige Sekretion. Nasenatmung und Riechvermögen sind beeinträchtigt, die Stimme verändert sich (Rhinophonia clausa). Die Haut des Naseneingangs wird durch die mechanische Irritation wund. Bei Kleinkindern können Nahrungsaufnahme und Schlaf gestört sein, auch Erbrechen und Durchfall sind möglich. Das Nasensekret wird zunehmend visköser und führt zur Bildung von Krusten in den Nasenhaupthöhlen. Die Abheilung erfolgt in 1–2 Wochen. Ein längerer Verlauf ist bei bakterieller Superinfektion möglich (Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenzae). Die akute Rhinitis kann zu Sinusitis maxillaris, Serotympanon, Otitis media oder Bronchitis führen.
4. Infektionsweg und Pathogenese
Die Eintrittspforte für die Infektion ist die Nasenschleimhaut. Die Übertragung erfolgt vermutlich durch Kontakt mit infiziertem Nasensekret über die Hände oder durch Inhalation infektiöser Partikel (Musher 2003). Die Infektion breitet sich in den Zellen der Nasenschleimhaut aus. Durch ein submuköses Ödem wird die Zilien-tragende Schleimhaut abgestoßen, der mukoziliare Transport ist gestört und die Viskosität des Nasensekrets erhöht sich durch Beimengung von abgestoßenen Epithelzellen und Leukozyten. Die Schleimhaut ist am fünften Tag der Infektion am stärksten geschädigt, die Regeneration erfolgt in den nächsten zehn Tagen. Die völlige Wiederherstellung der Transportfähigkeit des Flimmerepithels benötigt aber etwa vier Wochen, wodurch Reinfekte begünstigt werden (Wald 1996). Die maximale Virusvermehrung liegt zwischen dem zweiten und fünften Tag, die höchste Viruskonzentration findet sich im Nasensekret. Beim typischen Schnupfen bleibt die Infektion auf die Schleimhaut der oberen Luftwege beschränkt, es kommt nicht zur Virämie. Der Schweregrad der Infektion scheint von der Konzentration des freigesetzten Kinins abzuhängen (Wald 1996). Die Überwindung des Infektes wird durch das in der Schleimhaut gebildete Interferon ermöglicht. Die Infektion induziert die Bildung von humoralen Antikörpern, die eine erneute Infektion gegen denselben Erreger verhindern oder ihren Verlauf mildern können.
5. Diagnostik
Die Diagnose einer akuten Rhinitis kann bei kleinen Kindern Schwierigkeiten bereiten, ist aber bei älteren Kindern und Erwachsenen aufgrund der Anamnese und des klinischen Bildes leicht zu stellen. Laboruntersuchungen sind im Allgemeinen nicht erforderlich. Die Isolation von Viren im Nasensekret ist möglich, hat aber noch kaum Konsequenz für die Therapie. Mittlerweile stehen sehr gute Verfahren zum gleichzeitigen Nachweis von Influenza-A -und-B-Viren, RSV, Parainfluenzaviren und Adenoviren zur Verfügung.
6. Therapie
Eine kausale Therapie ist nur beschränkt möglich (Influenzaviren). Für Rhinovirus-Infektionen sind verschiedene Substanzen in der Erprobung (Canyonblocker, WIN-Substanzen). Ein Medikament aus dieser Substanzgruppe befindet sich in den USA im Zulassungsverfahren (Pleconaril).
Die Behinderung der Nasenatmung kann mit abschwellenden Nasentropfen und Inhalationen (z.B. von Kamillendampf) gelindert werden, gegen Schmerzen und gelegentliches Fieber können Analgetika/Antipyretika eingesetzt werden.
7. Prävention
Zur Verhinderung einer Ansteckung sollten Kontakte zu Menschen mit akuter Rhinitis vermieden werden (nicht die Hand geben!), im medizinischen Bereich sind Hygienemaßnahmen wichtig (Händedesinfektion usw.). Die Wirksamkeit von Vitamin C zur Verhinderung von Schnupfen ist nicht erwiesen. Die Anfälligkeit für Schnupfen wird durch kaltes Wetter oder nasse Füße nicht erhöht (Wald 1996).
Rhinoviren.
Therese Popow-Kraupp
-
•
Erregerbeschreibung
Rhinoviren (RHV) gehören zu der Familie der Picornaviren, Genus Rhinoviren. Sie sind kleine (20–27 nm), nicht umhüllte RNS-Viren mit Dodekaeder-förmiger Symmetrie, bestehend aus vier Strukturproteinen. RHV sind Äther -und Chloroform-resistent und säurelabil. Bis jetzt konnten mehr als 100 verschiedene Serotypen identifiziert werden. Intertypen und antigene Unterschiede zwischen verschiedenen Stämmen eines Serotyps sprechen für eine Antigendrift. Die Bindungsstelle von RHV an den Zellrezeptor wird durch den so genannten Canyon an der Virusoberfläche gebildet, der durch Faltung der drei Oberflächenproteine an deren Grenzfläche entsteht. Der Canyon ist eine zwischen den Serotypen konservierte Struktur (Couch 2001).
-
•
Epidemiologie
Infektionen mit RHV treten weltweit auf, und etwa 30–50% akuter Atemwegsinfektionen werden durch RHV hervorgerufen. In den gemäßigten Klimazonen können RHV während des ganzen Jahres isoliert werden. Ein Anstieg der Infektionen ist meist im Frühherbst und im späten Frühling zu beobachten. Die höchsten Infektionsraten finden sich bei Kindern, und die Häufigkeit von RHV-bedingten akuten Atemwegsinfektionen nimmt mit zunehmendem Alter ab. RHV werden durch virushaltige Sekrete des Respirationstraktes von Mensch zu Mensch übertragen. Die Infektion erfolgt entweder durch Inhalation von Aerosolen oder über Hände durch den Kontakt mit kontaminierten Gegenständen (z.B. Türklinken). RHV sind relativ widerstandsfähig und überleben einige Stunden auf kontaminierten Oberflächen. Neben der Familie (Einschleppen meist durch Kinder im Vorschulalter, Ansteckungsrate innerhalb der Familie ca. 50%) gelten Schulen und Kasernen als Hauptübertragungsorte für RHV-Infektionen (Dick et al. 1998).
-
•
Erreger-Wirts-Beziehung
Die Inkubationszeit von RHV-Infektionen beträgt 1–4 Tage. Die höchsten Viruskonzentrationen finden sich nach 2–3 Tagen im Nasensekret, wobei ein direkter Zusammenhang zwischen der Viruskonzentration und dem Auftreten von Symptomen bzw. dem Schweregrad der Erkrankung besteht. Primär werden Epithelzellen der Nasenschleimhaut infiziert. Gravierende pathologische Veränderungen als Folge der RHV-Infektion treten nicht auf. Die für RHV-Infektionen charakteristische Hyperämie der Schleimhaut, das starke Ödem des subepithelialen Bindegewebes und die beträchtliche Transsudation von Serumproteinen in das Nasensekret werden zum Teil durch Freisetzung vasoaktiver Peptide und Aktivierung neurologischer Reflexe hervorgerufen. Eine Virämie im Rahmen einer RHV-Infektion konnte bis jetzt noch rnicht nachgewiesen werden. Die Freisetzung von Interferon (vor allem α-Interferon), das Auftreten virusspezifischer zytotoxischer T-Zellen und die Bildung von virusneutralisierenden Antikörpern (überdeckung des Canyons) im Serum und im Nasensekret führen zur Viruselimination und zur Beendigung der Infektion. Neutralisierende Antikörper bleiben über längere Zeit nachweisbar und schützen vor einer Reinfektion mit dem gleichen Serotyp.
-
•
Krankheitsspektrum
RHV verursachen die typische Erkältungskrankheit, den so genannten Schnupfen, deren Symptome bis zu zwei Wochen dauern können. Eine rinnende und verstopfte Nase, Halsschmerzen, Husten und Heiserkeit sind die häufigsten Beschwerden. Fieber und andere Allgemeinsymptome sind bei gesunden Erwachsenen eher ungewöhnlich (10–20%) (Gwaltney und Jordan 1964).
Bei Säuglingen, Kleinkindern und immunsupprimierten Patienten können RHV auch Infektionen der tiefen Atemwege (Tracheobronchitis, Pneumonie) hervorrufen (Kellner et al. 1988). Infektionen mit RHV können zu einer akuten Verschlechterung chronischer Bronchitiden führen und Anfälle bei Asthma-Patienten auslösen. Sinusitis und Otitis media, meist bedingt durch bakterielle Superinfektionen, treten als Komplikationen von RHV-Infektionen auf.
-
•
Virologische Diagnostik
Erregernachweis
Der Virusnachweis erfolgt mittels Nukleinsäure-Amplifikation (RT-PCR) oder Virusisolierung aus abgesaugten Nasen-Rachensekret, Nasenspülflüssigkeit, Trachealsekret, Bronchuslavage, Obduktionsmaterial (Trachealsekret, Lungengewebe in Transportmedium oder steriler physiologischer NaCl-Lösung). Die Proben sollten möglichst rasch und gekühlt (Gefäß mit Eiswürfeln) transportiert werden (Al-Nakib und Tyrrell 1988, Steininger et al. 2001).
Antikörpernachweis
Nicht von praktischer Relevanz.
-
•
Antivirale Therapie
Es gibt keine zugelassenen antiviralen Substanzen. Nicht zugelassene, in der Prüfung befindliche antivirale Substanzen: So genannte Canyon-Blocker (Pleconaril) oder Picornavirus-spezifische, kurze interferierende RNS-Fragmente (siRNAs) (Whitton et al. 2005).
-
•
Prophylaxe
Kontaktprophylaxe, Händehygiene.
-
•
Meldepflicht
Keine.
-
•
Referenzzentren
Konsiliarlaboratorium für respiratorische Infektionen (viral), Ansprechpartner: Dr. Dr. R. Heckler, Niedersächsisches Landesgesundheitsamt Hannover, Roesebeckstr. 4–6, 30449 Hannover; Telefon: 0511/4505–201, Fax: 0511/4505–240, E-Mail: Rolf.Heckler@nlga.niedersachsen.de
Speziallabor für respiratorische Virusinfektionen, Ansprechpartner: Prof. Dr. T. Popow-Kraupp, Institut für Virologie der Medizinischen Universität Wien, Kinderspitalgasse 15, A-1090 Wien; Telefon: 0043 1 40490–79521, Fax: 0043 1 40490–9795, E-Mail: theresia.popow-kraupp@meduniwien.ac.at
-
•
Literatur
Literatur
- Al-Nakib W., Tyrrell D.A. Picornaviridae: Rhinoviruses-common cold viruses. In: Lennette E.H., Halonen P., Murphy F.A., editors. Vol. II. Springer; Heidelberg: 1988. pp. 723–742. (Laboratory Diagnosis of Infectious Diseases, Principles and Practice). [Google Scholar]
- Couch R.B. Rhinoviruses. In: Knipe D.M., Howley P.M., editors. Fields Virology. 4th ed. Lippincott Williams and Williams; Philadelphia: 2001. pp. 777–797. [Google Scholar]
- Dick E.C., Inhorn S.L., Glezen W.P. Rhinoviruses. In: Feigin R.D., Cherry J.D., editors. 4th ed. Vol. II. Saunders Company; Philadelphia: 1998. pp. 1839–1865. (Textbook of Pediatric Infectious Diseases). [Google Scholar]
- Gwaltney J.M., Jordan W.S. Rhinoviruses and respiratory disease. Bacteriol Rev. 1964;28:409–422. doi: 10.1128/br.28.4.409-422.1964. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kellner G., Popow-Kraupp T., Kundi M. Contribution of rhinoviruses to respiratory viral infections in childhood: A prospective study in a mainly hospitalized infant population. J Med Virol. 1988;25:455–469. doi: 10.1002/jmv.1890250409. [DOI] [PubMed] [Google Scholar]
- Steininger C., Aberle S.W., Popow-Kraupp T. Early detection of acute rhinovirus infections by rapid reverse transcription-PCR assay. J Clin Microbiol. 2001;39:129–133. doi: 10.1128/JCM.39.1.129-133.2001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Whitton J.L., Cornell C.T., Feuer R. Host and virus determinants of picornavirus pathogenesis and tropism. Nature Reviews Microbiology. 2005;3:765–776. doi: 10.1038/nrmicro1284. [DOI] [PubMed] [Google Scholar]
B3.2. Sinusitis
1. Vorbemerkungen
1.1. Definition
Die Sinusitis ist die Entzündung der Schleimhautauskleidung einer oder mehrerer Nasennebenhöhlen. Man unterscheidet zwischen der akuten und der chronischen Sinusitis. Zu den Nasennebenhöhlen gehören die Kieferhöhlen, die Siebbeinzellen, die Stirnhöhlen und die Keilbeinhöhlen. Die Nasennebenhöhlen sind von einem Flimmerepithel ausgekleidet, das Becherzellen und Schleimdrüsen enthält. Der Schleim, der die Schleimhaut bedeckt, ist an der Oberfläche mukös, um Partikel (z.B. Bakterien) aufnehmen zu können, auf der Zilien-Seite serös, um die Transportfunktion des Flimmerepithels zu ermöglichen.
1.2. Epidemiologie
Etwa 5% der mitteleuropäischen Bevölkerung leiden an akuter oder chronischer Sinusitis. Die akute Sinusitis entsteht meist in der Folge eines Virusinfekts der oberen Luftwege, der durch Schädigung der Schleimhaut in den Nasennebenhöhlen eine bakterielle Superinfektion ermöglicht (Cherry und Dudley 1992, Newton 1996). Bei Schwimmern kann chlorhaltiges oder mit Bakterien kontaminiertes Wasser eine Sinusitis verursachen. Allergien, angeborene Schleimhautschäden (Mukoviszidose, Kartagener-Syndrom) und Immundefekte disponieren zu Sinusitiden.
2. Erregerspektrum
Etwa zwei Drittel der Sinusitiden werden durch Pneumokokken und Haemophilus influenzae ausgelöst. Bei Kindern sind bis zu 20% der Infektionen durch Moraxella catarrhalis bedingt. Je nach Patienten sind auch fakultativ aerobe, gramnegative Stäbchen in bis zu 25% der Fälle nachweisbar. Der Anteil β-Lactamase-produzierender Stämme von H. influenzae und M. catarrhalis liegt zwischen 20 und 30% mit steigender Tendenz (Wald 1995). Bei Kindern mit Mukoviszidose muss auch an Pseudomonas aeruginosa und Burkholderia cepacia gedacht werden. Ein Virusnachweis (Rhino-, Adeno-, Parainfluenza -und Influenzaviren) ist in etwa 5–20% der Fälle möglich. Bei chronischer Sinusitis liegen in der Regel Mischinfektionen vor, in über 60% der Fälle unter Beteiligung von Anaerobiern, insbesondere Prevotella-Arten und anaerobe grampositive Kokken (Brook 2005, Finegold et al. 2002). Sowohl im Rahmen nosokomialer Infektionen (transnasal beatmete Patienten, Dialyse-Patienten) als auch ambulant in einem Endemiegebiet erworben können selten Pilze Erreger von Sinusitiden sein. Hierzu gehören Asperrgillus-Arten, aber auch so genannte Schwarze Hefen (Phaeohyphomyceten) und Zygomyzeten.
3. Akute Sinusitis
3.1. Klinik
Anhaltende, meist einseitige Sekretion aus der Nase nach einer Rhinitis weist auf eine akute Sinusitis hin. Hinzu kommen Gesichts -und Kopfschmerzen, die dumpf, bohrend oder stechend sein können und sich bei Druckerhöhung (z.B. durch Bücken oder Husten) verstärken. Bei Erwachsenen ist am häufigsten die Kieferhöhle betroffen, seltener Siebbein-, Stirn -und Keilbeinhöhle. Weder klinische Symptome noch radiologische Untersuchungsbefunde erlauben eine Unterscheidung hinsichtlich einer bakteriell oder viral bedingten Ätiologie mit akzeptabler Wahrscheinlichkeit (Lacroix et al. 2002).
3.2. Infektionsweg und Pathogenese
Die Infektion der Nasennebenhöhlen erfolgt über ihre Ostien von den Nasenhaupthöhlen aus. Ein Virusinfekt schädigt die Nebenhöhlenschleimhaut. Ein direkter zytopathischer Effekt ist z.B. bei Adenoviren nachgewiesen, bei anderen Spezies, wie z.B. Rhinoviren, dagegen nicht. Die Infektion kann das Ostium einengen und die Zusammensetzung des Schleims, der die Nebenhöhle auskleidet, verändern (Wald 1996). Der Luftaustausch zwischen Nasenhaupt -und Nasennebenhöhle ist beeinträchtigt, der Abtransport des Schleims verzögert sich bzw. es kommt zum Sekretstau. Die Zilien-Funktion ist durch Sauerstoffmangel (im Lumen der Nebenhöhle und in der Schleimhaut) beeinträchtigt. Die Bakterien gelangen beim Schneuzen oder infolge von Unterdruck in die Nasennebenhöhlen und können sich in der geschädigten Schleimhaut festsetzen. Bei Erwachsenen — selten bei Kindern — kann eine Sinusitis maxillaris von einer entzündeten Zahnwurzel ausgehen (typische fötide Sekretion).
3.3. Diagnostik
Die Diagnose stützt sich auf den klinischen Aspekt, die bildgebenden Verfahren und den Keimnachweis. Sie kann durch eine Röntgenuntersuchung gesichert werden. Charakteristisch für eine akute Sinusitis ist ein Sekretspiegel in der betroffenen Nebenhöhle. Ein durch Punktion oder Endoskopie gewonnenes Aspirat ist bei Verdacht auf Erreger mit besonderen Resistenzmustern bzw. im Rahmen von rezivierenden Infektionen für eine mikrobiologische Diagnostik unerlässlich, Abstriche oder Material von nasalen Spülungen sind dagegen wertlos (Sande und Gwaltney 2004).
3.4. Therapie
Ziel der Therapie ist die Ausheilung der akuten Entzündung der Nasennebenhöhle mit Wiederherstellung der Drainage und die Verhinderung von Komplikationen und Chronifizierung. Zur Behandlung gehören abschwellende Nasentropfen und Inhalationen (mit Kamilledampf oder ätherischen Ölen) sowie die Bekämpfung der Infektion durch Wärmeanwendung und der Einsatz von Antibiotika. Die antibiotische Therapie sollte eingeleitet werden, noch bevor das Ergebnis der bakteriologischen Untersuchung vorliegt (von Cauwenberge und Ingels 1996). Mittel der Wahl ist Amoxicillin (3 × 1 g/d) über 10–14 Tage, aber mindestens sieben Tage nach Beginn einer deutlichen Minderung der klinischen Symptome (Conrad und Jenson 2002). Bei dentogenen Prozessen ist die Gabe von Clindamycin (4 × 150 mg/d) vorzuziehen (Zambrano 1993). Bei Verdacht auf β-Lactamase-produzierende Keime sind Amoxicillin-Clavulansäure (3 × 1,2 g/d) oder Cephalosporine (z.B. Cefuroximaxetil, 2 × 250–500 mg/d) (Grimwood et al. 1997) geeignet. Tritt nach 48 Stunden keine Besserung ein, sollte die Nebenhöhle gespült und das aspirierte Sekret bakteriologisch untersucht werden (Carroll und Reimer 1996, Wald 1996). Die Spülung der Kiefernhöhle wird über den unteren Nasengang vorgenommen, die der Stirnhöhle über eine Eröffnung ihrer Vorderwand (Becksche Bohrung). Bei Kindern ist eine Spülung der Nasennebenhöhlen zur Behandlung der akuten Sinusitis selten erforderlich. In der amerikanischen Literatur wird auch eine abwartend-beobachtende Haltung vor einer antibiotischen Therapie propagiert (Piccirillo 2004, Poole und Portugal 2005).
3.5. Komplikationen
Komplikationen entstehen durch Übergreifen der Entzündung auf benachbarte Strukturen und betreffen am häufigsten die Orbita (Abb. B3-1 ), seltener das Endokranium oder den knöchernen Schädel.
Abb. B3-1.

Computertomographie der Nasennebenhöhlen eines 13-jährigen Jungen mit orbitaler Komplikation einer Siusitis.
3.5.1. Orbitale Komplikationen
Orbitale Komplikationen sind fast ausschließlich Folge einer akuten Entzündung der Siebbeinzellen, die nur durch eine dünne Knochenwand von der Orbita getrennt sind und über klappenlose Venen mit ihr in Verbindung stehen. Wegen der frühen Ausformung der Siebbeinzellen können auch kleine Kinder betroffen sein. Ein entzündliches Ödem von Ober -und Unterlid weist auf eine Beteiligung der Augenhöhle hin (Abb. B3-2 ). In diesem Stadium kann durch eine antibiotische Therapie mit Amoxicillin-Clavulansäure oder Oralcephalosporinen und abschwellende Maßnahmen (abschwellende Nasentropfen, Abspreizung der mittleren Nasenmuschel) eine Heilung erreicht werden. Unterbleibt eine Therapie, kommt es zur orbitalen Zellulitis mit Durchbruch des Eiters durch die Lamina papyracea, zum subperiostalen Abszess und schließlich zur Orbitalphlegmone, bei der das Auge höchst gefährdet ist. Ein Einbruch der Entzündung in den Bereich der Orbitaspitze führt zum Apex-orbitae-Syndrom mit Beteiligung des II.-VII. Hirnnerven und der Gefahr der Erblindung. Zur Behandlung der orbitalen Zellulitis, des subperiostalen Abszesses und der Orbitalphlegmone sind Antibiotika alleine nicht ausreichend. Bei der orbitalen Zellulitis müssen die erkrankten Siebbeinzellen drainiert werden, beim subperiostalen Abszess und der Orbitalphlegmone ist zusätzlich die Orbita zu entlasten.
Abb. B3-2.

Linksseitige orbitale Komplikation einer Pneumokokken-bedingten Sinusitis der Nasennebenhöhlen und der Kieferhöhle bei einem 13 Jahre alten Jungen (zu Abb. B3-1).
3.5.2. Intrakranielle Komplikationen
Etwa 5% aller Patienten mit Sinusitis weisen endokranielle Komplikationen auf. Sie gehen meist von der Stirnhöhle oder den Siebbeinzellen aus (Jones et al. 1995). Die Ausbreitung erfolgt über Knochenvenen oder direkt über entzündlich oder traumatisch bedingte Lücken im Knochen. Die häufigste endokranielle Komplikation einer Sinusitis ist der Hirnabszess, gefolgt von der Meningitis, dem epi -und subduralen Abszess und der Sinus-cavernosus-Thrombose. Die Therapie endokranieller Komplikationen besteht in der operativen Sanierung der betroffenen Nasennebenhöhle, der Abszess-Drainage durch den Neurochirurgen und einer antibiotischen Therapie, beginnend mit einer Kombination aus Penicillin G, einem Cephalosporin (z.B. Cefotaxim) und Metronidazol. Liegt das Ergebnis der bakteriologischen Untersuchung vor, wird die antibiotische Therapie entsprechend dem Antibiogramm umgestellt. Die Antibiotika müssen hoch dosiert und über lange Zeit (3–6 Wochen) verabreicht werden (Giannoni et al. 1997, Rosenfeld und Rowley 1994).
3.5.3. Knochenkomplikationen
Ausgehend von einer Sinusitis frontalis breitet sich die Entzündung direkt über die Gefäße oder — selten — auf hämatogenem Weg in der Diploe-Schicht des Stirnbeins aus. Es besteht die Gefahr des Durchbruchs nach innen (endokranielle Komplikation) oder nach außen (subperiostaler Abszess). Betroffen sind vor allem Jugendliche. Im Bereich des erkrankten Knochens tritt eine schmerzhafte Schwellung auf. Die BSG ist stark beschleunigt, das CRP erhöht. Die Diagnose wird nach dem klinischen Aspekt und der Computertomographie gestellt. Die Therapie beruht auf der operativen Sanierung der erkrankten Stirnhöhle und der Entnahme des befallenen Knochens in Kombination mit einer hoch dosierten antibiotischen Therapie (2–3 Wochen i.v., anschließend sechs Wochen p.o.), möglichst nach Antibiogramm.
4. Chronische Sinusitis
4.1. Klinik
Die chronische Sinusitis als eigenes Krankheitsbild entsteht auf dem Boden einer nicht ausgeheilten akuten Sinusitis. Die Beschwerden sind geringer und untypischer als bei der akuten Entzündung. Kopfschmerzen und ein dumpfes Druckgefühl, meist beidseitige Sekretion aus der Nase und in den Rachen, Behinderung der Nasenatmung durch die Schleimhautschwellung oder Polypen, unter Umständen Riechstörungen (respiratorische Hyp-oder Anosmie) werden beklagt (von Cauwenberge und Ingels 1996).
4.2. Pathogenese
Die chronische Sinusitis führt zu einer Schädigung der Nebenhöhlenschleimhaut mit Leukozyten-Infiltration und Einlagerung von Flüssigkeit und schließlich zur Bildung von Polypen (Melen 1994). Die chronische Sinusitis im Kindesalter tritt häufig zusammen mit Ohrproblemen auf (akute Mittelohrentzündung, chronische Belüftungsstörung). Sie kann sich durch subfebrile Temperaturen und Entwicklungsstörungen äußern (von Cauwenberge und Ingels 1996). Das Postulat einer durch Pilz-(insbesondere Aspergillus-) Besiedlung der Sinus hervorgerufene, vornehmlich allergische chronische Sinusitis ließ sich in prospektiven Studien weder mikrobiologisch noch ex iuvantibus bestätigen (Weschta et al. 2004).
4.3. Befund und Diagnostik
Die Diagnose stützt sich auf die Inspektion und die Computertomographie (Calderon et al. 1996). Bei der Inspektion mithilfe starrer Optiken (nach Abschwellung) ist eine Verlegung des Kieferhöhlenostiums erkennbar, oder Polypen verlegen den mittleren Nasengang bzw. die Choane (Choanalpolyp, ausgehend von der Kiefernhöhle oder dem Siebbein). Die Computertomographie ermöglicht die Beurteilung der Schleimhautbeschaffenheit in den einzelnen Nebenhöhlen und ist für die Diagnose der chronischen Sinusitis unverzichtbar. Auch in der konventionellen Röntgenuntersuchung können sich Hinweise auf eine chronische Sinusitis (Schleimhautschwellung, Polypen) ergeben.
4.4. Therapie
Bei der Erstmanifestation einer chronischen Sinusitis sollte über 3–4 Wochen antibiotisch behandelt werden, möglichst nach Antibiogramm. Nach Allergien, Medikamenten-Unverträglichkeiten, angeborenen Schleimhautstörungen (Mukoviszidose, Kartagener-Syndrom) oder Immundefekten muss gefahndet werden. Die Spülbehandlung ist bei der chronischen Sinusitis meistens nicht erfolgreich. Bei Rezidiven, vor allem mit Polypen-Bildungen, ist eine Operation mit Entnahme der Polypen und Wiederherstellung der Nebenhöhlenbelüftung notwendig.
Bei adäquater Behandlung hat die akute Sinusitis eine günstige Prognose. Die chronische Sinusitis neigt zu Rezidiven und gefährdet vor allem Patienten mit Immundefekten.
Als Prävention bei Kindern, die schon eine Sinusitis hatten, ist ein Schwimmverbot zu überlegen. Sind die Adenoide vergrößert, sodass sie zu einer Behinderung der Nasenatmung führen, sollte die Adenotomie durchgeführt werden. Wurde eine Allergie nachgewiesen, muss diese behandelt werden.
B3.3. Otitis externa, Otitis media, Mastoiditis
1. Otitis externa
1.1. Definition
Die Otitis externa ist eine akute oder chronische Entzündung der Haut des Gehörgangs. Diese enthält im äußeren, knorpeligen Anteil des Gehörgangs Talg und Ceruminaldrüsen, im inneren, knöchernen Anteil ist sie dünn, fest mit dem Periost verwachsen und besitzt keine Hautanhangsgebilde. Das Cerumen wirkt wasserabstoßend und verhindert wegen seines sauren pH-Wertes das Wachstum von Bakterien (Feigin 1992).
1.2. Epidemiologie
Die Otitis externa kommt gehäuft während der Badesaison vor, begünstigt durch feucht-warmes Klima.
1.3. Erregerspektrum
Am häufigsten ist bei der Otitis externa Staphylococcus aureus nachweisbar. Aber auch Pseudomonas aeruginosa, Proteus spp. und andere Enterobakterien, Streptococcus pyogenes, Candida albicans, Aspergillus fumigatus und A. terreus sowie Herpes-simplex -und Varicella-Zoster-Viren (Zoster oticus) sind für jeweils mehr als ein Prozent der Fälle verantwortlich.
1.4. Klinik
Die Otitis externa beginnt mit Juckreiz im Gehörgang, später kommen Schmerzen, Druckgefühl und Hörminderung hinzu. Druck auf den Tragus verstärkt die Schmerzen. Manchmal besteht eine eitrige Sekretion. Bei älteren Menschen mit Diabetes mellitus besteht die Gefahr der Otitis externa maligna, einer durch P. aeruginosa verursachten Entzündung, die auf das Felsenbein und die Schädelbasis übergreifen kann und mit Komplikationen wie Fazialisparese, Osteomyelitis bzw. endokranieller Infektion einhergehen kann.
1.5. Infektionsweg und Pathogenese
Die Erreger kommen von außen oder — bei einer chronischen Mittelohrentzündung — vom Mittelohr in den Gehörgang. Die Infektion wird durch eine Schädigung der Haut ermöglicht, z.B. durch unsachgemäße Reinigung des Gehörgangs, Aufstau von Cerumen bei Exostosen, Druckstellen von Hörgeräten oder durch Fremdkörper, besonders bei Kindern. Gefährdet sind vor allem Diabetiker.
1.6. Befund und Diagnostik
Der Gehörgang ist gerötet und geschwollen und außerordentlich schmerzhaft bei Reinigungsversuchen, es besteht ein Tragus-Druckschmerz.
Bei der Otitis externa maligna sind im Gehörgang Granulationen am Übergang vom knorpeligen zum knöchernen Anteil erkennbar. Die Ausbreitung der Entzündung kann mittels Computertomographie und Knochen-Szintigraphie festgestellt werden.
Zum Nachweis von Bakterien oder Pilzen erfolgt ein Ohrabstrich. Der Zoster oticus kann mit minimalen Bläschen einhergehen, ein Virusnachweis ist dann mittels Antigennachweis oder PCR möglich.
1.7. Therapie
Lokale Behandlung mit antiseptischen (z.B. Triphenyl-Farbstoffe, Solutio-Castellani DRF) oder antibiotischen Lösungen (z.B. Ciprofloxacin-Ohrentropfen) oder Salbenstreifen-Tamponaden (z.B. Gentamycin-Salbe), zusätzlich Kortison zur Abschwellung (Gentamycin -und Kortison-Salbe). Liegt ein Abszess vor, muss inzidiert werden. Eine systemische Therapie ist selten erforderlich. Beim Baden und Duschen sollte der Gehörgang mit einem wasserabweisenden Pfropfen verschlossen werden. Bis zur vollkommenen Ausheilung ist Schwimmbadkarenz ratsam. Beim Zoster oticus sind Aciclovir, Famciclovir und Brivudin wirksam.
1.8. Prävention
Der Gehörgang sollte nicht mit Wattestäbchen oder anderen Hilfsmitteln gereinigt werden. Exostosen, die zu Entzündungen führen, müssen abgetragen werden.
2. Otitis media und Mastoiditis
2.1. Definition
Die akute Otitis media ist eine rasch auftretende Entzündung der Schleimhautauskleidung des Mittelohrs, die nach wenigen Tagen wieder abklingt (Feigin et al. 1992). Infolge ungenügender Behandlung, bei virulenten Erregern oder bei Patienten mit eingeschränkter Infektabwehr kann die Entzündung auf die Zellen des Warzenfortsatzes (Mastoiditis), der Jochbogenwurzel (Zygomaticitis) oder der Felsenbeinspitze (Petroapiscitis) übergreifen. Eine Mastoiditis kann auch durch ein Cholesteatom, das das Antrum verlegt und damit die Belüftung und Drainage der Warzenfortsatzzellen blockiert, verursacht werden.
2.2. Epidemiologie
Die akute Otitis media ist eine sehr häufige Infektionskrankheit, die insbesondere Kinder im Vorschulalter betrifft. Bis zum dritten Lebensjahr haben mehr als 60% aller Kinder eine akute Otitis media durchgemacht, am häufigsten zwischen dem sechsten und zwölften Lebensmonat. Genetische und soziale Faktoren spielen eine Rolle. Kinder, die unter ungünstigen sozialen Bedingungen oder in Tagesstätten aufwachsen, erkranken häufiger (Uhari et al. 1996). Ähnlich wie die akuten Infekte der oberen Luftwege tritt die akute Otitis media gehäuft in den Wintermonaten auf. Aus einer akuten Entzündung des Mittelohrs kann sich eine Mastoiditis entwickeln.
2.3. Erregerspektrum
Bei Kindern sind für die akute Otitis media hauptsächlich verantwortlich (Feigin et al. 1992):
-
•
29–48% S. pneumoniae (vor allem die Serotypen 19 F, 14, 23 F, 6 B, 3, 9 V)
-
•
20–36% H. influenzae
-
•
3–23% M. catarrhalis.
Bei Neugeborenen finden sich häufiger Enterobakterien, S. aureus und P. aeruginosa. Anaerobier, insbesondere Peptostreptokokken, treten meist in Kombination mit anderen Keimen auf und werden in weniger als 15% der Fälle isoliert. Selten werden S. aureus und β-hämolysierende Streptokokken gefunden (Kilpi et al. 2001). Bei 5–15% der untersuchten Mittelohrsekrete sind Viren nachweisbar, am häufigsten RS-Viren, Rhino-, Influenza-, Parainfluenza -und Adenoviren (Bluestone und Klein 1995, Heikkinen et al. 1999, Pitkäranta et al. 1998, Vesa et al. 2001). Auch gemischt bakteriell-virale Infekte wurden beschrieben.
Bei Erwachsenen sind vor allem H. influenzae (26%) und S. pneumoniae (21%) für die akute Otitis media verantwortlich, selten auch S. pyogenes und M. catarrhalis (jeweils 3%). In etwa 30% werden keine Keime nachgewiesen (Bluestone und Klein 1995, Feigin et al. 1992, Willner et al. 1995). Die Einführung der molekularen Diagnostik erbrachte für einen Teil der kulturell sterilen Otitis-media-Fälle ebenfalls den Nachweis der zuvor genannten Bakterien, sodass der fehlende kulturelle Nachweis als durch bereits angesetzte Antibiotikatherapien, die Wirkung der Wirtsabwehr und bakterielle Autolyse-Phänomene begründet anzusehen ist (Post et al. 1995).
Die Mastoiditis kann durch viele verschiedene Erreger verursacht werden, am häufigsten durch S. pneumoniae, β-hämolysierende Streptokokken der Gruppe A und S. aureus. H. influenzae ist bei der Mastoiditis seltener nachweisbar als bei der akuten Otitis media (Lewis und Cherry 1992, Vassbotn et al. 2002).
2.4. Klinik
Die akute Otitis media folgt meistens einem Infekt der oberen Luftwege. Nach einem kurzen Stadium mit Druck -und Völlegefühl im Ohr und einer diskreten Hörminderung als Ausdruck der Tuben-Funktionsstörung treten Ohrenschmerzen und Fieber auf, die Hörminderung nimmt zu. Innerhalb weniger Stunden verstärken sich diese Symptome, hinzu kommen pulsierende Ohrgeräusche und Allgemeinsymptome (Appetitlosigkeit, Gliederschmerzen, gelegentlich Durchfall, Unruhe). Die Temperatur kann bis 40 °C ansteigen, die Ohrenschmerzen sind dumpf und bohrend. Ohrmuschel und Mastoid können berührungsempfindlich sein. Bei Kleinkindern äußern sich die Schmerzen durch erhöhte Reizbarkeit und Unruhe, Greifzwang nach dem Ohr oder unaufhörliches Weinen und Schreien.
In diesem Stadium, 2–3 Tage nach Auftreten der ersten Symptome, perforiert das Trommelfell. Es kommt zu einer blutig-serösen, später eitrigen Sekretion aus dem Gehörgang, und die Schmerzen und Allgemeinsymptome lassen nach. Der Sekretabfluss versiegt nach 1–2 Tagen. Die Heilung des Trommelfells erfolgt innerhalb von drei Wochen, kann aber auch längere Zeit in Anspruch nehmen.
Komplikationen entstehen durch Übergreifen der Entzündung auf die pneumatisierten Zellen des Felsenbeines und auf benachbarte Regionen. Eine Mastoiditis kann auch nach einem symptomfreien Intervall auftreten. Es gibt sogar Fälle von Mastoiditis mit sehr kurzer Anamnese ohne vorangegangene Mittelohrentzündung. Die Patienten haben häufig Fieber und machen einen kranken Eindruck.
2.5. Infektionsweg und Pathogenese
Eine entscheidende Rolle bei der Entstehung der akuten Otitis media spielt die Eustachische Röhre. Als Folge eines Virusinfekts der oberen Luftwege gelangen durch Reflux, Aspiration oder Insufflation Keime über die Tube ins Mittelohr (Fireman 1997). Eine hämatogene Infektion ist selten (Feigin et al. 1992). Der vorangegangene Virusinfekt schädigt die Mittelohrschleimhaut, sodass sich Bakterien ansiedeln können, und er führt zur Schwellung der Tuben-Schleimhaut, wodurch die Drainagefunktion der Tube zum Erliegen kommt. O2-Spannung und pH-Wert in den Zellen der Mittelohrschleimhaut nehmen ab, wodurch der bakterielle Infekt begünstigt wird (Feigin et al. 1992). Die kurze, gerade Tube und die häufig ausgeprägte Vergrößerung der Adenoide erleichtern bei kleinen Kindern die Entstehung der akuten Otitis media. Die Adenoide können die Tuben-Funktion beeinträchtigen und Erregerreservoir sein (Bluestone und Klein 1995). Auch Patienten mit einer Gaumenspalte neigen wegen der Störung der Tuben-Funktion zu Mittelohrentzündungen.
Die akute Otitis media erstreckt sich auch auf die Schleimhaut der Zellen des Mastoids. Dabei können die engen Belüftungswege verlegt werden, es entsteht eine Infektion in einem abgeschlossenen Hohlraum. Die Entzündung im Warzenfortsatz führt zu Knochenabbau, bei längerem Verlauf auch zu Knochenneubildung. Der Eiter aus den Mastoid-Zellen kann sowohl nach außen durchbrechen und im Bereich des Planum mastoideum einen subperiostalen Abszess bilden als auch — bei Kindern — über Spalten in der knöchernen Gehörgangswand zur Senkung der oberen Gehörgangsauskleidung führen. Ein Durchbruch durch die Mastoid-Spitze in die Halsweichteile (Bezold-Mastoiditis) hat Schmerzen und eine Schwellung der betroffenen Halsseite zur Folge und führt zur Schonhaltung des Kopfes. Die Entzündung in der Pyramidenspitze verursacht dumpfe Schmerzen hinter dem Auge (als Folge eines Trigeminus-Reizes) und in der Tiefe des Ohres und kann zu einer Abduzensparese (Gradenigo-Syndrom) führen.
2.6. Befund und Diagnostik
Die Diagnose der akuten Otitis media kann nach der Anamnese und dem Ohrbefund gestellt werden. Zu Beginn führt die Tuben-Störung zu Unterdruck mit Einziehung des Trommelfells und zu Flüssigkeitsansammlung im Mittelohr. Im weiteren Verlauf kommt es zur Hyperämie der Trommelfellgefäße, zu Rötung und Vorwölbung des Trommelfells und schließlich zur Trommelfellruptur (meist im vorderen unteren Quadranten) mit Auslaufen des entzündlichen Sekrets aus dem Mittelohr. Die Beweglichkeit des Trommelfells und die Schalleitung vom Trommelfell zum Innenohr werden zu Beginn der Entzündung durch den Unterdruck im Mittelohr, später durch das entzündliche Sekret zunehmend eingeschränkt. Die Entzündungsparameter im Blut sind erhöht.
Auf den Röntgenaufnahmen nach Schüller sind die Zellen des Warzenfortsatzes verschleiert, die Zellsepten aber unversehrt. Als Differentialdiagnose kommt eine Otitis externa in Betracht. Hierbei ist der Gehörgang durch die entzündlich bedingte Schwellung seiner Auskleidung eingeengt, charakteristisch ist eine Verstärkung der Schmerzen bei Druck auf den Tragus. Das Allgemeinbefinden ist weniger beeinträchtigt als bei der Otitis media.
Zur Diagnose der Mastoiditis führen die Anamnese und das klinische Bild. Der typische Befund einer Mastoiditis mit der abstehenden Ohrmuschel (Abb. B3-3 ) und der bei Berührung schmerzhaften retroaurikulären Schwellung ist nicht zu übersehen. Das Trommelfell weist immer pathologische Veränderungen auf. Auf der Röntgenaufnahme nach Schüller ist der Warzenfortsatz verschattet, knöcherne Zellsepten können eingeschmolzen sein. Bei dem Verdacht auf Komplikationen einer Mastoiditis ist die Computertomographie erforderlich.
Abb. B3-3.
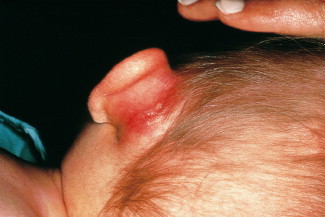
Akute Pneumokokken-bedingte Mastoiditis bei einem 2-jährigen Jungen.
Die BSG ist stark beschleunigt (unter Umständen mit Werten > 100 mm in der ersten Stunde), Leukozyten-Zahl und CRP sind erhöht.
Bei der Operation kann Sekret aus dem Mastoid und dem Mittelohr für die bakteriologische und virologische Untersuchung gewonnen werden. Besteht der Verdacht auf endokranielle Komplikationen, ist eine Lumbalpunktion erforderlich. Bei Anzeichen einer Sepsis müssen Blutkulturen angelegt werden.
2.7. Therapie
Therapieziel ist die Ausheilung der Entzündung und die Wiederherstellung der Schallübertragung. Der schmerzhafte Verlauf soll abgekürzt und die Entstehung von Komplikationen verhindert werden. Dies gelingt durch den Einsatz von Antibiotika. Die Antibiotikatherapie hat das Bild der akuten Otitis media verändert. Die Infektion kann eingedämmt werden, bevor eine Spontanperforation des Trommelfells eintritt, eine Parazentese ist nur noch selten erforderlich. Die Zahl der Komplikationen, die in der vorantibiotischen Ära oft zum Tod führten, ist deutlich zurückgegangen.
Die Therapie der Wahl beruht auf der Gabe von Amoxicillin für 5–10 Tage (Bluestone und Klein 1995, Scholz 1997). Tritt damit nach 2–3 Tagen keine Besserung der klinischen Symptomatik ein, wird die Therapie auf Amoxicillin plus Clavulansäure (Augmentan®), ein neueres Makrolid (Clarithromycin, Azithromycin) oder auf ein orales Cephalosporin der zweiten Generation umgestellt. Dieses Vorgehen gilt auch für die Otitis media bei Neugeborenen und Säuglingen (Turner et al. 2002). Geht dem Infekt ein Aufenthalt in Ländern mit einer hohen Rate an Penicillin-resistenten Pneumokokken voraus (z.B. Spanien, Ungarn, Südafrika), wird sofort mit Cephalosporinen oder neueren Makroliden (Clarithromycin oder Azithromycin) therapiert (Block 1997, Scholz 1997). Abschwellende Nasentropfen sollen die Drainagefunktion der Tube normalisieren.
Kommt es nach 1-bis 2-tägiger Therapie nicht zur Besserung der Symptome, sollte die Parazentese (bei Kindern in Narkose, dann eventuell auch Adenotomie) durchgeführt werden, um das Mittelohr zu entlasten und Sekret für die bakteriologische Untersuchung zu gewinnen.
Nicht jede akute Otitis media muss antibiotisch behandelt werden, denn die Selbstheilungsrate ist hoch (> 60%). Der Verzicht auf ein Antibiotikum ist möglich, wenn der Patient nur gering beeinträchtigt ist und engmaschige ärztliche Kontrollen gewährleistet sind (Pichichero und Casey 2003, Rosenfeld 1996). Sollten die Beschwerden zunehmen oder Symptome auf eine drohende Komplikation hindeuten, kann mit einer antibiotischen Therapie begonnen werden.
Liegt das Frühstadium einer Mastoiditis vor (keine Fluktuation der retroaurikulären Schwellung, Entzündungsparameter im Blut nur mäßig verändert), kann eine Behandlung mit Amoxicillin-Clavulansäure oder Oxacillin sowie abschwellenden Nasentropfen ausreichen. Ist die retroaurikuläre Schwellung 24 Stunden nach Beginn einer parenteralen Antibiotikatherapie nicht zurückgegangen oder ist eine fluktuierende Schwellung hinter der Ohrmuschel zu tasten und durch die Blutuntersuchung eine ausgeprägte Entzündung nachgewiesen worden, muss operiert werden. Bei der Mastoid-Ektomie werden die entzündlich veränderten Zellen des Warzenfortsatzes entfernt und ein breiter Zugang zum Antrum geschaffen, um die Passage zur Pauke wiederherzustellen. Die meist schon vor der Operation eingeleitete antibiotische Therapie muss entsprechend dem Ergebnis des intraoperativ entnommenen Abstrichs aus der Mastoid-Höhle modifiziert werden.
2.8. Prävention
Kinder, die immer wieder eine akute Otitis media bekommen, sollten adenotomiert werden (falls nicht eine Gaumenspalte vorliegt). Bei bereits adenotomierten Kindern kann das Einsetzen von Paukenröhrchen in die Trommelfelle weitere Infektionen verhindern. Im Vorfeld eines chirurgischen Eingriffs kann auch eine probiotische Therapie mit Streptokokken der physiologischen Flora der oberen Atemwege versucht werden (Roos et al. 2001).
3. Tuben-Mittelohrkatarrh (Seromukotympanon, Otitis media mit Erguss)
3.1. Definition
Als Folge einer akuten Mittelohrentzündung oder nach einem Infekt der oberen Luftwege kann die Belüftung der Pauke und der mit ihr verbundenen pneumatisierten Zellen gestört sein. Ähnlich wie zu Beginn einer akuten Mittelohrentzündung bildet sich zunächst ein Unterdruck im Mittelohr, später werden die Mittelohrräume von serösem, bei längerem Verlauf auch mukösem Sekret ausgefüllt.
3.2. Epidemiologie
Der Tuben-Mittelohrkatarrh bildet sich oft nach einer akuten Rhinitis, kommt wie diese überwiegend im Herbst und Winter vor und tritt bei Kindern gehäuft auf.
3.3. Erregerspektrum
Häufig ist das Mittelohrsekret steril (das erklärt den relativ symptomlosen Verlauf auch über einen langen Zeitraum), nur gelegentlich sind Keime nachweisbar (am häufigsten H. influenzae, S. pneumoniae, M. catarrhalis, seltener S. aureus, E. coli, K. pneumoniae und P. aeruginosa oder Anaerobier (Bluestone und Klein 1995, Feigin et al. 1992, Gok et al. 2001).
3.4. Klinik
Der Tuben-Mittelohrkatarrh kommt schleichend, verläuft symptomarm (Schwerhörigkeit, Druckgefühl im Ohr) und verursacht in der Regel keine Schmerzen. Bei Kindern entsteht er oft unbemerkt, da sie die Symptome noch nicht realisieren können und ihre Schwerhörigkeit übersehen oder fehlgedeutet wird. Der Tuben-Mittelohrkatarrh kann akut (bis drei Wochen), subakut (drei Wochen bis drei Monate) oder chronisch (länger als drei Monate) verlaufen.
3.5. Infektionsweg und Pathogenese
Eine Schlüsselstellung bei der Entstehung einer seromukösen Otitis nimmt die Tube ein. Ihre Funktion kann durch Infekte der oberen Luftwege, Allergien, Hyperplasie der Adenoide, Septum-Deviation, angeborene Anomalien (Gaumenspalte, Trisomie 21) und Tumoren (der Tuben-Schleimhaut und im Nasenrachen) beeinträchtigt sein. Eine längere Tuben-Funktionsstörung führt zur Verdickung der Mittelohrschleimhaut mit Vermehrung von Schleimzellen und Proliferation von Fibrozyten. Die Bindegewebsschicht des Trommelfells (Lamina propria) kann bei einem chronischen Tuben-Mittelohrkatarrh abgebaut werden, wodurch das Trommelfell seine Stabilität verliert und bei Unterdruck in das Mittelohr hineingezogen wird. Es kann den langen Ambossfortsatz und den Steigbügeloberbau zerstören und mit der Schleimhaut des Promontoriums verwachsen (Adhäsivprozess des Trommelfells). Auch eine Einziehung in den Kuppelraum oder die Zellen des Warzenfortsatzes ist möglich. Dadurch entsteht ein Cholesteatom. Selten bildet sich eine Paukenfibrose. Dabei ist die Paukenhöhle bei normaler Position des Trommelfells durch Bindegewebe obliteriert. Möglicherweise liegt eine besondere Reaktionsform der Mittelohrschleimhaut auf einen chronischen Paukenerguss vor.
3.6. Befund und Diagnostik
Die Diagnose des Tuben-Mittelohrkatarrhs kann nach dem Aspekt und der Prüfung der Trommelfellbeweglichkeit (Tympanometrie) gestellt werden. Bei der Untersuchung des Ohres mit dem Mikroskop ist ein Mittelohrerguss fast immer zu erkennen: Das Trommelfell ist eingezogen und hat durch den Erguss eine andere Farbe (Gelb bis Braun). Es kann durch Druckänderungen im Gehörgang nicht bewegt werden. Bei einem Mittelohrerguss besteht eine Schalleitungsschwerhörigkeit. Die Zellen des Warzenfortsatzes sind auf der Röntgenaufnahme verschattet.
3.7. Therapie
Therapieziel ist die Wiederherstellung der Tuben-Funktion. Bei der akuten Form des Tuben-Mittelohrkatarrhs kann dies durch abschwellende Nasentropfen und Inhalationen erreicht werden. Antibiotika sind nicht sinnvoll. Die Prognose ist günstig. Bei der chronischen Form gibt es bisher noch keine medikamentöse Therapie, deren Wirksamkeit über einen längeren Zeitraum erwiesen ist. Dies gilt für Antibiotika, Antihistaminika wie für Kortikosteroide (Luckhaupt 1997).
Bei älteren Kindern und Erwachsenen ist die Luftinsufflation des Mittelohres mit einem Politzer-Ballon möglich, bei kleineren Kindern gelingt dies manchmal dadurch, dass sie einen Luftballon mit der Nase aufblasen.
Die Indikation zur Operation ist gegeben, wenn ein Mittelohrerguss drei Monate besteht. Zusammen mit der Adenotomie wird die Parazentese durchgeführt und das Sekret abgesaugt. Bei einem Rezidiv, bei Patienten mit einem Spaltleiden oder bei deutlicher Einziehung des Trommelfells werden Paukenröhrchen eingesetzt.
3.8. Prävention
Zur Verhinderung eines Tuben-Mittelohrkatarrhs muss eine freie Nasenatmung sichergestellt sein. Hierzu dient im Kindesalter die Adenotomie, die Behandlung von Sinusitiden und Allergien, bei Erwachsenen die Korrektur einer Septum-Deviation. Auch Klimakuren können dazu beitragen.
4. Chronische Otitis media
Es gibt zwei Formen der chronischen Mittelohrentzündung: die chronische Schleimhauteiterung und die chronische Knocheneiterung, das Cholesteatom.
4.1. Chronische Schleimhauteiterung
4.1.1. Definition
Die chronische Schleimhauteiterung ist durch einen andauernden zentralen Defekt des Trommelfells charakterisiert. Die Mittelohrschleimhaut kann entzündungsfrei („trockene” Form der Schleimhauteiterung) oder entzündlich verändert sein (suppurative Form).
4.1.2. Erregerspektrum
Viele verschiedene Erreger können bei der chronischen Schleimhauteiterung nachgewiesen werden. Am häufigsten P. aeruginosa (60–90%), S. aureus (10–20%), Alloiococcus otitidis (bis 10%), Enterobakterien (Proteus spp., Klebsiella spp.; insgesamt 5–10%) und Anaerobier (Peptostreptokokken, Bacteroides spp., Prevotella spp.; insgesamt > 20%). Häufig liegt eine aerob-anaerobe Mischinfektion vor (Bluestone und Klein 1995). Selten kommt Mycobacterium tuberculosis als Erreger vor.
4.1.3. Klinik
Typischerweise besteht bei der chronischen Schleimhauteiterung eine rezidivierende Sekretion. Das schleimigeitrige Sekret ist im Gegensatz zum Cholesteatom nicht fötide, Schmerzen fehlen. Die Perforation des Trommelfells verursacht eine Schwerhörigkeit. Die chronische Schleimhauteiterung kann eine seröse Labyrinthitis, eine Fazialis-Schädigung oder endokranielle Komplikationen (über eine Ostitis) verursachen.
4.1.4. Infektionsweg und Pathogenese
Das Mittelohr kann bei der chronischen Schleimhauteiterung über die Tube oder über den Gehörgang infiziert werden. Die Trommelfellperforation erlaubt eine vermehrte Belüftung des Mittelohrs über die Tube, wodurch Infektionen erleichtert werden, insbesondere bei Infekten der oberen Luftwege. Zur Entstehung einer chronischen Schleimhauteiterung tragen viele Faktoren bei: genetische, familiäre und sozioökonomische Bedingungen sowie die Disposition zu Tuben-Funktionsstörungen und akuten Mittelohrentzündungen.
Die chronische Entzündung der Mittelohrschleimhaut kann zu Tympanosklerose und Ostitis führen. Die Tympanosklerose entsteht durch Kalkeinlagerungen in die Hyalin-umgewandelten Kollagenfasern der Schleimhaut. Durch die Ostitis sind die Gehörknöchelchen gefährdet. Die Pneumatisation des Warzenfortsatzes ist bei der chronischen Schleimhauteiterung im Allgemeinen gehemmt.
4.1.5. Befund und Diagnostik
Zur Diagnose führen die Inspektion des Trommelfells, die Hörschwellenaudiometrie und — bei Sekretion aus dem Ohr — eine bakteriologische Untersuchung. Da häufig Anaerobier beteiligt sind, muss die Probe in einem Transportmedium ins Labor geschickt werden. Einige der Erreger (z.B. Alloiococcus otitidis) wachsen nur langsam, weshalb die Kulturen länger als für eine Otitis-acuta-Diagnostik bebrütet werden müssen (Bosley et al. 1995). Um dies zu garantieren, muss auf dem Einsendeschein explizit auf die klinische (Verdachts-) Diagnose hingewiesen werden. Für eine Mittelohrtuberkulose sprechen weißlich-speckige, nicht blutende Granulationen, die mit ausgedehnten Gewebszerstörungen einhergehen.
4.1.6. Therapie
Die Behandlung der chronischen Schleimhauteiterung hat die Ausheilung der Entzündung und die Wiederherstellung der Anatomie des Ohres zum Ziel.
Die medikamentöse Therapie ist gegen die Entzündung gerichtet. Sie kann topisch oder systemisch durchgeführt werden. Zur Lodkalbehandlung können 3%iges H2O2, Salicyl-Alkohol-Glyzerin-oder Dequalinium-Chlorid-Ohrentropfen verwendet werden. Sind im Abstrich gramnegative Keime nachgewiesen worden, können Antibiotika-haltige Ohrentropfen eingesetzt werden, die z.B. Ciprofloxacin (Ciloxan®) oder Polymyxin, Neomycin und Kortison (Dexa Polyspectran®) enthalten. Sie sind aber ototoxisch und können, wenn sie unkontrolliert verwendet werden, zu irreparablen Innenohrschäden führen! Eine systemische Therapie kann bei grampositiven Keimen und Anaerobiern mit Augmentan®, bei S. aureus mit oralen Cephalosporinen der zweiten Generation, bei Anaerobiern mit Clindamycin oder Metronidazol durchgeführt werden.
Die Wiederherstellung der Anatomie des Ohres zum Schutz vor Entzündungsschüben und zur Verbesserung des Gehörs ist nur durch eine Operation möglich.
Zur Therapie der Tuberkulose siehe Kapitel C3.
4.1.7. Prävention
Da ein Zusammenhang zwischen Tuben-Störung und chronischer Schleimhauteiterung besteht, muss versucht werden, die Tuben-Funktion durch therapeutische Maßnahmen zu verbessern. Dazu gehören Adenotomie, Septum-Korrektur, Sanierung der Nasennebenhöhlen und Behandlung von Allergien (Fireman 1997). Wenn eine Trommelfellperforation besteht, muss das Eindringen von Wasser in das Mittelohr verhindert werden.
4.2. Die chronische Knocheneiterung (Cholesteatom)
4.2.1. Definition
Die Knocheneiterung entsteht durch verhornendes Plattenepithel, das sich im Mittelohr, also am falschen Ort, befindet. Das verhornende Plattenepithel ist von einer Schicht von Granulationsgewebe umgeben, das die Fähigkeit zum Knochenabbau besitzt. Betroffen sind alle Altersgruppen, besonders Menschen mit einer chronischen Belüftungsstörung des Mittelohres, z.B. bei Lippen-Kiefer-Gaumenspalte.
4.2.2. Erregerspektrum
Im Sekret eines infizierten Cholesteatoms sind ähnliche Keime nachweisbar wie bei der chronischen Schleimhauteiterung (siehe dort).
4.2.3. Klinik
Cholesteatom-Patienten leiden unter einer fötiden Sekretion aus dem Ohr und einer zunehmenden Schwerhörigkeit. Schmerzen sind selten. Im fortgeschrittenen Stadium kann die Knochenzerstörung Komplikationen verursachen und Schwindel, Taubheit, Fazialis-Lähmung sowie Symptome einer endokraniellen Beteiligung hervorrufen.
4.2.4. Pathogenese
Das Cholesteatom entsteht durch Unterdruck im Mittelohr, durch den sich verhornendes Plattenepithel des Trommelfells in die Mittelohrräume einsenkt oder aber durch Entzündungsprozesse im Mittelohr, die zu einem papillären Tiefenwachstum des Plattenepithels führen (primäres Cholesteatom). In den Gehörgang eindringendes Wasser kann zur Infektion des Cholesteatoms führen.
4.2.5. Diagnose
Die Diagnose des Cholesteatoms kann fast immer durch die Inspektion des Ohres mit dem Mikroskop gestellt werden. Die Audiometrie ergibt eine Schallleitungsschwerhörigkeit. Der Warzenfortsatz ist auf der Röntgenaufnahme meistens wenig pneumatisiert, in fortgeschrittenen Stadien können Knochenzerstörungen sichtbar sein.
4.2.6. Therapie
Eine medikamentöse Behandlung des Cholesteatoms ist nicht aussichtsreich. Zur Therapie ist die Operation notwendig. Ziel ist die Beseitigung des Cholesteatoms und die Wiederherstellung der Hörfähigkeit. Um vor der Operation das Ohr in einen entzündungsarmen Zustand zu bringen, können Ohrentropfen, z.B. Dequalinium-Chlorid-oder Salicyl-Alkohol-Glyzerin-Ohrentropfen bzw. Neomycin-Gentamycin-Kortison-Ohrentropfen (Dexa Polyspectran®) eingesetzt werden.
Auch bei Komplikationen muss — neben der Therapie mit breit wirksamen Antibiotika — operiert und somit der Ausgangsherd beseitigt werden.
4.2.7. Prävention
Zur Verhinderung eines Cholesteatoms muss für eine ausreichende Mittelohrbelüftung gesorgt werden.
B3.4. Infektionen des Rachens
1. Definition und Einteilung
Die Infektionen des Rachens als entzündliche Reaktionen im Oropharynx umfassen die Pharyngitis und die Tonsillitis, die meist gemeinsam als Tonsillopharyngitis imponieren. Hinzu kommen lokalisierte Sonderformen wie die Angina Plaut-Vincent, Kombinationen mit anderen Infektionsarten wie das Pharyngokonjunktivalfieber sowie Komplikationen und Folgeerkrankungen wie der retropharyngeale Abszess, das Lemièrre-Syndrom und das Nasopharynx-Karzinom.
2. Epidemiologie
Die Tonsillopharyngitis gehört zu den häufigsten Gründen für das Aufsuchen eines Arztes für Allgemeinmedizin bzw. für HNO-Erkrankungen. Sie ist bei Kindern unter einem Jahr selten und bei Kindern unter zwei Jahren ungewöhnlich. Sie zeigt einen Häufigkeitsgipfel im Alter von 4–7 Jahren. Auch in allen anderen Altersstufen ist die Erkrankung im Rahmen von Klein -und Großepidemien nachzuweisen. Das Reservoir für die Erreger sind ebenfalls häufig Kinder, entsprechend finden sich Übertragungsketten innerhalb der Familie sowie in Kindergärten und Schulen (Gerber et al. 1991, Huovinen et al. 1989). Die verschiedenen Erreger treten zum Teil saisonal gehäuft auf. Die häufigsten viralen und bakteriellen Erreger zeigen in der nördlichen Hemisphäre eine Bindung an die kältere Jahreszeit (Tab. B3-1 ) (Middleton 1996).
Tab. B3-1.
Erreger von Infektionen des Oropharynx und deren prozentuale Häufigkeit nach Carroll und Reimer 1996.
| Erreger | Relativer Beitrag (%) | saisonale Häufung/Besonderheiten |
| Rhinovirus | ≤20 | Herbst bis Frühjahr |
| Streptococcus pyogenes | 5–20 | später Winter bis Frühjahr |
| Adenovirus | 5–20 | Sommer |
| Epstein-Barr-Virus | 7–15 | enger persönlicher Kontakt („kissing disease”) |
| Coronavirus | 5–10 | Herbst bis Frühjahr |
| Influenzavirus (und andere Myxoviren) | 5–10 | Winter bis Frühjahr |
| Gruppe C- und G-Streptokokken | 5–10 | Epidemien im gesamten Jahr |
| Mycoplasma pneumoniae | 2–10 | Sommer bis Herbst |
| Herpes-simplex-Virus | 4 | enger persönlicher Kontakt |
| Parainfluenzaviren | 2 | Herbst bis Frühjahr |
| Respiratory-syncytial-Virus | 2 | Winter bis Frühjahr |
| Arcanobacterium haemolyticus | 2 | keine saisonale Häufung |
| seltene Erreger* | <1 | |
Coxsackie- und andere Enteroviren, Zytomegalievirus und andere Herpesviren, Hantaviren, HIV, Masernvirus, Reoviren, Rubella-Virus; Borrelia recurrentis, Chlamydia pneumoniae, Corynebacterium diphtheriae und C. ulcerans, Francisella tularensis, Fusobacterium spp. und andere Anaerobier, Haemophilus spp., Leptospiren, Neisseria gonorrhoeae, Rhodococcus equi, Streptobacillus monilliformis, Treponema pallidum und T. vincentii, Yersinia enterocolitica; Toxoplasmen; Candida spp., Histoplasma capsulatum und andere dimorphe Pilze.
3. Erregerspektrum
Das Erregerspektrum der Racheninfektionen ist überaus vielgestaltig (siehe Tab. B3-1), sodass umfassende Studien mit gleichberechtigter Erfassung aller potentiellen Erreger nicht existieren. Die in Tabelle B3-1 aufgeführten relativen Beiträge einzelner Erreger zur Morbidität beruhen also teilweise auf Schätzungen. Grundsätzlich gilt, dass Viren bis zu zwei Drittel dieser Infektionen auslösen, zum Teil auch in Mischinfektionen mit Bakterien (Esposito et al. 2004). Einige der wichtigsten Erreger weisen neben der saisonalen Häufung auch eine Assoziation mit dem Alter der Patienten auf. So sind Adenoviren bei Kindern zwischen sechs Monaten und fünf Jahren die häufigsten Auslöser einer Pharyngitis, Entsprechendes gilt für S. pyogenes in der Altersgruppe der 5-bis 12-jährigen Kinder und für Mykoplasmen bei Jugendlichen und Erwachsenen (Bisno 2001).
4. Klinik
Typische klinische Zeichen einer Pharyngitis sind Irritationsgefühl, „Rauhigkeit”, Rötung, ödematöse Schwellung und womöglich Schmerzen im Rachen. Weitere klinische Zeichen hängen von der Art des Erregers ab und sind entsprechend der großen Zahl möglicher Erreger vielgestaltig. Primäres Ziel bei der Anamnese-Erhebung und der körperlichen Untersuchung ist die Unterscheidung zwischen einer viralen und einer bakteriellen Genese der Pharyngitis, um so diejenigen Patienten zu erkennen, die von einer spezifischen Therapie profitieren können. Diese Unterscheidung ist allerdings ohne weitere diagnostische Maßnahmen nicht sicher möglich (Perkins 1997).
Durch Anamnese und körperliche Untersuchung sollte klar werden, ob
-
•
rhinitische Symptome der Pharyngitis vorausgingen
-
•
ein Hustenreiz besteht
-
•
vorausgehend oder zeitgleich ein Exanthem und/oder Enanthem, womöglich in Verbindung mit Fieber berichtet oder erfasst wird
-
•
eine Konjunktivitis oder zervikale bzw. generalisierte Lymphadenitis besteht
-
•
über Kopf -und Gliederschmerzen und gastrointestinale Symptome berichtet wird
-
•
ein pharyngeales Exsudat nachweisbar ist.
Je nach Befund sind dann bestimmte Erreger als Ursache der Pharyngitis wahrscheinlicher als andere (Abb. B3-4 ).
Abb. B3-4.

Häufige Assoziationen zwischen klinischen Zeichen und bestimmten Erregern einer Pharyngitis. Milder Verlauf (a), Rhinitis und Husten (b) bzw. pharyngeales Exsudat (c) bestimmen jeweils die herausragende Symptomatik. Dagegen schließen sich Kombinationen wie pharyngeales Exsudat plus milder Verlauf oder plus Rhinitis und Husten meist aus.
Für einzelne Erreger sind zusätzliche, spezifische Informationen von Bedeutung. So verlaufen EBV-(und CMV-)Infektionen bei kleinen Kindern eher asymptomatisch, bei Teenagern und Erwachsenen dagegen schwer, häufig auch mit länger anhaltenden oder fluktuierenden Erschöpfungszuständen.
Die enoralen Vesikel und Ulzera bei einer Coxsackie-A-Virus-Infektion sind im Vergleich zu einer Herpes-simplex-Virus-Infektion kleiner (1–2 mm versus 4–5 mm), haben einen breiten roten Saum und beschränken sich vornehmlich auf den harten Gaumen.
Eine Infektion mit S. pyogenes kann sich auch als Scharlach äußern. Dann fällt ein kleinfleckiges, sich zentrifugal ausbreitendes Exanthem mit perioraler Aussparung, die Himbeerzunge (Abb. B3-5 ) und eine Schuppung der Haut insbesondere der Handinnenflächen und der Fußsohlen auf. Die Tonsillitis ist bei Streptokokken-Infektionen meist beidseitig (Abb. B3-6 ), bei Anaerobier-Infektionen, z.B. im Rahmen einer Angina Plaut-Vincent, dagegen häufig nur einseitig.
Abb. B3-5.

„Himbeerzunge” bei Scharlach.
Abb. B3-6.

Chronisch rezidivierende S.-pyogenes-bedingte Tonsillitis bei einem 21-jährigen Mann.
Zu lokalen Komplikationen kommt es vornehmlich bei bakteriellen Infekten. Eine Verlagerung der Tonsillen nach medial und eine Dysphagie wird bei peritonsillärem Abszess beobachtet, während eine massive einseitige Halsschwellung auf eine Jugularvenenthrombose z.B. im Rahmen eines Lemièrre-Syndroms hindeutet (Sinave et al. 1989).
Ein juckendes, makulopapulöses Exanthem nach Gabe von Aminopenicillinen an einen Patienten mit akuter Mononukleose ist ebenfalls als Komplikation zu werten. Das Exanthem verschwindet nach Absetzen des Aminopenicillins rasch. In Verbindung mit der typischen Klinik der EBV-Infektion ist dieses Phänomen pathognomonisch. Weitere besondere Komplikationen der Mononukleose sind eine schwere Thrombozytopenie mit Blutungsgefahr und eine Splenomegalie mit Gefahr der Milzruptur auch bei relativ geringfügiger mechanischer Belastung.
Die Überwiegende Zahl der Pharyngitiden heilt spontan in 7–10 Tagen aus, nur EBV-Infektionen dauern regelhaft mindestens 14 Tage.
Nichtinfektiöse Differentialdiagnosen der Pharyngitis umfassen Allergien, Traumata durch Fremdkörper oder Verbrühungen, Neoplasien, Chemotherapie-sowie Bestrahlungsfolgen und schließlich Reizungen durch Toxine, Staub, Rauch oder Trockenheit. Auch im Rahmen einer subakuten Thyreoiditis können Schmerz -und Reizgefühle in den Pharynx projiziert werden.
5. Infektionswege und Pathogenese
Die Übertragung der Erreger erfolgt am häufigsten aerogen (Tröpfcheninfektion z.B. bei Rhino -und Coronaviren), aber auch als Schmierinfektion (Streptokokken, Adenoviren, Familie der Herpesviren). Für einige Erreger ist der Übertragungsweg noch nicht genau bekannt (Larsson und Linde 1990), für andere bedarf es spezieller Kontakte (z.B. genitooraler Kontakt für Neisserien und Treponema pallidum, Wildtiere für Francisella spp.), wiederum andere stammen aus der lokalen physiologischen Flora (Fusobakterien und andere Anaerobier, Candida spp.).
S. pyogenes kann nach überstandener Infektion zumindest über Monate hinweg symptomlos die Tonsillen besiedeln. Dazu scheint ein phasenhafter Wechsel der Bakterien zu einem Virulenzfaktor-negativen Status und eine Invasion und Persistenz in Epithelzellen sowie die gezielte Apoptose-Induktion in den Wirtszellen zur Freisetzung der persistierenden Bakterien von besonderer Bedeutung zu sein (Österlund und Engstrand 1997, Wang et al 2006).
Epstein-Barr-Viren lassen sich noch bis zu 18 Monate nach einer Mononukleose aus dem Oropharynx der Betroffenen isolieren (Miller et al. 1973). Der Status einerlatenten Infektion wird durch die Aktivität von zytotoxischen T-Zellen erreicht und kontrolliert.
6. Diagnostik
6.1. Laboruntersuchungen und bildgebende Verfahren
Aufgrund der Häufigkeit dieser Erkrankung, der überwiegend guten Prognose und den beschränkten therapeutischen Möglichkeiten wird häufig auf eine allgemeine Diagnostik verzichtet. Prinzipiell können die üblichen Entzündungsparameter gemessen werden. Eine CRP-Erhöhung auf Werte > 30 mg/l ist in Verbindung mit einer entsprechenden klinischen Symptomatik richtungweisend für eine bakterielle Infektion. Auch die Bestimmung des Procalcitonins hilft bei der Differenzierung zwischen den Erregergruppen, da nur bei bakteriellen und Pilzinfektionen pathologisch erhöhte Werte gemessen werden. Bildgebende Verfahren (z.B. CT) kommen nur bei lokalen und fortgeleiteten Komplikationen zur Anwendung.
6.2. Spezifische Diagnostik
Zum Nachweis bakterieller Infektionen werden mit einem trockenen Polyester-Tupfer beide Tonsillen(reste) und die hintere Pharynx-Wand kräftig abgestrichen. Dabei wird ein Kontakt des Tupfers mit Zunge oder Mundschleimhaut vermieden.
Für den kulturellen Nachweis von S. pyogenes und anderen Streptokokken sowie von Corynebacterium diphtheriae und anderen coryneformen Stäbchen wird der Tupfer schnellstmöglich (≤ 2 Stunden) in das Labor geschickt. Falls dies ausnahmsweise nicht möglich sein sollte, muss ein geeignetes Transportmedium (z.B. Port-a-cul®) verwendet werden, da nur so ein Überleben auch der selteneren Keime für länger als 24 Stunden garantiert werden kann. Bei Verdacht auf eine N.-gonorrhoeae-Infektion wird mit dem Tupfer ein vorgewärmtes Spezialmedium (z.B. GO-slide®) bestrichen und dieses bei Raumtemperatur möglichst rasch direkt ins Labor transportiert (Carroll und Reimer 1994, Kline und Runge 1994) bzw. wenn dies nicht möglich sein sollte ein molekularbiologischer Nachweis angestrebt.
Zum Nachweis des häufigsten bakteriellen Erregers, S. pyogenes, gibt es eine Reihe von Antigennachweistests, die schnell und unkompliziert am Patienten gehandhabt werden können. Diese Tests haben eine Spezifität von 90–99%, aber auch Neuentwicklungen wie der Gen-Probe-Gruppe-A-Streptokokken-Direkt-Test® und der BioStar-Strep-A-Optische-Immuntest® weisen nur eine Sensitivität von maximal 93% auf. In klinischen Testreihen lag die Sensitivität lediglich im Bereich von 60–80% (Carroll und Reimer 1996, Gerber et al. 1997, Middleton 1996). Daher wird bei Verdacht auf eine S.-pyogenes-Pharyngitis und negativem Antigennachweis häufig eine kulturelle Untersuchung empfohlen.
Infektionen durch RSV, Adeno-, Influenza -und Parainfluenzaviren werden aus Gründen ausreichender Sensitivität insbesondere bei Kindern durch Direktnachweis der Virusantigene mittels ELISA, Immunfluoreszenz-Test und/oder Kurzzeitkultur bestätigt. Eine frische EBV-Infektion wird durch den Nachweis heterophiler Antikörper (Paul-Bunnell-Test) wahrscheinlich. Diese treten bei ca. 90% der Jugendlichen und Erwachsenen mit einer Mononukleose auf. Bei Kindern unter zwei Jahren sind diese Antikörper nur sehr selten, bei Kindern zwischen zwei und zehn Jahren jedoch mit zunehmender Häufigkeit nachweisbar. Spezifischer und sensitiver ist der Nachweis von IgM und IgG gegen das virale Kapsid-Antigen (VCA). Diese Antikörper sind bei praktisch allen Mononukleose-Patienten zum Zeitpunkt des Aufsuchens eines Arztes nachweisbar. Das VCA-IgM verschwindet 4–8 Wochen nach Infektionsbeginn, während das VCA-IgG lebenslang nachweisbar ist.
7. Therapie
Eine spezifische Therapie viraler Pharyngitiden bleibt wenigen Erregern und speziellen, meist immunsupprimierten Patienten vorbehalten. HSV-Infektionen werden über fünf Tage mit 5 × 200 mg Aciclovir oder 3 × 250 mg Famciclovir bzw. Valaciclovir p.o. therapiert. Für die Therapie von CMV-Infektionen sind Ganciclovir und Foscarnet geeignet. Bei EBV-Infektionen beeinflusst zwar die Gabe von Aciclovir oder Ganciclovir die Virusvermehrung, ändert aber nichts am klinischen Verlauf der Infektion. Influenza-A-Virus-Infektionen können über fünf Tage mit 2 × 75 mg Oseltamivir bzw. in zweiter Linie auch über 5–7 Tage mit 2 × 100 mg Amantadin bzw. Rimantadin therapiert werden (Middleton 1996, Okano 1997, Whitley et al. 2001). Ein Präparat zur Therapie der Picornavirus-Infektionen (Pleconaril) befindet sich in klinischer Prüfung (Phase III).
Nur bei bakteriellen Infektionen ist eine Therapie mit Antibiotika sinnvoll. Gemessen am Anteil dieser Erreger an der Pharyngitis-Morbidität werden diese Medikamente häufig unnötig verschrieben (Little und Williamson 1996, McIsaac et al. 1997). Die klassische Therapie der S.-pyogenes-Pharyngitis besteht in der täglichen Gabe von 2 × 50 000 U Penicillin V oder Propicillin pro kg KG. Diese Therapie muss — auch bei Verschwinden der Symptome nach nur einem Tag — über zehn Tage durchgeführt werden, denn nur so lässt sich eine ausreichend hohe Eradikationsrate erzielen und die Rückfallhäufigkeit senken. Wegen Compliance-Problemeneinerseits und möglichen Penicillinallergien andererseits wurden als äquivalent wirksame Therapien die Gabe von 2 × 20 mg pro kg KG und Tag Cefuroxim (bzw. entsprechende Dosierungen anderer Oralcephalosporine der ersten und zweiten Generation), 2 × 40 mg pro kg KG und Tag Erythromycin-Estolat oder 2 × 15 mg pro kg KG und Tag Claritromycin über jeweils fünf Tage etabliert (Adam et al. 2000). Eine Makrolid-Therapie ist auch für eine Arcanobacterium-Infektion angebracht.
Fusobacterium.
Reinhard Marre
-
•
Erregerbeschreibung
Fusobakterien sind obligat anaerobe, gramnegative faden-bis spindelförmige Stäbchen. Die Gattung umfasst derzeit 13 Spezies, von denen die Spezies F. nucleatum und F. necrophorum die klinisch relevantesten Spezies sind.
-
•
Erreger-Wirts-Beziehung
Fusobakterien gehören zur physiologischen Standortflora des oropharyngealen bzw. gastrointestinalen Traktes. Das Krankheitsspektrum umfasst Infektionen, die vom Oropharynx ausgehen wie z.B. odontogene Infektionen, Peritonsillarabszesse, Sinusitis, Otitis, Pleuraempyem, Lungenabszesse, Bakteriämien im Rahmen lokaler Infektionen, Osteomyelitis (insbesondere des Gesichtskiefers und bei Gaucher-Syndrom). Gefürchtet ist das Lemièrre-Syndrom, eine eitrige, sich ausbreitende Seitenstrangangina, Jugularvenenthrombose mit metastatischer Absiedlung und Bakteriämie.
-
•
Diagnostik
Der Erregernachweis vom Fusobakterien ist aufwändig und setzt eine gute Präanalytik voraus. Da die Fusobakterien als obligate Anaerobier sauerstoffempfindlich sind, sollten die entsprechenden Untersuchungsmaterialien in geeigneten Transportmedien und ohne Zeitverzögerung in das mikrobiologische Labor gebracht werden.
-
•
Prophylaxe
Sanierung oraler Entzündungsherde und adäquate Mundhygiene sind wesentliche Maßnahmen zur Vermeidung von Fusobakterien-Infektionen.
-
•
Spezifische Therapie
Fusobakterien sind in aller Regel sensibel gegenüber Penicillinen, Cephalosporinen und Metronidazol. Die chirurgische Sanierung kann zusätzlich indiziert sein.
-
•
Maßnahmen bei Patienten und Kontaktpersonen
Besondere Maßnahmen sind nicht erforderlich.
-
•
Meldepflicht
Eine Meldepflicht besteht nach dem Infektionsschutzgesetz nicht.
-
•
Nationales Referenzzentrum
Konsiliarlaboratorium für anaerobe Bakterien, Zentrum für Infektionsmedizin, Institut für Medizinische Mikrobiologie und Infektionsepidemiologie, Prof. Dr. A. C. Rodloff (Ansprechpartner), Universität Leipzig, Liebigstr. 24, 04103 Leipzig; Telefon: 0341/9715-200, Fax: 0341/9715-209, E-Mail: acr@medizin.uni-leipzig.de.
-
•
Literatur
Literatur
- Smith G.R., Thornton E.A. Pathogenicity of Fusobacterium necrophorum strains from man and animal. Epidemiol Infect. 1993;11:499–506. doi: 10.1017/s0950268800050925. [DOI] [PMC free article] [PubMed] [Google Scholar]
Epstein-Barr-Virus.
Therese Popow-Kraupp
-
•
Taxonomie
Das Epstein-Barr-Virus (EBV) gehört zu der Familie der humanpathogenen Herpesviren und besitzt, wie alle Mitglieder dieser Virusfamilie, eine doppelsträngige DNS, ein Ikosaeder-förmiges Kapsid und eine Lipoproteinhülle mit spikeförmig eingelagerten Glykoproteinen. Seine Größe beträgt 180–200 nm. Die Virussynthese erfolgt im Kern der infizierten Zelle. EBV hat, ebenso wie alle anderen Herpesviren, die Fähigkeit nach klinisch oder subklinisch verlaufener Erstinfektion in einer latenten Form (nichtproduktive Infektion) im Organismus (B-Lymphozyten, undifferenzierte Epithelzellen) zu persistieren und bei Resistenzsenkungen endogen reaktiviert zu werden (Bildung infektiöser Viruspartikel = produktive Infektion) (Rickinson und Kieff 2001).
-
•
Epidemiologie
Infektionen mit EBV kommen weltweit vor, wobei die sozialen und hygienischen Bedingungen den Zeitpunkt der Primärinfektion beeinflussen. In den hoch entwickelten Ländern liegt der Erkrankungsgipfel zwischen dem 18. und 25. Lebensjahr, und eine vollständige Durchseuchung (90–95%) wird erst im mittleren Erwachsenenalter erreicht. Im Gegensatz zu sind in den Entwicklungsländern bereits mehr als 95% der einjährigen Kinder mit EBV infiziert (Henle und Henle 1980). Die Übertragung erfolgt durch infektiösen Speichel, meist im Rahmen eines intimen oralen Kontaktes („kissing disease”). Parenterale Übertragungen im Rahmen von Transplantationen sind besonders bei Kindern beobachtet worden. Die Inkubationszeit beträgt üblicherweise 4–7 Wochen, bei Kindern kann sie auch kürzer sein (zwei Wochen). Nach durchgemachter Infektion wird das Virus noch monatelang mit dem Speichel ausgeschieden.
-
•
Erreger-Wirts-Beziehung
Die primären Zielzellen für die EBV-Infektion sind vermutlich die Endothelzellen des Zungenrandes, der Mundschleimhaut und der Speicheldrüsen, wobei infektiöse Viruspartikel in großen Konzentrationen in den Speichel gelangen. Zusätzlich kommt es jedoch auch noch zu einer latenten Infektion von B-Lymphozyten (der EBV-Rezeptor auf den B-Lymphozyten, ein Glykoprotein, ist ein Rezeptor für die Komplement-Komponente C3d). Diese B-Lymphozyten werden durch das EBV transformiert und proliferieren. Die für die EBV-Infektion charakteristischen atypischen mononukleären Zellen im peripheren Blutbild sind aktivierte zytotoxische T-Zellen, die gegen die EBV transformierten proliferierenden B-Zellen gerichtet sind und diese eliminieren. Im Zuge der EBV-Infektion kommt es zur Expression von einer Reihe viruskodierter Proteine, gegen die Antikörper gebildet werden. Den Nachweis von Antikörpern gegen die verschiedenen Strukturund Nichtstrukturproteine nützt man für die differenzierte labordiagnostische Abklärung von EBV-Infektionen.
-
•
Krankheitsspektrum
Das charakteristische Krankheitsbild einer EBV-Infektion ist die infektiöse Mononukleose (IM), auch Pfeiffersches Drüsenfieber genannt. Dazu gehören Fieber (80–100%), Tonsillitis (80–100%) und eine pharyngeale lymphatische Hyperplasie (80–100%). Eine Erhöhung der Transaminasen findet sich häufig (80–100%), eine ausgeprägte Gelbsucht tritt jedoch nur in 5–10% der Fälle auf. Ein Exanthem wird nur sehr selten beobachtet. Gehäuftes Auftreten von Exanthemen nach Gabe von Ampicillin.
Atypische und chronische Krankheitsverläufe sind beschrieben. Seltene Komplikationen einer EBV-Infektion sind thrombozytopenische Purpura, aplastische und hämolytische Anämie, Milzruptur, Enzephalitis und Guillain-Barré-Syndrom (Sumaya 1998). Tödlich verlaufende Erstinfektionen, die mit der Entwicklung von Lymphomen oder einem Hämophagozytose-Syndrom einhergehen, treten familiär gehäuft bei männlichen Kindern mit einem seltenen, auf dem X-Chromosom lokalisierten Gendefekt (XLP-Syndrom) auf. Bei massivimmunsupprimierten Patienten (z.B. nach Transplantation) können EBV-assoziierte Lymphome (so genannte „posttransplantation lymphoproliferative disease”, PTLD) auftreten, die in der Regel eine ungünstige Prognose haben (Williams und Crawford 2005).
-
•
Virologische Diagnostik
Erregernachweis
Virusnachweis im Speichel durch Transformation von Nabelschnur-Lymphozyten. Diese aufwendige Methode ist für die Routinediagnostik nicht geeignet.
Ein quantitativer Nachweis von virusspezifischen DNS-Sequenzen (PCR, In-situ-Hybridisierung) in Speichel, Biopsie-Material, EDTA-Blut, Serum oder Liquor wird vor allem für die diagnostische Abklärung EBV-assoziierter Erkrankungen bei immunsupprimierten Patienten verwendet (Williams und Crawford 2005).
Die Abklärung einer EBV-Infektion erfolgt bei immunkompetenten Patienten in der Regel serologisch.
Antikörpernachweis
Mittels indirekter Immunfluoreszenz-Technik bzw. ELISA werden sowohl IgG -und IgM-Antikörper, die gegen den viralen Kapsid-Antigen-Komplex (VCA, Virusstrukturproteine) gebildet werden, als auch IgG-Antikörper, die gegen viruskodierte Nichtstrukturproteine (early Antigen-Komplex = EA, EBV-nukleäres Antigen 1 = EBNA1) gebildet werden, nachgewiesen. Im Verlauf einer Primärinfektion werden Antikörper, die gegen die verschiedenen EBV-Antigengruppen gebildet werden, zu unterschiedlichen Zeitpunkten nachweisbar. Diese Tatsache macht man sich für die Differenzierung von rezenten, länger zurückliegenden und reaktivierten Infektionen zunutze (Henle et al. 1987, Lennette 1988).
-
•
Prophylaxe und Therapie
Eine spezifische Prophylaxe und antivirale Medikamente sind nicht zugelassen.
Bei lymphoproliferativen Erkrankungen von Transplantationspatienten (PTLD) ist die Reduktion der immunsuppressiven Therapie die erste Wahl. Die Gabe von anti-CD20-Antikörpern (Rituximab) sowie der adoptive Transfer von T-Zellen sind in der Prophylaxe wie auch in der präemptiven Therapie relativ erfolgreich.
-
•
Meldepflicht
Keine.
-
•
Referenzzentren
Konsiliarlaboratorium für EBV, HHV 6, 7, 8; Prof. Dr. N. Müller-Lantzsch/Dr. B. Gärtner (Ansprechpartner), Institut für Medizinische Mikrobiologie und Hygiene der Universität des Saarlandes, Haus 47, 66421 Homburg; Telefon: 06841/162-3931, Fax: 06841/162-3980, E-Mail: vinmue@uniklinik-saarland.de oder vibgae@unikliniksaarland.de.
Speziallabor; Prof. Dr. H. Wolf (Ansprechpartner), Institut für Medizinische Mikrobiologie und Hygiene, Universität Regensburg, Franz-Josef-Strauß-Allee 11, 93053 Regensburg; Telefon: 0941/944-6401, Fax: 0941/944-6402, E-Mail: hans.wolf@klinik.uni-r.de.
-
•
Literatur
Literatur
- Henle W., Henle G. Epidemiologic aspects of Epstein-Barr Virus (EBV)-associated diseases. Ann N Y Acad Sci. 1980;353:326–331. doi: 10.1111/j.1749-6632.1980.tb27975.x. [DOI] [PubMed] [Google Scholar]
- Henle W., Henle G., Andersson J. Antibody responses to Epstein-Barr Virus-determined nuclear antigen (EBNA)-1 and EBNA 2 in acute and chronic Epstein-Barr virus infection. Proc Natl Acad Sci. 1987;84:570–574. doi: 10.1073/pnas.84.2.570. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Lennette E.T. Herpesviridae: Epstein-Barr Virus. In: Lennette E.H., Halonen P., Murphy F.A., editors. Vol. II. Springer; Berlin: 1988. pp. 230–246. (Laboratory Diagnosis of Infectious Diseases, Principles and Practice). [Google Scholar]
- Rickinson A.B., Kieff E. Epstein-Barr Virus. In: Knipe D.M., Howley P.M., editors. Fields Virology. 4th ed. Lippincott Williams and Williams; Philadelphia: 2001. pp. 2575–2628. [Google Scholar]
- Sumaya C.V. Epstein-Barr Virus. In: Feigin R.D., Cherry J.D., editors. 4th ed. Vol. II. Saunders Company; Philadelphia: 1998. pp. 1751–1764. (Textbook of Pediatric Infectious Diseases). [Google Scholar]
- Williams H., Crawford D.H. Epstein-Barr Virus: Impact of scientific advance on clinical practice. Blood. 2006;107:862–869. doi: 10.1182/blood-2005-07-2702. [DOI] [PubMed] [Google Scholar]
Corynebacterium diphtheriae.
Andreas Podbielski
-
•
Erregerbeschreibung
Corynebacterium diphtheriae ist ein grampositives, sporenloses, unbekapseltes, pleomorphes Stäbchenbakterium. Es gibt vier Biotypen: gravis, intermedius, mitis, belfanti. Der Biotyp „mitis” produziert weniger häufig Diphtherie-Toxin und verursacht statistisch weniger schwere Erkrankungen als die anderen Biotypen. Das potenziell ähnlich pathogene C. ulcerans und das wenig pathogene C. pseudotuberculosis gehören ebenfalls zur C.-diphtheriae-Gruppe. Auch nicht Toxin-bildende gravis -und mitis-Stämme sind pathogen.
-
•
Epidemiologie
Der Mensch ist das einzige bekannte Reservoir. Ausbreitung aerogen, bei Hautläsionen über Schmierinfektionen, selten über Lebensmittel. Laborinfektionen sind möglich! Niedriger Kontagionsindex von 10–20%, Inkubationszeit 2–5 Tage. Weniger als 5% der Exponierten erkranken nicht, sondern werden zu symptomlosen Keimträgern und damit zum Erregerreservoir in nichtepidemischen Zeiten. Die Haut hat die bedeutendere Reservoirfunktion, da die Übertragung von hier besonders effizient ist. Wintersaison und beengte Wohnverhältnisse begünstigen die Ausbreitung. In epidemischen Zeiten erkranken besonders Kinder unter 15 Jahren, sonst gleichermaßen auch Erwachsene.
Die Diphtherie-Inzidenz schwankt aus unverstandenen Gründen im Rhythmus von mehr als 100 Jahren. In Krisenzeiten (Weltkriege) kam es regelhaft zu größeren Epidemien. In Deutschland seit 1950 nur kleine Epidemien, in jüngster Zeit extrem geringe Inzidenz in Deutschland (2000, 2001, 2004: kein Fall; 1998, 1999, 2003: je ein Fall; 2002: vier Fälle). Endemie in anderen Regionen (östliches Mittelmeer, Pakistan, Indien, Indonesien, Philippinen, Brasilien, Nigeria) sowie der Rückgang eines suffizienten Impfschutzes auf < 50% der deutschen Erwachsenen erhöht die Gefahr des epidemischen Wiederauftretens in Deutschland.
-
•
Erreger-Wirts-Beziehung
Bei nur wenig invasivem Potential besiedelt C. diphtheriae den Wirt oberflächlich mit lokal milder Entzündungsreaktion. Weitergehende Krankheitserscheinungen werden durch die Produktion des Diphtherie-Exotoxins bedingt. Das Toxin-Gen wird von einem lysogenen Bakteriophagen kodiert. Der Phage kann andere C.-diphtheriae-bzw. C.-ulcerans-Stämme befallen und so das Toxin-Gen transferieren.
Die Toxin-Produktion wird über die Eisenkonzentration der Wirtsumgebung reguliert und ist bei der Racheninfektion deutlich höher als bei der Hautinfektion. Die A-Komponente des Exotoxins (AB-Komponententyp) wird in jegliche menschliche Zelle eingeschleust und katalysiert dort die ADP-Ribosylierung des Elongationsfaktors 2. Dies führt zum Zusammenbruch der Proteinsynthese. Besonders starke Effekte auf Herzmuskel-, Nerven -und Nierentubulus-Zellen.
Auf der Schleimhaut führt die Toxin-Wirkung zur Bildung eines nekrotischen Koagels aus Fibrin, Leukozyten, Epithelzellen und Bakterien. Beim Abheben dieser „Pseudomembran” blutet es aus der Submukosa. Die benachbarten Weichteile sind stark geschwollen und behindern die Atmung.
Durch bisher unverstandene Virulenzmechanismen können nicht-Toxin-bildende C.-diphtheriae-Stämme insbesondere bei Immunsuppression oder Drogenabusus schwere Organund systemische Infektionen (Endokarditis) auslösen.
-
•
Krankheitsspektrum
C. diphtheriae verursacht eine Infektion des oberen und seltener des unteren Respirationstrakts. Die lokale Infektion mit Gaumensegellähmung, Schwellung und massiven Exsudaten kann zur Verlegung der Atemwege führen. Durch die Toxin-Wirkung kommt es zusätzlich zu Symptomen an Herz, Nerven (siehe unten), Lungen (Embolie) und Nieren (Anurie). Besonders in den (Sub-)Tropen lösen die Bakterien ulzerierende Hautinfektionen (häufig gemeinsam mit S. aureus und/oder S. pyogenes), ferner selten auch Bindehaut-, Nasen -und Vaginalinfekte aus.
Bei 10–25% der Infizierten entwickelt sich 7–14 Tage nach Krankheitsbeginn eine schwere Myokarditis. Bei der Mehrzahl der schwer Erkrankten findet sich rasch auch eine toxische Neuropathie mit Paralyse des weichen Gaumens und der Hirnnerven, nach zehn Tagen bis drei Monaten eine periphere Neuritis. Die Letalität einer Atemwegsdiphtherie liegt bei 3,5 (2-23)%.
-
•
Mikrobiologische Diagnostik
Erregernachweis
Für einen kulturellen Nachweis dienen — vor Beginn der antibiotischen Therapie entnommene — Rachen-, Tonsillen -und Nasenabstriche bzw. Proben eines sonstigen fraglich infizierten Bereichs. Die Kultur erfolgt auch auf Tellur-haltigen Spezialmedien, die eine präsumptive Diagnose aufgrund der Kulturmorphologie erlauben.
Im mikroskopischen Bild nach Gramfärbung liegen die Stäbchen wegen der Längsteilung häufig (bizarr) aneinandergelagert (Palisaden, chinesische Schriftzeichen). Durch die Löffler-Spezialfärbung werden metachromatische Polkörperchen (Proteineinlagerungen) sichtbar.
Der Nachweis der Toxin-Produktion erfolgt über einen Meerschweinchen-Test oder eine Immunpräzipitation des auf dem Agar gebildeten Toxins mit Antitoxin (Elek-Test). Die Toxin-Produktion in der Kultur ist instabil, daher können die Tests insbesondere in wenig erfahrenen Händen falsch negativ ausfallen. Deshalb gewinnt in letzter Zeit eine Toxingen-bzw. Eisen-Regulatorgen-spezifische PCR immer größere Bedeutung für die Diagnose.
Antikörpernachweis
Spezifische Antikörper gegen Toxin können mit kommerziellen Tests bzw. mit Neutralisationstests in der Zellkultur quantifiziert werden — nur für die Epidemiologie und unter Umständen die Überprüfung des Impfstatus von Bedeutung.
-
•
Spezifische Therapie
Entscheidend für den Therapieerfolg ist die Eliminierung des noch nicht zellgebundenen Toxins durch Gabe von Diphtherie-Serum. Daher ist die Serumtherapie sofort nach Stellung der Verdachtsdiagnose durchzuführen. In Abhängigkeit von der Dauer der Symptomatik einmalig Gabe von Antitoxin. Vorher Hypersensitivität gegenüber dem Pferdeserum durch Intrakutan-oder Bindehauttests ausschließen und gegebenenfalls durch therapeutische Immunsuppression umgehen. Die Antibiotikatherapie beendet die Toxin-Produktion des Erregers, eliminiert ihn und senkt so das Ansteckungsrisiko. Bis zur Wiederherstellung der Schluckfähigkeit werden Penicillin oder Erythromycin i.v. verabreicht, danach für insgesamt 14 Tage oral. Während der Therapie ist der Patient strikt zu isolieren. Der Therapieerfolg muss vor Aufhebung der Isolation durch mindestens 3 über 48 Stunden hinweg genommene negative Abstriche belegt werden. Enge Kontaktpersonen und symptomlose „Carrier” sollten unabhängig vom Impfstatus aus seuchenhygienischen Gründen über sieben Tage mit Oralerythromycin behandelt werden. Die Wiederzulassung zu einer Gemeinschaftseinrichtung ist dann nach dem dritten Behandlungstag möglich.
-
•
Spezifische Prophylaxe
Die aktive Impfung mit dem Diphtherie-Toxoid gehört zu den ab dem dritten Lebensmonat öffentlich empfohlenen Impfungen. Der Impfstoff wird als einzelne Vakzine oder als Kombination mit der Tetanus-(DT-)-und zusätzlich der Pertussis-(DPT-)Vakzine angeboten. Für Personen über sieben Jahre sollten wegen Nebenwirkungen nur verminderte Antigenmengen („Td”) verwendet werden.
Grundimmunisierung: dreimalige i.m. Applikation, danach ca. alle zehn Jahre Auffrischimpfungen. Dies trifft insbesondere auf Personen mit hohem Expositionsrisiko zu (medizinisches und Laborpersonal, Migranten aus Risikogebieten, Bedienstete der Bundespolizei und des Zolls). Es sollte gegebenenfalls vor Ablauf dieser Zeit der Antikörperspiegel überprüft werden, da offenbar bei einer nicht zu vernachlässigenden Zahl von Personen der Impfschutz auch vor Ende der 10-Jahres-Frist unzureichend ist. Die Impfung vermindert das Erkrankungsrisiko um ca. 75%, bei Erkrankung die Letalität um 93%.
-
•
Meldepflicht
Erkrankungsverdacht, Erkrankung und Tod an Diphtherie sind nach § 6 IfSG und der Nachweis Toxin-bildender Stämme nach § 7 IfSG meldepflichtig.
-
•
Literatur
Literatur
- Anonymus Diphtherie. Epidemiol Bull. 2001;6:39–42. [Google Scholar]
- Brune I., Brinkrolf K., Kalinowski J. The individual and common repertoire of DNA-binding transcriptional regulators of Corynebacterium glutamicum, Corynebacterium efficiens, Cory-ne bacterium diphtheriae, and Corynebacterium jeikeium deduced from the complete genome sequences. BMC Genomics. 2005;6:86. doi: 10.1186/1471-2164-6-86. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Funke G., von Graevenitz A., Clarridge J.E. Clinical microbiology of coryneform bacteria. Clin Microbiol Rev. 1997;10:125–159. doi: 10.1128/cmr.10.1.125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Sing A., Roggenkamp A., Heesemann J. Charakterisierung von C. diphtheriae-Isolaten und weiteren toxigene Corynebakterien. Epidemiol Bull. 2002;15:119–121. [Google Scholar]
- Wilson A.P. Treament of infection caused by toxigenic and non-toxigenic strains of Corynebacterium diphtheriae. J Antimicrob Chemother. 1995;35:717–720. doi: 10.1093/jac/35.6.717. [DOI] [PubMed] [Google Scholar]
Der bloße Verdacht auf Diphtherie rechtfertigt eine schnellstmögliche stationäre Aufnahme und eine sofortige Serumtherapie. Zum Ausschluss einer anaphylaktischen Reaktion werden 0,1 ml Serum 1:10 verdünnt intrakutan oder auf der Bindehaut des Patienten getestet. Dann werden 200–1 000 IE Antitoxin/kg KG fraktioniert i.m. verabreicht. Bei toxischen Verläufen wird die Hälfte des Antiserums i.v. appliziert (gegebenenfalls unter gleichzeitiger Gabe von Prednisolon). Parallel wird eine Therapie mit 2 × 50 000 U Penicillin G über 14 Tage begonnen. Bei Penicillinallergie können alternativ 3 × 250 mg Erythromycin ebenfalls über 14 Tage gegeben werden.
8. Prävention
Für Influenzaviren A und B existiert eine — aufgrund der Antigenvariabilität der Viren jährlich zu erneuernde — i.m. Impfung mit einer Totvakzine. Für Adenoviren wurde vom amerikanischen Militär eine Schluckimpfung entwickelt, die aber nie der Zivilbevölkerung zugänglich gemacht wurde. Schließlich ist die Diphtherie-Impfung mit einem Toxoid breit eingeführt. Angesichts der Erfahrung mit kurzfristig auftretenden Diphtherie-Epidemien z.B. 1995–1998 in den Ländern der GUS, ist die konsequente Auffrischung dieser Impfung europaweit zu empfehlen.
Bei besonders gefährdeten Personen kann eine Chemoprophylaxe gegen HSV und CMV mit Aciclovir bzw. Ganciclovir oder gegen Influenza-A-Virus mit Amantadin indiziert sein.
Streptococcus pyogenes, „Gruppe-A-Streptokokken” (GAS).
Andreas Podbielski
-
•
Erregerbeschreibung
Grampositive Kettenkokken, deren Kolonien auf Blutagar von einem Hof vollständiger Hämolyse (β-Hämolyse) umgeben sind. Serologische Gruppe A innerhalb der Streptokokken-Familie aufgrund des besonderen Zellwand-Carbohydrats (C-Substanz). Ca. 80 M-Protein-Serotypen, zurzeit mehr als 200 M-Proteingen (emm)-Genotypen. Acht dieser Typen bedingen im mehrjährigen Wechsel ca. 57% der Infektionen. Sequenzierung von bisher zwölf vollständigen GAS-Genomen und Array-Analytik der Genome von über 1000 Stämmen ergab, dass sprunghafte Veränderung der GAS-Virulenz durch genomische Integration/Desintegration > 20 lysogenen Bakteriophagen offenbar ein häufiges Ereignis ist. Eine Erregertypisierung zur Aufdeckung von Infektketten wird modernerweise durch Multilokus-Sequenz-Typisierung durchgeführt.
-
•
Epidemiologie
Der Mensch ist das einzige bekannte Reservoir. Insbesondere in der Wintersaison sind bis zu 20% der gesunden Bevölkerung im Rachen mit GAS symptomlos kolonisiert. Symptomatisch infizierte Personen sind deutlich effizientere Überträger als asymptomatisch infizierte. Übertragung aerogen und durch Schmierinfektionen, selten durch Nahrungsmittel. Ein Zusammenleben auf engem Raum begünstigt die Ausbreitung. Die Inkubationszeit beträgt durchschnittlich 2–4 Tage. Individuelle Konstitution für Krankheitsverlauf mitentscheidend, daher Manifestationsindex und Symptomatik bei Ansteckung auch mit „invasiven Stämmen” kaum vorhersagbar. Nosokomiale Übertragung insbesondere von invasiven Stämmen wurde beschrieben, daher entsprechende Patienten zunächst isolieren. Ferner besteht die Möglichkeit von Laborinfektionen. In aller Regel sind GAS-Infizierte 24 Stunden nach Therapiebeginn nicht mehr infektiös. Pharyngeale GAS-Infektionen sind im Winterhalbjahr häufiger. Die Altersgipfel liegen für Hautinfektionen im Kleinkind-, für pharyngeale Infektionen im frühen Schulkindalter. Spezifische Folgeerkrankungen weisen entsprechende Altersgipfel auf. Jegliche GAS-bedingten Einzelerkrankungen sind nach IfSG nicht meldepflichtig, daher sind keine Inzidenzdaten verfügbar. Die Erfassung invasiver GAS-Infektionen in den USA deutet auf eine seit fünf Jahren sinkende Inzidenz.
-
•
Erreger-Wirts-Beziehung
GAS liegen extra -und intrazellulär vor, wobei erstere Form mit der Infektion, letztere Form wahrscheinlich mit der asymptomatischen Persistenz assoziiert ist.
GAS bilden eine Vielzahl von Virulenz-Faktoren in Abhängigkeit vom Status der Infektion. Die Anheftung an Zielzellen erfolgt durch verschiedene Fibronektin-bindende Proteine. Inhaltsstoffe der Zielzellen werden durch das Streptolysin S freigesetzt. Eine rasche Ausbreitung im Interzellularraum wird durch eigene Enzyme (z.B. Hyaluronidase), aber auch durch Aktivierung wirtseigener Proteasen erreicht. Durch eine Protease kann die Gerinnungskaskade, die Fibrinolyse und das Kinin-System maximal stimuliert werden. Die Phagozytose und die Komplement-Wirkung werden unterdessen durch die Kapsel und M(-ähnliche) Proteine blockiert. Immunglobuline werden durch Bindung am Fc-Teil ihrer Wirkung beraubt. Die kontrollierte Zytokin-Aktivität wird durch Superantigene und durch Bildung mehrerer, teils sehr spezifischer (Ziele: IL-2, IL-8, C5a) Proteasen nachhaltig gestört. Invasive Stämme zeichnen sich zudem durch Bildung eines Typ III-Sekretionssystem Äquivalentes (simultan gesteuerte Fibronektin -und Kollagen I-bindende Adhäsine, porenbildendes Streptolysin O plus in die Wirtszelle geschleuste NADase) aus. Die effiziente Abwehr bedarf der konzertierten Aktion von spezifischen T-Zellen und Antikörpern. Nach überwundenem Infekt womöglich lebenslange, M-Proteintyp-spezifische Immunität.
-
•
Krankheitsspektrum
GAS verursachen eitrige Pharyngotonsillitiden, Pyodermien (häufig zusammen mit S. aureus) und das Erysipel. Von all diesen Erkrankungen ausgehend kann zusätzlich ein Scharlach entstehen, sofern der Stamm einen lysogenen Bakteriophagen mit einem Toxin-Gen trägt. Derzeit sind zwei Toxin-Gene (speA, speC) sicher sowie über zehn Kandidatengene identifiziert. 10–20 Tage nach einer oberflächlichen GAS-Infektion kann es besonders bei 4-bis 10-jährigen Kindern und fehlender Antibiotikatherapie zum akuten rheumatischen Fieber oder zur akuten Glomerulonephritis kommen. Beide sowie die ebenfalls durch GAS getriggerten OCDs (obsessive-compulsive disorders, z.B. Tourette-Syndrom) und Exazerbationen der Psoriasis guttata beruhen auf immunologischen Fehlreaktionen. Selten kommt es zu invasiven, lebensbedrohenden Infektionen wie der nekrotisierenden Fasziitis, der Myositis und dem STSS (streptococcal toxic shock syndrome) bzw. Infektionen anderer solider Organe. Leichte GAS-Infektionen verlaufen innerhalb von 5–10 Tagen selbstheilend, schwere weisen trotz maximaler Therapie eine Letalität von 20–100% auf.
-
•
Mikrobiologische Diagnostik
Erregernachweis
Mikroskopie: Der mikroskopische Nachweis grampositiver Kettenkokken im Untersuchungsmaterial ist bei typischer Klinik zwar richtungweisend, aber wenig spezifisch, da morphologisch kein Unterschied zu anderen ß-hämolysierenden Streptokokken besteht.
Kultur: Der kulturelle Nachweis gilt weiterhin als Goldstandard. Typischerweise ist er aus Tonsillen -und Hautabstrichen, Punktaten und gegebenenfalls Blutkulturen zu führen. Bei Transportzeiten über zwei Stunden trotz relativer Trocknungsresistenz der Bakterien Abstriche mit mikrobiologischen Transportmedien (z.B. Port-a-cul®) einsenden. Die anwesende Begleitflora z.B. im Rachenabstrich kann eine Verlängerung der Bebrütungszeit von den üblichen 24 Stunden auf 48 Stunden erfordern.
Antigennachweise: Die in der Praxis durchführbaren Schnelltests sind nur mäßig sensitiv. Ein negatives Testergebnis erfordert eine kulturelle Untersuchung zum Ausschluss der Erkrankung. Die Zuverlässigkeit und die gerin Kosten eines kulturellen Nachweises machten bisher den Einsatz von prinzipiell verfügbaren Nukleinsäuretests überflüssig.
Antikörpernachweis: Antikörperuntersuchungen sind nur bei Verdacht auf eine Streptokokken-Folgeerkrankung und bei epidemiologischen Studien sinnvoll. Testantigene sollen immer Streptolysin O und DNase B sein. Altersabhängig gelten Titer von > 180 bzw. > 240 I.E. als pathologisch. Selektiv erhöhte Anti-DNase-B-Werte deuten auf eine vorangegangene GAS-Hautinfektion.
-
•
Spezifische Therapie
GAS sind gegenüber Penicillinen und Cephalosporinen grund sätzlich empfindlich. Resistenzen gegen Makrolide und Tetrazykline sind je nach Untersuchungsland unterschiedlich ausgeprägt. Eine Gabe dieser Antibiotika empfiehlt sich nur nach Resistenztestung. Co-trimoxazol und Fosfomycin sind meist unwirksam, während Rifampicin, Glykopeptide und Linezolid — soweit überprüft — immer wirksam sind.
Therapiemöglichkeiten der Wahl bei oberflächlichen GAS-Infektionen sind eine 10-tägige Gabe von Oralpenicillin bzw. eine 5-tägige Gabe verschiedener Oralcephalosporine oder neuerer Makrolide wie Azithromycin. Jeweils kürzere Regime erhöhen die Rückfallquote.
Bei schweren Infektionen wird eine initiale 3-tägige Therapie mit Clindamycin simultan zur 10-tägigen i.v. Penicillintherapie empfohlen. Zudem kann die 1-bis 5-tägige Gabe von polyvalentem Immunglobulin hilfreich sein.
-
•
Meldepflicht
Eine Meldepflicht nach § 7(2) bzw. (3) IfSG besteht nur im Rahmen von Infektionsketten bei invasiver Infektion oder bei nosokomialen Infektionen. In den USA werden schwere Infektionen erfasst. Aktuelle Zahlen sind wöchentlich aktualisiert über die CDC bzw. das MMWR einsehbar.
-
•
Prophylaxe
Eine aktive Impfung gegen GAS existiert weiterhin nicht. Eine Chemoprophylaxe mit Benzathin-Penicillin ist für Patienten mit akutem rheumatischem Fieber (ARF) indiziert. Die Dauer der Prophylaxe ist umstritten. Sie sollte minimal über fünf Jahre verabreicht werden, nach einem ARF-Rezidiv lebenslang. Die Chemoprophylaxe bei Kontaktpersonen von an invasiven GAS-Infektionen Erkrankten scheint aufgrund retrospektiver Studien nicht indiziert zu sein.
-
•
Literatur
Literatur
- Bisno A.L., Gerber M.A., Gwaltney J.M. Diagnosis and management of group A streptococcal pharyngitis: a practice guideline. Clin Infect Dis. 1997;25:574–583. doi: 10.1086/513768. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kreikemeyer B., McIver K.S., Podbielski A. Virulence factor regulation and regulatory networks in Streptococcus pyogenes and their impact on bacteria-host interactions. Trend Microbiol. 2003;11:224–232. doi: 10.1016/s0966-842x(03)00098-2. [DOI] [PubMed] [Google Scholar]
- Norrby-Teglund A., Norrby S.R., Low D.E. The treatment of severe group A streptococcal infections. Curr Infect Dis Rep. 2003;5:28–37. doi: 10.1007/s11908-003-0062-2. [DOI] [PubMed] [Google Scholar]
- Sumby P., Porcella S.F., Madrigal A.G. Evolutionary origin and emergence of a highly successful clone of serotype M1 group A Streptococcus involved multiple horizontal gene transfer events. J Infect Dis. 2005;192:771–782. doi: 10.1086/432514. [DOI] [PubMed] [Google Scholar]
- The Prevention of Invasive Group A Streptococcal Infections Workshop Participants Prevention of invasive group A streptococcal disease among household contacts of case patients and among postpartum and postsurgical patients: recommendations from the Centers for Disease Control and Prevention. Clin. Infect. Dis. 2002;35:950–959. doi: 10.1086/342692. [DOI] [PubMed] [Google Scholar]
- Vlaminckx B., van Pelt W., Schouls L. Epidemiological features of invasive and noninvasive group A streptococcal disease in the Netherlands, 1992–1996. Eur J Clin Microbiol Infect Dis. 2004;23:434–444. doi: 10.1007/s10096-004-1147-z. [DOI] [PubMed] [Google Scholar]
Gegen S. pyogenes ist in nächster Zukunft kein Impfstoff absehbar. Patienten mit einem akuten rheumatischen Fieber müssen gegen Reinfektionen mindestens über fünf Jahre mit Penicillin V geschützt werden. Die früher häufig durchgeführte Tonsillektomie wird heute nur noch empfohlen, wenn ein Betroffener sieben S.-pyogenes-Pharyngitiden innerhalb eines Jahres oder jeweils fünf innerhalb von zwei Jahren bzw. jeweils drei innerhalb von drei Jahren durchmacht. Ähnlich wie bei der rezidivierenden Otitis media kann auch hier vor einer Entscheidung zu einem operativen Eingriff die Gabe von Probiotika aus der Gruppe der vergrünenden Streptokokken, Laktobazillen oder Enterokokken angebracht sein, da dadurch persistierende S.-pyogenes-Bakterien verdrängt werden können (Falck et al. 1999, Glück und Gebbers 2003).
B3.5. Sialadenitis
1. Definition
Die Sialadenitis ist eine virale oder bakteriell bedingte Entzündung der Glandula parotis, G. submandibularis und G. sublingualis. Nichtinfektiöse Ursachen für die Entzündung der Speicheldrüsen sind z.B. das Sjögren-Syndrom im Rahmen verschiedener Vaskulitiden, die Sarkoidose sowie die Exposition gegenüber einer Reihe von Medikamenten und Schwermetallen. Nur die Entzündung der G. parotis hat eine geläufige eigenständige Bezeichnung („Parotitis”).
2. Einteilung
Bei den akuten Sialadenitiden werden viral bedingte und eitrige, bakteriell verursachte Infektionen unterschieden. Bei der chronischen Sialadenitis unterscheidet man eine rekurrente von einer chronisch obstruktiven Form.
3. Epidemiologie
Sialadenitiden sind relativ häufige Erkrankungen, umfassende Zahlen zur Morbidität existieren allerdings nicht. Von den akuten Formen sind insbesondere die viral bedingten bei Kindern häufig. Die Parotitis-Fälle bei Mumps nehmen in den letzten Jahren zu (Zimmermann et al. 1995). Die Inzidenz liegt bei ca. 12 pro 100 000 Einwohner. Bakteriell bedingte Formen kommen meist bei hospitalisierten Patienten oder bei älteren, schlecht ernährten und dehydrierten Personen vor. Rekurrente Formen sind überwiegend Folge von kongenitalen Abnormalitäten der Drüsenausführungsgänge und sind seltener als die chronisch obstruktive Form, die am häufigsten die G. submandibularis involviert (Chitre und Premchandra 1997, Goldberg 1987).
4. Erregerspektrum
Unter den Viren sind besonders die Vertreter der Paramyxoviren (Mumps — und Parainfluenzaviren) sowie CMV häufige Erreger. Bei den bakteriell bedingten Sialadenitiden stehen bei Kindern vergrünende Streptokokken, möglicherweise auch Pneumokokken und H. influenzae im Vordergrund (Chiu und Lin 1996, Giglio et al. 1997), während bei Erwachsenen S. aureus mit Abstand der häufigste Erreger sowohl der akuten als auch der chronischen Sialadenitis ist. Nicht selten werden Mischinfektionen mit anaeroben Bakterien gesehen. In Südostasien manifestiert sich eine lokalisierte Melioidose (Lumbiganon und Viengnondha 1995) bei Kindern am häufigsten als Parotitis (Tab. B3-2 ).
Tab. B3-2.
Erreger von Sialadenitiden.
| Häufigkeit | Erreger |
|---|---|
| häufig | Mumpsvirus, Parainfluenzavirus 1, 2 und 3 (akute Parotitis) |
| seltener | Haemophilus influenzae, Pneumokokken, Staphylococcus aureus, vergrünende Streptokokken (akute und chronische Parotitis) |
| sehr selten | Adenovirus, Coxsackievirus, EBV, HIV, HSV, Zytomegalievirus, Influenzavirus A und B, Bartonella henselae, Burkholderia pseudomallei, Klebsiellen, Mykobakterien, Pseudomonas aeruginosa, Salmonellen, Histoplasmen |
5. Klinik
In aller Regel macht sich die Infektion durch lokale Schmerzen (bei Parotitis Ohrenschmerzen), Schwellung, Kau -und Schluckbeschwerden sowie Fieber bemerkbar. Bei einem viralen Infekt geschieht dies nach 2-bis 3-wöchiger Inkubationszeit, häufig nach Prodromalsyndromen und betrifft bei der Parotitis zu ca. 70% beide Speicheldrüsen. Der Kieferwinkel der betroffenen Seite ist verstrichen (Abb. B3-7 ) und das Ohr erscheint, vom Hinterkopf aus betrachtet, verschoben. Durch den Druck kann es zu einer vorübergehenden Fazialis-Lähmung kommen.
Abb. B3-7.

Rechtsseitige Mumps-Parotitis bei einem 8 Jahre alten Jungen.
Komplikationen einer Mumpsvirus-Infektion sind in 3–15% der Fälle Affektionen des ZNS, in 15–40% der Fälle eine leichte Pankreas-Mitbeteiligung und selten Epididymitis, Orchitis, Akustikus-Neuritis und Labyrinthitis.
Die bakterielle Infektion beginnt abrupter, ist meist von einer lokalen Rötung und Erwärmung begleitet und in aller Regel einseitig. Im Gegensatz zur serösen Absonderung aus den Drüsenausführungsgängen beim viralen Infekt kann das Sekret bei der bakteriellen Infektion eitrig werden. Ohne Therapie besteht die Gefahr einer Abszedierung (Abb. B3-8 ) und, in der Folge, einer massiven Halsschwellung mit Obstruktion der Atemwege sowie einer Osteomyelitis der Gesichtsschädelknochen.
Abb. B3-8.

Parotis-Abszess bei einem 1-jährigen Jungen in der Folge einer Varizellen-Infektion.
6. Risikofaktoren
Für die Infektion mit dem Mumpsvirus besteht im fehlenden oder unzureichenden Impfschutz das höchste Risiko. Störungen der normalen Speichelproduktion sowie die Immunsuppression bedeuten ein besonderes Risiko für eine akute bakterielle Infektion. Für die chronischen Formen sind angeborene oder erworbene Beeinträchtigungen der Anatomie der Drüsenausführungsgänge relevant. Dies kann z.B. durch vorangegangene akute Infektionen, aber auch durch Zahnprothesen oder -korrekturhilfen und häufiges Aufblasen der Backen („Pneumoparotitis”) bewirkt werden (Goguen et al. 1995, McDuffie et al. 1993).
7. Infektionswege und Pathogenese
Paramyxo -und Herpesviren werden aerogen oder durch Schmierinfektion übertragen. Nach einer virämischen Phase kommt es im Rahmen eines unverstandenen Tropismus zur Infektion der Speicheldrüsen. Die Erreger bakterieller Infekte rekrutieren sich in der Regel aus der Mundflora des Patienten. Eine ungenügende Spülung der Drüsenausführungsgänge bei vermindertem Speichelfluss, häufig gepaart mit der Bildung von Speichelsteinen, begünstigt die Kolonisierung und Infektion des Gangsystems. Bei der Melioidose und Tuberkulose gelangen die Keime hämatogen oder lymphogen in die Speicheldrüsen.
8. Diagnostik
Die Diagnostik der Sialadenitiden dient vor allem zur Unterscheidung von viral und bakteriell bedingten Infektionen. Deswegen kann zur Basisdiagnostik ein Differentialblutbild oder die Bestimmung des CRP herangezogen werden. Als bildgebendes Verfahren wird heute die Sonographie eingesetzt, die allerdings als weniger spezifisch als die klassische Sialographie beurteilt wird (Yoshiura et al. 1997).
Für den kulturellen Nachweis von Bakterien wird nach Spülen des Mundes mit Wasser vom eitrigen Sekret des Ausführungsgangs ein Abstrich entnommen oder es werden Eiterproben durch eine extraorale Punktion gewonnen. Bei Verdacht auf hämatogen verschleppte Keime werden zusätzlich Blutkulturen angelegt. Die infrage kommenden viralen Erreger werden durch Virusisolierung oder durch PCR nachgewiesen. Für Mumps -und Parainfluenzaviren sollten spezifische IgM-Antikörpernachweise angefordert werden.
9. Therapie
Die meisten viralen Sialadenitiden sind therapeutisch nicht spezifisch beeinflussbar. Die Mumps-Parotitis heilt innerhalb einer Woche von selbst. Die symptomatische Therapie besteht aus der Gabe von Schmerzmitteln, reichlich Flüssigkeit und einer Suppen -und Breidiät sowie der Spülung der entzündeten Ausführungsgänge mit warmer Salzlösung (Peter und Haney 1996). Eine antibakterielle Therapie mit einem Cephalosporin (z.B. Orelox® 2 × 200 mg/d p.o. oder Cefotaxim 3×1 g/d i.v.) deckt die statistisch häufigsten Erreger ab. Für die chronische Parotitis muss zusätzlich eine Parotidektomie (Sadeghi et al. 1996) oder eine niedrig dosierte Strahlentherapie (Trott 1994) ins Auge gefasst werden.
10. Prophylaxe
Aerogen übertragene virale Sialadenitiden können all gemein durch eine Expositionsprophylaxe eingedämmt werden. Dies bedeutet, dass Mumps-infizierte Kinder frühestens zehn Tage nach Beginn der Infektion Gemeinschaftseinrichtungen besuchen sollten. Mumps-spezifische Antiseren zur passiven Immunprophylaxe stehen nicht zur Verfügung. Für die aktive Impfung wird zurzeit in Deutschland der attenuierte Mumpsvirus-Stamm „Jeryl Lynn” allein oder in Kombination mit einer Masern-oder Röteln-Vakzine verimpft. Die erste Impfung wird ab dem 15. Lebensmonat verabreicht, eine Booster-Impfung sollte ab dem sechsten Lebensjahr erfolgen. Über den Anteil an Geimpften mit protektiven Antikörperspiegeln existieren divergierende Angaben (15–95%). Der Impfschutz besteht wahrscheinlich lebenslang. Bei inkomplettem Impfschutz kann es durch die Infektion noch zu einer Parotitis kommen, die Ausbildung von Komplikationen ist aber unwahrscheinlich (Zimmermann et al. 1995).
Mumpsvirus.
Therese Popow-Kraupp
-
•
Taxonomie
Das Mumpsvirus, ein Mitglied der Familie der Paramyxoviren, ist ein umhülltes pleomorphes RNS-Virus (sphärisch bis filamentös, Durchmesser 100–600 nm). Die Reifung der Viruspartikel erfolgt durch einen Knospungsprozess an der Zytoplasmamembran der Wirtszelle, wobei deren Bestandteile (Lipidmembran) für die Virushülle verwendet werden. In diese sind zwei viruskodierte transmembrane Glykoproteine (HN und F) eingelagert, die spikeförmig aus der Virusoberfläche herausragen. Diese beiden Oberflächenglyko-proteine besitzen hämagglutinierende, Neuraminidase -und zellfusionierende Aktivität. Sie sind für die Bindung des Virus an den Zellrezeptor und für die Fusion der Virushülle mit der Zellmembran — eine Voraussetzung für das Eindringen der viralen RNS in die Zelle — verantwortlich. Antikörper, die gegen diese beiden Glykoproteine gerichtet sind, schützen vor einer Infektion mit dem Mumpsvirus (Carbone und Wolinsky 2001).
-
•
Epidemiologie
Infektionen mit dem Mumpsvirus treten weltweit endemisch auf. Epidemische Ausbrüche wurden vor Einführung der Impfung alle 2–5 Jahre mit 50% der Erkrankungen in der Gruppe der 5-bis 9-Jährigen und 90% der Infektionen vor dem 14. Lebensjahr beobachtet (CDC 1974). Durch die Einführung der Impfung kam es zu einer Veränderung in der Altersverteilung der Erkrankungen (25% bei den 5-bis 9-jährigen und > 50% bei den über 14-jährigen Kindern) (Cochi et al. 1988). Die Übertragung erfolgt durch Kontakt mit kontaminierten Tröpfchen und Speichel über Nase und Mund, wobei jedoch ein relativ enger Kontakt für die Virusübertragung notwendig ist. Die Inkubationszeit beträgt durchschnittlich 16–18 Tage. Die Virusausscheidung mit dem Speichel beginnt um den fünften Tag vor Beginn der klinischen Symptome und endet nach der ersten Krankheitswoche. Die Virusausscheidung mit dem Harn dauert einige Wochen. Etwa 30% der Infektionen verlaufen subklinisch.
-
•
Erreger-Wirts-Beziehung
Die primäre Virusvermehrung findet wahrscheinlich in den Epithelzellen der Nase und des oberen Respirationstraktes statt. Nach einer weiteren Vermehrung in den regionalen Lymphknoten kommt es über die Virämie (Plasmazellen -und T-Lymphozyten-assoziiert) zur Infektion der Zielorgane (Speicheldrüsen, ZNS, Hoden, Eierstöcke, Pankreas, Myokard). Die Infektion der Epithelzellen in den Speicheldrüsengängen führt zu degenerativen Zellveränderungen, Nekrosen, lokalen Entzündungsreaktionen (hauptsächlich sind Lymphozyten und Makrophagen involviert) und zu einem interstitiellen Ödem. Ähnliche mikroskopische Veränderungen findet man auch bei einer Infektion der Hoden und des Pankreas. Die Invasion des ZNS erfolgt über den Plexus chorioideus durch infizierte mononukleäre Zellen. Nach der Vermehrung in den chorioidalen Epithelzellen kommt es zur Ausbreitung über den Liquor und zur Infektion der Meningen und sehr selten auch von Neuronen. Mit dem Auftreten virusneutralisierender Antikörper (ca. ab dem elften Krankheitstag) beginnt die Viruselimination. Die Rolle der zellver-mittelten Abwehrmechanismen bei Mumpsvirus-Infektionen ist noch weitgehend ungeklärt.
-
•
Krankheitsspektrum
Das klassische klinische Bild der Mumpsinfektion ist die fieberhafte Parotitis (entweder einseitig oder nacheinander beidseitig). Als Komplikationen können ein-oder beidseitige Orchitiden (meist nur bei Infektion nach der Pubertät) und eine Pankreatitis auftreten. Relativ häufig kommt es zu einer Infektion des ZNS, meist als seröse Meningitis (1–10% der Patienten mit Parotitis; 40–50% der Patienten mit Mumps-Meningitis haben keine Parotitis). Sehr selten (ca. 1/6000 Infektionen) wird eine Enzephalitis diagnostiziert, wobei diese in der frühen Erkrankungsphase (Virusvermehrung in den Neuronen) oder erst 7–10 Tage nach Erkrankungsbeginn (postinfektiöser Demyelinisierungsprozess durch die Immunantwort) auftreten kann. Darüber hinaus können im Rahmen einer Mumpsvirus-Infektion eine Reihe anderer Organe befallen werden (z.B. Ovarien, Niere) (Cherry 1998). Eine bleibende Schwerhörigkeit kann in mehr als 4% der Fälle auftreten.
-
•
Virologische Diagnostik
Erregernachweis
Nukleinsäure-Amplifikation (RT-PCR) und Virusisolierung aus Speichel, Rachenabstrichmaterial, Urin und Liquor innerhalb der ersten Woche nach Krankheitsbeginn. Das Virus ist nicht sehr stabil und die Proben sollten daher in einem speziellen Transportmedium so rasch wie möglich in das Labor transportiert werden.
Antikörpernachweis
Der Nachweis von virusspezifischen IgM -und IgG-Antikörpern mittels ELISA in Serum und Liquor ist die Methode der ersten Wahl für die labordiagnostische Absicherung einer Mumpsvirus-Infektion, wobei die Impfanamnese für die Interpretation der Laborbefunde wichtig ist (Örvell 1988).
-
•
Prophylaxe
Aktive Immunisierung mit einem Lebendimpfstoff.
-
•
Therapie
Es ist keine spezifische Therapie verfügbar.
-
•
Meldepflicht
Keine.
-
•
Referenzzentren
Nationales Referenzzentrum für Masern, Mumps, Röteln; Dr. E. Gerike (Ansprechpartner), Robert-Koch-Institut/Fachbereich Virologie, Nordufer 20, 13353 Berlin; Telefon: 030/4547-2647, Fax: 030/4547–2328 oder -2605, E-Mail: gerikee@rki.de.
Speziallabor; Prof. Dr. U.G. Liebert (Ansprechpartner), Institut für Virologie, Universität Leipzig, Johannisallee 30, 04103 Leipzig; Telefon: 0341/9714-301, Fax: 0341/9714-309, E-Mail: liebert@medizin.uni-leipzig.de.
-
•
Literatur
Literatur
- Carbone K.M., Wolinsky J.S. Mumps Virus. In: Knipe D.M., Howley P.M., editors. Fields Virology. 4th ed. Lippincott Williams and Williams; Philadelphia: 2001. pp. 1381–1400. [Google Scholar]
- Centers for Disease Control and Prevention (CDC) Mumps surveillance 1973. MMWR. 1974;23:431. [Google Scholar]
- Cherry J.D. Mumps. In: Feigin R.D., Cherry J.D., editors. 4th ed. Vol. II. Saunders Company; Philadelphia: 1998. pp. 2075–2083. (Textbook of Pediatric Infectious Diseases). [Google Scholar]
- Cochi S.L., Preblud S.R., Orenstein W.A. Perspectives on the relative resurgence of mumps in the United States. Am J Dis Child. 1988;142:499–507. doi: 10.1001/archpedi.1988.02150050037025. [DOI] [PubMed] [Google Scholar]
- Örvell C. Paramyxoviridae: Mumps Virus. In: Lennette E.H., Halonen P., Murphy F.A., editors. Vol. II. Springer; Berlin: 1988. pp. 507–524. (Laboratory Diagnosis of Infectious Diseases, Principles and Practice). [Google Scholar]
B3.6. Infektionen des Kehlkopfes
1. Definition und Einteilung
Unter den infektiösen Erkrankungen des Kehlkopfes versteht man die akute Laryngitis, die akute subglottische Laryngitis bzw. Laryngotracheitis (Pseudokrupp), die Epiglottitis (Infektion der supraglottischen Teile des Kehlkopfes) und die laryngeale Papillomatose.
2. Epidemiologie
Die akute Laryngitis tritt meist im Rahmen einer viralen Infektion des oberen Respirationstraktes auf und ist eine Erkrankung, die üblicherweise ältere Kinder und Erwachsene betrifft.
Im Gegensatz dazu ist die subglottische Laryngitis bzw. Laryngotracheitis eine Erkrankung des Kleinkindesalters mit einem Altersgipfel zwischen dem 7. und 36. Lebensmonat und wird nur selten nach dem sechsten Lebensjahr beobachtet. Ein gehäuftes Auftreten von akuten Laryngitiden und von Pseudokrupp findet sich vorwiegend im Spätherbst und frühen Winter und korreliert mit der gesteigerten Aktivität respiratorischer Viren zu dieser Jahreszeit (Denny et al. 1983). Eine Zusammenstellung der mit diesen Krankheitsbildern assoziierten Viren findet sich in Tabelle B3-3 . Die Übertragung erfolgt durch virushaltige Sekrete der Atemwege, die Infektion findet entweder direkt von Mensch zu Mensch durch Inhalation von Aerosolen oder durch den Kontakt mit kontaminierten Gegenständen statt. Eine häufige Infektionsquelle für Kleinkinder sind Erwachsene mit einer Rhinitis. Beispielsweise sind Parainfluenzaviren bei Erwachsenen häufig die Ursache einer Erkältungskrankheit, bei Kleinkindern verursachen sie aber eine subglottische Laryngitis.
Tab. B3-3.
Virale und bakterielle Erreger akuter Infektionen des Kehlkopfes.
| virale und bakterielle Erreger | akute Laryngitis | akute subglottische Laryngitis | akute Epiglottis |
|---|---|---|---|
| Adenoviren | +++ | ++ | |
| Influenzavirus Typ A und B | +++ | ++ | |
| Parainfluenzavirus Typ 1, 2, 3 | ++ | +++ | |
| Rhinoviren | ++ | + | |
| Respiratory-syncytial-Virus | ++ | ++ | |
| Enteroviren | + | + | |
| Streptococcus pyogenes | ++ | ||
| Haemophilus influenzae Typ b | +++ | ||
| Streptococcus pneumoniae | (+) | ||
| Staphylococcus aureus | (+) | ||
| Haemophilus parainfluenzae | (+) | ||
| Haemophilus influenzae untypisierbar | (+) | ||
+++ sehr häufig.
++ häufig.
+ selten.
(+) sehr selten.
Die akute Epiglottitis (supraglottische Laryngitis) ist eine bakterielle Infektion, die fast immer durch H. influenzae Typ b verursacht wird und vorwiegend in der wärmeren Jahreszeit auftritt (Broughton und Warren 1984, Vernon und Sarnaik 1986). Am häufigsten sind Kinder zwischen dem ersten und fünften Lebensjahr betroffen (75% aller Fälle). Die Häufigkeit akuter Epiglottiden ist seit Einführung der Impfung gegen H. influenzae Typ b signifikant zurückgegangen.
Die laryngeale Papillomatose, eine sehr seltene Erkrankung, ist die Folge einer Infektion mit den humanen Papillomaviren Typ 6 und 11 (HPV-6 und HPV-11), den beiden häufigsten Erregern genitaler Kondylome. Obwohl laryngeale Papillome in jedem Alter auftreten können, besteht für Kinder vor dem fünften Lebensjahr (51% der Fälle) das höchste Risiko, daran zu erkranken. Die Virusübertragung während der Geburt gilt als die wahrscheinlichste Ursache kindlicher Infektionen (Quick et al. 1980). Bei Erwachsenen (Erkrankungsgipfel zwischen dem 20. und 40. Lebensjahr) sind Larynxpapillome typischerweise solitär und stellen Präkanzerosen dar, die in ca. 20% der Fälle maligne entarten.
3. Erregerspektrum
Eine Zusammenstellung der wichtigsten viralen und bakteriellen Erreger akuter Infektionen des Kehlkopfes und ihrer relativen Häufigkeit bei den verschiedenen Erkrankungsbildern findet sich in Tabelle B3-3.
Die Ursache der akuten Laryngitis und subglottischen Laryngotracheitis ist fast immer eine Virusinfektion, wobei das Spektrum der viralen Pathogene relativ breit ist und die einzelnen Viren mit unterschiedlicher Häufigkeit nachgewiesen werden können. Influenza -und Adenoviren sind sehr häufige Erreger akuter Laryngitiden, während Parainfluenzaviren (vor allem Typ 1 und 2) besonders häufig bei Patienten mit Pseudokrupp nachgewiesen werden können (Chanock et al. 1967, Hope-Simpson und Higgins 1969, Macasaet et al. 1968, Parrott et al. 1961, Parrott et al. 1962a, Tyrrel 1965).
Die akute Epiglottitis wird fast immer durch H. influenzae Typ b verursacht (Broughton und Warren 1984, Vernon und Sarnaik 1986). Nur sehr selten können S. pneumoniae, S. aureus und H. parainfluenzae nachgewiesen werden. Bei immunsupprimierten Patienten kommen zusätzlich Pasteurella multocida, Klebsiella pneumoniae und Aspergillus flavus in Betracht.
4. Klinik
Die spezifische klinische Manifestation der akuten Laryngitis ist die Heiserkeit. Alle weiteren Symptome hängen maßgeblich vom krankheitsauslösenden Erreger ab. Adeno -und Influenzaviren verursachen sehr schwere Krankheitsverläufe mit hohem Fieber, stark gerötetem Rachen sowie Muskel -und Kopfschmerzen. Im Gegensatz dazu treten bei Infektionen mit Rhinoviren, Parainfluenzaviren und RSV Allgemeinsymptome in einem nur sehr geringen Ausmaß auf. Im Vordergrund steht bei diesen Infektionen die Rhinitis. Ein inspiratorischer Stridor tritt nicht auf (DD: akute subglottische Laryngotracheitis). Die klinischen Symptome enden meist nach 4–7 Tagen. Gelegentlich kommt es, als Folge einer bakteriellen Superinfektion, zu einer länger anhaltenden Heiserkeit (2–3 Wochen).
Bei der akuten subglottischen Laryngotracheitis steht die Obstruktion der oberen Atemwege, d.h. ein inspiratorischer Stridor, im Vordergrund der klinischen Symptome. Die Erkrankung beginnt meist harmlos mit einer trockenen oder rinnenden Nase, Husten und Halsschmerzen. Üblicherweise tritt dann innerhalb von 24 Stunden Fieber und nach weiteren 12–48 Stunden ein zunehmender inspiratorischer Stridor auf. Bei leichtem Krankheitsverlauf dauert die Erkrankung 3–7 Tage. Schwere Verlaufsformen gehen mit Zyanose, supra-, infraklavikulären und sternalen Einziehungen einher und können ohne Intervention zum Tod durch Asphyxie führen. Die Krankheitsdauer beträgt in diesen Fällen sowohl mit als auch ohne Therapie 7–14 Tage. In seltenen Fällen kann die subglottische Laryngitis fortschreiten und zu einer obstruktiven Erkrankung der tiefen Atemwege führen, die so gravierend sein kann, dass eine Intubation oder eine Tracheostomie erforderlich wird.
Die akute Epiglottitis beginnt abrupt mit starken Halsschmerzen und einer beeinträchtigten Atmung bei nur geringgradig gesteigerter Atemfrequenz. Die Patienten leiden unter einem extremen Erstickungsgefühl, das zu gesteigerter Angst und Unruhe führt. Vorangehende Symptome einer Infektion der oberen Atemwege werden von ca. 25–50% der Patienten geschildert, und die Dauer bis zur Krankenhauseinweisung beträgt 2–24 Stunden. Bei Aufnahme findet sich bei etwa einem Drittel der Patienten eine eingeschränkte Bewusstseinslage, Zyanose und Fieber. In seltenen Fällen kann zusätzlich noch eine Tonsillitis, eine Otitis media, eine Meningitis, eine septische Arthritis oder eine Perikarditis vorhanden sein (Cherry 1998).
Bei laryngealen Papillomen sind die charakteristischen klinischen Symptome Heiserkeit und eine veränderte Stimme, da die Stimmlippen am häufigsten von dieser Virusinfektion betroffen sind. Laryngeale Papillome können zu einer Obstruktion der Atemwege führen, lokale Rezidive nach chirurgischer Entfernung sind häufig (Shah und Howley 1996).
5. Infektionswege und Pathogenese
Bei der akuten Laryngitis und Laryngotracheitis kommt es zunächst zu einer Virusinfektion der nasalen und pharyngealen Epithelzellen mit anschließender lokaler Ausbreitung in den Larynx und die Trachea. Die Infektion dieser Zellen führt zur Hemmung der Zilien-Funktion und zur Destruktion des respiratorischen Epithels und damit zu einer Infektion der Lamina propria, die mit Rötung und Schwellung einhergeht. Oft kommt es auch zu einer Schwellung der Stimmlippen, wodurch ihre Beweglichkeit beeinträchtigt wird. Bei der subglottischen Laryngitis breitet sich diese Schwellung bis unterhalb der Stimmlippen aus und führt zu einer massiven Einengung der Trachea, die durch ein fibrinöses Exsudat noch gesteigert wird.
Histologisch findet sich ein Ödem und eine Infiltration der Lamina propria, der Submukosa und der Adventitia mit Makrophagen, Lymphozyten, Plasmazellen und neutrophilen Granulozyten. Eine durch virusspezifische IgE-Antikörper vermittelte Hypersensitivitätsreaktion scheint zumindest bei Infektionen mit RSV und Parainfluenzaviren eine entscheidende Rolle zu spielen (Welliver et al. 1980, Welliver et al. 1982).
Bei der akuten Epiglottitis bewirkt die bakterielle Infektion eine ausgeprägte Schwellung der Epiglottis und der aryepiglottischen Falten. Mit zunehmendem Ödem kommt es zum Einrollen der Epiglottis und es besteht die Tendenz, den entzündeten supraglottischen Ring bei der Inspiration in den Larynx zu ziehen (Kugelklappeneffekt). Histologisch finden sich eine diffuse Infiltration mit neutrophilen Leukozyten, ein hämorrhagisches Ödem und Fibrin-Ablagerungen. Üblicherweise geht die Epiglottitis mit einer direkten bakteriellen Invasion und geringgradiger Bakteriämie von kurzer Dauer einher.
Bei der laryngealen Papillomatose führen die Papillome an den Stimmlippen zur Einschränkung ihrer Beweglichkeit und — durch ihre räumliche Ausdehnung — zur Obstruktion der oberen Atemwege.
6. Befund und Diagnostik
Die Diagnose beruht auf der klinischen Untersuchung und den Ergebnissen der bildgebenden Verfahren und der mikrobiologischen/virologischen Laboruntersuchungen.
Bei der akuten Laryngitis ergibt die Untersuchung des Patienten einen normalen oder geröteten Rachen und eine normale, nicht vergrößerte Epiglottis. Die Laborparameter sind in der Regel unauffällig. Bei länger anhaltender Heiserkeit sollten Tumoren, Papillome, Fremdkörper und andere chronische Erkrankungen durch eine laryngoskopische Untersuchung ausgeschlossen werden.
Bei der Inspektion eines Patienten mit akuter subglottischer Laryngotracheitis findet sich ein normaler oder nur minimal geröteter Rachen und eine leicht gesteigerte Atemfrequenz mit einer verlängerten inspiratorischen Phase. Das Differentialblutbild ergibt üblicherweise Leukozytenwerte von > 10 G/l mit 70% neutrophilen Granulozyten. Bei Leukozyten-Werten von > 20 G/l muss an eine bakterielle Superinfektion oder an eine akute Epiglottitis gedacht werden. In der p.-a. Thorax-Röntgenaufnahme findet sich eine subglottische Verengung, und das laterale Hals-Röntgenbild zeigt eine nicht vergrößerte Epiglottis.
Bei der Untersuchung von Patienten mit einer akuten Epiglottitis, die nur in Intubationsbereitschaft durchgeführt werden darf, findet man neben meist sehr hohem Fieber einen stark geröteten Rachen und eine vergrößerte, kirschrote Epiglottis. In der seitlichen Röntgenaufnahme fällt ein dilatierter Hypopharynx und eine Verengung der Vallecula epiglottica auf. Das periphere Blutbild zeigt eine Leukozytose (> 10 G/l) mit einem Anteil an neutrophilen Granulozyten von ca. 80%, das CRP ist meist auf Werte > 20 μg/ml erhöht. Die Differentialdiagnose der akuten Epiglottitis umfasst die virale Laryngotracheitis, die bakterielle Tracheitis, Fremdkörper in den Vallecula epiglottica, das angioneurotische Ödem, angeborene Anomalien und die laryngealen Papillome.
Für die labordiagnostische Absicherung einer viralen bzw. bakteriellen Infektion stehen der direkte Erregernachweis aus abgesaugtem Nasen-Rachen-Sekret (insbesondere für den Virusnachweis bei Kleinkindern) bzw. aus Abstrichmaterial vom Nasen-Rachen-Kehlkopfbereich (geeignete Transportmedien!) mittels ELISA (Arstila und Halonen 1988) und die Virusisolierung zur Verfügung. Bei Verdacht auf eine akute Epiglottitis sollte zusätzlich der Nachweis von H. influenzae Typ b aus dem Blut angestrebt werden (Ward et al. 1978). Der Nachweis virusspezifischer Antikörper mittels Komplement-Bindungsreaktion und/oder ELISA bzw. Immunoblot bleibt, insbesondere bei kleinen Kindern, nicht selten unbefriedigend (Meurmann et al. 1984, Parrott et al. 1962b, Popow-Kraupp et al. 1989).
Bei klinischem Verdacht auf laryngeale Papillome kann zur Absicherung der Diagnose der Nachweis viraler DNS in Biopsie-Material mittels PCR durchgeführt werden.
7. Therapie
Die Therapie der akuten Laryngitis besteht im Prinzip aus Stimmschonung, vermehrter Flüssigkeitszufuhr und Luftbefeuchtung. Bei sichtbar eitriger Infektion bzw. nach kulturellem Nachweis von Bakterien ist eine Therapie mit (oralen) Cephalosporinen der 2. Generation (z.B. Cefuro-xim-Axetil) bzw. einem Antibiotikum nach Resistenztestung (z.B. Ampicillin) angezeigt.
Die akute Laryngotracheitis ist in erster Linie eine virale Erkrankung, und klinische Erfahrungen mit einer spezifischen antiviralen Therapie (z.B. Ribavirin) gibt es nicht. Die symptomatische Behandlung besteht aus Luftbefeuchtung, periodischer Inhalation von (razemischem) Epinephrin, alternativ bzw. zusätzlich der inhalativen oder rektalen Gabe von Steroiden sowie Sauerstoffzufuhr bei Hypoxämie. Bei bakterieller Superinfektion erfolgt eine antibiotische Therapie in Abhängigkeit vom Kulturergebnis.
Die Therapie der akuten Epiglottitis besteht primär in der Sicherung der Luftzufuhr (Tracheostomie oder nasotracheale Intubation) und einer antibiotischen Therapie wie bei der Laryngitis.
Laryngeale Papillome müssen chirurgisch entfernt werden. Regelmäßige Nachkontrollen für das frühzeitige Erfassen von Rezidiven sind angezeigt. Die Rezidiv-freien Intervalle können bei einem Teil der Patienten durch Einspritzen von Cidofovir in die Papillombeete verlängert werden (Naiman et al. 2003).
8. Prävention
Eine Immunprophylaxe steht derzeit gegen Infektionen mit Influenza A (Immunisierung mit inaktivierten Ganzviren, Spaltimpfstoff, Subunit-Impfstoff) und H. influenzae Typ b (Immunisierung mit gereinigten Kapsel-Polysaccharid) zur Verfügung.
Als Chemoprophylaxe gegen eine Influenza-A-Virus-infektion kann Amantadin verabreicht werden. Eine Rifampin-Prophylaxe kann bei Haushaltskontakt mit einer H.-influenzae-Typ-b-infizierten Person durchgeführt werden.
LITERATUR
B3.1 Schnupfen
- Cherry J.D. The common cold. In: Feigin R.D., Cherry J.D., editors. vol. 1. Saunders; Philadelphia: 1992. p. 137 ff. (Textbook of Pediatric Infectious Disease). [Google Scholar]
- Musher D.M. How contagious are common respiratory tract infections? N Engl J Med. 2003;348:1256–1266. doi: 10.1056/NEJMra021771. [DOI] [PubMed] [Google Scholar]
- Wald E.R. Rhinitis and acute and chronic sinusitis. In: Bluestone C.D., Stool S.E., Kenna M.A., editors. vol. 1. Saunders; Philadelphia: 1996. p. 843 ff. (Pediatric Otolaryngology). [Google Scholar]
B3.2 Sinusitis
- Brook I. Bacteriology of acute and chronic ethmoid sinusitis. J Clin Microbiol. 2005;43:3479–3480. doi: 10.1128/JCM.43.7.3479-3480.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Calderon E., O'Neal M.L., Fox R.W. Chronic sinusitis in children. J Investig Allergol Clin Immunol. 1996;6:5–13. [PubMed] [Google Scholar]
- Carroll K., Reimer L. Microbiology and laboratory diagnosis of upper respiratory tract infections. Clin Infect Dis. 1996;23:442–448. doi: 10.1093/clinids/23.3.442. [DOI] [PubMed] [Google Scholar]
- Cherry J.D., Dudley J.P. Sinusitis. In: Feigin R.D., Cherry J.D., editors. vol. 1. Saunders; Philadelphia: 1992. p. 142 ff. (Textbook of Pediatric infectious disease). [Google Scholar]
- Conrad D.A., Jenson H.B. Management of acute bacterial rhino-sinusitis. Curr Opin Pediatr. 2002;14:86–90. doi: 10.1097/00008480-200202000-00015. [DOI] [PubMed] [Google Scholar]
- Finegold S.M., Flynn M.J., Rose F.V., Jousimies-Somer H., Jakielaszek C., McTeague M., Wexler H.M., Berkowitz E., Wynne B. Bacterio-logic findings associated with chronic bacterial maxillary sinusitis in adults. Clin Infect Dis. 2002;35:428–433. doi: 10.1086/341899. [DOI] [PubMed] [Google Scholar]
- Giannoni C.M., Stewart M.G., Alford E.L. Intracranial complications of sinusitis. Laryngoscope. 1997;107:863–867. doi: 10.1097/00005537-199707000-00005. [DOI] [PubMed] [Google Scholar]
- Grimwood K., Collignon P.J., Currie B.J. Antibiotic management of pneumococcal infections in an era of increased resistance. J Paediatr Child Health. 1997;33:287–295. doi: 10.1111/j.1440-1754.1997.tb01602.x. [DOI] [PubMed] [Google Scholar]
- Jones R.L., Violaris N.S., Chavda S.V. Intracranial complications of sinusitis: The need for aggressive management. J Laryngol Otol. 1995;109:1061–1062. doi: 10.1017/s0022215100132025. [DOI] [PubMed] [Google Scholar]
- Klein J.O. Current issues in upper respiratory tract infections in infants and children: Rationale for antibacterial therapy. Pediatr Infect Dis J. 1994;13:S5–S9. doi: 10.1097/00006454-199401001-00002. [DOI] [PubMed] [Google Scholar]
- Lacroix J.S., Ricchetti A., Lew D., Delhumaeu C., Morabia A., Stalder H., Terrier F., Kaiser L. Symptoms and clinical and radiological signs predicting the presence of pathogenic bacteria in acute rhinosinusitis. Acta Otolaryngol. 2002;122:192–196. doi: 10.1080/00016480252814216. [DOI] [PubMed] [Google Scholar]
- Melen I. Chronic sinusitis: Clinical and pathophysiological aspect. Acta Otolaryngol Suppl (Stockh) 1994;515:45–48. doi: 10.3109/00016489409124323. [DOI] [PubMed] [Google Scholar]
- Newton D.A. Sinusitis in children and adolescents. Prim Care. 1996;23:701–717. doi: 10.1016/s0095-4543(05)70358-4. [DOI] [PubMed] [Google Scholar]
- Piccirillo J.F. Acute bacterial sinusitis. N Engl J Med. 2004;351:902–910. doi: 10.1056/NEJMcp035553. [DOI] [PubMed] [Google Scholar]
- Poole M.D., Portugal L.G. Treatment of rhinosinusitis in the outpatient setting. Am J Med. 2005;118:45S–50S. doi: 10.1016/j.amjmed.2005.05.013. [DOI] [PubMed] [Google Scholar]
- Rosenfeld E.A., Rowley A.H. Infectious intracranial complications of sinusitis, other than meningitis, in children: 12-year review. Clin Infect Dis. 1994;18:750–754. doi: 10.1093/clinids/18.5.750. [DOI] [PubMed] [Google Scholar]
- Sande M., Gwaltney J.M. Acute community-acquired bacterial sinusitis: continuing challenges and current management. Clin Infect Dis. 2004;39:S151–S158. doi: 10.1086/421353. [DOI] [PubMed] [Google Scholar]
- von Cauwenberge P., Ingels K. Effects of viral and bacterial infection on nasal and sinus mucosa. Acta Otolaryngol (Stockh) 1996;116:316–321. doi: 10.3109/00016489609137849. [DOI] [PubMed] [Google Scholar]
- Wald E.R. Sinusitis. In: Mandell G.L., Brook I., editors. vol. 4. Churchill Livingstone; Philadelphia: 1995. (Atlas of Infectious Disease). [Google Scholar]
- Wald E.R. Rhinitis and acute and chronic sinusitis. In: Bluestone C.D., Stool S.E., Kenna M.A., editors. vol. 1. Saunders; Philadelphia: 1996. p. 843 ff. (Pediatric Otolaryngology). [Google Scholar]
- Weschta M., Rimek D., Formanek M., Polzehl D., Podbielski A., Riechelmann H. Topical antifungal treatment of nasal polyps - a randomized double blind clinical trial. J Allergy Clin Immunol. 2004;113:1122–1128. doi: 10.1016/j.jaci.2004.03.038. [DOI] [PubMed] [Google Scholar]
- Zambrano D. The role of anaerobic bacteria in human infections. Clin Ther. 1993;15:244–260. [PubMed] [Google Scholar]
B3.3 Otitis externa, Otitis media, Mastoiditis
- Block S.L. Causative pathogenes, antibiotic resistance and therapeutic considerations in acute otitis media. Pediatr Infect Dis. J. 1997;16:449–456. doi: 10.1097/00006454-199704000-00029. [DOI] [PubMed] [Google Scholar]
- Bluestone C.D., Klein J.O. Otitis media in Infants and Children. Saunders; Philadelphia: 1995. [Google Scholar]
- Bosley G.S., Whitney A.M., Pruckler J.M. Characterization of ear fluid isolates of Alloiococcus otitidis from patients with recurrent otitis media. J Clin Microbiol. 1995;33:2876–2880. doi: 10.1128/jcm.33.11.2876-2880.1995. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Feigin R.D., Kline M.W., Hyatt S.R. Otitis media. In: Feigin R.D., Cherry J.D., editors. vol. 1. Saunders; Philadelphia: 1992. p. 174 ff. (Textbook of Pediatric Infectious Diseases). [Google Scholar]
- Feigin R.D. Otitis externa. In: Feigin R.D., Cherry J.D., editors. vol. 1. Saunders; Philadelphia: 1992. p. 172 ff. (Textbook of Pediatric Infectious Diseases). [Google Scholar]
- Fetter T.W. Infections of the external ear. In: Mandell G.L., Brook I., editors. vol. 4. Churchill-Livingstone; Philadelphia: 1995. (Atlas of Infectious Diseases). [Google Scholar]
- Fireman P. Otitis media and its relation to allergic rhinitis. Allergy Asthma Proc. 1997;18:135–143. doi: 10.2500/108854197778984428. [DOI] [PubMed] [Google Scholar]
- Gok U., Bulut Y., Keles E., Yalcin S., Doymaz M.Z. Bacteriological and PCR analysis of clinical material aspirated from otitis media with effusions. Int J Pediatr Otorhinolaryngol. 2001;60:49–54. doi: 10.1016/s0165-5876(01)00510-9. [DOI] [PubMed] [Google Scholar]
- Heikkinen T., Thint M., Chonmaitree T. Prevalence of various respiratory viruses in the middle ear during acute otitis media. N Engl J Med. 1999;340:260–264. doi: 10.1056/NEJM199901283400402. [DOI] [PubMed] [Google Scholar]
- Kilpi T., Herva E., Kaijalainen T., Syrjänen R., Takala A.K. Bacteriology of acute otitis media in a cohort of finnish children followed for the first two years of life. Pediatr Infect Dis. J. 2001;20:654–662. doi: 10.1097/00006454-200107000-00004. [DOI] [PubMed] [Google Scholar]
- Leggiadro R.J. The clinical impact of resistance in the management of pneumococcal disease. Infect Dis Clin North Am. 1997;11:867–874. doi: 10.1016/s0891-5520(05)70394-9. [DOI] [PubMed] [Google Scholar]
- Lewis K., Cherry J.D. Mastoiditis. In: Feigin R.D., Cherry J.D., editors. vol. 1. Saunders; Philadelphia: 1992. p. 189 ff. (Textbook of Pediatric Infectious Diseases). [Google Scholar]
- Luckhaupt H. Otitis media mit Erguß. Chemother J. 1997;6(Suppl 16):35–38. [Google Scholar]
- Pichichero M.E., Casey J.R. Acute otitis media management. Minerva Pediatr. 2003;55:415–438. [PubMed] [Google Scholar]
- Pitkäranta A., Jero J., Arruda E., Virolainen A., Hayden F.G. Polymerase chain reaction beased detection of rhinovirus, respiratory syncytial virus, and coronavirus in otitis media with effusion. J Pediatr. 1998;133:390–394. doi: 10.1016/S0022-3476(98)70276-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Post J.C., Preston R.A., Aul J.J., Larkins-Pettigrew M., Rydquist-White J., Anderson K.W., Wadowsky R.M., Reagan D.R., Walker E.S., Kingsley L.A., Magit A.E., Ehrlich G.D. Molecular analysis of bacterial pathogens in otitis media with effusion. JAMA. 1995;273:1598–1604. [PubMed] [Google Scholar]
- Roos K., Hakansson E.G., Holm S. Effect of recolonisation with „interfering” a streptococci on recurrences of acute and secretory otitis media in children: randomised placebo controlled trial. Brit Med J. 2001;322:210–212. doi: 10.1136/bmj.322.7280.210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Rosenfeld R.M. An evidence-based approach to treating otitis media. Pediatr Clin North Am. 1996;43:1165–1181. doi: 10.1016/s0031-3955(05)70512-5. [DOI] [PubMed] [Google Scholar]
- Scholz H. Antibakterielle Chemotherapie der akuten Otitis media. Chemother J. 1997;6(Suppl 16):15–20. [Google Scholar]
- Turner D., Leibovitz E., Aran A., Piglansky L., Raiz S., Leiberman A., Dagan R. Acute otitis media in infants younger than two months of age: microbiology, clinical presentation and therapeutic approach. Pediatr Infect Dis. 2002;21:669–674. doi: 10.1097/00006454-200207000-00013. [DOI] [PubMed] [Google Scholar]
- Uhari M., Mantysaari K., Niemela M. A meta-analytic review of the risk factors for acute otitis media. Clin Infect Dis. 1996;22:1079–1083. doi: 10.1093/clinids/22.6.1079. [DOI] [PubMed] [Google Scholar]
- Vassbotn F.S., Klausen O.G., Lind O., Moller P. Acute mastoiditis in a Norvegian population: a 20 yar retrospective study. Int J Pediatr Otorhinolaryngol. 2002;62:237–242. doi: 10.1016/s0165-5876(01)00626-7. [DOI] [PubMed] [Google Scholar]
- Vesa S., Kleemola M., Blomqvist S., Takala A., Kilpi T., Hovi T. Epidemiology of documented viral respiratory infections and acute otitis media in a cohort of children followed from two to twenty-four months of age. Pediatr Infect J. 2001;20:574–581. doi: 10.1097/00006454-200106000-00006. [DOI] [PubMed] [Google Scholar]
- Weerda H. Entzündungen des äußeren Ohres (Otitis externa) In: Naumann H.H., Helms J., Herberhold C., Kastenbauer E., editors. Bd. 1. Thieme; Stuttgart: 1994. p. S. 499 ff. (Oto-Rhino-Laryngologie in Klinik und Praxis). [Google Scholar]
- Willner A., Grundfast K.M., Lazar R.H. Otitis media and infections of the inner ear. In: Mandell G.L., Brook I., editors. vol. 4. Churchill Livingstone; Philadelphia: 1995. (Atlas of Infectious Diseases). [Google Scholar]
B3.4 Infektionen des Rachens
- Adam D., Scholz H., Helmerking M. Short course antibiotic treatment of 4782 cultureproven cases of group A streptococcal tonsillopharyngitis and incidence of poststreptococcal sequelae. J Infect Dis. 2000;182:509–516. doi: 10.1086/315709. [DOI] [PubMed] [Google Scholar]
- Bhakdi S., Bayley H., Valeva A. Staphylococcal alpha-toxin, streptolysin-O, and Escherichia coli hemolysin: prototypes of pore-forming bacterial cytolysins. Arch Microbiol. 1996;165:73–79. doi: 10.1007/s002030050300. [DOI] [PubMed] [Google Scholar]
- Bisno A.L. Acute pharyngitis. N Engl J Med. 2001;344:205–211. doi: 10.1056/NEJM200101183440308. [DOI] [PubMed] [Google Scholar]
- Carroll K., Reimer L. Microbiology and laboratory diagnosis of upper respiratory tract infections. Clin Infect Dis. 1996;23:442–448. doi: 10.1093/clinids/23.3.442. [DOI] [PubMed] [Google Scholar]
- Esposito S., Blasi F., Bosis S., Droghetti R., Faelli N., Lastrico A., Principi N. Aetiology of acute pharyngitis: the role of atypical bacteria. J Med Microbiol. 2004;53:645–651. doi: 10.1099/jmm.0.05487-0. [DOI] [PubMed] [Google Scholar]
- Falck G., Grahn-Hakansson E., Holm S.E., Roos K., Lagergren L. Tolerance and efficacy of interfering alpha-streptococci in recurrence of streptococcal pharyngotonsillitis: a placebo-controlled study. Acta Otolaryngol. 1999;119:944–948. doi: 10.1080/00016489950180333. [DOI] [PubMed] [Google Scholar]
- Gerber M.A., Randolph M.F., Martin N.J. Community-wide outbreak of group G streptococcal pharyngitis. Pediatrics. 1991;87:598. [PubMed] [Google Scholar]
- Gerber M.A., Tanz R.R., Kabat W. Optical immunoassay test for group A ß-hemolytic streptococcal pharyngitis. JAMA. 1997;277:899–903. [PubMed] [Google Scholar]
- Glück U., Gebbers J-O. Ingested probiotics reduce nasal colonization with pathogenic bacteria (Staphylococcus aureus, Streptococcus pneumoniae, and ß-hemolytic streptococci) Am J Clin Nutr. 2003;77:517–520. doi: 10.1093/ajcn/77.2.517. [DOI] [PubMed] [Google Scholar]
- Huovinen P., Lahtonen R., Ziegler T. Pharyngitis in adults: the presence and co-existence of viruses and bacterial organisms. Ann Intern Med. 1989;110:612. doi: 10.7326/0003-4819-110-8-612. [DOI] [PubMed] [Google Scholar]
- Kline J.A., Runge J.W. Streptococcal pharyngitis: a review of patho-physiology, diagnosis, and management. J Emerg Med. 1994;12:665–680. doi: 10.1016/0736-4679(94)90420-0. [DOI] [PubMed] [Google Scholar]
- Larsson B.O., Linde A. Intrafamilial transmission of Epstein-Barr virus infection among six adult members of one adult family. Scand J Infect Dis. 1990;22:363–366. doi: 10.3109/00365549009027061. [DOI] [PubMed] [Google Scholar]
- Linder R. Rhodococcus equi and Arcanobacterium haemolyticum: two „coryneform” bacteria increasingly recognized as agents of human infection. Emerg Infect Dis. 1997;3:145–153. doi: 10.3201/eid0302.970207. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Little P., Williamson I. Sore throat management in general practice. Fam Pract. 1996;13:317–321. doi: 10.1093/fampra/13.3.317. [DOI] [PubMed] [Google Scholar]
- McIsaac W.J., Goel V., Slaughter P.M. Reconsidering sore throats. Can Fam Physician. 1997;43:485–500. [PMC free article] [PubMed] [Google Scholar]
- Middleton D.B. Pharyngitis. Primary Care. 1996;23:719–739. doi: 10.1016/S0095-4543(05)70359-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Miller G., Niederman J.C., Andrews L.L. Prolonged oropharyngeal excretion of Epstein-Barr virus after infectious mononucleosis. N Engl J Med. 1973;288:229–232. doi: 10.1056/NEJM197302012880503. [DOI] [PubMed] [Google Scholar]
- Okano M. Therapeutic approaches for severe Epstein-Barr virus infection. Pediatr Hematol Oncol. 1997;14:109–119. doi: 10.3109/08880019709030897. [DOI] [PubMed] [Google Scholar]
- Österlund A., Engstrand L. An intracellular sanctuary for Streptococcus pyogenes in human tonsillar epithelium - studies of asymptomatic carriers and in vitro cultured biopsies. Acta Otolaryngol. 1997;117:883–888. doi: 10.3109/00016489709114219. [DOI] [PubMed] [Google Scholar]
- Oudejans J.J., Jiwa N.M., Meijer C.J. Epstein-Barr virus in Hodgkin's disease: more than just an innocent bystander. Pathol. 1997;181:353–356. doi: 10.1002/(SICI)1096-9896(199704)181:4<353::AID-PATH782>3.0.CO;2-3. [DOI] [PubMed] [Google Scholar]
- Perkins A. An approach to diagnosing the acute sore throat. Am Fam Physician. 1997;55:131–138. [PubMed] [Google Scholar]
- Proud D., Naclerio R.M., Gwaltney J.M. Kinins are generated in nasal secretions during natural rhinovirus colds. J Infect Dis. 1990;161:120–123. doi: 10.1093/infdis/161.1.120. [DOI] [PubMed] [Google Scholar]
- Sinave C.P., Hardy G.J., Fardy P.W. The Lemièrre Syndrome: suppu-rative thrombophlebitis of the internal jugular vein secondary to oropharyngeal infection. Medicine. 1989;68:85–94. [PubMed] [Google Scholar]
- Vasef M.A., Ferlito A., Weiss L.M. Nasopharyngeal carcinoma, with emphasis on its relationship to Epstein-Barr virus. Ann Otol Rhinol Laryngol. 1997;106:348–356. doi: 10.1177/000348949710600416. [DOI] [PubMed] [Google Scholar]
- Wang B., Li S., Southern P.J., Cleary P.P. Streptococcal modulation of cellular invasion via TGF-ß1 signaling. Proc Acad Natl Sci USA. 2006;103:2380–2385. doi: 10.1073/pnas.0506668103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Whitley R.J., Hayden F.G., Reisinger K.S., Young N., Dutkowski R., Ipe D., Mills R.G., Ward P. Oral oseltamivir treatment of influenza in children. Pediatr Infect Dis J. 2001;20:127–133. doi: 10.1097/00006454-200102000-00002. [DOI] [PubMed] [Google Scholar]
B3.5 Sialadenitis
- Chitre V., Premchandra D. Recurrent parotitis. Arch Dis Child. 1997;77:359–363. doi: 10.1136/adc.77.4.359. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Chiu C., Lin T. Clinical and microbiological analysis of six children with acute suppurative parotitis. Acta Paediatr. 1996;85:106–108. doi: 10.1111/j.1651-2227.1996.tb13901.x. [DOI] [PubMed] [Google Scholar]
- Giglio M., Landaeta M., Pinto M. Microbiology of recurrent parotitis. Pediatr Infect Dis J. 1997;16:386–390. doi: 10.1097/00006454-199704000-00010. [DOI] [PubMed] [Google Scholar]
- Goguen L., April M., Karmody C. Self-induced pneumoparotitis. Arch Otolaryngol Head Neck Surg. 1995;121:1426–1429. doi: 10.1001/archotol.1995.01890120082017. [DOI] [PubMed] [Google Scholar]
- Goldberg M. Infections of the salivary glands. In: Topazian R.G., Goldberg M.H., editors. Oral and Maxillary Infections. 2nd ed. Saunders; Philadelphia: 1987. pp. 239–249. [Google Scholar]
- Lumbiganon P., Viengnondha S. Clinical manifestations of melioidosis in children. Pediatr Infect Dis J. 1995;14:136–140. doi: 10.1097/00006454-199502000-00010. [DOI] [PubMed] [Google Scholar]
- McDuffie M., Brown F., Raines W. Pneumoparotitis with orthodontic treatment. Am J Orthod Dentofacial Orthop. 1993;103:377–379. doi: 10.1016/0889-5406(93)70021-F. [DOI] [PubMed] [Google Scholar]
- Peter J., Haney H. Infections of the oral cavity. Pediatric Annals. 1996;25:572–576. doi: 10.3928/0090-4481-19961001-09. [DOI] [PubMed] [Google Scholar]
- Sadeghi N., Black M., Frenkiel S. Parotidectomy for the treatment of chronic recurrent parotitis. J Otolaryngol. 1996;25:305–307. [PubMed] [Google Scholar]
- Trott K. Therapeutic effects of low radiation doses. Strahlenther Onkol. 1994;170:1–12. [PubMed] [Google Scholar]
- Yoshiura K., Yuasa K., Tabata O. Reliability of ultrasonography and sialography in the diagnosis of Sjogren's syndrome. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997;83:400–407. doi: 10.1016/s1079-2104(97)90249-3. [DOI] [PubMed] [Google Scholar]
- Zimmermann H., Matter H., Kiener T. Mumps epidemiology in Switzerland: results from the Sentinella surveillance system 1986–1993. Sentinella Work Group. Soz Präventivmed. 1995;40:80–92. doi: 10.1007/BF01360322. [DOI] [PubMed] [Google Scholar]
B3.6 Infektionen des Kehlkopfes
- Arstila P.P., Halonen P.E. Direct antigen detection. In: Lennette E.H., Halonen P., Murphy F.A., editors. vol. II. Springer; Berlin: 1988. pp. 60–75. (Laboratory Diagnosis of Infectious Diseases, Principles and Practice). [Google Scholar]
- Broughton S.J., Warren R.E. A review of Haemophilus influenzae infections in Cambridge 1975–1981. J Infect. 1984;9:30–42. doi: 10.1016/s0163-4453(84)94446-3. [DOI] [PubMed] [Google Scholar]
- Chanock R., Chambon L., Chang W. WHO respiratory disease survey in children: A serological study. Bull WHO. 1967;37:363–369. [PMC free article] [PubMed] [Google Scholar]
- Cherry D.J. Epiglottitis (Supraglottitis) and Croup (Laryngitis, Laryngotracheitis, Spasmodic Croup, Laryngotracheobron-chitis, Bacterial Tracheitis, and Laryngotracheobroncho-pneumonitis) In: Feigin R.D., Cherry J.D., editors. vol. I. Saunders; Philadelphia: 1998. pp. 218–241. (Textbook of Pediatric Infectious Diseases). [Google Scholar]
- Denny F.W., Murphy T.F., Clyde W.A. Croup: An 11-year study in a pediatric practice. Pediatrics. 1983;71:871–876. [PubMed] [Google Scholar]
- Hope-Simpson R.E., Higgins P.G. A respiratory virus study in Great Britain: Review and evaluation. Prog Med Virol. 1969;11:354–407. [PubMed] [Google Scholar]
- Macasaet F.F., Kidd P.A., Bolano C.R. The etiology of acute respiratory infections. III. The role of viruses and bacteria. J Pediatr. 1968;72:829–839. doi: 10.1016/s0022-3476(68)80436-6. [DOI] [PubMed] [Google Scholar]
- Meurmann O., Ruuskanen O., Sarkkinen H. Immunoglobulin class-specific antibody response in repiratory syncytial virus infection measured by enzyme immunoassay. J Med Virol. 1984;14:67–72. doi: 10.1002/jmv.1890140110. [DOI] [PubMed] [Google Scholar]
- Naiman A.N., Ceruse P., Coulombeau B. Intralesional Cido-fovir and surgical excision for laryngeal papillomatosis. Laryngoscope. 2003;113:2174–2181. doi: 10.1097/00005537-200312000-00024. [DOI] [PubMed] [Google Scholar]
- Parrott R.H., Vargosko A.J., Kim H.W. Respiratory syncytial virus. II. Serologic studies over a 34-month period of children with bronchiolitis, pneumonia, and minor respiratory disease. J Am Med Ass. 1961;176:653–657. [PubMed] [Google Scholar]
- Parrott R.H., Vargosko A.J., Kim H.W. Acute respiratory diseases of viral etiology. III. Myxoviruses: Parainfluenza. Am J Public Health. 1962;52:907–917. doi: 10.2105/ajph.52.6.907. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Parrott R.H., Vargosko A.J., Kim H.W. Clinical syndromes among children. Am Rev Respir Dis. 1962;88:73–76. doi: 10.1164/arrd.1963.88.3P2.73. [DOI] [PubMed] [Google Scholar]
- Popow-Kraupp Th., Lakits E., Kellner G. Immunoglobuline class-specific immune response to respiratory syncytial virus structural proteins in infants, children, and adults. J Med Virol. 1989;27:215–223. doi: 10.1002/jmv.1890270307. [DOI] [PubMed] [Google Scholar]
- Quick C.A., Watts S.L., Krzyzek R.A. Relationship between condylomata and laryngeal papillomata. Clinical and molecular virological evidence. Ann Otol Rhinol Laryngol. 1980;89:467–471. doi: 10.1177/000348948008900521. [DOI] [PubMed] [Google Scholar]
- Shah K.V., Howley P.M. Papillomavirus. In: Fields B.N., Knipe D.M., Howley P.M., Chanock R.M., Monath T.P., Melnick J.L., Roizman B., Straus S.E., editors. Fields Virology. 3rd ed. Lippincott Williams and Williams; Philadelphia: 1996. pp. 2077–2109. [Google Scholar]
- Tyrrel D.A.J. Common Colds and Related Diseases. Williams and Wilkins; Baltimore: 1965. pp. 1–197. [Google Scholar]
- Vernon D.D., Sarnaik A.P. Acute Epiglottitis in children: A conservative approach to diagnosis and management. Crit Care Med. 1986;14:23–25. doi: 10.1097/00003246-198601000-00005. [DOI] [PubMed] [Google Scholar]
- Ward J.I., Siber G.R., Scheifele D.J. Rapid diagnosis of Haemo-philus influenzae type B infections by latex particle agglutination and counterimmunelectrophoresis. J Pediatr. 1978;93:37–42. doi: 10.1016/s0022-3476(78)80596-4. [DOI] [PubMed] [Google Scholar]
- Welliver R.C., Kaul T.N., Ogra P.L. The appearance of cell-bound IgE in respiratory tract epithelium after respiratory syncytial virus infection. N Engl J Med. 1980;303:1198–1202. doi: 10.1056/NEJM198011203032103. [DOI] [PubMed] [Google Scholar]
- Welliver R.C., Wong D.T., Middleton E. Role of parainfluenza-virus-specific IgE in pathogenesis of croup and wheezing subsequent to infection. J Pediatr. 1982;101:889–896. doi: 10.1016/s0022-3476(82)80005-x. [DOI] [PubMed] [Google Scholar]


