FIGURA 5-1.

Pulmón normal, vista macroscópica
Corte del pulmón normal (con tan sólo una mínima congestión posterior, visible en la zona inferior derecha). Los ganglios linfáticos hiliares son pequeños y tienen abundante pigmento antracótico (procedente del polvo en el aire inspirado, que es luego fagocitado por los macrófagos pulmonares, transferido a los vasos linfáticos y acumulado en los ganglios linfáticos). El pigmento antracótico confiere a los ganglios un aspecto negro-grisáceo.
FIGURA 5-2.

Pulmón normal, radiografía
Esta radiografía de tórax pone de manifiesto el aspecto normal de los pulmones en proyección posteroanterior en un varón adulto. La densidad aérea más oscura representa el parénquima, siendo más brillantes el hilio y las partes blandas de la pared torácica. Obsérvese que la sombra cardíaca normal tiene aproximadamente la anchura del pulmón izquierdo.
FIGURA 5-3.

Pulmón normal, vista macroscópica
Aquí se muestra la superficie pleural del pulmón, de aspecto liso y brillante. Este paciente presentaba edema pulmonar pronunciado, con ingurgitación de los vasos linfáticos situados entre los lóbulos pulmonares. En consecuencia, los lóbulos pulmonares se encuentran delimitados por una trama blanca. El pigmento antracótico derivado de la inhalación de polvos carbonosos es transportado por los vasos linfáticos hacia la superficie pleural y los ganglios linfáticos. En todos los pulmones adultos hay pequeñas cantidades de pigmento antracótico. Los fumadores tienen más antracosis.
FIGURA 5-4.

Pulmón normal, tomografía computarizada
Esta TC del tórax con densidad de partes blandas pone de manifiesto el aspecto normal de los pulmones derecho (*) e izquierdo (×) —prácticamente negros por su densidad aérea— en un hombre adulto normal. El material de contraste presente en el torrente circulatorio proporciona un aspecto brillante a las cavidades cardíacas derechas (■) e izquierdas (□), así como a la aorta (+). El hueso de los cuerpos vertebrales y las costillas también presenta un aspecto brillante. El diámetro anteroposterior es normal.
FIGURA 5-5.

Pulmón adulto normal, vista microscópica
Aquí se muestran, a gran aumento, las delicadas paredes de los alvéolos pulmonares. El citoplasma atenuado de las células epiteliales alveolares de tipo I no puede distinguirse fácilmente de los capilares de las paredes alveolares. Las delgadas paredes alveolares permiten un intercambio gaseoso eficiente, de modo que en los jóvenes sanos el gradiente alveolar-arterial (A-a) de oxígeno se mantiene por debajo de los 15 mmHg, aunque en los ancianos el gradiente A-a puede superar los 20 mmHg. En el interior de los alvéolos pueden observarse algunos macrófagos (*). Los neumocitos de tipo II (▴) producen surfactante, que disminuye la tensión superficial para aumentar la distensibilidad pulmonar y mantener los alvéolos expandidos.
FIGURA 5-6.

Pulmón fetal normal, vista microscópica
El pulmón fetal normal tiene un aspecto mucho más celular que el pulmón adulto. Los alvéolos no se hallan completamente desarrollados y el intersticio es más prominente. En esta vista de la fase canalicular del final del segundo trimestre, los bronquiolos (*) están formando saculaciones que se transformarán en alvéolos. Hay bronquios (■) y ramas de las arterias pulmonares (□) en desarrollo. En la primera parte del segundo trimestre, el pulmón fetal se halla en la fase glandular (fase tubular) del desarrollo. Tan sólo hay bronquiolos primitivos redondeados y aún no se ha formado ningún alvéolo. En el tercer trimestre, la fase sacular se caracteriza por el desarrollo progresivo de los alvéolos.
FIGURA 5-7.

Anomalías congénitas, diagrama
En este diagrama se ilustra el aspecto del secuestro pulmonar extralobular (SPE) y de la malformación congénita de las vías aéreas pulmonares (MCVAP). En la MCVAP, anomalía infrecuente que afecta a aproximadamente 1 de cada 5.000 nacidos vivos, hay una masa con componentes quísticos y sólidos, situada por completo dentro del parénquima pulmonar. En cambio, el SPE, que se caracteriza por la ausencia de conexión bronquial, da lugar a una masa separada, constituida por tejido pulmonar que obtiene su aporte sanguíneo de la aorta y no del árbol arterial pulmonar. Aunque algunos secuestros intralobulares son congénitos, se piensa que muchos se asocian a episodios neumónicos de repetición.
FIGURA 5-8.

Malformación congénita de las vías aéreas pulmonares, vista microscópica
En este pulmón fetal se observan espacios quísticos irregulares, revestidos por epitelio bronquial, que forman parte de una lesión pulmonar conocida como MCVAP. Aunque la lesión es benigna desde el punto de vista microscópico (muy similar al hamartoma), puede aumentar de tamaño y actuar como una lesión ocupante de espacio, produciendo hipoplasia del parénquima funcional pulmonar y dificultades respiratorias desde el nacimiento. Desde el punto de vista macroscópico, la MCVAP puede presentar un aspecto de grandes quistes (tipo I), pequeños quistes (tipo II) o masa sólida (tipo III).
FIGURA 5-9.

Secuestro extralobular, vista microscópica
En esta masa separada del resto del pulmón se observan bronquios irregulares (*), así como espacios aéreos distales dilatados, algunos de los cuales se hallan revestidos por epitelio bronquial (■). El aporte vascular es sistémico, no a partir de la arteria pulmonar, y por lo tanto esta parte del pulmón no funciona en la oxigenación normal. Cuando el segmento secuestrado está rodeado de pulmón normal se denomina secuestro intralobular. En cualquier caso, el pulmón secuestrado actúa como una masa y puede infectarse.
FIGURA 5-10.

Atelectasia, vista macroscópica
En esta autopsia se observa un pulmón derecho colapsado (*). El paciente había sufrido un traumatismo torácico que hizo que la sangre irrumpiese en la cavidad pleural (hemotórax). La atelectasia de compresión también puede producirse al ser ocupada la cavidad pleural virtual por aire (neumotórax), trasudado (hidrotórax), linfa (quilotórax) o exudado purulento (empiema). El pulmón colapsado no se ventila, con lo que se altera el cociente ventilación/perfusión (V/Q) y se crea una situación de exclusión pulmonar similar a la de un cortocircuito cardíaco derecha-izquierda, con parámetros de gases sanguíneos parecidos a los de la sangre venosa mixta al entrar en el corazón derecho.
FIGURA 5-11.

Atelectasia, radiografía
Esta radiografía de tórax pone de manifiesto atenuación disminuida en la parte derecha (neumotórax derecho). Obsérvese la expansión de la cavidad torácica derecha, con desplazamiento del corazón hacia la izquierda. Las causas de neumotórax incluyen lesiones torácicas penetrantes, inflamación con rotura de un bronquio a la pleura, rotura de una bulla enfisematosa y barotraumatismo por ventilación mecánica con presión positiva. El escape de aire al espacio pleural elimina la presión negativa de la cavidad torácica y colapsa el pulmón. El ejemplo que se muestra aquí es un neumotórax «a tensión», que desvía el mediastino porque el escape de aire ejerce un efecto de válvula que provoca una acumulación progresiva de aire en la cavidad torácica derecha. Para facilitar la reexpansión del pulmón, puede insertarse un tubo en la pared torácica. Por el contrario, en la atelectasia de resorción, que tiene lugar al obstruirse la vía aérea y reabsorberse el aire del parénquima pulmonar, se produce colapso pulmonar y desviación del mediastino hacia el pulmón afectado.
FIGURA 5-12.

Atelectasia, tomografía computarizada
Esta TC pone de manifiesto un gran derrame pleural derecho (■) y un derrame pleural izquierdo más pequeño (□). Los derrames pleurales que aquí se muestran están producidos por una insuficiencia cardíaca derecha, a su vez consecuencia de una estenosis mitral reumática con congestión pulmonar crónica e hipertensión pulmonar. Obsérvese el aumento de tamaño de la aurícula derecha (◆). Nótese también que este gran derrame ha producido atelectasia bilateral de los lóbulos inferiores, caracterizada por una pequeña semiluna densa de tejido pulmonar en la zona de derrame a ambos lados (▴).
FIGURAS 5-13 y 5-14.


Edema pulmonar, radiografía
La congestión pasiva acentúa la trama intersticial pulmonar y el líquido de edema se escapa a los alvéolos, creando infiltrados. La radiografía posteroanterior de tórax de la izquierda pone de manifiesto congestión pulmonar y edema en todos los campos pulmonares. Las venas pulmonares están distendidas en la vecindad del hilio. El margen del corazón izquierdo es prominente debido al aumento de tamaño de la aurícula izquierda. Este paciente tenía estenosis mitral. La radiografía posteroanterior de tórax de la derecha pone de manifiesto congestión y edema en todos los campos pulmonares, por insuficiencia cardíaca congestiva grave asociada a miocardiopatía. El edema oscurece la silueta cardíaca.
FIGURAS 5-15 y 5-16.


Edema pulmonar, vista microscópica
Los alvéolos a la izquierda están ocupados por un material rosado y algo flocular que es característico del edema pulmonar. Obsérvese también que los capilares de las paredes alveolares se encuentran congestivos, repletos de abundantes hematíes. La congestión pulmonar con edema es frecuente en los pacientes con insuficiencia cardíaca y en áreas de inflamación pulmonar. A la derecha se aprecia congestión pulmonar más pronunciada, con dilatación de los capilares, escape de la sangre hacia los espacios alveolares y aparición de macrófagos («células de insuficiencia cardíaca») cuyos citoplasmas están cargados de gránulos marrones de hemosiderina procedente de la destrucción de los hematíes.
FIGURA 5-17.

Daño alveolar difuso, vista macroscópica
Al corte, este pulmón prácticamente no contiene aire, es difusamente firme y elástico y tiene un aspecto brillante. Desde el punto de vista clínico, se trata del síndrome del distrés respiratorio del adulto. El daño alveolar difuso (DAD) es una forma de enfermedad pulmonar restrictiva aguda producida por lesiones de los endotelios capilares asociadas a múltiples causas, incluyendo infecciones pulmonares, sepsis, inhalación de gases tóxicos, anemias hemolíticas microangiopáticas, traumatismos, toxicidad por oxígeno, aspiración, embolismo graso o sobredosis de opiáceos. El DAD produce hipoxemia grave. La capacidad de difusión pulmonar para el monóxido de carbono (Dlco) se encuentra reducida. Las enfermedades que afectan a las paredes alveolares (DAD o enfisema) o al lecho capilar pulmonar (tromboembolismo o vasculitis) disminuyen la Dlco.
FIGURA 5-18.

Daño alveolar difuso, tomografía computarizada
Esta TC torácica en modo de «ventana pulmonar» pone de manifiesto extensas opacidades bilaterales en vidrio esmerilado del parénquima pulmonar, que son compatibles con DAD. La fase aguda del DAD puede desarrollarse al cabo de horas de la lesión capilar, con aumento de la permeabilidad vascular y escape de líquido intersticial a los alvéolos, dando lugar a infiltrados difusos en vidrio esmerilado. Tras ello, las proteínas plasmáticas exudadas pueden formar membranas hialinas. La lesión de los neumocitos de tipo II disminuye la producción de surfactante y reduce la distensibilidad pulmonar. La liberación de interleucina-1 (IL-1), IL-8 y factor de necrosis tumoral (TNF) promueve la quimiotaxis y activación de los neutrófilos, lo que potencia aún más la lesión del parénquima.
FIGURA 5-19.

Daño alveolar difuso, vista microscópica
El DAD es, simplemente, la vía final común de una gran variedad de lesiones pulmonares graves. Tal como se muestra aquí, en las fases iniciales del DAD hay membranas hialinas (*) que revisten los alvéolos. A continuación, durante la primera semana tras la lesión pulmonar, se resuelven las membranas hialinas y proliferan los macrófagos. Si el paciente sobrevive más de una semana, la inflamación intersticial y la fibrosis se hacen cada vez más prominentes, disminuye la distensibilidad pulmonar y se altera el cociente V/Q. Se necesita una tensión de oxígeno elevada para tratar la hipoxia producida por el DAD, pero la toxicidad del oxígeno administrado exacerba el DAD.
FIGURA 5-20.

Enfisema pulmonar, vista macroscópica
Hay dos tipos principales de enfisema: centrolobulillar (centroacinar) y panlobulillar (panacinar). El primero afecta primariamente a los lóbulos superiores, en tanto que el segundo afecta a todos los campos pulmonares, en particular a las bases. Aquí se observa pérdida lobulillar central de tejido pulmonar, con intensa pigmentación antracótica de color negro. A diferencia del riesgo de cáncer de pulmón, que disminuye cuando se deja de fumar, la pérdida de tejido pulmonar en el enfisema es permanente. El enfisema centrolobulillar se caracteriza por la pérdida de los bronquiolos respiratorios en la porción proximal del acino, sin que se afecten los alvéolos distales. Este patrón de enfisema es más típico en los fumadores.
FIGURA 5-21.

Enfisema pulmonar, radiografía
Esta radiografía posteroanterior de tórax pone de manifiesto una acentuación de la trama intersticial, con arquitectura irregular, aumento del volumen pulmonar total y aplanamiento bilateral de las hojas diafragmáticas, compatibles con enfisema centrolobulillar. El aplanamiento del diafragma reduce la eficiencia de la contracción muscular y la excursión pulmonar, lo que hace más laboriosa la respiración. A medida que aumenta la gravedad del enfisema, las personas afectadas comienzan a usar los músculos accesorios de la respiración, como los intercostales y el esternocleidomastoideo. Las personas afectadas también pueden presentar respiración «en boca de pez» (pursed lip breathing) para aumentar la presión de las vías aéreas centrales e impedir el colapso de las vías aéreas distales por aumento de la distensibilidad pulmonar. La mayor parte del incremento de la capacidad pulmonar total que acompaña al enfisema es consecuencia del aumento del volumen residual.
FIGURA 5-22.

Hipertensión pulmonar, tomografía computarizada del tórax
Esta TC torácica en modo de ventana pulmonar pone de manifiesto un aumento de la trama vascular pulmonar por hipertensión pulmonar. Hay radiotransparencias parenquimatosas consistentes con un patrón de enfisema centrolobulillar. El diámetro anteroposterior del tórax se halla aumentado como consecuencia del aumento del volumen pulmonar total, del que es responsable principal el aumento del volumen residual.
FIGURAS 5-23 y 5-24.


Enfisema pulmonar panacinar, vista macroscópica y radiografía
El enfisema panacinar se produce por la pérdida de todas las partes del acino, desde el bronquiolo respiratorio hasta los alvéolos. Este patrón es típico de la deficiencia de α1-antitripsina (AAT). Obsérvese, en la imagen de la izquierda, que las bullas son más prominentes en el lóbulo inferior. En la imagen de la derecha se muestra el aspecto típico de la radiografía de tórax del enfisema panlobulillar, con aumento del volumen pulmonar y aplanamiento del diafragma.
FIGURA 5-25.

Enfisema pulmonar, gammagrafía de ventilación
Hay áreas de ventilación anormal y áreas pálidas en que la emisión de radionúclido se halla disminuida, sobre todo en las bases pulmonares. Estos hallazgos son compatibles con enfisema panlobulillar.
FIGURA 5-26.

Enfisema pulmonar, gammagrafía de perfusión
Hay áreas de perfusión disminuida (◆) por reducción de los alvéolos pulmonares y pérdida de los lechos capilares, especialmente en las bases pulmonares. Estos hallazgos son compatibles con enfisema bulloso panacinar.
FIGURA 5-27.

Enfisema pulmonar, vista macroscópica
En esta autopsia se ha abierto la cavidad torácica por la cara anterior para exponer una gran bulla (◆) del pulmón izquierdo en un paciente que murió de enfisema pulmonar. Las bullas son grandes espacios aéreos dilatados que sobresalen bajo la pleura. Las bullas de gran tamaño pueden actuar como lesiones ocupantes de espacio que reducen aún más la función pulmonar. El enfisema se caracteriza por la pérdida de parénquima pulmonar por destrucción de los alvéolos, de manera que se produce la dilatación permanente de los restantes espacios aéreos. A medida que progresa el enfisema, hay pérdida de la capacidad de difusión (Dlco disminuida), hipoxemia e hipercapnia con acidosis respiratoria.
FIGURA 5-28.

Enfisema paraseptal, vista macroscópica
Una forma más localizada de enfisema es la conocida como enfisema paraseptal o enfisema acinar distal, que puede producirse tras la cicatrización focal del parénquima pulmonar periférico. El enfisema paraseptal no se relaciona con el tabaco. Puesto que este proceso es focal, no hay afectación importante de la función pulmonar, pero la localización periférica de las bullas, cuyo tamaño es de hasta 2 cm, puede hacer que se rompan al espacio pleural y causen un neumotórax espontáneo. Esto ocurre con más frecuencia en adultos jóvenes, con disnea brusca. Aquí se muestran dos bullas pequeñas, localizadas inmediatamente por debajo de la superficie pleural.
FIGURA 5-29.

Enfisema pulmonar, vista microscópica
Hay pérdida de los conductos alveolares y alvéolos en el enfisema, en tanto que los espacios aéreos restantes se dilatan. Hay menos superficie para el intercambio gaseoso. El enfisema produce pérdida del parénquima pulmonar, pérdida de la retracción elástica, distensibilidad pulmonar aumentada y mayor volumen pulmonar residual con incremento de la capacidad pulmonar total, principalmente por aumento de la capacidad residual. A medida que disminuye la excursión diafragmática, aumenta el uso de los músculos accesorios de la respiración. A la larga, disminuye la Pao2 y aumenta la Paco2.
FIGURA 5-30.

Bronquitis crónica, vista microscópica
Este bronquio tiene un número aumentado de células inflamatorias crónicas en la región submucosa. La bronquitis crónica no presenta hallazgos patológicos característicos, pero desde el punto de vista clínico se define como una tos productiva persistente durante al menos 3 meses consecutivos en al menos 2 años consecutivos. La mayoría de los pacientes son fumadores, pero la inhalación de contaminantes como el dióxido de azufre puede exacerbar la bronquitis crónica. A menudo también hay destrucción del parénquima y rasgos de enfisema, y los dos procesos se solapan clínicamente. Son corrientes las infecciones secundarias, que empeoran la función pulmonar. A menudo hay solapamiento entre el enfisema pulmonar y la bronquitis crónica, y los pacientes presentan elementos de ambos.
FIGURA 5-31.

Asma bronquial, vista macroscópica
Estos pulmones presentan un aspecto esencialmente normal, pero son los pulmones hiperinsuflados de un paciente que murió en estado asmático. Hay dos formas principales de asma, que pueden solaparse. En el asma atópica (extrínseca) hay una asociación característica a atopia (alergias) que es mediada por hipersensibilidad de tipo 1 y los ataques asmáticos se precipitan por contacto con alérgenos inhalados. Esta forma se da con más frecuencia en la infancia. En el asma no atópica (intrínseca), los ataques asmáticos se precipitan por infecciones respiratorias, exposición al frío, ejercicio, estrés, inhalación de irritantes y consumo de fármacos como la aspirina. Los adultos se ven afectados con más frecuencia.
FIGURA 5-32.

Asma bronquial, vista macroscópica
Este cilindro del árbol bronquial está formado por espesas secreciones de moco y fue expulsado con la tos por un paciente en un ataque asmático agudo. La producción de moco por las glándulas hipertrofiadas de la submucosa bronquial, junto con la broncoconstricción y la deshidratación, contribuyen a la formación de tapones mucosos que pueden bloquear las vías aéreas en los pacientes asmáticos. El resultado es un repentino ataque de asma con disnea grave, sibilancias e hipoxemia. El ataque grave conocido como estado asmático es potencialmente mortal.
FIGURA 5-33.

Asma bronquial, vista microscópica
Entre el cartílago bronquial (◆) de la derecha y la luz bronquial (■) llena de moco de la izquierda se encuentra una submucosa ensanchada por hipertrofia del músculo liso (*), edema e infiltración inflamatoria con abundantes eosinófilos. Éstos son los cambios del asma bronquial y, más específicamente, del asma atópica por hipersensibilidad de tipo I a los alérgenos. La sensibilización a los alérgenos inhalados induce la respuesta inmune del subtipo 2 de las células T cooperadoras (Th2), con liberación de IL-4 e IL-5 que estimulan la producción de inmunoglobulina E (IgE) por las células B y la infiltración y activación de los eosinófilos. El recuento de eosinófilos en la sangre periférica o el esputo puede aumentar durante el ataque asmático.
FIGURA 5-34.

Asma bronquial, vista microscópica
En este caso de asma bronquial, visto a gran aumento, puede apreciarse la presencia de numerosos eosinófilos, que destacan por sus gránulos citoplasmáticos rojo-brillante. Las dos formas clínicas principales de asma (atópica y no atópica) pueden solaparse en cuanto a sintomatología y hallazgos patológicos. En la fase precoz del ataque agudo de asma atópica tiene lugar la reacción entre los alérgenos y la IgE unida a las células cebadas. Estas últimas se desgranulan y liberan aminas biógenas y citocinas, provocando en pocos minutos una respuesta inmediata caracterizada por broncoconstricción, edema y producción de moco. Al cabo de horas se desarrolla una fase tardía, con infiltración leucocitaria, edema continuado y producción de moco.
FIGURA 5-35.

Asma bronquial, vista microscópica
El análisis del esputo de un paciente con un episodio asmático agudo puede poner de manifiesto numerosos eosinófilos, así como cristales de Charcot-Leiden (▴) derivados de la degradación de los gránulos de los eosinófilos. Los fármacos usados para el tratamiento urgente del asma incluyen los agonistas β-adrenérgicos de actuación inmediata, como la adrenalina y el isoproterenol. La teofilina, que es una metilxantina, induce broncodilatación mediante el aumento del adenosina-monofosfato cíclico (AMPc). Los anticolinérgicos, como el sulfato de atropina, también producen broncodilatación. El control a largo plazo del asma incluye el uso de glucocorticoides, inhibidores de los leucotrienos como el zileuton, antagonistas de los receptores como el montelukast, y agentes estabilizadores de las células cebadas como el cromoglicato sódico.
FIGURA 5-36.

Bronquiectasias, vista macroscópica
Esta área focal de bronquios dilatados es característica de una forma poco común de enfermedad pulmonar obstructiva conocida como bronquiectasia. La bronquiectasia suele ser un fenómeno localizado asociado a procesos tales como las neoplasias pulmonares y la aspiración de cuerpos extraños, que bloquean y obstruyen un segmento de la vía aérea, con distensión y destrucción inflamatoria del segmento distal de la vía aérea. Las bronquiectasias generalizadas son más típicas de los pacientes con fibrosis quística, que sufren infecciones recurrentes y obstrucción de las vías aéreas por tapones de moco en todos los campos pulmonares. Una causa rara de bronquiectasias es la discinesia ciliar primaria, presente en el síndrome de Kartagener, con pérdida de la actividad ciliar.
FIGURA 5-37.

Bronquiectasias, radiografía de tórax
Este broncograma pone de manifiesto bronquiectasias saculares que afectan al lóbulo inferior derecho. El medio de contraste rellena los bronquios dilatados y les proporciona un contorno sacular. Las bronquiectasias se producen cuando hay obstrucción o infección con inflamación y destrucción de los bronquios, dando lugar a una dilatación bronquial permanente. Una vez se ha instaurado esta dilatación bronquial, hay estasis en la vía aérea y el paciente tiene predisposición a infecciones recurrentes. La tos con producción copiosa de esputo purulento es una manifestación clínica frecuente. Hay riesgo de sepsis y diseminación de la infección a otras localizaciones. En casos de bronquiectasias graves diseminadas puede producirse cor pulmonale.
FIGURA 5-38.

Bronquiectasias, vista microscópica
En la zona central inferior de esta microfotografía se observa un bronquio dilatado cuya pared se halla desdibujada por inflamación necrosante con destrucción del tejido. La bronquiectasia no es una enfermedad específica, sino la consecuencia de otro proceso que destruye la vía aérea.
FIGURA 5-39.

Fibrosis pulmonar idiopática, radiografía
Hay acentuación de la trama intersticial en todos los campos pulmonares como consecuencia de una fibrosis pulmonar idiopática (neumonitis intersticial usual). Los pacientes afectados presentan pérdida continuada de los volúmenes pulmonares, de manera que en los estudios de función pulmonar se comprueba que la capacidad vital forzada (FVC) está reducida, pero que también lo está el volumen espiratorio en el primer segundo de la maniobra (FEV1), de modo que la proporción FVC/FEV1 permanece igual. De forma característica, estas reducciones son proporcionales en las enfermedades pulmonares restrictivas como la fibrosis pulmonar idiopática. Esta enfermedad probablemente está mediada por la respuesta inflamatoria a la lesión de la pared alveolar, pero el factor inicial se desconoce. Los pacientes pueden sobrevivir semanas o años, dependiendo de la gravedad del proceso, y a la larga se produce fibrosis terminal «en panal de abejas».
FIGURA 5-40.
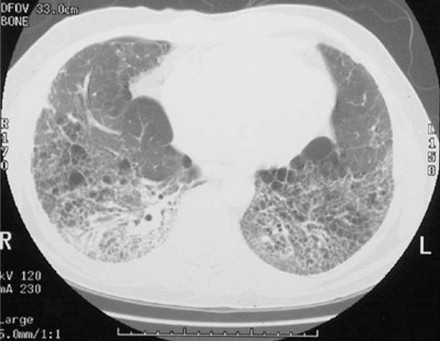
Fibrosis pulmonar idiopática, tomografía computarizada
En esta TC torácica en modo de ventana pulmonar se observa una trama intersticial muy prominente, particularmente en las bases pulmonares posteriores. También hay áreas radiotransparentes más pequeñas que representan cambios «en panal de abejas», rasgo característico de la neumonitis intersticial usual. Ésta es una enfermedad pulmonar restrictiva idiopática y progresiva que afecta a personas de mediana edad, en las que produce disnea progresiva, hipoxemia, cianosis, hipertensión pulmonar y cor pulmonale. El término neumonitis intersticial usual es descriptivo y no constituye un diagnóstico etiológico.
FIGURA 5-41.

Neumonía organizada criptogénica, vista microscópica
La neumonía organizada criptogénica, también llamada bronquiolitis obliterante con neumonía organizada (BOOP), afecta a las vías aéreas distales formando tapones (*) de exudado organizado en respuesta a la inflamación o la infección. El efecto es similar al de una enfermedad pulmonar intersticial aguda. La mayoría de los pacientes mejoran al administrar corticoides y tratar procesos subyacentes tales como infecciones o rechazos de trasplantes.
FIGURA 5-42.

Cambios «en panal de abejas» (honeycomb), vista macroscópica
Independientemente de la etiología de las enfermedades pulmonares restrictivas, muchas producen a la larga extensa fibrosis intersticial pulmonar. En este paciente con daño alveolar difuso en fase de organización, el aspecto macroscópico es el de un pulmón en «panal de abejas», con dilatación irregular de los espacios aéreos residuales y densas bandas de tejido fibroso intersticial. La distensibilidad pulmonar se halla muy reducida, de modo que los pacientes que reciben ventilación mecánica requieren presión positiva al final de la espiración (PEEP), lo que les predispone a la rotura de las vías aéreas y al desarrollo de enfisema intersticial.
FIGURA 5-43.

Fibrosis intersticial, vista microscópica
Esta tinción de tricrómico resalta en azul el tejido colágeno intersticial de la fibrosis pulmonar. La extensión de la fibrosis determina la gravedad de la enfermedad, que se caracteriza por el empeoramiento progresivo de la disnea. La alveolitis que produce la proliferación de fibroblastos y el depósito de colágeno progresa con el tiempo. Los espacios aéreos restantes pueden dilatarse y revestirse de epitelio bronquiolar metaplásico. Si estos pacientes son intubados y sometidos a ventilación mecánica, como se hace en los casos graves de enfermedad pulmonar obstructiva crónica, es improbable que puedan ser extubados. Así pues, es crucial establecer previamente las directrices para el cuidado de estos pacientes.
FIGURA 5-44.

Cuerpos ferruginosos, vista microscópica
A veces se conoce la etiología de la enfermedad pulmonar intersticial. El agente causal de la asbestosis es un objeto largo y delgado conocido como fibra de asbesto. Algunas casas, locales comerciales y barcos aún contienen productos de construcción con asbesto (en particular, los materiales aislantes), de manera que debe tenerse cuidado en prevenir la inhalación del asbesto cuando se hacen renovaciones o reconstrucciones. In vivo, las fibras de asbesto inhaladas se recubren de hierro y calcio, por lo que a menudo reciben el nombre de cuerpos ferruginosos, que aquí aparecen teñidos para el hierro con azul de Prusia. La ingestión de estas fibras por los macrófagos pone en marcha una respuesta fibrogénica mediante la liberación de factores de crecimiento que estimulan el depósito continuado de colágeno por los fibroblastos.
FIGURA 5-45.
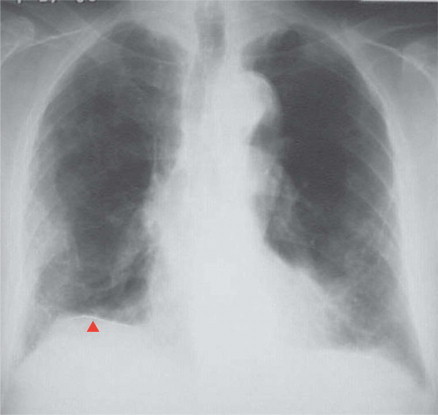
Neumoconiosis, radiografía
Esta radiografía posteroanterior de tórax pone de manifiesto fibrosis intersticial con infiltrados irregulares. Hay una placa pleural derecha (▴) con calcificación, así como una placa pleural izquierda. Este paciente había sufrido una exposición significativa al asbesto. El polvo inhalado es fagocitado por los macrófagos, que luego segregan citocinas activadoras de los fibroblastos, como el factor de crecimiento transformador β. Los fibroblastos activados producen fibrosis colágena, que se acentúa con el tiempo. La cantidad de polvo inhalado y la duración de la exposición determinan la gravedad de la enfermedad. Los pacientes pueden permanecer asintomáticos durante años, hasta que la fibrosis masiva y progresiva reduce la capacidad vital y se inicia la disnea. La neumoconiosis más común es la silicosis, que presenta un patrón intersticial al que, con el tiempo, se añaden nódulos silicóticos de mayor tamaño, que pueden hacerse confluentes.
FIGURA 5-46.

Placas pleurales fibrosas, vista macroscópica
Aquí se observan, en las caras pleurales de las hojas diafragmáticas, varias placas pleurales blanco-parduscas que son típicas de las neumoconiosis y, en particular, de la asbestosis. La inflamación crónica inducida por la inhalación de partículas de polvo produce fibrogénesis.
FIGURA 5-47.

Placa pleural fibrosa, vista microscópica
Esta placa pleural fibrosa se compone de densas capas de colágeno que tienen un aspecto rosado con la tinción de hematoxilina-eosina (H+E) y son blancas desde el punto de vista macroscópico. La fibrosis pulmonar progresiva produce enfermedad pulmonar restrictiva. La reducción del lecho vascular pulmonar produce hipertensión pulmonar y cor pulmonale, con insuficiencia cardíaca congestiva derecha que se manifiesta por edema postural periférico, congestión hepática y derrames de cavidades.
FIGURA 5-48.

Neumoconiosis de los trabajadores del carbón, vista microscópica
El depósito de pigmento antracótico en el pulmón es bastante corriente, pero habitualmente no es fibrogénico porque no se ha inhalado una gran cantidad de polvo carbonoso a partir de la polución aérea ambiental. Los fumadores tienen más pigmento antracótico debido a los alquitranes presentes en el humo del tabaco, pero aun así no presentan patología significativa como consecuencia del material carbonoso. Con la inhalación masiva de partículas (como en la «enfermedad de los pulmones negros» de los mineros del carbón) se puede poner en marcha una respuesta fibrogénica que produce la neumoconiosis de los mineros del carbón, con la mancha de carbón que aquí se observa. Se produce fibrosis masiva progresiva, pero no hay riesgo aumentado de cáncer de pulmón.
FIGURA 5-49.

Silicosis, vista microscópica
El nódulo pulmonar silicótico que aquí se muestra se compone principalmente de haces entrelazados de colágeno rosado y la reacción inflamatoria es mínima. Los macrófagos que fagocitan los cristales de sílice liberan citocinas, como el TNF, que inducen la fibrogénesis. El grado y la duración de la exposición a la sílice determinan la cantidad de nódulos silicóticos que se forman y el grado de enfermedad pulmonar restrictiva, que es progresiva e irreversible. La silicosis duplica el riesgo de carcinoma pulmonar.
FIGURA 5-50.

Neumoconiosis, radiografía
Esta radiografía de tórax pone de manifiesto múltiples nódulos silicóticos irregulares y brillantes, que se han hecho confluentes (fibrosis masiva progresiva) y han causado enfermedad pulmonar restrictiva grave. Este paciente desarrolló disnea grave. Todos los volúmenes pulmonares están disminuidos.
FIGURA 5-51.

Sarcoidosis, tomografía computarizada
La sarcoidosis es una enfermedad granulomatosa idiopática que puede afectar a muchos órganos, pero hay afectación de los ganglios linfáticos en el 100% de los casos, siendo los ganglios linfáticos hiliares los que con más frecuencia se ven afectados. Esta TC de tórax en modo de ventana ósea pone de manifiesto linfadenopatías hiliares prominentes (◆) en una mujer de mediana edad con sarcoidosis. Los pacientes con frecuencia presentan fiebre, tos no productiva, disnea, dolor torácico, sudoración vespertina y pérdida de peso.
FIGURA 5-52.

Sarcoidosis, radiografía
Una causa de fibrosis intersticial pulmonar es la sarcoidosis. Como se aprecia en este caso, además de la acentuación de la trama intersticial, la radiografía de tórax puede poner de manifiesto linfadenopatías hiliares prominentes (por inflamación granulomatosa no caseosa) (◀). La mayoría de los pacientes siguen un curso benigno, con mínima afectación pulmonar que a menudo se resuelve con terapia corticoidea. Algunos pacientes presentan un curso recurrente y remitente. Aproximadamente un quinto de los pacientes, de forma característica aquellos en que la afectación del parénquima pulmonar es mayor que la afectación de los ganglios linfáticos, evolucionan a enfermedad pulmonar restrictiva progresiva.
FIGURA 5-53.

Sarcoidosis, vista microscópica
Los granulomas intersticiales pueden producir enfermedad pulmonar restrictiva. Los granulomas tienden a tener una distribución bronquiovascular. Los pequeños granulomas sarcoideos suelen ser no caseosos, pero los granulomas de mayor tamaño pueden tener caseosis central. La inflamación se caracteriza por cúmulos de macrófagos epitelioides, células gigantes de Langhans, linfocitos (en particular, células CD4) y fibroblastos. Las células CD4 participan en la respuesta inmune TH1. En la sarcoidosis también pueden verse inclusiones tales como los cuerpos asteroides y los cuerpos de Schaumann, que no están presentes en esta imagen.
FIGURA 5-54.

Neumonitis de hipersensibilidad, vista microscópica
Este tipo de neumonitis intersticial se conoce como alveolitis alérgica extrínseca, ya que surge cuando la inhalación de polvos orgánicos produce una forma localizada de reacción de hipersensibilidad de tipo III (Arthus) por la formación de complejos antígeno-anticuerpo. Los síntomas de disnea, tos y fiebre cesan cuando el paciente abandona el medio donde está presente el antígeno responsable. Aquí se muestra un caso con inflamación más crónica, de tipo granulomatoso, correspondiente a hipersensibilidad de tipo IV. Con frecuencia es difícil establecer el diagnóstico y determinar el antígeno responsable. El estudio radiológico pone de manifiesto infiltrados reticulonodulares. Sin embargo, la progresión a fibrosis no es frecuente.
FIGURA 5-55.

Proteinosis alveolar pulmonar, vista microscópica
Ésta es una enfermedad rara conocida como proteinosis alveolar pulmonar. Las paredes alveolares son normales desde el punto de vista histológico, pero los alvéolos están inundados por un exudado granular PAS-positivo que contiene abundantes cuerpos lipídicos y lamelares (a la microscopia electrónica). Los pacientes pueden toser copiosas cantidades de esputo gelatinoso y son tratados con lavados pulmonares que intentan eliminar el líquido proteináceo. La enfermedad se produce por la deficiencia, en los macrófagos alveolares, del receptor del factor estimulador de colonias de granulocitos-macrófagos.
FIGURA 5-56.

Hemorragia pulmonar difusa, vista microscópica
Esta hemorragia intraalveolar aguda es consecuencia de una lesión capilar por anticuerpos anti-membrana basal en un paciente con el síndrome de Goodpasture. Los capilares glomerulares también están afectados, dando lugar a una glomerulonefritis rápidamente progresiva. El antígeno diana en el síndrome de Goodpasture es un componente del dominio no colagenoso de la cadena α3 del colágeno tipo IV. La cadena α3 se expresa de manera preferente en la membrana basal de los glomérulos y de los alvéolos pulmonares. Pueden detectarse anticuerpos circulantes anti-membrana basal glomerular y puede recurrirse al tratamiento con plasmaféresis.
FIGURA 5-57.

Embolismo pulmonar, vista macroscópica
Aquí se observa un «émbolo en silla de montar» que emerge del tronco de la arteria pulmonar al dividirse ésta en las arterias pulmonares derecha (■) e izquierda (*). Dicho émbolo en silla de montar puede causar muerte súbita por cor pulmonale agudo. Este tromboémbolo tiene una superficie algo irregular y presenta áreas parduscas pálidas mezcladas con áreas rojas oscuras. El émbolo con frecuencia mantiene el contorno de la vena en la cual se formó originalmente como un trombo. La mayoría de los grandes tromboémbolos pulmonares se originan en las grandes venas de las extremidades inferiores.
FIGURA 5-58.

Embolismo pulmonar, tomografía computarizada
En la mayoría de los casos de sospecha de embolismo pulmonar, el estudio más definitivo y fácilmente disponible para pacientes hospitalizados es una TC de tórax. Aquí se muestra un émbolo pulmonar en silla de montar (◆) con propagación a la arteria pulmonar derecha. Un hallazgo de laboratorio frecuente es el aumento del dímero D plasmático, aunque esta prueba es más útil como predictor negativo de embolismo pulmonar cuando no se detecta un aumento. Los riesgos de tromboembolismo pulmonar incluyen inmovilización prolongada, edad avanzada y estados de hipercoagulabilidad.
FIGURA 5-59.
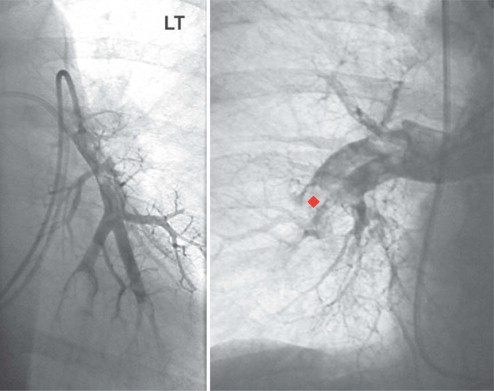
Embolismo pulmonar, angiograma
En estas imágenes de un angiograma TC de tórax se aprecian múltiples tromboémbolos pulmonares (◆). El contraste debería alcanzar la periferia de las arterias pulmonares. Los factores de riesgo de este paciente incluían edad avanzada, tabaquismo e inmovilización prolongada debida a hospitalización por obstrucción intestinal. Aunque la angiografía es el patrón oro para la demostración de tromboémbolos pulmonares, la TC estándar tiene una alta sensibilidad diagnóstica. Las manifestaciones clínicas incluyen disnea, taquipnea, tos, fiebre y dolor torácico.
FIGURA 5-60.

Embolismo pulmonar, gammagrafía V/Q
Aquí se muestra una gammagrafía V/Q. En la ilustración superior se evalúa la ventilación a medida que el paciente inhala un compuesto radiomarcado que se distribuye por todos los campos pulmonares. En este caso, la distribución parece ser relativamente uniforme, excepto por una porción del lóbulo inferior derecho en el cual hay falta de ventilación (▴). La perfusión se valora tras la inyección de un compuesto radiomarcado que se distribuye por los vasos pulmonares. En las dos ilustraciones inferiores se observan múltiples áreas con disminución de la perfusión (◆), siendo estas áreas diferentes de las que presentan una disminución de la ventilación. Así pues, se ha producido una alteración del cociente V/Q que indica una probabilidad alta de embolismo pulmonar. Puesto que el pulmón está ventilado, pero no perfundido, al administrar oxígeno al paciente tan sólo se obtiene un aumento mínimo de la Pao2.
FIGURA 5-61.

Embolismo pulmonar, vista microscópica
En esta arteria pulmonar hay áreas de color rosa pálido que se entrelazan con otras de color rojo, dando lugar a las líneas de Zahn características de los trombos. Estas líneas representan capas de hematíes, plaquetas y fibrina, que se depositan a medida que el trombo se forma en las venas. En este caso, el trombo se ha convertido en un tromboémbolo que ha viajado por la vena cava y el corazón derecho hasta detenerse en una rama de la arteria pulmonar. A la larga, si el paciente sobrevive, el tromboémbolo puede sufrir organización y disolución.
FIGURA 5-62.

Infarto pulmonar, vista macroscópica
Los tromboémbolos de mediano tamaño (capaces de bloquear una arteria pulmonar que irriga un lóbulo o conjunto de lóbulos) pueden producir infarto pulmonar hemorrágico, ya que el paciente sobrevive. El infarto presenta forma de cuña y tiene la base en la pleura. Estos infartos son hemorrágicos porque, aunque esté interrumpida la arteria pulmonar que transporta la mayor parte de la sangre y el oxígeno, no lo están las arterias bronquiales procedentes de la circulación sistémica (que suministran aproximadamente el 1% de la sangre a los pulmones). También es posible que se produzcan múltiples tromboémbolos pulmonares que no causen muerte súbita ni ocluyan una rama arterial pulmonar suficientemente grande como para causar infarto. Las manifestaciones clínicas incluyen dolor torácico y hemoptisis.
FIGURA 5-63.

Embolismo pulmonar, vista microscópica
Aquí se muestra un tromboémbolo en una pequeña arteria pulmonar periférica en la región de un infarto hemorrágico, caracterizado por la presencia de numerosos hematíes en los espacios alveolares. Hay recanalización parcial (◆) de esta arteria bloqueada. Los émbolos pequeños como éste no suelen provocar disnea ni dolor, a menos que sean múltiples y se produzcan a lo largo de un cierto tiempo, con lo que pueden causar el bloqueo colectivo de un gran número de pequeñas arterias y producir hipertensión pulmonar secundaria con cor pulmonale.
FIGURA 5-64.

Hipertensión pulmonar, radiografía
En esta radiografía de tórax posteroanterior se aprecian arterias pulmonares prominentes y dilatadas, que se ramifican desde las regiones hiliares. Los campos pulmonares están claros. Este paciente presentaba un proceso infrecuente conocido como hipertensión pulmonar, sin que haya una enfermedad pulmonar restrictiva u obstructiva que explique la hipertensión pulmonar. La consecuencia es una reducción del lecho vascular pulmonar con aumento de la presión arterial pulmonar. La presión capilar pulmonar tiende a permanecer normal hasta que la enfermedad está avanzada, cuando la insuficiencia cardíaca derecha da paso a insuficiencia cardíaca izquierda con dificultad del llenado ventricular izquierdo. Esta forma familiar de hipertensión pulmonar está producida por mutaciones del gen del receptor de la proteína morfogénica del hueso de tipo 2 (BMPR2). Las señales de BMPR2 inhiben la proliferación del músculo liso. También pueden contribuir otros factores genéticos y ambientales.
FIGURA 5-65.

Hipertensión pulmonar, vista microscópica
Tanto las enfermedades pulmonares restrictivas como las obstructivas pueden afectar a la circulación arterial pulmonar. La pérdida de parénquima pulmonar normal produce hipertensión pulmonar, dando lugar a engrosamiento y reduplicación de las pequeñas arterias, con formación de lesiones plexiformes como la que aquí se muestra en una arteria pulmonar periférica (en la ilustración izquierda con tinción de hematoxilina-eosina [H+E] y en la ilustración derecha con tinción de elásticas).
FIGURAS 5-66 y 5-67.
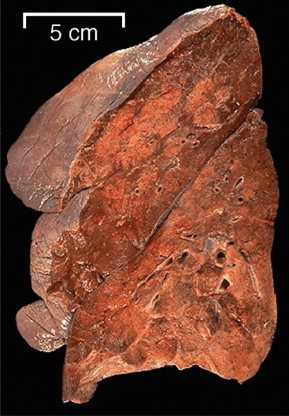

Neumonía bacteriana, vista macroscópica y radiografía
A la izquierda se ven áreas más pálidas que parecen estar sobreelevadas con respecto al parénquima pulmonar adyacente. La bronconeumonía (neumonía lobulillar) se caracteriza por áreas parcheadas de consolidación pulmonar. A la derecha, la radiografía posteroanterior de tórax pone de manifiesto extensos infiltrados bilaterales parcheados que se componen principalmente de exudados alveolares. Los infiltrados que aquí se muestran se han hecho aún más densos por la hemorragia provocada por el daño vascular asociado a la infección por Pseudomonas aeruginosa.
FIGURAS 5-68 y 5-69.

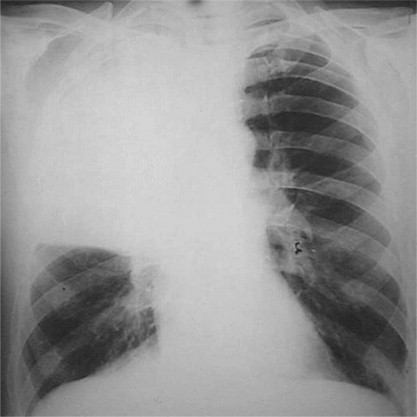
Neumonía bacteriana, vista macroscópica y radiografía
Se trata de una neumonía lobular con consolidación de todo el lóbulo superior izquierdo (ilustración izquierda). Este patrón es mucho menos frecuente que el patrón de bronconeumonía. La mayoría son secundarias a infección por Streptococcus pneumoniae (neumococo). En la radiografía posteroanterior de tórax (ilustración derecha) se observa la consolidación completa del lóbulo superior derecho, lo que es compatible con una neumonía lobular. El proceso oscurece los contornos del mediastino y del corazón derecho.
FIGURA 5-70.

Neumonía bacteriana, vista microscópica
A la izquierda, los alvéolos están repletos de un exudado neutrófilo que corresponde a áreas de consolidación en el examen macroscópico. Obsérvese la diferencia con las áreas de pulmón ventilado presentes a la derecha. Este patrón microscópico también se corresponde con la distribución radiográfica parcheada de la bronconeumonía. Las áreas consolidadas pueden presentar una distribución lobulillar (de ahí el término neumonía lobulillar). De forma clásica, la bronconeumonía es una neumonía que se adquiere en el hospital y la sufren pacientes que ya presentan otras enfermedades. Las bacterias que habitualmente la causan incluyen Staphylococcus aureus, Klebsiella pneumoniae, Haemophilus influenzae, Escherichia coli y Pseudomonas aeruginosa.
FIGURA 5-71.

Neumonía bacteriana, vista microscópica
Estos exudados alveolares se componen principalmente de neutrófilos. Las paredes alveolares que los rodean tienen capilares congestivos (dilatados y repletos de hematíes). Estos procesos exudativos son característicos de las infecciones bacterianas y dan lugar a la tos productiva con esputo amarillo purulento de las neumonías bacterianas. La estructura alveolar está conservada, razón por la cual incluso las neumonías extensas a menudo se resuelven con muy poca destrucción o mínima lesión residual del parénquima pulmonar. Sin embargo, en los pacientes con compromiso de la función pulmonar por neumopatía obstructiva o restrictiva subyacente, o con cardiopatía, incluso una neumonía limitada puede ser letal.
FIGURA 5-72.
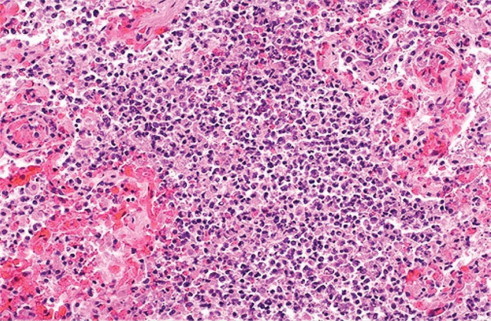
Neumonía bacteriana, vista microscópica
Los organismos bacterianos muy virulentos o las neumonías con inflamación muy pronunciada pueden asociarse a destrucción del parénquima pulmonar y hemorragia. Aquí puede apreciarse cómo las paredes alveolares ya no son visibles debido al inicio de la formación de un absceso, con sábanas de neutrófilos y también hemorragia. Muchas bronconeumonías surgen a continuación de una neumonía vírica, sobre todo en los ancianos durante los meses fríos, en los que son más frecuentes las infecciones por agentes víricos como el de la influenza.
FIGURA 5-73.

Abscesos pulmonares, vista microscópica
Ésta es una bronconeumonía abscesificante en la que se ven varios abscesos (◆) con paredes irregulares y rugosas en las áreas parduscas de consolidación. Los abscesos pulmonares, si son lo suficientemente grandes, contienen material necrótico licuado y exudado purulento que a menudo se manifiestan como niveles hidroaéreos en la radiografía o TC de tórax. Habitualmente, el absceso es una complicación de la neumonía grave, con más frecuencia por organismos virulentos como Staphylococcus aureus. Los abscesos a menudo son una complicación de la aspiración, particularmente en los pacientes en coma y en los que sufren enfermedades neurológicas, en los cuales aparecen con más frecuencia en el pulmón posterior derecho. Los abscesos pueden continuar siendo una fuente de septicemia y son difíciles de tratar.
FIGURA 5-74.

Absceso pulmonar, tomografía computarizada
En esta TC de tórax en modo de ventana pulmonar se aprecia un nivel hidroaéreo (▴) en un absceso que afecta al lóbulo inferior derecho. Obsérvense las áreas adyacentes con infiltrados neumónicos parcheados y brillantes, que son bilaterales y extensos. Obsérvese también la muesca en la línea media de la cara anterior del tórax, variación que se conoce como pectus excavatum. Los abscesos pueden desarrollarse tras aspiración, infección bacteriana u obstrucción bronquial, o por embolización séptica de origen venoso o cardíaco (endocarditis infecciosa con afectación del corazón derecho). Los pacientes afectados pueden presentar fiebre con tos productiva de copioso esputo purulento. La diseminación de la infección, con sepsis y émbolos sépticos a otros órganos, puede complicar los abscesos pulmonares.
FIGURA 5-75.

Empiema, vista macroscópica
Esta superficie pleural pone de manifiesto un denso exudado purulento de color amarillo-pardusco, y la cavidad pleural se halla ocupada por un exudado purulento. Se trata de una colección de pus en el espacio pleural (empiema). La neumonía puede diseminarse por el pulmón y puede complicarse con pleuritis. En las primeras fases puede haber tan sólo un derrame de tipo trasudado en el espacio pleural. También puede haber exudación de proteínas plasmáticas, dando lugar a pleuritis fibrinosa. Sin embargo, las infecciones bacterianas del pulmón pueden diseminarse a la pleura y producir pleuritis purulenta. La toracocentesis proporcionará un líquido con características de exudado, con un alto contenido de proteínas y un número elevado de leucocitos, principalmente neutrófilos.
FIGURA 5-76.

Neumonía vírica, vista microscópica
La neumonía vírica se caracteriza por infiltrados linfocitarios intersticiales. Obsérvese la ausencia de exudado alveolar. Así pues, un paciente con este tipo de neumonía probablemente tenga tos no productiva. Las causas más frecuentes de neumonía vírica son los virus de la influenza de tipo A y B, virus de la parainfluenza, adenovirus y virus sincitial respiratorio (VSR), que afecta principalmente a los niños. La infección por citomegalovirus es más común en los sujetos inmunodeprimidos. Pueden realizarse cultivos víricos del esputo o lavado bronquioalveolar. De forma alternativa, el estudio serológico puede identificar al agente causal. Algunos tipos de coronavirus pueden causar un síndrome respiratorio agudo grave.
FIGURA 5-77.

Neumonía por virus sincitial respiratorio, vista microscópica
Se trata de una neumonía por VSR en un niño. Obsérvense las células gigantes, que son consecuencia del efecto citopático del virus. En el recuadro puede apreciarse una típica célula multinucleada gigante, con una inclusión intracitoplasmática de color rosado, redonda y prominente. El VSR es responsable de muchos casos de neumonía en niños menores de 2 años y puede ser causa de muerte en lactantes de 1 a 6 meses de edad o mayores.
FIGURA 5-78.

Neumonía por citomegalovirus, vista microscópica
Obsérvense las células de gran tamaño con grandes inclusiones intranucleares de color violeta, rodeadas de un pequeño halo claro. En el citoplasma de estos elementos citomegálicos puede apreciarse un punteado basófilo. Habitualmente, esta infección afecta a pacientes inmunodeprimidos, como los infectados por VIH. Pueden infectarse tanto las células endoteliales como las epiteliales. No hay rasgos macroscópicos o microscópicos que sean característicos de la neumonía por citomegalovirus.
FIGURA 5-79.

Tuberculosis secundaria, vista macroscópica
Aquí se observan granulomas parduscos que se encuentran diseminados principalmente por los campos pulmonares superiores. Al examen macroscópico, las enfermedades pulmonares granulomatosas ofrecen un aspecto de nódulos redondeados de tamaño irregular. Los nódulos de mayor tamaño pueden tener necrosis caseosa central, que incluye elementos de necrosis de licuación y de coagulación. Este patrón de afectación de lóbulos superiores es muy característico de la tuberculosis secundaria (reactivación o reinfección), que clásicamente se ve en los adultos. Sin embargo, los granulomas por hongos (histoplasmosis, criptococosis, coccidioidomicosis) también pueden imitar este patrón. Esta tendencia de los granulomas a afectar a los lóbulos superiores es característica y ayuda a distinguir esta infección de las metástasis en el estudio radiológico.
FIGURA 5-80.

Tuberculosis primaria, vista macroscópica
Hay un pequeño granuloma subpleural amarillo-pardusco en el parénquima pulmonar. Además, en el hilio hay un granuloma de similares características que afecta a un ganglio linfático hiliar situado en la proximidad de un bronquio de gran calibre. Se trata de un complejo de Ghon, que es el aspecto macroscópico característico de la tuberculosis primaria. En la mayoría de los individuos, esta enfermedad granulomatosa es subclínica y no progresa. A la larga, los granulomas disminuyen de tamaño y pueden calcificarse, dejando en la radiografía de tórax una mancha calcificada focal que sugiere enfermedad granulomatosa antigua. La tuberculosis primaria es el patrón observado en la infección inicial, con más frecuencia en los niños.
FIGURA 5-81.

Tuberculosis miliar, vista macroscópica
Cuando la respuesta inmune es pobre o queda desbordada por una infección extensa, puede verse el patrón macroscópico de enfermedad granulomatosa conocido como patrón miliar porque hay multitud de pequeños granulomas parduscos, que miden de 2 a 4 mm, diseminados por todo el parénquima pulmonar. El patrón miliar recibe su nombre del parecido que tienen los granulomas a los granos de mijo. La diseminación del agente infeccioso causante (Mycobacterium tuberculosis, u hongos) puede producir un patrón miliar similar en otros órganos.
FIGURAS 5-82 y 5-83.


Tuberculosis miliar, radiografías
En la radiografía posteroanterior de tórax de la izquierda se observa afectación granulomatosa de los lóbulos superiores, caracterizada por densidades irregulares, con patrón reticular y nodular, y cavitación (*) secundaria a necrosis caseosa central, que es clásica de la tuberculosis. En la radiografía posteroanterior de tórax de la derecha se aprecia afectación granulomatosa extensa de ambos pulmones. Obsérvense las brillantes calcificaciones focales, que son características de la tuberculosis cicatrizada. Hay otras calcificaciones pequeñas (▴), diseminadas principalmente por los campos pulmonares medios y superiores, que son más prominentes en la imagen de la derecha. Este patrón de tuberculosis secundaria puede producirse por reactivación o reinfección.
FIGURAS 5-84 y 5-85.


Tuberculosis primaria y miliar, radiografías
La radiografía posteroanterior de tórax de la izquierda es característica de la tuberculosis primaria, con un granuloma subpleural (▴) y linfadenopatía hiliar pronunciada (▾). La combinación de estos dos hallazgos constituye el complejo de Ghon. La mayoría de los casos de tuberculosis primaria son asintomáticos. En la radiografía posteroanterior de tórax de la derecha se aprecia un patrón miliar que afecta a todos los campos pulmonares. Obsérvese el aspecto punteado, que recuerda al estilo artístico puntillista.
FIGURA 5-86.

Tuberculosis, vista microscópica
Los granulomas bien definidos tienen contornos redondeados con bordes bien delimitados. Los granulomas se componen de macrófagos transformados denominados células epitelioides, junto con linfocitos, ocasionales leucocitos polimorfonucleares, células plasmáticas y fibroblastos. Los macrófagos, estimulados por citocinas como el interferón-( segregado por los linfocitos T, pueden agruparse y dar lugar a células gigantes de tipo Langhans. El aspecto pequeño y localizado de estos granulomas sugiere que la respuesta inmune es bastante adecuada y que la infección está siendo contenida, lo que podría producir un patrón radiográfico reticulonodular en los pulmones.
FIGURA 5-87.

Tuberculosis, vista microscópica
La respuesta inflamatoria granulomatosa a la tuberculosis incluye principalmente células epitelioides, linfocitos y fibroblastos. Los macrófagos epitelioides del granuloma son alargados y tienen núcleos pálidos y citoplasmas rosados. Los macrófagos se organizan en «comités» llamados células gigantes. La célula gigante clásica de las infecciones granulomatosas se denomina célula gigante de tipo Langhans y tiene sus núcleos alineados en la periferia. El proceso de infección granulomatosa tiene lugar a lo largo de meses o años (¿alguna vez algún comité hizo algo en menos tiempo?).
FIGURA 5-88.

Bacilos ácido-resistentes, vista microscópica
Para identificar las micobacterias en una preparación histológica, se realiza una tinción para bacilos ácido-resistentes. Con esta tinción las micobacterias se observan como bastones, que aquí se ven a gran aumento. La gran cantidad de lípidos en forma de ácido micólico que tienen las micobacterias les confiere esta propiedad ácido-resistente y es responsable de su resistencia a la destrucción por células inmunes. Tal destrucción depende de la respuesta inmune Th1, con elaboración por parte de las células CD4 de interferón-γ, que recluta monocitos, los transforma en macrófagos epitelioides y luego estimula la producción de sintasa de óxido nítrico en los fagosomas de las células epitelioides y las células gigantes.
FIGURA 5-89.

Histoplasmosis, vista microscópica
La inhalación de aerosoles originados en la tierra con excrementos de pájaros o de murciélagos, contaminados con esporas de Histoplasma capsulatum, puede producir enfermedad granulomatosa pulmonar. La infección pulmonar puede propagarse a otros órganos, particularmente en los pacientes inmunodeprimidos. Tal como se muestra aquí, los macrófagos se cargan de numerosos organismos de pequeño tamaño (de 2 a 4 μm). Los macrófagos elaboran interferón-(, que activa y recluta más macrófagos para destruir estas levaduras. Los organismos muestran una zona clara alrededor de un núcleo central azul, que confiere a la membrana celular el aspecto de una cápsula; de ahí el nombre del organismo.
FIGURA 5-90.

Blastomicosis, vista microscópica
La inhalación de tierra contaminada con micelios de Blastomyces dermatitidis puede producir inflamación granulomatosa pulmonar. La infección pulmonar puede diseminarse a otros órganos. Con la inoculación cutánea directa puede originarse una forma cutánea, que es infrecuente. Los organismos, que miden entre 5 y 15 μm, existen en fase de levadura a temperatura corporal. Obsérvese las gemaciones de base amplia, resaltadas con una tinción de plata en la ilustración derecha. Este organismo tiene una distribución bastante amplia en áreas de temperatura semitropical de América del Norte, África y la India.
FIGURA 5-91.

Coccidioidomicosis, vista microscópica
El granuloma bien formado visible en la ilustración izquierda tiene en el centro una célula gigante de tipo Langhans que contiene dos esférulas de Coccidioides immitis. En la ilustración derecha pueden verse, a mayor aumento, las gruesas paredes de dos esférulas de C. immitis en el hígado. Nótese cómo una esférula se está rompiendo y expulsa las endosporas, que crecerán y propagarán la infección. En Estados Unidos, C. immitis es endémico en la zona desértica del sudoeste, pero también puede habitar las llanuras secas de la América del Norte y del Sur. En la naturaleza, C. immitis existe en forma de hifa alternando con artrosporas.
FIGURA 5-92.

Criptococosis, vista microscópica
En la ilustración izquierda hay numerosos organismos de Cryptococcus neoformans con una gruesa cápsula de polisacáridos que se manifiesta como una zona clara alrededor de un núcleo redondo. En la ilustración derecha, la tinción con tinta china resalta la cápsula clara alrededor del núcleo. Esta cápsula inhibe el reclutamiento de las células inflamatorias y la fagocitosis macrofágica. La neumonía por criptococos puede producirse tras la inhalación de aerosoles de tierra contaminada con excrementos de pájaros. Estas levaduras de 5 a 10 μm pueden diseminarse a otros órganos (en particular, al sistema nervioso central), produciendo con frecuencia meningitis en individuos inmunodeprimidos. La reacción inflamatoria puede ser desde supurativa hasta granulomatosa.
FIGURA 5-93.
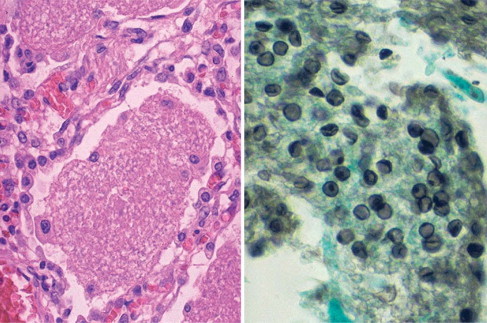
Pneumocystis, vista microscópica
En la ilustración izquierda puede apreciarse el exudado alveolar granular de color rosado de la neumonía por Pneumocystis carinii (jirovecii). El exudado consiste en líquido de edema, proteínas, organismos de Pneumocystis y células inflamatorias muertas. En la ilustración derecha, una tinción de plata de Gomori del líquido de lavado bronquioalveolar pone de manifiesto las paredes oscuras de los quistes de 4 a 8 μm, en el interior de los cuales los organismos presentan un aspecto de «bola de ping-pong» aplastada. Esta infección afecta a individuos inmunodeprimidos y habitualmente es diseminada. Los pacientes se suelen presentar con fiebre, tos no productiva y disnea. En los estudios radiológicos se observan infiltrados difusos bilaterales, que son más pronunciados en las regiones perihiliares.
FIGURA 5-94.

Aspergilosis, vista microscópica
En la ilustración izquierda, un corte sagital del pulmón izquierdo pone de manifiesto una lesión necrosante «en diana» con un borde hemorrágico, que se extiende por la cisura mayor e invade los vasos. En la ilustración derecha se observan hifas de Aspergillus, septadas y ramificadas, de 5 a 10 μm de grosor. La inhalación de conidios atmosféricos de Aspergillus puede producir infección pulmonar, sobre todo en individuos inmunodeprimidos, y especialmente en los que tienen neutropenia o reciben terapia corticosteroidea. Puede producirse diseminación hematógena a otros órganos. Aspergillus puede colonizar lesiones cavitadas preexistentes causadas por tuberculosis, bronquiectasias, abscesos o infartos. La reacción alérgica a este hongo, cuya respuesta inmune está mediada por células Th2, puede producir aspergilosis alérgica broncopulmonar, con manifestaciones agudas similares a las del asma y cambios crónicos de enfermedad pulmonar obstructiva crónica.
FIGURA 5-95.

Carcinoma de células escamosas, vista macroscópica
Este carcinoma, localizado en la zona central del pulmón (como la mayoría de los carcinomas de células escamosas), obstruye el bronquio principal derecho. Es muy firme al tacto y la superficie de corte es de color blanco-pardusco. Es uno de los tumores malignos primarios más frecuentes del pulmón, más frecuente en fumadores; en esta imagen también se ve enfisema. Las áreas negras representan pigmento antracótico atrapado en el tumor y los ganglios linfáticos del hilio.
FIGURAS 5-96 y 5-97.


Carcinoma de células escamosas, radiografía y TC
Obsérvese esta gran masa hiliar (◆). La TC de tórax muestra un gran carcinoma de células escamosas que afecta al lóbulo superior derecho y se extiende alrededor del bronquio principal derecho (■), invadiendo el mediastino y afectando a los ganglios linfáticos del hilio (▴).
FIGURA 5-98.

Carcinoma de células escamosas, vista microscópica
Estas células, con citoplasma rosado cargado de queratina, bordes celulares indistintos y puentes intercelulares (▴), son características del carcinoma de células escamosas, que aquí se muestra a gran aumento. Puede observarse una figura de mitosis (◆). Estos rasgos se ven en los tumores bien diferenciados (los que más se parecen a la célula de origen). La mayoría de los carcinomas broncogénicos, sin embargo, son pobremente diferenciados. A menudo hay mutaciones de los genes RB, p53 y p16. El síndrome paraneoplásico que con más frecuencia acompaña al carcinoma de células escamosas del pulmón es la hipercalcemia por producción del péptido relacionado con la paratormona.
FIGURA 5-99.

Carcinoma de células pequeñas, vista macroscópica
En este pulmón se observa un carcinoma anaplásico de células pequeñas (oat cell carcinoma) con localización central y diseminación extensa. La superficie de corte de este tumor ofrece un aspecto blando, lobulado y blanco-pardusco. Este tumor ha causado obstrucción del bronquio principal izquierdo y colapso del pulmón distal (atelectasia). Los carcinomas de células pequeñas son muy agresivos y a menudo metastatizan ampliamente antes de que el tumor primario alcance un gran tamaño. Estas neoplasias responden mejor a la quimioterapia que a la radioterapia o la cirugía, pero continúan teniendo un mal pronóstico. Los carcinomas de células pequeñas surgen casi exclusivamente en los fumadores.
FIGURAS 5-100 y 5-101.


Carcinoma broncogénico, radiografía y TC
Aquí se muestra un carcinoma (◆) que ocupa el hilio del lóbulo pulmonar izquierdo y ha causado atelectasia postobstructiva (con desviación del mediastino hacia la izquierda) y neumonía lipoidea, caracterizada por un aspecto borroso (+) e infiltrados distales a la masa. Las neoplasias pulmonares primarias de localización central, como el carcinoma de células pequeñas, pueden producir estas complicaciones. En la TC torácica de la derecha se aprecia la misma masa hiliar y la neumonía lipoidea distal, con desviación del mediastino hacia la izquierda.
FIGURA 5-102.

Carcinoma de células pequeñas, vista microscópica
El patrón microscópico del carcinoma de células pequeñas (oat cell carcinoma) se caracteriza por pequeñas células azules oscuras con mínimo citoplasma (cociente núcleo-citoplasmático elevado) que se agrupan en sábanas. Las células con frecuencia presentan un «artefacto de aplastamiento» ocasionado por la manipulación de la muestra. A menudo hay mutaciones de los genes supresores tumorales p53 y RB y del gen antiapoptótico BCL2. Los carcinomas de células pequeñas, que constituyen una forma muy maligna de tumor neuroendocrino, con frecuencia se asocian a síndromes paraneoplásicos de base hormonal. Dos de ellos son el síndrome de Cushing por producción ectópica de hormona adrenocorticotropa y la hiponatremia por secreción inapropiada de hormona antidiurética.
FIGURA 5-103.

Adenocarcinoma, vista macroscópica
Obsérvese la localización periférica de esta masa en el pulmón izquierdo. Los adenocarcinomas y los carcinomas anaplásicos de células grandes suelen localizarse en la periferia del pulmón. El adenocarcinoma es el tipo de tumor pulmonar primario más frecuente en los no fumadores y los ex fumadores. Si esta neoplasia estuviese confinada al pulmón (estadio precoz), la resección tendría mayores posibilidades de ser curativa. El aspecto solitario de esta neoplasia sugiere que el tumor es primario y no metastásico.
FIGURAS 5-104 y 5-105.


Adenocarcinoma, radiografía y TC
En esta radiografía de tórax de un no fumador se observa un adenocarcinoma periférico (▴). Los cánceres de pulmón son raros en los no fumadores pero, si ocurren, suelen ser adenocarcinomas. La TC torácica en modo de ventana pulmonar pone de manifiesto un adenocarcinoma en la periferia del pulmón derecho que fue extirpado fácilmente mediante una resección en cuña.
FIGURA 5-106.

Adenocarcinoma, vista microscópica
Las estructuras glandulares formadas por esta neoplasia son compatibles con un adenocarcinoma moderadamente diferenciado. En el citoplasma de las células tumorales pueden hallarse gotas de mucina. A menudo hay nucléolos prominentes. Sin embargo, muchos carcinomas broncogénicos (incluyendo los adenocarcinomas) son pobremente diferenciados, lo que dificulta el diagnóstico del tipo celular.
Desde el punto de vista terapéutico, la designación de carcinoma de células no pequeñas puede ser suficiente, dependiendo del estadio tumoral. Con frecuencia hay mutaciones de los genes RB, p53 y p16. Las mutaciones del gen K-RAS son más frecuentes en los fumadores.
FIGURA 5-107.

Carcinoma de células grandes, vista macroscópica
Esta masa pulmonar periférica en un paciente fumador (obsérvese el enfisema centroacinar) resultó ser un carcinoma anaplásico de células grandes. Este tipo de carcinoma broncogénico es pobremente diferenciado, sin que presente rasgos microscópicos de adenocarcinoma ni de carcinoma de células escamosas. Desde el punto de vista terapéutico, sigue siendo un carcinoma de células no pequeñas (como el adenocarcinoma y el carcinoma de células escamosas), para el que el estadio es el principal factor determinante de la terapia y el pronóstico.
FIGURA 5-108.

Carcinoma de células grandes, radiografía
En esta radiografía de tórax se observa una masa (▴) en el lóbulo inferior izquierdo, que al examen microscópico resultó ser un carcinoma de células no pequeñas, y más concretamente, un carcinoma anaplásico de células grandes. Los carcinomas de células grandes se ven con más frecuencia en los fumadores.
FIGURA 5-109.

Carcinoma pobremente diferenciado, vista microscópica
El carcinoma de células grandes se distingue por la falta distintiva de diferenciación glandular o escamosa. Muchos de ellos probablemente son adenocarcinomas, o carcinomas de células escamosas que están tan pobremente diferenciados que es difícil determinar la célula de origen. Aquí se muestran, con la tinción de PAS, gotitas de mucina intracelular que sugieren adenocarcinoma. Los carcinomas pulmonares de células no pequeñas se asocian a síndromes paraneoplásicos con menor frecuencia que los carcinomas de células pequeñas. Otras manifestaciones extrapulmonares de carcinoma broncogénico incluyen el síndrome miasténico de Lambert-Eaton, acantosis nigricans, neuropatía periférica y osteoartropatía hipertrófica pulmonar.
FIGURA 5-110.

Carcinoma bronquioloalveolar, vista macroscópica
Se trata de una variante menos frecuente de carcinoma pulmonar, cuyo aspecto macroscópico (y radiológico) es el de un área menos bien definida que recuerda a una consolidación neumónica. Esta masa pobremente definida que afecta al lóbulo pulmonar situado a la derecha tiene un aspecto entre pardusco claro y grisáceo.
FIGURAS 5-111 y 5-112.


Carcinoma bronquioloalveolar, radiografía y tomografía computarizada
La radiografía posteroanterior de tórax de la izquierda y la TC torácica de la derecha ponen de manifiesto un carcinoma bronquioloalveolar extenso que afecta a la mayor parte del pulmón derecho. La diseminación pulmonar extensa del tumor da lugar a un aspecto que recuerda al de las áreas de consolidación (*) presentes en las neumonías. Como puede verse a la izquierda, por encima de la neoplasia hay un derrame pleural loculado (▴).
FIGURA 5-113.

Carcinoma bronquioloalveolar, vista microscópica
El carcinoma bronquioloalveolar se compone de células cilíndricas que proliferan apoyándose en los septos alveolares. Estas células neoplásicas están bien diferenciadas. El carcinoma bronquioloalveolar, que es una forma de adenocarcinoma, en general tiene un pronóstico mejor que la mayoría de los otros cánceres primarios del pulmón, pero puede que no se detecte en un estadio inicial. Las variantes no mucinosas son habitualmente nódulos solitarios susceptibles de resección. Las variantes mucinosas tienden a diseminarse y formar tumores satélites o consolidaciones semejantes a las neumónicas.
FIGURA 5-114.

Carcinoide bronquial, vista macroscópica
Esta resección pulmonar fue necesaria debido a la presencia de un tumor carcinoide bronquial (▴) que provocó hemoptisis y obstrucción con atelectasia distal. Estas masas endobronquiales, de aspecto polipoideo y bien delimitadas, suelen afectar a los adultos jóvenes o de mediana edad. Su aparición no se relaciona con el tabaquismo. No son frecuentes. Constituyen una forma de tumor neuroendocrino que se origina en las células neuroendocrinas de la mucosa de las vías aéreas.
FIGURA 5-115.

Carcinoide bronquial, tomografía computarizada
Esta TC torácica en modo de ventana ósea pone de manifiesto un tumor carcinoide bronquial (▴) que causa obstrucción y atelectasia (◆) del lóbulo medio derecho. Las manifestaciones clínicas características pueden incluir tos y hemoptisis. Estas lesiones altamente vascularizadas pueden sangrar de manera profusa durante la biopsia. Hay otros adenomas bronquiales que son neoplasias endobronquiales de bajo grado y pueden ser localmente invasivos e incluso metastatizar; entre ellos se encuentran los tumores adenoide-quísticos y mucoepidermoides.
FIGURA 5-116.

Carcinoide bronquial, vista microscópica
Aquí se muestra una masa bien circunscrita que surge de la pared bronquial y se compone de pequeñas células azules y uniformes que se disponen en sábanas y nidos. Puesto que estos tumores son de origen neuroendocrino, las tinciones inmunohistoquímicas pueden ser positivas para compuestos como la cromogranina, la serotonina y la enolasa neuronoespecífica. Este tumor carcinoide se considera la contrapartida benigna del carcinoma de células pequeñas, situándose ambos en extremos opuestos del espectro de los tumores neuroendocrinos del pulmón. Entre los dos extremos se hallan los carcinoides atípicos. Los carcinoides bronquiales suelen alcanzar un tamaño entre 1 y 2 cm antes de producir síntomas relacionados con obstrucción y hemorragia. Raramente producen efectos hormonales.
FIGURA 5-117.

Hamartoma, vista macroscópica
Se muestran dos ejemplos de un tumor pulmonar benigno conocido como hamartoma pulmonar. En la Rx de tórax estas lesiones infrecuentes tienen un aspecto «en moneda» cuyo diagnóstico diferencial incluye granulomas y tumores malignos localizados. Son firmes y discretos, y a menudo contienen calcificaciones también visibles en la Rx. La mayoría son pequeños (<2 cm).
FIGURAS 5-118 y 5-119.


Hamartoma, Rx y TC
La Rx posteroanterior de tórax de la izquierda pone de manifiesto una lesión en moneda (▴) que no aumentó significativamente de tamaño con el tiempo. A la derecha, la TC torácica en modo de ventana pulmonar muestra una pequeña masa redondeada (▴) en el pulmón derecho de este individuo corpulento. El diagnóstico diferencial incluye granulomas, carcinomas periféricos, metástasis solitarias y hamartomas. Esta masa resultó ser un hamartoma: un buen diagnóstico, aunque poco frecuente.
FIGURA 5-120.

Hamartoma, vista microscópica
Desde el punto de vista microscópico, este hamartoma pulmonar se compone principalmente de elementos benignos: cartílago (a la derecha), que se halla mezclado con una estroma fibrovascular y glándulas bronquiales dispersas (a la izquierda). La naturaleza cartilaginosa de esta masa hace que rebote ante el empuje de la aguja de biopsia como si fuese una pelota de ping-pong. El hamartoma es una neoplasia compuesta de elementos tisulares normalmente presentes en ese órgano, pero que proliferan formando una masa desordenada.
FIGURAS 5-121 y 5-122.


Metástasis, vista macroscópica y radiografía
Aquí se muestran, en imagen macroscópica y radiografía posteroanterior de tórax, múltiples masas de tamaño variable (▴) dispersas por todos los campos pulmonares. Estos nódulos blanco-parduscos son característicos del carcinoma metastásico. Las metástasis a los pulmones son más frecuentes que incluso las neoplasias pulmonares primarias, simplemente porque son muchos los tumores que pueden metastatizar a los pulmones. Los ganglios linfáticos del hilio también contienen nódulos de carcinoma metastásico. Dichos nódulos a menudo se sitúan en la periferia y no causan obstrucción de las vías aéreas principales.
FIGURAS 5-123 y 5-124.

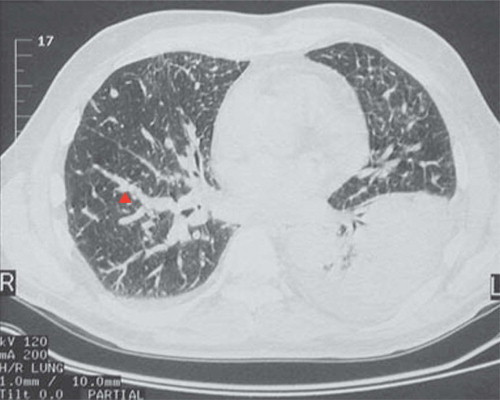
Metástasis, vista macroscópica y tomografía computarizada
La superficie de corte del pulmón pone de manifiesto la trama intersticial acentuada (▴) y la presencia de nódulos en un caso de carcinoma metastásico linfangítico, que es uno de los patrones menos frecuentes de metástasis. La TC torácica pone de manifiesto un patrón difuso reticular y nodular de afectación por carcinoma metastásico que se disemina por los canales linfáticos del pulmón. También hay un gran derrame pleural maligno en la región inferior izquierda.
FIGURA 5-125.

Derrame pleural seroso, vista macroscópica
Esta autopsia ofrece un ejemplo de acumulación de líquido en una cavidad corporal (derrame). Se trata de un derrame pleural derecho (en un niño). Obsérvese el aspecto claro y amarillo pálido del líquido. Es un derrame seroso. Las acumulaciones extravasculares de líquido pueden clasificarse de la siguiente manera:
Exudado. Acumulación extravascular de líquido que es rica en proteínas, células o ambas. El líquido tiene un aspecto macroscópico turbio.
Trasudado. Acumulación extravascular de líquido que es fundamentalmente un ultrafiltrado de plasma con pocas proteínas y pocas o ninguna células. El aspecto macroscópico del líquido es claro.
FIGURA 5-126.

Derrame pleural serohemorrágico, vista macroscópica
Obsérvese cómo el líquido de las cavidades pleurales tiene un aspecto rojizo porque ha habido hemorragia en el derrame. Los derrames de las cavidades corporales pueden describirse de la siguiente manera:
Seroso. Trasudado con líquido de edema y pocas células.
Serohemorrágico. Derrame con hematíes.
Fibrinoso (serofibrinoso). Las bandas de fibrina proceden de exudados ricos en proteínas.
Purulento. Hay numerosos leucocitos polimorfonucleares (en el espacio pleural también se le llama empiema).
FIGURA 5-127.

Quilotórax, vista macroscópica
La cavidad pleural derecha está repleta de líquido entre turbio amarillento y lechoso, que es característico del quilotórax. Éste es un proceso poco común en el que el líquido acumulado contiene numerosos glóbulos de grasa y pocas células, principalmente linfocitos. Los traumatismos penetrantes o la obstrucción del conducto torácico, en general, por una neoplasia primaria o metastásica, pueden provocar la formación de quilotórax. En este caso, un linfoma maligno con afectación de los vasos linfáticos del tórax y el abdomen produjo la acumulación de líquido quiloso. El pulmón derecho está muy atelectásico, debido a la compresión externa ejercida por la acumulación de líquido pleural.
FIGURAS 5-128 y 5-129.

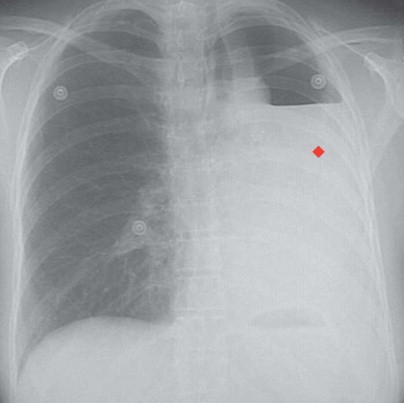
Derrame pleural, radiografías
En la radiografía posteroanterior de tórax de la izquierda se observa líquido (◆) en la cavidad pleural izquierda en un paciente con carcinoma pulmonar que ha provocado obstrucción y neumonía. Se ve un nivel hidroaéreo (▴) en el estómago bajo la cúpula del diafragma izquierdo, que está mucho más alto que el derecho, en consonancia con la atelectasia del pulmón izquierdo. En la radiografía posteroanterior de tórax de la derecha se ve un gran derrame pleural (◆) que ocupa casi totalmente la cavidad torácica izquierda. Esta acumulación de líquido se produjo tras una neumonectomía izquierda.
FIGURAS 5-130 y 5-131.


Neumotórax, radiografías
Estas radiografías posteroanteriores de tórax ponen de manifiesto un neumotórax derecho. Nótese el desplazamiento del corazón hacia la izquierda. El neumotórax se asocia a las lesiones penetrantes del tórax, la inflamación con rotura de un bronquio a la pleura, la rotura de una bulla enfisematosa o la ventilación con presión positiva. El escape de aire al espacio pleural colapsa el pulmón. Los ejemplos aquí mostrados son de neumotórax a tensión que desplaza el mediastino, al acumularse el aire en la cavidad torácica derecha como consecuencia de un efecto de válvula. En la radiografía de la derecha se observa un tubo torácico (◆) que se ha insertado para ayudar a expandir el pulmón.
FIGURA 5-132.

Mesotelioma maligno, vista macroscópica
Esta densa masa tumoral blanca que rodea al pulmón nace de la pleura visceral y es un mesotelioma maligno. Son tumores de gran tamaño que pueden ocupar toda la cavidad torácica. El factor de riesgo del mesotelioma es la exposición al asbesto. La asbestosis predispone con más frecuencia al carcinoma broncogénico, multiplicando el riesgo por cinco. El tabaquismo multiplica por diez el riesgo de cáncer de pulmón. Así pues, los fumadores con historia de exposición al asbesto tienen una probabilidad 50 veces más alta de desarrollar carcinoma broncogénico.
FIGURA 5-133.

Mesotelioma maligno, tomografía computarizada
En esta TC torácica en modo de ventana ósea se observa un mesotelioma maligno que afecta a la pleura derecha, que presenta engrosamiento (▴) y nodularidad. Este engrosamiento puede ocultar las placas pleurales previas. La neoplasia se ve cerca de la base del pulmón. El mesotelioma puede aparecer de 25 a 45 años tras la exposición inicial al asbesto, y la cantidad y duración de la exposición inicial puede haber sido mínima. En casos de exposición muy significativa al asbesto, el pulmón adyacente puede tener fibrosis intersticial y hay numerosos cuerpos de asbesto (cuerpos ferruginosos) en el parénquima pulmonar.
FIGURA 5-134.

Mesotelioma maligno, vista microscópica
Los mesoteliomas tienen células fusiformes o células amplias y redondeadas que dan lugar a configuraciones de apariencia glandular. Con frecuencia hay anomalías citogenéticas, así como mutaciones de p53. Desde el punto de vista citológico, los mesoteliomas son difíciles de diagnosticar. Aquí se muestran a gran aumento las células epitelioides y redondeadas del mesotelioma maligno. Los mesoteliomas son raros, incluso en individuos con exposición al asbesto, y prácticamente nunca se ven en individuos que no hayan sufrido exposición al asbesto. Además de la pleura, otras localizaciones menos comunes de esta neoplasia son el peritoneo, el pericardio y la túnica testicular.


