Abstract
Il bambino sotto 1 anno e, soprattutto, di meno di 6 mesi è ad alto rischio di disidratazione, la cui causa principale è una gastroenterite acuta, soprattutto di origine virale. La gestione di una disidratazione da gastroenterite ha due componenti: la sua correzione e il rapido ripristino della normale perfusione tissutale e il mantenimento dei fabbisogni di acqua e di nutrienti, per limitare al massimo il deficit energetico. La valutazione della gravità della disidratazione è l’elemento chiave che guiderà la terapia. La perdita di peso, espressa in percentuale di peso corporeo prima dell’episodio di disidratazione, è il metodo di riferimento, ma è spesso difficile o impossibile da ottenere. Inoltre, i segni clinici, come l’alterazione dell’aspetto generale, l’allungamento del tempo di riempimento capillare, il riconoscimento di una plica cutanea persistente, gli occhi infossati, una secchezza delle mucose e la mancanza di lacrime, sono i principali elementi che permettono di valutare la gravità della disidratazione. Il trattamento si basa sulla rapida correzione del deficit del settore extracellulare. Un’espansione volemica di 20 ml/kg di una soluzione isotonica somministrata per via endovenosa o intraossea può essere necessaria nella fase iniziale nei casi più gravi (disidratazione > 10%). In tutti gli altri casi, la reidratazione per via orale per correggere il deficit di acqua in 4-6 ore è la tecnica di scelta, che si è dimostrata efficace, sicura e veloce. Essa utilizza delle soluzioni di reidratazione adattate che soddisfano criteri specifici. Il loro utilizzo precoce è la prevenzione più efficace delle forme gravi. L’allattamento al seno non deve essere interrotto e l’alimentazione artificiale deve essere ripresa da 4 a 6 ore dopo l’inizio della reidratazione. La vaccinazione contro i rotavirus prima dei 6 mesi è fortemente raccomandata.
Parole chiave: Lattante, Disidratazione, Gastroenterite, Liquidi di reidratazione orale
Introduzione
La disidratazione acuta nei lattanti è una malattia molto comune che colpisce i bambini in tutto il mondo ed è la più frequente (più dell’80% dei casi) conseguenza di una gastroenterite acuta (GEA) di origine infettiva. Nei paesi in via di sviluppo, soprattutto nell’Africa sub-sahariana e nel Sud-Est asiatico, le disidratazioni da diarrea rappresentano la seconda causa di morte dei bambini al di sotto dei 5 anni (circa 800 000 decessi nel 2010), dietro alle polmoniti e davanti alla malaria [1]. Studi epidemiologici hanno identificato i cinque agenti patogeni più comuni in questa fascia d’età in diverse regioni del globo (rotavirus, shigella, Escherichia coli enterotossigeni, Cryptosporidium ed E. coli enteropatogeni) e consentono un migliore orientamento delle misure di prevenzione e dei trattamenti più adatti [2], [3]. I rotavirus sono, da soli, responsabili di più della metà dei decessi per diarrea nei bambini sotto i 5 anni (0,5 milioni circa) [4]. Gli sforzi dell’Organizzazione Mondiale della Sanità (OMS), che, dal 1975, sono incentrati sulla promozione e sulla diffusione di soluzioni reidratanti a livello comunitario, sulla formazione degli operatori di sanità pubblica e, dagli anni ′90, sul miglioramento delle condizioni sanitarie, hanno permesso di ottenere dei risultati impressionanti, anche se rimangono insufficienti [5]. Infatti, durante il decennio 2000-2010, mentre la popolazione infantile è aumentata, la mortalità generale dei bambini sotto i 5 anni sarebbe diminuita del 26% (9,6 milioni di morti nel 2000 rispetto a 7,6 milioni nel 2010). Durante lo stesso periodo, il numero di disidratazioni fatali è diminuito nelle stesse proporzioni [1].
Nei paesi con un livello sanitario elevato, la mortalità per diarrea e disidratazione è, ovviamente, molto minore, ma è inaccettabile nei paesi in cui le capacità di prevenzione e di trattamento sono importanti. Il numero di morti per disidratazione in Francia è, attualmente, di 8-20 all’anno. In questi paesi, si tratta anche di ridurre la morbilità di questa malattia, le cui conseguenze maggiori sono di sottoporre il sistema sanitario pediatrico a tensioni molto importanti nel periodo epidemico e di generare un alto costo economico per la società.
Le GEA colpiscono soprattutto i bambini dai 6 ai 24 mesi, con una predominanza stagionale (picco da gennaio a marzo in Francia). Sono soprattutto virali, causate da molti virus (norovirus, enterovirus, adenovirus, coronavirus, astrovirus, calicivirus), ma i rotavirus sono gli agenti più spesso responsabili, in particolare le forme più gravi (oltre la metà dei casi di ricovero in ospedale) [6], [7], [8]. La frequenza della diarrea è elevata, stimata, nella fascia 0-3 anni, tra 0,5 e 1,9 episodi per anno e per bambino in Europa, contro 2,9-4,5 nei paesi in via di sviluppo [3], [6]; così, le GEA sono responsabili, in Francia, del 7,9% di tutti i passaggi al Pronto Soccorso dei bambini di età inferiore ai 5 anni, ma di un terzo di questi passaggi durante le epidemie [7]. In Europa, causano dallo 0,5% al 10% di tutti i ricoveri secondo i paesi, ma più della metà dei ricoveri ospedalieri nel periodo epidemico [7], [8]. Anche le conseguenze economiche sono molto importanti, a causa dei costi medici diretti (legati principalmente alle cure ambulatoriali, in Pronto Soccorso e in ospedale), ma anche dei costi indiretti, legati specialmente all’assenteismo parentale durante la fase acuta della malattia. In Francia, il costo annuale diretto delle sole GEA da rotavirus è stato stimato tra i 26 e i 40 milioni di euro ed esse sarebbero responsabili di più di 500 000 giorni di assenza per malattia all’anno [8], [9].
Richiami di fisiologia
Il rischio di disidratazione è legato, prima di tutto, alla giovanissima età (meno di 12 mesi e, soprattutto, meno di 6 mesi), a causa della somma di molteplici fattori:
-
•
una proporzione corporea di acqua più elevata che nell’adulto; questa rappresenta l’80% del peso corporeo alla nascita e il 60% verso l’età di 1 anno e raggiunge dal 45% al 60% nell’età adulta, a seconda dell’età e del sesso;
-
•
una distribuzione sfavorevole di questa acqua corporea, poiché lo spazio extracellulare rappresenta il 45% del peso corporeo nel neonato e, poi, è inferiore o uguale al 23% in età adulta;
-
•
un tasso di ricambio della componente liquida dell’organismo molto più veloce (25% nelle 24 ore alla nascita, mentre è solo del 6% nell’adulto);
-
•
un potere di concentrazione del rene più limitato (gradiente corticomidollare insufficiente per l’inefficacia delle pompe al cloro dell’ansa di Henle);
-
•
la dipendenza dall’esterno per gli apporti idrici.
Questi diversi fattori contribuiscono alla rapida insorgenza di un grave deficit di liquidi nel lattante e spiegano che potrebbe perdere in poche ore più del 10% del suo peso durante una GEA o un colpo di calore, per esempio.
Valutazione dell’importanza della disidratazione
Una componente importante della strategia terapeutica contro una diarrea acuta si basa sulla valutazione della gravità della disidratazione. Una sottostima del deficit di liquidi può provocare una reidratazione insufficiente e/o inadeguata e portare ad acidosi, insufficienza renale o, anche, shock ipovolemico fatale, mentre una sovrastima del deficit di liquidi può portare a un trattamento per eccesso (per esempio, un’ospedalizzazione inappropriata o prolungata, un’infusione inutile con le sue possibili complicanze e un aumento della spesa sanitaria). La gravità della disidratazione dipende dall’importanza del deficit idrosodico ma anche dalla velocità di installazione, e la sua valutazione è molto difficile in pratica.
Anamnesi
È opportuno precisare la frequenza, il volume e la durata della diarrea e del vomito. Si ammette che il rischio di disidratazione aumenta con la giovane età (meno di 6 mesi) e con la frequenza delle scariche (più di otto al giorno) e del vomito (più di due o quattro al giorno). Il valore informativo dei diversi dati dell’anamnesi non è stato molto analizzato, ma va sottolineato che la persistenza dell’uso dei biberon e di una diuresi rende improbabile l’esistenza di una disidratazione significativa, mentre la scomparsa delle lacrime è correlata con l’ospedalizzazione [10].
Le informazioni sulla forma delle feci e sulla presenza di sangue orientano la diagnosi eziologica e gli eventuali esami necessari. Una storia di diarrea nelle persone vicine, inclusi i fratelli e le sorelle o gli altri bambini nella scuola materna, sono elementi per una possibile epidemia.
Esame clinico
Perdita di peso
Il criterio di riferimento per individuare una disidratazione acuta è la misura della perdita di peso, espressa in percentuale e definita come la differenza tra il peso appena prima della malattia e il peso nella fase acuta della malattia, diviso il peso appena prima della malattia. Anche se la valutazione della perdita di peso è molto utile, è un parametro raramente sfruttabile in pratica, per la mancanza di un peso recente prima della malattia acuta all’origine della disidratazione. Così, solo il 21% dei pazienti di età compresa tra 1 mese e 2 anni è stato pesato negli otto giorni precedenti la visita al Pronto Soccorso nella serie di Pruvost et al. [11]. Quindi, questi sono segni e sintomi clinici differenti che sono, il più delle volte, utilizzati per confermare la diagnosi di disidratazione e per valutarne la gravità.
Arthur, 8 mesi.

Allungamento del tempo di riempimento capillare
La misura del tempo di riempimento capillare (TRC) deve essere eseguita secondo un metodo standardizzato. Deve essere realizzata in un bambino calmo, dopo una pressione di cinque secondi sulla superficie palmare dell’estremità del dito indice, con la mano allo stesso livello del cuore, o sull’unghia del pollice o, ancora, sullo sterno nel neonato [12]. Un TRC normale è inferiore o uguale a tre secondi, ma la sua interpretazione deve tenere conto della temperatura ambientale [13], dal momento che il TRC è significativamente allungato quando la temperatura ambientale è inferiore ai 20 °C. L’allungamento del TRC sembra essere il segno più significativo nella diagnosi della disidratazione superiore al 5% nelle revisioni sistematiche di vari segni clinici e biologici presentati in letteratura [13], [14], [15]. Le prestazioni di questo test sono state migliorate con metodi di misurazione automatizzati. La videografia digitale non invasiva, chiamata digitally measured capillary-refill time, quindi, consentirebbe una migliore individuazione delle disidratazioni del 5% e più in una coorte di 83 bambini con GEA [16].
Ricerca di una plica cutanea persistente
La misura della plica cutanea periferica dovrebbe essere fatta al fianco, all’altezza dell’ombelico, sul lato opposto della posizione dell’esaminatore, pizzicando la plica cutanea tra il pollice e l’indice e misurando il tempo di scomparsa. La persistenza della plica cutanea riflette la diminuzione dell’elasticità della pelle e del tessuto sottocutaneo secondaria a una diminuzione del suo contenuto d’acqua. Questo è un fattore che contribuisce alla diagnosi di disidratazione, specialmente quando il metodo di misura è standardizzato, ma la misura non è facile nei lattanti con pannicolo adiposo spesso; in più, un’alterazione dell’elasticità della pelle non è specifica e può essere ritrovata nel corso di una malnutrizione.
Secchezza delle mucose
La secchezza delle mucose si ricerca passando il dito sulla mucosa orale (e non sulla lingua, spesso secca in un lattante febbrile e polipneico). L’assenza di questo segno aiuta a eliminare una grave disidratazione, come la presenza di lacrime.
Interesse dell’associazione di diversi segni: punteggi
Diversi studi hanno dimostrato che, a causa delle scarse sensibilità e specificità, nessun segno clinico o biologico di disidratazione era, da solo, sufficientemente discriminante per valutare lo stato di idratazione di un bambino; inoltre, dopo gli anni ′90, molti autori hanno proposto di associare diversi di questi segni per stimare con maggiore precisione il grado di disidratazione [13], [14], [15], [17]. Sono stati proposti molti punteggi; alcuni hanno mantenuto la distinzione dei tre gradi di disidratazione (lieve: 3-5%, moderata: 6-9% e grave: 10% o più) proposti dall’Accademia americana di pediatria nel 1996 [18], mentre altri hanno preferito semplificare in due categorie (lieve e moderata: 3-9% e grave: 10% e più) [6], [19], [20], [21], dal momento che la distinzione clinica fra disidratazione lieve e moderata appare a molti spesso difficile da fare nella pratica. I tre punteggi, quello dell’OMS, quello del Center for Disease Control and Prevention (CDC) di Atlanta e la Clinical Dehydration Scale (CDS) sono descritti qui.
Punteggio dell’Organizzazione Mondiale della Sanità
Esso fornisce una stima della gravità della disidratazione basata su quattro sintomi correlati in modo indipendente all’esistenza di una disidratazione: un TRC di più di due secondi, una secchezza delle mucose, un’assenza di lacrime e un’alterazione dell’aspetto generale (Tabella 1 ). L’associazione di almeno due di questi sintomi è correlata a una disidratazione di almeno il 5% del peso corporeo [21]. Anche se non è stato validato, il suo utilizzo è raccomandato dall’OMS nei paesi in via di sviluppo per i bambini da 1 mese a 5 anni ed è stato approvato dalla World Association of Gastroenterology.
Tabella 1.
Punteggio dell’Organizzazione Mondiale della Sanità [21].
| Nessuna disidratazione | Più di due segni di questa colonna: disidratazione tra il 5% e il 10% | Più di due segni di questa colonna: disidratazione grave > 10% | |
|---|---|---|---|
| Stato di coscienza | Comportamento normale, bambino vigile | Bambino irrequieto, irritabile | Bambino letargico o incosciente |
| Occhi | Normali | Orbite incavate | Orbite molto incavate |
| Sete | Beve normalmente | Beve avidamente perché assetato | Incapace di bere o beve molto lentamente |
| Plica cutanea | Ritorno rapido alla normalità | Ritorno lento alla normalità | Ritorno molto lento alla normalità |
Punteggio del Center for Disease Control and Prevention
È stato approvato dall’Accademia americana di pediatria e dal College degli urgentisti americani, ma contiene 12 elementi, cosa che lo rende di utilizzo meno facile per il triage in Pronto Soccorso (Tabella 2 ) [19]. Inoltre, non è convalidato.
Tabella 2.
Punteggio del Center for Disease Control and Prevention [19].
| Assenza di disidratazione | Disidratazione tra il 3% e il 9% | Disidratazione grave ≥ 10% | |
|---|---|---|---|
| Stato neurologico | Normale, vigile | Agitato, irritabile | Letargico o incosciente |
| Sete | Beve normalmente | Beve avidamente perché assetato | Incapace di bere o beve molto lentamente |
| Frequenza cardiaca | Normale | Aumentata | Molto aumentata > 150/min |
| Polsi periferici | Normali | Diminuiti | Deboli o non percepiti |
| Respirazione | Normale | Accelerata | Profonda, ampia |
| Occhi | Normali | Orbite leggermente incavate | Orbite profondamente incavate |
| Pianto | Presente | Diminuito | Assente |
| Mucose (guance) | Umide | “Collose” | Secche |
| Plica cutanea | Ritorno rapido alla normalità | Ritorno lento alla normalità | Ritorno molto lento alla normalità |
| TRC | Normale | Prolungato | Ricolorazione molto lenta |
| Estremità | Calde | Normali | Fredde e screziate |
| Diuresi | Normale | < 1 ml/kg/h | < 0,5 ml/kg/h (rare urine nei pannolini) |
TRC: tempo di riempimento capillare.
Clinical Dehydration Scale
Il punteggio più utilizzato negli studi clinici condotti in paesi a elevato tenore di vita è il CDS. Ha solo quattro item valutati da 0 a 2 (stato generale, condizione dei bulbi oculari e delle mucose delle guance e presenza o assenza di lacrime). Anche se validato in una popolazione di bambini di 1-36 mesi [22], [23], [24], la sua performance è ancora insufficiente per un uso individuale che permetta di guidare l’approccio terapeutico nella pratica clinica [25].
Contributo degli esami aggiuntivi
L’ecografia è stata recentemente proposta per valutare un’ipovolemia, con una capacità di rilevamento di una disidratazione grave (a partire dal 10%) migliore del punteggio dell’OMS. Il criterio utilizzato è stato un rapporto tra la vena cava inferiore/aorta inferiore a 0,8, la cui sensibilità era dell’86%-93% e la cui specificità era del 56%-59% [26], [27].
Le prove di laboratorio sono generalmente considerate non necessarie per la diagnosi della disidratazione e raramente sono utili per guidare la condotta di reidratazione [6], [18], [19], [20]. Secondo gli studi, il parametro biologico più significativo era un tasso di bicarbonati inferiore a 15 o 17 mmol/l [28], [29].

Tuttavia, in caso di disidratazione grave che giustifica una reidratazione endovenosa, le prove di laboratorio sono indispensabili [6], [18], [19], [20]; mirano a cercare le anomalie idroelettrolitiche associate, a valutare l’equilibrio acido-base e a specificare il tipo di disidratazione (glicemia con elettroliti, urea, creatininemia e osmolalità). Sono utili anche in caso di incertezza diagnostica (malattia chirurgica addominale o sindrome emolitica e uremica) o di fronte a quadri clinici insoliti [6], [18].
Decisione dell’orientamento del paziente
Il corretto orientamento del bambino è fondamentale ma difficile. Si basa sull’età del bambino (inferiore ai 6 mesi), sull’importanza dei disturbi digestivi (più di otto scariche diarroiche al giorno e/o più di quattro episodi di vomito al giorno), sull’esistenza o meno di un disidratazione e sulla sua importanza [6], [14]. È fondamentale riconoscere uno shock per correggere rapidamente l’ipovolemia ed evitare la progressione verso un’insufficienza multiorgano. I segni cardinali sono: tachicardia, polipnea, scarsa perfusione periferica e disturbi della coscienza. Nelle forme meno gravi, bisogna anche valutare eventuali difficoltà nella presa in carico al domicilio (grado di comprensione dei genitori, condizioni socioeconomiche precarie, possibilità di monitoraggio ravvicinato) e, infine, l’esistenza di comorbilità (storia di prematurità, sindrome dell’intestino corto, ileostomia, insufficienza renale, ecc.) [6].
Quali malati controllare in Pronto Soccorso e per quanto tempo?
I bambini ad alto rischio di sviluppare una disidratazione (età inferiore ai 3 mesi, più di otto scariche diarroiche al giorno e/o più di quattro episodi di vomito al giorno) devono essere attentamente monitorati in un’unità di ospedalizzazione d’urgenza di breve durata per un periodo di almeno quattro ore, per garantire l’efficacia della reidratazione [6], [20]. Il ritorno a casa si concorda in funzione dei seguenti elementi:
-
•
la buona tollerabilità della terapia di reidratazione per via orale e l’assenza di vomito;
-
•
una reidratazione considerata sufficiente, valutata sullo stato clinico e sul riacquisto del peso;
-
•
la capacità dei genitori di continuare la reidratazione a casa;
-
•
la possibilità di un follow-up per telefono o di visite del medico curante al domicilio.
Informazioni ai genitori in caso di diarrea acuta nei lattanti.

Quando ricoverare?
Il ricovero in ospedale è necessario:
-
•
se ci sono segni di gravità: stato di shock, disturbi della coscienza o solo disidratazione superiore o pari al 10%;
-
•
se vi è incertezza diagnostica (per esempio, la sindrome emolitica e uremica, possibile patologia chirurgica);
-
•
in caso di impossibilità o insuccesso di una reidratazione per via enterale;
-
•
se vi è un substrato a rischio (fibrosi cistica, diabete, HIV, ecc.);
-
•
quando l’ambiente socioculturale non assicura le semplici misure terapeutiche e il monitoraggio affidabile a casa [6], [19], [20].
Trattamenti
Obiettivi terapeutici
Di fronte a una disidratazione acuta infantile, il primo obiettivo terapeutico nelle disidratazioni gravi è di correggere l’ipovolemia attraverso una rapida espansione dello spazio extracellulare che permette di ripristinare una perfusione tissutale normale, soprattutto cerebrale e renale; nelle forme moderate o minime, l’assunzione orale di soluti di reidratazione orale (ORS) di solito è sufficiente. Il secondo obiettivo terapeutico è di ridurre al minimo il rischio di malnutrizione, ripristinando rapidamente gli apporti energetici normali.
Nei paesi con un alto livello sanitario, le GEA sono uno dei motivi più comuni per la consultazione d’urgenza e la loro gestione è ben codificata grazie a numerose raccomandazioni [6], [18], [19], [20], [21], la cui qualità è considerata da soddisfacente a eccellente [30].
Reidratazione rapida per via orale
Dovrebbe essere preferita per qualsiasi disidratazione inferiore al 10% (Fig. 1 ).
Figura 1.
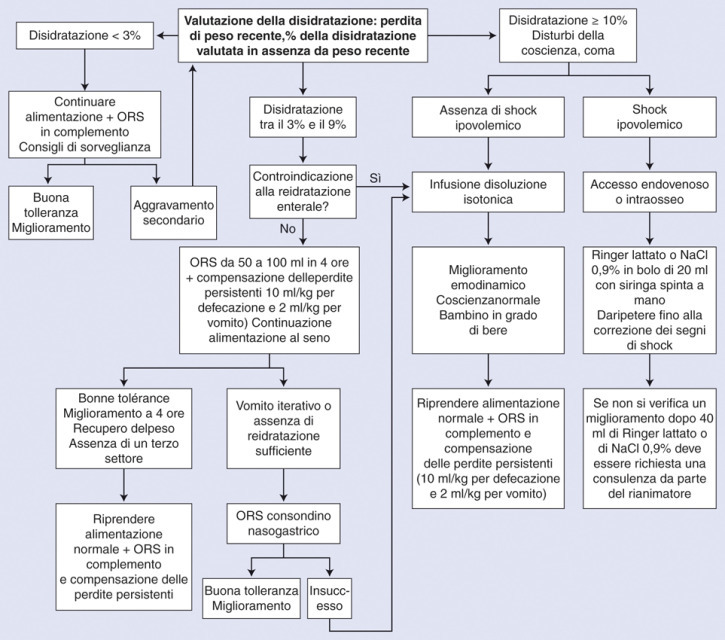
Algoritmo decisionale. Trattamento terapeutico di una disidratazione acuta nei lattanti. ORS: soluzioni reidratanti orali.
La reidratazione per via orale è il trattamento di prima linea raccomandato per la disidratazione inferiore al 10% [6], [18], [19], [20], [21]. I principali benefici della reidratazione attraverso la via orale sono provati da molto tempo [31], [32] e sono i seguenti:
-
•
stabilire rapidamente il trattamento e proseguirlo a casa;
-
•
evitare procedure dolorose, come l’inserimento di un’infusione endovenosa;
-
•
ridurre i costi sanitari.
Tuttavia, la durata del soggiorno in caso di emergenza o l’incidenza di complicanze come le convulsioni e un’ipo- o ipernatriemia non sono stati considerati differenti nella metanalisi più recente Cochrane [32]. Nella stessa revisione, un ileo paralitico era statisticamente più frequente nei due studi che non ne facevano un criterio di esclusione degli ORS (tra i 18 studi analizzati), ma questo rischio è stato giudicato sufficientemente basso da non rimettere in discussione il primato della reidratazione orale.
Modalità di reidratazione enterale
Via orale
Si raccomanda di lasciare bere il bambino, se può bere correttamente e se la disidratazione è inferiore al 5%. Nelle disidratazioni moderate (tra il 5% e il 9%) o in caso di vomito, si raccomanda inizialmente di fare bere al bambino piccole quantità a intervalli molto ravvicinati, se la sua condizione è stabile e se il suo stato di coscienza lo permette, per controllare la tolleranza digestiva. Si suggerisce, nella letteratura, di iniziare con dei volumi nell’ordine di 5 ml ogni due minuti durante i primi dieci minuti e poi, gradualmente, di aumentare la quantità somministrata, per esempio di somministrare dei volumi di 10 ml ogni 5 minuti durante i 20 minuti seguenti e, poi, di 20 ml ogni 10-15 minuti durante i 30 minuti seguenti [18], [19]. In assenza di vomito, i quantitativi possono essere aumentati rapidamente, riducendo la frequenza delle somministrazioni e lasciando il bambino libero di bere a volontà e di regolarsi da solo in base ai suoi bisogni. Grandi quantità possono essere assorbite nel corso delle prime 24 ore, pari o superiori ai 200 ml/kg al giorno. Questa modalità di reidratazione presuppone che il genitore o il caregiver del bambino possa assumersi questo compito. L’alimentazione non deve essere interrotta per più di sei ore al massimo e devono essere offerti gli apporti dietetici adeguati all’età. Una volta che il bambino è reidratato, può alimentarsi da solo con gli apporti dietetici adeguati alla sua età. In caso di vomito, si consiglia di attendere da 15 a 30 minuti prima di riprendere la terapia di reidratazione per via orale [18], [19].

Sondino nasogastrico
La seconda possibilità è la reidratazione attraverso il sondino nasogastrico. Questa possibilità, citata semplicemente nelle raccomandazioni più vecchie [18], [19], è dettagliata bene nelle raccomandazioni più recenti [6], [19], [33]. Non vi è alcun motivo per proporla sistematicamente in prima intenzione, ma, nel 5% degli insuccessi di una reidratazione orale ben condotta [32], si consigliadi utilizzare un sondino gastrico. L’analisi di studi che utilizzano la reidratazione enteralecon il sondino nasogastrico ha confermato un’efficacia e una sicurezza della via enterale almeno identiche a quelle della via venosa, con meno complicanze (il 2% di flebite nei bambini perfusi) e costi minori [6], [20], [33], [34]. Il fallimento del posizionamento di un sondino nasogastrico era molto più raro (4%) rispetto alle difficoltà di perfusione periferica (il 61% richiede diversi tentativi di posizionamento di un catetere breve 22 o 24 G) [35]. Infine, anche se questa indicazione non può essere consigliata nei casi più gravi, la reidratazione con il sondino nasogastrico può essere utile per i bambini molto difficili da perfondere [36].
Quali sono le soluzioni di reidratazione orale da utilizzare?
L’OMS e il Fondo delle Nazioni Unite per l’Infanzia (UNICEF) hanno promosso gli ORS nel 1975 e li raccomandando come primo mezzo di lotta contro la diarrea. Da allora, hanno notevolmente contribuito a ridurre la mortalità per diarrea nei paesi in via di sviluppo, cosa che ha portato a consacrarli come la più importante innovazione terapeutica del xx secolo. Gli ORS sono composti principalmente da acqua, zucchero, sodio, potassio e da un sale alcalino. Il glucosio facilita l’assorbimento intestinale di sodio e, quindi, di acqua, riducendo vomito. Consente anche un apporto energetico minimale, migliorando l’accettabilità della soluzione da parte del bambino. La composizione degli ORS si è evoluta: il primo aveva un’osmolarità elevata (330 mOsm/l) con 90 mmol/l di sodio ed era più adatto al trattamento del colera; nel 2002, l’OMS ha raccomandato che l’osmolarità fosse ridotta a 245 mOsm/l, con 75 mmol/l di sodio, poi la Società Europea di Gastroenterologia Pediatrica e Nutrizione (ESPGAN) ha proposto, per i bambini europei, l’utilizzo di una soluzione contenente solo 60 mmol/l di sodio, mentre, negli Stati Uniti, la maggior parte delle soluzioni disponibili aveva un’osmolarità vicina a 250 mOsm/l, con 45- 50 mmol/l di sodio [6], [18]. In Francia, i soluti commercializzati hanno un’osmolarità compresa tra 225 e 250 mOsm/l (Tabella 3 ) e sono ricostituiti nella stessa maniera (una bustina ogni 200 ml di acqua). Questi soluti ipo-osmolari permettono di provocare meno vomito e di diminuire il volume delle scariche e il ricorso alla reidratazione per via endovenosa [6], [20], [33]. La tolleranza può anche essere migliorata proponendo ORS rinfrescati [37].
Tabella 3.
Composizione di diverse soluzioni per la reidratazione orale (ORS) disponibili nel mese di febbraio 2014 (espressa per litro di ORS).
| ORS |
Glucidi (g) |
Na (mmol/l) |
K (mmol/l) |
Citrato o bicarbonato (mmol/l) |
Osmolarità (mOsm/l) |
|---|---|---|---|---|---|
| Reco ESPGAN 2008 | 14–20 | 60 | 20 | 10 | 200–250 |
| Adiaril® | 26 | 60 | 20 | 10 | 250 |
| Fanolyte® | 16 | 60 | 20 | 10 | 240 |
| Novalac® | 25 | 60 | 20 | 11 | 245 |
| Physiosalt® | 42 | 55 | 22 | 10 | 223 |
| Picolite® | 90 | 60 | 23 | 10 | 233 |
| Viatol® | 20 | 50 | 25 | 12 | < 270 |
ESPGAN: European Society of Paediatric Gastroenterology and Nutrition.
Nei lattanti, la reidratazione è basata sull’uso dei soli ORS. Tutte le altre bevande (acqua e zucchero, acqua pura, bibite tra cui la Coca-Cola® o bevande per gli sportivi) non sono adatte perché forniscono o poco o niente sodio o troppo zucchero.
Quale volume di reidratazione e in quanto tempo?
La quantità di soluto da somministrare durante le prime ore è quella del deficit liquido valutato: questo deficit (in litri) è uguale alla perdita di peso recente, se questa può essere quantificata. Nella maggior parte dei casi, non potendo disporre di un peso di riferimento recente, si ricorre al peso di ammissione (in kg) moltiplicato per la percentuale stimata di disidratazione. Per esempio, una disidratazione dell’8% in un lattante di 6 kg porta a somministrare con un sondino nasogastrico 480 ml di soluzione di reidratazione orale in quattro ore (120 ml/h). Per semplificare la gestione, alcune raccomandazioni propongono dei volumi di reidratazione standardizzati: 50 ml/kg se la disidratazione è inferiore al 5% e 100 ml/kg se la disidratazione è compresa tra il 5% e il 10% [18]. Una volta corretta la disidratazione, gli apporti dei liquidi tengono conto dei bisogni di manutenzione quotidiana e di eventuali perdite anomale persistenti (10 ml/kg per ogni scarica, 2 ml/kg per ogni vomito) [19].
La velocità di correzione delle disidratazioni da moderate a gravi varia a seconda delle raccomandazioni: è tra le 3 e le 4 ore per il CDC, di 4 ore per l’Accademia americana di pediatria e di 6 ore per le Linee Guida australiane [6], [18], [19], [20], [38], ma pochi studi hanno valutato rigorosamente l’interesse di una reidratazione più o meno rapida.
In assenza di shock, i vantaggi teorici che ci si aspetterebbe da una correzione “aggressiva” dell’ipovolemia sono una normalizzazione della concentrazione di ormone antidiuretico più rapida di quanto non farebbe una reidratazione più lenta o utilizzando una soluzione salina ipotonica [39]. Una volta recuperata la regolazione renale, l’eccesso di acqua e di sodio extracellulare può essere escreto nelle urine, riducendo, così, il rischio di disequilibrio idroelettrolitico secondario. Una correzione “aggressiva” dovrebbe anche migliorare la perfusione digestiva e la tolleranza di una rialimentazione precoce.
Valutazione del successo o del fallimento della terapia di reidratazione orale e indicazione della reidratazione per via endovenosa
Il successo della reidratazione è apprezzato grazie alla scomparsa dei segni clinici di disidratazione e al riacquisto del peso, dal momento che l’assenza di gonfiore addominale potrebbe indicare un terzo settore, e alla buona tollerabilità della terapia di reidratazione per via orale senza vomito (il rifiuto di bere non è, di per sé, un fallimento, perché è possibile e anche consigliato reidratare con sondino nasogastrico).
La reidratazione per via endovenosa deve essere effettuata in caso di insuccesso, o di controindicazioni della via enterale [6], [20], [33]. Queste sono rare e riguardano meno del 10% dei bambini:
-
•
qualsiasi disidratazione grave (superiore al 10%); in questa situazione, si tratta di una controindicazione temporanea: questi bambini dovrebbero ricevere prima di tutto una reidratazione endovenosa (o intraossea), ma, poi, non appena possono bere di nuovo, può essere utilizzata la via orale [6], [19], [20];
-
•
in caso di stato di shock, di disturbi della coscienza o di sospetto di una patologia chirurgica [6], [18], [19], [20].
Come reidratare per via endovenosa?
In presenza di uno shock ipovolemico, un’espansione volemica di 20 ml/kg di NaCl allo 0,9% o di Ringer lattato viene effettuata con una pompa o una siringa spinta a mano il più velocemente possibile, come consentito dalla via d’accesso. Un’espansione volemica di 40 ml/kg, a volte di più, può essere necessaria e i boli sono rinnovati fino a diminuire la tachicardia, a standardizzare il tempo di riempimento cutaneo, a far regredire le striature, a normalizzare la pressione arteriosa (se ipotensione) e a migliorare lo stato di coscienza.
Dopo aver corretto lo stato di shock o in assenza di segni di shock, la soluzione utilizzata deve essere salina isotonica per evitare il rischio di iponatriemia [40]. Non vi sono dati che mostrano la superiorità di una soluzione isotonica cristalloide rispetto a un’altra; il NaCl allo 0,9% rimane il più utilizzato, ma l’acidosi ipercloremica secondaria che viene indotta non è più vista come banale e giustifica il fatto di preferire delle soluzioni più povere di cloro come il Ringer lattato [41], [42].
La quantità di soluto da somministrare tiene conto del deficit di acqua (peso corporeo × percentuale stimata di disidratazione, necessità di manutenzione giornaliera ed eventuali perdite anomale persistenti [scariche, vomito]), ma bisogna tenere conto del fatto che i medici tendono a sopravvalutare l’importanza della disidratazione [13], [20].
Il soluto utilizzato comprende sempre la soluzione di glucosio al 5% o al 10% e del potassio (almeno 20 mmol/l di cloruro di potassio e, più spesso, 40 mmol/l, non appena riprende la diuresi).
La velocità di infusione proposta varia secondo gli autori; alcuni hanno proposto per la prima ora una reidratazione aggressiva di 50-60 ml/kg di soluzione fisiologica anziché 20 ml/kg [43], [44], [45]. La mancanza di benefici clinici e i potenziali rischi di tale reidratazione portano a proporre di evitare di reidratare troppo rapidamente in assenza di segni di basso flusso; sembra ragionevole mantenere un portata di reidratazione inferiore o uguale a 20 ml/kg all’ora [33]. Nella fase successiva, alcuni propongono di correggere la metà del deficit idrico nelle prime otto ore e altri propongono un flusso costante nelle 24 ore [46]. Al di là di queste differenze di strategia, va sottolineato che la procedura di reidratazione endovenosa deve essere particolarmente attenta perché si tratta di una forma grave, in quanto il trattamento stesso può causare delle complicanze. La velocità di infusione non deve essere prescritta per 24 ore, ma spesso deve essere aggiustata in funzione della regressione dei segni clinici di disidratazione, della persistenza o meno di feci acquose e di vomito, dell’evoluzione del peso ed eventualmente dei parametri biologici.
Casi particolari
Disidratazione iponatriemica
Una disidratazione iponatriemica (Na < 130 mmol/l) si verifica quando le perdite di sodio sono maggiori rispetto alle perdite di acqua o quando la reidratazione iniziale comprendeva grandi quantità di acqua pura. Il supporto terapeutico raccomanda generalmente di utilizzare NaCl allo 0,9% arricchito di glucosio al 5% e potassio (almeno 20 mmol/l) nelle prime 12 ore, poi di NaCl allo 0,45% nelle 24 ore seguenti, per correggere il deficit idrosodico [46]. Un dosaggio della natriuresi è essenziale per garantire la risposta renale e non ignorare un’insufficienza surrenalica.
Disidratazione ipernatriemica
Una disidratazione ipernatriemica (Na > 150 mmol/l) si verifica quando le perdite sono ipotoniche, vale a dire quando le perdite di acqua sono superiori alle perdite di sodio. L’ipertonicità del compartimento extracellulare causa una diminuzione nel contenuto di acqua nelle cellule, per ripristinare la stessa tonicità dei due mezzi. Di fronte a una situazione di ipertonia nel plasma, il cervello è l’unico organo in grado di proteggersi, producendo “osmoli idiogeniche”, la cui produzione, come l’eliminazione, è lenta, cosa che giustifica che la fase di correzione di un’ipernatriemia sia abbastanza lunga. L’obiettivo raccomandato è di eseguire la reidratazione orale in 12 ore invece che in 4 ore.
Quando la via orale è controindicata e deve essere utilizzata la via endovenosa, si raccomanda di non far diminuire il sodio nel siero oltre 1 mmol/l per ora, per evitare l’edema cerebrale. I soluti proposti sono abbastanza concentrati in NaCl (0,45% di NaCl o di 76 mmol/l) e arricchiti di glucosio al 5%. L’aggiunta di almeno 20 mmol/l di KCl quando esiste una diuresi rimane imperativa.
Alimentazione
Ripristinare gli apporti energetici normali per ridurre al minimo il rischio di malnutrizione è il secondo punto chiave della terapia delle diarree acute dei bambini. Si raccomanda di non interrompere l’allattamento al seno, anche durante la fase di reidratazione orale. I neonati allattati al seno dovrebbero ricevere l’allattamento al seno per tutte le volte e per tutto il tempo che vogliono per tutta la durata dell’episodio di diarrea.
Quando il bambino è abitualmente alimentato con un’alimentazione artificiale, questa può essere interrotta durante la fase di reidratazione orale e ripresa da 4 a 6 ore dopo l’inizio della reidratazione. Le attuali raccomandazioni invitano a riprendere l’alimentazione con il latte artificiale solito, non diluito [6]. Esse si basano sul fatto che la grande maggioranza dei bambini può continuare a essere alimentata con successo con un latte contenente lattosio. La revisione della letteratura condotta dal gruppo Cochrane [47] ha evidenziato una moderata riduzione della durata della diarrea (–18 ore) in caso di preclusione del lattosio e ha suggerito che questa misura potrebbe anche diminuire il tasso di fallimento della reidratazione orale. Tuttavia, gli autori chiamano questi risultati di bassa evidenza, a causa di una notevole eterogeneità dei risultati nei 16 studi analizzati (la durata media della diarrea nel gruppo che ha ricevuto il lattosio variava da 28,8 ore in uno studio finlandese a 230 ore in uno studio cinese). Questi limiti ci invitano a non rimettere in discussione la raccomandazione dell’ESPGAN del 2008, che non ritiene utile escludere sistematicamente il lattosio [6]. Tuttavia, nei casi specifici di lattanti con danni intestinali preesistenti, con malnutrizione grave o con una diarrea prolungata, un latte senza lattosio sembra appropriato [48].
Farmaci: un posto da rivalutare?
Le raccomandazioni del trattamento delle GEA hanno valutato i vari farmaci inutili o non necessari e la mancanza di prove sufficienti della loro efficacia o del loro interesse nella pratica clinica [6], [18], [19], [20]. Se è vero che le misure di reidratazione restano essenziali e non dovrebbero in nessun caso essere ritardate o danneggiate dalla prescrizione di farmaci, le revisioni della letteratura condotte nel 2013 dal gruppo Cochrane e dall’ESPGAN [33], [49] dovrebbero portare a modificare alcune raccomandazioni riguardanti i farmaci.
Odansetron
Viene ora dimostrato l’interesse per questo antiemetico, che ha permesso di ridurre il numero di ricorsi alla reidratazione per via endovenosa e al ricovero in ospedale, nonostante un aumento transitorio della diarrea che sembra comune [33], [49], [50]. Il rapporto rischio/beneficio appare favorevole, tanto più che una singola dose è sufficiente [33], [49]. La raccomandazione dell’EPSGAN del 2008, secondo la quale un antiemetico non dovrebbe essere usato di routine, resta valida, specialmente nei bambini in cui la diarrea è il sintomo dominante. Tuttavia, sembra legittimo offrire questo trattamento ai bambini disidratati che vomitano molto e che, quindi, hanno un maggior rischio di fallimento della reidratazione per via enterale, per ridurre l’ospedalizzazione e le reidratazioni per via endovenosa [49], [50]. L’ondansetron è già ampiamente utilizzato in Nord America [51]; è ancora poco prescritto in Europa e non lo è affatto in Francia (il 19% dei pediatri urgentisti belgi, svizzeri e olandesi ha detto che lo prescrive, ma non i pediatri francesi) [52].
Racecadotril
Una recente metanalisi sull’efficacia del racecadotril, che copre oltre 1300 pazienti, ha trovato una riduzione della durata della diarrea e del numero di scariche intestinali, nei bambini sia trattati in ambulatorio che in ospedale [53].
Probiotici
Diverse metanalisi hanno dimostrato che alcuni probiotici possono ridurre la durata della diarrea, in particolare Lactobacillus GG e, in misura minore, Saccharomyces boulardii [33], [49], ma i criteri di giudizio selezionati (durata della diarrea o numero di scariche diminuito) non sembrano sufficientemente convincenti per la maggior parte dei medici [33], [49], [52].
Supplementazione di zinco
Per l’OMS e l’UNICEF, un supplemento di zinco è parte integrante delle raccomandazioni per il trattamento della diarrea acuta per i bambini che vivono nei paesi in via di sviluppo, tra i quali la carenza di zinco è comune [54]. Ma, nei paesi europei, dove la malnutrizione e la carenza di zinco sono rare, non vi è alcuna prova del fatto che ci sarebbe stato un beneficio nella somministrazione di zinco [33], [49]. Le raccomandazioni dell’ESPGAN rimangono valide: anche se la supplementazione di zinco non ha un rischio particolare, non vi è alcuna prova del suo interesse per i bambini europei, con l’eccezione dei pochi bambini malnutriti che dovrebbero logicamente beneficiarne (10 mg se età inferiore a 6 mesi e 20 mg oltre, per 10-14 giorni).
Rispetto delle raccomandazioni e interesse della formazione
Molte valutazioni delle pratiche hanno dimostrato che le raccomandazioni sono state applicate solo parzialmente.
Primato della reidratazione orale
L’adesione dei pediatri urgentisti alla reidratazione orale di prima intenzione appare molto adeguata in Francia (sopra il 90%), come in altri paesi europei [9], [52] e molto meglio che in Nord America (76% in Canada e 47% negli Stati Uniti) [51].
Soluzione di reidratazione orale esclusiva
L’ORS era l’unico soluto utilizzato per la reidratazione nel 91% dei casi in un’inchiesta europea, mentre era così solo nel 73% dei casi in Canada e nel 76% dei casi negli Stati Uniti [51], [52].
Reidratazione enterale con sondino nasogastrico
I pediatri urgentisti francesi, come i pediatri del Nord America, non avevano quasi mai usato un sondino nasogastrico in caso di insuccesso della reidratazione orale nelle disidratazioni lievi-moderate (3% dei casi), preferendo una reidratazione per via endovenosa, mentre i pediatri belgi, svizzeri e olandesi hanno riferito di utilizzarlo nell’87% dei casi [37], [51], [55], [56].
Prescrizione di esami di laboratorio
Mentre le raccomandazioni ritengono inutili gli esami complementari, una virologia delle feci è stata richiesta in un quarto-un terzo dei casi dai pediatri urgentisti europei. Si noti che i pediatri francesi hanno richiesto più spesso esami di laboratorio rispetto ai loro colleghi belgi, svizzeri od olandesi (elettroliti sierici: 92% contro il 48%, esame emocromocitometrico completo: 51% contro il 29%) [52].
Interesse di una formazione
I principali ostacoli alla realizzazione di tutte le raccomandazioni provengono dal prezzo degli ORS (in Nord America, ma non in Francia, dove sono rimborsabili dal 2003) e dalla misconoscenza dei genitori e dei professionisti [19]. Per esempio, diversi studi condotti in Nord America hanno dimostrato che i genitori preferiscono la reidratazione per via endovenosa, perché è ritenuta più efficace, più facile da implementare e meno dolorosa rispetto a un sondino nasogastrico [55], [57]. Allo stesso modo, i professionisti (pediatri urgentisti, interni e infermieri) ingrandiscono i rischi di complicanze del posizionamento di un sondino nasogastrico, specialmente di falsa strada della sonda nella trachea o di epistassi [55]. Queste informazioni sottolineano il beneficio di programmi di formazione-azione mirati su alcuni aspetti della gestione terapeutica. Così, in Italia, un corso di formazione per due ore diretto ai medici ha permesso di ridurre molto le prescrizioni di esami microbiologici o di farmaci ritenuti inutili [58]; nella Carolina del Nord (Stati Uniti), una formazione più ambiziosa eseguita in una rete di assistenza ed elaborata dai lavoratori sul campo con il supporto degli universitari ha ridotto il numero di ricoveri per GEA quasi del 50% in tre anni [59].
Prevenzione
Due vaccini orali viventi attenuati sono disponibili in Europa, uno monovalente (Rotarix) e l’altro pentavalente (RotaTeq). La metanalisi di 41 studi di oltre 180 000 partecipanti ha chiaramente dimostrato i benefici della vaccinazione che previene almeno l’80% delle diarree gravi da rotavirus [4]. In studi più recenti, questi due vaccini hanno diminuito il numero di ricoveri o di passaggi in Pronto Soccorso di oltre il 90%. Dal 2008, la vaccinazione contro il rotavirus nei lattanti di meno di 6 mesi è stata fortemente raccomandata dalle società europee di gastroenterologia e di malattie infettive pediatriche (ESPGAN/ESPID) [60], dal momento che il rotavirus rimane la principale causa di diarrea grave con disidratazione nei bambini. In Francia, questa vaccinazione è consigliata solo dalla fine del 2013 dal Consiglio Superiore di Sanità Pubblica, che ha rivisto la posizione che aveva adottato nel 2006 e nel 2010 di non raccomandare questa vaccinazione [61]. Tuttavia, il Consiglio Superiore di Sanità Pubblica richiede che i genitori siano chiaramente informati del rischio aumentato di invaginazione intestinale acuta nei sette giorni dopo la somministrazione della prima dose di vaccino. Infatti, gli studi sulla sicurezza dopo l’autorizzazione all’immissione in commercio (AIM) hanno confermato un eccesso di rischio di invaginazione intestinale acuta postvaccinale dell’ordine di uno-cinque casi su 100 000 bambini immunizzati [62], [63].
I vaccini, somministrati per via orale, possono essere cosomministrati precocemente con gli altri vaccini del calendario vaccinale. La prima dose deve essere somministrata tra le 6 e le 12 settimane di vita e l’insieme di tutte le dosi (due per Rotarix, tre per RotaTeq) deve essere somministrato entro l’età di 6 mesi.
Dati complementari.

Punti importanti.
-
•
Gli ORS devono essere utilizzati in prima intenzione.
-
•
Gli ORS ipotonici, offerti ad libitum, dovrebbero essere preferiti.
-
•
La reidratazione orale deve essere veloce (in circa quattro ore).
-
•
Le perdite persistenti devono essere compensate da volumi supplementari di ORS (10 ml/kg per ogni scarica, 2 ml/kg per ogni episodio di vomito).
-
•
In caso di rifiuto di bere o di vomito persistente nonostante la reidratazione ben condotta, la via nasogastrica è da preferire alla reidratazione per via endovenosa.
-
•
L’allattamento al seno non deve mai essere interrotto.
-
•
In caso di alimentazione artificiale, non bisogna diluire il latte e non è necessario usare dei latti speciali.
-
•
Una rialimentazione normale (compresi i solidi) deve essere ripresa subito dopo la reidratazione (vale a dire dalla quarta alla sesta ora).
-
•
Ulteriori test complementari sono inutili in caso di disidratazione moderata.
-
•
Gli antibiotici non devono essere utilizzati nelle GEA abituali.
-
•
La vaccinazione contro il rotavirus deve essere completata all’età di 6 mesi.

Riferimenti bibliografici
- 1.Liu L., Johnson H.L., Cousens S., Perin J., Scott S., Lawn J.E. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000. Lancet. 2012;379:2151–2161. doi: 10.1016/S0140-6736(12)60560-1. [DOI] [PubMed] [Google Scholar]
- 2.Kotloff K.L., Blackwelder W.C., Nasrin D., Nataro J.P., Farag T.H., Van Eijk A. The Global Enteric Multicenter Study (GEMS) of diarrheal disease in infants and young children in developing countries: epidemiologic and clinical methods of the case/control study. Clin Infect Dis. 2012;55(Suppl. 4):S232–S245. doi: 10.1093/cid/cis753. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Fischer Walker C.L., Perin J., Aryee M.J., Boschi-Pinto C., Black R.E. Diarrhea incidence in low- and middle-income countries in 1990 and 2010: a systematic review. BMC Public Health. 2012;12:220. doi: 10.1186/1471-2458-12-220. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Soares-Weiser K., MacLehose H., Bergman H., Ben-Aharon I., Nagpal S., Goldberg E. Vaccines for preventing rotavirus diarrhoea: vaccines in use. Cochrane Database Syst Rev. 2012;(11):CD008521. doi: 10.1002/14651858.CD008521.pub3. [DOI] [PubMed] [Google Scholar]
- 5.UNICEF, OMS. Diarrhoea: why children are still dying and what can be done. 2009. http://whqlibdoc.who.int/publications/2009/9789241598415_eng.pdf.
- 6.Guarino A., Albano F., Ashkenazi S., Expert Working Group The ESPGHAN/ESPID evidenced-based guidelines for the management of acute gastroenteritis in children in Europe. J Pediatr Gastroenterol Nutr. 2008;46(Suppl. 2):S81–S122. doi: 10.1097/MPG.0b013e31816f7b16. [DOI] [PubMed] [Google Scholar]
- 7.Forster J., Guarino A., Parez N., Moraga F., Román E., Mory O. Hospital-based surveillance to estimate the burden of rotavirus gastroenteritis among European children younger than 5 years of age. Pediatrics. 2009;123:e393–e400. doi: 10.1542/peds.2008-2088. [DOI] [PubMed] [Google Scholar]
- 8.Ogilvie I., Khoury H., Goetghebeur M.M., El Khoury A.C., Giaquinto C. Burden of community-acquired and nosocomial rotavirus gastroenteritis in the pediatric population of Western Europe: a scoping review. BMC Infect Dis. 2012;12:62. doi: 10.1186/1471-2334-12-62. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Parez N., Pozzetto B., Texier N., Mory O., Garbarg-Chenon A., Téhard B. Incidence des gastroentérites à rotavirus chez les enfants de moins de cinq ans consultant un pédiatre ou un médecin généraliste en France. Pathol Biol. 2013;61:99–107. doi: 10.1016/j.patbio.2012.01.005. [DOI] [PubMed] [Google Scholar]
- 10.Porter S.C., Fleisher G.R., Kohane I.S., Mandl K.D. The value of parental report for diagnosis and management of dehydration in the emergency department. Ann Emerg Med. 2003;41:196–205. doi: 10.1067/mem.2003.5. [DOI] [PubMed] [Google Scholar]
- 11.Pruvost I., Dubos F., Chazard E., Hue V., Duhamel A., Martinot A. The value of body weight measurement to assess dehydration in children. PLoS One. 2013;8:e55063. doi: 10.1371/journal.pone.0055063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.King D., Morton R., Bevan C. How to use capillary refill time. Arch Dis Child Educ Pract Ed. 2014;99:111–116. doi: 10.1136/archdischild-2013-305198. [DOI] [PubMed] [Google Scholar]
- 13.Gorelick M.H., Shaw K.N., Murphy K.O. Validity and reliability of clinical signs in the diagnosis of dehydration in children. Pediatrics. 1997;99:E6. doi: 10.1542/peds.99.5.e6. [DOI] [PubMed] [Google Scholar]
- 14.Steiner M., Darren D., Byerley J. Is this child dehydrated. JAMA. 2004;291:2746–2754. doi: 10.1001/jama.291.22.2746. [DOI] [PubMed] [Google Scholar]
- 15.Duggan C., Refat M., Hashem M., Wolff M., Fayad I., Santosham M. How valid are clinical signs of dehydration in infants? J Pediatr Gastroenterol Nutr. 1996;22:56–61. doi: 10.1097/00005176-199601000-00009. [DOI] [PubMed] [Google Scholar]
- 16.Shavit I., Brant R., Nijssen-Jordan C., Galbraith R., Johnson D.W. A novel imaging technique to measure capillary-refill time: improving diagnostic accuracy for dehydration in young children with gastroenteritis. Pediatrics. 2006;118:2402–2408. doi: 10.1542/peds.2006-1108. [DOI] [PubMed] [Google Scholar]
- 17.Friedman J.N., Goldman R.D., Srivastava R., Parkin P.C. Development of a clinical dehydration scale for use in children between 1 and 36 months of age. J Pediatr. 2004;145:201–207. doi: 10.1016/j.jpeds.2004.05.035. [DOI] [PubMed] [Google Scholar]
- 18.American Academy of Pediatrics, Provisional Committee on Quality Improvement, Subcommittee on Acute Gastroenteritis. [No authors listed] Practice parameter: the management of acute gastroenteritis in young children. Pediatrics 1996;97:424–35. [PubMed]
- 19.King C.K., Glass R., Bresee J.S., Duggan C. Centers for Disease Control and Prevention. Managing acute gastroenteritis among children: oral rehydration, maintenance, and nutritional therapy. MMWR Recomm Rep. 2003;52(RR–16):1–16. [PubMed] [Google Scholar]
- 20.Colletti J.E., Brown K.M., Sharieff G.Q., Barata I.A., Ishimine P. The management of children with gastroenteritis and dehydration in the emergency department. J Emerg Med. 2010;38:686–698. doi: 10.1016/j.jemermed.2008.06.015. [DOI] [PubMed] [Google Scholar]
- 21.World Health Organization . World Health Organization; Geneva: 2005. Pocket book of hospital care for children: guidelines for the management of common illnesses with limited resources. [Google Scholar]
- 22.Goldman R.D., Friedman J.N., Parkin P.C. Validation of the clinical dehydration scale for children with acute gastroenteritis. Pediatrics. 2008;122:545–549. doi: 10.1542/peds.2007-3141. [DOI] [PubMed] [Google Scholar]
- 23.Gravel J., Manzano S., Guimont C., Lacroix L., Gervaix A., Bailey B. Validation multicentrique du score clinique de déshydratation pédiatrique. Arch Pediatr. 2010;17:1645–1651. doi: 10.1016/j.arcped.2010.09.009. [DOI] [PubMed] [Google Scholar]
- 24.Kinlin L.M., Freedman S.B. Evaluation of a clinical dehydration scale in children requiring intravenous rehydration. Pediatrics. 2012;129:e1211–e1219. doi: 10.1542/peds.2011-2985. [DOI] [PubMed] [Google Scholar]
- 25.Rebella G. Clinical dehydration scale appears valid, but its impact on clinical outcomes is not clear. J Pediatr. 2009;154:464. doi: 10.1016/j.jpeds.2008.11.048. [DOI] [PubMed] [Google Scholar]
- 26.Levine A.C., Shah S.P., Umulisa I., Munyaneza R.B., Dushimiyimana J.M., Stegmann K. Ultrasound assessment of severe dehydration in children with diarrhea and vomiting. Acad Emerg Med. 2010;17:1035–1041. doi: 10.1111/j.1553-2712.2010.00830.x. [DOI] [PubMed] [Google Scholar]
- 27.Chen L., Hsiao A., Langhan M., Riera A., Santucci K.A. Use of bedside ultrasound to assess degree of dehydration in children with gastroenteritis. Acad Emerg Med. 2010;17:1042–1047. doi: 10.1111/j.1553-2712.2010.00873.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Vega R.M., Avner J.R. A prospective study of the usefulness of clinical and laboratory parameters for predicting percentage of dehydration in children. Pediatr Emerg Care. 1997;13:179–182. doi: 10.1097/00006565-199706000-00001. [DOI] [PubMed] [Google Scholar]
- 29.Yilmaz K., Karabocuoglu M., Citak A., Uzel N. Evaluation of laboratory tests in dehydrated children with acute gastroenteritis. J Pediatr Child Health. 2002;38:226–228. doi: 10.1046/j.1440-1754.2002.00792.x. [DOI] [PubMed] [Google Scholar]
- 30.Lo Vecchio A., Giannattasio A., Duggan C. Evaluation of the quality of guidelines for acute gastroenteritis in children with the AGREE instrument. J Pediatr Gastroenterol Nutr. 2011;52:183–189. doi: 10.1097/MPG.0b013e3181e233ac. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Fonseca B.K., Holdgate A., Craig J.C. Enteral vs intravenous rehydration therapy for children with gastroenteritis: a meta-analysis of randomized controlled trials. Arch Pediatr Adolesc Med. 2004;158:483–490. doi: 10.1001/archpedi.158.5.483. [DOI] [PubMed] [Google Scholar]
- 32.Hartling L., Bellemare S., Wiebe N., Russell K.F., Klassen T.P., Craig W.R. Oral versus intravenous rehydration for treating dehydration due to gastroenteritis in children. Cochrane Database Syst Rev. 2006;(3):CD004390. doi: 10.1002/14651858.CD004390.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Piescik-Lech M., Shamir R., Guarino A., Szajewska H. The management of acute gastroenteritis in children. Aliment Pharmacol Ther. 2013;37:289–303. doi: 10.1111/apt.12163. [DOI] [PubMed] [Google Scholar]
- 34.Hopper S.M. A practical guide to successful rehydration. Clin Pediatr Emerg Med. 2010;11:153–162. [Google Scholar]
- 35.Nager A.L., Wang V.J. Comparison of nasogastric and intravenous methods of rehydration in pediatric patients with acute dehydration. Pediatrics. 2002;109:566–572. doi: 10.1542/peds.109.4.566. [DOI] [PubMed] [Google Scholar]
- 36.Sharifi J., Ghavami F., Nowrouzi Z., Fouladvand B., Malek M., Rezaeian M. Oral versus intravenous rehydration therapy in severe gastroenteritis. Arch Dis Child. 1985;60:856–860. doi: 10.1136/adc.60.9.856. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Santucci K.A., Anderson A.C., Lewander W.J., Linakis J.G. Frozen oral hydration as an alternative to conventional enteral fluids. Arch Pediatr Adolesc Med. 1998;152:142–146. doi: 10.1001/archpedi.152.2.142. [DOI] [PubMed] [Google Scholar]
- 38.Powell C.V., Priestley S.J., Young S., Heine R.G. Randomized clinical trial of rapid versus 24-hour rehydration for children with acute gastroenteritis. Pediatrics. 2011;128:e771–e778. doi: 10.1542/peds.2010-2483. [DOI] [PubMed] [Google Scholar]
- 39.Holliday M.A., Ray P.E., Friedman A.L. Fluid therapy for children: facts, fashions and questions. Arch Dis Child. 2007;92:546–550. doi: 10.1136/adc.2006.106377. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Neville K.A., Verge C.F., Rosenberg A.R., O’Meara M.W., Walker J.L. Isotonic is better than hypotonic saline for intravenous rehydration of children with gastroenteritis: a prospective randomised study. Arch Dis Child. 2006;91:226–232. doi: 10.1136/adc.2005.084103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Neville K., Verge C., Rosenberg A., O’Meara M., Walker J. Is hyperchloraemic acidosis a problem in children with gastroenteritis rehydrated with normal saline? Authors’ reply. Arch Dis Child. 2007;92:466–467. doi: 10.1136/adc.2006.114876. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Hahn R.G. Should anaesthetists stop infusing isotonic saline? Br J Anaesth. 2014;112:4–6. doi: 10.1093/bja/aet292. [DOI] [PubMed] [Google Scholar]
- 43.Nager A.L., Wang V.J. Comparison of ultrarapid and rapid intravenous hydration in pediatric patients with dehydration. Am J Emerg Med. 2010;28:123–129. doi: 10.1016/j.ajem.2008.09.046. [DOI] [PubMed] [Google Scholar]
- 44.Freedman S.B., Parkin P.C., Willan A.R., Schuh S. Rapid versus standard intravenous rehydration in paediatric gastroenteritis: pragmatic blinded randomised clinical trial. Br Med J. 2011;343:d6976. doi: 10.1136/bmj.d6976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Hunter B.R., Seupaul R.A. Rapid rehydration is not better than standard IV hydration in dehydrated pediatric patients with gastroenteritis. J Pediatr. 2012;160:885–886. doi: 10.1016/j.jpeds.2012.01.066. [DOI] [PubMed] [Google Scholar]
- 46.Assadi F., Copelovitch L. Simplified treatment strategies to fluid therapy in diarrhea. Pediatr Nephrol. 2003;18:1152–1156. doi: 10.1007/s00467-003-1303-1. [DOI] [PubMed] [Google Scholar]
- 47.MacGillivray S., Fahey T., McGuire W. Lactose avoidance for young children with acute diarrhoea. Cochrane Database Syst Rev. 2013;(10):CD005433. doi: 10.1002/14651858.CD005433.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Chouraqui J.P., Michard-Lenoir A.P. Alimentation au cours des diarrhées aiguës du nourrisson et du jeune enfant. Arch Pediatr. 2007;14(Suppl. 3):S176–S180. doi: 10.1016/s0929-693x(07)80024-8. [DOI] [PubMed] [Google Scholar]
- 49.Freedman S.B., Ali S., Oleszczuk M., Gouin S., Hartling L. Treatment of acute gastroenteritis in children: an overview of systematic reviews of interventions commonly used in developed countries. Evid Based Child Health. 2013;8:1123–1137. doi: 10.1002/ebch.1932. [DOI] [PubMed] [Google Scholar]
- 50.Carter B., Fedorowicz Z. Antiemetic treatment for acute gastroenteritis in children: an updated Cochrane systematic review with meta-analysis and mixed treatment comparison in a Bayesian framework. BMJ Open. 2012:2. doi: 10.1136/bmjopen-2011-000622. [pii:e000622] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Freedman S.B., Sivabalasundaram V., Bohn V., Powell E.C., Johnson D.W., Boutis K. The treatment of pediatric gastroenteritis: a comparative analysis of pediatric emergency physicians’ practice patterns. Acad Emerg Med. 2011;18:38–45. doi: 10.1111/j.1553-2712.2010.00960.x. [DOI] [PubMed] [Google Scholar]
- 52.Pelc R, Redant S, Lor J, Oostenbrink R, Angoulvant F. Gastroentérite aigüe et urgences pédiatriques : enquête multicentrique sur les pratiques 2012. www.gfrup.com/JPU12_angoulvant.
- 53.Lehert P., Cheron G., Calatayud G.A. Racecadotril for childhood gastroenteritis: an individual patient data meta-analysis. Dig Liver Dis. 2011;43:707–713. doi: 10.1016/j.dld.2011.03.001. [DOI] [PubMed] [Google Scholar]
- 54.UNICEF et OMS. Déclaration commune sur la prise en charge clinique de la diarrhée aiguë. 2004. http://www.unicef.org/french/publications/index_21433.html.
- 55.Freedman S.B., Keating L.E., Rumatir M., Schuh S. Health care provider and caregiver preferences regarding nasogastric and intravenous rehydration. Pediatrics. 2012;130:e1504–e1511. doi: 10.1542/peds.2012-1012. [DOI] [PubMed] [Google Scholar]
- 56.Nunez J., Liu D.R., Nager A.L. Dehydration treatment practices among pediatrics-trained and non-pediatrics trained emergency physicians. Pediatr Emerg Care. 2012;28:322–328. doi: 10.1097/PEC.0b013e31824d8b26. [DOI] [PubMed] [Google Scholar]
- 57.Karpas A., Finkelstein M., Reid S. Parental preference for rehydration method for children in the emergency department. Pediatr Emerg Care. 2009;25:301–306. doi: 10.1097/PEC.0b013e3181a34144. [DOI] [PubMed] [Google Scholar]
- 58.Albano F., Lo Vecchio A., Guarino A. The applicability and efficacy of guidelines for the management of acute gastroenteritis in outpatient children: a field-randomized trial on primary care pediatricians. J Pediatr. 2010;156:226–230. doi: 10.1016/j.jpeds.2009.07.065. [DOI] [PubMed] [Google Scholar]
- 59.Zolotor A.J., Randolph G.D., Johnson J.K., Wegner S., Edwards L., Powell C. Effectiveness of a practice-based, multimodal quality improvement intervention for gastroenteritis within a Medicaid managed care network. Pediatrics. 2007;120:e644–e650. doi: 10.1542/peds.2006-1749. [DOI] [PubMed] [Google Scholar]
- 60.Vesikari T., Van Damme P., Giaquinto C., Gray J., Mrukowicz J., Dagan R. ESPGHAN/ESPID evidence-based recommendations for rotavirus vaccination. Eur J Pediatr Gastroenterol Nutr. 2008;46:S38–S48. doi: 10.1097/MPG.0b013e31816f7a10. [DOI] [PubMed] [Google Scholar]
- 61.Haut Conseil de la santé publique. Avis relatif à la vaccination des nourrissons vis-à-vis des gastroentérites à rotavirus. 29 novembre 2013. http://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clefr=405.
- 62.Weintraub E.S., Baggs J., Duffy J. Risk of intussusception after monovalent rotavirus vaccination. N Engl J Med. 2014;370:513–519. doi: 10.1056/NEJMoa1311738. [DOI] [PubMed] [Google Scholar]
- 63.Yih W.K., Lieu T.A., Kulldorff M., Martin D., McMahill-Walraven C.N., Platt R. Intussusception risk after rotavirus vaccination in US infants. N Engl J Med. 2014;370:503–512. doi: 10.1056/NEJMoa1303164. [DOI] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.
Supplementary Materials
Arthur, 8 mesi.


Informazioni ai genitori in caso di diarrea acuta nei lattanti.


Dati complementari.




