Abstract
El asma es la enfermedad crónica más frecuente de la infancia. El diagnóstico suele ser fácil cuando se producen episodios de disnea espiratoria con sibilancias reversibles de forma espontánea o mediante el uso de broncodilatadores. Las radiografías de tórax, la exploración funcional respiratoria y el estudio alérgico constituyen el aspecto fundamental de las pruebas complementarias necesarias. El tratamiento de la crisis consiste en el uso de β2-adrenérgicos inhalados y, si es necesario, corticoides orales. El tratamiento de fondo tiene como objetivo limitar al máximo los síntomas y restaurar o mantener las funciones pulmonares normales. Se debe adaptar a la gravedad y al control de la enfermedad y los corticoides inhalados tienen un papel de elección.
Palabras Clave: Asma, Exacerbación, Broncodilatadores, Corticoides inhalados
Introducción
El asma, con una prevalencia del 8-10%, es la enfermedad crónica más frecuente de la infancia. De forma paradójica, también es una enfermedad que sufre retrasos diagnósticos y, por tanto, retrasos en cuanto al tratamiento, que a veces es insuficiente. Los progresos referentes a los mecanismos fisiopatológicos, así como la mejora de las estrategias terapéuticas centradas en la inflamación, deben permitir en el futuro que los niños asmáticos lleven una vida (casi) normal, a la vez que se conserva o se restaura su reserva funcional respiratoria.
El asma se puede considerar la resultante del entorno sobre un paciente predispuesto y los estudios sobre la genética del asma son muy numerosos, incluso aunque hasta el momento sólo han podido identificar los genes de susceptibilidad[1]. El asma de los niños mayores adquiere sus elementos característicos a partir de los 2 o 3 años. Antes de los 3 años, se habla del asma del lactante. De los 3 a los 5-6 años (niño de edad preescolar), las diferencias con el asma de los niños mayores se atenúan de forma progresiva. Desde un punto de vista práctico, se distingue esencialmente el asma del niño mayor, cuya definición tiende a confundirse con el del adulto, y el asma del lactante, cuya definición es clínica.
Asma en niños mayores
Definición
La definición del asma infantil insiste en el aspecto fisiopatológico. El asma es «una enfermedad inflamatoria crónica de las vías respiratorias en la que intervienen numerosas células, sobre todo los mastocitos, los eosinófilos y los linfocitos T. En las personas predispuestas, esta inflamación provoca síntomas recidivantes de sibilancias, disnea y tos, en especial por la noche y a primera hora de la mañana. Estos síntomas suelen asociarse a una obstrucción difusa, pero variable, de las vías respiratorias, que es al menos parcialmente reversible, ya sea de forma espontánea o bien con tratamiento. La inflamación también provoca un aumento de la reactividad de las vías respiratorias a numerosos estímulos».
Manifestaciones clínicas
Manifestaciones habituales
Es el principal motivo de consulta y su desarrollo suele corresponder a un modo estereotípico. El inicio pocas veces es súbito, sino que en la mayoría de las ocasiones la crisis comienza de forma progresiva por la tarde o al final del mediodía, precedida a veces de pródromos. Éstos varían según los niños, pero casi siempre son iguales en el mismo niño: rinorrea clara acuosa, tos seca en quintas. En este estadio, existe una disminución del flujo espiratorio máximo (FEM). La disnea, que al principio es silenciosa, después se vuelve ruidosa y, sobre todo, con sibilancias y un predominio espiratorio. La tos es frecuente y puede acompañarse de vómitos que conllevan un riesgo de comprometer la absorción de fármacos. Puede convertirse en productiva y dar lugar a una expectoración hiperviscosa. En la exploración, el niño está sentado o en bipedestación, inclinado hacia delante o incluso tumbado, a menudo angustiado. Las sibilancias pueden escucharse a distancia. En la palpación se percibe la hipersecreción a nivel del tórax; se debe buscar de forma sistemática en las zonas supra e infraclaviculares la presencia de una crepitación similar a la de la nieve debido a un enfisema subcutáneo. El tórax aparece distendido en inspiración e hipersonoro. La espiración es activa, lenta y ruidosa. La auscultación es característica enseguida, con numerosos estertores crepitantes bronquiales y, sobre todo, estertores sibilantes de predominio espiratorio. La temperatura suele ser normal. Sólo la existencia de una fiebre elevaba debe hacer que se busque una causa infecciosa de la crisis. La respuesta inicial a los broncodilatadores, la naturaleza y la intensidad de los síntomas permiten clasificar la crisis como leve, moderada o grave (Cuadro I ).
Cuadro I.
Clasificación de la gravedad de una crisis de asma
| Crisis leve | Crisis moderada | Crisis grave | Paro respiratorio inminente | |
|---|---|---|---|---|
| Disnea |
|
|
|
|
| Prefiere la posición sentada | Posición sentada | |||
| Elocución | Mantiene una conversación | Frases | Algunas palabras | |
| Frecuencia respiratoria | Aumentada | Aumentada | Aumentada | |
| (FR normal en el niño despierto: < 2 meses < 60/min; 2-12 meses < 50/min; 1-5 años < 40/min; 6-8 años < 30/min) | ||||
| Tiraje | No | Sí | Intenso | Balanceo toracoabdominal |
| Sibilancias | Moderadas, al final de la espiración | Considerables | En las dos fases | Abolidas |
| Conciencia | Posible agitación | Agitación frecuente | Agitación frecuente | Somnoliento o confuso |
| Frecuencia cardíaca | Normal | 100-120/min | > 120/min | Bradicardia |
| (FC normal en los niños: 2-12 meses < 160/min; 1-2 años < 120/min; 2-8 años < 110/min) | ||||
| Presión arterial (PA) | Normal | Normal | Disminuida | Disminuida |
| (Valores de referencia de PA sistólica-diastólica en mmHg: 3-5 años: 68-36; 6-8 años: 78-41; 10-11 años: 82-44) | ||||
| Pulso paradójico | Ausente < 10 mmHg | En ocasiones presente: 10-15 mmHg | A menudo presente: 20-40 mmHg | Ausencia, traduce un agotamiento |
| SpO2 | ≥95% | 91-94% | <91% | |
|
≥80% | 50-80% |
|
|
| Gasometría | Inútil | Generalmente inútil | ||
| PaO2 | Normal | >60 mmHg | <60 mmHg | |
| PaCO2 | <42 mmHg | <42 mmHg | >42 mmHg | |
Del National Heart and Blood Institute. National Asthma Education and Prevention Program Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma Full Report 2007 August 28, 2007. www.nhlbi.nih.gov. FR: frecuencia respiratoria; FC: frecuencia cardíaca; SpO2: saturación de oxígeno de la hemoglobina mediante pulsioximetría. FEM: flujo espiratorio máximo; PaO2: presión parcial de oxígeno en la sangre arterial; PaCO2: presión parcial de CO2 en la sangre arterial.
En teoría, la disnea cede de forma espontánea en unas horas, pero casi siempre se acorta en gran medida con los tratamientos apropiados. El retorno de la respiración y auscultación normales no es inmediato, pues se pueden observar algunas sibilancias que se trata en realidad de un cuadro de asma.
La exacerbación se define como la presencia de síntomas agudos que duran más de 24 horas y que requieren un cambio de tratamiento[2]. La exacerbación grave se define por la necesidad de tomar corticoides orales y de recurrir a la asistencia sanitaria. En la actualidad, este término tiende a sustituir al de crisis de asma, que se definía como un episodio paroxístico de cualquier duración. Los síntomas de corta duración (menos de 24 h) traducen en la mayoría de las ocasiones el control diario del asma. La crisis puede traducirse por uno solo de estos tres signos cardinales: tos, sibilancias o taquipnea.
Asma aguda grave
Más que de status asmaticus, es preferible hablar de asma aguda grave. Se trata de una crisis refractaria al tratamiento broncodilatador inicial realizado correctamente. Por tanto, el primer signo de alarma es la ausencia de respuesta a los broncodilatadores. Los factores de riesgo se resumen en el Cuadro II . Se pueden observar numerosos criterios en el propio domicilio del niño. El asma aguda grave requiere un tratamiento urgente.
Cuerpo extraño inhalado en el bronquio principal izquierdo. Lactante de 20 meses con bronquiolitis repetidas. El inicio de la primera crisis fue súbito, sin rinitis. Persistencia de obstrucción entre las crisis. Radiografía en inspiración (a) y espiración (b): hiperclaridad pulmonar izquierda.

Cuadro II.
Factores de asma aguda grave en la edad infantil
| Signos clínicos de gravedad extrema | Trastornos del nivel de conciencia |
| Pausas respiratorias | |
| Colapso | |
| Silencio auscultatorio | |
| Factores relacionados con el carácter de la crisis | Crisis desencadenadas por los alimentos, un fármaco (aspirina), la anestesia, estrés psicológico, etcétera |
| Crisis percibida como inhabitual (evolución rápida o signos de gravedad) | |
| Dificultad de elocución, ortopnea, agitación, diaforesis, cianosis | |
| Contracción permanente del esternocleidomastoideo | |
| FR > 30/min en mayores de 5 años, > 40/min en niños de 2-5 años | |
| FEM < 50%: crisis grave; FEM < 33%: crisis de AAG | |
| Normocapnia o hipercapnia | |
| Hipotensión arterial, PA sistólica - PA diastólica inferiores a: | |
| - 68-36 mmHg a los 3-5 años | |
| - 78-41 mmHg a los 7-8 años | |
| - 82-44 mmHg a los 8-11 años | |
| Factores relacionados con los hechos recientes | Síndrome de amenaza (reconocido y tratado a tiempo, permitiría evitar llegar al estadio de AAG): |
| - aumento de la frecuencia y de la gravedad de las crisis | |
| - menor respuesta a los tratamientos habituales, períodos intercríticos cada vez menos asintomáticos | |
| Factores relacionados con las características del paciente | Asma inestable |
| Asma con un tratamiento insuficiente | |
| Mala percepción de la obstrucción | |
| Antecedente de hospitalización por una crisis grave, sobre todo en reanimación | |
| Edad < 4 años y adolescentes | |
| Negación de la enfermedad, ausencia de cumplimiento | |
| Problemas sociopsicológicos del niño o de la célula familiar |
FR: frecuencia respiratoria; FEM: flujo espiratorio máximo; PA: presión arterial; AAG: asma aguda grave.
Complicaciones
Trastornos de ventilación
Lactante de 8 meses con obstrucción persistente.
a. Doble indentación esofágica en el tránsito esofagogastroduodenal (flechas).
b. Demostración de un doble cayado aórtico en la tomografía computarizada (TC) con contraste.

Un tapón mucoso puede obstruir un bronquio segmentario o lobar (en especial, el del lóbulo medio) y en menos ocasiones un bronquio principal, ramificarse a nivel distal, produciendo una impactación mucoide rica en polimorfonucleares eosinófilos y en cristales de Charcot-Leyden y causar una atelectasia o enfisema obstructivo. La evolución suele ser favorable con tratamiento. Si éste fracasa,
Secuela grave de una viriasis respiratoria.
Iconografía adicional 8a. Síndrome de MacLeod con un pequeño pulmón claro unilateral (hiperclaridad izquierda).
Iconografía adicional 8b. Imagen de tomografía computarizada (TC) donde se observa una atelectasia completa con dilatación de los bronquios del lóbulo inferior izquierdo. Hiperclaridad con hipoperfusión considerable del lóbulo superior izquierdo.

puede estar indicado realizar una endoscopia bronquial.
Neumomediastino, enfisema subcutáneo y neumotórax
El diagnóstico se sospecha cuando existe un cuadro de dolor retroesternal irradiado al brazo y al cuello, que se agrava por los movimientos respiratorios y, en ocasiones, por la deglución. Se suele asociar a un enfisema subcutáneo cuyo signo clínico esencial es la percepción de una crepitación similar a la de la nieve en la región cervical y torácica superior, dolorosa a la palpación. El neumomediastino se traduce en la radiografía pulmonar por hiperclaridades lineales verticales, a lo largo del mediastino y de los contornos cardíacos, con elevación de las dos hojas pleurales, mientras que el enfisema subcutáneo provoca imágenes claras subcutáneas cervicales o parietales. Se trata de complicaciones normalmente benignas del asma; su tratamiento coincide con el de la exacerbación y su desaparición se logra en unos días. Sin embargo, la hospitalización del niño es indispensable, debido al riesgo de neumotórax. El neumotórax, con independencia de si se debe a un neumomediastino o a una ruptura de una bulla pleural, es una complicación infrecuente.
Parada cardíaca anóxica
Se observa con más frecuencia en adolescentes que siguen mal su tratamiento o en quienes éste es insuficiente, al final de un deterioro progresivo del estado respiratorio al que no se ha prestado atención, de una duración que varía de varios días a varias semanas y, en menos ocasiones, en crisis muy graves cuyo inicio ha sido muy súbito.
Equivalentes de asma
No es infrecuente que las manifestaciones menos llamativas que la crisis sean la sintomatología predominante.
Tos y traqueítis espasmódicas
La tos crónica es un motivo habitual de consulta en pediatría sin que tenga relación con el asma. Puede estar relacionada con infecciones virales recidivantes de las vías respiratorias superiores y/o inferiores, a una enfermedad otorrinolaringológica (ORL) persistente o a un reflujo gastroesofágico. La tos espasmódica equivalente de asma se suele traducir por episodios de tos seca, a menudo de predominio nocturno, sobre todo en la última parte de la noche, pero también con la risa, durante episodios de enfado o de emociones, al interrumpir un esfuerzo o con el cambio de tiempo y son poco o nada sensibles a los tratamientos sintomáticos habituales.
Para relacionar una tos crónica aislada con un cuadro de asma, deben coincidir varios elementos:
-
•
episodios de tos seca, a menudo de predomino nocturno, sobre todo en la última parte de la noche, pero también con la risa, durante episodios de enfado o de emociones, al interrumpir un esfuerzo o con el cambio de tiempo y poco o nada sensibles a los tratamientos sintomáticos habituales;
-
•
positividad del estudio cutáneo alergológico;
-
•
presencia de una obstrucción bronquial basal, reversible tras el uso de broncodilatadores. La búsqueda de una hiperreactividad bronquial inespecífica es útil, pero parece menos discriminante;
-
•
positividad del tratamiento de prueba.
Al igual que en todos los niños, la tos crónica puede estar relacionada con infecciones virales recidivantes de las vías respiratorias superiores y/o inferiores, con una enfermedad ORL resistente o a un cuadro de reflujo gastroesofágico.
Bronquitis repetidas
Se producen sobre todo en niños menores de 6 años. Corresponden a manifestaciones de inflamación bronquial, de predominio en otoño e invierno y en relación con una hiperreactividad bronquial inespecífica, en ocasiones inducida por virus. La sintomatología es bastante estereotipada, con rinorrea, tos (bastante a menudo productiva), obstrucción respiratoria y, con mucha frecuencia, la percepción en la auscultación de estertores bronquiales o estertores sibilantes, con o sin fiebre.
Focos recidivantes
En los niños que presenten bronquitis recidivantes, no es infrecuente que las radiografías muestren focos pulmonares recidivantes o persistentes. El territorio que se afecta con más frecuencia es el lóbulo medio, con un borramiento del borde derecho del corazón. Si se realiza una fibroendoscopia bronquial, se observa un orificio lobar medio libre o, simplemente, con inflamación y secreciones.
Laringitis recidivantes
Indican la existencia de una hiperexcitabilidad de las vías respiratorias inferiores, con disnea laríngea afebril, de inicio y final bruscos, que aparecen de forma preferente en el período invernal.
Manifestaciones de esfuerzo
La aparición de molestias con el esfuerzo también es un motivo frecuente de consulta. El asma (broncoespasmo) inducida por el esfuerzo (AIE) se caracteriza por disnea, tos, opresión respiratoria y sibilancias, que suelen aparecer 5-10 minutos tras la interrupción de un esfuerzo físico intenso. En ocasiones, sólo aparece la tos. Aunque por lo general el cuadro de AIE aparece después de interrumpir el esfuerzo, también puede observarse durante el mismo. La AIE es distinta de una disnea indicativa de una falta de forma física, pero no siempre es fácil distinguir ambos cuadros. La AIE no debe confundirse con una anafilaxia inducida por el esfuerzo, tanto si es dependiente o no de una sensibilización alimentaria. En caso de duda, el diagnóstico se basa en la realización de una prueba de esfuerzo.
Diagnostico positivo
El diagnóstico de asma suele ser evidente cuando se asiste a la crisis. Pasado un tiempo de la crisis, el estudio inicial consta, además de la búsqueda de factores desencadenantes, de radiografías de tórax, la evaluación de elementos atópicos y la realización de pruebas funcionales respiratorias (PFR).
Búsqueda de factores desencadenantes
La anamnesis permite, en especial, estudiar los factores desencadenantes de la crisis: infecciones virales (en especial los rinovirus), contactos alérgenos, ejercicio físico mal controlado (carrera a pie), emociones, enfados, contaminación (incluido el humo de cigarrillos), cambio de tiempo o de clima. Algunas circunstancias también conllevan un riesgo de asma: vuelta al colegio, viajes, regreso al domicilio después de las vacaciones, regreso de una cura o estancia climática. Se debe destacar también la posibilidad de crisis al salir del hospital, después de una crisis y/o estudio. Los impactos psicoafectivos, sobre todo en situación de estrés crónico, aumentan el riesgo de las crisis.
Exploraciones radiológicas
Es indispensable realizar radiografías de tórax en proyección frontal, en inspiración y espiración forzadas durante el estudio inicial. Deben ser normales. Forman parte del diagnóstico diferencial y en ellas deben buscarse signos de asma grave (deformación y distensión torácica, mal vaciamiento espiratorio).
Valoración del contexto atópico
El componente hereditario de la atopia está claramente establecido[3]. El 80-90% de los niños asmáticos son atópicos y tienen al menos un resultado positivo de una prueba cutánea[4].
Anamnesis
La existencia de rasgos atópicos se define, por una parte, por la presencia de asma, polinosis, eccema, alergia alimentaria en los progenitores o en la fratría y/o de antecedentes personales de dermatitis atópica o de alergia alimentaria.
Pruebas cutáneas
Su utilidad es fundamental. Sus resultados completan la anamnesis y la exploración física. Las pruebas de punción constituyen el método de referencia. La técnica es simple, rápida e indolora, pero requiere un gran rigor en su ejecución. Se realizan con el niño en estado estable después de interrumpir los antihistamínicos H1. La positividad de una prueba cutánea debe interpretarse respecto a un control negativo (solución de glicerina al 50%) y positiva (histamina, 1 mg/ml y fosfato de codeína al 9%). Una prueba cutánea se considera positiva si el diámetro de la induración es superior a 3 mm y mayor del 50% del control positivo.
En los niños mayores, los alérgenos responsables más frecuentes son los ácaros, seguidos por los epitelios de animales (sobre todo el gato), los pólenes de gramíneas y después las cucarachas y los mohos. Los principales alérgenos usados en las pruebas se resumen en el Cuadro III . Las alergias alimentarias pocas veces son causas aisladas de crisis de asma.
Cuadro III.
Batería habitual de pruebas cutáneas en la edad pediátrica
| Siempre |
| - Controles positivos: fosfato de codeína e histamina |
| - Control negativo |
| Niños menores de 2 años |
| - Dermatophagoides pteronyssinus, Dermatophagoides farinae |
| - Gato, perro |
| - Leche entera |
| - Huevo (entero, amarillo, blanco) |
| - Cacahuete |
| - Soja |
| - Pescado |
| - Nuez, trigo y en función del contexto |
| Niños de 2-5 años |
| - En caso de síntomas respiratorios aislados: |
| - Dermatophagoides pteronyssinus y D. farinae |
| - Gato, perro, caballo |
| - Cinco pólenes de gramíneas |
| - Betuláceas y en función del contexto |
| - En caso de antecedentes o de dermatitis atópica con síntomas respiratorios: hacer además pruebas de alérgenos alimentarios |
| Niños mayores de 5 años |
| - Dermatophagoides pteronyssinus y D. farinae |
| - Gato, perro |
| - Cinco pólenes de gramíneas |
| - Abedul o betuláceas |
| - Mezcla de mohos, Altenaria, Cladosporium |
| - Cucaracha |
| - Caballo en función del contexto |
| - Cacahuete |
Pruebas biológicas
Argumentos a favor de un rasgo atópico.
-
•
Eosinofilia sanguínea ≥ 400 /mm3.
-
•
Elevación de las inmunoglobulinas E (IgE) séricas.
El límite superior de los valores de referencia puede estimarse de forma arbitraria en 20 U/ml por año de edad, hasta los 12 años.
Identificación de los alérgenos responsables. Las pruebas multialergénicas (PMA) pueden ser útiles para detectar una alergia ante una sintomatología respiratoria atípica o cuando las pruebas cutáneas son irrealizables o ininterpretables (tratamiento antihistamínico activo, dermografismo, dermatosis extensa). Las IgE específicas son útiles en caso de discordancia entre la clínica y las pruebas cutáneas.
PMA. La mayor parte de las PMA proporciona una respuesta global para los neumoalérgenos o para los alimentos. Las PMA a los neumoalérgenos cubren al menos el 95% de las posibilidades etiológicas para una afección como el asma alérgica. Para las PMA a los alimentos habituales (por ejemplo, la correspondiente a seis trofoalérgenos: leche, huevo, pescado, soja, cacahuete, trigo), el porcentaje de cobertura es similar.
Los otros dos tipos de PMA son de respuesta específica cualitativa o semicuantitativa. Estas pruebas no aportan por lo general elementos suplementarios en comparación con las pruebas de punción y son más caras. Su interpretación es complicada y algunos métodos son poco reproducibles en ocasiones.
Los resultados correlacionan bien con las pruebas cutáneas, sobre todo para los neumoalérgenos. En caso de IgE totales superiores a 3.000 UI/ml, los resultados pueden ser falsamente positivos.
Determinaciones unitarias. Las IgE específicas pueden determinarse mediante los métodos radioinmunológico o inmunoenzimático. Los resultados se presentan en Phadebas RAST Unit (PRU)/ml o en UI/ml convertibles en clases de 0 a VI. Un resultado superior a 0,35 UI o PRU se considera significativo. Se suelen utilizar tres métodos: el CAPsystem y el Phadezym (revelado por un anti-IgE marcado con β-galactosidasa) y el Phadebast Rast (revelado mediante un marcado con yodo radiactivo). Existe una buena correlación entre las pruebas cutáneas de alergia y las IgE específicas, en especial para los neumoalérgenos habituales.
Pruebas funcionales respiratorias
Las PFR son indispensables para el tratamiento del asma. La elección de las pruebas que se deben realizar depende de la edad del niño: medición de las resistencias de las vías respiratorias mediante pletismografía (Raw), de las resistencias totales del sistema respiratorio (Rrs) por interrupciones intermitentes del flujo de la corriente aérea o con la técnica de las oscilaciones forzadas; maniobras forzadas, espirometría y curvas de flujo-volumen a partir de los 6-7 años de edad.
Las PFR tienen poca utilidad durante una crisis (confirmarían el síndrome obstructivo y la distensión torácica), pero son obligatorias en el período intercrítico.
-
•
La búsqueda de una hiperreactividad bronquial inespecífica o la reversibilidad del broncoespasmo con la inhalación de β2-adrenérgicos son útiles sobre todo cuando el diagnóstico de asma es incierto. Desde el punto de vista diagnóstico, las PFR pueden poner de manifiesto un síndrome obstructivo de base reversible tras los broncodilatadores (mejora del 12% del volumen espiratorio máximo/segundo [VEMS] y de más del 40% de las resistencias)[5]. El umbral de reactividad corresponde a la dosis de metacolina que produce una disminución de al menos el 20% del VEMS o un aumento del 45% de la conductancia. La medición de la presión parcial transcutánea de oxígeno (tcPO2) puede completar o sustituir a estos métodos en los lactantes. Una disminución del 20% de la tcPO2 es significativa.
-
•
Las PFR permiten apreciar de forma objetiva el estado respiratorio. En los niños no tratados, las PFR normales en el período intercrítico permiten proponer sólo un tratamiento secuencial. Al contrario, una obstrucción intercrítica, incluso en ausencia de percepción clínica, incita a aplicar un tratamiento de fondo. En un niño que recibe tratamiento, las PFR permiten medir la eficacia real de los tratamientos prescritos y adaptar su posología. La normalización de los volúmenes y flujos gracias al tratamiento permite prever una calidad de vida excelente. Esta vigilancia debe implicar a todos los niños asmáticos, de forma anual en caso de asma bien controlado y de forma tri o cuatrimestral si se ha instaurado un tratamiento de fondo.
La medición del FEM es un complemento muy útil en la consulta o en el domicilio para medir la obstrucción bronquial. El valor se expresa en l/min y correlaciona con la estatura del niño. El aumento del FEM al menos en un 20% tras la inhalación de un broncodilatador tiene un excelente valor diagnóstico. Las variaciones circadianas mayores de un 20% del FEM indican un asma inestable. La magnitud de la disminución del FEM durante una crisis y la evaluación de la respuesta tras la administración de β2-adrenérgicos mejoran el tratamiento domiciliario.
Marcadores de la inflamación bronquial
Debido al carácter inflamatorio de la enfermedad asmática, muchos estudios se han centrado en la evaluación de los fenómenos inflamatorios y en la búsqueda de marcadores de la inflamación bronquial para el diagnóstico o la vigilancia.
-
•
Las determinaciones de los distintos mediadores, como la proteína catiónica de los eosinófilos (ECP), la histamina y los leucotrienos en el suero, las secreciones nasales o la orina, se han abandonado por ausencia de sensibilidad o de especificidad.
-
•
El enfriamiento súbito del aire espirado permite la recogida de varios mililitros de condensado. La búsqueda de marcadores de la inflamación (citocinas, metabolitos de los leucotrienos, por ejemplo) en el condensado exhalado sigue en fase de evaluación[6].
-
•
El recuento de eosinófilos en la expectoración inducida, que aumenta durante los episodios agudos, correlaciona con la obstrucción y la hiperreactividad bronquial. Disminuye bajo la influencia del tratamiento. La expectoración se induce por la inhalación de suero salino hipertónico. Por tanto, existe un riesgo de broncoespasmo, que se previene por lo general mediante β2-adrenérgicos. La técnica de la expectoración inducida es muy laboriosa y es difícil utilizarla antes de los 6 años de edad.
-
•
El óxido nítrico exhalado (eNO) es un marcador de la inflamación bronquial alérgica. Su concentración correlaciona con la hiperreactividad bronquial. Una concentración elevada se suele observar en pacientes asmáticos, sobre todo durante una crisis, y disminuye cuando se usa un tratamiento antiinflamatorio oral y/o inhalado. Existe una correlación entre el eNO y el número de eosinófilos sanguíneos, así como entre el eNO y la eosinofilia de la expectoración. La utilización del NO como parámetro del control o marcador predictivo de la aparición de exacerbaciones aún es motivo de controversia (cf infra).
En la actualidad, el eNO es el único método de evaluación no invasivo de la inflamación que puede usarse en la práctica clínica. Sin embargo, aún se requieren más estudios para precisar su papel exacto en el diagnóstico y, sobre todo, en la vigilancia del asma infantil.
Diagnóstico diferencial
No se puede hablar de asma sin descartar las otras causas de tos crónica y de disnea obstructiva (Cuadro IV ).
Cuadro IV.
Diagnóstico diferencial del asma infantil y del lactante
| Obstrucción proximal |
| - Cuerpo extraño |
| - Estenosis traqueal o bronquial |
| - Malformación broncopulmonar |
| - Tumores benignos o malignos |
| - Anomalías de los arcos aórticos, arteria pulmonar izquierda anómala |
| - Traqueo/broncomalacia |
| Obstrucción distal |
| - Mucoviscidosis |
| - Broncodisplasia pulmonar |
| - Discinesia ciliar primaria |
| - Secuelas de neumopatía viral |
| Enfermedad por inhalación |
| - Fístula traqueoesofágica |
| - Broncoaspiración |
| - Reflujo gastroesofágico |
| Bronquiectasias |
| Inmunodeficiencia (sobre todo humoral) |
| Enfermedad intersticial crónica (sobre todo en lactantes) |
| Pulmón eosinófilo |
| Cardiopatía congénita con cortocircuito izquierda-derecha |
| Insuficiencia cardíaca |
| Déficit de α1-antitripsina |
| Discinesia de las cuerdas vocales (sobre todo en adolescentes) |
| Síndrome de hiperventilación |
Algunas de ellas pueden coexistir con el asma o asociarse a hiperreactividad bronquial. Esta lista de los diagnósticos diferenciales muestra la relevancia de la exploración física completa, del estudio de los antecedentes, incluidos los neonatales (documento de salud infantil), de la curva de crecimiento pondoestatural y de las pruebas complementarias realizadas con anterioridad,
Falso asma en una niña de 13 meses. Tomografía computarizada (TC) con contraste donde se muestra la compresión de la tráquea por una arteria pulmonar izquierda anómala.

en especial de las radiografías pulmonares.
-
•
La demostración de un atrapamiento espiratorio localizado hace pensar en primer lugar en un obstáculo (sobre todo un cuerpo extraño) y debe llevar a realizar una endoscopia bronquial.
Niño de 10 años que presenta un cuadro de asma persistente desde hace 3 meses. Predominio de sibilancias en el lado derecho.
Iconografía adicional 10a. Hiperclaridad derecha que mejora en la radiografía en espiración (derecha). Imagen de la izquierda: inspiración.
Iconografía adicional 10b. Cuerpo extraño (flor de plástico) impactado en el bronquio principal derecho.

Si no hay cuerpos extraños, se deben buscar las secuelas de neumopatía viral.
-
•
La presencia de acropaquias indica en la mayoría de los casos una insuficiencia respiratoria crónica. Se puede observar en el asma grave, pero debe hacer que se busque sobre todo la existencia de bronquiectasias graves, con independencia de su causa.
-
•

-
•
Una alteración clara de la curva de crecimiento debe hacer que se busque una enfermedad más grave respiratoria, digestiva o endocrina que simule o que se asocie al asma. También hay que buscar una corticoterapia por vía general no citada por el paciente.
La discinesia de las cuerdas vocales puede simular una crisis de asma grave (tos y disnea intensa, en ocasiones sibilancias y tiraje intercostal)[7]. Este síndrome que afecta sobre todo a los adolescentes, refleja la aducción paradójica de las cuerdas vocales que se produce de forma exclusiva o principalmente durante la inspiración. No es fácil, durante una crisis, demostrar mediante laringoscopia el cierre paradójico de los dos tercios anteriores de la glotis y/o en la curva flujo/volumen (aspecto recortado) de la curva inspiratoria. La atención se centra en el desencadenamiento emocional de las «crisis de asma», pues su gravedad aparente contrasta con una saturación de oxígeno en la sangre arterial (SaO2) normal y una ausencia de distensión en las radiografías de tórax, la variabilidad inexplicada de las funciones respiratorias y, sobre todo, la resistencia a los tratamientos antiasmáticos de fondo y de las crisis. La coexistencia frecuente en la población neumoalergológica pediátrica de una disfunción de las cuerdas vocales y de asma puede causar un temible exceso terapéutico. Como sucede con la tos psicógena, no se debe considerar al paciente como un simulador. La discinesia de las cuerdas vocales tiene en la mayoría de las ocasiones, aunque no siempre, causas psicológicas y su mecanismo se ejerce a nivel subconsciente.
-
•
El diagnóstico de síndrome de hiperventilación pulmonar es difícil en ocasiones, porque los síntomas pueden asociarse a un asma auténtica. El diagnóstico se basa sobre todo en la anamnesis, complementada con un cuestionario estandarizado[8]. En ocasiones, se requiere una prueba de hiperventilación para reproducir los signos atípicos.
Tratamiento
Tratamiento de la crisis
El tratamiento debe instaurarse lo antes posible. El establecimiento de un plan de acción escrito y explicado debe permitir que los progenitores reconozcan y traten la crisis desde los pródromos en función de la gravedad.
Tratamiento en el domicilio
En las Figuras 1 y 2 se resumen los algoritmos del tratamiento inicial en el domicilio y en el medio hospitalario, así como después de 1 hora.
-
•Las nebulizaciones de broncodilatadores de corta duración de acción (BDCA) se administran con oxígeno, con un flujo de 6-8 l/min y vigilando la saturación de oxígeno de la hemoglobina mediante pulsioximetría (SpO2) con la siguiente posología:
-
○para el salbutamol: 2,5 mg si el peso es inferior a 16 kg y 5 mg si es superior a 16 kg (o 0,15 mg/kg, mínimo 1,25 mg y máximo 5 mg);
-
○para la terbutalina: 0,1-0,2 mg/kg (máximo 5 mg, es decir, una ampolla de 2 ml).Las nebulizaciones se repiten cada 15 minutos con un mínimo de tres nebulizaciones por hora.
-
○
-
•
Las nebulizaciones de ipratropio (0,25 mg [hasta los 6 años] o 0,5 mg [después de los 6 años]) se reservan a las exacerbaciones graves asociadas a los BDCA.
-
•
Los BDCA inyectables están representados por la terbutalina por vía subcutánea (a partir de los 2 años), con una posología de 10 μg/kg o el salbutamol por vía intravenosa con una dosis de carga de 1,5-5 μg/kg en 3 minutos.
-
•
La corticoterapia que se debe utilizar es la prednisona o la prednisolona (1-2 mg/kg) o la betametasona (0,15-0,3 mg/kg) en una toma diaria durante 5 días.
-
•
Los antibióticos suelen ser inútiles.
Figura 1.
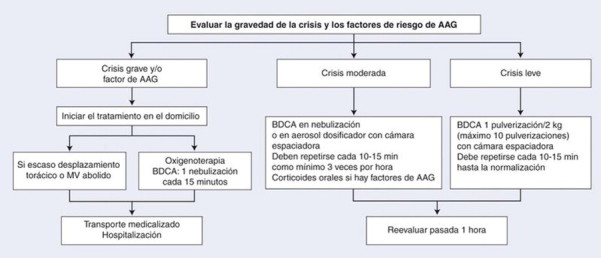
Árbol de decisiones. Tratamiento inicial (primera hora) de la crisis de asma en el domicilio o en el hospital. AAG: asma aguda grave; MV: murmullo vesicular; BDCA: broncodilatador de corta duración de acción; h: hora.
Figura 2.
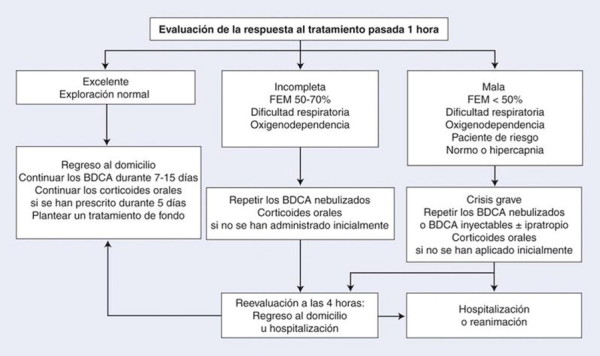
Árbol de decisiones. Tratamiento de la crisis de asma después de una hora. FEM: flujo espiratorio máximo (en porcentaje del valor teórico); BDCA: broncodilatador de corta duración de acción; h: hora.
Tratamiento en reanimación
Cuando existen signos de gravedad iniciales o en caso de agravamiento, es necesario trasladar al paciente a una unidad de reanimación. El tratamiento consiste en:
-
•
broncodilatadores: o bien nebulizaciones cada 20 minutos (cf supra) o bien nebulización continua con la siguiente mezcla durante 2 horas: 0,2 ml/kg de salbutamol al 0,5% + tres ampollas (=6 ml) de dibromuro de ipratropio + suero fisiológico hasta completar 30 ml o bien salbutamol intravenoso (dosis de carga: 15 μg/kg en 10 minutos y después perfusión: 3 μg/kg/min, tras lo que se administra 1 μg/kg/min desde la mejoría);
-
•
corticoides intravenosos: metilprednisolona 2 mg/kg (máximo 60 mg) y después 1 mg/kg/6 h;
-
•intubación y ventilación:
-
○únicamente si hay agotamiento con pausas respiratorias y alteraciones del nivel de conciencia;
-
○la ventilación tiene como objetivo mantener una SpO2 > 92% y evitar la hiperinflación dinámica. Se puede tolerar una hipercapnia de hasta 80 mmHg y una acidosis con un pH ≥ 7,10);
-
○la ventilación se asocia a una sedación, bien mediante curarización + remifentanilo o bien mediante ketamina + midazolam;
-
○
-
•otras medidas que ya casi no se usan:
-
○sulfato de magnesio: 25 mg/kg (máximo 2 g) por vía intravenosa lenta (20 min) una sola vez;
-
○aminofilina intravenosa: se utiliza mucho menos en la actualidad. Hay que tener cuidado con los riesgos de sobredosis por error de dilución de la preparación. La dosis de carga es de 7,5 mg/kg en 20 minutos, seguida de una perfusión de 1 mg/kg/h adaptada para obtener teofilinemias de 10-16 mg/l.
-
○
Cualquier crisis de asma que haya requerido una hospitalización y, con más motivo, una estancia en reanimación, debe hacer que se reevalúe el tratamiento: educación, tratamiento de fondo, indicaciones detalladas en caso de crisis (plan de acción).
Tratamiento de fondo
Objetivos del tratamiento
El tratamiento de un niño asmático tiene como objetivos limitar las exacerbaciones, los síntomas intercríticos y las necesidades de β2-adrenérgicos de rescate, permitir que el niño participe en las actividades familiares, escolares, deportivas y sociales, normalizar y mantener las funciones respiratorias normales y reducir las variaciones circadianas del FEM. Estos objetivos deben lograrse con unos tratamientos que sean bien tolerados.
Medicamentos disponibles
Corticoides inhalados (CI). Los CI son en la actualidad el arma esencial del tratamiento a largo plazo del asma persistente. Hoy en día se dispone del dipropionato de beclometasona, la budesonida y la fluticasona. En el Cuadro V se resumen las posologías en la edad pediátrica[9]. Pronto estarán disponibles otras moléculas como el furoato de mometasona y la ciclesonida. El índice terapéutico es la relación entre los efectos tópicos deseados y los efectos sistémicos indeseables. El índice terapéutico de un CI es elevado en los medicamentos cuya absorción orofaríngea es baja y el depósito pulmonar es significativo. Los efectos sistémicos de los corticoides se deben a la fracción del fármaco que pasa a la circulación general, por una parte desde el depósito broncopulmonar y, por otra, a partir del depósito orofaríngeo que se deglute secundariamente. Sólo la fracción sistémica procedente del depósito orofaríngeo y gastrointestinal está notablemente disminuida por los primeros pasos hepáticos que inactivan la molécula de corticoide.
Cuadro V.
Dosis diarias de corticoides inhalados (μg/día)
| Dosis bajas o medias | Dosis altas | Dosis máximas | |
|---|---|---|---|
| Beclometasona AD | 250-500 | >500 | 1.000 |
| Budesonida AD | 200-400 | >400 | 800 |
| Fluticasona AD | 100-200 | >200 | 400 |
| Budesonida nebulizada | 1.000-2.000 | NA | |
| Beclometasona nebulizada | 800-1.600 | NA |
AD: aerosol dosificador: NA: no aplicable.
Los CI aportan un beneficio seguro sobre la mejoría e incluso la desaparición de los síntomas (tos, sibilancias, despertares nocturnos), la actividad física, la disminución de las exacerbaciones, el uso de β2-miméticos de rescate[10 , 11] e incluso en los lactantes. Esta mejoría se acompaña de una mejora de los parámetros funcionales.
La excelente tolerancia clínica, incluso en dosis altas y prolongadas, no significa que los CI carezcan de repercusiones.
Eje corticosuprarrenal. Los CI pueden inhibir el eje corticosuprarrenal, lo que se mide mediante el área bajo la curva del cortisol plasmático o el cortisol libre urinario de 24 horas. Esta inhibición es dependiente de la dosis[12]. Para dosis ≤ 400 μg/día, los estudios muestran una ausencia de inhibición[13] o una inhibición modesta y parece inútil realizar una exploración de la función corticosuprarrenal. En cambio, hay que ser prudente con posologías superiores, sobre todo si son prolongadas. Se han descrito casos de insuficiencia suprarrenal aguda en niños que han recibido dosis elevadas de CI durante períodos prolongados[14].
Crecimiento. Los estudios a corto plazo (2 semanas) mediante knemometría han demostrado un retardo en la velocidad de crecimiento[15]. Los estudios a medio plazo (12 meses), muestran una desaceleración moderada, del orden de -0,5 DE, dependiente de la dosis y que se observa en los primeros meses de tratamiento[10 , 13 , 16]. A esta edad, el crecimiento depende sobre todo de factores endocrinos (hormona de crecimiento), al contrario de los lactantes, en quienes los factores nutricionales son primordiales y en los niños en período puberal, donde el crecimiento depende de una combinación entre las hormonas de crecimiento y las hormonas sexuales. En cambio, los estudios a largo plazo realizados en períodos de varios años muestran que la velocidad de crecimiento, aunque se ralentiza durante el primer año de tratamiento[10 , 13], después se conserva y la estatura definitiva de los adultos asmáticos es totalmente comparable a la de las personas del grupo control, tanto si han recibido corticoides inhalados como si no[10 , 17]. La interpretación de los estudios sobre la repercusión de la corticoterapia inhalada sobre el crecimiento no debe hacer que se pierda de vista que el asma mal equilibrada también provoca un retraso del crecimiento.
Metabolismo óseo. Los resultados sobre el recambio y la mineralización óseos que pueden hacer sospechar una osteoporosis a largo plazo también son discordantes. Se pueden evaluar distintos parámetros marcadores de la osteosíntesis y de la osteólisis. La mayoría de las mediciones de densitometría ósea mediante absorciometría bifotónica muestran resultados normales con tratamientos ≤ 400 μg/día. Algunos estudios biológicos apuntan a favor de un retardo del metabolismo óseo[18].
Riesgo de candidiasis bucal, de disfonía o de ronquera. Antes se consideraba bajo en los niños (1-2% de los casos), en especial con las cámaras espaciadoras. Los estudios más recientes han encontrado la presencia de candidiasis en el 10% de los casos[19].
Riesgo de cataratas o de atrofia cutánea. Es excepcional en los niños. La prevención de estos efectos secundarios, aunque son infrecuentes en las dosis que se suelen utilizar, se basa en:
-
•
la búsqueda sistemática de la dosis mínima eficaz;
-
•
la utilización de cámara espaciadora en caso de aerosol;
-
•
el lavado de la boca tras su utilización;
-
•
el fraccionamiento de la dosis diaria en los períodos de inestabilidad.
El análisis de las curvas de dosis/respuestas muestra que lo esencial de los efectos beneficiosos de los CI se obtiene con dosis de 100, 200 e incluso 400 μg/día[20]. Por encima de esta cifra, pueden obtenerse algunos beneficios funcionales, en especial sobre el AIE[21], pero la probabilidad de efectos secundarios aumenta
Broncodilatadores de larga duración de acción (BDLA). Se dispone de dos moléculas, el salmeterol y el formoterol. La utilidad de este último es su rapidez de acción, con una broncodilatación en 1-3 minutos. Los BDLA tienen una acción sinérgica con los CI. Los corticoides permiten también prevenir una posible desensibilización a la acción de los β2-miméticos (taquifilaxia). Los BDLA se utilizan en la prevención del AIE y/o asociados con los CI en el tratamiento de fondo del asma persistente moderada o grave. Hay que citar tres especialidades combinadas:
-
•
fluticasona (100, 250 μg) + salmeterol. Esta combinación se puede usar como inhalador de polvo (dosis de 100 y 250 μg de fluticasona) y también como aerosol (dosis de 50, 125 y 250 μg de fluticasona). Por tanto, puede administrarse con cámara espaciadora. Por este motivo es el único fármaco combinado que puede usarse en niños pequeños a partir de 4 años.
-
•
budesonida + formoterol. Sólo existe como inhalador de polvo (dosis de 100, 200 y 400 μg de budesonida). Su gran utilidad es la rapidez de acción del formoterol, que permite una nueva estrategia terapéutica en la que se usa esta asociación a la vez para el tratamiento de fondo y para el de la crisis. Esta estrategia terapéutica aún no está autorizada en algunos países para menores de 18 años.
-
•
beclometasona (100 μg) + formoterol (6 μg), a partir de los 12 años.
Antileucotrienos. Sólo el montelukast, que es un inhibidor de los receptores de leucotrienos, está disponible en algunos países, donde recientemente se ha autorizado a partir de los 6 meses:
-
•
en caso de asma persistente leve o moderada, como tratamiento aditivo en asociación con los CI, en los niños que tienen un control insuficiente con CI, o bien en monoterapia en caso de incapacidad de cumplir un tratamiento con CI en pacientes con un asma persistente leve o moderada controlada de forma insuficiente con CI y en quienes los β2-miméticos de acción inmediata y de corta duración administrados «a demanda» ya no proporcionan un control clínico suficiente del asma;
-
•
para el tratamiento preventivo del asma inducida por el ejercicio.
A partir de los 2 años de edad, el montelukast también se puede prescribir como monoterapia alternativa a los CI en dosis bajas en los pacientes que presentan un asma persistente leve sin antecedentes recientes de crisis de asma grave que hayan justificado una corticoterapia oral y cuya incapacidad de cumplir un tratamiento con CI se haya demostrado.
La variabilidad de respuesta podría estar relacionada con una variación genotípica en la vía de los antileucotrienos[22]. La posología pediátrica por vía oral es de 4 mg/día antes de los 6 años y de 5 mg/día entre los 6 y los 14 años. A partir de los 15 años, la posología es de 10 mg/día.
Bases xánticas: teofilina de liberación sostenida. Se pueden utilizar asociadas a los CI a partir del estadio de asma persistente moderada. En la práctica, pocas veces se prescriben, debido a la necesidad de vigilancia de las concentraciones séricas para evitar las sobredosis.
Anticuerpos anti-IgE: omalizumab. Los anticuerpos anti-IgE son una nueva clase terapéutica de la alergia respiratoria. El omalizumab es un anticuerpo monoclonal humanizado de origen murino que se une a las IgE circulantes, impidiendo su fijación a sus receptores celulares. Se administra por vía subcutánea cada 2-4 semanas con una posología dependiente del peso y de la concentración inicial de IgE, que debe estar comprendida entre 30 y 700 UI/ml. Su tolerancia parece ser buena, incluso en niños. La eficacia es óptima en el asma grave, con una reducción de la tasa de exacerbación, una disminución del uso de tratamientos de urgencia y una mejora de la calidad de vida[23 , 24]. Sin embargo, en los niños, aún se dispone de pocos datos, en especial en el asma grave. El omalizumab está autorizado en niños mayores de 12 años como indicación de tratamiento de segunda línea del asma alérgica (IgE específicas o pruebas cutáneas positivas) persistente grave después del fracaso de los tratamientos antiasmáticos convencionales.
Evaluación de la gravedad inicial del asma
Esta evaluación es el paso previo de cualquier tratamiento. Los criterios de evaluación propuestos por la Global Initiative for Asthma (GINA) en 2006 y el National Asthma Education and Prevention Program en 2007 (NAEPP 2007) son a la vez complejos, variables en sus componentes y en su frecuencia para un mismo estadio y en muchas ocasiones están extrapolados del adulto al niño (Cuadro VI ). No tienen en cuenta la variabilidad temporal de los síntomas y tienen umbrales de función respiratoria (FEM y VEMS) inadecuados en los niños, porque en la mayoría de las ocasiones están en los límites de la normalidad, incluso en los casos de asma grave. Por otra parte, puede haber un sesgo por un posible tratamiento de fondo que ya esté instaurado, sin evaluación inicial, lo que ha llevado a que en las recomendaciones del NAEPP y después en las de la GINA se incluya la carga terapéutica en la evaluación de la gravedad. La clasificación propuesta por el consenso internacional pediátrico en 1998 en tres estadios (intermitente, persistente leve y grave) es más simple[25], pero ya no se utiliza en los estudios de cohortes ni en los ensayos terapéuticos. Lo esencial en la práctica es distinguir, por una parte, los niños que tienen exacerbaciones poco frecuentes y que están bien entre ellas, de aquellos que tienen exacerbaciones frecuentes y/o síntomas intercríticos y que requieren el uso de CI debido a una inflamación persistente.
Cuadro VI.
Evaluación inicial de la gravedad según la Global Initiative for Asthma (GINA) 2006 y el National Asthma Education and Prevention Program (NAEPP) 2007
| GINA 2006 | NAEPP 2007 | |
|---|---|---|
| Asma intermitente | Síntomas < 1/semana | Síntomas ≤ 2/semana |
| Exacerbaciones breves | Uso de β2-agonistas ≤ 2/semana | |
| Síntomas nocturnos < 2/mes | Ausencia de interferencia con la actividad | |
| VEMS o FEM 80% pred | Exacerbaciones 0-1 anuales | |
| Variaciones nictemerales del FEM < 20% | Síntomas nocturnos ≤ 2/mes | |
| VEMS > 80% pred, VEMS/CVF > 85% | ||
| Asma persistente leve | Síntomas > 1/semana pero <1/día | Síntomas > 2/semana |
| Exacerbaciones => alteración de las actividades y durante el sueño | Uso de β2-agonistas > 2/semana | |
| Síntomas nocturnos > 2/mes | Pocas limitaciones de la actividad | |
| VEMS o FEM > 80% pred | Exacerbaciones ≥ 2 al año | |
| Variaciones nictemerales del FEM 20-30% | Síntomas nocturnos 3-4/mes | |
| VEMS ≥ 80% pred, VEMS/CVF > 80% | ||
| Asma persistente moderado | Síntomas diarios | Síntomas diarios |
| Exacerbaciones => alteración de las actividades y durante el sueño | Exacerbaciones => alteración de las actividades y durante el sueño | |
| Síntomas nocturnos > 1/semana | Síntomas nocturnos > 1/semana | |
| Uso diario de β2-agonistas | Uso diario de β2-agonistas | |
| VEMS o FEM 60-80% pred | Limitación notable de la actividad | |
| Variaciones nictemerales del FEM > 30% | VEMS 60-80% pred, VEMS/CVF 75-80% | |
| Asma persistente grave | Síntomas diarios | Síntomas continuos |
| Exacerbaciones frecuentes | Exacerbaciones frecuentes | |
| Síntomas nocturnos frecuentes | Síntomas nocturnos diarios | |
| Limitación de la actividad física | Uso de β2-agonistas varias veces al día | |
| VEMS o FEM < 60% pred | Limitación considerable de la actividad | |
| Variaciones nictemerales del FEM > 30% | VEMS < 60% pred, VEMS/CVF < 75% |
El niño se clasifica en el estadio correspondiente al componente más grave. VEMS: volumen espiratorio máximo/segundo; FEM: flujo espiratorio máximo; CVF: capacidad vital funcional; pred: del valor predicho
A cada nivel de gravedad inicial le corresponde una o varias opciones terapéuticas (Fig. 3 ):
-
•
el asma intermitente sólo requiere un tratamiento farmacológico a demanda;
-
•
en caso de asma persistente leve, el tratamiento de primera elección consiste en una corticoterapia inhalada en dosis baja. Cuando esto no puede realizarse, la alternativa es el tratamiento con antileucotrienos;
-
•
en los casos de asma persistente moderada, se propone la asociación de un BDLA con CI en dosis bajas. La asociación de un BDLA a los CI es más eficaz que la duplicación de las dosis de CI[26] o la adición de un antileucotrieno;
-
•
en caso de asma persistente grave, a los BDLA se asocian dosis altas de CI. Se pueden instaurar otras moléculas en función de los resultados. El uso de una corticoterapia oral prolongada es excepcional en los niños asmáticos;
-
•
por último, ante el fracaso y en los niños alérgicos, se debe plantear el uso de anti-IgE.
Figura 3.
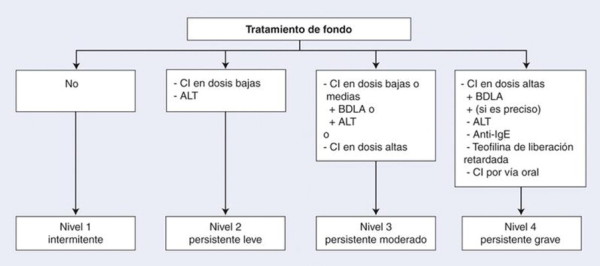
Árbol de decisiones. Estrategia terapéutica en función del nivel de la gravedad inicial. CS: corticoides; CI: corticoides inhalados; BDLA: broncodilatador de larga duración de acción; ALT: antileucotrienos; Ig: inmunoglobulinas.
Adaptación y vigilancia del tratamiento
Las recomendaciones insisten en la actualidad en el concepto de control, que refleja el dominio del asma y traduce, por tanto, la actividad, el carácter dinámico de la enfermedad a lo largo de varias semanas. Este concepto es útil con independencia de la gravedad del asma. Al igual que para la gravedad inicial, la GINA en 2006 y el NAEPP en 2007 (Cuadro VII ) han propuesto criterios de control. También en este caso existen diferencias en los elementos considerados y en el intervalo estudiado. De este modo, la aparición de una sola exacerbación en el año transcurrido se acepta en el NAEPP, mientras que es indicativa de un asma parcialmente controlada para la GINA. Por otra parte, la aparición de síntomas hasta 2 veces por semana se tolera en estas dos clasificaciones para aceptar un asma bien controlada. Sin embargo, el control total, definido por la ausencia de síntomas y por una función respiratoria normal, debe ser el objetivo en los niños[27]. Las posologías de CI que se recomiendan en la actualidad permiten controlar la gran mayoría de los cuadros de asma. Al principio del tratamiento, se inhalan en dos tomas diarias. La adaptación terapéutica depende del control del asma (Fig. 4 ).
Cuadro VII.
Definición del control del asma en niños mayores de 3 años, según NIH-NHLBI/WHO workshop report, Global Initiative for Asthma (GiNA). Global Strategy for Asthma Management and Prevention: www.ginasthma.com,, NIH publication, 2007. O2-3659; National Heart and Blood Institute. National Asthma Education and Prevention Program (NAEPP) Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma Full Report 2007 August 28, 2007. www.nhlbi.nih.gov www.nhlbi.nih.gov
| Asma controlada |
Asma parcialmente controlada |
Asma no controlada |
||||
|---|---|---|---|---|---|---|
| Todos los elementos son válidos |
Al menos un elemento presente, con independencia de en qué semana durante el período estudiado |
|||||
| GINA | NAEPP | GINA | NAEPP | GINA | NAEPP | |
| Síntomas diurnos | Ninguno (≤2 semana) | ≤2 semana | >2 semana | >2 semana | ≥3 elementos del control parcial presente, con independencia de en qué semana durante el período estudiado | Permanentes |
| Limitación de las actividades | Ninguna | Ninguna | Sí | Leve | Considerable | |
| Síntomas/despertares nocturnos | Ninguno | ≤1/mes | Sí | ≥2/mes | ≥2/sem | |
| β2 de rescate |
|
≤2/sem | >2/semana | >2/semana | Varias veces al día | |
|
>80% pred |
|
<80% |
|
|
|
|
Ninguno en el año | 0-1 al año | ≥1 al año | ≥2/año | Una crisis en cualquier semana del período estudiado | ≥2/año |
Para la GINA, la evaluación del asma a diario se centra sobre todo en los 3 últimos meses. Para el NAEPP, esta evaluación se realiza en las últimas 4 semanas. VEMS: volumen espiratorio máximo/segundo; FEM: flujo espiratorio máximo; CVF: capacidad vital funcional. pred: del valor predicho.
Figura 4.
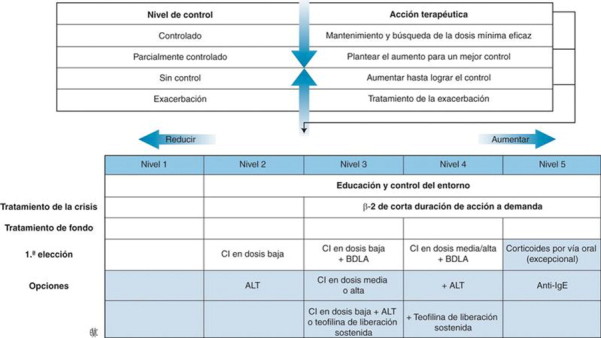
Adaptación del tratamiento en función del control. BDLA: broncodilatador de larga duración de acción; CI: corticoides inhalados; ALT: antileucotrienos; Ig: inmunoglobulinas. De NIH-NHLBI/WHO workshop report, Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, www.ginasthma.com,, NIH publication, 2007. 02-3659; National Heart and Blood Institute. National Asthma Education and Prevention Program Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma Full Report 2007, www.nhlbi.nih.gov.
En caso de asma controlada. La reducción de las dosis de CI es progresiva, cada 3-6 meses, hasta alcanzar la dosis mínima de CI que permita mantener el control del asma (dosis mínima eficaz). En función de la posología inicial de CI, la disminución de las dosis se realiza en pasos del 25-50%, teniendo siempre como objetivo mantener el control total del asma. Durante la disminución, se puede plantear pasar a una toma única[28 , 29] para favorecer el cumplimiento, a excepción de la beclometasona, debido a sus características farmacológicas[30].
En caso de tratamiento adicional, en dosis altas/medias de CI, la prioridad es la reducción de las dosis de CI[31 , 32]. Después de haber alcanzado una dosis baja de CI, se puede intentar interrumpir los CI o el tratamiento adicional. Si se está usando un tratamiento con una asociación de CI + BDLA, es preferible mantener el tratamiento combinado pasando de dos a una toma diaria, en lugar de pasar de entrada a un CI solo. No se recomienda dejar un BDLA solo (sin CI) como tratamiento de fondo diario.
En caso de asma no controlada. Cuando el control del asma es insuficiente, antes de reforzar el tratamiento es esencial buscar un defecto de la técnica o un factor agravante:
-
•
búsqueda y tratamiento de un reflujo gastroesofágico;
-
•
tratamiento de una rinitis alérgica o de una sinusitis;
-
•
reevaluación del control del entorno;
-
•
búsqueda de una alergia alimentaria enmascarada;
-
•
lucha contra el tabaquismo pasivo o activo en los niños mayores;
-
•
tratamiento del sobrepeso;
-
•
detección de situaciones de estrés agudas o crónicas.
En caso de ausencia de control y en los niños que no han recibido CI, se recomienda iniciar el tratamiento con dosis bajas de CI. La adición de BDLA mejora el control del asma en los niños que no se controlan solo con CI[33], [34], [35]. Un estudio reciente muestra la utilidad de la forma combinada frente a la duplicación de las dosis de CI en los niños de 4-11 años no controlados con fluticasona (200 μg/día). En caso de síntomas diarios o después de un asma aguda grave, se recomienda prescribir de entrada una asociación de CI + BDLA[36]. Los antileucotrienos se pueden utilizar en monoterapia o asociados a los CI. Los metaanálisis[37 , 38] apuntan a favor de una asociación de los BDLA con los CI como primera elección. La corticoterapia oral prolongada se ha convertido en algo totalmente excepcional en los niños.
Vigilancia del tratamiento. La clínica y las PFR siguen siendo los elementos de referencia del niño asmático. El control se debe evaluar en cada consulta. Se pueden usar como ayuda cuestionarios como el Asthma Control Test, que ha sido traducido a otros idiomas distintos al inglés. Las PFR deben realizarse de forma periódica. En caso de asma bien controlada y en niños que reciban dosis bajas de CI, este control puede ser anual. En los demás casos, debe ser bi o trianual. Sólo las PFR permiten detectar la aparición de una obstrucción intercrítica no percibida por el niño.
Se han estudiado estrategias de vigilancia de la inflamación bronquial para ayudar a adaptar el tratamiento de fondo. Los dos principales parámetros propuestos son la vigilancia del eNO y de la hiperreactividad bronquial. La hiperreactividad bronquial es un parámetro útil, relacionado con la gravedad y el riesgo de persistencia[39] del asma. La utilización del NO como parámetro de control o marcador predictivo de la aparición de exacerbaciones aún sigue estando discutido[40 , 41]. Zacharasiewicz et al han demostrado que la medición del eNO ha permitido una reducción de la posología de los corticoides sin desestabilizar el asma[42], mientras que en el estudio de Szefler et al, la utilización del NO se acompañó de un consumo mayor de CI sin un mejor control clínico[41]. La medición no invasiva de la inflamación también puede evaluarse mediante el estudio de la eosinofilia en la expectoración inducida y en los condensados exhalados, lo que parece una herramienta prometedora para adecuar el tratamiento antiasmático, pero cuya realización en la práctica clínica parece difícil[43].
Medidas no farmacológicas
Control del entorno. El control del entorno es un elemento fundamental del tratamiento, porque participa en gran medida en la lucha contra la inflamación bronquial. Las situaciones que aumentan el estrés oxidativo o la inflamación (tabaco, ozono, bacterias, virus, alérgenos) pueden disminuir la respuesta a los CI. Los factores alérgicos ocupan un papel destacado, no sólo en el desencadenamiento de las crisis, sino también en la perennización de la inflamación bronquial. Una carga alergénica intensa y precoz de ácaros aumenta el riesgo y la gravedad del asma[44]. El umbral de riesgo de sensibilización a los ácaros es de 2 μg/g de polvo y el umbral de riesgo de aparición de crisis, de 10 μg/g de polvo. La reducción de la carga alergénica, en especial de ácaros, permite disminuir la sintomatología, el consumo de fármacos y la hiperreactividad bronquial.
Se han propuesto varias técnicas para reducir la exposición a los neumoalérgenos[45]:
-
•para los ácaros:
-
○disminución de la humedad relativa (aireación, apertura de las ventanas y climas templados, deshumidificación y climatización en regiones cálidas y húmedas);
-
○utilización de ropa de cama sintética;
-
○empleo de fundas antiácaros;
-
○supresión de las alfombras, tapices y moquetas o limpieza periódica con acaricidas e incluso utilización de productos textiles que incorporen un acaricida;
-
○lavado regular de las sábanas a una temperatura > 55 °C, utilización de aspiradores provistos de filtros especiales;
-
○
-
•el control del entorno también consiste en:
-
○la lucha contra las cucarachas, que es difícil de poner en práctica, porque en la mayoría de las ocasiones, la contaminación de una vivienda proviene de otras viviendas adyacentes, lo que requiere un tratamiento de todo el inmueble;
-
○la limitación de los contactos alergénicos exteriores, en especial los pólenes;
-
○la evitación de los animales domésticos a los que sea alérgico el niño;
-
○la lucha contra los mohos, cuya multiplicación se ve favorecida por el entorno húmedo (y los humidificadores);
-
○la lucha contra el tabaquismo pasivo.
-
○
Inmunoterapia. La inmunoterapia específica tiene como objetivo reducir en los niños sensibilizados los síntomas provocados durante una nueva exposición al alérgeno. Ha demostrado ser eficaz, sobre todo en personas sanas, y puede mejorarse aún más con el uso de extractos alergénicos purificados. En la actualidad, la inmunoterapia por vía sublingual tiende a sustituir a la inmunoterapia específica por vía inyectable y puede comenzarse desde los 3 años de edad. La indicación de una desensibilización específica debe responder a un cierto número de criterios precisos[46]:
-
•
la responsabilidad del alérgeno debe demostrarse mediante la anamnesis, las pruebas cutáneas y, si es necesario, con las pruebas de provocación específicas;
-
•
los inconvenientes de la desensibilización deben ser inapreciables respecto a las consecuencias inmediatas de la enfermedad asmática;
-
•
la desensibilización sólo puede plantearse después de un control al menos parcial del asma;
-
•
el cumplimiento del niño y de sus progenitores es indispensable para una buena cooperación.
En el asma, la inmunoterapia está indicada en caso de asma persistente leve a moderada, estabilizada con tratamiento. La duración de dicho tratamiento se escalona a lo largo de un período de 3-5 años. Los alérgenos implicados son sobre todo los ácaros y los pólenes (gramíneas, betuláceas, cupresáceas, fagáceas). La prescripción debe basarse en una identificación precisa y una demostración de la responsabilidad de los alérgenos, que deben estar en un número limitado (si es posible, no más de dos).
Medidas adyuvantes.
-
•
La kinesiterapia respiratoria permite luchar contra una deformación. Cada vez se usa más en la lucha de la pérdida de forma física mediante el reentrenamiento del esfuerzo.
-
•
La antibioticoterapia pocas veces es útil. Pocas crisis de asma en los niños se desencadenan o se asocian a una infección bacteriana.
-
•
Las estancias prolongadas en altitud sólo están indicadas en las formas de asma grave no equilibrada a pesar de un tratamiento intenso, para evitar una corticoterapia oral prolongada, y parece necesario realizar un alejamiento temporal del medio familiar y un internamiento médico en un centro especializado.
-
•
Por último, la intervención de un paedopsiquiatra o de un psicólogo puede ser necesaria. El asma se ha considerado durante mucho tiempo como la enfermedad más «psicosomática» de todas. Muchos estudios han demostrado la repercusión del asma sobre la calidad de vida de los niños y las familias, el cumplimiento terapéutico y la incidencia de las complicaciones. Las dificultades psicopatológicas observadas en los niños y sus allegados se relacionan sobre todo con la gravedad del asma. El análisis de estos datos hace que se produzca una evolución en la presentación del asma respecto a la literatura existente. El asma se controla cada vez mejor desde el punto de vista terapéutico y, en la actualidad, altera poco la escolaridad y la calidad de vida de los niños, salvo en caso de mal cumplimiento.
Asma del lactante
Entre 2008 y 2009 se han propuesto varias recomendaciones sobre el tratamiento del asma de los niños menores de 3 años.
Manifestaciones clínicas
Al contrario que en los niños, en quienes la definición insiste en el aspecto fisiopatológico, la definición del asma del lactante aún sigue siendo clínica[47]. Se considera como asma «cualquier episodio disneico con sibilancias que se reproduce al menos 3 veces antes de los 2 años de edad y con independencia de la edad de inicio, de la existencia o no de estigmas de atopia y de la causa aparentemente desencadenante». Esta definición puede parecer amplia, en la medida en la que sólo una parte de estos lactantes continuarán teniendo crisis y se comportarán como asmáticos, mientras que los demás tendrán manifestaciones sólo transitorias relacionadas con la acción de las viriasis y/o de un tabaquismo pasivo sobre unas vías respiratorias que son más estrechas inicialmente. Sin embargo, en ausencia de criterios predictivos fiables, el reconocimiento del asma favorece el uso de tratamientos dirigidos.
La crisis de asma adopta habitualmente el carácter de una bronquiolitis aguda viral. Comienza con una rinitis o rinofaringitis banal que precede unos 2-3 días a la aparición de tos seca, en quintas, con polipnea, signos de lucha y sibilancias. La intensidad de los signos de lucha y de la polipnea, así como la tolerancia de los síntomas (desde el punto de vista digestivo y respiratorio) y la cifra de saturación de O2 (normal > 95%) son índices de gravedad. El cuadro evoluciona hacia la curación en varios días. Los agentes infecciosos principales en el período de otoño-invierno son el virus respiratorio sincitial, los rinovirus, los virus parainfluenza, los metapneumovirus y los virus de la gripe.
Puede haber otras características:
-
•
una sibilancia continua con persistencia, después de una bronquiolitis, de signos de obstrucción bronquiolar. La intensidad de las manifestaciones varía en función de los episodios infecciosos ORL y de la actividad del niño; los síntomas aumentan durante la agitación, las comidas y el esfuerzo, pero disminuyen en reposo y durante el sueño. No obstante, estos bebés «sibilantes» mantienen un desarrollo pondoestatural, una actividad y un apetito normales («sibilantes felices»);
-
•
episodios de disnea con sibilancias y una tos espasmódica con sibilancias al final de la tos. Estos episodios aparecen fuera de cualquier viriasis y, con más frecuencia, por la noche o durante la risa o con episodios de agitación;
-
•
las crisis graves pueden causar un cuadro de asma aguda grave, con necesidad de un traslado a reanimación.
Recientemente, se ha propuesto distinguir a los lactantes cuyas manifestaciones sean sólo inducidas por virus y aquellos que tengan múltiples factores desencadenantes[48].
Diagnóstico positivo y diferencial
En los lactantes, cualquier afección obstructiva que dificulte la evacuación de las secreciones provoca una inflamación bronquial y sibilancias. Algunas enfermedades completamente orgánicas responsables de una obstrucción pueden presentarse como un cuadro de asma del lactante e incluso de asociarse a él (Cuadro IV). Por tanto, la confrontación de los datos de la anamnesis (antecedentes de prematuridad, dificultad respiratoria neonatal, viriasis grave, antecedentes atópicos personales y familiares, signos de reflujo gastroesofágico), de la historia de la enfermedad (frecuencia e intensidad de los síntomas de asma, estado respiratorio entre los episodios, factores desencadenantes, respuesta a los tratamientos recibidos), de la exploración física (signos respiratorios: sibilancias, tos, disnea, signos de lucha, distensión, cianosis, etc., crecimiento, eccema, signos atípicos) y las radiografías de tórax es indispensable en el momento del diagnóstico.
El estudio alergológico debe reservarse a los niños que tengan síntomas respiratorios persistentes, recidivantes, que requieran un tratamiento continuo o que se asocien a síntomas extrarrespiratorios compatibles con un origen alérgico. Las pruebas de punción se recomiendan como primera elección en el estudio alergológico. Si su realización no es posible como primera elección, se recomienda orientarse hacia una PMA. En caso de positividad, el estudio alergológico debe continuarse. La determinación como primera elección de las IgE séricas totales o específicas de un neumoalérgeno no se recomienda en la práctica habitual.
Las PFR no se recomiendan como primera elección, porque en los niños menores de 3 años requieren una sedación y un material que sólo está disponible en laboratorios especializados. Algunos autores han mostrado concentraciones de eNO más elevadas en los lactantes con sibilancias crónicas que en los que presentaban el primer episodio de disnea con sibilancias[49].
A favor del diagnóstico de asma debe tenerse en cuenta:
-
•
la presencia de signos de atopia personales (eccema) y familiares (asma, eccema y rinitis polínica en los progenitores y/o en la fratría);
-
•
la repetición de episodios de tos y de sibilancias, a menudo favorecidos por las infecciones virales, los irritantes, el ejercicio o las emociones;
-
•
la normalidad de la exploración física entre las crisis y la ausencia de repercusión sobre la curva pondoestatural;
-
•
la normalidad de las radiografías de tórax;
-
•
las pruebas cutáneas positivas para los neumoalérgenos y/o los alérgenos alimentarios (leche, huevo) que poseen un buen valor predictivo positivo de recidiva de las manifestaciones clínicas.
Castro Rodriguez ha propuesto un índice predictivo de persistencia de las manifestaciones. Este índice es positivo cuando existe un criterio mayor o dos criterios menores:
-
•
criterios mayores: diagnóstico de asma en uno de los progenitores, diagnóstico confirmado médicamente de dermatitis atópica, sensibilización a al menos un neumoalérgeno;
-
•
criterios menores: sibilancias fuera de una infección ORL, eosinofilia sanguínea > 4%, sensibilización a un trofoalérgeno (leche, huevo, cacahuete).
Se debe sospechar otro diagnóstico ante:
-
•
la presencia de signos atípicos, cianosis, soplo cardíaco, vómitos excesivos, trastornos de la deglución, acropaquias, deformación torácica, diarrea grasa, etc.;
-
•
la persistencia de síntomas respiratorios (tos, obstrucción, sibilancias, disnea) entre los episodios agudos o manifestaciones después del nacimiento;
-
•
una interrupción de la curva pondoestatural;
-
•
estridor;
-
•
una anomalía radiológica;
-
•
un mal control a pesar de las dosis moderadas de CI mediante aerosol dosificador con cámara espaciadora.
En estos casos, es indispensable completar las exploraciones (endoscopia bronquial, tomografía computarizada [TC] de tórax, estudio de la motilidad ciliar, estudio inmunitario, prueba del sudor, etc.) en un medio especializado.
Tratamiento del asma del lactante
Tratamiento de la crisis
En los lactantes, la eficacia de los β2-adrenérgicos es muy inconstante, debido a un bajo depósito pulmonar y a la obstrucción bronquiolar de origen esencialmente mecánico, mientras que el componente del espasmo es muy limitado. Aunque las nebulizaciones de β2-adrenérgicos suelen tolerarse bien en los lactantes, hay que saber que antes del año de edad son susceptibles de causar hipoxia por agravamiento de la relación ventilación/perfusión. En las crisis menos graves, las cámaras espaciadoras de volumen reducido (300-400 ml) acopladas a una mascarilla facial permiten administrar de forma eficaz los β2-adrenérgicos con un aerosol dosificador.
Los corticoides orales se prescriben con más facilidad que en los niños mayores, en un ciclo de 5-10 días y en una dosis de 2 mg/kg de prednisolona o equivalente. Sin embargo, su eficacia sigue siendo controvertida, sobre todo cuanto más pequeño es el niño[50].
La prescripción de montelukast durante 4 semanas después de una bronquiolitis por virus respiratorio sincitial ha disminuido de forma significativa el número de días sin síntomas y el número de exacerbaciones[51]. Sin embargo, un estudio realizado con un numero mayor de lactantes no ha confirmado estos resultados[52].
Tratamiento de fondo
Los objetivos del tratamiento en los niños pequeños son la normalización de la exploración física, la ausencia de síntomas cada día (diurnos y nocturnos), el mantenimiento de una actividad física normal para la edad y la normalización del crecimiento ponderal cuando se había modificado.
Evaluación de la gravedad inicial
Es sobre todo clínica y diferencia el asma intermitente, el asma persistente leve a moderado y al asma persistente grave, así como el asma intermitente grave (Cuadro VIII ). La apreciación de la gravedad del asma se basa sobre todo en la frecuencia de los síntomas y de las exacerbaciones, así como en las necesidades de fármacos. Los síntomas intercríticos suelen evaluarse en el último mes y las exacerbaciones en los 6-12 últimos meses.
-
•
Asma intermitente: las crisis son poco frecuentes (tres a cuatro al año), aparecen en el período de otoño-invierto entre septiembre y abril. Entre las crisis, el asma no afecta a la vida diaria.
-
•
Asma persistente leve a moderada: las crisis aparecen alrededor de 1 vez al mes durante el otoño y el invierno y entre las crisis se producen episodios infrecuentes y más breves de tos nocturna o bien con el esfuerzo o los cambios de tiempo.
-
•
Asma persistente grave: se caracteriza por crisis frecuentes (al menos una vez al mes) que requieren una corticoterapia oral o bien por sibilancias persistentes o manifestaciones de tos seca diurna y nocturna, episodios de sibilancias transitorias con o sin disnea que se produce varias veces por semana aparte de las infecciones ORL, que requieren el uso de broncodilatadores y que no se controlan con tratamientos no esteroideos.
Cuadro VIII.
Clasificación de la gravedad del asma del lactante propuesta por los expertos franceses (adaptada de la referencia bibliográfica[27])
| Estadio | |||
|---|---|---|---|
| Asma intermitente | Asma persistente leve-moderada | Asma persistente grave | |
| Parámetros | |||
| Síntomas diurnos | <1/semana | 1-2 días/sem | >2 días/sem |
| Síntomas nocturnos | <1 noche/mes | 1-2 noches/mes | >2 noches/mes |
| Repercusión sobre las actividades diarias | Ninguna | Leve | Considerable |
| β2-miméticos de corta duración de acción | <1/semana | 1-2 días/mes | >2días/mes |
| Exacerbaciones que requieran corticoides por vía oral | ≤1 al año | ≥2 en 6 meses | ≥2 en 6 meses |
A estos tres estadios de gravedad se añade el asma intermitente grave, definido por la aparición de exacerbaciones frecuentes inducidas por virus sin síntomas intercríticos.
Fármacos disponibles
Los CI que se utilizan en el lactante son la fluticasona (aerosol dosificador de 50 μg), la budesonida (formas nebulizadas de 0,5 y 1 mg), la beclometasona en aerosol dosificador de 50 y 250 μg y nebulizada (formas de 0,4 y 0,8 mg). Se recomienda usar dos modalidades de administración: aerosol dosificador con cámara espaciadora de inhalación adaptada (y mascarilla facial) y nebulización con un generador neumático. En los lactantes y con las dosis bajas y medias, la tolerancia de los CI es buena. Con las dosis más elevadas, los resultados sobre el crecimiento son contradictorios y se aconseja una vigilancia de la curva estatural.
Los BDCA se utilizan sobre todo para el tratamiento de los síntomas. Sin embargo, pueden emplearse como tratamiento de fondo, asociados con los CI. Los BDLA sólo están autorizados a partir de los 4 años de edad.
La autorización del montelukast se ha modificado recientemente y se permite su uso a partir de los 6 meses de edad (cf supra).
Estrategia y adaptación terapéutica
La estrategia terapéutica de partida se basa en la evaluación inicial de la gravedad (Fig. 5 ). Los lactantes que sufren una exacerbación durante el invierno y que no presentan casi manifestaciones fuera de esa estación tienen un asma intermitente y sólo requieren más que un tratamiento secuencial. Cuando ha habido al menos dos exacerbaciones en los últimos 6 meses o si existen síntomas intercríticos más frecuentes, se recomienda aplicar una corticoterapia inhalada, en dosis bajas en caso de asma persistente leve o en dosis medias más altas en los casos de asma persistente moderada y grave. El fracaso de las dosis altas de CI en aerosol dosificador constituye una indicación para las nebulizaciones de CI. Recientemente se ha propuesto un estadio intermitente grave[54], que corresponde a un subgrupo de lactantes cuyas exacerbaciones son frecuentes en el período invernal, pero que carecen de síntomas en otras estaciones.
Figura 5.
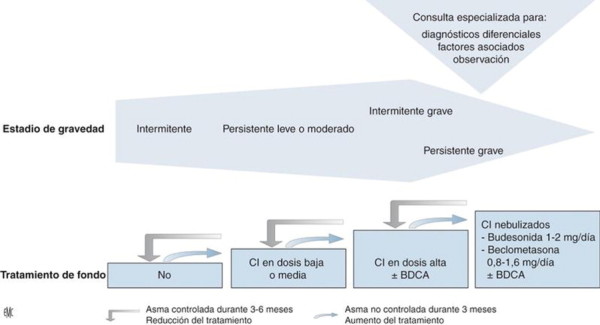
Estrategia terapéutica en el asma del lactante. BDCA: broncodilatador de corta duración de acción; CI: corticoides inhalados. De[53] y NIH-NHLBI/WHO workshop report, Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, www.ginasthma.com,, NIH publication, 2007. 02-3659; National Heart and Blood Institute. National Asthma Education and Prevention Program Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma Full Report 2007, www.nhlbi.nih.gov.
En todos los casos, la eficacia o el fracaso del tratamiento se deben evaluar con regularidad.
-
•
En caso de control del asma, la reducción de las dosis de CI debe ser progresiva, cada 3-6 meses, hasta alcanzar la dosis mínima de CI que permita mantener el control del asma (dosis mínima eficaz) como en los niños de más edad.
-
•
Si no se logra el control, es necesario (como en los niños mayores y antes de aumentar la presión terapéutica) asegurarse de que el diagnóstico del asma es adecuado y buscar los factores asociados con más frecuencia a la falta de control (evaluación del cumplimiento terapéutico de fondo y de la utilización de los dispositivos de inhalación, evaluación y tratamiento de una posible rinitis alérgica asociada, control del entorno doméstico, con evitación del tabaquismo ambiental y de los alérgenos interiores en los niños sensibilizados.
Asma grave
Definición y fenotipos
El asma grave asocia al menos un criterio mayor (necesidad de dosis altas de CI [≥800 μg/día de equivalente de beclometasona] o corticoterapia sistémica) y al menos dos de los criterios menores siguientes: tratamiento a largo plazo con BDLA, teofilina o antileucotrieno, síntomas de asma que requieren el uso casi diario de BDCA, obstrucción bronquial persistente con VEMS < 80% del valor teórico, variaciones nictemerales del FEM > 20%, al menos una demanda de consulta con los servicios de urgencia en el año precedente, al menos tres exacerbaciones que requieran una corticoterapia oral en el año precedente o un antecedente de asma aguda grave[55].
Se estima que su frecuencia es de alrededor del 5%, pero tiene una morbilidad considerable en términos de uso de los servicios asistenciales y de hospitalizaciones.
El asma grave constituye un grupo heterogéneo de situaciones y pueden encontrarse varios fenotipos:
-
•
persistencia de síntomas varias veces a la semana o exacerbaciones frecuentes en un niño cuya función respiratoria se mantiene normal;
-
•
persistencia de los síntomas asociada a un síndrome obstructivo intercrítico fijo, no reversible después de una prueba con corticoides;
-
•
presencia de un síndrome obstructivo intercrítico fijo en un niño poco o nada sintomático.
Esta definición implica también tres aspectos: la ausencia de otro diagnóstico, un tratamiento correcto de los factores precipitantes y un buen cumplimiento terapéutico.
Fisiopatología del asma grave
La diversidad de los perfiles clínicos y funcionales respiratorios del asma grave dificulta el enfoque fisiopatogénico y puede haber varios mecanismos implicados. Wenzel distingue los pacientes según el tipo de células predominante con un fenotipo «eosinofílico» y un fenotipo «neutrofílico»[56]. En el grupo que presenta una eosinofilia bronquial, el engrosamiento de la membrana basal era mayor, las crisis de asma sobreaguda más frecuentes y la obstrucción periférica, más intensa. El fenotipo neutrofílico se caracteriza por un aumento de los neutrófilos en la expectoración inducida, el líquido del lavado broncoalveolar (LBA) o las biopsias. La corticoterapia prolonga la supervivencia del polimorfonuclear neutrófilo por inhibición de la apoptosis, lo que podría explicar la menor eficacia de los corticoides en algunos pacientes. Por otra parte, existe un fenotipo «paucicelular» caracterizado por la ausencia de células inflamatorias y en cuya patogenia podrían participar anomalías estructurales fijas o una inflamación distal predominante no accesible a los estudios broncoscópicos. No es seguro que estos fenotipos puedan extrapolarse totalmente a la población infantil, pero es seguro que la magnitud de los fenómenos inflamatorios y de remodelación de las vías respiratorias intervendrá en el futuro en el tratamiento del asma infantil difícil al igual que las características clínicas y funcionales respiratorias.
Aparte de los procesos inflamatorios, hay varios factores de riesgo de asma grave que pueden intervenir: el polimorfismo genético, fenómenos de corticorresistencia, fenómenos de remodelación precoz y la magnitud de la hiperreactividad bronquial inespecífica.
Exploraciones del asma grave infantil
La exploración del asma difícil consta de tres fases esenciales: eliminar los falsos cuadros de asma grave, buscar los factores agravantes y evaluar los fenómenos inflamatorios y la remodelación de las vías respiratorias.
Descartar los falsos cuadros de asma grave
Los principales diagnósticos diferenciales deben descartarse (Cuadro IV). Sin embargo, los defectos del tratamiento, del cumplimiento y/o de educación sobre la enfermedad constituyen los problemas más frecuentes.
Buscar un factor agravante desconocido y/o no tratado
Los principales factores agravantes que deben buscarse están representados por el reflujo gastroesofágico, las enfermedades de la región ORL, la persistencia de exposiciones alergénicas, la existencia de alérgenos alimentarios «ocultos», así como el tabaquismo pasivo y también activo en los niños mayores
Evaluar los fenómenos inflamatorios y/o de remodelación de las vías respiratorias
Esta evaluación, que es reciente, representa el aspecto más innovador del tratamiento del asma difícil. En ella se recurre a métodos directos invasivos, LBA y biopsias bronquiales o a métodos indirectos no invasivos: medición del eNO, expectoración inducida, condensado exhalado, TC torácica.
Evaluación directa
Se basa en el análisis del LBA y, sobre todo, de las biopsias endobronquiales, que se realizan durante la endoscopia. Los principales resultados de las biopsias muestran que los fenómenos inflamatorios (aumento del número de polimorfonucleares eosinófilos y neutrófilos intraepiteliales, aumento del número de mastocitos submucosos y en el interior de los músculos lisos) correlacionan con los síntomas[57 , 58], mientras que, aparte del engrosamiento de la membrana basal, las anomalías estructurales de remodelación, es decir, la hipertrofia/hiperplasia del músculo liso, la hiperplasia miofibroblástica, la hipertrofia de las glándulas mucosas y la angiogénesis correlacionan más con el grado de obstrucción bronquial[59].
Evaluación indirecta
Hay varias técnicas que están en fase de evaluación: correlación entre el eNO y la inflamación/remodelación, medición de distintos marcadores en la expectoración inducida (limitada en los niños por su complejidad técnica) o el condensado exhalado (en fase de estandarización), valoración mediante TC de las remodelaciones estructurales asociadas al asma[60].
Tratamiento
El asma grave requiere en un primer momento un tratamiento educativo específico (autovigilancia del FEM, plan de acción de las crisis, coordinación entre la familia, el médico responsable, el pediatra, etc.), el tratamiento apropiado de los factores agravantes y la optimización de los tratamientos farmacológicos. Éstos se basan en la actualidad en la asociación de dosis altas de CI (800-1.000 μg/día de equivalente de budesonida) y de BDLA[53]. Este tratamiento optimizado permite el control de la mayor parte de los casos de asma supuestamente difíciles.
Sin embargo, algunos niños siguen estando sintomáticos o mantienen una obstrucción bronquial intercrítica y representan los verdaderos cuadros de asma grave, difíciles o refractarios. Aunque es tentador aumentar la posología diaria de CI, el riesgo potencial de efectos secundarios puede superar a los beneficios esperados. Ante esta posibilidad, en la actualidad se propone una prueba con corticoides (2 mg/kg/día durante 7-10 días). Una prueba positiva (control de los síntomas, mejora del VEMS ≥ 15%) incita a reforzar, al menos de forma temporal, el tratamiento antiinflamatorio y broncodilatador. Una prueba negativa, que se refleja por la persistencia de los síntomas clínicos o la ausencia de respuesta funcional respiratoria, debe hacer que se evalúe de un modo más completo al niño en un medio especializado. La identificación de subgrupos basados en los datos histopatológicos podría tener implicaciones terapéuticas. Por ejemplo, la ausencia de infiltración eosinofílica o neutrofílica asociada a la presencia de signos marcados de remodelación debería hacer que se disminuyera la presión de CI, mientras que una infiltración inflamatoria considerable debería llevar a reforzar, al menos temporalmente, dicha presión. Sin embargo, hasta el momento se han realizado demasiado pocos estudios prospectivos para validar esta distinción y, debido a la diversidad de la imbricación de los fenómenos inflamatorios implicados, es más probable que detrás de esta clasificación simple existan fenotipos muy diferentes.
Las indicaciones de los tratamientos alternativos destinados a reducir o a evitar los esteroides orales, tanto si se trata de Ig intravenosas o de la ciclosporina, nunca han sido objeto de estudios con doble ciego con un tamaño muestral suficiente o han sido negativos. La mejor comprensión de los mecanismos implicados en la fisiopatología del asma ha permitido el desarrollo de nuevas moléculas. Entre ellas, las anti-IgE han permitido, en los niños que tienen un asma persistente moderada o grave, evitar los CI, así como reducir el número de exacerbaciones. Otras moléculas como los inhibidores de la fosfodiesterasa, las antiinterleucinas (IL) 4 y los antagonistas de las quimiocinas o los inhibidores de la cinasa tal vez encuentren su lugar en el arsenal terapéutico de estos cuadros de asma grave[61].
Fallecimiento por asma
En Francia, por ejemplo, la mortalidad por asma ha disminuido en los últimos años. En 2005, la mortalidad en los menores de 15 años era de 0,1/100.000 habitantes tanto en varones como en mujeres, lo que supone ocho fallecimientos en niños de 1-4 años y cinco de niños de 10-14 años[62]. El fallecimiento se produce sobre todo en los asmáticos graves, incluso aunque se ha descrito en casos de asma aparentemente moderados. Por tanto, la adolescencia es un período especialmente expuesto, porque las exigencias médicas son mal vistas, el tratamiento se toma de forma caprichosa, dando prioridad a menudo a los β2-adrenérgicos, en detrimento de los tratamientos a largo plazo.
El fallecimiento se produce a menudo al final de un deterioro progresivo del estado respiratorio al que no se ha prestado atención, con una duración que varía de unos días a unas semanas. Se instaura un cuadro de asfixia progresiva al final del cual el niño fallece de repente en su casa, a veces después de una última toma de β2-adrenérgicos. En menos ocasiones, el fallecimiento se produce de un modo más súbito, con frecuencia en el domicilio. Las otras causas de fallecimiento en el asma son mucho menos habituales: exposición masiva a un alérgeno, neumotórax espontáneo, insuficiencia suprarrenal, arritmias, intoxicación farmacológica, shock por aspirina, abuso de sedantes. Es probable que las lesiones anatomopatológicas sean comparables a las observadas en los adultos con infiltración neutrofílica en la muerte súbita y eosinofílica en los fallecimientos menos repentinos[56 , 63]. Lo esencial es determinar cuál es la población de mayor riesgo (Cuadro IX ).
Cuadro IX.
Clasificación de los deportes en función de su carácter asmógeno
| Actividades débilmente asmógenas | Actividades fuertemente asmógenas |
|---|---|
| FV bajo | FV elevado |
| Tenis y juegos de raqueta | Baloncesto |
| Balonmano, béisbol | Rugby |
| Gimnasia | Ciclismo |
| Carreras de velocidad | Carreras de largas distancias |
| Kárate, boxeo | Fútbol |
| Esquí de pista | |
| Golf | |
| Condiciones de humedad y de calor | Condiciones de sequedad y frío |
|
|
FV: flujo ventilatorio.
En realidad, la gran mayoría de los fallecimientos puede prevenirse mediante un tratamiento adecuado. Es esencial enseñar a los niños y a sus progenitores a reconocer un deterioro de su asma, a evaluar la gravedad de la crisis, a interpretar los síntomas clave y a utilizar la flujometría máxima. Un plan de acción por escrito puede disminuir la mortalidad un 70% y la corticoterapia sistémica durante una crisis grave puede reducir dicha mortalidad un 90%[64 , 65].
Asma e infecciones virales
Las infecciones virales se reconocen en la actualidad como el factor precipitante más común de las crisis de asma, en los pacientes asmáticos comprobados[66]. En alrededor del 80% de las crisis de asma, el uso de las técnicas clásicas de diagnóstico (inmunofluorescencia, cultivo, serología) y de la reacción en cadena de la polimerasa (PCR) permite implicar al menos a un agente infeccioso. De este modo, el estudio de Caen efectuado con 75 niños de 3 meses a 13 años de edad, hospitalizados por una crisis de asma, ha detectado, por orden de frecuencia, rinovirus (46,9%), virus respiratorio sincitial (21,2%), enterovirus, (9,8%), virus influenza (5,1%), Chlamydia pneumoniae (4,5%), adenovirus (4,5%), coronavirus (4,5%), virus parainfluenza (3,7%) y Mycoplasma pneumoniae (2,2%)[67]. La clínica de las infecciones virales o relacionadas corresponde a una alteración de las vías respiratorias inferiores. Las infecciones virales tienen una recrudescencia en otoño e invierno. Pueden ser graves, con una insensibilidad relativa a los β2-adrenérgicos y requerir la hospitalización.
Las infecciones virales y el regreso a la escuela pueden combinarse para desequilibrar un cuadro de asma que se había controlado durante las vacaciones de verano. La recrudescencia de las exacerbaciones en el momento de la vuelta a la escuela se ha relacionado desde hace mucho tiempo con la asociación de modificaciones atmosféricas, alergénicas y psicológicas. Los datos recientes han demostrado que esta «epidemia» de exacerbaciones en septiembre es de origen viral[68].
Asma y deporte
El AIE se caracteriza por disnea, tos, opresión respiratoria y sibilancias que aparecen por lo general 5-10 minutos tras interrumpir un ejercicio físico intenso. Esta disnea es de intensidad variable, a menudo moderada, pero a veces intensa. De forma espontánea, es máxima unos quince minutos después de finalizar el ejercicio y desaparece una hora después. La existencia de una fase retardada está puesta en entredicho. Aunque, por lo general, el AIE se produce después de interrumpir el ejercicio, también puede observarse durante un ejercicio físico mantenido[69].
En el 40-50% de los pacientes, existe un período refractario alrededor de 1 hora durante la cual no se puede producir un nuevo broncoespasmo si se realiza un nuevo esfuerzo. Desde el punto de vista clínico, en los niños pequeños suele predominar la tos. En ocasiones, el niño consulta por disnea con pocas o ninguna sibilancia ni tos. La búsqueda del AIE debe ser sistemática si el niño no lo refiere de forma espontánea. En caso de duda diagnóstica, se puede realizar una prueba de esfuerzo, que será positiva si el VEMS o el FEM disminuyen al menos un 15% después del ejercicio[70].
En la actualidad, el AIE se incluye en la evaluación de la gravedad del asma. Un buen control del asma disminuye por lo general la frecuencia y la gravedad del AIE. La reducción de la inflamación es prioritaria en tales casos, sobre todo mediante la corticoterapia inhalada. En menos ocasiones, las manifestaciones de esfuerzo representan las únicas manifestaciones de asma. Por último, en algunos niños, mientras que el asma parece bien controlada desde el punto de vista clínico y funcional, el AIE, que en ocasiones es intensa, sigue siendo la manifestación más preocupante del niño. La adición de un tratamiento antileucotrienos parece ser eficaz en tales casos[71].
La respuesta de un niño al ejercicio puede variar de forma considerable de un día a otro, dependiendo de las características del ejercicio, de las condiciones atmosférica y de la hiperreactividad bronquial, que se ve afectada a su vez por las infecciones virales, la exposición a los alérgenos y la utilización de ciertos fármacos. Una gran parte de esta variabilidad se explica por la fisiopatología del AIE, en la que interviene sobre todo el nivel de ventilación, de pérdida de calor y de agua por el árbol respiratorio. La intervención de los fenómenos inflamatorios y de los mediadores procedentes de las células epiteliales, de los mastocitos, de los eosinófilos, de los macrófagos y de las células neurosensoriales explica probablemente la acción beneficiosa a largo plazo de los CI. La eficacia de los broncodilatadores β2-adrenérgicos inhalados, a título preventivo, tiene un gran valor diagnóstico.
El AIE es distinta de una disnea secundaria a una falta de forma física, pero la distinción no siempre es fácil. El AIE no debe confundirse con la anafilaxia inducida por el ejercicio, tanto si depende como si no de una sensibilización alimentaria[72].
El ejercicio físico corresponde a una necesidad somática, psicológica y sociocultural en los niños asmáticos. A excepción del submarinismo con equipo autónomo, los pacientes asmáticos pueden realizar cualquier deporte, una vez que se ha asegurado el buen control del asma y la ausencia de crisis recientes. Por tanto, los niños asmáticos no deben verse excluidos de las actividades deportivas, sobre todo en el medio escolar. Se debe hacer todo lo posible para sacar al niño asmático del círculo vicioso de falta de forma física. El reentrenamiento del esfuerzo debe formar parte de la estrategia terapéutica en los niños con asma. En el Cuadro IX se ofrecen las clasificaciones aproximadas de los deportes según sus características más o menos asmógenas.
Pronóstico a largo plazo del asma
El futuro a largo plazo del asma infantil es una preocupación considerable. La introducción de los CI ha transformado el tratamiento del asma infantil y del adulto. Una de las preguntas más frecuentes que plantean los progenitores es saber si el asma persistirá toda la vida o al menos hasta la adolescencia. Por tanto, se debe establecer qué factores de riesgo son determinantes en la persistencia de la enfermedad asmática.
Evolución del asma del lactante
Los estudios prospectivos de cohortes han permitido determinar mejor la evolución natural del asma de los niños de edad preescolar. Los resultados de la cohorte de Tucson en Arizona han permitido describir varios fenotipos evolutivos[73]. A los 6 años de edad, el 51,5% de los niños nunca había tenido sibilancias, un 15% nunca las había tenido antes de los 3 años de edad, pero sí a los 6 años (sibilantes tardíos), un 13,7% había tenido sibilancias antes de los 3 años y continuaba con ellas a los 6 años (sibilantes persistentes). En el 41% de los niños que habían tenido sibilancias antes de los 3 años persistían las manifestaciones:
-
•
los sibilantes transitorios, cuyas manifestaciones no perdurarán más allá de los 3 años de edad. Estas sibilancias se asocian al tabaquismo materno y a una disminución de las funciones respiratorias antes del primer episodio de afección respiratoria baja;
-
•
los sibilantes persistentes, cuyas manifestaciones persistirán a los 6 años de edad. Este grupo tiene funciones respiratorias normales durante la primera infancia y marcadores de atopia: aumento precoz de las IgE séricas totales, madres asmáticas con mucha frecuencia. La alteración de las funciones respiratorias a los 6 años en este grupo hace temer una remodelación precoz de las vías respiratorias asociada o secundaria a la inflamación bronquial persistente. En función de la existencia o no de una atopia, los sibilantes persistentes se han subdividido en «atópicos» y «no atópicos»;
-
•
los sibilantes tardíos, cuyas manifestaciones aparecen entre los 3 y los 6 años[74].
Por otra parte, el estudio reciente de Jackson muestra que el 90% de los lactantes que han tenido una bronquiolitis por rinovirus antes de los 3 años de edad tiene asma a los 6 años y que este riesgo es 8 veces mayor que la presencia a los 3 años de una sensibilización a sustancias transmitidas por el aire[75].
Factores de persistencia del asma del lactante en la edad infantil
Los estudios de cohortes[74 , [76], [77], [78], [79], [80] que han tenido un seguimiento prolongado muestran que los factores pronósticos de persistencia y/o de recaída en la infancia son:
-
•
la gravedad y la frecuencia de las manifestaciones iniciales;
-
•la existencia de atopia:
-
○sensibilización alergénica precoz (antes de los 3 años) y persistente a los neumoalérgenos domésticos (ácaros, gato, perro);
-
○sensibilización a los trofoalérgenos;
-
○atopia parental;
-
○
-
•
el bajo peso al nacer y el sexo masculino;
-
•
el tabaquismo materno durante la gestación y/o el tabaquismo pasivo en la primera infancia;
-
•
la presencia de una obstrucción bronquial en las PFR y una hiperreactividad bronquial persistente;
-
•
varios estudios prospectivos han evaluado el efecto de la corticoterapia inhalada sobre la evolución natural del asma[81], [82], [83]. Estos estudios han demostrado que los tratamientos tienen un efecto de suspensión sintomática, pero no un efecto sobre la evolución natural, quizá debido a que se prescriben demasiado tarde.
Evolución del asma infantil
Sólo los estudios prospectivos realizados desde la infancia hasta la edad adulta permiten evaluar de forma válida el pronóstico del asma. Estos estudios muestran que la evolución del asma puede seguir varios modos.
-
•
Las recidivas del asma se producen a veces de forma tardía no sólo en los asmáticos graves, sino también en los asmáticos benignos[84]. Esta evolución se ha demostrado en la cohorte de Strachan en Reino Unido[85]. Se seleccionó una muestra a partir de una cohorte de 18.559 niños nacidos en una semana de marzo de 1958. Estos niños fueron seguidos a los 7, 11, 16, 23 y 33 años de edad, con cuestionarios sobre el asma en los que se apuntaban los episodios de sibilancias. A los 7 años de edad, el asma o las sibilancias fueron referidas por el 18,2% de los pacientes; a los 11 años, sólo un 12% tenía síntomas de asma y a los 16 años, la prevalencia era aún menor, del 11,5%. En el grupo de 880 niños que habían tenido asma antes de los 7 años, el 50% estaba aún asintomático a los 7 años, el 18% continuaba con sibilancias persistentes a los 11 años, el 9% a los 23 años y el 27%, a los 33 años. Sólo el 5% de los pacientes había tenido manifestaciones de asma persistentes a lo largo de todo el seguimiento. De este modo, después de períodos asintomáticos que podían durar varios años, podían producirse recidivas, que eran más frecuentes en los pacientes atópicos y/o fumadores. El estudio de Gerritsen[86] se realizó con 119 niños asmáticos seguidos hasta los 32-42 años de edad. El 43% de ellos aún estaba sintomático en la edad adulta. Los pacientes que desde la infancia tenían un VEMS bajo, una sensibilidad a la histamina elevada y una puntuación clínica elevada eran los que tenían más probabilidades de persistencia del asma. La disminución del VEMS era más significativa en los asmáticos fumadores y que no tomaban los CI todos los días.
-
•
Por lo general, el grado de gravedad cambia poco con la edad. El estudio de Blair, realizado con 267 niños menores de 12 años y que fueron seguidos durante 20 años, muestra que el 66% de los niños con asma benigna tiene un estado excelente 20 años después[84]. En cambio, el 66% de los niños con asma preocupante sigue con él 20 años después, a pesar de tener verdaderas remisiones. En la cohorte de Melbourne[87], 479 niños se siguieron con regularidad desde 1964, desde el punto de vista clínico y funcional. En principio, los niños se clasificaron de la forma siguiente: ninguna sibilancia (105 niños), bronquitis disneizantes sibilantes poco frecuentes (es decir, menos de cinco antes de los 7 años de edad [74 niños]), bronquitis disneizantes sibilantes frecuentes (es decir, más de cinco antes de los 7 años de edad) y asociadas a virosis (104 niños), asma con aparición de crisis sin relación con viriasis (113 niños) y asma grave con crisis frecuentes y obstrucción intercrítica (83 niños). La evolución de las definiciones y del tratamiento del asma explica que, de forma progresiva, las denominaciones hayan sido un poco diferentes y, en la actualidad, los pacientes se clasifican en asintomáticos del modo siguiente: asintomático, asma intermitente, frecuente o persistente. A los 42 años de edad, alrededor del 60% de los niños que tenían bronquitis disneizantes episódicas está asintomático, el 20% tiene un asma episódico poco frecuente y sólo el 20% tiene un asma frecuente. A la inversa, más de la mitad de los casos de asma grave conserva un asma persistente sintomática, un 25% mantiene un asma frecuente y sólo un 10% tiene un asma episódica y otro 10% está asintomático. Durante todo el estudio se observó una buena correlación entre la gravedad de los síntomas clínicos y la alteración de la función respiratoria con el tiempo. Los asmáticos graves tienen muchos más riesgos de presentar síntomas persistentes a los 42 años de edad. Estos pacientes tenían desde el principio y durante la adolescencia hasta la edad adulta una obstrucción bronquial más grave. En Tasmania[88], 8.600 niños de 7 años de edad fueron estudiados con cuestionarios y espirometría y 2.000 de ellos (1.000 con asma y 1.000 sin asma) se revisaron 20 años después. Entre los pacientes asmáticos diagnosticados a los 7 años de edad, el 25,6% era asmático en la edad adulta en comparación con el 10% del grupo control que se volvió asmático. Los factores de persistencia del asma en la edad adulta eran una edad más avanzada de descubrimiento de la enfermedad y crisis de asma más frecuentes. El sexo femenino, el eccema, una alteración de la función pulmonar y los antecedentes familiares de asma eran factores de riesgo significativo del asma en Tasmania.
En todos estos estudios, el papel de los CI es difícil de apreciar, porque sólo se empezaron a prescribir a partir de la década de 1980 y sólo se han descrito a partir de los 21-28 años de edad. Se debe señalar e incluso insistir sobre el hecho de que a los 21 años de edad, el 79% de los casos de asma moderado y el 41% de los casos graves reciben un tratamiento inadecuado o incluso nulo, en especial con un exceso de broncodilatadores respecto a los antiinflamatorios. La mitad de estos pacientes que tienen un cuadro de asma preocupante fuman, mientras que el conocimiento del asma y el uso sensato de los fármacos es deficiente.
Factores de persistencia del asma infantil en la edad adulta
Los factores asociados a la persistencia del asma infantil que se han deducido a partir de estos principales estudios son:
-
•
antecedentes familiares de asma;
-
•
atopia personal. La mayoría de estos estudios epidemiológicos ha demostrado con claridad que las características de atopia personal son un factor de riesgo de persistencia del asma[84 , 87];
-
•
el tabaquismo materno durante la gestación[89] y/o el tabaquismo pasivo en la primera infancia;
-
•
la gravedad del asma infantil. La mayoría de los estudios han demostrado que cuanto más grave es el asma infantil, mayor es el riesgo de persistencia en la edad adulta[84 , 90];
-
•
la hiperreactividad bronquial. Se ha demostrado una relación inversa entre el nivel de la función respiratoria y el grado de hiperreactividad bronquial en los niños y los adultos[86 , 91];
-
•
el sobrepeso y la precocidad de la pubertad[92];
-
•
el sexo; aunque el asma infantil sea más frecuente en los varones que en las mujeres, el asma persistente parece afectar también a las mujeres en la adolescencia[93]. Los estudios longitudinales han demostrado que la prevalencia del asma actual cambia del varón a la mujer en el momento de la pubertad (la proporción se invierte entre los 15 y los 18 años).
Asma y escolaridad
El paciente asmático en la escuela
La escolaridad y, por tanto, el futuro sociolaboral de los niños asmáticos, puede verse alterado en varios niveles. El primer problema es el de las crisis de asma. Cualquier crisis de asma, incluso modesta e inicial, debe tratarse de inmediato, lo que justifica que el niño asmático tenga siempre cerca su broncodilatador inhalado. Algunas circunstancias y períodos son más propicios a la aparición de crisis: regreso a la escuela, educación física, por ejemplo. Es necesario que el niño asmático tenga el derecho de inhalar su β2-adrenérgico antes de la clase de educación física y deportiva. También se debe aceptar la idea de que en algunos períodos, los rendimientos físicos del niño se vean reducidos y de que se deba dar prioridad a algunas actividades físicas a expensas de otras más asmógenas. La escolaridad de los niños asmáticos también puede verse comprometida por problemas de alergia a los pequeños animales que se tienen en la clase, a las concentraciones apreciables de alérgenos de origen felino o canino transportados por la ropa de quienes tienen gatos y/o perros en casa, los picos de contaminación polínica o a una asociación a una alergia alimentaria. El proyecto de acogida individualizada concebido para favorecer la integración de los niños asmáticos debe permitir una buena integración del niño asmático en el medio escolar.
Escuelas del asma
El proyecto de acogida individualizada no exime a los progenitores de su propia responsabilidad. Lo esencial en el tratamiento del asma es la regularidad terapéutica. Son los progenitores quienes deben asegurar el cumplimiento terapéutico de su hijo. Los tratamientos que se toman por la mañana y la noche son los que permiten evitar la mayoría de las crisis que se producen durante el día. Todo esto justifica el desarrollo de las escuelas del asma. Los programas de educación terapéutica para los niños asmáticos y sus progenitores tienen por objetivo desarrollar en el niño asmático, sobre todo en los casos de asma moderado a grave, competencias que permitan una autogestión razonada de sus síntomas y mejorar el cumplimiento terapéutico. La educación terapéutica permite reducir la morbilidad, disminuir el coste de la enfermedad y mejora la calidad de vida de los niños asmáticos y de sus progenitores. La educación terapéutica debe estar estructurada, organizada y ha de llevarse a cabo por profesionales con formación al respecto, además de ser accesible a los pacientes tanto en el hospital como en el ámbito de la medicina de familia.
Conclusión
Los niños asmáticos deben someterse a un seguimiento médico prolongado. Este seguimiento debe ser clínico y funcional respiratorio. Se debe luchar contra el mito de la curación del asma en la pubertad y contra la idea de que los fármacos son más peligrosos que la enfermedad. La corriente actual se orienta a prescribir los tratamientos en una etapa precoz de la vida, lo que haría que el niño estuviese asintomático, pero también normalizaría sus funciones respiratorias. No se debe pasar por alto el control del entorno, tanto desde el punto de vista alérgico como de los irritantes (tabaco, por ejemplo). Se deben tener en cuenta las condiciones socioeconómicas que, si son desfavorables, complican el tratamiento global de los niños asmáticos y de su familia.

Bibliografía
- 1.Moffatt M.F. Genes in asthma: new genes and new ways. Curr. Opin. Allergy Clin. Immunol. 2008;8:411–417. doi: 10.1097/ACI.0b013e32830f1dc1. [DOI] [PubMed] [Google Scholar]
- 2.Marguet C. Prise en charge de la crise d'asthme de l'enfant (nourrisson inclus). Recommandations pour la pratique clinique. Rev. Mal. Respir. 2007;24:427–439. doi: 10.1016/s0761-8425(07)91567-3. [DOI] [PubMed] [Google Scholar]
- 3.Host A., Halken S. The role of allergy in childhood asthma. Allergy. 2000;55:600–608. doi: 10.1034/j.1398-9995.2000.00122.x. [DOI] [PubMed] [Google Scholar]
- 4.Huss K., Adkinson N.F., Jr., Eggleston P.A., Dawson C., Van Natta M.L., Hamilton R.G. House dust mite and cockroach exposure are strong risk factors for positive allergy skin test responses in the Childhood Asthma Management Program. J. Allergy Clin. Immunol. 2001;107:48–54. doi: 10.1067/mai.2001.111146. [DOI] [PubMed] [Google Scholar]
- 5.Groupe de recherche sur les avancées en pneumopédiatrie. Place des EFR dans l'évaluation et la surveillance de l'asthme chez l'enfant de plus de 3 ans. Rev. Mal. Respir. 2003;20:638–643. [PubMed] [Google Scholar]
- 6.Shahid S.K., Kharitonov S.A., Wilson N.M., Bush A., Barnes P.J. Exhaled 8-isoprostane in childhood asthma. Respir. Res. 2005;6:79. doi: 10.1186/1465-9921-6-79. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Noyes B.E., Kemp J.S. Vocal cord dysfunction in children. Paediatr. Respir. Rev. 2007;8:155–163. doi: 10.1016/j.prrv.2007.05.004. [DOI] [PubMed] [Google Scholar]
- 8.Baranes T., Rossignol B., Stheneur C., Bidat E. Syndrome d'hyperventilation chez l'enfant. Arch. Pediatr. 2005;12:1742–1747. doi: 10.1016/j.arcped.2005.09.015. [DOI] [PubMed] [Google Scholar]
- 9.de Blic J., Deschildre A., Pin I., Dubus J.C. Quand et comment modifier la prisen en charge de l'asthme de l'enfant asthmatique à partir de 4 ans? Rev. Mal. Respir. 2009 doi: 10.1016/s0761-8425(09)73678-2. (sous presse) [DOI] [PubMed] [Google Scholar]
- 10.Agertoft L., Pedersen S. Effect of long-term treatment with inhaled budesonide on adult height in children with asthma. N. Engl. J. Med. 2000;343:1064–1069. doi: 10.1056/NEJM200010123431502. [DOI] [PubMed] [Google Scholar]
- 11.Bisgaard H. Efficacy of steroid treatments in the asthmatic preschool child. Allergy. 2002;57:32–41. doi: 10.1034/j.1398-9995.57.s74.3.x. [DOI] [PubMed] [Google Scholar]
- 12.Sizonenko P.C. Effects of inhaled or nasal glucocorticosteroids on adrenal function and growth. J. Pediatr. Endocrinol. Metab. 2002;15:5–26. doi: 10.1515/jpem.2002.15.1.5. [DOI] [PubMed] [Google Scholar]
- 13.The Childhood Asthma Management Program Research Group Long-term effects of budesonide or nedocromil in children with asthma. N. Engl. J. Med. 2000;343:1054–1063. doi: 10.1056/NEJM200010123431501. [DOI] [PubMed] [Google Scholar]
- 14.Todd G.R., Acerini C.L., Ross-Russell R., Zahra S., Warner J.T., McCance D. Survey of adrenal crisis associated with inhaled corticosteroids in the United Kingdom. Arch. Dis. Child. 2002;87:457–461. doi: 10.1136/adc.87.6.457. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Agertoft L., Pedersen S. Short-term lower leg growth rate in children with rhinitis treated with intranasal mometasone furoate and budesonide. J. Allergy Clin. Immunol. 1999;104:948–952. doi: 10.1016/s0091-6749(99)70073-4. [DOI] [PubMed] [Google Scholar]
- 16.Verberne A.A., Frost C., Duiverman E.J., Grol M.H., Kerrebijn K.F. Addition of salmeterol versus doubling the dose of beclomethasone in children with asthma. The Dutch Asthma Study Group. Am. J. Respir. Crit. Care Med. 1998;158:213–219. doi: 10.1164/ajrccm.158.1.9706048. [DOI] [PubMed] [Google Scholar]
- 17.Silverstein M.D., Yunginger J.W., Reed C.E., Petterson T., Zimmerman D., Li J.T. Attained adult height after childhood asthma: effect of glucocorticoid therapy. J. Allergy Clin. Immunol. 1997;99:466–474. doi: 10.1016/s0091-6749(97)70072-1. [DOI] [PubMed] [Google Scholar]
- 18.Martinati L.C., Bertoldo F., Gasperi E., Fortunati P., Lo Cascio V., Boner A.L. Longitudinal evaluation of bone mass in asthmatic children treated with inhaled beclomethasone dipropionate or cromolyn sodium. Allergy. 1998;53:705–708. doi: 10.1111/j.1398-9995.1998.tb03957.x. [DOI] [PubMed] [Google Scholar]
- 19.Dubus J.C., Marguet C., Deschildre A., Mely L., Le Roux P., Brouard J. Local side-effects of inhaled corticosteroids in asthmatic children: influence of drug, dose, age, and device. Allergy. 2001;56:944–948. doi: 10.1034/j.1398-9995.2001.00100.x. [DOI] [PubMed] [Google Scholar]
- 20.Holt S., Suder A., Weatherall M., Cheng S., Shirtcliffe P., Beasley R. Dose-response relation of inhaled fluticasone propionate in adolescents and adults with asthma: meta-analysis. BMJ. 2001;323:253–256. doi: 10.1136/bmj.323.7307.253. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Anderson S.D. Exercise-induced asthma in children: a marker of airway inflammation. Med. J. Aust. 2002;177:S61–S63. doi: 10.5694/j.1326-5377.2002.tb04821.x. [DOI] [PubMed] [Google Scholar]
- 22.Lima J.J., Zhang S., Grant A., Shao L., Tantisira K.G., Allayee H. Influence of leukotriene pathway polymorphisms on response to montelukast in asthma. Am. J. Respir. Crit. Care Med. 2006;173:379–385. doi: 10.1164/rccm.200509-1412OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Humbert M., Beasley R., Ayres J., Slavin R., Hebert J., Bousquet J. Benefits of omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy. 2005;60:309–316. doi: 10.1111/j.1398-9995.2004.00772.x. [DOI] [PubMed] [Google Scholar]
- 24.Milgrom H., Berger W., Nayak A., Gupta N., Pollard S., McAlary M. Treatment of childhood asthma with anti-immunoglobulin E antibody (omalizumab) Pediatrics. 2001;108:E36. doi: 10.1542/peds.108.2.e36. [DOI] [PubMed] [Google Scholar]
- 25.Warner J.O., Naspitz C.K. Third International Pediatric Consensus statement on the management of childhood asthma. International Pediatric Asthma Consensus Group. Pediatr. Pulmonol. 1998;25:1–17. doi: 10.1002/(sici)1099-0496(199801)25:1<1::aid-ppul1>3.0.co;2-s. [DOI] [PubMed] [Google Scholar]
- 26.de Blic J., Ogodorova L., Klink R., Sidorenko I., Valiulis A., Hofman J. Salmeterol fluticasone propionate versus double dose fluticasone propionate on lung function and asthma control in children. Pediatr Allergy Immunol. 2009 doi: 10.1111/j.1399-3038.2009.00861.x. [Epub ahead of print] [DOI] [PubMed] [Google Scholar]
- 27.de Blic J., Deschildre A. Suivi de l'enfant asthmatique : définition et outils de mesure. Rev. Mal. Respir. 2008;25:695–704. doi: 10.1016/s0761-8425(08)73799-9. [DOI] [PubMed] [Google Scholar]
- 28.Bateman E.D., Jacques L., Goldfrad C., Atienza T., Mihaescu T., Duggan M. Asthma control can be maintained when fluticasone propionate/salmeterol in a single inhaler is stepped down. J. Allergy Clin. Immunol. 2006;117:563–570. doi: 10.1016/j.jaci.2005.11.036. [DOI] [PubMed] [Google Scholar]
- 29.Godard P., Greillier P., Pigearias B., Nachbaur G., Desfougeres J.L., Attali V. Maintaining asthma control in persistent asthma: comparison of three strategies in a 6-month double-blind randomised study. Respir. Med. 2008;102:1124–1131. doi: 10.1016/j.rmed.2008.03.014. [DOI] [PubMed] [Google Scholar]
- 30.McGivern D.V., Ward M., MacFarlane J.T., Roderick Smith W.H. Failure of once daily inhaled corticosteroid treatment to control chronic asthma. Thorax. 1984;39:933–934. doi: 10.1136/thx.39.12.933. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Campbell L.M., Bodalia B., Gogbashian C.A., Gunn S.D., Humphreys P.J., Powell J.P. Once-daily budesonide: 400 micrograms once daily is as effective as 200 micrograms twice daily in controlling childhood asthma. PETITE Research Group. Int. J. Clin. Pract. 1998;52:213–219. [PubMed] [Google Scholar]
- 32.Moller C. Once-daily inhaled corticosteroids in children with asthma: dry powder inhalers. Drugs. 1999;58(suppl4):35–41. doi: 10.2165/00003495-199958004-00005. [DOI] [PubMed] [Google Scholar]
- 33.Pohunek P., Kuna P., Jorup C., De Boeck K. Budesonide/formoterol improves lung function compared with budesonide alone in children with asthma. Pediatr. Allergy Immunol. 2006;17:458–465. doi: 10.1111/j.1399-3038.2006.00425.x. [DOI] [PubMed] [Google Scholar]
- 34.Russell G., Williams D.A., Weller P., Price J.F. Salmeterol xinafoate in children on high dose inhaled steroids. Ann. Allergy Asthma Immunol. 1995;75:423–428. [PubMed] [Google Scholar]
- 35.Tal A., Simon G., Vermeulen J.H., Petru V., Cobos N., Everard M.L. Budesonide/formoterol in a single inhaler versus inhaled corticosteroids alone in the treatment of asthma. Pediatr. Pulmonol. 2002;34:342–350. doi: 10.1002/ppul.10173. [DOI] [PubMed] [Google Scholar]
- 36.Visser M.J., Postma D.S., Arends L.R., de Vries T.W., Duiverman E.J., Brand P.L. One-year treatment with different dosing schedules of fluticasone propionate in childhood asthma. Effects on hyperresponsiveness, lung function, and height. Am. J. Respir. Crit. Care Med. 2001;164:2073–2077. doi: 10.1164/ajrccm.164.11.2103075. [DOI] [PubMed] [Google Scholar]
- 37.Ducharme F.M., Lasserson T.J., Cates C.J. Long-acting beta2-agonists versus anti-leukotrienes as add-on therapy to inhaled corticosteroids for chronic asthma. Cochrane Database Syst. Rev. 2006;(4):CD003137. doi: 10.1002/14651858.CD003137.pub3. [DOI] [PubMed] [Google Scholar]
- 38.Joos S., Miksch A., Szecsenyi J., Wieseler B., Grouven U., Kaiser T. Montelukast as add-on therapy to inhaled corticosteroids in the treatment of mild to moderate asthma: a systematic review. Thorax. 2008;63:453–462. doi: 10.1136/thx.2007.081596. [DOI] [PubMed] [Google Scholar]
- 39.Tantisira K.G., Fuhlbrigge A.L., Tonascia J., Van Natta M., Zeiger R.S., Strunk R.C. Bronchodilation and bronchoconstriction: predictors of future lung function in childhood asthma. J. Allergy Clin. Immunol. 2006;117:1264–1271. doi: 10.1016/j.jaci.2006.01.050. [DOI] [PubMed] [Google Scholar]
- 40.Pijnenburg M.W., De Jongste J.C. Exhaled nitric oxide in childhood asthma: a review. Clin. Exp. Allergy. 2008;38:246–259. doi: 10.1111/j.1365-2222.2007.02897.x. [DOI] [PubMed] [Google Scholar]
- 41.Szefler S.J., Mitchell H., Sorkness C.A., Gergen P.J., O'Connor G.T., Morgan W.J. Management of asthma based on exhaled nitric oxide in addition to guideline-based treatment for inner-city adolescents and young adults: a randomised controlled trial. Lancet. 2008;372:1065–1072. doi: 10.1016/S0140-6736(08)61448-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Zacharasiewicz A., Wilson N., Lex C., Erin E.M., Li A.M., Hansel T. Clinical use of noninvasive measurements of airway inflammation in steroid reduction in children. Am. J. Respir. Crit. Care Med. 2005;171:1077–1082. doi: 10.1164/rccm.200409-1242OC. [DOI] [PubMed] [Google Scholar]
- 43.Zacharasiewicz A., Erin E.M., Bush A. Noninvasive monitoring of airway inflammation and steroid reduction in children with asthma. Curr. Opin. Allergy Clin. Immunol. 2006;6:155–160. doi: 10.1097/01.all.0000225152.37403.21. [DOI] [PubMed] [Google Scholar]
- 44.Sporik R., Holgate S.T., Platts-Mills T.A., Cogswell J.J. Exposure to house-dust mite allergen (Der p I) and the development of asthma in childhood. A prospective study. N. Engl. J. Med. 1990;323:502–507. doi: 10.1056/NEJM199008233230802. [DOI] [PubMed] [Google Scholar]
- 45.de Blay F., Donnay C., Casset A., Ott M. Évictions allergiques. In: Scheinmann P., editor. Allergologie pédiatrique. Flammarion Médecine-Sciences; Paris: 2007. pp. 336–346. [Google Scholar]
- 46.Bousquet J., Demoly P., Michel F.B. Specific immunotherapy in rhinitis and asthma. Ann. Allergy Asthma Immunol. 2001;87:38–42. doi: 10.1016/s1081-1206(10)62193-x. [DOI] [PubMed] [Google Scholar]
- 47.Tabachnik E., Levison H. Infantile bronchial asthma. J. Allergy Clin. Immunol. 1981;67:339–347. doi: 10.1016/0091-6749(81)90077-4. [DOI] [PubMed] [Google Scholar]
- 48.Brand P.L., Baraldi E., Bisgaard H., Boner A.L., Castro-Rodriguez J.A., Custovic A. Definition, assessment and treatment of wheezing disorders in preschool children: an evidence-based approach. Eur. Respir. J. 2008;32:1096–1110. doi: 10.1183/09031936.00002108. [DOI] [PubMed] [Google Scholar]
- 49.Baraldi E., Dario C., Ongaro R., Scollo M., Azzolin N.M., Panza N. Exhaled nitric oxide concentrations during treatment of wheezing exacerbation in infants and young children. Am. J. Respir. Crit. Care Med. 1999;159:1284–1288. doi: 10.1164/ajrccm.159.4.9807084. [DOI] [PubMed] [Google Scholar]
- 50.Garrison M.M., Christakis D.A., Harvey E., Cummings P., Davis R.L. Systemic corticosteroids in infant bronchiolitis: a meta-analysis. Pediatrics. 2000;105:E44. doi: 10.1542/peds.105.4.e44. [DOI] [PubMed] [Google Scholar]
- 51.Bisgaard H. Montelukast in RSV-bronchiolitis. Am. J. Respir. Crit. Care Med. 2004;169:542–543. doi: 10.1164/ajrccm.169.4.952. [DOI] [PubMed] [Google Scholar]
- 52.Bisgaard H., Flores-Nunez A., Goh A., Azimi P., Halkas A., Malice M.P. Study of montelukast for the treatment of respiratory symptoms of post-respiratory syncytial virus bronchiolitis in children. Am. J. Respir. Crit. Care Med. 2008;178:854–860. doi: 10.1164/rccm.200706-910OC. [DOI] [PubMed] [Google Scholar]
- 53.Bacharier L.B., Boner A., Carlsen K.H., Eigenmann P.A., Frischer T., Gotz M. Diagnosis and treatment of asthma in childhood: a PRACTALL consensus report. Allergy. 2008;63:5–34. doi: 10.1111/j.1398-9995.2007.01586.x. [DOI] [PubMed] [Google Scholar]
- 54.Bacharier L.B., Strunk R.C., Mauger D., White D., Lemanske R.F., Jr., Sorkness C.A. Classifying asthma severity in children: mismatch between symptoms, medication use, and lung function. Am. J. Respir. Crit. Care Med. 2004;170:426–432. doi: 10.1164/rccm.200308-1178OC. [DOI] [PubMed] [Google Scholar]
- 55.Wenzel S. Severe asthma in adults. Am. J. Respir. Crit. Care Med. 2005;172:149–160. doi: 10.1164/rccm.200409-1181PP. [DOI] [PubMed] [Google Scholar]
- 56.Wenzel S.E., Schwartz L.B., Langmack E.L., Halliday J.L., Trudeau J.B., Gibbs R.L. Chu, Evidence that severe asthma can be divided pathologically into two inflammatory subtypes with distinct physiologic and clinical characteristics. Am. J. Respir. Crit. Care Med. 1999;160:1001–1008. doi: 10.1164/ajrccm.160.3.9812110. [DOI] [PubMed] [Google Scholar]
- 57.de Blic J., Tillie-Leblond I., Tonnel A.B., Jaubert F., Scheinmann P., Gosset P.P. Difficult asthma in children: an analysis of airway inflammation. J. Allergy Clin. Immunol. 2004;113:94–100. doi: 10.1016/j.jaci.2003.10.045. [DOI] [PubMed] [Google Scholar]
- 58.Payne D.N., Adcock J.M., Wilson N.M., Oates T., Scallan M., Bush A. Relationship between exhaled nitric oxide and mucosal eosinophilic inflammation in children with difficult asthma, after treatment with oral prednisolone. Am. J. Respir. Crit. Care Med. 2001;164:1376–1381. doi: 10.1164/ajrccm.164.8.2101145. [DOI] [PubMed] [Google Scholar]
- 59.Tillie-Leblond I., de Blic J., Jaubert F., Wallaert B., Scheinmann P., Gosset P. Airway remodeling is correlated with obstruction in children with severe asthma. Allergy. 2008;63:533–541. doi: 10.1111/j.1398-9995.2008.01656.x. [DOI] [PubMed] [Google Scholar]
- 60.de Blic J., Tillie-Leblond I., Emond S., Mahut B., Dang Duy T.L., Scheinmann P. High-resolution computed tomography scan and airway remodeling in children with severe asthma. J. Allergy Clin. Immunol. 2005;116:750–754. doi: 10.1016/j.jaci.2005.07.009. [DOI] [PubMed] [Google Scholar]
- 61.Adcock I.M., Caramori G., Chung K.F. New targets for drug development in asthma. Lancet. 2008;372:1073–1087. doi: 10.1016/S0140-6736(08)61449-X. [DOI] [PubMed] [Google Scholar]
- 62.Tual S., Godard P., Piau J.P., Bousquet J., Annesi-Maesano I. Asthma-related mortality in France, 1980-2005: decline since the last decade. Allergy. 2008;63:621–623. doi: 10.1111/j.1398-9995.2008.01657.x. [DOI] [PubMed] [Google Scholar]
- 63.Sur S., Crotty T.B., Kephart G.M., Hyma B.A., Colby T.V., Reed C.E. Sudden-onset fatal asthma. A distinct entity with few eosinophils and relatively more neutrophils in the airway submucosa? Am. Rev. Respir. Dis. 1993;148:713–719. doi: 10.1164/ajrccm/148.3.713. [DOI] [PubMed] [Google Scholar]
- 64.Campbell M.J., Cogman G.R., Holgate S.T., Johnston S.L. Age specific trends in asthma mortality in England and Wales, 1983-95: results of an observational study. BMJ. 1997;314:1439–1441. doi: 10.1136/bmj.314.7092.1439. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Mannino D.M., Homa D.M., Akinbami L.J., Moorman J.E., Gwynn C., Redd S.C. Surveillance for asthma--United States, 1980-1999. MMWR Surveill. Summ. 2002;51:1–13. [PubMed] [Google Scholar]
- 66.Heymann P.W., Platts-Mills T.A., Johnston S.L. Role of viral infections, atopy and antiviral immunity in the etiology of wheezing exacerbations among children and young adults. Pediatr. Infect. Dis. J. 2005;24:S217–S222. doi: 10.1097/01.inf.0000188164.33856.f9. [DOI] [PubMed] [Google Scholar]
- 67.Freymuth F., Vabret A., Brouard J., Toutain F., Verdon R., Petitjean J. Detection of viral, Chlamydia pneumoniae and Mycoplasma pneumoniae infections in exacerbations of asthma in children. J. Clin. Virol. 1999;13:131–139. doi: 10.1016/S1386-6532(99)00030-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Johnston N.W., Johnston S.L., Duncan J.M., Greene J.M., Kebadze T., Keith P.K. The september epidemic of asthma exacerbations in children: a search for etiology. J. Allergy Clin. Immunol. 2005;115:132–138. doi: 10.1016/j.jaci.2004.09.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Milgrom H., Taussig L.M. Keeping children with exercise-induced asthma active. Pediatrics. 1999;104:L1–L5. doi: 10.1542/peds.104.3.e38. [DOI] [PubMed] [Google Scholar]
- 70.Karila C. Test à l'exercice chez l'enfant. Arch. Pediatr. 2007;14:1045–1049. doi: 10.1016/j.arcped.2007.03.010. [DOI] [PubMed] [Google Scholar]
- 71.Kemp J.P., Dockhorn R.J., Shapiro G.G., Nguyen H.H., Reiss T.F., Seidenberg B.C. Montelukast once daily inhibits exercise-induced bronchoconstriction in 6- to 14-year-old children with asthma. J. Pediatr. 1998;133:424–428. doi: 10.1016/s0022-3476(98)70281-1. [DOI] [PubMed] [Google Scholar]
- 72.Guinnepain M.T., Eloit C., Raffard M., Brunet-Moret M.J., Rassemont R., Laurent J. Exercise-induced anaphylaxis: useful screening of food sensitization. Ann. Allergy Asthma Immunol. 1996;77:491–496. doi: 10.1016/S1081-1206(10)63357-1. [DOI] [PubMed] [Google Scholar]
- 73.Martinez F., Wright A., Taussig L., Holberg C., Halonen M., Morgan W. Asthma and wheezing in the first six years of life. N. Engl. J. Med. 1995;332:133–138. doi: 10.1056/NEJM199501193320301. [DOI] [PubMed] [Google Scholar]
- 74.Morgan W.J., Stern D.A., Sherrill D.L., Guerra S., Holberg C.J., Guilbert T.W. Outcome of asthma and wheezing in the first 6 years of life: follow-up through adolescence. Am. J. Respir. Crit. Care Med. 2005;172:1253–1258. doi: 10.1164/rccm.200504-525OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Jackson D.J., Gangnon R.E., Evans M.D., Roberg K.A., Anderson E.L., Pappas T.E. Wheezing rhinovirus illnesses in early life predict asthma development in high-risk children. Am. J. Respir. Crit. Care Med. 2008;178:667–672. doi: 10.1164/rccm.200802-309OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Custovic A., Wijk R.G. The effectiveness of measures to change the indoor environment in the treatment of allergic rhinitis and asthma: ARIA update (in collaboration with GA(2)LEN) Allergy. 2005;60:1112–1115. doi: 10.1111/j.1398-9995.2005.00934.x. [DOI] [PubMed] [Google Scholar]
- 77.Delacourt C., Benoist M.R., Le Bourgeois M., Waernessyckle S., Rufin P., Brouard J.J. Relationship between bronchial hyperresponsiveness and impaired lung function after infantile asthma. PLoS ONE. 2007;2:e1180. doi: 10.1371/journal.pone.0001180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Matricardi P.M., Illi S., Grüber C., Keil T., Nickel R., Wahn U. Wheezing in childhood: incidence, longitudinal patterns and factors predicting persistence. Eur. Respir. J. 2008;32:585–592. doi: 10.1183/09031936.00066307. [DOI] [PubMed] [Google Scholar]
- 79.Stern D.A., Morgan W.J., Halonen M., Wright A.L., Martinez F.D. Wheezing and bronchial hyper-responsiveness in early childhood as predictors of newly diagnosed asthma in early adulthood: a longitudinal birth-cohort study. Lancet. 2008;372:1058–1064. doi: 10.1016/S0140-6736(08)61447-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Strunk R.C. Childhood Asthma Management Program: lessons learned. J. Allergy Clin. Immunol. 2007;119:36–42. doi: 10.1016/j.jaci.2006.09.038. [DOI] [PubMed] [Google Scholar]
- 81.Bisgaard H., Gillies J., Groenewald M., Maden C. The effect of inhaled fluticasone propionate in the treatment of young asthmatic children: a dose comparison study. Am. J. Respir. Crit. Care Med. 1999;160:126–131. doi: 10.1164/ajrccm.160.1.9811024. [DOI] [PubMed] [Google Scholar]
- 82.Guilbert T.W., Morgan W.J., Zeiger R.S., Mauger D.T., Boehmer S.J., Szefler S.J. Long-term inhaled corticosteroids in preschool children at high risk for asthma. N. Engl. J. Med. 2006;354:1985–1997. doi: 10.1056/NEJMoa051378. [DOI] [PubMed] [Google Scholar]
- 83.Murray C.S., Woodcock A., Langley S.J., Morris J., Custovic A. Secondary prevention of asthma by the use of Inhaled Fluticasone propionate in Wheezy INfants (IFWIN): double-blind, randomised, controlled study. Lancet. 2006;368:754–762. doi: 10.1016/S0140-6736(06)69285-4. [DOI] [PubMed] [Google Scholar]
- 84.Blair H. Natural history of childhood asthma. 20-year follow-up. Arch. Dis. Child. 1977;52:613–619. doi: 10.1136/adc.52.8.613. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Strachan D.P., Butland B.K., Anderson H.R. Incidence and prognosis of asthma and wheezing illness from early childhood to age 33 in a national British cohort. BMJ. 1996;312:1195–1199. doi: 10.1136/bmj.312.7040.1195. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Roorda R.J., Gerritsen J., van Aalderen W.M., Schouten J.P., Veltman J.C., Weiss S.T. Follow-up of asthma from childhood to adulthood: influence of potential childhood risk factors on the outcome of pulmonary function and bronchial responsiveness in adulthood. J. Allergy Clin. Immunol. 1994;93:575–584. doi: 10.1016/s0091-6749(94)70069-9. [DOI] [PubMed] [Google Scholar]
- 87.Phelan P.D., Robertson C.F., Olinsky A. The Melbourne Asthma Study: 1964-1999. J. Allergy Clin. Immunol. 2002;109:189–194. doi: 10.1067/mai.2002.120951. [DOI] [PubMed] [Google Scholar]
- 88.Gibson H.B., Silverstone H., Gandevia B., Hall G.J. Respiratory disorders in seven-year-old children in Tasmania. Aims, methods and administration of the survey. Med. J. Aust. 1969;2:201–205. [PubMed] [Google Scholar]
- 89.Gilliland F.D., Berhane K., Li Y.F., Rappaport E.B., Peters J.M. Effects of early onset asthma and in utero exposure to maternal smoking on childhood lung function. Am. J. Respir. Crit. Care Med. 2003;167:917–924. doi: 10.1164/rccm.200206-616OC. [DOI] [PubMed] [Google Scholar]
- 90.Strachan D.P., Cook D.G. Health effects of passive smoking. 6. Parental smoking and childhood asthma: longitudinal and case-control studies. Thorax. 1998;53:204–212. doi: 10.1136/thx.53.3.204. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Gerritsen J., Koeter G.H., Postma D.S., Schouten J.P., van Aalderen W.M., Knol K. Airway responsiveness in childhood as a predictor of the outcome of asthma in adulthood. Am. Rev. Respir. Dis. 1991;143:1468–1469. doi: 10.1164/ajrccm/143.6.1468. [DOI] [PubMed] [Google Scholar]
- 92.Guerra S., Wright A.L., Morgan W.J., Sherrill D.L., Holberg C.J., Martinez F.D. Persistence of asthma symptoms during adolescence: role of obesity and age at the onset of puberty. Am. J. Respir. Crit. Care Med. 2004;170:78–85. doi: 10.1164/rccm.200309-1224OC. [DOI] [PubMed] [Google Scholar]
- 93.Jenkins M.A., Hopper J.L., Bowes G., Carlin J.B., Flander L.B., Giles G.G. Factors in childhood as predictors of asthma in adult life. BMJ. 1994;309:90–93. doi: 10.1136/bmj.309.6947.90. [DOI] [PMC free article] [PubMed] [Google Scholar]
Para saber más
- 94.NIH-NHLBI/WHO workshop report, Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention : www.ginasthma.com. NIH publication, 2007. 02-3659.
- 95.National Heart and Blood Institute. National Asthma Education and Prevention Program Expert Panel Report 3 : Guidelines for the Diagnosis and Management of Asthma Full Report 2007 August 28, 2007. www.nhlbi.nih.gov.
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.
Supplementary Materials
Cuerpo extraño inhalado en el bronquio principal izquierdo. Lactante de 20 meses con bronquiolitis repetidas. El inicio de la primera crisis fue súbito, sin rinitis. Persistencia de obstrucción entre las crisis. Radiografía en inspiración (a) y espiración (b): hiperclaridad pulmonar izquierda.

Lactante de 8 meses con obstrucción persistente.
a. Doble indentación esofágica en el tránsito esofagogastroduodenal (flechas).
b. Demostración de un doble cayado aórtico en la tomografía computarizada (TC) con contraste.

Secuela grave de una viriasis respiratoria.
Iconografía adicional 8a. Síndrome de MacLeod con un pequeño pulmón claro unilateral (hiperclaridad izquierda).
Iconografía adicional 8b. Imagen de tomografía computarizada (TC) donde se observa una atelectasia completa con dilatación de los bronquios del lóbulo inferior izquierdo. Hiperclaridad con hipoperfusión considerable del lóbulo superior izquierdo.

Falso asma en una niña de 13 meses. Tomografía computarizada (TC) con contraste donde se muestra la compresión de la tráquea por una arteria pulmonar izquierda anómala.

Niño de 10 años que presenta un cuadro de asma persistente desde hace 3 meses. Predominio de sibilancias en el lado derecho.
Iconografía adicional 10a. Hiperclaridad derecha que mejora en la radiografía en espiración (derecha). Imagen de la izquierda: inspiración.
Iconografía adicional 10b. Cuerpo extraño (flor de plástico) impactado en el bronquio principal derecho.

Aspectos característicos de las anomalías en la tomografía computarizada (TC) de las displasias broncopulmonares donde se asocian bandas de atelectasias (1), invaginaciones pleurales (2), zonas hipodensas (3) y bullas subpleurales (4).




