Résumé
La propagation du nouveau coronavirus SARS-CoV-2, découvert en Chine en janvier 2020, a mené à une pandémie dès mars 2020, obligeant chaque système de soins des pays touchés à une adaptation rapide. Pour mieux faire face à cette crise sanitaire majeure, qui a donné lieu à de nombreuses publications scientifiques, nous avons synthétisé les principales études cliniques originales afin de faciliter la prise en charge au quotidien des patients atteints de COVID-19. Nous détaillons les premiers signes et l’évolution de la maladie ainsi que les différentes formes cliniques, y compris extra-pulmonaires, telles qu’elles sont connues au début de cette pandémie. Nous insistons sur les marqueurs cliniques, biologiques et scannographiques prédictifs de sévérité ou de mortalité. Enfin, nous discutons de l’impact de l’infection par le SARS-CoV-2 dans les populations suspectes d’être à haut risque de formes sévères.
Mots clés: SARS-CoV-2, Nouveau coronavirus, COVID-19, Épidémiologie, Clinique
Abstract
The spread of the new coronavirus SARS-CoV-2, discovered in China in January 2020, led to a pandemic as early as March 2020, forcing every health care system in the affected countries to adapt quickly. In order to better address this major health crisis, which has given rise to numerous scientific publications, we have synthesized the main original clinical studies to facilitate the day-to-day management of patients with COVID-19. We detail the early signs and progression of the disease as well as the different clinical forms, including extra-pulmonary, as known at the beginning of this pandemic. We focus on clinical, biological and CT markers predictive of severity or mortality. Finally, we discuss the impact of SARS-CoV-2 infection in populations suspected to be at high risk of severe forms.
Keywords: SARS-CoV-2, Novel coronavirus, COVID-19, Epidemiology, Clinical
La famille des coronavirus est responsable d’infections respiratoires chez les mammifères et les oiseaux. Il s’agit de virus à ARN, regroupés en quatre sous-familles : Alphacoronavirus, Betacoronavirus, Gammacoronavirus et Deltacoronavirus. Chez l’homme, quatre sont responsables de pathologies bénignes chez les patients immunocompétents (HCoV-229E, HCoV-OC43, HCoV-NL63 et HKU1) [1]. Deux sont responsables de pathologies sévères et potentiellement mortelles : le SARS-CoV-1 et le MERS-CoV, identifiés respectivement en 2003 et 2012 [2], [3], [4]. Le SARS-CoV-1 avait provoqué la mort de 774 personnes en 2002–2003 après avoir infecté 8096 personnes, essentiellement en Chine dans la province de Guangdon et à Hong Kong. Le taux de létalité était estimé à 9,6 %. Le MERS-CoV a été responsable en 2012 d’une épidémie localisée au Moyen-Orient. Le taux de létalité était de 38 %. En 2015, une seconde épidémie, en Corée du Sud avait fait 36 morts sur 186 cas confirmés [5]. L’origine de ces deux virus était zoonotique : le SARS-CoV-1 avait probablement été transmis à l’homme à partir de la civette, du raton laveur ou du furet [6] et le MERS-CoV à partir du dromadaire [7]. L’hôte naturel était dans les deux cas la chauve-souris [1].
En décembre 2019, l’apparition de plusieurs cas de pneumopathies d’origine inconnue dans la province de Hubei en Chine a conduit à l’identification, en janvier 2020, d’un nouveau coronavirus [8], appelé SARS-CoV-2 par le groupe de travail Coronavirus du Comité international de taxonomie des virus [9]. Il s’agit d’un Betacoronavirus probablement transmis à l’homme par le pangolin, sur le marché de fruits de mer de Huanan, situé dans la ville de Wuhan [10]. La transmission interhumaine a entraîné la propagation du virus vers la Thaïlande puis vers d’autres pays, causant une pandémie aujourd’hui [11].
Le SARS-CoV-2 provoque une maladie respiratoire parfois sévère, nommée « COVID-19 » par l’Organisation mondiale de la santé (OMS). Après l’Asie, l’Europe, les États-Unis et l’Iran sont les régions du monde les plus touchées [12].
La rapidité et l’étendue de la propagation virale à travers le monde ont conduit à de nombreuses publications concernant les données cliniques, biologiques et radiologiques. Nous avons souhaité faire une revue des données descriptives de l’infection et discuter des stratégies diagnostiques. La thérapeutique est en revanche en dehors des objectifs de cet article.
Les données qui suivent ont été colligées à partir de la base de données Pubmed, interrogée entre le 20 mars 2020 et le 12 avril 2020, avec les termes MesH suivants : « Novel coronavirus AND clinical » ; « Novel coronavirus AND radiology » ; « Novel coronavirus AND Computed Tomography » « Novel coronavirus AND diagnostic » ; « Novel coronavirus AND biology » ; « Novel coronavirus AND RT-PCR » ; « Novel coronavirus AND Pregnancy » ; « Novel coronavirus AND Pediatrics ». Les recherches ont été restreintes aux publications de l’année 2020, le premier cluster de pneumopathies inexpliquées rapporté à la Commission de la santé nationale chinoise datant de fin décembre 2019 [13]. Ont été exclues les études sans traduction anglaise, les revues de la littérature et les études thérapeutiques. Les études cliniques et épidémiologiques présentant les effectifs les plus larges et la méthodologie nous paraissant la plus rigoureuse sont discutées dans cette revue. Nous avons aussi actualisé certaines données grâce à la veille bibliographique proposée par l’INSERM (REACTing) et utilisé des sources non référencées sur Pubmed comme UpToDate et COVID Reference [14], [15], [16]. Il est utile de souligner que la quasi-totalité des informations disponibles proviennent de données recueillies chez des personnes hospitalisées et décrivent donc les formes les plus graves de la maladie. Par ailleurs, beaucoup de données sont issues de séries de cas de faible effectif, ce qui en limite la portée.
1. Données épidémiologiques
1.1. Durée d’incubation
Dans l’étude de Guan et al. portant sur 1099 patients vus rétrospectivement, la durée médiane d’incubation, définie comme l’intervalle entre la date d’un premier contact potentiel avec un patient suspect ou confirmé de COVID-19 et la date d’apparition des symptômes, était estimée à 4 jours (IQR 2–7) [17]. Dans l’étude de Qun et al., elle était estimée à 5,2 jours (4,1–7) et pour 95 % des patients, les symptômes apparaissaient dans les 12,5 jours suivant le contage [10]. Enfin, dans une autre étude reprenant 181 cas d’infection à SARS-CoV-2, la durée médiane d’incubation était estimée à 5,1 jours et 97,5 % des patients développaient des symptômes dans les 11,5 jours suivant le contage [18].
1.2. Contagiosité
Le potentiel de contagiosité d’un agent infectieux peut s’évaluer par un indicateur appelé R 0 (ou taux de reproduction), correspondant au nombre moyen d’infections secondaires pouvant être générées à partir d’un cas index, dans une population entièrement susceptible d’être infectée, c’est-à-dire qui n’a pas été immunisée contre l’agent infectieux.
Lors du premier mois de l’épidémie en Chine, l’OMS avait estimé le R 0 à 2,6 (1,5–3,5) [19]. En mars 2020, une méta-analyse montrait que ce R 0 était probablement supérieur, estimé à 3,3 (médiane de 2,8, avec un intervalle interquartile à 1,2) [20].
La pratique répétée de reverse-transcriptase polymerase-chain-reaction (RT-PCR) sur prélèvements nasopharyngés a montré que la charge virale était plus élevée lors des premiers jours de symptômes et qu’elle diminuait jusqu’au 11e jour [21], [22]. La durée de positivité de la RT-PCR pouvait s’étendre jusqu’à 25 jours après l’apparition des premiers symptômes et dépassait 20 jours chez 7/21 patients rapportés dans une étude chinoise [23].
Ces études suggèrent que la contagiosité est probablement plus importante lors des premiers jours de symptômes et qu’elle pourrait persister plus de trois semaines. Cependant, ces résultats doivent être pondérés, un résultat positif de RT-PCR ne signifiant pas nécessairement que le virus est vivant et qu’il est infectieux. Des cultures virales sont pour cela indispensables.
1.3. Modes de transmission du SARS-CoV-2
La transmission interhumaine du virus SARS-CoV-2 a été démontrée en février 2020 après qu’une contamination intrafamiliale ait été rapportée [24].
L’étude de Jefferson, en 2009, avait montré que le port de masque N95 (proches des FFP2) diminuait de 91 % le risque d’infection par le SARS-CoV-1. Le port d’un tablier/sur-blouse diminuait ce risque de 77 % (ce qui peut sembler surprenant comparativement à la protection conférée par les autres mesures), le port de masque chirurgical de 68 %, et le lavage fréquent des mains de 55 % [25]. Ces observations suggéraient bien une transmission interhumaine par voie aéroportée (gouttelettes ou aérosols), oro-fécale ou contact. Par analogie avec le SARS-CoV-1, des modes de transmission similaire ont été évoqués pour le SARS-CoV-2. L’étude de Van Doremalen a montré que ce virus pouvait rester viable pendant 3 heures dans les aérosols et 72 heures sur les surfaces inertes, suggérant une contamination de type air et contact [26]. La diminution du risque d’infection par le SARS-CoV-2 par l’utilisation de masque de type N95, la désinfection et le lavage régulier des mains confortait cette hypothèse [27]. Enfin, une méta-analyse récente ne retrouvait pas de différence de protection entre le port de masque chirurgical et le port de masque N95, suggérant une transmission essentiellement de type gouttelette, mais cette étude repose encore sur un nombre limité de travaux [28].
Par ailleurs, la présence d’ARN viral dans le sang ou les selles a fait évoquer les possibilités d’une contamination sanguine ou oro-fécale, qui n’ont toutefois pas été démontrées à ce jour [29], [30]. La contamination par voie muqueuse oculaire semble possible [31], tandis que la transmission materno-foetale reste controversée (cf. infra)2 .
1.4. Fréquence des formes asymptomatiques
L’étude des 3711 passagers ou membre de l’équipage du bateau de croisière « Diamond Princess », restés en quarantaine au port de Yokohama (Japon), représente un modèle quasi expérimental de l’infection par le SARS-CoV-2. Parmi 634 cas confirmés d’infection à SARS-CoV-2, 17,9 % étaient asymptomatiques [32]. Il pourrait toutefois s’agir d’une sous-estimation, sachant que l’âge élevé des passagers (plus de 60 ans pour la majorité) exposait à des formes plus sévères de l’infection.
Dans une étude de 24 patients infectés lors de contacts intra-familiaux et hospitalisés pour surveillance et monitorage des symptômes, 29,2 % de patients ne présentait ni symptômes, ni anomalies scannographiques [33]. La durée médiane de suivi des patients n’était cependant pas disponible.
Enfin, les formes asymptomatiques semblent plus fréquente chez l’enfant : estimées à environ 30 % des cas (cf. infra).
L’impact épidémiologique de ces formes asymptomatiques n’est pas encore clair, mais plusieurs cas de contamination durant la période d’incubation ou à partir de patients asymptomatiques ont été rapportés [34].
1.5. Définition des formes sévères
Aucune définition des formes sévères n’a été validée. Les définitions des formes non sévères et sévères sont hétérogènes selon les études. La commission nationale de santé chinoise a proposé les critères suivants [35] : fréquence respiratoire > 30/min, saturation pulsée en oxygène (SpO2) ≤ 93 %, PaO2/FiO2 ≤ 300 mmHg, détresse respiratoire et nécessité d’une ventilation mécanique, signes de choc, défaillance d’organe nécessitant une prise en charge en soins intensifs.
1.6. Caractéristiques de la population infectée par le SARS-CoV-2 hospitalisée
Les critères d’hospitalisation ne sont pas consensuels, aussi il existe une hétérogénéité des données démographiques dans les populations de malade rapportées (Tableau 1 ). Dans les trois études retenues pour leurs effectifs importants, l’âge médian des patients hospitalisés était compris entre 47 et 56 ans avec des intervalles interquartiles resserrés (43 à 60 dans l’étude de Wu et al., 35 à 58 dans l’étude de Guan et al., 46 à 67 dans l’étude de Zhou et al.). Il existait une nette prédominance masculine en analyse univariée, 63,7 % des patients étaient des hommes dans l’étude de Wu et al., 58,1 % et 62 % dans les études de Guan et al. et Zhou et al., respectivement [17], [36], [37]. Cette différence est possiblement expliquée par la fréquence plus élevée de facteurs de risques de sévérité de la maladie dans la population masculine (cf. infra). Les principales comorbidités retrouvées dans la population hospitalisée étaient l’hypertension artérielle (HTA) (15 à 30 %), le diabète (7,4–19 %) et les pathologies vasculaires (2,5–8 %) [17], [36], [37]. Les fumeurs représentaient 6 à 12, 6 % des patients hospitalisés [17], [36].
Tableau 1.
Comorbidités associées à l’infection à SARS-CoV-2 symptomatique.
| Comorbidités | Guan (n = 1099) [17] | Wu (n = 201) [37] | Zhou (n = 191) [36] |
|---|---|---|---|
| Âge (médiane) et IQRa | 47 [35–58] | 51 [43–60] | 56 [46–67] |
| Sex-ratio (H/F) | 1,4 | 1,8 | 1,7 |
| Exposition préalableb | 43,9 % | 49,3 %c | 38 % |
| Comorbidité ≥ 1b | 23,7 % | 38,2 % | 48 % |
| Tabagisme actif | 12,6 % | ND | 6 % |
| HTAa | 15,00 % | 19,4 % | 30 % |
| Diabètea | 7,4 % | 10,9 % | 19 % |
| Coronaropathieb | 2,5 % | < 4 % | 8 % |
| BPCOb | 1,1 % | < 2,5 % | 3 % |
| Cancer | 0,9 % | 0,5 % | 1 % |
| IRC | 0,7 % | 1 % | 1 % |
IQR : intervalle inter quartile ; H/F : hommes/femmes ; HTA : hypertension artérielle ; BPCO : bronchopneumopathie obstructive ; IRC : insuffisance rénale chronique ; SDRA : syndrome de détresse respiratoire aiguë.
Associé à la survenue d’un SDRA [37].
Exposition au marché à poissons de Wuhan.
1.7. Caractéristiques de la population infectée par le SARS-CoV-2 nécessitant une prise en charge en soins intensifs
Dans une étude rétrospective de 1591 cas consécutifs hospitalisés en réanimation en Lombardie (Italie), 82 % des patients étaient de sexe masculin, 49 % des patients avaient une hypertension artérielle chronique, 21 % étaient suivis pour une maladie cardiovasculaire, 17 % pour un diabète, et seuls 8 % pour une néoplasie, 4 % pour une bronchopneumopathie chronique obstructive, 3 % pour une insuffisance rénale chronique [38].
1.8. Facteurs de risques de syndrome de détresse respiratoire aigu (SDRA) et de décès
L’âge supérieur à 50 ans apparaissait comme fortement associé à la survenue d’un SDRA et l’âge supérieur à 65 était associé à la mortalité [37]. En France, 89 % des patients décédés étaient âgés de plus de 65 ans et 90 % étaient porteurs d’une comorbidité dont les principales étaient le diabète, une pathologie cardiaque, une HTA, une pathologie pulmonaire ou une obésité morbide [39]. Dans les études de Zhou et al. et Wu et al., l’HTA et le diabète étaient significativement associés à la survenue d’un SDRA en analyse multivariée et à la mortalité en analyse uni-variée [36], [37]. L’existence d’une coronaropathie était un facteur de risque de mortalité en analyse univariée mais pas en analyse multivariée [36].
En revanche, l’existence d’une bronchopneumopathie chronique obstructive (BPCO), d’une immunosuppression préalable, d’une pathologie cancéreuse ou d’une insuffisance rénale chronique ne semblait pas majorer le risque de mortalité [17], [36], [37].
Dans l’étude de Grasseli et al., la mortalité en réanimation était de 38 % pour les 502 patients hypertendus, contre 22 % pour les 526 patients non hypertendus inclus [38].
Soulignons que ces données dépendent probablement des caractéristiques démographiques des populations touchées : en effet, comparativement aux observations chinoises ou italiennes, les premiers cas américains admis en réanimation semblent être plus souvent atteints d’insuffisance cardiaque et d’insuffisance rénale chroniques [40], [41].
Enfin, un indice de masse corporelle élevé a été rapporté chez 24 patients admis en réanimation à Washington (IMC moyen 32,3, écart-type 7,2), suggérant que le surpoids et l’obésité pouvaient être un facteur de risque d’infection sévère à SARS-CoV-2 [41].
1.9. Taux de létalité
Le taux de létalité dépend de la stratégie diagnostique. Il sera plus faible dans le cadre d’un dépistage de masse qui identifie les personnes symptomatiques et asymptomatiques, alors qu’il sera plus élevé en cas de diagnostic ciblé chez les patients symptomatiques qui présentent des facteurs de risques de maladie sévère ou des critères d’hospitalisation.
À bord du Diamond Princess, 3063 tests RT-PCR ont été effectués, pour une population totale de 3711 personnes. Parmi les 634 passagers dépistés positifs à SARS-CoV-2 à bord du bateau, 7 sont décédés, soit un taux de létalité à 1,1 %. Après ajustement sur l’âge (l’âge moyen de la population vivant à bord du bateau était élevé [58 ans]), le taux de létalité était estimé à 1,3 % [42]. En Corée du Sud, où plus de 150 000 tests RT-PCR ont été utilisés, 6284 cas avaient été confirmés et 42 patients étaient décédés le 6 mars 2020, soit un taux de létalité de 0,7 % [43].
Une modélisation effectuée au 30 mars 2020, à partir de 44 672 cas confirmés à travers le monde dont 1023 décès, estimait un taux de létalité ajusté de 1,4 %, atteignant 6,4 % dans la population âgée de plus de soixante ans [44].
Dans l’étude italienne de Grasselli et al., le taux de létalité chez les patients admis en réanimation était de 26 %.
Dans les pays qui ont choisi une stratégie de diagnostic ciblé, les estimations du taux de létalité n’étaient pas disponibles à l’heure de la rédaction de cet article.
2. Outils diagnostiques de l’infection à SARS-CoV-2
Le 11 janvier 2020, le génome viral était partagé en accès libre via virological.org [45]. Le 21 janvier 2020, un protocole de RT-PCR en temps réel était proposé par l’équipe européenne de Corman et al. [46]. Aujourd’hui, plusieurs techniques de RT-PCR sont utilisées à travers le monde. Chaque fournisseur propose des réactifs et des amorces différentes. En France, le Centre national de référence des virus respiratoires propose plusieurs combinaisons d’amorces. Il s’agit en pratique courante de RT-PCR qualitatives, les RT-PCR quantitatives étant utilisées essentiellement en recherche clinique.
L’étude de Wang et al. a comparé les performances de la recherche d’ARN viral par RT-PCR dans différents sites de prélèvement, sur 1070 échantillons obtenus chez 205 patients atteints de COVID-19 confirmé sur la base d’une association de symptômes compatibles et de signes radiologiques caractéristiques. Le prélèvement le plus sensible semblait être le lavage broncho-alvéolaire (93 %), suivi par les expectorations (72 %). La RT-PCR sur écouvillon nasal, largement pratiquée, apparaissait moins sensible (63 %) et devait être répétée pour diminuer la fréquence des faux-négatifs [47]. La rentabilité des RT-PCR sur selles, sang et urines semblait insuffisante pour être envisagée en pratique clinique (< 50 %) [30].
L’étude de Ai et al. analysait de façon rétrospective les résultats de RT-PCR et de scanners thoraciques de 1014 patients originaires de Wuhan. Le diagnostic d’infection à SARS-CoV-2 reposait sur la positivité d’une RT-PCR sur prélèvement pharyngé (répétée à plusieurs reprises pour 258 patients) ou sur l’association d’une symptomatologie clinique compatible et d’une présentation scannographique évocatrice. Les scanners thoraciques étaient relus par deux radiologues en aveugle des résultats des RT-PCR. Sur 601 patients avec RT-PCR initiale positive, le scanner retrouvait des anomalies évocatrices dans 97 % des cas. Pour 413 patients avec RT-PCR négative, le scanner retrouvait des anomalies évocatrices dans 75 % des cas. Sur 15 patients avec RT-PCR initiale négative et secondairement positive, le scanner thoracique était évocateur du diagnostic dans 93 % des cas et précédait la première RT-PCR positive d’une médiane de 8 jours. D’autre part, chez les patients avec négativation secondaire de la RT-PCR, le scanner de suivi montrait une amélioration dans 42 % des cas, qui précédait la négativation de la RT-PCR. Après revue des cas, la sensibilité du scanner thoracique pour le diagnostic d’infection à SARS-CoV-2 était estimée à 97 %, et la spécificité à 25 %. Les valeurs prédictives positives et négatives du scanner thoracique relativement à la RT-PCR étaient respectivement de 65 % et 83 % [48]. Ce manque de sensibilité pourrait recevoir plusieurs explications, telles qu’une mauvaise réalisation des prélèvements ou encore la prise en compte des images de scanner comme référence pour estimer cette sensibilité. En effet, sachant que les signes radiologiques ne sont pas spécifiques (voir infra) et qu’ils sont rencontrés dans d’autres maladies, d’origine infectieuse ou non, une indication trop large des scanners pourrait avoir induit une sous-estimation de la sensibilité de la RT-PCR.
La sérologie représente un enjeu majeur pour évaluer la protection immunitaire des populations contre le virus et mieux comprendre l’épidémiologie. Elle n’est pas disponible de façon fiable à ce jour. Les tests sérologiques ciblent notamment les antigènes suivants : la protéine de la capside nucléaire qui est fortement exprimée et apporte une sensibilité élevée, et la protéine spike qui apporte une spécificité élevée [49].
Guo et al. ont montré, à partir de 208 échantillons de plasma recueillis chez 82 patients confirmés COVID-19 et 58 cas possibles (symptômes typiques mais RT-PCR négatives), que les IgA et IgM anti-protéine de la capside nucléaire étaient détectés dans un délai médian de 5 jours après les premiers symptômes (IQR 3–6), dans 85,4 % et 92,7 % des cas, respectivement. Les IgM étaient détectés chez 93,1 % des cas possibles. Les IgG étaient détectées dans un délai médian de 14 jours (IQR 10–18) et dans 77,9 % des cas. L’association RT-PCR et test ELISA IgM détectait 98,6 % des cas [50]. Il faut probablement être très prudent sur la fiabilité de ces résultats, notamment sur la positivité très précoce de la sérologie, surprenante sachant les mécanismes de la réponse immunitaire.
Une autre étude de 173 patients montrait un délai plus long pour la détection des IgM anti-spike, avec un délai médian de 12 jours [51].
Au total, le diagnostic de certitude repose sur l’identification du virus par RT-PCR effectuée sur prélèvements respiratoires. Cependant, devant l’accessibilité à la RT-PCR parfois limitée et la fréquence élevée de faux négatifs de cette technique (environ 30 %), le diagnostic de COVID-19 peut être porté par l’association de signes cliniques évocateurs et d’une image scannographique compatible (cf. infra). L’utilisation de la sérologie est en cours d’évaluation.
3. Présentation clinique
3.1. Évolution de l’atteinte clinique
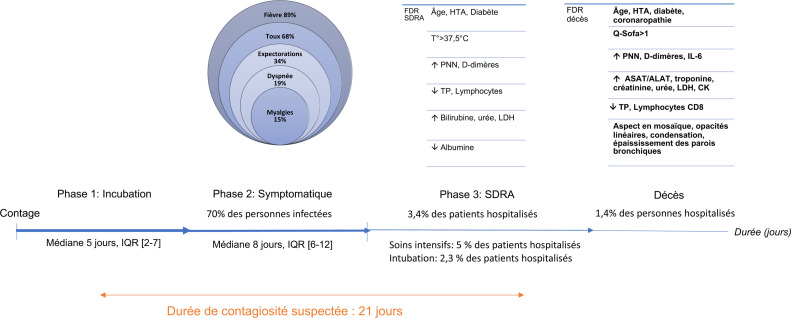
L’infection par le SARS-CoV-2 semble évoluer en trois phases (Tableau 2 , Fig. 1 ). La phase d’incubation est suivie d’une phase symptomatique qui apparaît dans un délai médian de 5 jours après le contage et qui concernerait 70 % des patients infectés. Une phase d’aggravation des symptômes respiratoires est possible et environ 3,4 % des patients développeraient un SDRA dans un délai médian de 8 jours après les premiers symptômes (IQR [6–12]) [17], [52]. La mortalité liée au SDRA est élevée, autour de 50 % [37].
Tableau 2.
Évolution des infections à SARS-CoV-2 symptomatiques.
| Évolution | Zhou (n = 191) [36] | Guan (n = 1099) [17] | Wu (n = 201) [37] |
|---|---|---|---|
| Co-infection | 15 % | ND | 0,6 % |
| Oxygénothérapie | 21 % | 41,3 % | 48,7 % |
| Ventilation mécanique | 17 % | 2,3 % | 3 % |
| SDRA | 31 % | 3,4 % | 41,8 % |
| Coagulopathie | 19 % | 0,1 % | ND |
| OAP | 23 % | ND | ND |
| Passage en réanimation | 26 % | 5 % | 26,4 % |
| Décès | 39,4 % | 1,4 % | 21,9 % |
SDRA : syndrome de détresse respiratoire aiguë ; OAP : œdème aigu des poumons ; ND : non disponible.
Fig. 1.
Présentation clinique et facteurs de sévérité de l’infection à SARS-CoV-2. SDRA : syndrome de détresse respiratoire aiguë. IQR : intervalle interquartile ; IOT/VM : intubation orotrachéale/ventilation mécanique ; FDR : facteur de risque ; HTA : hypertension artérielle ; LDH : lactate déshydrogénase ; CK : créatine kinase ; ASAT : aspartate amino transférase ; ALAT : alanine amino transférase ; TP : temps de prothrombine ; PNN : polynucléaires neutrophiles ; Q-Sofa : score de Quick SOFA (Sepsis-related Organ Failure Assessment).
3.2. Formes symptomatiques
L’infection par le SARS-CoV-2 se manifeste essentiellement par une atteinte respiratoire, mais une sémiologie plus riche commence à être rapportée (Tableau 3 ).
Tableau 3.
Caractéristiques cliniques de l’infection à SARS-CoV-2 symptomatique.
| Signes cliniques | Guan (n = 1099) [17] | Wu (n = 201) [37] | Zhou (n = 191) [36] |
|---|---|---|---|
| Fièvrea | 88,7 % | 93,5 % | 94 % |
| 37,5–38 °C | 30,9 % | ND | ND |
| 38,1–39 °C | 46,9 % | ND | ND |
| > 39 °Ca | 12,3 % | 38,3 % | ND |
| Tachycardie > 125/min | ND | ND | 1 % |
| Polypnée (> 24/min)b | ND | ND | 29 % |
| Dyspnéea | 18,7 % | 39,8 % | ND |
| Toux | 67,8 % | 81,1 % | 79 % |
| Expectorations | 33,7 % | 41,3 % | 23 % |
| Myalgies | 14,9 % | 32,3 %c | 15 % |
| Asthénie | 38,1 % | 32,3 %c | 23 % |
| Diarrhée | 3,8 % | ND | 5 % |
| Nausées/vomissements | 5,0 % | ND | 4 % |
| Céphalées | 13,6 % | ND | ND |
| Rhinite | 4,8 % | ND | ND |
| Frissons | 11,5 % | ND | ND |
| Éruption cutanée | 0,2 % | ND | ND |
| Adénopathies cervicales | 0,2 % | ND | ND |
Dans les trois études de Wu et al., Guan et al. et Zhou et al., les signes cardinaux du COVID-19 associaient une fièvre supérieure à 37,5 °C (88,7–4 %), une toux (67,8–81,1 %), des expectorations (23–41,3 %) et une dyspnée (18,7–39,8 %), survenant dans les premiers jours de l’infection [17], [36], [37].
Par ailleurs, des myalgies étaient fréquentes (14,9–32,3 %) et des signes digestifs pouvant être inauguraux étaient également rapportés, tels que diarrhée (3,8–5 %) et nausées/vomissements (4–5 %) [17], [36], [37], [53].
Certains patients présentent une atteinte neurologique, qui avait déjà été rapportée lors de l’épidémie provoquée par le SARS-CoV-1 [54]. Dans l’étude de Mao et al., 36,4 % des 214 patients inclus présentaient des signes neurologiques. Ces signes étaient plus fréquents chez les 88 patients atteints d’une forme sévère de la maladie, parmi lesquels on retrouvait une confusion (14,8 %), une atteinte neuro-musculaire (19,3 %) et des accidents vasculaires cérébraux (5,7 %) [55]. Par ailleurs, des cas d’épilepsie et d’encéphalopathie nécrotique ont été rapportés [40], [56], [57]. Enfin, le tropisme neurologique viral pourrait participer à la détresse respiratoire provoquée par le SARS-CoV-2 [58].
Une augmentation des consultations médicales pour anosmie/agueusie sans obstruction nasale a également été rapportée dans le contexte de la pandémie provoquée par le SARS-CoV-2, rappelant l’atteinte olfactive qui avait été rapportée pour le SARS-CoV-1 [59], [60]. Récemment, l’équipe d’Eliezer et al. ont montré par imagerie par résonance magnétique (IRM) que cette symptomatologie pourrait résulter d’une obstruction bilatérale inflammatoire des fentes olfactives causée par l’infection par le SARS-CoV-2 [61].
Une souffrance myocardique est retrouvée chez 10 à 20 % des patients, documentée par une élévation de la troponine au-delà du 99e percentile, des modifications électrocardiographiques et/ou échocardiographiques. Elle est plus fréquente en réanimation [36], [40], [52]. Sur 113 patients décédés de l’infection analysés rétrospectivement, 49 % présentaient une défaillance cardiaque, dont la moitié n’avaient pas d’antécédent de maladie cardiovasculaire [62]. Cinq cas de myocardites fulminantes ont également été rapportés [63]. Plus récemment, Doyen et al. ont rapporté, chez un patient de 69 ans infecté par le SARS-CoV-2, un cas de myocardite objectivé par une modification ECG, une élévation de la troponine et un rehaussement retardé subépicardique après l’injection de gadolinium sur l’IRM cardiaque [64].
Des atteintes ophtalmologiques à type de conjonctivite ont également été décrites, dont une a été objectivée par RT-PCR sur prélèvement conjonctival. Elles semblent associées aux formes sévères de la maladie [31].
Une atteinte rénale spécifique de l’infection n’a à ce jour pas été décrite, même si elle est suspectée. La fréquence de l’insuffisance rénale aiguë chez les patients infectés semblait faible dans l’étude de Guan et al. (0,5 %) [17]. De plus, une étude chinoise ayant monitoré la créatininémie et le sédiment urinaire de 116 patients (dont 7 avec SDRA) ne rapportait aucune insuffisance rénale aiguë [65]. Cependant, les études réalisées en réanimation retrouvent jusqu’à 19 % d’insuffisance rénale aiguë, dont le mécanisme reste à préciser [40].
L’hyperglycémie était retrouvée chez 45 % et 52 % des patients dans les études de Wu et al. et Chen et al., respectivement [37], [66]. Elle peut être expliquée par l’hypersécrétion de glucocorticoïdes endogènes secondaire dans le contexte de stress induit par l’infection ou par l’utilisation de corticoïdes à visée thérapeutique. Ilias et al. ont suggéré que le SARS-CoV-2 pourrait avoir une action directe dans le dérèglement glycémique comme le SARS-CoV-1 ou le Mers-CoV, qui, respectivement, provoquait une défaillance des îlots de Langerhans et activait la dipeptidyl peptidase 4 (DPP4) [67].
Enfin, des lésions cutanées sont évoquées mais n’ont pas à ce jour fait l’objet de publication confirmant leur association au COVID-19. Des lésions maculo-papuleuses érythémateuses touchant exclusivement le visage, et des lésions à types d’engelures possiblement liées au COVID-19 sont en cours de recueil [68]. Des réactions urticariennes ont aussi été observées au décours de l’infection, bien qu’elles puissent être aspécifiques.
3.3. Signes cliniques associés au SDRA et/ou à la mortalité
Un score Quick-Sofa > 1 (c’est-à-dire la présence d’au moins deux des trois paramètres suivants : fréquence respiratoire ≥ 22/minute, trouble des fonctions supérieures (confusion, désorientation, score de Glasgow < 15), pression artérielle ≤ 100 mmHg) est significativement associé à la mortalité en analyse multivariée [36]. Certains auteurs ont suggéré que l’utilisation d’un autre score de gravité, le NEWS 2, pourrait être plus adaptée à cette situation septique avec dysfonction d’organe [69].
L’existence d’une fièvre > 37,5 °C, et a fortiori > 39 °C était associée à la survenue d’un SDRA mais paradoxalement, aussi à une meilleure survie chez les patients en SDRA [36], [37], [62].
Il semble par ailleurs que l’infection par le SARS-CoV-2 soit associée à un état pro-thrombotique compliqué de thromboses veineuses profondes et d’embolies pulmonaires. Ce risque, dont la quantification n’a fait l’objet d’aucune publication, reste à préciser. Cependant, une anticoagulation préventive par héparine de bas poids moléculaires (enoxaparine 0,4 à 0,6 ml/24 h) ou par héparine non fractionnée (10 000–15 000 UI/24 h), prescrite pendant plus de 7 jours, était significativement associée à une diminution de la mortalité à 28 jours dans la population qui présentait une élévation des D-dimères supérieure à six fois la normale. Cette étude, réalisée chez 449 patients, suggère de façon indirecte un sur-risque de décès par événements thrombotiques chez les patients atteints de COVID-19 [70].
4. Signes biologiques
4.1. Formes symptomatiques
Les formes symptomatiques de l’infection à SARS-CoV-2 s’accompagnent des modifications biologiques suivantes (Tableau 4 ) :
-
•
élévation des polynucléaires neutrophiles et lymphopénie, étendue aux lymphocytes CD4 et CD8 (dont le ratio CD4/CD8 semble préservé) [37] ;
-
•
élévation de la CRP (60,7–85,6 %), jusqu’à 150 mg/L, hypoalbuminémie (médianes 32–32,3 g/L), hyperferritinémie (78,5–80 %) [36], [37] ;
-
•
élévation des ALAT/ASAT dans environ 25 % des cas (21,7–31 %) et hyperbilirubinémie (5,1–10,5 %) [17], [37] ;
-
•
élévation des LDH pour environ 40 % des patients (13–98 % selon le seuil choisi dans les études) associée à une diminution du TP (jusqu’à 94 % des patients) et à une augmentation des D-dimères (23,3–46,4 %), stigmates d’une coagulopathie associés aux formes graves et prédictives de la mortalité [36], [37] ;
-
•
élévation de la troponine chez 17 % des patients avec 23 % d’insuffisance cardiaque aiguë [36] ;
-
•
alcalose respiratoire chez 28 % des patients, probablement secondaire à la polypnée [57].
Tableau 4.
Caractéristiques biologiques de l’infection à SARS-CoV-2 symptomatique.
| Signes biologiques | Guan (n = 1099) [17] | Wu (n = 201) [37] | Zhou (n = 191) [36] |
|---|---|---|---|
| Anémie | médiane 13,4 g/dL | ND | 15 % |
| Lymphopéniea | 83,2 % (< 1500/mm3) | Médiane 910 < 64 %c | Médiane 1000, 40 % < 800 |
| Neutrophiliea | ND | Médiane 4,5 < 34,5 %c | ND |
| Plaquettesa | Médiane 168, 36,2 % < 150 G/L | Médiane 180, < 18,8 % | Médiane 206, 7 % < 100G/L |
| Augmentation des D-dimèresa | 46,4 % | 23,3 %$ | 42 % > 1 mcg/mL |
| Lymphopénie CD4a | ND | Médiane 353 | ND |
| Lymphopénie CD8a | ND | Médiane 236 | ND |
| Élévation créatininémie | 1,6 % | 4,5 % | 4 % |
| Élévation des LDHa | 41 % (seuil à 250 UI/L) | 98 % (seuil à 100 UI/L) | Médiane 300, 13 % > 245 |
| Élévation des CKa | 13,7 % | 4,5 % | Médiane 21,5, 13 % > 185 |
| Élévation de la troponine | ND | ND | 17 % |
| Hyperglycémie | ND | 45,2 % | ND |
| Hypoalbuminémiea | ND | Médiane 32 g/L, 98,5 % | Médiane 32,3 |
| Élévation de la CRP | 60,7 % | 85,6 % [6,60–152] | ND |
| Hyperferritinémiea | ND | 78,5 % | Médiane 722, 80 % > 300 |
| Élévation des ASAT/ALATa | 21,3 % | 21,7 % | ALAT : 31 % > 40 |
| Élévation de la bilirubine totalea | 10,5 % | 5,1 % | ND |
| Élévation de l’uréeb | ND | 4,5 % | ND |
| Hémostase | |||
| Diminution du TP < 16sa | ND | 2,1 % | 94 % |
ND : non disponible ; LDH : lactate deshydrogénase ; CK : créatine kinase ; ASAT : aspartate amino tansferase ; ALAT : alanine amino transferase ; TP : temps de prothrombine ; SDRA : syndrome de détresse respiratoire aiguë.
Données associées à la survenue d’un SDRA [37].
Données présentées en % de patients avec valeur anormale, sans en préciser le sens.
L’anémie et la thrombopénie semblent rares. L’insuffisance rénale aiguë apparaît peu fréquente (jusqu’à 4,5 %) alors que l’élévation de l’urée pourrait être associée à un pronostic péjoratif (cf. supra) [37].
Une étude chinoise détaille les caractéristiques de l’hémogramme et des sous-populations lymphocytaires, chez 166 patients avec forme non grave et 286 avec forme sévère. Les patients sévères avaient un ratio neutrophiles/lymphocytes significativement augmenté et des marqueurs de l’inflammation élevés (CRP, ferritine, Interleukine 6 [IL-6], Interleukine 8 [IL-8], mais aussi Interleukine 10 [IL-10]). De plus, il existait un déséquilibre de la réponse immunitaire lymphocytaire chez les patients sévères, qui présentaient une lymphopénie CD4 plus marquée, plus de cellules CD4 naïves et de lymphocytes T CD4 suppresseurs et moins de cellules CD4 mémoires et de lymphocytes T régulateurs, comparativement aux patients non sévères [71].
4.2. Signes biologiques associés à la survenue d’un SDRA et/ou à la mortalité
En modèle multivarié, les paramètres suivants étaient associés à une évolution péjorative :
-
•
augmentation des D-dimères > 1 μg/mL associée à la survenue d’un SDRA et à la mortalité [36], [37] ;
-
•
élévation des polynucléaires neutrophiles, associée à la survenue d’un SDRA et à la mortalité [37] ;
-
•
hyperbilirubinémie totale, hypoalbuminémie, élévation de l’urée et des LDH, toutes associées à la survenue d’un SDRA et à la mortalité [37] ;
-
•
baisse du TP, associée à la survenue d’un SDRA [37] ;
-
•
lymphopénie, associée à la survenue d’un SDRA [37] ;
-
•
élévation de l’interleukine-6 circulante associée au décès par SDRA mais pas à la survenue d’un SDRA [37].
En modèle univarié s’ajoutent les marqueurs de souffrance d’organe, qu’il s’agisse d’une élévation des ASAT/ALAT, de la créatininémie ou de la troponine, prédictifs de la mortalité [36], [37].
Le rôle prédictif de l’élévation des polynucléaires neutrophiles, ainsi que l’éosinopénie rapportée dans certaines études, devront être confirmés en s’affranchissant notamment du facteur confondant qu’est la corticothérapie, régulièrement administrée dans les formes sévères et inflammatoires.
5. Signes radiologiques de l’infection à SARS-CoV-2
5.1. Caractéristiques radiologiques
Les signes à la radiographie de thorax sont peu spécifiques : dans l’étude de Guan et al., les patients présentaient des images en verre dépoli dans 56,4 % des cas, des condensations alvéolaires unilatérales dans 41,9 % des cas et bilatérales dans 51,8 % des cas, avec anomalies interstitielles dans 14,7 % [17].
L’étude de Li et al. rapporte la présentation radiographique de 90 patients dont le diagnostic d’infection à SARS-CoV-2 reposait sur l’association d’un contexte épidémique, d’une RT-PCR positive sur échantillon naso-pharyngé, et ayant réalisé un scanner thoracique (Tableau 5 ). Les résultats du scanner thoracique étaient relus par deux radiologues expérimentés en aveugle de la gravité du patient [72]. Le tableau était celui d’une pneumopathie souvent bilatérale (95,2 %) avec anomalies à distribution postérieure et sous-pleurale, associant images en verre dépoli, foyers de condensation alvéolaire, opacités linéaires, mais également épaississement des parois bronchiques et plus rarement pleurésie et épanchement péricardique [72], [73].
Tableau 5.
Caractéristiques radiographiques de l’infection à SARS-Cov-2 symptomatique.
| Signes radiographiques | Guan (n = 1099) [17] | Li (n = 83) [72] |
|---|---|---|
| Condensation alvéolaire focale | 41,9 % | ND |
| Condensations alvéolaires bilatérales | 51,8 % | ND |
| Anomalies interstitielles | 14,7 % | ND |
| Images en verre dépoli | 56,4 % | 97,6 % |
| Opacités linéairesa | ND | 65,1 % |
| Foyer de condensationa | ND | 63,9 % |
| Épaississement des septa inter-lobulaires | ND | 62,7 % |
| Aspects en mosaïque (crazy-paving)a | ND | 36,1 % |
| Signe de la toile d’araignée | ND | 25,3 % |
| Épaississement des parois bronchiquesa | ND | 22,9 % |
| Épaississements sous-pleuraux | ND | 20,5 % |
| Adénopathie médiastinaleb | ND | 8,4 % |
| Épanchement pleurauxa | ND | 8,4 % |
| Épanchement péricardique | ND | 4,8 % |
| Lobe supérieur droita | ND | 64,7 % |
| Lobe moyen | ND | 73,5 % |
| Atteinte bilatérale | ND | 95,2 % |
La chronologie des signes radiologiques, étudiée chez 88 patients chinois séparés en quatre groupes selon le délai de réalisation du scanner par rapport aux premiers symptômes, montre une prédominance d’images en verre dépoli au stade initial évoluant vers une association de verre dépoli, d’opacité réticulaires et de foyers de condensation [74].
Sachant le caractère non spécifique des signes radiologiques, il est utile de rappeler que le scanner ne doit être utilisé qu’en cas de probabilité pré-test élevée (présence de manifestations cliniques évocatrices, chez des patients hospitalisés présentant des formes sévères).
Enfin, l’échographie pleurale et pulmonaire semble être une bonne alternative au scanner mais sa place dans la stratégie diagnostique reste à confirmer [75].
5.2. Signes radiologiques associés aux formes sévères
Dans l’étude de Li et al, l’extension des lésions scannographiques était mesurée grâce à un score allant de 0 à 25. L’extension de l’infection pulmonaire était estimée dans chaque lobe selon l’échelle suivante [72] :
-
•
0 : absence de signe radiologique ;
-
•
1 : atteinte < 5 % du lobe ;
-
•
2 : atteinte de 5 à 25 % du lobe ;
-
•
3 : atteinte de 26 à 49 % du lobe ;
-
•
4 : atteinte de 50 à 75 % du lobe ;
-
•
5 : atteinte > 75 % du lobe ;
Les valeurs pour chacun des cinq lobes étaient ensuite additionnées : un score > 7/25 était significativement associé à une forme grave de la maladie en analyse univariée. D’autres scores significativement associés à la mortalité, plus complexes, ont également été proposés [76].
Les autres signes radiologiques associés à une gravité clinique en analyse univariée (Tableau 5) dans l’étude de Li et al., étaient les suivants [72] :
-
•
opacités linéaires ;
-
•
foyers de condensation ;
-
•
épaississement des parois bronchiques ;
-
•
aspect en mosaïque (« crazy-paving ») ;
-
•
atteinte du lobe supérieur droit.
En France, la Société française de radiologie a proposé une harmonisation de l’estimation de l’extension pulmonaire totale, qualifiée de légère entre 0 et 25 %, modérée entre 25 et 50 %, sévère entre 50 et 75 % et critique au-delà de 75 % (https://ebulletin.radiologie.fr/covid19). Pour autant, l’association entre l’étendue des lésions radiologiques ainsi estimée et le pronostic de la maladie n’a pas été établie.
6. Infection à SARS-CoV-2 chez la femme enceinte
Les femmes enceintes représentent une population particulièrement exposée aux pneumopathies infectieuses, du fait des modifications physiologiques, propres à la grossesse (élévation du diaphragme, majoration de la consommation d’oxygène et œdème du tractus respiratoire). Les pandémies de grippe espagnole en 1918, de grippe H1N1 en 2009, de SARS-CoV et de MERS-CoV ont montré un sur-risque de formes graves pour les femmes enceintes [77], [78].
Huijun et al. ont étudié de façon rétrospective neuf femmes enceintes au troisième trimestre sans comorbidité, détectées positives pour le SARS-CoV-2 sur RT-PCR naso-pharyngées. Les données cliniques biologiques et radiologiques maternelles étaient comparables à celles observées dans la population générale. Il n’y a eu aucune forme grave respiratoire. Toutes les femmes ont accouché par césarienne, dont l’indication était antérieure à l’infection. Aucune asphyxie fœtale ni décès néonatal n’ont été rapportés et les scores d’Apgar étaient normaux. Quatre nouveau-nés sont nés prématurément (tous après la trente-sixième semaine d’aménorrhée) et deux présentaient une hypotrophie – mais ces complications s’expliquaient indépendamment de l’infection par le SARS-CoV-2 [77].
Dans cette même étude, l’ARN viral a été recherché par RT-PCR chez six patientes dans le liquide amniotique, le sang du cordon, sur écouvillon naso-pharyngé pratiqué chez le nouveau-né et dans le lait maternel. Tous les prélèvements étaient négatifs. Par conséquent, il ne semble pas y avoir de passage materno-fœtal du SARS-CoV-2. Ces données sont semblables à celles observées dans les pandémies de SARS-CoV-1 et de MERS-CoV [77].
L’étude de Yangli Liu et al., qui portait sur treize patientes, non comorbides, dont onze étaient au troisième trimestre, et dont dix ont accouché par césarienne, a rapporté une forme grave respiratoire chez une mère (5 % de l’effectif), nécessitant le passage en soins intensifs puis la mise en place d’une ECMO veino-veineuse. Cette étude recensait plus de complications périnatales : 38 % de césarienne en urgence pour détresse fœtale, rupture prématurée des membranes et mort fœtale. Il était difficile d’incriminer formellement le virus SARS-CoV-2 mais il est possible que ces complications traduisent une mauvaise tolérance à l’hypoxie [79].
L’équipe de Lingkong Zeng et al. évoque toutefois la possibilité d’une transmission materno-fœtale. En effet, trois nouveau-nés de mères infectées par le SARS-CoV-2 avaient une RT-PCR SARS-CoV-2 positive au deuxième jour de vie. Ils présentaient tous une pneumopathie confirmée par la radiographie thoracique. Comme les mesures de prévention de l’infection étaient respectées, la transmission du virus aéroportée ou au contact de l’équipe soignante semblait écartée par les auteurs [80].
Au total, ces études, très limitées en termes d’effectifs, semblent montrer que les femmes enceintes au troisième trimestre de grossesse ont un risque de développer une forme grave proche de celui observé dans la population générale. La possibilité d’une transmission materno-foetale est encore controversée. Par ailleurs, ces études ne permettent pas de savoir si l’accouchement par voie basse est plus à risque de contamination materno-fœtale que l’accouchement par césarienne. Le retentissement fœtal des infections maternelles à SARS-CoV-2 aux premier et deuxième trimestres reste également à éclaircir. Enfin, la description d’infection de nouveau-nés plusieurs jours après la naissance rappelle la nécessité d’une prévention stricte de l’infection dans les maternités [77], [81].
7. Infection à SARS-CoV-2 chez l’enfant
Plusieurs études se sont intéressées au profil évolutif de l’infection à SARS-CoV-2 chez les patients de moins de 15 ans.
L’infection à SARS-Cov-2 symptomatique semble peu fréquente dans cette population : en effet, les enfants de moins de 10 ans ne représentaient que 1 % des 44 672 cas confirmés dans l’étude de Wu et McGoogan [82] et 0,9 % des 1099 patients dans l’étude de Guan et al. Aucun décès, dans cette dernière étude, n’avait été rapporté [17]. De même, parmi les 1591 patients admis en réanimation en Lombardie, aucun n’avait moins de 14 ans [38].
Une large étude rétrospective portant sur 171 patients âgés de moins de 16 ans, diagnostiqués par RT-PCR sur prélèvement naso-pharyngé, retrouvait un âge médian de 6,7 ans avec une prédominance masculine (60 %). La contamination était essentiellement d’origine intra-familiale (90 %). La lymphopénie (3,5 %) apparaissait moins fréquente que chez l’adulte. Soixante-cinq pour cent des patients développaient une pneumopathie radiologique, sous la forme d’images en verre dépoli – dont 7 % sans signe clinique. Les trois patients (1,7 %) porteurs d’une comorbidité ont présenté des formes sévères nécessitant une hospitalisation en soins intensifs, et un patient est décédé. Quinze pour cent des patients ne présentaient ni signes cliniques, ni anomalie radiographique [83].
Une étude plus récente rapportait 36 patients de moins de 16 ans diagnostiqués par RT-PCR naso-pharyngée. Il s’agissait d’infections asymptomatiques dans 28 % des cas. Les stigmates biologiques de l’infection associaient une lymphopénie (31 %), une élévation des CK (31 %) et une élévation de la PCT (17 %) [84].
Dans un travail d’effectif plus réduit de 10 enfants diagnostiqués par RT-PCR naso-pharyngée, le mode de contamination était également familial (70 %). Les RT-PCR répétées devenaient positives dans les 48 premières heures des symptômes, puis négatives après 12 jours. La médiane d’incubation était estimée à 6,5 jours. Les principaux signes cliniques associaient une fièvre (80 %, durant en moyenne une journée) et une toux (60 %), et le scanner retrouvait des condensations alvéolaires unilatérales [85].
Des surinfections bactériennes à Mycoplasma Pneumoniae ont été rapportées chez 20 % des enfants (5/20) dans l’étude de Xia et al. [86].
Dans l’étude de Sun et al., les patients de moins de 15 ans hospitalisés en réanimation présentaient des taux de cytokines inflammatoires élevés, comme chez l’adulte : interleukine-6 chez quatre patients sur huit (50 %), interféron-γ chez deux patients sur huit (25 %). La mortalité apparaissait en revanche plus faible (0/8 patients décédés) [87].
Les enfants dans la première année de vie n’apparaissent pas à sur-risque de forme grave : seuls neuf patients âgés de moins d’un an étaient rétrospectivement identifiés sur l’intégralité des patients hospitalisés en Chine et diagnostiqués par deux RT-PCR consécutives. La fièvre était retrouvée chez 44 % des nourrissons, dont un seul était asymptomatique. Aucune forme grave n’était notée [88].
Au total, l’infection par le SARS-CoV-2 chez les enfants semble moins fréquemment symptomatique et moins grave que chez l’adulte.
8. Infection à SARS-CoV-2 chez les patients immunodéprimés
Par analogie à d’autres virus responsables d’infections potentiellement sévères chez les patients immunodéprimés, le SARS-CoV-2 a été considéré comme pouvant être responsable d’infections sévères dans cette population [89]. Pour autant, les patients immunodéprimés étaient peu représentés dans les études chinoises, ne constituant par exemple que 0,2 % de la population de malades décrite par Guan et al. [17].
Lorenzo D’Antiga rappelle que les patients immunodéprimés n’étaient pas à risque d’infections sévères lors des précédentes épidémies dues au SARS-CoV et au MERS-CoV, et qu’aucun des deux cents patients transplantés hépatiques (essentiellement des enfants) suivi dans l’hôpital de Bergame n’avait présenté de pneumopathie. À l’inverse, il suggère que les patients immunodéprimés seraient protégés de la réaction immunitaire innée possiblement excessive et dysrégulée, fréquemment retrouvée après l’infection par les coronavirus et participant aux dommages tissulaires [89].
Cette hypothèse ne semble pas partagée par l’équipe de Gandolfini qui rapporte deux cas d’infection à SARS-CoV-2 chez les patients transplantés rénaux. Ces deux patients immunodéprimés traités par tacrolimus, mycophenolate mofetil et corticothérapie ont présenté une forme sévère. Un des patients a présenté un syndrome inflammatoire systémique intense (IL-6 : 108,2 pg/mL) et a nécessité une ventilation non invasive, alors que l’autre patient est décédé [90].
Une autre étude italienne avait identifié quatre patients infectés par le SARS-CoV-2, quatre cas possibles et cinq patients asymptomatiques mais contacts d’un cas confirmé, parmi 320 patients suivis pour polyarthrite rhumatoïde (57 %) ou spondylarthrite ankylosante (43 %) et traités par biothérapies. Les traitements immunosuppresseurs (adalimumab (1/13), etanarcept (4/13), abatacep (2/13), tocilizumab (1/13), tafacitinib (2/13) et baricitinib (3/13)) avaient été arrêtés dès l’apparition des symptômes pour ces huit patients. Cinq patients étaient déjà traités par hydroxychloroquine. Les cinq cas confirmés ont reçu une antibiothérapie. Aucun des treize patients n’a présenté de forme grave. Un seul patient a été hospitalisé [91].
Ainsi, ces études réalisées sur de petits effectifs ne permettent pas de conclure quant au risque encouru par les patients immunodéprimés lors de la pandémie de SARS-CoV-2. Toutefois, il semble que cette population ne soit pas plus à risque de formes sévères que les patients immunocompétents. Un projet européen a été mis en place pour colliger les cas d’infections à SARS-CoV-2 chez les patients atteints de pathologies rhumatologiques et traités par immunosuppresseur [92]. Un recueil d’observation de COVID-19 chez les patients atteints de rhumatismes inflammatoires chroniques, de maladies auto-immunes ou auto-inflammatoires est également en cours en France, organisé par la filière de santé maladies rares FAI2R (Cohorte COVID19.FAI2R: https://www.fai2r.org).
9. Infection à SARS-CoV-2 chez les patients suivis pour un cancer
Les patients atteints d’un cancer représentaient 0,9 % des 1099 patients analysés par Guan et al. [17]. Deux études ont analysé les données de patients infectés par le SARS-CoV-2 et suivis pour un cancer. Dans l’étude de Wenhua Liang et al., ils représentaient 1 % de l’ensemble des patients infectés par le SARS-CoV-2 en Chine, en janvier 2020, alors que l’incidence du cancer dans la population générale était de 0,29 % en 2015. Dans cette même étude, les patients suivis pour un cancer étaient significativement plus à risque de développer des formes graves de COVID-19 que les patients qui n’avaient pas de cancer, avec un odds ratio de 5,43 (1,8–16,2). Ce risque était majoré si la chimiothérapie était récente (< 1 mois) [93]. Dans l’étude de Zhang et al., sur 1276 patients hospitalisés pour une infection à SARS-CoV-2 dans trois hôpitaux de Wuhan, 28 (2,2 %) étaient par ailleurs suivis pour un cancer. Les caractéristiques cliniques, biologiques et radiographiques initiales étaient proches de celles observées dans l’ensemble de la population infectée. En revanche, 53,6 % des patients ont présenté une forme sévère, et 28,6 % sont décédés. De plus, avoir reçu une chimiothérapie dans les 14 jours majorait de façon significative le risque de développer une forme sévère (hasard ratio 4,1 ; 1,1–15,3) [94]. C’est pourquoi, il est recommandé, en France, de préférer les téléconsultations, de diminuer la fréquence des chimiothérapies autant que possible, pour limiter l’exposition au virus des patients atteints de cancer. Pour les patients infectés, il est recommandé d’arrêter le traitement anticancéreux jusqu’à résolution complète de la symptomatologie [95].
Au total, les patients suivis pour un cancer semblent plus à risque de développer une forme sévère de COVID-19 que les patients non atteints de cancer et la chimiothérapie récente majore ce risque. Des études plus larges permettront de confirmer si les patients immunodéprimés font partie des populations à risque.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Remerciements
Nous remercions le Pr. Thomas Hanslik pour son aide précieuse. Nous remercions aussi Mélodie Sahraie, Shakeel Sumodhee et Innocent Muranda pour leur soutien.
Footnotes
https://www.has-sante.fr/jcms/p_3179992/fr/cahier-des-charges-de.
Références
- 1.Cui J., Li F., Shi Z.-L. Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol. 2019;17:181–192. doi: 10.1038/s41579-018-0118-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Ksiazek T.G., Erdman D., Goldsmith C.S., Zaki S.R., Peret T., Emery S. A novel coronavirus associated with severe acute respiratory syndrome. N Engl J Med. 2003;348(20):1953–1966. doi: 10.1056/NEJMoa030781. [DOI] [PubMed] [Google Scholar]
- 3.Drosten C., Günther S., Preiser W., van der Werf S., Brodt H.R., Becker S. Identification of a novel coronavirus in patients with severe acute respiratory syndrome. N Engl J Med. 2003;348(20):1967–1976. doi: 10.1056/NEJMoa030747. [DOI] [PubMed] [Google Scholar]
- 4.Zaki A.M., van Boheemen S., Bestebroer T.M., Osterhaus A.D., Fouchier R.A. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N Engl J Med. 2012;367(19):1814–1820. doi: 10.1056/NEJMoa1211721. [DOI] [PubMed] [Google Scholar]
- 5.Wong G., Liu W., Liu Y., Zhou B., Bi Y., Gao G.F. MERS, SARS, and Ebola: The role of super-spreaders in infectious disease. Cell Host Microbe. 2015;18(4):398–401. doi: 10.1016/j.chom.2015.09.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Guan Y., Zheng B.J., He Y.Q., Liu X.L., Zhuang Z.X., Cheung C.L. Isolation and characterization of viruses related to the SARS coronavirus from animals in southern China. Science. 2003;302(5643):276–278. doi: 10.1126/science.1087139. [DOI] [PubMed] [Google Scholar]
- 7.Azhar E.I., El-Kafrawy S.A., Farraj S.A., Hassan A.M., Al-Saeed M.S., Hashem A.M. Evidence for camel-to-human transmission of MERS coronavirus. N Engl J Med. 2014;370(26):2499–2505. doi: 10.1056/NEJMoa1401505. [DOI] [PubMed] [Google Scholar]
- 8.Zhu N., Zhang D., Wang W., Li X., Yang B., Song J. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020;382(8):727–733. doi: 10.1056/NEJMoa2001017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Wu Y., Ho W., Huang Y., Jin D.-Y., Li S., Liu S.-L. SARS-CoV-2 is an appropriate name for the new coronavirus. Lancet. 2020;395(10228):949–950. doi: 10.1016/S0140-6736(20)30557-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Li Q., Guan X., Wu P., Wang X., Zhou L., Tong Y. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. N Engl J Med. 2020;382(13):1199–1207. doi: 10.1056/NEJMoa2001316. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Okada P., Buathong R., Phuygun S., Thanadachakul T., Parnmen S., Wongboot W. Early transmission patterns of coronavirus disease 2019 (COVID-19) in travellers from Wuhan to Thailand, January 2020. Euro Surveill. 2020;25(8):2000097. doi: 10.2807/1560-7917.ES.2020.25.8.2000097. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Novel Coronavirus (2019-nCoV) situation reports. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports Consulté le 29 mars 2020.
- 13.Novel Coronavirus (2019-nCoV) situation reports. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports Consulté le 12 avril 2020.
- 14.COVID Reference. Kamps BS, Hoffmann C. www.CovidReference.com
- 15.UpToDate.,https://www.uptodate.com/contents/coronavirus-disease-2019-covid-19. Consulté le 10 avril 2020
- 16.Literature review. Reacting 2020. https://reacting.inserm.fr/literature-review. Consulté le 11 avril 2020
- 17.Guan W., Ni Z., Hu Y., Liang W., Ou C., He J. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020 doi: 10.1056/NEJMoa2002032. NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Lauer S.A., Grantz K.H., Bi Q., Jones F.K., Zheng Q., Meredith H.R. The incubation period of coronavirus disease 2019 (COVID-19) from publicly reported confirmed cases: estimation and application. Ann Intern Med. 2020:M20–M0504. doi: 10.7326/M20-0504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Novel Coronavirus (2019-nCoV) situation reports. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports sitrep3
- 20.Liu Y., Gayle A.A., Wilder-Smith A., Rocklöv J. The reproductive number of COVID-19 is higher compared to SARS coronavirus. J Travel Med. 2020;27(2) doi: 10.1093/jtm/taaa021. [taaa021] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Lescure F.-X., Bouadma L., Nguyen D., Parisey M., Wicky P.-H., Behillil S. Clinical and virological data of the first cases of COVID-19 in Europe: a case series. Lancet Infect Dis. 2020 doi: 10.1016/S1473-3099(20)30200-0. S1473-3099(20)30200-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Zou L., Ruan F., Huang M., Liang L., Huang H., Hong Z. SARS-CoV-2 viral load in upper respiratory specimens of infected patients. N Engl J Med. 2020;382(12):1177–1179. doi: 10.1056/NEJMc2001737. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.To K.K.-W., Tsang O.T.-Y., Leung W.-S., Tam A.R., Wu T.-C., Lung D.C. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis. 2020 doi: 10.1016/S1473-3099(20)30196-1. [S1473-3099(20)30196-1]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Chan J.F.-W., Yuan S., Kok K.-H., To K.K.-W., Chu H., Yang J. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020;395(10223):514–523. doi: 10.1016/S0140-6736(20)30154-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Jefferson T., Foxlee R., Del Mar C., Dooley L., Ferroni E., Hewak B. Physical interventions to interrupt or reduce the spread of respiratory viruses: systematic review. BMJ. 2009;339:b3675. doi: 10.1136/bmj.b3675. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Van Doremalen N., Bushmaker T., Morris D.H., Holbrook M.G., Gamble A., Williamson B.N. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med. 2020 doi: 10.1056/NEJMc2004973. [NEJMc2004973] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Wang X., Pan Z., Cheng Z. Association between 2019-nCoV transmission and N95 respirator use. J Hosp Infect. 2020 doi: 10.1016/j.jhin.2020.02.021. [published online ahead of print, 2020 Mar 3] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Bartoszko J.J., Farooqi M.A.M., Alhazzani W., Loeb M. Medical masks vs N95 respirators for preventing COVID-19 in health care workers a systematic review and meta-analysis of randomized trials. Influenza Other Respir Viruses. 2020:10. doi: 10.1111/irv.12745. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Chen W., Lan Y., Yuan X., Deng X., Li Y., Cai X. Detectable 2019-nCoV viral RNA in blood is a strong indicator for the further clinical severity. Emerg Microbes Infect. 2020;9(1):469–473. doi: 10.1080/22221751.2020.1732837. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Wang W., Xu Y., Gao R., Lu R., Han K., Wu G. Detection of SARS-CoV-2 in different types of clinical. JAMA. 2020:e203786. doi: 10.1001/jama.2020.3786. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Wu P., Duan F., Luo C., Liu Q., Qu X., Liang L. Characteristics of ocular findings of patients with coronavirus disease 2019 (COVID-19) in Hubei Province, China. JAMA Ophthalmol. 2020:e201291. doi: 10.1001/jamaophthalmol.2020.1291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Mizumoto K., Kagaya K., Zarebski A., Chowell G. Estimating the asymptomatic proportion of coronavirus disease 2019 (COVID-19) cases on board the Diamond Princess cruise ship, Yokohama, Japan, 2020. Euro Surveill. 2020;25(10):2000180. doi: 10.2807/1560-7917.ES.2020.25.10.2000180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Hu Z., Song C., Xu C., Jin G., Chen Y., Xu X. Clinical characteristics of 24 symptomatic infections with COVID-19 screened among close contacts in Nanjing, China. Sci China Life Sci. 2020:10. doi: 10.1007/s11427-020-1661-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Bai Y., Yao L., Wei T., Tian F., Jin D.-Y., Chen L. Presumed asymptomatic carrier transmission of COVID-19. JAMA. 2020:e202565. doi: 10.1001/jama.2020.2565. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.National Health Commission of the PRC. http://en.nhc.gov.cn/Consulté le 12 avril 2020.
- 36.Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054–1062. doi: 10.1016/S0140-6736(20)30566-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Wu C., Chen X., Cai Y., Xia J., Zhou X., Xu S. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med. 2020:e200994. doi: 10.1001/jamainternmed.2020.0994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Grasselli G., Zangrillo A., Zanella A., Antonelli M., Cabrini L., Castelli A. Baseline characteristics outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy region, Italy. JAMA. 2020:e205394. doi: 10.1001/jama.2020.5394. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Réseau Sentinelles, France. https://websenti.u707.jussieu.fr/sentiweb/Consulté le 12 avril 2020.
- 40.Arentz M., Yim E., Klaff L., Lokhandwala S., Riedo F.X., Chong M. Characteristics outcomes of 21 critically ill patients with COVID-19 in Washington State. JAMA. 2020:e204326. doi: 10.1001/jama.2020.4326. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Bhatraju P.K., Ghassemieh B.J., Nichols M., Kim R., Jerome K.R., Nalla A.K. Covid-19 in critically ill patients in the Seattle region–case series. N Engl J Med. 2020:10. doi: 10.1056/NEJMoa2004500. [1056] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Russell T.W., Hellewell J., Jarvis C.I., van-Zandvoort K., Abbott S., Ratnayake R. Estimating the infection and case fatality ratio for coronavirus disease (COVID-19) using age-adjusted data from the outbreak on the Diamond Princess cruise ship, February 2020. Euro Surveill. 2020;25(12):2000256. doi: 10.2807/1560-7917.ES.2020.25.12.2000256. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Shim E., Tariq A., Choi W., Lee Y., Chowell G. Transmission potential and severity of COVID-19 in South Korea. Int J Infect Dis. 2020;93:339–344. doi: 10.1016/j.ijid.2020.03.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Verity R., Okell L.C., Dorigatti I., Winskill P., Whittaker C., Imai N. Estimates of the severity of coronavirus disease 2019: a model-based analysis. Lancet Infect Dis. 2020 doi: 10.1016/S1473-3099(20)30243-7. [S1473-3099(20)30243-7] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Novel 2019 coronavirus genome. Virological 2020. http://virological.org/t/novel-2019-coronavirus-genome/319 Consulté le 11 avril 2020.
- 46.Corman V.M., Landt O., Kaiser M., Molenkamp R., Meijer A., Chu D.K. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 2020;25(3):2000045. doi: 10.2807/1560-7917.ES.2020.25.3.2000045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Li Y., Yao L., Li J., Chen L., Song Y., Cai Z. Stability issues of RT-PCR testing of SARS-CoV-2 for hospitalized patients clinically diagnosed with COVID-19. J Med Virol. 2020:10. doi: 10.1002/jmv.25786. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Ai T., Yang Z., Hou H., Zhan C., Chen C., Lv W. Correlation of chest CT and RT-PCR testing in coronavirus disease 2019 (COVID-19) in China: a report of 1014 cases. Radiology. 2020:200642. doi: 10.1148/radiol.2020200642. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Petherick A. Developing antibody tests for SARS-CoV-2. Lancet. 2020;395(10230):1101–1102. doi: 10.1016/S0140-6736(20)30788-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Guo L., Ren L., Yang S., Xiao M., Chang D., Yang F. Profiling early humoral response to diagnose novel coronavirus disease (COVID-19) Clin Infect Dis. 2020 doi: 10.1093/cid/ciaa310. [ciaa310] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Zhao J., Yuan Q., Wang H., Liu W., Liao X., Su Y. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin Infect Dis. 2020 doi: 10.1093/cid/ciaa344. [ciaa344] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Wang D., Hu B., Hu C., Zhu F., Liu X., Zhang J. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA. 2020:e201585. doi: 10.1001/jama.2020.1585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Li Y.C., Bai W.Z., Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J Med Virol. 2020:10. doi: 10.1002/jmv.25728. 10.25728. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Mao L., Jin H., Wang M., Hu Y., Chen S., He Q. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol. 2020:10. doi: 10.1001/jamaneurol.2020.1127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Poyiadji N., Shahin G., Noujaim D., Stone M., Patel S., Griffith B. COVID-19-associated acute hemorrhagic necrotizing encephalopathy: CT and MRI features. Radiology. 2020:201187. doi: 10.1148/radiol.2020201187. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Chen T., Wu D., Chen H., Yan W., Yang D., Chen G. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study. BMJ. 2020:368. doi: 10.1136/bmj.m1091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Li Y.C., Bai W.Z., Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J Med Virol. 2020:10. doi: 10.1002/jmv.25728. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Alerte-anosmie-covid-19. https://www.snorl.org/category-acces-libre/category-actualites/alerte-anosmie-covid-19-20-mars-2020/Consulté le 12 avril 2020.
- 60.Hwang C.S. Olfactory neuropathy in severe acute respiratory syndrome: report of A case. Acta Neurol Taiwan. 2006;15(1):26–28. [PubMed] [Google Scholar]
- 61.Eliezer M., Hautefort C., Hamel A.L. Sudden and complete olfactory loss function as a possible symptom of COVID-19. JAMA Otolaryngol Head Neck Surg. 2020:10. doi: 10.1001/jamaoto.2020.832. [1001] [DOI] [PubMed] [Google Scholar]
- 62.Mo P., Xing Y., Xiao Y., Deng L., Zhao Q., Wang H. Clinical characteristics of refractory COVID-19 pneumonia in Wuhan, China. Clin Infect Dis. 2020 doi: 10.1093/cid/ciaa270. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Ruan Q., Yang K., Wang W., Jiang L., Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020:1–3. doi: 10.1007/s00134-020-05991-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Doyen D., Moceri P., Ducreux D., Dellamonica J. Myocarditis in a patient with COVID-19: a cause of raised troponin and ECG changes. Lancet. 2020 doi: 10.1016/S0140-6736(20)30912-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Wang L., Li X., Chen H., Yan S., Li D., Li Y. Coronavirus disease 19 infection does not result in acute kidney injury: an analysis of 116 hospitalized patients from Wuhan, China. Am J Nephrol. 2020:1–6. doi: 10.1159/000507471. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Chen N., Zhou M., Dong X., Qu J., Gong F., Han Y. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395(10223):507–513. doi: 10.1016/S0140-6736(20)30211-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Ilias I., Zabuliene L. Hyperglycemia and the novel Covid-19 infection: Possible pathophysiologic mechanisms. Med Hypotheses. 2020;139:109699. doi: 10.1016/j.mehy.2020.109699. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.CORONAVIRUS–COVID-19–Événements SFD. https://evenements-sfd.fr/coronavirus-covid-19/. Consulté le 12-avr-2020.
- 69.Mellhammar L., Linder A., Tverring J., Christensson B., Boyd J.H., Sendi P. NEWS2 is superior to qSOFA in detecting sepsis with organ dysfunction in the emergency department. J Clin Med. 2019;8(8):1128. doi: 10.3390/jcm8081128. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Tang N., Bai H., Chen X., Gong J., Li D., Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020:10. doi: 10.1111/jth.14817. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Qin C., Zhou L., Hu Z., Zhang S., Yang S., Tao Y. Dysregulation of immune response in patients with COVID-19 in Wuhan, China. Clin Infect Dis. 2020 doi: 10.1093/cid/ciaa248. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Li K., Wu J., Wu F. The clinical and chest CT features associated with severe and critical COVID-19 pneumonia. Invest Radiol. 2020:10. doi: 10.1097/RLI.0000000000000672. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Zu Z.Y., Jiang M.D., Xu P.P., Chen W., Ni Q.Q., Lu G.M. Coronavirus disease 2019 (COVID-19): a perspective from China. Radiology. 2020:200490. doi: 10.1148/radiol.2020200490. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Shi H., Han X., Jiang N., Cao Y., Alwalid O., Gu J. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis. 2020;20(4):425–434. doi: 10.1016/S1473-3099(20)30086-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Poggiali E., Dacrema A., Bastoni D., Tinelli V., Demichele E., Ramos P.M. Can lung US help critical care clinicians in the early diagnosis of novel coronavirus (COVID-19) pneumonia? Radiology. 2020:200847. doi: 10.1148/radiol.2020200847. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Yuan M., Yin W., Tao Z., Tan W., Hu Y. Association of radiologic findings with mortality of patients infected with 2019 novel coronavirus in Wuhan, China. PLoS One. 2020;15(3):e0230548. doi: 10.1371/journal.pone.0230548. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Chen H., Guo J., Wang C., Luo F., YU X., Zhang W. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet. 2020;395(10226):809–815. doi: 10.1016/S0140-6736(20)30360-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Schwartz D.A. An analysis of 38 pregnant women with COVID-19, their newborn infants, and maternal-fetal transmission of SARS-CoV-2: maternal coronavirus infections and pregnancy outcomes. Arch Pathol Lab Med. 2020:10. doi: 10.5858/arpa.2020-0901-SA. [DOI] [PubMed] [Google Scholar]
- 79.Liu Y., Chen H., Tang K., Guo Y. Clinical manifestations and outcome of SARS-CoV-2 infection during pregnancy. J Infect. 2020 doi: 10.1016/j.jinf.2020.02.028. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Zeng L., Xia S., Yuan W., Yan K., Xiao F., Shao J. Neonatal early-onset infection with SARS-CoV-2 in 33 neonates born to mothers with COVID-19 in Wuhan, China. JAMA Pediatr. 2020 doi: 10.1001/jamapediatrics.2020.0878. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Cui Y., Tian M., Huang D., Wang X., Huang Y., Fan L. A 55-day-old female infant infected with COVID 19 presenting with pneumonia, liver injury, and heart damage. J Infect Dis. 2020 doi: 10.1093/infdis/jiaa113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Wu Z., McGoogan J.M. Characteristics of important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAM.A. 2020:10. doi: 10.1001/jama.2020.2648. [DOI] [PubMed] [Google Scholar]
- 83.Lu X., Zhang L., Du H., Zhang J., Li Y.Y., Qu J. SARS-CoV-2 Infection in children. N Engl J Med. 2020 doi: 10.1056/NEJMc2005073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Qiu H., Wu J., Hong L., Luo Y., Song Q., Chen D. Clinical and epidemiological features of 36 children with coronavirus disease 2019 (COVID-19) in Zhejiang, China: an observational cohort study. Lancet Infect Dis. 2020 doi: 10.1016/S1473-3099(20)30198-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Cai J., Xu J., Lin D., Yang Z., Xu L., Zhenghai Q. A case series of children with 2019 novel coronavirus infection: clinical and epidemiological features. Clin Infect Dis. 2020 doi: 10.1093/cid/ciaa198. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Xia W., Shao J., Guo Y., Peng X., Li Z., Hu D. Clinical and CT features in pediatric patients with COVID-19 infection: different points from adults. Pediatr Pulmonol. 2020:10. doi: 10.1002/ppul.24718. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Sun D., Li H., Lu X.X., Xiao H., Ren J., Zhang F.R. Clinical features of severe pediatric patients with coronavirus disease 2019 in Wuhan: a single center's observational study. World J Pediatr. 2020:10. doi: 10.1007/s12519-020-00354-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Wei M., Yuan J., Liu Y., Fu T., Yu X., Zhang Z.J. Novel coronavirus infection in hospitalized infants under 1 year of age in China. JAMA. 2020;323(13):1313–1314. doi: 10.1001/jama.2020.2131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.D’Antiga L. Coronaviruses immunosuppressed patients. The facts during the third epidemic. Liver Transpl. 2020:10. doi: 10.1002/lt.25756. [DOI] [PubMed] [Google Scholar]
- 90.Gandolfini I., Delsante M., Fiaccadori E., Zaza G., Manenti L., Degli Antoni A. COVID-19 in kidney transplant recipients. Am J Transplant. 2020:10. doi: 10.1111/ajt.15891. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Monti S., Balduzzi S., Delvino P., Bellis E., Quadrelli V.S., Montecucco C. Clinical course of COVID-19 in a series of patients with chronic arthritis treated with immunosuppressive targeted therapies. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-217424. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.EULAR - COVID-19 Database. https://www.eular.org/eular_covid19_database.cfm. Consulté le 13 avril 2020.
- 93.Liang W., Guan W., Chen R., Wang W., Li J., Xu K. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol. 2020;21(3):335–337. doi: 10.1016/S1470-2045(20)30096-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Zhang L., Zhu F., Xie L., Wang C., Wang J., Chen R. Clinical characteristics of COVID-19-infected cancer patients: A retrospective case study in three hospitals within Wuhan, China. Ann Oncol. 2020:S0923–S7534. doi: 10.1016/j.annonc.2020.03.296. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 95.You B., Ravaud A., Canivet A., Giraud P., Guimbaud R., Kaluzinski The official French guidelines to protect patients with cancer against SARS-CoV-2 infection. Lancet Oncol. 2020 doi: 10.1016/S1470-2045(20)30204-7. [DOI] [PMC free article] [PubMed] [Google Scholar]