Abstract
目的
探讨56 ℃ 30 min灭活处理对不同方法测定2019新型冠状病毒(SARS-CoV-2)抗体检测结果的影响。
方法
本文为回顾性研究。收集2020年2月12~18日在佛山市第一人民医院确诊为新型冠状病毒性肺炎患者血清样本、血浆样本及全血样本各11份, 同时收集同期疑似病例及其他疾病患者血清、血浆及全血样本各10份, 采用双盲法, 在样本采用56℃ 30 min灭活处理前后, 分别采用免疫层析法检测样本中的SARS-CoV-2总抗体、采用荧光免疫层析法检测样本中的SARS-CoV-2 IgM抗体、采用化学发光荧光免疫分析法检测血清及血浆样本SARS-CoV-2 IgM及SARS-CoV-2 IgG, 比较灭活前与灭活处理后样本的抗体检测结果, 并采用Pearson相关性分析灭活前后检测IgM及IgG半定量检测结果的相关性。
结果
免疫层析法检测灭活前后血清与血浆样本中SARS-CoV-2总抗体的阳性样本符合率为90.9%, 阴性符合率为100.0%, 总符合率均为95.2%。免疫层析法检测灭活前后全血样本中SARS-CoV-2总抗体的总符合率为100.0%。荧光免疫层析法检测灭活前后血清、血浆及全血样本中SARS-CoV-2 IgM抗体的阳性符合率均为100.0%, 阴性符合率均为0%, 总符合率均为47.6%。化学发光免疫分析法检测灭活前后血清样本中SARS-CoV-2 IgM及IgG抗体及血浆中的IgG抗体, 阳性符合率、阴性符合率及总符合率均为100.0%, 检测血浆IgM抗体的总符合率为95.2%。采用Pearson相关对灭活前后血清及血浆样本IgM和IgG半定量检测结果进行相关性分析, 其中IgM灭活前后结果的相关系数为0.9999(95%CI:0.9998~1.000, P < 0.001), IgG灭活前后结果的相关系数为0.9999(95%CI:0.9998~1.000, P < 0.001)。
结论
56 ℃ 30 min灭活处理血液样本对免疫层析法及化学发光免疫分析法检测SARS-CoV-2抗体结果几乎无影响, 可在检测前先进行灭活以降低检验人员感染风险, 荧光免疫层析法不可使用灭活后样本进行检测。
Keywords: 2019新型冠状病毒, 病毒灭活, 抗体, 血清, 血浆
Abstract
Objective
To evaluate the effects of heat inactivation of blood samples at 56℃ for 30 min on the results of SARS-CoV-2 antibody detection using different methods.
Methods
This retrospective study was conducted in 11 patients with established diagnosis of COVID-19 and 10 patients with diseases other than COVID- 19 in our hospital. We collected samples of serum, plasma and whole blood from each patient between February, 12 and 18, 2020, and with a double- blind design, the samples were examined for SARS-CoV-2 antibodies before and after heat inactivation at 56 ℃ for 30 min. In all the samples, the total SARS-CoV-2 antibodies were detected using immunochromatography, and the IgM antibodies were detected using fluorescence immunochromatography; the IgM and IgG antibodies in the serum and plasma samples detected with chemiluminescence immunoassay. We compared the detection results and analyzed the correlation of semi-quantitative detection results of IgM and IgG antibodies before and after heat inactivation of the samples.
Results
With immuno-chromatography, the coincidence rate of the total SARS-CoV-2 antibody detection before and after heat inactivation of the serum and plasma samples was 90.0% in COVID-19 cases and 100.0% in the negative cases, resulting in a total coincidence rate 95.2%; for the whole blood samples, the total coincidence rates of the total SARS-CoV-2 antibodies were 100.0%. For detection of IgM antibodies in the serum, plasma and whole blood samples using fluorescence immunochromatography, the coincidence rates in SARS-CoV-2-positive and negative cases and the total coincidence rate before and after inactivation were 100.0%, 0 and 47.6%, respectively. For detection of serum IgM and IgG antibodies and plasma IgG antibodies with chemiluminescence immunoassay, the coincidence rates in SARS-CoV-2-positive and negative cases and the total coincidence rate before and after inactivation were all 100.0%, and the total coincidence rate of plasma IgM antibodies was 95.2%. Pearson correlation analysis of the semi-quantitative results of IgM and IgG detection in the serum and plasma samples showed a correlation coefficient of 0.9999 (95%CI: 0.9998-1.000, P < 0.001) between the results before and after sample inactivation.
Conclusion
Heat inactivation of blood samples at 56 ℃ for 30 min does not obviously affect the results of immunochromatography and chemiluminescent immunoassay for detection of SARS-COV-2 antibodies but can reduce the risk of infection for the operators. Heat-inactivated samples can not be used in fluorescence immunochromatography for SARS-CoV-2 antibody detection.
Keywords: SARS-CoV-2, heat inactivation, antibodies, serum, plasma
2019新型冠状病毒(SARS-CoV-2)可引起新型冠状病毒性肺炎(新冠肺炎), 对我国人民的健康造成了巨大的威胁[1-2], 已作为急性呼吸道传染病已被我国纳入《中华人民共和国传染病防治法》规定的乙类传染病, 按照甲类传染病管理。由于SARS-CoV-2主要通过呼吸道飞沫和密切接触传播, 早发现传染源并进行隔离治疗, 是防治新冠肺炎的重要手段[3]。目前实验室检测仍是诊断新冠肺炎的重要依据, 但由于其传染性强, 检验人员在进行样本检测时将面临极大的风险[4], 而在检验前将样本进行病毒灭活则能大大降低风险。目前已有文献报道使用56 ℃ 30 min和75%乙醇处理咽拭子标本对后续SARS-CoV-2核酸检测无明显影响[5], 而灭活样本对SARS-CoV-2抗体检测是否存在影响尚未见报道。因此本研究探讨56 ℃ 30 min灭活方式对不同方法检测SARS-CoV-2抗体的结果是否存在影响, 报道如下。
1. 资料和方法
1.1. 研究资料
血液样本来自于我院急诊科、感染科及重症医学科的住院患者, 收集日期为2020年2月12~18日。其中阳性样本来源于新型冠状病毒性肺炎确诊患者, 确诊标准为《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》[6], 阴性样本来源于同期非新冠肺炎患者, 并排除免疫功能障碍、恶性肿瘤及使用肝素治疗等患者。所有病例入院时同时采集3管血:黄色带促凝胶采血管采集静脉血3 mL, 3000 r/min离心15 min后分离血清备用; 紫色EDTA-K2抗凝管采集静脉血2 mL, 3000 r/min离心15 min后分离血浆备用; 紫色EDTA-K2抗凝管采集静脉血2 mL为全血标本。所有研究对象或家属均签署知情同意书。
1.2. 检测原理及判读标准
免疫层析法SARS-CoV-2新型冠状病毒抗体检测试剂(免疫层析法)试剂盒购自广州万孚生物技术股份有限公司, 检测原理是采用免疫层析技术, 应用捕获法检测人血清、血浆、全血中的2019新型冠状病毒总抗体。当检测区及质控区各出现一条红色反应线为阳性, 质控区出现一条红色反应线为阴性。
荧光免疫层析法SARS-CoV-2新型冠状病毒IgM抗体检测试剂(荧光免疫层析法)试剂盒购自广州万孚生物技术股份有限公司, 检测原理是采用捕获法及荧光免疫层析技术, 检测人血清、血浆、全血中的2019新型冠状病毒IgM抗体, 采用免疫荧光检测仪扫描荧光信号。仪器结果显示界面直接显示"阳性""、疑似阳性"及"阴性"。
化学发光免疫分析法新型冠状病毒SARS-CoV-2 IgM抗体检测试剂盒(化学发光免疫分析法)及新型冠状病毒SARS-CoV-2 IgG抗体检测试剂盒(化学发光免疫分析法)试剂盒购自深圳市新产业生物医学工程股份有限公司, 检测原理是化学发光免疫间接法, 采用SARS-CoV-2重组抗原包被磁性微球, 小分子发光标记物标记抗人IgM或IgG单克隆抗体, 利用底物液启动化学发光反应并产生光信号, 检测相对光强度并计算出待测抗体浓度。检测结果 < 0.900 AU/mL为无反应性, 检测结果在0.900~1.10 AU/mL判断为可疑, 检测结果≥1.10 AU/mL为有反应性。IgM检测范围为0.050~30.0 AU/mL, IgG检测范围为0.020~30.0 AU/mL。
1.3. 检测方案
所有样本均同时采用免疫层析法及荧光免疫层析法检测SARS-CoV-2抗体, 由于全血样本不能用于化学发光免疫分析法, 因此血清和血浆样本采用化学发光免疫分析法检测SARS-CoV-2 IgM和IgG抗体。检测完毕后, 所有样本置于56 ℃水浴箱放置30 min灭活病毒。灭活后样本按原来检测方案全部复测1次, 比较灭活前与灭活处理后抗体检测结果。所有操作符合生物安全要求。
1.4. 统计学分析
免疫层析法及荧光免疫层析法为定性试验, 检测结果为分类变量, 采用"阴性""、疑似"或"阳性"表示。化学发光免疫分析法为半定量实验, 根据检测数值判定为"有反应性""、可疑"或"无反应性"。分别计算样本灭活前后检测结果的阳性符合率、阴性符合率及总符合率, 采用Pearson相关分析灭活前后血清及血浆样本IgM和IgG半定量检测结果。采用GraphPad Prism 5.0软件进行绘图及统计学分析, P < 0.05认为差异有统计学意义。
2. 结果
2.1. 灭活前与灭活处理后免疫层析法检测结果
采用免疫层析法检测灭活前后样本中SARS-CoV-2总抗体, 比较结果发现, 血清与血浆阳性各11例灭活前为阳性的样本, 经56 ℃ 30 min灭活后处理后, 各有1例变为阴性, 而灭活前为阴性的血清及血浆样本各10例, 阳性样本符合率为90.9%。灭活处理后全部均为阴性, 阴性符合率为100.0%。血清样本及血浆样本灭活前与灭活处理后的总符合率均为95.2%(κ= 0.905, P < 0.001)。全血11例阳性样本与10例阴性样本灭活前与灭活后检测结果完全一致, 总符合率为100.0%(κ=1.000, P < 0.001, 表 1)。
1.
灭活前与灭活处理后免疫层析法检测结果
Immunochromatographic results before and after heat inactivation of the samples
| Sample | Before inactivation | n | After inactivation | Coincidence rate (%) | κ | P | 95CI% | |
| Positive(+) | Negative(-) | |||||||
| Serum | Positive (+) | 11 | 10 | 1 | 95.2 | 0.905 | 0.000 | 0.000-0.000 |
| Negative (-) | 10 | 0 | 10 | |||||
| Plasma | Positive (+) | 11 | 10 | 1 | 95.2 | 0.905 | 0.000 | 0.000-0.000 |
| Negative (-) | 10 | 0 | 10 | |||||
| Whole blood | Positive (+) | 11 | 11 | 0 | 100.0 | 1.000 | 0.000 | 0.000-0.000 |
| Negative (-) | 10 | 0 | 10 | |||||
2.
灭活前与灭活处理后荧光免疫层析法检测结果
Fluorescence immunochromatographic results before and after heat inactivation of the samples
| Sample | Before inactivation | n | After inactivation | Coincidence rate (%) | k | P | 95CI% | ||
| Positive (+) | Gray zone (±) | Negative (-) | |||||||
| Positive (+) | 10 | 10 | 0 | 0 | |||||
| Serum | Gray zone (±) | 1 | 1 | 0 | 0 | 47.6 | 0 | - | - |
| Negative (-) | 10 | 10 | 0 | 0 | |||||
| Positive (+) | 10 | 10 | 0 | 0 | |||||
| Plasma | Gray zone (±) | 1 | 1 | 0 | 0 | 47.6 | 0 | - | - |
| Negative (-) | 10 | 10 | 0 | 0 | |||||
| Positive (+) | 10 | 10 | 0 | 0 | |||||
| Whole blood | Gray zone (±) | 1 | 1 | 0 | 0 | 47.6 | 0 | - | - |
| Negative (-) | 10 | 10 | 0 | 0 | |||||
2.2. 灭活前与灭活处理后荧光免疫层析法检测结果
采用荧光免疫层析法检测灭活前后样本中SARS-CoV-2 IgM抗体, 比较结果发现, 血清、血浆及全血样本经56 ℃ 30 min灭活处理后, 所有样本的检测结果均为阳性, 其中阳性符合率为100.0%, 但阴性符合率为0%, 总符合率为47.6%。
2.3. 灭活前与灭活处理后化学发光免疫分析法检测结果
采用化学发光免疫分析法检测灭活前后血清及血浆样本中SARS-CoV-2 IgM及IgG抗体, 经56 ℃ 30 min灭活处理后再检测, 其中血清IgM、IgG及血浆IgG检测结果与灭活前一致, 阳性符合率、阴性符合率及总符合率为100.0%(κ=1.000, P < 0.001), 1例血浆IgM灭活前为可疑(1.079 U/mL), 灭活后检测结果为无反应性(0.889 U/mL), 因此血浆IgM总符合率为95.2%(κ= 0.881, P < 0.001, 表 3)。
3.
灭活前与灭活处理后化学发光免疫分析法检测结果
Chemiluminescence immunoassay results before and after heat inactivation of the samples
| Sample | Item | Before inactivation | n | After inactivation | Coincidence rate (%) | κ | P | 95CI% | ||
| Positive (+) | Gray zone (±) | Negative (-) | ||||||||
| Serum | IgM | |||||||||
| Positive (+) | 5 | 5 | 0 | 0 | ||||||
| Gray zone (±) | 1 | 0 | 1 | 0 | 100.0 | 1.000 | < 0.001 | 0.000-0.000 | ||
| Negative (-) | 15 | 0 | 0 | 15 | ||||||
| IgG | ||||||||||
| Positive (+) | 7 | 7 | 0 | 0 | ||||||
| Gray zone (±) | 0 | 0 | 0 | 0 | 100.0 | 1.000 | < 0.001 | 0.000-0.000 | ||
| Negative (-) | 14 | 0 | 0 | 14 | ||||||
| Plasma | IgM | |||||||||
| Positive (+) | 5 | 5 | 0 | 0 | ||||||
| Gray zone (±) | 1 | 0 | 0 | 1 | 95.2 | 0.881 | < 0.001 | - | ||
| Negative (-) | 15 | 0 | 0 | 15 | ||||||
| IgG | ||||||||||
| Positive (+) | 7 | 7 | 0 | 0 | ||||||
| Gray zone (±) | 0 | 0 | 0 | 0 | 100.0 | 1.000 | < 0.001 | 0.000-0.000 | ||
| Negative (-) | 14 | 0 | 0 | 14 | ||||||
2.4. 灭活前与灭活处理后化学发光荧光免疫分析法检测结果相关性分析
采用Pearson相关对灭活前后血清及血浆样本IgM和IgG检测结果进行相关性分析, 其中IgM灭活前后结果的相关系数为0.9999(95% CI:0.9998~1.000, P < 0.001), IgG灭活前后结果的相关系数为0.9999(95% CI:0.9998~1.000, P < 0.001, 图 1)。
1.
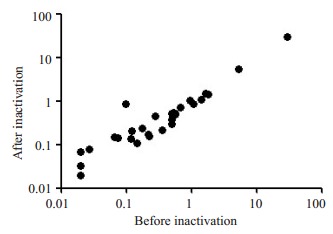
灭活前后化学发光法检测IgM结果相关性
Correlation between chemiluminescence immunoassay results before and after heat inactivation of the samples.
3. 讨论
SARS-CoV-2属于β属冠状病毒, 与蝙蝠SARS样冠状病毒同源性超过85%, 具有高度的传染性, 可引起新冠肺炎[7]。SARS-CoV-2对紫外线和热敏感, 56 ℃ 30min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒[8]。SARS-CoV-2核酸检测阳性是确诊新冠肺炎的主要实验室依据[9], 然而, 核酸检测耗时较长, 且易受到取材等因素的影响存在一定的假阴性, 因此, SARS-CoV-2抗体检测是诊断新冠肺炎的重要辅助手段, 是核酸检测的良好补充。由于已确证医学实验室人员在接触患者血液、尿液、粪便等样本时可产生气溶胶, 造成检验人员的感染[4], 除了做好生物安全防护外, 在不影响检测结果的前提下, 若能在检测前将样本进行灭活处理, 将大大降低感染的几率。因此, 本研究通过比较不同方法检测灭活前与灭活处理后样本的结果差异, 探讨56 ℃ 30 min灭活处理对不同方法测定SARS-CoV-2抗体检测结果的影响。
本研究发现, 免疫层析法检测SARS-CoV-2总抗体的结果基本不受样本灭活的影响, 其所有样本类型的阴性符合率均达到100%, 而11例灭活前检测结果为阳性的血清及血浆样本中, 只有1例在灭活后转变成阴性, 阳性符合率为90.9%。采用化学发光免疫分析法检测血清IgM、IgG及血浆IgG的结果与灭活前一致, 阳性符合率、阴性符合率及总符合率为100.0%, 血浆IgM 1例灭活前为可疑阳性, 灭活后检测结果为无反应性, 因此血浆IgM总符合率为95.2%。提示灭活处理对检测结果影响较小, 对化学发光免疫分析法检测血清IgM、IgG结果基本无影响。采用荧光免疫分析法检测SARS-CoV-2 IgM, 灭活前结果为阴性的标本, 灭活处理后所有检测结果均为阳性, 阴性符合率为0, 表明此方法不可采用56 ℃ 30 min灭活处理后的样本进行检测。
针对免疫层析法1例在经灭活处理后变成阴性的阳性样本, 结合化学发光免疫分析法检测IgM及IgG结果进行进一步分析, 发现两种方法前后不一致的样本来源于同一例患者。查阅其病历资料, 发现此患者处于感染初期, 化学发光免疫分析法检测血浆IgM检测结果为1.079 U/mL, 处于灰区0.9~1.10 U/mL, 经灭活处理后结果为0.889 U/mL, 变为无反应性, IgG在灭活前后结果均为无反应性, 考虑由于本身抗体滴度较低, 处于临床诊断的临界值附近, 需复查或结合临床症状综合判断。
化学发光免疫分析法检测SARS-CoV-2 IgM或IgG为半定量方法, 通过光电倍增管测出相对光强度, 与样本中的待测抗体呈一定正相关比例关系, 可在一定程度上反应患者体内IgM及IgG浓度的变化, 可用于SARS-CoV-2感染的辅助诊断。最近有文献报道, 患者恢复期血清可能用于新冠肺炎的治疗[10-11], IgM及IgG半定量检测有助于了解患者体内抗体水平, 对临床上开展抗体的采集有一定的指导意义。采用Pearson相关性分析灭活前后血清及血浆样本IgM和IgG检测结果, IgM及IgG灭活前后结果的相关性良好, 相关系数均达到0.9999(95%CI:0.9998~1.000, P < 0.001), 进一步证明56 ℃ 30 min灭活处理不会对化学发光免疫分析法检测SARS-CoV-2 IgM或IgG结果造成影响, 为了降低检验人员感染风险, 可在检测前对标本进行灭活处理。
综上所述, 56 ℃ 30 min灭活处理血液样本对免疫层析法及化学发光免疫分析法检测SARS-CoV-2抗体结果几乎无影响, 可在检测前先进行灭活以降低检验人员感染风险, 荧光免疫层析法不可使用灭活后样本进行检测。然而, 本研究存在一些不足:由于时间紧迫且样本来源较少, 本次纳入研究的总样本量较小, 且仅有1例抗体水平处于临床诊断灰区。在后续研究中应加大样本量, 并增加灰区样本量, 将有助于进一步明确灭活处理对检测结果的影响, 为降低临床检验人员的感染风险提供新策略。
Biography
薛雄燕, 主任技师, E-mail: xxyan@fsyyy.com
Funding Statement
佛山新型冠状病毒感染的肺炎应急攻关专项(2020001000431)
Contributor Information
薛 雄燕 (Xiongyan XUE), Email: xxyan@fsyyy.com.
李 炜煊 (Weixuan LI), Email: lwxuan@fsyyy.com.
References
- 1.Nishiura H, Jung SM, Linton NM, et al. The extent of transmission of novel coronavirus in wuhan, China, 2020. J Clin Med. 2020;24(9):pii: E330. doi: 10.3390/jcm9020330. [Nishiura H, Jung SM, Linton NM, et al. The extent of transmission of novel coronavirus in wuhan, China, 2020[J]. J Clin Med, 2020, 24 (9). pii: E330. DOI: 10.3390/jcm9020330.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.HuiDS, I AzharE, MadaniTA, et al. The continuing 2019-nCoV epi-demic threat of novel coronaviruses to global health-the latest 2019 novel coronavirus outbreak in Wuhan, China. Int J Infect Dis. 2020;91:264–6. doi: 10.1016/j.ijid.2020.01.009. [HuiDS, I AzharE, MadaniTA, et al. The continuing 2019-nCoV epi-demic threat of novel coronaviruses to global health-the latest 2019 novel coronavirus outbreak in Wuhan, China[J]. Int J Infect Dis, 2020, 91: 264-6. DOI: 10.1016/j.ijid.2020.01.009.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.关于印发医疗机构内新型冠状病毒感染预防与控制技术指南(第一版)的通知(.国卫办医函[2020]65号)[EB/OL].2020. <a href="http://www.nhc.gov.cn/yzygj/s7659/202001/b91fdab7c304431eb082d67847d27e14.shtml" target="_blank">http://www.nhc.gov.cn/yzygj/s7659/202001/b91fdab7c304431eb082d67847d27e14.shtml</a>.
- 4.华 文浩, 盛 琳君, 宋 丽红, et al. 生物安全Ⅱ级实验室开展新型冠状病毒感染患者实验检测的风险评估与防控. 中华检验医学杂志. 2020;43(00):E007–E007. doi: 10.3760/cma.j.issn.1009-9158.2010.0007. doi: 10.3760/cma.j.issn.1009-9158.2010.0007. [华文浩, 盛琳君, 宋丽红, 等.生物安全Ⅱ级实验室开展新型冠状病毒感染患者实验检测的风险评估与防控[J].中华检验医学杂志, 2020, 43(00): E007-E007. DOI: 10.3760/cma.j.issn.1009-9158.2010.0007.] [DOI] [Google Scholar]
- 5.陈 培松, 何 宇婷, 黄 裕立, et al. 不同方式灭活口咽拭子标本对2019新型冠状病毒实时荧光定量PCR检测结果的影响. 中华检验医学杂志. 2020;43(00):E004–E004. doi: 10.3760/cma.j.issn.1009-9158.2020.0004. doi: 10.3760/cma.j.issn.1009-9158.2020.0004. [陈培松, 何宇婷, 黄裕立, 等.不同方式灭活口咽拭子标本对2019新型冠状病毒实时荧光定量PCR检测结果的影响[J].中华检验医学杂志, 2020, 43(00): E004-E004. DOI: 10.3760/cma.j.issn.1009-9158.2020.0004.] [DOI] [Google Scholar]
- 6.国家卫生健康委".新型冠状病毒感染的肺炎诊疗方案"(试行第五版)[EB/OL]. 2020. <a href="http://www.nhc.gov.cn/yzygj/s7653p/202002/3b09b894ac9b4204a79db5b8912d4440.shtml" target="_blank">http://www.nhc.gov.cn/yzygj/s7653p/202002/3b09b894ac9b4204a79db5b8912d4440.shtml</a>.
- 7.Chu DKW, Pan Y, Cheng SMS, et al. Molecular diagnosis of a novel coronavirus (2019- nCoV) causing an outbreak of pneumonia. Clin Chem. 2020:pii: hvaa029. doi: 10.1093/clinchem/hvaa029. [Chu DKW, Pan Y, Cheng SMS, et al. Molecular diagnosis of a novel coronavirus (2019- nCoV) causing an outbreak of pneumonia[J]. Clin Chem, 2020. pii: hvaa029. doi: 10.1093/clinchem/hvaa029.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.中华人民共和国卫生健康委员会.国卫办医函[2020]109号.新型冠状病毒肺炎实验室检测技术指南(第四版). <a href="http://www.nhc.gov.cn/jkj/s3577/202002/573340613ab243b3a7f61df260551dd4.shtml" target="_blank">http://www.nhc.gov.cn/jkj/s3577/202002/573340613ab243b3a7f61df260551dd4.shtml</a>.
- 9.Corman VM, Landt O, Kaiser M, et al. Detection of 2019 novel coro-navirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 2020;25(3) doi: 10.2807/1560-7917.ES.2020.25.3.2000045. [Corman VM, Landt O, Kaiser M, et al. Detection of 2019 novel coro-navirus (2019-nCoV) by real-time RT-PCR[J]. Euro Surveill, 2020, 25(3). DOI: 10.2807/1560-7917.ES.2020.25.3.2000045.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Mair-Jenkins J, Saavedra-Campos M, Baillie JK, et al. The effec-tiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: a systematic review and exploratory meta-analysis. J Infect Dis. 2015;211(1):80–90. doi: 10.1093/infdis/jiu396. [Mair-Jenkins J, Saavedra-Campos M, Baillie JK, et al. The effec-tiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: a systematic review and exploratory meta-analysis[J]. J Infect Dis, 2015, 211(1): 80-90. DOI: 10.1093/infdis/jiu396.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.李 辉, 王 业明, 徐 九洋, et al. 2019新型冠状病毒抗病毒治疗有药可期. 中华结核和呼吸杂志. 2020;43(00):E002–E002. doi: 10.3760/cma.j.issn.1001-0939.2020.0002. [李辉, 王业明, 徐九洋, 等. 2019新型冠状病毒抗病毒治疗有药可期[J].中华结核和呼吸杂志, 2020, 43(00): E002-E002. DOI: 10.3760/cma.j.issn.1001-0939.2020.0002.] [DOI] [PubMed] [Google Scholar]


