Abstract
目的
研究新型冠状病毒56℃ 30 min灭活方法引起的改变对TDM液质联用优化检测伏立康唑的影响并探讨该方法在疫情防控期间的应用。
方法
将临床送检抗凝采血管以75%乙醇表面消毒后, 混匀全血, 分为非灭活分离血浆组, 全血灭活分离血浆组, 分离血浆后灭活组。灭活方法采用56 ℃ 30 min水浴, 再以1:3比例的乙腈或乙醇沉淀血浆蛋白处理样品。血浆标准曲线样品及质控样品分别采用同等条件灭活与非灭活处理。
结果
应用优化的串联质谱检测方法, 伏立康唑在不同浓度下灭活样品平均准确率为97.37%, 日间精密度为3.59%, 日内精密度为2.81%。以乙腈或乙醇为沉淀蛋白提取溶剂均能获得较高的提取回收率, 均值分别为100.56%及95.90%, 并且基质效应影响较小, 均值分别为102.85%及93.62%。临床标本中, 全血及血浆灭活的伏立康唑浓度与非灭活检测结果均呈现良好的线性相关性关系, 各组间相关系统均大于0.99。
结论
血液标本以采血管内56 ℃ 30 min灭活结合乙醇处理血浆样品对串联质谱法伏立康唑血浆浓度检测影响较小, 可用于疫情防控期间伏立康唑液相串联质谱法治疗药物监测的开展。
Keywords: COVID-19, 全血灭活, 伏立康唑, 治疗药物监测
Abstract
Objective
To investigate the effect of heat inactivation (56℃for 30 min) of SARS-CoV-2 on the results of therapeuticdrug monitoring (TDM) of voriconazole by liquid chromatography tandem mass spectrometry (LC-MS/MS).
Methods
We collected clinical blood samples from voriconazole-treated patients in heparinized tubes and sterilized the surface of the tubes with 75% ethanol. The whole blood samples were centrifuged to separate the plasma with or without prior heat inactivation, or only the separated plasma was heat inactivated. Heat inactivation of the samples was carried out at 56 ℃ for 30 min followed by protein precipitation with acetonitrile or ethanol. The plasma standard and quality control samples were inactivated in an identical manner and tested with LC-MS/MS along with the treated samples.
Results
The optimized method showed a high imprecision (with mean intra- and inter-day imprecisions of 3.59% and 2.81%, respectively) and a high accuracy (mean 97.37%) for detecting voriconazole in the inactivated samples at different concentration levels. Sample preparation with acetonitrile or ethanol resulted in a high mean recovery (100.56% or 95.90%) with minimal mean matrix effect (102.85% or 93.62%). The measured voriconazole concentrations in inactivated whole blood, inactivated plasma and the samples without inactivation all showed good linear correlations with correlation coefficients all greater than 0.99.
Conclusion
Heat inactivation at 56 ℃ for 30 min combined with ethanol sample preparation only has limited effects to affect LC-MS-based voriconazole concentration measurement in whole blood samples collected in heparinized tubes, and can be used for therapeutic drug monitoring of voriconazole during the ongoing COVID-19 pandemic.
Keywords: COVID-19, whole blood inactivation, voriconazole, therapeutic drug monitoring
目前, 由2019新型冠状病毒(SARS-CoV-2)感染引发的新型冠状病毒肺炎(COVID-19), 已发展成为全球性突发公共卫生事件, 国家卫健委及世卫组织高度关注此次疫情防控进展[1-2]。根据病例的回顾性研究, 重症COVID-19患者死亡率较高, 且部分重症患者存在合并真菌感染的情况[3], 因此, 临床上需采用抗真菌药物联合抗病毒方案进行治疗从而降低病死率。
伏立康唑是一种广谱三唑类抗真菌药, 广泛用于侵袭性真菌感染[4], 已有COVID-19合并真菌感染的患者使用伏立康唑的临床实践。我院自2014年起开展伏立康唑治疗药物监测(TDM)[5], 且国内外研究已证实伏立康唑治疗疗效及药物不良反应与其血谷浓度相关, 获得稳定的治疗窗内血谷度是达到疗效和减少不良反应的保障[6]。但伏立康唑治疗窗窄(1~5 mg/L), 个体间及个体内差异大, 高血浆谷浓度显著增加肝脏及神经系统不良反应发生率[7], 故常规监测浓度可提高疗效并降低不良反应[8]。由于重症COVID-19患者可能伴有的肝肾功能异常以及合并使用洛匹那韦/利托那韦, 均可影响伏立康唑的药动学过程[9], 因此, 伏立康唑的TDM对救治该类COVID-19的患者具有重要的临床价值。
SARS-CoV-2具有高传染性, 使得疫情防控期间, 特别是针对确诊和疑似患者的TDM工作面临极大的风险与挑战。根据该病毒特点及最新版诊疗方案, 需将标本进行56 ℃ 30 min的病毒灭活操作[10]。然而, 灭活处理是否对伏立康唑药物本身产生影响尚无相关资料, 并且至今尚未见关于液相串联质谱法伏立康唑灭活稳定性及相关TDM实践的报道。本研究以56 ℃ 30 min灭活方式对全血及血浆基质改变对TDM液质联用检测伏立康唑的影响并探讨该方法在疫情防控期间的应用。
1. 资料和方法
1.1. 标本来源
血液标本来源于我院2月24~28日急诊科、呼吸与危重症医学科、血液内科、小儿科及重症医学科的住院及门诊患者进行伏立康唑治疗药物浓度监测的肝素抗凝全血。
1.2. 液相串联质谱条件
美国Agilent Poroshell 120 EC-C18色谱柱(3.0 mm× 50 mm, 2.7 μm), 流动相:(A)0.1%甲酸乙腈(V:V), (B) 0.1%甲酸水溶液(V:V), 梯度洗脱, 起始比例为80%的B相, 流速为0.5 mL/min, 柱温30 ℃; 内标选用6, 7-二甲基-2, 3-二(2-吡啶基)喹喔啉[6, 7-Dimethyl-2, 3-di(2-pyridyl)quinoxaline, Qx]。串联质谱检测采用Agilent 1260高效液相色谱仪串联Agilent 6460三重四级杆质谱, 以电喷雾电离源(ESI)正离子化检测, 毛细管电压为3500 V, 喷雾气压力为35 psi, 干燥气体流速9 L/min, 干燥气体温度340 ℃。伏立康唑定量离子m/z为350.1→127.1, 碰撞能量42 V, 裂解电压100 V; 定性离子m/z为350.1→281.2, 碰撞能量12 V, 裂解电压100 V; 内标Qx定量离子m/z为313.0→284.1, 碰撞能量50 V, 裂解电压100 V; 各通道四级杆捕捉时间均为0.1 s。
1.3. 血液标本灭活方法
将临床送检抗凝采血管以75%乙醇表面消毒后, 混匀全血, 分为3份:非灭活组, 全血灭活分离血浆组, 分离血浆灭活组。灭活方法采用56 ℃ 30 min水浴, 分离血浆采用3500 r/min离心5 min, 离心完成后静置15 min再开盖取出样品以降低可能产生的气溶胶逸散。血浆标准曲线样品及质控样品分别采用同等条件灭活与非灭活处理。
1.4. 样品处理方法
精密吸取血浆100 μL于1.5 mL离心管中, 加入300 μL含有500 ng/mL内标液的乙腈或乙醇溶液, 涡旋1 min后, 14 000 r/min离心15 min, 取上清液2 μL进样。
1.5. 统计学方法
采用SPSS19.0统计软件对数据进行分析, 采用Pearson相关分析不同灭活方法、提取方法及灭活前后伏立康唑的定量检测结果, 采用GraphPad 5.0软件进行绘图。P < 0.05为差异有统计学意义。
2. 结果
2.1. 检测方法的方法学考察
通过考察不同来源经不同方法灭活及提取的空白血浆, 结果表明未用伏立康唑患者血浆内源性物质及其他循环成分不干扰伏立康唑及内标物的检测。伏立康唑及Qx的保留时间分别为2.185及2.105 min, 两物质互不干扰。结合临床检测实际, 以伏立康唑定量峰面积与对应Qx峰面积之比(y)为纵坐标, 以血浆药物浓度与相应的内标浓度之比(x)为横坐标, 权重系数为1/x2。全血灭活血浆经乙腈提取后伏立康唑浓度在0.1~10 μg·mL-1范围内呈良好的线性关系, 典型代表方程为:y= 2.185*x+0.5669, R2=0.9984(n=7)。
通过对高、中、低3个浓度水平质控样品不同处理方式的准确度、精密度、相对提取回收率以及相对基质效应进行考察, 结果表明, 伏立康唑在不同浓度下非灭活与灭活样品均具有较高的精密度与准确度, 以乙腈或乙醇为沉淀蛋白提取溶剂均能获得较高的提取回收率, 并且基质效应影响较小(表 1)。然而, 以乙醇沉淀蛋白的提取回收率低于乙腈法, 且基质效应大于乙腈法。
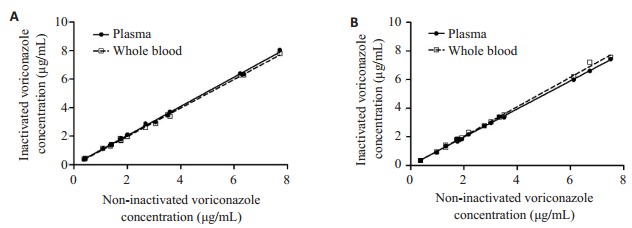
1.
灭活与非灭活样品伏立康唑浓度的相关性
Correlation of voriconazole concentration in inactivated and non-inactivated samples. A: Acetonitrile; B: Ethanol.
| Group | Level (μg/mL) | Accuracy (%) | Imprecision | Mean is normalized recovery (RSD%) | Mean is normalizedmatrix effect (RSD%) | |||||
| Intra-day (RSD%) | Inter-day (RSD%) | Acetonitrile | Ethanol | Acetonitrile | Ethanol | |||||
| Non inactivate | 0.2 | 95.74 | 3.98 | 3.06 | 100.29 (3.07) | 94.84 (2.41) | 101.18 (2.58) | 92.58 (4.79) | ||
| 2 | 95.87 | 2.53 | 2.21 | 106.90 (1.69) | 98.71 (2.19) | 104.69 (2.85) | 91.20 (2.72) | |||
| 5 | 99.68 | 1.96 | 1.42 | 101.86 (0.44) | 94.25 (1.97) | 104.92 (1.55) | 98.91 (3.30) | |||
| Plasma inactivate | 0.2 | 96.73 | 4.74 | 3.67 | 99.89 (4.04) | 93.77 (4.19) | 102.29 (3.29) | 95.02 (2.24) | ||
| 2 | 96.41 | 3.04 | 2.77 | 102.66 (1.88) | 96.44 (3.18) | 103.70 (2.70) | 91.58 (2.33) | |||
| 5 | 98.97 | 2.99 | 1.98 | 99.14 (1.61) | 97.49 (2.72) | 102.58 (1.83) | 94.27 (2.72) | |||
2.2. 临床标本全血灭活与血浆灭活对伏立康唑TDM的影响
采用LC-MS/MS法对不同灭活方法下伏立康唑的血浆浓度进行检测, 定量时, 以对应空白血浆标准曲线进行结果计算。结果表明, 以乙腈及乙醇沉淀蛋白时, 全血及血浆灭活的伏立康唑浓度与非灭活检测结果均呈现良好的线性相关性关系(图 1)。尽管在具体操作中发现, 全血灭活样品离心后, 出现轻度的溶血现象, 且在不同患者血样及4 ℃存放3 d内的不同存放时间的血样间, 溶血程度存在无规律性的差异。然而无论以乙腈或乙醇处理样品后, 溶血现象带来的血浆基质变化均对伏立康唑的检测不造成影响。
1.
灭活与非灭活样品方法学考察结果
Results of methodological validation parameters of inactivated and non-inactivated samples
3. 讨论
COVID-19在全球范围重症患者中均具有高死亡率[11-12], 而重症患者占15.74%[12]。该病典型临床表现之一为淋巴细胞持续下降[10, 12], 导致患者易合并真菌感染。在目前的治疗中, 约有7.5%的重症患者合并使用抗真菌治疗[12]。因此, 对于特殊COVID-19患者侵袭性真菌感染的预防与治疗是影响重症患者治疗及预后的重要因素。伏立康唑作为肺部侵袭性真菌感染的一线用药, 借助治疗药物浓度监测调整用药能够获得更大的临床收益, 故常规监测伏立康唑谷浓度具有重要的临床意义。
SARS-CoV-2属于β属冠状病毒, 具有高度的传染性。SARS-CoV-2对紫外线及热敏感, 56℃ 30 min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等溶剂均可以有效灭活病毒。从生物安全及保护一线防控工作人员的角度, 临床核酸检验及部分免疫检测操作中亦推荐使用56 ℃ 30 min水浴的方法灭活病毒[13-14]。与核酸检测不同, 对于TDM, 热灭活法可能影响伏立康唑的稳定性之外, 亦由于生物样品基质改变, 可带来未知的干扰。然而, 针对伏立康唑的串联质谱检测, 目前尚未见相关研究, 亦缺乏关于疫情期间抗菌药物TDM工作流程的建设性指导意见。因此, 本研究通过比较临床标本全血或血浆热灭活以及乙腈或乙醇处理样品对临床真实标本伏立康唑浓度检测的影响差异, 探讨新的检测流程在COVID-19疫情期间的应用。
本研究发现, 即使全血灭活可能出现轻度的溶血现象, 但不影响LC-MS/MS法对伏立康唑血浆浓度的检测。而在样品处理方法上, 尽管采用终浓度为75%的乙醇提取相较乙腈处理血浆后, 一定程度上降低了提取回收率并增加了基质效应, 但均可满足临床伏立康唑TDM, 不同处理方法的相关性良好。表明, 在液相梯度洗脱串联质谱检测方法下, 热灭活及乙腈/乙醇处理样品可用于伏立康唑血药浓度的临床检测。出于生物安全考虑, 最大程度上杜绝实验室感染性危害。
我院常规监测伏立康唑等抗菌药物血药浓度, 并参与临床给药方案调整, 具有较丰富的临床药学实践经验。在此次疫情中, 我院作为定点收治单位, 临床标本的TDM存在病毒传播风险。结合本研究结论, 在新型冠状肺炎疫情防控期间, 我院TDM实验室伏立康唑串联质谱检测在以75%乙醇灭活采血管表面病毒后, 采用采血管内全血56 ℃ 30 min灭活后再分离血浆, 并以1:3的比例以无水乙醇沉淀蛋白进行样品处理。在每批次检测中, 含药空白基质标准曲线及质控样品需与检测标本平行操作。为降低离心过程中产生的气溶胶危害, 离心后需静置15 min再执行开盖操作。操作人员需进行2级防护, 并推荐在生物安全柜内使用带滤芯的吸头进行加样操作。实验完毕后, 以75%乙醇或紫外灯对工作间、台面、地面等可能污染的区域进行表面灭活, 进样分析完成后, 以75%的色谱纯无水乙醇冲洗色谱柱及管路。检测中涉及的垃圾及废液按照感染性医疗垃圾处理原则, 单独标记处理。
综上所述, 采血管内全血56 ℃ 30 min灭活处理血液标本结合乙醇处理血浆样品可用于疫情防控期间伏立康唑液相串联质谱法的TDM检测, 对于COVID-19确诊/疑似患者标本, 可参考本实验室推荐的TDM工作流程进行操作。然而, 本研究未考虑对VOR用药调整具有实际意义的代谢产物在灭活过程中的影响, 在后续的研究中将进一步进行完善, 以期为疫情期间各实验室TDM的开展及降低TDM检测人员感染提供必要的实践参考。
Biography
赵博欣, 主管药师, 医学博士, E-mail: boxin_zhao@126.com
Funding Statement
国家自然科学基金(81803786);广东省自然基金(2016A030310399)
Supported by National Natural Science Foundation of China (81803786)
Contributor Information
赵 博欣 (Boxin ZHAO), Email: boxin_zhao@126.com.
李 国锋 (Guofeng LI), Email: liguofeng_2010@126.com.
张 庆 (Qing ZHANG), Email: zq1699@126.com.
References
- 1.World Health Organization. Clinical management of severe acute respiratory infection when Novel coronavirus (2019-nCoV) infection is suspected: Interim guidance[ER/OL]2020. <a href="https://www.who.int/publications-detail/clinical-management-of-severe-acute-respiratory-infection-when-novel-coronavirus-(ncov)-infection-is-suspected" target="_blank">https://www.who.int/publications-detail/clinical-management-of-severe-acute-respiratory-infection-when-novel-coronavirus-(ncov)-infection-is-suspected</a>.
- 2.国家卫生健康委, 国家卫生健康委关于新型冠状病毒肺炎暂命名事宜的通知[S].国卫医函[2020]42号.
- 3.Calisher C, Carroll D, Colwell R, et al. Statement in support of the scientists, public health professionals, and medical professionals of China combatting COVID-19[J/OL].Lancet, 2020, 395(1226): e42-3.
- 4.Walsh TJ, AnaissieEJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the infectious diseases. Clin Infect Dis. 2008;46(3):327–60. doi: 10.1086/525258. [Walsh TJ, AnaissieEJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the infectious diseases[J]. Clin Infect Dis, 2008, 46(3): 327-60.] [DOI] [PubMed] [Google Scholar]
- 5.赵 博欣, 刘 思佳, 李 国锋, et al. 炎症对伏立康唑代谢和外周血谷浓度的影响. http://d.old.wanfangdata.com.cn/Periodical/zgyyyx201822008. 中国医院药学杂志. 2018;38(22):2332–5, 2339. [赵博欣, 刘思佳, 李国锋, 等.炎症对伏立康唑代谢和外周血谷浓度的影响[J].中国医院药学杂志, 2018, 38(22): 2332-5, 2339.] [Google Scholar]
- 6.Dolton MJ, Ray JE, Chen SC, et al. Voriconazole pharmacokinetics and therapeutic drug monitoring: a multi-center study. Antimicrob Agents Chemother. 2012;56(9):4793–9. doi: 10.1128/AAC.00626-12. [Dolton MJ, Ray JE, Chen SC, et al. Voriconazole pharmacokinetics and therapeutic drug monitoring: a multi-center study[J]. Antimicrob Agents Chemother, 2012, 56(9): 4793-9.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Levine MT, Chandrasekar PH. Aderse effects of voriconazole: over a decade of use. Clin Transplant. 2016;30(11):1377–86. doi: 10.1111/ctr.12834. [Levine MT, Chandrasekar PH. Aderse effects of voriconazole: over a decade of use[J]. Clin Transplant, 2016, 30(11): 1377-86.] [DOI] [PubMed] [Google Scholar]
- 8.Patel JN, Hamadeh IS, Robinson M, et al. Evaluation of CYP2C19 genotype-guided voriconazole prophylaxis after allogeneic hematopoietic cell transplant. Clin Pharmacol Ther. 2020;107(3):571–9. doi: 10.1002/cpt.1642. [Patel JN, Hamadeh IS, Robinson M, et al. Evaluation of CYP2C19 genotype-guided voriconazole prophylaxis after allogeneic hematopoietic cell transplant[J]. Clin Pharmacol Ther, 2020, 107 (3): 571-9.] [DOI] [PubMed] [Google Scholar]
- 9.Zhu L, Bruggemann RJ, Uy J, et al. CYP2C19 genotype-dependent pharmacokinetic drug interaction between voriconazole and ritonavir-doosted atazanavir in healthy subjects. J Clin Pharmacol. 2017;57(2):235–46. doi: 10.1002/jcph.798. [Zhu L, Bruggemann RJ, Uy J, et al. CYP2C19 genotype-dependent pharmacokinetic drug interaction between voriconazole and ritonavir-doosted atazanavir in healthy subjects[J]. J Clin Pharmacol, 2017, 57(2): 235-46.] [DOI] [PubMed] [Google Scholar]
- 10.中华人民共和国卫生健康委员会.国卫办医函[2020]184号.新型冠状病毒肺炎诊疗方案(试行第七版)[ER/OL]. <a href="http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe4cef80dc7f5912eb1989.shtml" target="_blank">http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe4cef80dc7f5912eb1989.shtml</a>.
- 11.Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72314 cases from the Chinese center for disease control and prevention[J/OL]. JAMA, 2020, doi: <a href="http://dx.doi.org/10:1001/jama.2020.2648" target="_blank">10:1001/jama.2020.2648</a>.
- 12.Guan WJ, Ni ZY, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China[J/OL]. N Engl J Med, 2020, DOI: <a href="http://dx.doi.org/10.1056/NEJMoa2002032" target="_blank">10.1056/NEJMoa2002032</a>.
- 13.中华人民共和国卫生健康委员会.国卫办医函[2020]109号.新型冠状病毒肺炎实验室检测技术指南(第四版)[ER/OL].<a href="http://www.nhc.gov.cn/jkj/s3577/202002/573340613ab243b3a7f61df260551dd4.shtml" target="_blank">http://www.nhc.gov.cn/jkj/s3577/202002/573340613ab243b3a7f61df260551dd4.shtml</a>.
- 14.薛 雄燕, 朱 嫦琳, 黄 少珍, et al. 灭活血液样本对不同方法检测2019新型冠状病毒抗体检测结果的影响. http://www.j-smu.com/oa/pdfdow.aspx?Sid=202003316. 南方医科大学学报. 2020;40(3):316–20. doi: 10.12122/j.issn.1673-4254.2020.03.03. [薛雄燕, 朱嫦琳, 黄少珍, 等.灭活血液样本对不同方法检测2019新型冠状病毒抗体检测结果的影响[J].南方医科大学学报, 2020, 40 (3): 316-20.] [DOI] [PMC free article] [PubMed] [Google Scholar]


