Données générales
Spécificités infectieuses pédiatriques
A. Bourrillon, R. Cohen, E. Bingen
Épidémiologie et âge
L'épidémiologie bactérienne en pédiatrie est largement conditionnée par l'âge, les antécédents de l'enfant, notamment le statut vaccinal et la prise récente d'antibiotiques.
Nouveau-né
Infections bactériennes néonatales précoces (72 premières heures de vie)
Elles sont presque exclusivement d'origine materno-fœtale. Les deux germes les plus fréquents sont :
-
•
Streptococcus agalactiae ou streptocoque du groupe B (SGB), actuellement le premier germe des infections néonatales des enfants nés à terme ;
-
•
Escherichia coli, premier germe chez le prématuré.
L'antibioprophylaxie per-partum diminue les infections néonatales précoces à SGB mais n'a pas réduit les infections néonatales tardives.
Les autres streptocoques, bactéries à Gram négatif, anaérobies sont plus rares. Les infections à Listeria monocytogenes sont devenues exceptionnelles.
Infections bactériennes néonatales tardives (jusqu'à la fin du 1er mois)
Elles sont encore liées au streptocoque B et à E. coli.
Entre les âges de 1 et 3 mois
La survenue d'infections tardives aux germes habituels des infections néonatales est encore possible (ex. streptocoque B ou E. coli K1) ; les bactéries retrouvées chez les nourrissons âgés de plus de 3 mois peuvent être aussi impliquées.
Enfants âgés de plus de 3 mois
Au cours des infections systémiques (ou invasives) chez les enfants vaccinés par le vaccin pneumococcique conjugué Prevenar, le pneumocoque demeure prédominant (sérotype de remplacement), suivi de E. coli (point de départ urinaire), puis selon une fréquence variable, des salmonelles (point de départ digestif), de S. aureus, et plus rarement de N. meningitidis et du streptocoque du groupe A de fréquence récemment accrue.
Haemophilus influenzae et S. pneumoniae (pneumocoque) sont les principales bactéries responsables des otites moyennes aiguës (OMA) du nourrisson.
S. pneumoniae est en outre la première bactérie responsable des méningites avant l'âge d'un an et des pneumonies aiguës bactériennes.
La résistance à la pénicilline du pneumocoque (résistance liée à une diminution d'affinité des PLP [protéines liant les pénicillines]) est, en 2007, de 40 à 50 % pour les souches de portage isolées au cours des pathologies non invasives (OMA) et d'environ 30 % pour les pathologies invasives (méningites et pneumonies).
Chez les jeunes enfants, le portage du pneumocoque est plus fréquent et plus prolongé au niveau du rhinopharynx, ses taux élevés de résistance sont liés à la conjonction d'une consommation demeurant élevée d'antibiotiques au cours de cette tranche d'âge, et de la fréquentation des crèches ou autres collectivités.
-
•
Les infections invasives à Haemophilus influenzae de sérotype b (Hib) (méningites, épiglottites, pneumopathies infectieuses, etc.), responsables d'infections très sévères, sont devenues exceptionnelles, en France, depuis la généralisation de la vaccination spécifique contre cette bactérie.
-
•
Le méningocoque ne bénéficiant pas actuellement (pour le sérogroupe B) d'une prévention vaccinale reste responsable de la majorité des méningites bactériennes de l'enfant à partir de l'âge d'un an. La sévérité des infections à ce germe reste actuelle (ex. purpura fulminans).
Trois bactéries sont d'actualité par la sévérité des infections invasives qu'elles induisent aujourd'hui chez l'enfant :
-
•
le pneumocoque qui malgré l'augmentation de la couverture vaccinale, en France, par le Prevenar qui contient les sérotypes des infections invasives les plus fréquentes et les plus résistantes aux antibiotiques (4, 6B, 9 V, 14, 19 F et 23 F), reste encore responsable de pathologies infectieuses sévères (méningites, pneumonies, pleuropneumopathies) liées à des pneumocoques dont les sérotypes ne sont pas inclus dans le vaccin. L'augmentation de la couverture vaccinale associée à une réduction de la consommation des antibiotiques a permis d'obtenir une diminution significative de la résistance aux antibiotiques du pneumocoque. Des vaccins élargissant le nombre de sérotypes vaccinaux (1, 3, 5, 6A, 7 F, 19A) {Prevenar 13) sont actuellement disponibles, recommandés et remboursés en France, depuis le 15 juin 2010 ;
-
•
le streptocoque du groupe A est responsable de la quasi-totalité des angines bactériennes et d'un nombre important d'autres pathologies, sévères (fasciites nécrosantes, choc toxique streptococcique, septicémies, etc.) ou moins sévères (impétigo, érysipèle, anite, etc.). On observe depuis quelques années une diminution de la résistance du streptocoque A aux macrolides de 20 % en 2007 à 7 % en 2011. La biologie moléculaire a permis de mieux comprendre la physiopathologie des infections sévères qui sont en augmentation dans différents pays dont la France : protéine M intervenant parmi les facteurs de virulence antiphagocytaires ; exotoxines sécrétées par le SGA intégrées parmi les « superantigènes » les plus puissants connus et contribuant à l'invasion tissulaire et à « l'orage cytokines » responsable des nécroses cutanées et du syndrome du choc toxique. La sévérité de tels tableaux justifie la stratégie antibiotique actuelle conduisant dès la suspicion du diagnostic d'infection sévère à un streptocoque A à la prescription de l'association antibiotiques : bêtalactamines et clindamycine ;
-
•
Staphylococcus aureus communautaire est de plus en plus souvent méthicilline-résistant (de l'ordre de 10 %), susceptible de secréter une toxine particulièrement redoutable (PantonValentine) et d'être responsable notamment de pneumonies nécrosantes sévères.
Difficultés diagnostiques
Les enfants ont beaucoup plus fréquemment que les adultes des infections virales et bactériennes qu'il est difficile de départager de façon probabiliste sur les données cliniques. Les difficultés d'un diagnostic microbiologique d'une part facilement accessible, d'autre part suffisamment rapide pour influencer la décision de prescrire ou de ne pas prescrire un antibiotique, conduisent très souvent à une approche étiologique probabiliste, elle-même souvent mise en défaut.
Les scores prédictifs cliniques sont une approche intéressante. Cependant, leurs performances diagnostiques sont souvent insuffisantes. Il en est ainsi pour l'approche étiologique infectieuse clinique par exemple d'une angine (score de Mac Isaac), d'une otite moyenne aiguë ou d'une pneumonie.
Le clinicien est donc conduit, dans différentes circonstances, à demander des examens complémentaires dont les performances doivent être évaluées avec les mêmes paramètres (sensibilité, spécificité, valeurs prédictives positives et négatives, rapport de vraisemblance positif et négatif).
Au terme de l'examen clinique et d'éventuels examens complémentaires, le diagnostic étiologique de nombreuses infections bactériennes pédiatriques peut ne pas être assuré, conduisant parfois à un traitement antibiotique probabiliste selon l'âge de l'enfant, le site de l'infection, l'épidémiologie présumée et la sévérité des tableaux cliniques observés.
Le mode d'administration des antibiotiques sera en outre adapté à l'âge de l'enfant (mode d'administration buccale privilégié dans les infections habituelles) et à la sévérité de l'infection (antibiothérapie parentérale en monothérapie ou en association). Les modalités de prescription pour chaque situation infectieuse sont précisées dans les diverses recommandations de l'Afssaps ou les conclusions des conférences de consensus.
BIBLIOGRAPHIE
- Chalumeau M., Leroy S., Gendrel D. Calcitonine semi-quantitative aux urgences pédiatriques. Arch Pédiatr. 2007;14:527. doi: 10.1016/j.arcped.2007.02.015. 31. [DOI] [PubMed] [Google Scholar]
- Cohen R., Aujard Y., Bidet P. Streptocoques du groupe A : un pathogène majeur pour la prochaine décennie. Arch Pédiatr. 2005;12:1065. doi: 10.1016/j.arcped.2005.01.021. 7. [DOI] [PubMed] [Google Scholar]
- Cohen R., Wollner A. Utilisation des tests de diagnostic rapide du streptocoque A dans les infections inhabituelles. Arch Pédiatr. 2007;14(6):527. doi: 10.1016/j.arcped.2007.02.065. 8. [DOI] [PubMed] [Google Scholar]
- De Laroque F., Thollet F., Touitou R., Cohen R. Test de diagnostic rapide de la grippe. Quel intérêt aux urgences et en pédiatrie de ville ? Arch Pédiatr. 2007;14:532. doi: 10.1016/j.arcped.2007.02.037. 4. [DOI] [PubMed] [Google Scholar]
- Martineau A., Aurel M., Dubos F. Évaluation des performances des tests de diagnostic rapide. Arch Pédiatr. 2007;14:524. doi: 10.1016/j.arcped.2007.02.014. 6. [DOI] [PubMed] [Google Scholar]
- Pathologies . Flammarion Médecin Sciences; Paris: 2006. Pathologies sévères à Streptocoque A ; actualités, table ronde; pp. 190–219. (Journées Parisiennes de Pédiatrie). [Google Scholar]
Examens complémentaires en pathologie infectieuse pédiatrique
R. Cohen
La majorité des examens prescrits en pathologie infectieuse pédiatrique est assurée par des laboratoires de biologie. D'autres sont réalisables par le praticien lui-même « au lit du malade » et leurs résultats sont obtenus en quelques minutes : il s'agit de tests de diagnostic rapide (TDR). Certains TDR sont actuels (streptocoque du groupe A, bandelettes urinaires, CRP en microméthode, TDR grippe), d'autres sont programmés dans l'avenir. Ces TDR sont attractifs pour de multiples raisons car :
-
•
ils sont susceptibles d'améliorer les performances du diagnostic clinique ;
-
•
ils peuvent être déterminants dans la décision de prescrire ou non des antibiotiques, de demander ou non d'autres examens complémentaires ;
-
•
ils permettent la prescription de traitements précoces et adaptés ;
-
•
ils gagnent du temps d'attente et de séjour aux urgences ou dans les cabinets médicaux. Ce temps gagné sert non seulement à améliorer le confort des patients mais aussi réduit le risque de contracter une infection nosocomiale ;
-
•
ils peuvent induire enfin des économies de santé.
Quel que soit leur type, biologie classique ou TDR, la demande d'examens complémentaires ne doit se concevoir que dans le cadre d'une stratégie diagnostique dont la base reste une analyse clinique pertinente.
En effet, l'anamnèse et l'examen clinique doivent conduire à évoquer des diagnostics cliniques et à tenter d'établir une probabilité prétest. Les examens demandés permettent parfois un diagnostic de certitude, souvent ne permettent que d'augmenter ou de diminuer la probabilité diagnostique déjà évoquée par la clinique.
Évaluation des méthodes diagnostiques
Pour évaluer la performance d'un test diagnostique, il est nécessaire de le comparer à la méthode de référence afin de déterminer ses performances : sensibilité, spécificité, valeurs prédictives positive et négative.
Un test est rarement performant à 100 % car des faux positifs ou négatifs peuvent être observés. Pour calculer et interpréter ces indices, la connaissance de leurs définitions est nécessaire. Les valeurs sont présentées dans un tableau de contingence (tableau 18.1 ).
Tableau 18.1.
Tableau de contingence des tests diagnostiques.
| Résultat du « test » | Résultat de la méthode de référence |
|
|---|---|---|
| Maladie présente | Maladie absente | |
| Positif (a + b) | Vrai positif (a) | Faux positif (b) |
| Négatif (c + d) | Faux négatif (c) | Vrai négatif (d) |
Le tableau 18.2 donne les définitions des indices d'évaluation des méthodes diagnostiques (sensibilité, spécificité, valeurs prédictives, etc.).
Tableau 18.2.
Indices d'évaluation des méthodes diagnostiques.
| Caractéristiques du test | Synonymes | Formules | Remarques |
|---|---|---|---|
| Sensibilité (Se) | Capacité à correctement identifier les malades | a/(a + c] | Dépend en grande partie du « test » mais aussi de l'opérateur (conditions de prélèvements, etc.], et du patient (date de début des symptômes, âge, etc.) |
| Spécificité (Sp) | Capacité à correctement identifier les non-malades | d/(b + d] | |
| Valeur prédictive positive (VPP) | Proportion des tests positifs qui correspondent à des malades ou Probabilité post-test + |
a/(a + b] | Dépend aussi de la probabilité prétest (P) (ou prévalence de la maladie dans la population étudiée) Elle peut se calculer en fonction des sensibilité, spécificité, et prévalence P : VPP = Se × P/[Se × P + (1-Sp) × (1-P)] Elle peut être estimée en pratique clinique en calculant la probabilité post-test + (PPT +) : PPT + = P × LR + |
| Valeur prédictive négative (VPN) | Proportion des tests négatifs qui correspondent à des non-malades | d/(c + d] | Elle dépend aussi de la probabilité prétest (P) Elle peut se calculer en fonction des sensibilité, spécificité, et prévalence P : VPN = Sp × (1 P)/[Sp × (1 P) + 1 Se) × P] Elle peut être estimée en pratique clinique en calculant la probabilité post-test (PPT-) : PPT = P × LRVPN = 1 [PPT-] |
| Exactitude (Accuracy) | Proportion de résultats exacts | (a + d]/ (a + b + c + d] | Deux tests ayant exactement la même « exactitude » peuvent avoir des intérêts différents en fonction de la pathologie |
| Positive Likelihood Ratio (LR +) ou rapport de vraisemblance positif d'un test | Rapport de la probabilité d'avoir un test « vrai positif » sur la probabilité d'avoir un test « faux positif » | Se/(1 – Sp] | Dépend en grande partie du « test » considéré mais aussi de l'opérateur (conditions de prélèvements, etc.) et du patient (date de début des symptômes, âge, etc.) Il exprime combien de fois un résultat positif du test est plus probable chez un malade que chez un non-malade (ratio > 1) |
| Negative Likelihood Ratio (LR-) ou rapport de vraisemblance négatif d'un test | Rapport de la probabilité d'avoir un test « faux négatif » sur la probabilité d'avoir un test « vrai négatif » | (1 – Se]/Sp | Dépend en grande partie du « test » considéré mais aussi de l'opérateur (conditions de prélèvements, etc.) et du patient (date de début des symptômes, âge, etc.) Il exprime combien de fois un résultat négatif du test est moins probable chez un malade que chez un non-malade (ratio < 1) |
| Diagnostic Odds Ratio (DOR) | Indicateur de la performance diagnostique d'un « test » | LR+/LR- | Dépend en grande partie de la qualité du test mais aussi des conditions de prélèvements (opérateur) et du patient (date de début des symptômes, âge, etc.) |
D'après Greenhalgh.
En pratique clinique, ce sont les valeurs prédictives qui sont essentielles au clinicien pour porter un diagnostic probabiliste. Les VPP et VPN indiquent au clinicien la probabilité avec laquelle il peut affirmer ou infirmer la maladie qu'il recherche. Elles dépendent de la sensibilité, de la spécificité des « tests », mais aussi et surtout de la prévalence de la maladie dans la population étudiée.
Sensibilité, spécificité, et valeurs prédictives sont liées :
-
•
plus le test est sensible, meilleure est la valeur prédictive négative : le clinicien est d'autant plus assuré, avec un « test » négatif, que le sujet n'a pas par exemple d'infection à streptocoque du groupe A ;
-
•
plus le test est spécifique, meilleure est la valeur prédictive positive : le clinicien est d'autant plus assuré, avec un « test » positif, que le patient a la maladie, par exemple la grippe ;
-
•
l'augmentation de la sensibilité ou de la spécificité majore les valeurs prédictives positives et négatives.
Pour l'estimation des valeurs prédictives, la probabilité prétest est un facteur bien plus important que la sensibilité ou la spécificité. En effet, la sensibilité et la spécificité varient rarement de plus de deux fois, alors que la prévalence peut varier sur une échelle beaucoup plus grande.
Une mesure intéressante pour exprimer l'utilité d'un « test » est le rapport de vraisemblance positif (de l'anglais Positive Likelihood Ratio, LR +). Il s'agit du facteur par lequel il faut multiplier la probabilité prétest pour obtenir la probabilité post-test d'être porteur de l'agent infectieux pour les patients dont le test est positif. Il est spécifique au « test » diagnostique. Il ne change pas significativement d'un contexte clinique à l'autre.
De la même manière, il est possible de calculer un rapport de vraisemblance négatif (de l'anglais Negative Likelihood Ratio, LR–) à appliquer pour obtenir la probabilité post-test d'être atteint par un agent infectieux lorsque le résultat de l'examen est négatif.
Tests de recours fréquent
Examens non spécifiques
Bandelette urinaire
Les bandelettes urinaires comportant la recherche de leucocytes et de nitrites sont un examen de dépistage des infections urinaires qui doit très facilement être réalisé devant toute fièvre isolée chez l'enfant, en particulier le nourrisson âgé de plus de 3 mois. Elles ont une valeur prédictive négative de 97 % si l'on considère à la fois la négativité des leucocytes et des nitrites. La négativité (leucocytes et nitrites) paraît suffisante pour rendre très improbable le diagnostic d'infection urinaire et éviter la pratique d'un examen cytobactériologique des urines.
Hémogramme
Les données hématologiques apportées par l'hémogramme sont peu contributives pour l'orientation diagnostique d'une infection bactérienne en période néonatale.
Protéine C réactive (CRP)
Elle fait partie des nombreuses protéines dont le taux s'élève lors de la phase aiguë de l'inflammation. Les valeurs normales sont très basses (99e percentile : 10 mg/L) et l'augmentation est en moyenne sensiblement plus importante au cours des infections bactériennes qu'au cours des infections virales. La CRP a deux écueils importants qu'il faut connaître pour avoir une évaluation optimale de ses résultats :
-
•
de nombreuses pathologies ne correspondant pas à des infections bactériennes sont susceptibles d'augmenter la CRP (mauvaise spécificité) : l'augmentation de la CRP ne permet ainsi jamais ou presque d'affirmer le diagnostic d'infection bactérienne ;
-
•
la CRP a une élévation de son taux qui est retardée après le début de l'infection (12 à 24 heures) et apporte aussi des résultats peu sensibles au cours des 24 premières heures.
Enfin, certaines bactéries telles que les mycobactéries ou Kingella kingae, les staphylocoques et les infections « superficielles » n'entraînent que rarement une élévation de la CRP.
La probabilité d'infection virale ou bactérienne varie considérablement en fonction des seuils retenus. Il doit toujours être interprété en fonction du tableau clinique (durée d'évolution de la fièvre, diagnostic clinique, bactérie suspectée). Cet examen a aussi un intérêt évolutif pour l'évaluation de l'efficacité d'un traitement antibiotique. En effet la demi-vie de la CRP est constante, de l'ordre de 19 heures, et un traitement antibactérien efficace conduit à une chute de la CRP de moitié toutes les 24 heures.
Le regain d'intérêt actuel de la CRP est lié à la mise au point de techniques de diagnostic rapide utilisant une goutte de sang et dont les résultats sont obtenus en moins de 5 minutes permettant de raccourcir la prise en charge des patients tant aux urgences hospitalières qu'en cabinet libéral.
Dosage de la procalcitonine (PCT)
C'est un examen moins répandu que la CRP car son dosage est plus difficile, plus long et plus coûteux que celle-ci. Lorsque la PCT est élevée, elle est plus sensible pour le diagnostic d'infection bactérienne à son stade précoce (4 heures après le début de l'infection), et plus spécifique que les autres marqueurs biologiques utilisés en routine (NFS, CRP). Son taux n'augmente que peu au cours des infections virales.
Depuis peu, le résultat de ce dosage constitue de plus un marqueur possiblement prédictif du reflux vésico-urétéral de haut grade lors des infections urinaires.
Très peu de services d'urgences pédiatriques ont cependant actuellement en France la possibilité de réaliser le dosage quantitatif de ce marqueur en temps réel 24 heures/24.
Examens spécifiques
Pour affirmer le diagnostic bactériologique précis d'une infection, trois examens bactériologiques classiques peuvent apporter un diagnostic de certitude et guider l'antibiothérapie.
Hémocultures
Quand elles sont positives avec un germe pathogène, elles permettent d'affirmer le diagnostic de bactériémies ou de septicémie. Elles constituent un examen spécifique mais peu sensible qu'il ne faut pas hésiter à répéter avant le début de l'antibiothérapie. En effet, en cas de septicémies, la sensibilité d'une hémoculture est de l'ordre de 50 %, de deux hémocultures de 80 %, de trois hémocultures de plus de 90 %.
En dehors des bactériémies et septicémies, leur positivité peut être variable selon les infections en cause :
-
•
pyélonéphrites aiguës 30 % en période néonatale, 20 % entre 1 et 2 mois, 15 % entre 2 et 3 mois et seulement 5 % au-delà de l'âge de 3 mois ;
-
•
pneumonies aiguës : 3 à 10 % ;
-
•
méningites purulentes (70 %).
Examen bactériologique du liquide céphalorachidien
-
•
Examen direct positif dans 90 % des cas si S. pneumoniae (> 105 du germe dans le LCR) ; dans 75 % des cas si N. meningitidis (taux habituel 103-105 dans le LCR).
-
•
Cultures presque toujours positives en dehors d'une antibiothérapie préalable.
Examen cytobactériologique des urines
C'est l'examen bactériologique le plus souvent demandé en pédiatrie pratique. Il impose des techniques de prélèvement rigoureuses (privilégier le prélèvement permictionnel), des conditions de conservation et de réalisation précises ainsi qu'une interprétation critique des résultats. L'absence de leucocyturie et de bactériurie à l'examen direct des urines (qui peut être obtenu en moins d'une heure) a une excellente valeur prédictive négative, proche de 100 %, et permet d'exclure le diagnostic d'infection urinaire. L'examen direct doit être fait systématiquement et réalisé en moins d'une heure. La culture est cependant toujours nécessaire et permet de préciser l'espèce bactérienne, de quantifier la bactériurie et d'effectuer un antibiogramme. Le seuil classique de 105 UFC/mL (unités formant colonie) expose à des erreurs par excès et plus rarement par défaut :
-
•
ce taux peut être surévalué notamment en cas de temps trop prolongé de recueil des urines ;
-
•il peut ne pas être obtenu en cas d'authentique infection urinaire en cas de :
-
–prise récente d'antibiotiques,
-
–dilution excessive des urines par hyperhydratation,
-
–temps de stase insuffisant des urines dans la vessie (classiquement 4 heures pour le seuil de 105 UFC/mL).
-
–
TDR du streptocoque A
Le test de diagnostic rapide du streptocoque A a une spécificité supérieure à 95 % et une sensibilité de l'ordre de 90 %.
Il est essentiellement réalisé pour porter le diagnostic d'angine aiguë (aucun autre examen complémentaire n'est alors nécessaire) et peut conduire selon ces résultats à une antibiothérapie spécifique (test positif) ou à l'abstention thérapeutique (test négatif).
Essentiellement réalisé pour le diagnostic d'angine aiguë, il peut être aussi appliqué dans l'écoulement d'une otite moyenne aiguë, pour confirmer l'origine streptococcique d'une infection périnéovulvaire (anite ; vulvovaginite) ou celui d'un panaris périunguéal.
Le test de diagnostic rapide de la grippe
Il a une spécificité supérieure à 90 % et une sensibilité moindre de l'ordre de 40 à 80 % en fonction de la souche (il est cependant plus performant chez les jeunes enfants au-dessous de l'âge de 6 mois et dès la phase précoce du diagnostic moins de 4 jours après le début de la maladie).
La positivité de son résultat peut dispenser d'autres examens complémentaires et conduit parfois à un traitement spécifique antiviral.
Le test de diagnostic étiologique par immunofluorescence VRS
Au cours des bronchiolites aiguës, il a un intérêt essentiellement épidémiologique.
Signes, symptômes et syndromes
Ils ne sont pas specifiques d'une seule origine infectieuse mais peuvent temoigner d'une origine infl ammatoire associee ou exclusive.
Fièvre
Fièvre aiguë du nourrisson
A. Bourrillon
La fièvre, définie comme une température supérieure ou égale à 38 °C, est l'un des motifs de consultation les plus fréquents en pédiatrie.
La fièvre est un symptôme dont il importe de préciser l'origine, la tolérance et d'assurer la prise en charge.
Ce symptôme est le plus souvent relié chez l'enfant à une maladie infectieuse bénigne et son traitement est celui de l'inconfort (diminution de la vigilance, de l'appétit, des capacités relationnelles et aux jeux).
L'âge (< 2 ans = nourrisson) est un facteur essentiel à considérer vis-à-vis de la prise en charge des fièvres isolées.
La conduite à tenir devant une fièvre aiguë du nourrisson doit être explicitée par les données physiopathologiques qui concernent:
-
•
la régulation thermique ;
-
•
l'hyperthermie, et la fièvre elle-même.
Mécanismes de l'élévation thermique : hyperthermie et fièvre (fig. 18.1 et fig. 18.2)
Fig 18.1.

Mécanismes de l'homéothermie.
Fig 18.2.

Mécanismes de l'élévation thermique.
-
•
L’homéothermie résulte d'un équilibre entre thermogenèse et thermolyse régulé par un centre thermorégulateur (fig. 18.1).
-
•
La thermogenèse provient d'une part de réactions métaboliques intenses au niveau de la graisse brune et des muscles, d'autre part de l'activité musculaire.
-
•La thermolyse s'effectue au niveau du revêtement cutané et des voies respiratoires selon quatre mécanismes :
-
–conduction (diminuée par un mauvais état hémodynamique),
-
–convection (réduite par une température extérieure élevée),
-
–radiation (entravée par les vêtements),
-
–et surtout évaporation cutanée et pulmonaire (pertes insensibles quotidiennes : 400 mL/m2 de surface corporelle, majorée de 80 mL/m2 par degré au-dessus de 37 °C).
-
–
-
•
Le centre thermorégulateur est situé au niveau de l'hypothalamus antérieur et se comporte comme un thermostat réglé aux environs de 37 °C. Les récepteurs centraux et périphériques envoient des informations thermiques à l'hypothalamus qui émet alors des influx nerveux déclenchant les réactions d'adaptation de l'organisme dans le but de maintenir la température au point d'équilibre de 37 °C.
-
•
L'hyperthermie est provoquée par une augmentation de la thermogenèse (exercices musculaires intenses) et/ou une diminution de la thermolyse (température extérieure élevée) et/ou une diminution de la sudation et/ou une insuffisance des apports hydriques : le point d'équilibre thermique n'est alors pas modifié.
-
•
Au cours de la fièvre, le point d'équilibre est déplacé vers le haut, de sorte que l'hypothalamus antérieur va émettre des influx nerveux visant à augmenter la température centrale autour de ce nouveau point d'équilibre. Il en résulte une vasoconstriction (diminuant la thermolyse) et des frissons (augmentant la thermogenèse).
Traiter ou ne pas traiter ?
Certaines études expérimentales et cliniques suggèrent que la fièvre pourrait avoir un rôle bénéfique dans la lutte contre les infections. Des études récentes ont tenté d'en formuler des hypothèses. Leurs résultats appliqués aux seuls modèles animaux doivent cependant être évalués avec réserves.
Il convient davantage d'évaluer les motivations actuelles du traitement symptomatique d'une fièvre aiguë du nourrisson.
Elles étaient jusqu'alors justifiées par plusieurs objectifs visant à prévenir :
-
•
les convulsions fébriles mais celles-ci sont le plus souvent inaugurales ;
-
•
l'hyperthermie majeure devenue exceptionnelle depuis que les enfants fébriles ne sont plus surcouverts ;
-
•
la déshydratation aiguë évitée par les mesures de réhydratation préventive actuellement bien connues des parents.
L'objectif premier actuel est d'assurer le confort de l'enfant. Un enfant qui a de la fièvre doit demeurer « actif ».
Analyse des mécanismes d'action des moyens antihyperthermiques
Les moyens physiques augmentent les pertes de chaleur par thermolyse et compensent les pertes d'eau par évaporation.
Les produits médicamenteux habituellement utilisés, paracétamol, voire anti-inflammatoires non stéroïdiens, visent à modifier la réponse de l'hypothalamus aux pyrogènes, ce qui conduit à une réduction de l'élévation du point d'équilibre thermique et à une intervention des mécanismes de thermolyse. Les AINS, de plus, ont une action d'inhibition de la synthèse des prostaglandines.
Il convient toujours :
-
•
de préciser l'efficacité des divers antihyperthermiques par des études concernant de façon conjointe la rapidité d'action, le degré et la durée de la réduction thermique ;
-
•
d'approfondir les études pharmacocinétiques concernant ces médicaments et d'évaluer la réalité de leur toxicité ;
-
•
d'évaluer la compliance familiale à une prescription bien conduite (fréquence des « autoprescriptions » à posologies inadaptées).
Examen d'un nourrisson fébrile
L'examen clinique, systématique et complet, est indispensable et suffit le plus souvent pour chiffrer la fièvre, apprécier sa tolérance, évaluer ses éventuelles complications et identifier sa cause.
Identifier la fièvre
-
•
Elle est suspectée par la palpation du front d'un enfant qui apparaît anormalement chaud.
-
•
Elle doit être chiffrée.
Méthodes de mesures de la température corporelle
La méthode de référence pour la prise de température d'un enfant est le thermomètre électronique par voie rectale.
Les voies buccales et axillaires, bien que plus simples d'utilisation chez l'enfant, nécessitent des temps de mesure plus longs et ont l'inconvénient d'une sous-estimation fréquente.
Le thermomètre au gallium a une fiabilité équivalente à celle du thermomètre électronique mais reste de recours limité.
Le thermomètre à infrarouges, généralement utilisé par voie auriculaire, est moins précis notamment chez le nourrisson (mais la rapidité du temps de mesure en fait pour certains un instrument de dépistage possible).
Résultats
La fièvre est dite :
-
•
modérée entre 38 et 38,5 °C ;
-
•
élevée au-dessus de 38,5 °C. Son traitement éventuel ne serait justifié qu'au-delà de ce niveau thermique ;
-
•
susceptible d'être reliée à une hyperthermie si supérieure à 40,5 °C.
Attention : chez le nourrisson, il faut reprendre la température de l'enfant un quart d'heure après l'avoir découvert.
Le niveau de la température ne témoigne pas à lui seul de la gravité de la cause de la fièvre ou de la mauvaise tolérance de celle-ci (tableau 18.3 ).
Fig 18.3.

-
1.Troubles de la conscience.
-
2.Faciès pâle, enfant geignard, perte de l'appétit.
-
3.Tachycardie.
-
4.Pouls périphériques mal perçus.
-
5.Diurèse réduite.
-
6.Temps de recoloration cutanée allongé > 3 secondes.
-
7.Extrémités froides et marbrées.
Tableau 18.3.
Éléments d'appréciation de la tolérance d'une fièvre aiguë du nourrisson.
| Tolérance | Bonne | Mauvaise |
|---|---|---|
| Faciès | Vultueux | Pâle, cyanose péribuccale |
| Conscience | Normale | Somnolence |
| Cris | Vigoureux | Plaintifs, geignards |
| Téguments | Érythrosiques chauds | Marbrures, extrémités froides |
| Temps de recoloration | Immédiat | Allongé ≥ 3 secondes |
Situations d'urgence
Situations d'urgence liées à la fièvre
Convulsions fébriles (voir le chapitre 22, Convulsions-Épilepsies, page 640)
Elles sont évaluées à 5 % au-dessous de l'âge de 5 ans. Elles surviennent le plus souvent lors d'une ascension thermique brutale.
Elles sont :
-
•
cloniques ou tonicocloniques ;
-
•
bilatérales ;
-
•
isolées ;
-
•
le plus souvent brèves.
Les facteurs de gravité sont :
-
•
le caractère unilatéral ;
-
•
la durée > 15 ou 30 minutes ;
-
•
le déficit post-critique.
Syndrome d'hyperthermie majeure
Ce syndrome devenu exceptionnel est aussi appelé « choc hémorragique ou hyperthermique » avec encéphalopathie :
-
•
il concerne surtout les nourrissons ;
-
•
la température est toujours supérieure à 40,5 °C ;
-
•
il associe un collapsus et une atteinte pluriviscérale (notamment cérébrale) ;
-
•
son évolution est sévère, conduisant au décès ou à de lourdes séquelles neurologiques.
L'enquête étiologique est le plus souvent négative.
La physiopathologie de ce syndrome fait intervenir la conjonction de deux mécanismes :
-
•
la fièvre liée à une maladie intercurrente (virale) ;
-
•
et l'hyperthermie liée à une entrave à la thermolyse (enfant « surcouvert »).
La disparition de ce syndrome est sans doute liée au traitement adapté par les moyens physiques actuellement utilisés (enfants fébriles non surcouverts +++).
Déshydratation aiguë
Elle concerne surtout les jeunes nourrissons ayant une fièvre élevée et prolongée, dont la thermolyse est entravée (température extérieure élevée, excès de vêtements) et auxquels, malgré la soif, des suppléments hydriques n'ont pas été proposés.
Déshydratation par perte d'eau
Elle est à prédominance intracellulaire (langue sèche, soif) et est actuellement prévenue par des mesures de réhydratation correctes habituellement spontanément assurées par les parents.
Situations d'urgence liées à la cause de la fièvre
Elles concernent avant tout :
-
•
les purpuras fébriles +++ (si infection à méningocoque) ;
-
•
les méningites ou méningo-encéphalites ;
-
•
les troubles hémodynamiques (sepsis) ;
-
•
les pneumopathies infectieuses ou pleuropneumopathies ;
-
•
les gastro-entérites avec diarrhée invasive ;
-
•
les ostéoarthrites ;
-
•
les cellulodermites.
Situations d'urgence liées au terrain
Elles concernent :
-
•
les enfants âgés de moins de 3 mois (dont nouveau-né) (cf. ci-dessous) ;
-
•
les drépanocytoses ;
-
•
les pathologies viscérales chroniques ;
-
•
les déficits immunitaires.
En pratique cependant, la fièvre est le plus souvent isolée, bien tolérée et reliée à une cause bénigne (fièvre infectieuse d'origine virale).
Causes des fièvres aiguës du nourrisson (fig. 18.4)
Fig 18.4.

Étiologies des fièvres du nourrisson.
Fièvres bien tolérées
Elles concernent des maladies infectieuses de type viral et requièrent un traitement symptomatique.
Fièvres mal tolérées
Elles font redouter une méningite purulente ; une infection bactérienne (urinaire ou digestive) avec ou sans choc septique ; une fièvre éruptive sévère (méningococcie grave ; purpura fulminans).
Une évaluation hospitalière s'impose. Les examens complémentaires indispensables sont alors :
-
•
NFS, plaquettes ;
-
•
hémoculture ;
-
•
CRP et selon le contexte et les possibilités : procalcitonine ;
-
•
bandelette urinaire (âge > 3 mois) et selon résultats : ECBU ;
-
•
selon l'analyse clinique d'une symptomatologie respiratoire associée : radiographie du thorax. (cf. Diagnostic d'une pneumonie de l'enfant et Imagerie thoracique chapitre 31, page 885).
L'urgence et le type d'un traitement étiologique spécifique sont évalués selon chaque contexte.
Traitements de la fièvre aiguë
Il est justifié au-delà d'une température égale à 38,5 °C. Il vise en premier lieu à assurer le confort de l'enfant.
Ce traitement symptomatique utilise des moyens physiques et médicamenteux (encadré 18.1 ).
Encadré 18.1.
Recommandations de l'Afssaps (2004)
La fievre de l'enfant ne represente pas, par elle-meme, un danger. Apres recherche de l'etiologie, la prise en charge d'une fievre persistante, superieure a 38,5 °C, dans un contexte aigu, est une demarche a visee symptomatique qui repose sur les principes suivants.
Conseiller à l'entourage :
-
–
d'eviter de trop couvrir l'enfant,
-
–
d'aerer la piece,
-
–
de faire boire l'enfant le plus souvent possible.
Ces mesures simples contribuent a limiter l'ascension de la temperature, a augmenter l'efficacite du traitement medicamenteux et a maintenir une hydratation correcte de l'enfant (ce qui est tres important dans certains contextes infectieux courants tels que les gastro-enterites). Les autres methodes physiques (bain frais, enveloppements humides, poches de glace, etc.) vont a l'encontre de l'objectif principal du traitement, qui est la lutte contre l'inconfort, et sont a reserver a des situations exceptionnelles.
Ne prescrire qu'un seul médicament antipyrétique, aucune etude n'ayant demontre l'interet d'une alternance ou d'une association systematique ; seule, une fievre persistant 24 heures, malgre un traitement bien conduit, justifie l'adjonction d'un second medicament. De plus, il est deconseille de prescrire un AINS ou de l'aspirine en meme temps qu'un autre medicament de la meme famille (anti-infl ammatoires).
Choisir le médicament de première intention en fonction des contre-indications (cf. tableau), mises en garde et precautions d'emploi et en les respectant strictement :
-
–
verifier que l'enfant n'a pas deja absorbe un antipyretique de meme nature sous une forme ou sous une autre ;
-
–prescrire le medicament antipyretique en continu et a doses efficaces, sans chercher a l'adapter au niveau de la temperature. Soit, de maniere usuelle :
-
-pour le paracetamol : 15 mg/kg/prise toutes les 6 heures, sans depasser 80 mg/kg/j,
-
-pour l'ibuprofene : 7,5 mg/kg/prise toutes les 6 heures ou 10 mg/kg/prise toutes les 8 heures.
-
-
Lors de la prescription, il est indispensable de bien expliquer ces recommandations a l'entourage, y compris au personnel en garde de l'enfant.
Contre-indications et précautions d'emploi des antipyrétiques.
| Paracétamol | AINS | Aspirine | |
|---|---|---|---|
| Contre-indications | Hypersensibilité au paracétamol Insuffisance hépatocellulaire |
Hypersensibilité a l'AINS concerné Antécédent d'allergie ou d'asthme déclenche par la prise d'AINS ou de substance d'activité proche (aspirine) Insuffisance rénale sévère Ulcere gastroduodenal en evolution Insuffisance hépatique sévère Insuffisance cardiaque sévère non contrôlée Lupus érythémateux disséminé |
Hypersensibilité a l'aspirine Antécédent d'allergie ou d'asthme déclenché par la prise de salcylés ou de substance d'activité proche (AINS) Insuffisance rénale sévère Ulcére gastroduodénal en évolution Insuffisance hépatique sévère Insuffisance cardiaque sévère non contrôlée Toute maladie ou risque hémorragique constitutionnel ou acquis Méthotrexate |
| Précautions particulières | À éviter en cas de varicelle | À éviter en cas de viroses, en particulier, varicelle et épisodes d'allure grippale |
Moyens physiques : méthodes
Elles reproduisent les échanges que l'organisme met naturellement en jeu avec le milieu extérieur pour assurer sa régulation thermique. La thermolyse s'effectue ainsi :
-
•
par radiation (déshabillage) ;
-
•
par conduction (prise de boissons fraîches, etc.) ;
-
•
par évaporation ;
-
•
par convection.
Les facteurs limitant l'analyse de ces différentes méthodes physiques sont :
-
•
l'absence habituelle d'évaluation de leur efficacité par des études méthodologiques correctes ;
-
•
leur efficacité modeste ;
-
•
et transitoire (cédant à l'arrêt de la méthode de refroidissement);
-
•
l'inconfort qu'elles procurent parfois.
Ainsi, des mesures simples sont à privilégier :
-
•
suppléments de boissons hydriques fraîches (notamment la nuit) ;
-
•
retrait des vêtements en excès (ne pas surcouvrir +++);
-
•
aération de la pièce environnante.
La prescription des autres méthodes (bains tièdes, enveloppements humides) est actuellement abandonnée.
L'efficacité des bains tièdes cesse dès la sortie de l'enfant de l'eau et ne saurait dispenser d'un traitement médicamenteux. Dans tous les cas, les traitements médicamenteux antipyrétiques sont les seuls à avoir l'efficacité antipyrétique le plus rigoureusement évaluée dans le contexte du traitement symptomatique d'une fièvre d'un nourrisson.
Traitements médicamenteux
À la différence des méthodes physiques, les médicaments agissent principalement sur les mécanismes de régulation centrale de la fièvre.
Trois moLécuLes étaient utiLisées, en France, en première intention.
Paracétamol (Doliprane, Efferalgan)
Il n'a pas d'action sur la synthèse des prostaglandines et, de ce fait, ne partage pas les effets indésirables communs aux antiinflammatoires non stéroïdiens. après absorption, il est peu lié aux protéines plasmatiques et a ainsi un faible risque d'interactions médicamenteuses.
Sa toxicité hépatique est décrite à des doses supérieures à 120 mg/kg/j (doubLe des doses thérapeutiques), en dose unique. Les surdosages sont involontaires, liés à la multiplication des prises de paracétamol, ou à l'administration concomitante de plusieurs médicaments contenant ce produit (paracétamol « clandestin »).
C'est le médicament le plus utilisé actuellement pour le traitement de la fièvre de l'enfant.
Ibuprofène (Advil, Nureflex, Antarène) et kétoprofène
Ce sont les seuls AINS ayant une AMM pour le traitement de la fièvre de l'enfant.
Ils ont des effets antipyrétiques, antalgiques et anti-inflammatoires liés à l'inhibition de la synthèse des prostaglandines. L'ibuprofène est indiqué chez l'enfant de plus de 3 mois (le kétoprofène chez l'enfant de plus de 6 mois).
Des effets secondaires ont été décrits : infections des tissus mous (fasciites nécrosantes notamment en cas de varicelle) au cours desquelles ils ne doivent pas être prescrits ; toxicité digestive (hémorragies digestives) ; toxicité rénale (notamment en cas de gastro-entérite avec déshydratation ou chez les enfants ayant une insuffisance rénale).
Aspirine (acide acétylsalicylique) (Aspégic)
Il partage les effetsindésirablesdes autresanti-inflammatoires non stéroïdiens, notamment les risques allergiques, digestifs et rénaux. On lui attribue :
-
•
la survenue du syndrome de Reye (dont l'incidence reste cependant très faible en France 0,7/100 000 enfants en 1996) ;
-
•
la survenue de troubles de l'hémostase : inhibition irréversible de la cyclo-oxygénase plaquettaire, allongeant le temps de saignement ;
-
•
une toxicité aiguë : à des doses supérieures à 100 mg/kg/j.
Prescription pratique symptomatique
-
•
Inscrire sur l'ordonnance les prénom, nom, âge et poids de l'enfant.
-
•
En cas de consultation par téléphone, poser les questions indiquées dans l'encadré 18.2 .
-
•
Recourir à une monothérapie préférentielle par voie orale.
-
•
Utiliser des formes galéniques unitaires adaptées à l'enfant avec recours à des posologies unitaires facilement administrables (actuellement facilitée par les systèmes doseurs) : pipettes graduées en kg de poids (paracétamol, ibuprofène).
-
•
Utiliser en première intention de façon préférentielle le paracétamol (60 mg/kg en 4 prises de 15 mg/kg espacées toutes les 6 heures) sans omettre la prise nocturne. En seconde intention seulement, à la demande, en l'absence complète de défervescence, l'ibuprofène peut être proposé, en alternance « ciblée » à la posologie unitaire de 10 mg/kg (pipettes également graduées en kg de poids) (encadré 18.3 ).
-
•
Informer la famille sur les risques d'une « autoprescription » mal conduite (produits en vente libre en pharmacie).
Encadré 18.2.
Quelles questions poser lors d'une consultation téléphonique ?
-
–
Quel âge a l'enfant ?
-
–
Quel est son poids ?
-
–
Depuis quand a-t-il de la fièvre ?
-
–
Quel est le niveau de la fièvre ?
-
–Y a-t-il des symptômes associés ?
-
-si rhinorrhée, toux : consultation immédiate non obligatoirement nécessaire,
-
-si difficultés respiratoires, douleurs pharyngées, otalgies, boiterie : consultation rapide.
-
-
-
–
L'enfant est-il capable de boire ?
-
–
Quel est son degré d'activité ?
-
–
Quelle est la qualité du contact de l'enfant avec l'environnement ?
-
–
Quel traitement a-t-il pu être éventuellement administré spontanément par la famille : mesures physiques, antipyrétiques (à quelle dose, rapidité et efficacité de la chute thermique sous le traitement prescrit) ?
Encadré 18.3.
Type d'ordonnance pour un nourrisson âgé de 1 an (10 kg) atteint d'une infection fébrile virale (température initiale à 39,5 °C)
Nom, prénom Poids : 10 kg
-
–
Découvrir l'enfant.
-
–
Lui proposer fréquemment à boire (biberons supplémentaires y compris la nuit).
-
–Donner :
-
-paracétamol (ex : Doliprane, Efferalgan division 10) ;
-
-toutes les 6 heures ;
-
-systématiquement pendant les 24 à 48 premières heures.
-
-
-
–Uniquement, si 3 heures après la prise de Doliprane :
-
-l'enfant garde une température supérieure à 39 °C ;
-
-et semble inconfortable ;
-
-proposer une prise : ibuprofène (Advil ou Nurefl ex) division 10.
-
-
-
–
(À ne pas renouveler systématiquement en alternance pour ce dernier).
-
–
Reconsulter si persistance de la fièvre > 72 h ; ou apparition de signes nouveaux qui vous inquiètent.
Autres types de prescriptions antihyperthermiques en monothérapie
-
•
La voie intrarectale doit être réservée aux cas d'intolérance digestive haute ou basse ou lorsqu'une action antipyrétique prolongée (nocturne) est recherchée dans les fièvres modérées (10 à 20 mg/kg par prise pour le paracétamol à renouveler 2 à 3 fois par 24 heures).
-
•
La voie injectable (Perfalgan : 7,5 mg/kg < 1 an < 10 kg) est celle de l'urgence et de la sévérité (hyperthermie majeure ou rebelle supérieure à 41 °C). Elle peut être administrée à la dose de 15 mg/kg/injection à renouveler s'il y a lieu trois à quatre fois par 24 heures si nécessaire (jusqu'à 60 mg/kg/24 h).
En cas d'antécédents de convulsions fébriles (ne bénéficiant pas d'un traitement anticonvulsif préventif au long cours), il est généralement proposé aux parents d'administrer à l'enfant, au domicile, en cas de récidives des convulsions, du diazépam (Valium) par voie intrarectale à la dose 0,5 mg/kg.
Traitement de la cause de la fièvre
Il sera adapté à l'étiologie retrouvée (on se reportera aux chapitres concernés) en gardant à l'esprit que les infections virales sont les plus fréquentes chez le jeune nourrisson et le jeune enfant et que l'antibiothérapie ne saurait être systématique dans un tel contexte.
Toujours é:valuer, en cas de non-hospitalisation :
-
–
la compréhension de la prescription écrite par les familles ;
-
–
les possibilités de traitement (la nuit) ;
-
–les règles de surveillance :
-
–en informant qu'une maladie virale peut entraîner une fièvre supérieure à 3 jours qu'il appartient à la famille de tolérer…
-
–en précisant, sans alarmer, les signes de gravité qui doivent conduire à une nouvelle consultation urgente : anomalies du teint, des cris, pleurs inconsolables, troubles de la conscience, troubles hémodynamiques, etc.
-
–
Fièvre aiguë chez le nourrisson âgé de moins de 3 mois
V. Gajdos
La fièvre ne doit jamais être considérée comme un symptôme banal du fait d'un plus grand risque d'infections bactériennes invasives décrites à cet âge. Elle est définie par une température supérieure à 38 °C, mesurée par voie rectale. Les difficultés diagnostiques particulières à cette tranche d'âge tiennent au caractère non spécifique et souvent paucisymptomatique de l'expression d'infections potentiellement sévères (IPS) à leur début.
Une fièvre isolée, chez un enfant de moins de 3 mois, peut révéler aussi bien une infection virale sans gravité qu'une bactériémie nécessitant un traitement urgent.
Épidémiologie des infections du nourrisson âgé de moins de 3 mois
Les études menées chez des enfants hospitalisés montrent qu'environ deux tiers d'entre eux ont une infection virale. Les virus varient en fonction des saisons : entérovirus avant tout en été et en automne, VRS et influenzae en hiver.
Environ 10 % des nourrissons fébriles âgés de moins de 3 mois ont une bactériémie avec des risques de complications (méningites).
Prévalence des infections bactériennes sévères en cas de fièvre isolée < 3 mois
-
–
< 1 mois : 11 %.
-
–
1-2 mois : 7 %.
-
–
Bactériémie : 2 à 5 % selon études.
-
–
Méningites bactériennes : 0,5 %.
-
–
Pyélonéphrite aiguë : 5 %.
L'incidence de la bactériémie est plus élevée chez l'enfant âgé de moins d'un mois.
On définit comme IPS à cet âge les infections totalement reliées à certaines causes : méningite, infection urinaire, pneumopathie, ostéoarthrite, cellulite ou cellulodermite, gastro-entérite. Certains y incluent l'otite moyenne aiguë.
Signes de haut risque d'infections potentiellement sévères nécessitant une hospitalisation
Ce sont :
-
•
des troubles de la vigilance et/ou du tonus ;
-
•
des troubles du comportement : anomalies du cri, anomalies de la réactivité à la parole et/ou au sourire de l'entourage familier, irritabilité et/ou inconsolabilité, difficultés d'alimentation ;
-
•
des anomalies de l'hémodynamique évaluées avant tout sur l'augmentation de la fréquence cardiaque (et l'augmentation du temps de recoloration [> 3 secondes]) ;
-
•
des anomalies de la coloration : pâleur, cyanose, marbrures même transitoires ;
-
•
des signes de détresse respiratoire appréciés sur la fréquence respiratoire, le rythme respiratoire (régulier ou irrégulier), les signes de lutte ;
-
•
des signes de déshydratation ou un refus de boire ;
-
•
une distension abdominale ;
-
•
des signes en faveur d'une infection des parties molles ou du squelette (douleurs à la mobilisation) ;
-
•
la coexistence d'un purpura.
-
•
les nourrissons fébriles âgés de moins de 3 mois n'ayant pas de signes de haut risque mais dont le milieu familial ne peut assurer la surveillance et le dépistage des signes d'alarme du fait d'un faible niveau de compréhension et/ou de mauvaises conditions socio-économiques et/ou d'une anxiété trop importante.
Le bas risque infectieux est chez le jeune nourrisson fébrile de moins de 3 mois défini sur l'absence de signes cliniques définissant le haut risque… : une normalité hématologique ou biologique (absence de syndrome inflammatoire : CRP < 20 mg/L) ou absence d'anomalies radiologiques thoraciques.
Propositions pratiques d'orientation et de traitement (fig. 18.5)
Fig 18.5.

Conduite à tenir devant une fièvre > 38 °C chez un nourrisson de moins de 3 mois.
Nourrisson répondant aux critères cliniques de haut risque d'infection bactérienne
-
•
Orientation hospitalière pour numération formule sanguine ; CRP ; procalcitonine (anormale si > 0,5 μg/L) ; hémoculture ; ECBU ± selon le contexte, examen du liquide céphalorachidien (systématique < 6 semaines) et cliché thoracique.
-
•
Traitement antibiotique initié selon les données cliniques dans un contexte hospitalier : ceftriaxone 50 mg/kg en 1 injection par ± gentamycine en 1 injection : 5 mg/kg/j.
Nourrisson répondant aux critères de bas risque clinique
La surveillance (encadré 18.4 ) est possible au domicile en cas de possibilités de contacts faciles avec le médecin traitant ou avec les urgences hospitalières les plus proches avec information de la famille d'un recours rapide hospitalier en cas de survenue différée de signes cliniques de sévérité et dans tous les cas, une réévaluation clinique au terme de 24 heures.
Encadré 18.4.
Critères de surveillance
-
–
Niveau de vigilance.
-
–
Qualité du cri.
-
–
Couleur.
-
–
Réaction à la stimulation.
-
–
Réactivité à la parole et/ou au sourire de l'entourage familier.
-
–
Irritabilité et/ou inconsolabilité.
-
–
Acceptation de l'alimentation.
Cas du nourrisson de moins d'un mois (encadré 18.5)
Encadré 18.5.
Nouveau-né fébrile (moins d'un mois)
Les problèmes de diagnostic et de surveillance sont encore plus exigeants qu'aux 2e et 3e mois de vie. La fièvre peut témoigner d'une infection néonatale à révélation tardive dont le diagnostic peut être initialement difficile (symptomatologie non spécifique). Les examens complémentaires sont indispensables pour argumenter ou éliminer a posteriori une cause bactérienne. Il est nécessaire d'hospitaliser ces enfants jusqu'au résultat des examens bactériologiques (cultures).
Une telle attitude se conçoit si tous les critères de risques préalablement définis ont été régulièrement et systématiquement évalués par des médecins ayant l'expérience des très jeunes nourrissons. Elle évite alors le double écueil : celui d'un traitement systématique à l'aveugle comme celui d'un retard thérapeutique face à une infection potentiellement sévère.
BIBLIOGRAPHIE
- Afssaps . Mise au point sur la prise en charge de la fièvre chez l'enfant. décembre 2004. Paris. [Google Scholar]
- Bachur R.G., Harper M.B. Predictive model for serious bacterial infections among infants younger than 3 months of age. Pediatrics. 2001;108(2):311. doi: 10.1542/peds.108.2.311. 6. [DOI] [PubMed] [Google Scholar]
- Bourrillon A. Savoir prescrire les antipyrétiques chez le nourrisson. Rev Prat Med Gen. 1990;11:10. 6. [Google Scholar]
- Bourrillon A. Mesure de la température corporelle de l'enfant. Concours Médical. 2004;28(04):126. 36. [Google Scholar]
- Bourrillon A. Fièvre chez le nourrisson. In: Bourrillon A., Cheron G., editors. Urgencespédiatriques. 3e édition. Masson; Paris: 2005. [Google Scholar]
- Gajdos V., Beliah M., Bommenel L. Fièvre du nourrisson de moins de 3 mois. La Revue du Praticien de Médecine générale. 2007;21(786/787):984. 6. [Google Scholar]
- Gaudelus J., Chalvon-Demesay A., Sauvion S. Nourrissons fébriles de moins de 3 mois. Rev Prat Med Gen. 1995;9(282):33. 6. [Google Scholar]
- Pantel R.H., Newman T.B., Benzweig J. Management and outcomes of care of fever in early infancy. JAMA. 2004;29(10):1203. doi: 10.1001/jama.291.10.1203. 12. [DOI] [PubMed] [Google Scholar]
Fièvres éruptives
E. Grimprel
La survenue d'une éruption fébrile chez un enfant est un motif très fréquent de consultation en pédiatrie. Les éruptions fébriles de l'enfant connaissent cependant de nombreuses étiologies (tableau 18.4 ) ; certaines nécessitent d'être reconnues précocement du fait de risques particuliers liés à la maladie qu'elles déterminent. La constatation d'une éruption en climat fébrile chez un enfant impose ainsi une démarche en deux temps :
-
•
le premier est le temps de l'urgentiste qui recherche d'abord des signes de gravité imposant des mesures immédiates ;
-
•
le second est l'étape clinique de l'infectiologue et/ou du dermatologue, c'est-à-dire, in fine, de l'interniste. Elle est complexe car de multiples étiologies peuvent rendre compte d'éruptions similaires (une même éruption peut être de nature infectieuse ou allergique : toxidermie médicamenteuse) et une même étiologie peut donner des éruptions d'aspects différents.
Tableau 18.4.
Principales étiologies des fièvres éruptives de l'enfant selon le type d'éruption.
| Exanthème morbilliforme ou maculopapuleux | Exanthème scarlatiniforme | Éruptions vésiculobulleuses | Érythème noueux |
|---|---|---|---|
|
Infections virales Rougeole Rubéole Exanthème subit Mégalérythème épidémique Mononucléose infectieuse Adénovirose Acrodermatite érythématopapuleuse de Giannotti et Crosti Exanthème unilatéral thoracique Hépatites virales Cytomégalovirus Arboviroses Infections bactériennes Rickettsiose Dermoépidermite bactérienne Maladie de Lyme (érythème chronique migrant) Fièvre typhoïde Infections parasitaires Toxoplasmose Érythème polymorphe simple Maladies inflammatoires Maladie de Kawasaki Maladie de Still Lupus érythémateux systémique Cause médicamenteuse |
Infections bactériennes Scarlatine Syndrome de choc toxique streptococcique et staphylococcique Maladies infl ammatoires Maladie de Kawasaki Cause médicamenteuse |
Infections virales Varicelle Zona Herpès simplex Virus Coxsackie (syndrome pied-main-bouche) Impétigo
Épidermolyse staphylococcique Syndrome de Stevens-Johnson/Épidermolyse toxique ou syndrome de Lyell Infectieux
Toxique
Autres causes Leucémie, lymphome, etc. |
Infections bactériennes Streptocoque Tuberculose Yersiniose Chlamydia Mycoplasme Maladie des griffes du chat Brucellose, pasteurellose, tularémie, leptospirose, syphilis, gonococcie, lèpre, etc. Infections virales Virus Epstein-Barr Parvovirus B19 Infections fungiques Infections parasitaires Paludisme Trypanosomiase Maladies inflammatoires Sarcoïdose Maladie de Behcet Lupus érythémateux systémique Maladie de Crohn, rectocolite ulcérohémorragique, etc. Intolérance médicamenteuse Sulfamides, pénicillines, barbituriques, bromure, œstroprogestatifs, etc. Hémopathies malignes Leucémies Hodgkin |
Signes de gravité
Leur reconnaissance peut conduire à la mise en place d'un traitement urgent.
Ces signes sont :
-
•
la mauvaise « tolérance » de la fièvre : convulsions, troubles de la conscience, troubles hémodynamiques, choc, etc.
-
•l'existence de lésions purpuriques en climat fébrile qui doit avant tout faire suspecter une infection méningococcique et rechercher les autres signes essentiels :
-
–aspect nécrotique, de plus de 3 mm de diamètre, douloureux, déclive et extensif,
-
–tachycardie et mauvaise perfusion périphérique qui sont les signes précoces du choc infectieux ;
-
–
-
•
un aspect sévère de l'éruption : caractère douloureux et inflammatoire des lésions, décollement épidermique extensif avec exsudation plasmatique, atteinte des muqueuses, révélant une urgence infectieuse ou dermatologique.
Tout purpura fébrile doit faire rechercher des troubles hémodynamiques associés.
L'identification de ces signes impose les mesures immédiates de traitement du choc infectieux : remplissage vasculaire, antibiothérapie et hospitalisation en unité de soins intensifs.
Étape clinique
Quelle que soit l'éruption, l'analyse clinique comporte trois phases successives : interrogatoire, analyse de la sémiologie sur un plan dermatologique, puis examen général de l'enfant.
Interrogatoire
Il précise d'abord l'âge de l'enfant, puis :
-
•
la recherche des antécédents de fièvres éruptives ;
-
•
les dates et la nature des vaccinations reçues ;
-
•
le contexte épidémiologique : contage, épidémie scolaire ou familiale, conditions de vie ;
-
•
la chronologie des événements et éventuellement la nature et la durée des signes ayant précédé l'éruption, ou une prise médicamenteuse dans les jours précédant l'éruption ;
-
•
le degré de la fièvre, sa chronologie par rapport à l'éruption et l'aspect de la courbe thermique.
Sémiologie dermatologique
Elle permet de différentier plusieurs types de lésions élémentaires :
-
•
l'érythème se définit comme une rougeur congestive de la peau, sans infiltration palpable et disparaissant à la pression. Il peut être maculeux : petites taches rosées ou rouges sans relief ni infiltration, papuleux : lésions surélevées, d'aspect velouté, souvent associées aux précédentes (éruption maculopapuleuse), diffus en nappes ou en placards ;
-
•
le purpura est une tache rouge due à l'irruption des globules rouges hors des vaisseaux (extravasation). Il se différencie facilement de l'érythème car il ne s'efface pas la pression.
La topographie de l'éruption doit être notée : généralisée ou ¡2 localisée, respectant ou atteignant certaines zones, et l'asso| ciation des éléments entre eux : séparés ou confluents, «s nappes homogènes ou non. L'évolution de l'éruption doit être précisée : son mode d'installation et d'extension, son éventuelle régression suivie et la survenue d'une desquamation. À ce stade de l'examen, il est généralement possible de classer l'éruption :
-
•
érythème localisé ou diffus ;
-
•
érythème en nappe scarlatiniforme : vastes nappes rouge vif, uniformes, parsemées d'un piqueté maculopapuleux qui donne au toucher une sensation de peau grenue, sans intervalle de peau saine. Au sein des plaques, surtout en regard des plis, il peut exister un piqueté purpurique ;
-
•
érythème maculeux roséoliforme : d'aspect souvent très fruste ; il réalise des macules pâles de plusieurs millimètres de diamètre, rondes ou ovalaires, régulières, bien limitées, planes ;
-
•
érythème maculopapuleux morbilliforme : macules lenticulaires rosées ou rouges, planes ou très légèrement saillantes. Ces éléments confluent par endroits pour former de petites nappes de tailles inégales à contours irréguliers et séparées par des intervalles de peau saine ;
-
•
éruption de type urticarien : plaques érythémateuses et infiltrées (ortiées) prurigineuses et surtout fugaces, changeant de localisation d'une heure à l'autre ;
-
•
érythème polymorphe : lésions ovalaires érythémateuses polycycliques et fixées (à la différence de l'urticaire) prenant vers le 3e jour un aspect typique en cocarde (lésion concentrique avec, de l'extérieur vers l'intérieur, une zone érythémateuse, une zone plus claire et une nouvelle zone érythémateuse, purpurique ou cyanotique parfois centrée par un décollement vésiculeux ou bulleux) ;
-
•
érythème noueux : nodules ou nouures (élevures rondes saillantes et profondes, de grande taille) prédominant sur les faces d'extension des membres ;
-
•érythèmes vésiculobulleux :
-
–vésicules : soulèvement épidermique de petite taille contenant un liquide clair, cavité intra-épidermique,
-
–pustule : vésicule à liquide trouble,
-
–bulle : soulèvement cutané de grande taille à contenu clair, hémorragique ou purulent, cavité sous-épidermique.
-
–
Examen clinique
Il doit être précis et complet, et recherche en particulier la présence d'un énanthème buccal ou conjonctival, d'adénopathies, d'une hépatosplénomégalie, d'une atteinte articulaire, de signes digestifs ou méningés.
L'étape finale consistera à établir une présomption étiologique. C'est l'étape indispensable de synthèse entre les données de l'interrogatoire et de l'examen clinique de l'enfant. Elle nécessite donc de replacer l'éruption dans son contexte clinique et évolutif et permet, dans un grand nombre de cas, d'émettre une hypothèse raisonnable reposant sur des arguments clés, positifs ou négatifs.
Orientation du diagnostic
Selon le type d'éruption, les diagnostics possibles sont très différents, c'est pour cela qu'il est utile d'avoir au préalable classé l'éruption. La liste des étiologies présentées ici n'est pas exhaustive mais regroupe les diagnostics les plus importants et les plus fréquents avec les principaux éléments clés du diagnostic. Pour une description plus détaillée des pathologies infectieuses éruptives fébriles de l'enfant, se reporter aussi aux Infections bactériennes page 488 dans ce chapitre.
Érythèmes localisés
Ils ont des causes variées, principalement infectieuses ou inflammatoires exogènes.
Dermoépidermites bactériennes ou érysipèles
Les éléments diagnostiques clés sont :
-
•
fièvre élevée, frissons ;
-
•
plaque rouge limitée, infiltrée et douloureuse, parfois recouverte d'un décollement cutané ;
-
•
lésion préexistante, plaie, piqûre, eczéma, etc. ;
-
•
streptocoque A, parfois staphylocoque ;
-
•
atteinte hypodermique évoquée en cas de lésions mal limitées et plus profondes (cellulite ou dermohypodermite bactérienne).
Dermohypodermites inflammatoires ou érythèmes noueux
Les étiologies sont multiples (cf. tableau 18.4) et justifient une enquête systématique.
Les éléments diagnostiques clés sont :
-
•
une sensation initiale de malaise fébrile avec arthralgies ;
-
•
des nodosités multiples arrondies ou ovalaires fermes, inflammatoires et sensibles plus ou moins saillantes, roses ou rouge vif de 0,5 à plusieurs centimètres ;
-
•
bilatérales et symétriques, à la face d'extension des membres ;
-
•
une évolution subaiguë vers une teinte contusiforme (teintes successives de la biligénie locale, comme un hématome) ;
-
•
une durée prolongée, avec poussées successives sur 3 à 6 semaines.
Érythème chronique migrant (cf. Piqûres de tiques et maladie de Lyme page 495)
Les éléments diagnostiques clés sont :
-
•
une notion de piqûre de tique dans les jours ou semaines précédents (inconstant) ;
-
•
un érythème annulaire (unique le plus souvent), centré sur le point de piqûre ;
-
•
indolore ;
-
•
l'élargissement centrifuge de l'érythème, progressif sur plusieurs jours.
Exanthème unilatéral thoracique
Pathologie bénigne, probablement d'origine virale du nourrisson, les éléments diagnostiques clés sont :
-
•
un érythème maculopapuleux mal limité, localisé à la région latérothoracique ;
-
•
un prurit fréquent ;
-
•
une extension centrifuge plus ou moins étendue (pouvant atteindre les membres homolatéraux) ;
-
•
une adénopathie axillaire satellite ;
-
•
une régression spontanée et lente sur plusieurs semaines.
Érythèmes inflammatoires « toxiques »
Ce sont :
-
•
une piqûre d'insecte : érythème inflammatoire souvent papuleux centré par un point de piqûre ou une bulle ;
-
•
une brûlure : thermique ou caustique ;
-
•
un érythème phototoxique : limité aux territoires cutanés exposés à la lumière (visage, dos des mains et avant-bras, jambes).
Éruptions diffuses maculeuses et maculopapuleuses
Elles sont les plus fréquentes et se classent ensemble, regroupant pour leurs étiologies communes les éruptions rubéoliformes et morbilliformes. Les étiologies sont principalement infectieuses (surtout virales) mais aussi allergiques (toxidermies médicamenteuses).
Rougeole
Les éléments diagnostiques clés sont :
-
•
une notion de contage 7-10 jours avant le début des symptômes ;
-
•
l'absence d'antécédent de rougeole ou de vaccination complète (moins de deux doses) ;
-
•
des signes respiratoires : toux +++ ;
-
•
un déroulement typique de la maladie : phase d'invasion de 3-4 jours (catarrhe généralisé avec fièvre, toux et à l'examen signe de Kôplick) ; phase d'état = éruption débutant (J14) derrière les oreilles, avec marche descendante sur 3 jours, s'atténuant en 48 heures et disparaissant en 4 à 5 jours suivant la même marche descendante.
Rubéole
Les éléments diagnostiques clés sont :
-
•
une notion de contage 14 jours avant le début des symptômes (souvent absente car la maladie est généralement fruste sur le plan clinique) ;
-
•
l'absence d'antécédent de rubéole ou de vaccination ;
-
•
peu de symptômes associés ;
-
•
le déroulement de la maladie : invasion très brève, fièvre modérée et sensation de malaise général. L'éruption débute au visage puis évolue en une seule poussée : elle se généralise en 24 heures en respectant les extrémités. Des adénopathies occipitales et cervicales postérieures sont fréquentes. Il peut exister parfois une splénomégalie, des arthralgies des petites articulations (adolescent et adulte jeune).
La plupart des rubéoles sont cependant inapparentes !
Exanthème subit ou roséole infantile ou 6e maladie (agent étiologique : HHV-6)
Les éléments diagnostiques clés sont :
-
•
l'âge : entre 6 mois et 18 mois (95 % avant 2 ans) ;
-
•
le déroulement de la maladie : typiquement en deux phases : fièvre d'apparition brutale, élevée (≈ 39-40 °C), bien tolérée, pendant 3 à 4 jours avec de faibles oscillations, puis baisse très brutale de la température à 37 °C voire au-dessous et apparition de l'éruption ;
-
•
des petites macules voire maculopapules, plus ou moins marquées, prédominant au tronc et aux membres. L'éruption disparaît en 12 à 24 heures, signant la guérison.
NB : Il existe des formes atypiques, formes hyperthermiques pures sans rash, formes avec rash classique mais sans fièvre.
Mégalérythème épidémique
Il correspond à la primo-infection par le Parvovirus B19.
La contamination se fait par voie respiratoire et l'incubation silencieuse dure 6 à 14 jours.
Les éléments diagnostiques clés sont :
-
•
l'âge : enfant âgé de 5 à 10 ans ;
-
•
une notion d'épidémie familiale ou scolaire ;
-
•
les signes négatifs : pas de fièvre, pas d'atteinte de l'état général ;
-
•une éruption caractéristique :
-
–elle débute au visage : érythème bilatéral et symétrique des joues qui paraissent comme souffletées (comme après une paire de claques), entouré d'un halo pâle périphérique. Cet érythème disparaît spontanément en 4 à 5 jours,
-
–la deuxième phase débute 24-48 heures plus tard avec un érythème atteignant les membres (bras, cuisses, jambes) et s'étendant progressivement vers les extrémités et parfois le cou, le thorax et les fesses. Les éléments sont maculeux, légèrement œdémateux avec une majoration périphérique de l'érythème donnant un aspect figuré caractéristique, annulaire ou en carte de géographie. On peut retrouver de larges placards au niveau des fesses. Cette phase peut durer de 1 à 3 semaines,
-
–à la phase terminale, l'éruption devient variable d'un moment à l'autre pendant quelques jours, avec une accentuation possible au soleil, à la chaleur, ou à l'occasion d'émotions ou de stress, avant de disparaître. Des « rechutes » du phénomène éruptif sont possibles pendant les semaines suivantes, après un effort ou une exposition au soleil.
-
–
NB : Une crise érythroblastopénique (anémie aiguë profonde et non régénérative) est possible chez le sujet atteint d'une anémie hémolytique chronique (drépanocytose, thalassémie, etc.).
Mononucléose infectieuse
Elle correspond à la primo-infection à virus d'Epstein-Barr. Les éléments diagnostiques clés sont :
-
•
l'éruption morbilliforme : elle existe dans 5 à 10 % des cas en dehors de toute prise d'ampicilline ; elle était quasi constante si de l'ampicilline avait été prescrite. Elle est moins fréquente avec l'amoxicilline. Elle est généralement diffuse, plus rarement localisée aux paumes et aux plantes. Mais ce rash est parfois atypique : scarlatiniforme, purpurique (rechercher une thrombopénie), voire urticarien ;
-
•
les signes associés : altération de l'état général, asthénie, fièvre, angine érythémateuse, érythématopultacée ou pseudo-membraneuse, voix nasonnée (voire paralysie du voile), purpura du voile, œdème des paupières, adénopathies cervicales volumineuses, splénomégalie (en règle modérée).
Acrodermatite érythématopapuleuse de Giannotti et Crosti
Les éléments diagnostiques clés sont :
-
•
une éruption de survenue brutale sur la face et les extrémités chez un enfant âgé de 2 à 6 ans, apyrétique, avec des éléments maculopapuleux de taille variable ;
-
•
l'association d'une polyadénopathie, d'une hépatospléno mégalie et d'une hépatite anictérique ;
-
•
un état général conservé avec une guérison en 2 à 3 semaines.
NB : Il faut rechercher une hépatite aiguë B, mais d'autres «s micro-organismes peuvent être impliqués : EBV, Entérovirus (Coxsackies B4 et B5, échovirus type 7 et 9), CMV, adénovirus, Rotavirus, virus para-influenza.
Exanthèmes des entéroviroses
Les virus Echo ou Coxsackie donnent des exanthèmes maculeux discrets, survenant par petites épidémies estivales. Un possible syndrome pseudo-grippal non spécifique (céphalées, myalgies, diarrhée) peut être associé.
L'exanthème de Boston est dû à l'echovirus 16 et survient par petites épidémies. L'éruption survient après 2 à 3 jours de fièvre et a un aspect morbilliforme du visage et de la partie supérieure du tronc. Elle s'accompagne parfois d'adénopathies cervicales occipitales et rétro-auriculaires, d'un pseudo-signe de Koplick et de petites vésicules ou de petites érosions punctiformes pharyngées.
Infections à adénovirus
Certains adénovirus peuvent être responsables d'éruptions. Les éléments diagnostiques clés sont :
-
•
une éruption maculopapuleuse morbilliforme, parfois purpurique, prédominant à la partie supérieure du corps ;
-
•
l'association fréquente à une conjonctivite et une adénopathie préauriculaire ;
-
•
parfois, une atteinte respiratoire (bronchite, bronchiolite, foyer pulmonaire) ou digestive (douleurs abdominales, diarrhée).
Fièvre boutonneuse méditerranéenne
Il s'agit d'une infection bactérienne due à Rickettsia conorii, transmise par les tiques du chien. Elle sévit essentiellement dans les régions du pourtour méditerranéen (d'où son nom).
Les éléments diagnostiques clés sont :
-
•
un séjour récent en zone d'endémie ;
-
•
une piqûre de tique (souvent oubliée, rechercher un contact avec des chiens) ;
-
•
des signes généraux marqués : fièvre élevée, frissons, céphalées, myalgies, arthralgies, asthénie ;
-
•
un chancre d'inoculation + adénopathie satellite ;
-
•
une éruption maculopapuleuse non confluente diffuse avec atteinte des paumes et des plantes.
Primo-infection par le VIH
Elle est symptomatique dans plus de la moitié des cas au terme d'une incubation de 2 à 3 semaines.
Les éléments clés du diagnostic sont :
-
•
une exposition connue ou une situation à risque ;
-
•
un syndrome fébrile pseudo-grippal, avec parfois asthénie, adénopathies, pharyngite, érosions buccales et génitales ;
-
•
une éruption érythémato-maculeuse du tronc avec parfois une atteinte du visage ou des paumes et des plantes ;
-
•
un syndrome mononucléosique (inconstant) ;
-
•
une sérologie VIH négative mais une antigénémie P24 et surtout une charge virale positives à ce stade.
Maladie de Kawasaki ou syndrome adénocutanéomuqueux
Vascularite aiguë systémique d'étiologie inconnue, sa gravité est liée aux complications cardiaques (péricardite, myocardite et surtout anévrismes coronaires) qui en font une urgence diagnostique et thérapeutique. Le caractère protéiforme de cette vascularite rend parfois difficile son diagnostic, tous les organes étant susceptibles d'être atteints.
L'éruption du syndrome de Kawasaki est non spécifique et variable dans sa présentation : morbilliforme, rubéoliforme ou scarlatiniforme. Elle touche généralement le tronc. C'est l'association aux autres symptômes clés de la maladie qui permet le diagnostic (cf. Maladie de Kawasaki page 454).
Le diagnostic est habituellement porté lorsqu'au moins 4 critères cliniques sur les 5 suivants sont réunis :
-
•
une fièvre de plus de 5 jours ;
-
•
une conjonctivite bulbaire bilatérale non purulente ;
-
•
une atteinte de la cavité buccale (chéilite, stomatite, langue framboisée) ;
-
•
une atteinte des extrémités des membres (œdème induré des mains et des pieds, érythème des paumes et des plantes, desquamation tardive des doigts) ;
-
•
une éruption du tronc, maculopapuleuse ici, mais souvent polymorphe et fréquemment aussi scarlatiniforme (cf. cidessous).
Le sixième critère est la présence d'adénopathies cervicales de plus de 1,5 cm de diamètre, mais n'est pas reconnu par tous. Les autres symptômes les plus fréquents sont : agitation, enfant irritable, diarrhée, douleurs abdominales, arthralgies et arthrites.
Devant un tableau évocateur de syndrome de Kawasaki, il convient d'effectuer en urgence un bilan inflammatoire (NFS, CRP, VS) et une échographie cardiaque (péricardite, épaississement ou dilatation des coronaires). Le traitement est urgent et consiste en l'administration de fortes doses de gammaglobulines intraveineuses.
Urticaires aiguës
Les éléments cutanés sont infiltrés, ce qui peut conduire à discussion, avec les autres causes d'éruption maculopapuleuses (tableau 18.5 ). Les éléments diagnostiques clés sont :
-
•
l'aspect des lésions dermatologiques (cf. ci-dessus) ;
-
•
l'identification d'un facteur déclenchant : en premier lieu une infection virale au cours des jours précédents (le plus souvent une virose respiratoire banale mais aussi, une hépatite aiguë virale, une infection respiratoire aiguë à mycoplasme, une toxoplasmose), une prise médicamenteuse : antibiotiques surtout, mais aussi aspirine, voire tout médicament, même anodin et souvent oublié (sirop pour la toux par exemple).
Tableau 18.5.
Orientation étiologique devant une réaction cutanée évoquant une toxidermie médicamenteuse.
| Étiologie | Éruption maculopapuleuse | Urticaire | Syndrome de Stevens-Johnson |
|---|---|---|---|
| Délai | 7-14 jours | Quelques minutes ou heures | 7-21 jours |
| Médicaments | Aminopénicillines Sulfamides antibiotiques Anticomitiaux Allopurinol |
Pénicillines Produits de contraste Aspirine AINS |
Sulfamides antibiotiques Anticomitiaux AINS oxicams Allopurinol Chlormézanone |
Érythèmes polymorphes
Les éléments diagnostiques clés sont :
-
•
l'aspect typique des lésions (cf. ci-dessus) : lésions maculopapuleuses ovalaires, plus ou moins confluantes et souvent symétriques. Elles sont fixes (à la différence de l'urticaire) et évoluent en 2 à 3 jours vers un aspect caractéristique en cocarde, c'est-à-dire concentrique avec un halo périphérique œdématié et sombre, une large zone centrale claire, ellemême centrée par une petite lésion plus sombre ou bulleuse.
-
•le contexte :
-
–fièvre avec toux (rechercher une infection pulmonaire à mycoplasme),
-
–non fébrile (rechercher une éruption vésiculeuse de type herpétique),
-
–fébrile ou non : rechercher une prise médicamenteuse ;
-
–
-
•
la topographie acrale (extrémités) avec un aspect en cocardes ou cibles à au moins 3 anneaux ; l'étiologie est infectieuse et non médicamenteuse.
Toxidermies maculopapuleuses
Les éléments diagnostiques clés sont :
-
•
une éruption morbilliforme ;
-
•
l'absence des autres signes orientant vers une origine infectieuse ;
-
•
une prise médicamenteuse dans les 8-10 jours précédents ;
-
•
un prurit fréquent ;
-
•
le polymorphisme fréquent de l'éruption (lésions associées non strictement maculopapuleuses) ;
-
•
une hyperéosinophilie sanguine.
Cependant, chez l'enfant, le phénomène éruptif n'est pas toujours lié à une allergie médicamenteuse vraie mais souvent à une réaction d'intolérance transitoire survenant à l'occasion de la prise médicamenteuse concomitante à une infection, souvent virale. Les tests cutanés allergologiques sont alors négatifs.
Érythèmes diffus scarlatiniformes
Les étiologies sont principalement infectieuses (surtout bactériennes) mais aussi inflammatoires (Kawasaki) et allergiques (toxidermies médicamenteuses).
Scarlatine
Les éléments diagnostiques clés sont :
-
•
une phase prodromique avec fièvre élevée à 39-40 °C, angine érythémateuse, douloureuse et dysphagiante, langue saburrale, adénopathies cervicales, tachycardie, nausées ou vomissements ;
-
•
une phase d'état avec érythème en placards diffus extensifs sans intervalle de peau saine, maximum sur le tronc et les plis de flexion, épargnant les paumes et les plantes et énanthème lingual dessinant un V rouge entourant un triangle blanc évoluant vers la langue totalement dépapillée framboisée, couleur lie de vin ;
-
•
l'évolution vers une phase desquamative cutanée de grande valeur pour le diagnostic a posteriori.
Chocs toxiniques streptococciques et staphylococciques
Les chocs toxiniques staphylococcique ou streptococcique sont secondaires à la sécrétion d'une toxine sécrétée à partir d'un foyer bactérien.
Les éléments diagnostiques clés sont :
-
•
une éruption scarlatiniforme ;
-
•
l'association à des signes généraux sévères de type toxinique : fièvre élevée, choc, diarrhée, vomissements déshydratation, insuffisance cardiaque, hépatique et/ou rénale.
Syndromes scarlatiniformes staphylococciques et streptococciques
Ils représentent probablement des formes bénignes des chocs toxiniques streptococciques et staphylococciques.
Les éléments diagnostiques clés sont :
-
•
une éruption scarlatiniforme ;
-
•
l'absence d'angine et de langue framboisée ;
-
•
la présence d'une porte d'entrée ORL ou cutanée ;
-
•
l'évolution : desquamation beaucoup plus rapide en 1 à 2 jours après l'apparition de l'érythème avec une résolution complète en quelques jours.
NB : Les rashs scarlatiniformes ont de très nombreuses autres causes, en particulier virales (entérovirus, etc.). C'est actuellement l'un des principaux diagnostics différentiels avec le syndrome de Kawasaki.
Syndrome de Kawasaki
(Voir Maladie de Kawasaki page 454).
Toxidermies scarlatiniformes
Les éléments diagnostiques clés sont :
-
•
une éruption scarlatiniforme ;
-
•
l'absence des autres signes de la scarlatine ;
-
•
une prise récente médicamenteuse ;
-
•
un prurit fréquent.
Les produits responsables sont surtout : les sels métalliques (mercure, bismuth, or, arsenic), les barbituriques et opiacés, la digitaline, la belladone, les sulfamides, la quinine, les salicylates, les hydantoïnes, l'éphédrine et les pyrazolés.
Vascularites aiguës
Elles ont volontiers un caractère purpurique et périphérique (membres).
Purpura infectieux sévère méningococcique
Tout purpura fébrile doit faire évoquer de parti pris une infection méningococcique. Son pronostic (sévère) est lié à la précocité du traitement (et donc du diagnostic).
Plaident en faveur d'une infection méningococcique :
-
•
des lésions de plus de 3 mm de diamètre et aspect nécrof tique, souvent douloureuses ;
-
•
une topographie déclive ;
-
•
le caractère extensif des lésions (déshabiller complètement tout enfant fébrile, en particulier retirer ses chaussettes ! Marquer les premières lésions aperçues et noter l'heure de J, leur survenue).
Les signes généraux associés suivants sont marqués : fièvre élevée (> 40 °C), asthénie, prostration, céphalées, vomissef ments, signes méningés (parfois absents), douleurs diffuses (notamment au niveau des membres inférieurs).
Devant un purpura fébrile (encadré 18.6 ), évaluer toujours immédiatement le retentissement hémodynamique afin «s d'identifier les premiers signes de choc :
-
•
aspect des extrémités (cyanose, marbrures, froideur) ;
-
•
pâleur, temps de recoloration capillaire allongé > 3 secondes ;
-
•
tachycardie (la PA peut être normale ou augmentée) ;
-
•
polypnée ;
-
•
troubles de la conscience, agitation (qui signent l'existence d'un bas débit de perfusion cérébrale).
Encadré 18.6.
Orientation étiologique devant un purpura en climat fébrile
Vascularites
-
•
Infections méningococciques et en priorité : rechercher des signes de choc.
-
•Autres causes infectieuses :
-
-virales ;
-
-bactériennes : rickettsioses.
-
-
-
•Immunoallergiques (parfois fébriles) :
-
-purpura rhumatoïde ;
-
-œdème aigu hémorragique ;
-
-certaines urticaires ;
-
-érythème polymorphe.
-
-
Mécanique
Toux, vomissements, contention, traumatisme.
Thrombopénie (à rechercher systématiquement)
-
•
Périphérique (PTI, viroses, etc.).
-
•
Centrale (hémopathies).
L'urgence est thérapeutique : antibiothérapie intraveineuse IM immédiate sur place (ceftriaxone 50 mg/kg IM, y compris au domicile du médecin) ; restauration d'une hémodynamique par remplissage et mise sous drogues vasopressives, et transfert par SAMU vers un centre médicalisé (réanimation).
Purpura rhumatoïde
Maladie classique de l'enfant, elle est le plus souvent bénigne. Ses principales complications sont rénales et digestives.
Les éléments diagnostiques clés sont :
-
•
des lésions typiques de vascularite : érythémateuses infiltrées avec éléments purpuriques au centre ;
-
•
une localisation préférentielle sur la face postérieure des membres inférieurs et sur les fesses ;
-
•
l'association fréquente à des douleurs articulaires et abdominales ;
-
•
la conservation de l'état général et l'absence habituelle de fièvre.
Œdème aigu hémorragique du nourrisson
Il s'agit pour certains d'une forme particulière de purpura rhumatoïde concernant le jeune nourrisson.
Les éléments diagnostiques clés sont :
-
•
des lésions polycycliques et souvent extensives de caractère érythémateux cyanique et purpurique du visage (en particulier des oreilles) et des membres ;
-
•
un aspect souvent œdémateux et douloureux des lésions du visage et des zones périarticulaires des membres ;
-
•
un état général le plus souvent conservé ;
-
•
parfois fébrile dans un contexte de virose.
Érythème papuleux purpurique en gants et chaussettes (papular purpuric gloves and socks syndrome)
L'origine est virale : Parvovirus B19 et HHV-6 essentiellement, plus rarement, rougeole, CMV, Coxsackie B6.
Les signes généraux associent une fièvre modérée, un bon état général, sans choc.
Les éléments diagnostiques clés sont :
-
•
un énanthème buccal et génital érosif ou vésiculeux ;
-
•
une éruption maculopapuleuse purpurique des extrémités.
Arbovirose (Chikungunya par exemple)
Les éléments diagnostiques clés sont :
-
•
un séjour en zone d'endémie ;
-
•
une incubation silencieuse de 4 à 7 jours en moyenne ;
-
•
une fièvre élevée d'apparition brutale accompagnée d'arthralgies parfois intenses, touchant principalement les extrémités (poignets, chevilles et phalanges) ;
-
•
la présence d'autres signes tels que : myalgies, céphalées et exanthème maculopapuleux du tronc et des extrémités, parfois purpurique.
Maladies inflammatoires
Les maladies inflammatoires les plus fréquentes pouvant s'accompagner d'une éruption lors d'une poussée fébrile sont : la maladie de Still, la dermatomyosite, le lupus érythémateux disséminé.
Les éléments clés orientant vers ce type de diagnostic sont les suivants.
-
•maladie de Still :
-
–jeune enfant et nourrisson le plus souvent dans cette forme purement systémique,
-
–éruption morbilliforme intermittente, le plus souvent vespérale et au moment des pics fébriles,
-
–fièvre prolongée, élevée avec altération de l'état général,
-
–myalgies,
-
–polyarthrite plus fréquente chez l'enfant plus âgé, parfois au premier plan ;
-
–
-
•lupus érythémateuxaigu de l'enfant :
-
–grand enfant,
-
–début brutal associant fièvre, asthénie, amaigrissement, douleurs musculaires et/ou articulaires, polyadénopathie, hépatosplénomégalie,
-
–érythème papuleux du visage en aile de papillon (racine du nez et pommettes),
-
–érythème maculeux des paumes et des plantes, de la pulpe des doigts pouvant évoluer vers la nécrose,
-
–rash morbilliforme, ulcérations buccales, alopécie,
-
–photosensibilisation.
-
–
-
•dermatomyosite :
-
–début progressif avec fatigabilité musculaire et altération de l'état général,
-
–érythème lilas périorbitaire,
-
–lésions érythématosquameuses périarticulaires (articulations métacarpophalangiennes, interphalangiennes ou parfois grosses articulations),
-
–photosensibilisation.
-
–
Éruptions vésiculeuses et bulleuses
Varicelle (voir Varicelle-zona page 515)
Les éléments clés sont :
-
•
la lésion élémentaire : macule érythémateuse (2 à 4 mm), évoluant vers une vésicule molle claire puis trouble (2e jour avec ombilication centrale), puis une croûte prurigineuse qui chute entre J5 et J7 ;
-
•
des lésions réparties sur l'ensemble du corps y compris le scalp avec intervalles de peau saine ;
-
•
un nombre très variable de lésions selon les individus ;
-
•
2 ou 3 poussées successives à 24-48 heures d'intervalle, d'où la coexistence d'éléments d'âge différent ;
-
•
une durée totale de l'éruption de 10 à 12 jours.
Zona (type intercostal)
Les éléments clés sont :
-
•
phase prodromique (24-48 heures) marquée par : fièvre, malaise, céphalées, douleur localisée au futur territoire de l'éruption, adénopathie satellite sensible ;
-
•
éruption caractéristique par sa topographie unilatérale, hémicirculaire, radiculaire, horizontale, coupant la ligne des côtes, discontinue, en trois bouquets : parasternal, axillaire moyen et latérovertébral ; des éléments aberrants peuvent s'observer sur d'autres territoires.
Herpès
Les éléments clés sont :
-
•
des lésions vésiculeuses en bouquet (le plus souvent périlabial) ;
-
•
douloureuses ;
-
•
une évolution vers une croûte en 48 heures ;
-
•
le caractère récidivant, au même endroit.
Infections à Entérovirus (virus Coxsackie)
Les éléments clés orientant vers ce type de diagnostic sont :
-
•
une angine et/ou une stomatite à caractère vésiculeux (labile) ou ulcéreux ;
-
•
des lésions vésiculeuses des extrémités (paumes et plantes) ;
-
•
des vésicules grisâtres, fermes, enchâssées, un halo rouge périphérique ;
-
•
l'absence d'évolution vers le stade croûteux sauf en cas de grattage et surinfection.
Impétigo
Les éléments clés orientant vers ce type de diagnostic sont :
-
•
la survenue à tout âge ;
-
•
des vésicules ou bulles près d'une lésion primitive ;
-
•
des lésions secondaires plus erratiques ;
-
•
des régions accessibles au grattage (ventre, visage et membres) ;
-
•un aspect :
-
–soit vésiculobulleux = staphylocoque,
-
–soit croûteux et mélicérique = streptocoque.
-
–
Syndrome des enfants ébouillantés
Les éléments clés orientant vers ce type de diagnostic sont :
-
•
un début par une fièvre avec altération de l'état général ;
-
•
puis un érythème douloureux débutant habituellement à la face, au cou, aux plis axillaires et inguinaux ;
-
•
une peau qui devient fragile et se décolle par larges lambeaux avec présence d'un signe de Nikolski ;
-
•
des lésions parfois plus localisées avec des bulles de grande dimension à contenu clair ou discrètement trouble autour de lésions initiales d'impétigo.
Syndrome de Stevens-Johnson (SSJ) et syndrome de Lyell (nécrolyse épidermique toxique)
Ces deux syndromes sont intimement liés sur le plan physiopathologique et ne seraient que deux expressions cliniques plus ou moins avancées d'un même processus. Ils se différentient des érythèmes polymorphes simples décrits plus haut. Leurs étiologies (cf. tableau 18.4) sont principalement médicamenteuses.
Les éléments clés orientant vers ce type de diagnostic sont :
-
•
des manifestations générales intenses : fièvre élevée, prolongée, asthénie, adénopathies diffuses ;
-
•
des macules érythémateuses avec décollement épidermique au moindre frottement (signe de Nikolsky) ;
-
•
des pseudo-cocardes mal limitées avec seulement deux anneaux, dont une zone centrale grisâtre nécrotique ou bulleuse ;
-
•
une extension rapide en quelques heures avec aspect de « linge mouillé » sur une surface plus ou moins étendue jusqu'à l'aspect de « grand brûlé » (pronostic vital en jeu) ;
-
•
SSJ : décollement épidermique < 10 % ; Lyell : décollement > 30 % ;
-
•
des lésions prédominant sur le tronc ;
-
•
une atteinte périorificielle et des muqueuses : stomatite et chéilite érosives et hémorragiques très douloureuse, lésions érosives au niveau de l'anus, la vulve, le gland, ophtalmie purulente ;
-
•
des poussées successives sur plusieurs jours (3 à 10).
Syndrome d'hypersensibilité médicamenteux (DRESS)
De pronostic sévère (30 % de mortalité), le DRESS impose d'être reconnu au plus tôt sur les éléments clés suivants :
-
•
un début tardif par rapport à la prise médicamenteuse (2 à 6 semaines) ;
-
•
l'administration d'anticonvulsivants au long cours (carbamazépine, phénytoïne, phénobarbital), de sulfamides (cotrimoxazole), de minocycline ;
-
•
une fièvre élevée avec altération de l'état général, éruption maculopapuleuse diffuse, œdème ferme du visage, polyadénopathies, hépatosplénomégalie ;
-
•
une hyperleucocytose avec hyperlymphocytose, mononucléose, éosinophilie, cytolyse hépatique, insuffisance rénale aiguë ;
-
•
un rebond clinique plusieurs semaines après l'arrêt du traitement, déclenché par une réactivation virale : HHV-6, EBV.
Fièvre prolongée du grand enfant
J. Gaudelus
Les fièvres prolongées de l'enfant posent avant tout le «s problème de leur étiologie. Elles imposent une enquête méthodique dans laquelle l'étape clinique est essentielle, irremplaçable et doit être répétée.
La fièvre est définie par une température centrale dépassant 37,5 °C le matin au réveil et 38 °C le soir chez l'enfant ayant une activité physique normale. Chez le nourrisson, on retient comme limites 37,5 °C le matin et 37,8 °C le soir. La fièvre est prolongée lorsqu'elle dépasse 5 jours chez le nourrisson et une semaine chez l'enfant plus grand. La fièvre prolongée doit être différenciée des fièvres à répétition où les épisodes successifs brefs sont séparés par des intervalles d'apyrexie de plusieurs jours ou semaines.
Ainsi défini, le seul diagnostic différentiel des fièvres prolongées est la thermopathomimie ou « fièvre simulée ». Elle se discute chez le grand enfant ou l'adolescent devant une fièvre totalement isolée sur le plan clinique. La température est normale lorsqu'elle est prise sous surveillance, thermomètre tenu par une autre personne.
Bilan clinique
En présence d'une fièvre prolongée, l'interrogatoire précisera :
-
•
l'ethnie ;
-
•
les antécédents médico-chirurgicaux ;
-
•
l'état des vaccinations ;
-
•
la notion d'un voyage plus ou moins récent ;
-
•
un éventuel contage infectieux familial ou parmi les proches ;
-
•les caractéristiques de la fièvre :
-
–date de début, circonstances d'apparition, degré, aspect de la courbe thermique (plateau, pics, ondulante, oscillante),
-
–signes d'accompagnement,
-
–traitements éventuellement entrepris et leur efficacité.
-
–
L'examen clinique n'a pas de particularité en soi. Il doit être absolument complet, sans oublier l'examen des tympans chez le nourrisson. Il doit être répété.
Diagnostic étiologique
Au terme de cette première étape, deux éventualités se présentent (fig. 18.6 ).
Fig 18.6.

Conduite d'ensemble à tenir devant une fièvre prolongée de l'enfant.
S'il existe une orientation :
-
•
l'affection causale peut n'impliquer aucun examen complémentaire : le diagnostic repose sur les données sémiologiques (spontanées ou sous traitement) ;
-
•
la pathologie suspectée requiert des examens complémentaires qui viennent soit confirmer, soit récuser le diagnostic. S'il n'existe pas (ou plus) d'orientation :
-
•
si l'enfant n'inspire aucune inquiétude : fièvre parfaitement tolérée, enfant ou nourrisson continuant à manger, à boire, dormir et jouer normalement, il est nécessaire de recourir à un minimum d'examens complémentaires (fig. 18.7 ) ;
-
•
si l'état de l'enfant n'est pas totalement satisfaisant, il faut discuter l'éventualité d'une hospitalisation (si possible de jour) ; aux examens précités, il convient alors de rajouter des hémocultures et une ponction lombaire (au moindre doute).
Fig 18.7.

Orientation diagnostique générale devant une fièvre prolongée de l'enfant.
À ce stade, si ces premiers examens, la reprise de l'interrogatoire et un nouvel examen clinique n'ont pas permis de rattacher cette fièvre à une cause, d'autres examens sont nécessaires (cf. fig. 18.7).
S'il existe un syndrome inflammatoire, trois grands groupes de causes doivent être envisagés :
-
•
les maladies infectieuses, localisées ou généralisées (fig. 18.8 ) ;
-
•
les maladies inflammatoires (fig. 18.9 ) ;
-
•
les hémopathies et les tumeurs (fig. 18.10 ).
Fig 18.8.

Fièvre prolongée : principales causes infectieuses.
Fig 18.9.
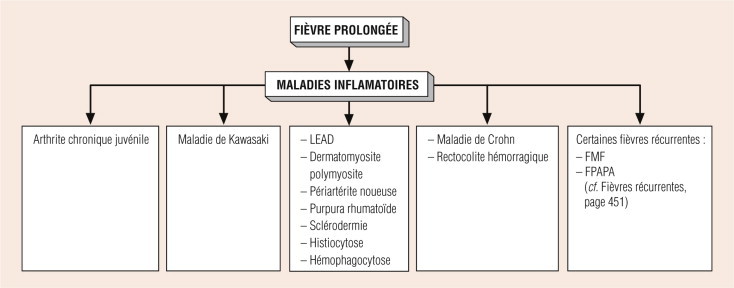
Fièvre prolongée : causes inflammatoires.
LEAD : lupus érythémateux aigu disséminé ; FPAPA : Periodic Fever, Aphtous stomatitis, Pharyngitis, cervical Adenitis.
Fig 18.10.

Fièvre prolongée : hémopathies, tumeurs.
S'il n'existe pas de syndrome inflammatoire, on discute :
-
•
une thermopathomimie ;
-
•les fièvres médicamenteuses : leur diagnostic d'élimination repose sur un interrogatoire minutieux portant sur :
-
–le terrain : elles se voient le plus souvent chez des sujets allergiques,
-
–la chronologie : disparition de la fièvre dans les 24-48 heures après l'arrêt du produit en cause,
-
–les drogues en cause : essentiellement les antibiotiques et tout particulièrement les bêtalactamines. Il faut également citer les barbituriques, les anticholinergiques, les phénothiazines, etc. En fait, virtuellement, n'importe quel médicament peut entraîner des réactions allergiques dont la fièvre ;
-
–
-
•
d'autres causes, exceptionnelles (fig. 18.11 ) ;
-
•enfin, une fièvre parfaitement isolée et bien tolérée fait discuter une « hyperthermie non pathologique » liée :
-
–soit à un niveau de thermorégulation déplacé vers le haut (tout se passe comme si le sujet était « programmé » pour une température normale à 38 °C au lieu de 37 °C),
-
–soit à un rythme circadien exagéré (peut se voir chez les adolescents des deux sexes présentant une température en fin de journée supérieure à la normale).
-
–
Fig 18.11.

Autres causes (rares) de la fièvre prolongée.
Ces diagnostics restent cependant des diagnostics d'élimination, et l'évolution peut les démentir.
Fièvre prolongée du nourrisson
Données générales
Une fièvre est estimée prolongée chez un nourrisson lorsqu'elle dépasse une durée de 5 jours.
Les causes habituelles de fièvre prolongée, chez le nourrisson, restent majoritairement infectieuses (75 % des infections prouvées ou probables).
Les causes habituelles d'infections prouvées sont les pyélonéphrites aiguës à diagnostic retardé, les otites à pneumocoque résistant à la pénicilline (échec thérapeutique), les pneumopathies à symptomatologie clinique respiratoire retardée (cliché thoracique différé) ou en échec d'un traitement antibiotique initial inadapté (infection pulmonaire à Mycoplasma pneumoniae).
La succession infection virale – pyélonéphrite aiguë mérite d'être connue.
Les infections à Parvovirus B19 sont probablement une cause fréquente parmi les infections virales induisant une fièvre prolongée.
La plupart des fièvres prolongées avec syndrome inflammatoire franc liées à une maladie systémique sont rapportées au syndrome de Kawasaki dont l'expression peut être paucisymptomatique. Certaines fièvres prolongées du nourrisson peuvent également témoigner du début d'une fièvre récurrente (cf. page 451).
Conduite à tenir pratique
Toujours :
-
•
enquête anamnestique complète : origine ethnique, statut vaccinal, contage infectieux surtout (entourage, crèche) ;
-
•
analyse de la courbe thermique (date et modalités de début, morphologie de la courbe, réponse aux traitements antihyperthermiques) ;
-
•
examen clinique complet.
Examens de débrouillage éventuels au 5e jour. Ils sont limités et ciblés :
-
•
NFS + plaquettes (orientation possible vers une cause bactérienne ou virale) ;
-
•
dosage de la protéine C réactive (syndrome inflammatoire). Elle est le plus souvent peu élevée ou normale en cas de « virose » de durée inhabituelle ;
-
•
examen cytobactériologique urinaire (pyélonéphrite aiguë à confirmation retardée) ;
-
•
radiographie du thorax en cas de pneumopathie avec examen pulmonaire initialement normal.
Ces examens complémentaires peuvent être renouvelés et complétés en cas de fièvre persistante inexpliquée au terme de 8-10jours d'évolution.
L'orientation dépend alors de la persistance ou non du syndrome inflammatoire :
-
•en cas de syndrome inflammatoire prédominant : examens d'imagerie :
-
–échocardiographie à la recherche d'un anévrisme coronarien (Kawasaki),
-
–échographie abdominale à la recherche d'adénopathies intrapéritonéales (tuberculose et maladie des griffes du chat, plus que lymphome) ;
-
–
-
•en l'absence de syndrome inflammatoire : examens sérologiques :
-
–avant tout, sérologie à Mycoplasma pneumoniae complétée si besoin par examen par PCR,
-
–sérologies : Epstein-Barr, maladie des griffes du chat, infections à salmonelles, brucellose.
-
–
Au 10e jour de fièvre, selon des données cliniques ou biologiques plus précises :
-
•
médullogramme ; scanner cérébral (abcès cérébral) ;
-
•
scintigraphie osseuse (ostéoarthrite).
Le pronostic des fièvres prolongées du nourrisson dont les causes sont habituellement bénignes est le plus souvent excellent.
BIBLIOGRAPHIE
- Bourrillon A. Conduite à tenir devant une fièvre prolongée du nourrisson. Arch Pédiatr. 1999;6(3):530. doi: 10.1016/s0929-693x(99)80276-0. 5. [DOI] [PubMed] [Google Scholar]
Fièvres récurrentes
V. Hentgen
Définitions
Fièvre récurrente
La fièvre récurrente est caractérisée par des épisodes de fièvre de durée spontanément limitée dans le temps séparés par des intervalles d'apyrexie de durée variable, se reproduisant pendant des mois, voire des années. Tous les épisodes de fièvre au cours d'une fièvre récurrente sont d'étiologie unique.
Fièvre récidivante (ou fièvre à répétition)
Toutes les fièvres ne répondant pas à tous les critères de la définition de fièvre récurrente sont à considérer comme des fièvres récidivantes (ou fièvres à répétition).
Démarche diagnostique
Au cours de sa vie, l'enfant va contracter de nombreuses pathologies qui génèrent de la fièvre, ce qui rend la notion de fièvre « à répétition » difficile à appréhender en pédiatrie. Le sentiment des parents que la fièvre est « trop fréquente » peut être une aide pour évoquer le diagnostic de fièvre récurrente. Néanmoins cette notion est dépendante de l'anxiété de la js famille, car la fièvre de l'enfant génère trop souvent une angoisse excessive et peut entraîner une demande d'explorations invasives et inutiles, alors que le plus souvent elle s'intègre dans le parcours normal de l'enfant qui se familiarise avec son environnement antigénique.
Toute la difficulté du rôle de médecin de l'enfant sera donc de rassurer les familles lorsque la fièvre signe les infections banales de la petite enfance, mais aussi de dépister les rares cas où la fièvre qui revient est effectivement un avertissement d'une pathologie plus grave qui nécessite une attention, si ce «s n'est un traitement particulier.
1re étape : affirmer le caractère récurrent ou non de la fièvre « qui revient »
Interrogatoire et anamnèse
L'interrogatoire s'efforce de confirmer le tableau de fièvre récurrente et d'éliminer les pathologies responsables d'une fièvre récidivante :
-
•
rechercher les caractéristiques précises des épisodes fébriles (date d'apparition, nombre, stéréotypie, signes d'accompagnement, caractère spontanément limité dans le temps, etc.) ;
-
•
rechercher des éventuels symptômes en dehors des épisodes fébriles ;
-
•
établir une courbe de croissance.
Examen clinique et examens complémentaires
L'examen clinique de l'enfant doit idéalement être fait pendant et en dehors d'un épisode de fièvre ; de la même manière, certains examens complémentaires devraient être effectués pendant l'épisode fébrile, alors que d'autres plutôt en dehors de la fièvre (tableau 18.6 ). Ces examens ne sont pas exhaustifs et doivent être complétés par des examens plus spécifiques (tels qu'échographie abdominale ou rénale par exemple) au moindre signe d'appel et d'orientation après cette 1re étape diagnostique.
Tableau 18.6.
Bilan minimal à effectuer en dehors et pendant une poussée fébrile.
| Bilan minimal à effectuer pendant une poussée fébrile | Bilan minimal à effectuer en dehors d'une poussée fébrile |
|---|---|
| NFS, plaquettes CRP (± procalcitonine) Hémoculture ECBU Radiographie de thorax |
NFS, plaquettes CRP VS (à jeun) lonogramme sang, urée, créatinine Bilan hépatique complet IgG, A, M ± bilan immunitaire de débrouillage (sérologies vaccinales, complément, phénotypage lymphocytaire, étude du PNN) |
Éliminer toutes les pathologies qui ne sont pas des fièvres récurrentes
Cette première étape permettra de poser dans la majorité des cas un diagnostic et d'éliminer un certain nombre de pathologies responsables de fièvre à répétition :
-
•
fièvres récidivantes infectieuses telles qu'infections ORL à répétition, viroses banales récidivantes (crèche), malformation urinaire, abcès profond, endocardite, etc. ;
-
•
infections récidivantes sur terrain particulier (déficit immunitaire ou neutropénie cyclique par exemple) ;
-
•
maladie tumorale ;
-
•
maladies de système se présentant sous une forme intermittente (arthrite juvénile idiopathique dans sa forme systémique, etc.).
2e étape : affirmer le caractère auto-inflammatoire de la fièvre récurrente
La notion de maladie auto-inflammatoire est apparue dans la littérature après la découverte des gènes impliqués dans les fièvres récurrentes héréditaires. Il s'agit d'un groupe de maladies pour lesquels il existe un dérèglement du système immunitaire « archaïque », c'est-à-dire de la première réponse immunitaire non spécifique. Cette anomalie se situe principalement au niveau des monocytes et polynucléaires neutrophiles et se traduit par une stimulation excessive de ces derniers. Par définition, un malade atteint d'une maladie auto-inflammatoire ne produit ni des autoanticorps spécifiques, ni des lymphocytes activés par un antigène spécifique. En pratique il n'existe pas de test spécifique pour retenir le diagnostic de maladie autoinflammatoire. Néanmoins la présence d'un syndrome inflammatoire non spécifique (élévation de la CRP et polynucléose neutrophile) en l'absence de marqueurs d'auto-immunité ou autoréactivité T permet de s'orienter vers le caractère autoinflammatoire de la symptomatologie. Par ailleurs au cours des fièvres récurrentes, ce syndrome inflammatoire doit spontanément régresser en dehors des épisodes fébriles.
3e étape : orienter le diagnostic vers une fièvre récurrente héréditaire (FRH)
L'interrogatoire s'efforce de trouver des facteurs de risque ou des signes cliniques permettant d'orienter le diagnostic soit vers une des quatre fièvres récurrentes héréditaires actuellement connues, soit vers les fièvres récurrentes spécifiques de l'enfant (tableau 18.7 ) :
-
•
FMF ou fièvre méditerranéenne familiale anciennement appelée maladie périodique ;
-
•
CAPS ou pathologies liées à la cryopyrine qui regroupe le CINCA, le syndrome de Muckle-Wells et le FCAS ;
-
•
MKD (déficit en mévalonate-kinase) anciennement appelé HIDS (syndrome d'hyper-IgD) ;
-
•
TRAPS (pathologies liées au récepteur du TNF) ;
-
•
syndrome de Marshall ou PFAPA (Periodic fever, aphtous stomatitis pharyngitis, cervical adenitis), pathologie exclusivement pédiatrique, sporadique, et non héréditaire.
Tableau 18.7.
Principales caractéristiques des fièvres récurrentes héréditaires.
| Syndrome | FMF | MKD = HIDS | TRAPS | CAPS | PFAPA |
|---|---|---|---|---|---|
| Hérédité | Autosomique récessif | Autosomique récessif | Autosomique dominant | Autosomique dominant ou sporadique | Aucune |
| Gène impliqué | MEFV codant la pyrine/ marenostrine | Gène de la mévalonatekinase | Gène du 1er récepteur du TNF | CIAS1 codant la cryopyrine | ? |
| Populations prédisposées | Pourtour méditerranéen et Moyen-Orient | Europe Probablement ubiquitaire |
Ubiquitaire | Ubiquitaire | Ubiquitaire |
| Âge de début | Habituellement avant 10 ans | 1re année de vie | Avant 20 ans | 1re année de vie | Après 1 an avant 5 ans |
| Durée des accès | 12 à 72 heures | 5 à 7 jours | Variable, > 7 jours | Variable, > 5 jours | 4 à 5 jours |
| Signes abdominaux | Tableau de péritonite aseptique | Douleurs abdominales | Douleurs abdominales | Non | Parfois douleurs abdominales |
| Signes articulaires | Arthrites Arthralgies Myalgies |
Arthrites Arthralgies | Arthrite Arthralgies Myalgies localisées |
Arthrites +++ Arthralgies |
Non |
| Douleurs thoraciques | Oui | Non | Oui | Non | Non |
| Signes cutanés | Pseudo-érysipèle Bursite | Aphtose buccale Exanthème tronc |
Pseudo-cellulite Œdème des paupières Exanthème polymorphe |
Urticaire diffus | Stomatite : aphtose buccale |
| Adénopathies | Non ou rares | Cervicales +++ | Non | Non | Cervicales +++ |
| Autres signes | Atteinte neurologique sévère (méningite chronique) | Pharyngite ou amygdalite aseptique | |||
| Signes biologiques spécifiques | ? | Mévolonaturie pendant les poussées | ? | ? | ? |
| Complications et évolution spontanée de la maladie | Amylose secondaire Stérilité en l'absence de traitement |
Amylose secondaire (rare) Colite inflammatoire | Amylose secondaire | Amylose secondaire | Guérison avant l'adolescence sans séquelles |
| Traitement | Colchicine | Corticoïdes Inhibiteur IL-1 (anakinra) |
Corticoïdes Inhibiteur TNF Inhibiteur IL-1 (anakinra) |
Corticoïdes Inhibiteur IL-1 (anakinra) |
Corticoïdes Amygdalectomie + ablation des végétations |
L'arbre généalogique détaillé avec les origines précises du patient est souvent utile. En cas d'origine méditerranéenne de l'enfant, il est licite de demander un dépistage génétique à la recherche de mutations dans le gène MEFV, gène impliqué dans la fièvre méditerranéenne familiale. En fonction du résultat de cette génétique ainsi que du remplissage ou non des critères cliniques simplifiés de Livneh (encadré 18.7 ), qui ne sont applicables que pour une population originaire méditerranéenne avec prévalence élevée de la maladie, le diagnostic de fièvre méditerranéenne familiale est retenu ou rejeté. Pour l'interprétation détaillée des résultats de la génétique combinés aux critères cliniques de Livneh, se reporter à la figure 18.12 .
Encadré 18.7.
Critères de Livneh pour le diagnostic de la maladie périodique
Critères majeurs
-
–
Péritonite (généralisée).
-
–
Pleurite (unilatérale) ou péricardite.
-
–
Monoarthrite (hanche, genou, cheville).
-
–
Fièvre isolée.
Critères mineurs
-
–Attaques incomplètes sur un ou plusieurs sites :
-
-abdomen,
-
-poumon,
-
-articulation.
-
-
-
–
Douleur des jambes induite par effort.
-
–
Réponse à la colchicine.
Diagnostic positif de fièvre méditerranéenne familiale
Présence d'au moins 1 critère majeur, ou au moins 2 critères mineurs au cours de 4 à 6 épisodes de fièvre inexpliquée.
Fig 18.12.

Démarche diagnostique devant un enfant d'origine méditerranéenne.
Pour les enfants qui n'ont pas d'ascendance méditerranéenne, la fièvre méditerranéenne familiale est exceptionnelle, ce qui fait que le test génétique de la FMF ne doit pas être effectué en première intention dans cette population. Par ailleurs les critères cliniques de Livneh ne sont pas validés dans une population à faible prévalence de FMF, ce qui les rend obsolètes dans une population non méditerranéenne. La démarche diagnostique dans cette population se fonde donc sur d'autres critères qui sont détaillés dans la figure 18.13 . Cet arbre de conduite à tenir est aussi applicable à un enfant d'origine méditerranéenne pour lequel on a rejeté le diagnostic de FMF et évoqué le diagnostic de fièvre récurrente d'une autre origine. Par ailleurs à ce stade du raisonnement doit intervenir la possibilité d'être en présence d'un enfant atteint d'un PFAPA. Les critères cliniques de ce dernier sont détaillés dans le tableau 18.8 . Noter néanmoins qu'il existe une forme atténuée de ce syndrome nommé par certains auteurs « fièvre récurrente bénigne de l'enfant ». Ce syndrome se caractérise par :
-
•
le jeune âge (médiane 2 ans) ;
-
•
une montée thermique brutale à 39-40 °C ;
-
•
la bonne tolérance de la fièvre ;
-
•
le caractère isolé : absence d'adénopathies ou d'éruption, des amygdales ayant un aspect et volume normal ;
-
•
une réponse thermique incomplète aux antithermiques et nulle aux antibiotiques.
Fig 18.13.

Démarche diagnostique devant un enfant d'origine non méditerranéenne.
Tableau 18.8.
Critères cliniques d'un syndrome de Marshall (ou actuellement PFAPA).
| Diagnostic positif de PFAPA si les 6 critères majeurs sont remplis | |
|---|---|
| I | Fièvre récurrente périodique avec un âge de début précoce (entre 12 mois et 5 ans] |
| II | Présence d'au moins un des trois signes suivants, en l'absence de toute atteinte des voies respiratoires supérieures : stomatite aphteuse adénopathies cervicales pharyngite |
| III | Présence de marqueurs d'inflammation pendant les accès |
| IV | Exclusion d'une neutropénie cyclique, ainsi que des autres syndromes récurrents |
| V | Enfant totalement asymptomatique en dehors des accès |
| VI | Développement psychomoteur et croissance normale |
Le diagnostic de ce syndrome, aux épisodes fébriles prévisibles et probablement relié à celui de PFAPA, ne peut être évoqué qu'au terme de 8 à 10 épisodes annuels identiques et totalement dissociés d'épisodes d'infections des voies aériennes supérieures. La guérison est assurée dans la majorité des cas par amygdalectomie.
En guise de conclusion
La démarche diagnostique devant une fièvre récurrente est complexe. Le rôle du médecin de l'enfant est de dépister les rares cas de fièvres récurrentes héréditaires, sans pour autant oublier qu'un enfant normal qui entre en collectivité a de multiples raisons pour souffrir d'une fièvre à répétition. Le médecin confronté à ces fièvres a la lourde tâche de trouver le juste milieu entre banaliser le symptôme observé et faire des explorations invasives – et chères – afin de poser coûte que coûte un diagnostic. Le problème devient encore plus complexe si l'on considère qu'un certain nombre d'enfants sont atteints d'une réelle fièvre récurrente autoinflammatoire pour lesquels la génétique est non contributive. Seul un suivi prolongé et attentif permettra éventuellement à ces enfants d'accéder à un diagnostic, mais le problème du traitement pour ces enfants n'est pas près d'être résolu dans un avenir proche.
Maladie de Kawasaki
Introduction, épidémiologie
La maladie de Kawasaki (MK) est la plus fréquente des vascularites observée avant l'âge de 5 ans. Sa prévalence est très importante en Asie où elle a été décrite pour la première fois en 1967 par Tomisaku Kawasaki sous la forme d'un syndrome fébrile, cutanéo-muqueux et ganglionnaire pouvant se compliquer d'anévrismes coronaires. La MK est considérée comme la première cause de cardiopathie acquise à l'âge pédiatrique. La maladie de Kawasaki semble prédominer nettement en extrême orient avec une tendance à l'augmentation. Bien que cette affection reste prédominante au Japon (en 2005, l'incidence annuelle était de 184,6/100 000 chez les enfants < 5 ans), à Hawaï (incidence annuelle : 41,6/100 000 ; la plus élevée chez les Asiatiques : >> Japonais > Chinois > Hawaïens autochtones > Philippins) et aux États-Unis (incidence : 19,6/100 00). En Europe on dispose de données anglaises semblant correspondre à un plateau annuel de 8,3/10 000. En France, l'épidémiologie de la maladie de Kawasaki n'a jamais été évaluée de façon systématique mais on estimait en 1998 par une étude rétrospective à environ 200 le nombre de nouveaux cas décrits annuellement. Des épidémies localisées, à prédominance saisonnière (février à mai), sont signalées, en particulier aux États-Unis.
Il s'agit essentiellement d'une affection du nourrisson et du jeune enfant : 80 % des cas rapportés concernent des enfants de moins de 5 ans avec un pic d'incidence de la maladie vers l'âge de 1 an. Celle-ci est plus rare avant l'âge de 3 mois et très rare chez les adolescents et les adultes. La prédominance masculine (sexe ratio = 1,5 à 1,8) est un autre fait épidémiologique remarquable.
Données étiologiques et physiopathologiques
L'étiologie est encore inconnue mais s'oriente sur la piste d'un virus « non classique ».
Les signes cliniques de la MK ainsi que sa périodicité saisonnière évoquent une infection par un pathogène ubiquitaire mais qui peut être prévalent dans certaines régions du globe. Ainsi de nombreux pathogènes ont été suspectés : Yersinia enterocolitica, staphylocoques et streptocoques producteurs de toxines superantigènes et, parmi les virus, les coronavirus, les adénovirus, le virus d'Epstein-Barr, les parvovirus et certains herpès virus. Les travaux les plus importants et les plus convaincants sont ceux de l'équipe de A.H. Rowley qui travaille depuis plusieurs années à la mise en évidence d'un agent viral pouvant infiltrer les poumons et le tube digestif des malades ayant une MK. L'observation initiale d'un infiltrat d'IgA présentant un répertoire CDR3 restreint dans les tissus enflammés (y compris les coronaires) a orienté vers une réponse spécifique à un antigène persistant. Des expériences d'immunohistochimie ont montré que ces anticorps détectaient des antigènes cytoplasmiques sous formes d'inclusions pouvant correspondre à des agrégats de protéines virales et d'acides nucléiques, ce qui est compatible avec l'implication possible d'un virus à ARN encore inconnu. La réponse immunitaire de l'hôte semble aussi importante. Elle implique une hyperactivité de l'immunité innée en particulier les leucocytes par le biais des Toll-like récepteurs (ou des NLR : NOD-Like Receptors) qui pourraient reconnaître ce pathogène et entraîner l'activation de NFKB (Nuclear Factor KB), ainsi par le système de la NO-synthase mais aussi une dysrégulation de l'immunité acquise via les lymphocytes T CD4 (IL-2R, IL-6, TNF). Il a été démontré que la présence d'une monocytose après perfusion d'Ig IV était un facteur de risque de développer des anévrismes coronaires alors que la présence d'une éosinophilie était protectrice, en relation avec la sécrétion de cytokines de type TH2. Des facteurs génétiques semblent aussi impliqués et des études wide-genome de dimension internationale sont en cours de lancement. Plusieurs cas de maladie de Kawasaki au décours d'une vaccination ont été publiés ou rapportés en pharmacovigilance mais, à notre connaissance, aucune étude n'a évalué l'association entre la vaccination et le risque de survenue de la maladie de Kawasaki.
Aspects cliniques
Symptômes principaux
La description initiale de la maladie comporte six manifestations cliniques principales, pour la plupart dermatologiques, qui vont signer le diagnostic sans pour autant être spécifiques décrites dans le tableau convient d'insister sur l'élément chronologique : l'apparition des symptômes s'étend sur plusieurs semaines, la fièvre est la première manifestation (tableau 18.9 ). Une desquamation périnéale dans les premiers jours de la maladie peut permettre un diagnostic précoce. La conjonctivite non purulente, l'atteinte des muqueuses (stomatites, chéilites, fig. 18.14 ), un érythème au niveau de la cicatrice du BCG et l'adénite cervicale sont également des manifestations précoces. Les adénopathies cervicales banales ne font pas partie de la maladie et seule peut être retenue comme critère de l'affection la présence d'un gros ganglion cervical douloureux de type pseudoadénophlegmon. Les modifications des extrémités sont plus tardives, dans la 2e semaine. La desquamation (fig. 18.15 ) survient plus tard et se fait en doigts de gants. On décrit encore plus tardivement, dans le 2e mois, l'apparition de stries transversales sur les ongles, véritable signature rétrospective de la maladie.
Tableau 18.9.
Principales manifestations de la maladie de Kawasaki.
| Symptômes principaux | Autres symptômes |
|---|---|
| Fièvre sans étiologie connue durant depuis 5 jours ou plus (95 %] Conjonctivite bilatérale (88 %) Modifications bucco-pharyngées :
Modification des extrémités :
Éruption polymorphe du tronc (92 %) Tuméfaction des ganglions cervicaux (plus de 1,5 cm de diamètre) sans suppuration (75 %) |
Atteinte cardiaque, en particulier myocardite et péricardite, atteinte de vaisseaux de moyen calibre autres que coronaires, régurgitations valvulaires Érythème du périnée avec desquamation Érythème et induration de la cicatrice du BCG Phénomène de Raynaud, gangrène périphérique Diarrhée, hydrocholécyste Arthralgies ou arthrites Irritabilité extrême, méningite aseptique, surdité de perception Urétrite, méatite Uvéite Modifications biologiques :
|
Fig 18.14.

Maladie de Kawasaki : chéilite.
Fig 18.15.

Maladie de Kawasaki : desquamation du siège.
Autres manifestations
Elles sont également décrites dans le tableau 18.9. Parmi les manifestations cliniques, l'hydrocholécyste n'est pas exceptionnel : il se révèle par un tableau douloureux abdominal avec parfois une masse palpable. Le diagnostic est échographique. Bien qu'il n'existe pas de stigmate biologique spécifique, le syndrome inflammatoire (VS, CRP) est toujours marqué, précoce et prolongé. La polynucléose est une manifestation précoce quasi constante, alors que l'hyperplaquettose, qui peut atteindre 2 millions/mm3, est maximale au cours des 2e-3e semaines et persiste 1 à 4 mois.
Diagnostic
Diagnostic clinique
Le diagnostic de la maladie reste exclusivement clinique (encadré 18.8 ) : il exige la présence d'au moins cinq des critères majeurs : une fièvre ≥ 5 jours et ≥ 4 des 5 signes cliniques principaux : modifications des extrémités, exanthème polymorphe, conjonctivite bulbaire bilatérale non exsudative, érythème des lèvres ou de la cavité orale, lymphadénopathies cervicales habituellement unilatérales > 1,5 cm de diamètre. En présence de moins de 4 critères cliniques et de 5 jours de fièvre, le diagnostic de maladie de Kawasaki est proposé devant l'existence d'anomalies coronaires, et l'exclusion des autres syndromes adénocutanéomuqueux, en particulier d'une infection streptococcique.
Encadré 18.8.
Critères de diagnostic de la maladie de Kawasaki
-
–
Fièvre ≥ 5 jours
-
–≥ 4 des 5 signes cliniques principaux :
-
-modification des extrémités ;
-
-exanthème polymorphe ;
-
-conjonctivite bulbaire bilatérale non exsudative ;
-
-érythème des lèvres ou de la cavité orale ;
-
-lymphadénopathies cervicales habituellement unilatérales > 1,5 cm de diamètre.
-
-
-
–
Si moins de 4 critères cliniques et 5 jours de fièvre, le diagnostic se fait en présence d'anomalies coronaires.
En présence d'au moins 4 des critères principaux, le diagnostic de MK peut être porté à J4 de la maladie. Les cliniciens expérimentés ayant traité beaucoup de MK peuvent établir le diagnostic avant J4.
D'après Newburger J et al. Diagnosis, Treatment, and Long-Term Management of Kawasaki Disease. Pediatrics 2004.
Les difficultés attenantes à cette définition sont liées à l'existence même de patients ne regroupant pas tous les critères et présentant des anomalies coronariennes (maladie de Kawasaki incomplète : MKI). Ces formes incomplètes sont le sujet d'un nombre croissant d'articles scientifiques, mais une définition claire et précise de ces cas potentiellement à risque manque encore à l'heure actuelle.
Diagnostic différentiel
Il est indiqué dans l'encadré 18.9 .
Encadré 18.9.
Diagnostics différentiels de la maladie de Kawasaki
-
–
Infections virales (rougeole, adénovirus, entérovirus, Epstein-Barr virus).
-
–
Scarlatine.
-
–
Staphylococcal scalded skin syndrome.
-
–
Syndrome de choc toxinique.
-
–
Lymphadénopathies bactériennes.
-
–
Réactions d'hypersensibilité médicamenteuse.
-
–
Syndrome de Stevens-Johnson.
-
–
AJI systémique (maladie de Still).
-
–
Fièvre boutonneuse.
-
–
Leptospirose.
-
–
Intoxication mercurielle (acrodynie).
D'après Newburger J et al. Diagnosis, Treatment, and Long-Term Management of Kawasaki Disease. Pediatrics 2004.
Manifestations cardiovasculares
Elles font toute l'originalité et la gravité de la maladie. Elles surviennent classiquement dans 60 à 80 % des cas, mais pourraient être constantes, comme cela a été montré par des biopsies endomyocardiques systématiques.
Il convient de distinguer :
-
•
les formes précoces (10 premiers jours) avec myocardites, régurgitations valvulaires (19 %), épanchements péricardiques (13 %), épisodes d'arythmie, épisodes hypotensifs, insuffisances cardiaques aiguës et infarctus myocardiques (1-2 %) ;
-
•
l'atteinte coronarienne plus tardive (2 à 4 semaines). L'incidence est très variable selon les séries, en moyenne 15 à 20 % des cas. Des facteurs prédictifs ont été identifiés : sexe masculin, enfants âgés de moins de un an ou de plus de 8 ans, CRP > 200 mg/L, albuminémie < 35 g/L, plaquettes > 350 0000/mm3, retard à la mise en route du traitement par immunoglobulines intraveineuses ou à dose insuffisante, récurrence de la maladie de Kawasaki. La topographie de ces anévrismes concerne le plus fréquemment les segments proximaux de l'interventriculaire antérieure et de la coronaire droite. Actuellement, il s'agit le plus souvent d'une découverte par une échocardiographie bidimensionnelle systématique (fig. 18.17 ). À un degré de plus, il s'agit de véritable anévrisme unique ou multiple qui peut régresser ou se compliquer de thrombose, d'infarctus, de rupture, de myocardiopathie ischémique ou de mort subite.
Fig 18.17.

Maladie de Kawasaki : anévrisme coronaire.
Des anévrismes peuvent moins souvent affecter les gros troncs, plus rarement les artères de moyen calibre, souvent de manière symétrique. On a également rapporté des gangrènes distales par atteinte des artères de petit calibre. Même après régression des anévrismes, la paroi vasculaire reste plus rigide qu'une paroi vasculaire saine, avec un certain degré d'épaissisf sement de l'intima, de dysfonction endothéliale et une réponse altérée aux agents vasodilatateurs, caractéristiques proches de celles observées dans les lésions athéromateuses débuts tantes de l'athérosclérose de l'adulte. L'évolution de ces anévrismes dépend de leur taille et de leur morphologie : une régression complète est observée dans 50 % des cas, uniquement pour les dilatations ou les anévrismes modérés, et survient dans les 2 premières années d'évolution ; une sténose apparaît dans 20 % des cas et les anévrismes persistent sans sténose dans 40 % des cas. Les anévrismes géants ne régressent jamais, la moitié environ développant une sténose ou une obstruction complète. Le développement d'une cardiopathie ischémique à l'âge adulte a été estimé à environ 5 %. La MK peut donc revêtir le profil d'une maladie chronique, ce qui implique qu'un suivi cardiovasculaire prospectif de patients ayant développé ou non des complications cardiaques soit nécessaire et devrait comprendre l'utilisation de moyens d'imagerie coronaire les plus modernes.
Évolution et pronostic
La maladie de Kawasaki guérit classiquement au terme d'une évolution qui atteint souvent 4 à 5 semaines. Les récidives sont rares (environ 3 %).
La mortalité est variable selon les études mais toujours < 1 % depuis que les formes bénignes sont systématiquement reconnues. La mortalité est liée aux anévrismes coronariens. Classiquement, la mort est volontiers subite et inattendue à la période de convalescence. Cependant, des décès ont été rapportés très à distance, chez des sujets dont l'atteinte cardiaque était restée asymptomatique.
La surveillance est essentiellement échocardiographique, cet examen s'imposant :
-
•
dès l'évocation du diagnostic ;
-
•
puis tous les 15 jours jusqu'à la 6e semaine ;
-
•
la nécessité d'une surveillance ultérieure est évaluée en fonction de l'existence ou non d'anomalies coronariennes à la période initiale.
Traitement
Aucun traitement antibiotique n'est nécessaire et celui-ci doit être arrêté lorsque le diagnostic est établi.
En fait, le traitement repose sur l'association d'aspirine et de gammaglobulines dont le but est de :
-
•
contrôler la fièvre et le syndrome inflammatoire ;
-
•
prévenir l'apparition d'anévrismes ;
-
•
faire régresser et disparaître ceux-ci si déjà constitués.
Le traitement reconnu actuellement comme le gold standard est l'utilisation d'immunoglobulines IV à la dose de 2 g/kg associée à 80 à 100 mg/kg/jour d'acide acétylsalicylique dans la phase aiguë. Par la suite, la plupart des équipes nordaméricaines diminuent la dose d'acide acétylsalicylique à une dose antiagrégante (3-5 mg/kg/jour) après 48 à 72 heures d'apyrexie et pendant une durée de 6 semaines ou plus en présence d'anomalies coronaires. La majorité des enfants répond à ce traitement cependant, 10 à 20 % d'entre eux ont une persistance ou une récurrence de la fièvre dans les 48 heures suivant le traitement conventionnel. Bien que la plupart de ces patients réponde à une nouvelle perfusion d'Ig IV, un certain nombre (jusqu'à un tiers) reste réfractaire au traitement standard. Les corticoïdes, d'abord bannis du traitement de la MK puis utilisés dans la phase aiguë avant l'aire des Ig IV, sont maintenant réservés à certains cas particuliers. L'addition à la phase aiguë de corticoïdes IV au traitement standard associant Ig IV et acide acétylsalicylique ne semble apporter aucun bénéfice. En revanche, les corticoïdes semblent être utiles dans les formes non contrôlées par le traitement conventionnel où ils permettent dans la plupart des cas d'améliorer les symptômes persistants. Ces données demandent à être confirmées par une étude prospective bien conduite. Le peu d'évidence du bénéfice apporté par les corticoïdes et le coût élevé des Ig IV font discuter des alternatives thérapeutiques. Une étude ouverte analysant un traitement par 5-10 mg/kg d'infliximab (anticorps monoclonal anti-TNF) proposé en 2e intention après un échec du traitement par Ig IV chez 16 patients dont 11 avaient des complications cardiaques a permis une réponse clinique complète chez 13 d'entre eux avec régression des dilatations coronaires chez 4 des 11 patients atteints.
Les cas de MK résistant aux Ig IV sont associés plus fréquemment à la présence d'anévrisme. Un score de prédiction à résistance aux Ig IV a été proposé par Egami et al. Il inclut : NRS < 6 mois (1), diagnostic fait avant 4 jours (1), plaquettes < 300 000/mm3 (1), CRP > 80 mg/L (1), ALAT > 80 UI/L (2). Un score > 3 prédisait chez ces patients une résistance aux Ig avec une sensibilité de 78 % et une spécificité de 76 %. Ces scores méritent d'être validés de manière prospective dans d'autres séries pédiatriques différant en particulier par l'origine géographique et l'origine ethnique.
À retenir
La maladie de Kawasaki comme une vascularite à reconnaître rapidement, essentiellement sur des éléments cliniques, car ses complications cardiaques fréquentes et graves :
-
–
représentent la première cause de cardiopathie ischémique acquise chez le sujet jeune et induisent donc une maladie chronique ;
-
–
peuvent être prévenues par l'instauration rapide d'un traitement par immunoglobulines intraveineuses.
BIBLIOGRAPHIE
- Galeotti C., Bayry J., Kone-Paut I., Kaveri S.V. Kawasaki disease : Aetiopathogenesis and therapeutic utility of intravenous immunoglobulin. In: Autoimmun RevfKawasaki T., Kosaki F., Okawa S., editors. A new infantile acute febrile mucocutaneous lymph node syndrome (MLNS) prevailing in Japan. Vol. 54. 1974. p. 271. (Pediatrics). 6. [PubMed] [Google Scholar]
- Newburger J.W., Takahashi M., Gerber M.A. Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Diagnosis, treatment, and long-term management of Kawasaki disease : a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Pediatrics. 2004;114:1708. doi: 10.1542/peds.2004-2182. 33. [DOI] [PubMed] [Google Scholar]
Adénopathies superficielles
A. Bourrillon, A. Faye
La découverte de ganglions est fréquente chez l'enfant au même titre que l'observation d'une hypertrophie amygdalienne ou de végétations adénoïdes.
Un tel constat aboutit à l'interrogation habituelle : le ganglion est-il banal ou bien le témoin d'une pathologie associée locale ou générale ?
L'inquiétude parentale devant une telle découverte est la crainte d'une hémopathie maligne, éventualité tout à fait rare en regard du caractère extrêmement fréquent des adénopathies en particulier cervicales chez l'enfant.
Attitude pratique pédiatrique devant une (des) adénophatie(s) superficielle(s)
Anamnèse
Il faut intégrer l'adénopathie dans son anamnèse :
-
•
âge de l'enfant ;
-
•terrain :
-
–infection des voies aériennes supérieures à répétitions,
-
–lésions cutanées de voisinage,
-
–animaux domestiques dans l'environnement,
-
–atopie ;
-
–
-
•circonstances de découverte :
-
–fièvre aiguë, éruptive ou non,
-
–épisodes infectieux des voies aériennes supérieures (angine) ;
-
–
-
•allure évolutive des ganglions :
-
–unique : stable ou de volume variable (extension ou régression),
-
–ou multiples : simultanés ou successifs ;
-
–
-
•
signes associés : fièvre, pâleur, asthénie ; sueurs ; prurit.
Examen du/des ganglion(s)
La palpation systématique apprécie, dans chaque territoire, s'il y a lieu et pour chaque ganglion :
-
•
la taille (adénopathie si ganglion lymphatique hypertrophié supérieur à 1 ou 2 cm selon la localisation) ;
-
•
la consistance (sensible ; douloureux ; ferme ou dur, rénitent) ;
-
•
la mobilité ;
-
•
le caractère éventuellement compressif ;
-
•
la topographie : isolée (unique) ou groupés ; diffus ou multiples ;
-
•
l'aspect cutané : périadénite, fistulisation, etc.
L'évaluation précise des régions explorées et de leurs territoires de drainage (recherche d'une porte d'entrée éventuelle) est inscrite sur un schéma daté.
Les aires explorées sont les suivantes :
-
•
cervicales (sous-mentales, sous-mandibulaires ; mastoïdiennes prétragiennes ; parotidiennes ; rétromandibulaires ; jugulocarotidiennes +++), territoires de drainage (sphère ORL +++ ; face ; cuir chevelu) ;
-
•
claviculaires : topographie habituellement redoutée : territoire de drainage : médiastin et/ou atteinte viscérale sous diaphragmatique ;
-
•
axillaires : territoire de drainage : membres supérieurs, paroi thoracique ;
-
•
inguinales et rétrocrurales : territoire de drainage : membres inférieurs, organes génitaux externes, marge anale.
Il convient de compléter cet examen local purement clinique par :
-
•un examen général à la recherche :
-
–d'une pâleur (conjonctives et muqueuses),
-
–d'une hépatosplénomégalie,
-
–d'éruptions,
-
–de signes d'atteintes musculaires ou ostéoarticulaires ;
-
–
-
•l'élimination de ce qui n'est pas une adénopathie :
-
–en tous territoires : neurinomes, fibromes, lipomes (pathologies rares),
-
–au niveau de l'aire cervicale : glande salivaire, kyste du tractus thyréoglosse, lymphangiome kystique, kystes branchiaux, ou dermoïdes, grenouillette-sus-hyoïdienne, etc. toutes lésions non exceptionnelles mais rares chez l'enfant, fibromatosis coli, (ex-hématome du sterno-cléïdo-mastoïdien) (nouveau-né ou jeune nourrisson),
-
–dans la région inguinale : abcès froid, hernie, kyste du cordon, etc.
-
–
Au terme de cet examen purement clinique, il existe deux éventualités décrites ci-après.
Adénopathie unique (fig. 18.18)
Fig 18.18.

Démarche diagnostique devant des adénopathies superficielles localisées.
-
•
Soit, cas évalué comme le plus urgent, l'adénopathie est aiguë, accompagnée de signes inflammatoires (adénite) et est supposée reliée à une cause bactérienne (avant tout staphylocoque ou streptocoque A) et nécessite un traitement antibiotique adapté (le plus souvent amoxicilline + acide clavulanique) susceptible d'induire la régression de l'adénopathie en quinze jours à trois semaines.
-
•
Soit, cas le plus fréquent, l'adénopathie est ancienne, mobile, non douloureuse, de topographie cervicale, unique ou groupée, et apparaît reliée à un foyer chronique infectieux actuel ou ancien de voisinage (ex. ORL ou dentaire).
-
•
Soit elle s'intègre dans un contexte infectieux général, précisé par l'anamnèse (maladie des griffes du chat ; infections à mycobactéries atypiques, tuberculose).
-
•
Soit, cas beaucoup plus rare, l'adénopathie est volumineuse dure, indolore, fixée, adhérente, infiltrante ou cervicale basse et peut être suspecte de malignité.
En l'absence de cause locale évidente, des examens d'orientation peuvent être proposés selon les cas :
-
•
NFS-plaquettes et frottis sanguin ; CRP ; VS ;
-
•
radiographie du thorax ;
-
•
Tubertest ± test interféron spécifique de la tuberculose (Quantiféron) ;
-
•
voire sérologie EBV complète et des griffes du chat.
Dans le contexte d'adénopathie isolée suspecte de malignité, se trouve généralement proposée d'emblée une biopsie chirurgicale (ou autre technique permettant la mise en évidence de cellules malignes, biopsie au pistolet).
Adénopathies multiples
Contexte fébrile
En contexte fébrile aigu, les pathologies recherchées sont avant tout :
-
•
des maladies infectieuses : la mononucléose infectieuse (infection à Epstein-Barr), les infections à CMV, la toxoplasmose, l'infection à VIH. Une localisation occipitale peut orienter vers le diagnostic de mononucléose infectieuse, de toxoplasmose ou de rubéole ;
-
•
les maladies inflammatoires de système ou dysimmunitaires (polyarthrite systémique), vascularite (Kawasaki, connectivites), syndrome d'activation macrophagique, granulomatose septique chronique. Dans ces étiologies, en général, d'autres signes associés orientent vers le diagnostic.
Contexte non fébrile
En contexte non fébrile, seront recherchées, en outre, les adénopathies reliées à une pathologie maligne, ce d'autant qu'il existe une hépatosplénomégalie associée.
Devant ces adénopathies atypiques n'ayant pas une orientation étiologique évidente, se situera également en première ligne l'intérêt des examens complémentaires de débrouillage déjà mentionnés :
-
•
NFS, VS, CRP, ASAT-ALAT ;
-
•
examens sérologiques : toxoplasmose, Epstein-Barr virus (sérologie complète), griffes du chat, VIH ;
-
•
radiologie du thorax ;
-
•
Tubertest.
Ici encore, la permanence d'adénopathies froides volumineuses et non intégrées à un contexte infectieux ou inflammatoire évident conduira à une biopsie chirurgicale de l'un des ganglions (fig. 18.19 ).
Fig 18.19.

Démarche diagnostique devant des adénopathies multiples.
Thérapeutiques curatives anti-infectieuses
Antibiotiques
É. Bingen
Antibiotiques utilisés en pédiatrie (liste non exhaustive)
Inhibiteurs de la synthèse de la paroi bactérienne
Bêtalactamines
Il s'agit de :
-
•
pénicilline A : amoxicilline : Clamoxyl (ou générique) (ex. traitements des angines ou pneumonies) ;
-
•
pénicilline A + inhibiteurs de pénicillinases : amoxicilline + acide clavulanique : Augmentin (ou générique) (ex. traitements des OMA ; surinfection des bronchiolites).
Céphalosporines
-
•
Céphalosporine de 1re génération (C1G) : céfaclor (Alfatil) indication pédiatrique devenue exceptionnelle chez l'enfant.
-
•
Céphalosporine de 2e génération (C2G) : céfuroxime (Zinnat) traitement rare des OMA.
-
•Céphalosporines de 3e génération (C3G) :
-
–orales :
-
–cefpodoxime-proxétil (Orelox) traitement devenu rare des OMA,
-
–céfixime (Oroken) relais du traitement par C3G injectables des infections urinaires ;
-
–
-
–injectables : ceftriaxone (Rocéphine) : céfotaxime (Claforan) : traitement initial des méningites purulentes du nourrisson (association avec la vancomycine) et des pyélonéphrites aiguës.
-
–
Glycopeptides
Vancomycine : Vancocine association aux C3G injectables en cas d'infection sévère à pneumocoque.
Inhibiteurs de la synthèse protéique 1 (macrolides, lincosamides, streptogramines)
-
•Macrolides :
-
–C14 : clarithromycine : Zeclar ;
-
–C15 : azithromycine : Zithromax ; infections à mycoplasmes ;
-
–C16 : josamycine : Josacine.
-
–
-
•
Lincosamides : clindamycine : Dalacine (voie injectable) : infections sévères à streptoccoques A.
-
•
Aminoside : gentamycine : Gentalline (voie injectable) assois ciation aux C3G si infection sévère.
Inhibiteurs de la synthèse des acides nucléiques
Ce sont :
-
•
les folates : sulfamides-triméthoprime (Bactrim) : infections urinaires basses ;
-
•
la transcription de l'ADN : rifamycine (Rifampicine) : contage d'infections invasives à méningocoque ;
-
•
l'inhibition de l'ADN gyrase : quinolones 2e et 3e générations (en pratique peu utilisés chez l'enfant sauf infections sévères).
Critères de choix d'un traitement antibiotique en pédiatrie
Le traitement antibiotique des infections en pédiatrie se distingue du traitement de l'adulte par de nombreux facteurs :
-
•
la vulnérabilité du grand prématuré et du nouveau-né aux défenses de l'organisme physiologiquement immatures ;
-
•
les risques spécifiques de complications et de localisations secondaires nécessitant une action rapide et bien adaptée ;
-
•
l'épidémiologie bactérienne sensiblement différente selon l'âge et les localisations ;
-
•
la pharmacologie particulière liée au développement compliquant la variabilité interindividuelle ;
-
•
une toxicité et une tolérance spécifiques selon les antibiotiques ;
-
•
un mode d'administration et une durée de traitement parfois différents ;
-
•
l'incidence du rôle de l'écosystème bactérien intestinal dans la survenue de septicémie d'origine endogène par translocation.
Tous ces facteurs expliquent la rigueur indispensable dans la conduite thérapeutique des infections chez l'enfant, nécessitant une antibiothérapie adaptée d'emblée au germe responsable de l'infection et une bactéricidie rapide dans le sang et au niveau du site infectieux. En pédiatrie, une corrélation a été établie entre, d'une part la densité de l'inoculum bactérien, en particulier dans le sang lors des bactériémies, et, d'autre part, le pronostic et les risques de localisations secondaires : méningites, épiglottites, arthrites. Une vitesse de bactéricidie optimale, assurant une éradication bactérienne rapide, représente ainsi un des objectifs majeurs du choix du traitement antibiotique en pédiatrie.
Le traitement des infections graves comprend enfin souvent chez l'enfant une association d'antibiotiques. Les raisons du recours à une telle association sont nombreuses :
-
•
élargissement du spectre en attendant l'identification du germe responsable de l'infection ;
-
•
diminution du risque d'émergence de mutants résistants, sélectionnés par l'emploi d'un antibiotique pour lequel le taux de mutation est supérieur à 108. C'est le cas de la rifampicine, de la novobiocine, de l'acide fusidique, des quinolones, de la fosfomycine et des céphalosporines de 3e génération en présence d'entérobactéries et de Pseudomonas aeruginosa producteurs d'une céphalosporinase chromosomique de classe I. Cependant, pour des raisons diverses, l'association n'empêche pas obligatoirement les risques de survenue de mutants résistants ;
-
•
moindre toxicité par diminution des posologies ou de la durée du traitement ;
-
•
effet synergique ou augmentation de la vitesse de bactéricidie ;
-
•
prévention de l'inactivation de l'un des deux antibiotiques avec, par exemple, un inhibiteur de bêtalactamases (acide clavulanique ou sublactam) ;
-
•
élimination des bactéries qui persistent malgré le premier antibiotique (ex : bactéries en phase de quiescence avec les bêtalactamines) à l'origine des échecs ou des rechutes.
Confronté au développement de nouvelles molécules antibiotiques, le praticien doit avoir une parfaite connaissance des critères de choix d'un traitement antibiotique de façon à sélectionner celui qui lui paraît le mieux adapté au traitement des infections en cause.
Deux types de raisonnement permettent de guider le choix thérapeutique :
-
•
la thérapeutique logique ;
-
•
la thérapeutique probabiliste.
Thérapeutique logique
La thérapeutique logique s'appuie sur les résultats de l'antibiogramme : à partir d'un prélèvement, le laboratoire va isoler le germe responsable de l'infection et réaliser une étude de la sensibilité aux antibiotiques qui permettra de choisir l'antibiotique le plus adapté, en fonction du contexte clinique.
Si l'on prend l'exemple des méningites bactériennes, et en particulier le cas des méningites à Haemophilus influenzae, ces germes sont sensibles à de très nombreux antibiotiques et le choix de l'antibiotique optimal parmi ceux-ci va dépendre de sa concentration au niveau du LCR, de son rythme d'administration et de sa tolérance. Dans ces conditions, le céfotaxime ou la ceftriaxone représentent les molécules optimales.
Mais des difficultés peuvent se présenter pour certains types de prélèvements, en particulier lorsque l'échantillon est souillé par des germes saphrophytes cutanés. Ainsi, par exemple, en présence d'otorrhée spontanée dans une otite moyenne aiguë, la difficulté pour le bactériologiste n'est donc pas tant d'isoler un germe que de caractériser la bactérie réellement en cause dans l'otite. Un traitement établi sur les bases d'une étude bactériologique menée sur un autre microorganisme que celui responsable de l'infection a toutes les chances de se révéler inefficace. Ce traitement inadapté est de plus générateur de résistances bactériennes, alors qu'un traitement bien ciblé permettra au contraire de réduire le risque d'émergence de résistance.
Thérapeutique probabiliste
La réalisation de prélèvements à visée bactériologique chez l'enfant est rare en pratique de ville. Pour toutes ces raisons, le clinicien s'en tiendra à une stratégie probabiliste : celle-ci se fait en l'absence de certitude bactériologique, ce qui ne signifie pas que le traitement antibiotique soit choisi de façon aveugle. La décision du prescripteur est en effet orientée par son expérience clinique et thérapeutique, le contexte et la localisation de l'infection, le terrain, la saison, les antécédents infectieux, et en particulier l'âge de l'enfant, mais également des données épidémiologiques locales actualisées, tenant compte de l'évolution des résistances des germes dans la région concernée. Le choix de l'antibiotique optimal dépend donc de différents critères : épidémiologie bactérienne, sensibilité des germes aux antibiotiques, concentration minimale inhibitrice, concentration minimale bactéricide, concentration tissulaire des antibiotiques, index inhibiteur, cinétique de l'index inhibiteur, tolérance, facilité d'administration, expérience clinique et coût. Nous illustrerons cette démarche en prenant comme exemple les OMA, pathologie fréquente de l'enfant (environ 2 millions de diagnostics par an).
Épidémiologie bactérienne
Elle varie en fonction de l'âge et de l'épidémiologie locale.
Âge de l'enfant
-
•
Chez l'enfant âgé de moins de 3 mois, dont le statut immunitaire dépend encore des anticorps transmis par la mère, les principaux germes responsables des OMA sont le staphylocoque, les entérobactéries, mais aussi Haemophilus influenzae et Streptococcus pneumoniae et plus qu'exceptionnellement Pseudomonas aeruginosa. Face à une telle diversité bactériologique, il est impossible d'envisager un quelconque traitement probabiliste car aucun antibiotique n'est efficace à la fois sur tous ces germes. Dans ce cas, le prélèvement est obligatoire, permettant d'adapter le traitement aux données de l'antibiogramme.
-
•
Chez l'enfant âgé de 3 mois à 3 ans, en revanche, toutes les études épidémiologiques montrent, en France, la prédominance de deux espèces : H. influenzae, puis le pneumocoque. Lensemble de ces deux germes représente environ 70 % des OMA.
Les H. influenzae responsables d'OMA sont, dans la plupart des cas, non capsulés et dénués de risque bactériémique car ils sont éliminés par les défenses de l'organisme.
La vaccination vis-à-vis d'H. influenzae de sérotype b a permis à la fois d'éliminer le risque de méningite à Hib et de diminuer le portage de ces souches virulentes.
Épidémiologie locale
L'épidémiologie bactérienne des OMA varie considérablement d'un pays à l'autre. En France, une étude épidémiologique effectuée par des praticiens ORL de ville entre 1987 et 1991 montre la prédominance nette de H. influenzae (tableau 18.10 ). Aux États-Unis, le premier germe en cause est S. pneumoniae (cf. tableau 18.10). Ces variations peuvent être expliquées par des différences dans les indications des paracentèses et les critères d'inclusion.
Certaines notions sémiologiques permettent de reconnaître l'étiologie des OMA.
Ainsi :
-
–
l'association chez un même enfant d'une conjonctivite purulente et d'une otite (syndrome otite-conjonctivite) évoque un H. influenzae ;
-
–
une otite très fébrile et douloureuse est présumée d'origine pneumococcique.
Tableau 18.10.
Étiologie comparée des OMA en France et aux États-Unis.
| Germe | France sur 1 232 OMA (%) | États-Unis sur 1 432 OMA (%) |
|---|---|---|
| H. influenzae | 40 | 20 |
| S. pneumoniae | 24 | 30 |
| Staphyloccus aureus | 8 | 1 |
| P. aeruginosa | 6,3 | 1 |
| M. catarrhalis | 6 | 11 |
| S. pyogenes | – | 3 |
D'après Gehanno P et al. La lettre de l'Infectiologue 1991 ; 22HS : 114-29 et Bluestone CD et al. Pediatr Infect Dis 1988 ; 7 : S129-36.
Sensibilité des germes aux antibiotiques
H. influenzae
En 1987-1988, 16 % des H. influenzae isolés dans les pus d'OMA étaient résistants à l'ampicilline. Ce taux devait s'élever rapidement pour atteindre 40 % en 2004 puis se réduire, actuellement en 2011, à 20 %. Cette résistance est due à la sécrétion de bêtalactamases. Il en est de même pour Moraxella catarrhalis (90 %) et la quasi-totalité des staphylocoques.
Récemment a été décrit pour H. influenzae un nouveau mécanisme de résistance à l'amoxicilline non associé à la production de bêtalactamase. Ce mécanisme repose sur une diminution d'affinité des protéines de liaison à la pénicilline. Ce mécanisme de résistance concerne certaines bêtalactamines comme les céphalosporines de première génération.
La résistance à l'amoxicilline est modérée avec des CMI (concentrations minimales inhibitrices) comprises entre 1 et 4 mg/L. L'acide clavulanique ne restaure pas la sensibilité à l'amoxicilline. Les CMI des céphalosporines de 3e génération orales ou injectables ne sont pas touchées par ce mécanisme. La prévalence de ce mécanisme de résistance est d'environ 10 % chez H. influenzae.
Pneumocoques
Ils résistent aux bêtalactamines par modification de l'affinité de leurs PLP : les bêtalactamines agissant sur des cibles avec des affinités particulières. Ces cibles vont modifier leur affinité et ainsi être saturées par des concentrations supérieures d'antibiotique. Le taux de résistance à la pénicilline avait augmenté de manière exponentielle depuis quelques années : il a été multiplié par 10 en 10 ans au cours des dernières années.
Ainsi ces taux s'étaient élevés de 4 % en 1987 à 48 % en 1997. Des études plus récentes montrent une réduction progressive de ces taux de résistance du pneumocoque (toutes souches confondues) de 50 % (2001) à 30 % (2008) (Centre de référence du pneumocoque, E. Varon, L. Gutmann, tableau 18.11 ).
Cette tendance à la baisse de la résistance à la pénicilline observée à partir de 2003 chez l'enfant est liée d'une part à la diminution de la consommation des antibiotiques et d'autre part au vaccin pneumococcique heptavalent conjugué.
Tableau 18.11.
Évolution du taux de résistance à la pénicilline des pneumocoques responsables d'OMA de 2001 à 2008.
| Année | Taux de résistance à la pénicilline (I + R) (%) |
|---|---|
| 2001 | 50 |
| 2002 | 45 |
| 2003 | 42 |
| 2004 | 39 |
| 2005 | 36 |
| 2006 | 34 |
| 2007 | 36 |
| 2008 | 31 |
Centre de référence du pneumocoque, E. Varon, L. Gutmann.
Les modifications des PLP sont la conséquence d'un échange de matériel génétique entre les streptocoques alphahémolytiques et les pneumocoques du nasopharynx favorisé par la pression de sélection induite par les multiples cures d'antibiotiques administrés chez l'enfant.
On distingue ainsi :
-
•
les pneumocoques de portage (sérotypes 6, 14, 19 F, 23 F) commensaux du nasopharynx (60 % des enfants sont porteurs asymptomatiques de pneumocoque avant l'âge de 2 ans), non virulents, mais à l'origine de pathologies non invasives du type OMA ou, parfois, à cet âge, de pathologies invasives ;
-
•
les pneumocoques virulents (sérotypes 1, 3, 4, 5, 7, 8, etc.) responsables de septicémies, de méningites ou de pleuropneumopathies demeuraient en majorité sensibles à la pénicilline car la pression de sélection à leur égard n'a pas eu le temps de s'exercer.
La couverture de protection vaccinale vis-à-vis de ces sérotypes a été modifiée par l'introduction puis l'évolution des politiques vaccinales par le Prevenar (tableau 18.12 ).
Tableau 18.12.
Évolution de la couverture du vaccin antipneumococcique entre 2001 et 2008 (%).
| Vaccin | 2001 | 2008 |
|---|---|---|
| Conjugué 7 valences (Prevenarl) | 66 | 10 |
| Conjugué 13 valences (Prevenar 13 valences) | 85 | 67 |
En 2007, les sérotypes 19A et 3 étaient les deux sérotypes prédominants des OMA, mais aussi des méningites et des pleuropneumopathies.
L'identification d'une résistance sur un antibiogramme n'est pas toujours synonyme d'échec car les guérisons spontanées varient entre 20 et 70 % des cas. Il peut certes s'agir d'otites virales mais aussi d'otites d'origine bactérienne (H. influenzae et M. catarrhalis).
Concentration minimale inhibitrice
La manière la plus précise de comparer l'activité de différents antibiotiques consiste à comparer leur CMI. La CMI est la plus petite concentration d'antibiotique inhibant toute culture visible de la souche à étudier après 18 heures de culture à 37 °C. Cette valeur caractérise l'effet bactériostatique d'un antibiotique visà-vis d'une bactérie. Un inoculum bactérien standardisé est mis en contact avec une gamme d'antibiotiques de concentrations croissantes et de progression géométrique de raison 2, soit en milieu liquide, soit en milieu gélosé (méthode de référence). Ainsi, l'expression de la CMI en mg/L permet de comparer plusieurs antibiotiques de la même famille, et donc de choisir celui qui a la CMI la plus basse.
Les CMI 90 de différentes bêtalactamines vis-à-vis de souches de S. pneumoniae sensibles, moins sensibles ou résistantes à la pénicilline G isolées d'OMA sont rapportées dans le tableau 18.13 .
Tableau 18.13.
Activité de différentes bêtalactamines vis-à-vis de souches de pneumocoques sensibles (S), intermédiaires (I) et résistantes (R) à la pénicilline G.
| Molécule | CMI 90 (mg/L) |
||
|---|---|---|---|
| S | I | R | |
| Pénicilline G | 0,032 | 1 | 4 |
| Amoxicilline | 0,032 | 1 | 2 |
| Céfaclor | 1 | 64 | 128 |
| Céfadroxil | 1 | 64 | 64 |
| Céfuroxime | 0,032 | 4 | 8 |
| Cefpodoxime | 0,064 | 4 | 4 |
| Céfixime | 0,25 | 32 | 32 |
| Ceftriaxone | 0,0032 | 1 | 2 |
La CMI 90 est la CMI maximale de 90 % des souches analysées. Tous les antibiotiques sont actifs vis-à-vis des souches sensibles. L'éventualité d'une souche résistante conduit à ne pas utiliser les C1G, certaines C2G et C3G orales en raison des CMI 90 de ces antibiotiques supérieures aux taux obtenus dans le sang avec les posologies usuelles.
Les CMI déterminées in vitro dans les conditions standards peuvent être plus élevées in vivo. En effet, l'activité d'un antibiotique peut alors être modifiée par différents facteurs : effet inoculum, croissance bactérienne ralentie dans les tissus, inactivation enzymatique, fixation aux protéines, pH, anaérobiose osmolarité, concentration en calcium, effet antagoniste de l'ADN leucocytaire.
CMB (concentration minimale bactéricide)
La bactéricidie s'évalue par la détermination de la CMB. La CMB est la plus petite concentration d'antibiotique laissant moins de 0,01 % de survivants de l'inoculum initial après 18 heures de culture à 37 °C. Elle s'apprécie par repiquage des tubes ne montrant pas de croissance visible lors de l'étude de la CMI en milieu liquide.
On distingue des antibiotiques bactéricides dont les CMB sont proches des CMI et les antibiotiques bactériostatiques dont les CMB sont éloignées des CMI. Les souches dites tolérantes sont les souches dont le rapport CMB sur CMI est supérieur à 32.
Cependant la comparaison des CMI ou des CMB de différents antibiotiques n'a qu'un intérêt théorique car elle ne tient pas compte des concentrations obtenues in vivo.
Concentration tissulaire des antibiotiques
Dans la majorité des tissus (sauf les émonctoires), la plupart des antibiotiques (bêtalactamines, aminosides, glycopeptides, fosfomycine, etc.) ont des concentrations moins élevées que dans le sérum mais une demi-vie plus longue. La détermination des concentrations tissulaires des antibiotiques pose encore des problèmes méthodologiques, en particulier dans les tissus solides. L'interprétation des valeurs observées est de plus toujours difficile du fait de l'hétérogénéité de la distribution (notamment intra ou extracellulaire), de la difficulté d'appréciation des formes effectivement (biologiquement) actives, de la difficulté d'obtenir plusieurs prélèvements à des temps différents (LCR) ou une quantité suffisante pour le dosage de liquide biologique, au niveau du site infecté. C'est le cas, en particulier, du liquide auriculaire où la majorité des dosages effectués dans les études thérapeutiques concernent des otites séreuses et non des OMA.
Le tableau 18.14 rapporte les concentrations d'antibiotiques obtenues dans le liquide auriculaire pour différents antibiotiques utilisés dans les OMA.
Tableau 18.14.
Concentration d'antibiotiques dans le liquide auriculaire et CMI 90 de différents antibiotiques vis-à-vis de souches de pneumocoque péni-I ou péni-R – Analyse de l'index inhibiteur.
| Antibiotique | Posologie (mg/kg) | Pic dans le liquide auriculaire (mg/L) | CMI 90 (mg/mL) des antibiotiques pour |
Index inhibiteur : conc. Pic liq. auriculaire CMI de l'antibiotique |
||
|---|---|---|---|---|---|---|
| Souches péni-I1 | Souches péni-R2 | Souches péni-I | Souches péni-R | |||
| Amoxicilline | 15 | 4-5,6 | 1 | 2 | 4 | 2 |
| Triméthoprime | 4 | l,4-2,0 | 16 | 16 | < 1 | < 1 |
| Érythromycine – éthylsuccinate | 15 | 4,5 | 4 | 8 | < 1 | < 1 |
| Céfaclor | 10-40 | 0,5-7,8 | 64 | 128 | < 1 | < 1 |
| Céfuroxime | 250 | 0,6 | 4 | 8 | < 1 | < 1 |
| Céfixime | 8 | 0,12 | 32 | 32 | < 1 | < 1 |
| Cefpodoxime | 5-10 | 0,20-0,24 | 4 | 4 | < 1 | < 1 |
| Ceftriaxone | 19 | 6 | 1 | 2 | 6 | 3 |
D'après Kaplan SL, Mason EO Jr. Antimicrobial agents : resistance patterns of common pathogens. Pediatr Infect Dis J 1994 ; 13 (11) : 1050-3.
Péni-I : souches moins sensibles à la pénicilline.
Péni-R : souches résistantes à la pénicilline.
Index inhibiteur
Une autre façon d'analyser l'activité d'un antibiotique est de comparer la CMI avec les concentrations obtenues dans l'organisme, d'où la notion d'index inhibiteur qui correspond au rapport concentration in vivo sur CMI. Un index inhibiteur peut ainsi être établi au moment du pic sérique, au moment du taux résiduel sérique au niveau du site infecté. Plus cet index inhibiteur est élevé, meilleure doit être l'activité thérapeutique, et ceci correspond ainsi à une marge de sécurité. Il doit, pour obtenir une activité in situ, être au moins supérieur à 10. Dans les méningites, l'efficacité thérapeutique optimale, c'està-dire une diminution de l'inoculum bactérien dans le LCR de 1 log CFU/mL/h, a été corrélée avec un index inhibiteur supérieur à 10. Le tableau 18.14 rapporte les index inhibiteurs pour le pneumocoque au niveau du liquide auriculaire d'antibiotiques utilisés dans les OMA, vis-à-vis des souches de pneumocoque résistant à la pénicilline.
Cinétique de l'index inhibiteur
Les cinétiques d'index inhibiteur sérique permettent d'intégrer une partie des données bactériologiques et pharmacocinétiques et de comparer de façon simple le comportement de plusieurs antibiotiques d'une même famille. La cinétique est exprimée sous forme d'une courbe de multiple de CMI en fonction du temps. Cette cinétique d'index inhibiteur peut prendre en compte soit la concentration totale d'antibiotique, soit la forme libre qui théoriquement est la seule biologiquement active et la CMl 50 ou la CMI 90 des bactéries.
Facteurs prédictifs d'efficacité des bêtalactamines
L'optimisation du traitement antibiotique est corrélée à l'intégration des données pharmacocinétiques et pharmacodynamiques (paramètre PK/PD). Les bêtalactamines sont des molécules temps-dépendantes, c'est-à-dire que le temps pendant lequel les concentrations sériques sont supérieures à la CMl (T > CMl) est le paramètre prédictif de l'activité in vivo.
Des études effectuées chez des enfants ayant une OMA avec double paracentèse ont permis de corréler l'éradication du germe après 2-7 jours de traitement antibiotique avec le temps au-dessus de la CMI. Des T > CMI supérieurs à 40 % ont été associés à une éradication bactérienne de 85-100 % pour S. pneumoniae et H. influenzae. Ces données permettent de hiérarchiser les différentes molécules (tableau 18.14). Ainsi vis-à-vis de souches de pneumocoque résistant à la pénicilline, parmi les antibiotiques oraux, seule l'amoxicilline conserve une activité avec un temps supérieur à la CMI de 40 %. La tolérance et la facilité d'administration représentent des critères importants de choix, en particulier en ce qui concerne la compliance des patients.
Le coût varie enfin de 1 à 10 en fonction des différentes molécules utilisées et de la durée de traitement proposé.
En dépit de ces critères rationnels, un traitement adapté peut malgré tout conduire à un échec thérapeutique, en particulier en raison d'une variabilité interindividuelle, en ce qui concerne la biodisponibilité, la pénétration dans le liquide auriculaire, l'activité biologique de l'antibiotique dans le pus, la réponse immunitaire locale.
Le rôle d'un antibiotique est d'atteindre une bactérie au niveau du site infectieux en inhibant une cible enzymatique située à l'intérieur de celle-ci. Les critères de choix du traitement antibiotique représentent tout au plus une approche optimale dans la détermination du meilleur traitement antibiotique que seuls les arguments cliniques avec l'évolution à plus long terme pourraient confirmer.
Analyse des échecs de l'antibiothérapie
La prescription d'un traitement antibiotique nécessite impérativement la réévaluation de ce traitement après 48 ou 72 heures. Ainsi, il convient d'évaluer la tolérance, l'efficacité clinique, l'efficacité bactériologique, c'est-à-dire la disparition du germe du site où il avait été isolé.
La persistance de signes d'infection ou la persistance du germe responsable de l'infection impose une analyse critique de la situation, en évoquant les différentes causes susceptibles d'être responsables de l'échec du traitement, afin de modifier en conséquence l'antibiothérapie initiale.
Causes liées au germe
Développement d'une résistance in vivo
Ceci correspond à la sélection de sous-populations résistantes que les tests in vitro n'avaient pas prévue. Ainsi, l'exemple le plus classique est la sélection au cours de la tuberculose lors de monothérapies de souches résistantes de Mycobacterium tuberculosis. C'est le cas également de la sélection par mutation chromosomique de souches productrices de céphalosporinase chromosomique à haut niveau et résistantes à toutes les céphalosporines de 3e génération chez Pseudomonas aeruginosa, Enterobacter cloacae, Citrobacter, Providencia, Acinetobacter. La sélection de mutants résistants a d'autant plus de risques d'apparaître qu'il existe au niveau du site infectieux une population microbienne supérieure ou égale à 107 germes/mL.
La sélection en cours de traitement de mutants résistants a également été observée avec les fluoroquinolones, la rifampicine et la fosfomycine. La bithérapie n'évite pas, dans tous les cas, la sélection de souches résistantes lorsque l'antibiotique associé possède une cinétique différente, une mauvaise diffusion au niveau du site infectieux ou s'il existe une inactivation partielle in vivo. Ainsi, à la notion de synergie in vitro de deux antibiotiques doit s'ajouter le concept de synergie pharmacocinétique.
Tolérance phénotypique
Au sein de foyers tissulaires où le support nutritif est faible, les bactéries ont une croissance beaucoup plus lente que dans les conditions de culture in vitro. Ceci a été rapporté au niveau du LCR, de valves cardiaques, articulations, os ou abcès. Dans le modèle de méningite expérimentale à pneumocoque, il a été observé que le LCR renferme des bactéries à croissance lente en phase stationnaire. Les bêtalactamines n'exercent un effet bactéricide que sur les bactéries en phase de croissance rapide. La perte de l'activité bactéricide des bêtalactamines sur les bactéries en phase de croissance ralentie laisse persister une partie de la population microbienne susceptible d'être responsable de rechute.
Effet inoculum
L'effet inoculum est défini comme une augmentation significative de la CMI en relation avec une augmentation de l'inoculum bactérien. Le mécanisme en est l'augmentation avec le nombre de germes, de la quantité de bêtalactamases ou du nombre de cibles bactériennes à atteindre pour l'antibiotique. In vivo, des taux supérieurs ou égaux à 107 germes/mL sont retrouvés au niveau de certains liquides biologiques (aspirations trachéales, LCR, sang) au cours des infections en pédiatrie.
Ces taux de germes sont très supérieurs à l'inoculum bactérien (104-105 germes/mL) utilisé pour l'antibiogramme standard. Ainsi, une sensibilité détectée in vitro peut parfois correspondre à une moindre sensibilité, voire à une résistance in vivo. Au cours des méningites purulentes, des taux supérieurs à 107 germes/mL de LCR ont été corrélés à un retard à la stérilisation du LCR, lié à une diminution d'activité des bêtalactamines.
Causes liées au traitement
Une mauvaise compliance, et une durée de traitement insuffisante peuvent être responsables d'échec.
Les mécanismes pharmacodynamiques peuvent être également impliqués dans ces phénomènes. L'activité des bêtalactamines est dite « temps-dépendante », c'est-à-dire, d'une part, qu'au-dessus d'un certain seuil de concentration d'antibiotique, il n'existe pas d'augmentation de la vitesse de bactéricidie et, d'autre part, qu'il n'y a plus d'activité antibactérienne (donc une recroissance possible) lorsque la concentration d'antibiotique diminue au-dessous de la CMI. Ainsi, une mauvaise adaptation du rythme d'administration (1 à 2 prises/24 h pour un antibiotique à demi-vie courte tel que l'amoxicilline, par exemple) risque d'induire au cours d'une période prolongée des concentrations inférieures à la CMI, voire des concentrations nulles au niveau du site infectieux. Ceci est susceptible de laisser persister des bactériémies avec un risque de localisations secondaires, comme ceci a été observé pour Haemophilus influenzae sérotype b à partir de foyers ORL.
L'espacement idéal des doses unitaires adapté à la demi-vie doit permettre de maintenir des taux d'antibiotiques au-dessus de la CMI dans le sang et le site infectieux au moment de la vallée.
Causes liées au foyer
-
•
La présence d'un obstacle sur les voies aériennes biliaires ou urinaires, ou d'un corps étranger, compromet le drainage du foyer et favorise la persistance d'un foyer malgré une antibiothérapie par ailleurs efficace.
-
•
La collection purulente peut inactiver certains antibiotiques. En effet, l'activité des aminosides est réduite dans certaines conditions : pH acide, anaérobiose, forte osmolalité et, surtout, neutralisation de l'aminoside par des fragments d'ADN libérés par la masse de polynucléaires altérés. Or, ces conditions sont susceptibles d'être réunies au sein d'un foyer purulent. L'aminoside, inactivé, ne peut exercer son rôle de protecteur de la bêtalactamine et, de ce fait, au site de l'infection, la bithérapie est réduite à une monothérapie au contact de la bactérie. Ainsi, une association comportant une céphalosporine de 3e génération et un aminoside peut ne pas prévenir l'émergence de mutants résistants lors du traitement des foyers profonds à Enterobacter cloacae, Serratia, Citrobacter et Pseudomonas aeruginosa. Une telle situation peut être également obtenue lorsque les deux partenaires d'une association n'ont pas la même diffusion tissulaire ou ont des cinétiques très différentes.
-
•
La présence au sein du foyer infectieux d'une flore polymorphe peut être en cause : la pathogénie indirecte a également été évoquée ici pour expliquer la persistance de germes pathogènes sensibles en présence d'un traitement par la pénicilline ou l'ampicilline. En effet, différents germes, appartenant à la flore commensale associée, peuvent produire une bêtalactamase extracellulaire ou une bêtalactamase diffusant facilement à travers la membrane externe de la bactérie. La libération de cette enzyme au sein du foyer infectieux entraîne alors une hydrolyse de la pénicilline ou de l'ampicilline, et peut être responsable d'un échec thérapeutique.
Causes liées au terrain
Les défenses de l'hôte jouent un rôle fondamental dans la guérison du syndrome infectieux. Chez les patients granulopéniques ou chez les patients normaux, mais dans des sites infectés où les mécanismes de défense locaux sont déficients (os, endocarde, matériel étranger), les traitements nécessitent l'utilisation d'antibiotiques bactéricides avec des posologies élevées et des durées de traitement plus longues que chez les patients normaux.
Les causes d'échec de l'antibiothérapie restent rares. Cependant en présence d'un échec réel, l'évaluation chez le patient des causes possibles doit permettre de modifier le traitement antibiotique et d'assurer l'éradication du foyer bactérien.
BIBLIOGRAPHIE
- Bingen E. Epidemiologie des germes et de la résistance au cours des OMA. Médecine thérapeutique/Pédiatrie. 2007;10(3):163. 71. [Google Scholar]
- Craig W.A. Pharmacokinetic/pharmacodynamic parameters : rationale for antibacterial dosing of mice and men. Clin Infect Dis. 1998;26:1–10. doi: 10.1086/516284. [DOI] [PubMed] [Google Scholar]
- Gehanno P., Lenoir G., Berche P. In vivo coorelates for Streptococcus pneumoniae penicilline resistance in acute otitis media. Antimicrob Agents Chemother. 1995;39:271. doi: 10.1128/aac.39.1.271. 2. [DOI] [PMC free article] [PubMed] [Google Scholar]
Antiviraux (tableau 18.15)
Tableau 18.15.
Principaux antiviraux (à l'exclusion des antirétroviraux) inhibiteurs de l'ADN-polymérase.
| Antiviral |
Mécanisme d'action |
Virus inhibé |
Présentations disponibles |
|---|---|---|---|
| Inhibiteurs de l'ADN-polymérase1,2 | |||
| Aciclovir (Zovirax) | Analogue nucléosidique | HSV-1 et 2, VZV, EBV | IV, cp, susp Cut |
| Valaciclovir (Zelitrex) | Analogue nucléosidique | HSV-1 et 2, VZV, EBV | Cp |
| Ganciclovir (Cymévan) | Analogue nucléosidique | HSV, VZV, EBV CMV |
IV, gel |
| Valganciclovir (Rovalcyte) | Analogue nucléosidique | HSV, VZV, EBV CMV |
Cp |
| Cidofovir (Vistide) | Analogue nucléotidique | CMV, HSV | IV |
| Acide phosphonoformique (Foscarnet) | Analogue de pyrophosphate Blocage direct du site pyrophosphate de l'ADN-polymérase et inhibition activité 3'5'exonucléase |
HSV, CMV, HHV-6 VHB |
IV |
| Autres mécanismes | |||
| Ribavirine | Inhibition de la transcriptase virale (virus à ARN) Inhibition de la synthèse de GTP Inhibition des ARNm |
VRS, Influenza A et B Quelques virus des fièvres hémorragiques |
IV, aérosol, cp |
| Amantadine, rimantadine | Inhibition de la décapsidation intracellulaire | Virus Influenza A | Caps |
| Oseltamivir (Tamiflu) Zanamivir (Relenza) |
Inhibition de la neuraminidase | Virus Influenza A et B Virus H5N1 | Susp,gel Inh |
| Interférons Interféron a (Roféron-A, Introna, etc.) |
Inhibition de la traduction des ARNm | VHB, VHC | SC, IM |
GTP : glutamate-pyruvate-transaminase ; ARNm : acide ribonucléique messager.
Après triphosphorylation intracellulaire, les analogues nucléosidiques entrent en compétition avec les nucléosides naturels pour le site actif de l'ADN-polymérase entraînant un blocage de l'élongation.
Ces inhibiteurs ne sont pas actifs sur le virus à l'état de latence.
J.-M. Treluyer
Pathologies infectieuses selon le site
Infections des voies respiratoires hautes
Voir chapitre 26, page 727.
Infections des voies respiratoires basses
A. Bourrillon
Introduction
Les infections bronchopulmonaires du nourrisson et de l'enfant constituent un problème majeur de santé publique dans les pays en voie de développement où elles demeurent une cause majeure de mortalité chez les enfants âgés de moins de 5 ans. Ainsi, l'OMS a pu évaluer à plus de 4 millions d'enfants par an (ou plus de 10 000 enfants/jour) le nombre de décès liés aux pneumopathies infectieuses dans les pays en voie de développement.
Le diagnostic des infections bronchopulmonaires et leur évaluation étiologique nécessitent une extrême rigueur d'analyse sémiologique, notamment clinique et radiologique.
Les stratégies antibiotiques doivent être adaptées selon des données épidémiologiques actualisées mais de recueil souvent difficile.
Anatomophysiopathologie
Les voies aériennes supérieures et inférieures ont une continuité anatomique et une structure mucociliaire comparables avec des mécanismes de défense proches expliquant la communauté possible des agents infectieux pathogènes.
Le tractus respiratoire sous-glottique est cependant habituellement protégé contre les infections bactériennes et virales par différents systèmes de défense :
-
•
mécaniques : filtration aérodynamique ; réflexe d'expulsion ; transport mucociliaire ;
-
•
phagocytaires : macrophages alvéolaires ; polynucléaires neutrophiles ;
-
•
immunitaires : lymphocytes et immunoglobulines.
Les infections parenchymateuses (pneumonies) sont liées à la conjonction de la pénétration d'un micro-organisme virulent (le plus souvent par voie aérienne) et d'une altération des mécanismes de défense.
La malnutrition, l'immunodépression, les infections virales récentes et l'obstruction « mécanique » (bronchopneumonies) sont des facteurs favorisants (fig. 18.20 ).
Fig 18.20.

Physiopathologie des pneumopathies infectieuses parmi les infections invasives à S. pneumoniae.
D'après Bingen E. Place du pneumocoque en pathologie infectieuse pédiatrique. Pathol Biol 2002 ; 50 : 374-9.
Contamination
La contamination habituelle se fait par les voies aériennes supérieures (initialement atteintes) par l'intermédiaire des gouttelettes de Pflügge. La fréquence des infections (en particulier bronchiques) est accrue par le jeune âge (nourrisson), la malnutrition (pays en voie de développement) mais aussi en tous pays, par la promiscuité au sein du logement, le mode de transport ou de garde (crèches), la pollution de l'environnement (tabagisme passif) ou l'immunodépression acquise par la répétition même des épisodes infectieux des voies respiratoires.
Bronchites aiguës
Elles sont liées à une inflammation le plus souvent diffuse de l'arbre bronchique. Les bronchites aiguës sont le plus souvent d'origine virale (VRS, virus influenzae, adénovirus).
Le diagnostic est clinique, évoqué devant l'association d'une fièvre généralement modérée et d'une toux. L'auscultation pulmonaire retrouve habituellement quelques râles ronflants (ronchi) ou « humides ».
Aucun examen complémentaire n'est nécessaire et en particulier pas de cliché pulmonaire. La seule indication d'une radiographie thoracique serait, comme lors de toute infection des voies respiratoires basses, une fièvre élevée et durable (> 5 jours) ou une polypnée laissant un doute diagnostique avec celui d'une pneumonie.
Le traitement est symptomatique :
-
•
désobstruction rhinopharyngée en cas de rhinopharyngite associée ;
-
•
traitement de la fièvre si nécessaire.
Les traitements antitussifs sont le plus souvent inutiles ou contre-indiqués.
L'antibiothérapie n'est indiquée que dans les cas très limités de suspicion de surinfection bactérienne (fièvre ≥ 38,5 °C) au cours d'une durée supérieure à 3 jours avec éventuelle coexistence de signes d'atteinte alvéolaire cliniques ou radiologiques. Les antibiotiques prescrits sont alors adaptés aux bactéries pathogènes habituelles de surinfection bronchique provenant des voies aériennes supérieures (S. pneumoniae et Haemophilus influenzae : amoxicilline + acide clavulanique).
L'évolution est spontanément favorable en 7 à 10 jours.
L'éventualité de leurs récidives est traitée dans le chapitre 26.
Bronchiolite aiguë du nourrisson
Cf. chapitre 30, page 795.
Pneumonie aiguë communautaire
Les pneumonies aiguës traduisent une atteinte infectieuse du parenchyme pulmonaire (cf. fig. 18.20).
Leur caractère « communautaire » fait référence à l'aspect collectif de l'infection transmise dans une population et ce, à la différence des pneumonies acquises en milieu hospitalier qualifiées de nosocomiales.
Les bronchopneumopathies aiguës regroupent à la fois les infections bronchiques et pulmonaires.
Épidémiologie
Les agents infectieux les plus fréquents au cours des pneumonies aiguës de l'enfant sont :
-
•avant l'âge de 3 ans :
-
–Streptococcus pneumoniae (pneumocoque),
-
–virus : VRS influenzae A et B, para-influenzae, grippe ;
-
–
-
•après l'âge de 3 ans :
-
–Mycoplasma pneumoniae (mycoplasme),
-
–Streptococcus pneumoniae (pneumocoque).
-
–
Le risque infectieux le plus important est relié quel que soit l'âge à certaines bactéries :
-
•
pneumocoque (80 % des cas) ;
-
•
Staphylococcus aureus (encadré 18.10 ), surtout si producteur de la leucodine de Panton et Valentine (10 %) ;
-
•
streptocoque bêtahémolytique du groupe A (10 %).
Encadré 18.10.
Staphylococcus aureus
La staphylococcie pulmonaire concerne plus particulièrement le jeune nourrisson.
Elle peut atteindre les enfants plus âgés en particulier si S. aureus producteur de la leucocidine de Panton et Valentine est en cause (pneumonie nécrosante).
La porte d'entrée est avant tout respiratoire or, parfois par voie hématogène à point de départ cutané.
Le tableau clinique n'est pas spécifique mais volontiers sévère. Il existe fréquemment des signes de détresse respiratoire et des signes généraux marqués témoignant souvent d'un sepsis sévère (tachycardie, TRC allongé). Les signes digestifs peuvent être au premier plan notamment chez le jeune nourrisson avec un météorisme abdominal « pseudo-occlusif ».
Chlamydia pneumoniae et Legionella pneumophila sont rarement impliquées chez l'enfant.
Haemophilus influenzae b est exceptionnellement en cause depuis la généralisation de la vaccination anti-Haemophilus influenzae b.
Redouter en 1er lieu le pneumocoque à tout âge.
Diagnostic d'une pneumonie de l'enfant
(fig. 18.21 )
Fig 18.21.

Démarche diagnostique devant une pneumopathie infectieuse communautaire (pneumonie).
Diagnostic clinique
Il est en général suspecté devant l'association :
-
•
d'une fièvre habituellement élevée ;
-
•
d'une tachypnée (avec ou sans signes de lutte) ; toujours compter la FR (fréquence respiratoire) : > 40 à 50/min (selon l'âge) ;
-
•
d'une toux (parfois retardée) ;
-
•
d'autres signes d'appel parfois trompeurs (douleurs abdominales ou thoraciques évocatrices d'une pneumonie à pneumocoque) ;
-
•
d'anomalies auscultatoires pulmonaires le plus souvent focalisées : diminution du murmure vésiculaire ; râles crépitants alvéolaires ; voire souffle tubaire.
Diagnostic radiographique
L'examen radiographique thoracique est nécessaire pour affirmer le diagnostic de pneumonie.
Il doit être prescrit dès la moindre suspicion clinique du diagnostic. Le seul cliché à demander en première intention est une radiographie de face en inspiration et en position debout.
Les aspects radiologiques sont multiples :
-
•l'image typique est une opacité parenchymateuse (fig. 18.22 ) ;
-
–alvéolaire : unique ou multiple, rarement bilatérale,
-
–systématisée ou à limites floues avec un éventuel bronchogramme, aérien au sein de l'opacité ;
-
–
-
•
les pneumonies rondes (images sphériques ou ovalaires à bord plus ou moins nets) sont particulières à l'enfant (fig. 18.23 ; voir aussi page 908).
Attention « pièges »
Les foyers de condensation segmentaire ou lobaire sont évocateurs mais non spécifiques d'une atteinte bactérienne.
Les clichés thoraciques peuvent rester normaux jusqu'à la 72e heure (pneumonie à pneumocoque).
Fig 18.22.

Foyer du lobe moyen droit.
Fig 18.23.

Pneumonies rondes (clichés thoraciques de face et de profil).
Situations d'urgence justifiant un avis spécialisé aux urgences pédiatriques ou une hospitalisation
Voir aussi chapitre 30.
-
•Certaines sont liées à la sévérité des signes cliniques :
-
–intensité des signes infectieux : fièvre élevée, troubles hémodynamiques (tachycardie, augmentation du temps de recoloration cutané), troubles de la conscience ;
-
–sévérité des signes respiratoires : polypnée (> 60/min) et signes de lutte, difficultés à la prise des biberons ;
-
–signes cliniques d'hypoxie (cyanose) (SaO2 < 95 % sous air) ou d'hypercapnie (troubles de la conscience ; sueurs) témoignant de l'étendue de l'atteinte alvéolaire.
-
–
Dans tous les cas, il convient de déceler comme signe d'alerte toute aggravation rapide des signes respiratoires initialement observés.
-
•D'autres sont liés à la fragilité du « terrain » :
-
–jeune âge (inférieur à 6 mois) ;
-
–maladies sous-jacentes (infections des voies respiratoires récidivantes ou maladie respiratoire chronique ; drépanocytose ; dénutrition ; immunodépression).
-
–
Approche étiologique : elle est probabiliste (tableau 18.16)
Tableau 18.16.
Critères évocateurs probabilistes de l'étiologie d'une pneumopathie aiguë infectieuse virale, à pneumocoque et à M. Pneumoniae.
| Pneumonie | Virale | Pneumocoque | M. pneumoniae |
|---|---|---|---|
| Épidémiologie | Épidémique | Sporadique | Épidémique |
| Âge | Tout âge | Tout âge (pneumo) | > 2 ans |
| Début | Progressif | Brutal | Progressif |
| Fièvre | + | +++ | + |
| S. respiratoires | Voies aériennes supérieures Toux + | Toux S. auscultatoires en foyers |
Toux sèche paroxystique |
| S. extrarespiratoires | Éruption Myalgies |
S. abdominaux S. pseudo-méningés |
Asthénie |
| Tolérance | Bonne | Mauvaise | Bonne |
Critères cliniques
La présomption clinique d'une pneumonie virale repose typiquement sur :
-
•
le contexte épidémique ;
-
•
le début progressif : rhinite ou pharyngite ;
-
•
l'existence d'une fièvre de niveau variable ;
-
•
la coexistence d'éruptions ou de myalgies ;
-
•
l'absence de signes auscultatoires focalisés.
L'orientation probabiliste vers une étiologie bactérienne peut apparaître variable selon le germe susceptible d'être en cause. Les pneumonies à pneumocoque sont le plus souvent évoquées :
-
•
devant une fièvre élevée à début brutal ;
-
•
une toux sèche ;
-
•
la coexistence de douleurs abdominales (pseudo-appendiculaires) ou de céphalées (syndrome pseudo-méningé) ;
-
•
des signes auscultatoires en foyer.
Mycoplasma pneumoniae à l'inverse est relié à des tableaux cliniques typiquement plus progressifs, moins fébriles, accompagnés d'asthénie avec des signes fonctionnels respiratoires susceptibles de témoigner d'une hyperréactivité bronchique associée.
En pratique cependant, une telle approche probabiliste clinique étiologique est le plus souvent mise en défaut.
Critères radiologiques
La radiographie thoracique n'est de même pas l'examen de référence susceptible d'argumenter le diagnostic étiologique :
-
•
la mise en évidence d'une opacité alvéolaire systématisée est typiquement reliée à la pneumonie à pneumocoque mais elle peut cependant être observée dans les infections virales ou à Mycoplasma pneumoniae ;
-
•
un aspect d'infiltrat diffus bilatéral, lobaire ou segmentaire, est plus compatible avec le diagnostic de pneumonie virale ou à mycoplasme mais elle n'exclut cependant pas l'éventualité d'un pneumocoque ;
-
•
les adénopathies hilaires évoquent a priori une tuberculose mais elles peuvent être observées au cours des pneumonies à mycoplasme.
« La radiographie du thorax n'est pas un examen microbiologique ».
Examens non spécifiques hématologiques et biologiques
La prescription de ces examens n'est pas justifiée pour la prise en charge ambulatoire d'une pneumopathie infectieuse sans signes de gravité.
Les examens hématologiques et biologiques ne constituent que des arguments d'appoint diagnostique limités pour un diagnostic étiologique probabiliste.
Ainsi, une hyperleucocytose à polynucléaires neutrophiles franche et l'élévation de la protéine C réactive sont typiquement reliées aux pneumonies bactériennes à pneumocoque mais elles peuvent être observées au cours des pneumonies virales. La procalcitonine, marqueur sérique des infections bactériennes sévères, a, dans le contexte, une remarquable spécificité et une excellente sensibilité. Le recours à cet examen est appelé à être d'un appoint privilégié pour confirmer l'origine bactérienne d'une pneumonie.
Le diagnostic de certitude de l'étiologie des pneumopathies bactériennes ne peut être en pratique assuré que par des examens bactériologiques. Seules les hémocultures affirment l'origine bactérienne de la pneumonie et contribuent aux études épidémiologiques les plus précises.
Leur sensibilité est cependant faible (3 à 10 % environ).
Les autres examens sont d'un appoint imprécis et limité (tableau 18.17 ) :
-
•
les prélèvements nasopharyngés ne peuvent mettre en évidence qu'une flore commensale de portage ;
-
•
l'examen cytobactériologique quantitatif (interprétable si plus de 106 germes/mL ; plus de 10 cellules épithéliales ; plus de 25 polynucléaires neutrophiles par champ) est de réalisation souvent difficile et peut être contaminé par la flore commensale pharyngée ;
-
•
les antigènes solubles (sang-urines) sont de sensibilité et de spécificité médiocres ;
-
•
les méthodes de détection des antigènes bactériens par amplification génique (PCR si Mycoplasma pneumoniae) sont réservées à des situations limitées ;
-
•
les prélèvements avec analyse quantitative obtenus par des méthodes invasives in situ (fibroscopie bronchique et lavage bronchoalvéolaire) ne sont réservés, en service de réanimation, qu'aux seules infections sévères sur terrain fragilisé.
Ainsi donc, sans appoint étiologique précis (hémocultures négatives), l'antibiothérapie des pneumonies communautaires de l'enfant est le plus souvent probabiliste.
Tableau 18.17.
Place des examens bactériologiques pour le diagnostic des pneumopathies bactériennes de l'enfant.
| Examen | Intérêt |
|---|---|
| Prélèvement nasopharyngé | Aucun |
| Examens cytobactériologiques des crachats Aspiration trachéale | Contamination oropharyngée |
| Hémocultures (systématiques) | Faible sensibilité 1–10 % |
| Antigènes solubles | Très faible sensibilité |
| Examens sérologiques | Diagnostic rétrospectif |
| Prélèvement invasif Biopsie pulmonaire Lavage bronchoalvéolaire |
Uniquement si pathologies sévères |
Un critère diagnostique d'appoint rétrospectif pourra être apporté par la rapidité de la réponse à une antibiothérapie probabiliste. Ainsi une défervescence obtenue en 24 à 36 heures sous amoxicilline peut être a posteriori évocatrice d'un diagnostic de pneumonie à pneumocoque.
Argumentation épidémiologique – Germes et niveaux de résistance
Antibiothérapie : rationnel
Les pneumonies ont une épidémiologie différente et variable selon l'âge de l'enfant.
Schématiquement :
-
•
avant l'âge de 3 ans, elles sont le plus souvent d'origine virale. Le pneumocoque est ensuite l'agent bactérien le plus fréquent en France. Son taux de sensibilité diminuée à la pénicilline est actuellement de 30 %. Sa résistance aux macrolides est élevée à 60 % (encadré 18.11 ) ;
-
•
après l'âge de 3 ans, les pneumonies virales sont moins fréquentes. Les deux bactéries le plus fréquemment en cause sont le pneumocoque et Mycoplasma pneumoniae ;
-
•
quel que soit l'âge, et ce depuis la généralisation de la vaccination spécifique, les Haemophilus influenzae b et, indépendamment de celle-ci, les Haemophilus non typables, Moraxella catarrhalis et Chlamydia pneumoniae, ne sont qu'exceptionnellement en cause.
On peut ainsi, de façon probabiliste, évaluer qu'un tiers des bronchopneumopathies communautaires de l'enfant est d'origine virale, un tiers d'origine exclusivement bactérienne, un tiers peut être lié à une co-infection (virale et bactérienne). La fréquence des infections (co-infections) bactériennes au cours des pneumonies de l'enfant justifie donc du caractère systématique de l'antibiothérapie dans ces pathologies.
Encadré 18.11.
Germes et résistances (France 2007)
Pneumocoques
-
–
30 % sensibilité diminuée à la pénicilline (amoxicilline).
-
–
60 % résistants aux macrolides.
Mycoplasma pneumoniae
-
–
Résistance naturelle aux bêtalactamines (absence de mur bactérien).
-
–
Sensibilité aux macrolides.
Lantibiothérapie est ainsi :
-
•
systématique lorsque le diagnostic de pneumonie est confirmé sur le cliché thoracique ;
-
•
urgente notamment en cas de signes de sévérité ;
-
•
probabiliste (selon la fréquence des agents infectieux supposés en cause selon l'âge).
Antibiothérapie : choix
Le choix initial peut être difficile car, pour rappel, il n'existe souvent :
-
•
aucun signe clinique ou radiologique prédictif de l'agent infectieux responsable ;
-
•
aucun examen bactériologique ne permettant un diagnostic fiable immédiat ;
-
•
aucun antibiotique avant l'AMM pédiatrique ne couvrant l'ensemble des germes potentiellement en cause.
Au cours des pneumonies aiguës et en l'absence de signes cliniques de sévérité, le traitement antibiotique est habituellement ambulatoire et administré par voie orale.
La cible bactériologique initiale et privilégiée est, du fait de la sévérité, le pneumocoque, et l'antibiothérapie est déterminée en fonction de l'âge.
Avant l'âge de 3 ans, l'amoxicilline per os à la posologie de 80-100 mg/kg/j en 3 prises/jour est recommandée en première intention.
Il est inutile, même pour les souches supposées ou confirmées de sensibilité diminuée (CMI < 2 mg/L), de prescrire des posologies supérieures d'amoxicilline, les concentrations tissulaires de cet antibiotique étant suffisantes vis-à-vis des pneumocoques.
En cas d'allergie à la pénicilline sans contre-indication aux céphalosporines, les céphalosporines de 3e génération par voie injectable (IM ou IV) sont recommandées (céfotaxime et ceftriaxone).
Les céphalosporines orales de 1re génération (ayant une activité insuffisante sur les souches de pneumocoque de sensibilité diminuée à la pénicilline) comme les céphalosporines de 2e génération (céfuroxime axétil) et de 3e génération (cefpodoxime proxétil) ne doivent pas être prescrites comme traitement antibiotique des pneumonies à pneumocoque car, si elles conservent une activité potentielle sur ce germe même de sensibilité diminuée à la pénicilline, elles ont une concentration intratissulaire toujours insuffisante au sein du parenchyme pulmonaire.
L'association trimétroprime-sulfaméthoxazole (Bactrim) a une efficacité insuffisante sur les souches de pneumocoque de sensibilité diminuée à la pénicilline. En cas de contre-indication aux bêtalactamines, l'hospitalisation est souhaitable pour mettre en place une antibiothérapie parentérale adaptée (C3G injectable).
Seul l'enfant non ou mal vacciné contre Haemophilus influenzae b, et/ou atteint d'une otite moyenne aiguë purulente associée, peut justifier d'un traitement initial par amoxicilline-acide clavulanique (80 mg/kg/j d'amoxicilline).
À partir de l'âge de 3 ans, l'amoxicilline est aussi le traitement d'attaque de référence si une pneumonie à pneumocoque est redoutée.
Elle est prescrite per os à la posologie de 80–100 mg/kg/j en 3 prises par jour jusqu'à l'âge de 10 ans. À partir de l'âge de 3 à 5 ans, cependant, une orientation anamnestique clinique ou radiologique susceptible d'évoquer Mycoplasma pneumoniae pourrait conduire, en l'absence de signes de sévérité, au recours en première intention à un macrolide ayant l'AMM (fig. 18.24 ).
Fig 18.24.

Stratégie diagnostique et thérapeutique devant une pneumonie de l'enfant.
En cas d'allergie avec contre-indication aux bêtalactamines, la pristinamycine peut aussi être utilisée à partir de l'âge de 6 ans dans les formes sans gravité et en l'absence de troubles digestifs associés.
Dans les cas de pneumonies avec signes de sévérité, lantibiothérapie probabiliste initiale est habituellement parentérale : C3G (céfotaxime 100 mg/kg/24 h ou ceftriaxone 50 mg/kg/24 h) parfois associée à un aminoside. Seule la crainte d'une pneumonie staphylococcique (anamnèse, contexte clinique, pneumopathie bulleuse ou avec épanchement pleural) pourrait conduire à une antibiothérapie élargie associant à une C3G injectable de la fosfomycine ou de la vancomycine.
Évolution
Sous traitement initial adapté, l'amélioration clinique varie en fonction de l'agent microbien présumé responsable.
Le critère principal d'efficacité thérapeutique est l'évolution de la fièvre. L'apyrexie est habituellement obtenue en moins de 36 heures en cas de pneumonie à pneumocoque (bon critère diagnostique probabiliste rétrospectif).
La toux se réduit en quelques jours mais peut être plus prolongée notamment en cas d'infection à mycoplasmes (hyperréactivité bronchique).
Une évaluation clinique et éventuellement radiologique à 48/72 heures de traitement n'est nécessaire qu'en cas de permanence de la fièvre et de signes fonctionnels respiratoires (fig. 18.25 ).
Fig 18.25.

Arbre décisionnel stratégique dans les pneumonies aiguës de l'enfant sans signe de sévérité.
Une nouvelle radiographie thoracique n'est pas indiquée selon les recommandations de l'Afssaps si l'évolution clinique est satisfaisante (apyrexie et disparition des signes fonctionnels respiratoires). Un contrôle au terme d'un mois est cependant utile pour affirmer la guérison de la pneumonie et permettre de définir en cas de nouvel épisode le caractère authentique d'une récidive.
Il est recommandé de traiter
-
•
une pneumonie à pneumocoque pendant 10 jours ;
-
•une pneumonie à bactérie atypique pendant une durée variable selon les macrolides utilisés :
-
–josamycine (Josacine) 50 mg/kg/j pendant 15 jours,
-
–ou clarithromycine (Zeclar) 15 mg/kg/j en 2 prises pendant 5 à 7 jours,
-
–ou azithromycine (Zithromax) pendant 5 jours.
-
–
La persistance de la fièvre ou des signes respiratoires au terme de 48 à 72 heures, au décours d'un traitement par amoxicilline (ambulatoire) ou C3G injectable (hospitalier), conduit à la pratique d'un cliché thoracique (fig. 18.26 ) :
-
•
si l'image thoracique reste inchangée, l'éventualité d'une infection à Mycoplasma pneumoniae se précise et un macrolide est substitué au traitement antérieur ;
-
•
si le cliché thoracique met en évidence un épanchement pleural, l'hospitalisation est justifiée pour préciser sa nature (échographie thoracique et ponction), pour modifier l'antibiothérapie et éventuellement associer des traitements adjuvants.
Fig 18.26.

Prise en charge d'une pneumopathie infectieuse de l'enfant.
Pleuropneumopathies de l'enfant
Physiopathologie
Le liquide pleural est produit essentiellement par la plèvre pariétale ; il transsude des vaisseaux systémiques de la plèvre, transite par l'interstitium et traverse le mésothélium vers l'espace pleural.
Ce liquide est ensuite totalement drainé par la plèvre pariétale vers les lymphatiques sous-pleuraux.
Au cours d'une infection pulmonaire, le processus inflammatoire :
-
•
augmente la perméabilité capillaire (plèvre viscérale) ;
-
•
altère l'intégrité endothéliale ;
-
•
permet le passage d'un liquide riche en protéines mais stérile ;
-
•
aboutit à la formation de fibrine ;
-
•
et permet l'organisation d'une coque autour du poumon.
Au cours d'une pleurésie purulente, le nombre des cellules est habituellement supérieur à 104/mL : les protides > 30 g/L et le glucose < 2,2 mmol/L.
Le diagnostic de pleurésie purulente est, comme celui de la pneumonie aiguë, évoqué devant un tableau associant habituellement :
-
•
des signes fonctionnels : polypnée, toux, mais plus fréquemment douleurs thoraciques ou abdominales ;
-
•
des signes physiques : polypnée (compter toujours la fréquence respiratoire), fièvre élevée, signes de comblement pleural ± condensation alvéolaire à l'auscultation et à la percussion clinique.
La ponction pleurale est indispensable au diagnostic étiologique si l'épaisseur de l'épanchement est supérieure à 1 cm (évaluation par échographie thoracique). Elle permet l'étude biochimique, cytologique et bactériologique susceptible d'identifier le germe et de guider l'antibiothérapie.
L'étude du liquide pleural permet l'isolement du germe dans environ 30 % des cas ; il autorise la pratique des antigènes solubles (Binax Now) et peut être complété par l'examen par PCR du gène de l'ARN 16 s En effet, la culture du liquide pleural est cependant habituellement stérile en raison des multiples antibiothérapies fréquemment reçues avant le diagnostic.
Le drainage pleural (cf. ci-dessous) n'est justifié qu'en cas d'intolérance clinique de l'épanchement.
Si l'examen bactériologique du liquide pleural est impossible, la confirmation du diagnostic bactériologique de la pleurésie purulente ne pourrait être affirmée, comme dans les pneumonies bactériennes, que par l'hémoculture.
Les antigènes solubles, le Binax (pneumocoque) contribuent à assurer l'orientation bactérienne étiologique. La NFS et le CRP évoquent un processus infectieux ou inflammatoire. La PCT orientera vers une origine bactérienne.
Imagerie
-
•La radiographie du thorax (face + profil) permet d'apprécier (fig. 18.27 ) :
-
–l'épaisseur de l'épanchement ;
-
–le retentissement sur le médiastin.
-
–
-
•L'échographie pleurale (fig. 18.28 ) autorise un repérage initial avant ponction et :
-
–évalue le volume de l'épanchement ;
-
–apprécie l'existence de cloisons parfois très précoces si pneumocoque.
-
–
-
•
L'examen tomodensitométrique thoracique peut évaluer l'état du parenchyme pulmonaire, identifier des lésions associées (abcès), guider éventuellement un drainage pleural chirurgical.
Fig 18.27.

Foyer pulmonaire gauche + épanchement supposé de grande abondance.
Fig 18.28.

Échographie thoracique (épanchement pleural cloisonné).
Traitement (fig. 18.29)
Fig 18.29.

Schéma de prise en charge thérapeutique (réduction de l'indication des drainages si épanchements cloisonnés ou bien tolérés).
Traitement médical
Antibiothérapie
L'antibiothérapie doit répondre à trois objectifs :
-
•
être adaptée aux trois principales bactéries responsables des pleurésies purulentes : Streptococcus pneumoniae (pneumocoque), Staphylococcusaureus, Streptococcus pyogenes (streptocoque du groupe A) ;
-
•tenir compte de la résistance de ces bactéries aux antibiotiques (2007) :
-
–S. pneumoniae : 30 % de sensibilité diminuée à la pénicilline ; 60 % macrolides R,
-
–S. aureus : 10 % méthi-R,
-
–SGA : 0 % péni R ; 7 % macrolides R ;
-
–
-
•
répondre à des paramètres PK/PD adaptés (voir page 464).
Le temps supérieur à la CMI est, pour le pneumocoque, de 100 % pour la ceftriaxone, la rifampicine et la vancomycine.
L'antibiothérapie doit, dans de telles infections sévères, comporter une association synergique, type céfotaxime (ou ceftriaxone) et vancomycine, identique à celle proposée pour le traitement des méningites à pneumocoques résistants à la pénicilline.
La rifampicine (en association avec les C3G injectables) a des concentrations supérieures aux CMI pour les trois espèces bactériennes et son quotient inhibiteur est meilleur dans la plèvre vis-à-vis des pneumocoques et des staphylocoques.
Les études conduisant à l'évaluation comparative, dès la phase initiale, du drainage simple et des ponctions itératives ont conclu en l'absence de déviation médiastinale à l'efficacité identique de ces deux techniques vis-à-vis de la durée de la fièvre, du volume de liquide drainé, de la durée de l'antibiothérapie et de la durée de l'hospitalisation, etc.
Le drainage est donc le plus souvent inutile en l'absence de signes fonctionnels d'intolérance clinique ou de déviation médiastinale radiologique.
Traitements adjoints
Les fibrinolytiques intrapleuraux ont été proposés pour réduire les phénomènes de cloisonnement et permettre la facilitation du drainage pleural. Si leur bénéfice a été reconnu chez l'adulte, peu d'études randomisées ont été effectuées chez l'enfant et ils ne sont habituellement pas utilisés actuellement en pratique pédiatrique.
La corticothérapie orale a été proposée à visée antiinflammatoire dans le but de réduire la durée de la fièvre et de diminuer les séquelles et les remaniements pleuraux. Aucune étude randomisée concernant son efficacité n'apporte de contribution déterminante à leur indication.
Le traitement essentiel des pleurésies purulentes du jeune enfant est donc l'antibiothérapie parentérale : céfotaxime + vancomycine ou rifampicine. Le drainage ne se justifie que lors de pleurésies volumineuses et cloisonnées responsables d'une mauvaise tolérance clinique et/ou d'une déviation médiastinale radiologique.
Prévention
Le vaccin antipneumococcique heptavallent conjugué (Prevenar) a démontré son efficacité vis-à-vis de la réduction des pneumonies à pneumocoque concernant les sérotypes inclus dans le vaccin (réduction de 30 % environ), mais a conduit à une augmentation de sérotypes de remplacement.
Les 3 sérotypes 1, 19A et 7Fqui représentaient, en 2011, 50 % des bactéries responsables de pleurésies purulentes de l'enfant, sont actuellement inclus dans le vaccin antipneumococcique 13 valences (Prevenar 13).
Conclusion
Les pleurésies purulentes de l'enfant constituent parmi les pathologies infectieuses pédiatriques un problème d'une très grande actualité. Leur augmentation est généralement constatée dans tous les pays du monde.
L'incidence éventuelle, dans leur physiopathologie, de la prescription d'anti-inflammatoires non stéroïdiens reste discutée.
BIBLIOGRAPHIE
- Houdouin V., Bourrillon A. Pneumonies et pleuropneumopathies bactériennes. In: Beydon N., editor. Pneumologie pédiatrique : guide pratique. Elsevier Masson; Issy-Les-Moulineaux: 2011. pp. 91–102. [Google Scholar]
- Maataoui N., Bidet P., Bingen E. A multiplex polymerase chain reaction method for rapid pneumococcal determination in childhood empyema. Diagn Microbiol Infect Dis. 2011;69:245. doi: 10.1016/j.diagmicrobio.2010.10.001. 9. [DOI] [PubMed] [Google Scholar]
Méningites infectieuses
Voir aussi chapitre 30, page 795.
Épidémiologie
L'incidence des méningites bactériennes est beaucoup plus élevée chez l'enfant que chez l'adulte.
Elle est estimée tous âges et tous germes confondus à 2,2/100 000 habitants en France, et à 50/100 000 habitants dans les pays en voie de développement.
Elles constituent des situations d'urgence diagnostique et thérapeutique.
La mortalité et les séquelles sont très élevées dans les pays en voie de développement. Elles demeurent également élevées dans les pays industrialisés malgré une antibiothérapie précoce et adaptée.
En France, les méningites à pneumocoque ont une mortalité évaluée à 10 % et des séquelles à 30 %.
Deux bactéries prédominent au cours des méningites bactériennes purulentes de l'enfant (tableaux 18.18 et 18.19 ) :
-
•
le pneumocoque (Streptococcus pneumoniae) : plus fréquent entre les âges de 2 et 12 mois ;
-
•
le méningocoque (Neisseria meningitidis) : plus fréquent après l'âge de 12 mois.
Tableau 18.18.
Distribution des méningites bactériennes (Observatoire des méningites, 2001–2009).
| Bactérie | Total |
Taux de mortalité (%) |
|---|---|---|
| N = 3 769 | 6 % | |
|
Neisseria meningitidis Groupe B Groupe C Autres groupes |
1 661 (44 %) 1 018 (61 %) 449 (27%) 194 (12 %) |
7 6 9 3 |
|
Streptococcus pneumoniae H. influenzae groupe B |
1 096 (29 %) 102 (3 %) |
11 2 |
| Streptocoque du groupe B E. coli |
537 (14 %) 217 (6 %) |
13 10 |
Levy C, Varon E, Bingen E ; Groupe de pédiatres et microbiologistes de l'Observatoire national des méningites : activ.france.fr. Arch Pédiatr 2011 : 18 : 91-3.
Tableau 18.19.
Fréquence relative (%) des différentes bactéries à l'origine des méningites selon le groupe d'âge, 2009.
| Âge | < 2 mois | 2-11 mois | 1-2 ans | 3-14 ans | 15-24 ans |
|---|---|---|---|---|---|
| Nombre de cas estimés | 112 | 182 | 106 | 162 | 167 |
| Haemophilus influenzae | 1 | 0 | 11 | 3 | 1 |
| Neisseria meningitidis | 7 | 39 | 51 | 49 | 91 |
| Streptococcus pneumoniae | 9 | 51 | 38 | 48 | 7 |
| Streptococcus agalactiae (B) | 77 | 9 | 0 | 0 | 1 |
| Listeria monocytogenes | 6 | 1 | 0 | 0 | 0 |
Epibac, France 2009.
Bactéries et résistances selon l'âge
Encadré 18.12.
Synthèse (2011)
Principales bactéries des méningites purulentes de l'enfant
-
•
À tout âge, le méningocoque. Il prédomine cependant chez l'enfant âgé de plus de 1 an (60 % environ) (méningocoque B dans deux tiers des cas ; méningocoque C dans un tiers des cas).
-
•Chez le nourrisson âgé de moins d'un an, le pneumocoque est :
-
-le plus fréquent : 60 % des méningites bactériennes à cet âge ;
-
-le plus sévère : mortalité 10 % ; séquelles psychomotrices, auditives (première cause de surdité acquise chez l'enfant] et cognitives (30 %).
-
-
-
•
Les méningites à Haemophilus influenzae b ont quasi totalement disparu en France, depuis la généralisation de la vaccination contre ce germe. Quelques cas de méningites à Haemophilus influenzae non b sont actuellement décrits. Haemophilus influenzae b reste cependant l'un des premiers germes responsables de méningites purulentes dans les pays en voie de développement ;
-
•
Entre les âges de 1 et 2 mois : le streptocoque B et Escherichia coli (germes de la période néonatale] sont encore prédominants. Streptococcus pneumoniae et Neisseria meningitidis ont une incidence limitée mais croissante.
Autres bactéries
L'incidence des autres bactéries est beaucoup plus rare et sur terrain particulier :
-
•
salmonelles : nourrissons atteints de malnutrition ou J enfants drépanocytaires ;
-
•exceptionnels :
-
-staphylocoque coagulase positive ou bacilles à Gram négatif (infections nosocomiales),
-
-germesopportunistes:enfantsimmunodéprimés.
-
-
Résistances bactériennes
Elles ont été évolutives depuis les années 1990 :
-
•
Neisseria meningitidis : sensibilité diminuée aux bêtalactamines (30 % en 2001) ;
-
•
Streptococcus pneumoniae : 12 % péni-R en 1992 ; 36 % péni-R en 1994 ; 53 % péni-R en 1997 ; 30 % péni-R en 2007 ;
-
•
Haemophilus influenzae b : 20 % ampicilline-résistants (ampi-R) essentiellement par production de bêtalactamases.
Pneumocoque
Les méningites à pneumocoque sont plus fréquentes entre les âges de 2 et 12 mois.
Elles représentent environ 60 % des méningites bactériennes à cet âge.
Streptococcus pneumoniae est une espèce bactérienne commensale des voies aériennes supérieures.
L'impact de la généralisation du vaccin antipneumococcique conjugué à 7 valences (Prevenar 7) s'est initialement traduit par une réduction du pourcentage des méningites purulentes liées à ce germe, ainsi que par une réduction de la résistance de celui-ci aux pénicillines.
Depuis 2007, le nombre de cas de méningites à pneumocoque s'est accru, en particulier du fait de l'émergence d'un pneumocoque de sérotype 19A. Ce dernier représentait en 2010 près de 20 % des pneumocoques responsables de méningites purulentes chez l'enfant, et est le plus souvent de sensibilité intermédiaire au céfotaxime (CMI aux C3G se situant entre 0,5 et 2 mg/L). L'émergence de sérotypes de remplacement (1, 3, 5, 6A, 7 F, 19A) a justifié en 2010 la recommandation généralisée du nouveau vaccin antipneumococcique conjugué à 13 valences (Prevenar 13).
Ce dernier contribuera très probablement dans les années à venir à la réduction du nombre de méningites liées aux sérotypes de pneumocoques inclus dans ce nouveau vaccin (en particulier le 19A).
Méningocoque
Les méningites à méningocoque sont plus fréquentes après l'âge de 12 mois mais l'incidence la plus élevée est observée chez les enfants âgés de moins de 1 an.
Elles représentent environ 60 % des méningites bactériennes après l'âge de 1 an.
Neisseria meningitidis est une espèce bactérienne commensale du rhinopharynx.
Elle possède une capsule polyosidique qui détermine son sérogroupe. Parmi les 12 sérogroupes décrits, le sérogroupe prédominant en France au cours des infections invasives à méningocoque est le B (2/3 environ), suivi de C (1/3 environ), puis du W135 et du Y (environ 3 % pour chacun d'eux). Toutes ces souches sont actuellement sensibles au céfotaxime et à la ceftriaxone.
La généralisation de la recommandation du vaccin antiméningococcique C conjugué et son remboursement sont effectifs depuis juin 2010.
La vaccination systématique des nourrissons âgés de 12 à 24 mois avec 1 seule dose de vaccin est recommandée ; ainsi que jusqu'à l'âge de 24 ans révolus selon le même schéma vaccinal à 1 dose.
Méningite et purpura fulminans s'intègrent dans le cadre des infections invasives à méningocoque.
La méningococcémie se définit par la présence de méningocoque dans le sang ou par prélèvement sur une biopsie cutanée, ou par le seul diagnostic clinique de purpura fulminans.
La méningite à méningocoque se définit par la présence de méningocoque dans le LCR, ou en cas de LCR évocateur de méningite si association soit à un purpura cutané, soit à des Ag solubles méningococciques positifs (sang, LCR, urines).
Un purpura cutané rapidement extensif peut être, ou non, associé au diagnostic de méningite à méningocoque.
Autres germes
L'incidence des autres bactéries dans les méningites purulentes de l'enfant est plus rare.
Le streptocoque du groupe B est le premier germe responsable des méningites chez les enfants âgés de moins de 2 mois. E. coli est le second germe aux mêmes âges.
Haemophilus influenzae b est actuellement exceptionnellement responsable des méningites de l'enfant depuis la généralisation en France de la vaccination anti-Haemophilus influenzae b.
Les méningites purulentes peuvent être liées à d'autres bactéries dans des contextes particuliers.
Elles surviennent habituellement chez des enfants plus âgés : salmonelles (enfant drépanocytaire), staphylocoque coagulase positif et bacilles Gram négatif (infections nosocomiales), germes opportunistes (immunodéprimés).
Physiopathologie
La Physiopathologie permet de mieux comprendre les données cliniques et thérapeutiques.
L'envahissement des bactéries vers les espaces méningés et le LCR s'effectue quasi exclusivement par voie hématogène. La pénétration par continuité (brèche méningée) susceptible d'induire des méningites à pneumocoque ou à Haemophilus influenzae non typable est exceptionnelle.
Les figures 18.30 et 18.31 résument les étapes successives de l'envahissement méningé par voie hématogène :
-
•colonisation bactérienne :
-
–des muqueuses nasopharyngées (pneumocoque, méningocoque),
-
–des muqueuses digestives (streptocoque du groupe B, E. coli) ;
-
–
-
•survenue d'une bactériémie élevée et prolongée expliquant :
-
–la fréquente positivité des hémocultures (pneumocoque : 75 %, méningocoque : 40 %),
-
–la nécessité d'une antibiothérapie précoce avec activité bactéricide systémique ;
-
–
-
•franchissement par les bactéries de la barrière hématoméningée :
-
–multiplication bactérienne lente dans le LCR,
-
–mais absence d'activité bactéricide naturelle dans le LCR (≠ sérum) ;
-
–
-
•réponse de l'hôte par la production de cytokines (TNF-α, interleukines 1 et 6) :
-
–afflux des PNN et augmentation de la perméabilité de la barrière hématoméningée,
-
–conduisant à l'inflammation méningée et l'œdème cérébral.
-
–
Fig 18.30.

Mécanismes d'envahissement des espaces méningés à partir d'une bactérie de portage nasopharyngé.
Fig 18.31.

Mécanisme général physiopathologique des méningites bactériennes.
Clinique et diagnostic
Reconnaître une méningite purulente est une urgence diagnostique et thérapeutique.
Le diagnostic doit être systématiquement :
-
•
suspecté sur les données cliniques (plus difficilement évaluables chez le nourrisson) ;
-
•
évalué en termes de gravité avant tout sur les données hémodynamiques et neurologiques ;
-
•
confirmé par l'étude du liquide céphalorachidien obtenu par ponction lombaire.
Il convient de repérer les signes cliniques susceptibles de conduire rapidement à cet examen.
Signes cliniques
Chez le nourrisson
C'est à cet âge que le diagnostic est le plus difficile. Il doit être évoqué devant :
-
•
une fièvre généralement élevée ;
-
•des signes d'infection potentiellement sévère :
-
–teint pâle ou gris, caractère geignard, somnolence,
-
–cris et pleurs inhabituels à la mobilisation, hyperirritabilité, inconsolabilité ;
-
–
-
•
un refus du biberon, des vomissements ;
-
•
des convulsions même brèves (notamment avant l'âge de 1 an).
L'examen neurologique doit particulièrement rechercher :
-
•
un bombement de la fontanelle antérieure avant l'âge de sa fermeture (identifiée au mieux en dehors des cris) ;
-
•une modification du tonus :
-
–hypotonie axiale (manœuvre du tiré-assis, position assise selon l'âge),
-
–raideur anormale à la mobilisation du rachis avec rejet de la tête en arrière ;
-
–
-
•
des signes neurologiques de localisation.
L'examen clinique recherche particulièrement à cet âge :
-
•
des signes de gravité (notamment hémodynamiques) ;
-
•des signes évocateurs d'infections associées :
-
–hautes : OMA purulente (35 % des cas si méningites à pneumocoque),
-
–basses : foyer pulmonaire plus rarement.
-
–
Chez l'enfant plus âgé
Le tableau clinique est souvent proche de celui décrit chez l'adulte, avec :
-
•un syndrome infectieux :
-
–fièvre à début brutal,
-
–parfois au décours d'une infection des VAS ou d'un syndrome grippal ;
-
–
-
•un syndrome méningé :
-
–céphalées, cervicalgies, photophobie,
-
–vomissements et/ou refus alimentaire.
-
–
L'examen neurologique doit conduire à rechercher :
-
•
une raideur de nuque (flexion de nuque douloureuse et limitée) ;
-
•
un signe de Kernig (flexion sur le tronc des membres inférieurs maintenus en extension, entraînant une flexion invincible des jambes sur les cuisses).
-
•
ou à évaluer un score de Glasgow.
Dans tous les cas, il convient de reconnaître comme situations d'urgence :
-
•les signes de gravité hémodynamiques → sepsis sévère :
-
–signes : tachycardie, TRC (temps de recoloration cutanée) , marbrures, extrémités froides, anurie, collapsus,
-
–urgence : remplissage vasculaire, contre-indication à la réalisation d'une PL ;
-
–
-
•les signes de gravité cutanés → laissant redouter un purpura fulminans (fig. 18.32 ) :
-
–purpura rapidement extensif et nécrotique (méningococcémie sévère),
-
–exigeant une antibiothérapie par C3G injectable avant transfert en réanimation ;
-
–
-
•
les signes de gravité neurologique → possiblement reliés à un tableau d'hypertension intracrânienne, abcès ou empyème sous-dural : troubles de conscience, coma, convulsions conduisant à la pratique d'une imagerie cérébrale (avant toute réalisation éventuelle d'une PL).
Fig 18.32.

Purpura fulminans.
Confirmation du diagnostic
Le diagnostic de méningite ne peut être affirmé que par l'examen du LCR.
Aucun examen complémentaire systématique : examen de l'hémostase (en l'absence de purpura) ou imagerie cérébrale, ne doit habituellement retarder la pratique d'une ponction lombaire.
Le fond d'œil, compte tenu des difficultés pratiques de sa réalisation en urgence ainsi que du retard d'apparition de l'œdème papillaire en cas d'œdème cérébral débutant, ne saurait être systématique avant la pratique d'une ponction lombaire.
Deux situations exigent de différer ou de ne pas réaliser une ponction lombaire immédiate :
-
–
le purpura fulminans et/ou une instabilité hémodynamique nécessitant un remplissage vasculaire et injection de C3G ;
-
–
des signes neurologiques sévères conduisant en premier lieu à la pratique d'une hémoculture (si possible) avant l'injection de C3G et la pratique de l'imagerie cérébrale (scanner)
Le pronostic des méningites bactériennes dépend de la rapidité de mise en route de l'antibiothérapie.
Caractéristiques du LCR
Analyse macroscopique
Elle montre un liquide hypertendu purulent ou trouble.
Analyse cytologique
-
•
Nombre de cellules > 10/mm3 avec prédominance habituelle de PNN altérés.
-
•Réaction panachée (PNN et lymphocytes) possible et alors liée :
-
–soit à la précocité de l'examen,
-
–soit à une antibiothérapie préalable inadéquate (méningite décapitée).
-
–
Analyse biochimique
-
•
Protéinorachie > 0,40 g/L.
-
•
Rapport glucose LCR/sang < 0,40 impliquant la nécessité absolue de doser la glycémie simultanément (l'hypoglycorachie serait par ailleurs l'indice d'un mauvais pronostic).
Examen direct
Il identifie très souvent le germe :
-
•coloration de Gram (résultat en 30 min mais opérateurdépendant) :
-
–cocci Gram positif : pneumocoque,
-
–diplocoque Gram négatif : méningocoque ;
-
–
-
•
Ag solubles Binax Now : S. pneumoniae.
À la culture (systématique)
Confirmation de l'identification de la bactérie et évaluation de la CMI de la pénicilline G, de l'amoxicilline et des C3G (céfotaxime : Claforan ou ceftriaxone : Rocéphine).
Hémoculture
Il est recommandé de réaliser au moins une hémoculture systématique.
Celle-ci permet d'isoler fréquemment la bactérie causale.
Elle ne se substitue pas à l'examen du LCR qui permet lui seul de porter le diagnostic de méningite.
Autres examens biologiques
Certains examens ont un intérêt complémentaire d'orientation vers une cause bactérienne :
-
•
NFS et CRP : hyperleucocytose et élévation de la CRP ;
-
•
dosage de la procalcitonine sérique si > 0,5 ng/mL ;
-
•
dosage des lactates dans le LCR si > 3,2 mmol/L.
D'autres examens peuvent permettre de confirmer la bactérie en cause :
-
•en cas d'examen du LCR négatif (cellularité sans germe au direct) :
-
–Ag solubles ; test immunochromatographique Binax Now : S. pneumoniae (pneumocoque),
-
–PCR pneumocoque ou PCR méningocoque dans le LCR ;
-
–
-
•selon les cas :
-
–PCR méningocoque dans le sang,
-
–PCR sur biopsie cutanée sur lésion nécrotique (celle-ci a un intérêt majeur en cas d'examen du LCR négatif ou impossible). La détermination du sérogroupe du méningocoque éventuellement isolé est le complément indispensable pour l'indication d'une prophylaxie vaccinale des sujets contacts.
-
–
Examens d'imagerie
L'imagerie cérébrale n'est pas systématique.
Le scanner cérébral (ou mieux l'IRM cérébrale) est indiqué en cas de signes cliniques évocateurs d'engagement cérébral (par déséquilibre de pression), ou plus exceptionnellement à ce stade en cas d'une complication abcédée précoce (empyème cérébral).
L'imagerie cérébrale (avant toute PL) est indiquée devant les signes suivants (Conférence de consensus, 2008) :
-
•
troubles de vigilance avec score de Glasgow < 11 ;
-
•crises épileptiques récentes ou en cours :
-
–si focales ou généralisées après l'âge de 5 ans,
-
–seulement si focales avant l'âge de 5 ans ;
-
–
-
•
signes de localisation neurologiques ;
-
•signes d'engagement cérébral :
-
–mydriase unilatérale, hoquet, mouvements d'enroulement,
-
–troubles ventilatoires, instabilité hémodynamique.
-
–
Un effet de masse et/ou des signes d'engagement cérébral à l'imagerie cérébrale contre-indiquent formellement la réalisation d'une ponction lombaire.
Traitement
Urgence et sévérité
La prise en charge d'une méningite purulente de l'enfant est une urgence thérapeutique.
La moindre suspicion clinique de méningite bactérienne conduit à une hospitalisation.
Les critères d'admission en réanimation médicale (Conférence de consensus 2008) sont :
-
•
un purpura extensif ;
-
•
un score de Glasgow ≤ 8 ;
-
•
des signes neurologiques focaux, des signes de souffrance du tronc cérébral ;
-
•
un état de mal convulsif ;
-
•
une instabilité hémodynamique.
L'orientation de l'enfant doit être alors au mieux toujours discutée avec un réanimateur pédiatrique.
Si l'enfant n'est pas hospitalisé en réanimation, l'admission devra se faire dans une unité de surveillance intensive ou rapprochée au cours des 24 premières heures et à proximité d'une réanimation prévenue de l'état de l'enfant.
Antibiothérapie
Rationnel
La prise en charge thérapeutique doit répondre à deux objectifs :
-
•
permettre une bactéricidie rapide dans le LCR ;
-
•
lutter contre l'inflammation méningée et l'œdème cérébral.
Le pronostic d'une méningite bactérienne dépend de la précocité de mise en route de l'antibiothérapie.
Celle-ci est débutée dès la réalisation de la ponction lombaire diagnostique, ou avant celle-ci si cette dernière est contreindiquée ou différée.
L'antibiothérapie repose sur la prescription d'une C3G injectable (céfotaxime ou ceftriaxone).
Une monothérapie « à doses méningées » est suffisante pour les méningites bactériennes à méningocoque et à pneumocoque « sensible ».
La crainte d'une méningite à pneumocoque « résistant » conduit à proposer chez l'enfant une antibiothérapie par une C3G injectable à doses méningées majorées (pour augmenter la concentration méningée), associé à un glycopeptide synergique tel que la vancomycine (pour réduire la CMI).
L'association de la vancomycine chez l'enfant demeure justifiée « pour les pédiatres » du fait des données suivantes :
-
•
concentrations variables du céfotaxime dans le LCR selon de grandes variabilités interindividuelles (si CMI C3G ≥ 0,5 mg/L) ;
-
•
retards de stérilisation observés sous C3G injectable en monothérapie ;
-
•
faible toxicité de la vancomycine ;
-
•
pourcentage encore élevé (20 %) des sérotypes 19A, intermédiaires à la pénicilline.
Modalités (tableau 18.20)
Tableau 18.20.
Traitement de première intention des méningites bactériennes de l'enfant selon l'orientation étiologique (cf.encadré 18.13).
| Orientation étiologique | Adaptation thérapeutique posologie | Rythme |
|---|---|---|
| N. meningitidis | Céfotaxime (200 mg/kg/j) Ceftriaxone (80-100 mg/kg/j) |
4 perf 1 à 2 injections] lente(s) |
| S. pneumoniae | C3G injectable (céfotaxime, 200 mg/kg/j) ou ceftriaxone (100 mg/kg/j) + vancomycine (40–60 mg/kg/j) | 4 perf 2 perf lentes 4 perf (> 60 min] ou perf continue (dose de charge 15 mg/kg] |
| H. influenzae | Céfotaxime (200 mg/kg/j) Ceftriaxone (80-100 mg/kg/j) |
4 perf 1 à 2 injection(s) lente(s) |
| Listeria | Amoxicilline en association avec gentamycine |
Les C3G injectables sont les antibiotiques de référence : céfotaxime 200 à 300 mg/kg/jour (Claforan) ; ceftriaxone 100 mg/kg/jour (Rocéphine).
Encadré 18.13.
Propositions pratiques (synthèse : Conférence de consensus)
Nourrissons et enfants âgés de moins de 5 ans
En cas de germe identifié à L'examen direct ou suspecté sur La positivité des résultats des antigènes soLubLes, L'antibiothérapie peut être immédiatement adaptée :
-
–
méningocoque : céfotaxime 200 mg/kg/24 heures en 4 perfusions ou ceftriaxone 100 mg/kg/j en 1 ou 2 injections intraveineuses lentes ;
-
–
Haemophilus influenzae b (enfant non vacciné) : céfotaxime 200 mg/kg/j en 4 perfusions ou ceftriaxone 100 mg/kg/j en 1 à 2 injections intraveineuses lentes ;
-
–
Streptococcus pneumoniae (pneumocoque) : (identification dans 75 % des cas environ dès L'examen direct). L'éventuaLité d'un pneumocoque résistant et L'objectif d'obtenir une bactéricidie rapide dans Le LCR conduisent à La prescription d'une association céfotaxime 200 à 300 mg/kg/24 h en 4 perfusions ou ceftriaxone 100 mg/ kg/j en 1 à 2 injections intraveineuses Lentes et de vancomycine (60 mg/kg/24 h en 4 injections intraveineuses Lentes d'une heure).
Si Le germe est uLtérieurement reconnu (E-Test) de sensibiLité normaLe au céfotaxime (CMI céfotaxime < 0,5 mg/L), L'antibiothérapie est réduite en une monothérapie par céfotaxime à La posoLogie habitueLLe (200 mg/kg/j) ; ou ceftriaxone (75-100 mg/kg/j).
Si La CMI des C3G est ≥ 0,5 mg/L, Le traitement initiaL est maintenu à L'identique.
Enfants âgés de plus de 5 ans
Le pourcentage actueL éLevé, en France, de La résistance du méningocoque à La péniciLLine (pLus de 25 % en 1998) conduit à La prescription initiaLe d'une céphaLosporine de 3e génération par voie intraveineuse : céfotaxime 200 mg/kg/j ou ceftriaxone 100 mg/kg/j. Cette antibiothérapie est également celle des méningites bactériennes à Haemophilus influenzae b (enfants. non vaccinés). Un contexte évocateur de méningite à pneumocoque (antécédents de traumatisme crânien ou de méningite purulente ; enfant drépanocytaire ; otite moyenne aiguë ou pneumopathies associées ; signes neurologiques sévères ; convulsions) conduit à la même antibiothérapie initiale que celle proposée chez le nourrisson (céfotaxime + vancomycine)
Si le diagnostic de méningite à pneumocoque est suspecté (âge < 1 an) ou confirmé (cocci Gram positif à l'examen direct du LCR, Binax Now S. pneumoniae positif) : une biantibiothérapie synergique = céfotaxime 300 mg/kg/jour (ou ceftriaxone 100 mg/kg/jour) + vancomycine (Vancocine) 60 mg/kg/jour est prescrite.
L'arrêt de la vancomycine et la réduction de la posologie du céfotaxime (300 à 200 mg/kg/jour) seront possibles si la CMI du pneumocoque aux C3G (à la culture du LCR) est inférieure à 0,5 mg/L (fig. 18.33 ).
Fig 18.33.

Traitement de première et de seconde intention des méningites à S. pneumoniae de l'enfant âgé de plus de 3 mois.
D'après le texte long de la Conférence de consensus 2008.
Si le diagnostic de méningite à méningocoque est suspecté (âge > 1 an, contage, purpura) ou confirmé (diplocoque Gram négatif à l'examen direct du LCR) : une monothérapie IV = céfotaxime 200 mg/kg/jour (ou ceftriaxone 100 mg/kg/jour) doit être prescrite.
La durée de l'antibiothérapie (en dehors de toute complication immédiate) diffère selon le germe :
-
•
10 à 15 jours pour le pneumocoque ;
-
•
5 à 7 jours pour le méningocoque.
Autres traitements
Traitement anti-inflammatoire
Les indications de la corticothérapie (dexaméthasone) restent discutées.
Celle-ci n'apparaît clairement démontrée comme susceptible de réduire les complications immédiates et tardives (surdité sévère) de l'enfant qu'au cours des méningites à Haemophilus influenzae b.
Elle aurait également un possible bénéfice au cours des méningites à pneumocoque (recommandations de la Conférence de consensus 2008 : dexaméthasone 0,15 mg/kg/4 fois/jour/4 jours en l'absence d'antibiothérapie parentérale antérieure).
La corticothérapie est inutile au cours des méningites à méningocoque.
Traitements symptomatiques associés
Un traitement antipyrétique et antalgique est justifié en cas de fièvre > 38,5 °C.
La restriction hydrique n'est indiquée que dans les sévères cas de SIADH (sécrétion inappropriée d'hormone antidiurétique) prouvé biologiquement.
Le monitoring de la pression intracrânienne et le traitement « agressif » de l'œdème cérébral n'ont pas été retenus par la conférence de Consensus 2008 mais leurs indications restent discutées.
Mesures de suivi
Le suivi immédiat est évalué avant tout sur la surveillance du niveau thermique (retour à l'apyrexie le plus souvent obtenu en 48 heures) et l'évolution des examens neurologiques répétés : mesure régulière du périmètre crânien, normalisation des signes neurologiques dans un délai de 2 à 5 jours.
Les examens complémentaires de surveillance sont adaptés aux données de l'évolution clinique :
-
•
NFS, CRP, PCT selon le caractère parfois durable du syndrome inflammatoire biologique ;
-
•l'examen de contrôle du LCR est (Conférence de consensus 2008) :
-
–inutile en cas d'évolution clinique rapidement favorable,
-
–mais indiqué à H48-H72 en cas d'évolution clinique défavorable (après imagerie cérébrale),
-
–et en cas de méningite à pneumocoque avec CMI aux C3G > 0,5 mg/L,
-
–ou en cas de méningite à germe inhabituel ;
-
–
-
•l'imagerie cérébrale, selon les recommandations de la Conférence de consensus de 2008 est :
-
–indiquée à H48-H72 en cas d'évolution clinique défavorable,
-
–et recommandée en cas de méningite à germe inhabituel.
-
–
Un test auditif adapté à l'âge est à réaliser dans les 15 jours suivant le début de la méningite.
Les infections sévères et invasives (sepsis, méningite) à bactéries encapsulées (pneumocoque, méningocoque et H. influenzae b), peuvent, même au décours d'un épisode unique, conduire à rechercher un déficit immunitaire (voir page 524).
Échec thérapeutique et complications
-
•
L'évolution clinique défavorable est définie par :la persistance au-delà de 48-72 heures après le début du traitement d'une fièvre > 38,5 °C et de troubles de conscience, céphalées importantes ;
-
•
et/ou des anomalies neurologiques durables ou aggravées voire des troubles sensoriels précoces auditifs ou visuels ;
-
•
l'augmentation du PC (nourrisson), ou la survenue de crises convulsives,
C'est dans ce contexte qu'il faudra avoir recours :
-
•
à une imagerie cérébrale ;
-
•
et à un contrôle de l'examen du LCR avec dosage de la C3G dans le LCR.
Selon les résultats et le dosage renouvelé des marqueurs infectieux, une modification de l'antibiothérapie est souvent prescrite.
La principale complication redoutée est l'empyème cérébral.
Suivi à long terme et pronostic
Le suivi doit être particulièrement attentif à dépister :
-
•une surdité acquise :
-
–par les otoémissions acoustiques (nourrissons), un audiogramme conventionnel (enfants plus âgés),
-
–à J15 de l'épisode aigu, puis tous les 3 mois pendant 1 an,
-
–suivis en cas d'hypoacousie précoce d'une consultation ORL pour évaluer l'indication d'une IRM labyrinthique ;
-
–
-
•
un retard de développement psychomoteur et des séquelles motrices ;
-
•
une hydrocéphalie par la mesure du périmètre crânien ;
-
•
une comitialité selon la survenue et des récidives de crises convulsives.
Les éléments de mauvais pronostic sont plus particulièrement :
-
•
le retard à la mise en route d'un traitement antibiotique bactéricide ;
-
•
l'âge : nourrisson ;
-
•
le germe causal : pneumocoque ;
-
•
la gravité du tableau neurologique initial : coma, signes de localisation neurologiques ;
-
•
l'existence d'un collapsus associé (choc septique) ;
-
•
la faible réaction cellulaire, l'hypoglycorachie, l'hyperprotéinorachie (à l'examen du LCR).
Un enfant précocement et correctement traité et dont l'examen neurologique s'est rapidement normalisé au décours de la phase aiguë peut être habituellement considéré comme préservé de séquelles tardives, avec une incertitude cependant vis- à-vis de l'éventualité de séquelles cognitives.
Prévention
Généralités
Les bactéries responsables des méningites purulentes de l'enfant proviennent du nasopharynx et sont susceptibles d'être diffusées à l'entourage avec cependant un risque minime de cas secondaires dans les pays développés.
L'isolement en milieu hospitalier du sujet malade est assuré jusqu'à la guérison clinique pour les méningites à méningocoque et Haemophilus influenzae b.
L'éviction de la collectivité des sujets contacts (éviction scolaire de la fratrie), la désinfection ou la fermeture d'un établissement scolaire fréquenté par l'enfant sont inutiles même en cas de méningite à méningocoque.
D'autres mesures ont pour but de réduire la survenue de cas secondaires. Ce sont, selon les bactéries causales :
-
•
une antibioprophylaxie des sujets contacts : méningocoque, Hæmophilus influenzae b (encadré 18.14 ) ;
-
•
la vaccination des sujets contacts (méningocoque C) ;
-
•
la déclaration obligatoire (infections invasives à méningocoque).
Encadré 18.14.
Sujet contact
Personne ayant été exposée directement aux sécrétions rhinopharyngées d'un cas dans les 10 jours précédant son hospitalisation, c'est-à-dire vivant ou gardé sous le même toit que le cas index pendant sa période de contagiosité.
Méningite à méningocoque
Antibioprophylaxie des sujets contacts
Les objectifs de l'antibioprophylaxie sont :
-
•
d'éliminer le portage chez les sujets exposés aux sécrétions oropharyngées de l'enfant atteint ;
-
•
et de prévenir la diffusion dans la population d'une souche pathogène par des porteurs sains.
Il faut retenir « en pratique » que l'antibioprophylaxie :
-
•
concerne les sujets contacts définis comme à risque (proximité : distance < 1 m et durée du contact > 1 heure) ;
-
•repose sur un rationnel bactériologique :
-
–efficacité sur N. meningitidis, avec concentration salivaire > CMI de la bactérie,
-
–action rapide et prolongée,
-
–administration sur une courte durée, absence de contreindications.
-
–
Elle doit être administrée rapidement : dans les 24-48 heures suivant le diagnostic en cas d'infection invasive à méningocoque. Elle n'a aucune utilité au-delà de 10 jours après le dernier contact avec le malade.
Elle consiste en la prescription de rifampicine (Rifadine) par voie orale pendant 2 jours aux posologies suivantes en informant d'une coloration possible des urines et des sécrétions lacrymales (lentilles de contact) :
-
•
nouveau-né : 5 mg/kg/12 h ;
-
•
nourrisson et enfant : 10 mg/kg/12 h ;
-
•
adulte : 600 mg/12 h.
Vaccination ciblée
Une prophylaxie vaccinale est indiquée pour les sujets contacts d'un cas dit IIM (Infections invasives à méningocoques) de sérogroupe A, C, Y ou W 135 vis-à-vis desquels un vaccin existe. D'une manière générale, l'utilisation des vaccins conjugués doit être privilégiée :
-
•
vaccin conjugué méningococcique C monovalent en cas d'IIM liée au sérogroupe C ;
-
•
vaccin tétravalent conjugué A, C, Y, W135 en cas d'IIM liée aux sérogroupes A, C, Y, W135 (Menveo) chez les enfants âgés de 11 ans et plus. La vaccination doit être alors réalisée au plus tard dans les 10 jours après le dernier contact avec le cas index.
L'évaluation du risque prend en compte l'ensemble des critères suivants :
-
•
la proximité (distance < 1 m) ;
-
•
la durée (augmentation du risque de transmission selon la durée pour une distance < 1 m), 1 h ;
-
•
le type de contact (face à face).
Aucun vaccin n'est actuellement (2011) disponible contre le sérogroupe B, le plus fréquent en France (2/3 cas).
Déclaration obligatoire
L'infection invasive à méningocoque est une pathologie infectieuse à déclaration obligatoire.
Le signalement est une procédure d'urgence et d'alerte.
Il doit être effectué sans délai par téléphone ou télécopie auprès du responsable de la veille sanitaire de l'ARS. Cette procédure permet à l'ARS d'identifier les sujets contacts, d'évaluer les mesures éventuelles de prophylaxie, d'organiser leur mise en œuvre, et de s'assurer qu'elles ont bien été prises. Les signalements transmis à l'ARS sont ensuite dirigés vers l'INVS (Institut de veille sanitaire) pour un suivi épidémiologique.
Méningite à pneumocoque
Les méningites à pneumocoque ne sont pas épidémiques.
L'antibioprophylaxie et la vaccination sont donc inutiles chez les sujets contacts.
Méningite à Haemophilus influenzae b
L'antibioprophylaxie n'est pas systématique.
Elle est indiquée chez les sujets contacts non vaccinés par le vaccin anti-Hæmophilus influenzae b.
L'antibiotique prescrit est la rifampicine (Rifadine) 20 mg/kg/j par voie orale pendant 4 jours.
Conclusion
La vigilance doit être maintenue vis-à-vis des structures de surveillance épidémiologique des méningites bactériennes de l'enfant et de l'adulte avec recours à des réseaux de surveillance clinique par des professionnels de santé.
Toutes les informations nouvelles repérées par ces différents dispositifs de surveillance pourront conduire à réviser dans les mois, voire les années à venir, les recommandations actuelles (2011).
Méningites à pneumocoque
La recommandation et la généralisation du vaccin antipneumococcique conjugué à 13 valences (Prevenar 13), depuis juin 2010, doivent conduire à la surveillance étroite de l'émergence des sérotypes de pneumocoque non inclus dans ce nouveau vaccin.
Méningites à méningocoque
La réussite de la politique vaccinale du vaccin antiméningococcique conjugué C recommandé actuellement entre les âges de 1 an à 24 ans est actuellement incertaine pour espérer permettre d'obtenir une immunité de groupe selon un schéma vaccinal limité à une seule dose. Ce schéma sera peut-être révisé lors de recommandations futures.
Une demande d'homologation devant les autorités européennes est en cours vis-à-vis d'un vaccin contre le méningocoque B. Les vaccins « OMV » spécifiques de clones n'ont été utilisés que sur autorisation d'utilisation dans des zones d'hyperendémie (notamment Seine-Maritime).
BIBLIOGRAPHIE
- BEH. 2011. Calendrier des vaccinations et les recommandations vaccinales 2011 selon l'avis du Haut conseil de la santé publique; pp. 10–11. 101-56. [Google Scholar]
- INVS. 2010. EPIBAC Surveillance des infections invasives.http://www.invs.sante.fr/surveillance/epibac/fiches.htm [Google Scholar]
- Floret D. Traitement des méningites bactériennes. Antibiotiques et traitement adjuvant. Arch Pédiatr. 2011;18:90. 7. [Google Scholar]
- levy C, varon E, bingen E et al.; GPIP (Groupe de pathologie infectieuse pédiatrique de la SFP). ACTIV et CNRPC (Centre national de référence du pneumocoque).
- SPILF . Prise en charge des méningites bactériennes aiguës communautaires : conférence de consensus. 2008. [Google Scholar]
Infections urinaires
Voir le chapitre 21.
Diarrhées aiguës bactériennes de l'enfant
D. Gendrel
À la différence de l'adulte, chez lequel la plupart des diarrhées aiguës bactériennes ont une évolution spontanée favorable, les diarrhées bactériennes de l'enfant comportent un risque septicémique qu'il convient de préciser.
L'intérêt de l'azithromycine et le recours éventuel en seconde intention aux fluoroquinolones sont des indications nouvelles concernant l'antibiothérapie des diarrhées bactériennes de l'enfant.
Pourquoi traiter ?
Le but du traitement est :
-
–
d'assurer un traitement curatif des formes sévères ;
-
–
d'éviter la survenue de complications ;
-
–
d'éviter la dissémination des germes dans l'environnement.
Ce dernier objectif est variable en fonction du germe considéré.
Ainsi, pour le choléra, l'antibiothérapie qui n'a aucune efficacité chez le malade évite la propagation du vibrion.
Pour les shigelles, il est prouvé que l'antibiothérapie non seulement réduit la durée de la fièvre et de la diarrhée mais surtout protège son environnement en diminuant l'excrétion fécale du germe chez les enfants atteints.
L'antibiothérapie des diarrhées à salmonelles n'a aucune action curatrice pour le patient ni protectrice pour son environnement.
Retenir aussi :
-
•
qu'il est important de différencier les diarrhées sanglantes des syndromes dysentériques systémiques (s'accompagnant de septicémie) ;
-
•
que toutes les diarrhées sanglantes ne sont pas bactériennes : 3 à 5 % des diarrhées à Rotavirus, ou à Calicivirus sont sanglantes.
En pratique
Encadré 18.15.
Recommandations ESPID-ESPGAN 2007
Doivent être traitées :
-
–
les diarrhées bactériennes systémiques ;
-
–
les shigelloses identifiées ;
-
–
les diarrhées graves à Campylobacter jejuni à la phase initiale (si le germe est identifié).
L'antibiothérapie est inutile pour les diarrhées habituelles, non sévères, à salmonelles.
Les diarrhées bactériennes du voyageur méritent une évaluation particulière chez l'enfant comme chez l'adulte.
Shigelles
Les diarrhées à ces germes justifient un traitement systématique du fait de la mortalité importante qu'elles risquent d'induire, en particulier chez le jeune enfant.
Ce traitement s'applique plus particulièrement à Shigella dysenteriae, Shigella flexneri. Il est également indiqué pour les autres types de diarrhées à Shigelles (Shigella boydii, Shigella sonnei).
Traitement de première intention :
-
•
azithromycine : 12 mg/kg le 1er jour (maximum 500 mg) ; 6 mg/kg les 4 jours suivants (maximum 250 mg), traitement de 5 jours ;
-
•
alternative si résistance à l'azithromycine : céfixime (mais 40 % de résistance) ; ciprofloxacine (Ciflox) (prescription habituellement hospitalière chez l'enfant).
En cas de forme systémique sévère : ceftriaxone ou ciprofloxacine injectable.
Ces recommandations sont justifiées si l'infection à shigelles est prouvée ou fortement suspectée en période épidémique.
Salmonelles
Le traitement des diarrhées à salmonelles n'a aucune efficacité symptomatique ni de réduction du portage.
Seules les formes sévères, c'est-à-dire les fièvres thyphoïde à S. typhi, ou les formes septicémiques à S. typhimurum peuvent également justifier d'une antibiothérapie.
Le traitement de la fièvre typhoïde chez l'enfant repose sur la ceftriaxone. La ciprofloxacine induit une apyrexie et une réduction symptomatique plus rapide que la ceftriaxone ou l'azithromycine. Elle est conseillée par l'OMS pour le traitement de la fièvre typhoïde.
Les salmonelles non typhoïdiques justifient d'un traitement antibiotique dans les seules formes sévères avec symptomatologie systémique : ceftriaxone injectable avec relais oral par azithromycine ou ciprofloxacine.
Cette indication s'applique également aux jeunes enfants âgés de moins de 3 mois ou 6 mois selon les auteurs, aux enfants atteints des déficits immunitaires et aux enfants drépanocytaires.
Il importe de rappeler que le traitement antibiotique ne prolonge pas le portage mais ne l'évite pas ; celui-ci est moindre après fluoroquinolones qu'après bêtalactamines.
Campylobacter jejuni
Ce germe est susceptible d'induire des diarrhées sévères et sanglantes dont l'évolution spontanée est le plus souvent rapidement favorable.
Les formes sévères doivent être traitées dès la phase initiale, dans les 3 premiers jours (les résultats de la culture étant différés). Ainsi le traitement sera proposé dans les seules diarrhées glairosanglantes à Campylobacter avec l'identification du germe à l'examen direct des selles. Le traitement repose alors sur l'azithromycine.
Diarrhées du voyageur
Il devrait être exceptionnel d'avoir à traiter de façon présomptive une diarrhée du voyageur supposée bactérienne.
Dans le cas contraire et en cas de sévérité, il est proposé :
-
•
en première intention : l'azithromycine pour une durée de 5 jours ;
-
•
en alternative : céfixime (Oroken), voire ciprofloxacine (Ciflox) (à ne pas prescrire par excès) ;
-
•
si sévérité : traitement par ceftriaxone ou ciprofloxacine par voie injectable.
Il faut rappeler cependant que, quel que soit le recours antibiotique probabiliste avec indication actuellement plus large par l'azithromycine, la majorité des épisodes diarrhéiques chez l'enfant comme chez l'adulte aura une évolution spontanément rapidement favorable.
BIBLIOGRAPHIE
- Gendrel D., Chalumeau M., Moulin F., Raymond J. Fluoroquinolones pediatrics Risk for the patients or for the community. Lancet Infect Dis. 2003;3(9):537. doi: 10.1016/s1473-3099(03)00736-9. 46. [DOI] [PubMed] [Google Scholar]
Infections ostéoarticulaires
Cf. chapitres 10 et 30.
Infections cutanées
R. Cohen
Les infections cutanées bactériennes sont fréquentes en © pédiatrie. Les deux espèces habituellement impliquées sont Staphylococcus aureus et Streptococcus pyogenes ou streptocoque du groupe A. L'antibiothérapie empirique doit donc être principalement dirigée contre ces deux agents pathogènes. De nombreux antibiotiques sont disponibles mais ne sont pas tous d'efficacité équivalente sur ces deux germes. Les espèces bactériennes habituellement retrouvées dans les infections de la peau sont résumées dans le tableau 18.21 . La vaste majorité des bactéries impliquées est représentée par S. aureus (environ deux tiers des cas) et SGA (environ un tiers).
Tableau 18.21.
Bactéries le plus fréquemment retrouvées dans les infections cutanées.
| Type d'infection | Espèces habituellement retrouvées |
|---|---|
| Furoncle, anthrax Dermohypodermite (cellulite) |
S. aureus Pneumocoque, S. aureus, H. influenzae b (exceptionnel depuis la vaccination], SGA |
| Fasciite nécrosante Echtyma Eczéma surinfecté |
Streptococcus pyogenes (SGA), anaérobies P. aeruginosa S. aureus, SGA |
| Érysipèle | SGA (exceptionnellement d'autres streptocoques b-hémolytiques] |
| Impétigo Maladie bulleuse Nodules chroniques Morsures animales |
S. aureus, SGA S. aureus Mycobacterium marinum (aquarium) Pasteurelles, cocci à Gram positif, anaérobies |
Épidémiologie bactérienne, résistance aux antibiotiques et critères pharmacocinétiques/pharmacodynamiques
Qu'elle soit locale ou générale, l'antibiothérapie doit être principalement dirigée contre ces deux bactéries, en sachant qu'elles peuvent parfois s'associer. Les traitements empiriques doivent prendre en compte le niveau de résistance des bactéries (tableau 18.22 ). Le SGA ne présente à ce jour aucune résistance aux bêtalactamines (pénicillines et céphalosporines). À l'inverse, la résistance aux macrolides est aux environs de 10 % en France dans plusieurs études récentes. Cette résistance aux macrolides justifie leur usage prudent.
Tableau 18.22.
Résistances aux antibiotiques.
| S. aureus communautaire | SGA | |
|---|---|---|
| Amoxicilline | 100 % R | 0 % |
| Amoxicilline + acide clavulanique | 3-10 % R | 0 % |
| Méthicilline (Bristopen) | 3-10 % R | - |
| Macrolides | Méthi-S : 10–20 % T Méthi-R : 60 % | 10 % |
| Pristinamycine | 0 % | 0 % |
L' amoxicilline + acide clavulanique (Augmentin) (25 mg/kg/8 h), qui a de plus le meilleur temps au-dessus de la CMI (100 %), est ainsi l'antibiotique, par voie buccale, le plus adapté pour traiter à la fois les infections staphylococciques et/ou streptococciques communautaires.
La pristinamycine reste active in vitro sur l'ensemble des souches. Rappelons que les streptocoques (dont le SGA) ne sont classés que dans les espèces modérément sensibles à la Fucidine. Cet antibiotique ne peut donc être conseillé par voie générale lorsque ce germe est isolé ou suspecté. Le niveau de résistance à la pénicilline G de S. aureus est proche de 100 %. L'amoxicilline est donc inappropriée dans ce cas, mais les pénicillines M, les céphalosporines de 1re génération et l'association amoxicilline-acide clavulanique restent actives. Les céphalosporines orales de 3e génération (céfixime, cefpodoxime) ne doivent pas être utilisées du fait de leur activité médiocre sur S. aureus. Si parmi les souches isolées d'infections communautaires, la résistance à la méticilline reste encore faible, plusieurs études, en particulier aux États-Unis, montrent une augmentation importante de la résistance couplée à l'émergence de souche productrice de la redoutable toxine de Panton et Valentine. La résistance de S. aureus méticilline-sensible aux macrolides se situe actuellement, en France (2007), entre 10 à 20 %. Les synergistines restent généralement actives, mais perdent leur capacité de bactéricidie en cas de résistance aux macrolides. La Fucidine garde une bonne activité sur la grande majorité des souches de S. aureus.
Parmi l'ensemble des antibiotiques proposés, et si l'on prend en compte le SGA et S. aureus, c'est l'amoxicilline-acide clavulanique qui a les meilleurs critères pharmacocinétiques et pharmacodynamiques prédictifs d'efficacité. Parmi les pénicillines M, c'est la cloxacilline qu'il faut privilégier. Les avantages et inconvénients des différents antibiotiques sont résumés dans le tableau 18.23 .
Tableau 18.23.
Avantages et inconvénients des différentes familles d'antibiotiques.
| Antibiotiques | Avantages | Inconvénients |
|---|---|---|
| Péni M | SGA : activité constante S. aureus : moins de 10 % de souches résistantes Spectre étroit et parfaitement adapté aux infections cutanées |
|
| Amox + ac. Clav. | SGA : activité constante S. aureus : moins de 10 % de souches résistantes Excellents critères PK/PD |
|
| C1G AMM i céfatrizine (Cé'faperos) |
SGA : activité constante S. aureus : moins de 10 % de souches résistantes Pharmacocinétique linéaire (augmentation des doses possibles] |
|
| Macrolides AMM i josamycine (Josacme), roxithromycine (Rulid) | Bonne diffusion tissulaire |
|
| Pristinamycine (Pyostacine) | Activité quasi constante sur SGA et S. aureus |
|
| Acide fusidique (Fucidine) | Peu de souches de S. aureus résistantes |
|
Les deux antibiotiques locaux utilisables dans les infections cutanées sont l'acide fusidique et la mupirocine (encadré 18.16 ).
Encadré 18.16.
Antibiotiques locaux
Mupirocine (Mupiderm forme cutanée, Bactroban forme muqueuse)
Avantages
-
–
Active in vitro sur Sa et SGA.
-
–
Études cliniques ≥ antibiotiques oraux.
Inconvénients
-
–
Sélection de mutants.
-
–
Longtemps réservée, dans sa forme muqueuse, à l'éradication de la flore nasale des porteurs de SARM (Staphylococcus aureus résistant à la méticilline).
Acide fusidique (Fucidine)
Avantages
-
–
Mêmes formes cutanée et muqueuse.
-
–
Pas utilisé pour l'éradication des porteurs de SARM.
Inconvénients
-
–
Activité in vitro médiocre sur SGA mais activité clinique démontrée par voie locale.
-
–
Sélection de mutants.
À venir : reptamucine (Setargo).
Infections non compliquées
Certaines infections cutanées (impétigo localisé, furonculose, furoncle, folliculite superficielle, eczéma surinfecté, escarres, herpès, plaie, brûlures) ne justifient généralement pas une antibiothérapie par voie orale, mais simplement de traitements locaux (tableau 18.24 ).
Tableau 18.24.
Infections où l'efficacité de l'antibiothérapie locale est prouvée.
| Infections | Efficacité |
|---|---|
| Impétigo | Oui |
| Furonculose | Oui |
| Folliculite superficielle | Non |
| Furoncle | Non |
| Plaie | Non |
| Herpès | Non |
| Escarres | Non |
Pour le traitement de l'impétigo et de la furonculose, les antibiotiques locaux ont prouvé leur efficacité clinique. En ce qui concerne l'impétigo, il a été montré que pour les formes localisées, les antibiotiques locaux, notamment la mupirocine, étaient aussi efficaces qu'un traitement antibiotique prescrit par voie générale. Les indications et les modalités d'utilisation des antibiotiques locaux sont bien définies par les recommandations de l'Afssaps de décembre 2004.
Les indications sont les suivantes :
-
•
surface cutanée atteinte < 2 % (2 paumes de mains) de la surface corporelle ;
-
•
au plus, 5 sites lésionnels actifs ;
-
•
absence d'extension rapide.
Les modalités de l'antibiothérapie sont les suivantes :
-
•
idéalement 3/jour ; dans la pratique, du fait des problèmes d'observance, 2 fois/jour ;
-
•
pendant 5 à 10 jours ;
-
•
l'administration des antibiotiques locaux précédée de soins de toilette quotidiens à l'eau et au savon : le savonnage décolle les bactéries, le rinçage les élimine.
Ordonnance type (impétigo)
Enfant 18 mois – 11 kg
-
–Nettoyer les lésions à l'eau et au savon :
-
–bien rincer à l'eau claire,
-
–matin et soir.
-
–
-
–
Mupiderm pommade : 1 application 3 fois/jour pendant 7 jours.
A contrario, les indications d'antibiothérapie par voie générale sont :
-
•
impétigo bulleux ou ecthyma (forme nécrotique creusante) ;
-
•
surface cutanée atteinte > 2 % de la surface cutanée ;
-
•
plus d'une dizaine de lésions actives ;
-
•
ou extension rapide.
Dans les infections de la peau non compliquées justifiant une antibiothérapie par voie générale, les antibiotiques administrés per os sont les mieux indiqués. On retiendra que, du fait de l'évolution des résistances, il vaut mieux prescrire soit l'amoxicilline-acide clavulanique, soit une céphalosporine de 1re génération.
L'efficacité clinique des antiseptiques locaux dans le traitement des infections cutanées n'a jamais été réellement évaluée : comparativement à l'antibiothérapie locale ou en adjonction à celle-ci, ou en adjonction à l'antibiothérapie par voie générale, ni même par comparaison au lavage seul.
Infections cutanées sévères
Elles incluent principalement l'érysipèle et la fasciite nécrosante. Autrefois, H. influenzae b était très fréquemment en cause, mais le vaccin contre ce germe a considérablement modifié l'étiologie de ces infections et ce sont les cocci Gram positifs qui sont aujourd'hui les bactéries le plus fréquemment en cause. Une récente conférence de consensus a proposé les recommandations qui vont suivre.
Érysipèle
Le traitement antibiotique doit être à visée antistreptococcique et repose sur l'administration d'une bêtalactamine par voie intraveineuse. La pénicilline G est l'antibiotique de référence. Cependant, l'amoxicilline peut être préférée par voie orale si le maintien à domicile est possible. En cas d'hospitalisation, la voie intraveineuse sera préférée. La durée du traitement est de 10 à 20 jours en tenant compte de l'évolution locale (3 jours après la disparition des signes locaux). En cas d'allergie à la pénicilline, la pristinamycine (ou un macrolide) est le traitement de choix.
Dermohypodermites (cellulites)
Elles sont définies par une atteinte plus profonde. Les germes le plus fréquemment en cause sont les pneumocoques, S. aureus, H. influenzae b et les streptocoques. Le traitement de première ligne est l'amoxicilline-acide clavulanique.
Fasciites nécrosantes
C'est la précocité du geste opératoire dans les premières 24 heures suivant l'admission qui est l'élément déterminant du pronostic. De nombreuses équipes utilisent précocement l'injection IV d'immunoglobulines polyvalentes. Le SGA est le plus souvent en cause, en particulier lorsque l'infection survient au cours d'une varicelle. Dans les fasciites des membres et les cellulites cervicofaciales, les bactéries anaérobies sont fréquemment impliquées. Différentes études ont démontré l'importance d'adjoindre à une bêtalactamine, la clindamycine.
BIBLIOGRAPHIE
- Afssaps Prescription des antibiotiques par voie locale dans les infections cutanées bactériennes primitives et secondaires. juillet 2004. www.afssaps.sante rubrique RBP. [DOI] [PubMed]
- Conférence de consensus : Érysipèle et fasciite nécrosante : prise en charge. Méd Mal Infect. 2000;30:241. 5. [PubMed] [Google Scholar]
- Raymond J., Cohen R. Antibiotiques et infections de la peau et des parties molles. Médecine & Enfance. 2003;13:541. 4. [Google Scholar]
- Zimbelman J., Palmer A., Todd J. Improved outcome of clindamycin compared with beta-lactam antibiotic treatment for invasive Steptococcus pyogenes infection. Pediatr Infect Dis J. 1999;18:1 096. doi: 10.1097/00006454-199912000-00014. 100. [DOI] [PubMed] [Google Scholar]
Synthèse : recommandations de l'antibiothérapie dans les infections communautaires de l'enfant
Les données rapportées dans ce chapitre concernant les stratégies antibiotiques au cours des principales infections bactériennes de l'enfant sont très étroitement reliées aux recommandations de l'Afssaps.
Ainsi, l'année 2010 a été marquée par un « tournant » dans tous les pays du monde (dont la France) par l'émergence de nouveaux mécanismes de résistance en particulier pour des entérobactéries responsables d'infections communautaires (pyélonéphrites aiguës) comme E. coliet productrices de bêtalactamases à spectre étendu (BLSE).
Ces craintes doivent conduire plus que jamais, le prescripteur à :
-
•
limiter l'utilisation des antibiotiques notamment pour le traitement des infections des voies respiratoires hautes : « les antibiotiques, ce n'est pas automatique » ;
-
•
s'adapter aux conséquences de stratégies vaccinales évolutives (ex ; vaccin antipneumococcique) ;
-
•
choisir Lorsqu'ils sont indiqués Les antibiotiques Les moins séLectionnants impLiquant actueLLement une réduction majeure du recours aux céphaLosporines orales (cefpodoxime, céfuroxime) pour Le traitement des infections respiratoires hautes ;
-
•
mettre en place ou poursuivre Les missions des Observatoires des réseaux de surveillance épidémioLogique.
Tous ces objectifs sont susceptibles de conduire à des stratégies et recommandations d'antibiothérapie souvent rapidement évolutives selon des données épidémioLogiques actualisées.
BIBLIOGRAPHIE
- Bingen E., Cohen R., Bourrillon A. Journées Parisiennes de Pédiatrie. Flammarion; Paris: 2004. Critères de choix rationnel des antibiotiques pour le traitement des infections bactériennes en pédiatrie; p. 163. 8. [Google Scholar]
- Bourrillon A., Benoist G., Cohen R., Bingen E. Prescriptions de l'antibiothérapie chez le nourrisson. Arch Pédiatr. 2007;14(7):932. doi: 10.1016/j.arcped.2007.03.029. 42. [DOI] [PubMed] [Google Scholar]
- Cohen R., Bingen E., Grimprel E. Résistance aux antibiotiques i un nouveau tournant à ne pas manquer. Arch Pédiatr. 2011;18(4):359. doi: 10.1016/j.arcped.2011.01.023. 61. [DOI] [PubMed] [Google Scholar]
- Dupont D., Mahjoub-messai F., Francois M. Evolving microbiology of complicated acute otitis media before and after introduction of the pneumococcal conjugate vaccine in France. Diagn Microbiol Infect Dis. 2010;1:89–92. doi: 10.1016/j.diagmicrobio.2010.04.012. [DOI] [PubMed] [Google Scholar]
Infections spécifiques : Infections bactériennes
Coqueluche de l'enfant
E. Grimprel
La coqueluche est une maladie infectieuse respiratoire bactérienne qui touche l'homme, du nouveau-né à l'adulte et ce, dans le monde entier.
L'Organisation mondiale de la santé a évalué que chaque année, 60 millions de sujets sont atteints et environ 600 000 enfants meurent de cette maladie.
La coqueluche reste une maladie redoutable car parfois mortelle chez le nouveau-né et le jeune nourrisson en l'absence de vaccination.
Son éradication est illusoire car l'immunité acquise après maladie ou vaccination est limitée à quelques années (6-8 ans). En revanche, son contrôle est envisageable par le biais de la vaccination universelle des nourrissons avec rappels chez les adolescents et les adultes jeunes et du traitement prophylactique des cas et de leur entourage.
Les bactéries responsables sont Bordetella pertussis (ou bacille de Bordet et Gengou) et Bordetella para-pertussis. Ces deux bactéries à Gram négatif sont difficiles à isoler et restent localisées au niveau de l'appareil respiratoire au cours de la maladie.
Pathogénie
La maladie associe une infection localisée à l'épithélium respiratoire bronchique sans dissémination du germe hors de l'appareil respiratoire et un syndrome toxinique également localisé à l'arbre respiratoire mais également plus diffus, responsable de symptômes généraux et neurologiques. Pour exprimer sa virulence, Bordetella pertussis exprime deux types de facteurs :
-
•
les toxines : toxine pertussique (PT), adénylate-cyclase (AC), toxine dermonécrotique (TDN), toxine cytotrachéale (TCT) ;
-
•
et les adhésines : hémagglutinine filamenteuse (FHA), pertactine (PRN) et les agglutinines ou fimbriae (AGG) dont le tropisme respiratoire ou neurologique fait toute la gravité de la maladie, notamment chez le nourrisson.
Certains de ces facteurs sont cependant également immunogènes, contribuent à la protection et constituent les vaccins actuels.
-
•
L'adhésion de B. pertussis est la condition indispensable à la survenue de la maladie. L'attachement de la bactérie aux cellules ciliées est surtout dû à la FHA, la PT et la PRN. Le rôle des AGG est plus limité.
-
•
Le syndrome toxinique succède à l'implantation de B. pertussis et se traduit par la destruction des cellules ciliées, l'hypersécrétion de mucus, la paralysie phagocytaire. Les rôles respectifs des différentes toxines et en particulier l'AC ne sont pas encore clairement élucidés. La PT provoque des perturbations intenses des fonctions cellulaires en inactivant les protéines cytoplasmiques G. Elle est aussi responsable de l'hyperlymphocytose, de l'hypersensibilité à l'histamine et de l'hyperinsulinémie. Elle est très immunogène. Les anticorps anti-PT sont liés à la protection contre la coqueluche bien qu'ils ne supportent vraisemblablement pas l'entière responsabilité de l'immunité.
-
•
L'immunité acquise après la maladie ou la vaccination est d'installation longue notamment chez le jeune nourrisson chez lequel elle n'apparaît souvent que plusieurs mois après l'infection. Elle se réduira ultérieurement avec le temps pouvant se réactiver à l'occasion de contage (naturel) avec des sujets atteints ou après la vaccination spécifique qu'il convient de renouveler.
Manifestations cliniques
Coqueluche du nourrisson
Signes cliniques
-
•
L'incubation est silencieuse (une dizaine de jours environ).
-
•
La maladie débute par une rhinite avec toux rapidement émétisante (phase catarrhale). La contagiosité est alors rapidement maximale. Il n'y a pas ou peu de fièvre.
-
•
La phase des quintes lui succède. Les quintes sont des accès violents et répétés de toux, sans respiration efficace, qui aboutissent à une turgescence du visage, avec rougeur conjonctivale, vomissements, cyanose, puis reprise inspiratoire en fin de quinte, sonore et comparable au chant du coq. À la fin de la quinte, le sujet libère de façon difficile une expectoration muqueuse claire et épaisse. Entre les quintes, le sujet est totalement asymptomatique.
-
•
De multiples stimuli peuvent entraîner l'apparition d'une quinte : déglutition, cris, effort, examen du pharynx ou pression du cartilage cricoïde. Les quintes prédominent la nuit ; leur nombre va augmenter pendant une dizaine de jours et peut dépasser le chiffre de 50 par 24 heures. Cette période des quintes dure généralement 3 à 4 semaines.
Gravité (encadré 18.17)
Encadré 18.17.
Signes de gravité d'une coqueluche du nourrisson
-
–
Âge inférieur à 3 mois.
-
–Quintes :
-
-caractère facilement provoqué (examen alimentation),
-
-fréquence, apnées, cyanose, bradycardie.
-
-
-
–
Difficultés d'alimentation (dénutrition).
-
–
Météorisme abdominal.
-
–
Troubles de la conscience.
-
–
Signe d'infection secondaire (fièvre élevée).
-
–
Hyperleucocytose (neutrophiles) ou surtout hyperlymphocytose reliée à la toxine pertussique.
-
–
Sécrétion inappropriée d'hormone antidiurétique.
La gravité de la coqueluche est essentiellement liée au jeune âge des malades, c'est-à-dire avant celui de 3 mois.
Le risque à cet âge est la survenue de quintes sévères :
-
•
quintes asphyxiantes (cyanosantes avec désaturation artérielle en O2) ;
-
•
quintes apnéisantes ou apnées silencieuses ;
-
•
accompagnées de bradycardies ;
-
•
plus rarement évolution vers une coqueluche « maligne » qui se traduit par un tableau de détresse respiratoire majeure avec hypoxie réfractaire, tachycardie extrême et défaillance multiviscérale à la fois cardiaque, rénale et neurologique (1 % des nourrissons hospitalisés). Le pronostic de ces coqueluches malignes est sévère, évoluant généralement vers le décès ou vers de graves séquelles pulmonaires.
Le risque de survenue d'une forme grave est élevé avant l'âge de 3 mois et justifie alors l'hospitalisation systématique. Ces formes graves nécessitent alors une prise en charge en réanimation.
Complications
Les autres complications de la coqueluche surviennent principalement chez le nourrisson :
-
•
trouble de ventilation pulmonaire (atélectasie) ;
-
•
oxygénodépendance;
-
•
surinfections : pneumopathies surtout (redouter particulièrement les bacilles Gram négatif) mais également otites purulentes favorisées par les vomissements ;
-
•
déshydratation ou malnutrition liées à l'intolérance alimentaire ou aux vomissements ;
-
•
plus rare encore, l'encéphalite de survenue différée, à la 2e ou 3e semaine et au pronostic sévère.
Coqueluche de l'enfant plus âgé et de l'adulte
Ces enfants ont acquis une immunité anticoquelucheuse, le plus souvent par la vaccination ou bien parfois à la suite de la maladie. Ils font en règle des formes moins sévères ou atypiques du fait d'une immunité protectrice résiduelle :
-
•
le classique chant du coq est inconstant ;
-
•
les symptômes se réduisent à une toux plus ou moins quinteuse mais souvent prolongée, au-delà de 8 jours, mais en règle inférieure à 2 mois.
Ces formes cliniques sont rarement reconnues comme des coqueluches au profit de diagnostics divers comme ceux de bronchite traînante, trachéite virale ou allergique, équivalent asthmatique, etc. La prolongation des symptômes respiratoires conduit souvent les patients à consulter plusieurs fois, et les médecins à prescrire de nombreux examens complémentaires (allant du simple cliché thoracique à l'endoscopie bronchique) et de multiples traitements anti-infectieux et antiasthmatiques inefficaces.
Lorsque l'immunité a disparu, les symptômes sont plus sévères et alors typiques : toux quinteuse violente et émétisante avec reprise inspiratoire sonore.
Chez l'adolescent et surtout l'adulte, des complications mécaniques peuvent alors survenir : fractures de côtes, douleurs musculotendineuses intercostales et abdominales, emphysème médiastinal, pneumothorax, otites barotraumatiques, hémorragie sous-conjonctivale, hernie, incontinence urinaire transitoire, prolapsus. Les complications infectieuses sont, à cet âge, les otites moyennes aiguës, les sinusites et les pneumonies.
L'infection, enfin, peut être plus sévère et plus longue chez les sujets fragilisés par une hyperréactivité bronchique de base (asthmatiques) et l'évolution se rapproche alors de celle du sujet non immun.
L'évolution de la coqueluche peut être prolongée (plusieurs semaines ou plusieurs mois) : la phase aiguë quinteuse est suivie par une convalescence de plusieurs semaines où la toux, désormais non quinteuse, persiste de façon spontanée (tic coqueluchoïde) ou provoquée par l'effort, le froid ou les cris, témoignant d'une probable hyperréactivité bronchique. La toux dure généralement au total 1 à 3 mois. Une pseudorechute est parfois observée chez le jeune nourrisson quelques jours ou semaines après la maladie, se manifestant par une réapparition transitoire des quintes, secondaire à une infection virale des voies aériennes. Les bronchites récidivantes sont ainsi possibles pendant plusieurs mois.
Diagnostic
Le diagnostic d'une coqueluche est essentiel car il permet une prise en charge précoce des sujets à risque de complications (jeune nourrisson) et un traitement des sujets contagieux (tous ceux qui toussent) afin de limiter la transmission. Ce diagnostic repose sur une présomption clinique et une confirmation biologique ou épidémiologique (contact prouvé avec un cas biologiquement confirmé).
Clinique
La présomption clinique est établie sur les trois critères suivants :
-
•
toux évocatrice car spasmodique et paroxystique, quinteuse, sans fièvre ni autre signe respiratoire, en particulier entre les quintes ;
-
•
qui persiste ou s'aggrave au bout de 7 jours ;
-
•
avec un contage potentiel dans l'entourage (sujet qui tousse) au terme d'une incubation « compatible » (de 5 à 15 jours).
Examens biologiques
-
•
La confirmation biologique repose sur la réaction de polymérisation en chaîne. C'est la méthode de référence pour les sujets toussant depuis moins de 21 jours et pour les cas secondaires que le cas index a contaminés si celui-ci tousse depuis 21 jours ou plus. Elle est remboursée en France depuis novembre 2010 ;
-
•
La culture sur milieu spécifique enrichi de Bordet et Gengou est moins sensible : maximale à la phase catarrhale (60 %), elle diminue rapidement (20 % à 15 jours d'évolution) ou si le sujet est traité par un antibiotique efficace (macrolide). Elle reste indispensable pour la surveillance des souches (CNR : Centre national de référence).
-
•
La sérologie doit être délaissée : sa fenêtre d'utilisation est très restreinte et les kits commerciaux utilisés en ville ne sont pas validés. Son remboursement a été supprimé en 2010.
Traitement
Traitement curatif
Aucun traitement n'a fait la preuve d'une efficacité curative au cours des coqueluches déclarées une fois atteinte la phase des quintes. Il est cependant essentiel car il a deux autres objectifs : prévenir les complications chez le jeune nourrisson et réduire la transmission.
Prévention des complications
-
•
Toute coqueluche du nourrisson de moins de 3 mois doit être hospitalisée et isolée.
-
•
Le monitoring cardiorespiratoire est indispensable (scope cardiorespiratoire).
-
•
Masque et embout d'oxygène doivent être à proximité de l'enfant.
-
•
L'alimentation sera fractionnée, parfois administrée par gavage.
Réduction de la transmission
-
•
Le traitement antibiotique reste indiqué et repose sur les macrolides. Le traitement de référence était l'érythromycine, mais n'est plus utilisé. Il faut désormais privilégier la clarithromycine 15 mg/kg en 2 prises pendant 7 jours, et l'azithromycine 10 mg/kg à J1, puis 5 mg/kg de J2 à J5 ou 10 mg/kg pendant 3 jours. Il n'y a pas de résistance aux macrolides documentée en France à ce jour. Les bêtalactamines sont inefficaces pour éradiquer le germe au niveau de l'arbre respiratoire. Les cas suspects ou avérés doivent être isolés pendant les 5 premiers jours du traitement, période au-delà de laquelle ils sont considérés comme non contagieux, même si les patients suspectés ont une toux persistante.
-
•
Les macrolides ont cependant un spectre limité vis-à-vis des germes responsables des surinfections bronchopulmonaires et otorhinolaryngologies chez l'enfant (pneumocoque, Haemophilus) et la survenue de telles surinfections au décours d'une coqueluche doit conduire à utiliser des molécules à spectre plus adapté (amoxicilline par exemple).
Autres traitements
-
•
Les sédatifs de la toux sont inutiles.
-
•
Les corticoïdes par voie générale ou inhalée et les bronchodilatateurs (salbutamol, terbutaline) n'ont pas fait preuve de leur efficacité dans les coqueluches de l'enfant et de l'adulte.
Traitement préventif
La vaccination est la meilleure prévention. Son utilisation a largement démontré son efficacité à la fois individuelle mais aussi collective, tant chez le nourrisson que chez l'adulte.
Deux types de vaccins coquelucheux sont utilisés dans le monde : les vaccins à germes entiers, qui ne sont plus disponibles en France depuis 2006, et les vaccins acellulaires (Ca ou ca) qui les ont remplacés. Ils sont combinés avec les autres vaccins du calendrier : diphtérie (D ou d), tétanos (T), polio, Haemophilus influenzae b (Hib), voire hépatite B (HB). Ils contiennent 2 à 5 antigènes coquelucheux purifiés (PT, FHA, PRN, AGG) et ont une meilleure tolérance locale et générale que les vaccins à germes entiers. Leur efficacité est de 85 %.
La vaccination contre la coqueluche n'est pas obligatoire mais recommandée. Le calendrier vaccinal français 2011 comporte :
-
•
une primovaccination précoce à 3 doses administrées à 2, 3 et 4 mois suivie d'un rappel à 16–18 mois avec un vaccin combiné pentavalent (DTCaPolio-Hib) ou hexavalent (DTCaPolio-Hib-HB) ;
-
•
un rappel tardif chez l'adolescent à 11–13 ans tétravalent (DTCaPolio) ;
-
•
un rappel tardif tétravalent (dTcaPolio) sous-dosé en anatoxine diphtérique (d) et valence coquelucheuse (ca) chez l'adulte ;
-
•
depuis 2004 : une vaccination chez l'adulte à risque de transmission au nourrisson (contact professionnel avec de jeunes nourrissons et adultes susceptibles de devenir parents dans les mois ou années à venir) ;
-
•
depuis 2008 : un rattrapage coquelucheux proposé chez l'adulte n'ayant pas reçu de vaccination contre la coqueluche au cours des 10 dernières années, notamment à l'occasion du rappel décennal diphtérie-tétanos-poliomyélite de 26–28 ans.
Les contre-indications vaccinales sont :
-
•
une anaphylaxie suivant une vaccination antérieure DTCOQ-Polio ou à un des constituants : néomycine, polymyxine, formol ;
-
•
une encéphalopathie d'origine inconnue survenant dans les 7 jours suivant une vaccination antérieure par un vaccin contenant la valence coqueluche ;
-
•
une maladie neurologique progressive convulsivante ou non, d'étiologie inconnue.
Les réactions suivantes ne sont pas des contre-indications mais citées parmi les mises en garde et précautions d'emploi :
-
•
fièvre ;
-
•
≥ 40 °C, dans les 48 heures sans autre cause identifiable ;
-
•
collapsus ou choc ;
-
•
cris persistants : durée ≥ 3 heures ;
-
•
convulsions avec ou sans fièvre dans les 3 jours suivant la vaccination ;
-
•
antécédents de convulsions fébriles nécessitent une prophylaxie de la fièvre.
Conduite à tenir chez un petit nourrisson non vacciné, ayant eu un contage avec un enfant ou un adulte coquelucheux ou suspect de coqueluche
-
–
Isolement du sujet malade au moins 3 semaines en l'absence de traitement ; 5 jours après le début d'une antibiothérapie efficace par un macrolide.
-
–
Traitement au même titre que tous les sujets contacts par 10 jours d'antibiotiques (macrolides).
BIBLIOGRAPHIE
- Grimprel E., Bassinet L. Formes cliniques de la coqueluche : du nourrisson à l'adulte. MTPédiatrie. 2006;9(3):138. 46. [Google Scholar]
- BEH. 2011. Calendrier des vaccinations et les recommandations vaccinales 2011 selon l'avis du Haut conseil de la santé publique; pp. 10–11. 101–56. [Google Scholar]
- Rapport du Conseil supérieur d'hygiène publique de France – section maladies transmissibles relatif à la conduite à tenir devant un ou plusieurs cas de coqueluche (Séance du 22 septembre 2006] (actualisation de la version du 1er septembre 2005), www.sante.gouv.fr/htm/dossiers/cshpf/r_mt_220906_catcoqueluche.pdf.
Scarlatine
E. Grimprel, A. Bourrillon
La scarlatine se définit comme une angine de l'enfant qui s'accompagne d'une éruption érythémateuse d'origine toxinique. Il s'agit d'une forme particulière d'infection pharyngée à streptocoque du groupe A bêtahémolytique, la souche bactérienne sécrétant une toxine érythrogène, après lysogénie par un bactériophage.
Présentation clinique
La contamination se fait par l'intermédiaire de gouttelettes de salive (contage direct) et donne lieu à une incubation de 3 à 5 jours.
-
•
La première phase est générale et correspond à l'invasion qui est brève (moins de 48 heures) et marquée par un début brutal avec fièvre élevée, tachycardie, malaise, frissons, algies diffuses (céphalées, douleurs abdominales), vomissements, douleur pharyngée et dysphagie. L'examen retrouve des adénopathies sous-digastriques sensibles, des amygdales turgescentes et un début d'énanthème buccal marqué par une muqueuse écarlate, une langue saburrale (pointe et bord rouge carminés).
-
•
La deuxième phase est éruptive et associe à l'énanthème initial, qui évolue, un exanthème (fig. 18.34 ). L'énanthème buccal devient caractéristique par la survenue d'une dépapillation de la langue entre le 2e et le 4e jour de type centripète (elle débute à la pointe de la langue et s'étend latéralement puis vers le centre de la langue), faisant apparaître un V lingual. La langue devient alors rugueuse et framboisée (entre le 6e et le 8e jour). C'est le tableau de glossite exfoliatrice aiguë. Pendant cette phase, l'angine persiste pendant 4 à 6 jours. L'exanthème débute au 2e jour aux plis de flexion et s'étend en 24 heures en une seule poussée au niveau du tronc, des membres, en respectant les paumes et les plantes. Il atteint parfois la face lui donnant un aspect souffleté et caractéristique par le respect de la zone du nez, de la région péribuccale et du menton. L'éruption est de type érythémateuse, écarlate, sèche, avec une sensation de granité à la palpation.
-
•
La troisième phase est post-éruptive. Elle survient après le 10e jour et se caractérise par une langue lisse, vernissée, écarlate et une desquamation cutanée qui débute là où l'exanthème a commencé avec de fines collerettes desquamatives au niveau du tronc, de fines squames furfuracées au niveau de la face et de larges lambeaux en doigt de gant au niveau des extrémités des membres.
Fig 18.34.

Scarlatine.
Complications
Les complications de la scarlatine sont celles des infections à streptocoque A. Elles se regroupent en trois types : complications septiques, toxiniques et immunologiques. Elles correspondent à des mécanismes différents qui font appel à des structures cellulaires du streptocoque particulières.
Constitution des streptocoques du groupe A
Les constituants antigéniques exocellulaires des streptocoques A comportent :
-
•
les toxines SLO ; SLS ; toxines érythrogènes A, B, C encore appelées exotoxines. Ces exotoxines sont différentes d'un point de vue immunologique mais ont des propriétés communes, en particulier l'induction de la fièvre et de lésions tissulaires hépatiques et myocardiques ;
-
•
les enzymes : streptokinase, DNAse, NADAse et hyaluronidase ;
-
•
d'autres protéines telles que les protéinase A, estérase et lipoprotéinase.
Les constituants antigéniques intracellulaires des streptocoques A sont situés :
-
•
au niveau de la capsule : acide hyaluronique ;
-
•
au niveau de la paroi, avec la protéine M qui permet d'identifier plus de 80 sérotypes, le polyoside C fait de N-acétylglucosamine et de rhamnose qui est à la base de la classification des streptocoques en 17 groupes par Lancefield, le peptidoglycane, et les acides teichoïques qui permettent d'individualiser deux autres groupes selon la classification de Lancefield.
Les toxines érythrogènes sont responsables des complications toxiniques de la maladie. Les enzymes ainsi que la capsule sont d'importants facteurs de virulence des streptocoques A qui induisent une relative résistance aux mécanismes naturels de défense de l'organisme et la diffusion de la bactérie au sein des tissus.
Les composants intracellulaires par leurs relations antigéniques avec certains tissus de l'organisme sont responsables de certaines manifestations du rhumatisme articulaire aigu : ainsi des relations sont établies entre : l'acide hyaluronique et les articulations ; la protéine M et le myocarde ; le polyoside C et les valves cardiaques ; et certaines protéines, glucides et lipides avec les noyaux caudés et subthalamiques (chorée).
La glomérulonéphrite aiguë streptococcique fait intervenir un double mécanisme à la fois toxique par l'intermédiaire des toxines actives sur le rein et immunopathologique par le biais d'antigènes streptococciques présentant une réaction croisée avec la membrane basale glomérulaire et faisant intervenir la voie alterne du complément, la formation d'immuns complexes et l'immunité cellulaire.
Infections à streptocoque A : complications
Les infections invasives à streptocoque A peuvent s'exprimer sur le plan local, par une diffusion de l'infection à la sphère ORL, mais également locorégionale avec une extension vers les tissus mous, ou bien à distance par le biais de bactériémies-septicémies et l'apparition de foyers secondaires.
Plus exceptionnelle, la fasciite nécrosante à streptocoque A est une entité particulière qui atteint, selon la porte d'entrée, la zone cervicale ou un membre. Le tableau est d'emblée gravissime avec un aspect septique (fièvre, frissons, trouble hémodynamique) et la survenue d'un œdème douloureux pâle et froid cutané avec des plages de cyanoses, un purpura distal nécrotique et de fréquentes bulles au sein du purpura. Son traitement consiste en une fasciotomie en urgence avec drainage des collections éventuelles, antibiothérapie intraveineuse couvrant le streptocoque A (dans l'urgence bêtalactamines + clindamycine). L'héparinothérapie et l'oxygénothérapie hyperbare restent actuellement discutées.
Complications toxiniques
Ces complications étaient décrites dans le passé sous les termes de scarlatine toxique ou maligne ou fulminante. Désormais, elles sont appelées Toxic Shock Syndrome streptococcique ou bien syndrome de choc streptococcique. Le TSS streptococcique se manifeste par l'apparition d'une fièvre élevée avec érythrodermie et hypotension et au moins trois atteintes supplémentaires parmi l'atteinte digestive (vomissement ou diarrhée), musculaire (myalgies, élévation des CPK), neurologique (désorientation temporo-spatiale ou trouble de conscience), muqueuse (pharyngée, conjonctivale, vaginale), rénale (insuffisance rénale, leucocyturie), hépatique (élévation de la bilirubine ou des transaminases) et hématologique (thrombopénie < 100 000/mm3).
Une parenté existe avec le Toxic shock syndrome staphylococcique avec toutefois une fréquence moindre de l'exanthème et de la desquamation, une défaillance multiviscérale plus sévère, des hémocultures plus souvent positives et une mortalité plus élevée. Trois exotoxines sont actuellement décrites avec les streptocoques A (A, B et C) qui sont pyrogènes et retrouvées chez 90 % des streptocoques sécréteurs d'exotoxines.
Au début du xxe siècle, l'exotoxine de type A était la plus souvent retrouvée et semblait correspondre à des scarlatines parfois sévères. Au milieu du xxe siècle, ce sont les exotoxines B et C qui étaient alors retrouvées et les scarlatines apparaissaient moins fréquentes et moins sévères.
Depuis les années soixante-dix – quatre-vingt, c'est le type A qui a de nouveau été mis en évidence principalement au cours des infections graves toxiniques et invasives aux États-Unis.
Complications immunologiques
Ces complications sont le rhumatisme articulaire aigu, la glomérulonéphrite aiguë post-streptococcique, la chorée et l'érythème noueux.
À la différence des complications invasives et toxiniques, il ne semble pas actuellement être observé d'une augmentation de ces complications dans les pays développés.
Rhumatisme articulaire aigu
Le RAA est devenu rare dans les pays développés, probablement du fait de l'amélioration des conditions d'hygiène et du traitement systématique des angines par les antibiotiques. Une étude française a estimé son incidence entre 0,13 et 0,17/100 000 enfants de 4 à 14 ans, la moitié des cas correspondant à des RAA d'importation.
Toutefois des foyers épidémiques ont été rapportés dans les années quatre-vingt aux États-Unis dont l'explication ici encore reste floue. Il semble d'abord s'agir plutôt de foyers épidémiques que d'une réelle résurgence et diverses hypothèses ont été soulevées faisant intervenir un phénomène de tolérance du streptocoque vis-à-vis des antibiotiques, l'intervention de bêtalactamases oropharyngées, une mauvaise compliance au traitement ou des facteurs sociologiques.
La définition du RAA répond toujours aux critères modifiés de Jones. Un RAA confirmé nécessite l'existence de deux critères majeurs ou d'un critère majeur avec deux critères mineurs ; et dans tous les cas la preuve d'une infection streptococcique récente. Un tableau de douleur articulaire avec une élévation des ASLO (antistreptolysines O) ne constitue donc pas à lui seul un tableau de RAA. Par ailleurs, les ASLO sont fréquemment augmentées chez l'enfant du fait d'infections streptococciques fréquentes et leur taux doit être interprété avec précaution.
Glomérulonéphrite aiguë post-streptococcique
Elle est moins fréquente que par le passé à l'instar du RAA et probablement ici encore, du fait de l'amélioration des conditions d'hygiène et du traitement antibiotique des infections pharyngées et cutanées.
Traitement de la scarlatine
C'est celui de l'angine streptococcique. Il repose sur l'antibiothérapie, son objectif est la prévention des complications. L'efficacité du traitement antibiotique des angines à SGA est démontrée sur les critères suivants : accélération de la disparition des symptômes, éradication et diminution de la dissémination du SGA à l'entourage et prévention du RAA (démontrée pour la pénicilline G injectable).
Le traitement antibiotique nécessite d'apporter la preuve de l'infection streptococcique par la pratique au préalable d'un test immunoenzymatique (TDR) sur un écouvillonnage de gorge au cabinet du praticien.
Le traitement recommandé est alors l'amoxicilline pendant 6 jours. Les céphalosporines de 2e et 3e générations orales peuvent être utilisées, notamment en cas d'allergie aux pénicillines sans contre-indication aux céphalosporines : céfuroxime-axetil : 4 jours, cefpodoxime-proxétil : 5 jours. En cas d'allergie documentée aux bêtalactamines (pénicillines et céphalosporine), l'alternative thérapeutique repose sur les macrolides. Les traitements courts ont démontré leur efficacité chez l'enfant : azithromycine : 3 jours ; clarithromycine : 5 jours ; josamycine : 5 jours.
Maladie des griffes du chat (chez l'enfant immunocompétent)
La maladie des griffes du chat a été décrite par Robert Debré en 1950 comme une adénopathie survenant dans le territoire de drainage d'une plaie cutanée due à une « griffure » ou une morsure de chat.
Épidémiologie et transmission
Les agents bactériens (Rochalimaea henselae avant tout) sont hébergés dans la cavité buccale du pharynx de l'animal et déposés pendant la toilette sur le pelage et les griffes. La contamination de l'enfant se fait essentiellement par « griffure » (95 %), en particulier par les chatons. Lincubation est de 1 à 2 semaines. Il survient ensuite une papule au point d'inoculation évoluant vers une vésicule ou une pustule précédant la survenue d'une croûte régressive (épisode initial souvent méconnu).
Clinique (tableau 18.25)
Tableau 18.25.
Fréquence des manifestations cliniques chez des sujets atteints de la maladie des griffes du chat.
| Formes habituelles (= 85 % des observations) | % | Formes inhabituelles (= 15 % des observations) | % |
|---|---|---|---|
| Adénopathies isolées | 50 à 100 * | Syndrome oculoglandulaire de Parineau | 6 |
| Asthénie | 30 | Encéphalopathie aiguë (+ autres atteintes neurologiques) | 2,4 |
| Fièvre > 38,3 °C | 28 | Signes d'atteintes systémiques | 2 |
| Anorexie, vomissements | 14 | Neurorétinites | 1,4 |
| Céphalées | 13 | Érythèmes noueux | 0,8 |
| Splénomégalie | 9 | Atteintes hépatospléniques | 0,3 |
| Pharyngites | 7 | Ostéomyélites | 0,3 |
| Conjonctivites | 3 | Pneumonies atypiques | 0,2 |
Synthèse des données bibliographiques recueillies chez près de 2 000 patients atteints de la maladie. * Selon les études.
D'après Bourillon A, Lechanche L. Maladie des griffes du chat chez l'enfant. Revue du Praticien de Médecine générale 1994 ; 8 (266) : 41-6
Le diagnostic est habituellement porté devant des adénopathies localisées, satellites d'un site de griffure (ou de morsure) survenue environ 15 jours à 3 semaines plus tôt.
Le site habituel des griffures explique la topographie des territoires le plus fréquemment atteints : axillaire (45 % des cas), cervical et sous-maxillaire (25 % des cas) ou inguinal (10 % des cas).
Dans la moitié des cas, l'adénopathie est unique ; dans un quart des cas, il existe plusieurs adénopathies dans le même territoire ganglionnaire ; dans un tiers des cas, les adénopathies sont multiples et situées dans des aires ganglionnaires différentes témoignant soit de sites d'inoculation dispersés, soit d'une forme sévère systémique.
Les ganglions ont en général 1 à 3 cm de diamètre. Ils sont habituellement élastiques, mobiles, indolores ou sensibles à la palpation. La peau en regard est saine. Quinze pour cent d'entre eux évolueront vers la suppuration.
La fièvre est en général modérée. Une asthénie, une anorexie, des douleurs pharyngées, des éruptions variées, des arthralgies ont pu être décrites. La régression des signes est habituellement spontanée et lente.
L'actualité a conduit à mettre en évidence des formes inhabituelles de tableaux trompeurs ou sévères :
-
–
le syndrome oculoglandulaire de Panneau : il correspond à l'inoculation de l'agent pathogène au niveau de la conjonctive ou des paupières soit directement, soit indirectement par frottements des yeux avec des mains contaminées. Il associe une conjonctivite unilatérale non purulente mais douloureuse avec chémosis et œdèmes des paupières et des adénopathies prétragiennes. La guérison est spontanément la règle en quelques semaines ;
-
–d'autres manifestations témoignent, en général, d'une atteinte systémique, que celle-ci soit évoquée au sein d'un contexte marqué par l'intensité des signes généraux (fièvre élevée et prolongée) et d'une atteinte multiviscérale associée (cas les plus habituels), ou qu'elle reste limitée à une atteinte élective d'un organe ;
-
•encéphalite aiguë avec crise convulsive ou pathologies neurologiques variées (myélite, atteinte extrapyramidale, paralysie faciale, neuropathie périphérique, etc.) d'évolution toujours favorable ;
-
•atteinte hépatosplénique avec, à l'échographie abdominale, zones hypoéchogènes multiples de petite taille. La ponction biopsie hépatique sous échographie permet alors, si elle est pratiquée, de mettre en évidence des lésions d'hépatite granulomateuse (fig. 18.35 ).
-
•
Fig 18.35.

Maladie des griffes du chat : échographie abdominale.
Images de granulomes hépatiques et spléniques.
La guérison est ici encore la règle avec régression de la fièvre en quelques semaines et des images radiologiques en quelques mois.
-
–Les autres atteintes atypiques sont encore plus rares :
-
•osseuses (lésions ostéolytiques de topographie variable et avant tout vertébrale) ;
-
•hématologiques (anémie hémolytique, purpura thrombopénique) ;
-
•pseudo-tumorales (masse parotidienne ou mammaire) ;
-
•articulaires (arthralgies, arthrites) ;
-
•dermatologiques variées (érythème noueux, rash maculeux ou maculopapuleux, urticaire).
-
•tableaux de fièvres récurrentes avec adénopathies récidivantes.
-
•
Une entité particulière est représentée par l'angiomatose bacillaire survenant essentiellement chez les sujets immunodéprimés (infectés par le VIH).
Diagnostic
Dans les formes habituelles, le diagnostic est probabiliste sur le contexte suivant :
-
•
contage avec un chat : exclusion de toute autre cause de lymphadénopathie chronique et résolution spontanée rapide ;
-
•formes atypiques qui seules peuvent bénéficier d'examens complémentaires :
-
–diagnostic sérologique par les techniques d'immunofluorescence indirecte ou les techniques ELISA (IgM ; IgG),
-
–surtout, biologie moléculaire : PCR sur prélèvement tissulaire selon les cas (IgG).
-
–
Pronostic
Le pronostic de la maladie des griffes du chat est le plus souvent excellent chez l'enfant immunocompétent. L'atteinte ganglionnaire périphérique régresse spontanément en 2 à 6 mois chez 95 % des malades, parfois plus lentement, en 1 à 3 ans, chez 1 à 2 % d'entre eux.
L'immunité est solide et durable.
Traitement
Dans les formes habituelles, aucun traitement antibiotique n'apparaît justifié. L'exérèse chirurgicale n'est indiquée que si le diagnostic est incertain ou lorsque l'évolution est traînante. Dans les formes systémiques et chez les sujets non immunodéprimés, des succès thérapeutiques ont été observés avec certains antibiotiques :
-
•
azithromycine (10 mg/kg) en 1 prise à J1 et (5 mg/kg) en 1 prise de J2 à J5 ;
-
•
rifampicine (10 à 20 mg/kg/j) en 2 à 3 prises pendant 7 à 14 jours ;
-
•
ciprofloxacine (chez l'enfant âgé de plus de 12 ans) à la dose de 20 à 30 mg/kg/j en 2 prises pendant 7 à 14 jours.
Prévention
La seule mesure susceptible d'être efficace serait de conduire les enfants à ne pas avoir de contact avec les chats et notamment les chatons. On conçoit la difficulté à pratiquer de telles mesures (45 % des Américains possèdent un chat) et on connaît l'attachement souvent bénéfique des enfants pour ces animaux. La maladie constituée, il n'y a plus lieu de se séparer du chat incriminé (par ailleurs sain et asymptomatique) qui n'est sans doute contaminant que sur une très courte période (3 semaines environ).
BIBLIOGRAPHIE
- Leclainche L., Bourrillon A. Maladie des griffes du chat chez l'enfant immunocompétent. Arch Pédiatr. 1996;3(4):378. doi: 10.1016/0929-693x(96)84695-1. 82. [DOI] [PubMed] [Google Scholar]
Piqûres de tiques et maladie de Lyme
Toute morsure de tique acquise sur le territoire métropolitain est désormais considérée comme potentiellement vectrice de la borréliose de Lyme.
La période à risque de transmission correspond à la saison des tiques, soit de mai à octobre.
En contexte d'exposition aux piqûres de tiques, seule la présence de signes cliniques évocateurs doit faire discuter l'indication d'un traitement antibiotique curatif. Après piqûre de tique et en l'absence de signes cliniques, un traitement antibiotique préventif n'a plus d'indication.
Physiopathologie
Il s'agit d'une infection transmise par un vecteur ectoparasitaire : tique du genre Ixodes (I. ricinus en Europe).
L'infection bactérienne disséminée est due à une bactérie spirochète, mobile, intracellulaire du genre Borrelia (B. burgdorferi sensu lato dont trois espèces sont reconnues pathogènes chez l'homme en Europe : B. afzelii, B. garinii et B. burgdorferi sensu stricto).
Le réservoir de Borrelia est strictement animal (rongeurs, cochons sauvages, cervidés, oiseaux et renards) ; les tiques transitent d'un animal à l'autre suivant leur stade de développement s'infestant – et devenant ainsi infectantes – à tous les stades de leur développement (larve, nymphe, adulte). Les bactéries sont hébergées dans le tube digestif des tiques.
Les borrélioses sont des zoonoses (infections strictement animales) ; l'infection humaine est accidentelle et constitue une impasse bactériologique (pas de transmission hommeanimal ni interhumaine).
Si la transmission est possible sur tout le territoire métropolitain, il existe un gradient croissant ouest-est pour le risque de transmission de Borrelia après une piqûre de tique.
Le risque de transmission de Borrelia est significativement plus élevé si la tique est restée fixée à la peau pendant plus de 48 heures.
Clinique
La maladie de Lyme doit être suspectée devant l'association d'une exposition aux piqûres de tiques et de signes cliniques évocateurs.
La révélation est typique pour les bactéries spirochètes (voire tréponèmes) en trois phases :
-
•
phase primaire (phase localisée) ;
-
•
phase secondaire (phase disséminée précoce) ;
-
•
phase tertiaire (phase disséminée tardive).
La phase primaire est caractérisée par l'érythème migrant (EM) : lésion érythémateuse annulaire centrifuge, centrée sur la piqûre de la tique, dont le centre s'éclaircit à mesure que le halo s'élargit. LEM apparaît entre J3 et J30 après la piqûre de tique. Cette lésion est pathognomonique de la maladie de Lyme. Les lésions apparues avant la 72e heure ne doivent pas faire suspecter un EM, mais plutôt une réaction inflammatoire locale (granulome lié à un rostre non extrait ou infection à pyogène).
La phase secondaire n'apparaît qu'en cas de retard diagnostique ou d'échec thérapeutique en phase primaire. Les signes sont principalement neurologiques (méningoradiculites dont la plus classique est l'association méningite lymphocytaire/paralysie faciale ; méningites ; méningo-encéphalites) et rhumatologiques (mono ou oligoarthrites des grosses articulations, incluant typiquement les genoux). L'apparition de lésions d'EM à distance de la piqûre initiale est possible durant cette phase. Le lymphocytome cutané bénin (tuméfaction violacée pseudo-tumorale observée au niveau du pavillon de l'oreille ou du mamelon) est typique de cette phase. La cardite de la maladie de Lyme est caractérisée par des troubles du rythme ou de conduction.
La phase tertiaire (ou syndrome post-Lyme) est caractérisée par des symptômes non spécifiques : asthénie, céphalées, douleurs abdominales, arthralgies, troubles cognitifs associant des troubles de l'attention, de mémorisation ou d'apprentissage. Le retentissement sur la vie quotidienne a parfois valeur d'indication thérapeutique.
Confirmation diagnostique
Au décours d'une piqûre de tique (au moins 72 heures), la constatation d'un EM suffit pour affirmer le diagnostic de maladie de Lyme et débuter un traitement antibiotique curatif.
Le syndrome inflammatoire biologique est habituellement modéré ou absent. S'il est important, il doit faire discuter les diagnostics différentiels de la maladie de Lyme, infectieux ou non.
Le test d'immunofluorescence indirecte (ELISA : EnzymeLinked Immunosorbent 4ssay), très sensible mais peu spécifique, est utile pour le dépistage. La recherche d'anticorps spécifiques par empreinte immunologique (western blot) sert à confirmer biologiquement le diagnostic. La recherche de Borrelia par culture ou amplification génique (PCR) n'est pas envisageable en routine.
En cas de doute clinique, un test ELISA doit être proposé en première intention. S'il est négatif, aucun autre test ne doit être réalisé. S'il est positif ou douteux, un test en western blot peut être demandé.
Si le liquide céphalorachidien est prélevé, une méningite lymphocytaire (avec hyperprotéinorachie) est le plus souvent observée ; un test ELISA et une recherche d'anticorps spécifiques peuvent être réalisés sur le LCR.
La sérologie n'a aucun intérêt dans quatre cas (16e Conférence de consensus, décembre 2006) :
-
–
forme clinique évidente (EM) ;
-
–
sujets asymptomatiques après une piqûre de tique ;
-
–
dépistage systématique des sujets exposés non récemment piqués et asymptomatiques ;
-
–
contrôle des patients traités.
Attitude thérapeutique
Lors de la découverte d'une tique fixée sur la peau : il convient d'avoir deux réflexes élémentaires (fig. 18.36 ) :
-
•
retirer la tique : au mieux à l'aide d'un crochet adapté vendu en pharmacie (ex : Tire tique) ; l'usage d'éther est formellement déconseillé car il favorise la contamination en provoquant la régurgitation des tiques. L'emploi d'une pince (ex : pince à épiler) a souvent le même effet en écrasant le corps de la tique. La persistance du rostre n'est pas associée au risque de maladie de Lyme (partie non infectante) ;
-
•
désinfecter la zone de piqûre de la tique (particulièrement en cas de persistance du rostre) pour éviter une infection locale à germes pyogènes.
Fig 18.36.

Schéma thérapeutique après piqûre de tique.
wb :Western Blot.
L'apparition d'un granulome (d'autant plus fréquente que le rostre est resté enchâssé dans la peau après retrait de la tique) doit être reconnue et différenciée d'un EM ou d'une infection locale à pyogènes. L'évolution naturelle est généralement bénigne (en l'absence d'infection locale à pyogènes). Le traitement médical sert à éviter la progression vers une phase secondaire ou tertiaire en éradiquant Borrelia de l'organisme. La variation du profil sérologique n'est pas l'effet du traitement antibiotique.
La survenue d'un em typique indique la prescription d'amoxicilline (per os) à 50 mg/kg/j en 3 prises pendant 2 à 3 semaines, sans nécessiter de confirmation biologique. À partir de 8 ans, la doxycycline (per os) à 4 mg/kg/j en 2 prises (max. 100 mg/ prise) peut être utilisée. L'azithromycine (30 mg/kg/jour en 2 prises) n'est prescrite qu'en cas de contre-indication à l'amoxicilline ou à la doxycycline.
Au-delà de 30 jours après une piqûre de tique et en l'absence d'EM, la sérologie (ELISA) ne doit être demandée qu'en cas de doute clinique ; si elle est positive, elle doit faire compléter le bilan clinique à la recherche d'une méningoradiculite, d'arthrites ou d'une cardite. Si une de ces atteintes est observée, le traitement antibiotique sera parentéral et prolongé (ceftriaxone pendant 4 semaines).
Prévention
Prévention primaire
Elle comporte les éléments suivants :
-
•
information du risque de transmission aux promeneurs et professions exposées (exploitants forestiers, agriculteurs) ;
-
•
port de vêtements couvrants (manches et jambes longues, col étroit) ;
-
•
utilisation de répulsifs antitiques (humains et animaux domestiques) ;
-
•
désinfection locale après ablation de la (des) tique(s) ;
-
•
éducation/surveillance de la survenue d'un EM.
Prévention secondaire
Elle consiste en :
-
•
l'inspection complète de tous les humains (cuir chevelu et plis) et animaux domestiques au retour de promenade ;
-
•
le retrait précoce de toutes les tiques fixées à la peau (sans éther) ;
-
•
le non-recours à une antibioprophylaxie ou une sérologie | systématique après piqûre de tique ;
-
•
la surveillance pour détecter l'apparition d'un EM.
Conclusion
Bien que la prévalence et l'incidence de la maladie de Lyme ne soient pas connues en France, il s'agit d'une maladie potentiellement transmissible sur l'ensemble du territoire métropolitain. La prévention primaire (éviter les piqûres de tique) est essentielle mais difficile à mettre en œuvre à grande échelle. L'information et l'éducation des familles sont capitales dans la prévention secondaire (conduite à tenir devant une piqûre de tique/traitement antibiotique dès la phase primaire en cas d'EM). Le traitement sert à limiter la progression vers les phases secondaire ou tertiaire, parfois invalidantes.
BIBLIOGRAPHIE
- Brouqui P., Bacellar F., Barenton G. Guidelines for the diagnosis of tick-borne bacterial diseases in Europe. Clin Microbiol Infect. 2004;10:1108. doi: 10.1111/j.1469-0691.2004.01019.x. 32. [DOI] [PubMed] [Google Scholar]
- Letrilliart L., Ragon R., Hanslik T., Flahaut A. Lyme disease in France : a primary care-based prospective study. Epidemiol Infect. 2005;133:935. doi: 10.1017/S0950268805004413. 42. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Société de pathologie infectieuse de langue française . 16e Conférence de consensus en thérapeutique anti-infectieuse. Institut Pasteur; Paris: 13 décembre 2006. Borreliose de Lyme : démarches diagnostiques, thérapeutiques et préventives. [PubMed] [Google Scholar]
Infections à Mycoplasma pneumoniae
Atteintes respiratoires
Mycoplasma pneumoniae est le seul mycoplasme respiratoire pathogène pour l'homme. Responsabe surtout de bronchites ou de trachéo-bronchites, il est le deuxième agent des pneumopathies communautaires bactériennes et est probablement impliqué dans les exacerbations de l'asthme. il peut être asymptomatique (25 % des cas).
La pneumopathie atypique justifie une confirmation diagnostique argumentant un traitement par macrolides (cf. Pneumonie aiguë communautaire page 468).
D'autres manifestations extrapulmonaires peuvent évoquer le diagnostic d'infections à Mycoplasma pneumoniae, qu'elles soient ou non associées à des signes d'atteintes respiratoires. L'encéphalite et la méningo-encéphalite sont les plus fréquentes des atteintes neurologiques. Des méningites, myélites et polyradiculonéphrites ont également été décrites.
Atteintes cardiaques et hématologiques
Les atteintes cardiaques essentiellement péricardiques et myocardiques peuvent engager le pronostic vital. L'anémie hémolytique (à agglutinines froides) est la plus fréquente des manifestations hématologiques.
Chez l'enfant drépanocytaire, Mycoplasma pneumoniae peut être à l'origine de crises aiguës vaso-occlusives ou d'infarctus pulmonaire.
Atteintes cutanées
Des formes cutanées d'expression variable (exanthème maculopapuleux, vésiculeux, bulleux), urticaire, érythème noueux, purpura rhumatoïde ont été décrites.
Mycoplasma pneumoniae peut être également responsable de fièvres prolongées avec asthénie durable.
Diagnostic
La preuve étiologique de diverses manifestations extrarespiratoires des infections à Mycoplasma pneumoniae est actuellement possible par amplification moléculaire mais aussi par les examens sérologiques sanguins de recours plus facile.
La pathogénie des atteintes extrapulmonaires n'est pas clairement élucidée ; elle repose probablement sur un mécanisme d'invasion directe et/ou un processus immunologique à médiation cellulaire.
Traitement
Le traitement repose habituellement sur la prescriptionde macrolides pour les pneumopathies (5 jours d'azithromycine ; 15 jours de josamycine).
BIBLIOGRAPHIE
- Bebear C.M. Physiopathologie et diagnostic des infections à Mycoplasma pneumoniae. Revue Française d'Allergologie et d'Immunologie clinique. 2007;47:438. 41. [Google Scholar]
- Garnier A., Noel G., Retournaz K. Infections extrapulmonaires à Mycoplasma pneumoniae. Arch Pédiatr. 2005;12:S2–S6. doi: 10.1016/s0929-693x(05)80002-8. [DOI] [PubMed] [Google Scholar]
- Gendrel D., Bicardi S., Marc E. Mycoplasma pneumoniae, pneumonies et asthme. Arch Pédiatr. 2005;12:S7–S11. doi: 10.1016/s0929-693x(05)80003-x. [DOI] [PubMed] [Google Scholar]
Infections à Salmonella
Le terme de salmonelloses regroupe toutes les infections cliniques, apparentes ou inapparentes, déterminées par les bactéries de l'espèce Salmonella enterica (encadré 18.18 ).
Encadré 18.18.
Principales salmonelloses de l'enfant
Fièvre typhoïde : bacille d'Eberth ou Salmonella typhi.
Fièvres paratyphoïdes :
-
–
Salmonella paratyphi A ;
-
–
Salmonella paratyphi B ;
-
–
Salmonella paratyphi C.
Salmonelloses non typhiques : plus de 2 200 sérotypes ; quelques exemples :
-
–
Salmonella Newport ;
-
–
Salmonella Manchester ;
-
–
Salmonella Karachi, etc.
Ces salmonelles appartiennent à la famille des entérobactéries dont elles s'individualisent par un ensemble de caractères culturaux, biochimiques et antigéniques communs, et sont à l'origine d'affections très différentes, non seulement dans leur expression clinique mais aussi dans leur physiopathologie et leur traitement.
II est classique et pratique de distinguer :
-
•
d'une part, les salmonelloses majeures, c'est-à-dire les fièvres typho-paratyphoïdes s'accompagnant de septicémie et d'endotoxinémie ;
-
•
d'autre part, les salmonelloses mineures ou salmonelloses non typhiques, responsables de gastro-entérites aiguës sans endotoxinémie mais se compliquant parfois de bactériémies, avec ou sans localisations.
Bactériologie et nomenclature des salmonelles
Caractères morphologiques et culturaux
Les salmonelles sont des bacilles Gram négatif de 1 à 3 μm, mobiles, aérobies-anaérobies, poussant facilement sur des milieux de culture ordinaires en 24 à 48 heures. Elles sont absentes de la flore normale du côlon.
Caractères biochimiques
Les salmonelles n'acidifient pas le lactose mais fermentent le glucose ; elles possèdent une nitrate-réductase mais n'ont ni oxydase ni uréase.
Caractères antigéniques
Chaque salmonelle possède une mosaïque d'antigènes parmi lesquels on distingue :
-
•
l'antigène somatique O de nature lipopolysaccharidique correspondant à l'endotoxine du germe ;
-
•
l'antigène flagellaire H de nature protéinique ;
-
•
l'antigène d'enveloppe K ou antigène de surface Vi (virulence) qui n'existe seulement que chez certains sérotypes de salmonelles (Salmonella typhi).
L'analyse des antigènes O et H a permis de répertorier plus de 2 200 sérotypes (classification de Kauffman et White selon la formule antigénique des salmonelles).
Dénomination
Les noms donnés aux sérotypes de Salmonella furent d'abord :
-
•
des noms de syndromes (S. enteritidis) ;
-
•
puis des noms d'animaux qui en semblaient les hôtes habituels (S. typhi murium).
Actuellement, on donne aux salmonelles le nom des villes où elles furent pour la première fois isolées (S. Dublin, S. Panama, S. Goettingen).
En France, c'est actuellement S. typhi murium qui est le sérotype le plus fréquemment isolé des salmonelloses ubiquitaires, suivi de S. enteritidis et S. virchow.
Apport de la biologie moléculaire
Il va modifier la classique nomenclature sérotypique des salmonelles qui sera progressivement abandonnée. L'analyse de la séquence du gène de l'ARN 16 S ribosomique classe l'espèce Salmonella enterica dans les protéobactéries du groupe gamma.
Épidémiologie et modes de contamination
Salmonelloses non typhiques
Les salmonelles sont présentes dans l'intestin de nombreux animaux sauvages et domestiques. La transmission est essentiellement orofécale (encadré 18.19 ) :
-
•
soit indirectement par l'intermédiaire de l'eau et des aliments souillés. Il s'agit d'une contamination digestive par ingestion de viandes mal cuites ou crues, d'abats ou de charcuterie mais surtout par les laitages, les volailles et les œufs. La contamination est également fréquente à partir de l'eau de boisson polluée ; enfin la contamination par consommation de coquillages est classique ;
-
•
soit directement par défaut d'hygiène (maladie des « mains sales »). Cette contamination interhumaine est plus rare. Elle se produit électivement à l'hôpital dans les services de nourrissons à partir d'un malade ou d'un porteur méconnu. En l'absence de précautions rigoureuses, les germes vont être dispersés rapidement par les mains du personnel soignant. C'est dans ce mode épidémiologique que certains sérotypes multirésistants peuvent être rencontrés (Salmonella Wien).
Encadré 18.19.
Transmission orofécale
-
–Contamination digestive et contamination interhumaine :
-
-eau souillée ;
-
-aliments contaminés ;
-
-chaîne alimentaire contaminée : viandes, œufs, poissons ;
-
-crustacés, coquillages ;
-
-matériel de collectivités ;
-
-maladie des mains sales.
-
-
-
–À partir des malades :
-
-hôpitaux (épidémie à Salmonella Wien dans les années soixante-dix) ;
-
-crèches.
-
-
-
–
À partir de porteurs sains (portage chronique).
Fièvres typho-paratyphoïdes
Les germes en cause sont Salmonella typhi (bacille d'Eberth) et Salmonella paratyphi A et B et C.
Le réservoir de germes pour Salmonella typhi et Salmonella paratyphi A est strictement humain. Les selles des sujets infectés en assurent la dissémination (rôle des porteurs chroniques). Le mode de contamination directe joue un rôle restreint, opposé à la transmission indirecte par l'eau et la consommation de coquillages ou de fruits de mer.
Incidence
Si les fièvres typhoïdes ont vu leur fréquence nettement décroître (3 à 4 % des salmonelloses), les salmonelloses mineures en raison de leur grande contagiosité sont en nette augmentation. Cette recrudescence s'accompagne d'un développement de souches multirésistantes.
Une prédominance estivo-automnale est retrouvée pour toutes ces infections à salmonelles.
La moitié des infections à salmonelles surviennent chez l'enfant et 50 % d'entre elles avant l'âge de 2 ans.
Portage asymptomatique
Des coprocultures systématiques, faites en l'absence de toute symptomatologie digestive dans l'entourage de malades ou parmi les personnels de l'alimentation, sont parfois positives. En règle, il s'agit d'un portage transitoire qui cédera au bout de quelques jours ou de quelques semaines.
Physiopathologie et facteurs de virulence
Salmonelloses non typhiques
Après ingestion et adhésion, les salmonelles colonisent l'intestin grêle et le côlon. Elles envahissent la muqueuse et se multiplient dans les macrophages des formations lymphoïdes (plaques de Peyer de la sous-muqueuse) où elles causent une réaction inflammatoire à cellules mononucléées, des ulcérations superficielles et une exsudation liquidienne.
Elles n'élaborent ni d'endotoxine comme le bacille d'Eberth ni d'entérotoxine. Les ganglions mésentériques sont souvent atteints, mais le passage dans le sang est rare (5 à 10 % dans l'ensemble). Lorsqu'il se produit, on peut observer des localisations secondaires suppurées qui peuvent atteindre de nombreux organes.
Les états d'immunodépression favorisent l'apparition de septicémies. En cas de bactériémies, les salmonelles se fixent volontiers sur des lésions préexistantes telles qu'une atteinte valvulaire ou une malformation urinaire.
La maladie drépanocytaire s'accompagne d'une fréquence toute particulière d'ostéites, d'ostéomyélites ou de spondylites à salmonelles.
Le caractère prolongé ou récidivant de salmonelloses doit faire évoquer la possibilité d'une bilharziose urinaire associée où Schistosoma haematobium héberge la salmonelle qui disparaîtra après traitement de la seule bilharziose.
Fièvre typhoïde
La fièvre typhoïde est une toxi-infection. Après ingestion et passage de la muqueuse intestinale, les germes gagnent, au niveau de la partie terminale de l'iléon, les ganglions lymphatiques mésentériques où ils se multiplient (période d'incubation) avant d'être déversés avec la lymphe dans le sang circulant (septicémie d'origine lymphatique : hémocultures positives).
Les lésions intéressent les formations lymphoïdes (plaques de Peyer et follicules clos). Ces lésions évoluent en plusieurs phases :
-
•
infiltration avec formations lymphoïdes et infiltrats de cellules mononucléées ;
-
•
nécrose vers le 4e-10e jour et formation d'une escarre ;
-
•
ulcération par chute de l'escarre entraînant un risque de perforation ;
-
•
cicatrisation.
La lyse bactérienne dans les ganglions mésentériques libère une endotoxine à l'origine de l'irritation du territoire splanchnique abdominal et des centres neurovégétatifs. Elle est responsable des signes toxiniques.
Aspects cliniques
Salmonelloses non typhiques (encadré 18.20)
Encadré 18.20.
Salmonelloses non typhiques : arguments décisifs
-
–
Selles glairosanglantes.
-
–
Déshydratation.
-
–
Faciès toxique.
-
–
Pus et hématies dans les selles.
-
–
Coproculture +++.
Salmonelloses digestives
Gastro-entérite aiguë fébrile du nourrisson
Elle atteint essentiellement les jeunes nourrissons.
La diarrhée constante, particulièrement importante s'accompagne de vomissements et d'une fièvre élevée et persistante, irrégulière, avec pics fébriles souvent supérieurs à 40 °C. L'aspect des selles est très variable : grumeleuses, cholériformes, afécales avec pus, sang et mucus ; l'anorexie contraste avec la soif intense du nourrisson.
La déshydratation peut s'installer précocement avec une perte de poids très rapide et impressionnante qui fait toute la gravité de cette diarrhée invasive.
Les signes physiques sont pauvres : ventre ballonné et météorisé, très sensible, sans splénomégalie. Le plus souvent la symptomatologie est spontanément résolutive en 3 à 6 jours.
Toxi-infection alimentaire collective
Elle s'observe surtout en milieu scolaire ou au cours d'intoxications familiales. Elle apparaît 8 à 12 heures après l'absorption d'aliments contaminés. Son tableau clinique peut aller de la simple gastro-entérite avec douleurs abdominales à la forme sévère avec déshydratation aiguë et collapsus.
Formes à symptomatologie infectieuse prédominante
Elles représentent 5 à 10 % de l'ensemble des salmonelloses. Elles peuvent accompagner un tableau de gastro-entérite aiguë ou être en apparence primitives. Dans ce cas, elles surviennent le plus souvent chez un malade dénutri ou en état d'immunodépression ou atteint d'une drépanocytose.
Formes septicémiques
Elles se caractérisent par une température élevée avec frissons et altération rapide de l'état général, proche du tableau de la fièvre typhoïde. Le germe sera mis en évidence dans les hémocultures. La mortalité pour l'ensemble des formes septicémiques est de l'ordre de 15 %.
Bactériémies
Plus fréquentes chez le nourrisson, elles se manifestent par un état fébrile isolé et sont authentifiées par la positivité des hémocultures. Ces bactériémies exposent au risque de localisations métastatiques.
Localisations secondaires
Elles peuvent compléter les tableaux précédents ou survenir d'emblée. Elles peuvent être respiratoires (bronchopneumonie, pleurésie), ORL (otite moyenne suppurée, mastoïdite), méningées, cardiovasculaires (endocardite, péricardite, phlébite), urinaires, osseuses (ostéites et arthrites), abcès hépatiques ou spléniques.
Fièvre typhoïde (encadré 18.21)
Encadré 18.21.
Fièvres typho-paratyphoïdes : arguments diagnostics décisifs
Signes cliniques
-
–
Fièvre élevée.
-
–
Altération rapide de l'état général.
-
–
Tuphos, céphalées.
-
–
Fosse iliaque droite gargouillante.
Signes biologiques
-
–
Hémoculture ++++.
-
–
Absence de leucocytose, leucopénie.
-
–
Coproculture : décevante.
Profil biochimique particulier ++
-
–
Baisse du taux de prothrombine.
-
–
Baisse de la calcémie.
-
–
Cytolyse hépatique modérée.
-
–
Hyponatrémie.
Sérodiagnostic de Widal et Félix (fig. 18.37)
Pour les sujets non vaccinés, sont considérés positifs :
-
–
la présence d'agglutinines O supérieures à 1/100 ;
-
–
la présence d'agglutinines H supérieures à 1/200.
Fig 18.37.

Courbe d'apparition et de durée des anticorps permettant d'interpréter un sérodiagnostic.
Incubation
Elle dure de 5 à 21 jours.
Début
Il est classiquement insidieux, marqué par des troubles digestifs à type de douleurs abdominales, nausées et diarrhée, une fièvre d'ascension progressive avec céphalées, asthénie, épistaxis et un certain degré de prostration. À l'examen clinique, la langue est saburrale ; il existe un météorisme abdominal. La fosse iliaque droite est sensible et gargouillante ; la splénomégalie est inconstamment retrouvée. Le pouls est peu accéléré, dissocié de la température.
Le début peut être atypique, marqué par un syndrome pseudogrippal, ou prendre l'allure d'une gastro-entérite fébrile ou se révéler d'emblée par une complication ou une localisation viscérale.
Période d'état
Typiquement, la fièvre est constante à 39-40 °C (avec frissons, pouls dissocié, tuphos et prostration). Diarrhée, douleurs abdominales, soif vive et anorexie sont notées. La fosse iliaque droite est sensible et gargouillante avec présence d'un météorisme abdominal et d'une splénomégalie ; les taches rosées lenticulaires et les ulcérations superficielles du voile du palais sont classiques mais rares.
La fièvre typhoïde peut également se présenter de façon ambulatoire avec une fièvre isolée et persistante. À l'opposé, il existe des formes graves, avec des signes d'imprégnation toxinique à type de tuphos, d'hypotension, de météorisme abdominal avec un risque accru de perforations, d'hémorragies digestives ou de collapsus cardiovasculaire.
Chez le nourrisson, il s'agit le plus souvent d'un tableau de gastro-entérite fébrile avec déshydratation aiguë.
Évolution
Elle est marquée sous traitement par une lente amélioration avec défervescence en 3 à 5 jours.
Complications
Elles relèvent pour la plupart d'un mécanisme toxinique :
-
•
complications digestives à type d'hémorragies intestinales, de perforations ou de syndromes pseudo-perforatifs ;
-
•
complications hépatobiliaires à type d'hépatites, de cholécystites ;
-
•
complications cardiovasculaires (myocardite, collapsus cardiovasculaire) ;
-
•
complications neuroméningées (méningites et encéphalites typhiques) ;
-
•
complications ostéoarticulaires (ostéomyélites et arthrites) ;
-
•
complications hématologiques (anémies et thrombopénies).
Diagnostic
Salmonelloses non typhiques
L'hémogramme révèle généralement une leucocytose ; l'anas lyse des selles retrouve des leucocytes et des hématies. La coproculture permet d'affirmer l'origine bactérienne.
Fièvres typho-paratyphoïdes
Devant un tableau d'allure septicémique, l'absence de leucocytose, voire la présence d'une leuconeutropénie sont très évocatrices.
Le diagnostic de certitude d'une salmonellose repose sur l'isolement du germe +++ :
-
•
l'hémoculture est l'examen clé qui permet de poser le diagnostic dans la plupart des cas ;
-
•
la coproculture est moins souvent positive. Elle doit être effectuée devant des selles glairosanglantes ou mucopurulentes ou dans un but épidémiologique ;
-
•
d'autres prélèvements, selon le type de localisation de l'infection, sont possibles : pus, urines, LCR.
Le sérodiagnostic de Widal et Felix se positive tardivement :
-
•
les agglutinines O apparaissent en premier vers le 8e jour et n'ont de valeur qu'au 1/100, leur taux s'élève ensuite à 1/400-1/800 puis décroît vers le 30e jour pour disparaître en 2 à 3 mois ;
-
•
les agglutinines H apparaissent vers le 12e jour et s'élèvent rapidement à des taux élevés supérieurs à 1/1 600 pour diminuer ensuite lentement et persister pendant des années.
Traitement
Les aspects thérapeutiques diffèrent peu de ceux de l'adulte en termes d'indication et de sensibilité aux antibiotiques en dehors des fluoroquinolones classiquement contre-indiquées en pédiatrie. L'utilisation de cette famille d'antibiotiques a été proposée dans des circonstances particulières chez l'enfant.
Salmonelloses non typhiques
Traitement curatif
Il est avant tout diététique : solutés glucosés et hydroélectrolytiques.
L'antibiothérapie est actuellement déconseillée : par la destruction de la flore microbienne normale qu'elle entraîne, elle augmente la durée du portage sain à la convalescence. Elle provoque l'apparition de bactéries résistantes à l'antibiothérapie.
L'antibiothérapie n'est indiquée que dans les formes sévères ou chez des sujets porteurs d'un déficit immunitaire. Les produits les plus utilisés et conseillés sont les amoxicillines et le cotrimoxazole par voie orale, l'azithromycine, voire le céfixime.
Dans les formes septicémiques ou dans les formes localisées, l'antibiothérapie est impérative et repose sur des céphalosporines de 3e génération associées à un aminoside.
Traitement prophylactique
Il consiste en :
-
•
des mesures individuelles : règles strictes d'hygiène générale ;
-
•
des mesures collectives : éviter la contamination de l'eau et des aliments, assurer un contrôle de l'industrie alimentaire à tous les niveaux ;
-
•
une déclaration obligatoire n° 12 pour les toxi-infections alimentaires collectives.
Traitement du portage
Il n'existe pas d'attitude consensuelle vis-à-vis du portage asymptomatique des salmonelles. Pourtant le risque de contamination dans les crèches et autres collectivités est réel ainsi que le risque de bactériémies à partir de translocation digestive chez le nourrisson. Si les cures prolongées de bêtalactamines ont été accusées de prolonger le portage des germes, des traitements courts de fluoroquinolones ont permis l'éradication des salmonelles.
Fièvres typho-paratyphoïdes
Traitement curatif
-
•
Mesures hygiénodiététiques.
-
•
Antibiothérapie : les phénicolés, l'amoxicilline et le cotrimoxazole ont progressivement été supplantés par les céphalosporines de 3e génération. Ceftriaxone ou céfotaxime pendant 5 jours ont donné d'excellents résultats. Un traitement de 7 jours est malgré tout conseillé pour éviter les rechutes. L'emploi de fluoroquinolones pourrait particulièrement être utile après un échec clinique des bêtalactamines, pourtant actives in vitro. L'azithromycine, active in vitro sur les entéropathogènes, possède une excellente pénétration tissulaire, atteignant des concentrations intracellulaires 100 fois supérieures aux concentrations sériques. Elle a été proposée dans les formes non compliquées de fièvre typhoïde chez l'enfant et l'adolescent aux doses de 10 mg/kg/j pendant 7 jours ou aux doses de 20 mg/kg/j pendant 5 jours.
-
•
Corticothérapie réservée aux formes graves avec syndrome toxinique sévère.
Traitement prophylactique
Le vaccin TAB a été abandonné au profit du vaccin Typhim Vi, vaccin injectable, polysaccharidique, spécifique de Salmonella typhi (une seule injection).
Il s'agit d'une maladie à déclaration obligatoire n° 1.
Ce qu'il faut retenir
-
–
La recrudescence actuelle des salmonelloses mineures : étiologies les plus fréquentes des gastro-entérites aiguës fébriles bactériennes du nourrisson.
-
–
L'existence de tableaux sévères chez les immunodéprimés et les drépanocytaires.
-
–
Les salmonelloses majeures sont les fièvres typho-paratyphoïdes s'accompagnant de septicémie et d'endotoxinémie.
-
–
Les salmonelloses mineures ou salmonelloses non typhiques sont responsables de gastro-entérites aiguës sans endotoxinémie mais se compliquant parfois de bactériémies avec ou sans localisations et ne justifiant pas d'antibiothérapie.
BIBLIOGRAPHIE
- Bégué P. Pathologie Infectieuse de l'Enfant. Flammarion Médecine-Sciences; Paris: 1988. Infections à salmonelles. [Google Scholar]
- Gendrel D., Raymond J., Moulin F. Éradication du portage asymptomatique des salmonelles non typhoïdiques par deux doses de pefloxacine. Arch Pédiatr. 1995;2:418. doi: 10.1016/0929-693x(96)81175-4. 22. [DOI] [PubMed] [Google Scholar]
- Humbert G., Lemeland J.F., Lecomte F. EMC Maladies Infectieuses. 1986. Salmonelloses non typhiques. 8018, A10, 4. [Google Scholar]
- Lalande M., Guyon G., Morin C. Les infections à salmonelles chez l'enfant : étude rétrospective sur quatre ans. Arch Pédiatr. 2005;12:23. doi: 10.1016/j.arcped.2004.10.009. 7. [DOI] [PubMed] [Google Scholar]
- Perelman R. Pédiatrie pratique. II. Maladies infectieuses. 2e ed. Maloine; Paris: 1990. Infections à Salmonella. Salmonelloses. [Google Scholar]
Conduite à tenir devant une tuberculose pulmonaire de l'enfant
C. DeLacourt
La tuberculose reste un problème d'actualité en France. En 2008, le taux d'incidence en France métropolitaine était de 9,0 cas pour 100 000 habitants. Il existe d'importantes disparités régionales. L'Île-de-France reste la région la plus touchée avec un taux d'incidence de 17,9 cas pour 100 000 habitants. Les enfants de moins de 15 ans représentent 5,1 % des cas déclarés ; soit environ 300 nouveaux cas/an. Presque la moitié de ces cas (n = 143) concernent des enfants de moins de 5 ans. Les localisations retrouvées de la maladie chez l'enfant sont représentées dans l'immense majorité des cas par une atteinte pulmonaire et/ou des ganglions hilaires et médiastinaux. Un à trois cas de méningite sont rapportés chaque année chez des enfants de moins de 5 ans. Une augmentation des cas de tuberculose-maladie est attendue chez le jeune enfant, du fait de l'arrêt de la vaccination généralisée par le BCG. Il importe de la limiter au maximum par une reconnaissance et un traitement de l'infection au stade latent, avant tout signe clinique ou radiologique de maladie. Cet objectif ne peut être réalisé que par une stratégie de dépistage efficace des enfants exposés à un cas de tuberculose pulmonaire. La reconnaissance rapide des enfants avec tuberculose-maladie est également importante, car elle permet d'identifier le contaminateur de donc de limiter le nombre de cas secondaires.
Bref rappel de physiopathologie
L'infection tuberculeuse se transmet essentiellement par voie aérienne. La lésion primaire (ou nodule primaire) se situe donc dans le parenchyme pulmonaire dans plus de 95 % des cas. De ce site initial, les bacilles tuberculeux sont drainés par les macrophages vers les ganglions régionaux, le plus souvent hilaires, mais éventuellement latérotrachéaux si le nodule primaire siège à la partie apicale du poumon. Le nodule primaire peut disparaître ou au contraire augmenter de taille et s'étendre au parenchyme et/ou à la plèvre adjacents. Il peut également se caséifier. C'est à ce stade que le risque de dissémination hématogène est le plus important, entraînant des lésions soit focales, soit de type miliaire, dans différents viscères. Le développement de l'hypersensibilité, en 2 à 10 semaines, permet le plus souvent d'empêcher cette évolution : l'enfant reste asymptomatique, les lésions guérissent, et aucune anomalie n'est visible sur la radiographie de thorax standard. Il s'agit alors d'une infection tuberculeuse latente (ITL). Toutefois, dans 5 à 40 % des cas d'infection tuberculeuse, essentiellement selon l'âge de l'enfant et la qualité de ses défenses immunitaires, la multiplication bacillaire se poursuit et des signes cliniques et/ou radiologiques (ou tuberculose-maladie : TM) apparaissent, en règle dans l'année qui suit l'infection initiale. L'insuffisance rénale et le diabète sont également des terrains classiquement associés à une évolution plus fréquente vers la TM. Dans un très faible nombre de cas (environ 5 %), la maladie ne se développera qu'après plusieurs années, à partir d'anciens foyers d'infection (notamment à l'adolescence ou à l'âge adulte). Les ganglions régionaux peuvent grossir, comprimant les voies aériennes adjacentes, entraînant atélectasie ou emphysème obstructif. Ils peuvent aussi se caséifier et se fistuliser dans les bronches ou dans la trachée, faisant courir le risque d'un accident asphyxique aigu. Un épanchement pleural ou une miliaire peuvent également survenir à tout moment après l'infection initiale.
Dépistage des enfants exposés à un cas de tuberculose pulmonaire
Le dépistage rapide des enfants exposés à un cas de tuberculose pulmonaire, suivi du traitement des infections latentes avant toute évolution vers la maladie est un maillon essentiel de la prévention des TM pédiatriques. La source de contamination est le plus souvent un adulte, même si la transmission d'enfant à enfant est possible. Toute tuberculose pulmonaire de l'adulte, même si les examens directs des expectorations sont négatifs, doit donc motiver une évaluation rapide du risque d'infection chez les enfants exposés.
C'est le Centre de lutte antituberculeuse (CLAT) du lieu de résidence du patient qui doit coordonner l'enquête, en collaboration étroite avec les différents médecins partenaires : médecine du travail, médecine scolaire, pédiatres, services de PMI, etc. Les coordonnées des CLAT de chaque département sont disponibles à l'adresse : www.splf.org/s/spip.php?article448.
Le dépistage comprend un examen clinique, un test tuberculinique intradermique (Tubertest) et une radiographie de thorax. Il doit démarrer dès que le diagnostic est porté chez le cas index, sans attendre le résultat des cultures. En l'absence d'arguments initiaux en faveur d'une infection tuberculeuse, ces explorations doivent être renouvelées 2 à 3 mois plus tard. Toute anomalie radiologique évocatrice (adénopathies hilaires ou médiastinales, infiltrats ou nodules parenchymateux) doit faire évoquer le diagnostic de tuberculose-maladie, quel que soit le résultat du Tubertest.
Savoir identifier une infection tuberculeuse
Le diagnostic d'infection tuberculeuse chez l'enfant repose le plus souvent sur un faisceau d'arguments épidémiologiques, cliniques, immunologiques et radiologiques. Les examens microbiologiques ne sont positifs que dans une minorité de cas, le nombre de bacilles présents dans les sécrétions des enfants infectés étant habituellement très faible.
Arguments cliniques
Par définition, l'ITL ne s'accompagne d'aucun signe clinique. De nombreux cas de TM pédiatrique restent également asympto matiques, pouvant même guérir spontanément, et n'être identifiés que plusieurs années plus tard. La présence de symptômes au cours de la TM est d'autant plus fréquente que l'enfant est jeune, en particulier avant 2 ans. L'adolescence est également une période particulière, avec le développement de formes cavitaires très symptomatiques, comme chez l'adulte.
Lorsqu'ils sont présents, les symptômes sont non spécifiques : toux, fièvre, baisse de l'appétit, amaigrissement, signes auscul tatoires localisés, détresse respiratoire.La dissémination hématogène des bacilles est à l'origine des formes graves : miliaire, atteinte cérébrale et méningée, polysérite et notamment péricardite. Le risque de dissémination est particulièrement élevé chez l'enfant de moins de 5 ans. Les localisations extra-thoraciques peuvent également être observées dans environ un tiers des tuberculoses de l'adolescence.
La radiographie de thorax va le plus souvent être anormale avant l'apparition de signes cliniques, justifiant sa réalisation systématique lors des dépistages.
Test tuberculinique intradermique (Tubertest)
Les seules indications chez l'enfant de ce test sont désormais :
-
•
la recherche d'une infection tuberculeuse chez des sujets exposés à un contaminateur identifié ou à une situation à très haut risque (séjour prolongé dans un pays à forte prévalence) ;
-
•
ou une aide diagnostique dans une situation clinique évocatrice.
La réalisation de ce test à titre de dépistage systématique ou de contrôle post-vaccinal n'est plus justifiée. Sa technique doit être irréprochable pour ne pas fausser son interprétation. L'injection s'effectue en règle sur l'avant-bras et doit être strictement intradermique. Une bonne technique est attestée par l'existence d'une papule après l'injection. La lecture du résultat se fait 72 heures après l'injection et porte habituellement sur le diamètre transversal de l'induration. L'interprétation va dépendre de la fréquence attendue de l'infection dans la population testée, c'est-à-dire en pratique du niveau de risque d'infection chez l'enfant testé. Le choix du seuil pour parler d'infection doit également tenir compte de possibles faux positifs liés à la vaccination par le BCG. Si l'on exige une valeur prédictive positive d'au moins 80 % pour le seuil choisi, la valeur de 10 mm ne peut être retenue chez l'enfant vacciné que pour les situations où le risque d'infection dépasse 40 % chez l'enfant exposé, ce qui correspond en pratique à une exposition familiale, étroite et répétée, à un cas index fortement contaminant (BAAR + [bacille acido-alcoolo-résistant] à l'examen direct et/ou porteur de cavernes). Lorsque le risque estimé est plus faible, un seuil de 15 mm doit être maintenu pour porter le diagnostic d'infection tuberculeuse. En l'absence de vaccination BCG antérieure, les seuils considérés sont respectivement de 5 et 10 mm. Les principaux facteurs influençant le risque d'infection chez l'enfant exposé, et devant être systématiquement recueillis lors d'un dépistage, sont résumés dans l'encadré 18.22 .
Encadré 18.22.
Principaux facteurs augmentant le risque d'ITL ou de TM chez l'enfant exposé
Contagiosité du cas index
-
–
Bacilles à l'examen direct des expectorations.
-
–
Cavernes sur la radiographie de thorax.
Conditions d'exposition
-
–
Même domicile que le contaminateur.
-
–
Contact dans pièce exiguë et non aérée.
-
–
Proximité du contact (parents).
Terrain personnel de l'enfant
-
–
Âge.
-
–
Immunodépression.
-
–
Diabète.
-
–
Insuffisance rénale.
-
–
Situation socio-économique défavorable.
Tests de diagnostic in vitro
Le Tubertest n'est désormais plus le seul test capable d'identifier une infection tuberculeuse. La découverte d'antigènes très spécifiques du complexe M. tuberculosis, et absents des souches BCG, a abouti à la mise au point de tests sanguins permettant le diagnostic d'infection avec d'excellentes spécificité et sensibilité, y compris dans les populations vaccinées par le BCG. Ces tests mesurent la libération d'interféron gamma par les lymphocytes du patient, après stimulation par ces antigènes spécifiques (ESAT-6, CFP-10, TB7.7). Les deux tests commercialement disponibles sont le QuantiFERON et le Tspot-TB. La spécificité de ces tests, mesurée dans des populations à très faible risque d'infection, est supérieure à 95 %, y compris dans les populations vaccinées par le BCG. Leur sensibilité dans la TM de l'enfant est comparable à celle de l'IDR à la tuberculine. Leur sensibilité dans l'ITL est plus difficile à mesurer, puisqu'aucun examen ne permet d'affirmer ce diagnostic avec certitude. Des discordances sont fréquemment observées avec des tests interféron restant négatifs malgré un test tuberculinique très positif, compatible avec un diagnostic d'ITL. Plusieurs études démontrent que les valeurs prédictives positive et négative d'un test interféron gamma pour le développement d'une tuberculose-maladie ultérieure sont au moins égales, voire supérieures, à celles de l'IDR. Il est donc possible que les tests in vitro permettent une reconnaissance privilégiée des infections récentes. Dans l'état actuel des connaissances, la Haute autorité de santé ne propose le remplacement du Tubertest par ces tests dans le cadre d'un dépistage que chez le patient de plus de 15 ans (avis du 13 décembre 2006). Un élargissement de ces recommandations devrait bientôt intervenir.
Imagerie
Radiographie de thorax
Par définition, elle doit être normale pour affirmer le diagnostic d'ITL. Les incidences face et profil sont souhaitables pour une visualisation radiologique optimale chez le jeune enfant. Au cours de la TM de l'enfant, la radiographie de thorax permet d'affirmer l'atteinte gangliopulmonaire et de dépister les complications éventuelles (atélectasie, emphysème obstructif, épanchement pleural ou péricardique) (fig. 18.38 ).
Fig 18.38.
Tuberculose pulmonaire de l'enfant : atteintes parenchymateuses et ganglionnaires.
Tomodensitométrie thoracique
Elle est utile pour préciser l'atteinte gangliopulmonaire et notamment la taille et la topographie des adénopathies. Elle constitue un document initial de choix pour juger de l'évolution et des séquelles éventuelles. Elle n'a aucune indication dans l'ITL, lorsque le cliché standard est clairement normal.
Recherches microbiologiques
La recherche de bacilles sur crachats ou tubages gastriques est indispensable dès qu'il existe une suspicion de tuberculosemaladie. Lorsque l'infection est latente, avec une radiographie de thorax normale, la réalisation systématique d'examens microbiologiques n'est plus recommandée chez l'enfant de plus de 2 ans. Le recours aux tubages gastriques est souvent nécessaire chez l'enfant, du fait de l'absence d'expectoration. Ils doivent être effectués le matin, à jeun, idéalement au réveil avant que l'enfant ne se lève, et sont donc au mieux réalisés en milieu hospitalier. Ils sont en règle répétés 3 jours de suite. La réalisation d'expectorations induites semble une alternative intéressante aux tubages gastriques.
Les systèmes d'amplification génomique sont capables de détecter de faibles quantités de matériel génétique de M. tuberculosis. Leur intérêt principal est l'identification rapide de M. tuberculosis, et de son éventuelle résistance aux antituberculeux majeurs, dans les prélèvements respiratoires à examen microscopique positif. Le niveau de sensibilité des tests PCR peut néanmoins être très intéressant dans la TM de l'enfant, habituellement pauci-bacillaire. Ces tests peuvent donc être également utiles à visée diagnostique chez l'enfant, notamment dans des situations difficiles, comme les nouveaunés et les immunodéprimés, chez lesquels des faux négatifs de l'IDR ou des tests interféron gamma sont fréquents.
Endoscopie bronchique
L'endoscopie bronchique peut apporter des arguments diagnostiques importants chez les enfants suspects de TM. Les aspects les évocateurs sont une réduction du calibre bronchique par compression d'une adénopathie adjacente, un granulome, ou du caséum obstructif. Un scanner de bonne qualité peut permettre de mieux guider les indications endoscopiques, l'absence de rétrécissement trachéobronchique en tomodensitométrie ayant été associée à une endoscopie constamment normale. L'endoscopie bronchique ne se justifie pas à visée uniquement microbiologique.
Synthèse
La démarche diagnostique et décisionnelle chez un enfant exposé à un cas de tuberculose est résumée dans la figure 18.39 . La recherche d'une tuberculose cérébroméningée par étude du LCR et tomodensitométrie cérébrale est systématique dès qu'il existe une suspicion clinique (céphalées, troubles du comportement, convulsions) ou des signes de maladie disséminée.
Fig 18.39.

Algorithme pour la prise en charge d'une suspicion de tuberculose chez l'enfant.
Traitement
Les différents antibiotiques utilisés, leur posologie, leurs effets secondaires sont résumés dans le tableau 18.26 .
Tableau 18.26.
Principaux antibiotiques utilisés dans le traitement d'une primo-infection tuberculeuse.
| Antibiotiques | Présentations | Posologie (mg/kg/j) | Dose maximale quotidienne | Effets secondaires |
|---|---|---|---|---|
| Isoniazide Rimifon |
Cp 50 et 150 mg | 5 (< 2 ans) 10 (≥ 2 ans) |
300 mg | Toxicité hépatique par ses métabolites (élévation transaminases ; ictère) Neuropathies périphériques Convulsions |
| Rifampicine Rimactan Rifadine |
Gélules 300 mg Suspension 2 % (5 mL = 100 mg) |
10 | 600 mg | Induction enzymatique des enzymes microsomiales hépatiques (accélère le métabolisme de : glucocorticoïdes, digoxine, théophylline, anticonvulsivants, kétoconazole, ciclosporine, isoniazide, augmente l'hépatotoxicité de l'isoniazide) Coloration rouge orangé des urines et sécrétions Troubles gastro-intestinaux Rares accidents immunoallergiques |
| Éthambutol Myanbutol Dexambutol |
Gélules 100 et 400 mg Dragées 250 et 500 mg |
5-20 | 2,5 g | Névrite optique (dose-dépendante) Rash cutané |
| Pyrazinamide Pirilène |
Cp 500 mg | 20-30 | 2 g | Hépatotoxicité (dose-dépendante) Hyperuricémie Troubles gastro-intestinaux Arthralgies Rash cutané |
Traitement d'une ITL
Il repose préférentiellement sur une bithérapie par isoniazide et rifampicine (RMP) pendant 3 mois.
Traitement d'une tuberculose-maladie
Il repose habituellement sur une trithérapie par isoniazide, rifampicine, et pyrazinamide (PZA) pendant 2 mois puis par une bithérapie par isoniazide et rifampicine pendant 4 mois, soit une durée totale de traitement de 6 mois. L'éthambutol (EMB) n'est le plus souvent adjoint à la phase initiale du traitement que dans certains cas : tuberculose pulmonaire floride ou fortement bacillifère, dissémination hématogène, suspicion de résistance primaire à l'isoniazide.
Lorsque la tuberculose s'accompagne d'une dissémination hématogène (miliaire, atteinte cérébroméningée, etc.), l'attitude n'est pas parfaitement codifiée : le plus souvent, la période de quadrithérapie est d'au moins 3 mois et la durée totale du traitement d'environ 12 mois. Ces données sont en fait dépendantes de l'évolution sous traitement.
Place des corticoïdes
Elle n'est pas parfaitement définie. Elle est indiquée devant un trouble de ventilation récent ou une obstruction endobron chique significative (> 50 %) constatée lors de la fibroscopie (compression extrinsèque, granulome), que cette obstruction entraîne ou non des modifications sur le cliché radiologique. L'existence chez le nourrisson d'une adénopathie latérotrachéale compressive avec une muqueuse trachéale fragile reste une contre indication classique, en raison du risque d'asphyxie par fistulisation.
Les corticoïdes sont également fréquemment recommandés en cas de miliaire retentissant sévèrement sur la fonction respiratoire. ils n'ont en revanche aucun d'intérêt démontré au cours des atteintes pleurales.
Leur posologie est de 1 à 2 mg/kg/j pendant 2 à 4 semaines suivie d'une baisse progressive, en se méfiant des rebonds.
Particularités du nouveau-né
Un nouveau-né de mère tuberculeuse doit être traité à la naissance si la mère n'a pas été elle-même traitée au moins 2 mois avant l'accouchement. Le choix d'une bithérapie ou d'une trithérapie est variable selon les équipes. En cas de négativité persistante de l'IDR à 3 mois, il est licite de stopper le traitement, même si certains auteurs préfèrent le poursuivre jusqu'au 6e mois. Le traitement maternel ne contre indique pas l'allaitement du nouveau-né.
Recherche du contaminateur
Elle est impérative, ainsi que le traitement de celui-ci.
L'infection tuberculeuse est par ailleurs une maladie à déclaration obligatoire.
Surveillance du traitement
L'écueil essentiel du traitement est la non-observance qui a pour conséquences d'une part de retarder l'élimination de la tuberculose malgré des drogues actives, et d'autre part d'accroître la proportion de souches résistantes à ces drogues. S'assurer d'une bonne observance est donc un des rôles essentiels de l'équipe soignante. Les problèmes à cet égard peuvent être difficiles à résoudre, faisant de la tuberculose une véritable maladie « sociale ». La surveillance repose sur une consultation clinique mensuelle et la répétition d'examens biologiques, radiologiques et éventuellement endoscopiques visant à dépister les complications liées à la tuberculose ou à son traitement. Lors d'un traitement de tuberculosemaladie, un bilan hépatique initial est indispensable afin d'en vérifier la normalité. il doit être vérifié 15 jours et 1 mois après le début du traitement. Lors d'un traitement d'infection latente par isoniazide et rifampicine, la réalisation systématique d'une surveillance biologique hépatique n'est plus recommandée chez l'enfant. La famille doit toujours être informée des signes évocateurs de toxicité (vomissements répétés, ictère) et de la nécessité d'une consultation urgente en cas d'apparition de l'un de ces signes. En l'absence d'une bonne compréhension de ces signes d'alerte, une surveillance biologique reste nécessaire.
Formes extrapulmonaires de la tuberculose
A. Bourrillon
Méningites tuberculeuses
La méningite tuberculeuse débute habituellement de façon insidieuse par une fatigue, des troubles du comportement et du sommeil, des céphalées, une fièvre modérée et prolongée.
La suspicion du diagnostic surtout dans un contexte épidémiologique évocateur (contage tuberculeux, immunodépression cellulaire, retour de pays de forte endémie, échec de traitements antibiotiques antérieurs non spécifiques) conduit à un examen du liquide céphalorachidien (précédé d'une imagerie cérébrale dans toutes les situations où la clinique pourrait laisser craindre une pathologie tumorale).
L'examen du liquide céphalorachidien est typiquement celui d'une méningite lymphocytaire avec parfois hypoglycorachie. Le BAAR est parfois retrouvé à l'examen direct, le plus souvent à la culture. La détection directe de M. tuberculosis par amplification génique (biologie moléculaire) ou PCR est moins sensible que la culture mais très spécifique.
Les tests de sensibilité au antituberculeux sont systématiques (antibiogramme) voire par la détection de gène de résistance par PCR (pour la RMP et l'INH notamment). Cette dernière n'est cependant pas encore une pratique de routine mais souvent utile chez les enfants revenant d'une zone à risques de multirésistances.
D'autres examens contribuent à l'argumentation diagnostique et pronostique :
-
•
le fond d'œil s'il montre des tubercules de Bouchut ;
-
•
le cliché thoracique à la recherche d'images de tuberculose médiastinale, pulmonaire, voire miliaire ;
-
•
l'imagerie cérébrale (TDM ou mieux IRM précédant l'examen du liquide céphalorachidien dans la crainte de la méconnaissance d'une pathologie tumorale) à la recherche de granulomes cérébraux ;
-
•parmi les éléments de diagnostic indirect :
-
–Le Tubertest à interpréter en fonction du statut vaccinal,
-
–et plus récemment le quantiferon.
-
–
Le diagnostic doit être précoce : des séquelles motrices (hémi f plégie), sensorielles (cécité) ou épileptiques sont possibles.
Les éléments de pronostic défavorable sont : le délai du diagnostic, le jeune âge (< 1 an) et l'existence de troubles de la «s conscience prolongés ou profonds (coma).
Le traitement initial est celui des formes de tuberculose grave (quadrithérapie : INH + RMP + EMB + PZA) pendant les 2 premiers mois relayé par une bithérapie (inh + RMP) pendant 6 à 9 mois.
L'adjonction d'une corticothérapie (prednisone à la dose de 1 à 2 mg/kg) est généralement proposée jusqu'à normalisation du liquide céphalorachidien (4 à 6 semaines en général).
Autres tuberculoses extrapulmonaires
Tuberculose osseuse
Elle peut survenir 1 à 3 ans après la primo-infection.
L'atteinte se fait généralement par voie hématogène.
Les localisations les plus fréquentes sont vertébrales mais peuvent aussi concerner les os du crâne, les phalanges, les os longs. Une biopsie avec éventuelle exérèse des granulomes peut être indiquée. La culture des BK (bacille de Koch) et les techniques de biologie moléculaire (PCR) sont utiles pour confirmer le diagnostic.
Tuberculose abdominale
Elle comporte des aspects multiples (atteintes mésentériques, péritonéales ou digestives) à l'origine de diagnostics parfois difficiles ce d'autant que rares chez l'enfant.
L'association à une tuberculose pulmonaire chez l'enfant est également rare.
Deux types d'atteinte abdominale peuvent être identifiés :
-
•
l'atteinte ganglionnaire isolée révélée par la découverte d'une masse abdominale profonde à l'échographie abdominale initiale dans un contexte d'état général altéré (asthénie, fièvre prolongée) ;
-
•
l'atteinte péritonéale suspectée par des douleurs abdominales (avec souvent ascite). Les manifestations caséeuses peuvent être isolées ou associées à cette ascite (empâtement profond diffus).
Tuberculose intestinale
Elle prédomine dans la région iléo-cœcale, Elle est de diagnostic souvent difficile à différencier de celui de la maladie de Crohn.
Les éléments évocateurs du diagnostic sont :
-
•
la positivité des IDR à la tuberculine
-
•
le recours actuel au test interféron (Quantiféron) ;
-
•
l'intensité du syndrome inflammatoire biologique ;
-
•
la radiographie de l'abdomen sans préparation si calcifications ganglionnaires paravertébrales ;
-
•
l'échographie abdominale (valeur d'orientation en cas de mise en évidence de ganglions lymphatiques mésentériques volumineux) ;
-
•
et surtout le scanner abdominal.
Le diagnostic sera définitivement assuré :
-
•
non pas tant par ponction d'une masse sous contrôle échographique ou scanographique (à la recherche du BK) ;
-
•
que souvent par une laparotomie exploratrice (prélèvements biopsiques multiples).
Le traitement repose également sur une quadrithérapie associant : INH + RMP + EMB + PZA pendant 2 mois. Ce traitement d'attaque est généralement relayé par une bithérapie (INH + RMP) pendant 12 à 18 mois.
En conclusion
La tuberculose demeure un risque toujours élevé en France.
Tout doit être réalisé pour assurer correctement sa prévention :
-
•rompre la chaîne de la contagion :
-
–recherche des agents contaminateurs (enquête familiale associant les équipes hospitalières et médico-sociales),
-
–déclaration obligatoire de toute tuberculose confirmée (au minimum BK positif à l'examen direct et/ou à la culture),
-
–traitement immédiat, et isolement des adultes à risque de contagion et en contact avec les enfants au cours des premières semaines de ce traitement ;
-
–
-
•
apprécier la compliance du sujet à la thérapeutique proposée : identification des groupes à risques. Certains de ceux-ci (famille revenant de pays de forte endémie tuberculeuse et généralement de milieux socio-économiques défavorisés) justifient de mesures de dépistage et de prévention (BCG ; tubertest) d'indication particulièrement large dans un contexte de surveillance rigoureuse.
Infections virales
Voir aussi Fièvres éruptives, page 440 .
Les maladies infectieuses détaillées ici ont en commun :
-
•
leur fréquence chez l'enfant ;
-
•
un diagnostic clinique le plus souvent facile, devant des formes typiques, les plus fréquentes chez l'enfant, parfois plus difficile devant des complications inaugurales et parfois isolées ;
-
•
des examens complémentaires à limiter aux seules formes atypiques ;
-
•un retentissement socio-économique conduisant :
-
–au minimum à un absentéisme parental et de l'enfant dans les pays les plus développés,
-
–au maximum à une morbidité et à une mortalité dans les pays en voie de développement, conduisant à des politiques de prévention prioritaire en terme d'objectifs de santé.
-
–
Grippe
H. Haas
Agent infectieux
L'agent infectieux responsable est le Myxovirus influenzae virus à ARN de la famille des orthomyxoviridae et du genre Influenzavirus.
Son enveloppe ou peplos porte à la surface des glycoprotéines antigéniques :
-
•
la neuraminidase (NA) permettant la libération de la particule virale fixée sur les cellules respiratoires et sa dissémination dans l'épithélium respiratoire ;
-
•
les hémagglutinines (HA1 et 2) fixant le virus sur les récepteurs cellulaires et permettant d'agglutiner les hématies de certaines espèces animales.
Les caractères antigéniques permettent de classer les virus grippaux en trois types majeurs (A, B, C) totalement distincts, ne présentant pas d'immunité croisée.
Les souches sont nommées selon :
-
•
leur type antigénique ;
-
•
l'hôte d'origine s'il n'est pas l'homme ;
-
•
le lieu d'isolement de la souche virale la première fois ;
-
•
le numéro de la souche ;
-
•
l'année d'isolement ;
-
•
pour les souches A, la nature des antigènes de surface HA et NA (sous-type).
Par exemple : A/Sydney/5/1993 (H1N1).
Épidémiologie
La grippe est une maladie aiguë virale d'une extrême contagiosité évoluant sur un mode épidémique. La transmission est directe, interhumaine, par voie aérienne. Une épidémie atteint entre 30 et 60 % des individus non immunisés d'une population. En France, la grippe est une des causes élevée de morbidité par maladies infectieuses.
Variabilité antigénique
La principale caractéristique des Myxovirus est leur grande labilité génétique : les gènes codant pour les protéines de surface se modifient constamment par des mécanismes mal connus (recombinaison, délétion, insertion, mutation). Ces modifications apparaissent en premier lieu dans les pays d'Extrême-Orient permettant la préparation des souches vaccinales pour chaque campagne annuelle. La plasticité antigénique très particulière des virus grippaux, surtout de type A, explique pour l'essentiel l'absence d'immunisation durable et les difficultés de la prophylaxie vaccinale.
Résurgence des virus
La constatation récente de la réapparition de virus peu modifiés, responsables d'épidémies anciennes, suggère le rôle d'un réservoir de virus animal (peut-être le porc et des oiseaux domestiques ou sauvages).
Modes épidémiques
On retrouve deux modes évolutifs épidémiques : des pandémies consécutives à un changement antigénique brusque et complet (ou cassure) d'une hémagglutinine et/ou de la neuraminidase, d'une morbidité très élevée, survenant tous les 15 ans environ et, entre ces pandémies, des épidémies saisonnières et hivernales (entre novembre et février en France) consécutives à l'évolution progressive et permanente des antigènes de surface du virus (ou glissement).
Physiopathologie
L'hémagglutinine du virus grippal se fixe d'abord de façon réversible puis irréversible à un récepteur spécifique de la surface des cellules des voies respiratoires (cellules ciliées et à mucus de l'épithélium), la couche basale étant respectée. Cette fixation est suivie de la pénétration intracellulaire puis de la réplication virale. Les nouveaux virions sont libérés grâce à la neuraminidase. Ceci aboutit à la nécrose et la lyse cellulaire (réaction inflammatoire sous-muqueuse avec œdème interstitiel, afflux de cellules macrophagiques, desquamation hémorragique des cellules alvéolaires, œdème pulmonaire et thrombose capillaire). La virémie est inconstante et transitoire.
Clinique
C'est une maladie généralement bénigne chez les sujets jeunes sans comorbidité.
Grippe commune
Chez le grand enfant au terme d'une phase d'incubation brève de 24 à 72 heures, la phase d'invasion se traduit par l'apparition brutale avec malaise général, frissons, fièvre élevée d'emblée, céphalées et myalgies. La phase d'état se caractérise par un contraste entre l'intensité des signes généraux et fonctionnels et la pauvreté des signes physiques :
-
•
signes généraux : fièvre à 40 °C, tachycardie, frissons, asthénie, anorexie, abattement ;
-
•
signes fonctionnels : douleurs diffuses (arthralgies, myalgies), catarrhe des voies aériennes supérieures (injection conjonctivale, rhinorrhée, douleurs pharyngées avec odynophagie, dysphonie, brûlures rétrosternales, toux sèche douloureuse), céphalées vives frontales et rétro-orbitaires, photophobie, et lombalgies ;
-
•
signes physiques : rougeur diffuse du pharynx, langue saburrale, râles sous-crépitants, otite.
Chez le petit enfant, la présentation est plus atypique avec un tableau d'infection respiratoire haute non spécifique (rhinorrhée claire et toux) mais avec aussi fréquemment au premier plan des troubles digestifs à type de diarrhées et vomissements. Une anorexie et une somnolence sont plus souvent présentes que chez l'enfant plus grand ou l'adulte. La guérison se fait spontanément en 4 à 7 jours, la fièvre chutant rapidement, sa réascension passagère (le V grippal) est rare. L'asthénie et la toux peuvent persister plusieurs semaines.
Les examens complémentaires sont d'un intérêt limité (leuconeutropénie inconstante ; hyperleucocytose avec polynucléose possible). La radiographie du thorax peut être normale, ou montrer des images parahilaires de pneumopathie atypique grippale ; parfois des infiltrats limités ou micronodulaires, des opacités en bandes, voire des images systématisées sont constatés.
Grippes compliquées
Surinfections
L'atteinte des voies respiratoires par le virus grippal favorise la surinfection bactérienne, principalement H. influenzae, S. pneumoniae et S. aureus en particulier chez le vieillard. La persistance de la fièvre, le caractère purulent de l'expectoration, l'aggravation de la condition respiratoire, l'hyperpolynu cléose neutrophile sont des éléments en faveur de cette atteinte. Chez l'enfant, ce sont surtout les voies aériennes supérieures qui peuvent se surinfecter (otite, sinusite, laryngite).
Atteintes extrapulmonaires
Elles sont possibles sous forme de troubles digestifs, méningite lymphocytaire, avec ou sans signes encéphalitiques, atteinte myocardique ou péricardique, rhadbomyolyse chez l'enfant.
Grippe maligne
Rare, souvent mortelle, elle est due au virus lui-même, causant un tableau d'œdème pulmonaire lésionnel avec syndrome de détresse respiratoire aiguë quelques jours après le début d'une grippe apparemment banale. Des manifestations extrarespiratoires sont possibles : myocardite et péricardite, hépatite, insuffisance rénale, méningo-encéphalite.
L'évolution est habituellement fatale. En cas de survie, les séquelles sévères par fibrose septale aiguë diffuse sont fréquentes.
Diagnostic de la grippe
En période d'épidémie, le diagnostic clinique est facile devant une grippe commune.
Le diagnostic de certitude fait appel aux examens de laboratoires : méthodes directes (culture, immunofluorescence et RT-PCR : Reverse Transcriptase PCR) et indirectes (sérologie, tests de diagnostic rapide).
Méthodes directes
La culture cellulaire peut être pratiquée durant les 3 premiers jours à partir de prélèvements des voies aériennes supérieures, mais aussi parfois à partir d'autres produits pathologiques (sang, LCR), mais nécessite parfois plusieurs jours. Elle a un intérêt de production de matériel viral pour la détermination des sous types et des variants des souches isolées, et de dépistage de l'apparition de résistances aux antiviraux spécifiques.
La sérologie par réaction de fixation du complément ou par réaction d'inhibition de l'hémagglutination nécessite de pratiquer deux prélèvements à 2 semaines d'intervalle pour mettre en évidence l'augmentation du taux d'anticorps et permet donc un diagnostic uniquement rétrospectif.
La RT-PCR est une technique d'amplification en chaîne par polymérisation après transcription inverse de l'ARN viral en ADN complémentaire. Elle est en passe de devenir la méthode de référence.
Méthodes indirectes
La réaction d'immunofluorescence directe sur prélèvement nasal est positive durant les 3 premiers jours de la maladie.
Les tests de diagnostic rapide de la grippe par immunochromatographie sur membrane permettent la détection d'antigènes viraux à l'aide d'anticorps spécifiques antigrippaux adsorbés sur bandelette. Elle a l'avantage d'être réalisable en quelques minutes au « lit du malade ».
Traitement
Traitement symptomatique
La grippe commune nécessite essentiellement des mesures symptomatiques : repos, antalgiques, antipyrétiques, sédatifs de la toux, hydratation correcte et alimentation équilibrée, antibiotiques en cas de complication bactérienne.
La grippe maligne doit être traitée en service de réanimation.
Traitement antiviral
Inhibiteurs de la neuraminidase (zanamivir, oseltamivir)
Ils agissent à la phase tardive de l'infection en inhibant la libération des virions néoformés.
Ils ont une activité in vitro sur les virus grippaux A et B. Leur efficacité curative n'est démontrée que si le traitement est administré précocement (dans les 48 heures) après le début des symptômes.
Amantadine
Elle est inactive sur des souches de virus de type B. L'amantadine est très souvent mal tolérée. Ses principaux effets secondaires sont neuropsychiques (sensations vertigineuses, insomnies, nervosité) et digestifs.
Vaccination
Vaccin
Il s'agit d'une suspension virale inactivée, préparée sur œufs de poule embryonnée. Sa composition est fixée chaque année par l'OMS en fonction des données épidémiologiques et virologiques recueillies à travers le monde. il prévient 70-90 % des adultes en bonne santé, âgés de moins de 65 ans lorsqu'il est bien assorti aux souches circulantes.
Il est recommandé de vacciner à l'automne en sous-cutané profond (deltoïde, fosse sous-épineuse) ou intramusculaire (enfant) à une dose de 0,5 mL chez l'adulte et de 0,25 mL chez l'enfant de moins de 3 ans. Avant l'âge de 8 ans inclus, 2 doses à 1 mois d'intervalle sont nécessaires en primovaccination. L'immunité apparaît après 10 à 15 jours.
La tolérance est bonne (réaction locale : 10 % des cas, courbatures fébriles du 5e jour : 5 % des cas, réactions allergiques chez sujets sensibilisés aux protéines d'œuf).
Recommandations générales
La vaccination est officiellement recommandée chez :
-
•
les personnes âgées de plus de 65 ans ainsi que les sujets, y compris les enfants à partir de l'âge de 6 mois et les femmes enceintes, atteints d'une des pathologies suivantes : affections bronchopulmonaires chroniques dont asthme, dysplasie bronchopulmonaire et mucoviscidose, cardiopathies congénitales mal tolérées, insuffisance cardiaque grave et valvulopathies graves, néphropathies chroniques graves, syndromes néphrotiques purs et primitifs, drépanocytoses, homozygotes et doubles hétérozygotes S/C, thalassodrépanocytose, diabètes insulinodépendants ou non insulinodépendants ne pouvant être équilibrés par le seul régime, déficits immunitaires cellulaires ;
-
•
les enfants de 6 mois à 18 ans dont l'état de santé nécessite un traitement prolongé par acide salicylique ;
-
•
l'entourage familial de nourrissons de moins de 6 mois présentant des facteurs de risque de grippe grave : prématurés, cardiopathies congénitales, déficit immunitaire congénital, de pathologie pulmonaire, neurologique ou neuromusculaire.
Recommandations particulières
La vaccination est officiellement recommandée chez :
-
•
les professionnels de santé et tout professionnel en contact régulier et prolongé avec les sujets à risque de grippe sévère ;
-
•
les personnels naviguant des bateaux de croisière et des avions ainsi que les guides de groupes de voyageurs ;
-
•
les personnes infectées par le VIH quels que soient leur âge et leur statut immunovirologique ;
-
•
les personnes séjournant dans un établissement de moyen ou long séjour, ainsi que dans un établissement médico-social d'hébergement, quel que soit leur âge.
Contre-indications
Elles sont très limitées, soit temporaires (maladies infectieuses aiguës évolutives, injection récente de gammaglobulines), soit définitives (allergie authentique à l'ovalbumine).
Rougeole
E. Grimprel
La rougeole est la fièvre éruptive qui atteint le plus grand nombre d'enfants dans le monde. Ses complications, rares dans les pays à haut niveau socio-économique, sont fréquentes dans le Tiers-Monde où elles sont un facteur majeur de mortalité et de morbidité infantile.
Épidémiologie
La rougeole est liée à un Paramyxovirus. Elle sévit sous forme d'épidémies à recrudescence hivernale et printanière dans les zones tempérées.
Les enfants âgés de moins de 6 mois sont en général protégés par les anticorps transmis par la mère, à condition que celleci ait été atteinte par la maladie ou ait été vaccinée.
La contamination s'effectue essentiellement par les gouttelettes de salive provenant des sujets infectés. Le virus est présent dans le sang, les sécrétions et les urines, dans les 5 jours précédant l'éruption (phase de contagiosité maximale). La virémie et la virurie disparaissent 5 jours environ après le début de l'exanthème.
L'immunité est solide et définitive.
Clinique
L'enfant est habituellement atteint à l'âge préscolaire. L'incubation est de 10 jours. L'invasion est de 3 à 4 jours avec fièvre élevée, catarrhe diffus :
-
•
oculaire (conjonctivite, œdème palpébral, yeux bouffis) ;
-
•
nasal (rhinorrhée) ;
-
•
trachéobronchique (toux) ;
-
•
digestif (diarrhée, douleurs abdominales).
L'énanthème (inconstant) ou signe de Köplick survient 24 ou 48 heures après le début du catarrhe, et disparaît 24 à 48 heures après le début de l'exanthème.
Les caractéristiques de l'exanthème sont les suivantes :
-
•
il débute derrière les oreilles et s'étend de la tête vers les pieds en 3 à 4 jours ;
-
•
il est fait de macules non prurigineuses, parfois confluentes mais respectant des intervalles de peau saine ;
-
•
la fièvre décroît lorsque l'éruption s'est généralisée ; sa réapparition signe la surinfection bactérienne ;
-
•
l'exanthème disparaît en une semaine dans l'ordre d'apparition.
Le diagnostic de la rougeole typique est avant tout clinique. Les examens sérologiques effectués ne seront justifiés que dans les formes atypiques où les complications sont au premier plan.
Complications
Complications ORL et pulmonaires
Complications virales respiratoires
-
•Certaines sont bénignes :
-
–laryngite aiguë précoce ;
-
–bronchite et pneumopathie.
-
–
-
•D'autres sont plus graves :
-
–forme pulmonaire sévère liée à une atteinte alvéolaire diffuse ;
-
–atteinte de la fonction mucociliaire (pneumopathie séquellaire et formes à prédominance bronchiolaire).
-
–
Complications bactériennes
-
•
Certaines sont fréquentes (otites purulentes).
-
•
D'autres sont plus rares sous nos climats mais hautement redoutables chez certains enfants notamment dénutris : infections pleuropulmonaires à Haemophilus, pneumocoque ou staphylocoque.
Complications virales neurologiques
Encéphalite aiguë morbilleuse
Elle survient environ dans 1 cas pour 1 000 rougeoles :
-
•
il s'agit d'une leuco-encéphalite périveineuse avec démyélinisation ;
-
•
elle apparaît le 2e ou 7e jour après le début de l'exanthème ;
-
•
les signes neurologiques en sont extrêmement variés mais non spécifiques ;
-
•
le décès peut survenir dans 15 à 20 % des cas. Les séquelles (intellectuelles, neuro-déficitaires) peuvent être observées dans un tiers des cas.
Panencéphalite sclérosante subaiguë (Van Bogaert)
C'est une complication très retardée de la rougeole (5 à 10 ans après la rougeole maladie). Elle est évoquée devant la survenue de troubles du comportement qui précèdent l'apparition de mouvements anormaux (hyperkinésie périodique des membres superieurs et de la tete). L'evolution est fatale en 1 a 2 ans dans un tableau d'hypertonie generalisee.
La gravité d'une telle complication suffirait à elle seule à justifier la prévention de la maladie par la vaccination antirougeoleuse systématique.
Traitement
Curatif
-
•
Symptomatique : antipyrétiques.
-
•
Antibiothérapie générale en cas de complications chez les enfants à risque : antibiotiques actifs sur Haemophilus influenzae, les streptocoques, les pneumocoques, mais aussi parfois sur les staphylocoques dorés (ex. amoxicilline + acide clavulanique).
-
•
Éviction : jusqu'à 5 jours après le début de l'éruption.
Préventif
Il repose sur la vaccination universelle à deux doses des nourrissons selon le calendrier vaccinal (encadré 18.23 ). Une prophylaxie après contage est possible chez les sujets non protégés avec la vaccination après contage dans un délai de 3 jours et l'immunoprophylaxie passive (immunoglobulines intraveineuses).
Encadré 18.23.
Vaccination (vaccin triple rougeole-oreillonsrubéole)
-
–
Vaccin viral vivant suratténué.
-
–
Maladie éradicable si couverture vaccinale > 90 % de la population.
-
–
Et surtout âge optimal : 12 mois (voire plus précocement à 9 mois si l'enfant est en collectivité).
-
–
2e dose : 1 mois après la 1re injection et avant l'âge de 2 ans.
-
–
Durée de protection : définitive.
Les indications actuelles de la vaccination post-contage sont :
-
•
nourrissons de 6 à 8 mois : une dose de vaccin monovalent dans les 72 heures suivant le contage présumé (le sujet recevra par la suite deux doses de vaccin trivalent suivant les recommandations du calendrier vaccinal). En l'absence : immunoprophylaxie selon les cas ;
-
•
nourrissons de 9 à 11 mois non encore vaccinés (vivant en collectivité) : une dose de vaccin trivalent dans les 72 heures suivant le contage présumé, la seconde dose sera administrée entre 12 et 15 mois. En l'absence : immunoglobulines selon les cas ;
-
•
personnes ayant plus de 1 an et nées après 1980 : mise à jour du calendrier vaccinal pour atteindre deux doses de vaccin trivalent ;
-
•
personnes nées entre 1965 et 1979, travaillant en crèche, halte-garderie et assistantes maternelles : une dose de vaccin trivalent ;
-
•
professionnels de santé : une dose de vaccin trivalent.
Les indications actuelles de l'immunoprophylaxie passive sont :
-
•
la femme enceinte non vaccinée et sans antécédents de rougeole ;
-
•
le sujet immunodéprimé, quels que soient son statut vaccinal et ses antécédents avérés de rougeole ;
-
•
les enfants de moins de 6 mois dont la mère présente une rougeole ;
-
•
les enfants âgés de moins de 6 mois dont la mère n'a pas d'antécédent de rougeole et n'a pas été vaccinée (dans le doute, une sérologie maternelle igG peut être demandée en urgence) ;
-
•
les enfants âgés de 6 à 11 mois non vaccinés en postexposition dans les 72 heures après contact quels que soient le statut vaccinal de la mère ou ses antécédents de rougeole.
La rougeole en zones tropicales et subtropicales
Ce qu'il faut savoir :
-
•
la rougeole atteint des enfants jeunes : nourrissons < 2 ans ;
-
•
le catarrhe digestif est plus net que dans les pays occidentaux (surtout diarrhée avec déshydratation aiguë) ;
-
•
l'éruption est sur peau noire de type maculopapuleux ;
-
•
la desquamation est évidente : fine couche poudreuse blanche ;
-
•les complications sont très fréquentes et volontiers associées :
-
–pneumopathies bactériennes (streptocoques, Haemophilus influenzae, staphylocoques dorés),
-
–bronchopneumopathies, troubles de ventilation, laryngites ulcéronécrotiques (staphylocoques),
-
–stomatites, conjonctivites purulentes ;
-
–
-
•
la rougeole précipite l'évolution fatale de malnutritions graves (kwashiorkor).
La vaccination précoce et universelle est le seul garant de l'élimination de la maladie et de ses graves complications dans les pays concernés. Elle devrait permettre une réduction de la mortalité infantile.
Oreillons
A. Bourrillon
Il s'agit d'une maladie infectieuse, contagieuse, virale habituellement bénigne, liée à un paramyxovirus et conférant une immunité prolongée. Avant la généralisation de la vaccination par le ROR, cette infection concernait avant tout les enfants âgés de 5 à 7 ans. Des études de séroprévalence ont mis en évidence que 50 % des enfants âgés de 4 à 6 ans et 90 % entre 14 et 15 ans avaient des anticorps contre le virus ourlien.
Clinique
L'incubation est de 21 jours en moyenne.
La contamination s'effectue par les gouttelettes de salive provenant des sujets infectés.
La période de contagiosité débute 48 heures avant les premiers signes cliniques et se prolonge jusqu'au 3e ou 4e jour suivant le début de la parotidite.
Le tableau clinique débute par une phase d'invasion qui associe un syndrome infectieux discret avec fébricule à 38 °C, otalgies et gêne à la mastication. L'examen retrouve alors une sensibilité à la palpation rétromandibulaire, au niveau de l'angle de la mâchoire, à la pointe de la mastoïde et au niveau de l'articulation temporomaxillaire (classiques points de Rillet et Barthez). L'examen attentif de la cavité buccale retrouve typiquement une rougeur avec turgescence de l'orifice du canal de Sténon, au niveau de la face interne de la joue, en regard de la 2e molaire supérieure. il existe parfois une angine érythémateuse ou érythématopultacée, et des adénopathies sous-angulomaxillaires ou prétragiennes.
En 24-48 heures, le tableau s'est enrichi d'une tuméfaction parotidienne bilatérale typique que l'on distingue aisément d'une adénopathie jugulocarotidienne ou sous-angulomaxillaire : cette tuméfaction est localisée en arrière de la branche montante du maxillaire et comble le sillon rétromandibulaire. Elle est séparée en avant de la mastoïde et peut soulever le lobule de l'oreille. L'atteinte concomitante des glandes sous-maxillaires et sublinguales peut donner un aspect piriforme au visage. La palpation donne une sensation de résistance élastique, sensible sans caractère de fluctuation. La peau en regard n'est pas inflammatoire ni œdématiée. L'évolution est habituellement simple : la fièvre disparaît en 24-48 heures, la tuméfaction parotidienne est maximale vers le 4e-5e jour et s'efface sans suppuration ni atrophie résiduelle vers le 8e-10e jour.
Complications
Des complications peuvent survenir et sont parfois au premier plan du tableau clinique.
Elles se regroupent essentiellement en deux groupes du fait du tropisme particulier du virus : neurologiques et glandulaires.
Complications neurologiques
Méningite lymphocytaire
Elle survient classiquement vers le 4e jour d'évolution de la parotidite, mais elle peut survenir avant ou en l'absence de celle-ci. Elle débute généralement par une recrudescence thermique accompagnée de malaise, céphalée et vomissements. L'examen retrouve des signes méningés francs : raideur de nuque, signes de Kernig et de Brudzinski. La ponction lombaire met en évidence un LCR clair, hypertendu, comportant une hypercytose variable (300 à 1 000 éléments/mm3) à prédominance lymphocytaire (une formule panachée, voire une prédominance initiale de polynucléaires neutrophiles), une hyperprotéinorachie, une glycorachie et un taux de chlorures normaux. Le virus peut être identifié dans certains cas par amplification génique dans le LCR. L'évolution est le plu souvent bénigne, spontanément favorable en quelques jours. La ponction lombaire soulage souvent considérablement l'enfant et participe à la régression symptomatique. De nombreuses formes cliniques sont possibles, allant de la forme totalement latente à des formes plus sévères parfois sans autres signes associés évocateurs de la maladie. L'infection ourlienne était, avant la vaccination, l'étiologie la plus fréquente des méningites virales de l'enfant et du nourrisson. Cette place prépondérante a désormais été prise par les Entérovirus.
Méningo-encéphalite aiguë
Cette complication est rare (fréquence évaluée entre 0,2 à 2,5/1 000). La symptomatologie est celle d'une leuco-encéphalite aiguë non spécifique associant des troubles variables et fluctuants de la conscience avec confusion et survenue de convulsions. Le pronostic est globalement favorable.
Atteinte des paires crâniennes
On peut observer, au décours d'une méningite ou d'une méningo-encéphalite ourlienne, diverses atteintes des paires crâniennes : II (névrite optique), VII (paralysie faciale) et surtout VIII (surdité). La surdité unilatérale est plus fréquente (5 %) mais rarement définitive. Elle est sévère en cas d'atteinte bilatérale et précoce avant l'acquisition du langage car possiblement responsable d'une surdi-mutité définitive.
Autres complications neurologiques
D'autres complications sont plus rares : myélites, polyradiculonévrites (syndrome de Guillain-Barré).
Complications glandulaires
Pancréatite
Le diagnostic peut être évoqué devant la survenue de douleurs abdominales avec vomissements. Il sera confirmé par l'élévation des chiffres de l'amylasémie et de la glycémie. Sa fréquence est estimée entre 5 et 7 %.
Orchite
L'orchite survient après la puberté. Elle est le plus souvent unilatérale. Elle s'observe classiquement entre le 4e et le 10e jour d'évolution de la parotidite ourlienne. Le début est brutal, associant une fièvre élevée (40 °C), des douleurs abdominales et des vomissements. Au terme de quelques heures, les signes généraux régressent et les douleurs testiculaires sont au premier plan.
L'examen met en évidence un scrotum inflammatoire : rouge, chaud, tendu et œdématié avec parfois une lame d'hydrocèle vaginale. Le testicule est volumineux, lisse, régulier et extrêmement douloureux ; le cordon est normal ainsi que le déférent et l'épididyme.
L'évolution se fait lentement vers la guérison spontanée en une dizaine de jours. Une atrophie séquellaire peut survenir dans les semaines ou mois qui suivent, marquée par une diminution progressive et indolore de la taille du testicule qui devient mou et insensible. Dans les très rares cas d'orchite bilatérale évoluant vers l'atrophie, ont été observés des cas de stérilité définitive par azoospermie.
Autres atteintes glandulaires
D'autres atteintes glandulaires ont été décrites : ovarite, mastite, etc.
Diagnostic
Le diagnostic étant habituellement clinique, la confirmation biologique n'est que rarement utile du fait de la rareté des cas actuellement décrits depuis la généralisation de la vaccination : il conduit au dosage des IgM spécifiques qui sont élevées au début de la maladie (dans la 1re semaine d'évolution) ou par séroconversion IgG sur deux sérums prélevés à 3 semaines d'intervalle (intérêt rétrospectif).
Les autres diagnostics de parotidites sont rares chez l'enfant :
-
•
parotidite infectieuse, unilatérale très fébrile, avec pus au canal de Sténon après massage parotidien ;
-
•
lithiase salivaire, tuméfaction récidivante non infectieuse avec lithiase visible sur le cliché parotidien voire sialographie ;
-
•
tumeur de la parotide, affirmée par la biopsie qui s'impose devant une tuméfaction parotidienne dure et surtout persistante.
Traitement
Curatif
-
•
La parotidite ourlienne ne nécessite habituellement qu'un traitement symptomatique : antipyrétique et antalgique (paracétamol).
-
•
L'isolement est nécessaire jusqu'à la guérison clinique.
Préventif
Le vaccin vivant atténué a une efficacité épidémiologique prouvée. Il est recommandé de le pratiquer dès l'âge de 1 an (9 mois si entrée en collectivité) en association avec la rougeole et la rubéole et en rattrapage en association avec rougeole et rubéole avant l'âge de 2 ans.
Rubéole
E. Grimprel
La rubéole acquise est liée à un virus ARN dont il n'existe qu'un sérotype.
La vaccination a sensiblement modifié l'épidémiologie mais du fait d'une insuffisance de couverture vaccinale, la circulation du virus n'a pas été stoppée et la rubéole de l'adulte n'a pas disparu. Or, la gravité réelle de la rubéole est le risque de survenue de rubéole congénitale lorsque l'infection survient chez une femme enceinte non immune.
Le contage est respiratoire (aérosols), l'incubation longue, de 14 à 21 jours. Le virus s'implante et se réplique initialement au niveau du nasopharynx. Au terme d'une 2e semaine d'incubation, les symptômes de la maladie apparaissent : fièvre modérée, malaise, conjonctivite, adénopathies cervicales (occipitales et rétro-auriculaires) et éruption érythémato-maculopapuleuse de la face et du cou, s'étendant vers le tronc et les membres, et respectant les extrémités en 2 à 3 jours pour regresser ensuite.
Les principales complications sont articulaires (arthralgies, parfois véritables arthrites, surtout chez l'adulte), neurologiques (rares encéphalites) ou hématologiques (purpura thrombopénique).
La fréquence de l'atteinte fœtale varie selon le terme auquel survient l'infection maternelle : élevé jusqu'à 90 % avant la 10e semaine, il chute ensuite à 10-20 % à la 16e semaine. L'embryopathie est la conséquence de l'atteinte précoce et comporte diverses atteintes malformatives :
-
•
cérébrales : responsable de retard mental, surdité ;
-
•
oculaire : cataracte, rétinite, glaucome ;
-
•
cardiaque : persistance du canal artériel, sténose de l'artère pulmonaire, etc.
Le tableau de fœtopathie secondaire à une atteinte plus tardive comporte : hypotrophie, hépatite, splénomégalie, thrombocytopénie, encéphalite. Enfin, l'infection fœtale est responsable de prématurité et d'avortements.
Le diagnostic, lorsqu'il s'avère indispensable, repose sur le titrage des anticorps en inhibition de l'hémagluttination ou méthode immunoenzymatique : séroconversion avec taux d'anticorps IgG multiplié par 4 entre la phase aiguë et la convalescence, ou bien présence d'IgM en phase aiguë (pendant 2 mois). L'isolement du virus est possible mais délicat, dans le sang pendant la phase prodromique, dans le nasopharynx pendant la phase prodromique et au-delà (2 semaines) de l'éruption. La PCR est sensible et spécifique et permet dans certaines situations un diagnostic pré et postnatal.
La seule stratégie thérapeutique est préventive et implique la vaccination universelle des garçons et des filles, avec l'objectif d'élimination de la maladie au même titre que la rougeole et les oreillons (voir Vaccinations de l'enfant, page 528). Les immunoglobulines polyvalentes sont peu efficaces (très nombreux échecs), leur seule indication potentielle est la femme enceinte exposée, atteinte d'une infection prouvée et refusant l'avortement.
Infection à Herpes viridae
E. Grimprel
Les herpès virus comprennent :
-
•
le groupe HSV (HSV1 et HSV2) ;
-
•
le virus de la varicelle et du zona (VZV) ;
-
•
le virus de la mononucléose (EBV) ;
-
•
le cytomégalovirus (CMV) ;
-
•
l'HHV-6 ; l'HHV-7 et l'HHV-8.
Ces virus strictement humains ont en commun :
-
•
un tropisme neuroectodermique ou lymphotrope ;
-
•
la persistance à l'état latent après une primo-infection symptomatique +++;
-
•
un risque de réactivation (récurrence) plus fréquent et plus grave chez les enfants immunodéprimés.
Herpès simplex virus (HSV1 et HSV2)
Épidémiologie
-
•HSV1 :
-
–infection précoce ;
-
–partie supérieure du corps (herpès oral, oculaire).
-
–
-
•HSV2:
-
–atteinte génitale, méningée ;
-
–herpès néonatal.
-
–
Il n'existe pas de protection réciproque entre ces deux virus.
Physiopathologie
La primo-infection se fait après transmission par contact direct cutané ou muqueux :
-
•
HSV1 : salive et lésions cutanéomuqueuses ;
-
•
HSV2 : relations sexuelles (adolescents) ; transplacentaire et voies génitales maternelles (nouveau-né).
L'infection patente est permanente au niveau des neurones des ganglions sensitifs ; en cas de récurrence, une migration virale nerveuse centrifuge est possible vers la peau ou le système nerveux central susceptible de devenir symptomatique.
Diagnostic
HSV1
Herpès oral
-
•
Primo-infection (enfant 6 mois 4 ans) : gingivostomatite aiguë (lésions douloureuses buccales ou des lèvres), dysphagie, fièvre, asthénie, adénopathies cervicales (en particulier sous-maxillaire).
-
•
Récurrence (adultes) parfois facilitée par le stress, immunodépression transitoire : bouquet de vésicules unilatérales (cutanéomuqueuses des lèvres, narines).
Primo-infection oculaire
Elle se traduit le plus souvent par une kérato(conjonctivite) unilatérale aiguë avec œdème.
HSV2
L'herpès génital a les caractéristiques suivantes :
-
•
primo-infection : symptomatique (1 cas sur 3), adolescentes, vulvaire ou vaginale aiguë et douloureuses, fièvre, adénopathies inguinales ;
-
•
récurrence : limitée à des brûlures locales + prurit et des vésicules en bouquet. Transmission virale possible chez les asymptomatiques.
Diagnostic de sévérité
Encéphalite herpétique
Le diagnostic est évoqué sur la clinique, l'imagerie (zones hypodenses temporales sur le scanner) et la PCR-HSV ; le pronostic est sévère.
Herpès néonatal (HSV2)
Il concerne 70 à 200 cas annuels en France. il correspond à des infections néonatales extrêmement sévères chez le nouveau-né.
Kaposi-Juliusberg (herpès diffus sur lésions d'eczéma)
Il concerne les sujets immunodéprimés. L'immunodépression cellulaire (sida, transplantation, hémopathie) favorise les récurrences sévères et extensives avec risque de dissémination viscérale (pneumopathie et hépatite).
Diagnostic confirmé par les tableaux de sévérité :
-
–
culture cellulaire virale ;
-
–
PCR (surtout si encéphalite).
Traitement
Primo-infection
Pour la gingivostomatite herpétique, il n'existe pas de consensus pour un traitement antiviral des primo-infections herpétiques non compliquées du nourrisson et de l'enfant. L'aciclovir (Zovirax) par voie orale ou le valaciclovir (Zelitrex) ont une AMM dans cette indication mais leur efficacité partielle n'est démontrée que lors d'un traitement précoce, dans les premières 24 heures d'évolution.
Récurrences
-
•
Génitales : Zovirax ou Zelitrex par voie orale.
-
•
Formes sévères chez l'immunodéprimé : aciclovir IV (Zovirax IV, 5 mg/kg × 3/j).
-
•
Encéphalite herpétique : aciclovir IV (Zovirax IV, 10 à 15 mg/ kg × 3/j pendant 21 jours).
-
•
Herpès commun superficiel : pommade ophtalmique Zovirax (contre-indications : corticoïdes et anesthésiques locaux).
Prévention des infections récidivantes (enfants > 6 ans)
-
•
Cutanéomuqueuses : Zovirax per os pendant 6 à 12 mois ;
-
•
Infections génitales : Zelitrex per os pendant 6 à 12 mois.
Autres infections à Herpes viridae
Voir varicelle, zona, mononucléose et cytomégalovirus ci-après.
Varicelle-zona
Varicelle-zona
E. Grimprel
La varicelle et le zona sont provoqués par le virus de la varicelle-zona, virus du groupe Herpes, qui en possède les principales propriétés que sont les phénomènes de latence et de réactivation. La varicelle représente la primo-infection par le VZV pendant laquelle le virus diffuse à l'ensemble du corps après une double virémie. La primo-infection est rarement asymptomatique. Le virus persiste toute la vie à l'état de latence au niveau de structures ganglionnaires nerveuses sensitives. Sa réactivation entraîne une migration axonale du virus vers les extrémités nerveuses correspondantes avec apparition d'une éruption cutanée = zona (localisée à un dermatome cutané, rarement plusieurs dermatomes contigus).
Varicelle
La varicelle est une maladie pédiatrique, elle s'observe avec prédilection entre 2 et 10 ans. Elle a été décrite de façon exceptionnelle chez le nouveau-né. Une transmission transplacentaire est possible, responsable en début de grossesse d'exceptionnelles embryopathies et en fin de grossesse de varicelles néonatales. Elle est beaucoup plus rare chez l'adulte mais plus sévère (pneumopathie). Elle est gravissime car mortelle en l'absence de traitement antiviral et parfois encore malgré le traitement chez le sujet immunodéprimé.
La maladie évolue sur un mode endémo-épidémique en France et quasi obligatoire, touchant chaque année 553 000 à 751 000 sujets.
Description clinique
La varicelle, dans sa forme typique, a une incubation de 14 jours, silencieuse.
La période d'invasion est brève (24 à 36 heures), peu fébrile et non spécifique : elle associe : fièvre, en règle modérée (38 °C) mais parfois élevée (39-40 °C), céphalée, malaise général. La période d'état est spécifique, elle est marquée par :
-
•
l'exanthème : multiples lésions élémentaires évoluant en plusieurs stades : macule érythémateuse (2 à 4 mm), vésicule molle puis trouble (2e jour), ombilication centrale et assèchement pour une croûte prurigineuse qui chute entre le 5e et le 7e jour. Les lésions sont réparties sur l'ensemble du corps y compris le scalp, avec des intervalles de peau saine, leur nombre est très variable selon les individus. La durée de la phase éruptive est de 10 à 12 jours, constituée de 2 ou 3 poussées successives à 24-48 heures d'intervalle, et aboutissant ainsi à la coexistence d'éléments d'âges différents ;
-
•
l'énanthème buccal, généralement plus discret : quelques vésicules rapidement éclatées laissant place à de petites ulcérations superficielles. L'atteinte des autres muqueuses est plus rare : conjonctives, vulve, larynx.
La contagiosité de la varicelle est extrêmement importante. Elle débute 24 heures avant l'éruption en période d'invasion, est maximale jusqu'au 7e jour, c'est-à-dire tant que persistent des lésions au stade vésiculeux. Les croûtes non ulcérées sont généralement peu ou pas contagieuses.
Complications
Les complications sont rares (4 %) mais parfois sévères, générant 3 500 hospitalisations annuelles en France (deux tiers concernent des enfants) et 18 décès survenant principalement chez des sujets sains (absence d'immunodépression) :
-
•
en premier, les surinfections cutanées à Staphylococcus aureus et Streptococcus pyogenes du groupe A. Elles se manifestent par des pyodermites superficielles, ou profondes, dermohypodermites, varicelle gangréneuse, lymphangite, adénite, impétigo bulleux ou non, syndrome de la peau ébouillantée. Plus rarement, bactériémie, choc, fasciite nécrosante. Des localisations secondaires sont également observées : pneumonie, arthrite, ostéomyélite ;
-
•
ensuite, les complications nerveuses : ataxie cérébelleuse, paralysie faciale, méningite, plus rarement névrite optique, encéphalite aiguë, et exceptionnellement, myélite aiguë transverse et polyradiculonévrite ;
-
•
certaines formes sévères par leur extension (varicelle grave sur eczéma diffus, Kaposi-Juliusberg) ou leur localisation (atteinte muqueuse : stomatite, conjonctivite, vulvite, plus rarement laryngite avec œdème glottique) ;
-
•
autres complications : hématologiques (thrombopénie), hépatiques (hépatite souvent purement biologique), respiratoires (pneumopathie varicelleuse), articulaires (polyarthrite), rénales (protéinurie, glomérulonéphrite aiguë), métaboliques (syndrome de Reye 2,5/10 000 favorisé par la prise d'AiNS formellement contre-indiqué en cas de varicelle), myocardite, orchite.
Traitement
Traitement curatif
Le traitement de la varicelle est essentiellement symptomatique : mesures simples d'hygiène de la peau, antiseptiques et colorants locaux, antihistaminiques oraux contre le prurit parfois efficaces, antipyrétiques type paracétamol (l'ibuprofène et l'aspirine sont contre-indiqués), antibiothérapie urgente (amoxicilline-acide clavulanique) en cas de surinfection des vésicules. Sont formellement proscrits tous les produits poudrés (à base de talc) réputés pour calmer le prurit ou contenant des antiseptiques car ils ont été associés à la survenue de surinfections cutanées sévères.
L'usage des antiviraux (aciclovir) en curatif n'est indiqué que dans les situations suivantes :
-
•
le sujet immunodéprimé, quel que soit son type d'immunosuppression, congénital ou acquis ;
-
•
le nouveau-né dont la mère débute sa varicelle dans une période courte allant de 2 jours avant l'accouchement à 5 jours après la naissance (risque de varicelle néonatale sévère) ;
-
•
les formes compliquées.
Traitement préventif
il n'y a aucune AMM ni recommandation officielle pour l'utilisation des antiviraux en prophylaxie.
Un traitement préventif par immunoglobulines spécifiques anti-VZV (Varitect, 5 à 25 Ui/kg voie iV dans les 96 heures suivant le contage) est indiqué en ATU nominative dans certaines situations :
-
•
enfants et adultes immunodéprimés ;
-
•
nouveau-nés dont la mère a eu la varicelle dans les 5 jours avant ou les 2 jours après l'accouchement ;
-
•
prématurés (hors contage maternel) qui doivent rester longtemps à l'hôpital ;
-
•
prématurés AG < 28 semaines ou PN < 1 000 g quel que soit le statut maternel ;
-
•
femmes enceintes (recommandation de l'académie américaine de pédiatrie) ;
Seule une vaccination ciblée (voir Vaccinations de l'enfant, page 528) est actuellement recommandée en France.
Zona
Le zona ne se rencontre que chez les sujets ayant déjà fait la varicelle, sauf dans les exceptionnels cas de varicelle in utero où le zona peut être la première manifestation observée chez l'enfant. On retrouve parfois un facteur déclenchant à l'apparition cette réactivation : maladie infectieuse (grippe, pneumonie, tuberculose, etc.), stress, fatigue, intoxication, traumatisme, maladie maligne (hémopathie, métastase rachidienne, etc.). Bien souvent, aucune cause déclenchante n'est retrouvée.
Les lésions du zona sont moins contagieuses que celles de la varicelle car la quantité de virus excrétée à leur niveau est plus faible. Cependant ces lésions sont réellement contagieuses, au moins à leur début et sont susceptibles d'entraîner une varicelle chez un sujet non immun (n'ayant pas fait la varicelle). En revanche, elles n'entraînent pas de zona car la réactivation virale est un phénomène intrinsèque à l'individu porteur du virus à l'état de latence et ne provient donc pas d'une contamination externe.
Zona intercostal
Dans sa forme typique, il réalise une éruption ayant une topographie précise, le plus souvent unilatérale (orbite, épaule, ceinture).
L'invasion (24-48 heures) est marquée par un syndrome infectieux discret (fièvre, malaise, céphalées), une douleur localisée au territoire de la future éruption, adénopathie satellite (ici axillaire homolatérale) sensible.
L'éruption qui suit est caractéristique par sa topographie : unilatérale, répartie en trois bouquets d'apparition successive, latérovertébral, axillaire moyen et parasternal, de topographie hémicirculaire, radiculaire, horizontale, coupant la ligne des côtes, discontinue. Des éléments aberrants peuvent s'observer sur d'autres territoires.
Les signes associés sont :
-
•
neurologiques portant sur le territoire de l'éruption : hypoesthésie, anesthésie douloureuse, hyperesthésie périphérique, troubles dits sympathiques : vasomoteurs (rougeur ou pâleur), sécrétoires (sudation diminuée ou exagérée), thermiques (augmentation de la chaleur locale) ;
-
•
un syndrome méningé, uniquement biologique le plus souvent et sans conséquence clinique.
Autres zonas
Les autres zonas se distinguent par la topographie de l'éruption :
-
•
rachidiens (95 % des cas) ;
-
•abdominaux :
-
–lombo-inguinal (région inguinale et organes génitaux externes),
-
–lombofémoral (face supéroexterne de la cuisse) ;
-
–
-
•sacrés :
-
–sacro-ischiatique (fesse, sacrum et périnée),
-
–périnéo-génital (périnée, marge anale, OGE, urètre) ;
-
–
-
•cervicaux :
-
–cervico-occipital C1-C2-C3 (nuque, cuir chevelu),
-
–cervico-subclaviculaire C3-C4 (sterno-cléido-mastoïdien jusqu'à la clavicule) ;
-
–
-
•
des membres, supérieurs ;
-
•crâniens :
-
–ophtalmique : une seule ou plusieurs des 3 branches du nerf ophtalmique de Willis :
-
–zona frontal : partie supéro-interne de la paupière supérieure, partie interne de l'hémi-front, deux tiers antérieurs de l'hémi-cuir chevelu,
-
–zona lacrymal : moitié externe de la paupière supérieure et de la conjonctive, région temporomalaire, hypersécrétion lacrymale ;
-
–
-
–nasal :
-
–
-
•
zona nasal externe : racine du nez, partie inféro-interne de la paupière supérieure avec la conjonctive et parfois la cornée, devant faire rechercher une anesthésie cornéenne +++,
-
•zona nasal interne : aile du nez, partie antérieure de la cloison nasale, face postérieure de l'os propre du nez avec coryza douloureux homolatéral ;
-
–zona du ganglion géniculé : otalgie, paralysie faciale périphérique, adénopathie prétragienne, éruption au niveau de la zone de Ramsay-Hunt (tympan, conduit auditif externe, conque de l'oreille, deux tiers de l'hémi-langue, pilier antérieur du voile). L'association à des troubles cochléovestibulaires réalise le zona otitique total de Sicard,
-
–zona du trijumeau avec deux branches :
-
–
-
•
branche maxillaire supérieure avec une topographie qui comprend : la paupière inférieure, l'aile du nez, la région génienne antérieure, la lèvre supérieure, les fosses nasales, la voûte palatine,
-
•branche maxillaire inférieure avec comme topographie : la fosse temporale, la partie postérieure de la joue, la partie supérieure de la région massétérine, le menton, la partie interne de la joue, les gencives, les deux tiers antérieurs de la langue ;
-
–zona bucco-pharyngé et pharyngolaryngé, de topographie complexe.
-
–
L'évolution du zona est souvent bénigne chez l'enfant à la différence de l'adulte, âgé (douleurs post-zostériennes sévères), mais elle se fait parfois au prix d'une cicatrice atrophique, dyschromique, même en l'absence de surinfection.
Le traitement du zona est symptomatique chez l'enfant. L'indication du traitement antiviral est limitée au zona ophtalmique (zona nasal externe particulièrement), au zona du sujet immunodéprimé et de l'adulte du fait du risque plus élevé de complications.
Infection à Epstein-Barr virus : mononucléose infectieuse
A. Bourrillon
La mononucléose infectieuse (MNI) est la traduction clinique de la primo-infection par le virus d'Epstein-Barr. Ce virus à ADN qui appartient au groupe des herpès virus est par ailleurs incriminé dans la pathogénie du lymphome de Burkitt africain et du carcinome nasopharyngé.
La mononucléose infectieuse de l'enfant réalise une infection fréquente, souvent inapparente et classiquement réputée pour sa bénignité. Le recours plus systématique à la pratique des sérologies spécifiques de l'EBv a permis d'identifier récemment de nombreux aspects cliniques atypiques pouvant être au premier plan de la symptomatologie chez l'enfant.
Épidémiologie
La primo-infection par EBV est ubiquitaire, quasi obligatoire.La mononucléose infectieuse est une infection qui prédomine chez l'adolescent et l'adulte jeune (75 % des sujets de 15 à 25 ans). Elle est rare avant l'âge de 2 ans (rôle des anticorps transmis), et après l'âge de 40 ans. La fréquence avec laquelle la sérologie EBV est positive conduit à supposer que l'infection est souvent inapparente chez l'enfant.
La transmission du virus est interhumaine, soit par contact direct (« maladie du baiser »), soit par l'intermédiaire d'objets contaminés (jouets sucés, etc.) : le dénominateur commun de ces deux modes de transmission est la salive. Le site initial de la pénétration de l'EBV est l'oropharynx.
Clinique
L'incubation de la maladie est estimée de 30 à 50 jours chez l'adulte jeune et serait plus courte chez l'enfant. La mononucléose infectieuse réalise chez le grand enfant un tableau clinique assez proche de celui de l'adulte jeune avec la tétrade symptomatique classique :
-
•
fièvre, souvent élevée ;
-
•
angine ou pharyngite ;
-
•
polyadénopathies ;
-
•
splénomégalie.
La mononucléose infectieuse revêt souvent chez l'enfant des tableaux plus atypiques :
-
•
symptomatologie dissociée ou pauvre, pouvant laisser méconnaître la maladie ;
-
•
révélation par des complications parfois isolées.
Complications
Hépatistique
Elle est quasi constante, comme en témoigne le taux des transaminases sériques, presque toujours élevé. La survenue conjointe d'une hépatite aiguë à virus B est possible. Le pronostic de l'hépatite est excellent dans la majorité des cas.
Atteintes neurologiques
Leur fréquence est estimée à 7 % de l'ensemble des complications de la maladie. Il s'agit le plus souvent d'affections du système nerveux central :
-
•
méningite lymphocytaire ;
-
•
encéphalite révélée par des convulsions ;
-
•
méningo-encéphalite ;
-
•
myélite transverse ;
-
•
atteinte des paires crâniennes ;
-
•
ataxie aiguë cérébelleuse ;
-
•
polyradiculonévrite aiguë type syndrome de Guillain-Barré où la classique dissociation albuminocytologique peut être mise en défaut. Les atteintes neurologiques périphériques sont exceptionnelles.
Les examens sérologiques spécifiques ont ici tout leur intérêt pour relier ces manifestations à leur étiologie précise.
Atteintes otorhinolaryngologiques
L'intensité du processus inflammatoire concernant la muqueuse pharyngée et les amygdales, jointe à l'existence éventuelle d'exsudats ou de fausses membranes rend compte de la sévérité de certaines présentations de la maladie à type d'obstruction aiguë des voies aériennes supérieures. Un tableau de détresse respiratoire obstructive haute est ainsi réalisé, pouvant conduire à l'injection immédiate de corticoïdes ou, en cas d'échec, dans certaines formes sévères, à une intubation trachéale.
Atteintes hématologiques
La mononucléose infectieuse peut se compliquer :
-
•
d'une anémie hémolytique aiguë (8 % des cas) ;
-
•
d'une thrombopénie ;
-
•
très rarement de leucopénies profondes, voire d'agranulocytose.
Atteintes cardiologiques
Les péricardites ou myocardites ont une traduction le plus souvent électrique et un pronostic excellent.
Atteintes pneumologiques
Des pneumopathies interstitielles ont pu être décrites, parfois associées à Mycoplasma pneumoniae.
Atteintes dermatologiques
Elles comportent des manifestations cutanées très variées (exanthèmes polymorphes, morbilliformes, rubéoliformes, etc.) souvent généralisées et fugaces. Les « rashs » ou éruptions transitoires apparus à la suite de la prise d'ampicilline sont assez évocateurs de la maladie. Ils ne sauraient contre-indiquer l'emploi ultérieur de l'ampicilline ou de ses dérivés chez les enfants atteints.
Autres atteintes
Elles apparaissent exceptionnelles :
-
•
ophtalmologiques (conjonctives) ;
-
•
stomatologiques (gingivostomatites) ;
-
•
rhumatologiques (arthralgies, monoarthrites).
Arguments diagnostiques
Examens hématologiques
La mise en évidence d'un syndrome mononucléosique complet, classiquement requise pour le diagnostic de la maladie, fait souvent défaut chez l'enfant. On peut ainsi évoquer le diagnostic devant une neutropénie relative (40 % des leucocytes circulants) et/ou une hyperlymphocytose (40 % des leucocytes circulants) et/ou une monocytose en l'absence de lymphocytes atypiques. La survenue d'une thrombopénie modérée est un argument possible (50 % des cas).
Examens sérologiques
La mononucléose infectieuse s'accompagne de la présence d'anticorps hétérophiles, capables d'agglutiner les hématies hétérologues. Deux techniques permettent de les mettre en évidence :
-
•
le MNItest ;
-
•
la classique réaction de Paul-Bunnell-Davidsohn, mais elle n'est plus utilisée.
Le MNl-test est l'examen privilégié car d'obtention rapide, de bonne spécificité et d'assez bonne sensibilité. Il est positif dès la 1re semaine de l'infection et se négativise en 2 ou 3 semaines. Le MNl-test est en règle négatif avant l'âge de 3 ans.
Chez le jeune enfant, les anticorps hétérophiles ne sont pas détectés dans un tiers des cas.
La négativité du MNItest conduit, lorsqu'il apparaît nécessaire de confirmer le diagnostic (forme compliquée dont l'étiologie virale doit être précisée), à prescrire un examen sérologique spécifique (fig. 18.40 ). La primo-infection par EBV se caractérise par l'apparition d'anticorps anti-VCA (IgM) puis de type IgG ; ces derniers persisteront toute la vie à des valeurs moyennes (en France taux résiduel à 195). Les taux d'anticorps anti-EBNA persisteront également toute la vie à des valeurs plus faibles (en France taux à 45).
Fig 18.40.
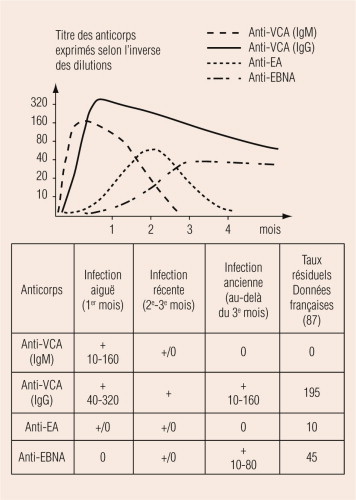
Sérologie spécifique de la mononucléose.
0 : résultats < 10 pour les anticorps anti-VCA ou anti-EA, < 2 pour les anticorps anti-EBNA.
+ : résultats ≥ 10 pour les anticorps anti-VCA ou anti-EA, ≥ 2 pour les anticorps anti-EBNA.
EA : Early Antigens ; EBNA : Epstein-Barr Nuclear Antigens.
D'après Fleisher G et al. J Infec Dis 1979 ; 139 : 553-8.
Traitement
Dans la quasi-totalité des cas, aucune thérapeutique n'est utile. La guérison spontanée sans séquelle est la règle.
-
•
La corticothérapie ne doit être réservée qu'à certaines complications aiguës de la maladie (obstruction aiguë des voies aériennes supérieures, purpura thrombopénique par exemple).
-
•
La vaccination contre EBV n'est actuellement qu'une perspective d'avenir.
Infections à CMV
E. Grimprel
(Voir aussi Embryofœtopathies virales chapitre 4, page 40) Les infections à CMV sont le plus souvent asymptomatiques. Le diagnostic peut être évoqué chez un sujet immunocompétent dans un contexte de :
-
•
fièvre prolongée ;
-
•
asthénie ;
-
•
arthralgies et myalgies ;
-
•
avec syndrome mononucléosique et cytolyse hépatique.
La confirmation du diagnostic est assurée par un examen sérologique si séroconversion ou présence d'IgM.
Diagnostic chez les enfants immunodéprimés
-
•
Antigénémie pp65 ou PCR dans le sang dont la positivité peut précéder les signes cliniques.
-
•
Techniques d'immunohistochimie pour détection directe du CMV dans les tisus.
-
•
Imagerie selon le site présumé d'atteinte.
Traitement curatif uniquement chez les sujets immunodéprimés
-
•
Ganciclovir (Cymévan).
-
•
Foscarnet (Foscavir).
-
•
Valganciclovir (Rovalcyte) en cas de rétinite.
BIBLIOGRAPHIE
- Collège des universitaires des maladies infectieuses et tropicales (CMIT) Le Popi : guide de traitement ; référence pour une bonne pratique médicale. 2007. [Google Scholar]
Mégalérythème épidémique
Il s'agit d'une infection contagieuse de l'enfant d'âge scolaire due au Parvovirus B19. La maladie est endémique avec survenue d'épidémies hiverno-printanières. La contamination est respiratoire, l'incubation est silencieuse et dure de 6 à 14 jours.
La maladie consiste en une éruption, typique, en trois phases :
-
•
érythème bilatéral et symétrique des joues, souffletées, avec un halo pâle périphérique, de petites adénopathies occipitales et un énanthème maculopapuleux rouge du palais et du pharynx. Elle disparaît spontanément en 4 à 5 jours. Parfois l'éruption est atypique : morbilliforme, confluente, papuleuse, vésiculeuse ou purpurique (pseudo-purpura rhumatoïde) ;
-
•
24-48 heures plus tard, survient l'érythème maculeux des membres s'étendant progressivement avec une majoration périphérique avec aspect figuré en carte de géographie. Dans 15 % des cas, l'éruption s'accompagne d'un prurit. Cette phase peut durer de 1 à 3 semaines. À cette éruption peuvent s'ajouter des phénomènes articulaires : arthralgies ou arthrites touchant préférentiellement les petites articulations distales des mains, mais également les genoux, les poignets avec une fréquence variable (60 % au-delà de 20 ans, 3 % avant 9 ans). La guérison est observée en quelques semaines ;
-
•
phase terminale, l'éruption devient variable d'un moment à l'autre avec accentuation possible par le soleil, la chaleur, les émotions, le stress et rechutes possibles pendant les mois suivants, à l'effort ou au soleil.
Les complications sont hématologiques, en rapport avec la virémie et la multiplication du virus dans la moelle osseuse avec un effet cytolytique pour les cellules précurseurs de la lignée rouge. Chez les sujets normaux, le mégalérythème épidémique n'a pas de traduction hématologique clinique. Chez les sujets dont la demi-vie des globules rouges est raccourcie (drépanocytose homozygote SS et SC, maladie de Minkowski-Chauffart, thalassémie, etc.) survient une crise aiguë transitoire érythroblastopénique se traduisant par une anémie aiguë sévère arégénérative dont l'unique traitement est la transfusion en urgence. Chez les sujets immunodéprimés, l'infection est chronique (anémie chronique arégénérative). Chez le fœtus, la primo-infection maternelle à Parvovirus B19 provoque pendant la grossesse des avortements spontanés précoces (1er trimestre) ou des anémies fœtales tardives avec anasarque fœtoplacentaire et mort in utero.
Le diagnostic repose sur la sérologie spécifique IgM et IgG.
Infection à VIH-1 chez l'enfant
A.Faye
Le nombre d'enfants vivants avec le VIH/sida était de plus de 2 millions à la fin de l'année 2008 dont plus de 90 % infectés par transmission mère-enfant. Durant cette année, 430 000 enfants ont été contaminés et environ 300 000 enfants sont décédés dans le monde. L'Afrique subsaharienne, où l'on dénombre plus de 90 % des enfants infectés, est particulièrement touchée.
En France, l'infection à VIH ne touche qu'un petit nombre d'enfants mais elle nécessite une prise en charge médicale et psychosociale lourde. Le nombre total d'enfants infectés par le VIH en France n'est pas connu avec précision mais avoisine sans doute environ 1 000 cas pédiatriques.
Deux grands événements ont bouleversé ces dernières années la prise en charge de l'infection à VIH chez l'enfant : la prévention de la transmission mère-enfant du VIH par les antirétroviraux pendant la grossesse et l'utilisation large des multithérapies antirétrovirales chez les enfants infectés.
Grâce au traitement préventif de la transmission mère-enfant durant la grossesse utilisé largement en France depuis 1994, moins de 20 nourrissons naissent infectés par le VIH chaque année depuis 2000. Le taux de transmission mère-enfant du VIH qui avoisinait les 15-20 % avant 1994 a diminué de façon considérable et se situe actuellement aux alentours de 1 %. Ainsi, la plupart des nouveaux enfants infectés par le VIH nouvellement diagnostiqués en France sont des enfants nés en pays de forte endémie où les taux de transmission mèreenfant du virus restent élevés autour de 20-25 %. Cependant un certain nombre de nourrissons nés en France sont infectés par le VIH du fait d'un échec du dépistage chez la mère (déni de la séropositivité, primo-infection pendant la grossesse ou l'allaitement, refus du dépistage, grossesse non suivie, etc.). Ceci doit inciter à une vigilance accrue sur la possibilité d'une infection à VIH chez des nourrissons à risque dont les mères ont une sérologie négative en début de grossesse.
L'utilisation large des multithérapies antirétrovirales depuis 1996 dans les pays du Nord a permis de considérablement diminuer la mortalité et la morbidité de l'infection à VIH chez l'enfant infecté. Dans une grande cohorte américaine, on a pu constater une diminution de la mortalité, essentiellement liée à l'introduction des inhibiteurs de protéase, de 5,3 % en 1996 à 0,7 % en 1999. Ceci a été confirmé dans d'autres cohortes et registres nationaux. Cependant, bien que les résultats des multithérapies soient satisfaisants sur le plan clinique et immunologique, les pédiatres sont confrontés à de nombreux échecs virologiques associés à des mutations de résistance du virus aux antirétroviraux.
La complexité du traitement chez l'enfant, l'évolution rapide des connaissances et le faible nombre d'enfants infectés en France imposent un suivi thérapeutique dans un centre spécialisé ou en collaboration étroite avec ce centre. S'il existe quelques particularités pédiatriques d'utilisation des antirétroviraux, l'essentiel des connaissances reste toutefois extrapolé de l'expérience du traitement des adultes.
Diagnostic de l'infection à VIH chez le nourrisson et l'enfant
Le diagnostic de l'infection à VIH peut être nécessaire dans deux situations : chez un nourrisson de mère séropositive pour le VIH et chez un nourrisson ou un enfant présentant une pathologie qui pourrait être en rapport avec une infection à VIH. Une troisième situation qui ne sera pas détaillée est celle du diagnostic post-exposition à une aiguille ou à du matériel potentiellement contaminé pour lequel aucune contamination n'a été décrite chez l'enfant jusqu'à présent.
Les nourrissons de mères séropositives sont porteurs des anticorps maternels anti-VIH jusqu'à l'âge de 16-18 mois. Le diagnostic de contamination est donc effectué durant cette période par des techniques de détection du virus. La recherche du virus peut se faire par PCR ADN à partir des cellules sanguines pour la recherche de génome viral intégré, ou par détection de l'ARN VIH plasmatique avec les techniques habituelles de charge virale.
La recherche de virus par culture reste intéressante en cas de virus atypiques ou variants non reconnus par les techniques moléculaires mais il s'agit d'une technique lourde et coûteuse. En l'absence de traitement antirétroviral préventif de l'enfant, les sensibilités des deux techniques de PCR ADN et ARN VIH plasmatique sont équivalentes. À 15 jours et à 3 mois de vie, ces techniques atteignent respectivement une sensibilité de 90 % et de 100 %.
Pour poser le diagnostic d'infection il est nécessaire d'avoir deux prélèvements positifs quels que soient la technique utilisée et le moment du prélèvement. Inversement, pour poser un diagnostic de non-infection, il faut deux prélèvements négatifs après l'âge d'un mois (en pratique le diagnostic de non-contamination peut être posé à l'âge de 3-4 mois).
En cas de traitement préventif de la transmission virale, le diagnostic est peu fiable tant que l'enfant est sous traitement antirétroviral. Il faut donc deux prélèvements négatifs hors période de traitement pour considérer un enfant comme non infecté. Les prélèvements précoces, à la naissance et dans la 1re semaine de vie, peuvent être informatifs en cas de résultats positifs, ils permettent notamment d'affirmer une infection in utero en cas de positivité dès la naissance.
En pratique, la recherche du virus est effectuée à la naissance, à 1, 3 et 6 mois. En cas d'allaitement maternel, il est nécessaire de rechercher l'infection dans les 3 mois qui suivent l'arrêt définitif de l'allaitement.
Au-delà de l'âge de 18 mois, les techniques sérologiques permettent de détecter la réponse anticorps de l'enfant, elles peuvent être utilisées selon le même algorithme que celui utilisé pour le diagnostic de l'infection de l'adulte.
Mortalité et de la morbidité avant « l'ère des multithérapies »
L'ensemble des études effectuées au sein de grandes cohortes avant l'utilisation large des multithérapies a permis de décrire une évolution bimodale de la maladie de l'enfant :
-
•
en l'absence de traitement, environ 15-20 % des enfants infectés développent une forme évolutive précoce et sévère souvent avec encéphalopathie et survenue rapide d'un déficit immunitaire sévère compliqué d'infections opportunistes ;
-
•
80-85 % des enfants présentent une forme évolutive lente comparable à l'adulte, avec un risque cumulatif de sida de l'ordre de 4 à 5 % par an.
La connaissance de l'évolution de l'infection à VIH chez l'enfant avant l'utilisation large des multithérapies est particulièrement importante car elle permet d'orienter en partie les indications cliniques de traitement. Par exemple, en l'absence d'altération significative des marqueurs immunovirologiques, le traitement pourra être retardé chez un enfant peu ou pas symptomatique (stade N ou A du CDC) dont l'espérance de vie sans traitement avoisine 90 % à 8 ans.
Il est possible que les multithérapies permettent de diminuer voire d'éviter la forme précoce et sévère du nourrisson mais aucune conclusion définitive ne peut être actuellement avancée. Par ailleurs la morbidité, l'évolution vers le stade sida et la mortalité sont diminuées dans les cohortes d'enfants sous multithérapie.
La classification clinique pédiatrique du CDC est présentée dans le tableau 18.27 .
Tableau 18.27.
Classification pédiatrique de 1994 du CDC.
| A. Classification clinique (résumée) | |||||
|---|---|---|---|---|---|
| Catégorie N | Asymptomatique | ||||
| Catégorie A |
Symptômes mineurs : lymphadénopathie, hépatosplénomégalie, dermatose, parotidite, infections ORL ou bronchiques récidivantes |
||||
| Catégorie B |
Symptômes modérés (liste non limitative) : infection bactérienne, pneumopathie lymphoïde, thrombopénie, anémie, neutropénie, zona, candidose ou herpès buccal récidivant, néphropathie, cardiopathie, léiomyosarcome |
||||
| Catégorie C |
Symptômes sévères : infection opportuniste, infections bactériennes sévères répétées, encéphalopathie, lymphome ou cancer, cachexie |
||||
| La classification clinique (N, A, B, C) est croisée avec une classification biologique (I, II, III) ci-dessous | |||||
| B. Évaluation du degré de déficit immunitaire, basé sur le taux de lymphocytes CD4 en fonction de l'âge(exprimé en nombre absolu NA et en pourcentage) | |||||
| < 12 mois* | 1-5 ans | 6-12 ans | |||
| I | Pas de déficit immunitaire | % | ≥ 25 | ≥ 25 | ≥ 25 |
| NA (/mm3) | ≥ 1 500 | ≥ 1 000 | ≥ 500 | ||
| II | Déficit modéré | % | 15-24 | 15-24 | 15-24 |
| NA (/mm3) | 750-1 499 | 500-999 | 200-499 | ||
| III | Déficit sévéré | % | < 15 | < 15 | < 15 |
| NA (/mm3) | < 750 | < 5 00 | < 200 | ||
D'après Centers tor Disease Control and prevention. 1994 revised classification system tor human immunodeficiency virus infection in children less than 13 years ot age. MMWR 1994 ; 43 RR-12 : 1-10.
Les normes sont probablement plus hautes pour l'entant âgé de 0 à 6 mois. Le nombre normal de lymphocytes CD4 à la naissance est de l'ordre de 3 000/mm3.
Marqueurs immunovirologiques prédictifs d'évolution chez l'enfant et difficultés d'interprétation
Comme chez l'adulte, l'évaluation pronostique repose sur la mesure du taux de lymphocytes CD4 circulants et de la charge virale.
Chez l'enfant, le taux de lymphocytes CD4 est généralement exprimé en pourcentage du nombre total de lymphocytes, à cause des variations physiologiques du nombre de lymphocytes avec l'âge (hyperlymphocytose progressivement décroissante de 0 à 6 ans). Les seuils de déficits immunitaires exprimés en pourcentage sont ainsi les mêmes quel que soit l'âge de l'enfant alors qu'ils varient de façon importante lorsqu'ils sont exprimés en nombre absolu (cf. tableau 18.27). Chez l'enfant de plus de 2-3 ans, la morbidité infectieuse opportuniste est directement dépendante, comme chez l'adulte, du degré de lymphopénie CD4. La relation est moins nette chez le nourrisson, surtout avant 1 an, car des infections opportunistes peuvent être observées malgré un pourcentage de lymphocytes CD4 supérieur à 15 %. Si la charge virale est un marqueur très prédictif de l'évolution de la maladie, son interprétation paraît plus difficile que chez l'adulte en particulier pour le nourrisson et le petit enfant avec un chevauchement important des charges virales entre les groupes de progresseurs et de non-progresseurs. Il apparaît en effet que les valeurs de charge virale sont globalement plus élevées que chez l'adulte, avec pourtant une morbidité et une mortalité proches. Si la valeur prédictive de la charge virale n'est nullement remise en cause, l'interprétation individuelle doit reposer sur plusieurs tests et sur un profil évolutif plutôt que sur une valeur.
Chez l'enfant non traité, une méta-analyse récente incluant les données de plusieurs cohortes et évaluant le risque de progression à un an en fonction du niveau de CD4 et de charge virale de l'enfant a mis en évidence que le risque de progression pour un même niveau de CD4 et de charge virale variait en fonction de l'âge de l'enfant (fig. 18.41 ). Ce risque de progression est particulièrement élevé chez le nourrisson quelles que soient les valeurs de CD4 et de charge virale.
Fig 18.41.

Probabilité de décès dans les 12 mois en fonction de l'âge et du pourcentage des CD4 chez les enfants sans traitement.
D'après Dunn et al. Short-term risk of disease progression in HIV-1-infected children receiving no antiretroviral therapy or zidovudine monotherapy : a meta-analysis. Lancet 2003 ; 362 : 1605-11.
Cas particulier du nourrisson
Le profil de l'infection à VIH chez le nourrisson est comparable à celui de la primo-infection de l'adulte. Dans 65 % des cas le virus est transmis pendant l'accouchement et dans 35 % des cas dans les semaines qui précèdent l'accouchement.
Ainsi le moment du diagnostic de l'infection est souvent proche du moment de la contamination. La réplication virale après infection du nouveau-né atteint en quelques semaines des valeurs parfois très élevées (> 107 copies d'ARN VIH/mL de plasma) avec une décroissance nettement plus lente que chez l'adulte en primo infection. Il n'y a pas d'explication claire à ces charges virales initialement très élevées. Un défaut de clairance du virus chez le petit nourrisson et/ou une augmentation des cellules cibles ont parfois été avancés. Les enfants atteints d'une forme précoce et sévère ont en moyenne des charges virales plus élevées dans les premières semaines et mois de vie mais la grande dispersion des valeurs rend l'analyse individuelle difficile. Une charge virale supérieure à 106 et un déclin dès les premières semaines des CD4 à moins de 25 % sont toutefois considérés empiriquement comme pouvant être associés à une évolution défavorable. Il existe par ailleurs des éléments prédictifs d'évolution vers une forme sévère d'infection à VIH : les résultats virologiques positifs à la naissance (isolement du virus et/ou quantification possible avant J7, signant une infection in utero), la présence de signes cliniques chez l'enfant dès la naissance (hépatosplénomégalie, adénopathie), des CD4 < 30 % ou une co-infection à CMV ont été démontrés comme pouvant être associés à une évolution rapidement défavorable. Certains facteurs maternels peuvent aussi être associés à une progression rapide chez le nourrisson. Le stade clinique sida chez la mère, une charge virale élevée des lymphocytes CD4 < 200/mm3 pendant la grossesse constituent des facteurs de risques de formes sévères du nourrisson.
Résultats des traitements antirétroviraux chez l'enfant
Outre les études de pharmacocinétique, les données disponibles en pédiatrie sont pour la plupart des analyses observationnelles non comparatives résumant l'expérience d'un centre, d'un réseau ou celle acquise autour d'une molécule ou d'une association. Les études contrôlées comparatives à large échelle sont rares, longues à mener, et leurs résultats parfois obsolètes au moment de leur publication. La plupart des questions sur les stratégies d'utilisation des antirétroviraux chez l'enfant restent donc extrapolées de l'expérience adulte. L'utilisation large des multithérapies antirétrovirales chez l'enfant a permis d'améliorer considérablement le pronostic de l'infection à VIH. Chez le nourrisson infecté par le VIH, des études rétrospectives et une étude rétrospective randomisée menée en Afrique du Sud mettent clairement en évidence l'intérêt d'un traitement précoce initié avant l'âge de 6 mois sur la survenue des événements sida voire de l'encéphalopathie à VIH.
La majorité des études réalisées chez l'enfant constate toutefois une proportion importante d'enfants en échec virologique malgré une amélioration clinique et immunitaire indiscutable.
Ces échecs virologiques semblent plus fréquents que chez l'adulte.
Les différentes études pédiatriques montrent que la tolérance des différentes molécules chez l'enfant est proche de ce qui est décrit chez l'adulte. La toxicité mitochondriale sévère avec acidose lactique a été observée chez l'enfant. Une attention particulière est portée au syndrome lipodystrophique chez l'enfant. Les différentes composantes du syndrome (lipoatrophie et/ou lipohypertrophie, hypertriglycéridémie, hypercholestérolémie, insulinorésistance) peuvent être observées chez l'enfant. Leur incidence respective ainsi que d'éventuelles spécificités pédiatriques sont en cours d'évaluation. L'impact à long terme sur le système cardiovasculaire reste lui aussi à déterminer.
Recommandations sur le traitement antirétroviral chez l'enfant
En fonction des données cliniques et immunovirologiques précédemment discutées, deux tranches d'âge ont été distinguées pour établir ces recommandations : les nourrissons de moins de 24 mois et les enfants de plus de 24 mois. L'ensemble de ces recommandations est synthétisé dans l'encadré 18.24 . En résumé général, le traitement antirétroviral est systématique avant l'âge de 2 ans et le plus souvent instauré chez l'enfant de plus de 2 ans avec un degré d'urgence variant en fonction de l'importance des symptômes et du déficit immunitaire.
Encadré 18.24.
Quand initier un traitement chez l'enfant ?
Traitement à initier sans délai
-
–
Enfant de moins de 2 ans, même asymptomatique quel que soit le niveau de CD4 et de charge virale.
-
–
Enfant symptomatique au stade B ou C.
-
–
Ou CD4 < 20 % de 2 à 5 ans.
-
–
Ou CD4 < 15 % après 5 ans.
Traitement indiqué mais ne relevant pas de l'urgence
-
–
Enfant peu symptomatique (CDC A).
-
–
Enfant asymptomatique et CD4 compris entre 20-25 % (2-5 ans) et 15-25 % (> 5 ans).
-
–
Ou charge virale > 100 000 copies/mL.
-
–
Préparation de l'enfant et de son entourage pour obtenir la meilleure « adhésion ».
Traitement à discuter (indications restreintes)
-
–
Enfant > 2 ans.
-
–
Totalement asymptomatique (hors adénopathies), croissance normale, pas d'infections répétées, activité physique normale (CDC N).
-
–
Et CD4 > 25 % et charge virale < 100 000 copies/mL.
-
–
Situation clinique et biologique à évaluer de façon rapprochée environ/3 mois.
D'après Yéni P et al. Prise en charge médicale des personnes infectées par le VIH (Prise en charge de l'enfant et de l'adolescent). Recommandations du groupe d'experts. La Documentation Française et le ministère de la Santé et des Sports, 2010.
Choix des molécules
Les principes généraux sont comparables à ceux de l'adulte, basés sur une multithérapie antirétrovirale comportant au moins 3 molécules avec pour objectif l'obtention d'une charge virale indétectable au seuil de 50 copies/mL. Le choix peut être cependant limité par l'inadéquation de certaines formes galéniques et/ou le manque de données de pharmacocinétiques pédiatriques et/ou de tolérance.
Le choix doit aussi tenir compte des facteurs de bonne adhésion à évaluer individuellement avec l'enfant et sa famille. En règle générale, la première prescription repose sur l'association classique de 2 inhibiteurs nucléosidiques de la transcriptase inverse (INTI) + un inhibiteur de la protéase (IP) ou de deux IN et d'un inhibiteur non nucléosidique de la transcriptase inverse (INNTI) (névirapine ou éfavirenz) ; cette dernière association étant plutôt une alternative nécessitant une observance prévisible parfaite (tableau 18.28 ). L'IP classiquement utilisé en pédiatrie en première ligne est le lopinavir/ritonavir (Kalétra), essentiellement pour sa galénique moins mal adaptée que les autres molécules. L'association habituelle d'INTI est AZT + 3TC ou 3TC + abacavir. Enfin le traitement devra être initié après un bilan exhaustif des co-infections et d'éventuelles atteintes viscérales liées au VIH. Concernant les co-infections, une recherche particulièrement attentive du CMV et des mycobactéries sera effectuée chez des enfants présentant un déficit immunitaire sévère afin de prévenir les réponses inflammatoires exacerbées observées lors de la reconstitution immunitaire.
Tableau 18.28.
Traitement antirétroviral de 1re ligne chez l'enfant.
| Deux inhibiteurs nucléosidiques | |
|---|---|
| Abacavir + lamivudine | Association privilégiée si l'enfant est capable d'ingérer la coformulation HLA-B*5701 avant prescription d'abacavir Éviter la lamivudine en cas de risque de mauvaise observance |
| Zidovudine + abacavir | |
| Zidovudine + lamivudine | |
| + un inhibiteur de protéase « boosté » par de petites doses de ritonavir (AIIa) | |
| Lopinavir/r | Quel que soit l'age |
| Fosampénavir/r | A partir de 6 ans |
L'association de 2 INTI et d'un INNTI peut être éventuellement proposée en alternative mais seulement en cas d'excellente observance prévisible.
D'après Yéni P et al. Prise en charge médicale des personnes infectées par le VIH (Prise en charge de l'enfant et de ladolescent). Recommandations du groupe d'experts. La Documentation Française et le ministère de la Santé et des Sports, 2010.
Déterminants de l'échec thérapeutique chez l'enfant
Comme le montrent quelques études observationnelles, un nombre important d'enfants sont cliniquement asymptomatiques, sans déficit immunitaire mais en « échec virologique » avec réplication virale persistante et souvent présence de mutations de résistances aux antirétroviraux. Chez l'enfant, une partie des échecs du traitement pourrait être expliquée par les spécificités pharmacologiques pédiatriques des antirétroviraux. Les difficultés d'observance constituent aussi en pédiatrie un des principaux déterminants de l'échec virologique. Même si l'observance est difficile à évaluer, quelques études mettent en évidence une corrélation entre la mauvaise observance et l'échec thérapeutique. L'inadaptation des formes galéniques à l'enfant, chez le nourrisson, les difficultés liées à l'adolescence sont par exemple des éléments responsables d'une mauvaise prise du traitement. Le pédiatre doit être à l'écoute de ces difficultés afin de les prévenir ou de proposer des alternatives thérapeutiques satisfaisantes.
Éléments de prise en charge en dehors du traitement antirétroviral
Du fait de l'amélioration de l'état clinique des enfants infectés par le VIH, l'essentiel de leur prise en charge se fait actuellement en consultation. Des hôpitaux de jour annuels peuvent être proposés au début de la prise en charge et en présence d'un déficit immunitaire à la recherche de co-infections et/ou d'atteintes viscérales liées au VIH.
Aux urgences pédiatriques, la prise en charge doit reposer sur l'importance du déficit immunitaire. Une fièvre chez un enfant présentant un déficit immunitaire sévère doit faire rechercher en premier lieu une bactériémie ou une septicémie en particulier à pneumocoque. L'hospitalisation est en règle nécessaire ainsi que l'initiation urgente d'une antibiothérapie probabiliste à large spectre (céphalosporine de 3e génération IV). D'autres infections doivent être recherchées en cas de fièvre persistante : infection à CMV, tuberculose, mycobactérie atypique, cryptococcose, toxoplasmose, pneumocystose essentiellement. Chez un enfant fébrile ne présentant pas de déficit immunitaire, un foyer infectieux banal devra être recherché avec soin. Les bactériémies à pneumocoque doivent être aussi redoutées. La prise en charge est le plus souvent ambulatoire chez l'enfant sans déficit immunitaire.
La prévention des infections opportunistes les plus fréquentes repose sur l'utilisation du triméthoprime-sulfométhoxazole. La prévention de la pneumocystose est systématique avant l'âge de 1 an et adaptée au chiffre de CD4 par la suite (si < 15 %). La posologie de 25 mg/kg de sulfométhoxazole 3 fois/semaine permet la prévention efficace de la pneumocystose et des infections bactériennes répétées. La toxoplasmose rare chez le petit enfant peut être prévenue par l'utilisation de cette molécule à la même posologie mais une fois/jour en cas de déficit immunitaire très sévère.
Les vaccinations chez l'enfant infecté par le VIH sans déficit immunitaire sont les mêmes que chez les autres enfants du même âge, excepté pour le BCG qui reste contre-indiqué. Chez l'enfant présentant un déficit immunitaire sévère, tous les vaccins vivants sont contre-indiqués. Dans tous les cas il faudra réaliser de façon impérative chez l'enfant infecté par le VIH le vaccin antipneumococcique conjugué.
Conclusion
L'utilisation large des multithérapies chez l'enfant a permis une amélioration considérable de l'évolution de la maladie en pédiatrie. Cependant de nombreuses questions restent posées : quel est le meilleur moment pour débuter un traitement ? À quel moment changer le traitement en cas d'échec ? Quelle est la place des stratégies d'interruption thérapeutique en pédiatrie et celle de l'immunothérapie ? La meilleure connaissance de la pharmacologie des antirétroviraux chez l'enfant et l'amélioration des formulations galéniques en pédiatrie sont des enjeux majeurs qui devraient permettre d'optimiser les traitements et de diminuer la fréquence des échecs virologiques en pédiatrie.
BIBLIOGRAPHIE
- Blanche S., Mayaux M.J., Rouzioux C. Relation of the course of HIV infection in children to the severity of the disease in their mothers at delivery. N Engl J Med. 1994;330:308. doi: 10.1056/NEJM199402033300502. 12. [DOI] [PubMed] [Google Scholar]
- Blanche S., Newell M.L., Mayaux M.J. Morbidity and mortality in European children vertically infected by HIV-1. AIDS. 1997;14:442. doi: 10.1097/00042560-199704150-00008. 50. [DOI] [PubMed] [Google Scholar]
- Connor E.M., Sperling R.S., Gelber R. Reduction of maternal-infant transmission of human immunodeficiency virus type 1 with zidovudine treatment. Pediatric AIDS Clinical Trials Group Protocol 076 Study Group. N Engl J Med. 1994;331:1173. doi: 10.1056/NEJM199411033311801. 80. [DOI] [PubMed] [Google Scholar]
- De Martino M., Tovo P.A., Balducci M. Reduction in mortality with availability of antiretroviral therapy for children with perinatal HIV-1 infection. Italian Register for HIV Infection in Children and the Italian National AIDS Registry. JAMA. 2000;284:190. doi: 10.1001/jama.284.2.190. 7. [DOI] [PubMed] [Google Scholar]
- Dunn D., Simmonds R.J., Bultery M. Interventions to prevent vertical transmission of HIV-1: effect on viral detection rate in early infant samples. AIDS. 2000;14:1421. doi: 10.1097/00002030-200007070-00016. 8. [DOI] [PubMed] [Google Scholar]
- Dunn D.T., Brandt C.D., Krinvine A. The sensitivity of HIV-1 DNA polymerase chain reaction in the neonatal period and the relative contribution of intra-uterine and intra-partum transmission. AIDS. 1995;9:F7–11. doi: 10.1097/00002030-199509000-00001. [DOI] [PubMed] [Google Scholar]
- Duval M., Faye A., Rohrlich P. Failure of pediatric AIDS prevention despite maternal HIV screening in Paris, France. J Acquir Immune Defic Syndr Hum Retrovirol. 1999;20:100. doi: 10.1097/00042560-199901010-00019. 1. [DOI] [PubMed] [Google Scholar]
- Faye A., Bertone C., Teglas J.P. Early multitherapy including a protease inhibitor for HIV infected infants. Pediatr Infect Dis J. 2002;21:518. doi: 10.1097/00006454-200206000-00008. 25. [DOI] [PubMed] [Google Scholar]
- Faye A., Le Chenadec J., Dollfus C. for the French Perinatal Study. Early versus deferred antiretroviral multitherapy in Human Immunodeficiency Virus Type-1 infected infants. Clin Infect Dis. 2004;39:1692. doi: 10.1086/425739. 8. [DOI] [PubMed] [Google Scholar]
- Gortmaker S.L., Hughes M., Cervia J. Effect of combination therapy including protease inhibitors on mortality among children and adolescents infected with HIV-1. N Engl J Med. 2001;345:1522. doi: 10.1056/NEJMoa011157. 8. [DOI] [PubMed] [Google Scholar]
- Kovacs A., Schlüter M., Easley K. Cytomeglovirus infection and HIV-1 disease progression in infants born to HIV-1 infected women. Pediatric pulmonary and cardiovascular Complications of Vertically transmitted HIV infection study group. N Engl J Med. 1999;341:77–84. doi: 10.1056/NEJM199907083410203. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Luzuriaga K., Wu H., Mcmanus M. Dynamics of human immunodeficiency virus type 1 replication in vertically infected infants. J Virol. 1999;73(1):362. doi: 10.1128/jvi.73.1.362-367.1999. 7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Mandelbrot L., Landreau-Mascaro A., Rekacewicz C. Lamivudinezidovudine combination for prevention of maternal-infant transmission of HIV-1. JAMA. 2001;285:2083. doi: 10.1001/jama.285.16.2083. 93. [DOI] [PubMed] [Google Scholar]
- Mandelbrot L., Le Chenadec J., Berrebi A. Perinatal HIV-1 transmission : interaction between zidovudine prophylaxis and mode of delivery in the French Perinatal Cohort. JAMA. 1998;280:55–60. doi: 10.1001/jama.280.1.55. [DOI] [PubMed] [Google Scholar]
- Mayaux M.J., Burgard M., Teglas J.P. Neonatal characteristics in rapidly progressive perinatally acquired HIV-1 disease. JAMA. 1996;275:606. 10. [PubMed] [Google Scholar]
- Mofenson L., Korelitz J., Meyer W.A. The relationship between serum HIV-1 RNA level, CD4 lymphocyte percent and long term mortality risks in HIV-1 infected children. J Infect Dis. 1997;175:1029. doi: 10.1086/516441. 38. [DOI] [PubMed] [Google Scholar]
- Onusida . 2003. Rapport décembre.www.unaids.org [Google Scholar]
- Palumbo P.E., Raskino C., Fiscus S. Disease progression in HIV-infected infants and children : predictive value of quantitative plasma HIV RNA and CD4 lymphocyte count. JAMA. 1998;279:756. doi: 10.1001/jama.279.10.756. 61. [DOI] [PubMed] [Google Scholar]
- Rich K.C., Fowler M.G., Mofenson L.M. Maternal and infant factors predicting disease progression in human immunodeficiency virus type 1-infected infants. Women and Infants Transmission Study Group. Pediatrics. 2000;105:e8. doi: 10.1542/peds.105.1.e8. [DOI] [PubMed] [Google Scholar]
- Rouet F., Montcho C., Rouzioux C. Early Diagnosis of paediatric HIV-1 infection among African breast-fed children using a quantitative plasma HIV RNA assay. AIDS. 2001;15:1849. doi: 10.1097/00002030-200109280-00015. 56. [DOI] [PubMed] [Google Scholar]
- Rouzioux C., Costagliola D., Burgard M. Estimated timing of motherto-child human immunodeficiency virus type 1 (HIV-1) transmission by use of a Markov model. The HIV Infection in Newborns French Collaborative Study Group. Am J Epidemiol. 1995;142(12):1330. doi: 10.1093/oxfordjournals.aje.a117601. 7. [DOI] [PubMed] [Google Scholar]
- Shearer W.t., Quinn T.C., Larussa P. Viral load and disease progression in infants infected with human immunodeficiency virus type 1. N Engl J Med. 1997;336:1337. doi: 10.1056/NEJM199705083361901. 42. [DOI] [PubMed] [Google Scholar]
- Steketee R.W., Abrams E.J., Thea D.M. Early detection of perinatal human immunodeficiency virus type 1 infection using HIV RNA amplification and detection. J Infect Dis. 1997;175:707. doi: 10.1093/infdis/175.3.707. 11. [DOI] [PubMed] [Google Scholar]
- Teglas J.P., Mayaux M.J., Blanche S. Antiretroviral therapy and mortality among children with perinatal HIV infection. JAMA. 2000;284:2871. doi: 10.1001/jama.284.22.2871. 2. [DOI] [PubMed] [Google Scholar]
- The Italian register for HIV Infection in Children Rapid disease progression in HIV-1 perinatally infected children born to mothers receiving zidovudine monotherapy during pregnancy. AIDS. 1999;13:927. 33. [PubMed] [Google Scholar]
- Violari A., Cotton M.F., Gibb D.M. Early antiretroviral therapy and mortality among HIV-infected infants. N Engl J Med. 2008;359:2233. doi: 10.1056/NEJMoa0800971. 44. [DOI] [PMC free article] [PubMed] [Google Scholar]
Diagnostic d'un déficit immunitaire héréditaire
C. Picard
Si les infections virales ou les surinfections bactériennes répétées de la sphère ORL chez le jeune enfant sont un motif fréquent de consultation pédiatrique, les déficits héréditaires de l'immunité sont des affections rares. Il est cependant important d'en faire précocement le diagnostic car une prise en charge adaptée et précoce permet un bien meilleur pronostic. La plupart des déficits acquis sont actuellement liés à l'infection à VIH qui sera à rechercher chez la mère et l'enfant.
Signes d'alerte devant faire évoquer un déficit immunitaire héréditaire
Ce sont (tableau 18.29 ) :
-
•
la présence d'antécédents familiaux de déficit immunitaire ou de signes cliniques similaires : un arbre généalogique est à réaliser lors de la consultation et une consanguinité doit être recherchée, ainsi que des décès pour des causes infectieuses dans la famille. La majorité des déficits immunitaires héréditaires ont une transmission autosomique récessive, certains sont liés au chromosome X et ne touchent que les garçons et d'autres plus rares ont une transmission autosomique dominante ;
-
•
la présence d'infections récurrentes des voies respiratoires hautes et basses avec une fréquence de plus de 8 otites/an pendant l'automne et l'hiver chez enfants de moins de 4 ans, plus de 4 otites/an (pendant l'automne et l'hiver) chez les enfants de plus de 4 ans, plus de 2 pneumonies par an et/ou plus de 2 sinusites/an. Les fréquences données ici le sont à titre indicatif, il faudra les pondérer en fonction du mode de garde de l'enfant ; en effet un enfant qui est gardé en crèche aura tendance à développer plus d'infections ORL qu'un enfant gardé seul au domicile ;
-
•
toutes infections bactériennes sévères et/ou récurrentes (ex. méningite, sepsis, ostéomyélite, péritonite, abcès profonds, etc. : un seul épisode de méningite ou de sepsis causé par une bactérie encapsulée (pneumocoque, Haemophilus influenzae type b, Neisseria meningitidis) se doit d'être exploré ;
-
•
des infections inhabituelles et/ou d'évolution inhabituelle (ex. infection par un germe opportuniste, diarrhée infectieuse persistante, muguet ou candidose cutanéomuqueuse récidivante, BCGite, infection virale respiratoire chronique, etc.) ;
-
•
une cassure de la courbe staturo-pondérale et/ou une diarrhée persistante ;
-
•
la présence d'autres manifestations cliniques non infectieuses : un eczéma, une auto-immunité (ex. cytopénie auto-immune), une inflammation chronique ou une lymphoprolifération (adénopathies et hépatosplénomégalie).
Tableau 18.29.
Symptomatologie des déficits immunitaires héréditaires prédominants.
| Déficit | Infections bactériennes sévères | Infections virales | Infections opportunistes (pneumocystose, etc.) | Infections fongiques | Infections voies respiratoires | Dilatation des bronches | Diarrhée | Autoimmunité |
|---|---|---|---|---|---|---|---|---|
| Déficit immunitaire combiné | ++ | +++ | +++ | +++ | +++ | ++ | +++ | + |
| Déficit immunitaire humoral | +++ | +/- | - | - | +++ | +++ | + | + |
| Déficit immunitaire phagocytaire | +++ | - | - | +++ | + | - | + | 0 |
| Déficit du complément | +++ | - | - | - | ++ | - | - | +++ |
Les infections urinaires et les infections virales répétées sans gravité n'évoquent généralement pas un déficit immunitaire héréditaire. Les infections de la sphère ORL ou des voies respiratoires, même répétées, mais de courte durée, ne témoignent pas d'un déficit immunitaire chez le nourrisson.
Leurs facteurs favorisants sont actuellement mieux connus :
-
•
contage répété (crèches, écoles) ;
-
•
atopie ou pollution atmosphérique (tabagisme) ;
-
•
reflux gastro-œsophagien ;
-
•
carence en fer.
Examens pour diagnostiquer un déficit immunitaire héréditaire
Les examens à réaliser en première intention sont des examens simples qui vont permettre d'orienter le diagnostic. Ces premiers examens à réaliser sont une NFS plaquettaire, un dosage pondéral des immunoglobulines et des sérologies post-vaccinales et/ou post-infectieuses et une évaluation de la voie classique du complément (CH50) (tableau 18.30 ).
Tableau 18.30.
Concentration sérique des IgG, A et M étudiées par néphélimétrie chez les enfants normaux.
| Âge | IgG (g/L) | IgA (g/L) | IgM (g/L) |
|---|---|---|---|
| Nouveau-né | 6, 15-13,03 | 0,07-0,22 | 0,04-0,65 |
| 1 mois | 4,62-8,58 | 0,10-0,30 | 0,25-0,71 |
| 3 mois | 2,95-5,49 | 0,12-0,38 | 0,30-0,85 |
| 6 mois | 2,35-4,37 | 0,20-0,62 | 0,34-0,95 |
| 12 mois | 3,35-6,23 | 0,27-0,86 | 0,48-1,36 |
| 3 ans | 4,82-8,96 | 0,33-1,22 | 0,50-1,53 |
| 5 ans | 5,49-10,19 | 0,41-1,41 | 0,54-1,53 |
| 9 ans | 5,82-11,54 | 0,46-1,57 | 0,54-1,55 |
| 15 ans | 6,55-12,29 | 0,50-2,03 | 0,53-1,62 |
| Adulte | 6,55-12,78 | 0,70-3,44 | 0,50-2,09 |
Numération de la formule sanguine
Elle recherche une neutropénie et/ou une lymphopénie (à interpréter avec les normes en fonction de l'âge de l'enfant). Des lymphocytes inférieurs à 2 500/mm3 au cours de la 1re année de vie doivent faire évoquer un déficit immunitaire combiné sévère. Un nombre normal de lymphocytes n'élimine cependant pas ce déficit immunitaire. L'analyse du frottis sanguin permet de rechercher des corps de Jolly lorsqu'une asplénie est suspectée.
Dosage pondéral des immunoglobulines (G, A, M)
Il permet d'apprécier la production globale d'anticorps sans tenir compte de leur spécificité. Ces dosages d'Ig doivent être interprétés en fonction de l'âge (cf. tableau 18.30 ; interprétation difficile du taux d'IgG, au cours des premiers mois de vie, car présence des IgG maternelles). En cas d'anomalies des explorations de première intention, un dosage des sousclasses des IgG (1, 2, 3 et 4) sera proposé aux enfants de plus de 20 mois, cet examen étant difficilement interprétable avant cet âge.
Étude des sérologies post-vaccinales et post-infection
Elle permet d'apprécier la capacité de production d'anticorps spécifiques qui peuvent être de deux types, soit de type antiprotidique, soit de type antipolysaccharide. Les anticorps de type anti-protidique font appel à une coopération entre les lymphocytes T et B. Ils sont produits au décours d'une infection ou après une vaccination avec un vaccin conjugué (ex. vaccin antidiphtérique). Les anticorps de type antipolysaccharide font eux appel à une réponse lymphocytaire B seule, ils sont produits après une infection par une bactérie encapsulée (ex. pneumocoque) ou bien après une vaccination par les vaccins non conjugués antipneumocoque ou antiméningocoque. Les allohémagglutinines de groupe sanguin sont également des anticorps de type antipolysaccharide, ce sont des IgM naturelles dirigées contre les antigènes des groupes sanguins A et/ou B. L'enfant de moins de 2 ans présente de manière physiologique un défaut de production de ces anticorps anti-polysaccharidiques, la production de ces anticorps n'est donc pas évaluable avant l'âge de 2 ans. L'ensemble des sérologies doit être interprété avec prudence pendant les 6 premiers mois de vie, période pendant laquelle il peut exister des sérologies faussement positives dues à la persistance d'IgG maternelles chez l'enfant.
Examens complémentaires utiles (tableau 18.31)
Tableau 18.31.
conduite du diagnostic devant une suspicion de déficit immunitaire héréditaire (DIH).
| Motif de consultation | Première consultation | Deuxième consultation avec résultat Bilan n° 1 | Bilan n° 2 |
|---|---|---|---|
symptomatologie évocatrice de DIH :
|
|
|
|
|
|
NK : natural killer ; NBT : nitroblue tetrazolium ; DHR : dihydrorhodamine.
-
•
La voie classique du complément est explorée par le dosage du CH50. Un défaut d'un des composés du Cl au C9 entraîne une baisse du CH50 et le diagnostic sera confirmé par le dosage spécifique des divers composants.
-
•
La normalité de tels examens élimine la grande majorité des déficits immunitaires sévères de l'immunité cellulaire, humorale ou du complément.
Examens biologiques de deuxième intention
Dans la grande majorité des cas, l'ensemble des éléments apportés par les examens simples conjointement à ceux apportés par l'anamnèse et l'examen clinique permet de cibler les examens à demander en deuxième intention.
-
•
Lorsqu'un déficit de l'immunité cellulaire est évoqué, il faut réaliser un phénotypage lymphocytaire. C'est un examen quantitatif qui permet également d'apprécier la répartition des différentes populations lymphocytaires : lymphocytes T et les deux sous-populations lymphocytaires T (les cellules auxiliaires [CD4] et cytotoxiques [CD8]), les lymphocytes B et les lymphocytes NK. Cet examen pourra être complété dans un 2e temps par des tests fonctionnels lymphocytaires T. L'étude des proliférations lymphocytaires T en présence de mitogènes et d'antigènes en choisissant les antigènes que l'enfant a rencontrés au cours d'infections (ex. Candida, CMV) ou des vaccins (ex. tétanos, tuberculine). Les TTL permettent d'apprécier la fonction lymphocytaire.
-
•
Lorsqu'un déficit de l'immunité phagocytaire est évoqué, devant des infections bactériennes et/ou fongiques tissulaires, il est nécessaire de prescrire une étude des fonctions phagocytaires, comme le NBT test ou l'étude par DHR qui apprécient la production d'H2O2 par les polynucléaires neutrophiles. Cet examen permet de diagnostiquer la granulomatose septique chronique. Une étude du chimiotactisme des polynucléaires neutrophiles sera à réaliser en cas de leucocytose importante pour écarter un déficit de l'adhésion leucocytaire.
-
•
Une étude des facteurs de la voie alterne du complément sera proposée en cas d'infections bactériennes récurrentes (ex. déficit en facteur I).
-
•
En cas d'absence d'anomalie biologique, il ne faut pas hésiter à se mettre en contact avec un immuno-pédiatre pour orienter l'exploration du patient en fonction des signes cliniques et biologiques vers des explorations spécifiques du déficit immunitaire suspecté.
Autres examens
Devant une complication infectieuse comme :
-
•
une pneumonie interstitielle chez l'enfant atteint ou suspect de déficit immunitaire, il est indispensable de rechercher par lavage bronchoalvéolaire (LBA) les micro-organismes suivants : CMV, adénovirus, VRS, Pneumocystis jirovici, mycobactéries et, plus rarement, en fonction du contexte, le toxoplasme ou les champignons.
-
•
De plus, une radiographie pulmonaire prescrite devant des difficultés respiratoires peut permettre d'identifier l'absence de l'ombre thymique ou la présence de foyers interstitiels, évocateurs d'un déficit immunitaire combiné ;
-
•
des troubles digestifs chroniques ou récidivants, il faut rechercher les micro-organismes suivants : Salmonella, Cryptosporidium, giardiase, CMV, adénovirus, etc.
Principes thérapeutiques
Ils sont résumés dans le tableau 18.32 ; la plupart sont institués uniquement en milieu spécialisé.
Tableau 18.32.
Principales thérapeutiques des déficits immunitaires héréditaires.
| Déficit | Immunoglobulines polyvalentes | Antibiotiques prophylactiques | Antifongiques prophylactiques | Vaccination vis-à-vis bactéries encapsulées | Autres |
|---|---|---|---|---|---|
| Déficit immunitaire combiné sévère (absence de lymphocytes T] |
+++ | +++ Cotrimoxazole* 25 mg/kg × 3 / semaine |
± | - | Isolement Transplantation de cellules souches hémopoïétiques |
| Déficit immunitaire combiné (lymphopénie T et/ou déficit fonctionnel T] | +++ | +++ Cotrimoxazole* 25 mg/kg × 3 / semaine |
± | - | Selon les déficits, une transplantation de cellules souches hémopoïétiques pourra être proposée |
| Déficit en CD40 ligand | +++ | +++ Cotrimoxazole* 25 mg/kg × 3 / semaine |
- | + | Kinésithérapie Cure d'antibiothérapie en cas de surintection |
| Agammaglobulinémie (absence de lymphocytes B] | +++ | ± Antibiothérapie prophylactique | - | - | Kinésithérapie Cure d'antibiothérapie en cas de surintection |
| Hypogammaglobulinémie | +*** | + Cotrimoxazole 20 à 25 mg/kg/j** |
- | ++ | Kinésithérapie |
| Granulomatose septique chronique |
- | +++ Cotrimoxazole 25 mg/kg/j** |
+++ Iraconazol (prophylaxie primaire) |
+ | Cure d'antibiothérapie ou d'antifongiques parentéraux en cas d'infection Selon la gravité des infections, une transplantation de cellules souches hémopoïétiques pourra être proposée |
| Déficit du complément | - | + Pénicilline V ou cotrimoxazole |
- | +++ | Kinésithérapie |
La posologie du cotrimoxazol est une posologie anti-pneumocystis pour ces déficits immunitaires.
La posologie du cotrimoxazol est une posologie anti-bactérienne pour ces déficits immunitaires.
Seuls les patients hypogammaglobulinémiques encore symptomatiques, malgré une antibiothérapie bien conduite (en général par cotrimoxazole 20 à 25 mg/kg/jour), recevront un traitement substitutif par immunoglobulines polyvalentes.
Prévention
Éviction des maladies infectieuses
R. Cohen
Les conduites à tenir en cas de risques de maladies transmissibles dans une collectivité d'enfants sont proposées dans le tableau 18.33 .
Tableau 18.33.
Conduites à tenir en cas de risques de maladies transmissibles dans une collectivité d'enfants.
| Pathologies | Contamination | Incubation | Durée de contagiosité | Éviction |
|---|---|---|---|---|
Angines :
Scarlatine |
D : OP D : OP |
1 à 7 jours 1 à 4 jours |
Variable 48 h > début antibiothérapie efficace |
Non Oui > 2 jours début antibiothérapie efficace |
| Bronchite | D aérienne | 2-8 jours | Variable selon virus | Non1 |
| Bronchiolite | D aérienne | 1-7 jours selon virus | 3-8 jours (≥ 3 à 4 semaines! | Non1 |
| Conjonctivite | D | Variable | Variable | Non |
| Coqueluche | D aérienne | 5 jours 3 semaines, moyenne 7 jours | 5 J après début antibiothérapie efficace | Oui, > 5 jours après début antibiothérapie efficace |
| Gale commune | D (peau) | 3 semaines > 1er contact Quelques jours si contact antérieur | Courte | Oui, 3 jours après traitement |
Gastro-entérite :
|
Selles, surfaces contaminées D : selles I : surfaces I : surfaces I : aliments contaminés I : aliments contaminés I : volailles, œufs, eaux D : fécale, orale I : aliments contaminés |
Variable 24 à 72 h selon virus 2 à 4 jours 2 à 4 jours 12 à 36 h 2 à 4 jours |
Variable Durée de la diarrhée Durée de la diarrhée Tant qu'agent pathogène dans les selles Durée de la diarrhée Tant qu'agent pathogène dans les selles |
Non1 Non1 Non1 Oui 2 copro (−) à 24 h d'intervalle Non1 Oui, 2 copro (−) à 24 h d'intervalle (> 48 h après l'arrêt du traitement) |
| Grippe virus influenzae b | D : respiratoire | 1 à 3 jours | 5 à 7 jours > signes cliniques | Non1 |
Herpes simplex :
|
D : sécrétions orales D : lésions cutanées |
5 à 7 jours après contact infectieux | Prudence +++ Eczéma atopique de l'enfant (Kaposi-Julinsberg) Immunodéprimés |
Non1 Non1 |
Impétigo :
|
D : lésions cutanées | 1 à 10 jours | 48 h après début antibiothérapie | Non si lésions peu nombreuses protégées Oui 48 h après début antibioth. si lésions nombreuses ou non protégées |
| Pieds-mains-bouche Coxaskies virus A |
D : sécrétions nasales, oropharyngees |
3 à 5 jours | 1-4 semaines oropharynx 1-18 semaines dans les selles |
Non |
| Varicelle Virus VZV |
D : aérienne | 12 à 21 jours | 2 à 4 jours < éruption → croûtes (moyenne 5 à 7 J après éruption) |
Non2 |
| CMV | D : sécrétions : salive, nasales, génitales Lait maternel |
2 à 4 semaines | Plusieurs semaines-mois | Non3 |
| Rougeole | Voie aérienne Microaérosols persistant plusieurs heures dans l'atmosphère |
8 à 12 jours | 2 à 4 jours avant l'éruption et jusqu'à 5 jours après le début de l'éruption | Oui 5 jours après le debut de l'éruption |
D : direct ; I : indirect ; OP : oropharyngé.
Souhaitée en phase symptomatique aiguë.
Non souhaitée en phase aiguë recommandations autour d'un cas.
Mesures préventives à connaître : informations du personnel, lavage des mains (solutés hydroalcooliques après tout contact avec liquides + sécrétions).
Vaccinations de l'enfant
E. Grimprel
Bases immunologiques
Les vaccins à usage humain sont des préparations contenant des substances antigéniques destinées à induire chez le sujet auquel elles sont administrées une immunité active spécifique contre un agent infectieux donné : bactérien, viral ou parasitaire. Les préparations vaccinales ont des compositions variables selon le type de vaccin. Il peut s'agir de préparations contenant :
-
•
l'agent infectieux entier, virus ou bactérie dont la virulence est réduite après mutation (vaccins vivants ou atténués) ;
-
•
l'agent infectieux entier, virus ou bactérie, inapte à la multiplication du fait d'un traitement physique ou chimique préalable (vaccins inactivés ou tués) ;
-
•
des antigènes spécifiques de l'agent infectieux après extraction et modification ou fabrication de novo (vaccins sous-unités).
Réponse immune
La réponse immune anti-infectieuse a pour effet d'éviter ou d'atténuer la maladie naturelle ou ses conséquences délétères lors d'un contact ultérieur avec l'agent infectieux. Elle ressemble à celle induite par l'agent infectieux lui-même et met en jeu par étapes successives l'immunité cellulaire et humorale. L'antigène vaccinal est d'abord capté par les cellules présentatrices d'antigène (macrophages, cellules dendritiques) qui les dégradent en peptides qui vont se lier spécifiquement aux antigènes (de classes I et II) du complexe majeur d'histocompatibilité (CMH-1 et 2) et activer ensuite les lymphocytes (CD4 + et CD8 +). Le premier contact avec l'antigène produit une réponse anticorps dite primaire qui met en jeu la synthèse rapide des IgM puis, par commutation isotypique, la synthèse plus lente des IgG et IgA et la production de cellules B mémoires. Tout contact ultérieur générera, par la mise en jeu des cellules mémoires, une réponse dite secondaire, plus rapide, plus intense et spécifique, faite d'emblée d'IgG et IgA. Le rôle des anticorps vaccinaux est de reconnaître et de s'assembler aux épitopes de l'agent infectieux pour le neutraliser au terme d'une lyse cellulaire. La réponse cellulaire fait intervenir les cellules T CD4 + et CD8 + dans leurs actions spécifiques, cytotoxicité cellulaire, activation des cytokines (interféron gamma, en particulier), mais également dans le cadre d'une coopération entre ces mêmes cellules (activations réciproques) qui contribue à renforcer la réponse immunitaire.
Pour augmenter l'immunogénicité des vaccins, des substances dites adjuvantes sont incorporées (hydroxyde ou phosphate d'aluminium). Les conservateurs (comme le thiomersal) sont utilisés pour maintenir la stabilité des produits mais sont dénués d'effets sur l'immunogénicité.
Nature de l'immunité
La nature de l'immunité active spécifique induite par la fraction vaccinale varie en fonction du type de vaccin utilisé :
-
•
les vaccins atténués ou vivants réalisent une infection a minima avec multiplication initiale chez le sujet vacciné et induisent une immunité de même nature que celle conférée par la maladie naturelle. Elle est donc le plus souvent mixte, à la fois humorale et cellulaire, sauf pour le BCG où elle exclusivement cellulaire. Elle peut être également locale lorsque l'inoculation vaccinale se fait au niveau d'une muqueuse (IgA digestives avec le vaccin polio oral) ;
-
•
les vaccins inactivés ainsi que les sous-unités induisent classiquement une réponse essentiellement humorale. En fait, on connaît maintenant l'existence d'une réponse cellulaire puissante pour les vaccins anti-Haemophilus, de l'hépatite B et de la coqueluche. L'immunité cellulaire engendrée par le vaccin de l'hépatite B est en outre très prolongé, au moins 10 ans, ce qui a permis d'alléger (1998) le calendrier vaccinal français ;
-
•
les antigènes protéiques sont thymodépendants (type anatoxine) et donnent lieu à une réponse primaire faible (IgM), puis secondaire (IgG) qui se renforcera après les inoculations ultérieures (effet rappel). L'association à des adjuvants chimiques (hydroxyde ou phosphate d'aluminium) stimule la réponse immunitaire en retardant la destruction de l'antigène et en majorant sa dispersion vers les cellules immunocompétentes ;
-
•
les antigènes polysaccharidiques sont thymodépendants et donnent lieu à une réponse faible, lente, uniquement primaire et sans effet rappel. La combinaison avec des antigènes protéiques thymodépendants augmente leur immunogénicité dans la réponse primaire et leur confère un effet mémoire au moment du rappel qui amplifie de façon durable la réponse initiale (ex. vaccins Haemophilus et pneumocoque conjugués).
Protection vaccinale
Pour certains vaccins comme les vaccins viraux atténués, une ou deux injections suffisent pour conférer une protection optimale et durable (ex. deux doses pour les vaccins RougeoleOreillons-Rubéole ; une seule vaccination pour le BCG). Pour les autres vaccins, inactivés ou sous-unités, plusieurs injections successives et espacées d'au moins un mois sont nécessaires pour amplifier la réponse immune initiale : c'est la primovaccination. L'immunité vaccinale ainsi obtenue n'est cependant pas définitive et nécessite la pratique régulière d'injections supplémentaires appelées rappels (ex. diphtérie, tétanos, polio). Le maintien de l'immunité vaccinale peut également être garanti par les contacts itératifs avec l'agent infectieux qui continue de circuler, réalisant autant de rappels dits naturels (ex. Haemophilus influenzae b pour lequel les rappels tardifs ne sont pas nécessaires au-delà du rappel de 16-18 mois). Cependant, en cas de réduction importante de la circulation de l'agent infectieux, les rappels naturels deviennent aléatoires et l'immunité baisse avec le temps rendant nécessaire la pratique de rappels vaccinaux tardifs (ex. coqueluche).
La protection conférée par un vaccin s'apprécie de deux façons différentes : le dosage des anticorps post-vaccinaux (anticorps neutralisants) et la mesure du taux de protection (efficacité) au cours d'études cliniques prospectives et comparatives avec un placebo ou d'autres vaccins. La durée de protection varie en fonction des types de vaccins utilisés :
-
•
les vaccins vivants atténués confèrent une protection durable après une seule infection : 10 ans pour la fièvre jaune, toute la vie en théorie pour le vaccin Rougeole-OreillonsRubéole, grâce aux effets rappels dus aux contacts avec les virus naturels (ces effets rappels disparaissant lorsque la maladie est complètement éradiquée, des rappels vaccinaux deviennent alors nécessaires)
-
•
les vaccins tués inactivés, ainsi que les vaccins sous-unités, nécessitent généralement plusieurs injections, suivies de rappels pour développer une immunité efficace et durable. L'efficacité vaccinale dépend également de l'âge auquel le sujet est vacciné :
-
•
avant 2 ans, la réponse immune aux antigènes thymoindépendants comme les antigènes polysaccharidiques (antigènes capsulaires des pneumocoques, Haemophilus influenzae b et méningocoques) est immature et donc inefficace. Pour obtenir une réponse immune et donc une protection, il est nécessaire de coupler ce type d'antigène avec un antigène protéique thymodépendant (ex. le polysaccharide capsulaire PRP d'Haemophilus influenzae b est couplé avec une anatoxine tétanique). Chez le sujet âgé, la réponse immune décroît progressivement et nécessite d'être renforcée par des rappels (ex. tétanos) ;
-
•
la réponse immune du nourrisson varie également selon la présence d'anticorps maternels. Lorsque la mère est immune de façon naturelle ou après vaccination vis-à-vis d'une maladie, la transmission in utero d'anticorps maternels confère au nourrisson une protection de durée variable selon la maladie en question. Les anticorps materno-transmis ont un effet protecteur vis-à-vis de la maladie et du vaccin, entraînant un échec vaccinal lorsqu'ils sont présents à un taux élevé dans le sérum. Cette protection est en fait très variable, fonction de l'agent pathogène : nulle pour la coqueluche, elle est limitée à 2 mois pour le tétanos et la diphtérie. Les anticorps rougeoleux maternels protègent le nourrisson pendant 9 à 12 mois. Pendant cette période, ces anticorps peuvent rendre inefficace la vaccination par inactivation du virus vaccinal. Un phénomène identique est observé quel que soit l'âge avec les anticorps transmis par injection IV ou IM de gammaglobulines.
La protection induite par la vaccination peut être :
-
•
directe et individuelle : elle repose sur l'immunité postvaccinale ;
-
•
indirecte et collective : elle repose sur la réduction de la transmission interhumaine au sein d'une collectivité par une immunité dite « de troupeau ».
Selon les maladies considérées, l'objectif de la vaccination peut être :
-
•
l'élimination de la maladie (absence de cas dans une région géographique définie pendant une période suffisamment longue sous l'effet des mesures de prévention), voire son éradication (disparition définitive de l'agent infectieux au niveau mondial permettant l'arrêt des mesures de prévention). Ces objectifs sont envisageables pour certaines maladies infectieuses virales comme la variole, la rougeole et la poliomyélite dont la transmission est strictement interhumaine et pour lesquelles la vaccination avec un taux élevé de couverture permet, sans nécessiter de rappels, l'arrêt de la circulation de l'agent infectieux ;
-
•
le contrôle de l'infection dans une population donnée, particulièrement à risque. C'est le cas des maladies infectieuses bactériennes comme la diphtérie et le tétanos qui nécessitent des rappels itératifs pour maintenir une immunité durable. La protection individuelle est ici essentielle pour réduire le nombre de cas. Lorsque la transmission interhumaine de l'agent infectieux est importante, comme pour la coqueluche, les rappels tardifs chez l'adolescent et l'adulte permettent d'installer une immunité collective de troupeau : ils réduisent la circulation du germe et protègent les jeunes nourrissons les plus fragiles d'une contamination de leur entourage (stratégie du « cocooning »).
Modalités pratiques des vaccinations chez l'enfant
Règles de vaccination
La vaccination est un acte médical à part entière qui engage la responsabilité du médecin. Cet acte doit obéir aux règles suivantes :
-
•
toute vaccination doit être consignée sur le carnet de santé de l'enfant ou de l'adulte. Les pages « vaccinations » du carnet de santé tiennent lieu de certificat. À défaut, un certificat sera délivré ;
-
•
doivent figurer sur ces documents : le cachet du médecin, la date, la marque du vaccin et le numéro du lot de fabrication ;
-
•
les mêmes renseignements doivent rester en possession du médecin (fichier) ou du centre de vaccination (registre) ;
-
•
la vaccination implique également le patient et doit, comme tout acte médical, être expliquée et comprise de la personne ou de ses parents ou tuteurs légaux. La consultation médicale qui précède la vaccination doit comporter un entretien qui précisera les bénéfices attendus tant individuels que collectifs ainsi que la possibilité de survenue d'effets secondaires et les mesures à prendre pour les atténuer.
Voies d'administration
Elles varient selon le type de vaccin
-
•
intradermique stricte (ex. BCG) ;
-
•
sous-cutanée profonde au niveau de la fosse sus-épineuse ;
-
•
intramusculaire dans le deltoïde après 2 ans ou face antérolatérale de la cuisse avant 2 ans. La vaccination dans la fesse n'est pas recommandée chez le nourrisson (risque d'injection intragraisseuse avec mauvaise efficacité et d'atteinte du nerf sciatique, même à distance du point d'injection).
Les vaccins atténués (à l'exception du BCG) et les vaccins polysaccharidiques peuvent être faits en IM et en SC. Les vaccins inactivés et les autres vaccins sous-unités donnent une meilleure réponse et une meilleure tolérance par voie IM que par voie SC.
Intervalles à respecter
-
•
Pour les vaccins combinés inactivés comportant les valences Diphtérie-Tétanos-Polio-Coqueluche et Haemophilus, un intervalle minimum de 4 semaines est recommandé entre 2 injections successives de vaccin. En cas de retard, il est recommandé de compléter les injections manquantes selon le schéma du calendrier et non de recommencer une vaccination complète. En cas d'intervalle inférieur à 3 semaines, la dernière dose doit être considérée comme non immunisante et répétée avec un intervalle correct.
-
•
Pour les vaccins viraux atténués, le même intervalle de 4 semaines entre deux vaccins est recommandé. Le risque encouru en cas d'intervalle inférieur à 4 semaines est l'inactivation partielle du second vaccin par la réponse immune (interféron) induite par le premier vaccin.
-
•
Pour certains vaccins, un intervalle plus long est recommandé entre deux injections afin d'obtenir un meilleur effet rappel. Par exemple un délai de 5 à 12 mois est recommandé entre la 2e et la 3e dose de vaccin hépatite.
-
•
Le BCG peut être associé aux autres vaccins bactériens et viraux. Le délai de 1 mois entre BCG et les autres vaccinations n'est pas justifié.
Associations vaccinales
-
•
Certains vaccins sont mélangés dans une même seringue : ils sont dits combinés et s'administrent en même temps en une seule injection. Ex. le vaccin trivalent Rougeole-Oreillons-Rubéole, les combinaisons pentavalentes (Dipthérie-Tétanos-Coqueluche-Polio-Haemophilus) et hexavalentes (avec ens complément le vaccin hépatite B).
-
•
D'autres s'administrent au même moment mais en des sites séparés, on parle de vaccination simultanée. Ces vaccins ne peuvent pas être mélangés dans la même seringue. Tous les vaccins inactivés peuvent être administrés de façon simultanée. Les vaccins atténués peuvent être administrés de façon simultanée avec les vaccins inactivés. Certains vaccins atténués peuvent également être administrés de façon simultanée lors d'une même séance, ex. BCG et Rougeole-Oreillons-Rubéole. D'autres nécessitent un intervalle d'un mois entre leur administration (ex. fièvre jaune et Rougeole-Oreillons-Rubéole).
Contre-indications aux vaccinations
-
•
D'une manière générale, les vaccins atténués sont contreindiqués en cas de déficit immunitaire congénital ou acquis : immunosuppression thérapeutique, affection néoplasique en cours de traitement, sida.
-
•
Les vaccins bactériens inactivés sont contre-indiqués en cas de forte réaction après une précédente injection.
-
•
Les vaccins anatoxiniques et polyosidiques n'ont pas de contre-indication.
-
•
Les néphropathies, l'insuffisance cardiaque ou respiratoire, les maladies dermatologiques, y compris l'eczéma, ne sont pas des contre-indications à condition d'être effectués en dehors d'une période de poussée de la maladie.
-
•
Les contre-indications spécifiques de chaque vaccin sont régulièrement remises à jour (textes de l'AMM voir le dictionnaire Vidal).
Calendrier et stratégies vaccinales
Le calendrier vaccinal définit la politique vaccinale du pays concerné. Il s'applique aux enfants et aux adultes. C'est un choix stratégique qui tient compte de divers éléments :
-
•
épidémiologie de la maladie en question dans le pays ;
-
•
disponibilité des vaccins et caractéristiques de ceux-ci : efficacité, durée de protection ;
-
•
rapports bénéfice/risque et coût/efficacité de la vaccination selon la stratégie envisagée ;
-
•
harmonisation avec les recommandations de l'OMS-Europe. Le calendrier est élaboré et révisé chaque année en France par le Comité technique des vaccinations (CTV), comité permanent du Haut conseil de la santé publique (HCSP), proposé au ministère de la Santé et publié chaque année au Bulletin Épidémiologique Hebdomadaire, accessible sur le site www.invs.sante.fr/beh/ (tableau 18.34 ).
Tableau 18.34.
Calendrier vaccinal 2011 - Tableau synoptique.
| Vaccins contre | Naissance | 2 mois | 3 mois | 4 mois | 12 mois | 16-18 mois | 2 ans | 6 ans | 11-13 ans | 14 ans | 16-18 ans | |
| RECOMMANDATIONS GÉNÉRALES | Diphtérie (D), Tétanos (T) Poliomyélite inactivé (Polio) | DT Polio | DT Polio | DT Polio | DT Polio | DT Polio1 | DT Polio | DT Polio2 | ||||
| Coqueluche acellulaire (Ca) | Ca | Ca | Ca | Ca | Ca | |||||||
| Haemophilus infl uenza B (Hib) | Hib | Hib | Hib | Hib | ||||||||
| Hépatite B (Hep B) | Hep B | Hep B | Hep B | |||||||||
| Méningocoque C (vaccin conjugué) | 1 dose | |||||||||||
| Pneumocoque (Pn conj) | Pn3 conj | Pn conj | Pn conj | |||||||||
| Rougeole (R) Rubéole (R) Oreillons (O) | 1re dose (à 9 mois si collectivité) | 2e dose entre 13 et 24 mois (de 12 à 15 mois si collectivité) | ||||||||||
| Papillomavirus humain (HPV) | 3 doses selon le schéma 0, 1 ou 2, 6 mois (filles) | |||||||||||
| RATTRAPAGE | Coqueluche acellulaire (ca) | 1 dose dTcaPolio4 si non vacciné à 11-13 ans | ||||||||||
| Hépatite B | 3 doses selon le schéma 0, 1, 6 mois Ou 2 doses selon le schéma 0, 6 mois5 de 11 à 15 ans révolus |
|||||||||||
| Méningocoque C (vaccin conjugué) | 1 dose6 | |||||||||||
| Papillomavirus humain (HPV) | 3 doses selon le schéma 0, 1 ou 2 mois, 6 mois (jeunes filles de 15 à 18 ans)7 | |||||||||||
| R R O | 2 doses à au moins 1 mois d'intervalle si pas de vaccin antérieur ; 1 dose si une seule dose vaccinale antérieure | |||||||||||
| POPULATIONS PARTICULIÈRES ET À RISQUE | BCG | 1 dose recommandée dès la naissance si enfant à risque de tuberculose8 | ||||||||||
| Grippe | 1 dose annuelle si personne à risque9, à partir de l'âge de 6 mois | |||||||||||
| Hépatite A | 2 doses selon le schéma 0, 6 mois si exposition à des risques particuliers10, à partir d'un an | |||||||||||
| Hépatite B | Nouveau-né de mère Ag HBs positif11 : 3 doses selon le schéma 0, 1, 6 mois | 3 doses selon le schéma 0, 1, 6 mois si risques12 | ||||||||||
| Méningocoque C (vaccin conjugué) | 1 ou 2 doses (plus rappel) selon l'âge, si exposition à un risque particulier13 | |||||||||||
| Méningocoque ACYW135 | 1 dose si présence de facteurs de risque particuliers14 | |||||||||||
| POPULATIONS PARTICULIÈRES ET À RISQUE | Pneumocoque | Si risque15 : 1 dose de Pn conj à 2, 3 et 4 mois | Si risque entre 24 et 59 mois16 et non vaccines antérieurement : 2 doses de Pn conj et 1 dose de Pneumo 23 | Si risque à partir de 5 ans17 : 1 dose de Pneumo 23 tous les 5 ans | ||||||||
| Varicelle | 2 doses18 selon un schéma dépendant du vaccin utilisé, chez des enfants au contact de personnes à risque ou candidats à une greffe | 2 doses chez adolescents19 de 12 à 18 ans sans antécédent et sérologie négative (sérologie facultative) | ||||||||||
NB : Les vaccins indiqués sur fond rose existent sous forme combinée.
Lorsqu'un retard est intervenu dans la réalisation du calendrier de vaccinations indiqué, il n'est pas nécessaire de recommencer tout le programme des vaccinationsce qui imposerait des injections répétées. Il suffit de reprendre ce programme au stade où il a été interrompu et de compléter la vaccination en tenant compte du nombre d'injections manquantes et de l'âge de la personne.
Le vaccin contenant une dose réduite d'anatoxine diphtérique ¡dTPoliol peut être utilisé en cas de pénurie du vaccin combiné contre la diphtérie, le tétanos et la poliomyélite, à partir de l'âge de 6 ans (AMM provisoire).
dTPolio : vaccin combiné diphtérie, tétanos, poliomyélite avec une dose réduite d'anatoxine diphtérique (d).
Pn conj : vaccin pneumococciqué conjugue 13-valent.
dTcaPolio : vaccin combine flipnterie, tétanos, poliomyélite et coqueluche avec des doses réduites d'anatoxine diphtérique (d) et d'antigènes coquelucheux (ca).
Ce schéma vaccinal à 2 doses n'est possible qu'avec les vaccins ayant l'AMM pour cette indication (Engerix B 20 μg ou Genhevsc B Pasteur 20 μg) en respectant un intervalle ce 6 mois entre les 2 doses. Levaccinfngerâ B10 pg n'est pas adapté au schéma vaccinal à 2 doses.
Durant la période initiale de mise en place de la vaccination systématique des nourrissons de 12 à 24 mois et en attendant son impact optimal par la création d'une immunité de groupe, une vaccination de rattrapage selon le même schéma vaccinal à une dose est aussi recommandée jusqu'à l'âge de 24 ans révolus.
La vaccination est recommandée chez les jeunes femmes n'ayant pas eu de rapports sexuels ou au plus tard dans l'année suivant le début de leur vie sexuelle.
Les enfants à risque élevé de tuberculose répondent à l'un des critères suivants : nés dans un pays de forte endémie tuberculeuse ; dont au moins l'un des parents est originaire de l'un de ces pays ; devant séjourner au moins un mois d'affilée dans l'un de ces pays ; ayant des antécédents familiaux de tuberculose (collatéraux ou ascendants directs) ; résidant en Île-de-France ou en Guyane ; dans toute situation jugée par le médecin à risque d'exposition au Dacille tuberculeux notamment enfants vivant dans des conditions de logement défavorables (habitat précaire ou surpeuplé) ou socio-économiques défavorables ou précaires (en particulier parmi les bénéficiaires de la CMU, CMUc, AME. etc.) ou en contact régulier avec des adultes originaires d'un pays de forte endémie.
-
–maladies respiratoires chroniques ne remplissant pas les critères de l'ALD mais susceptibles d'être aggravées ou décompensées par une affection grippale, dont asthme, bronchite chronique, bronchiectasies, hyperréactivité bronchique, – dysplasies bronc ho pulmonaires.
-
–mucoviscldose, – cardiopathies congénitales cyanogènes ou avec une HTAP et/ou une insuffisance cardiaaue. – insuffisances cardiaques graves. – valvulopathies craves, – troubles du rythme graves justifiant un traitement au long cours. – maladies des coronaires.
-
–antécédents d'accident vasculaire cérébral, – formes graves des affections neurologiques et musculaires [dont myopathie, poliomyélite, myasthénie, maladie de Cnarcotl, – paraplégies et tétraplégies avec atteinte diaphragmatique, – néphropathies chroniques graves,
-
–syndromes néphrotiques. – drépanocytoses. homozygotes et doubles hétérozygotes S/C, thalassodrépanocytoses. – diabètes de type 1 et de type 2, – déficits immunitaires primitifs ou acquis (pathologies oncoloqiques et hématoloqiaues, transplantation d'organe et de cellules souches hématopoïétiques. déficits immunitaires héréditaires, maladies inflammatoires et/ou auto-immunes recevant un traitement immunosuppresseurl. excepté îes personnes qui reçoivent un traitement régul er par immunoglobulines, personnes infectées par le VIH quel que soit leur âge et leur statut immunovirologique ; b/l'entouraçe familial des nourrissons âgés de moins de 6 mois avec des facteurs de risque de grippe grave ; c/pour les enfants et adolescents séjournant dans un établissement médico-social d'hébergement, quel que soit leur âge.
Sont concernés : aAes jeunes de plus de un an séjournant dans des structures collectives pour l'enfance et la jeunesse handicapée ; b/les enfants atteints de mucoviscidose ou de pathologie hépatobiliaire chronique susceptibles d'évoluer vers une hépatopathie chronique (notamment dues aux virus de l'hépatite B et de l'hepatite C) ; c/les enfants ces familles doni l'un au moins des membres est originale d'un pays de haute endémicité et susceptibles d'y séjourner ; d/les personnes dans l'entourage familial d'un patient atteint d'hépatite A.
À la naissance pour les enfants nés de mère Ag HBs positif : vaccination dans les 24 heures qui suivent la naissance avec un vaccin autre oue HBVAX Pro 5 μg et immunoglobulines anti-HBs administrées simultanément en des points différents. Deuxième et troisième doses respectivement à 1 et 6 mois d'âge. Schéma en 4 doses (0-1-2-6 mois) pour les prématurés < 32 semaines ou de moins de 2 kg. L'efficacité de cette prévention doit être évaluée à partir de l'âge de 9 mois par une recherche d'antigène HBs et d'anticorps anti-H3s, au mieux 1 à 4 mois après la dernière dose vaccinale.
Sont exposés à un risque particulier les adolescents : a/accueillis dans les services et institutions pour l'enfance et la jeunesse handicapées ; b/accueillis dans les institutions psychiatriques ; c/ayant des relations sexuelles avec des partenaires multiples ; d/voyageurs ou résidents dans des pays de moyenne ou forte encémie (après évaluation des risques) ; e/toxicomanes utilisant des drogues parentérales ; f/susceptibles de recevoir des transfusions massives et/ou itératives ou de médicaments dérivés du sana (hémophiles, dialyses, insuffisants rénaux, etc.) ; g/candidats à une greffe d'organe, de tissus ou de cellules ; h/entourage d'une personne infectee par le virus de l'hépatite B ou porteur chronique de l'antigène HBs Ifamille vivant sous le même toit) ; i/partenaires sexueis d'une personne infectée par le virus de l'hépatite B ou porteur chronique de l'antigène HBs.
La vaccination est recommandée pour les personnes non vaccinées contacts d'un cas d'infection invasrve à méningocoque C et pour les enfants Ijusqu a l'âge de 2 ans) ayant un déficit en complément ou en pnoperdir.e. recevant un traitement anti-C5A ou aspléniques ; selon le schéma suivant : pour les nourrissons entre l'âge de 2 mois et 1 an : 2 doses à au moins 2 mois d'intervalle et 1 rappel entre 12 et 24 mois ; pour les personnes â partir de l'âge d'1 an : 1 dose.
La vaccination est recommandée, avec une dose du vaccin tétravalent conjugué, pour les personnes (à partir de l'âge de 2 ans) ayant un déficit en complément ou en properdine, recevant un traitement anti-C5A ou aspléniques.
Une dose complémentaire de vaccin pneumococcique conjugué est recommandée à 3 mois (avec un rappel entre : 2 et :5 mois) pour les prématurés et les nourrissons à haut risque de faire une infection invasrve à pneumocoque, c'est-à-dire présentant l'une des affections suivantes : asplenie fonctionnelle ou splénectomie ; orépanocytose homozygote ; infection par le VIH ; déficits immunitaires congénitaux ou secondaires à une insuffisance rénale chronique ou un syndrome néphrotique. à un traitement immunosuppresseur ou une radiothérapie pour néoplasie. lymphome ou maladie de Hodgkin. leucémie, transplantation d'organe ; cardiopathie congénitale cyanogène ; insuffisance cardiaque ; pneumopathie chronique (à l'exception de l'asthme, sauf les asthmes sous corticothérapie prolongée) ; brèche osîéoméninçée ; diabète).
Pour les enfants à risque de 24 à 59 mois (cf. ci-dessus note n° 15) non préalablement vaccinés, la vaccination pneumococcique est recommandée selon le schéma suivant : 2 doses de vaccin conjugué Pn13 à 2 mois d'intervalle survies d'une dose de vaccin polyosidique 23-valent au moins 2 mois après la 2e dose de vaccin conjugué.
À partir de l'âge de 5 ans sont considérés comme à risque élevé d'infections à pneumocoque les personnes atteintes de : a/asplénie fonctionnelle ou splénectomie ; b/drépanocyiose homozygote ; c/infection à VIH ; d/syndrome néphrotique ; e/insuffisance respiratoire ; f/insuffisance cardiaaue ; g/antécédents d'infection pulmonaire ou invasive à pneumocoque.
Le schéma vaccinal est (le 2 doses espacées de 4a 8 semaines ou de 6 à 10 semaines selon le vaccin utilisé, quel que soit l'âge ; recommandé chez des enfants, sans antécédent de varicelle et dont la sérologie est négative, en contact étroit avec des personnes immunodéprimées ou candidats receveurs d'une greffe d'organe.
La vaccination contre la varicelle chez une adolescente en âge de procréer doit être précédée d'un test négatif de grossesse et une contraception efficace de 3 mois est recommandée après chaque dose de vaccin.
Il précise les nouvelles modifications des stratégies, les recommandations éventuelles concernant de nouveaux vaccins et est incorporé au carnet de santé et au Vidal.
Certaines vaccinations ont un caractère obligatoire en France selon le code de la santé publique. Elles sont désormais au nombre de trois : vaccination contre le tétanos, la diphtérie, la poliomyélite avant 18 mois. D'autres sont recommandées et figurent à cet égard au calendrier vaccinal. Seules les vaccinations recommandées et obligatoires justifient d'une prise en charge financière par la sécurité sociale. L'intérêt du caractère obligatoire des vaccinations est actuellement débattu en France, et on s'oriente vers une suppression de cette obligation au profit d'une meilleure information des familles sur l'intérêt de la vaccination et l'obtention de leur libre consentement.
La stratégie envisagée peut être :
-
•
une vaccination universelle ou généralisée, destinée à l'ensemble de la population lorsque la maladie que l'on veut prévenir constitue par sa fréquence ou sa gravité une priorité de santé publique ;
-
•
une vaccination ciblée, restreinte aux sujets identifiés à risque comme par exemple les sujets de plus de 65 ans pour la vaccination grippale ou les nouveau-nés de mère porteuse de l'antigène HBs pour la vaccination contre l'hépatite B ;
-
•
quelques professions justifient également de recommandations spécifiques. Certaines de ces vaccinations peuvent avoir un caractère obligatoire pour des professions particulières (la vaccination contre l'hépatite B est aussi obligatoire pour les professions de santé).
Principaux vaccins chez l'enfant
Vaccin antitétanique
Ses caractéristiques sont les suivantes :
-
•
nature : anatoxine (ou toxoïd) tétanique (toxine purifiée et détoxifiée par Ramon à l'Institut Pasteur en 1923) ;
-
•
voie d'administration : sous-cutanée ou intramusculaire ;
-
•
présentation : isolé ou combiné avec d'autres valences vaccinales : diphtérie, polio, Haemophilus b, coqueluche, hépatite B, grippe ;
-
•
indications et nombre de doses : vaccination universelle et obligatoire avec primovaccination à 3 doses à un mois d'intervalle (2, 3 et 4 mois) et rappel un an plus tard puis tous les 5 ans chez l'enfant, puis tous les 10 ans chez l'adulte ;
-
•
âge : dès l'âge de 2 mois (disparition des anticorps transmis d'origine maternelle) en association avec diphtérie, polio, coqueluche, Haemophilus, hépatite B ;
-
•
efficacité : 100 % après 4 injections chez le sujet immunocompétent ;
-
•
tolérance : excellente ;
-
•
contre-indications : aucune.
Vaccin antidiphtérique
Ses caractéristiques sont les suivantes :
-
•
nature : 30 UI d'anatoxine (ou toxoïd) purifiée (Ramon) ; il existe une préparation vaccinale sous-dosée (2 UI) en anatoxine diphtérique destinée à l'enfant de plus de 16 ans et l'adulte ;
-
•
voie d'administration : isolée ou combinée (cf. supra Vaccin antitétanique) ;
-
•
indications et nombre de doses : vaccination universelle et obligatoire avec primovaccination à 3 doses à un mois d'intervalle (2, 3 et 4 mois) et rappel un an plus tard puis tous les 5 ans chez l'enfant, puis tous les 10 ans chez l'adulte ;
-
•
âge : comme pour le vaccin antitétanique ;
-
•
efficacité : remarquable, disparition quasi totale de la maladie en France mais nécessité du maintien d'une excellente couverture vaccinale, car le portage pharyngé reste possible chez le sujet vacciné, donc risque de contamination des enfants non immuns ;
-
•
tolérance : moins bonne, possibilité de réaction locale. D'où l'intérêt de vaccins faiblement dosés en anatoxine diphtérique en rappel chez le sujet âgé de plus de 16 ans ;
-
•
contre-indications : aucune.
Vaccin polio
Deux vaccins trivalents fabriqués à partir des trois souches de virus polio 1, 2 et 3 sont utilisés dans le monde :
-
•le vaccin polio injectable type Salk-Lépine, seul disponible en France :
-
–c'est un vaccin inactivé,
-
–voie d'administration : sous-cutanée (ou intramusculaire),
-
–présentation : isolé ou associé avec d'autres vaccins : diphtérie, tétanos, Haemophilus b, coqueluche, hépatite B (TPolio, DTPolio, DTCoq-Polio, DTCoq-Polio Haemophilus),
-
–indications et nombre de doses : vaccination universelle et obligatoire avec primovaccination à trois doses à un mois d'intervalle (2, 3 et 4 mois) et rappel un an plus tard puis tous les 5 ans chez l'enfant, puis tous les 10 ans chez l'adulte,
-
–tolérance : excellente,
-
–contre-indications : aucune ;
-
–
-
•le vaccin polio oral type Sabin est atténué, donc vivant, et encore utilisé dans certains pays en voie de développement. Il se distingue du vaccin polio injectable par :
-
–sa voie d'administration orale,
-
–sa présentation : sous une seule forme, simple : vaccin poliomyélite buvable Sabin,
-
–sa tolérance qui est bonne, mais il existe un risque rare (un cas pour un million de doses) de paralysie due au virus vaccinal (polio type 3) par mutation reverse. Ce risque incompressible justifie la recommandation actuelle en France, où la poliomyélite autochtone a quasiment disparu, de ne pas utiliser ce type de vaccin en primovaccination. En revanche, ce vaccin reste indiqué en situation d'épidémie (Tiers-Monde) compte tenu de son coût faible et de l'avantage épidémiologique dû à l'excrétion des virus vaccinaux dans les selles des sujets vaccinés, permettant la vaccination des sujets contacts,
-
–ses contre-indications : ce sont celles de tout vaccin vivant atténué : immunosuppression chez le sujet à vacciner ou bien dans son entourage, grossesse, maladie infectieuse aiguë en évolution.
-
–
Vaccins de la coqueluche
Deux types de vaccins sont utilisés dans le monde : les vaccins à germes entiers et les vaccins acellulaires.
Vaccins acellulaires (Ca et ca)
Ils sont désormais les/ seuls utilisés en France, dans d'autres pays d'Europe et aux États-Unis. Leurs caractéristiques sont les suivantes :
-
•
nature : composants bactériens purifiés (2 ou 3 composants) : toxine pertussique détoxifiée, hémagglutinine filamenteuse ± pertactine ;
-
•présentation : forme combinée :
-
–pentavalente nourrisson : DTCaPolioHIB (Infanrix quinta, Pentavac),
-
–hexavalente nourrisson : DTCaPolioHIB Hépatite B (Hexavac),
-
–quadrivalente adolescent : DTCaPolio (Infanrixpolio, Tétravac),
-
–quadrivalente adulte : dTcaPolio (Boostrix tetra, Repevax) ;
-
–
-
•indications et nombre de doses :
-
–primovaccination universelle recommandée à 2, 3, 4 mois suivie d'un rappel un an plus tard avec les combinaisons pentavalentes et hexavalentes,
-
–rappel universel tardif adolescent (11-13 ans) avec un vaccin tétravalent DTCaPolio contenant une dose normale d'anatoxine dipthérique (D) et coqueluche acellulaire (Ca),
-
–rappel tardif ciblé adulte avec un vaccin tétravalent dTcaPolio contenant une dose faible d'anatoxine dipthérique (d) et coqueluche acellulaire (ca). L'indication de la vaccination de rappel adulte est recommandée en France depuis 2004 :
-
–chez les adultes susceptibles de devenir parents dans les mois ou années à venir,
-
–ainsi qu'à l'occasion d'une grossesse, pour les membres du foyer (enfant qui n'est pas à jour pour cette vaccination, adulte qui n'a pas reçu de vaccination contre la coqueluche au cours des 10 dernières années), selon les modalités suivantes : père et enfants : durant la grossesse de la mère ; mère : le plus tôt possible après l'accouchement,
-
–de même, le rappel est recommandé pour les professionnels en contact avec des nourrissons trop jeunes pour avoir reçu 3 doses de vaccins coquelucheux : maternités, services de néonatalogie et de pédiatrie prenant en charge des nourrissons âgés de moins de 6 mois, étudiants des filières médicales ou paramédicales ;
-
–
-
–depuis 2008, un rattrapage coquelucheux est également proposé chez l'adulte n'ayant pas reçu de vaccination contre la coqueluche au cours des 10 dernières années, notamment à l'occasion du rappel décennal diphtérie-tétanos-poliomyélite de 26-28 ans ;
-
–
-
•
efficacité : excellente, 90 à 95 % de séroconversion après les 4 injections pour le vaccin à germes entiers, environ 85 % pour les vaccins acellulaires ; 92 % de protection après vaccination de rappel tardif chez l'adulte ;
-
•
voie d'administration : sous-cutanée (ou intramusculaire) ;
-
•
tolérance : excellente au niveau local et général, avec moins de 10 % de réactions fébriles et moins de 5 % de réactions générales dans la plupart des études ;
-
•
contre-indications : encéphalopathie évolutive ou d'étiologie inconnue survenue dans les 7 jours suivant une vaccination antérieure avec un vaccin contenant la valence coquelucheuse, hypersensibilité après vaccination antérieure ou à l'un des composants du vaccin, infection fébrile sévère aiguë, forte réaction dans les 48 heures suivant une précédente injection (hyperthermie au-delà de 40 °C, choc, convulsion fébrile ou non, cris persistants, hypotonie-hyporéactivité).
Vaccins à germes entiers
Ils sont encore utilisés dans de nombreux pays dans le monde :
-
•
nature : suspension bactérienne inactivée par la chaleur ;
-
•
présentation : en règle, sous forme combinée avec : diphtérie, tétanos, Haemophilus, hépatite B et méningocoque conjugué ;
-
•
tolérance : les réactions sont essentiellement locales ¡ (douleur, œdème au point d'injection pour 30 à 50 % des enfants), mais aussi générales (fièvre dans les 24 heures J après l'injection dépassant rarement 38,5 °C, chez 30 à 3 40 % des enfants, convulsion fébrile, plus rarement choc, syndrome des cris persistants). La responsabilité du vaccin < actuel coquelucheux vis-à-vis la survenue d'encéphalopathies durables n'a pas été démontrée.
Vaccins Haemophilus
Il a pour objectif de protéger les nourrissons et les enfants jusqu'à 5 ans vis-à-vis les infections graves à Haemophilus influenzae de type b : méningite, épiglottite et arthrite :
-
•
nature : il s'agit de vaccins polyosidiques constitués par le polyribosyl-ribitol-phosphate ou PRP, d'origine capsulaire. Comme tout vaccin polyosidique, le vaccin anti-Haemophilus est thymo-indépendant et peu immunogène avant 24 mois. La conjugaison à une protéine lui confère cette thymodépendance et permet l'administration du vaccin Haemophilus dès l'âge de 2 mois ;
-
•
indication et nombre de doses : vaccination universelle recommandée du nourrisson avec primovaccination à 3 doses à partir de deux mois (2, 3, 4 mois) combinées avec les vaccines D, T, coquelucheux, Polio (± hépatite B) avec un rappel à un an. Entre 6 et 12 mois, 2 injections à un mois d'intervalle avec rappel à un an : après un an une seule injection est suffisante ; un rattrapage vaccinal peut-être effectué jusqu'à 5 ans ;
-
•
tolérance : très bonne ;
-
•
efficacité : elle a été démontrée par des essais comparatifs en Finlande et aux États-Unis. En Finlande, les méningites à Haemophilus sont éliminées depuis 1992. Tous les pays qui vaccinent largement constatent la quasi-disparition de la pathologie invasive à Hib ainsi que l'effondrement du portage pharyngé de l'Hib chez les jeunes enfants, qui explique la moindre circulation de l'Hib et un effet de protection indirect chez les non protégés.
Vaccin pneumococcique conjugué
Ses caractéristiques sont les suivantes :
-
•
nature : vaccins contenant 13 sérotypes (1, 3, 4, 5, 6A, 6B, 7 F, 9 V, 14, 18 C, 19A, 19 F et 23 F) conjugués à la protéine CRM 197 qui est une toxine diphtérique mutante non toxique (vaccin Prevenar 13) ; comme pour le vaccin Hib, ce vaccin polyosidique conjugué rend possible la vaccination des nourrissons ;
-
•
voie d'administration : IM ;
-
•indications et nombre de doses :
-
–vaccination universelle recommandée du nourrisson avec primovaccination à 2 doses à 2 et 4 mois en association (vaccination simultanée en deux sites différents et non en combinaison) aux vaccins penta ou hexavalents du nourrisson, et rappel à 12 mois,
-
–vaccination ciblée également recommandée chez les enfants de 2 à 5 ans définis comme à risque d'infection pneumococcique sévère invasive selon le schéma suivant : 2 doses de vaccin pneumococcique conjugué séparées d'un mois suivies d'un rappel polyosidique 23-valent. Les sujets dits à risque sont les suivants : asplénie fonctionnelle ou splénectomie ; drépanocytose homozygote ; infection par le VIH ; déficits immunitaires congénitaux ou secondaires à une insuffisance rénale chronique ou à un syndrome néphrotique, à un traitement immunosuppresseur ou à une radiothérapie pour néoplasie, lymphome ou maladie de Hodgkin, leucémie, transplantation d'organe ; cardiopathie congénitale cyanogène, insuffisance cardiaque ; pneumopathie chronique (à l'exception de l'asthme, sauf les asthmes sous corticothérapie prolongée) ; brèche ostéoméningée ; diabète ; candidats à l'implantation cochléaire ou porteurs d'implants cochléaires ;
-
–
-
•
efficacité : excellente sur les bactériémies et les méningites ; faible sur l'ensemble des otites (6 %) mais atteignant 50 % si l'otite est due à un pneumocoque ayant un sérotype contenu dans le vaccin ; bonne également sur les pneumonies documentées à pneumocoque ;
-
•
effet rappel : si l'on vaccine ensuite avec le vaccin 23-valents.
Vaccins contre l'hépatite B
Nature
Les vaccins disponibles sont des vaccins recombinants par génie génétique qui contiennent la protéine d'enveloppe, l'antigène HBs. Pour les enfants jusqu'à 15 ans, le choix se pose entre le vaccin Engerix B 10, vaccin HBVax DNA ; au-delà de 15 ans, c'est le vaccin Engerix B 20 ou le vaccin Genhevac B. Un vaccin combiné associe vaccin de l'hépatite B et vaccin de l'hépatite A pour l'enfant (vaccin Twinrix Enfant) qui s'administre alors en 2 injections IM à un mois d'intervalle avec un rappel 6 à 12 mois plus tard.
Indications et nombre de doses
Depuis 1995, la vaccination universelle est recommandée pour les adolescents et les nourrissons. Le schéma recommandé chez le nourrisson et l'enfant comporte 2 injections à au moins 1 mois d'intervalle suivies d'une dose de rappel au moins 5 mois après la 2e dose. Ce vaccin peut être administré de façon combinée avec diphtérie, tétanos, coqueluche, polio et Hib (vaccin hexavalent Infanrix hexa) à 2 et 4 mois avec rappel à 16-18 mois (DTCalPV-Hib-HepB). Dans ce cas, l'injection de 3 mois ne comporte que le vaccin pentavalent (schéma : primovaccination hexa à 2 mois, penta à 3 mois, hexa à 4 mois, rappel hexa à 16-18 mois). Chez l'adolescent entre 11 et 15 ans, un schéma simplifié à 2 doses de vaccin hépatite B espacées de 6 mois suffit.
Les nouveau-nés de mère porteuse d'antigène HBs doivent être vaccinés dans les 12 heures qui suivent la naissance et avec un vaccin autre que l'HBVAXPRO 5 pg. Cette première injection doit s'accompagner d'administration d'immunoglobulines anti-HBv. Actuellement, un décret de 1992 impose le dépistage de l'antigène HBs chez toutes les mères dans le dernier trimestre de la grossesse. Par conséquent, l'ensemble des nouveau-nés de mères porteuses d'antigène HBs devrait être dépisté et protégé en France. Pour le nouveau-né de moins de 2 kg ou d'âge gestationnel inférieur à 32 semaines, un schéma à 4 injections : 0, 1, 2, 6 mois est recommandé, sinon, le schéma classique à trois doses 0, 1, 6 mois suffit. Un contrôle sérologique post-vaccinal est préconisé pour ces patients de mère Ag HBS positive vaccinés à la naissance : dosage des Ag HBS et Ac HBS 1 à 4 mois après la dernière dose de vaccin.
Efficacité
Ils sont hautement immunogènes, plus de 90 % des sujets vaccinés ayant un titre d'anticorps protecteurs après la 3e injection. L'immunité cellulaire est également très forte, ce qui explique que, malgré un taux d'anticorps inférieur au taux protecteur, on n'observe pas de maladie évolutive ni de portage d'antigène HBs après la surveillance de cohortes d'anciens vaccinés sur 10 années.
La diminution de l'incidence de l'hépatocarcinome rapportée à Taïwan en 1997 est la première preuve épidémiologique de l'efficacité clinique de ces vaccins après 10 années d'utilisation.
Politique vaccinale
En France la stratégie adoptée est la vaccination des nourrissons et durant 10 ans le rattrapage des préadolescents. En octobre 1998, la vaccination en milieu scolaire pour les élèves de 6e a été provisoirement suspendue, ces enfants devant être vaccinés par leur médecin pour mieux apprécier le bénéfice et le risque potentiel de cette vaccination. En 2005, seulement un quart des enfants nés en 2000 était vacciné.
Effets indésirables
Le vaccin est bien toléré. À la suite de plusieurs études récentes il a été prouvé qu'il n'existe aucune preuve d'un lien causal entre la vaccination de l'hépatite B et la survenue d'une maladie démyélinisante du système nerveux central (essentiellement la sclérose en plaques). Ainsi cette maladie ne contre-indique pas la vaccination mais justifie d'une simple précaution d'emploi avec évaluation individuelle de l'indication.
Vaccin BCG
La suspension du caractère obligatoire de la vaccination BCG a été décidée en France en 2007 au profit d'une vaccination ciblée vers les populations à risque accompagnée d'un plan renforcé de lutte antituberculeuse. La vaccination reste obligatoire pour les personnels de santé. Elle est fortement recommandée chez les populations considérées à risque, c'est-à-dire les enfants jusqu'à l'âge de 15 ans répondant à l'un des critères suivant :
-
•
enfant né dans un pays de forte endémie tuberculeuse ;
-
•
enfant dont au moins l'un des parents est originaire de l'un de ces pays ;
-
•
enfant devant séjourner au moins un mois d'affilée dans l'un de ces pays ;
-
•
enfant ayant des antécédents familiaux de tuberculose (collatéraux ou ascendants directs) ;
-
•
enfant résidant en Île-de-France ou en Guyane ;
-
•
enfant dans toute situation jugée par le médecin à risque d'exposition au bacille tuberculeux notamment enfant vivant dans des conditions de logement défavorables (habitat précaire ou surpeuplé) ou socio-économiques défavorables ou précaires (en particulier parmi les bénéficiaires de la CMU, CMUc, AME* , etc.) ou en contact régulier avec des adultes originaires d'un pays de forte endémie.
Chez les nourrissons à risque élevé de tuberculose (définis ci-dessus), la vaccination BCG doit être réalisée au plus tôt, si possible à la naissance ou au cours du 1er mois de vie.
Les zones géographies à forte incidence de tuberculose sont celles définies par l'OMS :
-
•
le continent africain dans son ensemble ;
-
•
le continent asiatique dans son ensemble, y compris les pays du Proche et Moyen-Orient ;
-
•
les pays d'Amérique centrale et du Sud ;
-
•
les pays d'Europe centrale et de l'Est y compris les pays de l'ex-URSS ;
-
•
dans l'Union européenne : Bulgarie, Estonie, Hongrie, Lettonie, Lituanie, Pologne, Portugal, Roumanie.
Cette recommandation s'inscrit dans le cadre plus général du programme de lutte contre la tuberculose en France et dont l'application sera essentielle si l'on veut éviter ou au moins réduire l'augmentation du nombre de cas de tuberculose dès à présent anticipée du fait de la suppression de la vaccination universelle. Le rôle des médecins praticiens généralistes et pédiatres sera essentiel dans cette stratégie pour identifier les personnes à risque, les vacciner et participer aux enquêtes de dépistage autour des cas.
Les caractéristiques du vaccin BCG sont les suivantes :
-
•
nature : vaccin bactérien vivant atténué à germes entiers ;
-
•
voie d'administration : une seule possible depuis 2006, la voie intradermique : poudre lyophilisée à suspendre dans son diluant (vaccin BCG intradermique SSI, souche Copenhague). Risque d'inefficacité et d'abcès si l'injection est pratiquée en intragraisseux ou en sous-cutané. Le volume est de 0,1 mL (plus d'un an) ou de 0,05 mL (moins d'un an). Le test tuberculinique (Tubertest) n'est plus recommandé après vaccination ;
-
•
âge : dès la naissance en cas de situation à risque : population immigrée, contacts fréquents avec des contaminateurs potentiels, voyages prévisibles en zone de forte endémie, sinon obligatoire avant l'entrée à la grande école (6 ans) ou dans toute collectivité : garderie, crèche ; après 3 mois, un test tuberculinique négatif est nécessaire avant vaccination ;
-
•
efficacité : protection non absolue contre la tuberculose, notamment après un contage massif, mais protection prouvée contre les formes graves : 80 % pour méningite et miliaire, 50 % pour les autres formes de tuberculose chez le sujet vacciné ayant développé une allergie à la tuberculine ;
-
•
tolérance : bonne le plus souvent, mais risque de BCGite localisée ou d'adénite (0,2 à 4 %). Toute complication doit être signalée au fabricant ;
-
•
contre-indications : immunodépression de type cellulaire congénitale ou acquise (sida).
Vaccin rougeole
Ses caractéristiques sont les suivantes :
-
•
nature : vivant atténué, souche Edmonston ou Schwarz selon les vaccins (ROR-vax ou Priorix) lyophilisé, à utiliser dans les 8 heures suivant la reconstitution dans le solvant. À conserver impérativement à + 4 °C mais jamais au congélateur ;
-
•
voie d'administration : sous-cutanée (ou intramusculaire) ;
-
•
présentation : combinée avec les vaccins rubéole et oreillons (ROR-Vax, Priorix) ;
-
•
âge : à partir de l'âge de 12 mois, possible dès 9 mois en crèche mais un rappel devra être pratiqué un an plus tard ;
-
•
indication et nombre de doses : vaccination combinée triple Rougeole-Oreillons-Rubéole universelle recommandée à 2 doses avant 2 ans selon le schéma suivant : une 1re dose dès 12 mois, une 2e dans la 2e année de vie avec au moins un mois entre les 2 doses. Cette 2e dose n'est pas un rappel mais permet de rattraper 90 % des enfants qui n'ont pas fait de séroconversion après la 1re dose et de rattraper les enfants non vaccinés par oubli ou réticence. On continue de vacciner par le vaccin triple les enfants de 11-13 ans qui n'ont jamais été ° vaccinés ; entre 14 et 26 ans (nés entre 1985 et 1997), une dose de vaccin trivalent est recommandée ; au-delà, les sujets sont considérés comme probablement naturellement immuns ;
-
•
tolérance : très bonne tolérance locale, possibilité de réaction générale entre le 5e et le 12e jour après la vaccination (fièvre, éruption morbilliforme). L'incidence des purpuras thrombopéniques post-ROR a été estimée à 3,3/100 000 ;
-
•
la vaccination d'un sujet qui aurait déjà fait la maladie ou qui aurait déjà été vacciné est dénuée de tout risque : en conséquence, le vaccin triple Rougeole-Oreillons-Rubéole est particulièrement indiqué quel que soit l'âge, en vaccination de « rattrapage » si le sujet n'est pas immunisé contre l'une des maladies, même s'il l'est contre les autres (après maladie ou vaccination) ;
-
•
contre-indications : celles de tout vaccin vivant : immunodépression de tout type chez le sujet vacciné ou bien dans son entourage, grossesse. On ajoute également l'injection d'immunoglobulines standard moins de 3 mois avant et jusqu'à 15 jours après l'injection (risque d'échec vaccinal).
Vaccin oreillons
Ce vaccin est non obligatoire mais recommandé. Ses caractéristiques sont les suivantes :
-
•
nature : vivant atténué, souche « Jeryl Lynn » ;
-
•
voie d'administration : sous-cutanée (ou intramusculaire) ;
-
•
présentation : combinée dans le vaccin triple RougeoleOreillons-Rubéole (ROR-vax et Priorix) ;
-
•
indication et nombre de doses : vaccination combinée triple Rougeole-Oreillons-Rubéole universelle recommandée à 2 doses avant 2 ans selon le même schéma que pour la rougeole ;
-
•
âge : comme pour la vaccination rougeole ;
-
•
efficacité : excellente, 98,8 % de séroconversion avec le ROR, durée de protection estimée à 15 ans minimum ;
-
•
tolérance : bonne, on peut observer entre le 10e et le 20e jour après l'injection une parotidite d'évolution spontanément favorable, exceptionnellement une méningite lymphocytaire ;
-
•
contre-indications : celles de tout vaccin vivant, plus allergie confirmée aux protéines de l'œuf ou à la kanamycine.
Vaccin rubéole
Vaccin non obligatoire mais recommandé, chez le garçon comme chez la fille. Ses caractéristiques sont :
-
•
nature : vivant atténué, souche Wistar RA-27/3 m, cultivé sur cellules diploïdes humaines ;
-
•
voie d'administration : sous-cutanée (ou intramusculaire) ;
-
•
présentation : isolé (Rudivax) ou associé dans un vaccin divalent (Rudi-Rouvax) ou trivalent (ROR) ;
-
•
indication et nombre de doses : vaccination combinée triple Rougeole-Oreillons-Rubéole universelle recommandée à 2 doses avant 2 ans selon le même schéma que pour la rougeole ;
-
•
âge : comme pour la vaccination rougeole ;
-
•
efficacité : 100 % de séroconversion avec le ROR ;
-
•
tolérance : bonne, des arthralgies 15 jours après l'injection peuvent s'observer surtout chez le grand enfant et l'adulte ;
-
•
contre-indications : celles de tout vaccin vivant, dont la grossesse. Cependant, aucun effet tératogène n'a été enregistré à ce jour.
En Finlande et en Suède, cette triple vaccination ROR a permis l'élimination virtuelle des trois maladies avec une politique vaccinale à 2 doses et une couverture vaccinale de 95 %.
Vaccin méningococcique conjugué C
Depuis 2009, la vaccination méningococcique C conjuguée est recommandée en en France chez les nourrissons de 1 à 2 ans avec une extension transitoire de la cible jusqu'à l'âge de 24 ans selon un schéma à une seule dose.
Autres vaccins
Vaccin pneumocoque non conjugué
Ses caractéristiques sont les suivantes :
-
•
nature : sous-unité, polyosidique contenant 23 sérotypes différents d'antigènes capsulaires de Streptococcus pneumoniae virulents ;
-
•
voie d'administration : sous-cutanée ;
-
•
présentation : isolé (Pneumo 23) ;
-
•
nombre de doses : une seule, mais nécessité de rappels tous les 5 ans ; tous les 3 ans chez les drépanocytaires SS et les splénectomisés ;
-
•
âge : à partir de 5 ans seulement chez les sujets splénectomisés, drépanocytaires, les patients atteints de syndrome néphrotique ou porteurs de brèche ostéoméningée ; également recommandé chez les sujets insuffisants respiratoires ;
-
•
efficacité : bien démontrée pour les infections invasives ;
-
•
tolérance : bonne ;
-
•
contre-indications : aucune.
Vaccin contre la typhoïde
Il est recommandé chez les enfants devant se rendre dans les pays où persiste une forte endémie de fièvre typhoïde (enfant voyageur) et se caractérise par les propriétés suivantes :
-
•
nature : sous-unité, polyosidique (antigène capsulaire Vi) ; il existe un vaccin oral non commercialisé en France ;
-
•
présentation : isolé, vaccin Typhim Vi, vaccin Typhérix ;
-
•
nombre de doses : une seule ;
-
•
âge : à partir de 2 ans ;
-
•
efficacité : bonne, comprise entre 64 et 80 % selon différentes études pratiquées en pays d'endémie ;
-
•
tolérance : excellente ;
-
•
contre-indications : aucune.
Vaccin contre la fièvre jaune
Ses caractéristiques sont les suivantes :
-
•
nature : vivant atténué, souche Rockfeller 17D ;
-
•
voie d'administration : sous-cutanée (ou intramusculaire) ;
-
•
présentation : isolé ;
-
•
nombre de doses : une seule ;
-
•
âge : à partir de 9 mois ;
-
•
efficacité : 100 %, 10 jours après primovaccination. Durée de validité : 10 ans ;
-
•
tolérance : possible réaction douloureuse ou fébrile entre le 5e et le 10e jour ;
-
•
contre-indications : celles des vaccins vivants.
Un règlement sanitaire international rend ce vaccin obligatoire pour l'Afrique intertropicale et les régions tropicales de l'Amérique du Sud. Il est obligatoire pour se rendre en Guyane. Les pays d'Asie qui sont indemnes de la fièvre jaune exigent également ce vaccin pour tout voyageur en provenance d'une région d'endémie.
Vaccin méningococcique quadrivalent conjugué
Ce vaccin est indiqué à partir de 11 ans pour les sujets exposés à d'autres méningocoques que ceux de sérogroupes C :
-
•
voyageurs en zone d'endémie en contact avec la population ;
-
•
sujets à risque élevé d'infection invasive méningococcique : déficit en complément, asplénie fonctionnelle ou anatomique, traitements anticomplémentaires (vaccination recommandée dès l'âge de 2 ans sur l'avis de l'Afssaps).
Vaccins de l'hépatite A
Il existe des vaccins réservés aux enfants jusqu'à l'âge de 15 ans :
-
•
nature : vaccin viral inactivé (vaccin Havrixenfants 720, vaccin Avaxim chez l'enfant de plus de 16 ans et l'adulte) ;
-
•
présentation : isolée ; vaccin Havrix 720 Enfant Nourrissons, vaccin Avaxim chez l'enfant de plus de 16 ans et l'adulte, et combinée au vaccin de l'hépatite B : vaccin Twinrix enfants ;
-
•
voie d'administration : intramusculaire ;
-
•
schéma : une première dose unique suivie d'un rappel 6 à mois plus tard nécessaire pour obtenir une protection estimée à 10 ans ; schéma à 3 doses avec les combinaisons hépatite A hépatite B ;
-
•
tolérance : bonne, seule une douleur locale et de rares céphalées et malaises sont signalés ;
-
•
efficacité : excellente, prouvée par de larges études en Thaïlande ;
-
•
indications : la vaccination peut être pratiquée dès l'âge de 12 mois. Pour les enfants voyageurs en zone d'endémie, pour les enfants des internats des établissements et services pour l'enfance et la jeunesse handicapées, après contage.
Vaccins rotavirus
Deux vaccins ont une AMM européenne :
-
•
le premier, élaboré par les laboratoires Glaxo-Smith-Kline (Rotarix), est un vaccin monovalent humain atténué à partir d'une souche de type G1 qui confère une protection croisée avec les autres souches circulantes humaines ;
-
•
le second vaccin élaboré par les laboratoires Merck (SanofiPasteur-MSD), est un vaccin pentavalent d'origine bovine réassortant et incorporant les sérotypes G1, G2, G3,G4 et P1a. La vaccination universelle est recommandée aux États-Unis et dans quelques autres pays, notamment en Europe mais non recommandée en France (2006 et 2010) :
-
•
nature : vaccins vivants atténués, administrés par voie orale ;
-
•
présentation : isolé ;
-
•schéma et nombre de doses :
-
–Rotarix, schéma à 2 doses : la première dose peut être administrée à partir de l'âge de 6 semaines, l'intervalle entre les doses doit être au moins de 4 semaines. Le schéma de vaccination doit préférentiellement être administré avant l'âge de 16 semaines, et doit être terminé avant l'âge de 24 semaines,
-
–RotaTeq, schéma à 3 doses, 1re dose entre 6 et 12 semaines, intervalle entre les doses 4 à 10 semaines, 3e dose administrée avant 32 semaines ;
-
–
-
•
efficacité : efficacité supérieure à 70 % contre toutes les formes de gastro-entérite à rotavirus et supérieure à 90 % et souvent proche de 100 % pour les formes sévères de gastroentérite à Rotavirus des sérotypes circulants couverts par les vaccins (G1, 2, 3, 4 et G9) ;
-
•
tolérance : excellente ; risque possible d'invagination intestinale aiguë au décours de la 1re dose dans un délai de 7 à 30 jours (risque estimé à 1-2/million de doses) ;
-
•
contre-indications : immunodépression, antécédent d'invagination intestinale aiguë, malformation congénitale du tractus gastro-intestinal pouvant prédisposer à une invagination intestinale, hypersensibilité à la substance active ou à l'un des excipients, hypersensibilité suite à une précédente administration de vaccins rotavirus.
Vaccins HPV (Human Papillomavirus)
Les papillomavirus humains sont responsables de la survenue de lésions précancéreuses et cancéreuses du col utérin chez la femme (HPV présents dans 99,7 % des cancers du col). La contamination se fait par voie sexuelle et 75 % de la population en âge de procréer est infectée par un HPV. Parmi les différents HPV, les sérotypes 16 et 18 représentent 84 % des cancers invasifs (11,2 % de co-infections). À un moindre degré certains sérotypes (6 et 11 en particulier) sont responsables de verrues génitales (condylomes acuminés ou crêtes de coq) chez l'homme et la femme.
La prévention est devenue possible par la vaccination avant l'âge des premiers rapports sexuels. Deux vaccins ont été développés et ont obtenu une AMM dans cette indication : ce sont deux vaccins viraux inactivés (tués) :
-
•
Gardasil : vaccin quadrivalent (sérotypes 6, 11, 16 et 18) ;
-
•
Cervarix : vaccin bivalent (sérotypes 16 et 18).
Leurs caractéristiques sont les suivantes :
-
•
présentation : isolée ;
-
•
voie d'administration : intramusculaire ;
-
•
schéma vaccinal à 3 doses avec un intervalle de 2 mois entre la 1re et la 2e dose, et un intervalle de 4 mois entre la 2e et la 3e ;
-
•
âge : la recommandation Française (2007) concerne les jeunes filles à partir de 14 ans avant qu'elles ne soient exposées au risque de l'infection HPV et un rattrapage est proposé aux jeunes filles et jeunes femmes de 15 à 23 ans qui n'auraient pas eu de rapports sexuels ou au plus tard, dans l'année suivant le début de la vie sexuelle ;
-
•
tolérance : bonne, réaction locale et fièvre transitoire sont signalées ;
-
•
efficacité : le recul actuel (2011) est de 9 ans et montre une efficacité de 100 % sur le développement des lésions précancéreuses du col génital chez la femme.
Footnotes
CMU : couverture maladie universelle ; CMUc : CMU complémentaire ; AME : aide médicale de l'État.