Abstract
Hintergrund
Das klinische Wissen zu Verlauf, Komplikationen und Therapie von COVID-19 bei Kindern und Jugendlichen ist bisher begrenzt.
Ziel
Der vorliegende systematische Review fasst die aktuelle wissenschaftliche Evidenz zum klinischen Verlauf von COVID-19 bei hospitalisierten Kindern zusammen. Zusätzlich werden die ersten Daten aus Deutschland aus einem Kinderklinik-Survey der Deutschen Gesellschaft für Pädiatrische Infektiologie e. V. (DGPI) vorgestellt.
Methodik
Ausgewertet wurden insgesamt 12 Fallserien aus China mit 6 bis 2143 SARS-CoV-2-infizierten Kindern, die über eine PubMed-Literatursuche bis zum 31.03.2020 identifiziert wurden. Die Datenbank des deutschlandweiten COVID-19 Kinderklinik-Survey der DGPI wurde am 06.04.2020 abgefragt.
Ergebnisse
In den Fallserien lag das mediane Alter zwischen 2 und 7 Jahren, mit einem Anteil von Säuglingen von 18 bis 45 %. Am häufigsten berichtete Symptome waren Fieber und Husten; bei 40–100 % lag eine radiologisch (zumeist CT) bestätigte Lungenbeteiligung vor. Schwere/kritische Verläufe – inklusive 2 Todesfälle – wurden bei bis zu 8 % der Kinder berichtet. Die Hospitalisierungsdauer lag bei 5 bis 20 Tagen. Der COVID-19-Survey der DGPI erfasste bis zum 06.04.2020 33 Kinder aus 21 Kliniken, mit überwiegenden Infektionen der oberen Atemwege. 45 % waren Säuglinge, 32 % hatten eine Vorerkrankung. Bislang benötigten 3 Kinder (9 %) eine intensivstationäre Behandlung.
Diskussion
COVID-19 bei hospitalisierten Kindern und Jugendlichen verläuft überwiegend als unkomplizierte febrile Erkrankung der oberen oder der unteren Atemwege. Nur sehr selten kommt es bei Kindern zu schweren Komplikationen oder Todesfällen. Weitere Informationen zum Verlauf von COVID-19 bei Neugeborenen, Säuglingen und Patienten mit Vorerkrankungen sowie zu therapeutischen und präventiven Maßnahmen werden dringend benötigt.
Schlüsselwörter: Coronavirus, SARS-CoV‑2, Akute respiratorische Infektion, Pädiatrie, Pneumonie
Abstract
Background
The clinical knowledge about the course, complications and treatment of COVID-19 in children and adolescents is so far limited.
Aim
This systematic review summarizes the current scientific evidence regarding the clinical presentation of COVID-19 in hospitalized children based on available case series from China. In addition, first data from a nationwide pediatric hospital survey conducted by the German Society for Pediatric Infectious Diseases (DGPI) are presented.
Methods
This study evaluated 12 case series from China with 6–2143 children infected with SARS-CoV‑2, which were identified by a literature search in PubMed up to 31 March 2020. The database of the German nationwide DGPI COVID-19 survey was accessed on 6 April 2020.
Results
The median patient age in the case series was between 2 and 7 years and 18–45% were infants <1 year of age. The duration of hospital stay was 5–20 days. Most commonly reported symptoms were fever and cough; in 40–100% of cases involvement of the lower respiratory tract was reported, usually confirmed by computed tomography (CT). Severe and critical courses of disease were reported in up to 8% of the children including 2 fatalities. So far the German DGPI COVID-19 survey reported 33 hospitalized children up to 6 April 2020, mostly with upper airway infections. Of these children, 45% were infants and 32% had an underlying medical condition. So far 3 children (9%) needed admission to an intensive care unit.
Conclusion
COVID-19 in hospitalized children usually presented as an uncomplicated febrile upper airway infection or mild pneumonia. Severe cases or fatalities rarely occurred in children. Information on neonates and children with underlying chronic conditions as well as on therapeutic and preventive measures are urgently needed.
Keywords: Coronavirus, SARS-CoV‑2, Acute respiratory tract infection, Pediatric, Pneumonia
Einleitung
Bei Kindern scheinen COVID-19-Erkrankungen durch SARS-CoV‑2 insgesamt leichter zu verlaufen als bei Erwachsenen. Bislang gibt es nur wenige Veröffentlichungen zu klinischem Verlauf, Komplikationen und Therapie bei Kindern. Der vorliegende systematische Review zu Fallserien bei hospitalisierten Kindern gibt einen Überblick zum aktuellen Stand der wissenschaftlichen Evidenz, inklusive erster Daten aus Deutschland aus einem Krankenhaus-Survey der Deutschen Gesellschaft für Pädiatrische Infektiologie e. V. (DGPI).
Das neue Coronavirus SARS-CoV‑2 hat sich innerhalb weniger Wochen seit seinem ersten bekannten Auftreten in Wuhan/Hubei/China im Dezember 2019 in nahezu alle Länder verbreitet. Am 11.03.2020 deklarierte die WHO den Ausbruch als Pandemie. Laut dem European Centre for Disease Prevention and Control (ECDC) wurden mit dem Stand 02.04.2020 weltweit insgesamt 928.437 durch das Virus verursachte Erkrankungen („coronavirus disease 2019“, COVID-19) bestätigt, davon waren 46.891 Patienten verstorben (5,1 %) [11]. In Deutschland waren bis zu diesem Zeitpunkt 73.522 Fälle gemeldet, darunter 872 Todesfälle (1,2 %).
An COVID-19 erkranken zumeist erwachsene Patienten (≥95 %). Nach der aktuellen ECDC-Surveillance sind Fieber (47 %), trockener/produktiver Husten (25 %), Halsschmerzen (16 %), Abgeschlagenheit (6 %) und Schmerzen (5 %) die häufigsten Symptome [11]. Pulmonale Komplikationen, wie Bronchitis, Pneumonie und ARDS („acute respiratory distress syndrome“) sind vorwiegend bei Personen über 60 Jahre und Personen mit Grunderkrankungen beschrieben, darunter Patienten mit chronischen Lungen- und kardiovaskulären Erkrankungen, Hypertonie, Diabetes, kardialen und onkologischen Erkrankungen. Ca. 30 % der bislang bekannten COVID-19-Fälle in Europa wurden hospitalisiert. Bei ca. 4–14 % der Patienten nimmt die Krankheit einen schweren Verlauf; der Fall-Verstorbenen-Anteil (englisch „case-fatality rate“) in Europa liegt zwischen 0–9 % und in China bei 2,3 % [11, 31]. Die häufigsten Komplikationen bei verstorbenen Patienten waren respiratorische Insuffizienz/ARDS (97–100 %), akutes Nierenversagen (25–29 %), akute Myokardschädigungen (10–77 %) und bakterielle Superinfektionen/septischer Schock (9–100 %) [5, 11].
Der erste pädiatrische Nachweis einer SARS-CoV-2-Infektion erfolgte in China am 20.01.2020 bei einem 10-jährigen asymptomatischen Kind im Rahmen einer Untersuchung von familiärer Transmission [4]. Danach wurden zum klinischen Verlauf von hospitalisierten Kindern mit COVID-19-Infektion in rascher Folge Einzelfallberichte und Fallserien unterschiedlicher Größe v. a. aus China publiziert.
Insgesamt scheint das Erkrankungsbild von COVID-19 bei Kindern einen überwiegend leichten Verlauf zu zeigen [3, 22, 36], auch wenn vereinzelt Komplikationen besonders bei Patienten mit Risikofaktoren, wie z. B. kardialen, pulmonalen und immunologischen Grunderkrankungen, sowie bei Säuglingen berichtet wurden. Das Ziel des vorliegenden systematischen Reviews ist es, dem klinisch tätigen Pädiater eine Übersicht über den klinischen Verlauf, Komplikationen, Therapie und Prognose von COVID-19-Infektionen bei hospitalisierten Kindern anhand der bisher publizierten wissenschaftlichen Evidenz zu geben.
Methodik
Es wurde eine Literatursuche in PubMed zu den Stichworten „child/children/childhood/p(a)ediatric/p(a)ediatrician/pregnancy/neonate/baby/infant/adolescent“ AND „corona/coronavirus/CoV/nCoV/CoV2/SARS-CoV-2/Covid/COVID/COVID-19“ AND „2020“ durchgeführt (zuletzt am 31.03.2020). Referenzen relevanter Publikationen und Review-Artikel wurden manuell auf weitere relevante Artikel überprüft. Artikel wurden nur bei Vorliegen zumindest einer englischsprachigen Zusammenfassung berücksichtigt. Ein „Pre-print“-Artikel [23] ohne Peer Review wurde mitaufgenommen. Fallserien mit mehr als 5 hospitalisierten COVID-19-Patienten mit symptomatischer Infektion wurden eingeschlossen.
Demografische und klinische Daten wurden unabhängig von zwei der Verfasser extrahiert. Die Daten von 12 Fallserien wurden in Übersichtstabellen einzeln und für die 8 größten Studien zusammengefasst dargestellt. Falls der Anteil von Kindern mit Pneumonie von den Autoren nicht explizit ausgewiesen war, wurde der Nachweis von Veränderungen (milchglasartige bzw. fleckige Verschattungen sowie sonstige Auffälligkeiten) der Lunge in der Computertomographie (CT) sowie von Infiltraten in der Röntgenaufnahme als Kennzeichen einer Pneumonie gewertet. Die Einteilung des Schweregrades (asymptomatisch/mild/moderat/schwer/kritisch) beruhte zumeist auf den Angaben/Definitionen der jeweiligen Autoren; für Studien mit entsprechend verfügbaren Details wurde anhand der klinischen Angaben analog der Definition von Dong et al. [10] nachträglich eine Zuordnung vorgenommen (Kriterien: s. Legende zu Tab. 2). Die Normwertbereiche der jeweiligen lokalen Labore divergierten, daher wurde der jeweilige Anteil der Patienten mit abweichenden Laborwerten angegeben.
| Zusammenfassunga | Klinische Charakteristika | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor (Studiennr.) | Studiennr. (1)–(8) | Dong Y (1) | Lu X (2) | Ma H (3) | Qiu H (4) | Wang D (5) | Zheng F (6) | Xia W (7) | Cai J (8) | Zhou Y (9) | Wei M (10) | Sun D (11) | Liu W (12) |
| Patienten (n) | 10–2143 | 2143b | 171 | 50 | 36 | 31 | 25 | 20 | 10 | 9c | 9d | 8e | 6 |
| Symptome | |||||||||||||
| Fieber | 36–80 % | kA | 42 % | 64 % | 36 % | 65 % | 52 % | 60 % | 80 % | 44 % | 44 % | 75 % | 100 % |
| Husten | 19–65 % | kA | 49 % | 44 % | 19 % | 45 % | 44 % | 65 % | 60 % | 22 % | 22 % | 75 % | 100 % |
| Rhinitis | 8–40 % | kA | 8 % | 16 % | kA | kA | 8 % | 15 % | 40 % | 11 % | 11 % | kA | 17 % |
| Pharyngitis | 2–46 % | kA | 46 % | 2 % | 6 % | kA | kA | 5 % | 40 % | kA | kA | 13 % | 83 % |
| Diarrhö | 0–15 % | kA | 9 % | 6 % | 3 % | 9 % | 12 % | 15 % | 0 % | 0 % | kA | 38 % | 0 % |
| Erbrechen | 4–10 % | kA | 6 % | 4 % | 3 % | kA | 8 % | 10 % | kA | 0 % | kA | 50 % | 67 % |
| Tachy‑/Dyspnoe | 0–29 % | kA | 29 % | kA | 3 % | kA | 8 % | 10 % | 0 % | kA | kA | 100 % | 17 % |
| Abgeschlagenheit | 4–10 % | kA | 8 % | 4 % | kA | 10 % | kA | 5 % | kA | 0 % | kA | 13 % | 0 % |
| Pneumonie | 40–100 % | 45 % | 65 % | 86 %f | 53 % | 45 %f | 68 % | 100 %f | 40 %f | ≥89 % | kA | 100 % | 67 % |
| Schweregradg | |||||||||||||
| Asymptomatisch | 0–28 % | 4,4 %h | 16 % | 4 % | 28 % | 13 % | 0 % | kA | 0 % | kA | 11 % | – | 0 % |
| Mild | 10–60 % | 51 % | 19 % | 10 % | 19 % | 42 % | 32 % | kA | 60 % | kA | 22 % | – | 33 % |
| Moderat | 39–82 % | 39 % | 62 % | 82 % | 53 % | 45 % | 60 % | kA | 40 % | kA | kA | – | 50 % |
| Schwer | 0–5 % | 5 % | 1 %i | 0 % | 0 % | 0 % | 0 % | kA | 0 % | 0 % | 0 % | 63 % | 17 % |
| Kritisch | 0–8 % | 0,6 % | 0,6 % | 4 % | 0 % | 0 % | 8 % | kA | 0 % | 0 % | 0 % | 38 % | 0 % |
| Todesfälle (Alter/Geschl.) | 2 | 1 (14 J./männl.)j | 1 (10 M./weibl.)k | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Hospitalisierungs- bzw. Krankheitsdauer (Tage) | 5–23 | kA | kA | 5–19 |
10–20 7–22l |
7–23l | kA | 8–20 | 6–22l | – | kA | >9–>28m | 5–13 |
aZusammenfassende Angaben beziehen sich nur auf Studien ≥10 Patienten (Studiennr. 1–8)
bKlinisch-laborbestätigt: 731, klinisch-epidemiologisch: 1412
cNur Einschluss von Kindern ≤3 Jahren
dNur Einschluss von Kindern jünger als ein Jahr
eNur Einschluss von schwer/kritisch kranken Kindern
fAuffälligkeiten im Thorax-CT
gNach Definition des jeweiligen Autors bzw.: asymptomatisch ≙ keine klinischen Symptome/Zeichen und radiologischer Befund normal; mild ≙ Infektion der oberen Luftwege (IDOL); moderat ≙ (milde) Pneumonie; schwer ≙ intensivpflichtig/<92 %-Sauerstoffsättigung; kritisch ≙ Acute respiratory distress syndrome (ARDS), Sepsis, Multiorganversagen
hLaborbestätigt: 13 %, Verdachtsfälle: 0 %
i2 intensivstationär behandelte Patienten mit invasiver Beatmung
jTodesursache kA
kTodesursache Multiorganversagen
lKrankheitsdauer, definiert als Zeitspanne bis zum Vorliegen eines negativen Ergebnisses des Polymerase chain reaction (PCR)-Virusnachweises aus dem Rachenabstrich (Tage)
mKrankheitsdauer (Tage)
Zusätzlich wurden erste Daten zu stationär aufgenommenen Kindern aus Deutschland aus einem Survey der Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI) verfügbar (Stand 06.04.2020; COVID-19 Survey, https://dgpi.de) [9].
Resultate
Fallserien aus China
Ergebnisse der Literatursuche
Von 219 identifizierten Artikeln wurden nach Inspektion des Titels und des Abstract insgesamt 75 Artikel näher geprüft. Insgesamt wurden 12 Fallserien mit hospitalisierten Kindern und Jugendlichen (n = 6–2143) mit COVID-19 identifiziert, die alle aus China stammten.
Insgesamt 8 Studien enthielten Angaben zu 10 oder mehr hospitalisierten Kindern. Die Studie von Dong et al. [10] zu allen bei der nationalen chinesischen Meldebörde bis zum 08.02.2020 registrierten Kindern mit COVID-19 (n = 2143) enthielt sowohl hospitalisierte als auch ambulante betreute Kinder.
Die Fallserie von Liu et al. [19] beschreibt die ersten 6 aus Wuhan dokumentierten Fälle von COVID-19 bei Kindern. Drei kleinere Fallserien (8 bis 9 Patienten) bezogen sich auf Säuglinge [30], Säuglinge und Kleinkinder [35] und intensivstationär behandelte Kinder [28].
Sechs Studien stammten aus dem Wuhan Children’s Hospital [19, 21, 23, 28, 32] bzw. der entsprechenden Provinz Hubei [34], davon 5 aus annähernd demselben Zeitraum Mitte/Ende Januar bis ca. Mitte/Ende Februar [21, 23, 28, 32, 34]. Diese Studien zeigten teilweise Überschneidungen insbesondere in der Angabe von Kindern mit spezifischen Vorerkrankungen, Koinfektionen, schwer und kritisch kranken Kindern bzw. Todesfällen.
Demografische Daten, Inkubations- und Hospitalisierungsdauer, Vorerkrankungen
Insgesamt umfassten die 12 Studien 2518 Patienten aus dem gesamten pädiatrischen Altersspektrum. Bei den 8 Fallserien mit mindestens 10 hospitalisierten Kindern lag der Altersmedian im Bereich von 2 bis 7 Jahren. Der Anteil von Säuglingen unter einem Jahr war 18–45 %. Der Anteil der männlichen Kinder lag insgesamt bei 40–65 %, bei 27 Säuglingen (zusammengefasst aus 4 Studien) bei 41 % [2, 23, 28, 30].
In 2 Studien wird die Inkubationszeit bei Kindern mit 2 bis 10 Tagen angegeben, mit einem Median von 6 bis 7 Tagen [2, 28]. Die Hospitalisierungsdauer lag bei 5 bis 20 Tagen, bei intensivstationären Patienten bei bis zu über 28 Tagen [28].
Vorerkrankungen wurden bei 12 (12 %) von 98 Patienten in 6 Studien berichtet: 8 Kinder mit kardiologischer (davon 6 in der Studie von Xia et al. [32]), 2 Kinder mit hämatologisch-onkologischer [21, 28] und je ein Kind mit nephrologischer und neurologischer Vorerkrankung.
Übersicht: Tab. 1.
| Zusammenfassunga | Demographische Daten und Vorerkrankungen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor (Studiennr.) | Studiennr. (1)–(8) | Dong Y (1) | Lu X (2) | Ma H (3) | Qiu H (4) | Wang D (5) | Zheng F (6) | Xia W (7) | Cai J (8) | Zhou Y (9) | Wei M (10) | Sun D (11) | Liu W (12) |
| Publiziert | 16.03.2020 | 18.03.2020 | 12.03.2020 | 25.03.2020 | 02.03.2020 | 24.03.2020 | 05.03.2020 | 28.02.2020 | 22.03.2020 | 14.02.2020 | 19.03.2020 | 12.03.2020 | |
| Zeitschrift | – |
Pediatrics (accepted) |
N Eng J Med |
Lancet (pre-print) |
Lancet Infect Dis | Zhonghua Er Ke Za Zhi | Curr Med Sci | Pediatr Pulmonol | Clin Infect Dis | Zhongguo Dang Dai Er Ke Za Zhi | JAMA | World J Pediatr | N Engl J Med |
| Referenz | – | [10] | [21] | [23] | [26] | [29] | [34] | [32] | [2] | [35] | [30] | [28] | [19] |
| Region | China | China |
China, Wuhan |
China, Wuhan |
China, Zhejiang |
China |
China, Hubei |
China, Wuhan |
China, Shanghai |
China Shenzhen |
China |
China, Wuhan |
China, Wuhan |
| Setting | – | Stationär/ambulant | Stationär | Stationär | Stationär | Stationär | Stationär | Stationär | Stationär | Stationär (Säuglinge, Kleinkind) | Stationär (Säuglinge) |
Stationär (Intensivmedizin) |
Stationär |
| Anzahl der Kliniken | – | kA | 1 | 1 | 3 | 21 | 10 | 1 | 5 | kA | kA | 1 | 1 |
| Patienten (n) | 10–2143 | 2143b | 171 | 50 | 36 | 31 | 25 | 20 | 10 | 9c | 9d | 8e | 6 |
| Alter | |||||||||||||
| Median | 2 J–7 J | 7 J | 6,7 J | 2,5 J | kA | 7,1 J | 3 J | 2,1 J | 6,5 J | kA | 0,6 J | 5 J | 3 J |
| Durchschnitt | – | kA | kA | 4,4 J | 8,3 J | kA | kA | kA | 6,2 J | kA | kA | 6,8 J | kA |
| Bereich | 1 T–17 J | 1 T–17 J | 1 T–15 J | 0,1–14 J | 1–16 J | 6 M–17 J | 3 M–14 J | 1 T–14 J | 3 M–10 J | 0–3 J | 1–11 M | 2 M–15 J | 1–7 J |
| Altersgruppe | |||||||||||||
| <1 J | 18–45 % | 18 % | 18 % | 28 % | kA | kA | kA | 45 % | 20 % | kA | 100 % | 25 % | 0 % |
| 1–5 J | 20–38 % | 23 % | 23 % | 38 % | kA | kA | kA | kA | 20 % | kA | – | 25 % | 67 % |
| 6–10 J | 22–60 % | 24 % | 34 % | 22 % | kA | kA | kA | kA | 60 % | – | – | 12 % | 33 % |
| >10 J | 0–35 % | 35 % | 25 % | 12 % | kA | kA | kA | kA | 0 % | – | – | 38 % | 0 % |
| Geschlecht männlich | 40–65 % | 57 % | 61 % | 56 % | 64 % | kA | 56 % | 65 % | 40 % | kA | 22 % | 75 % | 33 % |
| Vorerkrankungen | – | kA | 2/3f | kAg | 0/36 | kA | 2/25h | 7/20i | kA | kA | kA | 1/8j | 0/6 |
aZusammenfassende Angaben beziehen sich nur auf Studien ≥10 Patienten (Studiennr. 1 bis 8)
bKlinisch-laborbestätigt: 731, klinisch-epidemiologisch: 1412
cNur Einschluss von Kindern ≤3 Jahren
dNur Einschluss von Kindern jünger als ein Jahr
eNur Einschluss von schwer/kritisch kranken Kindern
f168 von 171 keine Angabe (kA) zu Vorerkrankungen, nur Angaben zu 3 Intensivpatienten: davon ein Patient mit hämatoonkologischer Vorerkrankung, ein Patient mit nephrologischer Vorerkrankung, ein Patient ohne Vorerkrankung
gUnklar, ggf. 4 Pat. mit „cardiac damage“
hEin Patient von 25 kardiologische und metabolische Vorerkrankungen, ein Patient von 25 kardiologische Vorerkrankung
iSechs von 20 Patienten kardiologische Vorerkrankungen, einer von 20 neurologische Vorerkrankung
jEin Patient von 8 mit hämatoonkologischer Vorerkrankung
Klinische Charakteristika
Übersicht: Tab. 2.
Symptome.
Das häufigste Symptom war Fieber (36–80 %), mit einer mittleren Dauer von 2 bis 3 Tagen [2, 21, 26] und einem Bereich von einem bis 16 Tagen [21, 29]. Der Anteil der Kinder mit Fieber ≥38,5 °C lag bei 11–49 % [2, 26], mit hohem Fieber >39 °C bei 9 % [21]. Häufig waren auch (trockener) Husten (19–65 %), Rhinitis (8–40 %) und Pharyngitis (2–46 %). Eine Studie erfasste eine Tachykardie bei 42 % von 171 Kindern [21]. Bis zu 29 % zeigten eine Tachypnoe/Dyspnoe, 0–15 % gastrointestinale Symptome (Erbrechen, Diarrhö, Bauchschmerzen), 4–10 % Abgeschlagenheit und 4–8 % Kopfschmerzen [23, 26]. Bei Säuglingen und Kleinkindern wurden ebenfalls Fieber, Husten und Rhinitis als häufigste Symptome genannt [2, 23, 30, 35].
Pneumonie.
Eine Pneumonie bzw. ein Nachweis von Auffälligkeiten bzw. Verschattungen der Lunge im CT lag bei 40–100 % der Kinder vor. Davon zeigten 11–42 % kein Fieber oder Husten bzw. sonstige Symptome einer Infektion [21, 26].
In der Studie von Lu et al. [21] mit 111 Kindern mit Angabe einer Pneumonie waren in jeder pädiatrischen Altersgruppe (<1, 1–5, 6–10 und 11–15 J) zwischen 23 und 31 % betroffen. In der Studie von Zheng et al. [34] war der Anteil von Kindern mit abnormalem CT am höchsten bei Kindern unter 3 Jahren (8 von 10 Kindern <3 J), inklusive zweier kritisch erkrankter Kinder.
Eine Sauerstofftherapie war nur selten notwendig (0–17 %); eine invasive Beatmung auf Intensivstation erfolgte bei 0–8 % der Patienten.
Schweregrad.
Der Anteil asymptomatischer Patienten lag in den 5 größten Studien bei 4–28 %. Die Krankheit verlief bei 10–60 % der Kinder mild, vorwiegend als fieberhafte Erkrankung der oberen Atemwege. Mit 39–82 % am häufigsten war ein moderater Krankheitsverlauf mit leichter Pneumonie. Einen schweren oder sehr schweren Verlauf zeigten bis zu 5 % bzw. 8 % der hospitalisierten Kinder.
In der großen Studie von Dong et al. [10] mit 2143 Patienten waren 60 % der schwer bzw. 69 % der kritisch Erkrankten in der Altersgruppe unter 5 Jahren. 11 % der Säuglinge bzw. 7 % der Ein- bis 5‑Jährigen mit COVID-19 zeigten hier einen schweren bis sehr schweren Verlauf, im Vergleich zu 3–4 % bei älteren Kindern und Jugendlichen.
Intensivmedizinisch behandelte Patienten und Todesfälle.
Insgesamt liegen zu 11 intensivmedizinisch behandelten Kindern (Altersmedian 2 Jahre, Bereich 2 Monate bis 15 Jahre; 8 von 11 männlich) detaillierte Beschreibungen vor [19, 28, 34]. Darunter waren 3 Säuglinge jünger als ein Jahr, 4 Kleinkinder ≤3 Jahren und 4 Schulkinder. Bei 4 Kindern war eine Grunderkrankung bekannt, hierunter 2 Säuglinge mit angeborenen Herzfehlern, ein 8‑jähriger Junge mit akuter lymphatischer Leukämie und ein einjähriger Junge mit Hydronephrose [28, 34].
Die beiden kritischen Patienten mit angeborenen Herzfehlern zeigten Fieber, Dyspnoe und Husten (männl., 8 Mo.) bzw. Diarrhö (männl., ein J.) sowie radiologisch bilaterale Konsolidierungen in der Lunge. Im Verlauf entwickelten beide ein ARDS und mussten invasiv beatmet werden. Als zusätzliche Komplikationen wurden bei dem Einjährigen eine Hyponatriämie (Natrium 126 mmol/l) sowie ein dialysepflichtiges akutes Nierenversagen beschrieben [34].
Ein 3‑jähriges Mädchen mit schwerem Verlauf litt unter hohem Fieber (>39 °C) über 11 Tage, Husten, Tonsillitis, Erbrechen und Tachypnoe. Im CT-Bild des Thorax zeigten sich beidseits fleckige, milchglasartige Verschattungen [19].
Von den 8 intensivpflichtigen Kindern der Fallserie von Sun et al. [28] zeigten alle pulmonale Komplikationen mit ein- oder meist beidseitigen (6 von 8 Patienten) Auffälligkeiten in der Bildgebung (milchglasartige Verschattungen 6 von 8, fleckige Verschattungen 6 von 8, „white lung“ im Verlauf 1 von 8). Insgesamt 6 der 8 Kinder erhielten eine Sauerstofftherapie, 2 Kinder wurden zusätzlich invasiv beatmet. Zwei Patienten entwickelten ein septisches Geschehen bis zum septischen Schock mit Multiorganversagen, hierunter ein 13 Monate altes männliches Kleinkind mit Herzinsuffizienz, Koagulopathie, Nierensteinen und Hydronephrose [28], sowie ein im Verlauf verstorbenes 10 Monate altes Mädchen mit einer toxischen Enzephalopathie, Status epilepticus, disseminierter intravasaler Gerinnung und Invagination [21, 23, 28]. In der Arbeit von Dong et al. [10] wurde ein weiterer Todesfall eines 14-jährigen Jungen ohne weitere Informationen berichtet.
Diagnostik
Übersicht: Tab. 3.
| Zusammenfassunga | Diagnostik und Therapie | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor (Studiennr.) | Studiennr. (1)–(8) | Dong Y (1) | Lu X (2) | Ma H (3) | Qiu H (4) | Wang D (5) | Zheng F (6) | Xia W (7) | Cai J (8) | Zhou Y (9) | Wei M (10) | Sun D (11) | Liu W (12) |
| Patienten (n) | 10–2143 | 2143b | 171 | 50 | 36 | 31 | 25 | 20 | 10 | 9c | 9d | 8e | 6 |
| Virologie | – | RT-PCRf/gen. Sequenzierung | RT-PCRg | RT-PCRg | RT-PCRg | PCR |
PCR gen. Sequenzierung |
RT-PCRg | RT-PCRg | PCR | RT-PCRg | RT-PCRg | RT-PCRg |
| Radiologie | – | kA | Thorax-CT | Thorax-CT | Thorax-CT | Thorax-CT | Thorax-CT/-röntgen | Thorax-CT | Thoraxröntgen | Thorax-CT | kA | Thorax-CT/-röntgen | Thorax-CT (1 kA) |
| Milchglasartige Verschattungen | 29–60 % | kA | 33 % | 58 % | 53 % | 29 % | kA | 60 % | kA | 67 % | kA | 75 % | 17 % |
| Fleckige Verschattungenh | 31–67 % | kA |
19 % UL 12 % BL |
32 % UL 18 % BL |
kA | kA |
21 % ULi 46 % BL |
50 % | 40 % UL | 78 % | kA | 88 % | 50 % |
| Sonstige Auffälligkeiten | 0–35 % | kA | 1 % | 6 % | kA | 16 % | kA | 35 % | 0 % | 67 % | kA | 25 % | 0 % |
| Medikamentöse Therapie | |||||||||||||
| Antiviral | 0–48 % | kA | kA | 24 %j | 39 %k | kA | 48 %l | kA | 0 % | kA | kA | 100 %m | 100 %n |
| Interferon | 0–100 % | kA | kA | 86 % | 100 %o | kA | 48 % | kA | 0 % | kA | kA | 100 % | 0 % |
| AB-Therapie | 42–56 %p | kA | kA | 42 %p | kA | kA | 56 %p | kA | 50 %p | kA | kA | 63 %p | 100 %p |
| Glukokortikoide | 0–8 % | kA | kA | 0 % | kA | kA | 8 %q | kA | 0 % | kA | kA | 63 %q | 67 % |
| Immunglobuline, i.v. | 0–8 % | kA | kA | 8 % | kA | kA | 8 % | kA | 0 % | kA | kA | 50 % | 17 % |
| O2-Therapie | 0–17 % | kA | 2 % | kA | 17 % | 0 % | 8 % | kA | 0 % | kA | 0 % | 75 % | 17 % |
| Invas. Beatmung | 0–8 % | kA | 2 % | kA | 0 % | 0 % | 8 % | kA | 0 % | kA | 0 % | 25 % | k. A. |
aZusammenfassende Angaben beziehen sich nur auf Studien ≥10 Patienten (Studiennr. 1–8)
bKlinisch-laborbestätigt: 731, klinisch-epidemiologisch: 1412
cNur Einschluss von Kindern ≤3 Jahren
dNur Einschluss von Kindern jünger als ein Jahr
eNur Einschluss von schwer/kritisch kranken Kindern
fNasopharyngeal oder Rachenabstrich oder Blutprobe
gNasopharyngeal oder Rachenabstrich
hUL unilateral, BL bilateral
iSiehe Table 2 aus Zheng et al. [34], Zuordnung „bilateral patchy shadows“ aus Textangaben entnommen
jGanciclovir, Ribavirin, Oseltamivir
kLopinavir-Ritonavir
lUmifenovir (Arbidol), Oseltamivir, Lopinavir/Litonavir
mRibavirin, Oseltamivir, Interferon
nRibavirin 2 von 6 Patienten, Oseltamivir 6 von 6 Patienten
oInterferon‑α, inhalativ
pAB-Therapie explizit angegeben, bei Ma et al. [23] und Zheng et al. [34] auch bakterieller Erreger spezifiziert
qi.v.
Erregernachweise.
SARS-CoV‑2 wurde zumeist mittels Reverse-Transkriptase(RT)-PCR detektiert. Koinfektionen mit Influenzavirus (6), RSV (2), Zytomegalievirus (1), Mykoplasmen (12) sowie Enterobacter aerogenes wurden bei 12–40 % der Patienten aus 4 Studien beschrieben [23, 28, 32, 34].
SARS-CoV‑2 konnte in respiratorischen Kontrollabstrichen nach 6 bis 22 Tagen nicht mehr nachgewiesen werden. In einer Studie wurden auch Stuhlproben von 6 Kindern untersucht, bei einem der älteren Kinder (10 J.) war die Testung nach 10 Tagen negativ, aber bei 5 Kindern „viral shedding“ für mindestens 18 bis 30 Tage nachweisbar; Serum und Urinproben dieser 5 Patienten waren negativ [2].
Radiologie.
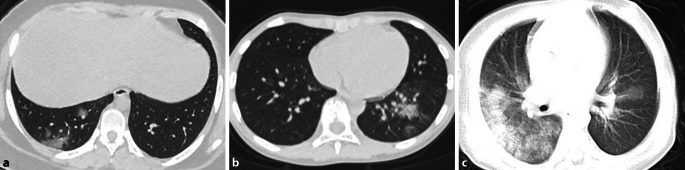
Die meisten Informationen liegen zu CT-Aufnahmen des Thorax vor. Typisches Zeichen der SARS-CoV-2-positiven Kinder in der CT-Diagnostik waren milchglasartige (29–60 %) und fleckige Verschattungen (gesamt 31–67 %; 19–40 % unilateral, 12–46 % bilateral). Bei bis zu 35 % der Kinder konnten weitere Auffälligkeiten in der CT-Bildgebung beschrieben werden: Konsolidierungen mit „halo sign“ (10 von 20 Patienten, bzw. 3 von 9), kleine Knötchen (3 von 20, bzw. 6 von 9), retikuläre Zeichnungsvermehrung (4 von 20) und Pleuraerguss (1 von 50) [21, 23, 32, 35]. Typische Aufnahmen zeigt Abb. 1 (aus Xia et al. [32]).
Nach Ma et al. [23] finden sich die COVID-19-assoziierten Verschattungen meist pleuranah (82 %) und in den Unterlappen (56 %). 12 von 15 Kindern zeigten bei Entlassung (im Durchschnitt nach 8 Tagen) noch radiologische Auffälligkeiten im Kontroll-CT des Thorax, trotz fehlender klinischer Symptome [23]. Eine weitere Studie wies ebenfalls pulmonale Auffälligkeiten (milchglasartige Verschattungen) bei 8 asymptomatischen von insgesamt 19 CT-untersuchten Kindern nach [26]. In der Studie von Xia et al. [32] waren ebenfalls noch CT-Auffälligkeiten nach Abklingen der klinischen Symptomatik und 2 negativen Virusnachweisen sichtbar.
Labor.
Übersicht: Tab. 4.
| Zusammenfassunga | Laborb | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor (Studiennr.) | Studiennr. (1)–(8) | Dong Y (1) | Lu X (2) | Ma H (3) | Qiu H (4) | Wang D (5) | Zheng F (6) | Xia W (7) | Cai J (8) | Zhou Y (9) | Wei M (10) | Sun D (11) | Liu W (12) |
| Patienten (n) | 10–2143 | 2143c | 171 | 50 | 36 | 31 | 25 | 20 | 10 | 9d | 9e | 8f | 6 |
| Leukozyten | |||||||||||||
| Leukozytose | 4–30 % | kA | kA | 4 % | kA | 10 %g | (50 % [1/2])h | 10 % | 30 % | 22 % | kA | 25 % | 0 % |
| Leukopenie | 6–38 % | kA | 26 % | 38 % | 19 % | 6 % | (0 % [0/2])h | 20 % | 10 % | 0 % | kA | 13 % | 67 % |
| Lymphozyten | |||||||||||||
| Lymphozytose | 8–20 % | kA | kA | 8 % | kA | 13 %g | kA | 15 % | 20 % | 67 % | kA | 25 % | 0 % |
| Lymphopenie | 0–40 % | kA | 4 % | 20 % | 31 % | 6 % | 40 % | 35 % | 0 % | 0 % | kA | 13 % | 100 % |
| Thrombozyten | |||||||||||||
| Thrombozytose | 6–20 % | kA | kA | 16 % | kA | 6 % | kA | kA | 20 % | kA | kA | 25 % | 0 % |
| Thrombopenie | 10–16 % | kA | kA | 16 % | kA | kA | kA | kA | 10 % | kA | kA | 13 % | 0 % |
| CRP erhöht | 3–35 % | kA | 20 % | 18 % | 3 % | 10 % (3/30) | (50 % [1/2])h | 35 %i | 30 % | kA | kA | 63 % | 83 % |
| PCT erhöht | 4–80 % | kA | 64 % | kA | 17 % | 4 % (1/28) | kA | 80 % | 10 % | kA | kA | 63 % | kA |
| BSG beschleunigt | 0–19 % | kA | kA | kA | 0 % | 19 % (4/21) | kA | kA | kA | kA | kA | kA | 40 % (2/5) |
| ALT erhöht | 6–25 % | kA | 12 % | kA | 6 % | 22 % (6/27) | kA | 25 % | 10 % | kA | kA | 50 % | 17 % |
| AST erhöht | 8–22 % | kA | 15 % | kA | 8 % | 22 % (6/27) | kA | kA | 20 % | kA | kA | 0 % | 67 % |
| CK erhöht | 3–15 % | kA | kA | kA | 3 % | 15 % (4/27) | (100 % [2/2])h | kA | kA | kA | kA | 25 % | 0 % |
| CK-MB erhöht | 25–50 % | kA | kA | kA | 31 % | kA | kA | 25 %i | 50 % | kA | kA | kA | kA |
| LDH erhöht | 30 % | kA | kA | kA | kA | kA | (100 % [2/2])h | kA | 30 % | kA | kA | 63 % | 33 % |
| D‑Dimere erhöht | 8–40 % | kA | 14 % | kA | 8 % | kA | kA | kA | 40 % (2/5) | kA | kA | 20 % (2/5) | 50 % |
CRP C-reaktives Protein, PCT Prokalzitonin, BSG Blutkörperchensenkungsgeschwindigkeit, ALT Alanin-Aminotransferase, AST Aspartat-Aminotransferase, CK Kreatinkinase, LDH Laktatdehydrogenase
aZusammenfassende Angaben beziehen sich nur auf Studien ≥10 Patienten (Studiennr. 1–8)
bGrenzwerte entsprechend den lokalen Laboren, wie in Originalarbeit angegeben
cKlinisch-laborbestätigt: 731, klinisch-epidemiologisch: 1412
dNur Einschluss von Kindern ≤3 Jahren
eNur Einschluss von Kindern jünger als ein Jahr
fNur Einschluss von schwer/kritisch kranken Kindern
gAus Henry et al. 2020 [12]
hLaborwerte nur für kritische Patienten vorhanden, nicht in Zusammenfassung eingeschlossen
iAus Table 2 von Xia et al. [32] entnommen (im Text von Xia et al davon abweichende Angaben)
In den 8 größeren Studien waren die absoluten Zahlen der Leukozyten, Lymphozyten sowie Thrombozyten bei der Mehrheit der Kinder normwertig. Leukozytose und Leukopenie wurden unabhängig vom Schweregrad bei 4–30 % bzw. 6–38 % beobachtet, eine Lymphopenie bei 0–40 % und eine Lymphozytose bei 8–20 %. Die Zahl der Thrombozyten war bei 6–20 % der Kinder erhöht und bei 10–16 % erniedrigt. Die Blutbildauffälligkeiten bei schwer und kritisch erkrankten Kindern waren vergleichbar [19, 28, 34].
Als Entzündungsparameter wurden C‑reaktives Protein (CRP in 9 von 12 Publikationen), Prokalzitonin (PCT in 6 von 12) und Blutkörperchensenkungsgeschwindigkeit (BSG in 3 von 12) berichtet. Das CRP war bei 3–35 % meist leicht erhöht, die BSG war bei bis zu 19 % der Kinder leicht erhöht. Prokalzitonin war je nach Fallserie bei 4–80 % der Kinder erhöht. CRP und PCT stiegen bei Kindern mit schweren und kritischen Verläufen z. T. deutlich an [19, 28, 34].
Eine leichtgradige Erhöhung der Transaminasenaktivität wurde bei 6–25 % (Alanin-Aminotransferase, ALT) und 8–22 % (Aspartat-Aminotransferase, AST) der Kinder beobachtet. Leichtgradige Erhöhungen der Kreatinkinase (CK) wurden in 4 Arbeiten bei 3–15 % der Kinder berichtet, sowie bei 36 % (4 von 11) aller Patienten auf Intensivstation. Ein im Verlauf verstorbener Säugling verzeichnete einen CK-Anstieg auf 20.702 U/l. Eine erhöhte, für die Herzmuskulatur spezifischere CK-MB wurde in 3 Arbeiten bei 25–50 % der Patienten angegeben. Ein Anstieg der Laktatdehydrogenase (LDH) (361–891 U/l) wurde bei 73 % (8 von 11) der Kinder mit schwereren Verläufen beobachtet [19, 28, 34]. D‑Dimer-Bestimmungen wurden in 5 Arbeiten angegeben und waren bei 8–40 % der Patienten sowie bei 50 % (3 von 6, [19, 28]) aller intensivpflichtigen Kinder erhöht. Neben überwiegend leichten Erhöhungen ist bei dem verstorbenen Säugling ein Anstieg der D‑Dimere auf bis zu 40,34 mg/l dokumentiert [21].
In der Studie von Qiu et al. [26] zeigten Kinder mit Pneumonie gegenüber Kindern mit asymptomatischer/milder Erkrankung häufiger eine Lymphozytopenie sowie Erhöhungen für Prokalzitonin, D‑Dimere und CK-MB.
Medikamentöse Therapie
Angaben zur symptomatischen, antiinflammatorischen und antiviralen Therapie sind nur teilweise vorhanden. In 3 der größeren Studien [23, 26, 34] erhielten 48–100 % der Patienten Interferon und 24–48 % antivirale Medikamente (Lopinavir/Ritonavir bzw. Litonavir, Ribavirin, Oseltamivir, Ganciclovir, Umifenovir). In 2 der Studien wurden Immunglobuline jeweils 8 % der Patienten verabreicht, in einer Studie Glukokortikoide (8 %). Eine antibiotische Therapie wurde 42–56 % der Kinder verabreicht. Die intensivmedizinisch behandelten Patienten bei Sun et al. [28] erhielten alle Oseltamivir, Ribavirin und Interferon, Antibiotika in 63 %, Glukokortikoide in 63 % und Immunglobuline i.v. in 50 %. Bewertungen zur Wirksamkeit der Behandlungen liegen nicht vor.
Hospitalisierungen in Deutschland (DGPI-Survey)
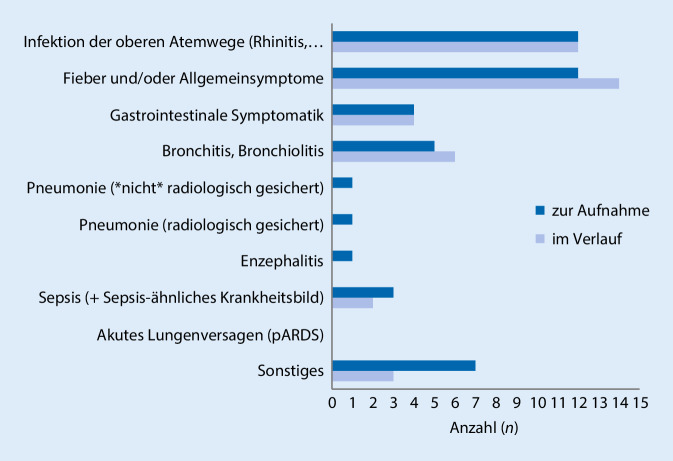
Seit dem 18.03.2020 werden im Survey der DGPI – in enger Kooperation mit DGKJ, VLKKD und vielen Konventgesellschaften – Fälle aus ganz Deutschland registriert. Im Zeitraum bis zum 06.04.2020 wurden dort Aufnahmen von 33 Kindern aus 21 Kliniken erfasst, davon 3 auf Intensivstation. Von den 33 Kindern waren 15 (45 %) Säuglinge (darunter 5 Neugeborene), 12 Kinder im Alter von einem bis 5 Jahren, ein Kind in der Altersgruppe von 6 bis 10 Jahren und 5 Kinder über 11 Jahren; 22 von 33 (67 %) waren weiblich. Die häufigsten Symptome waren Fieber und/oder Allgemeinsymptome (14 von 33; 42 %), Infektion der oberen Atemwege (12 von 33; 36 %) und gastrointestinale Symptome (4 von 33; 11 %). Eine Bronchitis/Bronchiolitis wurde bei 6 Kindern (18 %), Pneumonie bei 2 Kindern (6 %), Sepsis bei 3 (9 %) und Enzephalitis bei einem Kind (3 %) berichtet (Abb. 2). Von 22 Kindern mit verfügbaren Angaben hatten 7 (32 %) Kinder kardiale (3), pulmonale (4), neurologische (3) oder andere (6) Vorerkrankungen. Therapeutisch wurden eine Sauerstoffsupplementation bei 3 von 33 Kindern (9 %) sowie eine nichtinvasive Beatmung bei einem Kind durchgeführt (3 %). Medikamentös wurden inhalative Bronchodilatatoren (5; 15 %), systemische Antibiotika (7; 21 %), NSAID (3; 9 %) und systemische Steroide (2; 6 %) verabreicht. Bei einem Kind war eine Nierenersatztherapie/Dialyse erforderlich. Mit dem Stand zum 06.04.2020 waren 22 (67 %) der 33 gemeldeten Kinder bereits gesundet oder zeigten nur noch leichte Restsymptome.
Diskussion
Das neue Coronavirus SARS-CoV‑2 hat sich als pandemisches Virus innerhalb kurzer Zeit weltweit verbreitet und alle Altersgruppen erfasst. Auch wenn Morbidität und Letalität bei Patienten über 60 Jahren am höchsten sind, treten in Einzelfällen auch schwer verlaufende Infektionen im Kindes- und Jugendalter auf. In dem vorliegenden systematischen Review wurden die Daten von insgesamt 2518 Kindern mit SARS-CoV-2-Infektion aus 12 chinesischen Fallserien untersucht und hinsichtlich des Verlaufes bei hospitalisierten Kindern evaluiert. Für die Einschätzung von hospitalisierten Patienten, aber auch für die Vorbereitung auf das Management der Pandemie in der Pädiatrie ist es wertvoll, dass bereits 3 Monate nach Auftreten der ersten COVID-19-Erkrankungen publizierte Daten zur Verfügung stehen. Dennoch muss die vorliegende Evidenz für den klinischen Verlauf sowie die Diagnostik und Therapie von COVID-19 bei Kindern noch als begrenzt angesehen werden. Obwohl alle 12 Fallserien vorwiegend hospitalisierte Kinder eingeschlossen haben, sind sie in ihrem methodischen Aufbau, der Qualität der Datenerhebung, der Auswahl der Patientenuntergruppen und der Repräsentativität für die Pädiatrie sehr unterschiedlich. Daher müssen jeder Vergleich der Fallserien untereinander sowie jede Schlussfolgerung aus diesen Veröffentlichungen mit Vorsicht interpretiert werden.
Klinische Symptomatik und Verlauf
Nach derzeitigen Erkenntnissen infizieren sich Kinder und Jugendliche nicht seltener als Erwachsene mit SARS-CoV‑2, ihre Infektion scheint aber oft asymptomatisch oder oligosymptomatisch abzulaufen [22]. Die hier vorgestellten Fallserien bestätigen die früheren Beobachtungen, dass auch symptomatische Infektionen bei hospitalisierten Kindern generell weniger schwer und mit einer besseren Prognose als bei Erwachsenen verlaufen [11, 22, 26, 31, 36]. Typische Kennzeichen einer COVID-19-Infektion bei hospitalisierten Kindern waren Fieber und eine Infektionserkrankung der oberen Atemwege mit Rhinitis, Pharyngitis und Husten oder der unteren Atemwege mit Pneumonie und/oder Bronchitis. In einer Gegenüberstellung in der Studie von Ma et al. [23] zeigten die erkrankten Kinder ein ähnliches Spektrum an Symptomen wie Erwachsene, aber der Anteil der Patienten mit Fieber (64 % vs. 88 %), Husten (44 % vs. 68 %), Halsschmerzen (2 % vs. 14 %) und Abgeschlagenheit (4 % vs. 38 %) war bei Kindern deutlich niedriger. Zusätzlich berichten Qiu et al. [26] von einem selteneren Auftreten von Pneumonie (53 % vs. 95 %), von seltener erhöhtem CRP (3 % vs. 49 %) und von selteneren schweren Verläufen (0 % vs. 23 %). Intensivstationäre Behandlungen wurden bei Kindern selten berichtet [10, 28].
Bei Kindern <6 Jahre bestand jedoch ein etwas erhöhtes Risiko für einen schwereren Verlauf [10]. Die Wirksamkeit der häufig durchgeführten antiviralen und antiinflammatorischen Therapie ließ sich aufgrund der fehlenden Kontrollen nicht beurteilen. In Deutschland kam es seit dem 23.03.2020 zu einer deutlichen Zunahme der dem DGPI-Survey gemeldeten stationären Aufnahmen, mit einem Kind (KW 11) bzw. 14 (KW 12) SARS-CoV‑2 infizierten Kindern pro Woche mit überwiegend leichtem klinischen Verlauf [9].
Todesfälle im Kindes- und Jugendalter
In den hier untersuchten chinesischen Fallserien wurden insgesamt nur 2 Todesfälle berichtet [10, 21]. Weder im DGPI-Survey [9] noch durch das Robert Koch-Institut [27] wurde bis zum 06.04.2020 ein Todesfall bei Kindern gemeldet. Zum 03.04.2020 weisen die Meldestatistiken der italienischen Gesundheitsbehörde (Istituto Superiore di Sanità) [14] bei insgesamt 13.241 COVID-19-Verstorbenen einen Patienten im Alter unter 20 Jahren auf. In Spanien wurde am 05.04.2020 bei insgesamt 4709 Todesfällen von einem verstorbenen Patienten unter 10 Jahren sowie einem verstorbenen Patienten im Alter von 10 bis 19 Jahren berichtet [24]. In den USA wurde am 28.03.2020 der Tod eines Säuglings von der Gesundheitsbehörde von Illinois veröffentlicht [13]. Noch unbestätigte Pressemeldungen betrafen die Tode einer 16-Jährigen in Frankreich, eines 14-Jährigen in Portugal, eines 13-Jährigen aus Großbritannien und einer 12-Jährigen aus Belgien.
Neugeborene und Säuglinge
Zu COVID-19-Erkrankungen bei Neugeborenen gibt es bislang nur wenige Einzelfallberichte [15, 33]. In der Studie von Xia et al. [32] wurden 3 Neugeborene, in einem Review aus China 2 Neugeborenen mit COVID-19-Erkrankungen genannt [20], darunter ein 17 Tage alter Junge mit Fieber, Husten und Erbrechen (Infektion im Haushalt) und ein 5 Tage altes Kind mit Fieber (Mutter infiziert). Von Neugeborenen, die von COVID-19-erkrankten Müttern geboren wurden, ist bisher nur über ein infiziertes, aber asymptomatisches Kind berichtet worden [20]. Bislang gibt es keine Belege für eine vertikale Transmission von COVID-19 [16, 17, 25]. Interessanterweise waren im DGPI-Survey unter den ersten 26 stationären Aufnahme insgesamt 15 Säuglinge (45 %), darunter 5 im Neugeborenenalter unter 28 Tagen [9].
Ein weiblicher Säugling im Alter von 2 Monaten erkrankte an einer Pneumonie [7], darüber hinaus zeigen 2 kleinere chinesische Fallserien [30, 35] bei Säuglingen vorwiegend das Vorliegen von Infektionszeichen der oberen Atemwege. Die große vergleichende Studie von Dong et al. belegt jedoch insgesamt ein erhöhtes Risiko für einen schwereren Verlauf von COVID-19 im Säuglingsalter [10].
Kinder mit Vorerkrankungen
Insgesamt wurde nur von 12 Kindern mit Vorerkrankungen in den vorgestellten Fallserien berichtet. In den beiden größten Studien sind die Angaben dazu allerdings nicht [10] oder nur unvollständig [21] vorhanden, sodass von einem „underreporting“ auszugehen ist. Auffällig war die häufige Nennung kardiologischer Vorerkrankungen (8 von 12 Patienten), die jedoch lediglich aus 2 Fallserien gemeldet wurde, sodass hier möglicherweise ein zentrumsbedingtes „overreporting“ besteht [32, 34].
Bisher gibt es erstaunlich wenige Meldungen zu immunkompromittierten Kindern mit COVID-19. Bei dem in den Studien von Lu et al. [21] und Sun et al. [28] sowie in dem Fallbericht von Chen et al. [6] berichteten 8‑jährigen Jungen mit akuter lymphatischer Leukämie, chemotherapieassoziierter Granulozytopenie und COVID-19-assoziierter Pneumonie handelt es sich um denselben Patienten. Ein erster Bericht aus einem pädiatrischen Transplantationszentrum aus der Lombardei/Italien zu immunkompromittierten Patienten erwähnt 3 positiv auf SARS-CoV‑2 getestete Kinder, die jedoch keine Komplikation oder klinische Zeichen einer Lungenerkrankung aufwiesen [8].
Labor- und radiologische Diagnostik
Im Blutbild waren bei bis zu zwei Dritteln der hospitalisierten Kinder keine Auffälligkeiten nachweisbar. Bei den übrigen Kindern konnte kein eindeutiger Trend bezüglich der Erhöhung bzw. Erniedrigung der Leukozyten, Lymphozyten und Thrombozyten beobachtet werden. Auch bei schwer und kritisch erkrankten Kindern zeigte sich im Blutbild kein klarer Hinweis. Dies deckt sich mit der Übersichtsarbeit zu Laborwerten von 66 Kindern mit SARS-CoV-2-Infektion von Henry et al. [12]. Hingegen wurden in Studien bei Erwachsenen mit schweren Verläufen häufiger erhöhte Leukozyten- sowie erniedrigte Lymphozytenzahlen beschrieben [5, 18].
Deutliche Anstiege der LDH und der D‑Dimere wurden in einzelnen Studien bei bis zu der Hälfte der Kinder mit schweren Verläufen [21, 28, 34] sowie bei dem verstorbenen Säugling [21] beobachtet. Analog dazu wurden Erhöhungen der D‑Dimere in Erwachsenenstudien als Risikofaktor für schwere Verläufe identifiziert [5] und könnten als Hinweise auf thrombotische und ischämische Komplikationen im pulmonalen Gefäßbett interpretiert werden.
Bezüglich der bildgebenden Diagnostik ließen sich im CT des Thorax milchglasartige und fleckige Verschattungen als typische Zeichen der COVID-19-Pneumonie frühzeitig nachweisen, teilweise auch bei asymptomatischen und PCR-negativen Kindern [23, 32]. Die auffälligen Befunde fanden sich vorwiegend in den Unterlappen sowie in den pleuranahen, peripheren Lungenabschnitten. Die Indikation zu einer CT-Untersuchung sollte wie bei anderen Erkrankungen sehr kritisch gestellt werden, da es keine eindeutige Korrelation zum klinischen Verlauf gibt und somit nicht notwendigerweise therapeutische Konsequenzen abgeleitet werden können. Stets sollte die hohe Strahlenbelastung der Untersuchung bei der Indikationsstellung bedacht werden [1].
Vergleich COVID-19 zu anderen respiratorischen Viruserkrankungen
Einige Autoren evaluierten auch den Schweregrad von COVID-19 bei Kindern im Vergleich zu anderen viralen Erkrankungen anhand von Literaturangaben. Klinisch scheint das deutlich seltenere Auftreten von Halsschmerzen bzw. Pharyngitis ein mögliches Unterscheidungsmerkmal im Vergleich zu Influenza-A-H1N1 zu sein (3 % vs. 95 %) [26]. Nach Qiu et al. [26] kommt es zwar bei Kindern mit COVID-19 häufiger zu einer Pneumonie als bei Kindern mit Influenza-A-H1N1 (53 % vs. 11 %), jedoch sei der Anteil an schweren Verläufen deutlich seltener (0 % vs. 11 %). Auffällig bei COVID-19-Patienten war in dieser Studie auch eine Erhöhung der myokardialen Enzyme (31 % vs. 11 %) [26]. Gegenüber anderen epidemisch auftretenden Coronaviren wie SARS-CoV und MERS-CoV scheint eine Infektion mit SARS-CoV‑2 in der Regel deutlich weniger schwer zu verlaufen [26, 36].
Limitationen
Insgesamt waren die Fallserien von sehr heterogener Qualität. Angaben insbesondere zu Vorerkrankungen und Medikation sind nur teilweise vorhanden. Vor allem in der Anfangsphase der Epidemie ist davon auszugehen, dass möglicherweise ein Teil der Kinder primär zur Diagnostik/Isolierung und nicht aufgrund von COVID-19-Symptomen hospitalisiert wurde. Darauf weisen die Angabe von „asymptomatischen“ Kindern und der z. T. hohe Anteil an „milden“ Infektionen in den Fallserien hin. Die Nennung vermutlich z. T. derselben Patienten mit Vorerkrankung, Koinfektionen und kritischen Verläufen in verschiedenen Studien erschwert zudem die Einschätzung deren tatsächlicher Häufigkeit. Die z. T. auch mit antiviralen Medikamenten durchgeführten Therapieversuche lassen aufgrund fehlender Kontrollen keinen Rückschluss auf ihre Wirksamkeit zu.
Ausblick
Die dargestellten Daten aus Fallserien zu insgesamt 2518 Kindern mit COVID-19 aus China zeigen bei hospitalisierten Kindern einen in der Regel milderen Verlauf als bei Erwachsenen. Schwere und kritische Verläufe bei Kindern und Jugendlichen wurden bisher auch bei Risikogruppen nur selten berichtet, auch wenn Säuglinge und Kleinkinder hierfür ein insgesamt leicht erhöhtes Risiko aufweisen. Inwiefern eine Erhöhung der LDH und der D‑Dimere oder andere Laborparameter bzw. Biomarker mit einem schwereren Verlauf assoziiert sind, muss weiter untersucht werden. Aufgrund der verfügbaren Daten erscheint eine Therapie mit antiviralen und/oder antiinflammatorischen Medikamenten derzeit allenfalls als Heilversuch in Ausnahmefällen indiziert. Weitere möglichst populationsbezogene Daten sowie Daten zu Risikopatienten werden dringend benötigt, um das neue Krankheitsbild COVID-19 bei Kindern einordnen und mögliche präventive wie therapeutische Maßnahmen möglichst effizient und sicher anwenden zu können.
Fazit für die Praxis
In der Pädiatrie ist von einer hohen Anzahl von oligosymptomatischen und asymptomatischen Kindern mit SARS-CoV-2-Infektion auszugehen.
Bei hospitalisierten Kindern mit COVID-19 überwiegen leichte bis moderate Verläufe, oft als leichte Pneumonie. Todesfälle sind sehr selten.
Säuglinge und Kleinkinder sind häufiger von COVID-19-Hospitalisierungen betroffen. Vereinzelt werden schwere Verläufe berichtet.
Die Datenlage zu Risikogruppen, Laborparametern und Therapie ist bislang begrenzt.
Weitere Erhebungen sind dringend erforderlich, insbesondere ergibt sich über die Beteiligung aller Kinderkliniken am DGPI COVID-19-Survey die Möglichkeit, innerhalb kurzer Zeit die in Deutschland verfügbaren Daten zu erfassen und zugänglich zu machen (https://dgpi.de/).
Einhaltung ethischer Richtlinien
Interessenkonflikt
A. Streng, K. Hartmann, J. Armann, R. Berner und J. Liese geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Antoch G, Urbach H, Mentzel HJ. SARS-CoV-2/COVID-19: Empfehlungen für die Radiologische Versorgung. Fortschr Röntgenstr. 2020 doi: 10.1055/a-1149-3625. [DOI] [PubMed] [Google Scholar]
- 2.Cai J, Xu L, Lin D, et al. A case series of children with 2019 novel coronavirus infection: clinical and epidemiological features. Clin Infect Dis. 2020 doi: 10.1093/cid/ciaa198. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Cao Q, Chen Y-C, Chen C-L, et al. SARS-CoV-2 infection in children: transmission dynamics and clinical characteristics. J Formos Med Assoc. 2020;119:670–673. doi: 10.1016/j.jfma.2020.02.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Chan JF, Yuan S, Kok KH, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020;395:514–523. doi: 10.1016/S0140-6736(20)30154-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Chen T, Wu D, Chen H, et al. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study. BMJ. 2020;368:m1091. doi: 10.1136/bmj.m1091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Chen Z, Xiong H, Li JX, et al. COVID-19 with post-chemotherapy agranulocytosis in childhood acute leukemia: a case report. Zhonghua Xue Ye Xue Za Zhi. 2020;41(0):E4. doi: 10.3760/cma.j.issn.0253-2727.2020.0004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cui Y, Tian Mm Huang D, et al. A 55-day-old female infant infected with COVID 19: presenting with pneumonia, liver injury, and heart damage. J Infect Dis. 2020 doi: 10.1093/infdis/jiaa113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.D’Antiga L. Coronaviruses and immunosuppressed patients. The facts during the third epidemic. Liver Transpl. 2020 doi: 10.1002/LT.25756. [DOI] [PubMed] [Google Scholar]
- 9.DGPI https://dgpi.de. Zugegriffen: 6. Apr. 2020
- 10.Dong Y, Mo X, Hu Y, et al. Epidemiological characteristics of 2143 pediatric patients with 2019 coronavirus disease in China. Pediatrics. 2020 doi: 10.1542/peds.2020-0702. [DOI] [PubMed] [Google Scholar]
- 11.ECDC http://www.ecdc.europa.eu/en. Zugegriffen: 3. Apr. 2020
- 12.Henry BM, Lippi G, Plebani M. Laboratory abnormalities in children with novel coronavirus disease 2019. Clin Chem Lab Med. 2020 doi: 10.1515/cclm-2020-0272. [DOI] [PubMed] [Google Scholar]
- 13.Illinois Department of Public Health (2020) Public health officials announce the first death of an infant with coronavirus disease. http://dph.illinois.gov/news/public-health-officials-announce-first-death-infant-coronavirus-disease. Zugegriffen: 5. Apr. 2020
- 14.Istituto Superiore di Sanità https://www.epicentro.iss.it/coronavirus/bollettino/Infografica_3aprile%20ENG.pdf. Zugegriffen: 4. Apr. 2020
- 15.Kamali Aghdam M, Jafari N, Eftekhari K. Novel coronavirus in a 15-day-old neonate with clinical signs of sepsis, a case report. Infect Dis (Lond) 2020;1:1–3. doi: 10.1080/23744235.2020.1747634. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Karimi-Zarchi M, Neamatzadeh H, Dastgheib SA, et al. Vertical transmission of coronavirus disease 19 (COVID-19) from infected pregnant mothers to neonates: a review. Fetal Pediatr Pathol. 2020;2:1–5. doi: 10.1080/15513815.2020.1745970. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Li Y, Zhao R, Zheng S, et al. Lack of vertical transmission of severe acute respiratory syndrome coronavirus 2, China. Emerg Infect Dis. 2020 doi: 10.3201/eid2606.200287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Lippi G, Plebani M. Laboratory abnormalities in patients with COVID-2019 infection. Clin Chem Lab Med. 2020 doi: 10.1515/cclm-2020-0198. [DOI] [PubMed] [Google Scholar]
- 19.Liu W, Zhang Q, Chen J, et al. Detection of COVID-19 in children in early January 2020 in Wuhan, China. Engl J Med. 2020 doi: 10.1056/NEJMc2003717. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Lu Q, Shi Y. Coronavirus disease (COVID-19) and neonate: What neonatologists need to know. J Med Virol. J Med Virol. 2020 doi: 10.1002/jmv.25740. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Lu X, Zhang L, Du H, et al. SARS-CoV‑2 infection in children. N. Engl J Med. 2020 doi: 10.1056/NEJMc2005073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Ludvigsson JF. Systematic review of COVID-19 in children show milder cases and a better prognosis than adults. Acta Paediatr. 2020 doi: 10.1111/APA.15270. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Ma H, Hu J, Tian J, et al. Visualizing the novel coronavirus (COVID-19) in children: what we learn from patients at Wuhan children’s hospital. SSRN Journal. 2020 doi: 10.2139/ssrn.3550012. [DOI] [Google Scholar]
- 24.Ministerio De Sanidad Gobierno de España (2020) Actualización nº 65. Enfermedad por el coronavirus (COVID-19). 04.04.2020 (datos consolidados a las 21:00 horas del 03.04.2020). https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/Actualizacion_65_COVID-19.pdf. Zugegriffen: 5. Apr. 2020
- 25.Mullins E, Evans D, Viner RN, et al. Coronavirus in pregnancy and delivery: rapid review. Ultrasound Obstet Gynecol. 2020 doi: 10.1002/uog.22014. [DOI] [PubMed] [Google Scholar]
- 26.Qiu H, Wu J, Hong L, et al. Clinical and epidemiological features of 36 children with coronaviorus disease 2019 (COVID-19) in Zhejiang, China: an observational cohort study. Lancet Infect Dis. 2020 doi: 10.1016/S1473-3099(20)30198-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Robert Koch-Institut (2020) Täglicher Lagebericht des RKI zur Coronavirus-Krankheit-2019 (COVID-19). https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/2020-04-02-de.pdf?__blob=publicationFile. Zugegriffen: 5. Apr. 2020
- 28.Sun D, Li H, Lu XX, et al. Clinical features of severe pediatric patients with coronavirus disease 2019 in Wuhan: a single center’s observational study. World J Pediatr. 2020 doi: 10.1007/s12519-020-00354-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Wang D, Ju XL, Xie F, et al. Clinical analysis of 31 cases of 2019 novel coronavirus infection in children from six provinces [autonomous region] of northern China. Zhonghua Er Ke Za Zhi. 2020;58(4):E011. doi: 10.3760/cma.j.cn112140-20200225-00138. [DOI] [PubMed] [Google Scholar]
- 30.Wei M, Yuan J, Liu Y, et al. Novel coronavirus infection in hospitalized infants under 1 year of age in China. JAMA. 2020 doi: 10.1001/jama.2020.2131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese center for disease control and prevention. JAMA. 2020 doi: 10.1001/jama.2020.2648. [DOI] [PubMed] [Google Scholar]
- 32.Xia W, Shao J, Guo Y, et al. Clinical and CT features in pediatric patients with COVID-19 infection: different points from adults. Pediatr Pulmonol. 2020 doi: 10.1002/ppul.24718. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Zeng LK, Tao XW, Yuan WH, et al. First case of neonate infected with novel coronavirus pneumonia in China. Zhonghua Er Ke Za Zhi. 2020 doi: 10.3760/cma.j.issn.0578-1310.2020.0009. [DOI] [PubMed] [Google Scholar]
- 34.Zheng F, Liao C, Fan QH, et al. Clinical characteristics of children with coronavirus disease 2019 in Hubei. China. Curr Med Sci. 2020;40(2):1–6. doi: 10.1007/s11596-020-2172-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Zhou Y, Yang GD, Feng K, et al. Clinical features and chest CT findings of coronavirus disease 2019 in infants and young children. Zhongguo Dang Dai Er Ke Za Zhi. 2020;22(3):215–220. doi: 10.7499/j.issn.1008-8830.2020.03.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Zimmermann P, Curtis N. Coronavirus infections in children including COVID-19. An overview of the epidemiology, clinical features, diagnosis, treatment and prevention options in children. Pediatr Infect Dis J. 2020 doi: 10.1097/INF.0000000000002660. [DOI] [PMC free article] [PubMed] [Google Scholar]