5.1. Persönliche Hygiene von Patient und Personal
Axel Kramer, Sylvia Ryll und Christoph Aspöck
Alle unmittelbar und mittelbar gesundheitsrelevanten Verhaltensweisen des Menschen in seiner Selbstverantwortung für Gesundheit, Leistungsfähigkeit sowie körperliches und seelisches Wohlbefinden werden als Anliegen der Primärprävention zur Individualhygiene gerechnet.
Der Weltgesundheitstag vom 7. April 1983 stand unter dem Motto „Gesundheit für alle – Aufgabe für jeden“. Die damit verbundenen Appelle, sich bewusst um die eigene Gesundheit zu kümmern, begründen sich in der Erkenntnis, dass die sog. Zivilisationskrankheiten einschließlich Tumoren und Infektionskrankheiten meist multifaktoriell entstehen und zumindest teilweise durch die Lebensweise mitbestimmt werden. Das betrifft auch die Einflussnahme auf den Genesungsprozess hospitalisierter Patienten (Kap. 8.5) und dessen Schutz vor NI. Der Patient erwartet für seine Betreuung gepflegte, gesunde Mitarbeiter.
5.1.1. Bettlägeriger Patient
Menschliche Zuwendung vermag in Verbindung mit individueller Betreuung dem Patienten die Kraft zu geben, die Krankheit zu überwinden oder sie zumindest zu ertragen.
Die verständnisvolle Zuwendung zu Persönlichkeit des Patienten, seinen Ängsten und Genesungsaussichten helfen ihm in Ergänzung zur eigentlichen Therapie bei der Krankheitsbewältigung. Hieraus ergibt sich eine der schönsten und dankbarsten Aufgaben für alle im Gesundheitswesen Tätigen: die Betreuung des Patienten im umfassenden Anspruch zu Wiederherstellung der Gesundheit, Erhalt der Leistungsfähigkeit und Förderung des physischen, psychischen und sozialen Wohlbefindens.
Bei stationärer Behandlung hat der Patient die meisten Kontakte mit dem Pflegeteam. Ihm vertraut er vielfach seine Probleme, Hoffnungen, Wünsche, u. U. seine Lebensgeschichte an. Er erhofft sich warmherzige Zuwendung, Beratung und Pflege. Durch die Vertrauensstellung vermag das Pflegeteam auf den Heilungsprozess und die Persönlichkeit des Patienten Einfluss zu nehmen, nicht mit erhobenem Zeigefinger, sondern sozusagen im Vorübergehen. Die Einflussnahme kann sich auf Körperhygiene, Ernährung einschließlich der Aufklärung vor Missbrauch von Genussmitteln, körperliche Aktivität sowie das richtige Verhältnis zum Arzneimittel und zur Krankheit erstrecken. Im günstigsten Fall vermag das Team dem Patienten gedanklich Wege zu eröffnen, die Krankheit zu überwinden, mit dem Leiden, wenn es sich um eine chronische Erkrankung handelt, zu leben bzw. Beistand im Prozess des Sterbens zu erhalten.
Zur Anregung gesundheitsfördernder Verhaltensweisen sind die Vorbildwirkung des einzelnen Mitarbeiters sowie das Erscheinungsbild und der Hygienestatus der Einrichtung wichtige Einflussgrößen, aber auch gesunde angepasste Patientenverpflegung kann zum Nachdenken über gesunde Ernährung beitragen.
Das betrifft z. B. das Frühstück- und Abendessenangebot, die Möglichkeit von Wahlessen einschließlich spezieller Diäten für die Mittagsmahlzeit und die Beratung bei der Essenauswahl.
Eine ruhige, besonnene Arbeitsatmosphäre gibt dem Patienten das Gefühl der Geborgenheit und erleichtert ihm die Anpassung an einen gesundheitsfördernden Tagesrhythmus.
Zur Dispositionsprophylaxe gehören ebenso der Schutz vor physikalischen und chemischen Umgebungsfaktoren (Kap. 9.8, Kap. 9.9), behagliches Raumklima, Innenausstattung und Beleuchtung (Kap. 9.7).
Körperreinigung und -pflege
Individuelles Sauberkeitsverhalten lässt sich nicht in Normen und Vorschriften festschreiben.
Die Einstellung zur Sauberkeit wird im Wesentlichen durch Einflüsse der Erziehung, Tradition und das soziale Umfeld geprägt und unterliegt in der weiteren Entwicklung geschlechts- und berufsspezifischen Einflüssen bis hin zu Modetrends. Bei den aufgeführten Empfehlungen zur Körperhygiene (Tab. 5.1 ) ist zu berücksichtigen, dass aufgrund starken Schwitzens einerseits, hingegen geringerer Verschmutzung andererseits der Rhythmus im Krankenhaus abweichen kann.
Tab. 5.1.
Empfehlungen zur Körperhygiene .Vorsorge:arbeitsmedizinische\"\r\"ArbeitsmedVorsKörperhygiene, Empfehlungen
| Maßnahme | Rhythmus |
|---|---|
| Ganzkörperbad | Wöchentlich |
| Duschen oder Körperwaschung | Täglich |
| Waschung Rima ani | Morgens und abends, u. U. auch zwischenzeitlich |
| Zähneputzen | Morgens, abends (mindestens je 2 Minuten) |
| Haarwäsche | 1- bis 2-mal/Woche |
| Händewaschen | Vor dem Essen, nach Toilettenbenutzung, nach Verschmutzung |
| Eincremen des Körpers | Nach jedem Duschen |
| Gesichtspflege: | |
|
Nach morgendlicher Reinigung |
|
Nach abendlicher Reinigung |
| Anwendung dermatologischer Salbe | Bei Wundsein bzw. individuellem Bedürfnis |
| Wechsel Unterwäsche, Strümpfe | Täglich |
| Wechsel Hemden, Blusen | Täglich bis jeden 2. Tag |
| Wechsel Pyjama | Wöchentlich1 |
| Bettbezug, Bettlaken, Kopfkissen | Mindestens alle 2 Wochen1 |
Häufiger bei starkem Schwitzen, nach Durchfeuchtung oder während antiseptischer Sanierung (Kap. 5.1, Kap. 6.2).
(abgeleitet aus Untersuchungen von Bergler 1973, 1989 und Kramer et al. 1993)
Hände: Zur Hautreinigung sind Seifen auf Tensidbasis zu bevorzugen (Tab. 5.2 ).
Tab. 5.2.
Wirkung von Alkali- und Tensidseifen auf die Haut.Tensidseifen, WirkungAlkaliseifen, Wirkung
| Wirkung | Alkaliseifen | Tensidseifen |
|---|---|---|
| Kalkseifenbildung | Ja | Nein |
| Quellung | Ausgeprägt | Gering |
| Austrocknung | Mäßig | Gering bis mäßig (abhängig von rückfettenden Zusätzen) |
| Entfettung | Ausgeprägt | |
| Verschiebung des Haut-pH-Werts zum Alkalischen | Je nach Expositionsdauer mäßig bis stark | Nein |
| Alkalineutralisationsvermögen | Deutlich verzögert | Wenig verzögert |
| Haut-pH-Regeneration | Stark beeinträchtigt | Kaum beeinflusst |
| Spreitung | Nein | Möglich |
(nach Kramer et al. 1973)
Obwohl die Händedesinfektion signifikant wirksamer ist als Händewaschung (Kap. 2.1), was sich selbst außerhalb des Krankenhauses epidemiologisch nachweisen lässt (Hübner et al. 2010), wird durch Waschen mit Wasser und Seife mit der Ablösung der Schmutzpartikel zugleich ein großer Teil der transienten Flora, aber nur ein geringerer Teil der residenten Flora entfernt. Bei Virusgrippe ist durch Händewaschung eine Schutzwirkung erreichbar (Eggers et al. 2009), bzw. es war kein zusätzlicher Effekt der Händedesinfektion nachweisbar (Hübner et al. 2010). Allerdings ist die Seifenwaschung deutlich aggressiver als die Händedesinfektion (Kap. 5.20). Durch Abspülen mit Wasser und Abtrocknen wird die Keimzahlverminderung noch verbessert (Schmidt und Kramer 1996). Bei Trocknung mit Heißluft dauert der Trocknungsvorgang lange und belässt im Vergleich zur Handtuchanwendung eine höhere Restfeuchte auf der Haut, sodass ihre Mazeration begünstigt wird. Außerdem fehlt die mechanische Komponente des Abtrocknens, die zum Entfernen zurückgebliebener Anschmutzung, Seifenreste und Mikroorganismen beiträgt.
Körperwaschung: Das Pflegeteam kann auf die Motivierung des Patienten zur Körperhygiene mit Takt und Einfühlungsvermögen Einfluss nehmen. Baden, Duschen oder Waschen wirken nicht nur reinigend, sondern auch wohltuend und durch Kreislaufanregung belebend, was vor allem für geriatrische Patienten erwünscht ist. Wegen der mit dem Baden verbundenen Kreislaufbelastung sollten betagte Patienten nicht länger als 20 Minuten und nicht zu heiß (37–38 °C) gebadet werden. Es ist die Verwendung hautschonender, rückfettender Badezusätze zu empfehlen. Stark schäumende Badezusätze sind ungeeignet. Das Zusammenspiel von warmem Wasser, oberflächenaktiven Substanzen und längerer Einwirkzeit begünstigt durch Aufquellen der Haut mit Rhagadenbildung beim Abtrocknen den Eintritt von Infektionserregern, weshalb Dusch-, Sitz- und Halbbad dem Vollbad im Alter vorzuziehen sind. Werden Bad oder Dusche von mehreren Heimbewohnern benutzt, ist die Nasszelle nach jedem Gebrauch desinfizierend zu reinigen. In Einrichtungen der Altenpflege wird z. T. ein Badeplan erstellt, der festlegt, wer wann badet. Diese Badepläne machen das Dilemma der Altenpflege in Heimen deutlich: Auf der einen Seite sind sie unumgänglich, wenn jeder Bewohner ein sauberes Bad vorfinden will, auf der anderen Seite beschneiden sie die Freiheit gerade der jüngeren, mobilen Bewohner.
Intimhygiene: Das Bewusstsein für die Wichtigkeit der Intimhygiene ist bei Männern schwächer ausgeprägt als bei Frauen. Dabei besteht für Männer eine besondere Verpflichtung, da ein Zusammenhang von Smegma und der Entstehung des Zervixkarzinoms diskutiert wird. Bei der Intimhygiene, Patient, bettlägerigerIntimhygiene soll auf antimikrobielle Substanzen verzichtet werden, da die physiologische Schleimhautflora gestört werden kann.
Bei der Wöchnerin ist die Intimhygiene besonders wichtig; 24 Stunden nach der Entbindung sollten sich die Patientinnen mehrmals täglich spülen bzw. bei Bettlägerigkeit gespült werden, auch bei Dammnähten und Episiotomien. Dadurch werden Verkrustungen und Verklebungen vermieden und einer mikrobiellen Kolonisation durch Krankheitserreger entgegengewirkt. Etwa 4–6 Wochen post partum kann die normale Reinigung z. B. mit Intimwaschlotionen begonnen werden. Stillende reinigen sich die Brüste mehrmals täglich mit einer Handdusche; durch die Massagewirkung wird zugleich das Gewebe gekräftigt und die Milchsekretion angeregt (Seidenschnur 1988).
Nasenpflege: Bei Patienten mit eitrigem oder serösem Schnupfen sind die Benutzung von Einmalmaterialien und deren hygienische Abwurfmöglichkeit zu gewährleisten. Bei Gefahr oder ersten Anzeichen von Wundwerden im Bereich der Naseneingänge sind dem Patienten Wundheilsalbe oder pflegende Öle Nasenpflege, Patient:bettlägerigerzur Verfügung zu stellen.
Reinigen der Fingernägel (Maniküre): Die Maniküre umfasst das kurzeitige Baden der Hände in warmem Wasser, damit die Nägel weicher werden und sich leichter schneiden lassen, das Schneiden und/oder ggf. Feilen der Fingernägel und das Maniküre, Patient, bettlägerigerabschließende Eincremen der Hände. Beim Schneiden der Fingernägel ist darauf zu achten, dass die umliegende Haut und das Nagelbett nicht verletzt werden.
Mund- und Zahnpflege: Hier ist der Zusammenhang zwischen Verhalten und Krankheitsverhütung evident.
Gesunde Ernährung sowie regelmäßige Entfernung von Speiseresten und Plaque sind maßgebliche Faktoren zur Verhinderung von Parodontopathien und Karies.
Die Empfehlung, die Zähne nach jeder Mahlzeit zu putzen, wird leider nicht konsequent umgesetzt. Selbst die praktikable Norm, morgens und abends die Zähne zu putzen, ist nicht Zahnpflege, Patient(en):bettlägerigerdurchgehend Allgemeingut. Mit Trainingsprogrammen in Kindergärten und Schulen können Häufigkeit und Putztechnik mit positiver Auswirkung auf die Mundhygiene eingeübt werden. Dazu bedarf es der adäquaten Zahnbürste (möglichst elektrisch), die bei regelmäßigem Gebrauch nach 8–12 Wochen erneuert werden soll, sowie Zahnseide und Zahnbürstchen unterschiedlicher Stärke für den Zahnzwischenraum. Durch im Borstenbereich abgewinkelte Bürsten kann die Reinigung der hinteren Molaren erleichtert werden.
Für die Dauer eines Klinikaufenthalts sollten neue Zahnbürsten benutzt werden, um mögliche Infektionsketten vom häuslichen Milieu in die Klinik und umgekehrt zu unterbrechen. Zahnbürsten sind mit dem Bürstenteil nach oben aufzustellen.
Die Zahnreinigung kann durch antiseptische Mundspülung sinnvoll ergänzt werden (Kap. 5.18.4).
Wegen der erhöhten Kariesgefährdung in der Schwangerschaft und bei Erkrankungen mit veränderter Mundhöhlenflora ist die Zahnreinigung nach jeder Mahlzeit möglichst in Verbindung mit der Anwendung von Zahnseide besonders wichtig.
Für den Patienten kann bei der Krankenhausaufnahme zusätzlich zur Aushändigung des desinfizierbaren Patientenidentifikationsarmbands die Aushändigung einer kurz gefassten Darstellung der Körperpflege zur Gesundheitsaufklärung beitragen.
5.1.2. Mitarbeiter
Berufs-, Bereichs- und Schutzkleidung für medizinisches Personal: Keine Mitarbeiter, HygieneVorschrift löst so viel Diskussionen und unbegründeten Widerstand aus wie die Einführung einer Kleiderordnung (Empfehlung ![]() Online-Ergänzung 5.1).
Online-Ergänzung 5.1).
Duschen: Beim Duschen kommt es zur stärkeren Personal:KleidungAuflockerung der oberen Epidermisschichten als beim medizinisches Personal\t\"Siehe PersonalWaschen mit Seife und Lappen. Die damit verbundene verstärkte Freisetzung der Hautflora auch aus tieferen Hautschichten ist ggf. zu berücksichtigen. Falls sich z. B. Mitglieder des OP-Teams zu Dienstantritt oder vor Anlegen der Bereichskleidung duschen, kann durch anschließendes Eincremen der Haut die Partikel- und Erregerabgabe auf < 1⁄10 reduziert werden.
Haar: Bei der Haarpflege wird die soziale Funktion des äußeren Erscheinungsbilds besonders deutlich. Mit ungepflegten, fettigen oder strähnigen Haaren wird eine Nachlässigkeit des Trägers verbunden.
Längeres Haar sollte während der Arbeit so durch Spangen, Bänder o. Ä. gebündelt werden, dass sich bei der Patientenversorgung keine Infektionsrisiken ergeben, bzw. in bestimmten Bereichen, z. B. im OP, komplett bedeckt sein.
Nägel: Sichtbarer Schmutz ist zu entfernen. Nagelbettentzündungen sind durch sorgfältige Nagelpflege zu vermeiden. Die Nägel müssen so kurz geschnitten bzw. gefeilt werden, dass sie zirkulär etwas überstehen, um Nagelbettverletzungen vorzubeugen, andererseits für die Patienten bei der Pflege keine Verletzungen verursachen können und Einmalhandschuhe intakt bleiben. Wegen der Gefahr des Abplatzens sollte Nagellack nicht benutzt werden, zumal er zu geringerer Intensität der Händehygiene verleiten und Schmutz verdecken kann. Hinzu kommt, dass, wenn auch nicht bei frischem, so doch bei 5 Tage altem Nagellack, die Effektivität der Händedesinfektion herabgesetzt wird (Assadian et al. 2011). Künstliche und gegelte Fingernägel sind untersagt (Kap. 2.1).
5.2. Allgemeine und spezielle Pflege
Axel Kramer, Sylvia Ryll und Ojan Assadian
5.2.1. Allgemeine Pflege
Körperwaschung: Sie erfüllt in Hygiene:persönliche\"\r\"Hygperserster Linie ein ästhetisches Bedürfnis, leistet aber durch die mechanische Verminderung von Mikroorganismen möglicherweise auch einen Beitrag zur Minimierung der Weiterverbreitung multiresistenter Erreger (MRE).
Von der Reihenfolge Waschen und Abtrocknen vom Körperwaschung:PatientKopf beginnend abwärts, Genitalbereich am Schluss mit separatem Lappen kann individuell auf den Patienten abgestimmt unter Einhaltung hygienischer Grundsätze abgewichen werden. Bei Beachtung der Grundregel „sauber vor kolonisiert/infiziert“ ist der Wechsel des Waschwassers während einer Waschung ist nicht immer erforderlich, da die Erregerbelastung bei ausreichender Wassermenge und steigendem Kontaminationsgrad des Waschwassers gering ist.
Sinnvoll ist der Wasserwechsel in folgenden Fällen:
-
•
starke Verseifung des Wassers, damit keine Seifenrückstände auf der Haut verbleiben,
-
•
Infektion im gewaschenen Bereich, um eine Erregerverschleppung zu verhindern,
-
•
vor Waschung in der Umgebung von Eintrittsstellen für Katheter u. Ä.,
-
•
nach Waschung des anogenitalen Bereichs.
Werden patienteneigene Utensilien verwendet, sollten für Waschlappen schnell trocknende Materialien (z. B. Frottee) Verwendung finden. Handschuhwaschlappen sind wegen langsamer Trocknung infolge der doppelten Textilschicht ungünstiger. Als Alternative stehen in den letzten Jahren auch Einwegwaschlappen zur Verfügung. Diese können entweder als normale Einwegwaschlappen oder Einwegwaschlappen mit antimikrobieller Dotierung (z. B. Octenidindihydrochlorid) eingesetzt werden. Zur Arbeitserleichterung und geringeren Hautbelastung tragen gebrauchsfertige, handelsüblich vorgetränkte Waschlappen bei, weshalb sie besonders in der Intensivpflege vorteilhaft sind. Sie können in Risikobereichen von der Klinik zur Verfügung gestellt werden. Bei der Auswahl sind die Inhaltstoffe der Tränkflüssigkeit zu beachten. Wegen der Gefahr von Allergien sollten keine Parfümstoffe und Konservierungsmittel enthalten sein.
Nach Benutzung sollen die Waschlappen idealerweise in einem eigenen Wasch- und Trockenraum aufbereitet werden, alternativ in der Sanitärzelle oder am Waschplatz ausgebreitet aufgehängt werden. Bei Verwendung krankenhauseigener Utensilien sind für jeden Patienten frisch aufbereitete Waschlappen und Handtücher zu verwenden.
Für das Waschen des Genital- und Analbereichs werden Schutzhandschuhe angelegt, um eine Kontamination der Hände mit der Fäkalflora zu vermeiden, aber auch zur Wahrung der Intimsphäre. Bei Frauen wird der äußere Genitalbereich von der Symphyse zum Anus gewaschen, um keine Darmflora in den Genitalbereich zu verschleppen, danach wird abgetrocknet. Bei Männern wird mit dem äußeren Genitalbereich einschließlich der Glans penis begonnen, danach das Gesäß abgewaschen und abgetrocknet. Nach Ablegen der Schutzhandschuhe wird eine hygienische Händedesinfektion durchgeführt.
Vor Operationen sind folgende Maßnahmen der Körperhygiene empfehlenswert:
-
•
Bei geplanten Eingriffen wird am Vorabend eine Ganzkörperreinigung (falls möglich, Duschbad) mit gleichzeitiger Haarwäsche durchgeführt und danach der Körper eingefettet.
-
•
Bei ungeplanten Noteingriffen ist abhängig von der Verschmutzung vor dem Eingriff eine Reinigung durch Ganz- oder Teilkörperwaschung anzustreben.
Haarwäsche: Ihre Häufigkeit richtet sich nach dem Bedürfnis des Patienten. Bei Verschmutzungen durch Erbrochenes oder Blut ist sie unverzüglich durchzuführen. Ein Sonderfall ist die Therapie von Mykosen oder Kopflausbefall.
Nasenpflege: Ist der Haarwäsche, PatientPatient nicht selbstständig zur Nasenpflege fähig, übernimmt das Pflegepersonal diese Aufgabe bei der täglichen Körperpflege. Sichtbare Borken müssen vorsichtig mit Watteträger entfernt werden. Diese können vorher mit Kochsalz oder pflegenden Ölen angefeuchtet werden. Für Nasenpflege, Patientjeden Reinigungsgang muss ein neuer Watteträger benutzt werden.
Äußerer Gehörgang: Die Reinigung wird mit einem mit Leitungswasser angefeuchteten dünnen Lappen bzw. Tuch ohne Benutzung von Seife oder anderen Reinigungs- bzw. Lösungsmitteln durchgeführt. Damit sollen Gehörgang- und Trommelfellreizungen bis hin zu chronischem Ekzem durch Eindringen der Präparate Gehörgangsreinigungin den Mittelohrbereich (bei Perforation) vermieden werden. Falls Paraffinöl angewendet wird, ist es aus sterilen Ampullen oder steril abgefüllten Tropfflaschen zu entnehmen, um ein Erregerreservoir zu vermeiden. Von außen sichtbare Beläge (Ohrenschmalz) können vorsichtig mit feuchten Watteträgern entfernt werden. Der Watteträger darf wegen der Gefahr von Verletzungen nicht in den Gehörgang eingeführt werden. Ausnahmen sind Wattetupfer, die sich im Anschluss an den zur Reinigung des Gehörgangs bestimmten eingeführten Teil so verdicken, dass die Eindringtiefe limitiert ist und keine Verletzungsgefahr für das Trommelfell besteht.
Die Ohrenpflege ist täglich zu gewährleisten.
Der Patient wird so gelagert, dass die Reinigung bequem durchführbar ist und Flüssigkeitsreste ablaufen können. Dann wird mit linkem Daumen und Zeigefinger die Ohrmuschel leicht abgezogen und mit Hilfe der rechten Hand vorsichtig u. U. so lange wiederholt gereinigt, bis Tupfer oder Träger sauber bleiben. Tupfer sind nach einmaliger Benutzung abzuwerfen.
Maniküre und Pediküre:
Das Pediküre, Patient Maniküre:PatientSchneiden der Finger- und Fußnägel durch Pflegepersonal setzt die Einwilligung des Patienten voraus.
Bei Patienten mit peripheren Durchblutungsstörungen, Polyneuropathien und Diabetes mellitus sollte die Fußpflege, insbesondere das Schneiden der Nägel, durch einen Podologen (medizinische Fußpflege) übernommen werden. Bei Verletzung des Nagelbetts können häufig schwer bzw. nicht heilende Wunden entstehen. Die Fußnägel sollten entlang der Zehenkuppe, links und rechts nicht abgerundet (Gefahr der Verletzung des Nagelbetts, Verhinderung des Einwachsens der Nägel), geschnitten werden.
Die Pediküre umfasst Fußbad, Schneiden der Zehennägel und ggf. Entfernen der Hornhaut. Sie sollte nach dem Baden oder Duschen durchgeführt werden, da die Nägel dann weicher und weniger brüchig sind. Fingernägel werden rund, Zehennägel gerade und nicht zu kurz geschnitten.
Geräte, bei deren Einsatz es zu unbeabsichtigten Verletzungen kommen kann (z. B. Rasierapparat, Nagelschere), sind bei Verwendung an verschiedenen Patienten nach jedem Gebrauch zu reinigen und zu desinfizieren bzw. der maschinellen Aufbereitung zuzuführen.
Für den Fall der Hautverletzung ist ein Wundverband mitzuführen.
Mundpflege: Ziel ist neben dem subjektiven Wohlbefinden des Patienten der Erhalt intakter Schleimhaut, belagfreier Zunge, geschmeidiger Lippen und des Zahnstatus. Als Pflegeproblem durch unzureichende Mundpflege kann sich die Mundflora verändern, gefolgt von Austrocknung, Rhagaden, Aphthen, Mundpflege:Patient(en)Entzündungen, Schädigung der Zähne, Mukositis, Parodontitis, Parotitis und ggf. absteigenden respiratorischen Infektionen. Besonders gefährdete Patientengruppen sind behinderte Patienten, Senioren, Patienten während Chemo- oder Strahlentherapie sowie beatmete und immunsupprimierte Patienten.
Der Patient wird über den Sinn der Mundpflege informiert. Nach Möglichkeit sollten patienteneigene Pflegemittel angewendet werden. Falls die patienteneigenen Utensilien nicht vollständig sind, müssen sie durch Angehörige bzw. die Einrichtung ergänzt werden. Wegen der Aspirationsgefahr wird der Patient zur Mundpflege möglichst mit erhöhtem Oberkörper gelagert. Zuerst wird die Mundhöhle (Taschenlampe) inspiziert, um den oralen Status zu erheben und zu dokumentieren. Gegebenenfalls ist ein zahnärztliches Konsil anzufordern. Im Anschluss wird die Mundhöhle gereinigt. Ist kein spezieller Wunsch des Patienten bekannt oder eine Mundhöhlenantiseptik indiziert, wird mit frischem Wasser gespült. Ist keine Mundspülung durchführbar, muss die Mundhöhle (Wangeninnenfläche, Wangentaschen, harter und weicher Gaumen, auf und unter der Zunge) mit einem Tupfer ausgewischt werden. Die Industrie bietet sog. Denta Swabs™ an, die besser von Patienten toleriert werden, da sie angenehmer als Mulltupfer empfunden werden.
Zur Lippenpflege sind patienteneigene Pflegemittel oder alternativ Wund- und Heilsalbe anzuwenden.
Prothesenträger sind gehalten, ihre Zahnprothese regelmäßig zu tragen. Nach jeder Mahlzeit ist die Zahnprothese unter fließendem warmem Wasser mit mittelharter Zahnbürste (vier Borstenreihen + extra Bürstenelement für Protheseninnenfläche) und Zahnpasta zu reinigen. Vor Einsetzen der Prothese wird der Mund mit Wasser ausgespült. Werden Zahnprothesen nachts herausgenommen, werden sie nach Reinigung mit Zahnpasta und Bürste in Reinigungslösung aufbewahrt. Vor Einsetzen der Zahnprothese ist die Reinigungslösung mit klarem warmem Wasser abzuspülen. Der Behälter wird anschließend entweder in der Geschirrspülmaschine mit anderem Geschirr aufbereitet oder manuell gereinigt. Prothesen sind regelmäßig auf Plaque und Pilzbefall zu inspizieren und ggf. zur Reinigung in ein zahntechnisches Labor zu geben. Wenn möglich, ist die normale Kautätigkeit zu erhalten; zur Förderung des Speichelflusses kann Kaugummi oder Brotkruste gekaut (anschließend Mund spülen) oder Zitronensaft/-scheibe verabreicht werden. Für ausreichende Flüssigkeitszufuhr und ausgewogene Ernährung ist zu sorgen.
Standard zur Augenpflege bei Krankenhauspatienten: Kap. 5.15.
Nasenpflege:
Bei nasaler Nasenpflege, PatientAbsaugung bzw. Intubation sind die Naseneingänge ständig sauber zu halten, wobei für jede Nasenöffnung ein frischer Watteträger zu verwenden ist.
Die Watteträger werden mit fettenden Salben oder Ölen getränkt und die Reinigung wird ggf. in Verbindung mit Antiseptik so oft wiederholt, bis keine Borken bzw. Verunreinigungen mehr erkennbar sind. Der hygienische Abwurf benutzter Materialien ist zu gewährleisten.
5.2.2. Spezielle Pflege
Antiseptische Körperwaschung: Die tägliche antiseptische Ganzkörperwaschung einschließlich Haarwäsche mit antiseptischer Pflege:allgemeine\"\r\"pflegeallgSeife oder Lotion ist unerlässlich im Konzept der antiseptischen Sanierung von MRSA-Trägern (Kampf und Kramer 2004). Zusätzlich erfolgt die Sanierung von Nasenvorhöfen (Salbe) und Körperwaschung:antiseptischeMundhöhle (Spülung) 3-mal/d. Ist nach dem ersten Sanierungszyklus von 7 Tagen der MRSA noch nicht eradiziert, empfiehlt sich ein erweitertes Screening zur Auffindung der Rekontaminationsquelle einschließlich Stuhluntersuchung. Bei Patienten mit Tracheostoma werden die Antiseptik der Tracheostomiewunde und die Desinfektion des Tracheostomas durchgeführt. Infizierte oder kolonisierte chronische Wunden werden ebenfalls antiseptisch behandelt. Bei apparativer Beatmung wird die Mundhöhle mit antiseptikumgetränktem Tupfer ausgewischt. Herausnehmbarer Zahnersatz kann z. B. in Mundhöhlenantiseptikum eingelegt werden. Es sind Einmalzahnbürsten zur Verfügung zu stellen. Zahncremetube und Mundwasserflasche sind in die Wischdesinfektion der Patientenkontaktflächen einzubeziehen.
Um eine Rekolonisation durch das Bett zu verhindern, sind Matratze, Kissen und Decke im besten Fall mit bakteriendichten Bezügen zu überziehen, die während der Zeitdauer der antiseptischen Sanierung der täglichen Wischdesinfektion unterzogen werden. Die Benutzung privater Pflegeartikel durch den Patienten (Deos, Cremes etc.) sollte wegen der Rekontaminationsgefahr auf ein Minimum beschränkt sein. Die täglich während der antiseptischen Körperwaschung zu wechselnde Bett- und Nachtwäsche wird direkt in den Wäschesack entsorgt, der im Schleusungsbereich in einen bakteriendichten Plastiksack gegeben wird. Die ungeschützte Lagerung außerhalb des Patientenzimmers ist unzulässig. Die Entsorgung hat so zu erfolgen, dass von der Wäsche keine Kontaminationsgefahr ausgeht (Schutzhandschuhe beim Hantieren, abschließend Händedesinfektion). Während des Umlagerns auf den Entsorgungswagen sollen die Türen zu anderen Patientenzimmern geschlossen gehalten werden und sich Personen, die nicht zum Umlagern beteiligt sind, fernhalten. Anschließend ist zu lüften.
Die erfolgreiche Kontrolle einer Rekolonisation des Patienten muss neben der sachgerechten Aufbereitung des Bettzeugs allerdings noch weiter greifen. Dazu gehört die Desinfektion aller direkt mit dem Patienten in Kontakt kommenden Gegenstände nach Gebrauch, und, falls eine kontaminationsfreie Lagerung im Patientenzimmer nicht gewährleistet ist, auch vor neuerlichem Einsatz am Patienten.
In diesem Zusammenhang bisher wenig beachtet werden MP wie Stauschläuche, wobei eine Zwischendesinfektion aufgrund der textilen Materialbeschaffenheit nur mit fragwürdiger Effektivität erfolgt. Für Patienten, für die aufgrund einer Kolonisation mit MRE eine Indikation zur Isolierung besteht, wird das Belassen von Stauschläuchen im Isolierzimmer empfohlen (AORN 2002). Dennoch kann von einem solchen Stauschlauch bei nicht ordnungsgemäßer Aufbereitung eine Rekolonisation ausgehen (Golder et al. 2000, Rourke et al. 2001, Fellowes et al. 2006). Seit kurzem steht mit einem Einwegstauschlauch (Tournistrip™) eine effiziente Möglichkeit bereit, die Rekontamination zu unterbinden (Kerstein und Fellowes 2009).
Antiseptische Mundpflege:
In Abhängigkeit von der Art der Erkrankung bzw. des Eingriffs kann adäquate Mundhygiene in Verbindung mit Antiseptik zur Verminderung des NI-Risikos beitragen.
Das betrifft z. B. immunsupprimierte granulozytopenische Patienten während der Chemotherapiephase. Vor elektiver Chemotherapie ist ein Zahnarzt zu konsultieren, um ggf. eine professionelle Zahnreinigung und Sanierung kariöser Zähne durchführen zu lassen (Teseler 1990).Mundpflege:antiseptische Für die Dauer der Panzytopenie kann der Mukositis durch antiseptische Mundspülungen vorgebeugt werden. Chlorhexidin ist für diese Indikation offenbar ungeeignet (Ferretti et al. 1990, Spijkervert et al. 1989). Foote et al. (1994) sowie Pitten et al. (2003) beschreiben sogar eine Zunahme der Mukositis mit Geschmacksbeeinträchtigung. Stattdessen kann Meridol® oder eine polyhexanidbasierte Mundspüllösung eingesetzt werden.
Nach Resektion oder Bestrahlung von Mundhöhlenmalignomen kann durch antiseptische Spülung mit nichtalkoholischen Lösungen auf Basis von Chlorhexidin oder Cetylpyridiniumchlorid die Rate oraler Komplikationen reduziert werden (Lanzos et al. 2010). In der Wirksamkeit mindestens gleichwertig sind octenidin- und polihexanidbasierte Mundhöhlenantiseptika (Rohrer et al. 2010).
Bei Beatmungspatienten ist die Mundhöhlenpflege in Form mechanischer Zahnreinigung, regelmäßiger Befeuchtung mittels Instillieren steriler Ringer-Lösung, Sekretabsaugung und antiseptischer Mundspülung wichtig. Grundsätzlich wird empfohlen, bei Beatmungspatienten eine Mundhöhlenantiseptik durchzuführen (Lokken et al. 2010), wobei octenidinbasierte Lösungen in der Wirksamkeit gleichwertig, in der Verträglichkeit aber überlegen sind.
Mundduschen führen nicht unbedingt zur Verbesserung der Zahnpflege und sind mit dem Risiko der bakteriellen Besiedelung des Restwassers im Schlauchsystem behaftet. Hier kann sich insbesondere P. aeruginosa massiv vermehren.
Auch bei behinderten und betagten Patienten ist durch gute Mundhygiene in Verbindung mit antiseptischer Mundhöhlenspülung nicht nur eine Verbesserung der Mundhöhlengesundheit, sondern auch eine Herabsetzung respiratorischer Infektionen einschließlich Pneumonie erreichbar (Kap. 5.18).
Harn- und Stuhlinkontinenz: Vielfach genieren sich Patienten und spielen die Beschwerden unbewusst herunter oder ignorieren sie. Umso dankbarer sind sie dann für ein „beherztes“ Ansprechen des Problems, dem allerdings nicht Patient(en):inkontinente, Pflegemaßnahmenallein die Zuteilung von Inkontinenzvorlagen oder speziellen Matratzenbezügen, sondern eine zügige urologische und/oder proktologische Abklärung mit adäquater Therapie folgen muss.
Harninkontinenz per se ist keine Indikation für einen transurethralen oder suprapubischen Harnblasenkatheter.
Unterstützende Maßnahmen beinhalten das Blasen- bzw. Beckenbodentraining, ausreichende Flüssigkeitszufuhr bei Harninkontinenz und ballaststoffreiche Ernährung (z. B. Leinsamen) bei Stuhlinkontinenz. Bei der Auswahl von Inkontinenzhilfen ist der Inkontinenzgrad zu beachten. Grundsätzlich müssen sie sicheren Schutz gegen Ausscheidungen und Gerüche gewährleisten sowie hautverträglich und problemlos zu entsorgen sein: Für Männer kommt als Alternative das Kondomurinalsystem in Betracht.
Da durch das feuchte Milieu leicht Druckgeschwüre entstehen, sind Inkontinenzhilfen nach jeder Entleerung zu wechseln. Zur Vorbeugung von Hautmazeration ist die Füllung regelmäßig zu kontrollieren. Hilfreich sind Inkontinenzhilfen mit Indikatorstreifen.
Bei jedem Vorlagenwechsel ist die Haut zum Erhalt ihres Säure- und Fettschutzmantels möglichst nur mit Wasser, ggf. mit pH-neutraler Waschlotion, zu reinigen und sorgfältig mit klarem Wasser nachzuwaschen. Alkaliseifen sowie parfümierte oder desodorierende, d. h. mit antibakteriellen Zusätzen versehene, Waschlotionen sind ungeeignet. Zur Hautpflege sind W/O-Emulsionen geeignet. O/W-Lotionen wirken austrocknend. Abdeckende Cremes (z. B. Baby-Schutz-Creme, Vaseline) sollten nicht verwendet werden, weil sie zum Wärmestau mit nachfolgender Verdunstung und Austrocknung der Haut führen.
Immobile Patienten: Grundsätzlich gelten für den immobilen Patienten keine anderen Sauberkeitsanforderungen, sofern er nicht z. B. stark schwitzt, große, nicht abgedeckte infektionsanfällige Wundflächen oder Bestrahlungsareale aufweist. Es Patient(en):immobile, Pflegeist zu beachten, dass Verbände im Bereich von Eintrittsstellen von Urinkathetern, Drainagen oder Gefäßzugängen nicht durchfeuchten, weil damit das Risiko der Vermehrung insbesondere sog. Nasserreger gegeben ist.
Besondere Maßnahmen gelten für Patienten mit stark nässenden und juckenden Hauterkrankungen, die leicht superinfiziert werden können (z. B. chronisches Ekzem). Bezüglich der Abdeckung ist das Vorgehen z. B. mit dem Wundmanager abzustimmen. Juckreiz kann schon durch Vermeidung eines Wärmestaus vorgebeugt werden, Dermatosen:Pflegeggf. sind zusätzlich juckreizstillende Medikamente zu Pflege:Hauterkrankungenverabreichen. Der Lagewechsel zur Dekubitusprophylaxe wird für jeden Patienten individuell bestimmt.
Zur Infektionsprävention beim Verbandswechsel Kapitel 5.5, bei Blutgefäß- und Harnwegskathetern Kapitel 4.2 und Kapitel 4.3Kapitel 4.2Kapitel 4.3, bei Beatmung Kapitel 5.9 und bei Isolierung Kapitel 2.11.
5.3. Infektionsprävention durch gezielte Ernährung und Probiotika
Arved Weimann, mit einem Teilbeitrag von Julian-Camill Harnoss, Axel Kramer und Arved Weimann
5.3.1. Fehlernährung und Wundinfektion
Der Begriff FehlernährungFehlernährung fasst alle klinisch relevanten Ernährungsdefizite zusammen. Das betrifft ausschließlich Mangelzustände, nicht dagegen Überernährung (Pirlich et al. 2003).
Pflege:spezielleHäufig ist das Bestehen einer Mangelernährung Ausdruck der Grunderkrankung, z. B. eines Tumorleidens oder einer chronischen Organinsuffizienz.
In der Chirurgie konnte die Bedeutung des Ernährungsstatus für die postoperative Morbidität und Letalität bei verschiedenen Krankheitsbildern retrospektiv (Weimann et al. 2006, 2009) gezeigt werden. In einer klassischen Erhebung resultierte bei 101 Patienten vor großen Operationen am Gastrointestinaltrakt eine Mangelernährung mit ErnährungsstatusProteinmangel in einer signifikant höheren Rate schwerer postoperativer Komplikationen einschließlich Pneumonie und eine signifikant längere Krankenhausverweildauer. Auch die Häufigkeit an SSI war erhöht, wenn auch nicht signifikant (Hill 1994). Relevant ist Mangelernährung besonders für die Prognose nach Organtransplantation und für die postoperative Morbidität in der Chirurgie alter Menschen (Weimann et al. 2006, 2009).
In einer prospektiven Erhebung an 5.031 chirurgischen Patienten (Ausschluss Kardiochirurgie) der Veterans Administration von 1995 bis 2000 wurden als unabhängige präoperative Risikofaktoren für das Entstehen einer SSI Diabetes mellitus und Mangelernährung identifiziert (Malone et al. 2002). Mangelernährung wurde als signifikanter Gewichtsverlust innerhalb von 6 Monaten vor der Operation definiert. Bereits früher haben Khuri et al. (1997) in einer Kohortenstudie der Veterans Administration bei 87.078 chirurgischen Patienten (Ausschluss Kardiochirurgie) als Hauptrisikofaktoren für die Mangelernährungpostoperative 30-Tages-Letalität den präoperativen Serumalbuminspiegel, die American Society of Anesthesia Class (ASA) und die Notwendigkeit einer Notfall-OP identifiziert. Auch das Vorliegen eines Gewichtsverlusts > 10 % war ein signifikanter prädiktiver Faktor.
5.3.2. Erkennung der Mangelernährung
Die Definition einer Mangelernährung ist nicht einheitlich.
Die Europäische Gesellschaft für Klinische Ernährung und Metabolismus (ESPEN; Kondrup et al. 2003) empfiehlt als Parameter für das Prä-Screening von Risikopatienten das Vorliegen
-
•
eines Körpermassenindex (BMI) < 20 kg/m2,
-
•
eines Gewichtsverlusts innerhalb der letzten 3 Monate,
-
•
einer reduzierten Nahrungsaufnahme in der letzten Woche und
-
•
einer schweren Erkrankung.
Bei Zutreffen eines der Faktoren erfolgt eine genauere Stratifizierung. Für geriatrische Patienten wird das Screening mit dem Mini Nutritional Assessment empfohlen, worin zusätzlich Mobilität und neuropsychologischer Status berücksichtigt Mangelernährung:Definitionwerden (Kondrup et al. 2003). Noch genauer ist das Subjective Global Assessment (SGA; Jeejeebhoy et al. 1990), das neben sorgfältiger Anamnese (Änderungen von Gewicht, Nahrungszufuhr, Leistungsfähigkeit, gastrointestinale Symptome) die körperliche Untersuchung (Ödeme, Aszites, Muskel- und Fettmasse) einschließt und von Pirlich et al. (2003) v. a. für Patienten mit krankheitsassoziiertem Gewichtsverlust empfohlen wird. Anhand des Vorliegens bzw. der Ausprägung der Mangelernährung werden Grade A bis C differenziert.
5.3.3. Präoperative Ernährung
Eine präoperative parenterale Ernährung ist mit dem Ziel einer Verbesserung des Outcomes in vielen Studien v. a. der 1980er Jahre auch prospektiv untersucht worden. Problematisch sind u. a. die hohe Variabilität der Eingangskriterien, der Inzidenz und Definition der Ernährung:präoperativeMangelernährung, der Komplikationen und der Zusammensetzung der Ernährung. In einer Metaanalyse (Klein et al. 1997) hat sich bei präoperativer parenteraler Ernährung eine Reduktion der absoluten Rate postoperativer Komplikationen um 10 % gezeigt. Eine besondere Bewertung im Hinblick auf das Auftreten von SSI wurde nicht durchgeführt. Am meisten profitierten Patienten mit schwerer Mangelernährung (Veteran Affairs Study Group 1991, Bozzetti et al. 2000, Heyland et al. 2001). Es besteht heute Konsens, dass die Verschiebung einer OP zur Durchführung einer gezielten Ernährung nur bei schwerer Mangelernährung angezeigt ist (Weimann et al. 2006, Braga et al. 2009).
Die Arbeitsgruppe „Enterale Ernährung: Chirurgie und Transplantation“ der Deutschen Gesellschaft für Ernährungsmedizin (DGEM) schlägt für das Vorliegen einer schweren Mangelernährung folgende Definition vor:
-
•
BMI < 18,5 kg/m2,
-
•
Gewichtsverlust > 10–15 % in den letzten 6 Monaten,
-
•
Subjective Global Assessment (SGA) Grad C,
-
•
Albumin < 30 g/l (Ausschluss Leber- und Niereninsuffizienz).
Die Leitlinien der Europäischen Gesellschaft für klinische Ernährung und Metabolismus (ESPEN) empfehlen eine präoperative Ernährung bei mangelernährten Patienten vor großen gastrointestinalen Eingriffen für die Dauer von 7–14 Tagen, wenn die OP ohne Risiko verschoben werden kann (Weimann et al. 2006, Braga et al. 2009).
Aus der grundsätzlichen Überlegung, dass die enterale Zufuhr physiologisch ist, sollte ihr der Vorzug gegeben werden (Weimann et al. 2006).
Die Datenlage zum präoperativen Vergleich enteraler mit parenteraler Ernährung ist unzureichend. Die prästationäre Durchführung der enteralen Ernährung ist auch zur Vermeidung von NI anzustreben. Für Tumorpatienten wird vor großen viszeralchirurgischen Operationen (Ösophagusresektion, Gastrektomie, partielle Duodenopankreatektomie) der Einsatz einer Trinknahrung mit immunmodulierenden Substraten (Arginin, ω-3-Fettsäuren und Ribonukleotide) für die Dauer von 5–7 Tagen empfohlen. Eine enterale Ernährung wird üblicherweise bis zum Abend vor der OP durchgeführt (Weimann et al. 2006). Mit dem Ziel der metabolischen Konditionierung und Vermeidung unnötiger präoperativer Nüchternheit wird in den Leitlinien vor großen Operationen nicht zuletzt im Rahmen eines Fast-Track- oder Enhanced-Recovery-after-Surgery-Konzepts (ERAS) die Aufnahme glukosehaltiger Trinklösung (12,6 g/100 ml) empfohlen (Ljungqvist et al. 2002, Weimann et al. 2006, Lassen et al. 2009). Ob das auch zu einer geringeren Komplikationsrate mit Abnahme von SSI führt, ist noch nicht endgültig geklärt (Yuill et al. 2005, Noblett et al. 2006, Mathur et al. 2010).
5.3.4. Einfluss der postoperativen Ernährung auf SSI
Generell ist postoperativ keine Unterbrechung der Nahrungszufuhr erforderlich.
Der orale Kostaufbau sollte sich v. a. nach der Toleranz des Patienten richten (Weimann et al. 2003, 2005).\
Ein frühzeitiger oraler bzw. enteraler Kostaufbau führt gegenüber längerfristiger Nüchternheit zur Verminderung des Risikos einer Infektion und wirkt sich günstig auf die Krankenhausverweildauer aus (Weimann et al. 2006).
Lewis et al. (2001, 2009) zeigten in einer Metaanalyse aus 11 Studien mit 837 Patienten eine – wenn auch nicht signifikante – Verminderung des SSI Risikos. Eine nicht ausreichende Nahrungszufuhr für mehr als 14 Tage war mit erhöhter Letalität assoziiert.
Die Indikation zu künstlicher Ernährung besteht auch bei Patienten ohne Zeichen der Mangelernährung, die perioperativ voraussichtlich mehr als 7 Tage keine orale Nahrungszufuhr oder mehr als 14 Tage oral eine nicht bedarfsdeckende Kost (< 60 %) erhalten. Hier wird ohne Verzögerung der Beginn einer enteraler Ernährung empfohlen (Weimann et al. 2003).
In einer Metaanalyse zum Vergleich enteraler mit parenteraler Ernährung, die Studien sowohl an chirurgischen als auch an internistischen Patienten berücksichtigte, zeigte sich eine signifikant niedrigere SSI-Rate bei den enteral ernährten Patienten (Braunschweig et al. 2001). Auch für kritisch Kranke fand sich in mehreren Metaanalysen eine Assoziation der enteralen Ernährung mit einer signifikant niedrigeren lnfektionsrate (Marik und Zaloga 2001, Heyland et al. 2003). Daher wird in den allen aktuellen Leitlinien zur Ernährung beatmeter Intensivpatienten die Bevorzugung der enteralen vor der parenteralen Ernährung empfohlen, bei hämodynamisch stabilen Patienten mit möglichst frühzeitigem Beginn innerhalb von 24–48 Stunden (Kreymann et al. 2006, McClave et al. 2009, Reinhart et al. 2010). Sofern eine kalorienbedarfsdeckende enterale Substratzufuhr nicht möglich ist, wird ergänzend die Kombination enteraler mit parenteraler Ernährung empfohlen (Singer et al. 2009, Weimann et al. 2009). Sofern eine parenterale Ernährung indiziert ist, kann die Supplementierung mit ω-3-Fettsäuren erwogen werden, für die sich in einer Metaanalyse Vorteile bzgl. Verminderung von SSI gezeigt haben (Chen et al. 2010).
In den ESPEN-Leitlinien für Enterale Ernährung in der Chirurgie (Weimann et al. 2006) werden immunmodulierende Sondennahrungen für Patienten nach großen hals- und viszeralchirurgischen Tumoroperationen (Larynx-, Pharynx-, Ösophagusresektion, Gastrektomie, partielle Duodenopankreatektomie) oder schwerem Polytrauma empfohlen.
Wahrscheinlich ist die präoperative Gabe entscheidend, die postoperative Zufuhr immunmodulierender Sondennahrung, insbesondere bei unkompliziertem Verlauf, ist nicht erforderlich.
Für den Einsatz einer Kombination immunmodulierender Substrate (Arginin, Glutamin, ω-3-Fettsäuren, Ribonukleotide) in der enteralen Ernährung chirurgischer Patienten konnte in fünf Metaanalysen eine signifikante Reduktion infektiöser Komplikationen und der stationären Verweildauer gezeigt werden (Heyland et al. 2001a, Montejo et al. 2003, Marik und Zaloga 2010, Cerantola et al. 2011, Drover et al. 2011). In der Metaanalyse von Montejo et al. (2003) wurde in 5 der 26 Studien die Inzidenz von SSI angegeben, weitere 10 enthielten Daten zum Auftreten von SSI. Die Odds Ratio von 0,46 mit dem 95 %-Konfidenzintervall von 0,30–0,69 (p = 0,003) spricht auch hier für den Einsatz der immunmodulierenden Kombination. Farreras et al. (2005) zeigten in einer prospektiven randomisierten Studie nach Magenresektion mit Supplementierung immunmodulierender Substrate signifikant weniger Komplikationen (Tab. 5.3 ). Als Maß für die Wundheilung war die Menge an Hydroxyprolin in einem s. c. implantierten Katheterröhrchen signifikant höher in der Testgruppe und bei Patienten ohne Wundkomplikation.
Tab. 5.3.
Postoperative Komplikationen bei enteraler Ernährung nach Magenresektion mit und ohne Supplementierung immunmodulierender Substrate:
| Komplikation | Testgruppe (n = 30) | Kontrollgruppe (n = 30) | P |
|---|---|---|---|
| Wundheilungsstörung | 0 | 8 (26,7 %) | 0.005 |
| Wunddehiszenz | 0 | 2 (6,7 %) | n. s. |
| Eviszeration | 0 | 1 (3,3 %) | n. s. |
| Nahtbruch | 0 | 5 (16,6 %) | 0.03 |
| Infektiöse Komplikationen | 2 (6,7 %) | 9 (30,0 %) | 0.01 |
| Chirurgische Wundinfektionen | 1 (3,3 %) | 4 (13,3 %) | n. s. |
| Intraabdomineller Abszess | 0 | 1 (3,3 %) | n. s. |
| Sepsis | 0 | 0 | |
| Pneumonie | 0 | 2 (6,7 %) | n. s. |
| Harnwegsinfektionen | 1 (3,3 %) | 2 (6,7 %) | n. s. |
| Komplikationen insgesamt | 4 (13,3 %) | 13 (43,3 %) | 0.01 |
| Letalität | 1 (3,3 %) | 2 (6,7 %) | n. s. |
Im Ergebnis einer retrospektiven Kosten-Nutzen-Analyse anhand einer nationalen US-amerikanischen Datenbank kann ein ökonomischer Vorteil durch die kostenaufwändigere immunmodulierende Supplementierung für normal ernährte Patienten bereits ab einer Infektionsrate > 0,91 % und für Mangelernährte > 3,31 % erwartet werden. Für die spezielle Vermeidung einer SSI werden Werte von 1,7 % für Patienten in gutem Ernährungsstatus und von 4,8 % bei Vorliegen einer Mangelernährung angegeben (Strickland et al. 2005).
Für die parenterale Gabe von Glutamin wurden günstige Auswirkungen auf die SSI-Rate und die Hospitalliegedauer chirurgischer Patienten in 2 Metaanalysen aus 14 Studien gezeigt (Novak et al. 2002, Wang et al. 2010). Problem vieler in die Metaanalysen eingeschlossener Studien ist der Umstand, dass aus heutiger Sicht auch enteral ernährbare Patienten parenteral Glutamin erhielten. In den DGEM-Leitlinien zur parenteralen Ernährung (Weimann et al. 2009) wird aufgrund dieser Datenlage nicht zuletzt aus Kostengründen die parenterale Gabe von Glutamin nur für mangelernährte, enteral nicht adäquat ernährbare Patienten empfohlen. Zur Frage, ob eine parenterale Glutaminapplikation günstigerweise mit einer enteralen Ernährung mit und ohne Kombination immunmodulierender Substrate erfolgen sollte, liegen keine Daten vor.
Zhou et al. (2003) fanden in einer randomisierten Studie bei 40 Verbrennungspatienten bei Anreicherung der enteralen Diät mit 0,35 g Glutamin/kg KM/d als Monosubstanz nach 30 Tagen eine signifikant weiter fortgeschrittene Wundheilung (86 vs. 72, p = 0,041).
Auch die frühe enterale Ernährung mit Präbiotika reduziert signifikant die postoperative Infektionsrate (Kap. 5.3.5).
Dies gilt ebenso, wenn auch nicht signifikant, für die SSI-Rate. Möglicherweise hat die zusätzliche Gabe des probiotischen Lactobacillus plantarum 299 günstige Auswirkungen auf die Infektionsrate von Patienten nach Magen- und Pankreasresektionen (Rayes et al. 2002). Eine Verminderung der Rate an Wundinfektionen konnte von derselben Arbeitsgruppe auch für Patienten nach Lebertransplantation gezeigt werden (Rayes et al. 2005, 2007). Die in den Studien verwandte synbiotische enterale Diät steht allerdings noch nicht auf dem Markt zur Verfügung.
Für orale Supplemente als Trinklösung wurde in einer randomisierten Studie bei Pflegeheimbewohnern mit Wundproblemen eine signifikante Verbesserung von Parametern der Wundheilung sowie der kognitiven Funktion gezeigt (Collins et al. 2005).
Der Einfluss des Ernährungsstatus bzw. einer perioperativen Ernährungstherapie auf das Auftreten infektiöser Komplikationen, hierunter auch die Rate an SSI, und auf die Morbidität insgesamt kann als gesichert gelten. Mit dem Ziel einer Verkürzung der Krankenhausverweildauer in der Chirurgie muss die Erkennung von Risikopatienten insbesondere zur Frage der präoperativen Ernährungstherapie bereits prästationär realisiert werden. Hier könnten integrierte Versorgungsformen zukünftig Bedeutung erhalten. Auch postoperativ sollte die Ernährung möglichst frühzeitig oral bzw. enteral erfolgen. Bei Patienten nach großen viszeralchirurgischen Tumoroperationen wird die perioperative Gabe mit immunmodulierenden Substraten empfohlen. In Abhängigkeit von der jeweiligen Infektionsrate können trotz erhöhten Kostenaufwands die günstigen Auswirkungen der Ernährungsintervention im Gesamtergebnis mit Einsparungen einhergehen.SSI:Ernährung, postoperative Ernährung:postoperative
5.3.5. Infektionsprävention durch Probiotika
Julian-Camill Harnoss, Axel Kramer und Arved Weimann
Der menschliche Darm ist von etwa 1013–1014 aeroben und anaeroben Bakterien und Pilzen besiedelt. Das entspricht mindestens der Anzahl der Körperzellen. Mehr als 1.000 Spezies sind an der Besiedlung beteiligt, wobei die Zusammensetzung nur in Ansätzen definiert ist. Die Darmflora wird wegen ihrer Dimension und Bedeutung teilweise auch als das vergessene Organ bezeichnet.
Die natürliche Darmflora dient im Zusammenwirken mit der mechanischen Schleimhautbarriere und der darauf befindlichen bis zu 1,5 mm dicken Schleimschicht (Glykokalix) sowie unspezifischen Schutzfaktoren und lokalen Immunmechanismen der Abwehr unerwünschter Kolonisation mit nachfolgender Infektion durch Krankheitserreger.
Begriffe
Unter Eubiose wird die statistische Norm der kultivierbaren Darmflora verstanden (Grütte und Hänel 1968).
Bei der Dysbiose liegt eine Störung des Verhältnisses der Arten der Darmflora zueinander vor.
Als Probiose Eubiosewird das Zusammenleben artfremder Spezies bezeichnet, von der eine oder mehrere Arten einen Vorteil und die anderen keinen Nachteil erfahren.
Im DysbioseUnterschied dazu charakterisiert die Antibiose die Beziehung zwischen einzelnen Individuen oder Gruppen verschiedener Mikroorganismenspezies, die Probiosefür eine oder mehrere der beteiligten Spezies Nachteile mit sich bringt (Wachstumshemmung oder sogar Abtötung).
Präbiotika sind Präbiotikanatürliche, nicht verdauliche Lebensmittelbestandteile (z. B. Oligosaccharide wie Inulin).
Präbiotika sollen die Gesundheit verbessern, indem sie die Darmflora durch selektive Stimulation probiotisch aktiver Bakterien günstig beeinflussen (Gibson und Roberfroid 1995, Takemura et al. 2010). Sie erwiesen sich z. B. wirksam zur primären Prävention bei Kindern mit geringem Risiko für eine atopische Dermatitis (Gruber et al. 2010).
Bei Probiotika handelt es sich um eine Präparation aus lebensfähigen Mikroorganismen.
Probiotika sollen durch Verbesserung der gastrointestinalen mikrobiellen Balance einen gesundheitsfördernden Einfluss auf den Wirt entfalten (Fuller 1989, 1991, Fuller und Gibson 1997).
Synbiotika Synbiotikasind Kombinationen aus Pro- und Präbiotika, also von lebensfähigen Mikroorganismen und ihrem Substrat.
Der Begriff Probiotika wurde 1965 von Lilly und Stillwell nach dem Vorbild der Natur kreiert, ausgehend von der Erkenntnis, dass bei Ernährung mit Muttermilch anstelle von Flaschennahrung Lactobacillen und Bifidusbakterien die Darmflora dominieren, was mit einem geringeren Anteil von Pathogenen verbunden ist. Etwa 1980 begann die moderne Ära der Probiotika mit der Wiederbelebung des Konzepts, dass sich oral in ausreichender Anzahl zugeführte apathogene oder kommensale Mikroorganismen in der Darmschleimhaut ansiedeln und zur Prävention und Therapie von Infektionen beitragen können. In der Folge sind seit 1998 mehr als 500 Peer Reviews zur Probiose erschienen.
Wirkungsweise von Probiotika
Verschiedene Faktoren tragen zur probiotischen Wirkung bei, wobei deren Zusammenwirken im Einzelnen noch nicht geklärt ist (O'Hara und Shanahan 2007, West et al. 2009, Karlsson et al. 2010). Dazu gehören
-
•
die Vergrößerung der bakteriellen Diversität im Darm,
• die Probiotika:WirkungsweiseSynthese antimikrobieller Substanzen,
-
•
pH-Absenkung durch Essig- und Milchsäurebildung,
-
•
Nährstoffkonkurrenz,
-
•
Adhäsionshemmung durch Besetzung oder Modifikation von Attachmentrezeptoren,
-
•
die Modifikation von Toxinen,
-
•
Immunstimulation durch IgA und antiinflammatorische Zytokine,
-
•
die Interaktion mit intestinalen Toll-like-Rezeptoren,
-
•
der Abfall der Fettsäuren Isovalerin- und Valerinsäure im Kot.
Die Wechselwirkung der Darmflora mit dem Darmepithel und dem Immunsystem hat positive Auswirkungen nicht nur auf den Darm selbst, sondern auch auf den oberen Respirationstrakt, die Haut und den Urogenitaltrakt.
Probiotisch wirkende Spezies
Eine Reihe von Bakterienspezies wirken probiotisch, insbesondere Bifido- und Laktobazillen (Azais-Braesco et al. 2010), aber auch Enterococcus-faecium-Stämme (Hosseini et al. 2009), Bacillus-subtilis- und Escerichia-coli-Stämme (Tsaruk'ianova und Osadchaia 2007), Clostridium Bakterienspezies, probiotisch wirkende butyricum (Pan et al. 2008) und Saccharomyces spp. (Czerucka et al. 2007). Die infektionspräventiven Effekte von Probiotika scheinen zum einen spezies-, zum anderen auch dosisabhängig zu sein (Azais-Braesco et al. 2010). Seit 2008 wurden mehr als 230 probiotische Produkte registriert.
Tierexperimentelle Befunde zur protektiven Wirkung von Probiotika
An folgenden Modellen konnte eine Schutzwirkung nachgewiesen werden: Reisediarrhö/Wistarratte (Bisson et al. 2010), Citrobacter-rodentium-Infektion/neonatale Maus (Gareau et al. 2010), akute Gastroenteritis/Hund (Herstad et al. 2010), bessere Entwicklung, Anstieg Plasmaimmunoglobuline/Broileraufzucht (Mountzouris et al. 2010), Kolonkarzinom/Maus (de Moreno de LeBlanc und Perdigón 2005).
Klinische Effektivität von Probiotika
In den letzten Jahren ist die Anzahl registrierter klinischer Studien mit der Zielsetzung, die Effektivität von Probiotika zu untersuchen, deutlich angestiegen (Tab. 5.4 ).
Tab. 5.4.
Registrierte klinische Studien.
| Jahr | USA | Außerhalb der USA |
|---|---|---|
| Vor 2003 | 0 | 2 |
| 2003 | 0 | 3 |
| 2004 | 4 | 5 |
| 2005 | 5 | 15 |
| 2006 | 6 | 21 |
| 2007 | 6 | 24 |
(Gorbach 2008)
Nach Vanderhoof und Young (2008) erscheint es aussichtsreich, durch Probiotika folgende Erkrankungen präventiv oder therapeutisch zu beeinflussen: virale Diarrhö, antibiotikaassoziierte Diarrhö, C.-difficile-assoziierte Diarrhö, Reisediarrhö, atopische Dermatitis, Reizdarmsyndrom, rheumatoide Arthritis, Morbus Crohn und/oder ulzeröse Kolitis, bakterielle Überbesiedlung des Dünndarms (small intestinal bacterial overgrowth), Karies, kindliche Allergien und/oder Asthma (Prävention), Laktoseintoleranz, Dickdarmkrebs (symptomatische Besserung) und zu hoher Cholesterolspiegel.
Bei der Rotavirus-Gastroenteritis (Verkürzung der Erkrankungsdauer) und zur Prävention der nekrotisierenden Enterokolitis (NEC) bei Neugeborenem mit sehr niedrigem Geburtsgewicht (VLBW) ist der Nutzen von Probiotika als gesichert anzusehen.
Bei akuter Rotavirus-Gastroenteritis konnte die Erkrankungsdauer ohne weitere Nebenwirkungen um 3 Tage verkürzt werden, sofern Lactobacillus GG am 1. Erkrankungstag gegeben wurde (Shornikova et al. 1997).
In einer prospektiven randomisierten verblindeten Studie wurde bei VLBW Ernährung mit Muttermilch (2-mal/d, n = 187) verglichen mit Ernährung durch Muttermilch + Infloran (Lactobacillus acidophilus + Bifidobacterium infantis; 2-mal/d, n = 180). Sowohl die Letalität (24/187 vs. 9/180) als auch die NEC > Stadium 2 (10/187 vs. 2/180) wurden durch Zusatz von Infloran signifikant reduziert. Es waren keine Probiotika in der Blutkultur nachweisbar (Lin et al. 2005). Als Ergebnis einer Metaanalyse, bei der 7 von 12 randomisierten Studien auswertbar waren, ergaben sich gleichfalls ein geringeres Risiko für NEC (relatives Risiko 0,36), eine reduzierte Letalität (relatives Risiko 0,47) und eine verkürzte Zeit bis zu normaler Ernährung. Die Gabe von Probiotika hatte keinen Einfluss auf die Sepsisrate (relatives Risiko 0,94) und auch sonst wurden keine Nebenwirkungen beobachtet (Deshpande et al. 2007).
Eine schwächere Evidenz zur Effektivität von Probiotika mit dem Erfordernis weiterer Studien ist gegeben bei
-
•
antibiotikaassoziierter Diarrhö bei Erwachsenen mit Einsatz einer Mischung von B. mesentericus, E. faecalis und C. butyricum, allerdings nicht bei C.-difficile-assoziierter Diarrhö (Chen et al. 2010),
-
•
Therapie der akute Diarrhö im Kindesalter (Weizmann 2010),
-
•
chronischer Obstipation,
-
•
Reisediarrhö (McFarland 2010),
-
•
Senkung der Morbidität von akuten respiratorischen Infektionen (Cox et al. 2010).
Aussichtsreich ist der Einsatz von Probiotika zur Prävention von SSI vor viszeralchirurgischen Eingriffen, präoperativ beginnend und fortgesetzt postoperativ bis zur Stabilisierung der Darmflora (Gianotti et al. 2010, Liu et al. 2011), ausgehend von der Hypothese, dass es während der Hospitalisierung zu einem Wechsel der Darmflora mit Ansiedlung unerwünschter nosokomialer Erreger kommt, die lokal und durch Translokation (Linton und Hinton 1988, Wells 1990) Ursache von SSI werden können. Weitere Hinweise für die Effektivität von Probiotika liefert die Erhöhung der Kolonisationsresistenz als Schutz vor nosokomialer Besiedlung bei Intensivpatienten (Forestier et al. 2008), als Schutz vor H.-pylori-Infektion (Lesbros-Pantoflickova et al. 2007) sowie als Schutz vor Darminfektion mit Pathogenen (Paton et al. 2006). Ebenso wurde die durch Lipopolysaccharide induzierte Akute-Phase-Response durch Probiotika reduziert (Jiang et al. 2010). Die Hypothese wird weiterhin dadurch gestützt, dass diverse Lactobacilli und verwandte Species physiologisch eine größere Rolle im Magen spielen als bisher bekannt war (Ryan et al. 2008).
Erste vielversprechende klinische Ergebnisse zur Reduktion von SSI wurden erzielt bei Pankreatoduodenektomie und Lebertransplantation (Rayes et al. 2002b, 2005, 2007) sowie bei Hepatektomie wegen Gallengangskarzinom (Sugawara et al. 2006). Bei Patienten mit multiplem Trauma oder akuter Pankreatitis wurden die Raten an Sepsis und SSI sowie die Mortalität reduziert (Madsen 2008). Möglicherweise ist die Gabe von Probiotika eine kostengünstige gleichwertige Alternative zur selektiven Darmdekontamination ohne deren Problematik des erhöhten Selektionsdrucks auf Bakterien (Rayes et al. 2002a).
Derzeit ist die Indikation nicht gesichert bei
-
•
Reizdarmsyndrom (positive Wirkungen in Einzelstudien, starker Placeboeffekt, keine Langzeitergebnisse; Hoveyda et al. 2009),
-
•
Morbus Crohn und Colitis ulcerosa (Marteau et al. 2006),
-
•
Neurodermitis (Brouwer et al. 2006).
Bei nekrotisierender Pankreatitis wurde in der PROPATRIA-Studie durch Probiotika eine erhöhte Letalität induziert (Besselink et al. 2008).
Als absolute Kontraindikationen für den klinischen Einsatz von Probiotika sind Sepsis, akute Pankreatitis und schwere Immunsuppression anzusehen.
Bei nekrotisierender Pankreatitis wurde in der PROPATRIA-Studie durch Probiotika eine erhöhte Letalität induziert (Besselink et al. 2008). Bei probiotischer Therapie eines Neonaten mit Omphalozele wurde eine Sepsis durch Bifidobacterium breve ausgelöst (Ohishi et al. 2010).
Als Fazit der bisherigen Studien lässt sich ableiten: Probiotika sind wie ein Gegenfeuer – mit der richtigen Idee wirkungsvoll, mit der falschen Idee verhängnisvoll.Probiotika\"\r\"Infektionspraevprobiotika Probiotika:Infektionsprävention\"\r\"Infektionspraevprobiotika
5.4. Der verstorbene Patient
Stefan Koch und Infektionsprävention:Ernährung\"\r\"InfektionspraevErnaehrMichael Ossadnik
Die hygienische Bedeutung von Leichen wird vom Laien, aber auch vom Ernährung:Infektionsprävention\"\r\"InfektionspraevErnaehrmedizinischen Personal vielfach überschätzt. Erst bei fortgeschrittener Leichenfäulnis treten als Folge der Proteolyse biogene Amine und Ptomaine auf, deren Berührung jedoch ungefährlich ist.
Bei im Krankenhaus auftretenden Sterbefällen können folgende Situationen unterschieden werden:
-
•
Sterbefall mit bekannter Anamnese und Diagnose. Sofern keine ansteckende Krankheit vorlag, besteht kein höheres hygienisches Risiko als zu Lebzeiten.
-
•
Sterbefall mit noch nicht geklärtem Grund- und Nebenleiden (z. B. Tod zu Beginn des Krankenhausaufenthalts) soll so lange als potenziell ansteckend betrachtet werden, bis etwaige Verdachtsmomente (Tbk, AIDS, Virushepatitis, CJD) ausgeräumt sind. Ebenso müssen bei der Behandlung akut erkrankter Patienten, die im bewusstlosen oder moribunden Zustand zunächst in der Notaufnahme des Krankenhauses behandelt wurden und noch dort verstorben sind, Schutzmaßnahmen beachtet werden.
-
•
Sterbefall infolge ansteckender Krankheit bzw. mit ansteckender Krankheit als Nebenleiden (z. B. auch bei immunsuppressiver Behandlung und reduzierter Immunitätslage) bedarf in Abhängigkeit von der Erkrankung spezieller Schutzmaßnahmen (Kap. 2.11).
5.4.1. Versorgung verstorbener Patienten
Bei der Versorgung Verstorbener, die i. d. R. vom Pflegepersonal durchzuführen ist, sind folgende Prinzipien zu beachten:
-
•
Wichtigster Grundsatz ist die dem Verstorbenen entgegenzubringende Achtung, wie sie auch dem Lebenden gebührt.
-
•
Der Verstorbene wird, falls nicht schon in der Sterbephase geschehen, mit seinem Bett in ein Einzelzimmer gebracht. Sollte sich im Notfall der Sterbeplatz in einem Mehrbettzimmer befinden, ist er mit Wandschirmen vom übrigen Zimmer abzutrennen.
Der Todeseintritt ist durch die ärztliche Leichenschau festzustellen. Bei dieser sind medizinische Schutzhandschuhe, ein Schutzkittel und, sofern ansteckende Krankheiten vermutet werden oder bekannt sind, ggf. Mund-Nasen- und Gesichtsschutz zu tragen.
-
•
Die Versorgung des verstorbenen Patienten sollte möglichst frühzeitig nach dem ärztlich festgestellten Todeseintritt durchgeführt werden.
-
•
Durch das Pflegepersonal wird der Verstorbene flach im Bett gelagert. Alle Kissen, Decken und Lagerungshilfsmittel werden entfernt. Eventuelle Verschmutzungen wie Blut oder Reste von Pflaster und Salbenverbänden werden ebenso entfernt wie Infusionen, Katheter und Sonden.
-
•
Drainagen sollten durch das Pflegepersonal knapp über der Wunde gekürzt, mit dicht schließenden Klemmen oder eng anliegenden Plastikbeuteln verschlossen, aber nicht gezogen werden. Eine vollständige Entfernung gekürzter Drainageschläuche usw. sollte erst vom Personal der Pathologie bzw. des Bestattungswesens erfolgen, um die im Rahmen einer evtl. durchzuführenden Sektion erfolgende Dokumentation nicht zu verfälschen.
-
•
Dem Verstorbenen wird ein frisches Hemd (Einmalhemd) angezogen; verstorbene Säuglinge werden in ein Leinentuch eingeschlagen. Die Augen sind zu schließen und mit feuchtem Tupfer zu beschweren. Die Haare werden gekämmt, das Kinn wird mit einer Mullbinde hochgebunden, die Hände werden gefaltet oder seitlich neben den Körper gelegt.
-
•
Schmuck ist zu entfernen. Wird ein Ehering getragen, ist der Ehegatte zu befragen, ob dieser zu entfernen ist. Zahnprothesen sollen erst entfernt werden, wenn sicher ist, dass keine Angehörigen vom Verstorbenen Abschied nehmen wollen.
-
•
Zur Identifizierung erhält der Verstorbene einen sog. Fußzettel an Großzehe oder Unterschenkel gebunden. Auf ihm sind die Personalien des Verstorbenen, Sterbedatum und Station zu notieren.
-
•
Der Verstorbene wird abschließend mit einem sauberen Leinentuch ganz bedeckt.
Infektiöse Verstorbene sollten besonders gekennzeichnet werden. Die Leinentuchabdeckung sollte ggf. mit Desinfektionslösung getränkt werden; besser ist ein Leichensack aus Plastikfolie mit Reißverschluss (bodybag).
Im Fall einer übertragbaren Krankheit soll der Verstorbene nicht gewaschen, rasiert oder frisiert werden. Situationsabhängig ist zu entscheiden, ob ein Umkleiden erforderlich bzw. vertretbar ist. In Abhängigkeit von der Übertragbarkeit der vorliegenden Erkrankung ist die Kleidung des Verstorbenen ggf. als infektiöse Wäsche zu entsorgen bzw. zur Wiederaufbereitung einem Desinfektionswaschverfahren zuzuführen.
Die nachfolgenden Empfehlungen sind in jedem Fall auf die vorliegende Infektionskrankheit abzustimmen:
-
•
Das Personal hat Hygieneschutzbekleidung mit Überkleidern bzw. flüssigkeitsundurchlässigen Schürzen und Handschuhe zu tragen.
-
•
Nicht klimatisierte Zimmer sollten gelüftet werden.
Nach der Versorgung einschließlich der Abschiednahme wird der Verstorbene so unauffällig wie möglich in die Leichenhalle bzw. den Leichenkühlraum transportiert.
Bett, Nachttisch und je nach Todesursache auch das übrige Bettenzimmer werden desinfizierend gereinigt.
Privateigentum wird erfasst und geht ggf. desinfiziert an die Angehörigen mit Nachlassprotokoll zurück.
5.4.2. Abschiednahme und Aufbahrung
Die Abschiednahme auf Station sollte ärztlich oder pflegerisch begleitet werden. In Vorbereitung der Abschiednahme werden der Oberkörper, zumindest aber das Gesicht des Verstorbenen aufgedeckt, Augentupfer und Kinnbinde werden entfernt. Sollte der Mund nicht geschlossen bleiben, empfiehlt sich eine unter das Kinn gelegte und mit dem Hemd versteckte Mullbinde. Es versteht sich leider nicht von selbst, dass die letzte Begegnung nicht im Stationsbad oder im Geräteraum stattfinden kann.
Da die zeitliche Verzögerung des Abtransports des Leichnams, wenn die Hinterbliebenen längere Anfahrtswege haben, organisatorische und hygienische Probleme aufwerfen kann, sollte in der Einrichtung oder bei Vorhandensein eines Instituts für Pathologie innerhalb desselben ein Raum der Stille existieren, in dem eine pietätvolle hygienisch einwandfreie Abschiednahme gewährleistet ist. Der Leichnam sollte in einem desinfizierbaren, abwaschbaren Spezialsarg mit Edelstahlboden und abnehmbaren Seitenwände liegen. Die Innenauskleidung des Aufbahrungssargs (meist Papier bzw. Karton) muss bei eventueller Verschmutzung problemlos entfernbar sein. Die zur Aufbahrung verwendete Sarggarnitur und das Leichenhemd können bei der Abholung des Verstorbenen durch das Bestattungsunternehmen mit übergeben werden und verursachen dadurch keine zusätzlichen hygienischen, organisatorischen und finanziellen Aufwendungen.
Aus krankenhaushygienischen Gründen ist eine Wand- und Fußbodengestaltung mit abwaschbaren Werkstoffen (z. B. Keramik, Kunst- oder Naturstein) vorzuziehen. Der Raum sollte über eine Be- und Entlüftung verfügen. Der Aufbahrungsraum muss für das Personal zum Zwecke der Herrichtung des Leichnams vom Einsargungsraum zugängig sein und nach Möglichkeit nahe den Kühlräumen liegen. Eine Abtrennung des Aufbahrungsraums vom Besucherraum über eine stabile (bruchsichere) Scheibe oder eine nicht übersteigbare Barriere ist nicht mehr zeitgemäß.
Die Lage des Aufbahrungs- und Besucherraums sollte jeglichen Durchgangsverkehr, Beeinträchtigungen durch Geräusche (Kühlmaschinen, Rohre, Gespräche des Personals usw.) zugunsten einer pietätvollen besinnlichen Abschiednahme ausschließen. Nach der Aufbahrung ist der Aufbahrungssarg zu desinfizieren und zu reinigen.
Für kleinere Einrichtungen, in denen eine Abschiednahme auf der Station nicht möglich und kein Raum der Stille vorhanden ist, sollten die Angehörigen darauf hingewiesen werden, dass die meisten Bestattungsunternehmen über Räume für die Abschiednahme verfügen.
Zu beachten ist, dass verschiedene Konfessionen teilweise strenge Riten für den Umgang mit Verstorbenen haben. Die evangelische und katholische Kirche haben keine besonderen Vorschriften. Angehörige jüdischen Glaubens möchten Totenwache halten. Ist keine Familie bekannt, muss die jüdische Gemeinde benachrichtigt werden. Der Islam fordert, dass die Füße des Verstorbenen nicht nach Südosten gerichtet sind. Nach der rituellen Leichenwaschung darf der Leichnam nicht mehr von Andersgläubigen berührt werden
Bei Verstorbenen mit ansteckenden Krankheiten ist auf eine Aufbahrung zu verzichten.
5.4.3. Transport von Verstorbenen
Der Transport wurde in der Vergangenheit auf unterschiedliche und z. T. pietätlose Weise praktiziert (fahrbare Blechwanne mit Haube, Transport ohne gesondertes Behältnis in Fahrzeugen usw.). Die einzig akzeptable Variante ist der Transport des Verstorbenen in seinem Bett (oder Stretcher), das i. d. R. höhenverstellbar ist und ein kräfteschonendes Umlagern erleichtert.
Der Leichentransport außerhalb des Krankenhauses bleibt autorisierten Bestattungsunternehmen vorbehalten. Mit der fachgerechten Aufbewahrung des Verstorbenen in speziell dafür vorgesehenen Kühleinrichtungen und der Übergabe des Leichnams an das beauftragte Bestattungsunternehmen endet die Verantwortlichkeit des Krankenhauses.
5.5. Prävention von SSI in der Chirurgie
Axel Kramer, Günter Kampf, Kurt Oldhafer, Stefan Maier und Claus-Dieter Heidecke
5.5.1. Grundlagen
Definition der SSI
Verstorbene\"\r\"PatzienttotGemäß CDC-Definition wird Patient(en):verstorbene\"\r\"Patzienttotnach dem Schweregrad unterschieden zwischen oberflächlichen (A1) und tiefen Infektionen des OP-Schnitts (A2) sowie Infektionen von Räumen und Organen im OP-Gebiet (A3; Kap. 3.1).
Die Diagnose gründet sich auf klinischen, radiologischen und/oder labordiagnostischen Befunden, insbesondere Erreger- und/oder Antigen- bzw. Antikörpernachweise, mikroskopische Befunde sowie die Diagnose des behandelnden Arztes (Kap. 3.1).
Grundbegriffe der Epidemiologie zur Charakterisierung von SSI
Inzidenz: Sie ist definiert als Anzahl von Patienten mit Neuerkrankungen in einem bestimmten Zeitraum an einer bestimmten Krankheit, bezogen auf 1.000, 10.000 oder 100.000 Personen.
In der Studie der DKG (1990) wurden unterschiedliche Inzidenzen für SSI und weitere NI ermittelt (Tab. 5.5 ). Erwartungsgemäß war das Infektionsrisiko in der Abdominalchirurgie aufgrund der endogenen Erregerexposition am höchsten.
Tab. 5.5.
Inzidenz nosokomialer Infektionen in chirurgischen Abteilungen (DKG 1990).nosokomiale Infektion(en):Chirurgie
| Abteilung | % | Art der NI | % |
|---|---|---|---|
| Gefäßchirurgie | 1 | Harnwegsinfektion | 37,4 |
| Allgemeinchirurgie | 7,1 | SSI | 34,1 |
| Knochen- und Gelenkchirurgie | 10,6 | Infektionen der unteren Atemwege | 15 |
| Abdominalchirurgie | 13,5 | Infektionen der oberen Atemwege | 3,7 |
| Sepsis | 1,7 |
Im KISS-Projekt (NRZ 2001) wurde das Infektionsrisiko eingriffabhängig ermittelt (Tab. 5.6 ). Insofern ist ein Vergleich mit Tabelle 5.5.1 nicht möglich. Es fällt aber die niedrigere Inzidenz auf.
Tab. 5.6.
SSI-Inzidenz im Zeitraum Januar 1997 bis Dezember 2000 (NRZ 2001).
| Eingriff | n | Gepoolte SSI-Raten |
||
|---|---|---|---|---|
| A1 | A2 | A3 | ||
| Appendektomie | 7.436 | 1,43 | 0,47 | 0,38 |
| Cholezystektomie | 11.911 | 0,99 | 0,39 | 0,24 |
| Kolonchirurgie | 5.624 | 2,76 | 2,03 | 1,83 |
| Gefäßchirurgie | 3.591 | 1,62 | 1,48 | 0,25 |
| Herniotomie | 11.093 | 1,28 | 0,49 | 0,03 |
| Mastektomie | 3.011 | 1,16 | 0,37 | 0,13 |
| Strumektomie | 3.063 | 0,2 | 0,13 | 0,03 |
Hansis und Jakschik (2001) geben im Ergebnis der Literaturauswertung Richtwerte für „akzeptable“ SSI-Raten an (Tab. 5.7 ), machen aber darauf aufmerksam, das SSI-Raten aufgrund bisher nicht allgemein akzeptierter Erfassungsmethoden nur intrahospital Gültigkeit SSI:Inzidenzbesitzen und lediglich orientierend für einen interhospitalen Vergleich herangezogen werden können.
Tab. 5.7.
Richtwerte für „akzeptable“ SSI-Inzidenzraten.
| Disziplin | „Akzeptable“ Inzidenzrate für SSI (%) |
|
|---|---|---|
| Kontaminationsgrad des OP-Felds | ||
| Aseptisch | Kontaminiert | |
| Viszeralchirurgie | 2,5 | 15 |
| Gefäßchirurgie | 1 | 8 |
| Thoraxchirurgie | 2 | 10 |
| Unfallchirurgie/Orthopädie | 2 | 10 |
(Hansis und Jakschik 2001)
Prävalenz: Sie gibt die Anzahl einer definierten Krankheit an einem Stichtag (point prevalence) oder in einem Intervall (period prevalence) an. Sie ist abhängig von der Krankheitsdauer. Zur Ermittlung der Prävalenz von NI werden alle Patienten, die sich an einem bestimmten Tag in einem Krankenhaus oder Prävalenzauf einer Station befinden, durch trainierte Prüfärzte auf das Vorhandensein der NI beurteilt (Kampf et al. 1996a). Um möglichst konsistente Daten zu erhalten, ist eine Mindesthospitalisierungsdauer von z. B. 2 Tagen als Einschlusskriterium bei eindeutiger Falldefinition festzulegen. Prävalenzraten vermitteln nur einen begrenzten Eindruck über die tatsächliche Verbreitung einer Krankheit aufgrund einer Vielzahl von Faktoren wie Neuzugängen, Liegedauer usw. (Kap. 3.1).
In der NIDEP-1-Studie wurde für 5.377 Patienten chirurgischer Abteilungen von 72 Krankenhäusern als SSI-Prävalenz 1,34 % ermittelt. Betrachtet man nur die operierten Patienten, lag die Prävalenz bei 2,13 %, aufgeschlüsselt für Cholezystektomien bei 1 %, für Herniotomien bei 2,9 %, für Kolon- oder Rektumoperationen bei 3,8 % und für Appendektomien bei 4,1 % (Kampf et al. 1996b). SSI sind nach Harnwegsinfektionen (1,45 %) die zweithäufigste NI in der Chirurgie (Kampf et al. 1996a).
Letalität: Sie gibt die Zahl der Sterbefälle einer bestimmten Krankheit, bezogen auf die Zahl der Erkrankten an dieser Krankheit, an. Als Letalitätsrate wird sie in Abhängigkeit von der Häufigkeit der Erkrankung auf 10.000 oder 100.000 Erkrankte bezogen. Sie ist ein Maß für die Gefährlichkeit einer Krankheit.Letalität
Infektionsquelle: Sie ist der Ort, an dem sich ein Erreger aufhält, ggf. vermehrt (z. B. Mensch, Erdboden, Tier) und von dem aus die Infektion ihren Ursprung nimmt.
Erregerreservoir: Es bezeichnet den Standort, an dem sich ein Erreger nach Kontamination Infektionsquelle(n)häufig oder dauernd (ende misch) aufhält und von dem aus eine Infektion oder Kolonisation ausgelöst wird.
Übertragung: Sie erfolgt direkt (z. B. Tröpfchen-, Schmier-, Erregerreservoirsexuelle, natale, transplazentare Infektion) oder indirekt über belebte (z. B. Hände) oder unbelebte Träger (z. B. Wasser, Lebensmittel, Körpersekrete, unzureichend aufbereitete MP), durch Vektoren (z. B. Schaben, Ameisen) oder durch Stäube und ÜbertragungAerosole (z. B. Legionellen, atypische Mykobakterien).
Infektionsketten: Sie bezeichnen den Weg der Übertragung vom Krankheitserreger von einem Wirt auf den anderen. Bei der Kreuzinfektion wird ein identischer Krankheitserreger von einer Infektionsquelle oder einem Erregerreservoir direkt oder indirekt auf andere Wirte übertragen und von dort aus Infektionskette(n)weiterverbreitet, z. B. in derselben Pflegeeinheit.
Infektionsrisiko: Das Infektionsrisiko wird durch die Eigenschaften der Mikroorganismen bestimmt wie Virulenz (Grad der Pathogenität), Kontagiosität (Übertragbarkeit), Anzahl der Krankheitserreger, Tenazität (Haftfähigkeit), Invasivität (Eindringvermögen), Vitalität (Vermehrungsvermögen), Toxizität (Giftigkeit), InfektionsrisikoImmunität (Abwehrvermögen). Patienten mit malignen Erkrankungen, Leukopenie, Autoimmunerkrankungen, offenen Verletzungen, AIDS und Diabetes mellitus sind besonders infektionsgefährdet. Ist die Dauer für eine bestimmte OP über der 75. Percentile, ist damit ein höheres SSI-Risiko verbunden (Anonym 1991). Tracheostoma, apparative Beatmung, Harnblasen- und Gefäßkatheter sowie Drainagen erhöhen ebenfalls das Infektionsrisiko (Abb. 5.1 ).
Abb. 5.1.
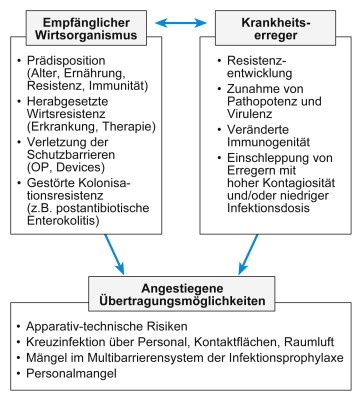
Ursachenkomplex für SSI:UrsachenSSI.
Zweifellos ist der Patient selbst wichtigste Quelle für SSI, gefolgt vom Personal. Bezüglich des Stellenwerts der Übertragungswege lässt sich anhand von Basiswissen, Kasuistiken und Studien bestenfalls eine grobe Einstufung ableiten (Abb. 5.2 ).
Abb. 5.2.
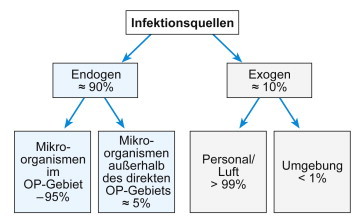
Übertragungswege für Erreger von SSI:ÜbertragungswegeSSI.
Für das Entstehen von SSI ist eine Reihe von Risikofaktoren gesichert (Tab. 5.8 ).
Tab. 5.8.
Risikofaktoren für das Entstehen von SSI.
| Risikofaktor | |
|---|---|
| Präoperativ (Wirtsorganismus) | Hoher NNIS-Score (Kap. 5.7), verlängerte präoperative Verweildauer, höheres Lebensalter, Vorerkrankungen wie Diabetes mellitus, Infektion/Kolonisation mit MRE, Infektion anderer Lokalisation, nasale Kolonisation mit Staphylococcus (S.) aureus/MRSA, Mangelnährung, Adipositas, Vitamin-C-Mangel, Rauchen, Alkoholabusus, Tumorstadium, Anämie, Granulozytopenie < 1.500/μl, bestimmte OP-Arten |
| Perioperativ | Unsachgerechte OP-Feldvorbereitung, nicht korrekte PAP, verzögerter OP-Zeitpunkt bei Verletzung, Hypothermie, Hypoxie, bakterienpermeable Schutzkleidung und Abdeckmaterial, unsachgerechte chirurgische Händedesinfektion, Handschuhperforation, Respirationstraktinfektion beim OP-Team |
| Eingriffbezogen | Anzahl und Umfang des Eingriffs, OP-Technik einschließlich Blutstillung, Notfall- oder Elektiveingriff, Implantat |
| Postoperativ | Unsachgerechte postoperative Wundversorgung, Drainage, parenterale Ernährung, antibiotische Behandlung > 1 Tag postoperativ |
(Quellenangaben in KRINKO 2007)
Das Hygienemanagement muss folgende Infektionsmöglichkeiten berücksichtigen:
-
•
Iatrogene NI durch direkte Übertragung durch Arzt oder Pflegepersonal bei diagnostischen oder therapeutischen Eingriffen,
-
•
apparativ bedingte NI durch MP oder krankenhaustechnische Ausrüstungen,
-
•
Umgebungsinfektion aus dem Milieu der Gesundheitseinrichtung, z. B. über Hände oder Raumluft (z. B. Schimmelpilzinfektion bei Immunsuppression),
-
•
endogene oder Selbstinfektion mit Herkunft des Erregers vom Patienten selbst (Kap. 3.1),
-
•
eingeschleppte Infektion durch andere Patienten, das Team oder Besucher (überwiegend sog. community-acquired infections).
Voraussetzung für das Entstehen einer SSI ist die endogene Präsenz von Krankheitserregern oder deren exogene Eintrag. Die Infektion kann prä-, intra- und selten auch postoperativ entstehen und u. U. erst nach Wochen oder Monaten zum Ausbruch kommen.
Es ist zu beachten, dass das ärztliche und pflegerische Team nicht nur als Überträger, sondern auch als Infektionsquelle in Betracht kommt. Aus diesem Grund dürfen Mitarbeiter mit eitrigen Infektionen für die Dauer der Infektiosität nicht operativ tätig werden (KRINKO 2007).
Ätiologie von SSI
In der Viszeralchirurgie sind Vertreter der Darmflora häufigste Ursache von SSI (Tab. 5.9 ). Ebenfalls endogen ist S. aureus, ausgehend von der Kolonisation im Nasen-Rachen-Raum, häufige Ursache von SSI (Wenzel und Perl 1995). Im Ergebnis des NNIS wird deutlich, dass sich im Vergleich der Zeiträume 1986–1989 mit 1990–1996 die Ätiologie von SSI nicht wesentlich geändert hat (Tab. 5.9).
Tab. 5.9.
Isolate bei SSI.Staphylococcus aureus:SSIPseudomonas aeruginosa:SSIProteus mirabilis:SSIKNS:SSIKlebsiella pneumoniae:SSIEnterokokken:SSIEnterobacter:SSIE. coli:SSI
| Erreger | Anteil (%) der Isolate1 | |
|---|---|---|
| 19.861–989 (n = 16.727) | 1990–1996 (n = 17.671) | |
| S. aureus | 17 | 20 |
| KNS | 12 | 14 |
| Enterococcus spp. | 13 | 12 |
| E. coli | 10 | 8 |
| P. aeruginosa | 8 | 8 |
| Enterobacter spp. | 8 | 7 |
| P.mirabilis | 4 | 3 |
| Klebsiella (K.) pneumoniae | 3 | 3 |
| andere Streptococcus spp. | 3 | 3 |
| C. albicans | 2 | 3 |
| Streptococcus Gruppe D | – | 2 |
| andere grampositive Aerobier | – | 2 |
| B. fragilis | – | 2 |
Ausschluss von Isolaten mit einem Anteil < 2 %.
Folgen von SSI
Durch Fall-Kontroll-Studien konnte gezeigt werden, dass Patienten mit SSI eine 2-fach höhere Wahrscheinlichkeit haben zu sterben, eine 60 % höhere Wahrscheinlichkeit, auf der Intensivstation behandelt zu werden, und eine 5-fach höhere Wahrscheinlichkeit, neuerlich im Krankenhaus behandelt zu werden. Durchschnittlich entstehen durch eine SSI Kosten von ca. 3.000 Euro, die Aufenthaltsdauer in der Klinik verlängert sich um ca. 6,5 Tage (Kirkland et al. 1999).
5.5.2. Prävention von SSI
Nachfolgend werden nur Quellen angegeben, die nicht in der Empfehlung der KRINKO zur Prävention postoperativer Infektionen (2007) enthalten sind, um den Kapitelumfang zu limitieren.
Während eine Reihe von Präventionsmaßnahmen ungeachtet der Evidenzstärke etablierter Standard ist, unterliegen aufgrund neuer Erkenntnisse oder Entwicklungen eingeführte Maßnahmen der fortlaufenden Evaluierung (Tab. 5.10 ).
Tab. 5.10.
Verankerung ausgewählter Maßnahmen zur Prävention von SSI im chirurgischen Alltag.
| Zeitpunkt der Maßnahme | Aktuelle Verankerung |
|---|---|
| Prä-, perioperativ | |
|
Standard1 |
|
Wachsende Bedeutung1 |
|
Standard1 |
|
Standard1 |
|
Standard2 |
|
Wachsende Bedeutung2 |
|
Standard1 |
|
Standard1, 2 |
|
Standard1 |
|
Beginnende Bedeutung1 |
|
Wenig verbreitet1 |
|
Wachsende Bedeutung1 |
| Intraoperativ | |
|
Wachsende Bedeutung1 |
|
Standard1 |
|
Wachsende Bedeutung1 |
|
Beginnende Bedeutung2 |
|
Nutzen nur für Implantation von Hüft- und Knieendoprothesen mit geringer Evidenz2 |
| Postoperativ | |
|
Standard2 |
|
Wachsende Bedeutung1 |
|
Standard1 |
| Einführung sog. Bundles | Wachsende Bedeutung1 |
Epidemiologische Evidenz,
Begründet durch Risk Assessment
Präoperativ
Diabetes mellitus: Empfohlen wird die engmaschige Kontrolle des Blutglukosespiegels mit Vermeidung von Werten > 200 mg/dl bzw. > 11,1 mmol/l.
Adipositas: Bei Adipositas Grad II (BMI 35–40 kg/m2) und III (BMI > 40 kg/m2) Diabetes mellitus, SSI-Präventionkann im Rahmen elektiver Eingriffe eine Reduktion der Körpermasse erwogen werden. Das gilt insbesondere für Eingriffe, bei denen der Erfolg der OP unabhängig vom Auftreten von SSI von der Körpermasse beeinflusst Adipositas, SSI-Präventionwird (HEP, Narbenhernienrepair).
Mangelernährung: Bei der Etablierung der „Fast-Track“-Konzepte hat sich die Erkenntnis durchgesetzt, dass mehrtägiges Fasten vor viszeralchirurgischen Eingriffen zu vermeiden ist. Mangelernährung ist bei aufschiebbaren Eingriffen präoperativ auszugleichen (Kap. 5.3). Ob auch bei Mangelernährung:SSI-PräventionTumorerkrankungen ein Aufschieben der OP mit dem Ziel der Optimierung des Ernährungszustands sinnvoll ist, ist offen, weil keine Parameter bekannt sind, in welchem Ausmaß das Fortschreiten der onkologischen Grunderkrankung bei Verschieben der OP zu befürchten ist, und fraglich ist, ob und in welcher Zeit eine Verbesserung des Ernährungszustands erreichbar ist.
Grundsätzlich sollen Patienten bis zum OP-Tag und so rasch wie möglich postoperativ beginnend enteral ernährt werden.
Rauchen: Der Verzicht auf Rauchen ist dem Patienten dringend nahezulegen. Eine Karenz von 6–8 Wochen vor einem elektiven Eingriff reduziert das Auftreten von SSI signifikant.
Es wird empfohlen, das Rauchen mindestens 30 Tage vor einem elektiven Eingriff einzustellen.
In Anbetracht der akut vasokonstriktiven Wirkung ist es sinnvoll, auch unmittelbar postoperativ das Rauchen einzustellen.Rauchverzicht, SSI-Prävention
Anämie: Eine präoperativ nachgewiesene Anämie sollte nach den geltenden Leitlinien der Bundesärztekammer und der medizinischen Fachgesellschaften (KRINKO 2007) ausgeglichen werden.
Immunsuppression: Bei immunsupprimierten Patienten ist ein interdisziplinäres präoperatives Patientenmanagement zu empfehlen, damit sowohl Anämie, SSI-Präventionindividuelle Möglichkeiten der Reduktion der Immunsuppression als auch spezifische Maßnahmen zur Prophylaxe und ggf. antimikrobiellen Therapie festgelegt werden können.
Infektionen außerhalb sowie im OP-Gebiet:
Wann immer möglich, sollen vor elektiven Eingriffen klinisch manifeste Infektionen außerhalb sowie im OP-Gebiet identifiziert und saniert werden.
Screening auf Problemerreger:
Vor Problemerreger:Screening, SSI-Präventiongeplanten Eingriffen ist präoperativ das Screening auf S. aureus bzw. MRSA im Vestibulum nasi zu empfehlen, um bei positivem Nachweis die nasale Kolonisation zu eradizieren.
In der Greifswalder Universitätsmedizin konnte durch Erweiterung des MRSA-Screenings auf Patienten bereits mit einem Risikofaktor die Rate positiver Nachweise etwa 7-fach erhöht werden. Durch mehrere Studien ist belegt, dass ein mikrobiologisches MRSA-Screening mit sich anschließender Sanierung zur Reduktion sekundärer MRSA-Infektionen beiträgt und kosteneffektiv ist. Auch durch Sanierung von MSSA kann die Rate von SSI signifikant gesenkt werden (van Rijen et al. 2008, Awad et al. 2009, Bode et al. 2010). Da etwa ein Drittel der gesunden Bevölkerung MSSA im Vestibulum nasi trägt, erscheint der Aufwand für ein Screening entbehrlich und stattdessen bei jedem Patienten die präoperative Antiseptik im Vestibulum nasi sinnvoll (und kostenffektiv), allerdings wegen der Resistenzentwicklung anstatt mit Mupirocin z. B. mit Octenidin (Hübner et al. 2009).
Präoperative Verweildauer: Sie soll so kurz wie möglich (< 24 Stunden) gehalten werden (präoperative Diagnostik ggf. ambulant beginnen).
Präoperative Darmreinigung: In einer prospektiven Studie hatte der Verzicht auf eine präoperative Verweildauer:präoperativeDarmreinigung keinen Einfluss auf Mortalität (de Aguilar-Nascimento et al. 2009) oder SSI-Rate (Pena-Soria et al. 2008, Howard et al. 2009). Sie wird inzwischen als entbehrlich angesehen (Duncan und Quietmeyer Darmreinigung, präoperative2009), zumal dadurch Komplikationen einschließlich SSI verursacht werden können (Peppas et al. 2008, Shawki und Wexner 2008).
Perioperativ
Patientbezogen
Haarentfernung im OP-Gebiet: Falls die OP-technische Notwendigkeit gesehen wird, sind Technik und Zeitpunkt von Einfluss auf die SSI-Rate.
Bei Entfernung direkt vor dem Eingriff ist das SSI-Risiko am niedrigsten. Anstelle von Rasur (trocken oder nass) ist elektrisches Clipping wegen des geringeren SSI-Risikos und der geringeren Hautbelastung die Methode der Wahl.
Einschränkungen für den Einsatz von Enthaarungscreme sind das Risiko für Unverträglichkeiten und der Zeitaufwand. Die im Vergleich zur Rasur höheren Kosten für das Haarentfernung, OP-GebietClipping werden durch die geringere SSI-Rate kompensiert (Kramer et al. 2008).
Körperreinigung: In bisherigen Studien war durch über die übliche Körperhygiene hinausgehende präoperative Ganzkörperreinigung (Waschen oder Duschen/antiseptische Waschung) kein Einfluss auf die SSI-Rate nachweisbar. In einer neueren Studie wurde durch Kombination von Chlorhexidinbad Körperreinigung, SSI-Präventionund Clipping eine Senkung der SSI-Rate erreicht, wobei der Einfluss des Chlorhexidinbads offen bleibt (Dizer et al. 2009).
Perioperative Hautantiseptik:
Hautantiseptik:perioperative, SSI-PräventionMittel der Wahl sind alkoholbasierte Präparate.
Hier erwies sich Propan-1-ol als der wirksamste Monoalkohol im Vergleich zu Propan-2-ol bzw. Ethanol (Reichel et al. 2009). Wässrige PVP-Iod- und wässrige Chlorhexidin-Lösung sind signifikant geringer wirksam als alkoholbasierte Antiseptika. Ungeklärt ist, ob sich die Kombination von Chlorhexidin bzw. PVP-Iod mit Alkohol (z. B. Propan-2-ol) in der infektionspräventiven Wirksamkeit bei Anwendung zur Hautantiseptik unterscheiden (Tab. 5.11 ).
Tab. 5.11.
Wirksamkeit PVP-Iod- und chlorhexidinbasierter (Chx) bzw. alkoholbasierter Hautantiseptika.PVP-Jod:SSI-PräventionHautantiseptika, SSI-PräventionChlorhexidin:SSI-Prävention
| Verglichene Formulierungen | Studientyp | Endpunkt der Studie | Ergebnis | Quelle |
|---|---|---|---|---|
| Wässrige PVP-Iod-Lösung (A) vs. 2 % Chx in 70 % Propan-2-ol (Prop) (B) | Randomisiert | SSI-Rate innerhalb 30 d nach sauber-kontaminierten Eingriffen | B signifikant wirksamer als A | Darouich et al. (2010) |
| 2 % Chx in 70 % Prop1 vs. 2 % ethanolische Iodtinktur vs. 70 % Prop | Prospektiv, verblindet | Kontaminierte Blutkultur nach Blutentnahme | Kein Unterschied | Trautner et al. (2002) |
| Wässrige PVP-Iod-Lösung (A) vs. Iodpovacrylex in 70 % Prop (B) vs. 2 % Chx in 70 % Prop (C) | Sequenziell | SSI-Rate innerhalb 30 d | B signifikant wirksamer als A und C, in Subgruppen-Analyse A = B | Swenson et al. (2009) |
| 3 % Chx (A) vs. 10 % PVP-Iod (B), beides in wässriger Grundlage | Retrospektiv, quasi-experimentell | Kontaminierte Blutkultur nach Blutentnahme (2–36 Monate alte Kinder) | A signifikant wirksamer als B | Marlowe et al. (2010) |
| 70 % Propan-2-ol vs. PVP-Iod in 70 % Propan-2-ol | Partiell verblindet | Kontaminierte Blutkultur nach Blutentnahme | Kein Unterschied | Kiyoyama et al. (2008) |
| 70 % Prop (A) vs. PVP-Iod in 70 % Prop (B) | Randomisiert | Hautflora | B signifikant wirksamer als A | Birnbach et al. (2003) |
| 10 % PVP-Iod wässrig (A) vs. 2 % Chx wässrig (B) vs. 0,5 % Chx alkoholisch (C) | Prospektiv, randomisiert, kontrolliert | Kolonisation am distalen Ende von ZVK und arteriellen Kathetern | B und C signifikant wirksamer als A, B = C | Valles et al. (2008) |
| 10 % PVP-Iod wässrig (A) vs. 5 % PVP Iod in 70 % Ethanol (B) | Randomisiert | Kolonisation von ZVK | B signifikant wirksamer als A | Parienti et al. (2004) |
| 10 % PVP-Iod wässrig, 70 % Prop, Iodtinktur und PVP-Iod in 70 % Ethanol | Randomisiert, cross-over, verblindet | Kontaminierte Blutkultur nach Blutentnahme | Kein signifikanter Unterschied, tendenziell waren alkoholbasierte Präparate wirksamer | Calfee et al. (2002) |
| 10 % PVP-Iod (A) vs. 0,5 % Chx (B), je in 70 % Ethanol | Randomisiert, prospektiv | SSI-Rate innerhalb 30 d | B tendenziell wirksamer | Veiga et al. (2008) |
| 89,5 % Propan-1-ol ohne bzw. mit Chx (0,5, 1 bzw. 2 %) | randomisiert, prospektiv, verblindet | Rekolonisation der Hautflora | Zusatz von Chx verzögert Rekolonisation signifikant | Reichel et al. (2009) |
Propan-2-ol
(Assadian und Kramer 2011)
Perioperative Hautversiegelung: Nach Hautantiseptik verbleiben durchschnittlich 1 log KbE Mikroorganismen/cm2 auf der Haut. Hierbei handelt es sich um residente Hautflora mit S. epidermidis im Vordergrund. Hiervon ausgehend können Erreger intraoperativ in die OP-Wunde gelangen und Hautversiegelung, perioperative, SSI-PräventionSSI verursachen. Ursache für die unvollständige Wirksamkeit der Hautantiseptik ist die Lokalisation eines Teils der Bakterien in den Haarfollikeln (Lademann et al. 2010). Zur Blockierung dieses Erregerreservoirs durch Hautversiegelung nach Hautantiseptik war eine signifikante Senkung der SSI-Rate erreichbar (Dohmen und Konertz 2007, Wilson 2008, Dohmen et al. 2009).
Beim Einsatz von OP-Inzisionsfolie steigt dagegen die SSI-Rate signifikant an (Webster und Alghamdi 2007).
Im Unterschied dazu ist iodimprägnierte Inzisionsfolie in vitro mikrobiozid und auf der Haut antiseptisch wirksam. Aufgrund der Effektstärke ist eine Reduzierung der SSI-Rate allerdings nur bei großem Stichprobenumfang zu sichern (Kramer et al. 2010).
Perioperative Antibiotikaprophylaxe (PAP): Die Indikation zur PAP ergibt sich aus der Wundklassifikation und der Analyse zusätzlicher Risikofaktoren. Die entsprechenden Konsensusempfehlungen der Fachgesellschaften (z. B. PEG) sind zu beachten.
Bei gesicherter Indikation und einmaliger Verabreichung innerhalb des Zeitfensters von 30–60 Minuten leistet die PAP einen signifikanten Beitrag zur SSI-Reduktion.
Die Auswahl des Antibiotikums richtet sich nach der Wirksamkeit gegen die häufigsten Wundinfektionserreger für die jeweilige OP-Art und der lokalen Resistenzsituation (Prospero et al. 2010, Kap. 2.10.2).
OP-Feld-Abdeckung: Nach präoperativer Antiseptik wird das OP-Feld steril abgedeckt. Es gibt nur wenige Untersuchungen zur infektionspräventiven Bedeutung von Abdeckmaterialien. Nachgewiesen sind der infektionsbegünstigende Einfluss von Baumwollpartikeln sowie die Herabsetzung der Bakterienzahl in der Wunde und im OP-Feld bei erregerdichter impermeabler Abdeckung. Sofern OP-Abdeckmaterialien als MP Klasse IIa die Anforderungen der DIN EN 13795-1/3 (2010) erfüllen, sind Einweg- und Mehrwegmaterialien aus infektionspräventiver Sicht gleichwertig, denn beide sind bakteriendicht.
In Abhängigkeit vom Eingriff muss der Patient nicht vollständig entkleidet werden. Allerdings sind nicht entkleidete Patienten ggf. keimarm zu bedecken, um einen Erregereintrag in den OP-Situs einzuschränken und standardisierte OP-Bedingungen zu gewährleisten.
Normothermie: Als Hypothermie gelten Körpertemperaturen ≤ 36 °C. Intraoperativ tritt sie bei ca. 20 % der chirurgischen Patienten auf, verursacht durch Radiation, Konvektion, Evaporation und Konduktion (Kurz 2008). Intraoperative Hypothermie ist ein unabhängiger Risikofaktor für SSI (Normothermie, SSI-PräventionKurz et al. 1996; Linam et al. 2009). Die Ursachen sind multifaktoriell, z. B. verzögerte Gerinnung, erhöhte Fibrinolyse, durch Thrombozytopenie und verringerte Thromboxan-B2-Synthese vermehrter Blutverlust mit Transfusionsbedarf, Immunsuppression, periphere Vasokonstriktion mit Hypoxie der Wunde (Allen et al. 1997, Hopf et al. 1997, Greif et al. 2000).
Perioperativ soll der Zustand der Normothermie aufrechterhalten werden, sofern nicht therapeutische Gründe (z. B. Neuroprotektion) eine Hypothermie erfordern.
Die wirksamste Maßnahme zum Schutz vor Hypothermie ist die (aktive) präoperative Erwärmung in Verbindung mit intraoperativer Hauterwärmung. Zum Schutz des Patienten vor Auskühlung eignen sich temperierte OP-Tischauflagen, Wärmestrahler (Raumheizer, Infrarotlampen) und eine Wärme speichernde bzw. Wärme freisetzende Abdeckung. Aktives inneres Erwärmen ist endogen durch Aminosäureinfusion und exogen z. B. durch warme Infusionen, Inhalationen, Lavagen erreichbar.
Antiseptisches Nahtmaterial: Nahtmaterial ist einem Implantat vergleichbar. Als Oberfläche ergeben sich für einen 150 cm langen 1er polyfilen Vicryl-Faden 130 cm2, was der Oberfläche einer CD-Hülle (eine Seite) entspricht. Die um die Naht stattfindende Biofilmbildung schützt die Mikroorganismen vor der Nahtmaterial, SSI-PräventionWirtsabwehr (Everett 1970, Edlich et al. 1973, Kathju et al. 2009) und erhöht das SSI-Risiko (Blomstedt et al. 1977, Österberg und Blomstedt 1979). Nähte in kontaminierten Bereichen befähigen Bakterien zur Penetration in tiefere Gewebeschichten (Chu und Williams 1984). Zugleich wird die zur Infektion erforderliche Bakterienmenge durch Nahtmaterial ca. 10.000-fach reduziert (Howe und Marston 1962). Als Folge ist das Risiko der Nahtinsuffizienz durch Infektion in bakteriell besiedelten Darmbereichen erhöht. Mit Triclosan imprägniertes Nahtmaterial ist nicht nur in vitro und tierexperimentell antimikrobiell effektiv (Edmiston et al. 2006, Gomez-Alonso et al. 2007, Marko et al. 2007, Ming et al. 2008), sondern führte bei verschiedenen Eingriffsarten zur Senkung der SSI-Rate (Fleck et al. 2007, Pico et al. 2008, Rozzelle et al. 2008, Justinger et al. 2009, Galal und El-Hindawy 2011, Zhang et al. 2001). Auch die intraabdominale Verwendung absorbierbaren Nahtmaterials trägt zur Reduktion von SSI bei (Togo et al. 2008, Watanabe et al. 2008).
Teambezogen
Chirurgische Händedesinfektion (zusätzliche Quellenangaben in AWMF-Leitlinie 2008): Vor jedem chirurgischen Eingriff wird vom OP-Team die chirurgische Händedesinfektion mit alkoholbasierten Präparaten durchgeführt. PVP-Iod und Chlorhexidin sind in wässriger und in tensidbasierter Grundlage signifikant geringer wirksam. Aus toxikologischen Gründen ist PVP-Iod auch in alkoholbasierten Händedesinfektionsmitteln abzulehnen. Der Zusatz von Chlorhexidin kann in alkoholbasierten Händedesinfektionsmittel anaphylaktische oder allergische Reaktionen hervorrufen, eine verbesserte Wirksamkeit konnte nicht nachgewiesen werden. Die Dauer der chirurgischen Händedesinfektion kann je nach Präparat zwischen 1 und 5 Minuten betragen.
Die Handflächen sind für die Dauer der deklarierten Einwirkungszeit mittels Einreibetechnik komplett feucht zu halten.
Es empfiehlt sich folgendes Vorgehen: Zuerst Benetzung beider Hände (ca. 10 Sekunden), danach Benetzen beider Unterarme (je 10 Sekunden), für die restliche Zeit wiederholte Benetzung beider Hände mit sorgfältiger Erfassung der gesamten Fläche einschließlich Falzen und Interdigitalbereichen (Hübner et al. 2011). Bei der Durchführung sind keine nicht desinfizierten Hautbereiche zu berühren.
Die Seifenwaschung ist nicht mehr Bestandteil der chirurgischen Händedesinfektion. Dadurch wird die Wirksamkeit der nachfolgenden Desinfektion beeinträchtigt und die Haut irritiert (Kramer et al. 2008a). Der OP-Trakt ist mit sauberen Händen zu betreten, wobei die Händewaschung schon bei Betreten des Krankenhauses oder der Praxis stattfinden kann, um ausreichenden Abstand zur chirurgischen Händedesinfektion (mindestens 10 Minuten) zu bekommen (Kap. 2.1). Unabhängig davon, ob die Händewaschung in der OP-Schleuse oder zu einem früheren Zeitpunkt durchgeführt wurde, ist vor Anlegen der OP-Bereichskleidung eine hygienische Händedesinfektion durchzuführen, um nicht die Bereichskleidung beim Anlegen zu kontaminieren. Diese Maßnahme ist bei jeder neuen Einschleusung in den OP-Trakt zu wiederholen.
Fingernägel müssen rund und mit den Fingerkuppen abschließend geschnitten sein.
Es sind keine künstlichen Fingernägel zu tragen, weil diese als Quelle von Ausbrüchen von NI identifiziert wurden.
Die Nageloberfläche soll nicht rissig sein, z. B. durch abgeplatzten oder gerissenen Nagellack. Farbiger Nagellack ist abzulehnen, weil er die Sichtbeurteilung der Nägel verhindert. Bei Prüfung der hygienischen Händedesinfektion gemäß EN 1500 entsprach die Wirksamkeit 4 Stunden nach Auftragen von Nagellack dem Referenzverfahren. Dagegen konnte bei 5 Tage altem Nagellack eine signifikant geringere Wirkung der Händedesinfektion beobachtet werden. Damit erscheint die Empfehlung, keinen Nagellack im Gesundheitswesen zu tragen, berechtigt (Assadian et al. 2011).
Vor operativen Eingriffen sollten keine Nagelbettverletzungen oder entzündlichen Prozesse an der Hand vorliegen. Unter sorgfältiger Risikoabwägung erscheint es bei nichtentzündlichen Veränderungen bzw. kleinen Verletzungen im Bereich der Hand vertretbar, die OP mit zwei übereinandergezogenen Paar Handschuhen, ggf. nach vorheriger Abdeckung mit antiseptischer Salbe und zusätzlichem Fingerling, durchzuführen.
Zur Erhaltung des physiologischen Hautzustands sind regelmäßiger Hautschutz und Hautpflege unerlässlich (Kap. 5.20).
OP-Handschuhe sind wegen des Risikos der Hautirritation und erhöhter Perforationsgefahr erst auf der trockenen Hand anzulegen und nur so lange wie nötig zu tragen. Durch unter dem OP-Handschuh angelegte sterile Baumwollhandschuhe kann dem Feuchtigkeitsstau entgegengewirkt werden. Auch Biosorb™ Pudercreme reduziert die Schweißbildung ohne Einfluss auf die Perforationsrate (Partecke et al. 2009). Ungepuderte Handschuhe sind hautverträglicher als gepuderte.
Gepuderte Latexhandschuhe sind wegen der hohen Allergiegefahr untersagt.
Wegen des Perforationsrisikos wird das Tragen von zwei Paar übereinandergezogenen OP-Handschuhen empfohlen (double gloving). In der Viszeralchirurgie empfiehlt sich wegen der über die OP-Dauer ansteigenden Perforationsrate ein Handschuhwechsel für Operateur und 1. Assistenten nach spätestens 90 Minuten, für weitere Assistenten und OP-Schwestern nach 150 Minuten (Harnoß et al. 2009, Partecke et al. 2009, Hübner et al. 2010). Indikatorhandschuhe zeigten die Perforation in bis zu 83 % nicht an (Thomas et al. 2001).
Nach Ablegen der OP-Handschuhe ist eine hygienische Händedesinfektion zu empfehlen, weil die Hände durch unerkannte Leckagen mit Krankheitserregern kontaminiert sein können. Bei Eingriffen mit bekannter Viruslast muss das Desinfektionsmittel eine deklarierte Wirksamkeit gegen das betreffende Virus besitzen.
Bereichs- und Schutzkleidung: Die farbige OP-Bereichskleidung wird in der Schleuse angelegt. Sie ist bei sichtbarer Verschmutzung bzw. Kontamination sowie bei neuer Einschleusung zu wechseln. Beim Wechsel von Personal zwischen Aufwach- und OP-Raum muss (ggf. durch Schutzkittel) Sorge getragen werden, dass die Bereichskleidung nicht mit Krankheitserregern kontaminiert wird (Holst et al. 1997).
Vor Betreten des OP-Saals sollen chirurgischer Mund-Nasen-Schutz (MNS nach DIN EN 14683) und Haarschutz angelegt werden, sofern die sterilen Instrumente bereits gerichtet sind, eine OP demnächst beginnt oder eine OP durchgeführt wird. Der MNS muss ausreichend groß sein, Mund und Nase bedecken und eng am Gesicht anliegen. Barthaare müssen (ggf. in Kombination mit der OP-Haube) vollständig abgedeckt sein. Aus Gründen des Arbeitsschutzes kann es erforderlich sein (z. B. OP von Patienten mit florider Tuberkulose), eine Atemschutzmaske zu tragen (Kramer et al. 1997). Der Haarschutz muss das Haupthaar vollständig bedecken. Er darf nicht zu Hause gewaschen werden, weil aufgrund fehlender Verfahrensvalidierung keine sichere Desinfektion gewährleistet ist; vielmehr war im Gegenteil nach dem Waschprozess eine zunehmende Kontamination einschließlich potenziell pathogener Erreger nachweisbar (Hübner et al. 2011).
Wache Patienten mit Eingriff in Regionalanästhesie sollten ebenfalls einen MNS tragen, um beim Sprechen und Atmen die Verbreitung von Aerosolen zu vermeiden.
Hygieneverstöße sind ein nach OP herunterhängender MNS und dessen erneute Verwendung sowie der Griff zur benutzten Maske ohne nachfolgende Händedesinfektion.
Bei Gefahr des Verspritzens von Blut oder Sekreten sind Schutzbrille bzw. Gesichtsschild angezeigt.
OP-Schuhe sollen vor Kontamination durch Flüssigkeit schützen und maschinell aufbereitbar sein.
Vor jeder neuen OP muss die sterile OP-Kleidung gewechselt werden. Gleiches gilt für MNS und Haarschutz.
Standard-Performance-Qualität (flüssigkeitsabweisend) ist für feuchtigkeitsarme bzw. wenig dynamische Operationen, High-Performance-Qualität (flüssigkeitsdicht) für chirurgische Eingriffe mit hohem Flüssigkeitsanfall bzw. mit von der Intensität oder Dauer der Operation (Schwitzen) verbundenem erhöhtem Infektionsrisiko vorgesehen.
Sofern Schutzkleidung nicht die Anforderungen der DIN EN 13795 erfüllt, führt sie zur Patientengefährdung. Eine zusätzliche Sicherheit kann durch kritische (z. B. die Ärmel) und unkritische Bereiche des Schutzkittels – je nachdem, inwieweit der Bereich als Infektionsüberträger infrage kommt – erreicht werden. Der OP-Mantel soll knöchellang sein und darf in der Gestaltung von Kragen und Ärmelbündchen den Träger nicht behindern. Bewegungsfreiheit, Feuchtigkeitsaustausch und ergonomische Qualität sind für ein aseptisches Arbeiten wichtig (AWMF Leitlinie 2010).
Untersuchungen des OP-Teams auf S. aureus und A-Streptokokken sind indiziert, wenn eine Häufung entsprechender SSI verzeichnet wird und der begründete Verdacht einer Übertragung durch das Personal besteht.
Asepsis: Strikte Einhaltung der Asepsis durch Schutzkleidung:SSI-Prophylaxe\"\r\"schutzkleidungSSIProphyldas OP-Team ist eine Basismaßnahme. Elementarer Bestandteil der Asepsis ist die Verwendung Bereichskleidung:SSI-Prävention\"\r\"schutzkleidungSSIProphylsteriler MP und deren Kontaminationsschutz zwischen Bereitstellung im OP und Anwendung.
Raumlufttechnik: Kap. 9.4.Asepsis:SSI-Prävention
Postoperativ
Aufenthaltsdauer: Kurze stationäre Aufenthaltsdauer (Roumbelaki et al. 2008) und frühzeitige Mobilisierung des Patienten können zur Verminderung des SSI-Risikos,
von Thrombosen und zur Verkürzung der Hospitalisierung beitragen (Browning et al. 2007).
Drainagen: Zur Aufenthaltsdauer, stationäre, SSI-PräventionNotwendigkeit von Drainagen gibt es eine bemerkenswerte Diskrepanz zwischen Evidenz und täglicher Praxis. Unbestritten ist der Einsatz bei therapeutischen Indikationsstellungen (Abszess-, Hämato-, Pneumo-, Pyothoraxdrainagen). Allgemein akzeptiert wird die prophylaktische Drainagen, SSI-PräventionIndikation zur Sicherung/Ableitung einer Ösophagusanastomose (Lebensbedrohung durch Mediastinitis). Für die hepatobiliäre, kolorektale, Pankreas- und Schilddrüsenchirurgie haben sich routinemäßige Drainagen nicht als vorteilhaft erwiesen (Domínguez Fernández und Post 2003). Bei Hohlraumbildung durch größere Defekte oder beim Belassen eröffneter Schleimbeutel kann eine Drainage zur Gewährleistung des ungehinderten Abflusses von Zellresten, Blut, Lymphe, Galle und Wundsekret sowie zur Wundflächenadaptation erforderlich sein (z. B. nach Eingriffen an Leber- und Gallenwegen, Pankreas, Magen, Thorax, Mediastinum, Milz-, Kolon-, Rektumresektion, Lymphknotendissektion).
Eine Drainage stellt abhängig von der Indikation zur Anlage, der Art des Drainagesystems, der Lage der Durchtrittsstelle und der Liegedauer einen Risikofaktor für SSI dar.
Je nach Lage des Drains kann es zu lokal begrenzter Infektion, Abszess oder Sepsis kommen. Mit der Liegedauer steigt die bakterielle Kontamination des primär sterilen Drains (Drinkwater und Neil 1995). Weitere Risiken ergeben sich durch mögliche Druckschädigung, Fistelbildung, Narbenhernie oder Ausbreitung von Tumorzellen entlang dem Drainkanal.
Zahlreiche Publikationen dokumentieren die Gefahr einer SSI bei offener Wunddrainage (Cruise und Foord 1973). Bei geschlossener Drainage scheint das SSI-Risiko geringer zu sein (Moro et al. 1996), es gibt prospektive randomisierte Studien, bei denen Drains nicht als Risikofaktor identifiziert werden konnten (Wong 2004). Durch intraoperativ gelegte Drainagen ergeben sich folgende Risiken (Roth et al. 1996):
-
•
Die offene Drainage leitet das Wundsekret in einen nach außen offenen Verband (z. B. Kompresse) mit hohem SSI-Risiko ab.
-
•
Die bedingt geschlossene Drainage leitet in ein aseptisch aufgebrachtes Drainagebehältnis, das zu jedem Wechsel diskonnektiert wird. Bei Schwerkraftdrainagen wird das Sekret ohne Sog abgeleitet. Dadurch ist die Ableitung nicht gesichert, es besteht die Gefahr des Sekretrückflusses mit Infektions- und Reinfektionsgefahr, außer bei abdominaler Lage, da der abdominale Druck höher ist. Bei Unterdruckdrainagen mit Hochvakuum (Redon-Drainage) sind Komplikationen aufgrund des hohen Unterdrucks möglich. Bei Niederdruckdrainagesystemen sind die abgeleitete Sekretmenge größer, das Risiko des Nachblutens und postoperativer Hämatome geringer und die Wundheilung verbessert.
-
•
Die geschlossene Drainage ist mit dem Auffanggefäß ohne Diskonnektionsmöglichkeit fest verbunden. Das Auffangsystem wird aufgrund seines Fassungsvermögens (> 1 l) nicht zwischenzeitlich entleert, sondern zusammen mit der Drainage entfernt.
-
•
Nur mit speziellen Drains ist die Erregerverschleppung in die Tiefe vermeidbar.
Die optimale Drainage sollte nicht nur unterschiedliche Saugleistungen ermöglichen, diese sollten auch innerhalb des geschlossenen Systems je nach Heilungsstadium variierbar sein.
Da Drainagen das SSI-Risiko erhöhen, sollten sie nur bei klarer Indikation und so kurzzeitig wie möglich gelegt werden. Bei primär nicht infizierten Wunden ist die Verwendung offener Drainagen obsolet (Willy et al. 2003). Drains sollen nicht über die OP-Wunde, sondern über eine separate Inzision oder über ein steriles Führungsrohr gelegt werden (Roth et al. 2006). Der Drain ist mittels Naht zu fixieren. Die Punktionsstelle ist mit sterilem Verband ohne Abknicken der Drainage abzudecken. Bei geplant länger liegenden Wunddrainagen ist ein Saugsystem mit Rücklaufsperre einzusetzen.
Beim Wechsel des Auffangbehältnisses ist Asepsis zu wahren (Händedesinfektion, keimarme Handschuhe, Desinfektion der Konnektionsstelle mit Hautantiseptikum).
Verbandswechsel: Die primär verschlossene OP-Wunde wird am OP-Ende mit steriler Wundauflage abgedeckt.
Die Wundabdeckung wird bei geschlossener Wunde i. d. R. 24–48 Stunden postoperativ belassen. Bei Auftreten klinischer Zeichen einer Infektion sowie durchgebluteter oder durchgefeuchteter Wundabdeckung muss der Verband sofort gewechselt werden.
Ist der äußere Wundverschluss abgeschlossen, kann aus hygienischen Gründen auf eine erneute Wundabdeckung verzichtet werden.
Bei sekundär heilenden Wunden sind beim Verbandswechsel folgende Grundsätze zu beachten (AWMF-Leitlinien-Register Nr. 029/031, 2004):
-
•
Vorbereitung: Händedesinfektion, Desinfektion der Arbeitsfläche, Vorbereiten des Materials, Einmalhandschuhe (unsteril, nach Bedarf steril), Instrumentensammelbehälter, Abfallsack.
-
•
Unreine Phase: Bei Bedarf (großflächige bzw. Verbrennungswunden) Schutzkleidung (Kittel, Maske, Haube), Händedesinfektion, Verband mit Einmalhandschuhen oder instrumentell entfernen und kontaminationsfrei entsorgen, Handschuhe ausziehen, Wundinspektion.
-
•
Reine Phase: Händedesinfektion, Reinigung der Wunde, Anlegen des neuen Verbands je nach Wundgröße mit sterilen Instrumenten oder sterilen Handschuhen, Instrumente nach Gebrauch kontaminationsfrei entsorgen, abschließende Händedesinfektion, Dokumentation.
Verbandswechsel sind in der Reihenfolge zuerst aseptische, dann Verbandswechsel, SSI-Präventioninfizierte Wunden einzuplanen.
Die Entfernung von Verband, Nahtmaterial und Drainagen erfolgt unter aseptischen Bedingungen.
Surveillance: Kap. 3.1.
5.5.3. Schutz vor Infektionen durch HBV, HCV und HIV
Blutgetragene Viren stellen für Patienten und Personal ein Risiko dar.
Erkrankungen an akuter Virushepatitis und Erregernachweise für HBV, HCV (namentlich) und HIV (SSI:Prävention\""\r""SSIPräventionnichtnamentlich) sind gemäß §§ 6 und 7 IfSG meldepflichtig.
Personalgefährdung: In der Dialyse war nach Pflege HCV-positiver Patienten signifikant häufiger HCV-RNA an den Händen der Mitarbeiter nachweisbar als nach der Pflege HCV-negativer Patienten, und das trotz der Hepatitis-C-Virus:Personalgefährdungbekannten Maßnahmen zur Vermeidung einer Kontamination der Hände mit Blut Hepatitis-B-Virus:Personalgefährdungwährend des direkten Patientenkontakts (Alfurayh et al. 2000).
Eintrittspforte für HBV und HCV ist in chirurgischen Disziplinen in erster Linie das Panaritium, gefolgt von Stich- und Schnittverletzungen. In der akuten virämischen Phase sind von Patienten mit HBV bis zu 5 × 108 (Zyzik et al. 1086), bei Patienten mit HCV bis zu 107 infektiöse Einheiten/ml Blut nachweisbar (Davies und Lau 1995). Eine fast unsichtbare Menge Blut (1 μl) kann noch immer infektiös für HBV und HCV sein. Aufgrund der in bis zu 83 % unbemerkten Perforation von OP-Handschuhen (Thomas et al. 2001) kommt es bei 13 % der Mitarbeiter zur Ansammlung nachweisbarer Blutmengen unter dem Handschuh (Naver und Gottrup 2000).
Die Impfung ist nur bei HBV möglich, wobei die Effektivität des Impfstoffs sehr hoch ist (Kralj et al. 1998). Umso unverständlicher ist die unterlassene Schutzimpfung.
Bei akzidenteller Kontamination des Personals sind die empfohlenen Sofortmaßnahmen einzuleiten (Kramer et al. 1997a; Kap. 5.29).
Patientengefährdung: Der Patient kann durch infektiöse Mitarbeiter mit HBV, HCV oder HIV infiziert werden. Beispiel: Ein Assistenzarzt in der Anästhesie, der von einem HCV-Indexpatienten infiziert wurde und erst nach 6 Wochen eine Hepatitis-B-Virus:Patientengefährdungklinisch apparente Hepatitis aufwies, führte in diesem Zeitraum weitere Hepatitis-C-Virus:PatientengefährdungNarkosen durch. Gleichzeitig wies er am rechten Mittelfinger eine Wunde auf, HIV:Patientengefährdungdie wiederholt blutete bzw. aus der Exsudat austrat. Während der Arbeit am Patienten trug der Mitarbeiter keine Handschuhe. Nachfolgend wurde eine Hepatitis C bei 5 Patienten nachgewiesen, die außer der Behandlung durch diesen Arzt keine Risikofaktoren für eine Hepatitis C aufwiesen. Obwohl der genaue Übertragungsweg nicht bewiesen werden konnte, wurde die Übertragung durch die Hautläsion des Arztes als die wahrscheinlichste angesehen (Ross et al. 2000). Insgesamt sind mehr als 40 Fälle bekannt, in denen HBV von Ärzten auf Patienten übertragen wurden. Eine hohe Dunkelziffer wird angenommen (Beier 2000).
Das kalkulierte Risiko einer HCV-Infektion wird bei unbekanntem Serostatus des Operateurs mit 0,00018 %, bei positivem HCV-Status mit 0,014 % angegeben (Ross et al. 2000a), d. h., die Wahrscheinlichkeit der Übertragung bei mindestens 1 von 5.000 Operationen innerhalb von 10 Jahren beträgt 0,9 % (unbekannter Serostatus des Operateurs) bzw. 50,3 % (positiver HCV-Status des Operateurs). Der Schutz des Patienten ist hier nicht einfach herzustellen. Nach aktueller Rechtsprechung handelt es sich bei HBV- bzw. HCV-positiven Mitarbeitern um Carrier. Grundsätzlich kann die zuständige Behörde Kranken, Krankheitsverdächtigen, Ansteckungsverdächtigen und Ausscheidern die Ausübung beruflicher Tätigkeiten ganz oder teilweise untersagen (§ 31 IfSG). Kommt es zur Untersagung der beruflichen Tätigkeit durch die Behörde, muss berücksichtigt werden, dass die Maßnahme notwendig, geeignet und verhältnismäßig sein muss. Bei Feststellung einer Infektiosität des Arbeitnehmers für HBV, HCV bzw. HIV ist die individuelle Beratung des Arbeitnehmers durch den Betriebsarzt zum weiteren beruflichen Einsatz erforderlich (Kap. 5.29).
5.5.4. Schlussfolgerungen
Durch Einhaltung der Hygieneregeln kann ein substanzieller Anteil von SSI verhindert werden.
In der SENIC-Studie wurde durch retrospektive Analyse von 339.000 Patientenakten der Jahre 1970–1975 ermittelt, dass etwa ein Drittel der NI durch ein Infektionssurveillance- und Kontrollprogramm mit den Schwerpunkten der ständigen Überprüfung der Maßnahmen der Primärprävention, der Surveillance von NI und der personellen Realisierung des Präventionsprogramms (Krankenschwester/-pfleger für Krankenhaushygiene und ein für die Infektionsprävention spezialisierter Arzt) vermeidbar ist (Haley et al. 1985).
Die Umsetzung akzeptierter Standards zur Prävention von SSI wird immer dann besonders erfolgreich sein, wenn unterschiedliche einander ergänzende Möglichkeiten in Form des Multibarrierensystem der Primärprävention mit Einführung sog. Bundles etabliert werden und die Effektivität durch Infektionssurveillance ermittelt wird (Kap. 3.1).
Studien zur Compliance bestätigen die Notwendigkeit, evidenzbasierte Maßnahmen konsequent umzusetzen. So wurde die Compliance für die PAP nur mit 80 % ermittelt (Pons-Busom et al. 2004) und der Zeitpunkt wurde nur in 29 % eingehalten (Yalcin et al. 2007). In einer prospektiven, doppelblinden Kohortenstudie wurde durch Einführung einer neuen Strategie die Compliance zur zeitgerechten PAP von 5,9 auf 92,6 % und zur perioperativen Normothermie von 60,5 auf 97,6 % verbessert (Forbes et al. 2008). Bei der Überprüfung ausgewählter Hygienemaßnahmen ergab sich nach Einführung eines sog. clean practice protocol im Vergleich zum ersten Audit in allen untersuchten Merkmalen eine signifikante Verbesserung der Compliance für die Händedesinfektion von 28 auf 87 %, für den korrekten Handschuhgebrauch von 2 auf 50 % und für die Beachtung der Nonkontamination von 34 auf 89 % (Howard 2009a).
Voraussetzung für die Umsetzung infektionspräventiver Maßnahmen sind die Ausarbeitung des Hygieneplans und seine Präzisierung durch SOPs.
Damit der Hygieneplan umgesetzt wird, müssen bei jedem Mitarbeiter das Problembewusstsein provoziert und die Einhaltung der zuvor im Team erarbeiteten Regelungen überwacht werden. Eine wirksame Methode ist die Kontrolle mittels Checklisten, z. B. wurde der Infektionspräventions-Check-in mit 12 Hygieneplan:ChirurgieItems entwickelt, der vom Chirurgen vor jeder OP auf Einhaltung überprüft wird. Zur Überprüfung der Einhaltung von Hygienemaßnahmen in der postoperativen Betreuung wurde der sog. Infektionspräventions-Check-out mit 14 Items entwickelt. Hierdurch erhält der Patient die Möglichkeit der Bewertung (Kramer et al. 2010).
Prinzipiell besteht unter Chirurgen große Akzeptanz für Lehrvideos als Lernmedium (http://www.dgch.de/de/wissen/mediathek/index.html). Unter diesem Gesichtspunkt soll der Lehrfilm „Prävention postoperativer Wundinfektionen“ (http://www.egms.de/static/pdf/journals/dgkh/2009-4/dgkh000128.pdf) einen Beitrag zur Umsetzung der World Alliance for Patient Safety von 2004 leisten.
Durch Einhaltung der Standards durch jeden Mitarbeiter – sog. Nulltoleranz gegenüber Handlungslücken – lässt sich der Anteil der SSI auf das unvermeidbare Minimum reduzieren.
Aufgrund der endogenen Entstehung von SSI und der nicht komplett realisierbaren Distanzierung des Patienten vor Krankheitserregern gibt es jedoch kein Nullrisiko für SSI.
5.6. Orthopädie und Unfallchirurgie
Julia Seifert, Dirk Stengel und Axel Ekkernkamp
In der Geschichte der Asepsis und Antisepsis sowie der nosokomiale Infektion(en):ChirurgieEntwicklung präventiver Ansätze und Behandlung chirurgischer Infektionen SSI:Chirurgie\"\r\"SSIsind drei Personen besonders wichtig. Girolamo Fracastoro (1478–1553) legte den Grundstein der modernen Infektionslehre. Er ging davon aus, dass Krankheiten und Infektionen nicht durch fremde Wesen (ontologisches Krankheitsverständnis) oder schlechte Säftemischung (Hippokratische Humorallehre), sondern durch „Kontagien“ entstehen. Er postulierte, dass es drei Infektionsformen geben müsse: per contactem (durch Kontakt), per formitem (verunreinigte Gegenstände) und ad distans (aerogen) und war entgegen Galen der Meinung, dass auch gesunde Menschen infiziert werden und erkranken können. Ein Beweis dieser Hypothese gelang ihm zum damaligen Zeitpunkt nicht. Joseph Lister (1827–1912), englischer Chirurg und ein sog. Kontagionist, beobachtete, dass Frakturen mit geschlossenem Weichteilmantel i. d. R. gut heilten, während offene häufig eiterten. Er zog daraus den Schluss, dass die Erreger auch in der Luft sein müssten, deckte fortan offene Frakturen mit karbolgetränkten Decken ab, tränkte aus Schafsdarm gefertigtes chirurgisches Nahtmaterial sowie chirurgische Instrumente in Karbol und versprühte das Karbol im OP. Hierdurch gelang es, die SSI-Rate offener Frakturen von ca. 45 % auf etwa 15 % zu senken. Penicillin, eine Zufallsentdeckung von Alexander Fleming (1881–1955) und eine „Wunderwaffe“ gegen Eiter erzeugende Bakterien, stellte den Beginn der medikamentösen Therapiemöglichkeit von Infektionen dar, die bis dahin nicht selten tödlich endeten (Seifert und Ekkernkamp 2007, Webster und Osborne 2007).
Heutzutage wird unter Aspekten der Qualitätssicherung, der Prävention und des Hygienemanagements zwischen exogenen und endogenen NI unterschieden, wobei die Genese nicht immer klar abgrenzbar ist. Im Folgenden beschränken wir uns auf die für die Unfallchirurgie und Orthopädie relevanten Formen von SSI hinsichtlich Inzidenz, Ätiologie, Pathogenese, Therapie und Prävention.
5.6.1. Epidemiologie
Mittlerweile werden in Deutschland > 12 Mio. Operationen/Jahr durchgeführt. Mit > 3,9 Mio. operativen Eingriffen am Bewegungsapparat im Jahr 2009 liegt die Orthopädie/Unfallchirurgie an der Spitze der Eingriffsstatistik der chirurgischen Fächer (Gesundheitsberichterstattung des Bundes: www.gbe-bund.de). Heutzutage werden mit technisch aufwändigen, anspruchsvollen OP-Verfahren einerseits eine ältere Patientenpopulation mit hoher Komorbidität, andererseits junge Patienten nach Hochrasanztraumen mit zunehmender Verletzungsschwere und -komplexität versorgt. Allein 2009 wurden > 150.000 proximale Femurfrakturen operativ versorgt (www.gbe-bund.de). Bei aktuell > 350.000 gelenkersetzenden Maßnahmen/Jahr in deutschen Kliniken und einer Infektionsrate von 1–2 % (Geipel und Herrmann 2004, Frommelt 2004, Trampuz und Zimmerli 2006) entstehen rein rechnerisch 3.500–7.000 behandlungsbedürftige Infektionen/Jahr. Berücksichtigt man die erhöhte Infektionsrate von bis zu 5 % in Risikokollektiven, könnte die SSI-Zahl auf 17.500 ansteigen.
In der NIDEP-1-Studie (Kap. 3.1) betrug die Prävalenz von NI bei 14.966 eingeschlossenen Patienten 3,0 % bei internistischen, 3,8 % bei chirurgischen, 1,5 % bei gynäkologisch-geburtshilflichen und 15,3 % bei Intensivpatienten. Für die Unfallchirurgie/Orthopädie werden SSI seit 1996 nach festgelegten Indikatoroperationen (Knie- und Hüftgelenkersatz, Oberschenkelhalsfrakturversorgung) im KISS ausgewertet. Nach Harnwegsinfektion und Pneumonie stellen SSI die dritthäufigste NI-Form dar.
Die Häufigkeit von SSI hängt u. a. von Wundkontaminationsklasse, OP-Dauer und Erkrankungsschwere des Patienten ab. Zur Risikoadjustierung und Vergleichbarkeit wird im KISS jeder OP jeweils ein Risikopunkt zugeordnet, wenn die Wundkontaminationsklasse „kontaminiert“ oder „septisch“ war, die OP länger gedauert hat als 75 % der Operationen dieser Art regelhaft dauern oder die Anästhesisten dem Patienten aufgrund der Erkrankungsschwere einen ASA-Score > 3 zuordnen.
SSI nach Haut- und Weichteilverletzungen oder bei offenen Frakturen entstehen exogen. Die Inzidenz bei offenen Frakturen wird in der Literatur mit 3–43 % angegeben und ist von verschiedenen Faktoren abhängig (Kap. 5.6.2; Heppert 2008, Ostermann et al. 1995). Seltener ist die endogene Infektion, die sich typischerweise als Spätinfektion an Implantaten (Osteosynthesematerial, Prothesen) manifestiert und durch poststationäre endogene Bakteriämie entstehen kann (z. B. sind chronische Urogenitaltraktinfektionen geriatrischer Patienten Quelle für E. coli und Enterokokken).
5.6.2. Pathogenese von SSI
Für die Entstehung von SSI sind verschiedene Faktoren verantwortlich (Tab. 5.12 ).
Tab. 5.12.
Risikofaktoren für die Entstehung von Infektionen.
| Patientenseitig | Andere |
|---|---|
| Offene Fraktur Fraktur mit Weichteilschaden Patientenalter Ernährungszustand (Hypalbuminämie, BMI Grad II und III, Kachexie) Verminderte Mikrozirkulation Geschwächte Resistenz und Immunität Präoperative mikrobielle Last (z. B. MRSA-Kolonisation, Urogenitalinfektion) Maligne Erkrankung Bestimmte Medikamente (z. B. Kortikoide) Rauchen |
Dauer des präoperativen Krankenhausaufenthalts Unsachgemäße Haarentfernung Intraoperative Abdeckung Hygiene des OP-Teams Raumlufttechnik Dauer der OP Weichteilmanagement Intra-/perioperative Hypothermie Intra-/perioperative Hypoxie Postoperatives Wundhämatom, -ödem Art und Dauer der Wunddrainage |
(nach Geipel und Herrmann 2004, Hofmann 2004, Kommission für Krankenhaushygiene und Infektionsprävention des RKI 2007)
Eine weitere pathogenetische Rolle spielen avitale Fremdkörper und Implantate wie Osteosynthesematerialien oder Endoprothesen. Sie lösen chemisch lokaltoxische Reaktionen aus: neben dem elektrochemischen Korrosionsprozess, Metall- oder Polyethylenabrieb begünstigt die hohe Oberflächenspannung die Adhäsion von Albumin, Wirtszellen und Pathogenen. Eine Kolonisation von Fremdmaterial mit nur 102–105 Erregern kann bereits eine Infektion auslösen. Nach Adhäsion der Erreger auf der Oberfläche des Fremdmaterials kommt es zur Biofilmbildung (Kap. 4.9), wodurch die Toleranz gegenüber pH- und Temperaturschwankungen, Antibiotika, UV- und Röntgenstrahlung sowie Nährstoffmangel erheblich steigt.
Einige Erreger (S. aureus, S. epidermidis, P. aeruginosa, E. coli) sind in der Lage, Small Colony Variants (SCV) zu bilden, die sich durch langsamere Wachstumsraten und eine erniedrigte Stoffwechselaktivität auszeichnen. Sie schützen sich durch ihre Inaktivität, sind schwer oder nicht nachweisbar und typischerweise Auslöser von Infektionsrezidiven (Zimmerli et al 2004).
Ob die Erreger erfolgreich bekämpft werden können oder sich eine Infektion manifestiert, wird letztlich durch eine komplexe Interaktion zwischen Körperabwehr (Wirtsfaktor), Erregerlast und Virulenz (Erregerfaktoren) sowie von operativen Bedingungen wie Handhabung der Antibiotikaprophylaxe, gewebeschonendes Operieren und dem Implantat bestimmt.
5.6.3. Erregerspektrum
Etwa zwei Drittel der Infektionserreger von SSI gehören zum grampositiven Spektrum. Häufigste Erreger, insbesondere auch von Implantaten, sind Staphylokokken (Trampuz und Widmer 2006). Etwa 25 % der SSI werden durch gramnegative Stäbchenbakterien und ca. 10 % durch obligat anaerobe Bakterien verursacht.
Seit den 1970er Jahren wird eine Zunahme von MRSA-Stämmen beobachtet. Es gibt Hinweise, dass eine Eradikation von nasalem MRSA-Trägertum vor elektiven Eingriffen mit einer signifikanten Senkung von MRSA-Infektionen einhergeht (Perl et al. 2002). Für die Therapie stehen stamm- und empfindlichkeitsabhängig Trimethoprim, Fosfomycin, Fucidinsäure, Vancomycin, Daptomycin, Linezolid und Tigecyclin zur Verfügung. Diese übertreffen aber alle β-Lactam-Antibiotika nicht in ihrer antimikrobieller Effektivität bei gleichzeitig geringsten Nebenwirkungen.
5.6.4. Diagnostik und Nachweisverfahren
Die Diagnose einer Infektion beruht auf der Inspektion und Untersuchung, bei der auf die fünf typischen klinischen Zeichen Rubor, Tumor, Calor, Dolor und Functio laesa, auf radiologisch nachweisbare Veränderungen im Röntgenbild und MRT (Weichteilinfiltration und -abszess, Osteolyse, SSI:Diagnosestellungperiostale Reaktionen, Sequester, Implantatlockerung, ausbleibende knöcherne Durchbauung) sowie einen positiven Erregernachweis zu achten ist. Die Größe des Implantats und die magnetische Flussdichte sind ausschlaggebend, ob ein MRT möglich oder kontraindiziert ist. Zu große Implantate erhitzen sich und liefern eine schlechte Bildqualität.
Wichtigstes Kriterium für den Nachweis einer manifesten Infektion ist der Erregernachweis. Drei bis sechs Abstriche sollten immer aus verschiedenen Regionen des Infektionsgebiets gewonnen werden. Günstigerweise erfolgen sie vor der Antibiotikaerstgabe. Besser als Abstriche sind Abradate, die ebenfalls kulturell aufgearbeitet werden können. Zusätzliche Abradate sollten auch für die histologische Untersuchung gewonnen werden.
Die Abstrichentnahme ist im Rahmen jeder Revisions-OP obligat, sollte aber erst am Ende der OP, also zur Kontrolle des Therapieerfolgs, erfolgen. Abstriche aus purem Eiter sind häufig steril.
Wichtig ist, dass Abstriche/Abradate mit 1 ml steriler physiologischer Kochsalzlösung in sterilen Röhrchen eine Transportzeit von 2 Stunden keinesfalls überschreiten dürfen. Prinzipiell sollen die Probentransportzeiten so kurz wie möglich sein und bei Raumtemperatur erfolgen, um falsch positive und falsch negative Ergebnisse zu minimieren. Punktate in sterilen Spritzen sollten nicht länger als 30 Minuten bis zur Verarbeitung durch das Labor benötigen. Sie können bei positivem Befund durch Gramfärbung und mikroskopische Untersuchung innerhalb kürzester Zeit den Verdacht bestätigen (Sensitivität 10–30 %, Spezifität > 90 %). Die angesetzten Kulturen sollten mindestens 14 Tage bebrütet werden, da andernfalls mit falsch negativen Ergebnissen zu rechnen ist. Das gilt besonders für den Nachweis von Propionibakterien, die nahezu regelhaft erst in der 2. Woche der Bebrütung nachgewiesen werden konnten (Schäfer et al 2008). Bei wiederholt negativen Ergebnissen empfiehlt sich die PCR (Breitspektrum-, erregerspezifische PCR). Allerdings sind diese Verfahren teuer, weisen eine hohe Sensitivität und geringere Spezifität auf und können noch nicht zu den Standardverfahren gezählt werden.
Paraklinische Parameter wie CRP, Leukozyten und BSG sind unspezifisch. Sie eignen sich als Verlaufsparameter und besonders zur Beurteilung des Therapieerfolgs, wenn sie initial erhöht waren.
Ein weiterer diagnostischer Ansatz bei Implantatinfektionen besteht darin, das entfernte Material in einen sterilen Behälter zu geben, um im Labor durch Ultraschallbehandlung den Biofilm ablösen zu lassen. Hierdurch lässt sich die Sensitivität des kulturellen Erregernachweises insbesondere bei Patienten mit Antibiotikabehandlung signifikant verbessern (Trampuz et al. 2007).
5.6.5. Therapie
Unabhängig von der Infektionsgenese besteht die Therapie aus der Kombination von chirurgischem Vorgehen und antibiotischer Behandlung.
In Abhängigkeit von der Akuität des Infektionsgeschehens, der Erregerresistenz und der Anzahl zugrunde liegender Risikofaktoren kann bei unkomplizierten Wund- und Weichteilinfektionen Ampicillin/Sulbactam eingesetzt werden. Komplizierte Wund- und Weichteilinfektionen und/oder fremdkörperassoziierte Infektionen erfordern aufgrund der Biofilmbildung und möglichen Entwicklung von SCV i. d. R. eine antibiotische Kombinationstherapie. Diese muss resistenzgerecht sein, sollte einen bakteriziden Wirkmechanismus, eine gute Knochen- und Gewebegängigkeit haben und eine niedrige Rate spontaner Resistenzentwicklung aufweisen (Tab. 5.13 ).
Tab. 5.13.
Geeignete Antibiotika für Infektionen im Bereich Unfallchirurgie und Orthopädie.Antibiotikatherapie:Orthopädie/Unfallchirurgie
| Erreger | Antibiotikum |
|---|---|
| S. aureus, S. epidermidis | Ampicillin/SulbactamRifampicin + Penicillin oder ChinolonFosfomycin + ChinolonCephalosporin, Glykopeptid |
| S. aureus(MRSA) | Vancomycin + RifampicinAlternativ: Daptomycin, Linezolid |
| Streptococcus, Enterococcus spp. | AminopenicillineAlternativ: Cephalosporine der 3. Generation |
| Gramnegative Erreger | Cephalosporine der 3. Generation + Chinolone |
| Anaerobier | ClindamycinAlternativ: Carbapeneme |
Die systemische Antibiose sollte bei Infektionen von Osteosynthesematerial für die Dauer von mindestens 6 Wochen und bei Protheseninfektionen für mindestens 3 Monate verabreicht werden (Trampuz und Zimmerli 2006). Vor Reosteosynthese oder Prothesen-Reimplantation sollte eine 2-wöchige Antibiotikapause Infektion(en):Osteosynthesematerialeingehalten werden. In einer Metaanalyse zur Antibiotikatherapie von Knochen- und Gelenkinfektionen zeigten Stengel et al. (2001) die methodischen Schwächen von 22 randomisierten kontrollierten Studien und 3 Quasi-RCTs mit insgesamt 927 Patienten: nur 12 Studien lieferten Ergebnisse zum primären Endpunkt (Infektionsfreiheit nach 1 Jahr), 8 Studien wiesen inadäquate Randomisierungsprozeduren, stark heterogene Patientenpopulationen und z. T. erhebliche Schwächen im Bereich der Erregergewinnung (Punktate und Gewebe nur in 7 Studien) auf. Basis für die noch heute gültige Kombinationstherapie von Rifampicin und Chinolonen bei staphylokokkenassoziierten Implantatinfektionen ist die Studie von Zimmerli (Zimmerli et al. 1998). Als Fazit dieser Metaanalyse war keine Überlegenheit eines Therapieansatzes über einen anderen nachweisbar, wobei sich ein Benefit für die Kombinationstherapie Rifampicin/Fluorchinolone ergab, das chirurgische Vorgehen wesentlicher Co-Faktor für die erfolgreiche Sanierung ist, eine Eradikation bei 77 % der Patienten gelang, aber in 19 % der Fälle unerwünschte Ereignisse auftraten.
Die systemische Antibiotikatherapie kann durch Platzierung lokaler antiobiotikahaltiger Träger ergänzt werden. Hierfür kommen als Trägermaterial resorbierbares Kollagen oder bei Osteitis mit knöchernen Defekten Polymethylmethacrylat (PMMA) infrage (Penner et al. 1996). Dem Zement können hitzeresistente Antibiotika (Ampicillin, Gentamicin, Amikacin, Vancomycin, Clindamycin, Teicoplanin, Daptomycin, Linezolid, Ofloxacin) zugemischt werden. Dabei sollte das pulverisierte Antibiotikum 10 % der Gesamtpulvermenge nicht überschreiten (Hendrich et al. 2004, Hofmann 2004). Zu beachten ist, dass der mit Antibiotikum vermischte Zement eine Modifizierung eines MP darstellt. Der Patient ist daher vorab über das Vorgehen aufzuklären und muss einwilligen. Günstig sind kommerzielle gentamicinhaltige Zementgemische, die sich bei weiterer Zugabe z. B. von Vanco- und Clindamycin besonders in der Therapie von Problemerregern mit rezidivierender oder persistierender Infektion als vorteilhaft erwiesen haben. Ein interessanter Aspekt ist, dass Vancomycin die Freigabe anderer zugesetzter Antibiotika verbessert (Gentamicin, Tobramycin), weshalb eine Kombination z. B. von Vancomycin und Gentamicin im Zement sinnvoll sein kann (Ostermann et al. 1995). Die Gefahr der Resistenzentwicklung ist durch die hohen lokalen Konzentrationen gering (8- bis 25-Fache der MHK). Systemische Nebenwirkungen sind bisher nicht beschrieben. Die Freisetzung der Antibiotika aus dem Zement ist nach ca. 3 Wochen beendet. Zementspacer oder PMMA-Ketten sollten dann nach Möglichkeit wieder entfernt werden, da sie selbst als Fremdkörper fungieren und zur Infektionsquelle werden können. Antibiotikahaltige Kollagenvliese sind nach 3–4 Wochen vollständig resorbiert. Sie können im Rahmen des Resorptionsvorgangs zu unerwünschter Wundsekretion führen.
Neben der Antibiotikatherapie kommt dem chirurgischen Vorgehen eine entscheidende Bedeutung bei der Infektionssanierung zu.
Gelingt es nicht, durch eine einzige operative Revision mit Débridement und Resektion avitalen infizierten Gewebes Erregerfreiheit und Infektionsberuhigung zu erzielen, ist der Patient in ein sog. Etappenprogramm aufzunehmen. Zwischen den Eingriffen kann ein Wundverschluss durch spannungsfreie Naht erfolgen oder, falls nicht möglich, durch temporäre Deckung mit Polyvinylalkohol-Hydroschaum (z. B. Coldex®) oder Hautersatzstoffen (z. B. Epigard®). Bei erkennbarer Heilungs- und sekundärer Granulationstendenz großer, stark sezernierender Wunden kann eine weitere Wundkonditionierung durch einen Vakuumverband erfolgen.
Knochensequester sind eine persistierende Infektionsquelle und müssen vollständig entfernt werden. Sie lassen sich präoperativ im Röntgen, CT oder MRT lokalisieren. Prinzipiell sollte die operative Radikalität derjenigen in der Tumorchirurgie entsprechen.
Die gepulste und in Niederdrucktechnik durchgeführte Jet-Lavage mit 1–3 l Ringer-Laktat- oder NaCl-Lösung kommt insbesondere bei verschmutzten sowie stark mit Débris behafteten Wunden oder tiefen, unzugänglichen Infektionsbereichen zur Anwendung.
Empfehlenswert sind Spülungen mit 0,02 % oder 0,04 % Polihexanidlösung, die möglichst über einen Zeitraum von 5–10 Minuten einwirken sollte. Im Gelenkbereich kann Polihexanid aufgrund seiner Knorpeltoxizität nicht in dieser Konzentration angewandt werden.
Ob und wann bei implantatassoziierten Infektionen eine Entfernung des „Fremdkörpers“ notwendig ist, wird anhaltend kontrovers diskutiert.
Prinzipiell gilt: Frühinfektionen mit niedrig virulenten Erregern und geringer Komorbidität des Patienten können, sofern keine Zeichen der Materiallockerung bestehen, der chirurgisch-antibiotischen Kombinationstherapie unter Erhalt des Implantats zugeführt werden (Trampuz und Widmer 2006, Trampuz und Zimmerli 2006). Prothesen können in diesem Fall belassen, bewegliche Teilkomponenten gewechselt oder ein einzeitiger kompletter Wechsel durchgeführt werden (Cierny und DiPasquale 2002, Geipel und Herrmann 2004).
Bei allen anderen Infektionsformen, insbesondere Implantatinfektionen mit sog. Difficult-to-treat-Erregern (rifampicinresistente Staphylokokken, chinolonresistente gramnegative Stäbchenbakterien, Enterokokken, SCV) ist die Entfernung des infizierten Implantats bzw. der Prothese dringlich zu empfehlen.
Bei zementierten Prothesen ist darauf zu achten, dass der Zement rückstandslos entfernt wird. Nach Ausbau der Prothese können Zementspacer mit Antibiotikazumischung eingebracht werden. Der Wiedereinbau einer Prothese erfolgt nach zeitlichem Abstand von mindestens 6 Wochen, nicht jedoch vor dem Nachweis der Infektionsfreiheit. Vor einer Prothesen-Reimplantation empfehlen wir daher die operative Gewinnung von Gewebematerial aus dem ehemals infizierten Gelenkbereich (3–6 Abradate) und den kulturellen Nachweis der Erregerfreiheit. Die Antibiotikatherapie sollte zum Zeitpunkt der Gewebegewinnung 2 Wochen beendet sein (Abb. 5.3 ).
Abb. 5.3.
Die 5 Säulen der Therapie bei implantatassoziierten Infektionen.
Für Frakturen, die noch nicht knöchern konsolidiert sind, muss ein Verfahrenswechsel geplant werden. Ebenso sind alle gelockerten Osteosynthesen zu entfernen. Bis zur Infektionssanierung kann ein Fixateur externe (monoaxial oder Ringfixateur) angelegt werden. Lassen sich Fraktur(en):Infektion(en), Therapiesichere Zeichen einer Osteitis oder Osteomyelitis nachweisen, kann die Resektion des infizierten Knochensegments notwendig werden. Die verschiedenen Verfahren der Kallusdistraktion und des Segmenttransports (Methode nach Ilizarov; Schnettler und Steinau 2004, Seifert und Ekkernkamp 2007) einschließlich der plastischen Weichteilrekonstruktion sollten Kliniken mit großer Erfahrung in der Behandlung dieser Erkrankung vorbehalten bleiben.
Erst nach sicherer Infektionssanierung (fehlender Erregernachweis, Leukozyten und CRP im Normalbereich, keine klinischen oder radiologischen Infektionszeichen über einen Zeitraum von mindestens 6 Wochen) ist ein erneuter Verfahrenswechsel, sofern notwendig, möglich.
5.6.6. Prävention
Die Indikation für sog. Bagatelleingriffe in der Unfallchirurgie und Orthopädie (Gelenkpunktion, Materialentfernung, diagnostische Arthroskopie usw.) ist nach Abwägung aller bestehenden Risiken kritisch zu stellen.
Für die präoperative antiseptische Waschung der OP-Region liegt keine Evidenz vor (Webster und Osborne 2007, Tiemann und Hofmann 2009). Sofern keine Verschmutzung vorliegt, sind übliche Maßnahmen der Körperhygiene ausreichend. Die Haarentfernung im OP-Gebiet mittels Rasur sollte unbedingt vermieden werden, da sie das Infektionsrisiko erhöht. Sie ist nur bei OP-technischer Notwendigkeit zu empfehlen (Kap. 5.5). Patienten mit bekannter Kolonisation des Nasenvorhofs mit S. aureus oder MRSA sollten wegen des signifikant erhöhten SSI-Risiko vor elektiven Knochen- und Weichteileingriffen eradiziert werden (Perl et al. 2002, Wertheim et al. 2004).
Für den Bereich der Unfallchirurgie und Orthopädie ist die Effektivität der i. v. Single-Shot- und Kurzzeitantibiotikaprophylaxe (24 Stunden) durch Metaanalysen (Grad-Ia-Evidenz) und darin nicht berücksichtigte placebokontrollierte, randomisierte Studien belegt (Grad-Ib-Evidenz; Stengel et al. 2003; Kap. 2.10.3).nosokomiale Infektion(en):Orthopädie\"\r\"InfektionsschutzOrthopaed
5.7. Häufigkeit, Ursachen und Prävention von Infektionen in der Neurochirurgie
SSI:Orthopädie/Unfallchirurgie Infektionsschutz:Orthopädie\"\r\"InfektionsschutzOrthopaed Jan-Uwe Müller und Henry W. S. Schroeder
5.7.1. Infektionsgefährdung und Einflussfaktoren auf das SSI-Risiko
Infektionsschutz:Unfallchirurgie\"\r\"InfektionsschutzOrthopaedObwohl postoperative entzündliche Komplikationen bei neurochirurgischen Patienten ein seltenes Ereignis darstellen, haben sie insbesondere bei Kraniotomien und ausgedehnten spinalen Eingriffen oft dramatische Folgen. Die Kenntnis von Risikofaktoren und kritischen Patientenpopulationen ermöglicht eine bewusste Einschätzung des individuellen Risikos für einzelne Patienten und erlaubt den Einsatz präventiver Maßnahmen.
Neben oberflächlichen und tiefen lokalen Infektionen, deren Häufigkeit zwischen 0,5 und 6,4 % schwankt (Tab. 5.14 ), spielen systemische entzündliche Komplikationen eine wesentliche Rolle. Die Wahrscheinlichkeit dieser Komplikationen liegt mit 5,4–6,2 % (Agarwal und Thomas 2003, Erman et al. 2005) um ein Mehrfaches höher als die lokaler Infektionen. Beispielhaft zeigt das der National Nosocomial Infections Surveillance System Report (NNIS System Report 2004) mit einer Infektionsrate bei der Verwendung von Urindauerkathetern von 6,7 Fällen, bei zentralvenösen Zugängen und dem Einsatz von Beatmungsgeräten von 4,6 respektive 11,2 Fällen auf 1.000 Behandlungstage bei neurochirurgischen Patienten.
Tab. 5.14.
Infektionsraten bei neurochirurgischen Eingriffen.
| n | Lokale Infektionen (%) | Systemische Infektionen (%) | Autor |
|---|---|---|---|
| 408 | 0,5 | 0 | Chang et al. 2003 |
| 2.334 | 1,6 | 5,43 | Agarwal und Thomas 2003 |
| 503 | Keine Angaben | 6,2 | Erman et al. 2005 |
| 2.944 | 4 % | Keine Angaben | Korinek 1999 |
| 1921/2052 | 2,11/5,92 | Keine Angaben | Bullock 1988 |
| 1711/1852 | 0,61/2,72 | Keine Angaben | Djindjian et al. 1990 |
| 2031/1992 | 0,51/3,52 | Keine Angaben | Geraghty 1984 |
| 4181/4122 | 1,01/3,62 | Keine Angaben | Young 1987 |
| 2.249 | 6,4 | Keine Angaben | Narotam et al. 1994 |
unter Antibiotikaprophylaxe
Kontrollgruppe ohne Antibiotikaprophylaxe
Zusätzliche Risikofaktoren hängen von der Art des Eingriffs, dem Kontaminationsgrad der Wunde und den individuellen Risiken des Patienten ab. Der NNIS System Report 2004 zeigte eine Infektionsrate von 0,91 % bei Kraniotomie in der Low-Risk- group gegenüber 1,72 % bzw. 2,4 % in der Patientenpopulation mit erhöhtem und stark erhöhtem Risikoindex (Tab. 5.15 ).
Tab. 5.15.
Infektionsrate (NNIS System Report 2004) bei neurochirurgischen Eingriffen unter Beachtung des NNIS-Risikoindex.
| Eingriff | Infektionsrate in % (Anzahl der Eingriffe) |
||
|---|---|---|---|
| Risikoindex 0 | Risikoindex 1 | Risikoindex 2, 3 | |
| Kraniotomie | 0,91 (4.717) | 1,72 (14.864) | 2,4 (4.666) |
| Andere neurochirurgische Eingriffe | 1,53 (2.356) | Wie Risikoindex 0 | Wie Risikoindex 0 |
| Ventrikelshunt | 4,42 (4.208) | 5,36 (12.324) | Wie Risikoindex 1 |
| Spinale Fusion | 1,04 (51.057) | 2,64 (26.372) | 6,35 (8.122) |
| Laminektomie | 0,88 (73.846) | 1,35 (55.517) | 2,46 (18.106) |
(Culver et al. 1991)
Der verwendete NNIS-Score (Culver et al. 1991) erfasst die Faktoren präoperativer Zustand des Patienten gemäß ASA-Score (American Society of Anesthesiologists 1963), Kontaminationsgrad der Wunde sowie Dauer der OP (Werte der 75. Perzentile). Basierend darauf werden die Gruppen 0 bis 3 mit zunehmendem Infektionsrisiko für einzelne Eingriffgruppen gebildet (Tab. 5.16 ).
Tab. 5.16.
Berechnung des NNIS-Scores.NNIS-Score
| Faktor | Score | Berechnung |
|---|---|---|
| a) Klassifikation der Wundkontamination | ||
| Sauber (aseptisch) | 1 | 1 Punkt, falls Score für Wundkontamination > 2, sonst 0 Punkte |
| Sauber-kontaminiert | 2 | |
| Kontaminiert | 3 | |
| Schmutzig | 4 | |
| b) ASA-Score | ||
| ASA 1: gesunder Patient | 1 | 1 Punkt, falls ASA-Score > 2, sonst 0 Punkte |
| ASA 2: geringgradige bis mittelschwere systemische Erkrankung | 2 | |
| ASA 3: schwere systemische Erkrankung | 3 | |
| ASA 4: schwere lebensbedrohliche systemische Erkrankung | 4 | |
| ASA 5: moribunder Patient, der ohne OP wahrscheinlich nicht überleben würde | 5 | |
| c) Dauer der OP | ||
| Kraniotomie: T = 4 h | 1 Punkt, falls Operationsdauer T überschritten wird, sonst 0 Punkte | |
| Anderer ZNS-Eingriff: T = 4 h | ||
| Ventrikulärer Shunt: T = 2 h | ||
| Spinale Fusion: T = 4 h | ||
| Laminektomie: T= 2 h | ||
| Die Addition der Werte für a, b und c ergibt den NNIS-Score mit Werten von 0–3. | ||
(Culver et al. 1991)
Die in dieser Untersuchung verwandte Einteilung der Eingriffe in die Gruppen sauber (aseptisch), sauber-kontaminiert (bedingt aseptisch), kontaminiert und verschmutzt (infiziert) bildet jedoch die spezifischen Risiken bei Eingriffen am Liquorsystem bzw. auch beim Einsatz großer Implantate in der kranialen und Wirbelsäulenchirurgie nicht ausreichend ab. Näher am klinischen Alltag ist die von Narotam et al. (1994) vorgenommene Modifikation mit der zusätzlich aufgenommenen Gruppe „Sauber mit Fremdkörper“ (Tab. 5.17 ).
Tab. 5.17.
Risikoklassifikation neurochirurgischer Eingriffe.
| Kategorie | Beschreibung |
|---|---|
| Verschmutzt | Patienten mit einer Infektion zum OP-Zeitpunkt (viszerale oder Hirnabszesse, subdurale Empyeme, Meningitis, Osteitis, purulente Hautinfektionen) |
| Kontaminiert | Keine Zeichen einer Infektion, aber Kontamination des OP-Gebiets, d. h. offene Schädelbasisfraktur, Skalpierungsverletzung (älter als 4 h), Liquorrhö, Re-Eingriff innerhalb von 4 Wochen |
| Sauber-kontaminiert | Eröffnung der Nasennebenhöhlen, Schädelbasisfraktur, Abweichung von der Standardtechnik, OP-Dauer > 2 h |
| Sauber mit Fremdkörper | Eingriff erfüllt Kriterien „saubere Chirurgie“, aber permanente oder temporäre Verwendung von Fremdmaterialen wie Shunts, Reservoirs, Ventrikelkatheter oder große Metallimplantate |
| Sauber | Ausschluss aller o. g. Kriterien, Wunddrainagen im subgalealen Raum nicht länger als 48 h |
(Narotam et al. 1994)
Andere identifizierte Risikofaktoren sind:
-
•
Liquorfistel-Leakage (Narotam et al. 1994, Korinek 1997, Agarwal und Thomas 2003),
-
•
Eingriffsart Shunt-OP (Narotam et al. 1994, Erman et al. 2005),
-
•
Kontaminationsgrad des OP-Gebiets (Notfalleingriffe, sauber-kontaminierte und kontaminierte Eingriffe; Narotam et al. 1994, Korinek 1997),
-
•
OP-Dauer > 4 h (Narotam et al. 1994, Korinek 1997, Valentini et al. 2008),
-
•
lang liegende Urinkatheter (Agarwal und Thomas 2003, NNIS System Report 2004),
-
•
Alter (Erman et al. 2005),
-
•
Gegenwart von Fremdkörpern/Implantaten (Erman et al. 2005),
-
•
Diabetes mellitus (Erman et al. 2005),
-
•
ICP-Monitoring (Erman et al. 2005),
-
•
Re-Eingriffe (Korinek 1997),
-
•
Fremdkörperimplantation (Narotoam et al. 1994),
-
•
gestörte Bewusstseinslage (Agarwal und Thomas 2003),
-
•
elektive Beatmung (Agarwal und Thomas 2003, NNIS System Report 2004),
-
•
externe Ventrikelableitung (Agarwal und Thomas 2003),
-
•
fehlerhafte Händedesinfektion, falscher Handschuheinsatz (Agarwal und Thomas 2003),
-
•
extensiver Antibiotikaeinsatz (Agarwal und Thomas 2003).
80 % der lokalen SSI werden durch Staphylokokken hervorgerufen. Dabei muss man sich in Erinnerung rufen, dass sowohl das OP-Gebiet als auch die Hände nur desinfiziert und nicht sterilisiert werden und der endogene Erregereintrag dominiert.
Aufgrund der Heterogenität der neurochirurgischen OP-Gebiete ist eine getrennte Analyse der Risikofaktoren sinnvoll, daher werden folgende Teilgebiete separat behandelt:
-
•
elektive Kraniotomien,
-
•
transorale und transsphenoidale Eingriffe,
-
•
liquorableitende Operationen,
-
•
spinale Eingriffe,
-
•
Medikamentenpumpen und Implantate zur Tiefenhirnstimulation,
-
•
offenen Schädel-Hirn- und spinale Traumen,
-
•
Eingriffe bei entzündlichen Erkrankungen.
5.7.2. Infektionsgefährdung bei ausgewählten neurochirurgischen Eingriffen und Präventionsmöglichkeiten
Grundsätzlich gelten auch für die Neurochirurgie die in der Chirurgie etablierten fachübergreifenden Prinzipen der Infektionsprävention (Kap. 5.5). Deshalb soll in diesem Kapitel nur auf fachspezifische Besonderheiten eingegangen werden.
Elektive Kraniotomie
Die Gefahr von SSI ist mit 0,9–2,4 % in Abhängigkeit von der Risikogruppe des Patienten sehr gering. Der Nachweis einzelner Risikofaktoren gestaltet sich deshalb äußerst schwierig, da nur die wenigsten Studien eine ausreichend hohe Anzahl von Patienten einschließen.
Faktoren mit Einfluss auf das Infektionsrisiko sind
-
•
Liquorfistel (Narotoam et al. 1994, Korinek 1997, Agarwal et al. 2003),
-
•
Re-Eingriff innerhalb von 4 Wochen,
-
•
lange OP-Dauer,
-
•
externe Liquordrainage,
-
•
Einsatz großflächiger Implantate.
Kraniotomie, elektiveWährend patientenbedingte Risikofaktoren kaum zu beeinflussen sind, können Modifikationen der OP-Technik zu einer Senkung der Infektionsrate beitragen.
Ein besonderes Augenmerk sollte auf die Vermeidung von Liquorfisteln gelegt werden.
Für die plastische Deckung von Duradefekten ist autologem Material der Vorzug einzuräumen, da es zumindest Hinweise auf eine erhöhte Infektionsrate bei Verwendung von Durasubstituten (Nakagawa et al. 2003, Malliti et al. 2004) gibt. Die Autoren bevorzugen daher die Verwendung autologen Materials, das bei sorgfältiger Präparation i. d. R. in ausreichendem Maß schon im OP-Gebiet zur Verfügung steht.
Inwiefern die Rasur der Haare einen Einfluss auf das Infektionsrisiko hat, ist nicht endgültig geklärt. Zumindest weisen einzelne Publikationen keinen negativen Effekt bei Verzicht auf eine Rasur nach (Kretschmer et al. 2000, Bekar et al. 2001, Miller et al. 2001, Tang et al. 2001).
PAP scheint die Rate lokaler SSI zu senken (Young und Lawner 1987, Holloway et al. 1996a, Kanat 1998). Allerdings sind die betrachteten Untersuchungen mit bis zu maximal 2.900 eingeschlossenen Patienten bei einer primären Infektionsrate von weniger als 1 % statistisch bei zu geringem Stichprobenunfang nicht aussagekräftig. Das Ergebnis deckt sich jedoch mit den klinischen Erfahrungen, sodass auch in unserer Klinik die PAP mit einem gegen Staphylokokken wirksamen Cephalosporin der 2. Generation etabliert wurde.
Transorale und transsphenoidale Eingriffe
Der transorale Zugang zum kraniozervikalen Übergang bzw. der transsphenoidale Zugang zur Hypophyse erfolgt durch kontaminiertes Gebiet mit nur eingeschränkten Möglichkeiten der Antiseptik.
Trotzdem treten Eingriff(e):transoralehier auffallend wenige Infektionen auf.
Komplikationen bei Eingriff(e):transsphenoidaletranssphenoidalem Zugang zur Hypophyse sind relativ gut dokumentiert. Ciric et al. (1997) berichteten nach der Befragung von mehr als 900 Neurochirurgen lediglich über 2 % Meningitiden im postoperativen Verlauf. Buchfelder und Fallbusch (1988) gaben eine Infektionsrate von 0,6 % an. Ursache dieser Komplikationen ist in den meisten Fällen das Auftreten einer Liquorfistel (Black et al. 1987). Diese ermöglicht ein sekundäres Aufsteigen von Erregern aus dem kontaminierten Zugangsbereich. Andere Komplikationen sind Abszesse der Hypophyse sowie Entzündungen und Mukozelen im Bereich des Sinus sphenoidalis (Herman et al. 1998, Buchinski et al. 2001).
In der Vorbereitung solcher Eingriff ist daher eine gezielte Fokussuche im Bereich der Nasennebenhöhlen sinnvoll. Postoperative Liquorfisteln müssen zügig diagnostiziert und saniert werden.
Maßnahmen zur Reduktion des Infektionsrisikos bei transsphenoidalem Zugang zur Hypophyse sind
-
•
der präoperative Ausschluss von Entzündungen im Zugangsbereich,
-
•
die Verwendung minimalinvasiver Techniken mit geringer Gewebetraumatisierung,
-
•
die Vermeidung einer postoperativen Liquorrhö durch Schonung des Diaphragma sellae und durch einen liquordichten Verschluss des Zugangswegs,
-
•
die sorgfältige Schleimhautpräparation zur Vermeidung einer Mukozele,
-
•
eine Nachuntersuchung auf Liquorrhö und Sekretstau in den Nasennebenhöhlen,
-
•
PAP.
Die Datenlage beim seltener genutzten transoralen Zugang zum kraniozervikalen Übergang und zum Klivus ist sehr heterogen. Typische entzündliche Komplikationen sind hier lokale Wundheilungsstörungen (Kingdom et al. 1995), Auftreten von Liquorfisteln (Hayakawa et al. 1981, Kondoh et al. 1990, Tuite et al. 1996) und in deren Folge Meningitiden (Kingdom et al. 1995). Seltene Komplikationen sind Entzündungen im Bereich des weichen Gaumens und eine Otitis media infolge eines Verschlusses oder einer Durchtrennung der Tuba auditiva.
Empfohlene Maßnahmen zur Verringerung des Infektionsrisikos bei transoralem Zugang zur Schädelbasis und zum kraniozervikalen Übergang sind
-
•
die kleinstmögliche anatomische Freilegung,
-
•
die Vermeidung der Spaltung des weichen Gaumens,
-
•
der mehrschichtige Wundverschluss an der Rachenhinterwand (Hayakawa et al. 1981),
-
•
bei Duraeröffnung Anlage einer temporären externen Liquordrainage (Hayakawa et al. 1981),
-
•
eine Tracheostomie bei erwarteten Schluckstörungen zur Vermeidung einer Aspirationspneumonie.
Liquorableitende Operationen
Ventrikuloperitoneale und ventrikuloatriale Ableitungen: Die Implantation permanenter Liquorableitungen ist mit Infektionsraten von 3–15 % im Langzeitverlauf verbunden (Kulkarni et al. 2001). Risikofaktoren sind die OP-Dauer (Kestle et al. 1993, Kotny et al. 1993), das Alter der Patienten (Renier et al. 1984, Shapiro et al. 1988, Choux et al. 1992, Pople et al. 1992, Piatt und Carlson 1993, Mancao et al 1998) mit gehäuftem Auftreten bei Frühgeborenen (Int PHVD Drug Trial Group 1998) und postoperative Liquorfisteln (Welch 1979). Eine weitere Ursache kann im intraoperativen Kontakt zwischen Kathetermaterial und der Haut des Patienten bzw. der des Operateurs liegen. So zeigten Kulkarni et al. (2001) einen signifikanten Zusammenhang zwischen Beschädigung der OP-Handschuhe und Shuntinfektionen.
Zur Reduktion von Shuntinfektion(en):ReduktionShuntinfektionen sind folgende Maßnahmen empfehlenswert:
-
•
Vermeidung postoperativer Liquorleckagen durch äußerste Sorgfalt bei der Implantation,
-
•
Vermeidung des Hautkontakts der Implantate,
-
•
wenn möglich, Verwendung shuntfreier Versorgungstechniken wie z. B. der endoskopischen Ventrikulostomie,
-
•
Verkürzung der OP-Dauer durch optimale Koordination der Abläufe,
-
•
PAP mit staphylokokkenwirksamem Antibiotikum,
-
•
atraumatische OP-Technik,
-
•
Tragen von doppelten Handschuhen.
Temporäre externe ventrikuläre und lumbale Liquorableitungen: Ein hohes Risiko für NI besteht bei der Verwendung externer Liquordrainagen. Dabei werden Infektionsraten zwischen 6 und 22 % beim Einsatz externer Ventrikeldrainagen (Holloway et al. 1996, Lyke et al. 2001, Acikbas et al. 2002) und bis zu 10 % bei lumbaler Katheteranlage beschrieben (Shapiro et al. 1992, Coplin et al. 1999).
Es besteht ein sicherer Zusammenhang zwischen Dauer der Liquordrainage und Wahrscheinlichkeit einer Infektion. Infektionsraten zwischen 27 und 100 % werden bei einer Drainagedauer von > 10 Tagen mit einer Häufung ab dem 5. postoperativen Tag beschrieben (Schade et al. 2005).
Empfehlenswert ist daher der routinemäßige Wechsel der Drainage zwischen dem 5. und 10. Tag der Liegedauer, bei klinischen oder paraklinischen Hinweisen auf eine Infektion sofort.
Die externe Liquordrainage ist keine Indikation zur prophylaktischen Antibiotikagabe, weil keine Evidenz in Form randomisierter Studien mit dem Endpunkt Meningitis vorliegt (Poon et al. 1998, McCarthy et al. 2010).
Möglicherweise kann die Infektionsrate durch langstreckige Tunnelung des Ventrikelkatheters reduziert werden (Khanna et al. 1995). Das Risiko ventrikulärer und lumbaler Drainagen unterscheidet sich bei gleicher Liegedauer nicht. Für externe Ventrikelableitungen sind silberimprägnierte bzw. antibiotikabeschichtete Katheter verfügbar, deren antimikrobieller Effekt in vitro nachgewiesen wurde (Secer et al. 2008). Randomisierte Studien zum klinischen Effekt dieser Katheter liegen jedoch derzeit nicht vor (Galiano et al. 2008, Lackner et al. 2008; Fichtner et al. 2010).
Risikofaktoren für Infektion(en):Liqurdrainagen, RisikofaktorenInfektionen bei externen Liquordrainagen (Bader et al. 1995, Lozier et al. 2002, Schade et al. 2005) sind
-
•
die Dauer der Drainage,
-
•
Diskonnektion des Drainagesystems,
-
•
Verschluss der Drainage.
Vorgehen bei Shuntinfektionen: Infektionen bei ventrikuloperitonealen Ableitungen stellen eine der häufigsten Komplikationen dar.
Die aussichtsreichste Behandlungsmethode besteht in der vollständigen Entfernung des infizierten Ableitungssystem, intermittierender oder kontinuierlicher externer Liquordrainage und Neuimplantation nach Ausheilung der Infektion (Schreffler et al. 2002).
Deutlich geringer ist die Wahrscheinlichkeit einer Ausheilung der Infektion bei direktem Austausch des infizierten Ableitungssystems unter Antibiotikagabe. Eine Ausheilung der Shuntinfektion(en):Therapiehäufig chronischen Infektion unter antibiotischer Therapie bei Belassen des Shuntsystems ist gegenüber den beiden o. g. Behandlungsverfahren die Methode mit der geringsten Erfolgsaussicht (Schreffler et al. 2002).
Spinale Eingriffe
Die Wahrscheinlichkeit von NI nach spinalen Eingriffen beträgt in Abhängigkeit von der Art des Eingriffs und patientenindividueller Risikofaktoren 1–6 % (NNIS-Operation(en):liquorableitende\"\r\"OPSliquorableitendSystem Report 2004, Takahashi et al. 2009). Dabei führen v. a. patientenindividuelle Risikofaktoren zur Vervielfachung des Infektionsrisikos.
Risikofaktoren für Infektionen nach spinalen nosokomiale Infektion(en):spinale EingriffeEingriffen sind
-
•
das Ausmaß der Wunde,
-
•
die Dauer des Eingriffs,
-
•
lang dauernde Verwendung von Drainagen,
-
•
das Ausmaß des Blutverlusts,
-
•
Instrumentierung.
Eine Zunahme der NI-Rate tritt bei instrumentierten Eingriffen auf. Hier wird über eine Inzidenz von 3,8 bzw. 4,2 % berichtet (Levi et al. 1997, Wimmer et al. 1998). Daher müssen spinale Eingriffe mit und ohne Instrumentierung in Bezug auf das Infektionsrisiko getrennt betrachtet werden.
Implantatfreie spinale Eingriffe: Bei nicht instrumentierten spinalen Eingriffen ist eine SSI-Rate von ca. 1–2 % zu erwarten (Dimmick et al. 2000). Neben oberflächlichen und tiefen Weichteilinfektionen stellen Diszitiden und Spondylodiszitiden unangenehme und langwierige Komplikationen dar. Seltener, aber in ihrem Ausmaß bedeutsamer sind spinale epidurale Abszesse, in deren Folge durch Raumforderung und Kompression neuraler Strukturen oder durch sekundäre Entwicklung von Meningitiden und Myelitiden schwerste neurologische Defizite eintreten können.
Maßnahmen zur Reduktion entzündlicher Komplikationen in der Wirbelsäulenchirurgie sind
-
•
die Verminderung des Gewebetraumas durch mikrochirurgische und minimalinvasive OP-Techniken (O'Toole et al. 2009),
-
•
intermittierende Spülung der Wunde mit NaCl-Lösung,
-
•
Minimierung des Einsatzes von Wunddrainagen (Payne et al. 1996),
-
•
PAP,
-
•
Handschuhwechsel nach 90 Minuten (Partecke et al. 2009).
Das Risiko von NI steigt proportional zum Ausmaß des Gewebetraumas. Daher sollten nach Möglichkeit mikrochirurgische (Olsen et al. 2003) und minimalinvasive Techniken eingesetzt werden.
Gesicherte Daten über den Nutzen einer PAP liegen nicht vor. Alle hierzu publizierten Studien verfügen über eine zu geringe Fallzahl, um einen statistisch gesicherten Nutzen dieser Maßnahme nachzuweisen. Brown et al. (2004) empfehlen jedoch eine Prophylaxe mit einem Cephalosporin der 1. oder 2. Generation, bei Vorliegen einer Allergie gegen diese Wirkstoffe bzw. Vorliegen einer Kolonisation mit methicillinresistentem S. aureus (MRSA) die Gabe eines Glykopeptids (Teicoplanin oder Vancomycin) in Kombination mit Gentamicin
Instrumentierte spinale Eingriffe: Die Infektionsrate instrumentierter Eingriffe ist deutlich höher als die nicht instrumentierter Wirbelsäuleneingriffe. Dabei scheint die Inzidenz bei posteriorer Instrumentierung höher zu sein als bei ventraler Instrumentierung (Wimmer et al. 1998, Olsen et al. 2003). Häufigste Erreger sind auch hier Staphylokokken. Allerdings finden sich bei posterioren lumbosakral lokalisierten Zugängen häufig gramnegative Erreger. Disponierend ist hier eine Inkontinenz, die zur Kontamination der Wunden führen kann.
Aufgrund des erhöhten Infektionsrisikos ist eine PAP empfehlenswert (Arbeitskreis „Krankenhaushygiene“ der AWMF, 2005, Watters et al. 2009).
Bei Auftreten von Infektionen ist die Entfernung metallischer Implantate nicht zwingend erforderlich. Kunststoffimplantate müssen dagegen i. d. R. explantiert werden.
Medikamentenpumpen, Implantate zur tiefen Hirnstimulation und andere Neurostimulatoren
Eingriff(e):spinale\""\r""EingriffespinaleBei Pumpen zur intrathekalen Medikamentenapplikation und Stimulatoren für verschiedene Einsatzgebiete sind implantatabhängige entzündliche MedikamentenpumpenKomplikationen mit 1–3 % ein seltenes Ereignis (Harke et al. Implantat(e):zur tiefen Hirnstimlation2003). Neben lokalen Entzündungen können sowohl Meningitiden als auch spinale Neurostimulatorenund zerebrale Abszesse und Granulome mit dem Bild einer Paraplegie bzw. mit zentralen neurologischen Defiziten auftreten.
Bei der Implantation gelten daher dieselben Vorsichtsmaßnahmen wie bei der Implantation ventrikuloperitonealer Ableitungen. Eine PAP mit einem staphylokokkenwirksamen Antibiotikum ist empfehlenswert.
Sanierungsversuche bei belassenen Implantaten, obwohl als erfolgreich beschrieben (Zed et al. 2000, Boviatsis et al. 2004), sollten wegen der geringen Erfolgschancen und der hohen Komplikationsgefahr unterbleiben. Vielmehr ist die vollständige Entfernung des Implantats und eine Neuimplantation in Analogie zur Sanierung chronisch infizierter ventrikuloperitonealer Ableitungen das Mittel der Wahl.
Offene Schädel-Hirn- und spinale Traumen
Aufgrund des unterschiedlichen Verletzungs- und Kontaminationsmusters werden penetrierende Schädel-Hirn-Verletzungen, fronto- und otobasale offene Schädel-Hirn-Traumen sowie offene spinale Verletzungen getrennt betrachtet.
Direkt offene penetrierende Schädel-Hirn-Traumen: Bei Schussverletzungen ist eine Wundversorgung mit Entfernung von Blutungen, Nekrosen, Knochenfragmenten sowie eingedrungenen Fremdkörpern wie Haaren und Kleidung vorzunehmen. Das intakte Hirngewebe sollte dabei geschont werden. Sowohl am Ein- als auch am Austritt des Schädel-Hirn-Trauma, offenesProjektils ist eine plastische Deckung des Duradefekts notwendig.
Eine prophylaktische antibiotische Behandlung über 5 Tage mit einer Kombination aus Clavulansäure und Amoxicillin, alternativ Cefuroxim, sowie Metronidazol wird empfohlen (Baystone et al. 2000). Ein analoges Vorgehen ist bei anderen penetrierenden Schädel-Hirn-Verletzungen notwendig.
Indirekt offene frontobasale und otobasale Schädel-Hirn-Verletzungen: Bei offenen frontobasalen Verletzungen besteht ein deutlich erhöhtes Meningitisrisiko im Langzeitverlauf. Daher ist die plastische Deckung des Duradefekts unbedingt erforderlich. Oftmals verhindert jedoch ein begleitendes Hirnödem die frühzeitige operative Versorgung.
Schädel-Hirn-Trauma:offenesDer Nutzen einer prophylaktischen antibiotischen Behandlung ist umstritten. Eljamel und Foy (1990) stellten einen Rückgang entzündlicher Komplikationen unter prophylaktischer antibiotischer Behandlung fest. Choi et al. (1996) konnten dagegen eine Zunahme entzündlicher Komplikationen unter prophylaktischer antibiotischer Therapie zeigen. Prospektive randomisierte Studien hierzu liegen nicht vor. Die Autoren empfehlen den Verzicht auf eine prophylaktische antibiotische Therapie bei engmaschigem Screening nach Hinweisen auf eine Meningitis.
Otobasale posttraumatische Liquorfisteln heilen i. d. R. unter intermittierender oder kontinuierlicher externer Liquorableitung spontan aus. Eine prophylaktische antibiotische Therapie ist nicht notwendig.
Penetrierende Wirbelsäulenverletzungen: Schussverletzungen der Wirbelsäule sind mit einer Infektionsrate von 5–8 % verbunden. Kolonverletzungen vor Eintritt des Projektils erhöhen die Wahrscheinlichkeit einer Infektion (Romanick et al. 1985, Velmahos et al. 1994). Bei dieser Art der Verletzung wird die operative Entfernung des Wirbelsäulenverletzung(en), penetrierendeProjektils empfohlen, um die Infektionsrate zu senken. Allerdings zeigten andere Autoren (Kithir et al. 1991, Lin et al. 1995, Kumar et al. 1998), dass unter antibiotischer Therapie keine spinalen Infektionen trotz Verzicht auf spinale Revision auftraten.
Eingriffe bei entzündlichen Erkrankungen
Hirnabszess: Die Ursache eine Abszedierung ist in den meisten Fällen die direkte Fortleitung einer Infektion aus der Umgebung. Häufigste Lokalisationen sind dabei Otitiden und Mastoiditiden sowie Entzündungen der Nasennebenhöhlen (Tab. 5.18 ).
Tab. 5.18.
Lokalisation des infektiösen Fokus bei direkter und hämatogener Ausbreitung von Hirnabszessen.
| Direkte Fortleitung | Hämatogen |
|---|---|
|
|
Bei hämatogener Ausbreitung finden Hirnabszess(e)sich häufig multiple Abszesse bevorzugt im Stromgebiet der A. cerebri media. Weitere Risikofaktoren sind vorangegangene neurochirurgische Eingriffe sowie offene Schädel-Hirn-Verletzungen (Tab. 5.18).
Im Rahmen der Geneseklärung sollten auch eine medikamentöse Immunsuppression, konsumierende Grunderkrankungen, eine HIV-Infektion und ein chronischer intravenöser Drogenabusus beachtet werden.
Die Behandlung des Hirnabszess(e):TherapieHirnabszesses besteht in der operativen Entfernung des Eiters, der Sanierung des Fokus sowie systemischer antibiotischer Therapie.
Eine medikamentöse Therapie sollte erst nach der Entnahme einer mikrobiologischen Probe eingeleitet werden. Bei ausgeprägtem perifokalem Ödem ist eine zusätzliche Gabe von Dexamethason empfehlenswert.
Eine ausschließlich medikamentöse Therapie ist nur in der Frühphase vor der eitrigen Einschmelzung des Abszesses oder bei multiplen Herden sinnvoll (Tab. 5.19 ). Die sich entwickelnde Membran behindert später eine ausreichende Medikamentenpenetration. Die Dauer der antibiotischen Behandlung sollte mindestens 4 Wochen betragen.
Tab. 5.19.
Empfohlene ungezielte antibiotische Therapie bei Hirnabszess.Antibiotikatherapie:Hirnabszess
| Medikament | Dosierung |
|---|---|
| Flucloxacillin (alternativ Oxacillin) | 3 × 2 g i. v. |
| Cefotaxim | 3 × 2 g i. v. |
| Metronidazol | 2 × 500 mg i. v. |
(Dosierung für einen ca. 75 kg schweren Erwachsenen)
Bei bereits eingeschmolzenen Abszessen ist die ultraschallgestützte oder stereotaktische Abszessentleerung Mittel der Wahl. In seltenen Fällen kann ein reifer Abszess in toto analog einer Tumoroperation entfernt werden.
Subdurales Empyem: Hierbei handelt es sich um eine fulminant verlaufende, akut lebensbedrohliche Erkrankung. Häufig findet sich ein ausgeprägtes Hirnödem mit der akuten Gefahr einer zerebralen Herniation. Ursächlich sind häufig Entzündungen der Stirnhöhle oder des Mastoids, offene Schädel-Hirn-Empyem(e):subduralesVerletzungen sowie vorangegangene neurochirurgische Eingriffe (Nathoo et al. 1999).
Die Therapie besteht in der sofortigen Drainage des Empyems in Kombination mit antiödematöser Kortikoidtherapie. Eine ungezielte antibiotische Initialtherapie mit einer Kombination aus Metronidazol, Flucloxacillin und Cefotaxim ist sofort nach Entnahme der mikrobiologischen Proben durchzuführen.
Spinale Abszesse und Empyeme: In den letzten Jahren ist eine deutliche Verschiebung der Ursachen spinaler Entzündungen von spontan lokalen oder hämatogenen Ursachen hin zu Komplikationen iatrogener Maßnahmen zu beobachten. Dabei spielen v. a. die extensive Empyem(e):spinaleNutzung von Schmerzkathetern und die sog. periradikuläre Abszess(e), spinaleTherapie eine wichtige Rolle. Das Risiko entzündlicher Komplikationen liegt bei ca. 0,2 % für diagnostische Eingriffe (Zeidman et al. 1995). Problematisch ist dabei die Kombination aus vorbestehenden vertebrogenen oder diskogenen Schmerzen mit neu auftretenden Schmerzen als Folge der Entzündung, die häufig erst in der Spätphase bei manifesten neurologischen Defiziten zur Diagnosestellung führen. Die wichtigste prophylaktische Maßnahme ist daher die Reduktion invasiver Behandlungsmaßnahmen. Die häufigsten Erreger sind auch hier Staphylokokken (Rigamonti et al. 1999).
Prädisponierende Faktoren für spinale Entzündungen sind (Rigamonti et al. 1999)
-
•
intravenöser Drogenabusus,
-
•
Diabetes mellitus,
-
•
vorangegangene spinale Eingriffe oder Injektionen.
In der Regel ist die chirurgische Sanierung des Prozesses erforderlich. Üblicherweise wird neben der Ausräumung des Abszesses besonders bei langstreckigen epiduralen Abszessen der Einsatz einer Saug-Spül-Drainage notwendig. Die antibiotische Therapie sollte sofort nach Materialentnahme für die mikrobiologische Diagnostik mit einer Kombinationstherapie gegen anaerobe und aerobe Bakterien begonnen werden.
5.7.3. Antibiotikaprophylaxe
Die Zielstellung der PAP liegt in der Senkung postoperativer Infektionen. Sie stellt aber keinen Ersatz für Basismaßnahmen der Aseptik und Antiseptik dar.
Der Einsatz eines Antibiotikums ist indiziert, falls ein erhöhtes Infektionsrisiko besteht oder schwerwiegende Konsequenzen zu befürchten sind. Ein erhöhtes Infektionsrisiko besteht bei allen Eingriffen, die nicht der Wundklassifikation sauber entsprechen sowie bei Verwendung von Implantaten. Aufgrund der schwerwiegenden Konsequenzen ist eine Antibiotikagabe auch bei allen intrakraniellen Eingriffen indiziert.
Die erste Gabe sollte zwischen 30 und 60 Minuten vor dem Hautschnitt erfolgen. Die Auswahl des Präparats richtet sich nach den wahrscheinlichsten Erregern. In der Neurochirurgie sind Infektionen mit S. aureus bzw. KNS am wahrscheinlichsten (NNIS System Report 2004), was bei der Wahl des Antibiotikums berücksichtigt werden sollte. Als Prophylaxe ist die Gabe eines Cephalosporins der 1. oder 2. Generation (Cefuroxim, Cefazolin, Cefradin, Cefamandol; Holloway et al. 1996b) empfehlenswert. Bei Allergien gegen diese Antibiotika und ausgeschlossener Kreuzallergie gegen Penicilline ist die Gabe eines Carbapenems in Kombination mit Gentamicin sinnvoll. Bei Allergien gegen diese Antibiotika und ausgeschlossener Kreuzallergie gegen Penicilline sollte das alternative Vorgehen mit einem klinischen Infektiologen/Mikrobiologen abgestimmt werden.
Bei Kolonisation mit MRSA ist vor geplanten Operationen die präoperative Sanierung anzustreben.
Die Applikation von Antibiotika in der postoperativen Phase ist nicht sinnvoll und fördert lediglich die Entwicklung resistenter Antibiotikastämme (Brown et al. 2004).
5.7.4. Händehygiene
Wie in allen Disziplinen wird auch in der Neurochirurgie die SSI-Rate durch indikationsgerecht durchgeführte Händedesinfektion reduziert.
In einer Interventionsstudie konnte nach Einführung eines Händehygieneprogramms die SSI-Rate von 8,3 auf 3,8 % gesenkt werden (Le Ta et al. 2007).
5.7.5. Einfluss der Raumklasse
In einigen Fällen konnte ein Erregereintrag via Raumluft in das OP-Areal als Ursache neurochirurgischer SSI identifiziert werden (Duhaime et al. 1991, Reichert et al. 2002). Da durch Laminar Air Flow (LAF) eine effektivere Verdrängung luftgetragener Mikroorganismen und Raumklasse(n):SSI, neurochirurgischePartikel im Vergleich zu Mischlüftung erreicht wird und bei der Implantation von Hüftendoprothesen ein infektionspräventiver Einfluss nachgewiesen werden konnte (Kramer et al. 2010), ist davon auszugehen, dass durch LAF zumindest bei lang dauernden Eingriffen mit Implantation von Fremdmaterial ein zusätzlicher Schutz erreichbar ist.
5.7.6. Surveillance
Zur exakten Identifizierung neurochirurgischer SSI ist ein aktives Surveillanceprogramm zu etablieren (Burnichon et al. 2007, Heipel et al. 2007).
Nur auf dieser Basis sind eine Evaluation des QM und eine Qualitätssicherung möglich. In unserer Klinik wurde als Marker-OP die postoperative Disziitis ausgewählt.
5.8. Neurologie und Psychiatrie
Bernd Griewing, Annett Pohl und Maren Eggers
In der Neurologie und Psychiatrie müssen die Standardmaßnahmen der Infektionsprävention zur Infektion(en):Neurochirurgie\"\r\"InfektionenNeurochirVermeidung der Verbreitung von Krankheitserregern unter Patienten, Personal und Besuchern eingehalten werden. Da entzündliche Prozesse des ZNS zu Beginn oft ein uncharakteristisches klinisches Bild bieten, ist die Entscheidung nicht einfach, welche Hygiene- und Schutzmaßnahmen eingeleitet werden müssen.
Die Furcht vor neuen Infektionskrankheiten wie vCJD und SARS und das häufigere Auftreten von Borreliose, FSME und Influenza haben zu Unsicherheiten über notwendige Hygienemaßnahmen geführt. Die Situation wird dadurch erschwert, dass bisher keine Studien zu spezifischen hygienischen Fragestellungen in der Neurologie und Psychiatrie nach Aussagen der Deutschen Krankenhausgesellschaft, des NNIS und der Study of the Efficacy of Nosocomial Infection Control (SENIC) vorliegen.
5.8.1. Infektionsrisiko bei Eingriffen und neurologischen Krankheitsbildern
Grundsätzlich unterscheidet sich der Umgang mit potenziell infektiösem Gewebe, Liquor oder Blut in der Neurologie nicht von anderen Fachgebieten. Eine Infektionsgefährdung kann in seltenen Fällen im Rahmen therapeutischer und diagnostischer Verfahren in der Neurologie ausgehen.
Elektroden:
Durch Oberflächenelektroden sind keine lokalen oder systemischen Infektionen beschrieben. Infektionen durch Nadelelektroden sind eine Rarität.
Letztere wurden nach elektromyographischen Untersuchungen durch S. epidermidis, Mycobacterium (M.) fortuitum und HBV verursacht (Burris und Elektroden, InfektionsrisikoFairchild 1986, Nolan et al. 1991). Die HBV-EMG:Infektion(en)Übertragung ereignete sich zwischen 1991 und 1996 und betraf 75 Patienten. Überträger war ein HBe-positiver Techniker, der die EEGs durchgeführt hatte (Johnson et al. 2000) und die Nadeln lediglich 3–4 Stunden in 2 % Glutaral-Lösung eingelegt hatte, mit nachfolgendem Abspülen mit Wasser und Absprühen mit Alkohol. Nach Einführung der abschließenden Sterilisation nach der Reinigung und Desinfektion traten keine Fälle mehr auf. Außerdem wird über einen Patienten berichtet, der durch Implantation von EEG-Tiefenelektroden an CJD erkrankte (Bernoulli et al. 1977). Die Elektroden waren vorher bei einem Patienten mit dieser Erkrankung benutzt und mit einem Standardverfahren sterilisiert worden.
Bei der lumbalen oder subokzipitalen Liquorpunktion kann die Übertragung von Krankheitserregern durch Kontamination der Liquornadel bei der Passage durch die Haut erfolgen.Die iatrogene Meningitis nach Liquorpunktion ist eine seltene, aber schwerwiegende Komplikation. Kasuistiken betreffen z. B. Meningitiden durch S. aureus (n = 3), S. salivarius (n = 2), P. aeruginosa, Acinetobacter spp. und M. tuberculosis (je n = 1; Torres et al. 1993, Domingo et al. 1994, Pandian et al. 2004. In einer prospektiven Studie an 1.880 Neugeborenen konnte nur in einem Fall der Zusammenhang zwischen lumbaler Liquorentnahme und sekundärer bakterieller Meningitis festgestellt werden (Hristeva et al. 1993). Bei sehr unreifen Frühgeborenen mit Hydrocephalus malresorptivus nach intraventrikulären Blutungen wird heute meist vorübergehend ein Rickham-Reservoir implantiert. Die unter der Haut gelegene Punktionskammer ist über einen Katheter mit dem Seitenventrikel verbunden. Dies lässt die wiederholte Punktion und Druckmessung unter streng aseptischen Kautelen zu. Bei einem Teil der Kinder kann das Reservoir im Verlauf ersatzlos explantiert werden. Persistiert der Hydrocephalus, erhalten die Kinder einen dauerhaften ventriukuloperitonealen Shunt. Griewing und Machetanz (2001) registrierten im Zeitraum 1970–1995 bei etwa 28.000 diagnostischen Liquorentnahmen keine Meningitis, bei 2000 Lumbalpunktionen mit Einzelinjektion im Rahmen einer intrathekalen Zytostatikatherapie bei Meningeosis neoplastica kam es in 3 Fällen zu postpunktionellen Meningitiden.
Da in seltenen Fällen mit einer iatrogenen Entzündung des Liquorraums nach einer Punktion gerechnet werden muss, sind ausreichende Schutzmaßnahmen nicht nur aus hygienischer, sondern auch aus juristischer Sicht einzuhalten (Tab. 5.20 ).
Tab. 5.20.
Diagnostische und therapeutische Verfahren mit besonderen hygienischen Anforderungen.Nervenleitgeschwindigkeitsmessung, HygienemaßnahmenLiquorpunktion:HygienemaßnahmenEMG:HygienemaßnahmenElektroenzephalographie, Hygienemaßnahmen
| Eingriff/Maßnahme | Anforderungen |
|---|---|
| Liquorpunktion (lumbal, subokzipital, ventrikulär) | Hautantiseptik, sterile Tupfer, sterile Handschuhe, Mund-Nasen-Schutz |
| Verschiedene Nadelinstrumente zur klinischen Untersuchung der Schmerzempfindung | Hautantiseptik, sterile Nadeln, Hautantiseptik, grundsätzlich Einmalmaterial |
| EMG, Messung von Nervenleitungsgeschwindigkeit und evozierten Potenziale mit Nadelelektroden | |
| Elektroenzephalographie (Nadel-Skalpelektroden, Sphenoidalelektroden) | |
| Infusionen von aus Humanserum gewonnenen Substanzen (z. B. Immunglobulintherapie bei Polyradikulitiden) | Einhaltung der Grundsätze der Infusionstherapie |
Übertragungsgefahr von Slow-Virus-Infektionen: 1920 berichtete Creutzfeldt über eine 23-jährige Frau, die an einem rasch progredienten hirnatrophischen Prozess verstorben war.
Drei ähnliche Fälle wurden ein Jahr später von Jakob publiziert. In den folgenden Jahrzehnten fielen neuropathologische Slow-Virus-Infektionen, ÜbertragungsrisikoÄhnlichkeiten zwischen CJD, Kuru, BSE beim Rind und Scrapie auf (Hadlow 1959). Infektiöses Agens sind in allen Fällen Prionen. Beim Menschen werden durch Prionen ferner vCJD, das Gerstmann-Sträussler-Syndrom und die Fatal Familial Insomnia (FFI) ausgelöst (Kap. 3.3).
Bekannt gewordene iatrogene Übertragungen wurden durch Hornhauttransplantation, Duraimplantation, kontaminierte stereotaktische EEG-Elektroden und durch in üblicher Weise und damit bezüglich CJD ungenügend sterilisiertes neurochirurgisches OP-Besteck verursacht (Will und Matthews 1982, Collins et al. 1999, Kap. 3.3). 1985 und 1986 wurden Fälle beschrieben, bei denen 5–22 Jahre nach Erhalt von aus menschlichen Hypophysen extrahiertem Wachstumshormon die CJD auftrat (Gibbs et al. 1985, Titner et al. 1986).
Bei medizinischem Personal wurde die Erkrankung bisher nur selten dokumentiert (Brown 1980), wobei sich die Infektion nicht auf Patienten zurückführen ließ. Obwohl Pathologen, Neuropathologen und Sektionsgehilfen einem erhöhten Infektionsrisiko ausgesetzt sind, liegen keine Berichte über Infektionen vor (Rosenberg et al. 1986). Ebenso sind keine Veröffentlichungen zur Gefährdung bei Zahnbehandlungen bekannt, z. B. bei der Eröffnung der Pulpahöhle oder bei Anwendung hochtouriger Präparationsinstrumente mit Freisetzung von Nervengewebe. Hier muss man vorläufig davon ausgehen, dass ein potenzielles, aber nicht näher untersuchtes Risiko besteht. Damit ergibt sich, dass CJD nicht ansteckend im üblichen Sinne, aber übertragbar ist. Für Ärzte und Pflegepersonal ist im persönlichen Umgang mit Erkrankten keine Infektion zu befürchten.
Bei invasiven Maßnahmen, z. B. Blut- oder Liquorentnahme, EMG oder operativen Maßnahmen, ist bei Verdacht oder gesicherter Diagnose von CJK große Vorsicht vor Selbstverletzung geboten. Nur die ausschließliche Verwendung von Einmalmaterialien bietet die sichere Gewähr, dass eine Krankheit nicht auf andere Patienten übertragen werden kann.
Zur Wiederverwendung vorgesehene MP sind vor der Sterilisation risikoabhängig zusätzlich effektiven Dekontaminationsverfahren zu unterziehen (Kap. 3.3).
5.8.2. Antimikrobielle Maßnahmen bzw. Verfahren aus neurologischer Sicht
Hautantiseptik
Vor jedem Einstich in die Haut ist die Antiseptik erforderlich (Kap. 2.2), wobei abhängig vom Eingriff sterilisierte oder sterile Tupfern zu verwenden sind. Für Peridural-/Spinalanästhesie mit Katheteranlage bzw. Anlage eines Periduralkatheters zur Schmerztherapie sind sterile Tupfer, steriles Abdeck- Hautantiseptik:Neurologie/Psychiatrieoder Lochtuch, sterile Handschuhe, Mund-Nasen-Schutz, steriler Kittel und OP-Haube zu verwenden (Morin et al. 2006).
Auf talgdrüsenreicher Haut, wie in der Schweißrinne des Rückens, ist vor lumbaler Liquorentnahme und vor der Diagnostik mit Nadelelektroden die verlängerte und für das ausgewählte Antiseptikum deklarierte Einwirkungszeit zu beachten (jeweils aktuelle Desinfektionsmittelliste des VAH).
Nach aktuellen Erkenntnisssen kann die Einwirkungszeit auf 3 Minuten begrenzt werden (Hübner et al. 2011).
Vor dem Aufbringen von Oberflächenelektroden ist dagegen keine Antiseptik erforderlich.
Aseptik
Die überlegte adäquate Vorbereitung der Lumbalpunktion unter Anwendung aseptischer Arbeitstechniken und die zu Beginn durchgeführte hygienische Händedesinfektion helfen, Infektionen vorzubeugen. Die Vorbereitung muss durch geschultes Personal erfolgen. Der Hautantiseptik:Neurologie/PsychiatrieKontaminationsvermeidung dient das Arbeiten mit freien Unterarmen.
Für die Lumbalpunktion müssen sterile Handschuhe und ein Mund-Nasen-Schutz getragen werden.
Es konnte der Zusammenhang zwischen der Kontamination des Areals aus der Mundhöhle vor der Lumbalpunktion mit nachfolgender Meningitis nachgewiesen werden (Veringa et al. 1995, Pandian et al. 2004).
Erfolgt die Vorbereitung des Zubehörs auf einer Arbeitsfläche, muss diese zuvor wischdesinfiziert bzw. bei Punktionen, die einen Wechsel und ein zwischenzeitliches Ablegen steriler Instrumente erfordern, zusätzlich steril abgedeckt werden.
Aus Gründen des Selbstschutzes ist das Tragen von Schutzhandschuhen bei der neurophysiologischen Diagnostik mit Nadelelektroden zur Vermeidung von durch Blut übertragbaren Infektionen routinemäßig zu empfehlen.
Aufbereitung von Medizinprodukten
Das Problem der Aufbereitung dürfte sich bei Nadeln und Kanülen, die nicht als Einwegmaterialien benutzt werden, kaum mehr ergeben.
Oberflächenelektroden werden nach jedem Patienten von der verbliebenen Elektrolytpaste gereinigt und eine Wischdesinfektion durchgeführt.
Bei Patienten mit floriden bakteriellen oder viralen Infekten wird empfohlen, Oberflächenelektroden sorgfältig zu reinigen und, wenn es das Elektrodenmaterial ermöglicht, mit einem Instrumentendesinfektionsmittel unter Beachtung von Konzentration und Einwirkungszeit der VAH-Liste zu desinfizieren; bei Infektionen mit unbehüllten Viren sind virozide Mittel zu verwenden. Wenn die Elektrode nicht zu desinfizieren ist, muss sie weggeworfen werden.
Nadeln für Akupunktur, Myographie und Nervenleitgeschwindigkeitsmessung sind wegen des CJD-Risikos grundsätzlich als Einwegmaterial zu empfehlen.
Bei bestätigter oder ungeklärter Diagnose sind kritische und semikritische Medizinprodukte CJD-spezifisch aufzubereiten oder zu entsorgen (Kap. 3.3).
Distanzierung bei Meningoenzephalomyelitis
Grundsätzlich richtet man sich zunächst nach dem potenziellen Erreger, bei dem die strengsten Isolierungsmaßnahmen notwendig sind. Nach Klärung der Ätiologie sind die Maßnahmen dem nachgewiesenen Erreger anzupassen (Tab. 5.21 ).
Grundsätzlich ist zunächst eine Einzelunterbringung des Patienten, insbesondere bei klinischen Hinweisen auf eine Genese durch Pneumo- und Meningokokken, notwendig.
Tab. 5.21.
Isolierungsempfehlungen bei Meningitiden/Enzephalitiden (Frau PD M Eggers, Stuttgart, danke wir für Ihre Beratung bei der Erstellung der Tabelle).Meningitis:IsolierungsmaßnahmenEnzephalitis, Isolierungsmaßnahmen
| Reich | Erreger | Isolierung | Schutzkittel, Handschuh1 | Mund-Nasen-Schutz | Haarschutz | Wirkungsspektrum für die Desinfektion | Aufhebung der Isolierung |
|---|---|---|---|---|---|---|---|
| Unbekannt | + | + | + | + | Virozid | Nach Diagnose fehlender Übertragung | |
| Bakterien | N. meningitidis | + | + | + | + | Bakteriozid | 24 h nach Therapiebeginn |
| S. pneumoniae | (+) | – | – | – | |||
| B. burgdorferii, L. monocytogenes, E. coliH. influenzae | – | + | – | – | |||
| M. tuberculosis | Nur bei offener Tbk | + | + | + | Tuberkulozid | Bei offener Tbk bis neg. Sputumbefund | |
| Pilze | C. neoformans2 | – | – | – | – | Fungizid | |
| Behüllte Viren | Herpes-simplex-Virus Typ-I und II, Varicella-Zoster-Virus, Epstein-Barr-Virus | – | + | – | – | Begrenzt virozid | |
| HIV | – | + | – | – | Achtung bei profuser Diarrhö | ||
| Influenza3 | + | + | + | + | 7 Tage nach Erkrankungsende | ||
| Masern3 | + | + | + | + | Nach Erkrankungsende | ||
| Mumps3 | – | + | + | + | Nach Erkrankungsende | ||
| Tollwut | + | + | – | Während der Erkrankung | |||
| FSME, Dengue, West-Nil, Sandfliegenfieber (Toskana), weitere mosquito-transmitted Viren | – | – | – | – | |||
| Unbehüllte Viren | Adenoviren | +2 | + | + | + | Virozid | Nach Erkrankungsende |
| Enteroviren (Coxsackie A und B, Echo, Enterovirus 71, Polio) | + | + | – | – | Nach Erkrankungsende | ||
| Parvovirus B192 | – | – | – | – | – | Kein Kontakt zu nicht immunen Schwangeren | |
| Prionen | CJD4, vCJD4 | – | Bei Lumbalpunktion | Bei Verunreinigung mit Liquor u. Ä. Guanidin-thiocyanat | Während der Erkrankung | ||
| Protozoen | T. gondii | – | – | – | – | ||
| Würmer | ZystizerkoseToxocariasis | – | – | – | – | Gründliche Händewa-schung nach operativer Entfernung |
Bei erwartetem Kontakt
Kein Kontakt zu Immunsupprimierten
Geimpftes bzw. immunes Personal einsetzen (+) keine Pflege durch Ungeimpfte > 60 Jahre
bei Verletzung mit Expositionsrisiko Wunde mit 1 M NaOH auswaschen, danach gründlich unter fließendem Wasser spülen
Als Schutz vor Distanzierungsmaßnahmen:MeningoenzephalomyelitisKontamination müssen Mund-Nasen-Schutz, Schutzkittel und Handschuhe bei möglichem Kontakt mit erregerhaltigem Material, mit kontaminierten Objekten oder mit der erkrankten Person angelegt werden. Zur Desinfektion von Instrumenten, Flächen und Wäsche sollen Desinfektionsmittel und -verfahren mit dem Wirkungsbereich B angewandt werden (Kap. 2.4). Für die hygienische Händedesinfektion sind bis zur Diagnoseklärung virozide Präparate auszuwählen. Bei allen routinemäßigen Desinfektionsmaßnahmen und bei der Schlussdesinfektion ist jeweils die Konzentration für die Einwirkungszeit von 1 Stunde einzusetzen. Infektion(en):Neurologie\"\r\"InfektionenNeurolPsych Hygienemaßnahmen:Psychiatrie\"\r\"HygmassnahmeNeurolPsych
5.9. Intensivmedizin
Matthias Gründling, Infektion(en)\t\"Siehe auch nosokomiale Infektion(en)Sven-Olaf Kuhn, Michael Wendt und Axel Kramer
Nosokomiale Infektionen (NI) limitieren, nosokomiale Infektion(en)\t\"Siehe auch Infektion(en)insbesondere wenn sie zur Sepsis führen, häufig den Erfolg intensivmedizinischer Bemühungen.
5.9.1. Epidemiologie
Nach der Gesundheitsberichterstattung des Bundes treten in Deutschland auf Intensivstationen (ITS) jährlich > 60.000 NI auf (Geffers et al. 2002). Bei den neuesten Daten der Extended Prevalence of Infection in Intensive Care (EPIC II) Study (7. Mai 2007) auf 1.265 Intensivstationen aus 75 Ländern (Vincent et al. 2009), bei denen nicht zwischen nosokomialen und nichtnosokomialen Infektionen unterschieden wurde, wurden von 13.796 gescreenten Intensivpatienten 51 % als infiziert eingestuft. Am häufigsten waren bei 64 % der infizierten Patienten Infektionen des Respirationstrakts, gefolgt von abdominalen Infektionen (20 %), Blutstrom- (15 %) und Harnwegsinfektionen (14 %). Bei 70 % der Infektionen gelang ein Erregernachweis, dabei handelte es sich in 62 % um gramnegative, in 47 % um grampositive Bakterien und in 17 % um Pilze. Bei der EPIC Study 15 Jahre zuvor waren 45 % der Patienten infiziert, wobei bei 23 % eine auf der ITS erworbene Infektion vorlag (Vincent et al. 1995). Atemwegsinfektionen waren mit 65 % am häufigsten, gefolgt von Harnwegs- (18 %) und Blutstrominfektionen (12 %). Die am häufigsten nachgewiesenen Erreger waren Enterobacteriaceae (34 %), S. aureus (30 %), Pseudomonas (P.) aeruginosa (29 %), KNS (19 %) und Pilze (17 %).
5.9.2. Pathophysiologie
Das Entstehen von NI auf der Intensivmedizin ist durch verschiedene Faktoren bedingt. Durch Grunderkrankungen oder die akute lebensbedrohliche Situation (OP, Trauma, Herzinfarkt) existiert eine eingeschränkte Pilzinfektion(en):Intensivstation(en)Immunkompetenz des kritisch kranken Patienten. Diese trifft auf eine Vielzahl invasiver diagnostischer und therapeutischer Verfahren, die physiologische Barrieren durchbrechen. Die besondere hygienische und mikroökologische Situation auf einer ITS (Häufung infizierter Patienten, massiver Breitspektrumantibiotikaeinsatz, enger Kontakt zwischen Personal und Patient) begünstigt zusätzlich das Entstehen von NI. In der Regel geht der Infektion eine Kolonisation primär nicht kolonisierter Areale voraus. Diese kann durch Erregerwanderung, Selektion und Übergewicht potenziell pathogener Erreger der patienteneigenen Flora (Oropharynx, Gastrointestinal-, Urogenitaltrakt) oder durch exogene Übertragung entstehen.
Wird das Gleichgewicht zwischen Immunkompetenz und Erregerlast gestört, kommt es zur NI.
5.9.3. Diagnostik von NI in der Intensivmedizin
Die Infektionsdiagnostik gestaltet sich im Einzelfall schwierig, da zwar oft klassische Infektionssymptome vorhanden sind, diese aber durchaus eine nichtinfektiöse Ursache haben können. Der Nachweis von Bakterien in primär sterilen Arealen gestattet noch keine ausreichende Differenzierung zwischen Infektion und Kolonisation. Andererseits entscheidet die adäquate Therapie über das Outcome des infizierten Patienten (Kumar et al. 2009). Daher ist es wichtig, vor dem schnellen Beginn der antiinfektiven Therapie Blutkulturen und mikrobiologisches Material vom vermuteten Infektionsort zu gewinnen.
Infektionssymptome wie Fieber, Bewusstseinsstörungen und Kreislaufdepression können beim Intensivpatienten oftmals nichtinfektiöse Ursachen haben. Andererseits sollte bei derartigen Symptomen bis zum Ausschluss immer an eine NI gedacht werden. Hilfreich ist neben apparativen Verfahren wie Röntgen, Sonografie und CT die Bestimmung von Entzündungsparametern. Bei der Diagnostik lebensbedrohlicher Infektionen bietet Procalcitonin (PCT) wegen vergleichsweise guter Sensitivität und Spezifität Vorteile gegenüber dem CRP und dem Leukozytengehalt im Blut (Hetherill et al. 1999). Entscheidend für die Wahl des Infektionsparameters ist zudem die Kinetik der Marker. Während Interleukin-6 in den ersten Stunden einer Infektion bzw. Entzündung erhöht ist und dann schnell wieder abfällt, werden PCT nach 6 Stunden und CRP nach 24 Stunden signifikant ansteigen und länger erhöht bleiben (Meisner et al. 2006). Für schwere Infektionen scheint PCT daher der am besten geeignete Parameter zu sein. Ausreichende klinische Daten liegen jedoch bisher nur für die ambulant erworbene Pneumonie vor (Christ-Crain et al. 2004). Für die klinische Routine empfiehlt sich die Diagnosestellung strikt nach Definitionskriterien in Kombination mit einer PCT-Bestimmung. Beispielhaft sei die Pneumoniediagnostik erwähnt (Kap. 4.4).
5.9.4. Allgemeine Maßnahmen zur Prävention nosokomialer Infektionen in der Intensivmedizin
Händehygiene:
Die Händehygiene:IntensivmedizinDurchsetzung indizierter Händehygiene vermeidet die Übertragung der wichtigsten nosokomialen Krankheitserreger, was für Intensivpatienten besondere Bedeutung besitzt.
Wichtig ist, dass vor und nach jedem Patientenkontakt sowie nach Kontakt mit Sekreten oder den dem Patienten zugeordneten Flächen (Bett, Spritzenpumpe, Monitor usw.) eine Händedesinfektion erfolgt. Darüber hinaus ist sie zum Eigenschutz des Personals essenziell. Wegen der Hautbelastung ist Händewaschen nur bei Verschmutzung der Hände bzw. Kontamination mit Bakteriensporen wie Clostridium (C.) difficile mit vorausgehender Händedesinfektion durchzuführen (ansonsten Risiko der Umfeldkontamination mit anderen Erregern + schlechtere Hautverträglichkeit + beeinträchtigte Wirkung durch Restfeuchte).
Im Griffbereich jedes Patienten und am Zutritt zur Station ist ein Desinfektionsmittelspender vorzusehen, um die Händedesinfektion für jeden Eintretenden einschließlich Besucher zu ermöglichen, und durch ein Piktogramm auf die Benutzung aufmerksam zu machen.
Distanzierung:
Mit Zunahme von MRE kommt der Einhaltung der Distanzierungsmaßnahmen:IntensivmedizinDistanzierungsmaßnahmen, insbesondere der Isolierung (Kap. 2.1) sowie der Gewährleistung von Aseptik (Barrierepflege, Schutzhandschuhe, Non-Touch-Technik, Schutzkleidung) und Antiseptik, besondere Bedeutung zu.
Räumliche und personelle Voraussetzungen beeinflussen die NI-Rate, weil der auf einer ITS häufige enge Kontakt zwischen Personal und Patient insbesondere bei Pflegemaßnahmen eine erhebliche Gefahr der Erregerübertragung birgt. Daher ist ein geringer Pflegeschlüssel mit höherer Morbidität und Mortalität assoziiert (Needleman et al. 2002, Spigaglia et al. 2009). Bei aufwändiger Intensivtherapie sind nach den Richtlinien der Deutschen interdisziplinären Vereinigung für Intensivmedizin (1979) 3 Pflegekräfte/Patient anzustreben. Natürlich gibt der beste Personalschlüssel keine Garantie für eine effektive Infektionsprophylaxe, wenn das Personal nicht geschult ist.
Die Abtrennung der Station mittels Schleuse bringt keinen infektionspräventiven Nutzen (Pitten et al. 2001). Eine ITS ist so zu gestalten, dass ausreichend separate Vorbereitungsräume, Entsorgungs- und Lagerräume vorhanden sind. Neben den räumlichen Voraussetzungen müssen die hygienischen Anforderungen an die Intensivtechnik beachtet werden (Beachtung der Desinfizierbarkeit von Oberflächen, ggf. Sterilisierbarkeit von Geräteelementen und Reduktion von Kabelverbindungen, Tastaturen und Bedienelementen mit oder ohne Touchscreen bei der Geräteauswahl).
Bei der Neuplanung von Intensiveinheiten empfiehlt es sich, mindestens die Hälfte der Zimmer als Einbett- und die übrigen als Zweibettzimmer vorzusehen. Ideal sind Lösungen mit beweglichen Zwischenwänden. Einzelzimmer mit vorgeschalteten Schleusen ermöglichen die Isolierung von Patienten mit MRE, offener Tuberkulose, Virusgrippe oder ausgedehnten Wundflächen sowie die Umkehrisolation stark abwehrgeschwächter Patienten. Bei letzteren muss die RLTA die Luftzirkulation von innen nach außen sicherstellen (leichter Überdruck im Isolationszimmer). Ansonsten reduziert ein leichter Unterdruck, im einfachsten Fall durch Luftabführung in der Sanitärzelle, den Erregertransfer nach außen. Je nach Lage der Räume spricht bei Ausstattung der Fenster mit Fliegengaze nichts gegen die zusätzliche Möglichkeit der Fensterlüftung.
Die Zimmer selbst müssen so groß sein (> 20 m2), dass die intensivmedizinische Ausstattung (z. B. Beatmungsgerät, Infusionspumpe) ohne hygienische Risiken bedient werden kann, d. h. bei der Bedienung bettseitiger Technik der Kontakt mit dem Patientenbett vermieden wird. Das betrifft auch den Bettenabstand zur Wand. Um auf die Notwendigkeit der Desinfektion patientennaher Flächen aufmerksam zu machen, sollten diese bereits herstellerseitig mit einer Warnfarbe (z. B. gelb) markiert werden. Bei Kontamination von Flächen z. B. mit Blut, Sputum, Wundsekret u. Ä. hat die umgehende Beseitigung mit Schutzhandschuh und desinfektionsmittelgetränktem Tuch zu erfolgen.
Auf der Station müssen ausreichende Arbeitsflächen zur Vorbereitung von Infusionslösungen vorhanden sein. Speziell für die neonatologische ITS ist wegen der mitunter gegebenen Notwendigkeit der dezentralen Zubereitung von Zytostatika eine Sicherheitswerkbank in einem separaten Raum vorzusehen (Muster einer SOP ![]() Online-Ergänzung 5.9).
Online-Ergänzung 5.9).
Die desinfizierende Reinigung der Fußböden sollte trotz fehlender epidemiologischer Evidenz 2-mal täglich durchgeführt werden, weil auf Fußböden MRE nachgewiesen werden, sodass deren wiederholte Eliminierung sinnvoll ist, zumal sich der personelle Aufwand zwischen Reinigung und desinfizierender Reinigung nicht unterscheidet (Kap. 2.5).
Auf der ITS müssen mikrobielle Umweltreservoire eliminiert werden (z. B. Blumenvase, Waschlotion, Tee u. a. Lebensmittel; Ausstattung von Waschbecken und Duschen mit bakteriendichten Filtern sowie selbstdesinfizierenden Syphons, Kap. 6.6).
Screening: Intensivstationen haben die höchste Prävalenz v. a. von MRSA und Glykopeptid-intermediär-sensiblem S. aureus (GISA), der zunehmend für Therapieversagen verantwortlich ist. Deshalb ist auf der ITS ein generelles Intensivmedizin:MRSA-ScreeningMRSA-Aufnahmescreening mittels PCR mit Schutzisolierung bis zum MRSA-Screening:Intensivmedizinnegativen Befund notwendig (Wilson et al. 2006, Simon et al. 2009, Kalenic et al. 2010, Kramer et al. 2010). In Verbindung mit konsequenter Sanierung der MRSA-Träger kann die MRSA-Prävalenz auch klinikweit gesenkt werden und erwies sich als kosteneffektiv (Trautmann 2008; Kap. 3.7). Wird der Patient bereits bei Aufnahme mit einem MRSA-wirksamen Antibiotikum behandelt, kann das Screening erst nach Abschluss der Antibiose begonnen werden. Risikopatienten und Patienten in Risikobereichen sind bis dahin als MRSA-positiv anzusehen.
Rationale Antibiotikatherapie: Antibiotikaanwendung und -auswahl sind wegen des häufigen Einsatzes und der Häufung von MRE in der Intensivmedizin besonders relevant. Darüber hinaus wirkt sich der inadäquate Umgang mit Antibiotika Antibiotikatherapie:rationale, Intensivmedizinan einem Klinikum auf die Intensivstationen besonders ungünstig aus. Insofern müssen alle Fachrichtungen dazu beitragen, durch rationalen Umgang mit Antibiotika die Probleme in der Intensivmedizin zu reduzieren.
Grundlage des rationalen Umgangs mit Antibiotoka muss eine Antibiotikarichtlinie mit verbindlicher Regelung allgemeiner Grundsätze und lokaler Besonderheiten sein.
Sie sollte mindestens alle 3 Jahre aktualisiert werden. Kernpunkte sind die sofortige, kalkulierte, hochdosierte und frühzeitige i. v. Gabe eines Breitspektrumantibiotikums ebenso wie eine bis auf wenige Ausnahmen auf 7–10 Tage begrenzte Behandlungsdauer. Die Auswahl richtet sich nach dem nachgewiesenen oder vermuteten Infektionsherd, der Antibiotikaanamnese des Patienten, der lokalen Resistenzsituation am Klinikum, pharmakokinetischen und pharmakodynamischen Aspekten sowie den durch die Behandlung zu erwartenden Nebenwirkungen.
Jede begonnene Antibiotikatherapie sollte alle 48–72 Stunden anhand klinischer und mikrobiologischer Kriterien neu evaluiert werden.
Die nicht indikationsgerechte Gabe kann zu vermehrter Resistenzentwicklung und Selektion von MRE führen. Vor der kalkulierten Antibiotikatherapie sollte ohne Zeitverzug unbedingt der Versuch der Erregerisolierung aus dem bekannten oder vermuteten Infektionsherd erfolgen. Die isolierten Erreger sind eine der Grundlagen für die Deeskalation oder Umstellung der Therapie (Kap. 4.4). Wesentlich für die weitere Behandlung sind die Veränderung des klinischen Zustands und die Kinetik der Entzündungsparameter (s. o.). Es konnte für Intensivpatienten mit lebensbedrohlichen Infektionen gezeigt werden, dass bei identischem Outcome in der Gruppe, bei der die Antibiotikatherapie mittels PCT gesteuert wurde, signifikant weniger Antibiotika verabreicht wurden (Bouadma et al. 2010).
Der rationale Antibiotikaeinsatz kann sowohl beim einzelnen Patienten sekundär endogene Infektionen reduzieren helfen als auch das infektiologische Geschehen allgemein positiv beeinflussen.
Surveillance: Aufgrund der Relevanz von NI für das Outcome des Patienten sind nach § 23 IfSG Intensivstationen verpflichtet, mindestens eine NI zu erfassen. Die dafür bedeutsamste ist die nosokomiale bzw. ventilatorassoziierte Pneumonie (VAP). Schon die Einführung der Surveillance trägt zur Intensivmedizin:SurveillanceReduzierung der NI-Rate bei (Haley et al. 1985), weil die Aufmerksamkeit für das Problem erhöht wird und die Ergebnisse Basis für anschließende Interventionen sind.
Für die Intensivmedizin kommen als zu überwachende Infektionen die Pneumonie und die Sepsis infrage.
Zur Erfassung der Sepsis sind die vom RKI vorgeschlagenen Definitionen wegen ihrer Unschärfe jedoch ungeeignet (KRINKO 2001; Kap. 4.5).
Aus- und Fortbildung: Der Effekt strukturierter Ausbildungsprogramme auf die NI-Rate ist für katheterassoziierte Blutstrominfektionen und verbesserte Händehygiene nachgewiesen (Kap. 2.1, Kap. 4.2). In die Ausbildung des Intensivpersonals werden zunehmend Trainingseinheiten an Simulatoren implementiert, für die eine Reduktion der Komplikationen bei Katheteranlage und gefäßkatheterassoziierter Blutstrominfektionen (CRBSI) nachgewiesen wurde (Barsuk et al. 2009). Auch für die VAP ist die Wirksamkeit von Ausbildungsprogrammen und des Einsatzes speziell geschulten Personals bezüglich Reduktion von Pneumonie, Beatmungsdauer und Intensivverweildauer belegt (Zack et al. 2002, Babcock et al. 2004). Ebenso existieren für die Sepsis als häufigste Todesursache in der Intensivmedizin zunehmend Daten über den die Sterblichkeit reduzierenden Effekt von Ausbildungsprogrammen (Kap. 4.5).
In den Empfehlungen der CDC werden Personalschulung, Aus- und Fortbildung als infektionspräventive Maßnahme in den höchsten Evidenzgrad eingestuft.
5.9.5. Spezielle Infektionsprophylaxe
Ventilatorassoziierte Pneumonie
Die VAP ist bei beatmeten Intensivpatienten die am häufigsten erworbene NI. Ihre Bedeutung resultiert daraus, dass sie die häufigste Sepsisursache ist, die Mortalität von Intensivpatienten signifikant erhöht und die Dauer der mechanischen Beatmung sowie des Intensiv- und Krankenhausaufenthalts verlängert. In zahlreichen Empfehlungen wird auf die Prävention der VAP eingegangen (Dodek et al. 2004, Tablan et al. 2004, Rotstein et al. 2008). Die beste Prophylaxe ist die Verhinderung der Beatmung. Unabhängige Risikofaktoren sind höherer SOFA-Score bei Aufnahme auf die ITS, Länge der mechanischen Beatmung sowie schlechter Ernährungsstatus (Zahar et al. 2009). Eine effektive Prophylaxe reduziert nicht nur Morbidität und Mortalität von Intensivpatienten, sie führt auch zur erheblichen Reduktion der Behandlungskosten. Surveillance und Personalschulungen zählen auch bei VAP zu den effektiven Prophylaxeregimen (Zack et al. 2002). Maßnahmen wie Händedesinfektion vor und nach jedem Kontakt mit der Beatmungseinheit sowie mit Sekreten des Respirations- und Oropharyngealtrakts sind Standard der Pneumonieprophylaxe. Insbesondere bei Kolonisation mit MRE müssen die Patienten isoliert werden, da die Übertragung mit anschließender Kolonisation des Oropharynx eine der Ursachen für die Entstehung der VAP ist. Vor Operationen sollten der prä- und perioperative Zustand optimiert werden. Neben optimalem Ernährungszustand sowie Beachtung der Hygienestandards bei Intubation und Beatmung während der Narkose ist die effektive perioperative Schmerztherapie mit nicht sedierenden Medikamenten und regional schmerzausschaltenden Verfahren zu bevorzugen.
Ist die mechanische Ventilation unvermeidbar, sollte sie so kurz wie möglich sein.
Tägliche Aufwachversuche und anschließende Adaptation der Sedierung reduzieren die Beatmungsdauer und somit die VAP-Rate. Maßnahmen, die zu andauernder Alkalisierung des Magensafts führen, wie Gabe von H2-Blockern und Protonenpumpenhemmern zur Stressulkusprophylaxe sowie die kontinuierliche Ernährung über eine Magensonde, sollten auf das Mindestmaß beschränkt werden. Die enterale Ernährung soll an die Peristaltik adaptiert sein und bei Subileuszuständen über eine Jejunalsonde erfolgen, um die Gefahr der Aspiration zu minimieren. Bei Verdacht auf Schluckstörungen und bei tracheotomierten Patienten ist vor oraler Nahrungszufuhr mittels Schluckdiagnostik die Gefahr der Aspiration auszuschließen. Bei Schluckstörungen sollte die enterale Ernährung über eine perkutane endoskopische Gastrostomie (PEG) erfolgen.
Nichtinvasive Maskenbeatmung ist bei geeigneten Patienten der endotrachealen Intubation und Beatmung vorzuziehen.
Die invasive Beatmung sollte über einen orotrachealen Tubus erfolgen. Nasotracheale Tuben gehen mit höherer Sinusitisrate einher, die wiederum mit einer höheren Pneumonierate assoziiert ist. Ob die frühe Tracheotomie die VAP-Rate reduziert, ist nicht abschließend geklärt. Die subglottische Absaugung und Drainage über spezielle Tuben ist geeignet, die VAP-Rate zu reduzieren. Mundhöhlenantiseptik mit Chlorhexidin reduziert die Häufigkeit von Pneumonien bei kardiochirurgischen Patienten. In mehreren Studien konnte gezeigt werden, dass durch selektive Darmdekontamination (SDD) die Rate nosokomialer Pneumonien und die Letalität beatmeter Intensivpatienten reduziert werden können (Kap. 2.10.11). Aufrechte Körperposition bzw. Oberkörperhochlagerung bis 45° ist eine effektive Pneumonieprophylaxe und sollte, wenn keine Kontraindikationen bestehen, angewendet werden. Mittels Lagerungsmaßnahmen und Anwendung kinetischer Betten kann zwar eine Reduktion der Pneumonierate, nicht aber der Sterblichkeit erreicht werden, eine generelle Empfehlung zur Prophylaxe der VAP kann daher nicht gegeben werden (Delaney et al. 2006). Beatmungsschläuche sollten nicht häufiger als wöchentlich und nach jedem Patienten gewechselt werden. Zur Anfeuchtung sollten HME-Filter gegenüber aktiver Kaskadenbefeuchtung bevorzugt werden. Ob Atemgymnastik bzw. Physiotherapie die VAP-Rate reduziert, ist nicht belegt. Zur Prophylaxe der VAP bietet die geschlossene endotracheale Absaugung keine Vorteile gegenüber der offenen (Jongerden et al. 2007).
Durch Bündelung der Maßnahmen (sog. Bundles) wird der Erfolg der Infektionsprävention optimiert. Das Bundle zur VAP-Prävention umfasst Training, Händehygiene, Schräglagerung, antiseptische Mundpflege, Verzicht auf Sedierung, Prophylaxe tiefer Venenthrombosen und peptischer Ulzera, Einhaltung des Beatmungs-Weaning-Protokolls und kontinuierliche subglottische Sekretabsaugung (Resar et al. 2005).
Gefäßkatheterassoziierte Blutstrominfektion (CRBSI)
Während bei peripheren Venenzugängen und arteriellen Kathetern NI von untergeordneter Bedeutung sind, stellen zentrale Gefäßkatheter wie ZVK und Rechtsherzkatheter (Pulmonalarterienkatheter) ein nicht unerhebliches Infektionsrisiko dar. Etwa 80 % aller primären Bakteriämien sind mit dem Anlageort eines zentralen Gefäßkatheters assoziiert. Den KISS-Surveillance-Daten zufolge war 2005 von 1,5 CRBSI/1.000 Kathetertagen (entspricht 8.400 Infektionen/Jahr) auszugehen, einem europäischen Survey zufolge wird eine Häufigkeit von 1–3,1 CRBSI/1.000 Kathetertage angenommen (Suetens et al. 2007).
Durch regelmäßige Fortbildung des Personals müssen Indikationen, sachgerechte Anlage, Pflege und Infektionskontrollmaßnahmen zur Prävention von CRBSI vermittelt werden.
Infektionswege können intraluminal, extraluminal und hämatogen sein. Ätiologisch kommen v. a. CoNS, S. aureus, Enterococcus spp., Corynebacterium spp., gramnegative Erreger wie E. coli oder P. aeruginosa und Candida (C.) albicans in Betracht. Die Infektionsrate verschiedener Punktionsstellen für ZVK wurde offenbar nie randomisiert untersucht. Die Punktion der V. subclavia zeigt in einigen Untersuchungen die geringste Kolonisations- bzw. Infektionsrate im Vergleich zur V. jugularis bzw. V. femoralis (Nagashima et al. 2006, Templeton et al. 2008). Die Anzahl der Lumina erhöht die Infektionsrate: nicht benötigte Lumina sollten unter aseptischen Kautelen mit steriler 0,9%iger NaCl-Lösung geblockt werden. Die Katheteranlage ist unter hygienisch optimierten Bedingungen wie auf der ITS bzw. im OP mit einer niedrigeren Kolonisationsrate verbunden. Shaldon-Katheter können bei schlanken, normalgewichtigen Patienten auch in der Leiste gelegt werden.
Die Anlage hat streng aseptisch zu erfolgen, d. h., nach Händedesinfektion werden Kopfbedeckung, Mund-Nasen-Schutz, steriler Kittel und sterile Einmalhandschuhe angezogen, das Punktionsgebiet wird großflächig mit Hautantiseptikum benetzt und mit ausreichend großem sterilem Lochtuch abgedeckt. Bei ultraschallgestützter Punktion ist der Ultraschallkopf steril zu verpacken.
Die Katheterinsertionsstelle wird entweder mit steriler Gaze oder mit einem sterilen, transparenten (semipermeablen) Folienverband abgedeckt. Während bislang für die wiederholte Antiseptik an der Insertion venöser oder arterieller Katheter kein infektionspräventiver Effekt nachgewiesen werden konnte, gibt es Hinweise für die Effektivität beim ZVK. Sowohl durch 0,1-prozentiges Octenidin/30-prozentiges Propan-1-ol + 45-prozentiges Propan-2-ol als auch durch 74-prozentiges Ethanol/10-prozentiges Propan-2-ol war eine signifikante Reduktion der Mikroflora an der Katheterinsertionsstelle nachweisbar, wobei Octenidin/Propanol über 24 Stunden effektiver war (Dettenkofer et al. 2002). Auch für PVP-Iod (Levin et al. 1991, Maki et al. 1991), 70-prozentiges Ethanol und 2-prozentige chlorhexidinhaltige wässrige Lösung (Maki et al. 1991) wurde eine infektionspräventive Wirksamkeit nachgewiesen. Nach Hautantiseptik vor der Katheterinsertion wurde alle 48 Stunden der alte Verband entfernt, der Insertionsbereich erneut mit einer der drei antiseptischen Lösungen gereinigt und danach ein frischer Verband angelegt. Mit diesem Vorgehen war die Rate katheterassoziierter Bakteriämien in der Chlorhexidingruppe signifikant niedriger als in den anderen beiden Gruppen. Eine Metaanalyse von 6 randomisierten Studien, die unterschiedliche Zusammensetzungen aus Chlorhexidin und 10-prozentiges PVP-Iod in ihrer Eigenschaft zur Prävention katheterassoziierter Infektionen beurteilte, zeigte die Überlegenheit von Chlorhexidin (Chaiyakunapruk et al. 2002). Analysiert man diese Metaanalyse genauer, ergibt sich jedoch lediglich für die Studien, in denen Chlorhexidin in alkoholischer Lösung eingesetzt wurde, eine Überlegenheit gegenüber den Interventionsgruppen, in denen 10-prozentiges PVP-Iod allein eingesetzt wurde. Da Ethanol selbst hochwirksam ist, bleibt offen, ob ein Unterschied zwischen alkoholhaltigem Chlorhexidin vs. alkoholhaltigem PVP-Iod nachweisbar ist. Dieser Frage wurde teilweise von Parienti et al. (2004) nachgegangen mit dem Ergebnis, dass eine Kombination aus 70-prozentiges Ethanol und 5-prozentiges PVP-Iod zu signifikant weniger katheterassoziierten Infektion führte als 10-prozentiges PVP-Iod allein (Kap. 5.5).
Durch Einsatz von chlorhexidinbeschichteten Schwämmen als Verband (sog. BioPatch) kann eine weitere Reduktion von Kolonisation und CRBSI erreicht werden (Raad et al. 2007, Timsit et al. 2009). Auch durch Baden mit Chlorhexidin wurden in der medizinischen Intensivtherapie die Raten ZVK-assoziierter Blutstrominfektionen und positiver Blutkulturen signifikant reduziert (Popovich et al. 2009).
Es ist zu berücksichtigen, dass bisher fast alle Studien zur Infektionsprävention bei Intensivpatienten mittels Antiseptik bzw. Imprägnierung mit Chlorhexidin durchgeführt wurden, weil Octenidin-haltige Antiseptika bisher in angloamerikanischen Ländern nicht verbreitet sind. Bezüglich Nutzen-Risiko-Bewertung sind Octenidin-haltige Antiseptika zur Pflege der ZVK-Eintrittsstelle gut geeignet.
Die tägliche Reevaluation der Notwendigkeit des Gefäßzugangs trägt entscheidend zur Verhinderung von CRBSI bei.
Zur Vermeidung von CRBSI ist die Beachtung von Empfehlungen im Umgang mit Infusionen und Infusionssystemen essenziell. Fetthaltige Lösungen (sog. 3-in-1-Lösungen) sollten in 24 Stunden einlaufen, reine Lipidlösungen in 12 Stunden und Blut bzw. Blutprodukte in 6 Stunden. Die aktuellen Empfehlungen legen ein Wechselintervall für Infusionssysteme von 72 Stunden bzw. für reine Lipdlösungen von 24 Stunden fest.
Für die Verwendung antibiotika- bzw. antiseptikaimprägnierter Katheter kann derzeit v. a. dann eine Empfehlung ausgesprochen werden, wenn die Rate an CRBSI hoch ist. Bei Einhaltung des Präventionsbundles bleibt offen, ob sich ein zusätzlicher Effekt sichern lässt (Hockenhull et al. 2009). Die Blockung von ZVK-Lumina mit Antibiotika kann derzeit nicht generell empfohlen werden (O'Grady et al. 2002).
Mit der Bundle-Strategie ist eine signifikante Reduzierung der ZVKBSI-Rate erreichbar (Berenholtz et al. 2004). Sie umfasst Training, Händehygiene, optimale Auswahl der Insertion, maximale Asepsis bei Anlage und Diskonnektion, Hautantiseptik mit Chlorhexidin oder Octenidin, Unversehrtheit der Abdeckung sowie tägliche Überprüfung der Notwendigkeit mit rechtzeitiger Katheterentfernung.
Katheterassoziierte Harnwegsinfektionen (HWI)
Im Ergebnis der deutschen Prävalenzstudie des Kompetenznetzwerks Sepsis (SepNet) sind urogenitale Infektion mit 6,5 % bzgl. schwerer Sepsis prävalent. Die 2009 vom CDC veröffentlichte Guideline for Prevention of Catheter-associated Urinary Tract Infections (Hooton et al. 2010) fasst die aktuellen Empfehlungen zusammen. Darin wird auf die strenge Indikationsstellung für Urinkatheter hingewiesen (Kap. 4.3).
Analog wie bei zentralen Gefäßzugängen sollte regelmäßig die Notwendigkeit von Harnwegskathetern überprüft werden. Bei Querschnittssyndrom ist intermittierender Einmalkatheterismus zu bevorzugen. Die Anlage transurethraler Katheter hat streng aseptisch mit geschlossenem Urinableitsystem zu erfolgen.
Ein Routinewechsel von Katheter oder Drainagesystem ist nicht empfehlenswert. Zur Vermeidung eines Refluxes muss sich der Sammelbehälter unter dem Patientenniveau befinden. Auf freien Abfluss ist zu achten bzw. ein Abknicken oder eine Obstruktion des Ableitschlauchs ist zu vermeiden. Um Ablagerungen und Verkrustungen zu vermeiden, sind Silikonkatheter am besten geeignet.
Ob suprapubische Urinableitungen eine Alternative zum transurethralen Zugang darstellen, ist aus infektionsprophylaktischer Sicht nicht geklärt. Hier ist die individuelle Nutzen-Risiko-Abwägung notwendig. Eine Harnableitung mittels Urinkondomen ist ggf. zu erwägen. Für silberimprägnierte Katheter war mittels Cochrane-Analyse eine signifikante Reduktion von HWI nachweisbar, die die von antibiotikabeschichteten Kathetern übertraf. Das Kosten-Nutzen-Verhältnis ist noch ungeklärt (Schum und Lamm 2008).
Ventrikelkatheterinfektionen
Das Risiko der bakteriellen nosokomialen Enzephalitis bzw. Ventrikulitis durch Liquorableitung bzw. intrakranielle Sonden oder Katheter wird mit bis zu 22 % (Mittel 6,6 %) angegeben. Durch die Lokalisation der Ableitsysteme ist Ventrikelkatheterinfektion(en), Infektionsprophylaxe, Intensivmedizindie Vermeidung von Kontaminationen der Eintrittsstelle problematisch. Die behaarte Kopfhaut stellt ein Reservoir v. a. für grampositive Erreger dar.
Da die Kontamination bei der Anlage des Katheters Hauptursache für die spätere Liquorinfektion ist, kommt dem streng aseptischen Vorgehen besondere Beutung zu. Die Wahl des Antiseptikums und die Vorbereitung der Haut durch Haarentfernung sind Gegenstand verschiedener Untersuchungen. Die Verwendung chlorhexidinhaltiger Hautantiseptika scheint am effektivsten. Zur Infektionsvermeidung ist die ausreichend lange Tunnelung des Katheters zu empfehlen. Wiederum gilt der Grundsatz, Katheter bzw. Sonde so bald als möglich zu entfernen.
Die generelle Anlage von antibiotika- bzw. antiseptikaimprägnierten Kathetern und die prophylaktische intrathekale Antibiotikaapplikation sind nicht zu empfehlen. Eine Option stellen mit Silber-Nanopartikeln beschichtete Katheter dar. Nach neurochirurgischen Operationen mit durchschnittlich 10 Tagen Katheterlage war durch antibiotisch beschichtete Katheter der gleiche Präventionseffekt wie durch systemische Antibiotikagabe erreichbar (Wong et al. 2010).
Postoperative Wundinfektionen (SSI)
Sie stellen die dritthäufigste NI dar. S. aureus ist im Erregerspektrum führend. Darüber hinaus ist die Kolonisation bzw. Infektion mit MRE besonders bei längerer Krankenhausliegedauer als weitere Ursache zu nennen. Am bedeutendsten ist die intraoperative SSI:Prophylaxe, IntensivmedizinInfektionsentstehung (Kap. 5.5). Postoperativ spielen Eintrittspforten wie Wunddehiszenzen oder Drainagen eine große Rolle. Somit sind strenge Wundhygiene und Sorgfalt bei der Wundversorgung die wichtigsten postoperativen Maßnahmen zur Vermeidung von SSI. Der Verbandswechsel erfolgt aseptisch frühestens nach 24–48 Stunden, bei durchfeuchteten bzw. durchgebluteten Verbanden sofort. Drainagebeutel sind unter Patientenniveau zu befestigen; eine Dekonnektion ist so weit wie möglich zu vermeiden, d. h. kein Routinewechsel der Auffangbehältnisse. Drainagen sollten generell so bald als möglich entfernt werden (Kap. 5.5).
Gastrointestinale nosokomiale Infektionen
Häufigster Erreger ist bei erwachsenen Intensivpatienten C. difficile (Kap. 3.9). Lediglich kleine Kinder akquirieren vorrangig Rotaviren. Seltener sind die sonst typischen Darmpathogene wie Salmonellen, Yersinien, Campylobacter oder nosokomiale Infektion(en):gastrointestinale, ProphylaxeNoroviren. Die Zunahme der Clostridium-difficile-assoziierten Diarrhö (CDAD) ist v. a. mit dem Antibiotikaübergebrauch speziell von Cephalosporinen der 3. Generation, Clindamycin und zunehmend Gyrasehemmern erklärbar (Spigaglia et al. 2009). Zur Prävention ist die Überprüfung einer kalkulierten Antibiose nach 72 Stunden unbedingt CDAD:Prophylaxe, Intensivmedizinerforderlich. Ob ein vermehrter Einsatz von Protonenpumpenhemmern ebenfalls begünstigend auf die Zunahme der CDAD wirkt, ist aktuell nicht bestätigt. Darüber hinaus ist die Einhaltung der Standardhygiene und besonders der Händehygiene die wichtigste Maßnahme zur Verhinderung der Infektion und ihrer Ausbreitung. Wegen der Sporenresistenz sind alkoholische Händedesinfektionsmittel unwirksam. Nach dem Ablegen der Einmalhandschuhe muss erst eine Seifenwaschung der Hände und anschließend eine Händedesinfektion erfolgen.
Die Distanzierung infizierter Patienten durch Einzel- bzw. Kohortenisolierung von an CDAD erkrankten Patienten ist bis 2 Tage nach Abklingen der Symptome erforderlich.
Zur kosteneffektiven Diagnostik einer Durchfallerkrankung auf der ITS sollte in der Anamnese v. a. die Zeit seit der Hospitalisierung berücksichtigt werden. Es ist zwar nicht auszuschließen, dass auch Intensivpatienten durch Nahrungsmittel an einer Salmonellose erkranken, eine CDAD ist jedoch am wahrscheinlichsten. Als Cut-off gilt die Zeitspanne von 72 Stunden seit Hospitalisierung. Bei Patienten, die innerhalb dieser Zeit eine Diarrhö entwickeln bzw. einem speziellen Risikoprofil (Alter > 65 Jahre und dauerhafte Organfunktionsstörung, HIV, Neutropenie oder V. a. Ausbruch) zuzuordnen sind, sollte die Stuhldiagnostik auf Salmonellen, Shigellen, Yersinien, Campylobacter usw. erfolgen. Bei allen anderen Fällen oder im Zweifelsfall ist durch bettseitige Rektoskopie noch vor dem mikrobiologischen Ergebnis eine Differenzialdiagnose mit dem Nachweis typischer Pseudomembranen möglich. Die Stuhldiagnostik erfolgt zum Nachweis der Clostridium-difficile-Glutamat-Dehydrogenase (GDH) und der Toxine TcdA und TcdB. Die Erregeranzucht ist bei Proben symptomatischer Patienten aus klinischen Hochrisikobereichen zu empfehlen, damit ggf. eine toxigene Kultur angelegt und frühzeitig hypervirulente CD-Isolate identifiziert werden können. In Ausbruchsituationen kann jedoch die kulturelle Anzucht für infektionsepidemiologische Untersuchungen notwendig sein und können sanierende Maßnahmen veranlasst werden.
Zur Therapie der CDAD eignen sich v. a. enteral appliziertes Vancomycin und Metronidazol. Die Risiko-Nutzen-Abwägung sollte sich an der lokalen Inzidenz von VRE orientieren. Etwa ein Drittel aller Patienten erleidet mindestens einen Rückfall während des Aufenthalts.Intensivmedizin:Infektionsprophylaxe\"\r\"InfektionsprophylInstensivmed Infektionsprophylaxe:Intensivmedizin\"\r\"InfektionsprophylInstensivmed
5.10. Anästhesie
Sven-Olaf Kuhn, Matthias Gründling, Michael Wendt und Axel Kramer
5.10.1. Allgemeine Prinzipien
Intensivstation(en):nosokomiale Infektion(en)\"\r\"InfektionInstensivmed
Bei der Durchführung von Anästhesieverfahren besteht ein hohes Risiko des Erregertransfers.
Sowohl nichtinvasive Techniken wie die orotracheale Intubation als auch Verfahren zur Anlage verschiedener intravasaler bzw. regionaler Katheter sind für den Patienten und seine Umgebung mit einer Vielzahl möglicher Kontaminationen verbunden. Mit dem Anstieg des Durchschnittsalters der Patienten und der Zunahme der Komorbiditäten ist auch eine Zunahme von Infektionen mit Problemerregern zu beobachten.
In jedem Fall sind die Maßnahmen der Standardhygienemaßnahmen:Anästhesie Anästhesie:StandardhygieneStandardhygiene, d. h. die Gesamtheit der Hygienemaßnahmen, die bei der Versorgung der Patienten angewendet werden, einzuhalten, um die Übertragung von Erregern oder Sekreten auf den Patienten bzw. zwischen Patienten (Patientenschutz), auf das medizinische Personal (Personalschutz) sowie auf Geräte und Flächen zu verhindern.
Trotz der zunehmenden Präsenz von MRE und anderen Problemerreger existiert kein 100-prozentig zuverlässiges Screeningverfahren, das es ausreichend lange präoperativ erlaubt, im Bedarfsfall speziell erforderliche Hygienemaßnahmen zu treffen. Insbesondere die Einbestellung von Patienten unmittelbar vor dem geplanten Eingriff oder für ambulante Eingriffe ist für ein frühzeitiges Erkennen von „Hygieneproblemen“ ungeeignet. Andererseits ist die Beachtung gerade der Standardhygienemaßnahmen eine häufig unterschätzte Möglichkeit zur Infektionsverhütung (Beovic et al. 2005).
Die Hände sind Hauptüberträger für NI. Deshalb kommt der Händedesinfektion eine herausragende Bedeutung zu. Das gut sichtbare Anbringen von ausreichend vielen Desinfektionsmittelspendern in den Vorbereitungs- und Eingriffsräumen sowie direkt am Anästhesiearbeitsplatz (kurze Wege) ist eine einfache und effektive Maßnahme. Besonders vor der Zubereitung von Medikamenten und Infusionslösungen sowie vor aseptischen Tätigkeiten wie dem Legen von Gefäßzugängen, Urinableitungen, Intubation oder endotrachealem Absaugen, aber auch nach Toilettengang, Naseputzen oder Ablegen von Schutzhandschuhen hat eine Händedesinfektion zu erfolgen. Weiterhin ist das Tragen von Einmalhandschuhen bei Kontakt mit Sekreten und Körperflüssigkeiten unverzichtbarer Bestandteil der Händehygiene (Boyce und Pittet 2002, Gemmell et al. 2008).
5.10.2. Personalhygiene
In den OP-Bereichen ist das Tragen von farblich sich von anderen Bereichen unterscheidender Bereichskleidung, maschinell desinfizierbaren Bereichsschuhen sowie von geeigneter Kopfbedeckung, Mund- Nasen- bzw. Personalhygiene, AnästhesieGesichtsschutz obligat. Die Kleidung ist bei Verunreinigung. vor Anästhesie:PersonalhygieneVerlassen des OP-Bereichs bzw. nach Verlassen eines „septischen Saals“ zu wechseln. Das Wechseln des Mund-Nasen-Schutzes soll bei Durchfeuchtung oder Verunreinigung sowie zumindest dann vor jedem neuen Patienten erfolgen, wenn bei dem Patienten eine respiratorische Infektion oder tracheale Kolonisation mit Problemerregern bekannt ist. Einmal abgenommener Mund-Nasen-Schutz ist in jedem Fall zu verwerfen. Die hygienische Händedesinfektion ist vor Betreten und Verlassen des OP-Bereichs Pflicht. Aus hygienischen Gründen und zur Verhütung von Arbeitsunfällen verbieten sich jeglicher Schmuck und Uhren an Händen und Unterarmen (UVV BGV C8 § 22). Situationsabhängig sind Hautschutz- und Hautpflegemittel anzuwenden. Fingernägel sind sauber und kurz zu halten, künstliche Fingernägel sind nicht zulässig.
Von infektiösen Durchfallerkrankungen (z. B. Norovirusinfektionen) betroffene Mitarbeiter sind von der Patientenversorgung auszuschließen.
Zur Durchsetzung der Hygienestandards und zur Verbesserung der Compliance muss die regelmäßige Fortbildung durch die ärztliche und pflegerische Leitung der Anästhesiebereiche in Zusammenarbeit mit dem Hygienefachpersonal durchgeführt werden.
5.10.3. Räumliche Besonderheiten
Eine Trennung zwischen OP-Saal bzw. Eingriffsraum, Einleitungs- und Ausleitungsraum und dem Aufwachbereich ist nicht zwingend erforderlich. Prinzipiell bestehen keine Bedenken, die Anästhesieein- bzw. -ausleitung direkt im OP-Saal durchzuführen (Kap. 9.4). Auch die Anästhesie:räumliche Besonderheitenverschiedenen Punktionen und Katheteranlagen sind unter Beachtung der Standardhygiene unproblematisch.
Ein Saalwechsel des Anästhesiepersonals bei aseptischen Eingriffen ist nach hygienischer Händedesinfektion möglich, sollte jedoch so weit es geht vermieden werden. Bei septischen Eingriffen ist der direkte Saalwechsel untersagt. In diesen Fällen muss ein Wechsel der OP-Kleidung inklusive Schuhe, Mund-Nasen-Schutz und OP-Haube erfolgen.
5.10.4. Medikamente, Narkosemittel, Blut und Blutprodukte
Medikamente und Narkosemittel müssen staubgeschützt, übersichtlich und den Fachinformationen entsprechend temperiert gelagert werden. Die Temperatur der Medikamenten- und Blutkühlschränke ist regelmäßig zu kontrollieren und zu dokumentieren. Die Bevorratung hat ökonomisch und so zu Narkosemittel, Lagerungerfolgen, dass Überlagerung bzw. Verfall vermieden werden. Für die Applikation von Narkotika und anderen Medikamenten ist die Verwendung steriler Einwegmaterialien Standard. Das Vorbereiten der Medikamente bzw. Infusionen erfolgt immer unmittelbar vor Verwendung und nicht auf Vorrat (BGH Urteil 1981, Schneider und Bierling 1996). Aus hygienischen Gründen verbietet sich eine Resteverwertung! Ob die Verwendung Medikament(e):Vorbereitungvon Rückschlagventilen vor einer Spritze in Spritzenpumpen und Infusion(en):Vorbereitungeine mindestens 1 m langes Überleitsystem eine Alternative darstellt, ist nicht belegt und daher abzulehnen, weil es nicht nur um bakterielle, sondern auch virale Infektionsgefährdung geht und gerade bei horizontaler Lage und Druckschwankungen die Klappen flottieren und Rückspüleffekte auftreten können (Koller und Assadian 2000, Kiski 2009). Obsolet ist die Verwendung von Vorratsbehältnissen für Medikamente wie Spritzen oder Flaschen zur Versorgung mehrerer Patienten und die Weiterverwendung von Infusionsresten oder Infusionssystemen für nachfolgende Patienten (Hirschmann 2010). Abzulehnen ist auch die mehrfache Nutzung von Einmalspritzen während der Anästhesie bei demselben Patienten, z. B. für Repetitionsdosen, da eine Kontamination des ausgezogenen Spritzenstempels bei erneutem Befüllen einer entleerten Spritze möglich ist. Bei Nutzung von Ampullen zur mehrfachen Entnahme ist die Verwendung neuer Einwegmaterialien (Spritzen und Kanülen) nach vorheriger Desinfektion des Gummiverschlusses erforderlich (Kap. 4.1).
Medikamente ohne Konservierungsstoffe und v. a. lipidhaltige Medikamente wie Propofol sind besonders kontaminationsanfällig, sodass die Aseptik besonders sorgfältig zu wahren ist. Für lipidhaltige Infusionen wird eine maximale Infusionsdauer von 12 Stunden gefordert.
Eröffnete („angestochene“) Blutkomponenten sind innerhalb von 6 Stunden zu transfundieren. Nach den Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie), aufgestellt gemäß Transfusionsgesetz von der Bundesärztekammer im Einvernehmen mit dem Paul-Ehrlich-Institut in der jeweils gültigen Fassung, dürfen Blutprodukten vom Anwender keine Medikamente bzw. Infusionslösungen beigefügt werden (Vorstand der Bundesärztekammer auf Empfehlung des Wissenschaftlichen Beirats 2008).
Erforderliche Ausnahmen von den oben aufgeführten Regeln (z. B. Notfallmedikamente) müssen vom Krankenhaushygieniker und dem zuständigen Apotheker in einer Standardarbeitsanweisung festgelegt werden (KRINKO 2011).
Zur Applikation von Anästhetika und anderen Medikamenten ist neben der Beachtung der Zubereitungsvorschriften des Herstellers das aseptische Arbeiten Vorschrift. Vor allen vor Manipulationen an Zuspritzstellen, Spritzenpumpensystemen oder Infusionen ist eine Händedesinfektion notwendig. Besonders Zuspritzstellen z. B. an Venenverweilkanülen, Wegehähnen und Kathetern sollen frei von Blut oder Blutprodukten gehalten werden und sind vor Benutzung zu desinfizieren und danach mit sterilen Verschlussstopfen zu sichern. Für die Transfusion von Blut und Blutprodukten sowie Gerinnungspräparaten gelten neben den Festlegungen der Transfusionsrichtlinien die gleichen Hygienevorgaben (O'Grady et al. 2011, KRINKO 2002).
Spitze Gegenstände wie Punktionsnadeln oder Skalpelle sind umgehend in einem speziellen Abwurfbehältnis zu entsorgen – kein Recapping!
5.10.5. Anästhesie
Allgemeinanästhesie: Zur Narkoseeinleitung gelten die o. g. Hygieneanforderungen für den Umgang mit Medikamenten zur intravasalen Injektion. Die Zuspritzstellen und Wegehähne sind mit sterilen Verschlussstopfen Hygienemaßnahmen:Allgemeinanästhesiezu verschließen. Die Intubation hat aseptisch zu erfolgen. Jeder Patient Allgemeinanästhesie, Hygienemaßnahmenerhält einen neuen Atemsystemfilter (ASF). Wird kein ASF verwendet, müssen nach Beendigung der Narkose das Narkosesystem und das Kreisteil gewechselt werden. Bei Verwendung eines ASF kann das Narkoseschlauchsystem bis zu 7 Kalendertage eingesetzt werden, sofern seine Funktionalität und Dichtigkeit gegeben sind, die Abscheideleistung des ASF für luftgetragene Partikel > 99 % beträgt und für Flüssigkeit Retentionswerte bis zu Drücken von mindestens 60 hPa (= 60 mbar) oder 20 hPa oberhalb des gewählten maximalen Beatmungsdrucks im Narkosesystem erreicht werden. Kommt es unter Rückatmungsbedingungen zu sichtbarer Kondensation von Wasser im Schlauchsystem, kann der Einsatz von Elektretfiltern derzeit nicht empfohlen werden. Nach jedem Patienten sind alle Handkontaktflächen an der Narkosegerätschaft einschließlich Schlauchsystem und Handbeatmungsbeutel desinfizierend aufzubereiten. Bei Vorliegen oder Verdacht einer meldepflichtigen Infektionskrankheit mit Übertragungsmöglichkeit wird als zusätzliche Vorsichtsmaßnahme der komplette Wechsel von Schlauchsystem und Handbeatmungsbeutel nach der Narkose empfohlen (Kramer et al. 2010).
Regionalanästhesie: Mit 2,4 % liegt die Infektionsrate von Katheterverfahren nach Angaben deutscher Einzelzentren im Bereich der häufigen Komplikationen (Maier et al. 1986). Das Infektionsrisiko einer postoperativen Hygienemaßnahmen:RegionalanästhesieSchmerztherapie mittels Periduralkatheter ist unter den organisatorischen Regionalanästhesie, HygienemaßnahmenBedingungen normaler Krankenpflegestationen niedrig (Neuburger et al. 2006, Wiegel et al. 2007, Popping et al. 2008). Wenn, dann sind multifaktorielle Ursachen wie lokalisationsspezifische Besonderheiten (talgdrüsenreiche Haut potenziell häufiger infiziert), Komorbiditäten oder Mehrfachpunktionen für die Infektionen verantwortlich.
Periphere Regionalanästhesie: Rumpfferne Regionalanästhesieverfahren werden nach Hautantiseptik und sterilem Abdecken mit sterilen Handschuhen durchgeführt. Für die Anlage von Kathetern zur Regionalanästhesie ist das Abdecken des Punktionsgebiets mit einem Lochtuch erforderlich.
Zentralvenöse Katheter, Arterienkatheter in Seldinger-Technik, Peridural- bzw. Spinalkatheter, rumpfnahe Nervenblockaden: Die Katheter:zentralvenöse, Hygienemaßnahmen Arterienkatheter, HygienemaßnahmenAnlage erfolgt unter streng Hygienemaßnahmen:Gefäßkatheteraseptischen Bedingungen. Nach der Händedesinfektion wird der Periduralkatheter, HygienemaßnahmenInstrumentiertisch mit Mund-Nasen-Schutz, Kopfbedeckung, sterilem Kittel und sterilen Spinalkatheter, HygienemaßnahmenEinmalhandschuhen aseptisch vorbereitet, das Punktionsgebiet ausreichend Nervenblockade(n), rumpfnahe, Hygienemaßnahmenlange großflächig desinfiziert und mit einem ausreichend großen sterilen Lochtuch bedeckt. Bei sonographiegestützter Punktion muss der Ultraschallkopf steril bezogen werden; die Verwendung von sterilen Handschuhen als „steriler Bezug“ ist abzulehnen.
Die Insertionsstelle der Katheter wird entweder mit sterilem Gaze- oder mit sterilem transparentem (semipermeablem) Folienverband abgedeckt. Durch Applikation alkoholbasierter Hautantiseptika mit Gehalt an remanentem Wirkstoff auf die Insertion des ZVK war eine signifikante Reduktion der Hautkolonisation erreichbar (Dettenkofer et al. 2002).
Reinigung und Desinfektion des Anästhesieequipments: Die Katheter:suprapubischer\t\"Siehe Blasenverweilkatheter, suprapubischerregelmäßige, mindestens tägliche Desinfektion der Reinigung:AnästhesieequipmentAußenflächen der Narkosegeräte, Überwachungsmonitore und Kabel ist obligat, bei vermuteter bzw. sichtbarer Kontamination der Kontaktflächen nach Anästhesieequipment:Reinigungjedem Patienten. Eine äußere Kontamination macht nicht nur bei Anästhesieequipment:DesinfektionFaltenschläuchen einen Systemwechsel erforderlich.
Die Verwendung hydrophober, virusdichter Filter zwischen Patient und Narkoseschlauchsystem ermöglicht die mehrmalige Nutzung der Schlauchsysteme (s. o.). Prinzipiell bestehen keine Einwände für die Verwendung wiederaufbereitbarer Narkosesysteme. Die Aufbereitung der Kreisteile ist nur erforderlich im Rahmen von Wartungsarbeiten und nicht routinemäßig.
Die Reinigung bzw. Desinfektion von Computerbildschirmen und Eingabegeräten erfolgt regelmäßig mit vom Hersteller empfohlenen Produkten.
Bei der Benutzung von Laryngoskopen ist neben der Reinigung und Desinfektion der Spatelblätter besonderes Augenmerk auf die Desinfektion der Griffe zu legen.
Blutdruckmanschetten, Pulsoxymeter, EKG-Kabel oder Temperatursonden werden nach jedem Patienten desinfiziert.
5.10.6. Perioperative Antibiose
Sie soll 30 Minuten bis 1 Stunde vor dem Schnitt verabreicht werden. Abgesehen von sehr langen Operationen ist keine Repetitionsdosis erforderlich. Das Infektionsrisiko wird dadurch nicht zusätzlich positiv beeinflusst, wohl aber der Selektionsdruck zur Verbreitung von MRE Antibiotikatherapie:perioperative, Anästhesieverstärkt (Kap. 2.10.1).
Der Anästhesist sollte für die rechtzeitige Applikation der Antibiotika Sorge tragen.
5.10.7. Hygieneanforderungen bei speziellen Erregern
Clostridium (C.) difficile: Von dem rasanten Anstieg durch Infektionen mit C. difficile sind v. a. ältere und multimorbide Patienten betroffen. Die Hauptübertragung der C.-difficile-Sporen erfolgt v. a. von infizierten oder kolonisierten Patienten über die Hände des Clostridium difficile:Hygieneanforderungen, AnästhesiePersonals (Kap. 3.9). Alkoholische Händedesinfektionsmittel sind unwirksam. Zur Beseitigung der Sporen sollten eine Händewaschung mit Wasser und Seife sowie die Händedesinfektion mit Peressigsäure durchgeführt werden. Patienten mit C.-difficile-Infektionen sollten mindestens so lange isoliert werden, wie die akute Durchfallssymptomatik existiert.
Andere fäkal-oral übertragbare Infektionen: Nur bei Kontakt mit Stuhl bzw. ggf. mit Erbrochenem besteht ein Übertragungsrisiko. Das Tragen von Schutzhandschuhen ist notwendig. Abgesehen von den Standardhygienemaßnahmen sind keine speziellen Maßnahmen erforderlich.
Bei Norovirusinfektionen sind zur Händedesinfektion virozide Händedesinfektionsmittel zu verwenden.
Patienten mit MRE, MRSA, (VRE) und ESBL: Generell muss auf das Risiko einer MRE:Hygieneanforderungen, AnästhesieTransmission auf andere Patienten hingewiesen werden. Neben der OP-Planung (Saal, MRSA:Hygieneanforderungen, AnästhesieZeitpunkt) ist das beteiligte Personal vorab gut zu informieren. Auf die VRE:Hygieneanforderungen, AnästhesieEinhaltung der Händehygiene ist zu achten. Eine Distanzierung zu anderen ESBL:Hygieneanforderungen, AnästhesiePatienten ist zu gewährleisten. Patienten mit nasaler MRSA-Besiedlung sind so lange wie möglich mit Mund-Nasen-Schutz zu versorgen. In der Regel werden zur Versorgung solcher Patienten Handschuhe, Kopfbedeckung, Mund-Nasen-Schutz und ein zusätzlicher Schutzkittel über der Bereichskleidung empfohlen. Verbrauchsmaterialien und Geräte werden nur patientengebunden verwendet. Soweit möglich, sollte nicht benötigtes Equipment aus der Umgebung des Patienten entfernt werden. Bei Auftreten von VRE bzw. ESBL werden prinzipiell dieselben Distanzierungsmaßnahmen wie bei MRSA empfohlen (Kap. 3.6, Kap. 3.7).
Parenteral übertragbare Krankheiten (HIV, HBV, HCV): Medizinisches Personal ist gegen Hepatitis B zu impfen. Eine Übertragung durch Blut zu Blut bzw. HIV:Hygieneanforderungen, AnästhesieBlut auf Schleimhäute ist im Rahmen von Anästhesien möglich. Zum Schutz vor Blut oder Körpersekreten ist zusätzlich zu Einmalhandschuhen ein kombinierter Augen- Hepatitis-C-Virus:Hygieneanforderungen, Anästhesieund Mund-Nasen-Schutz zu tragen.
Durch Tröpfchen übertragbare Infektionen: Hierzu zählen Infektionserkrankungen durch Herpes-Virus (EBV, CMV), Influenza, Pertussis, Mumps, MRSA, Meningokokken, humanes Parvovirus B19, Streptokokken, Adeno-, Coxsackie-, ECHO-, Parainfluenza-, Metapneumo-, Rhino-, RS-Viren und Diphtherie.
Aerogen (durch Tröpfchenkerne) übertragbare Infektionen: SARS, offene Tuberkulose, Varizellen und Masern.
Bei geschlossener Tuberkulose sind keine besonderen Maßnahmen seitens der Anästhesie erforderlich. Bei offener Tuberkulose ist für Patient und Personal das Tragen von Atemschutzmasken mindestens der FFP-Klasse 2 erforderlich. FFP-2- bzw. FFP-3-Masken sind des Weiteren empfohlen bei SARS, Vogelgrippe und virusbedingtem hämorrhagischem Fieber. Bei Influenza ist bei aerosolgenerierenden Tätigkeiten (z. B. Intubation, offenes endotracheales Absaugen, Bronchoskopie) eine FFP3-Maske erforderlich; ansonsten ist der dicht sitzende chirurgische Mund-Nasen-Schutz ausreichend.
Bei Patienten mit den o. g. Infektionen ist die Verwendung von Einwegnarkosesystemen zu bevorzugen.
CJD und Variante CJD: Prophylaktisch ist die strikte Einhaltung der Standardygiene ausreichend, da die CJD nicht per inhalationem übertragbar ist (Kap. 3.3). Der Nutzen sog. prionensicherer Beatmungsfilter ist nicht belegt. Aus Sicherheitsgründen wird eine Creutzfeldt-Jakob-Krankheit:Hygieneanforderungen, Anästhesieprionendekontaminierende spezifische Aufbereitung aller Instrumente, die direkten Kontakt mit Mundhöhle, Pharynx, Tonsillen und Respirationstrakt hatten, empfohlen.
Bei Patienten mit erhöhtem Risiko, eine CJD zu haben oder zu entwickeln, sind Einwegprodukte zu verwenden. Es dürfen keine nicht dampfsterilisierbaren MP wie Gummituben und Larynxmasken wiederaufbereitet werden – sie werden nach Gebrauch entsorgt. Ebenfalls empfiehlt sich die Verwendung von Einwegmaterialien für Akupunkturnadeln, Myographie- bzw. NLG-Nadeln (AWMF-Leitlinie 2007). Die Einwegprodukte sind separat zu entsorgen und als Abfall (Abfallschlüssel 180103/C-Abfall) in sicheren Behältnissen zur Verbrennung geben (Tast Force vCJK 2002). Für die Endoskopie von CJD-Patienten sollte der Gerätepool in der Uniklinik Göttingen am Institut für Neuropathologie oder eine in der Aufbereitung befähigte Zentralsterilisationsabteilung genutzt werden (Kap. 3.3).
5.11. Gynäkologie und Geburtshilfe
Axel Kramer, Behzad Razavi und Marek Zygmunt
5.11.1. Häufigkeit und Ätiologie nosokomialer Infektionen
Gynäkologie
Während Mitte der 1990er Jahre Harnweginfektionen (HWI) mit 50–80 % an der Spitze der NI standen, hat sich ihr Anteil durch konsequenten Verzicht auf transurethrale Verweilkatheter und verbesserte postoperative Versorgung bei suprapubischer Harnableitung deutlich reduziert. In einer Stichprobe betrug der Anteil von HWI 33 %, für SSI 38 % und für Sepsis, Haut- und Weichteilinfektionen je 11 %. Die stationäre Verweildauer verlängerte sich mehr als dreifach, und im Durchschnitt fanden sich 2,4 Risikofaktoren bei Auftreten einer NI (Diabetes mellitus, Hypertonie, Durchblutungsstörungen, Blasenkatheter; Ullmann 2003).
Im OP-KISS betrug die SSI-Rate zwischen 0,3 und 3,2 (Tab. 5.22 ). International differiert die SSI-Rate nach abdominaler Hysterektomie zwischen 2 und 21 % (Lazenby und Soper 2010). Als unabhängige Risikofaktoren wurden hoher Glukoseserumspiegel 5 Tage postoperativ, Bluttransfusion und Body Mass Index (BMI) > 35 ermittelt (Olsen et al. 2009).
Tab. 5.22.
SSI-Rate (%) in Deutschland im Zeitraum 2005–2009.
| Engriff | Risikokategorie |
|||
|---|---|---|---|---|
| 0 | 1 | 2,3 | 0–3 | |
| Hysterektomie: abdominal vaginal |
1,08 0,38 |
1,89 0,28 |
3,22 0,65 |
1,47 0,37 |
| Mamma-OP | 0,52 | 1,23 | 2,58 | 0,87 |
(Nationales Referenzzentrum für Surveillance von nokosomialen Infektionen, NRZ 2010)
Etwa ⅔ der SSI in der Gynäkologie verlaufen als oberflächliche A1-Infektion. An erster Stelle des Erregerspektrums steht S. aureus (24,2 %), gefolgt von MRSA (10,9 %), Enterococcus spp. (9 %), E. coli (8,1 %), KNS (7,6%), Proteus spp. (3,5 %), P. aeruginosa (2,5 %), Klebsiella und Bacteroides spp. (je 1,9 %), Enterobacter spp. (1,7 %), Streptococcus spp. (1,5 %) und Citrobacter spp. (0,3 %) (NRZ 2010).
Die nekrotisierende Fasziitis, nekrotisierendeFasziitis mit meist polymikrobieller Ätiologie erfordert als lebensbedrohliche SSI ausgedehntes sofortiges Débridement des betroffenen Gewebes bei gleichzeitiger parenteraler Breitspektrum-Antibiotikatherapie.nosokomiale Infektionen:nosokomiale InfektionenGynäkologie
Geburtshilfe
Bis zur Einführung der Händewaschung mit Chlorkalklösung betrug die Letalität an Kindbettfieber 3–11 % (Semmelweis 1861). Heute werden die meisten geburtshilflichen Infektionen durch Vertreter der vaginal-zervikalem Flora mit S. aureus und/oder Anaerobiern als häufigstem Erreger zumeist aszendierend verursacht (Emmons et al. 1988).
Präpartale Risikofaktoren für NI: Schwangere,nosokomiale Infektionen:nosokomiale InfektionenRisikofaktoren die präpartal längere Zeit stationär behandelt werden, haben ein höheres Risiko für NI als Kreißende, die erstmals unmittelbar vor Wehenbeginn aufgenommen werden, bedingt z. B. durch infektionsbedingte drohende Fehl- oder Frühgeburt und/oder durch Kolonisation mit der Hospitalflora (Koepcke 2001).
Der Zusammenhang zwischen bakterieller Vaginose/aerober Vaginitis und Gefahr der aszendierenden Infektion mit und ohne vorzeitigem Blasensprung, vorzeitiger Geburt, Chorioamnionitis sowie neonatalen, puerperalen und maternal-fetalen Infektionen gilt als gesichert (Saling et al. 1997, AWMF S1-Leitlinie 2008, Donati et al. 2010, Lamont und Taylor-Robinson 2010). Die Strategie der vaginalen pH-Selbstmessung ermöglicht die Erkennung von pH-Wert-Abweichung, sodass ein Teil der für Spätabort und Frühgeburt relevanten Risikofaktoren binnen kurzer Frist mit adäquater Therapie beantwortet werden kann (Hoyme 2005, AWMF S1-Leitlinie 2008).
Infektionen nach Amniozentese oder anderen Formen der invasiven pränatalen Diagnostik und Therapie (Choriozentese, Cordozentese) werden mit < 1 % angegeben (Workman und Philpott-Howard 1997). Invasives Monitoring des Fetus (Amniozentese, fetale Blutgasanalyse, Skalpelektrode) generell und insbesondere bei Vorliegen einer blutübertragbaren Infektionskrankheit sollte vermieden werden oder nur bei strenger Indikationsstellung nach Abwägung der Risiken durchgeführt werden. Zu Risikofaktoren für Frühgeburt und Spätabort Kap. 2.10.7.
Postpartale Risikofaktoren für NI: nosokomiale Infektionen:nosokomiale InfektionenRisikofaktorenPostpartale Infektionen sind in absteigender Reihenfolge HWI, Endometritis, SSI (Dammriss bzw. Schnitt und ggf. Laparotomiewunde), prä- und postpartales AmnioninfektionssyndromAmnioninfektionssyndrom (AIS) und Mastitis puerperalis (auch Kap. 2.10.7).
HWI sind sowohl während der Schwangerschaft als auch postpartal häufig, weshalb während der Schwangerschaft (und erneut bei Fieber) ein Screening auf Bakteriurie mit Sanierung bei relevantem Befund empfohlen wird (Kressel und Linnemann 2004, AWMF S3-Leitlinie Harnweginfektionen 2010). Obwohl die antibiotische Therapie von Harnweginfektionen wirksam ist, kann auf Grund der Datenlage kein spezifisches Behandlungsregime während der Schwangerschaft präferiert werden (Vazquez und Abalos 2011).
Nach Sectio caesarea (SC) ereigneten sich nach älteren Angaben in Deutschland in 12 % Inflammation der abdominalen Wunde, gefolgt von Endometritiden in 11 %. Der Anteil an Atemweginfektionen betrug 3,6 %, an Haut- und Schleimhautinfektionen 2,6 %, an Bakteriämien 0,4 % (Decker und Hirsch 1977). Nach vaginaler Entbindung wurde in 3,6 % der Fälle eine Bakteriurie gefunden (Decker und Hirsch 1977). Für den Zeitraum 2005–2010 wurde die SSI-Rate nach SC mit 0,73 % ermittelt (NRZ 2010). Im Ergebnis einer prospektiven Studie in Norwegen war die SSI-Rate innerhalb 30 postoperativer Tage mit 8,9 % deutlich höher, betrug dagegen nur 1,8% bei Erfassung bis zur Entlassung. Als unabhängige Risikofaktoren wurden OP-Dauer > 38 min und BMI > 30 ermittelt (Opoien et al. 2007). In Alberta, Kanada, war die SSI-Rate mit 9,9 % innerhalb des Zeitfensters von 30 postoperativen Tagen noch höher, wobei die in mehr als 25 % fehlende PAP von Einfluss gewesen sein dürfte (Griffiths et al. 2005). Das steht in Übereinstimmung zu Ergebnissen einer estnischen Studie mit einer SSI-Rate von 6,2 %, wobei 42 % erst nach Entlassung auftraten. Invasives fetales Monitoring, Chorioamnionitis und die Wundklassifikationen kontaminiert und schmutzig-infiziert waren mit erhöhtem SSI-Risiko korreliert (Mitt et al. 2005).
Als Konsequenz ist die Häufigkeit des invasiven fetalen Monitorings auf das erforderliche Minimum zu reduzieren und eine Chorioamnionitis so rasch wie möglich zu behandeln.
Weitere Risikofaktoren sind Dauer des Eingriffs und OP-Technik. Durch intraoperativen Handschuhwechsel des OP-Teams nach Plazentalösung konnte die SSI-Rate signifikant gesenkt werden (Ventolini et al. 2004).
Nur selten treten SSI nach Episiotomie auf (Kressel und Linnemann 2004).
Die postpartale Endometritis kann in 5–95 % nach SC und in 1–4 % nach vaginaler Entbindung auftreten und sich auf Myometrium und parametrales Gewebe mit Abszess und Sepsis ausbreiten (Kressel und Linnemann 2004). Wichtigster Risikofaktor sind vorzeitiger Blasensprung, aber auch protrahierte Entbindung, Retention von Plazentaresten und Häufigkeit vaginaler Untersuchungen.
Das AISAmnioninfektionssyndrom entsteht vorwiegend aszendierend durch Vaginalflora. Bei begründetem Verdacht auf AIS müssen unverzüglich antibiotische Therapie und rasche Geburtsbeendigung erfolgen.
Milchstau und mangelnde Stillhygiene begünstigen die Entstehung einer Mastitis puerperalis. Beim Saugen kann vor allem S. aureus von der Haut und/oder aus dem kindlichen Nasopharynx über Rhagaden in die mütterliche Brustdrüse gelangen und sich lymphogen, seltener kanalikulär oder hämatogen ausbreiten. Bei Vermeidung von Milchstau und Rhagadenbildung wird die Frühmastitis kaum noch beobachtet.
Ausbrüche von A-Streptokokken-Infektionen sind selten, bedürfen aber der sofortigen Abklärung und Therapie (Mastro et al. 1990). An eine A-Streptokokken-Infektion ist immer bei rascher Verschlechterung des Zustands der Wöchnerin zu denken. Der Ursprung kann im (Nasen-)Rachen-Raum der Mutter sein. Es sind aber auch Fälle beschrieben, in denen A-Streptokokken von kolonisiertem chirurgischem Personal insbesondere intraoperativ auf Patienten übertragen wurden (Literatur in Oldhafer et al. 2006).
Ausbrüche von Staphylokokkeninfektionen sind selten, lediglich für MRSA und CA-MRSA ist das Risiko höher (Moore und Williams 1991, Bratu et al. 2005, Jenum et al. 2008). Auch für S. marcescens (Stephen und Lalitha 1993) und Virusgrippe (Pramanick et al. 2011) sind Ausbrüche beschrieben.
Infektionen des Neugeborenen: NeugeboreneNeugeboreneninfektionen sind vor allem durch Infektionen mit B-Streptokokken, H. simplex und C. trachomatis gefährdet.
Spontan geborene Neugeborene leiden seltener als nach Sectio entbundene an gastrointestinalen Infektionen in der Neugeborenenperiode (van Epps 2006, Lotz et al. 2006), bedingt durch die physiologische Besiedlung des Neugeborenen mit der mütterlichen Flora (Kramer et al. im Druck). Allerdings kann das Neugeborene bei Kolonisation des Geburtskanals mit Pathogenen z. B. eine Ophthalmia neonatorum erwerben. Ihre Inzidenz wurde für die USA mit 1,6 %, für afrikanische Länder > 23 % angegeben (Kramer et al. 2002). Staphylokokken waren zu 37%, Chlamydien zu 34% an der Ätiologie beteiligt, während Virusinfektionen selten waren (Assadian et al. 2002).
In seltenen Fällen kann durch mütterliche Mykosen eine Candida-Sepsis ausgelöst werden (Chapman 2003, Mendling et al. 2006). Außerdem können Neugeborene durch Anogenital- und Mundcandidosen in ihrem Befinden beeinträchtigt werden (Blaschke-Hellmessen 1998, Mendling et al. 2006).nosokomiale Infektionen:nosokomiale InfektionenGeburtshilfe
5.11.2. Prävention von NI
Gynäkologie
Präoperatives Screening: Das RisikoGynäkologie:Gynäkologiepräoperatives Screening für eine postoperative Infiltration der Vaginalmanschette nach Hysterektomie wird durch präoperative Vaginitis oder Vaginose (bakteriell oder T. vaginalis) erhöht. Deshalb wird gelegentlich von einigen Autoren ein präoperatives Screening empfohlen, um vor elektiven Eingriffen eine antibiotische Sanierung vorzunehmen (Lazenby und Soper 2010). Zusätzlich zur antibiotischen Prophylaxe gehört der Wiederaufbau der physiologischen Scheidenflora.
Haarentfernung: Falls die Haare im Schambereich aus operationstechnischer Notwendigkeit entfernt werden sollen, ist Clipping anstelle Rasur mit dem geringsten SSI-Risiko verbunden (Kramer et al. 2010).
Präoperative Katheterisierung: Kap. 2.10.7.
Antiseptik: Gynäkologie:GynäkologieAntiseptik Antiseptik:AntiseptikGynäkologieZusätzlich zu den in anderen chirurgischen Disziplinen für ein erhöhtes SSI-Risiko identifizierten Risikofaktoren (Kap. 2.10.7, Kap. 5.5) ist die kolonisierte bzw. infizierte Vagina ein spezieller Risikofaktor. Vagina und Vulva werden nach der Geburt mit diphtheroiden und anaerob wachsenden Stäbchenbakterien, Sarzinen, Koli- und Smegmabakterien sowie Hefen besiedelt. Bis zur Pubertät dominieren Staphylokokken, Streptokokken, Coliforme und Diphtheroide. Im Erwachsenenalter herrscht L. acidophilus vor (Wewalka und Spitzbart 1993), daneben kommen auch andere Lactobacillus spp. vor.
Vor diagnostischen oder therapeutischen transvaginalen Eingriffen ist die Vaginalantiseptik indiziert. Zur Antiseptik sind mindestens drei separate Tupfer für die großen, die kleinen Labien und den Urethraeingang zu verwenden. In klassischen Vorschriften werden fünf Tupfer gefordert (getrennt für rechts und links, große und kleine Schamlippe, Urethra). Nach Antiseptik der äußeren Schamlippen mit frischem, satt mit Antiseptikum getränktem Tupfer wird die gesamte Vagina mit leichtem mechanischem Druck für 1 min ausgewischt, der Vorgang für 1 min wiederholt. Die Antiseptik soll die gesamte Anourogenitalregion einbeziehen. In Hinblick auf Wirksamkeit und fehlende systemische Gefährdung ist die Kombination von Octenidin mit Phenoxyethanol PVP-Iod-basierten Antiseptika vorzuziehen (Below et al. 2009, Hübner et al. 2010).
Bei abdominalen und Mamma-Eingriffen müssen Bauchnabel und intertriginöse Bereiche gründlich gesäubert und anschließend antiseptisch behandelt werden. Hierfür sind alkoholbasierte Hautantiseptika Mittel der Wahl. Durch Anwendung der Kombination von 2 % Chlorhexidin in 70 % Alkohol war die SSI-Rate signifikant geringer als nach Anwendung wässriger PVP-Iod-Lösung (10 %) mit nachfolgender Applikation von 10 % PVP-Iod in 65 % Alkohol (Levin et al. 2011). Da Octenidin in vitro signifikant wirksamer als Chlorhexidin ist (Koburger et al. 2010), könnte durch die Kombination von Octenidin mit Propanolen vermutlich eine gleichartige Wirksamkeit erreicht werden; allerdings beträgt der Gehalt an Octenidin in dem Handelsprodukt nur 0,1 %. Auf wunden Hautarealen kommen Octenidin- oder Polihexanid-basierte Antiseptika auf wässriger Basis in Betracht.
PAP: Sie wirdAntibiotikaprophylaxe:Antibiotikaprophylaxeperioperative für alle Arten der Hysterektomie empfohlen, nicht dagegen routinemäßig für diagnostische oder operative Hysteroskopie, Endometrium Ablation, abdominale Myomektomie, Laparoskopie ohne Hysterektomie (Kap. 2.10.7; Lazenby und Soper 2010) und elektive Mammachirurgie bei Wundklassifikation 1 (Gupta et al. 2000). Eine großzügige PAP wird in der Fertilitätschirurgie empfohlen, ist aber nicht durch Studien belegt.
Nahtmaterial: Entrolltes Nahtmaterial soll wegen des Kontaminationsrisikos nicht auf dem Instrumentiertisch zwischengelagert werden, um den Rest für die Subkutannaht zu verwenden. Antiseptisch imprägniertes Nahtmaterial könnte zur Prävention von SSI im gynäkologischer Bereich beitragen, worauf In-vitro-Studien (Di Lonardo et al. 2011) und tierexperimentelle Arbeiten (Marco et al. 2007) hinweisen. In der Geburtshilfe ist diese zusätzliche präventive Möglichkeit bisher allerdings nicht durch Studien belegt.
Drainage: Wegen des erhöhten SSI-Risikos ist die Indikationsstellung streng zu stellen (Kap. 2.10.7). Wird die Drainage für erforderlich angesehen, ist ein geschlossenes System anzuwenden (z. B. Niederdruckverfahren, Handy-Vac, keine intraperitoneale Redon-Drainage wegen starker Gewebetraumatisierung).
Aufbereitung fachspezifischer MP: Spekula Medizinprodukteaufbereitung:MedizinprodukteaufbereitungGynäkologie sind MP semikritisch A und sollten vorzugsweise im RDG, können aber auch manuell aufbereitet werden.
Vaginalsonden werden vor der Ultraschalluntersuchung mit einer Hülle (z.B. Untersuchungskondom oder Einmalhandschuh) geschützt. Nach der Untersuchung und Entfernung von Schutzhülle und Gelresten mit weichem Einmaltuch ist die Desinfektion z.B. mit desinfektionsmittelgetränkten Fertigtüchern durchführbar. Wegen möglicher Kontamination mit Papillomaviren ist auf die Deklarierung virozid, d.h. Wirksamkeit gegen unbehüllte Viren, zu achten. Bei sichtbaren Ablagerungen ist die Sonde mit einer mit sterilem Wasser getränkten Kompresse abzuwischen.
Ultraschallköpfe mit Hautkontakt werden nach jeder Untersuchung mit einem mit Instrumentendesinfektionsmittel getränkten Tuch abgewischt. Sofern kein Hinweis auf eine Infektion durch unbehüllte Viren vorliegt, ist die Deklarierung „begrenzt virozid“ ausreichend. nosokomiale Infektionen:nosokomiale InfektionenGynäkologie
Geburtshilfe
Obwohl Schwangerschaft keine Erkrankung ist und die Entbindung primär kein operativer Eingriff darstellt, sind die Maßnahmen der Standardhygiene zum Schutz vor NI wie hygienische Händedesinfektion, Anlegen von Bereichs- und ggf. Schutzkleidung (Schutzbrille, Handschuhe), Einsatz adäquat aufbereiteter Medizinprodukte, Antiseptik und Desinfektion notwendig und im Hygieneplan festzuschreiben.
Präpartale mikrobiologische und virologische Screeninguntersuchungen: Kap. 2.10.7.
Händehygiene: Die wichtigste Maßnahme zur Prävention postpartaler Infektionen ist die Händedesinfektion in Verbindung mit dem Tragen von sterilen Handschuhen bei der vaginalen Untersuchung. Bei vaginalen operativen Entbindungen (Vakuumextraktion, Forceps), Nachtastung und manueller Plazentalösung sind sterile Handschuhe bzw. OP-Kittel zu benutzen. Bei drohender Frühgeburt sollte einer Spiegeluntersuchung und vaginaler Sonographie der Vorzug gegeben und von der Palpation Abstand genommen werden.
PAP: Sie Antibiotikaprophylaxe:Antibiotikaprophylaxeperioperativeist erforderlich bei vorzeitigem Blasensprung, Fieber, elektiver und sekundärer SC (Wagner et al. 2006) oder Zeichen eines AIS (Kap. 2.10.7), nicht jedoch bei einfacher operativer vaginaler Entbindung (Kressel und Linnemann 2004). Antibiotikagabe bei Nachweis von B-Streptokokken oder zur Endokarditisprophylaxe muss ebenfalls berücksichtigt werden.
Aseptik: Aseptik:AseptikGeburtshilfeVaginale und transvaginale Untersuchungen, insbesondere nach Blasensprung, invasives fetales Monitoring und Harnblasenkatheterisierung müssen streng indiziert unter Wahrung der Aseptik durchgeführt werden.
Antiseptik: Aus der Sicht der Gynäkologie wird nur im Falle einer Verletzung der Geburtswege oder bei Plazentalösung die Vagina vorbereitet. Dagegen ist in Deutschland die Antiseptik:AntiseptikGeburtshilfeAntiseptikGeburtshilfe:GeburtshilfeAntiseptik des Geburtskanals vor der Entbindung nicht üblich und wird derzeit nicht empfohlen. Allerdings gibt es einige Studien im angloamerikanischen Raum, wonach durch Antiseptik des Geburtskanals vor der Entbindung das Risiko für die neonatale und mütterliche postpartale Infektion reduziert werden kann (Burman et al. 1992, Bakr und Karkour 2005).
Hygiene im Kreißsaal: Die Einrichtung soll Behaglichkeit vermitteln, trotzdem müssen Oberflächen und Mobiliar der desinfizierenden Reinigung zugängig sein. Nach der Entbindung werden mit Blut oder Körperflüssigkeiten kontaminierte Gegenstände und Flächen der desinfizierenden Reinigung mittels Wischen unterzogen. Gleiches gilt für Gebärstuhl/-bett der Kreißenden.
Die Anwesenheit des Vaters im Kreißsaal ist aus psychohygienischen Gründen zur Selbstverständlichkeit geworden (David et al. 1994, Sioma-Markowska et al. 2004, David et al. 2009); nach SC werden der frühe Haut-zu-Haut-Kontakt gefördert und das Risiko der Hypothermie des Neugeborenen reduziert (Pestvenidze und Bohrer 2007). Das Team muss trainiert werden, die Väter zur aktiven Teilnahme an der Geburt und ggf. auch bei SC zu befähigen (Gutmann und Tabak 2011). Durch den Vater ergibt sich kein erhöhtes Infektionsrisiko (Banda 2008). Vor dem Eintreten soll er die Hände desinfizieren. Schutzkleidung ist nicht erforderlich (Ausnahme SC). Bei respiratorischen Infektionen ist insbesondere bei epidemischer Virusgrippesituation das Tragen eines Mund-Nasen-Schutzes zu empfehlen (CDC 2011); zu Herpes labialis siehe unten.
Wassergeburt: Durch WassergeburtWassergeburt wird im Ergebnis einiger Studien die Entbindungsdauer verkürzt, die Rate von Episiotomien und die Schmerzperzeption der Gebärenden verringert (Thoni et al. 2010). Werden die Hygieneanforderungen nicht eingehalten, ist die Gebärende durch Infektionen mit P. aeruginosa und andere Wasserpathogene gefährdet. Das Neugeborene ist sowohl durch Wasserpathogene als auch durch die Stuhlflora der Mutter, das Personal durch Kontakt mit bluthaltigem Wasser gefährdet. Fallberichte lassen den Schluss zu, dass Infektionen beim Neugeborenen zu schwerwiegenden Erkrankungen sowohl durch P. aeruginosa (Vochem et al. 2001) als auch durch L. pneumophila, letztere mit tödlichem Verlauf, führen können (Franzin et al. 2001, Nagai et al. 2003). Damit ist höchste Wasserqualität die wichtigste Voraussetzung bei der Unterwassergeburt.
Hygieneempfehlung zur Unterwassergeburt (Bösenberg et al. 2002): Voraussetzungen seitens der Kreißenden und des Kindes sind keine geburtshilflichen Risiken, Information über Infektionsstatus der Kreißenden, um bei das Personal gefährdenden Infektionskrankheiten keine Wassergeburt zuzulassen, Impfschutz des Personals gegen blutgetragene Infektionen, Reinigungseinlauf bei der Kreißenden. Nur die Kreißende darf sich in der Wanne aufhalten.
-
•
Das Einlaufwasser muss den Anforderungen an Wasser für den menschlichen Gebrauch genügen. Wird die mikrobiologische Wasserqualität inklusive Pseudomonaden (0/100 ml) und Legionellen (0/100 ml) (Dyck et al. 2007) nicht erreicht, sind endständige Bakterienfilter zu verwenden. Diese müssen nach 8 Wochen Dauernutzung aufbereitet werden (Daeschlein et al. 2007).
-
•
Die Gebärwanne muss der Kreißenden ausreichende Bewegungsfreiheit gewähren und sollte von drei Seiten zugängig sein. Die Wassereinläufe sollten sich im Beinbereich befinden. Überläufe sind wegen des Kontaminationsrisikos abzulehnen. Gleiches gilt für Luftdüsen.
-
•
Nach Entbindung und Ablassen des Wassers mit kurzem Nachspülen der Wanne sind die kontaminierten Flächen mit einem Flächendesinfektionsmittel mit begrenzt virozider Wirksamkeit zu behandeln; vor erneuter Benutzung ist die deklarierte Einwirkungszeit abzuwarten.
-
•
Es sind Gesichts-, Augen- und langärmliger Hand-/Armschutz als Personal- und Patientenschutz zu empfehlen.
-
•
Schon allein aus Haftungsgründen ist die Infektionssurveillance zu empfehlen.
Whirlpool: Die Nutzung von Whirlpools während der Wehen hatte positiven Einfluss auf Analgesie, Zustand des Perineums und Zufriedenheit, die mütterliche und kindliche Infektionsrate blieb unbeeinflusst (Rush et al. 1996).
Wochenstation: Rooming-in-PflegeWochenstation im Einzel- bzw. Doppelzimmer mit zugehöriger Sanitäreinheit oder das Familienzimmer sind fest etabliert (De Carvalho Guerra Abecasis und Gomes 2006, Lee et al. 2010). Durch die enge Mutter-Kind-Bindung werden die Entwicklung des Kindes und das Behaglichkeitsempfinden der Mutter gefördert (Janssen et al. 2006) und ein hoher Anteil Neugeborener erreicht, der nach Entlassung weiter gestillt wird. Im Vergleich zur zusammengefassten Unterbringung der Neugeborenen in größeren Einheiten wird das Infektionsrisiko für das Neugeborene bei Rooming-in reduziert (Fujita und Murono 1996). Ausnahmen sind gegeben, wenn durch die Infektion der Mutter eine vitale Bedrohung des Neugeborenen zu befürchten ist. Vorlagen müssen keimarm sein und kontaminationsgeschützt gelagert werden.
Mastitis puerperalis: Ihre Prävention beinhaltet Händedesinfektion vor dem Anlegen des Neugeborenen, Vermeiden von Milchstau durch Training der Stilltechnik, Wechsel zwischen unterschiedlichen Stillpositionen, um beim Saugen durch das kindliche Kinn verschiedene Quadranten zu massieren, Anlegen an beide Brüsten nacheinander in wechselnder Reihenfolge (Leertrinken beider Brüste), Vermeidung des Kontakts zwischen Brust und Lochien, Verwendung sauberer Stilleinlagen, lokale Behandlung entstehende Rhagaden der Brustwarzen, nach dem Stillen anhaftende Milchreste zuerst trocknen lassen und erst dann den BH anlegen, Stressvermeidung (evtl. mit dem Kind tagsüber schlafen).
Herpes simplex neonatorum: Bei der Herpes simplex:Herpes simplexneonatorumMehrzahl der Patienten mit primärer Herpes-labialis-Manifestation im Bläschenstadium lässt sich an den Händen HSV nachweisen. Die Läsionen sollten deshalb abgedeckt, die Patienten zur Händedesinfektion angehalten und beim Stillen ein Mund-Nasen-Schutz angelegt werden. Kreißenden mit genitalen Herpesbläschen wird die SC empfohlen (ACOG 2007). Bei einer mehrfach rezidivierenden HSV-Infektion wird antivirale Therapie empfohlen. Säuglinge mit disseminiertem Herpes neonatorum müssen isoliert werden (Kap. 3.4).
Ophthalmia neonatorum: DurchOphthamia neonatorum die Credé-Prophylaxe ist die Gonoblennorrhö in den Industrieländern auf < 0,04% zurückgegangen. Bei Auslassversuchen kam es dagegen wieder zu einem signifikanten Anstieg. Die Anwendung von Silbernitrat ist vor allem wegen fehlender Wirksamkeit gegen Chlamydien (Assadian et al. 2002, Kramer et al. 2002) in die Kritik geraten. 1969 wurde daher in den USA Silbernitrat durch Erythromycin und Tetracyclin ersetzt und diese Empfehlung erneut bestätigt (CDC 1989). Wegen des fehlenden Risikos der Resistenzentwicklung ist jedoch PVP-Iod 2,5%ig zu bevorzugen (Isenberg et al. 1995). Da bereits 1,25%ige PVP-Iod-Lösung gegen Chlamydien hoch wirksam und lokal und systemisch verträglich ist (Aspöck et al. 2004, Below et al. 2006, Richter et al. 2006, Hansmann et al. 2007), ist sie als Antiseptikum der Wahl anzusehen.
Schutzmaßnahmen vor peri- und postpartalen Infektionen: Kap. 3.3, Kap. 3.4.
In Tabelle 5.23 wird das von Gebärenden ausgehenden Infektionsrisiko für Dritte orientierend eingestuft.
Tab. 5.23.
Risiko der Infektionsausbreitung bei ausgewählten Infektionen der Gebärenden.
| Erreger | Risiko |
|---|---|
| B. burgdorferi, T. gondii | Nein |
| C. albicans, CMV, C. trachomatis, B-Streptokokken, HBV, HCV, Hepatitis-D- und -E-Virus, HIV, L. monocytogenes, N. gonorrhoeae, Parvovirus B19, Röteln, T. pallidum | Gering |
| EHEC, M. tuberculosis, Skabies | Mäßig |
| HSV, Masern, Mumps, Rota-, Noroviren, Varizellen, Virusgrippe | Hoch |
Neugeborene mit Masern, Mumps, Varizellen, Röteln, Influenza- oder Norovirusinfektion müssen isoliert werden.
Bei postpartaler und postoperativer A-Streptokokken-Infektion müssen Mutter und Kind bis 24 Stunden nach Beginn der Antibiotikatherapie isoliert werden. Bei gehäuftem Auftreten (> 2 Erkrankungen) ist ein Personalscreening durchzuführen.
Da B-Streptokokken schwere Infektionen beim Neugeborenen hervorrufen können (Early und Late Onset), wird das Screening aller Schwangeren auf B-Streptokokken zwischen 35 + 0 und 37 + 0 SS (vaginal und rektal) empfohlen, um bei positivem Nachweis sub partu antibiotisch zu sanieren (Kressel und Linnemann 2004, AWMF S2k-Leitlinie 2008a).
Dadurch kann in bis zu 90 % der Fälle eine Neugeborenensepsis verhindert wird, ohne dass nach bisherigem Wissensstand eine Zunahme anderer potenzieller Risiken (z. B. Anaphylaxie, Zunahme von nicht durch B-Streptokokken verursachten Sepsisfällen) verbunden ist.
Bei Auftreten von MRSA und weiterer MRE gelten die diesbezüglichen Regeln (Kap. 3.7, Kap. 3.8). Ggf. ist die antiseptische Sanierung der Scheide zu empfehlen, jedoch ist keine SC erforderlich. Die Hautdekontamination beim Neugeborenen kann mit Octenidin erfolgen.
Wegen des Risikos der alimentären Aufnahme von Listerien und EHEC ist während der Schwangerschaft kein Genuss von rohen Fleischwaren, Rohmilch, Vorzugsmilch und nicht pasteurisierten Milchprodukten zu empfehlen.
Bei HBsAg-positiven Müttern ist das Neugeborene nach der Geburt aktiv und passiv zu immunisiert. Es kann gestillt werden.
Bei Hepatitis C sollte bei hohem Virustiter und gleichzeitiger HIV-Infektion eine CS durchgeführt werden. Die HCV-Infektion allein stellt dagegen keine Kontraindikation für die vaginale Entbindung dar (Ross et al. 1999). Bei operativer Entbindung ist double gloving zu empfehlen. Da das Übertragungsrisiko für HCV durch Stillen nicht sicher eingeschätzt werden kann (CDC 1998), wird die Viruslast als Entscheidungskriterium herangezogen.
Wichtig ist das Screening auf HIV, da durch präpartale antivirale Therapie das Übertragungsrisiko auf das Kind um nahezu 70 % gesenkt werden kann (Public Health Service Task Force 2004) und durch primäre SC die Transmissionsrate mit 55–80 % deutlich reduziert wurde (International Perinatal HIV Group 1999, European Mode of Delivery Collaboration 1999). Bei HIV-Infektion sind die Empfehlungen zur HIV-Therapie in der Schwangerschaft und bei HIV-exponierten Neugeborenen (2008) und der AWMF zur Prävention blutübertragbarer Virusinfektionen (2002) zu beachten.
Bei offener Lungentuberkulose sind die Schutzmaßnahmen des RKI-Ratgebers (2009), des Deutschen Zentralkomitees zur Bekämpfung der Tuberkulose (2006) und der AWMF (2006) einzuhalten.
Candida-Infektionen können zwar unter der Geburt von der Mutter auf das Kind übertragen werden, erfordern aber unter der Entbindung kein besonderes Hygieneregime zum Schutz Dritter. nosokomiale Infektionen:nosokomiale InfektionenGeburtshilfe
Besucher: Sofern diese gesund sind, gibt es keine Besuchseinschränkung. Allerdings sollte beim Eintritt eine Händedesinfektion durchgeführt werden. Bei Erkältungen von Personal und Besuchern ist ein Mund-Nasen-Schutz anzulegen. Nach dem Naseputzen ist die Händedesinfektion durchzuführen. Personal und Besucher mit floridem Herpes labialis dürfen nur nach Händedesinfektion und Anlegen eines Mund-Nasen-Schutzes und Schutzkittels Kontakt mit dem Kind haben (Kap. 3.4). Bei Vorliegen hoch kontagiöser Darminfektionen soll für die Dauer der Erkrankung kein Kontakt mit Neugeborenen erfolgen.
5.11.3. Infektionsprophylaxe bei Verfahren der assistierten Reproduktion
Zur Infektionsprävention werden folgende Maßnahmen empfohlen (AWMF S1-Leitlinie 2008): Präkonzeptionelle Sanierung bei Infektion der Vagina (Screening auf Vaginose, Chlamydien, B-Streptokokken, vor invasiven Maßnahmen Auswaschen der Vagina bzw. Abtupfen der Portio mit steriler isotoner Kochsalzlösung, Antiseptik wird wegen möglicher Beeinflussung des Spermas nicht empfohlen), Verwendung von Einmalinstrumenten bei Follikelpunktion, Spermienpräparation, Embryokultur und Embryotransfer, Hitzesterilisation und ggf. Ultraschallreinigung von Mehrweg-Utensilien, Anreicherung des Kulturmediums mit Penicillin und Streptomycin, Qualitätskontrollen des Kulturmediums (Mikroorganismen, Endotoxine, Pyrogene), als Serumsupplement nur Albuminpräparationen aus getesteten (HIV, HBV, HCV, CMV, Treponema pallidum), quarantänegelagerten Spenderpools; notfalls Eigenserum der Patientin verwenden, Einhaltung der Hygienevorschriften zur Spermiengewinnung, regelmäßige Aufbereitung der Lagerbehälter für Kryokonservate, Röteln- und Varizellenschutz der Mutter, Impfprävention und hygienische Schutzmaßnahmen für das Laborpersonal. Zellspender müssen frühestens sieben Tage vor jeder Eizellentnahme oder Samengewinnung ein Screening für HIV, Hepatitis B und Hepatitis C (Anti-HIV-1, -2, HbsAg, Anti-HBc, Anti-HCV-Ab) durchführen lassen (Gewebegesetz 2007). Bei Vaginose wurden durch vaginale Applikation von Probiotika die Spermien vor Lipidperoxidation geschützt, was eine aussichtsreiche Option zur Verbesserung der In-vitro-Fertilisation darstellt (Barbonetti et al. 2011).
5.11.4. Surveillance
Durch Surveillance wirdGeburtshilfe:GeburtshilfeSurveillance Gynäkologie:GynäkologieSurveillance das Infektionsrisiko quantifiziert, und es können Schlussfolgerungen für Präventionsmaßnahmen abgeleitet werden. Daher ist die Surveillance unverzichtbares Instrument der Infektionskontrolle (Vincent-Bouletreau et al. 2005, Mahmood et al. 2008).
5.11.5. Personalschutz
Im Ergebnis der Gefährdungsanalyse (Kap. 5.29) sind die erforderlichen Arbeitsschutzmaßnahmen zu treffen und die Aufklärung zu Schutzimpfungen zu dokumentieren (Kap. 2.12). Auf Grund des häufigen Kontakts mit Blut, Amnionflüssigkeit und weiteren Sekreten und Exkreten (bis zu 39 % Kontamination bei der Geburtshilfe; Panlilio et al. 1992) sind die erforderlichen Sofortmaßnahmen bei akzidenteller Kontamination regelmäßig in Erinnerung zu bringen (Lewis et al. 1995, Arribas Llorente et al. 2004, Catanzarite et al. 2007, Jagger et al. 2009).
Zum Infektionsrisiko für das OP-Team bei Laserentfernung von Kondylomata Kap. 6.4.1.
5.12. Urologie
Hansjürgen Piechota und Peter Brühl
5.12.1. Transurethrale Harnblasenkatheterisierung
Antiseptik: Zielsetzung ist die weitestgehende Reduktion der Mikroflora der Genitoperinealregion um den Meatus urethrae bzw. am Introitus vaginae vor Katheterisierung (Heeg 1997). Das Wirkungsspektrum muss im Gegensatz zum Desinfektionsmittel nur auf die mikrobielle Zusammensetzung Antiseptik:Harnblasenkatheterisierungdieses Biotops ausgerichtet sein. Bei der Auswahl des Schleimhautantiseptikums ist nicht nur auf die lokale Verträglichkeit, sondern auch auf fehlende Resorptionstoxizität zu achten. Produkte auf Alkoholbasis sollen aufgrund der Schleimhautunverträglichkeit nur beim anästhesierten Patienten verwendet werden. Quecksilberhaltige Präparate sind aus toxikologischen Gründen und wegen mangelhafter Wirksamkeit obsolet. Iodophore sind am weiblichen Orificium urethrae Octenidin und Chlorhexidin in der Sofortwirkung überlegen, es ist die Resorptionstoxizität zu beachten. Am männlichen Genitale war dieser Unterschied nicht nachweisbar. Hier sind octenidin- bzw. chlorhexidinbasierte Antiseptika Wirkstoffe der Wahl. Bei benötigter remanenter Wirkung sind in jedem Fall octenidin- bzw. chlorhexidinbasierte Antiseptika zu bevorzugen (Assadian und Kramer 2008).
Aseptische Technik: Beim Mann muss nach steriler Abdeckung die Harnröhrenöffnung mit Daumen und Zeigefinger gespreizt und mitsamt Eichel dreimal hintereinander mit je einem satt getränkten Tupfer abgerieben werden. Bei der Frau werden die großen Schamlippen von der Symphyse weg zum Anus Asepsis:Harnblasenkatheterisierungantiseptisch abgerieben und dann mit Daumen und Zeigefinger der einen Hand gespreizt. Die kleinen Schamlippen werden mit der freien Hand und neuem Tupfer in der gleichen Weise von vorn nach hinten gereinigt. Zum Schluss wird die Harnröhrenmündung mit einem weiteren Tupfer behandelt und der letzte Tupfer in den Vaginaleingang eingebracht. Mit der anderen Hand wird der sterile Katheter nach Instillation eines sterilen, anästhesierenden Gleitmittels eingeführt.
Bezüglich Aseptik und Antiseptik ist jeder Harnblasenkatheterismus einem chirurgischen Eingriff gleichzusetzen.
Voraussetzung für das aseptische Vorgehen sind standardisierte Arbeitsmaterialien (Set) und ein standardisierter Arbeitsablauf (KRINKO 1999). Bei industriell gefertigten Sets (Handschuhe, Abdeckmaterial, Tupfer, ggf. Pinzette zur aseptischen Katheterinsertion, Schleimhautantiseptikum, Gleitmittel) haftet der Hersteller für die Zusammensetzung des Sets und dessen Sterilität. Das ist vor allem in Disziplinen wichtig, in denen seltener katheterisiert wird.
Intermittierender Katheterismus: Der aseptische intermittierende Katheterismus (IK)) ist eine erprobte, sichere Methode der Blasenentleerung bei bestimmten Formen der neurogenen Blasenfunktionsstörung (Tab. 5.24 ). Der IK kann langfristig erfolgen, wobeiKatheterismus, intermittierender die Infektionsprävention von der adäquaten Technik und der Katheterismus, intermittierender:aseptischerKatheterisierungsfrequenz abhängt (4- bis 6-mal in 24 Stunden). Es stehen handelsübliche sterile Einmalkatheter mit gerader, weicher, konisch verlaufender Spitze und abgerundeten, „entschärften“ Katheteraugen in gut handhabbarer Verpackung in Kombination mit sterilem Gleitmittel zur Verfügung. Letzteres muss die gleiche Biokompatibilität wie der Katheter besitzen (Kramer et al. 2001). Es werden verschiedene Techniken praktiziert: Im Krankenhaus sollte der IK unter streng aseptischen Kautelen erfolgen. Außerhalb werden beim hygienischen Selbstkatheterismus oder wenn der Katheterismus immer durch die gleiche Fremdperson durchgeführt wird (clean intermittent catheterisation, CIC), die hygienische Händedesinfektion und Antiseptik des Meatus und seiner Umgebung vorgenommen. Die Utensilien sind sterile Einmalartikel. Auf Selbstkatheterismus, hygienischerHandschuhe und sterile Abdeckung wird verzichtet und der gebrauchsfertige Katheter direkt „aus der Hülle“ in die Harnröhre eingeführt. Die Intervalle sollten eine Füllung der Harnblase über 400 ml vermeiden. Je öfter katheterisiert wird, desto niedriger bleiben Blasenfüllung und Infektionsrate. Die Methode kann unter bestimmten Voraussetzungen vom Patienten selbst erlernt werden. Wichtig ist die Schulung des Patienten bzw. der Personen, die den IK durchführen.
Tab. 5.24.
Indikationen für den Katheterismus der Harnblase.Harnblasenkatheterisierung:VerweilkatheterHarnblasenkatheterisierung:IndikationenHarnblasenkatheterisierung:Einmalkatheter
| Diagnostischer Katheterismus (meist Einmalkatheterismus) | Therapeutischer Katheterismus (meist Verweilkatheter) |
|---|---|
|
|
intermittierender Einmalkatheterismus
Kathetermaterial: Der transurethrale Harnwegskatheter kann als Fremdkörper durch physikalische und chemische Faktoren das physiologische Gleichgewicht urothelialer Abwehrmechanismen beeinträchtigen. Abhängig von den Eigenschaften des Kathetermaterials kommt es zur mechanischen Irritation mit nachfolgender Harnwegskatheter:transurethraler, MaterialSchädigung des Urothels (Nacey et al. 1985), die durch Manipulation am Katheter, Katheterwechsel, Zug am Katheter und Ableitungssystem oder durch Blasenspülungen verstärkt werden kann (Kap. 4.3).
Zu den spezifischen Adhärenzmechanismen einiger Mikroorganismen gehören die Fimbrien (Pili), mit denen sie an Urothel und Katheteroberflächen anhaften und persistieren können. Zu den unspezifischen Adhärenzmechanismen gehört der Biofilm (Kap. 4.9), der Mikroorganismen an den Oberflächen des Katheterdrainagesystems eingebettet festhält (Warren 1990). Beides wird durch eine raue Katheteroberfläche begünstigt wie auch die Katheterinkrustation durch Struvit oder Carbonatapatit, die an ein alkalisches Urinmilieu gebunden und pathognomonisch für eine bestehende Bakteriurie mit ureasebildenden Mikroorganismen ist. Die Inkrustation führt zu geringerer Drainageleistung bis zur Katheterinkrustation, Harnblasenkatheter, transurethralerObstruktion von Katheterlumen und Ableitungssystem (Stamm 1998) mit Blasenentleerungsstörung und Erhöhung des intravesikalen Drucks (Warren 1997; Kap. 4.3). Lumenobstruktion führt zu verkürzter Liegedauer des Katheters und erhöht das Infektionsrisiko durch gesteigerte Wechselfrequenz mit Manipulation und Zug am Katheter. Struvit und Apatit auf der Katheteraußenfläche irritieren beim transurethralen Katheter das Urothel vor allem der Harnröhre und haben zusätzliche urethrale Läsionen beim Wechsel des Katheters und als Spätfolge mögliche Harnröhrenstrikturen zur Folge (Bull et al. 1991). Im Biofilm sind Mikroorganismen vor antibiotischen und antiseptischen Maßnahmen geschützt. Harnwegskatheterassoziierte Harnwegsinfektionen (HWI) sind daher häufig therapieresistent und persistieren so lange, bis der kontaminierte Fremdkörper entfernt ist. Es bestehen daher hohe Anforderungen an die Biokompatibilität eines Katheters.
Die Anforderungen an einen Harnwegskatheter:AnforderungenHarnwegskatheter sind indikationsabhängig (Tab. 5.24) und beinhalten beim Verweilkatheter im Idealfall folgende:
-
•
chemisch biostabil, d. h. indifferent, alterungsfrei, korrosionsfrei,
-
•
physikalisch formstabil, elastisch, elektrostatisch neutral,
-
•
morphologisch glatt, wasserabstoßend, antiadhäsiv,
-
•
physiologisch gut drainierend, strömungsfördernd, allergenfrei, biokompatibel.
Zur Einmalkatheterisierung ohne längeren Gewebekontakt können preisgünstige Katheter aus PVC verwendet werden.
Latex ist mechanisch stabil und flexibel, jedoch nicht biokompatibel. Die elektronenmikroskopisch erkennbare raue Oberflächenstruktur führt zu erheblicher Inkrustationsneigung und starken Harnwegskatheter:PVCUrothelirritationen (Cox 1990, Hedelin et al. 1991). Durch Urethralsekret und Harn werden chemische Zusätze wie Harnwegskatheter:LatexWeichmacher und Stabilisatoren aus dem Latex herausgelöst. Latexkatheter induzieren innerhalb weniger Stunden chemisch-toxische Urethritiden, indem Anaphylotoxine freigesetzt werden, die bei der Herstellung als Akzeleratoren (Zinkcarbamat usw.) benötigt werden. Diese wirken toxisch auf das Urothel. Von der längerfristigen Verwendung (> 5 Tage) unbeschichteter Latexkatheter wird schon aus diesem Grund abgeraten (KRINKO 1999). Latexbestandteile können sowohl lokale als auch generalisierte allergische Reaktionen besonders bei Atopikern und Patienten, die häufig oder dauerhaft katheterisiert werden müssen (z. B. Kinder mit Spina bifida, Patienten mit neurogener Blasenentleerungsstörung und im Rahmen von Mehrfachoperationen), auslösen (Hamann 1994, Turjanmaa 1994). Die Symptome reichen von milder Kontakturethritis über Quincke-Ödem und generalisierte Urtikaria bis zum anaphylaktischen Schock (Shenot et al. 1994). Leider berühren die Schutzvorschriften (TRWS 540) bisher nur den Umgang mit gepuderten Latexhandschuhen.
Das allergene Potenzial von Latexkathetern muss beachtet werden. Wer auf Früchte wie Bananen, Kiwis, Walnüsse, Aprikosen oder Pfirsiche allergisch reagiert, kann auch auf Latexproteine reagieren (Kreuzallergie).
Polyurethan wird für Harnleiter- (endoureterale Schiene, Splint, Doppel-J- oder „Pigtail“-Katheter) und Nephrostomiekatheter verwendet. Es werden auch nach längerer Liegedauer bis zu 6 Monaten keine nennenswerten Mengen von Harnleiterkatheter, PolyurethanWeichmachern oder anderen Additiven herausgelöst. Die Oberfläche zeigt sich Nephrostomiekatheter, Polyurethanelektronenmikroskopisch relativ glatt.
Katheter aus reinem Silikon haben den Vorteil der geringsten kinetischen Reibung und induzieren weniger Urothelirritationen, da sie chemisch inaktiv sind (Khoury et al. 1991). Sie besitzen hohe Elastizität und Formstabilität und sind temperatur- und altersbeständig. Die Hydrophobie Harnwegskatheter:Silikonverhindert vor allem Ablagerungen wasserlöslicher oder wasserhaltiger klebender Substanzen, z. B. Harn, Serum, Blut. Davon profitieren besonders Patienten mit hoher Katheterinkrustationsneigung. Elektronenmikroskopisch ist die Oberfläche sehr glatt. Der Silikonkatheter kann daher bei längerfristiger, mehrwöchiger Drainage verwendet werden. Harnwegskatheterassoziierte Urothelkomplikationen und Kosten können verringert werden. Bezüglich der Durchflusskapazität zeigt sich eine signifikante Überlegenheit gegenüber Latexkathetern (Hedelin et al. 1991). Die Materialbeschaffenheit des Silikons erlaubt den dünnwandigeren Aufbau des Katheterschafts, sodass eine größere Lumenquerschnittsfläche erreicht werden kann. Da auch nach der Inkrustationsphase diese Vorteile erhalten bleiben, ist schon aus diesem Grund eine Bevorzugung bei langen Verweilzeiten gerechtfertigt (Hesse et al. 1994).
Katheter aus reinem Silikon stellen das Optimum an Biokompatibilität, Biostabilität und Urothelverträglichkeit dar.
Katheterbeschichtungen: Latexkatheter werden häufig mit Materialien beschichtet, die biostabiler und verträglicher als reines Latex sein sollen. Durch Beschichtung der inneren und äußeren Oberfläche mit einer Silikonelastomer- oder Teflonschicht konnte das toxische Potenzial des Latexkatheters gesenkt Harnwegskatheter:Beschichtungenwerden. Durch die glattere Oberfläche werden Reibung und Inkrustationsneigung im Vergleich zu unbehandelten Latexkathetern reduziert (Bull et al. 1991). Von Interesse ist ferner die Beschichtung mit hydrophilen Polymeren, die chemisch relativ inaktiv und biokompatibel sind. Es handelt sich um hydrophiles Polyurethan (Hydrogel), das bei Kontakt zum Urothel Wasser absorbiert und so zu „weichem Gel“ mit geringem Reibungskoeffizienten wird. Diese Katheter gleiten gut bei Katheterinsertion und irritieren das Urothel nur gering. Tierexperimentell konnte nachgewiesen werden, dass der hydrogelbeschichtete Katheter nicht zytotoxisch ist und sich in situ keine zytotoxischen Substanzen herauslösen (Davies 1985). In vitro wurde eine gegenüber Latex geringere mikrobielle Adhäsions- und Inkrustationsneigung nachgewiesen (Roberts et al. 1993). Durch die chemische Bindung der Beschichtung an das Substrat kommt es bei kurzer Liegedauer (5 Tage) nicht zu Materialbruch oder Abreibung der Beschichtung, sodass die Bedingungen für die hohe Biokompatibilität kurzfristig erhalten bleiben. Längerfristig ist aber die Oberfläche im Vergleich zu reinem Silikon deutlich instabiler (Bach 1995).
Ziel der antiinfektiven Imprägnierung ist es, Antibiotika oder Antiseptika in hohen Wirkkonzentrationen in oder auf das Kunststoffmaterial zu bringen und so über einen Low-Delivery-Mechanismus hohe Wirkspiegel gezielt am potenziellen Infektionsort freizusetzen. Gleichzeitig sollen der Harnwegskatheter:antiinfektiöse Imprägnierungsystemische Wirkstoffspiegel niedrig sowie die Nebenwirkungen gering sein. In bisherigen Untersuchungen führte das Eintauchen der Kathetermaterialien z. B. in antibiotische Lösungen trotz Optimierung aller physikalisch-chemischen Parameter nur zur relativ kurzfristigen Bindung des Antibiotikums (Warren 1997). Die dauerhaft wirksame Beschichtung mit den verschiedenen Wirkstoffen konnte bisher nicht gesichert werden (Schierholz 1998). Dabei müssen Aspekte wie Antibiotika:HarnwegskatheterResistenzentwicklung, Nebenwirkungen und Kosten-Nutzen-Vergleich beachtet werden.
Die Adhäsion von Mikroorganismen am Katheterpolymer soll durch Beschichtung mit Silberionen verhindert werden (Guggenbichler et al. 2008). Bisher konnte kein Einfluss auf die Inzidenz katheterassoziierter Bakteriurien gesichert werden (Riley et al. 1995). Auch durch Behandlung von Kathetern mit Salicylsäure (Farber und Wolff 1993) und durch Silberionen, HarnwegskatheterbeschichtungChloridionenfreisetzung aus Iontophorese-Kathetern (Wong et al. 1995) konnte keine Senkung der täglichen Inzidenz neu erworbener Bakteriurien erreicht werden. Zur Limitierung der Anlagerung von Harnkristallen an Katheteroberflächen wurde heparinisiertes Material entwickelt. Heparin verhindert die Anlagerung von Fibrinmonomeren. Dadurch sollen die Inkrustationsneigung verhindert und die bakterielle Kolonisation reduziert werden (Fuse et al. 1994). Ein signifikanter Effekt konnte tierexperimentell nicht bewiesen werden.
Wie schwierig bei antiinfektiv Heparin, Harnwegskatheterimprägnierten Kathetern trotz erfolgreicher Laborversuche der Nachweis klinischer Effizienz ist, zeigt sich darin, dass es trotz jahrzehntelanger Entwicklungsarbeit zurzeit keine Modifikation gibt, die zuverlässig eine harnwegskatheterassoziierte Bakteriurie bzw. bakterielle Entzündung des Urogenitaltrakts zu unterdrücken vermag. Kein Kathetermaterial und keine Katheterbeschichtung können die patientenspezifischen und die mechanisch-physikalischen Faktoren, die die anatomische Integrität des Urothels beeinflussen, eliminieren (Haacke et al. 1997).
Katheterstärke:
Der transurethrale Harnwegskatheter:KatheterstärkeKatheter darf kein größeres Kaliber aufweisen als der urethrale Meatus.
Zu große Katheter traumatisieren bereits bei Insertion das Urothel. Ein zu enges Anliegen der Harnröhrenwand kann zur Verlegung des Sekretabflusses aus den urethralen Anhangsdrüsen mit erhöhtem Risiko einer Urethritis und Epididymitis (Khoury et al. 1991) führen. Es können Urothelischämien und Drucknekrosen mit nachfolgenden Harnröhrenstrikturen entstehen. Eine Katheterstärke zwischen 14 und 18 Char. für Männer, von 12–16 Char. für Frauen und für Kinder je nach Lebensalter von 6–10 Char. wird empfohlen. Größere Kaliber wie z. B. Spülkatheter können nur bei spezieller urologischer Indikation erforderlich werden. Zu dünne Katheter sollten nicht verwendet werden, da sich diese beim Einführen in den Mukosafalten verfangen können (via falsa) und leichter obstruieren und abknicken.
Katheterhygiene:
Die Katheterhygiene, Harnwegskathetertägliche Reinigung des Meatus und Genitale beim transurethralen Harnwegskatheter bzw. des Punktionsbereichs beim suprapubischen Katheter mit nichtmedizinischer Seifenlotion und Wasser reicht zur Reduktion der Kontamination und Kolonisation aus (KRINKO 1999).
Die Häufigkeit einer kathetervermittelten Bakteriurie wird mit antiseptischer Meatuspflege nicht beeinflusst. Bei 2-mal täglicher Anwendung von PVP-Iod-Salbe war die Bakteriurierate höher als in einer nicht behandelten Kontrollgruppe (Burke und Riley 1996). Inkrustationen des meatusnahen Katheters werden mit 3 % H2O2 getränkten Mullkompressen schonend ohne Katheterirritation abgelöst. Jeder Zug am Katheter ist zu vermeiden. Bei immobilen Patienten kann als zusätzliche Maßnahme zum Schutz der Bettwäsche vor Verschmutzung und zum Schutz des Meatus vor Fäkalflora eine trockene, saubere Kompresse ohne Antiseptikum vor den Meatus urethrae um den Katheter geschlungen und geknotet werden. Häufige Lagekontrollen sind empfehlenswert. Bei Durchfeuchtung ist ein Wechsel erforderlich. Auf perineale Hygiene ist insbesondere bei Stuhlinkontinenz zu achten (Lima et al. 1990). Zur Dekontamination empfiehlt sich hier die Verwendung antiseptischer Waschlotionen.
Katheterwechsel:
Katheterwechsel, HarnwegskatheterVerweilkatheter sollen nicht routinemäßig in festen Intervallen, sondern bei Bedarf nach individuellen Gesichtspunkten gewechselt werden, z. B. bei symptomatischer HWI sowie bei Verschmutzung, Inkrustation und Obstruktion (KRINKO 1999).
„Blasentraining“: Bei der Verweilkatheterdrainage wird das Urothel der Harnblase zunächst durch mechanische Einwirkungen des Katheters (Katheterspitze, Katheterballon) geschädigt. Zystoskopisch zeigen sich multiple petechiale Hämorrhagien und ein bullöses Ödem (sog. Kathetermarke) als Zeichen der Verletzung des BlasentrainingUroepithels mit Infiltration der Submukosa durch Entzündungszellen (Kunin 1997). Durch die partielle Zerstörung der anatomischen Integrität der Blasenwand ist die katheterisierte Harnblase besonders infektionsgefährdet. Beim sog. Blasentraining durch intermittierendes Abklemmen eines Dauerkatheters vor dessen Entfernung zur Wiedergewinnung des Gefühls für einen normalen Miktionsrhythmus und zum „Auftrainieren“ der Blasenkapazität kann es zu unerwünschten intravesikalen Drucksteigerungen von > 100 cmH2O kommen (Brühl 1995). Der infizierte Harn wird durch unkontrollierbare hohe intravesikale Drücke in die vorgeschädigte Blasenwand eingepresst mit den möglichen Konsequenzen der bakteriellen Invasion (Kap. 4.3, Abb. 4.1). Die Bakteriämie kann zum pyelonephritischen Schub, zu Urosepsis bis zum uroseptischen Schock führen. Bei Insuffizienz der Harnleiterostien (Reflux) steht außerdem der Weg für eine direkte kanalikuläre Keimaszension in die Niere(n) offen. Detrusorspasmen führen zu weiteren intravesikalen Druckerhöhungen mit der Folge einer „Katheterleckage“, d. h. des hygienisch bedenklichen unwillkürlichen Urinverlusts neben dem Katheter.
Ein „Blasentraining“ vor Entfernung eines transurethalen Verweilkatheters ist abzulehnen, da es keine Vorteile bietet und wegen des Infektionsrisikos als gefährlich anzusehen ist (RKI 1999).
Selbst eine Schrumpfblase beim Dialysepatienten kann ohne Blasentraining problemlos die ursprüngliche Kapazität und Funktion wiedergewinnen. Die Kontrolle der Spontanmiktion und des Restharns sind Vorteile der suprapubischen Blasenkatheters.
5.12.2. Suprapubischer Blasenverweilkatheter (SBK)
Bei erforderlicher Harnblasendrainage > 5 Tage, Wochen oder Monate und nach größeren operativen Eingriffen bietet der SBK entscheidende Vorteile zur Prävention von HWI (AWMF 2008).
Der SBK umgeht das genitoperineale Biotop und die schutzbedürftige Harnröhre. Der Pflegeaufwand ist geringer. Es Harnblasenkatheterisierung:transurethrale\"\r\"Harnblasenkathtransurethralentstehen kein(e) katheterassoziierte(s) Urethritis, Balanitis, Präputialödem, Prostatitis, Epididymoorchitis und Harnröhrenstriktur (O'Kelly et al. 1995). Eine vesikale Bakteriurie tritt deutlich verzögert auf (Ringert und Groß 1996). Patienten mit transurethralem Verweilkatheter haben pro Kathetertag ein nahezu 5-fach höheres Infektionsrisiko (Geiss 1994). Beim SBK ist das Infektionsrisiko mit Problemerregern (bei geschlossener Harnableitung) reduziert, da die Bauchhaut vergleichsweise geringer kolonisiert ist (Stickler 1994). Der SBK sollte daher bevorzugt zur Anwendung kommen (KRINKO 1999, Piechota und Pannek 2003). Bei Verwendung eines Silikon-Ballonkatheters besteht nur eine geringe subjektive Belästigung des Patienten, da der SBK im Gegensatz zum transurethralen Katheter den Blasenverschlussmechanismus nicht irritiert. Ein postoperatives Training der Miktionsfähigkeit ist nur mit SBK möglich, weil der Patient spontan Wasser lassen kann. Danach wird über den SBK der Restharn geprüft. Das versuchsweise Entfernen und die ggf. erforderliche Wiedereinlage wie beim transurethralen Katheter entfallen. So können die Wiederherstellung der MiktionsfähigkeitstrainingSpontanmiktion schneller erfolgen, der stationäre Aufenthalt verkürzt und Belastungen für den Patienten sowie Kosten reduziert werden (Schiotz et al. 1989, Warren 1997).
Der Trokar zur suprapubischen Blasenpunktion und Kathetereinführung sollte eine einfache, hygienisch einwandfreie und vor allem sichere Handhabung ermöglichen (Irby und Stoller 1993). Die Steuerbarkeit bei der Punktion sollte durch ergonomischen Griff, mechanische Stabilität des Schafts und eine Trokarspitze gewährleistet sein, die eine sanfte Durchstechung der verschiedenen Gewebeschichten mit minimalem Kraftaufwand gewährleistet. Hygienisch bedenkliche Quetsch-, Riss- oder Gewebeausstanzeffekte, wie sie bei Voll-, Hohl- und innenliegenden Trokaren auftreten, müssen dabei zuverlässig vermieden werden. Durch den Trokar soll ein Punktionskanal geschaffen werden, der eine die Elastizität der Haut ausnutzende Spannung aufweist, die den Austritt von Urin neben dem Katheter und den Eintritt von Mikroorganismen in die Tiefe der Gewebeschichten bis in die Harnblase minimiert. Die Trennung des Katheters vom (rinnenförmigen) Trokarschaft nach der Punktion soll ohne Verletzungsgefahr für Patienten, Katheter und Hände des Anwenders gewährleistet sein. Diese Postulate an den optimalen Trokar werden z. B. von dem Curity®-Punktionssystem durch wichtige Details am Trokargriff und Trokarschaft sowie durch eine funktionell definierte und geometrisch dreigeteilte Trokarspitze erfüllt (Piechota et al. 1992, Meessen et al. 2000). So werden nicht nur das Handling und die Sicherheit für Arzt und Patient objektiv verbessert, sondern auch Probleme bei der Harnblasenpunktion minimiert.
Bei der suprapubischen Blasenkathetereinlage handelt es sich um einen operativen Eingriff, der nach Aufklärung und Vorbereitung nur vom Arzt durchzuführen ist (KRINKO 1999).
Aseptische Technik: Unbedingte Voraussetzung ist die Kenntnis des Füllungszustands der Blase (Palpation, vorzugsweise Sonografie). Die Gefahr einer Verletzung von Peritoneum und Dünndarm ist bei Asepsis:suprapubischer Blasenverweilkatheterungenügender Blasenfüllung (< 150 ml) erhöht. Besondere Sorgfalt muss bei Patienten mit früheren Unterbauchoperationen angewandt werden. Hier weisen Peritoneum und Darm oft Verwachsungen auf und stehen deutlich tiefer als im Normalfall. Bei Blasentumoren oder Hauterkrankungen im Punktionsbereich sollte die SBK-Anlage nicht durchgeführt werden.
Nach leichter Beckenhochlagerung, Clipping der suprasymphysären Behaarung, Hautantiseptik und Lokalanästhesie ca. 2 Querfinger oberhalb der Symphyse wird unter sanftem Druck, ggf. über eine kleine Stichinzision der Haut und der Faszie, der rinnenförmige Trokar mit dem innen liegenden Katheter in die Blase vorgeschoben. Nach Entfernung des Punktionstrokars wird der Katheterballon mit steriler 8–10-prozentiger Glycerollösung gefüllt. Die Verwendung einer antimikrobiellen Blockerlösung kann zur Reduktion der Bakteriurie und Inkrustations-/Okklusionsrate beitragen (Pannek und Vestweber 2011). Der Ballon soll nicht überfüllt werden (Studer et al. 1983). Bei einer Annaht im Einzelfall soll nur ein monofiler Kunststofffaden verwendet werden. Nach 8–10 Tagen wird der Faden entfernt. Der aseptische Verband ist für 2–3 Tage zu belassen. Beim späteren Wechsel des SBK ist reichlich steriles Gleitmittel zu verwenden und auf zuvor ausreichende Blasenfüllung (ca. 100 ml) zu achten! Die Verweildauer des SBK kann 1–2 Monate betragen. Duschen und Baden sind erlaubt.
5.12.3. Geschlossene Harndrainage
Bereits Kass (1956) sowie Kunin und McCormack (1966) konnten zeigen, dass bei der Verweilkatheterdrainage der Harnblase der Beginn der Bakteriurie von 4 Tagen beim Blasenverweilkatheter:suprapubischer\"\r\"SBKoffenen bis zu mehr als 30 Tag beim geschlossenen Harndrainagesystem hinausgezögert werden konnte. Die retrograde intrakanalikuläre Aszension im Katheterlumen war früher bei der Verwendung offener Behälter zum Auffangen des Harns der Hauptinfektionsmodus. Damals wurden bereits nach 2–4 Tagen Bakteriurieraten von nahezu 100 % erreicht, da stehender Harn ein ausgezeichnetes Kulturmedium ist und E. coli und Proteus spp. in stehenden Harnsäulen aufsteigend das Blaseninnere leicht erreichen können. Die Öffnung des außen kontaminierten Harndrainagesystems zur Gewinnung von Harnproben, zur Harnblasenspülung, zum Abstöpseln des Katheters (z. B. beim „Blasentraining“) oder zum Entleeren eines vollen Harnsammelbeutels propagieren die retrograde mikrobielle Aszension im Harnableitungssystem.
Bei Verweilkatheterdrainage der Harnblase muss ein geschlossenes Harndrainagesystem verwendet werden.
Ein geschlossenes Harnableitungssystem schützt während der Ableitung weitestgehend das Lumen der Harndrainage vor Kontamination von außen, kann jedoch die extrakanalikuläre Migration der Mikrooganismen in der mukopurulenten Bakterienstraße nicht verhindern. Im Handel sind verschiedene geschlossene Systeme, die den Anforderungen der ISO/DIS 8669-2 (1994) entsprechen.
Es sollen nur Systeme zur Anwendung kommen, die die nachfolgenden hygienischen Anforderungen (Exner et al. 1980, Brühl 1985) erfüllen: Harndrainage, geschlossene:Systemanforderungen
-
•
sterile Einzelverpackung (Setsystem),
-
•
Schutzkappe am Konnektor des Drainageschlauchs,
-
•
Drainageschlauch, transparent, weitgehend unbenetzbar, mit ausreichender Knickfestigkeit und Flexibilität, Lumenweite (0,7–0,8 cm) und Länge (ca. 1 m),
-
•
plan im Konnektor eingelassene Harnprobeentnahmestelle,
-
•
flüssigkeitsdicht belüftetete, nicht komprimierbare Tropfkammer am Übergang vom Drainageschlauch zum Harnsammelbeutel mit durchgehend identischer Lumenweite,
-
•
Pasteur-Einlauf aus dem Drainageschlauch in die Tropfkammer,
-
•
Harnsammelbeutel, Kapazität 2.000 ml, Markierungsskala mit 100 ml graduiert, gut ablesbar, auch bei längerem Gebrauch transparent und nicht verfärbend, flüssigkeitsdichte Belüftung,
-
•
vertikal angeordnete, verklebungsgeschützte Rückflusssperre zwischen Tropfkammer und Harnsammelbeutel, die nur bei retrogradem Fluss volumendicht schließt,
-
•
sichere Aufhängung bzw. Fixierung, wobei die Tropfkammer senkrecht positioniert sein muss,
-
•
Ablassstutzen am tiefsten Punkt des Harnsammelbeutels, leicht zu bedienen bei ausreichender Bodenfreiheit und nicht nachtropfend, integrierte ergonomische Rückstecktasche.
Bei der Harnentsorgung darf der Ablassstutzen des geschlossenen Harndrainagesystems nicht mit dem Auffanggefäß in Kontakt kommen. Auf Spritzschutz ist zu achten. Nach Entleerung wird er mit einem alkoholischen Desinfektionsmittel dekontaminiert (Seuffer 1999). Bei intensivmedizinisch betreuten Patienten soll wegen der Volumenbilanzierung ein hygienisch geprüftes, geschlossenes Harndrainagesystem mit integriertem Urinmessgerät (Urimeter) verwendet werden (Drehsen et al. 1998). Bei Harnentsorgung oder Systemwechsel sind Einweghandschuhe zu tragen. Vor und nach jeder Manipulation am Harnwegskatheter oder Drainagesystem ist eine hygienische Händedesinfektion erforderlich (RKI 1999). Fehler bei der Auswahl und Handhabung des Katheterdrainagesystems sind ein bedeutender Risikofaktor für harnwegskatheterassoziierte HWI. So fand Bonza (1994) bei einer Prävalenzstudie, dass bei etwa der Hälfte der untersuchten Patienten das Drainagesystem „inadäquat“ war.
Das Personaltraining ist in Bezug auf Wissensstand und Verhalten eine wichtige Präventivmaßnahme für katheterassoziierte HWI.
Beim intakten Katheterdrainagesystem ist die Verweildauer des Urins in der Blase und im System extrem kurz, weil der Urin durch das System kontinuierlich abfließt. Eine Harntransportstörung wie bei Blasenentleerungsstörungen des nicht katheterisierten Patienten kann bei Patienten mit Verweilkatheter als Folge einer Katheterobstruktion oder -okklusion auftreten. Diese entsteht durch intrakanalikuläre Präzipitation von Harnsalzen mit Inkrustation und Verschmutzung des Katheter- und Drainagelumens durch Zelldetritus und eiweißhaltiges Matrixmaterial. Sie wird begünstigt durch dünnlumige Katheter in Verbindung mit herabgesetzter Diurese.
Verschmutzte und inkrustierte Harndrainagesysteme sind mitsamt Katheter auszuwechseln.
Die Isolierung von Patienten mit harnwegskatheterassoziierten nosokomialen HWI mindert nicht das Übertragungsrisiko von Krankenhausinfektionserregern und ist außer bei MRE nicht erforderlich. Das Einhalten der Asepsis bei Katheterismus und Katheterpflege sowie die Verwendung geeigneter geschlossener Harndrainagesysteme können nicht durch räumliche Trennung ersetzt werden (Brühl und Werner 1986).
5.12.3. Katheter-/Blasenspülung und Instillation
Die früher übliche Blasenspülung beim dauerkatheterisierten Patienten als Infektions- und Inkrustationsprophylaxe ist zu RechtHarndrainage, geschlossene\"\r\"Harndrainagegeschlossene anhaltender Kritik ausgesetzt, die sich auf die Gefahren durch unsachgemäße Spülung (Elliott et al. 1989), fehlende Effektivität, Erregerverschleppung und ungeeignete Spülmedien bezieht (Kennedy et al. 1992, Schneeberger et al. 1992). Durch Manipulationen am Katheter und direkte Instillation wird die Integrität eines geschlossenen Systems unterbrochen und das Infektionsrisiko erhöht. Eine Reduktion von Mikroorganismen in der Blase wird nicht erreicht. Blasenspülungen bei dauerkatheterisierten Patienten sind nicht nur ineffektiv, sondern im Vergleich zu optimaler Katheterpflege und adäquater Diurese ohne Spülung kostenintensiver und gefährlich.
Die unkontrollierte Erhöhung des intravesikalen Drucks während der Blasenspülung steigert das Risiko einer Bakteriämie (Urosepsis), indem sie die bakterielle Invasion des entzündlich oder durch den Harnwegskatheter mechanisch vorgeschädigten Urothels und der Blasenwand begünstigt (Cartier und Lobel 1990). Die Spülung der Harnblase über einen Harnwegskatheter wird lediglich bei speziellen urologischen Indikationen als Reinigungsvorgang bei fibrinös-eitriger Zystitis, zur Prophylaxe oder Ausräumung von Blutkoagula (Tamponadeprophylaxe nach Blasen- und Prostata-OP) und zur lokalen Instillationsbehandlung, z. B. im Rahmen einer intravesikalen Chemotherapie, durchgeführt.
Spüllösungen müssen steril sein, wobei indifferenten Fertigmedien (0,9-prozentige NaCl- oder Ringer-Lösung) der Vorzug zu geben ist. Die Aufbrauchfrist sollte 12 Stunden nicht überschreiten. Ihre Applikation sollte im Katheterspülung:Spüllösungengeschlossenen System z. B. über doppelläufige Spülkatheter erfolgen. Die besteBlasenspülung:Spüllösungen Spülmethode ist eine endogene Flüssigkeitsdiurese von mehr als 1.500 ml/24 h unter entsprechender Flüssigkeitszufuhr (spezifisches Harngewicht ≤ 1.015). Bei alkalischem Harn-pH sollte eine orale Harnansäuerung z. B. mit Vitamin C oder Acimethin® auf ein pH-Optimum von 5,8–6,2 zur Inkrustationsprophylaxe angestrebt werden (KRINKO 1999).
Die topische Applikation systemischer Antiinfektiva in die Harnblase ist obsolet.
Ist die Blase gut drainiert und fließt der Harn klar ab, ist der Einsatz von Antibiotika meist nicht erforderlich (KRINKO 1999). Trüber und übel riechender Urin ist oft Folge mangelnder Diurese. Eine ausreichende Diurese trägt über den Mechanismus einer „inneren Spülung“ zur Erregerelimination und Inkrustationsprophylaxe bei.
Synopse der Empfehlungen zur Einschränkung kathetervermittelter nosokomialer HWI
Katheterismus:Harnblasenkatheterismus, Empfehlungen
-
•
strenge Indikationsstellung durch den Arzt,
-
•
Sachkundigkeit (geschultes Personal),
-
•
aseptisches Arbeiten mit standardisierten Arbeitsmitteln (Set),
-
•
Antiseptik (Meatus/Glans/Introitus vaginae), hygienische Händedesinfektion,
-
•
Instillation eines sterilen Gleitmittels in die Harnröhre,
-
•
Anpassung der Kathetergröße an die Harnröhrenweite,
-
•
bei Insertionsschwierigkeiten SBK (vorzugsweise für therapeutischen Katheterismus).
Therapeutischer Katheterismus:
-
•
Auswahl des geeigneten Katheters (vorzugsweise Silikon),
-
•
SBK bevorzugen,
-
•
hygienisch geprüftes geschlossenes Harnableitungssystem,
-
•
Auffangbeutel senkrecht, frei hängend unter Blasenniveau ohne Bodenkontakt,
-
•
kontaminationsfreie Entleerung über Ablassstutzen; anschließend Sprühdesinfektion, Nachtropfen vermeiden, Rückstecktasche benutzen,
-
•
Tropfkammer ohne Flüssigkeitsspiegel, vertikal angeordnete Rückflusssperre,
-
•
perineale Hygiene,
-
•
Katheterhygiene mit geringstmöglicher Irritation (3-prozentige H2O2 zur Reinigung des meatusnahen Katheters),
-
•
keine Blasenspülungen (nur bei spezifischer urologischer Indikation),
-
•
kein Blasentraining,
-
•
keine Antibiotikaprophylaxe (indizierte Therapie auf 1 Woche begrenzen),
-
•
täglich Katheterindikation überprüfen, ggf. Alternativen diskutieren.
Obstruktionsprophylaxe:Obstruktionsprophylaxe, Harnwegskatheter
-
•
Harndilution: Flüssigkeitszufuhr steigern, Ausscheidung 1,5–2 l/24 h, spezifisches Gewicht ≤ 1015 g/ml,
-
•
Harnansäuerung mit (Vitamin C, Acimethin®) auf pH 5,8–6,2,
-
•
ungestörter Harnabfluss unter Verwendung biokompatiblen Kathetermaterials.Katheterspülung\"\r\"Katheterspülung Blasenspülung\"\r\"Katheterspülung
5.12.4. Urologische Endoskopie
Neben rein diagnostischen transurethralen Untersuchungen werden immer mehr invasive therapeutische Eingriffe (transurethral und perkutan) endoskopisch durchgeführt.
Die Hygiene im OP-Raum für Eingriff(e):urologische, Hygieneanforderungentransurethrale und perkutane Eingriffe entspricht der Aseptik und Antiseptik in der OP-Abteilung für Schnittoperationen.
Röntgenuntersuchungstische für retrograde oder antegrade (perkutane) urologische Eingriffe müssen in Räumen positioniert sein, in denen die Einhaltung aseptischer Bedingungen für den Patienten möglich ist. Die Zuordnung und Einrichtung derartiger Räume hat zu berücksichtigen, dass die gesamte Behandlungsmaßnahme an einem Arbeitstisch durchgehend vollzogen werden kann. Die Umlagerung von Patienten mit liegenden Sonden vom Endoskopieraum in einen anderen, fern liegenden Röntgenraum ist aus hygienischen Gesichtspunkten indiskutabel. Ein vom Untersuchungs- und Behandlungsraum abgetrennter Aufbereitungsraum ist sowohl bei manueller als auch bei maschineller Aufbereitung erforderlich (Brühl 1983). Weitere Anforderungen der Hygiene an die baulich-funktionelle Gestaltung und apparative Ausstattung von Endoskopieeinheiten sind in der KRINKO Empfehlung (2002) aufgeführt.
Für videounterstützte minimalinvasive endoskopische Eingriffe gilt der gleiche Anspruch an die Aseptik wie für konventionelle Schnittoperationen. Einzige Ausnahme ist die Videokamera, die nicht sterilisierbar ist und einschließlich des Übertragungskabels mit einem sterilen Plastikschlauch überzogen werden muss. Die transurethrale Videoresektion (Prostata, Blasentumor) minimiert die Gerätekontamination durch den Operateur, bewahrt diesen vor unmittelbarem Augen- bzw. Gesichtskontakt mit dem Okular und minimiert so das Kontaminationsrisiko durch Blut und Urin. Aus Gründen des Personenschutzes ist ein Mund-Nasen-Schutz (chirurgischer MNS nach DIN EN 14683), ggf. auch Augenschutz, erforderlich (Muir und Davies 1996, Öge et al. 1998).
AOP-Tisch, Patient und Operateur müssen am Ende des Eingriffs trotz Spülung trocken sein.
Sterile Abdeckung des Patienten und sterile OP-Schutzkleidung des Operateurs und Instrumentierenden sind selbstverständlich. Wegen des erheblichen Spülwasseranfalls in der operativen urologischen Endoskopie ist es erforderlich, dass weder das Abdeckmaterial noch die OP-Kleidung und OP-Bereichskleidung durchweichen. Das ist keine Frage des Handlings, sondern eine wesentliche Anforderung an flüssigkeitsdichtes Abdeckmaterial (Werner und Feltgen 1998). Die Verwendung geeigneter Einwegmaterialien wie flüssigkeits- und bakteriendichter, reißfester Vliesstoffe vermeidet mögliche Probleme der Aufbereitung (Hansis 1998).
Das Kontaktgel, Endoskopie, urolgischeKontaktgel zur Durchführung ultraschallgesteuerter, perkutaner endoskopischer Eingriffen muss steril sein.
Konservierungsmittel wie Formaldehyd, Phenol, Glyzerol u. Ä. bewirken keine Sterilität. Kontaktgel in Weithalsflaschen mit Schraubverschluss ist ungeeignet, da es durch die Entnahme zahlreicher Einzelproben zur bakteriellen Verunreinigung kommt. Kontaktgel ist ein guter Nährboden für Mikroorganismen. Für ultraschallgesteuerte perkutane endoskopische Eingriffe ist ein portioniertes steriles Gel zum Einmalgebrauch zu fordern. Diesen Zweck erfüllen alternativ auch die handelsüblichen Gleitmittel für den transurethralen Katheterismus. Bei der Desinfektion von Ultraschallköpfen sind die Herstellerangaben zum zulässigen Aufbereitungsverfahren zu beachten (Schrader 2003).
Endoskopisches Instrumentarium muss unmittelbar nach Gebrauch einer Grob- und Vorreinigung außerhalb des Eingriffraums unterzogen werden. Grobverschmutzungen sind sofort nach der OP mit einem Tuch abzuwischen, das mit geeigneter Instrumentendesinfektionslösung plus Reinigungskomponente oder mit einem auf das Desinfektionsmittel abgestimmten Reinigungsverstärker getränkt ist (KRINKO 2003, 2004, Rutala und Weber 2004). Wiederverwendbare Schlauchsysteme müssen durchgespült werden. Trockenentsorgung von Endoskopen sollte nur dann erfolgen, wenn die Instrumente zur Vermeidung von Inkrustierung und Korrosion unverzüglich maschinell aufbereitet werden können. Werden für die OP Einmalinstrumente verwendet, gibt es keine hygienischen Probleme. Aus Kostengründen werden allerdings zunehmend wiederverwendbare Instrumente eingesetzt. Ihre Anwendung kann nur empfohlen werden, wenn die Konstruktion eine vollständige Aufbereitung und sichere Sterilisation der Kanäle und beweglichen Teile zulässt (Leiss et al. 1995). Bei der Gruppe der thermolabilen Instrumente wie den flexiblen Urethrozystoskopen und Ureteroskopen erfolgt eine chemothermische Desinfektion im RDG, was voraussetzt, dass das Endoskop wasserdicht ist, also auch der Instrumentenkopf mit dem Okular und den Bedienungselementen. Alle Endoskope ohne diese Eigenschaften und ohne die Möglichkeit, die Dichtigkeit überprüfen zu können, dürfen nicht mehr verwendet werden. Ist nach Herstellerangaben die Möglichkeit der Gassterilisation gegeben, muss diese wahrgenommen werden. Grundsätzlich sollte alles autoklavierbare endoskopische Instrumentarium der Dampfsterilisation zugeführt werden (Steuer und Junghannß 1990).
Endoskop(e):urologischeEndoskope, die bei haut- oder schleimhautpenetrierenden Eingriffen und/oder in physiologisch sterilen Körperhöhlen eingesetzt werden, müssen steril sein.
Grundsätzlich sind bei der Aufbereitung von starren und flexiblen urologischen Endoskopen und wiederverwendbaren Instrumenten die Herstellerangaben und die KRINKO-Empfehlungen (2001, 2002) zu berücksichtigen (KRINKO 2005). Es ist unabdingbar, dass das Personal in der ZSVA über den Einsatzbereich des Instrumentariums und den Ablauf der OP informiert ist, damit funktionsfähige Siebe zur Verfügung stehen. Dafür sollten sog. Team-Hospitationen gemeinsam von Arzt, Endoskopieschwester/-pfleger, HFK und Personal der ZSVA organisiert werden.
Unzureichend aufbereitete und/oder aufbewahrte Endoskope und Endoskopiezubehörteile sind die Hauptursache für exogene Infektionen bei der Endoskopie.
Mängel liegen entweder im angewandten Reinigungs- und/oder Desinfektionsverfahren oder die Geräte werden durch unsachgemäße Handhabung oder verunreinigte Spüllösungen (während der Endoskopie) kontaminiert. Die sichere Aufbereitung wird der endoskopierende Arzt nach den Europäischen Medizinproduktrichtlinien (MPG) ggf. nachzuweisen haben. Nicht der Patient muss beweisen, dass er vom Endoskopanwender geschädigt wurde, sondern der Endoskopanwender muss nachweisen, dass er die vorhandenen Möglichkeiten zur Sicherung der Hygiene und Infektionsprävention ausgeschöpft hat (Produkthaftung). Hier kann es Probleme geben, wenn ein Endoskop manuell aufbereitet oder ein RDG verwendet wurde, dessen Funktion nicht in allen Verfahrensschritten durch Prozessdaten (Validierung) im Rahmen der Qualitätssicherung belegt ist. Die Strukturqualität umfasst damit nicht zuletzt personelle und technische Voraussetzungen, definierte hygienische Handlungsweisen, Schulung und Information der Mitarbeiter sowie die Dokumentation (Emori und Gaynes 1993). Von der KRINKO sind in diesem Zusammenhang folgende Empfehlungen relevant:
-
•
Anforderungen der Hygiene bei Operationen und anderen invasiven Eingriffen (2000),
-
•
Anforderungen an die Hygiene bei der Aufbereitung von MP (2001),
-
•
Anforderungen der Hygiene an die baulich-funktionelle Gestaltung und apparative Ausstattung von Endoskopieeinheiten (2002),
-
•
Anforderungen an die Hygiene bei der Aufbereitung flexibler Endoskope und endoskopischen Zusatzinstrumentariums (2005),
-
•
personelle und organisatorische Voraussetzungen zur Prävention von NI (2009).
5.12.5. Hygienische Hilfsmittel bei Harninkontinenz
Zu den aufsaugenden Hilfsmitteln zählen am Körper getragene Vorlagen/Endoskopie:urologische\"\r\"EnsodkopieurologInkontinenzslips und Unterlagen zum Schutz des Patienten sowie von Betten, Stühlen und der Umgebung. Man unterscheidet körpernahe Einwegvorlagen/Inkontinenzslips, Einwegkrankenunterlagen, am Harninkontinenz, Hilfsmittel, hygienischeKörper getragene Mehrwegvorlagen sowie Mehrwegunterlagen. Der unfreiwillig ausgeschiedene Urin wird von absorbierenden Materialien aufgesaugt und gebunden. Als aufsaugende Materialien werden üblicherweise Zellstoffe wie Zellulose oder Pulp verwendet, aber auch Textilien kommen in Betracht; diese sind mit erhöhtem HWI-Risiko assoziiert (Zimakoff et al. 1996).
Die Qualitätsanforderung an aufsaugende Hilfsmittel betrifft Lebensqualität, Wirtschaftlichkeit und umweltgerechte Produktgestaltung. Damit eine optimale Auswahl getroffen wird, müssen Schweregrad, Häufigkeit und Ursache der Harninkontinenz in die Entscheidung einbezogen werden (Füsgen et al. 1998).
Ableitende Hilfsmittel für Männer sind bei anders nicht beherrschbarer Harninkontinenz Kondomurinale. Sie bestehen aus eng anliegendem Latex (cave Allergie!) oder Silikon und werden entweder außen durch einen Klebestreifen befestigt oder sind an der Innenseite selbstklebend. Sie werden an ein Harnauffangsystem angeschlossen. Auf Kondom- oder Schlauchabknickung ist zu achten. Wichtig sind KondomurinaleKondomgröße, Klebetechnik und regelmäßiger Wechsel. Bei der Kondomableitung finden sich häufig HWI und entzündliche Affektionen der Penisschafthaut (Stover et al. 1991, Zimakoff et al. 1996). Sie darf nicht von Patienten mit Blasenentleerungsstörungen, symptomatischen HWI oder retrahiertem Penis verwendet werden. Wegen der erheblichen mikrobiellen Kolonisation von Urethra und Perineum mit Pseudomonas, Klebsiella oder Providencia (Montgomerie und Maeder 1998) ist eine sorgfältige genitoperineale Antiseptik erforderlich.
Kondomurinale sollen über Nacht abgenommen werden, um die mikrobielle Kolonisation zu reduzieren.
Für Frauen stehen keine vergleichbaren ableitenden Hilfsmittel zur Verfügung. Anstelle aufsaugender Hilfsmittel ist der suprapubische Katheter eine mögliche Alternative.
5.12.6. Urostomapflege
Urostomata sind alle operativ angelegten artifiziellen Körperöffnungen, die der Harnableitung bei geschädigtem Ureter und bei stark funktionsgestörter oder entfernter Harnblase dienen. Dabei werden trockene Stomata wie beim kontinenten UrostomapflegeNabelpouch (Mainz-Pouch-Darmersatzblase) von nassen Stomata wie Urostomatabei Harnleiter-Haut-Fisteln oder beim Ileum-Conduit unterschieden. Während trockene Stomata des regelmäßigen sauberen Einmalkatheterismus bedürfen, müssen nasse Stomata ständig abgeleitet werden. Das erfolgt mit Klebebeuteln, die den Harn unmittelbar nach Austritt aus dem Stoma auf der Hautoberfäche (Harnleiter-Haut-Fistel) oder idealerweise ohne Hautkontakt (Ileum-Conduit) aufnehmen. Kontinente Stomata werden für die Katheterisierung genauso behandelt wie das Orificium urethrae externum und die Harnröhre.
Stomata mit Verweilkatheterableitung bedürfen der regelmäßigen Pflege von Stoma und Katheter.
Beide sind täglich zu reinigen und mit trockenem Verband zu schützen. Die Harnableitung erfolgt über spezielle Systeme mit Beinbeutel (Bach und Brühl 1995). Stomata mit Klebebeuteln (Ileum-/Kolon-Conduit, Ureterostoma) bedürfen der regelmäßigen speziellen Stomapflege und Hauthygiene, wobei der Schutz der Haut vor Mazeration im Vordergrund steht. Voraussetzung dafür sind exakt für das Stoma ausgeschnittene und abdichtende Klebeplatten. Ihre Hautverträglichkeit muss bei jedem Patienten geprüft und das Fabrikat (z. B. einteiliger Klebebeutel oder zweiteiliges System mit Basisplatte und Beutel) ggf. von Zeit zu Zeit gewechselt werden. Das Haften des Beutels bzw. der Platte setzt eine saubere, trockene, gesunde Haut voraus. Die Säuberung erfolgt mit warmem Wasser und nicht parfümierten, flüssigen Tensidseifen. Pflasterrückstände werden mit speziellen Lösungsmitteln (nicht Benzin oder Ether) entfernt. Die Trocknung der Haut vor Aufkleben des Beutels bzw. der Platte erfolgt erforderlichenfalls mittels Föhn. Bei narbigen, verzogenen oder eingesunkenen Stomata sind vor Aufkleben des Beutels zum Niveauausgleich ggf. Hautschutzpasten (z. B. Karaya) aufzutragen oder spezielle konkave Basisplatten mit Gürtelsystemen zu verwenden.
5.13. Neonatologie und Pädiatrie
Arne Simon
Kinder, die in neonatologischen oder pädiatrischen Kliniken oder Abteilungen betreut werden, sind in Bezug auf die Surveillance, Prävention und Kontrolle nosokomialer Infektionen (NI) keine „kleinen Erwachsenen“ (Jarvis et al. 1991, Jarvis und Robles 1996, Harris 1997, Hudome und Fisher 2001, Neely und Toltzis 2001, Adams-Chapman und Stoll 2002, Rowin et al. 2003).
Dieses Kapitel nimmt auf die Besonderheiten Bezug, die sich bei Infektion(en):urologische\"\r\"Urolinfektionender infektionspräventiven Betreuung dieser Patienten ergeben.
5.13.1. Patienten mit besonders hohem Risiko für nosokomiale Infektionen
Urologie, Infektionen\"\r\"UrolinfektionenEin erhöhtes Risiko ergibt sich durch
-
•
patientenspezifische Faktoren (z. B. fehlende Immunität und fehlender Nestschutz; Immunschwäche oder -suppression, gestörte Barrierefunktion von Haut und Schleimhaut; angeborene Fehlbildungen),
-
•
invasive Maßnahmen und Einsatz spezieller Medizinprodukte (Devices; Katheter, Drainagen, ventrikuloperitonealer Shunt [Prusseit et al. 2009], Beatmung [Turton 2008]),
-
•
anhaltende Exposition gegenüber Antibiotika mit breitem Wirkungsspektrum,
-
•
hygienerelevante Gegebenheiten in der belebten und unbelebten Umgebung des Patienten (Händehygiene, Isolierungsmaßnahmen, personelle Besetzung, Ausbildungsstand des Personals, Umgang mit Formulanahrung, Umgebungsdesinfektion, Aufbereitung).
In den meisten Hochrisikogruppen ergänzen sich verschiedene Aspekte zu einem komplexen individuellen Risikoprofil, dem nur durch ein Multibarrierenkonzept der Infektionsprävention und -kontrolle angemessen begegnet werden kann (Cavalcante et al. 2006).
Bei Geburt extrem unreife Frühgeborene nosokomiale Infektion(en):Frühgeborene Frühgeborene:nosokomiale Infektionen(Gestationsalter < 28 Wochen, Geburtsgewicht < 1.500 g) weisen die höchsten NI-Raten in der Pädiatrie auf (bis 45 %).
Ihr Immunsystem ist unreif, ihre Haut- und Schleimhautbarriere ist in den ersten Lebenswochen nicht ausreichend ausgebildet, sie sind in hohem Maße gegenüber invasiven Devices und breit wirksamen Antibiotika exponiert, ihre spezielle Pflege bedingt mannigfache direkte und indirekte (Hand-)Kontakte zum Behandlungsteam, zu den Eltern und zur unbelebten Umgebung, und sie verweilen nicht selten länger als 100 Tage im Krankenhaus.
NI bei Hochrisikofrühgeborenen gehen auf Seiten der Patienten mit einer signifikant erhöhten Morbidität und Mortalität einher (Benjamin et al. 2004, Kommission für Krankenhaushygiene und Infektionsprävention beim Robert Koch-Institut 2007). Sie können zudem, vor allem wenn sie als Ausbruch auftreten und in der Öffentlichkeit diskutiert werden, für die Klinik sehr ungünstige Konsequenzen nach sich ziehen (Gortner et al. 2000, Reiss et al. 2000).
Pädiatrische Intensivpflegeeinheiten sind meist interdisziplinär organisiert und behandeln ein breites Spektrum von Patienten mit unterschiedlichen Risikofaktoren für NI (Gilio et al. 2000, Yogaraj et al. 2002, Armenian et al. 2005). Patienten mit angeborenen Fehlbildungen etwaIntensivpflegeeinheiten, pädiatrische, nosokomiale Infektionen des zentralen Nervensystems (McGirt et al. 2003, Turgut et al. 2005), des Herzens (Fischer et al. 2000, Lanari et al. 2004) oder der Harnwege (Ferroni et al. 1998, Langley et al. 2001), die operativ korrigiert werden müssen, Kinder nach schweren Unfällen (Upperman und Sheridan 2005, Urrea et al. 2005) sowie Patienten mit Verbrühungen und Verbrennungen (Gastmeier et al. 2002, Sheridan 2005) oder extrakorporalen Lungenersatzverfahren (Steiner et al. 2001) sind einem besonders hohen Risiko für NI ausgesetzt.
Sarvikivi et al. publizierten 2008 eine prospektive Studie zu postoperativen Infektionen bei Patienten einer kinderherzchirurgischen Intensiveinheit in Helsinki, die erstmals auch ein Modul für eine Surveillance nach Entlassung (bis zu 30 Tage nach der OP) vorsah. Es wurden 511 Patienten (614 herzchirurgische Eingriffe) in die Studie aufgenommen. Insgesamt wurden 80 NI bei 66 Patienten diagnostiziert (NI-Rate im Krankenhaus 6,3 pro 1.000 Patiententage). Es handelte sich um 27 SSI, 20 Blutstrominfektionen (BSI; Bakteriämie, Sepsis), 17 gastrointestinale Infektionen (GIT), 4 Pneumonien, 6 Weichteilinfektionen und jeweils 3 Harnwegsinfektionen und Konjunktivitiden. Die SSI-Rate betrug 4,4 pro 100 Eingriffe; hierunter auch 2 Fälle einer Mediastinitis nach Sternotomie (0,3/100 Eingriffe). Die mittlere Verweildauer der Patienten mit NI war verlängert (23 vs. 13 Tage; p < 0.01); das galt auch für die Patienten mit SSI (16 vs. 10 Tage; p < 0.001). Die Surveillance in den ersten 72 Stunden nach Entlassung dokumentierte bei 29 von 291 Patienten (Instrument: Fragebogen an die Eltern, Rücklauf: 90 %) Symptome einer nosokomialen Virusinfektion der Atemwege. Bei 9 Patienten wurde RSV nachgewiesen, ein Virus, das bei Kindern mit angeborenen Herzerkankungen lebensbedrohliche Komplikationen auslösen kann (Altman et al. 2000, Feltes et al. 2003).
Des Weiteren traten bei 29 Patienten in den ersten 72 Stunden nach Entlassung Symptome einer nosokomialen Gastroenteritis auf, die in 18 % zu einer Rehospitalisierung führten; parallel hierzu gab es in der Abteilung einen Ausbruch mit Noro- und Rotavirus. In Bezug auf SSI wurden 20 % aller Infektionen erst nach Entlassung diagnostiziert, wobei es sich um oberflächliche SSI handelte. Die Untersuchung zeigt, dass sich die Surveillance und Prävention in kinderherzchirurgischen Abteilungen auf SSI und BSI fokussieren sollte. Jedoch spielen auch die klassischen Ausbrucherreger (RSV, Noro-, Rotavirus) eine wichtige Rolle in der Prävention und Kontrolle der Intensivpflegeeinheit. Der Nutzen einer Surveillance nach Entlassung, wenn diese länger als 10 Tage postoperativ stattfindet, wird kontrovers diskutiert. Da NI, die mit der Implantation von Fremdmaterial assoziiert sind, Wochen bis Monate nach der OP manifest werden können, sollten insbesondere diese Komplikationen in der Nachsorge Beachtung finden. Kürzlich ist eine Übersicht zu NI bei kinderkardiologischen Patienten mit operativen Interventionen erschienen, auf die gezielte Interventionen zur Prävention von NI Bezug nehmen können (Dresbach et al. 2009).
Pädiatrisch onkologische Patienten mit Leukämien, hochmalignen Lymphomen oder soliden Tumoren sind auch außerhalb der autologen und allogenen Stammzelltransplantation besonders infektionsgefährdet. Die Grunderkrankung oder deren Therapie (zytotoxische Chemotherapie, Bestrahlung, OP) bedingt eine Patient(en):pädiatrisch onkologischeausgeprägte Störung der Infektionsabwehr (Lehrnbecher et al. 1997, Simon und Hasan 2003, Lehrnbecher et al. 2004, Laws et al. 2005, Lehrnbecher und Laws 2005) und eine vorübergehende hochgradige Beeinträchtigung der Schleimhautbarriere (Mukositis; Tunkel und Sepkowitz 2002, Clarkson et al. 2003, Epstein und Schubert 2003, Wohlschlaeger 2004, Barker et al. 2005). Der am besten gesicherte Risikofaktor ist die Granulozytopenie (Granulozyten < 0,5 × 109/l) deren Dauer mit dem Infektionsrisiko korreliert (Bodey et al. 1966). Bei den meisten pädiatrisch onkologischen Patienten sind dauerhaft implantierte zentrale Venenkatheter vom Typ Port oder Hickman/Broviac in Gebrauch (central venous access device; CVAD; Morrison et al. 1990), die eine spezielle Pflege nach schriftlich fixiertem Standard erfordern (Beutel und Simon 2005, Simon et al. 2008a, Simon et al. 2008b). Hinzu kommen besondere infektionsepidemiologische Gegebenheiten wie z. B. verlängerter Krankenhausaufenthalt während der Induktions- oder der Intensivierungstherapie, häufiger Wechsel zwischen stationärer und ambulanter Behandlung (McCarthy et al. 1998, Friedman et al. 2002, Gaynes 2002, Jarvis 2002, Smith et al. 2002, Jarvis 2004), höheres Risiko der Besiedlung und Infektion mit fakultativ pathogenen (teils multiresistenten) Mikroorganismen (Farr et al. 2001, Gaynes et al. 2005), erhöhte Exposition gegenüber breit wirksamen Antibiotika (Simon et al. 2005), intensive direkte und indirekte soziale Kontakte zwischen den Patienten (Familien) sowie zwischen den Patienten (Familien) und dem Behandlungsteam, spezielle Risiken, z. B. lebensmittelassoziierte Infektionen (Schmid et al. 2008).
Die Mehrzahl der Infektionen bei hochgradig immunsupprimierten Patienten sind endogenen Ursprungs (Gaur 2004, Gaur et al. 2004) und somit eine nur bedingt vermeidbare Konsequenz der Grunderkrankung und deren intensiver Therapie (Risi und Tomascak 1998, Crawford et al. 2004). Gerade deshalb sollten zusätzliche NI – wenn irgend möglich – verhindert werden, die den Krankenhausaufenthalt verlängern, die Behandlungskosten potenzieren und z. T. mit erhöhter Mortalität einhergehen (Grigull et al. 2003, Raymond et al. 2003, Lehrnbecher et al. 2004, Kommission für Krankenhaushygiene und Infektionsprävention beim Robert Koch-Institut [RKI] 2010).
Patienten mit Mukoviszidose (zystische Fibrose, CF) müssen generell vor Atemwegsinfektionen (auch vor RSV! Arnold et al. 1999, Aujard und Fauroux 2002, Meissner 2003), insbesondere jedoch vor einer Infektion mit P. aeruginosa u. a. Nonfermentern wie Burckholderia (B.) Mukoviszidose-Patienten:nosokomiale Infektionen cepacia und Stenotrophomonas (S.) maltophilia, die v. a. in wässrigem Milieu oder im Leitungswasser vorkommen, geschützt werden (Doring et al. 1996, Doring et al. 2000, Doring und Hoiby 2004). Zudem können bereits mit P. aeruginosa sowie anderen gramnegativen (v. a. B. cepacia; Pegues et al. 1996, Coenye et al. 2004) oder grampositiven Erregern (MRSA! Thomas et al. 1998, Miall et al. 2001) infizierte Patienten mit CF selbst Überträger nosokomialer Infektionen sein (Jones und Webb 2003, Campana et al. 2004, Steinkamp et al. 2005). Für die stationäre Behandlung und Betreuung dieser Patienten in der Spezialambulanz sollte ein schriftlich formulierter Hygienestandard vorliegen (Saiman und Siegel 2003, Saiman und Siegel 2004, Vonberg et al. 2004, Vonberg und Gastmeier 2005).
5.13.2. Referenzdaten für NI in der Neonatologie und Pädiatrie?
Für neonatologische und pädiatrische Intensivpflegepatienten und insbesondere für pädiatrisch onkologische Patienten sind eigene Definitionen für NI erforderlich. Bei bestimmten NI-Entitäten, z. B. der beatmungsassoziierten Pneumonie, gibt es in diesen Patientengruppen erhebliche diagnostische Probleme (Simon et al. 2000, Simon et al. 2009).
Das Nationale Referenzzentrum für die Surveillance nosokomialer Infektionen (Gastmeier et al. 1998, Gastmeier et al. 2000, Gastmeier 2004, Gastmeier et al. 2004) hat aus dem ITS-KISS-Modul kumulative Daten von 17 pädiatrischen Intensivstationen (IST) publiziert (Geffers et al. 2009). Die primäre Sepsis ist auf pädiatrischen IST mit einem Anteil von 47 % die häufigste NI-Entität. Das Alter der nosokomial infizierten Kinder beträgt im Median 1 Jahr und die Infektionen entwickeln sich durchschnittlich am Tag 18 des IST-Aufenthalts (Median). 81 % der Infektionen waren zeitlich mit ZVK, Beatmung oder Harnwegskatheter assoziiert. Folgende deviceassoziierte Infektionsraten wurden auf pädiatrischen ITS ermittelt: ZVK-assoziierte Sepsisrate 1998–2907 = 3,16, 2008 = 1,91; beatmungsassoziierte Atemwegsinfektionsrate 1998–2004 = 2,62, 2005–2008 = 2,32; HWK-assoziierte Harnwegsinfektionsrate 1998–2008 = 1,72 (jeweils pro 1.000 Anwendungstage). Die Letalität der NI liegt zwischen 3 % (Harnwegsinfektion) und 7,9 % (Atemwegsinfektion). Die beiden jeweils häufigsten Erreger sind für die primäre Sepsis KNS und S. aureus, für Atemwegsinfektionen P. aeruginosa und Klebsiella spp. und für die Harnwegsinfektionen E. coli und P. aeruginosa. Multiresistente Erreger haben einen Anteil von knapp 5 % an den Erregern von NI auf pädiatrischen ITS (Geffers et al. 2009).
Für neonatologische Intensivpflegepatienten steht das Neo-KISS-Modul bereit (http://www.nrz-hygiene.de/), dessen Interimsergebnisse in regelmäßigen Abständen im Internet publiziert werden. Durch einen Beschluss des Gemeinsamen Bundesausschusses ist für hochspezialisierte neonatologische Intensivbehandlungszentren (NIPS) die Surveillance von NI durch die Kostenträger vorgeschrieben (Gemeinsamer Bundesausschuss gemäß § 91 Abs. 7 SGB V 2005). Dabei ist zu bedenken: Eine Surveillance, die von den Teilnehmern nur als lästige Pflicht verstanden wird, kann nicht zu belastbaren Ergebnissen führen und nutzt weder dem Patienten noch der teilnehmenden Institution. Zur Surveillance von NI in der Pädiatrie sind 2009 Konsensusempfehlungen der DGPI und der DGKH erschienen, die dem Hygienefachpersonal in Kinderkliniken bekannt sein sollten (Simon et al. 2009).
Das Referenzmodul für die Surveillance von NI bei pädiatrisch onkologischen Patienten in Deutschland ist das Oncoped Modul (Simon et al. 2008b), das in Zusammenarbeit mit der Gesellschaft für Pädiatrische Hämatologie und Onkologie (GPOH) und der Deutschen Gesellschaft für pädiatrische Infektiologie (DGPI) entwickelt wurde (Simon et al. 2000, Simon und Fleischhack 2001, Simon et al. 2003, Simon et al. 2005). Quantitativ treten die meisten NI bei pädiatrisch onkologischen Patienten außerhalb der kleinen Gruppe der Patienten auf, die eine Stammzelltransplantation bekommen, obwohl die Inzidenzdichte der NI bei den allogen transplantierten Kindern und Jugendlichen doppelt so hoch ist (Laws et al. 2005). Patienten während der Phase der Granulozytopenie nach Stammzelltransplantation können selbstverständlich auch in das Onko-KISS-Modul des NRZ aufgenommen werden (Dettenkofer et al. 2003, 2005).
Mit dem CVAD können auch dann lebensbedrohliche Infektionen assoziiert sein, wenn keine Granulozytopenie vorliegt (Gorelick et al. 1991, Aledo et al. 1998, Beutel und Simon 2005). Bestimmte Infektionen, wie z. B. die C.-difficile-assoziierte Enterokolitis, werden in mehr als der Hälfte der Fälle erst symptomatisch, wenn die Leukozytenzahl wieder über 1 × 109/l (> 1.000/μl) ansteigt (Simon et al. 1998, Gorschluter et al. 2001, Dettenkofer et al. 2003). Ein erheblicher Teil der invasiven Schimmelpilzinfektionen der Lunge tritt auf, wenn der Patient die akute Phase der Granulozytopenie nach autologer oder allogener Stammzelltransplantation überwunden hat (Tablan et al. 2004, Laws et al. 2005). Epidemische Virusinfektionen (Simon et al. 2008c), wie etwa gastrointestinale Infektionen durch Rotaviren (Rogers et al. 2000, Simon und Fleischhack 2001, Rayani et al. 2007), Noroviren (Simon et al. 2006b, Ludwig et al. 2008, Roddie et al. 2009) sowie Atemwegsinfektionen durch RSV (Simon und Khurana 2003, Simon et al. 2006a) oder das humane Metapneumovirus (HMPV; Pelletier et al. 2002, Wilkesmann et al. 2006a, Wilkesmann et al. 2006b), betreffen auch nicht granulozytopenische Kinder.
5.13.3. Erwartungen des Behandlungsteams an das Hygienefachpersonal
Das in der Regel an internistischen oder chirurgischen Fallbeispielen ausgebildete Hygienefachpersonal ist in pädiatrischen Abteilungen besonders auf die enge Zusammenarbeit mit dem Behandlungsteam angewiesen. Im Einzelfall kann die Zuordnung von NI bei Früh- und Neugeborenen und bei immunsupprimierten Kindern schwierig sein. Daher sollte stets ein Hygienefachpersonal, pädiatrische AbteilungenKonsens in der Beurteilung der nosokomialen Infektionsereignisse zwischen Hygienefachkräften und den behandelnden Kinderärzten angestrebt werden. Die Ergebnisse der Surveillance müssen zeitnah verfügbar sein, aktiv an das Behandlungsteam zurückgemeldet (Gaynes 1997, Gaynes et al. 2001) und vertraulich behandelt werden. Es ist sehr erfreulich, wenn durch die vermehrte Präsenz des Hygienefachpersonals ein intensiver Austausch über alle hygienerelevanten Aspekte der Versorgung entsteht, eine aktive Supervison des Behandlungsteams stattfindet und so der Hawthorne-Effekt (Harbarth et al. 2002) optimal genutzt werden kann (Vandenberghe et al. 2002, Vandenbroucke-Grauls und Schultsz 2002). Undifferenzierte Schuldzuweisungen, wirtschaftlich unvernünftige, nicht kosteneffektive Interventionen oder ein Auftreten mit dem Impetus der Hygienepolizei sind nicht hilfreich. Insbesondere beim Pflegepersonal trifft jedes ernst gemeinte Angebot zur Zusammenarbeit bei der Vermeidung von NI schnell auf Verbündete. Die aktuelle KRINKO-Empfehlung (2009) zum Hygienemanagement muss dazu genutzt werden, die angemessene Verfügbarkeit von Hygienefachpersonal vor Ort einzufordern (Kommission für Krankenhaushygiene und Infektionsprävention beim Robert Koch-Institut Berlin 2009).
5.13.4. Kolonisation ist nicht gleich Infektion
Insbesondere bei „Langliegern“ mit vielen Komplikationen und rezidivierenden Infektionen ist die Unterscheidung zwischen Besiedlung und Infektion entscheidend. Ein Beispiel für eine meist asymptomatische Besiedlung in der Neonatologie sind toxinbildende C. difficile (Gerding et al. 1995, Brook 2005), die im Neugeborenen- und frühen Säuglingsalter von bis zu 60 % der Patienten ausgeschieden werden, jedoch nur extrem selten symptomatische Erkrankungen auslösen (Simon et al. 1998). Das Gleiche gilt für den Nachweis von Clostridium difficile:Besiedlung, NeonatologieBakterien auch von gramnegativen) ohne Zeichen einer Pneumonie im Trachealsekret bei langzeitbeatmeten Frühgeborenen Cordero et al. 1997, 2000).
5.13.5. Katheterassoziierte Blutstrominfektionen
Auch in der neonatologischen und pädiatrischen Intensivmedizin sowie bei pädiatrisch-onkologischen Patienten ist die Mehrzahl aller Blutstrominfektionen (BSI) mit dem Gebrauch von ZVK assoziiert (Simon et al. 2000, Fisher 2001, Shah et al. 2002, Rowin et al. 2003, Beutel und Simon 2005, Shah et al. 2005, Newman 2006, Geffers et al. 2008, 2009). Insbesondere bei den häufigsten in diesem Kontext isolierten Erregern in der Blutkultur, den KNS, ist die Unterscheidung zwischen Kontamination, Katheterkolonisation und Infektion schwierig (Craft und Finer 2001, Weinstein 2003, Weisman 2004, Huang et al. 2006).
Im Zweifelsfall werden symptomatische Patienten mit Nachweis von KNS in der Blutkultur in situ (bei liegendem Katheter) behandelt, weil diese Erreger (im Unterschied zu gramnegativen Erregern und Candida spp.) nicht mit einem erhöhten Mortalitätsrisiko assoziiert sind (Benjamin et al. 2004, Kaufman und Fairchild 2004, Armenian et al. 2005). Lediglich bei wiederholt positiven Blutkulturen wird der Katheter entfernt (Karlowicz et al. 2002). Bei größeren Kindern ist bei Infektionsverdacht auch der Wechsel über einen Führungsdraht möglich, wenn die Eintrittsstelle keine lokalen Infektionszeichen aufweist. Zu den wichtigsten Aspekten der Prävention gefäßkatheterassoziierter Infektionen Tabelle 5.25 . Für kinderonkologische Patienten mit dauerhaft implantierten Kathetern vom Typ Port oder Hickman/Broviac konnte eine signifikante Reduktion katheterassoziierter BSI durch KNS oder MRSE durch routinemäßigen Einsatz einer taurolidinhaltigen antimikrobiellen Blocklösung erreicht werden (Simon et al. 2008a).
Tab. 5.25.
Prävention gefäßkatheterassoziierter Infektionen.
| Kontrollpunkt | Vorgehen |
|---|---|
| Schulung und Ausbildung | Einheitliches Vorgehen nach schriftlich fixiertem Pflegestandard; nur geschultes Personal darf an den ZVK/CVAD1; in speziellen Patientenpopulationen Eltern ausbilden! |
| Antibakterielle Prophylaxe | Antibiotische Prophylaxe nur bei Implantation getunnelter Katheter (eine Gabe, 30 Minuten vorher, z. B. Cefuroxim oder Sultampicillin); keine Vancomycin-Prophylaxe; kein prophylaktischer Antibiotikablock (nur in Ausnahmesituationen); Taurolidin/Zitrat-Block bei CVAD |
| Frühe Infektion nach Anlage2 | Maximale Barrierevorkehrungen (Tuch, Maske, steriler Kittel, Haube); analgosediertes Kind; auch die V. femoralis ist eine zulässige Insertionsstelle; Hautantiseptik mit Octendin bei Säuglingen (später auch PVP-Iod zulässig, aber nicht zu empfehlen); CVAD-Anlage unter aseptischen Kautelen im OP (Vollnarkose) |
| Manipulation am Gefäßkatheter (inklusive Dreiwegehähne, Zuspritzmembranen, nadelfreie Infusionsventile) | Händedesinfektion vor jeder Manipulation; durch gute Arbeitsorganisation; Manipulationen/Diskonnektionen so gering wie möglich halten; sterile Handschuhe und Hubdesinfektion bei jeder Diskonnektion von ZVK; Zahl der Lumina (der Dreiwegehähne) auf das Notwendige begrenzen; kein routinemäßiger Wechsel eines ZVK, aber: Liegedauer begrenzen (jeden nicht mehr benötigten ZVK sofort entfernen) |
| Eintrittsstelle | Keine unsterilen Pflaster an der Eintrittsstelle eines Gefäßkatheters; transparenter Folienverband, Wechsel alle 7 Tage und bei Bedarf; nicht transparentes Pflaster: Wechsel alle 3 Tage und bei Bedarf (täglich mit behandschuhten Finger palpieren); unbedingt gute Zugsicherung (cave: Dislokation); Hautantisepsis lokal mit Octenidin; keine lokalen Antibiotika verwenden (außer Mupirocin bei MRSA). |
| Systemwechsel | Maximal alle 72 Stunden, Ausnahmen Blutprodukte (6 h), Lipidinfusionen (24 h) |
| Kontamination von Infusionslösungen | Aseptische Zubereitung, Mischinfusionen, wenn möglich, unter Reinraumbedingungen in der Apotheke; keine Mehrdosisampullen, die nicht vom Hersteller als solche deklariert sind; kein Heparinflush mit selbst gemischten Lösungen, verteilt auf mehrere Patienten |
CVAD = dauerhaft implantierte (getunnelte) Katheter
Immer radiologische Lagekontrolle nach Anlage. Keine ausreichenden Daten zu antiseptisch imprägnierten Kathetern. Keine Empfehlung für den routinemäßigen Zusatz von Heparin zur Infusionslösung. Keine Empfehlung zum routinemäßigen Einsatz von antibakteriellen Inline-Filtern.
(Auswahl der wichtigsten Kontrollpunkte; Kommission für Krankenhaushygiene und Infektionsprävention 2002, O'Grady et al. 2002, Shah et al. 2002, Trautmann und Krier 2004, de Jonge et al. 2005, Simon et al. 2005)
5.13.6. Zubereitung von Parenteralia
Die von den Herstellern zur Verfügung gestellten Ampullen für Parenteralia sind i. d. R. auf erwachsene Patienten ausgelegt. Wenn bei pädiatrischen und insbesondere bei neonatologischen Patienten alle pharmakologisch stabilen Reste stets verworfen Parenteralia:Zubereitung, pädiatrische Abteilungenwürden, käme es zu einer Vervielfachung des Arzneimitteletats der Kinderkliniken. Daher werden die Erwachsenen-Ampullen in der Pädiatrie oft fraktioniert verabreicht, was eigentlich nicht zulässig ist, da es sich nicht um Mehrdosisampullen handelt. Vor dem Hintergrund der restriktiven rechtlichen Rahmenbedingungen kann das spezielle Vorgehen vor Ort nach sorgfältiger Prüfung der Arbeitsabläufe in einem Konsens zwischen leitenden Ärzten und dem Krankenhaushygieniker des jeweiligen Zentrums schriftlich vereinbart werden, die Verantwortung bleibt jedoch bei den behandelnden Ärzten.
In der Monographie der KRINKO-Arbeitsgruppe neonatologische Intensivmedizin (2007, kann beim RKI im FG 14 bestellt werden) hat sich eine Expertengruppe mit Vorschlägen geäußert, die hierfür Denkanstöße geben, aber nicht rechtsverbindlich sind. Dabei werden prinzipiell drei Kategorien bei der Herstellung von Parenteralia unterschieden:
-
•
Kategorie 1: elektive, planbare zentrale Herstellung in der Klinikapotheke (alle komplexen parenteralen Ernährungslösungen mit einer maximalen Haltbarkeit von 5 Tagen; sterile Standardlösungen aus Glukose und Elektrolytzusätzen, die Parenteralia:Kategorienkontaminationsgeschützt über mehrere Wochen zwischengelagert werden).
-
•
Kategorie 2: dezentrale, am täglichen Bedarf orientierte aseptische Herstellung im Stationsbereich unter Laminar Airflow (LAF) mit besonderen Barrieremaßnahmen (z. B. i. v. applizierbare Antibiotika, die maximal 12 Stunden auf Station zwischengelagert werden dürfen).
-
•
Kategorie 3: unter aseptischen Bedingungen nach sorgfältiger Händedesinfektion und nach Desinfektion der Durchstechmembran frisch aufgezogens Medikament (innerhalb 1 Stunde mit dem venösen Zugang verbinden).
Die Frage, ob die Applikation über einen periphervenösen oder einen zentralvenösen Katheter erfolgt, ist in diesem Kontext unerheblich für die Vorsichtsmaßnahmen bei der aseptischen Zubereitung, da nicht die Lage der Katheterspitze, sondern die Kontamination des Infusats über das Infektionsrisiko entscheidet.
Die zentrale Herstellung in der Apotheke ist ein qualitätsgesicherter Herstellungsprozess, der von speziell geschultem qualifiziertem Fachpersonal in Reinraumklasse A (LAF-Werkbank, umgeben von Reinraumklasse B mit Personalschleuse), durchgeführt wird. Wer Parenteralia als Arzneimittel herstellt, die nicht innerhalb 1 Stunde (aseptisch aufgezogen) verabreicht werden, benötigt hierzu eine behördliche Zulassung (Apothekenverordnung) und unterliegt einer engmaschigen behördlichen Kontrolle der Prozess- und Ergebnisqualität. Es ist erwiesen, dass diese speziellen Voraussetzungen die Rate kontaminierter Parenteralia signifikant senken (Austin und Elia 2009), während die aseptische Zubereitung auf Station (Gruppe 3) mit einer deutlich höheren Kontaminationsrate (bis 10 %) einhergeht (Vonberg und Gastmeier 2007, Stucki et al. 2009).
Unter intensivmedizinisch behandelten Frühgeborenen sind zahlreiche Todesfälle beschrieben (Letalität bis 50 %), die durch Kontamination von Infusionslösungen verursacht wurden. Die in dieser Patientengruppe aus Kostengründen vielerorts übliche unsachgemäße Verteilung von Lösungen aus einer („Mehrdosis“-)Ampulle auf mehrere Patienten potenziert die Konsequenzen jeder Kontamination (Archibald et al. 1998, Tresoldi et al. 2000, Yu et al. 2000, Ganeswire et al. 2003, Macias et al. 2005, Moore et al. 2005). Prinzipiell sind Mehrdosisampullen als solche vom Hersteller deklariert; in der Gebrauchsinformation werden die genauen Lagerungsbedingungen und die Dauer der Haltbarkeit beschrieben. Das Verwenden einer Aspirationshilfe mit Luer-Lock-Anschluss (z. B. Minispike®) macht aus einer Ampulle zur einmaligen, patientenbezogenen Verwendung keine Mehrdosisampulle. Minispikes bieten keine zusätzliche Sicherheit in Bezug auf das Kontaminationsrisiko, sondern sind nach Gebrauch häufig bakteriell kontaminiert (Größenordnung 10–20 %, pers. Kommunikation Dr. Geffers, Prof. Kramer). Auch unter Kategorie-2-Kautelen (LAF auf Station) ist die Verwendung von Durchstechstopfen aus Kunststoff, die vorher sachgerecht desinfiziert werden, aus der Sicht des Kontaminationsrisikos günstiger. Um die Kontaminationsrate i. v. applizierbarer Lösungen möglichst gering zu halten, sollte vor diesem Hintergrund die Zubereitung nach Kategorie 3 die begründete Ausnahme darstellen, sodass nahezu alle erforderlichen Lösungen nach Kategorie 1 oder 2 hergestellt werden.
Ampullen mit Parenteralia sollen bei Zubereitung der i. v. Lösung im Stationsbereich patientenbezogen verwendet werden, da die unsachgemäße Verteilung auf mehrere Patienten das Risiko von Infektionsausbrüchen signifikant erhöht.
5.13.7. Beatmungsassoziierte Pneumonie (VAP)
Aufgrund der Probleme mit der Sensitivität und Spezifität der Erregerdiagnostik sind bislang nur wenige Studien zur VAP bei Kindern publiziert worden (Fayon et al. 1997, Patel et al. 2000, Ferrer und Artigas 2002, Zar und Cotton 2002, Abramczyk et al. 2003, Apisarnthanarak et al. 2003, Baltimore 2003, Elward 2003, Lanotte et al. 2003, Almuneef et al. 2004, Safdar et al. 2005a, Safdar et al. 2005b). In diesem Kontext erfordert auch die Pflege von Tracheostomata bei langzeitbeatmeten Kindern ein eigenes schriftlich fixiertes Konzept (Morar et al. 2000, Morar et al. 2002, Pereira et al. 2004). Zu den verschiedenen Maßnahmen zur VAP-Prävention Tabelle 5.26 .
Tab. 5.26.
Orientierende Hinweise zur Prävention der beatmungsassoziierten Pneumonie.
| Maßnahme | Evidenz Erwachsene | Empfehlung | FG < 1.500 g/ Kinder |
|---|---|---|---|
| Händedesinfektion | IB | Vor (und nach) jedem Kontakt mit Patient, Tubus, Beatmungszubehör oder nach Kontakt mit kontaminierten Gegenständen | Ja |
| Intubationsindikation und -umstände | IB | Vermeidung einer (Re-)Intubation, wenn möglich, nichtinvasive Atemhilfe | Ja |
| Intubationsvorgang | IB | Keimarme Handschuhe,Asepsis | Steriler Tubus, sterile Handschuhe, Asepsis |
| Extubation | IB | Absaugung vor Extubation | Ja |
| Beatmungsfilter | III | Keine Empfehlung | Nein (CO2-Retention) |
| Beatmungsschläuche | IB | Entfernen von Kondenswasser,kein routinemäßiger Wechsel | Ja1 |
| Absaugsystem | 1: IA2. IB3: III | 1. Sterile intratracheale Spüllösung2. Sterile Absaugkatheter bei offenem Absaugen3. Offen vs. geschlossen: unentschieden | 1. Ja2. Ja3. Idem2 |
| Medikamentenvernebler | IA/B | Thermische oder chemische Desinfektion; trockene Lagerung; sterile Medikamente/Stammlösung aus Einzelampullen | Thermische Reinigung; Sterilisation und Sterilgutlagerung3. |
| Wiederaufbereitung von Beatmungszubehör | IB | Thermische Desinfektion; trockene, geschützte Lagerung. | Thermische Vorreinigung; Sterilisation und Sterilgutlagerung3. |
| Lagerung des Patienten | IB | Oberkörperhochlagerung 30–45° | Ja |
| Ernährung | II | Frühzeitige enterale Ernährung | Ja |
| Ernährungssonden frühzeitig entfernen | Ja | ||
| Magensonde Lageprüfung vor jeder Sondierung | Ja | ||
| Stressulkusprophylaxe | III | Verzicht, wenn möglich. | Ja |
Handschuhe tragen, danach Händedesinfektion.
Bei Patienten, die tracheal mit MRE besiedelt sind oder eine Virusinfektion der Atemwege aufweisen, reduziert die geschlossene Absaugung die Umgebungskontamination und die Exposition des Pflegepersonals
Zumindest bei immunsupprimierten Patienten und bei Frühgeborenen
(nach Frau PD Dr. Hentschel, Homburg/Saar)
5.13.8. Virale Erreger nosokomialer Infektionen
Virale Infektionserreger spielen aufgrund der bei pädiatrischen Patienten oft noch fehlenden Immunität eine bedeutende Rolle als Erreger von NI, und zwar auch in den scheinbar gut abgeschirmten Intensivbehandlungseinheiten (Viren:PädiatrieGelber und Ratner 2002, Roe et al. 2003). Besonders zu nennen sind das RSV (Drews et al. 1995, Hall 2000, Simon 2004, Ehlken et al. 2005, Simon et al. 2006a), Influenza- (Slinger und Dennis 2002, Stott et al. 2002, Bridges et al. 2003, Poland et al. 2005), Parainfluenza- (Singh-Naz et al. 1990), Rota- (Berner et al. 1999, Simon 1999, Ratner et al. 2001, Gleizes et al. 2006) und Adenovirus (Birenbaum et al. 1993, Simon und Eis-Hübinger 2003), in hämatologisch-onkologischen Abteilungen auch das gegenüber den routinemäßig eingesetzten Desinfektionsmitteln unempfindliche humane Parvovirus B19 (Bell et al. 1989, Miyamoto et al. 2000).
Eine von 1984 bis 1987 durchgeführte US-Untersuchung fand unter 4.684 NI 23 % virale Infektionen, 25 % aller respiratorischen NI wurden durch RSV, 42 % aller gastrointestinalen NI durch Rotavirus verursacht (Jarvis 1987, Ford-Jones et al. 1989). Auch in einer europäischen Studie waren 22 % aller NI viraler Ätiologie (Raymond und Aujard 2000). In einer Studie zu NI auf einer Neugeborenen-Intensivpflegestation (NICU) der Universitäts-Kinderklinik Freiburg waren 38 % aller nosokomialen Pneumonien RSV-Infektionen (Drews et al. 1995, Berner et al. 2001); 75 % aller viralen Pneumonien bei Richards et al. 1999 (n = 36) entfielen auf RSV (Richards et al. 1999). Somit darf bei der Diagnostik von NI im Kindesalter (auch bei den VAP) nicht auf die gezielte Virusdiagnostik verzichtet werden. Den Patienten werden ggf. a priori unwirksame therapeutische Interventionen zugemutet oder wirksame Interventionen (z. B. Ganciclovir bei CMV-Pneumonie) vorenthalten. Klinische Zeichen unterscheiden nicht spezifisch zwischen viralen und bakteriellen Infektionen. So kann eine RSV-Infektion bei Frühgeborenen mit systemischen Infektionszeichen einhergehen, die nicht von den ersten klinischen Anzeichen einer Sepsis abzugrenzen sind (z. B. gräuliches Hautkolorit, verlängerte Rekapillarisierungszeit, gehäuft auftretende Apnoe-Bradykardie-Episoden; Forster und Schumacher 1995).
Für nosokomiale Virsuinfektionen ist charakteristisch, dass sie leicht auf vergleichsweise gesunde Mitpatienten und auf das Behandlungsteam übertragen werden können, sodass Schwestern und Pfleger, Ärztinnen und Ärzte zum einen selbst erkranken (Agah et al. 1987, Bell et al. 1989), zum anderen zum Vektor der Infektionsübertragung im Krankenhaus werden. So wurden auch nosokomiale Epidemien beschrieben, die langfristig erhebliche Konsequenzen für das Behandlungsteam und die Patienten haben können, wie etwa die Ausbreitung einer Hepatitis C in pädiatrisch onkologischen Abteilungen (Rieske et al. 1998, Widell et al. 1999) oder einer Hepatitis A durch ein mobiles Kind, das wegen seiner Immunsuppression keine spezifischen Symptome einer Hepatitis aufweist (Burkholder et al. 1995).
5.13.9. Problematik der asymptomatischen Ausscheider
Das RSV findet sich bei immunkompetenten Patienten für 1–2 Wochen in den respiratorischen Sekreten, Frühgeborene und andere immungeschwächte Patienten können das Virus über Wochen bis Monate ausscheiden, obwohl sie die Infektion klinisch überwunden haben (Simon und Ausscheider, asymptomatischeKhurana 2003, Simon et al. 2006a). Ähnliches gilt für Influenza- (Weinstock et al. 2003), Rota- und Norovirus (im Stuhl; Eiden et al. 1988, Richardson et al. 1998, Simon et al. 2006b) sowie Adenovirus (in respiratorischen Sekreten bzw. im Stuhl), sodass asymptomatische Kinder zum Überträger viraler Infektionen werden können.
Neben dem nur schwer kontrollierbaren Eintrag der Krankheitserreger durch Eltern und Besucher sind dies Gründe dafür, dass virale NI in der stationären Kinderheilkunde nie vollständig vermieden werden können.
Die verlängerte Ausscheidung macht es erforderlich, die Isolierung bis zur Entlassung fortzuführen oder eine Kontrolle der Virusausscheidung vorzunehmen.
Pädiatrisch-onkologische Patienten, die einmal mit VRE besiedelt oder infiziert waren, scheiden nach jeder erneuten Exposition gegenüber Antibiotika wieder VRE aus, sodass sie während der gesamten intensiven Behandlungsphase isoliert werden müssen (Henning et al. 1996, Singh-Naz et al. 1999, Simon et al. 2004).
5.13.10. Händedesinfektion als wichtigste Barrieremaßnahme
Vor und nach Händedesinfektion:Pädiatrie Händedesinfektion:Neonatologiejedem Kontakt zum Patienten, vor jeder Manipulation an Kathetern, Sonden oder Beatmungssystemen, vor dem Arbeiten im Inkubator, vor der Zubereitung von Medikamenten oder dem Umgang mit Nahrung, nach Kontakt mit potenziell kontaminierten Oberflächen oder Gegenständen und nach dem Toilettenbesuch müssen die Hände einer hygienischen Händedesinfektion unterzogen werden.
Die Händedesinfektion ist mit Abstand die wichtigste und kosteneffektivste Maßnahme der Infektionsprävention in pädiatrischen Behandlungseinheiten. Daher sollte ein erheblicher Anteil aller Bemühungen um Aufklärung und Praxisanleitung (auch der Angehörigen und der Besucher) der Händedesinfektion gewidmet werden. Es müssen patientennah fest montierte Spender in ausreichender Zahl vorhanden sein. Selbstverständlich ist darauf zu achten, dass diese außerhalb der Reichweite von Kleinkindern angebracht sind.
Ein von der DGKH und anderen Fachgesellschaften und Verbänden unterstütztes Projekt des Instituts für Hygiene und öffentliche Gesundheit am Universitätsklinikum Bonn stellt Informationsmaterialien für Patienten und Eltern in leicht verständlicher Form und eingängigem Layout zur Verfügung (http://www.hygiene-tipps-fuer-kids.de/). Zusätzlich zur Informationsbroschüre, die über Basishygieneregeln inklusive Händedesinfektion informiert, sind ansprechend gestaltete Poster zum Thema Händehygiene und Mund-Nasen-Schutz sowie Schulungsmaterialien für Klinikclowns entwickelt worden.
Bei zahlreichen Analysen von Ausbrüchen auf neonatologischen ITS wurden die epidemischen Infektionserreger von den Händen des Personals isoliert (Levin et al. 1998, Harbarth et al. 1999, Gupta 2002, Ganeswire et al. 2003, Milisavljevic et al. 2004, Pessoa-Silva et al. 2004). Das unterstreicht die herausragende Bedeutung der Händehygiene (Kommission für Krankenhaushygiene und Infektionsprävention beim Robert Koch-Institut 2000, Neely und Toltzis 2001, Boyce und Pittet 2002) zur Prävention der Ausbreitung von MRE (Noskin et al. 1995, Farr et al. 2001, Jarvis 2004, Wendt et al. 2004). Bei einigen dieser Ausbrüche spielten künstliche Fingernägel als Vektor der Übertragung von Pseudomonas spp. oder multiresistenten Klebsiella spp. eine wichtige Rolle (Foca et al. 2000, Moolenaar et al. 2000, Gupta et al. 2004, Kennedy et al. 2004).
Neben bakteriellen Erregern werden auch Viren (Hall 2000, Cox et al. 2001, Gelber und Ratner 2002, Sharma et al. 2002, Widdowson et al. 2002) und Candida spp. (Fowler et al. 1998, Huang et al. 1998, Levin et al. 1998, Huang et al. 1999, Lupetti et al. 2002, Borderon et al. 2003, Roilides et al. 2003) vorwiegend über die Hände des Pflegepersonals, der behandelnden Ärzte und weiterer Kontaktpersonen übertragen (Moore 2004). Die Händedesinfektion ist keineswegs nur dann notwendig, wenn eine sichtbare Kontamination der Hände möglich oder erfolgt ist (Wendt et al. 2004). Durch intensivierte Schulung und Supervision kann eine „Kultur der selbstverständlichen Händedesinfektion“ erzeugt und die Compliance beim Behandlungsteam verbessert werden; der Einsatz zusätzlicher Ressourcen zur Verbesserung der Compliance (Wendt 2004) bei der Händedesinfektion ist kosteneffektiv (Pittet 2000, Pittet et al. 2000, Posfay-Barbe und Pittet 2001, Pittet et al. 2004, Pittet et al. 2004).
Dabei ist zu beachten, dass die Technik der Händedesinfektion heute nicht mehr strikt vorgegeben wird (6 Schritte), sofern die individuelle Technik zu einer (z. B. mit UV-Licht) überprüften kompletten Benetzung der Hände führt. Mitarbeiter in verantwortlicher Position (Schichtleitung, Stationsleitung, Ärzte) müssen mit gutem Beispiel vorangehen und ihre Kollegen zu einer guten klinischen Praxis der Händehygiene zum Schutz der Patienten und des Personals motivieren.
5.13.11. Einmalhandschuhe und Schutzkittel
EinmalhandschuheEinmalhandschuhe sind zum Schutz des Personals immer dann erforderlich, wenn ein direkter Kontakt mit potenziell infektiösen Materialien (Speichel, Blut, Urin, Liquor, Stuhl) wahrscheinlich ist.
Insbesondere beim Wechseln der Windeln müssen prinzipiell zusätzlich zur hygienischen Händedesinfektion Einmalhandschuhe getragen werden, unter anderem, weil auch asymptomatische Kinder jeden Alters pathogene Viren und andere Krankheitserreger ausscheiden können (Eiden et al. 1988, Richardson et al. 1998, Matson und Szucs 2003Einmalhandschuhe:Neonatologie). Den Eltern ist zu erklären, dass diese besondere Maßnahme im Einmalhandschuhe:PädiatrieKrankenhaus zwingend erforderlich ist.
Auch nach dem Gebrauch von Einmalhandschuhen ist eine hygienische Händedesinfektion erforderlich (Kommission für Krankenhaushygiene und Infektionsprävention beim Robert Koch-Institut 2000). Der Gebrauch von Einmalhandschuhen ist eine wichtige Maßnahme zur Eindämmung der Übertragung von Krankheitserregern, die eine verminderte Empfindlichkeit gegenüber herkömmlichen Händedesinfektionsmitteln aufweisen, z. B. humanes Parvovirus B19 (Bell et al. 1989, Naides 1989, Crowcroft et al. 1999, Miyamoto et al. 2000), Norovirus (Matson u. Szucs 2003, Gehrke et al. 2004, Hota 2004), C. difficile (Simon et al. 1998, Langley et al. 2002, Cartolano et al. 2003, Tang et al. 2005).
Das generelle Anlegen eines Schutzkittels (Personal oder Besucher) trägt nicht zur Vermeidung nosokomialer Infektionen bei (Agbayani et al. 1981, Cloney und Donowitz 1986, Donowitz 1986, Oliver 1994, Pelke et al. 1994, Webster und Pritchard 2003) und verbessert nicht die Compliance der hygienischen Händedesinfektion (Golan et al. 2006).
Schutzkittel sollen ausschließlich patientenbezogen zur Eindämmung bestimmter übertragbarer Infektionserreger (Madge et al. 1992, Gelber und Ratner 2002, Singh 2004, Singh et al. 2005, Gerber et al. 2006), generell bei der Pflege des Frühgeborenen außerhalb des Inkubators und bei der Pflege Schutzkittelhochgradig immunsupprimierter Patienten getragen werden (Simon 2001).
5.13.12. Anteil von Isolierzimmern
Der Bedarf an Zimmern zur Einzelzimmerisolierung von Patienten mit kontagiösen Erkrankungen folgt der Saisonalität von Atemwegsinfektionen und Gastroenteritiden. In den Wintermonaten muss daher damit gerechnet werden, dass 30 % der Patienten aus Gründen der Infektionsprävention einzeln oder in einer Kohorte Isolierzimmer, pädiatrische Stationenisoliert werden müssen (Langley et al. 1994). Andernfalls sind erhebliche Verluste durch gesperrte Betten in Mehrbettzimmern zu befürchten. Pro 10 Intensivbehandlungsplätze sollte ein Behandlungszimmer vorgehalten werden, in dem eine Intensivtherapie bei Patienten mit aerogen übertragbarer Infektion (Masern, Varizellen, Tuberkulose, mit Einschränkung auch Influenza) möglich ist (Schleuse, Unterdruck). Zentren, die pädiatrisch-onkologische Patienten oder Kinder nach Organtransplantationen behandeln, sollten zudem im Intensivbereich eine Möglichkeit der protektiven Einzelzimmerisolierung hochgradig immunsupprimierter Patienten vorhalten (Kommission für Krankenhaushygiene und Infektionsprävention beim Robert Koch-Institut [RKI] 2010).
5.13.13. Sicherheit und Versorgungsqualität bei Einzelzimmerisolierung
Dass ein Kind wegen einer Besiedlung oder Infektion mit einem kontagiösen Erreger in einem Einzelzimmer isoliert werden muss, darf nicht eine Verschlechterung der klinischen Überwachung oder der medizinischen Versorgung insgesamt nach sich ziehen (Kirkland und Weinstein 1999, EinzelzimmerisolierungStelfox et al. 2003, Safdar und Maki 2004).
Hierzu sind bei Kindern z. B. Überwachungsmonitore und Pulsoxymeter in ausreichender Zahl vorzuhalten. Das resultiert auch in einem signifikant erhöhten Personalbedarf in pädiatrischen Einheiten. Ungünstige psychosoziale Konsequenzen der Einzelzimmerisolierung sind insbesondere bei mobilen Kleinkindern und ihren Familien von erheblicher Relevanz. Eine angemessene Ausstattung von Isolierzimmern (Telefon, Fernseher, ggf. desinfizierbare Spielmatte, Spielzeug) ist zu empfehlen. Die Stigmatisierung der Patienten kann vermieden werden, indem das Zimmer statt mit einem Warnhinweis („Ansteckende Erkrankung“) mit einem Informationsblatt „Intensivpflege“ gekennzeichnet wird, auf dem die notwendigen Barrieremaßnahmen hervorgehoben werden.
5.13.14. Spielzeug
Auch Spielzeug kann zum Vektor von NI werden und sollte daher entweder desinfizierbar sein und zwischen den Patienten desinfiziert oder nur von beaufsichtigten Kindern genutzt werden, die zu einer ggf. assistierten Händedesinfektion in der Lage sind (Zimakoff et al. 1983, Akhter et al. 1995, Buttery et al. Spielzeug1998, Rogers et al. 2000, Hicks et al. 2003).
Hier gerät man naturgemäß in einen Konflikt mit der Lebensqualität der Kinder. Kinder, die wegen ansteckender Erkrankungen isoliert werden müssen, sollten ggf. ihr eigenes Spielzeug von zu Hause mitbringen dürfen. Auch die Bedienkonsolen von Fernsehern, Notebooks und Videospielen sind in den Desinfektionsplan einzubeziehen (Neely 2000, Neely und Maley 2001, Neely und Sittig 2002, Rutala et al. 2006).
5.13.15. Besucherregelung
Schwer erkrankte Patienten mit längerem stationärem Aufenthalt und ihre Familien befinden sich in einer akuten psychischen Belastungssituation. Meist empfinden sie den Besuch durch Angehörige, Freunde, Geschwisterkinder usw. Pädiatrie:Besucherregelungals Lichtblick und Unterstützung. Besuche sind daher in den Neonatologie:Besucherregelunghierfür vorgesehenen Zeiten erwünscht. Lediglich in wenigen speziellen Behandlungssituationen wie z. B. in der akuten Phase einer allogenen Stammzelltransplantation (SCT) ist ein restriktiveres Vorgehen aufgrund der lang anhaltenden hochgradigen Immunsuppression erforderlich.
Auf die besondere Bedeutung und die korrekte Durchführung der Händedesinfektion sind die Angehörigen und jeder Besucher so früh wie möglich hinzuweisen (auch Ablegen von Schmuck und Uhren, die sich an Fingern, Händen und Unterarmen befinden; s. http://www.hygiene-tipps-fuer-kids.de/).
Die schriftlich vom Behandlungsteam festgelegte Besucherregelung sollte erläutern, dass von bestimmten Erkrankungen, die sich zum Zeitpunkt des Besuchs möglicherweise noch in Inkubation befinden (Windpocken, Masern, Pertussis, aber auch RSV, Influenza), besondere Gefahren für die Patienten ausgehen und wie wichtig die vollständige und ggf. geboosterte Immunisierung der Angehörigen (Kinder nach STIKO-Empfehlung) für den Patienten sein kann (Herdenimmunität; Krause et al. 1994, Weber et al. 1996, Tennenberg et al. 1997, Russell und Henderson 2003, McIntosh 2005, Poland et al. 2005, Uckay et al. 2005, Boulay et al. 2006).
Angehörige/Besucher mit Zeichen einer akuten Infektion (Fieber, Diarrhö, Atemwegsinfektion mit Husten und Fließschnupfen, unklares Exanthem, Konjunktivitis) sollten von einem Besuch ausgeschlossen werden. Je enger und offener die Kommunikation zwischen Behandlungsteam und Angehörigen ist, desto eher werden die Kontaktpersonen sich vorab erkundigen („Es ist Scharlach im Kindergarten. Was sollen wir tun?“). Ein Herpes labialis muss durch einen korrekt angelegten Mund-Nasen-Schutz bedeckt sein und darf nicht mit den Händen berührt werden (Händedesinfektion!). Kinder müssen sich in unmittelbarer Nähe der Eltern aufhalten und von den Eltern (nicht vom Pflegepersonal) beaufsichtigt werden.
Ein orientierendes „klinisches Screening“ aller Kinder vor Betreten der Station wird vielerorts vereinbart. Wenn die Eltern verstanden haben (bei erkennbaren Barrieren ist eine muttersprachliche Übersetzung unbedingt notwendig), wie sie sich verhalten müssen, und im Zweifelsfall das Behandlungsteam vorab konsultieren, ist ein solches Screening nicht erforderlich.
5.13.16. Küchenhygiene
In Stationsküchen von Kinderkrankenhäusern, in denen Lebensmittel zubereitet oder portioniert werden, bestehen besondere Infektionsrisiken (Nassauer und Kommission für Krankenhaushygiene und Infektionsprävention am Robert Koch-Institut 2006). Bei jeder Zubereitung von Speisen für Patienten sind die Küchenhygiene:Kinderkrankenhäuserhygienischen Regeln der Herstellung und Zubereitung von Lebensmitteln besonders zu beachten, da erkrankte, mitunter immungeschwächte Menschen zu versorgen sind und kontaminierte Lebensmittel einen Ausbruch auslösen können. Bei Kindern mit speziellen Stoffwechselerkrankungen (z. B. Diabetes mellitus) und bei pädiatrisch-onkologischen Patienten kann Eltern der Zutritt zur Stationsküche gewährt werden, weil z. B. Steroide Heißhunger auch außerhalb der Essenszeiten verursachen, mitunter eine Gewichtsabnahme unbedingt zu vermeiden und der Essensplan den Bedürfnissen des Kindes anzupassen ist (Schmid et al. 2008). Die Eltern müssen in die Grundregeln der Küchenhygiene aktiv eingewiesen und supervidiert werden, bis sie den praktischen Ablauf verstanden haben.
5.13.17. Umgang mit Muttermilch und mit Formulanahrung
Muttermilch kann bakterielle und virale Krankheitserreger enthalten und zum Vektor von Infektionen für das Neugeborene oder für das Personal werden. Beim Umgang mit Muttermilch ist eine Kontamination der Hände des Pflegepersonals möglich (Koletzko und Ernährungskommission der Deutschen Gesellschaft für MuttermilchKinderheilkunde und Jugendmedizin 2004). Das gilt auch für die Verabreichung von Muttermilch oder Formulanahrung über eine Magensonde mit Hilfe von Einmalspritzen (Berthelot et al. 2001).
Wird Muttermilch mit speziellen Zusätzen supplementiert, sollte durch einen vom Hygienefachpersonal überprüften und regelmäßig supervidierten Ablaufplan gewährleistet sein, dass keine Kontamination der Muttermilch erfolgt (Berthelot et al. 1999).
Vor und nach jedem Kontakt mit Muttermilch (auch vor und nach dem Abpumpen) muss eine Händedesinfektion durchgeführt werden. Zusätzlich wird dem Behandlungsteam empfohlen, bei möglichem Handkontakt zu Muttermilch Einmalhandschuhe zu tragen. Zur Pasteurisierung von Muttermilch CMV-seropositiver Mütter, die Frühgeborenen unter einem Gestationsalter von 32 SSW (< 1.500 g Geburtsgewicht) verabreicht werden soll, kann derzeit keine evidenzbasierte Empfehlung abgegeben werden, sodass vor Ort die verschiedenen Optionen vom Behandlungsteam abgewogen werden müssen (Vorschlag ![]() Online-Ergänzung 5.13).
Online-Ergänzung 5.13).
In Pulverform vom Hersteller gelieferte Formulanahrung für Neugeborene ist nicht steril, sondern kann bei Einhaltung der Richt- und Warnwerte mit grampositiven und gramnegativen Bakterien kontaminiert sein (Rowan et al. 1997, Roy et al. 2005). Besonders kritisch ist in diesem Zusammenhang die Kontamination der Formulanahrung mit Enterobacter (E.) sakazakii (Simmons et al. 1989, Clark et al. 1990, Nazarowec-White und Farber 1997), der durch seine Temperaturtoleranz den Herstellungsprozess überlebt (Nazarowec-White und Farber 1997, Weir 2002, Edelson-Mammel et al. 2005, Gurtler et al. 2005). In nahezu 50 publizierten Fällen einer mit Enterobacter sakazakiiFormulanahrung assoziierten Infektion durch E. sakazakii zeigte sich eine hohe Rate septischer Infektionen mit Meningitis, Hirnabszess (Weir 2002) und nekrotisierender Enterokolitis (NEC; van Acker et al. 2001) mit einer Letalität zwischen 30 und 80 % (Nazarowec-White und Farber 1997, Agostoni et al. 2004) und schweren neurologischen Beeinträchtigungen bei den überlebenden Kindern (Centers for Disease Control and Prevention 2002).
Möglicherweise erhöht auch die praktisch nicht zu vermeidende Kontamination der Pulvernahrung mit Sporen von B. cereus das Infektionsrisiko, wobei septische Infektionen durch B. cereus eine Rarität darstellen (Gray et al. 1999, Girisch et al. 2003, Hilliard et al. 2003, Heep et al. 2004) und über mit Formulanahrung assoziierte B.-cereus-Ausbrüche bislang nicht berichtet wurde (Van Bacillus cereus:Formulanahrungder Zwet et al. 2000).
Auch bei sorgfältiger Einhaltung des Hygieneplans in der Milchküche kann somit die dort zubereitete Formulanahrung primär kontaminiert sein. Die Kontamination von Formulanahrung mit bakteriellen Krankheitserregern trägt zu Nahrungsunverträglichkeiten und damit zur Hygieneplan:MilchkücheVerzögerung des enteralen Nahrungsaufbaus bei (Mehall et al. 2002b). Sie wurde in Milchküche:Hygieneplaneiner Studie mit vier Fällen einer NEC in Verbindung gebracht, wobei die diesen Kindern verabreichte Formulanahrung mit mehr als 105 KbE/ml gramnegativen Erregern kontaminiert war (Mehall et al. 2002a). Bei Ausbrüchen auf neonatologischen Intensivpflegestationen mit (teils multiresistenten) Erregern wie Klebsiella (K.) oxytoca (Berthelot et al. 2001), Serratia (S.) marcescens (Berthelot et al. 1999) und MRSA (Mehall et al. 2002a) stellte die Ernährung des Frühgeborenen über eine Magensonde einen unabhängigen Risikofaktor für die Kolonisation oder Infektion dar. DieseSerratia marcescens, Formulanahrung und andere Studien (Carneiro et al. 2003) zeigen, dass neben der Klebsiella oxytoca:Formulanahrungprimären Kontamination des Industrieprodukts und der Kontamination bei der Zubereitung insbesondere auch der unsachgemäße Umgang mit Formulanahrung (Transport, Lagerung, Zusatz von Fortifiern1 , Erwärmung, Lagerung in erwärmtem Zustand, Verabreichung) auf der NICU in kritischer Weise zur Kontamination des Produkts beitragen kann. Auch steril vom Hersteller gelieferte Flüssignahrung für Frühgeborene bietet daher keinen vollständigen Schutz.
Die European Society for Paediatric Gastroenterology, Hepatology and Nutrition (Agostoni et al. 2004), die Ernährungskommission der Deutschen Gesellschaft für Kinderheilkunde und Jugendmedizin (Koletzko und Ernährungskommission der Deutschen Gesellschaft für Kinderheilkunde und Jugendmedizin 2004) und die Österreichische Gesellschaft für Kinder und Jugendheilkunde (von Schnakenburg und Zoubek 2005, Zwiauer 2005) haben auf diese Problematik mit aktuellen Empfehlungen reagiert, die im Wesentlichen folgende Punkte enthalten:
-
•
schriftliche Leitlinie, deren Einhaltung überwacht wird,
-
•
Einsatz von speziell geschultem, betriebsärztlich überwachtem Personal,
-
•
Gebrauch steriler, portionierter Flüssignahrung für Frühgeborene,
-
•
täglich frische Zubereitung, Lagerung bei 4 °C maximal 4 Stunden bei Raumtemperatur,
-
•
angebrochene, aus der Kühlkette genommene Gebinde verwerfen.
Bislang ist ungeklärt, ob ein Erwärmen der in der Regel bei 4 °C für maximal 24 Stunden gelagerten Nahrung über Raumtemperatur überhaupt notwendig ist. In der Praxis ist es mitunter üblich, vorbereitete Formulanahrung:EmpfehlungenSpritzen für die Sondenernährung im Inkubator vorzuwärmen; das ist abzulehnen, da so das Kontaminationsrisiko mit Erregern aus der unmittelbaren Umgebung des Kindes (auch aus dem Windelbereich) erhöht wird. In den o. g. Empfehlungen der europäischen Fachgesellschaften wird eine maximale Aufbewahrung (Synonym: Verabreichungszeit) bei Raumtemperatur von 4 Stunden angegeben (Agostoni et al. 2004). Dem entsprechen auch die Empfehlungen der CDC (2002). Diese Empfehlung ist nicht zu verwechseln mit der Praxis, angebrochene Nahrung in einer Warmhalteapparatur bis zur nächsten „Sondierungsrunde“ (meist alle 3–4 Stunden) vorzuhalten. Selbst für die Betreuung von gesunden Neugeborenen zu Hause wird der Gebrauch von Warmhalteapparaturen mit oder ohne Wasserbad für fertig zubereitete Säuglingsnahrung abgelehnt (Agostoni et al. 2004).
Das Aufwärmen der Muttermilch oder Formulanahrung im Milchwärmer auf 28–37 °C (Temperaturoptimum der meisten Erreger) schafft ideale Voraussetzungen für ein exponenzielles Bakterienwachstum.
Wasserbäder zum Aufwärmen von Milchflaschen Formulanahrung\"\r\"formulanahrungkönnen mit gramnegativen Feuchtkeimen (Pseudomonas spp., Klebsiella spp., Acinetobacter spp.) kontaminiert sein und sind daher obsolet.
5.13.18. Isolierung bei Kinderkrankheiten
Einige im Krankenhaus behandelte Kinder sind gegen klassische Kinderkrankheiten weder immunisiert noch haben sie diese bereits durchgemacht. Mitunter sind diese Krankheiten bereits während der Isolierung:KinderkrankheitenInkubationszeit ansteckend und hoch kontagiös. Als Hilfe für die Praxis sind Kinderkrankheiten:Isolierungeinige Aspekte dieser Thematik zusammengefasst (Tab. 5.27 ).nosokomiale Infektion(en):Neonatologie\"\r\"Neugeboreneninf
Tab. 5.27.
Orientierende Hinweise zu Kinderkrankheiten (Auswahl) für das Hygienefachpersonal.Rotaviren:KinderPneumonie(n):KinderPneumonie(n):bakterielle, kindlichePertussisParvovirus-B19-Infektion(en):KinderMumps:KinderMononukleose, infektiöse, KinderMeningokokkensepsis, KinderMeningokokkenmeningitis, KinderMasern:KinderKrupp-HustenKinderkrankheitenKeuchhusten\t\"Siehe PertussisInfluenza:KinderHydrops fetalisGastroenteritis, KinderBronchitis, Kinder
| Erreger | Erkrankung | Inkubations-zeit | Ansteckungsweg | Dauer der Kontagiosiät | Isolierung1 |
|---|---|---|---|---|---|
| Bakterielle Pneumonieerreger | Pneumonie | 3–5 Tage | Tröpfcheninfektion | Bis 24 Stunden nach Beginn einer klinisch wirksamen antibakteriellen Therapie | EinzelzimmerKittel, Handschuhe (Sekrete), Mund-Nasen-Schutz bei engem Kontakt (< 1,5 m) |
| Bordetella pertussis | KeuchhustenPertussis | 7–20 Tage (meist < 10 Tage) | Tröpfcheninfektion | Beginnt am Ende der Inkubationszeit, erreicht ihren Höhepunkt während der ersten beiden Wochen der Erkrankung (Stadium catarrhale) und klingt dann allmählich ab (insgesamt etwa 3 Wochen)Bei Durchführung einer antibiotischen Therapie verkürzt sich die Dauer der Ansteckungsfähigkeit auf etwa 5 Tage nach Beginn der Therapie | Einzelzimmer, KontaktisolierungMund-Nasen-Schutz bei engem Kontakt (< 1,5 m)Auch immune Menschen können B. pertussis übertragen!Im Einzelfall Postexpositionsprophylaxe mit Makroliden |
| Epstein-Barr-Virus | Pfeiffer-DrüsenfieberInfektiöse Mononukleose | 4–7 Wochen | Tröpfcheninfektionenger Kontakt„kissing disease“ | Bei EBV-Ausscheidern lebenslang(Speichel, Zervixsekret) | StandardhygieneAuf Station Kontakt mit Kindern vermeiden, bei denen ein primärer oder erworbener Immundefekt vorliegt (z. B. Wiskott-Aldrich-Syndrom, Severe Combined Immunodeficieny, HIV-Patienten) |
| Influenzavirus | Influenza | 1–3 Tage | Überwiegend durch Tröpfchen, (> 5 μm), nach einzelnen Publikationen auch aerogen.Kontakt der Hände zu kontaminierten Oberflächen und anschließendem Hand-Mund-/Hand-Nasen-Kontakt | Beginnt < 24 Stunden vor Auftreten der klinischen Symptomatik und besteht danach gewöhnlich für 3–5 TageKleine Kinder und Immunsupprimierte können das Virus früher und für längere Zeit (> 1 Woche) ausscheiden.Bei Verbleib im Krankenhaus aus anderen Gründen: PCR einmal pro Woche wiederholen bis negativ | Einzelzimmer, Kittel, Handschuhe (Sekrete), Mund-Nasen-Schutz bei engem Kontakt (< 1,5 m) |
| Masernvirus1 | Masern | 8–10 Tage bis zu den Prodromi14 Tage bis zum Exanthem | AerogenTröpfcheninfektion | 5 Tage vor bis 7 Tage nach Auftreten des Exanthems | Einzelzimmer mit Schleuse (es darf nur jeweils eine von beiden Türen geöffnet werden)Falls vorhanden Unterdruckbelüftung |
| Mumpsvirus | Parotitis epidemica | 12–25 Tage | Tröpfcheninfektion(Speichel) | 7 Tage vor bis 9 Tage nach Auftreten der Parotisschwellung | Einzelzimmer, Kontaktisolierung (Zusammenlegung mit zweimal geimpften, immungesunden Kindern möglich) |
| Neisseria meningitidis | MeningokokkenmeningitisMeningokokkensepsis | 1–4 (–10) Tage | Tröpfcheninfektion | Bis 48 Stunden nach Beginn einer wirksamen intravenösen antibakteriellen Therapie.Eine Penicillintherapie führt vermutlich nur zu einer Suppression, aber nicht zu einer Eradikation der nasopharyngealen Meningokokken (Rifampicin zusetzen!) | EinzelzimmerKittel, Handschuhe (Sekrete), Mund-Nasen-Schutz bei engem Kontakt (< 1,5 m)Bei ausgedehnten Hautläsionen im Anschluss protektive Isolierung wie bei VerbrühungspatientenUmgebungsprophylaxe mit Rifampicin oder Ciprofloxacin! |
| Norovirus | Gastroenteritis | 10–50 Stundenh | Fäkal-oral oder durch Bildung virushaltiger Aerosole während des Erbrechens | In der Regel 7–14 Tage, in Ausnahmefällen aber auch mehrere Wochen.Bei Verbleib im Krankenhaus aus anderen Gründen: PCR einmal pro Woche wiederholen bis negativ | Einzelzimmer oder KohortenisolierungHändedesinfektionsmittel mit norovirozider Wirksamkeit, Kittel, Handschuhe, Mund-Nasen-SchutzWindeln sofort entsorgen. Umgebungsdesinfektion |
| Parvovirus B19 | RingelrötelnHydrops fetalisTransiente aplastische Krise (Anämie) | 4–28 Tage | TröpfcheninfektionBlut(produkte)hohe Tenazität! | 2 Tage vor Ausbruch des Exanthems am größten.Bis zum Ende der klinischen Erkrankung | Einzelzimmer v. a. für immunsupprimierte Kinder oder Kinder mit aplastischer Krise bei angeborenen HämatopathienHandschuhe, Kittel, Händewaschen (zusätzlich zur Händedesinfektion) |
| Respiratory Syncytial VirusAnalog: humanes Metapneumovirus (HMPV) | Krupp-HustenBronchitisPneumonie | 2–5 Tage | Tröpfcheninfektion (auch über Gegenstände!) | Immunkompetente Kinder:7 Tage. Immungeschwächte Patienten: bis mehrere Wochen.Bei Verbleib im Krankenhaus aus anderen Gründen: Antigentest einmal pro Woche wiederholen bis negativ | Einzelzimmer oder KohortenisolierungKittel, Handschuhe, Mund-Nasen-Schutz |
| Rotavirus | Gastroenteritis | 1–3 Tage | Fäkal-oral | Bis zum Ende der klinischen Symptomatik, mindestens jedoch 1 Woche.Bei Verbleib im Krankenhaus aus anderen Gründen: Antigentest einmal pro Woche wiederholen bis negativ | Einzelzimmer oder Kohortenisolierung. Kittel, Handschuhe, Windeln sofort entsorgen, Umgebungsdesinfektion |
| Varicella-Zoster-Virus2 | WindpockenHerpes zoster | 14–21 Tage | AerogenTröpfcheninfektion | 3 Tage vor Ausbruch des Exanthems bis ca. 7 Tage nach Auftreten der ersten Bläschen (alle Läsionen verkrustet)Abwehrgeschwächte Patienten mit protrahierten Varizellen sind kontagiös, solange neue Läsionen auftreten bzw. bis alle Läsionen verkrustet sind | Einzelzimmer mit Schleuse (es darf nur jeweils eine von beiden Türen geöffnet werden), falls vorhanden: UnterdruckbelüftungDas „Auslüften“ in der Schleuse ist obsolet |
Prinzipiell sollte dem Behandlungsteam der eigene Immun-/Immunisierungsstatus bekannt sein (Betriebsärztliche Untersuchung). Das gilt in pädiatrischen Behandlungseinheiten für Masern, Mumps Röteln, Diphtherie, Tetanus, Varizellen, Parvovirus B19, EBV und CMV sowie für HIV, Hepatitis A, B und C und für Tbk (GT10).
Prophylaxe nach Exposition durch Inkubationsimpfung (nur immunkompetente Kinder!) oder Aciclovir und ggf. Hyperimmunglobulin (VZV; Inkubationsimpfung [nur immunkompetente Kinder!]) oder Standardimmunglobulin (0,5 g/kg einmalig).
(Garner 1996, Richardson et al. 2001, Robert Koch-Institut 2001, Siegel 2002, Musher 2003, Weinstock et al. 2004)
5.14. HNO-Heilkunde
nosokomiale Infektion(en):Pädiatrie\"\r\"NeugeboreneninfHorst Luckhaupt
Auch in der HNO-Heilkunde sind die wichtigsten Maßnahmen zur Infektionsprävention die Etablierung und konsequente Einhaltung der Standardhygienemaßnahmen.
Im Pädiatrie:nosokomiale Infektion(en)\"\r\"NeugeboreneninfWesentlichen befassen sich diese mit Verhaltensregeln bei Kontakt mit Blut, allen Neonatologie:nosokomiale Infektion(en)\"\r\"NeugeboreneninfKörperflüssigkeiten, Sekreten, nicht intakter Haut und Schleimhäuten (Mlangeni und Daschner 2004). Nachfolgend werden klinisch praktisch wichtige Aspekte der Hygiene und des Infektionsschutzes im HNO-Bereich dargestellt.
5.14.1. Nosokomiale HNO-Infektionen
Septumabszess nach rhinochirurgischen Eingriffen, Otitis media acuta nach länger liegender vorderer oder hinterer Nasentamponade (aufsteigende Infektion via Tuba Eustachii), Ohrmuschel-HNO-Infektionen, nosokomialePerichondritis nach Ohr-OP, nosokomiale Sinusitis (Intensivmedizin!) und infiziertes nosokomiale Infektion(en):HNO-HeilkundeTracheostoma sind mögliche NI im HNO-Gebiet. Bei Einhaltung der Hygienemaßnahmen und rationalem Einsatz von Antibiotika werden derartige Infektionen bis auf das infizierte Tracheostoma heutzutage in HNO-Kliniken nur sehr selten beobachtet.
Auf Intensivstationen werden bei Patienten mit nasotrachealer Intubation und nasogastralen Sonden gelegentlich nosokomiale Nasennebenhöhlenentzündungen beobachtet. Hier sollte in jedem Fall ein Erregernachweis, z. B. durch endoskopisch gewonnenen Abstrich aus dem mittleren Nasengang oder Punktion von geeignetem Material aus der Kieferhöhle, angestrebt werden. Neben typischen Sinusitiserregern wie S. Nasennebenhöhlenentzündungen, nosokomiale pneumoniae, H. influenzae und M. catarrhalis muss bei Patienten mit nosokomialer Sinusitis auch mit gramnegativen Bakterien, Anaerobiern und selten mit Pilzen gerechnet werden (Luckhaupt 1996). Die Therapie umfasst abschwellende Maßnahmen und eine gezielte antibakterielle und/oder antimykotische Behandlung bei therapierefraktärem Verlauf oder Komplikationen, ggf. auch operative Eingriffe an den Nasennebenhöhlen.
In den 1990er Jahren wurde die Häufigkeit von Krankenhausinfektionen in HNO-Abteilungen mit 0,5–0,9 % angegeben (Schu 1992). In einer prospektiven Studie wurde in einer Klinik für Kopf- und Halschirurgie eine deutlich höhere Prävalenz von 15,4 % ermittelt, davon 9,2 % SSI (Vossing et al. 1996). Bei ausgedehnter Tumorchirurgie betrug die Prävalenz von SSI 50,5 % (Penel et al. 2004).
5.14.2. Tracheostoma
Besondere klinische Bedeutung kommt der sachgerechten Behandlung von Tracheostomata zu, sowohl bei Patienten mit temporärer als auch solchen mit permanenter Tracheostomie und nach Laryngektomie. Die Tracheostomie ist ein invasiver Eingriff, der die Trachealschleimhaut in ihrer TracheostomaAbwehrfunktion beeinträchtigt; wesentliche klinische Bedeutung kommt auch einem möglichen Sekretstau zu.
Alle Manipulationen am Tracheostoma sind unter aseptischen Bedingungen durchzuführen.
Maßnahmen am Stoma sind immer kontaminationsanfällig, insbesondere in den ersten Tagen nach Tracheostomie. Hierzu zählen auch das Sauber- und Trockenhalten der Wundränder.
Bei Patienten mit Tracheostoma wird der Verband nach Händedesinfektion mit einer Pinzette entfernt. Falls erforderlich, wird abgesaugt. Die Luftröhrenkanüle wird entfernt und z. B. in einer sterilen Nierenschale abgelegt. Nach erneuter Händedesinfektion und Überziehen steriler Handschuhe erfolgt die Reinigung der Wundränder (z. B. mit octenidin- oder polihexanidbasierten Antiseptika). Nach Einsetzen einer neuen Trachealkanüle erfolgen das Unterlegen einer sterilen Schlitzkompresse und die Fixierung der Kanüle (Kap. 7.6).
Eine Pneumonie ist die häufigste NI bei Patienten nach Laryngektomie, insbesondere in den ersten Wochen nach der OP. Diese kann zuverlässig durch spezielle Hygienemaßnahmen beim Absaugen und bei der Befeuchtung der Atemluft verhindert oder zumindest in der Häufigkeit ihres Auftretens deutlich gesenkt werden (Schu 1992).
5.14.3. Antiseptik
Die Datenlage zum Einsatz von Antiseptika in der HNO-Heilkunde ist nicht zufriedenstellend (Müller 2008). Eine Reihe von Operationen findet im nicht sterilen Gebiet statt, z. B. Adenotomien, Tonsillektomien, Nasen- und Nasennebenhöhleneingriffe. Die Nase ist ein bedeutsames Erregerreservoir. Andererseits kommt es zu Antiseptik:HNO-Heilkundetransienter Bakteriämie z. B. während und nach Tonsillektomie. Ferner spielen entzündliche Erkrankungen in der HNO-Heilkunde eine große Rolle; hier sind vielfach auch lokale Therapiemaßnahmen indiziert. Antiseptika kommen regelmäßig z. B. als begleitende Lokalbehandlung bei Erysipel im Kopf-Hals-Bereich, bei Nasen- oder Oberlippenfurunkel u. a. zur Anwendung
Ein wichtiges Antiseptikum zur Anwendung auf Schleimhäuten und angrenzender Haut vor diagnostischen und operativen Eingriffen ist Octenidin. Es kann zur Antiseptik der umgebenden Haut im Gesichtsbereich vor Operationen in der Nase und an den Nasennebenhöhlen eingesetzt werden. Auch zur MRSA-Sanierung wird es erfolgreich eingesetzt (Hübner et al. 2009). Zu beachten ist die Kontraindikation der Anwendung am Octenidin:HNO-HeilkundeTrommelfell (Müller 2008).
Im HNO-Bereich hat sich Polihexanid als Wundantiseptikum bei schlecht heilenden oder chronischen Wunden (z. B. nach großen tumorchirurgischen Eingriffen mit Wundheilungsstörungen) bewährt. Auch bei Weichteilphlegmonen und Osteomyelitis (z. B. radiogene Unterkieferosteomyelitis) ist Polihexanid verträglich und Polihexanid:HNO-Heilkundewirksam. Die Anwendung am Mittelohr (z. B. chronische Otitis media) ist kontraindiziert.
2-prozentiges Taurolidin kann bei Patienten mit purulenter chronischer Otitis media eingesetzt werden.
Eine vernachlässigbare Rolle (unter Beachtung der Kontraindikation von Schilddrüsenerkrankungen) im HNO-Gebiet spielt Povidoniod. Nur Taurolidin, HNO-Heilkundebei Schnitt- und Stichverletzungen mit HIV-, HBV-, HCV-Gefährdung (Kap. 5.29) sowie Tierbissen ist die Kombination von PVP-Iod mit Alkohol nach der Phase des Blutens indiziert (Kramer et al. 2010).
Die Povidoniod"\t""Siehe PVD-JodAnwendung von Chlorhexidin in PVD-Jod:HNO-Heilkundeder Mundhöhle sollte wegen der zytotoxischen und mutagenen Potenz sowie des Risikos der Induktion prämaligner Veränderungen auf 14 Tage begrenzt werden (Müller 2008). Die Substanz sollte keine Anwendung bei chronischen und tiefen Wunden finden. Kramer et al. (2004) Chlorhexidin:HNO-Heilkundehalten Chlorhexidin für entbehrlich in der Wundantiseptik. Wegen möglicher ototoxischer Effekte ist eine Anwendung am Mittelohr kontraindiziert.
Farbstoffe werden wegen unzureichender Wirkung und unerwünschter Arzneimittelwirkungen nicht mehr zur Wundantiseptik empfohlen. Allerdings wurde bei therapierefraktären Gehörgangentzündungen und infizierten Ohrradikalhöhlen Chlorhexidin-Fuchsin-Lösung (nicht unmittelbar am Trommelfell) zeitlich begrenzt angewendet (Jungheim et al. 2006).
5.14.4. HNO-fachspezifische Empfehlungen zur Aufbereitung von MP
HNO-Ärzte in Praxis und Klinik müssen beachten, dass mit Krankheitserregern kontaminierte MP wie medizinisch-technische Geräte und Instrumente eine Infektionsquelle im Zusammenhang mit medizinischen Eingriffen sein können. Hierbei sind insbesondere semikritische und kritische MP zu berücksichtigen.
In der HNO-Heilkunde aufzubereitende MP
Nasenspekula, Kehlkopfspiegel, starre Optiken ohne Arbeitskanal, Pinzetten, Watteträger und Mundspatel für die HNO-Spiegeluntersuchung sind Instrumente und Hilfsmittel, die als MP semikritisch A gelten (mit Schleimhaut oder krankhaft veränderter Haut in Berührung kommend ohne besondere Anforderungen an die Aufbereitung, Kap. 2.9). Trotz der einfachen Aufbereitbarkeit waren bei einer Analyse von Otoskopen unmittelbar vor der Anwendung am Patienten 90 % der Griffe mikrobiell kontaminiert, davon 45 % mit S. aureus und 10 % mit MRSA (Cohen et al. 1997). Das verdeutlicht, dass auch Semikritisch-A-MP der ordnungsgemäßen Aufbereitung bedürfen.
MP semikritisch B (mit Schleimhaut oder krankhaft veränderter Haut in Berührung kommend mit erhöhten Anforderungen an die Aufbereitung) sind solche mit Hohlräumen oder schwer zugänglichen Teilen wie Tubenkatheter, Ohrzängelchen, Nasenspekula, Nasensauger, Speicheldrüsenkatheter, Tonsillensauger, Zerstäuber (für Kehlkopf), Griff für Kehlkopfspiegel und starre Optiken mit Arbeitskanal.
MP kritisch A (Haut oder Schleimhaut durchdringend mit Kontakt zu Blut, inneren Geweben oder Organen ohne besondere Anforderungen an die Aufbereitung) sind Instrumente für Operationen ohne Hohlräume oder schwer zugängliche Teile, z. B. in der Ohrchirurgie Parazentesemesser, Raspatorium, Meißel, scharfe Löffel, Rund-, Sichelmesser, in der Nasenchirurgie Drahtschlingen, Septummesser, Elevatorium, Raspatorium, Meißel, Metallhammer, Raspel, starre Optiken ohne Arbeitskanal, bei Operationen im Mund- und Rachenraum Spatel, Tonsillenschlingen, Elevatorium u. a.
MP kritisch B (Haut oder Schleimhaut durchdringend mit Kontakt zu Blut, inneren Geweben oder Organen mit besonderen Anforderungen an die Aufbereitung) sind solche zur Verwendung bei operativen Eingriffen mit Hohlräumen oder schwer zugänglichen Teilen, z. B. bei Ohroperationen Ohrschlingen, Knochenzangen, Wundsperrer, Hammerkopfstanze, Ohrhandstück mit Fräse, in der Nasenchirurgie Nasenschere, -zange, Konchotom, Knochenzange, Knorpelquetschzange u. a., bei Operationen im Mund-Rachen-Raum Mundsperrer, Tonsillenabszesszange, Speichelgangschere, Tonsillenschnürer, Tonsillenkompressorium, ferner Instrumente für Koniotomie, Tracheotomie, Mikrolaryngoskopieinstrumente u. a. (Stasche und Hartwig-Bade 2010).
Grundlage für die Aufbereitung von MP in HNO-Klinik und -Praxis sind die Empfehlungen der KRINKO und des BfArM.
Aufbereitung von Laryngoskopen und starren Endoskopen
Laryngoskope und Rhinoskope ohne Zusatzschächte werden direkt nach dem Einsatz mit einem Reiniger gründlich behandelt und in Desinfektionslösung eingelegt (Wirkstoffauswahl und Einwirkzeit nach Herstellerangaben). Nach EndeLaryngoskop(e), Aufbereitung der Einwirkungszeit werden sie mit sauberem, z. B. steril filtriertem, Rhinoskop(e), AufbereitungWasser abgespült, getrocknet und staubgeschützt aufgehängt.
Irreparable Schäden entstehen bei Reinigung von Geräten mit Lichtleitern im Ultraschallbad.
Die gelegentlich beschriebene Praxis, Laryngoskope nach Gebrauch lediglich mit alkoholgetränkten Kompressen abzuwischen, ist abzulehnen.
Hohlinstrumente aus der HNO-Praxis sollen generell nicht durch alleiniges Einlegen in Desinfektionslösung aufbereitet werden. Die Innenaufbereitung im RDG mit Spülanschluss gewährleistet die erforderliche Sicherheit. Flexible und starre Endoskope mit Manipulations- und/oder mit Luftinsufflationskanal können aber auch manuell aufbereitet werden, weil der Lumendurchmesser das manuelle Durchspülen erlaubt (Kap. 5.17). Für starre lumenlose Endoskope wird nachfolgend ein Beispiel für eine Aufbereitungsvorschrift gegeben (Kramer und Hosemann, pers Mitt.):
Die manuelle Aufbereitung von flexiblen und starren Endoskopen ohne Innenlumina (MP semikritisch A) erfolgt in vier Schritten:
-
•
Vorreinigung unmittelbar nach der Untersuchung,
-
•
Desinfektion,
-
•
Spülung,
-
•
Lagerung.
Manuelle Vorreinigung unmittelbar nach der Untersuchung:
-
•
Erfolgt immer unter Berücksichtigung des Personalschutzes (Handschuhe, ggf. Schutzkittel und Augenschutz).
-
•
Bereits beim Entfernen nach der Untersuchung wird das Einführungsteil mit flusenfreiem Einwegtuch abgewischt, um grobe Verunreinigungen zu entfernen und ein Antrocknen organischer Materialien zu vermeiden.
-
•
Danach wird das Endoskop unter steril filtriertem Wasser abgespült und erneut mit flusenfreiem Einmaltuch getrocknet. Dadurch soll ein Verdünnungseffekt des Desinfektionsmittels verhindert werden.
Desinfektion:
-
•
Das gereinigte Endoskop wird in die Desinfektionsmittellösung eingestellt. Dafür müssen passende Einsätze verwendet werden. Das Instrumentarium muss vollständig benetzt sein (außer Griffteil). Es dürfen keine Hohlräume oder Luftblasen Desinfektion:Endoskop(e), HNO-Heilkundebestehen.
-
•
Bei der Anwendung sind die vorgegebenen Einwirkzeiten und Einsatzkonzentrationen einzuhalten.
-
•
Der Griffteil des Endoskops wird mit dem gleichen Desinfektionsmittel desinfizierend nass gereinigt, das zur Tauchdesinfektion benutzt wird.
-
•
Die Desinfektionsmittellösung ist arbeitstäglich und zusätzlich bei sichtbarer Kontamination zu wechseln.
-
•
Die Einsätze sind ebenfalls arbeitstäglich und bei sichtbarer Kontamination desinfizierend zu reinigen.
Schlussspülung:
-
•
Nach Einwirkzeit des Desinfektionsmittels wird das Endoskop gründlich mit steril filtriertem Wasser abgespült, um Desinfektionsmittelreste zu entfernen.
-
•
Abschließend wird der Außenmantel des Endoskops mit frischem Einmaltuch abgetrocknet.
Lagerung:
-
•
Bis zur nächsten Anwendung des Endoskops kann es sowohl trocken als auch in Aqua dest. zwischengelagert werden (Aqua dest. ist mindestens arbeitstäglich und nach sichtbarer Verschmutzung zu wechseln).
-
•
Grundsätzlich werden flexible Endoskope hängend und staubgeschützt gelagert.
Überprüfungen: Einmal jährlich erfolgt die hygienisch-mikrobiologische Überprüfung der Aufbereitungsqualität jedes Endoskops. Sind die mikrobiologischen Befunde der Endoskope zu beanstanden, erfolgt eine Nachkontrolle. Die Intervalle der Nachkontrollen werden situationsbedingt festgelegt.
Endoskope mit mehreren ineinander schiebbaren Röhren und mit eingeschobener Hopkins-Optik müssen vor der Aufbereitung komplett zerlegt werden, nur so sind alle inneren und äußeren Oberflächen der Reinigung und Desinfektion zugänglich (Weidenfeller und Reick 2010).
Aufbereitung von HNO-Behandlungseinheiten
Wasserführende Teile der HNO-Behandlungseinheit sind grundsätzlich anfällig für Medizinprodukteaufbereitung:HNO-spezifische\""\r""MPAubereitungHNOBiofilmbildung (Kap. 5.24, Kap. 6.6). Dadurch können sich in den Leitungen über das zugeführte Trinkwasser typische Biofilmbildner wie P. aeruginosa und L. HNO-Behandlungseinheiten, Aufbereitung pneumophila verbreiten.
Daher wird empfohlen, das aus der Behandlungseinheit abgegebene Wasser vierteljährlich mikrobiologisch zu kontrollieren (Grenzwerte Kap. 6.6).
Ohrspülungen sollten mit sterilem Wasser, das über endständige Sterilwasserfilter hergestellt wird, erfolgen (Kap. 6.6).
Bakteriendichte Filter sollen heutzutage Standard bei den Absaugeinrichtungen der Behandlungseinheiten sein. Stirnlampe für die HNO-Untersuchung und Lichtleiter werden täglich wischdesinfiziert. Die Behandlungseinheit wird täglich mit einem Reiniger behandelt und täglich oder im Bedarfsfall mit einem vom Hersteller empfohlenen Flächendesinfektionsmittel wischdesinfiziert (Weidenfeller und Reick 2010).
Auch wenn in der HNO-Heilkunde NI eine sehr geringe Rolle spielen und die Resistenzsituation wichtiger Krankheitserreger gegenüber Antibiotika noch als günstig bezeichnet werden kann, ist ein konsequentes Hygienemanagement in HNO-Praxis und -Klinik unverzichtbarer Bestandteil der täglichen Arbeit!
5.15. Ophthalmologie
Stefan Clemens, W. Behrens-Baumann und Axel Kramer
5.15.1. Risikofaktoren nosokomialer Infektionen
Weniger als 1 % nosokomialer Infektionen ereignen sich in der Augenheilkunde (Bialasiewicz 1991). Die Gesamtrate aller nosokomialen Augeninfektionen wird auf 0,1 % aller Entlassungen geschätzt.
Neben gewebeeröffnenden Eingriffen sind in den Glaskörper injizierte VEGF-Hemmer bei feuchter altersbedingter Makuladegeneration und in der refraktiven Chirurgie zusätzlich zu die Hornhaut lamellierenden und gewebeabtragenden Techniken und additiv ins Auge eingeführte Kunstlinsen ein Infektionsrisiko. Weitere Risikokonstellationen sind das trockene Auge, Vitaminmangel, Innervations- und Durchblutungsstörungen, Bindehautdehiszenzen, Fistulationen, im Auge befindliche Fremdkörper, weiche Kontaktlinsen sowie die mikrobielle Kontamination ophthalmologischer Geräte und Medikamente.
Die meisten Infektionen treten an Bindehaut und Hornhaut auf, gefolgt von posttraumatischen und postoperativen Endophthalmitiden. In der Ätiologie der Vorderabschnittinfektionen hat ein Erregerwandel stattgefunden, der im Gesamtkonzept der antiinfektiösen Maßnahmen zu berücksichtigen ist (Details ![]() Online-Ergänzung 5.15).
Online-Ergänzung 5.15).
Während die Serotypen A bis C von C. trachomatis Chlamydia trachomatis:nosokomiale Infektion(en), ophthalmologischein tropischer Umgebung (Südostasien, Südamerika, Indien, Mittlerer Osten, Afrika) das in Mitteleuropa und den USA sehr selten auftretende Trachom hervorrufen, verursachen die Serotypen D bis K die Einschlusskörperchenkonjunktivitis.
Die in unseren Breiten häufig vorkommende okulogenitale oder vom Tier übertragene Chlamydieninfektion (15 verschiedene Serotypen) führt beim Neugeborenen zur Ophthalmia neonatorum, bei Kindern und Erwachsenen zur follikulären Konjunktivitis und selten auch zur akuten Hornhautinfiltration. Unbehandelt kann es durch chronische Umbauprozesse an allen Teilen der Konjunktiva mit sekundärer Einwirkung auf die Hornhaut zu anhaltenden Sehstörungen kommen (Behrens-Baumann 2007).
Keratitiden werden in der Hauptsache bei vorher symptomlosen Intensivpatienten als endogene Infektion bei Septikämie gefunden.
Die Häufigkeit von Neuinfektionen liegt bei intubierten Patienten bei 1–3 %. Tritt eine Infektion des Respirationstrakts hinzu, kann die Häufigkeit auf 14 % ansteigen. Ein besonderer Risikofaktor ist der Lagophthalmus mit Störung der Benetzung und Entstehung eines Ulcus corneae. Haupterreger sind S. aureus, Pneumokokken, P. aeruginosa und Moraxella spp. Pilzinfektionen durch Fusarium (F.) solani, Aspergillus und Candida spp. sind wesentlich seltener (Details ![]() Online-Ergänzung 5.15).
Online-Ergänzung 5.15).
Postoperative Keratitiden betreffen vor allem Infektionen durch Tropfflaschen nach Katarakt-OP, Glaukom-OP und Keratoplastiken.
Keratitiden bei Kontaktlinsenträgern sind Ulcus corneaestreng genommen keine Krankenhausinfektionen, da die Anpassung meist ambulant erfolgt. Häufigste Erreger sind Pseudomonas spp., Akanthamöben und Pilze.
Die EndophthalmitisEndophthalmitis lässt sich auf vier wesentliche Ursachen zurückführen:
-
•
postoperative Endophthalmitis nach intraokularen Eingriffen (exogen),
-
•
posttraumatische Endophthalmitis nach perforierenden Verletzungen (exogen),
-
•
fortgeleitete Lokalinfektion, z. B. als Sickerkisseninfektion oder nach Keratitis (exogen),
-
•
septisch-metastatisch besonders bei eingeschränkter Immunantwort (endogen).
Wesentliche Ursachen für die Entstehung der Endophthalmitis nach Katarakt-OP sind ein komplizierter OP-Verlauf mit Ruptur der Hinterkapsel, Glaskörpereinklemmung im Wundspalt, dehiszente Naht, exponierte Lidränder mit Exprimat der Meibom-Drüsen, Kontakt der Zilien mit der intraokularen Linse, verlängerte OP-Dauer und Erregerverschleppung aus der Umgebung (Behrens-Baumann 2008).
Eine Endophthalmitis nach Katarakt-OP bedeutet eine hohe Gefahr der Erblindung oder des Augenverlusts (zwischen 10 und 20 %). Orientierendes Sehen von 0,05 oder mehr wird nur in etwa 50 % der behandelten Fälle, Lesefähigkeit nur in etwa 33 % erreicht (Zell et al. 2000).
Durch präoperative Erregerfreiheit im Konjunktivalabstrich konnte die Rate postoperativer Endophthalmitiden von 0,69 % auf 0,11 % gesenkt werden (Rummelt et al. 1992).
Auch für Keratoplastiken ist das kolonisierte Epithel eine Infektionsquelle.
Bei der Hornhautspende muss die Übertragung von Virusinfektionen, insbesondere HIV:HornhautspendeHIV, aber auch HBV, HCV und CMV, mit den zur Verfügung stehenden Möglichkeiten ausgeschlossen werden.
Die Seroprävalenz für HIV 1 liegt bei Hornhautspendern in den USA bei 0,3–0,84 % (Ortiz und Aaberg 1991). Wegen der Möglichkeit der Serokonversion nach bis zu 2 Jahren dauernder Latenz und der Seroreversion mit zumindest vorübergehendem Fehlen serologischer Nachweismöglichkeiten kann es keine absolute Sicherheit für den Ausschluss infizierter Spender geben. Ist der Spender CMV-positiv, sind zumindest Empfänger mit Immunsuppression und Abwehrschwäche von der Spende auszuschließen (Kramer und Werner 1995, s. auch Bredehorn-Meyer et al. 2009).
5.15.2. Epidemiologie nosokomialer Augeninfektionen
Jeglicher Übertragungsweg von Mensch zu Mensch ist bei NI in der Augenheilkunde möglich. Quellen sind das Personal, Mitpatienten und Besucher. Chirurgisches oder diagnostisches Instrumentarium, kontaminierte Ophthalmika, die ungeschützte Hand des Untersuchers bis hin zu kontaminierten Klimaanlagen kommen als Überträger in Betracht.
Die Abwehrmechanismen unterscheiden sich auf den einzelnen Stufen der Erregerinvasion (Details ![]() Online-Ergänzung 5.15).
Online-Ergänzung 5.15).
5.15.3. Antimikrobielle Maßnahmen und Verfahren
Hauptquelle für SSI in der Ophthalmologie ist der Patient selbst.
Hygiene in der Operationseinheit
Das nosokomiale Infektion(en):ophthalmologische\""\r""OphthalmologieInfektonenVerhalten des OP-Teams unterscheidet sich nicht von dem anderer operativer Fächer. Nach Abszessspaltung oder OP bei Endophthalmitis sollte die OP-Einheit im Kontaminationsbereich desinfiziert werden. In Abhängigkeit von der RLTA ist zu gewährleisten, Operationseinheit(en):Hygiene, Ophthalmologiedass es intraoperativ nicht zur Austrocknung am Auge kommt.
Bezüglich des Endophthalmitisrisikos scheint Wimpernschneiden nicht mit einer Erniedrigung verbunden zu sein (Behrens-Baumann et al. 2003). Das OP-Feld wird mit einem Lochtuch (low performance) abgedeckt. Durch Abdecken der Lidkanten mit Wimpern und Ausführungsgängen der Meibom-Drüsen mit Inzisionsfolie nach Antiseptik wird vermutlich ein zusätzlicher Schutz erreicht (Pervanidi und Sonntag 1982, Behrens-Baumann und Kramer 2002), außerdem wird die bei der OP störende Anwesenheit von Wimpern im Arbeitsgebiet vermieden.
Die präoperative Untersuchung auf Disposition zur bakteriellen Kontamination durch Blepharitis, Rosazea, Neurodermitis, trockenes Auge und Verschluss des Tränensacks ist empfehlenswert.
OP-Verfahren zur Herabsetzung von Infektionsrisiken
Zur Erzielung präoperativer Erregerarmut kann die Lidkorrektur mit Wiederherstellung der Kongruenz zwischen Tarsus, Lidkante und Bulbus dienen. Der Irrigations- und Wischeffekt der Tränenflüssigkeit und der Lider kann so zur Wiederherstellung ausreichender Benetzung und zum vollständigen Lidschluss führen. Im Fall eines trockenen Auges bei OP an der LidkorrekturHornhaut kann durch temporären Verschluss der Tränenpünktchen ein vorzeitiger Abfluss der Tränenflüssigkeit über die Tränenpumpe vermieden werden. Ist es zu einem Verschluss im Bereich der Tränenkanälchen ohne Sackbeteiligung gekommen, ist nicht mit erhöhter Infektionsgefahr zu rechnen, vorausgesetzt, eine Kanalikulitis durch Aktinomyzeten konnte ausgeschlossen werden. Ist es zu einem Verschluss innerhalb des Tränensacks gekommen, sollte vor intraokularer OP eine Dakryozystorhinostomie durchgeführt werden. Obwohl die temporäre Diathermieverödung der Tränenpünktchen in Gebrauch ist, steht der Nachweis, ob dadurch eine Erregerreduktion erreichbar ist, aus. Bei Patienten mit reduziertem Allgemeinzustand und der Zumutbarkeit einer OP kann ein temporärer Verschluss mit einem Kanälchenstopfen oder einer Naht durchgeführt werden. Bei Dakryophlegmone sollte zunächst konservativ lokal antiinfektiv und systemisch antibiotisch behandelt werden, bis ein spontaner Rückgang erfolgt oder eine Abszessspaltung möglich wird.
Lidabszesse können mit Spaltung, Einlegen einer kleinen Lasche und begleitend lokal und systemisch antimikrobiell behandelt werden.
Zur Therapie eines destruierenden Hornhautprozesses mit und ohne Infektion kann die Keratoplastik à chaud gerechnet werden (Weidle und Thiel 1984, Behrens-Baumann 1984Lidabszess(e)). Sie dient der Stabilisierung des Auges, der Exzision der Infektion und der Verbesserung der Möglichkeiten der antiinfektiven Therapie.
Infektionen des Augeninneren nach Trauma, OP oder metastatisch bei immunkompromittierten Patienten erfordern neben der lokalen und systemischen antibakteriellen Therapie zumindest eine Probenahme zur mikrobiologischen Untersuchung mit Entfernung von toxischem Exsudat und Erregern. Die Infektion(en):Augeninneresvon Erregern und Abwehrzellen freigesetzten Substanzen haben ein hohes Destruktionspotenzial, das frühzeitig auf die Netzhaut einwirken kann. Antibiotika müssen als Basistherapie intraokular verabreicht werden. Zu beachten ist die bei Entzündung um rund 40 % verkürzte Verweildauer intravitreal injizierter Antibiotika, die experimentell zwischen 5 und 14 Stunden lag. Aphakie und Zustand nach Vitrektomie verkürzen die Zeiten entscheidend (Shaarway et al. 1995). Das freie Zirkulationsvolumen für intraokular applizierte oder durch die Blut-Kammerwasser-Schranke herangeführte Antibiotika wird durch Vitrektomie gewährleistet und ermöglicht das Erreichen des Wirkspiegels in allen Nischen, insbesondere in der Ziliarregion. Experimentell konnte nachgewiesen werden, dass durch intraokulare Entzündung und Vitrektomie die Schrankenfunktion für systemisch applizierte Antibiotika deutlich reduziert wurde (Meredith et al. 1995).
Die Indikation zur interventionellen Therapie nach intraokularen Eingriffen oder Verletzungen ist gegeben, wenn ein nicht adäquater postoperativer Reizzustand mit stärkeren Schmerzen und starker Rötung des Auges beobachtet wird. Hinzu kommt ein rasch progredienter Befund mit Verlust des Rotreflexes innerhalb von Stunden. Je nach Pathogenität der Erreger ist die Prognose für die Wiedererlangung einer verwertbaren Sehschärfe von ≥ 0,2 unterschiedlich. Nach Infektion mit KNS und gramnegativen Erregern erreichten etwa zwei Drittel, nach Infektion mit Enterokokken und der Streptokokken nur etwa ein Viertel diese Sehschärfe (Kreutzer 2005).
Bei aufgehobenem Einblick in den Augenhintergrund ermöglicht die echographische Untersuchung die Darstellung einer Verdickung der Netz- und Aderhaut als unmittelbares Zeichen der segmentalen oder totalen Beteiligung der Augenrückwand (Clemens et al. 1988). Elektrophysiologische Methoden vermögen lediglich eine Alles-oder-Nichts-Antwort zu geben.
Die Gabe von Antiinfektiva sollte nach zu erwartendem Spektrum und Direktabstrich auf mehreren Wegen, auch intravitreal, erfolgen. Kortikoide vermögen den Reizzustand zu verringern und tragen zur Verbesserung des funktionellen Resultats bei (Details ![]() Online-Ergänzung 5.15).
Online-Ergänzung 5.15).
Isolierung
Bei stationärem Isolierungsmaßnahmen:OphthalmologieAufenthalt von Patienten mit Keratoconjunctivitis Keratoconjunctivitis epidemicaepidemica müssen diese durch Einzelunterbringung oder Kohortenisolierung räumlich separiert werden, sofern aus medizinischer Indikation keine sofortige Entlassung möglich ist.
Bei epidemischem Auftreten kann die vorübergehende Schließung einer Station oder Praxis notwendig werden. Bei Kontakt mit Patienten oder infiziertem Material sind Schutzkittel und Handschuhe zu Operationsverfahren, Ophthalmologie\"\r\"OPVerfOphthaltragen. Nach Ablegen der Handschuhe muss die Händedesinfektion mit einem virozid wirksamen Mittel durchgeführt werden. In der Isoliereinheit ist die laufende virozide Desinfektion insbesondere aller Kontaktflächen zu gewährleisten (Kap. 2.11). Neuaufnahmen sind erst nach Schlussdesinfektion vorzunehmen (Kap. 2.4, Kap. 2.11).
Ebenso sollten Patienten mit anderen Augeninfektionen mit vermutlich hoher Kontagiosität und/oder hochvirulenten Erregern von frisch operierten Patienten sowie von Patienten in Vorbereitung auf die Operation separiert werden (in jedem Fall bei Kolonisation oder Infektion durch MRE).
Fachspezifische Besonderheiten der Sterilisation und Desinfektion
Ophthalmologisches Sterilisation:ophthalmologisches Instrumentarium Desinfektion:ophthalmologisiches InstrumentariumInstrumentarium Medizinprodukteaufbereitung:Ophthalmologieist aus Gründen der Effizienz und des Personalschutzes soweit wie möglich einem maschinellen Reinigungs-Desinfektions-Verfahren zuzuführen.
Für zur manuellen Aufbereitung verbleibende Materialien (z. B. spezielle Einführungsdrähte oder Schnüre, Spezialbürsten u. a.) wird nach vorsichtiger (!) Vorreinigung im Ultraschallbad eine Oberflächenreinigung vorgenommen.
Im Interesse des Funktionserhalts des empfindlichen ophthalmologischen Instrumentariums empfiehlt es sich, den Aufbereitungsprozess einschließlich der Sterilisation als Substerilisation in der Verantwortung ophthalmologisch Erfahrener zu belassen und nicht in die allgemeine ZSVA auszulagern.
Die Aufbereitung ophthalmologischer Untersuchungs- und OP-Geräte erfolgt materialabhängig unterschiedlich. Auch Metallinstrumente sind nicht in jedem Fall dampfsterilisierbar, da Oberflächenvergütungen oder Entspiegelungen ihre Funktion einbüßen können. Eine Alternative für homogene Metallwerkstoffe ist die Heißluftsterilisation. Funktionsansätze wie Diathermie für intraokulare Anwendung und Lichtkabel sowie Ophthalmoskopierlupen aus Kunststoff mit Oberflächenvergütung müssen meist in Formaldehyd oder Ethylenoxid sterilisiert werden. Phakoemulsifikationsansätze können meist dampfsterilisiert werden. Mikroskopadapter für die indirekte Ophthalmoskopie müssen wegen der Nähe zum OP-Feld sterilisiert oder können in eine sterile Kunststoffumhüllung eingepasst werden. Wegen des Risikos von CJD bzw. vCJD ist als erster Aufbereitungsschritt die alkalische Reinigung (pH ≥ 11) erforderlich. Nach Neutralisierung und Desinfektion (möglichst im RDG) ist eine Dampfsterilisation bei 134 °C für mindestens 5 Minuten erforderlich (Kap. 3.3).
Schiötz-Tonometer aus Ganzmetall können hitzedesinfiziert werden. Nach chemischer Desinfektion müssen vor der Anwendung Rückstände mit steriler physiologischer Kochsalzlösung abgespült werden. Goldmann-Applanationstonometer können mit Sauerstoffabspaltern (z. B. Dismozon pur 0,25-prozentig 5 Minuten) desinfiziert werden. Hiermit werden auch Adenoviren erfasst. Danach ist gründlich mit steril filtriertem Trinkwasser oder steril abgepacktem Wasser nachzuspülen.
Generell ist die Desinfektion von Tonometerköpfen auch mit Gigasept (4-prozentig 30 Minuten) oder wegen fehlender Eiweißfixierung günstiger aldehydfrei z. B. mit Gigasept AF forte (2-prozentig 15 Minuten, 0,75-prozentig 30 Minuten) durchführbar (beide Mittel erfassen Adenoviren). Nach der Desinfektion müssen die Messkörper gemäß Herstellerangabe 10–60 Minuten gründlich abgespült werden.
Sicherer sind zur Vermeidung einer Übertragung Methoden mit Luftimpulstonometrie oder transpalpebrale Methoden. Hier ist aber die Messgenauigkeit noch nicht vergleichbar genau. Beim Tonometertyp Tonopen XL ist der Tonometerkopf mit einer Einwegschutzkappe geschützt, die nach jedem Patienten gewechselt wird. Eine Alternative sind Einwegtonometerköpfe.
Ein Übertragungsrisiko besteht auch für Kontaktgläser bei der intraokularen Untersuchung. Zur Desinfektion wird NaOH oder Natriumhypochlorid empfohlen. Hierbei ist ein aufwändiges Neutralisierungsverfahren unumgänglich. Nur für Personen ohne Anamnese auf Prionenerkrankung wird die aldehydbasierte Desinfektion der Kontaktflächen empfohlen, da Prionen durch Aldehyde auf Oberflächen fixiert werden (Gibbs 1994). Wichtig ist als erster Schritt die Reinigung direkt nach der Anwendung (Iffenecker 2002). Inzwischen wurden dampfsterilisierbare Kontaktgläser eingeführt.
Gonioskope werden unter Leitungswasser abgespült, mit 70-prozentigem Ethanol abgewischt und vor Gebrauch getrocknet. Koeppe-, Goniotomie- oder BIOM-Linsen aus Kunststoff werden in Ethylenoxid sterilisiert. Formaldehyd erfordert etwas höhere Temperaturen und kann die Oberflächen beschädigen.
In Augentropfflaschen können bei unsachgemäßem Gebrauch Bakterien gelangen, die Infektionen verursachen können.
Zur Vermeidung der Kontamination von Augentropfflaschen ist die korrekte Tropftechnik einzuhalten, d. h. Händedesinfektion, kein Kontakt der Tropfflasche mit den Zilien und Ektropionieren des Unterlids (durch die Pflegekraft nur mit Tupfer, um die Kontamination der Finger und Weiterverbreitung auf andere Patienten zu vermeiden). Jeder Patient soll seine eigene Tropfflasche haben (Behrens-Baumann 2004; vgl. Augenpflege ![]() Online-Ergänzung 5.15).
Online-Ergänzung 5.15).
Ebenso sind die Verwendungsfrist und Lagerungsvorschrift einzuhalten.
Antiseptik
Die prophylaktische Anwendung von Antiseptika am Auge ist indiziert
-
•
präoperativ periorbital und konjunktival, ggf. zusätzlich intraoperativ,
-
•
zur Prophylaxe der Ophthalmia neonatorum,
-
•
bei akzidenteller Erregerkontamination des Auges,
-
•
zur Konjunktivitis- und Keratitisprophylaxe bei Intensivtherapiepatienten,
-
•
zur antiseptischen Spülung von Spenderbulbi,
-
•
bei Kolonisation mit MRE (speziell MRSA) und ggf. zur Prophylaxe okulärer Infektionen bei epidemiologischer Situation.
Spülung der Tränenwege
Die präoperative Spülung der Tränenwege hat keinen Einfluss auf die Kontamination von Kammerwasseraspiraten. Wird sie unmittelbar vor dem Eingriff durchgeführt, werden sogar vermehrt Erreger aus dem Tränen- in den Bindehautsack gespült (Behrens-Baumann et al. 2003).
Präoperative Antiseptik von Konjunktiva und Kornea
Tränenwege, SpülungAntiseptika der Wahl sind derzeit PVP-Iod 1,5–5 % und Polihexanid 0,01–0,04 %. Die Wischantiseptik des OP-Gebiets bietet sich zur präoperativen Keimzahlreduktion an. Durch 5-prozentiges PVP-Iod konnte die Endophthalmitisinzidenz im Vergleich zur Kontrollgruppe (Silber-Protein-Lösung) signifikant gesenkt werden (Speaker und Menikoff 1991). Da bereits mit 1,25-prozentigem PVP-Iod eine signifikante Reduktion der Konjunktivalflora erreichbar ist, dürfte dieser Konzentration aufgrund der In-vitro-Befunde zur Wirksamkeit und besseren Verträglichkeit im Vergleich zu höher konzentrierten Lösungen der Vorzug zu geben sein, was jedoch noch der epidemiologischen Überprüfung bedarf.
Als Alternative kommt Polihexanid in Betracht. Im Neuen Rezeptur-Formularium des DAC sind Polihexanid-Augentropfen 0,02 %, NRF 15.25, und Polihexanid-Augenbad 0,04 %, NRF 15.26, enthalten. Polihexanid wird schon länger zur Therapie der Akanthamöbenkeratitis eingesetzt und ist bezüglich Zytotoxizität, Irritation und Remanenz 2,5-prozentigem PVP-Iod überlegen (Kramer und Behrens-Baumann 1997, Kramer et al. 1998). 0,04-prozentig war Polihexanid analog wirksam wie 1,25-prozentiges PVP-Iod, jedoch mit später einsetzender, dafür aber länger anhaltender Wirkung, sodass 24 Stunden postoperativ kein Erregernachweis gelang. Die Verträglichkeit unterschied sich nicht von PVP-Iod (Hansmann et al. 2005). Bei Polihexanid ist der im Vergleich zu PVP-Iod langsamere Wirkungseintritt (geeignetes Applikationsregime) zu beachten. Im Unterschied dazu wurde mit gentamicinhaltiger Salbe keine Erregerfreiheit nach 24 Stunden Einwirkung erreicht (Hansmann et al. 2004).
Kontaktlinsenträger müssen präoperativ als bakteriell kolonisiert betrachtet werden, da sich auf der Kontaktlinse leicht Biofilme bilden. Die Herausnahme der Linse mindestens 24 Stunden vor der OP mit mehrfacher Reinigung und Antiseptik des Bindehautsacks ist daher zu empfehlen.
Präoperative topische Antibiotikaprophylaxe
Nach vorliegenden Daten scheint eine präoperative topische Antibiotikaprophylaxe zur Reduzierung der Erregermenge im Bindehautsack sinnvoll zu sein (Behrens-Baumann et al. 2003). Hier ist die zeitlich kombinierte Prophylaxe über 3 Tage mit einerAntibiotikaprophylaxe:präoperative topische, Ophthalmologie kurzfristigen Prophylaxe (1 Stunde) der alleinig kurzfristigen überlegen (Ta et al. 2002). Eine Reduzierung der intraokularen Kontamination lässt sich dadurch jedoch nicht nachweisen.
Vergleichende Studien mit Antiseptika liegen bisher nicht vor. Aus prinzipiellen Erwägungen (Resistenzentwicklung, Allergien) und wegen der höheren In-vitro-Wirksamkeit von Antiseptika sind gleichwertige oder gar bessere Ergebnisse mit diesen Substanzen zu erwarten.
Unter Berücksichtigung der regionalen Resistenzlage sind Breitspektrumantibiotika, z. B. neuere Gyrasehemmer oder Kombinationspräparate wie Bacitracin-Gramicidin/Neomycin/Polymyxin B, empfehlenswert. Vancomycin und andere Reserveantibiotika sollen nicht prophylaktisch gegeben werden (Behrens-Baumann et al. 2003).
Präoperative periorbitale Hautantiseptik
Auswahlkriterium für Hautantiseptika ist die Augenreizwirkung, da Präparatreste ins Auge gelangen können (Kramer und Behrens-Baumann 1996). Mittel der Wahl ist 10-prozentiges PVP-Iod, wobei als Einwirkungszeit 10 Minuten einzuhalten sind, da es sich im Hautantiseptik:präoperative, periorbitaleBereich der Stirn um talgdrüsenreiche Haut handelt. Bei Kontraindikationen für Iodophore ist auf ein alkoholisches Hautantiseptikum mit reduziertem Ethanolgehalt (z. B. Hospidermin) auszuweichen.
Credé-Prophylaxe
Die Credé-Credé-ProphylaxeProphylaxe ist nach wie vor indiziert und dient in erster Linie der Vermeidung der Infektion des Neugeborenen durch den ggf. mit Chlamydien oder weitaus seltener mit Gonokokken infizierten Geburtskanal.
In Deutschland beträgt die Gonokokkenprävalenz etwa 0,1 %. Die Durchseuchung der Mütter mit Chlamydien beträgt 2–11 %. Seit 1992 ist in Deutschland die Credé-Prophylaxe nicht mehr vorgeschrieben. Heute wird wegen der lokalen Reizwirkung und der fehlenden Wirksamkeit gegen Chlamydien anstelle 1-prozentiger Silbernitratlösung 1,25-prozentige bzw. 2.5-prozentige PVP-Iod-Lösung empfohlen (Isenberg et al. 1995, Assadian et al. 2002). Hiermit wird auch eine hohe Wirksamkeit gegenüber Chlamydien erzielt. Die Schilddrüsenfunktion wird nicht beeinträchtigt (Richter et al. 2006).
Ein weiterer Wirkstoff mit breitem Spektrum und Erfassung der Gonoblenorrhö und Chlamydieninfektion ist Moxifloxacin; als Augentropfen (z. B. Vigamox®) ist Moxifloxacin auch für Kinder zugelassen.
Prophylaxe der Konjunktivitis und Keratitis
Bei Intensivtherapiepatienten besteht insbesondere bei beeinträchtigtem Lidschluss und Infektion des Respirationstrakts das Risiko einer Konjunktivitis und Keratitis. Als Konsequenz wird ein Screening zur früheren Konjunktivitis:ProphylaxeIdentifikation empfohlen (McHugh et al. 2008).
Ein weiterer Keratitis:ProphylaxeRisikofaktor ist der Lagophthalmus mit Störung der Benetzung und Entstehung eines Ulkus. Zur Vermeidung der Hornhautaustrocknung mit dem Risiko der Ulkusbildung werden daher bei beeinträchtigtem Lidschluss die Augen mit Klebebändern, Salben, Uhrglasverband oder – bei Patienten mit Fazialisparese – mittels Tarsorrhaphie oder alternativ durch Injektion von Botulinumtoxin verschlossen. Da die entstehende feuchte Kammer unter dem Uhrglasverband bei nicht vollständig geschlossenem Epithel infektionsbegünstigend wirkt und eine Infektion u. U. zu spät bemerkt wird, empfiehlt sich die tägliche Applikation von isoosmolarer PVP-Iod-Lösung (1-prozentiges PVP-Iod) beim Wechsel des Uhrglasverbands. Wichtig ist, dass das Klebeband um die zentrale Glasscheibe dicht aufgeklebt ist. Die Dichtigkeit erkennt man daran, dass die zentrale durchsichtige Scheibe (meist Plexiglas) von der Innenseite beschlägt. Wegen der mit dem Aufkleben des Klebebands üblicherweise verbundenen Hautreizung sollte der Verband maximal zweimal täglich geöffnet werden, um Antiseptika zu applizieren. Da bei lang dauernden Operationen im nichtophthalmologischen Bereich die Augen z. T. ebenfalls mit Klebebändern abgeklebt werden, sollte auch hier die antiseptische Prophylaxe erwogen werden (siehe auch Augenpflege ![]() Online-Ergänzung 5.15).
Online-Ergänzung 5.15).
Hornhautspende
Das Risiko einer Transplantatinfektion mit Transplantatabstoßung beträgt bei Keratoplastik < 1 %, kann aber zum Verlust des Auges führen. Die antiseptische Entnahme der Bulbi beinhaltet folgende Schritte (Wilhelm et al. 2001, 2002, Bredehorn-Meyer et al. 2009):
-
•
initialer HornhautspendeBindehautabstrich zur mikrobiologischen Diagnostik,
-
•
vor Entnahme Tropfen des Spenderfornix mit 0,5-prozentigem PVP-Iod-Augentropfen (1 Minute),
-
•
Abwaschen des OP-Gebiets mit 10-prozentigem PVP-Iod-Lösung und Abdecken (Lochtuch),
-
•
aseptische Entnahme der Spenderbulbi und Lagerung in sterilen Transportgefäßen,
-
•5
Minuten Eintauchen der Spenderaugen in 0,5-prozentigem PVP-Iod-Lösung und Abspülen mit steriler NaCl-Lösung, Balanced Salt Solution (BSS) oder Nährmedium wie für die Konservierung,
-
•
aseptisches Präparieren und Umlagern der Transplantate unter Sterilwerkbank,
-
•
Einbringen der Transplantate in Kulturmedium mit Antibiotika- bzw. Antimykotikazusatz und Lagerung für mindestens 7 Tage im Brutschrank bei + 37 °C,
-
•
nach Umlagerung der Transplantate in dextranhaltiges Kulturmedium zwecks Entquellung Mediumprobe zur mikrobiologischen Untersuchung (48-h-Befund abwarten).
Lokale antiinfektive Therapie
Blepharitis, Konjunktivitis und Keratitis können topisch behandelt werden, während Dakryoadenitis und -zystitis, Lid- und Orbitalphlegmone, Endophthalmitis, Konjunktivitiden durch Chlamydien oder Haemophilus und topisch nicht erfolgreich behandelte Konjunktivitis der Anophthalmushöhle und Blepharitis systemisch behandelt werden müssen (Behrens-Baumann 2004).
Die Anzahl der Applikationen beeinflusst die Oberflächen- und Tiefenkonzentration. Die Lipophilie ist bei der Penetration des Hornhautstromas entscheidend (Riechert et al. 1991). Salben führen zu verlängerter topischer Konzentration. Epithelschäden und Anästhesie führen zu erhöhter Permeabilität des Stromas.
Antiseptika sind in ihrer Wirksamkeit bei oberflächlichen Infektionen des Auges Antibiotika ebenbürtig bzw. überlegen. Die therapeutische Anwendung von Antiseptika am Auge ist bei allen lokalen Infektionen indiziert, wenn der Wirkstoff den Fokus erreichen kann, z. B. bakterielle Konjunktivitis und Blepharitis, Tränengangsinfektion, chronische bakterielle Entzündungen der Anophthalmushöhle, Keratokonjunktivitiden durch Chlamydien und Viren sowie bakterielle, virale, mykotische oder protozoische (Akanthamöben) Keratitiden (Bialasiewicz 2002, Kramer und Behrens-Baumann 2002). Als Antiseptikum kommt 1,25-prozentiges PVP-Iod in Betracht, z. B. zur MRSA-Sanierung oder Konjunktivitisbehandlung sowie bei Keratoconjunctivis epidemica (Pleyer 2002). Sollen bei bakterieller Ätiologie Antibiotika lokal angewendet werden, ist wegen des Risikos der Resistenzentwicklung solchen der Vorzug zu geben, die selten oder nicht systemisch angewendet werden, z. B. Polymyxin, Neomycin oder Gramicidin.
Blepharitis: Basistherapie ist die Lidrandhygiene. Mittels Watteträger und lauwarmen Wassers werden morgens und abends die Meibom-Ausführungsgänge an Ober- und Unterlid gesäubert. Bei Staphylokokkeninfektion mit begleitender Inflammation haben sich Augensalben mit Antibiotika und Blepharitis, TherapieKortikoiden bewährt.
Hordeolum: Normalerweise kann unter mehrfach täglicher Therapie mit trockener Wärme der Miniabszess zum Aufplatzen und Abfließen gebracht werden.
Bakterielle Konjunktivitis: Eine bakterielle Konjunktivitis führt in den allermeisten Fällen Hordeoluminnerhalb einer Woche zur Spontanheilung. Bei heftiger Ausprägung sollten kurzfristig (etwa 3 Tage) antibiotische Augentropfen eingesetzt werden. Alternativ kommen Polihexanid-Augentropfen oder -salbe infrage.
Abhängig vom klinischen Befund sollten antibiotische Augentropfen mindestens 5-mal täglich bzw. bis zu viertelstündlich getropft werden (Behrens-Baumann 2004). Fehlerhaft ist eine Applikationshäufigkeit unter 5-mal (Pumpmechanismus der Bakterien!). Im Allgemeinen sollte die Anwendung eine Woche nicht überschreiten (dann abruptes Absetzen, kein Ausschleichen).
Bei Pilzinfektionen Konjunktivitis:bakteriellekommen lokal Amphotericin B, Natamycin 5 %, Fluconazol und Voriconazol zur Anwendung (Behrens-Baumann 2002). Zur Behandlung der Akanthamöbenkeratitis werden Diamidine wie Propamidinisethionat, Dibrompropamidin oder Pentamidinisethionat, Aminoglykoside wie Neomycin, Gentamicin oder Tobramycin und als Antiseptika Polihexanid oder Chlorhexidin eingesetzt (Behrens-Baumann und Kramer 2002).
Bakterielle Keratitis/Ulcus corneae: Hierbei handelt es sich um eine für das Auge gefährliche Situation, da eine intraokulare Beteiligung entstehen kann, die bei Perforation angefacht wird und über eine Endophthalmitis zur Phthisis bulbi führen kann. Die Keratitis:bakterielle, TherapieTherapie sollte nach Bindehautabstrich (ohne Anästhetikum!) und Ulcus corneae:TherapieMaterialentnahme vom Ulkusgrund gemäß Resistogramm erfolgen. Die halbstündliche bis stündliche Gabe des Antibiotikums ist wichtig, um den Wirkspiegel aufrechtzuerhalten. Die subkonjunktivale Gabe eines Antibiotikums kann den Wirkspiegel erhöhen. Die antiseptische Spülung der Tränenwege ist nützlich, da von hier aus eine bakterielle Besiedlung unterhalten werden kann.
Weitere Details zur Antiseptik sowie zur Chemoprophylaxe und Chemotherapie ![]() Online-Ergänzung 5.15.
Online-Ergänzung 5.15.
Systemische Chemoprophylaxe und Chemotherapie
Durch antibiotische Tropfenbehandlung ist nur in Hornhaut und Vorderkammer eine therapeutische Dosis erzielbar (Donnenfeld et al. 1997). Systemische Antibiotika Antiseptik:Ophthalmologie\"\r\"AntispeptikOphthaldiffundieren am wenigsten in bradytrophe Gewebe wie Glaskörper, Linse oder Hornhaut. Zur Erzielung eines intraokularen Wirkspiegels muss die Blut-Kammerwasser-Schranke überwunden werden. Kommt es im Rahmen einer Infektion zur Störung der Blut-Kammerwasser-Schranke, ist die Penetration jedoch vielfach höher. Auch durch subkonjunktivale oder parabulbäre Applikation ist eine Konzentrationserhöhung in der Vorderkammer erreichbar. Bei Endophthalmitiden wird eine intrakamerale oder meist besser intravitreale Injektion vorgenommen.
Perioperative Antibiotikaprophylaxe: Bei aseptischen intra- und extraokulären Eingriffen ist eine systemische Antibiotikaprophylaxe unüblich. Nach penetrierender Verletzung wird prophylaktisch ein systemisches Antibiotikum gegeben, z. B. Cefuroxim (Behrens-Baumann et al. 2003) oder Moxifloxacin (Viestenz et al. 2008).
Intraoperative Antibiotikaprophylaxe: Bisher konnte in keiner prospektiven kontrollierten placebokontrollierten Studie der Nachweis der Senkung der Endophthalmitisinzidenz erbracht werden (Behrens-Baumann et al. 2003). Zur Überprüfung der in Schweden eingeführten intrakameralen Antibiotikaprophylaxe:intraoperative, OphthalmologieCefuroxim-Injektion am Ende der Katarakt-OP wurde die ESCRS-Studie durchgeführt (Barry et al. 2007). Aufgrund der Studienlimitationen kann keine Empfehlung zur intrakameralen Antibiotikaprophylaxe abgeleitet werden (Behrens-Baumann 2008).
Chemotherapie: Die Behandlung der Endophthalmitis ist nach wie vor uneinheitlich. Das liegt daran, dass jeder Fall individuelle Besonderheiten aufweist, z. B. Aggressivität der Erreger, Lokalisation der Infektion, Zeitpunkt des Therapiebeginns, Art einer vorherigen OP oder Grunderkrankung (Behrens-Baumann et al. 2010). Endophthalmitis:TherapieEmpfehlungen finden sich z. B. in der Leitlinie der Deutschsprachigen Gesellschaft für Intraokularlinsen-Implantation (DGII – www.dgii.org), in den ESCRS Guidelines (Barry et al. 2007) sowie der PEG Leitlinie (2010).
Die antibiotische Behandlung ist bei allen Infektionen des Augeninneren indiziert. Die akute Endophthalmitis erfordert als Notfall sofortiges Handeln.
Gravierende Infektionen mit ungünstiger Prognose sollten unmittelbar nach mikrobiologischer Materialentnahme mit einem Breitbandantibiotikum evtl. in Kombination mit einem weiteren Antibiotikum je nach zu erwartendem Erregerspektrum systemisch behandelt werden. Als Grundlage zur Auswahl ist der sog. Magdeburger Dreistufenplan geeignet, der fortlaufend aktualisiert wird (www.med.uni-magdeburg.de/augenklinik). Bei Fremdkörperverletzungen sollte immer eine Kombinationstherapie gewählt werden, z. B. β-Lactam-Antibiotikum + Aminoglykosid.
Bakterielle Dakryoadenitis und -zystitis: Zur Prävention einer Ausbreitung sollte systemisch behandelt werden (Lid- oder Orbitaphlegmone oder Sinus-cavernosus-Thrombose als lebensbedrohliche Komplikation sind mögliche Folgen unzureichender oder Dakryadenitis, bakterielleverspäteter Behandlung). Abszesse des Tränensacks sind zu spalten. Nach Dakryzystitis, bakterielleAbklingen der Entzündungsreaktion in der Umgebung sollte eine Dakryozystorhinostomie oder Tränensackexstirpation erfolgen. Falls der Verschluss im Bereich des Tränensacks weiterhin besteht, könnte sonst wieder eine Phlegmone entstehen.
5.15.4. Indikation zur mikrobiologischen Diagnostik und Materialentnahme
Bei Diagnostik, mikrobiologische, Ophthalmologieinfektiös bedingter Endophthalmitis ist der Erregernachweis mit Resistogramm wichtig, da hierdurch die gezielte Antibiotikatherapie ermöglicht wird. Er sollte so schnell wie möglich nach Diagnosestellung erfolgen.
Das Ergebnis der Mikroskopie liegt nach wenigen Minuten vor, das Resultat der Kultur nach etwa Ophthalmologie, antiinfektiöse Maßnahmen\"\r\"OphthalmologieantinifektMassn24 Stunden, das der Resistenztestung nach 6–10 Stunden bei Anwendung der RAST-Methode bzw. nach 24–48 Stunden bei konventionellen Methoden.
Die Materialgewinnung erfolgt aus dem Bindehautsack mittels Watteträger. Beim Ulcus corneae soll Material aus dem Ulkusgrund oder dem unterminierten Rand mit dem Hockeymesser gewonnen werden. In diesem Fall sowie bei Endophthalmitis ist die Beimpfung eines Nährbodens oder Transportmediums sinnvoll, weil der Transport auf Wattetupfern einen hohen Erregerverlust erzeugt und die Nachweisrate reduziert, die im Idealfall um 90 % liegt (Mino de Kaspar et al. 1993).
Bei Verdacht auf Endophthalmitis wird die höchste Nachweisrate bei mikroskopischer und mikrobiologischer Aufarbeitung von Glaskörpermaterial erzielt (Details ![]() Online-Ergänzung 5.15).
Online-Ergänzung 5.15).
5.15.5. Infektionsüberwachung
Entsprechend den Empfehlungen des Deutschen Ärztetags 1994, des RKI und der DGKH ist in der Ophthalmologie wie in allen operativen Disziplinen die einrichtungsinterne Erfassung und Bewertung von Krankenhausinfektionen als ein entscheidendes Kriterium der hygienischen Infektionsüberwachung, OphthalmologieQualitätssicherung durchzuführen.
5.16. Weaningzentrum
Ralph Ewert, Christian Warnke und Evelyn Bartsch
5.16.1. Besonderheiten von Weaningpatienten aus hygienisch-infektiologischer Sicht
Die maschinelle Beatmung spielt eine zentrale Rolle in der modernen Intensivmedizin, wobei seit Jahren die Patientenzahl mit längeren Beatmungszeiten steigt. Hintergrund ist u. a. die verbesserte medizinische Versorgung von multimorbiden und älteren Patienten. Als Folge resultiert ein Weaningpatientenimmer größerer Teil an Patienten, bei dem die Entwöhnung von der Beatmung oft schwierig ist (sog. Weaningprobleme). Etwa 7–10 % der Intensivpatienten mit einer länger als 3 Wochen dauernden Beatmung erfüllen die Kriterien einer prolongierten Entwöhnung (Aboussouan et al. 2008), die als Notwendigkeit von mehr als 3 Weaningversuchen oder einer Weaningdauer von mehr als 7 Tagen definiert ist (Boles et al. 2007). Diese Patienten binden einen wesentlichen Teil der apparativen und personellen Ressourcen einer Intensivstation. Durch den wachsenden Bedarf an Beatmungsbetten, die beschränkten Ressourcen und den permanenten Kostendruck wurden daher weltweit sog. Weaningzentren etabliert. Auch in Deutschland existieren solche Zentren seit Jahren, wobei in letzter Zeit eine deutliche Zunahme sichtbar wird (Schönhofer und Wagner 2006, Schönhofer et al. 1999, Schönhofer et al. 2008a).
Folgende Merkmale bestimmen das erhöhte Infektionsrisiko für Weaningpatienten:
-
•
Durchschnittsalter > 60 Jahre, lange Krankenhausliegedauer, häufig vorheriger Aufenthalt in verschiedenen medizinischen Einrichtungen mit mehrfacher Antibiotikatherapie (infektiologisch Hochrisikopatienten), hoher Versorgungsgrad mit Kathetern und Weaningpatienten:InfektionsrisikoSonden (ZVK, Dialysekatheter, Drainage, Magensonde, Harnblasenkatheter) und lange Verweildauer der Katheter.
-
•
Patienten sind bei der Übernahme meist > 30 Tage beatmet (Schönhofer et al. 2008a); mit zunehmender Beatmungsdauer steigt die Mortalität (Esteban et al. 2002, Pilcher et al. 2005), zumindest z. T. bedingt durch beatmungsassoziierte Komplikationen wie Pneumonie (Tobin 1994); in jüngeren Jahren scheinen pulmonale Infektionen einen geringeren Einfluss auf die Mortalität in erfahrenen Weaningzentren zu spielen (Bachfeld und Schönhofer 2008).
-
•
Erhöhte Aspirationsgefahr bei Schluckstörung durch Dekonditionierung, pharyngeale Desensibilisierung (Sekret, Magensonde) und/oder Trachealkanüle.
-
•
Hohe Komorbidität (ca. 28 % der Patienten bei Aufnahme dialysepflichtig, verbunden mit mehrfach erhöhtem Letalitätsrisiko; APACHE-II-Score ca. 30).
5.16.2. Eingangsisolierung
Bei allen Patienten führen wir bei der Aufnahme eine Eingangsisolierung im Einzelzimmer in Verbindung mit einem MRSA-Screening durch. Bis zum Eintreffen der Befunde (negative PCR reicht aus, wenn nicht inhibiert) verlässt der Patient das Zimmer nur mit Weaningzentrum:Eingangsisolierungkompletter Schutzbekleidung. Personal und Besucher tragen bei Aufenthalt im Zimmer bzw. bei Begleitung vollständige Schutzbekleidung. Ein Sanierungsversuch wird erst dann durchgeführt, wenn alle Katheter, Sonden und Beatmungszugänge entfernt wurden. Während des gesamten Aufenthalts auf der Weaningstation erfolgt routinemäßig bei jedem Patienten ein wöchentliches kulturelles MRSA-Screening aus den Nasenvorhöfen, dem Rachen, Tracheostoma, evtl. vorhandenen Wunden und vom Perineum. Zusätzlich werden Urin und Trachealsekret auf Erreger/Resistenz untersucht.
5.16.3. Prävention im Vordergrund stehender nosokomialer Infektionen
Dekubitalulzera: Teilweise fortgeschrittene Dekubitalulzerationen bedürfen der konsequenten Versorgung einschließlich chirurgischer Intervention (Püllen 2007).
Atemwegsinfektionen: Aus infektiologischer Sicht sind Maßnahmen zur Vermeidung von DekubitalulzeraAtemwegsinfektionen essenziell. Neben den üblichen Verfahrensweisen (Oberkörperhochlagerung, antiseptische Mund-, Nasen- und Rachenpflege bei kolonisierten Patienten in der Früh- und Atemwegsinfektion(en), Prävention, WeaningzentrumSpätschicht, nachts nur bei Bedarf zur Gewährleistung der Nachtruhe, antiseptische Tracheostomapflege) sollen nur bei klinischem Bedarf endotracheale Absaugungen mit geschlossenem System oder sterilem Katheter und sterilen Handschuhen vorgenommen werden. Verneblersets für Medikamente werden alle 24 Stunden gewechselt, wobei routinemäßig keine Anfeuchtung der Inspirationsluft vorgenommen wird. Der Wechsel von HME-Filter, Absaugungen sowie Schlauchverlängerung (Gänsegurgel) erfolgen alle 48 Stunden (bei MRSA-Kolonisation bzw. Infektion alle 24 Stunden). Beatmungsschläuche werden nur bei sichtbarer Verunreinigung gewechselt. Ein weiterer Bestandteil der Prophylaxe ist die gezielte Schluckdiagnostik und bei Störungen das strukturierte Training des Schluckvorgangs (Kausäckchen, Schlucken unter Aufsicht und Anleitung, Flüssig- und nachfolgend breiige Nahrung). Durch konsequentes Vorgehen beim Schlucktraining können Aspirationen deutlich reduziert werden.
Blutstrominfektionen: Bei langzeitbeatmeten Patienten führen wir bei Übernahme externer Patienten einen zeitnahen Wechsel aller Zugänge mit Verwendung von Kathetern mit wenigen Lumina zur Minimierung der mikrobiellen Besiedlungsfläche durch und entfernen intravasale Blutstrominfektion(en):Prävention, WeainingzentrumKatheter, sobald es vertretbar ist. Falls keine Transparentverbände eingesetzt werden, muss bei nicht vorhandener Compliance des Patienten zur Beurteilung der Einstichstelle täglich der Verband gewechselt werden. Zur Infektionsprävention hat sich beim Verbandswechsel die Applikation octenidinbasierter Hautantiseptika als wirksam erwiesen.
Octenidindihydrochlorid wirkt langsamer als alkoholische Hautantiseptika, erreicht aber bei entsprechend langer Einwirkungszeit ähnliche Reduktionen (Kramer und Assadian 2008). Im Vergleich zu einem Hautantiseptikum auf Basis von 74-prozentigem Ethanol und 10-prozentigem Propan-2-ol erwies sich die Kombination von 0,1-prozentigem Octenidindihydrochlorid mit 30-prozentigem Propan-1-ol und 45-prozentigem Propan-2-ol an der Katheterinsertionsstelle über 24 Stunden effektiver in der Reduktion von Hautbakterien (Dettenkofer et al. 2002).
Neben dem Vermeiden häufigen An- und Abstöpselns der Zugänge (bei zunehmender Mobilisierung der Patienten nicht zu umgehen), Handschuhpflicht bei Arbeiten am Katheter, konsequenter alkoholischer Desinfektion der Wegehähne, Verwendung von stets neuen, sterilen Verschlüssen erfolgt ein regelmäßiger aseptischer Wegehahnwechsel alle 72 Stunden. Wichtig ist, dass die Beatmungsschläuche nicht mit zentralen Gefäßzugängen in Berührung kommen. Das erfolgt durch Lagerung der Beatmungsschläuche auf der gegenüberliegenden Körperseite des Katheters und Abdeckung desselben mit einem sterilen Tuch. Beim Wechsel der Infusionssysteme wird für eine sterile Unterlage der Konnektionsstelle gesorgt.
Dialysekatheter: Dialysekatheter sind für die Hämodialyse reserviert und dürfen nur in Notfallsituationen artfremd verwendet werden. Wenn möglich, sollten sie nicht in der V. femoralis liegen. Die Durchtrittsstelle durch die Haut wird abgedeckt (z. B. Cutiplastverband) und täglich desinfiziert. Die Dialysekatheter:Weaningzentrumflexiblen Enden werden vor jedem Gebrauch mit alkoholischem Desinfektionsmittel besprüht, dann wird die „Blockung“ mit sterilen Spritzen großzügig (je Schenkel 10 ml) abgezogen und verworfen. Anschließend werden die Schenkel mit 0,9-prozentiger NaCl-Lösung gespült und die Dialyseschlauchsysteme mit dem Katheter verbunden. Nach Beendigung der Dialyse muss vor Dekonnektierung erneut eine Desinfektion der Konnektionsstelle stattfinden. Dann erfolgen die Spülung der Katheterschenkel mit 0,9-prozentiger NaCl-Lösung und anschließend die Blockung der Schenkel entsprechend den Füllvolumina der einzelnen Seiten (Trinatriumcitratlösung 46,7-prozentig). Dann erst erfolgt der Verschluss der Schenkel mit sterilen Kombistoppern. Abschließend wird ein steriler Verband um den Katheter gelegt.
Harnwegsinfektionen: Eine weitere wichtige Infektionsquelle bei intensivmedizinisch betreuten Patienten sind Harnwegsinfektionen. Zur Reduktion führen wir nach Übernahme der Patienten auf die Weaningstation einen Wechsel des Dauerkatheters durch. Wichtig ist dabei die Harnwegsinfektion(en):Prävention, WeaningzentrumÜberlegung, ob der Patient wirklich einen Katheter benötigt. Bei längerem Bedarf eines Katheters wird die Möglichkeit des suprapubischen Zugangs geprüft. Die Pflege erfolgt nach üblichen Standards (Kap. 5.12).
Wundinfektionen: Sie bedürfen des speziellen Managements und sind häufig nur in enger Kooperation mit chirurgisch tätigen Kollegen zu beherrschen. Wenn möglich, sollte das Wundsekret über Drainagen abgeleitet werden. Bei ausgedehnten, tiefen Wunden bevorzugen wir Vakuumverbände, die durchWundinfektion(en):Prävention, Weaningzentrum die Saugeinrichtung die Mobilität der Patienten gelegentlich einschränken.
Ursachen für das erhöhte Infektionsrisiko bei Weaningpatienten:
-
•
lange Krankenhausliegedauer, häufig in mehreren medizinische Einrichtungen gewesen,
-
•
hoher Versorgungsgrad mit „künstlichen“ Kathetern und Sonden (ZVK, Dialysekatheter, Drainagen, Magensonde, Harnblasenkatheter) und lange Verweildauer der Katheter,
-
•
lange Beatmungsdauer,
-
•
erhöhte Aspirationsgefahr bei Schluckstörung durch Dekonditionierung, pharyngeale Desensibilisierung (Sekret, Magensonde) und/oder Trachealkanüle.
5.16.4. Räumlichkeiten
Es hat es Weaningzentrum:nosokomiale Infektion(en), Prävention\"\r\"WeaningzentrumNIPraeventionsich als sinnvoll herausgestellt, schon bei der Planung des Weaningzentrums den Krankenhaushygieniker einzubeziehen. Die Anforderungen entsprechen im Wesentlichen denen einer Intensivstation, wobei größerer Platzbedarf besteht (Toilette im Zimmer, Duschmöglichkeit, auch Weaningzentrum:Räumlichkeitenwenn der Patient nur im Pflegestuhl mobilisiert und noch beatmet ist). Wasserhähne an Waschbecken mit direktem Patientenkontakt sollen ohne Handkontakt zu betätigen sein. Der Wasserstrahl ist neben den Siphon gerichtet, um Verspritzen von erregerhaltigem Wasser zu vermeiden, die Siphonabdeckung ist nach oben gewölbt und es sind endständige Sterilfilter am Wasserauslass installiert. Mindestens zwei Einzelzimmer sollten für die Eingangsisolierung vorhanden sein. Lagerflächen außerhalb der Zimmer müssen ausreichend vorhanden sein, da im Vergleich zu Intensivstationen deutlich mehr Mobilisierungshilfen benötigt werden (Pflegestühle, Stehbrett, Balancetrainer, Trainingsgeräte).
5.16.5. Apparative Ausstattung und Verbrauchsmaterialien
Die Prävalenz von Problemerregern ist bei Patienten einer Weaningstation im Vergleich zu einer Intensivstation in der Akutversorgung deutlich höher. Daher sollten bei der apparativen Ausstattung grundsätzliche Überlegungen beachtet werden. Medizinisch-technische Geräte sollten, da sie Weaningzentrum:Ausstattungleider oft bauartbedingt schlecht desinfizierbar sind (Ultraschall, EKG, Physiotherapiegeräte), zur ausschließlichen Verwendung auf der Weaningstation vorgesehen werden.
Auch alle weiteren Geräte sollten allein für diese Station verfügbar sein, da eine erhebliche Zahl der Patienten mit multiresistenten Erregern besiedelt bzw. infiziert ist und trotz Einhaltung aller Hygienemaßnahmen durch das auf Weaningstationen gut geschulte Personal bei der Ausleihe von Hilfsmitteln oder medizinischen Geräten von anderen Stationen die Gefahr einer Erregerausbreitung nicht ausgeschlossen werden kann. Auf der Weaningstation selbst wird eine solche Ausbreitung durch strikte Anwendung aller Hygienemaßnahmen einschließlich der Verwendung von vollständig desinfizierbaren Hilfsmitteln, einer patientengebundenen Medizintechnik (Monitoring ambulant/stationär ist identisch, individuelles PDMS [Patientendaten-Managementsystem] mit elektronischer Patientenakte) und die räumliche Abtrennung von Patienten mit Problemerregern minimiert. Für Computer sind integriertes Touchscreen und eine wisch-, besser tauchdesinfizierbare Tastatur zu gewährleisten. Bei Verwendung einer „Maus“ wird diese nach Entlassung eines mit multiresistenten Erregern besiedelten Patienten entsorgt.
Verbrauchsmaterialien sollten nur in kleinen Mengen im Patientenzimmer vorgehalten werden, um Verwurf bei Kontamination vorzubeugen (Modulsystems ist günstig).
Desinfektionsmittelspender müssen mindestens an allen Arbeitsflächen sowie am Eingang und Ausgang des Zimmers vorhanden und bequem für alle Mitarbeiter mit dem Ellenbogen erreichbar sein. Die tägliche Flächendesinfektion aller Betten, Arbeitsflächen, sämtlicher Griffe und aller Pflege- und Hilfsmittel ist notwendig zur Unterbrechung von Infektionsketten.
5.16.6. Anforderungen an das Personal
Entsprechend den Besonderheiten der zu versorgenden Patienten muss ausreichend geschultes und motiviertes Personal vorhanden sein. Obwohl diese Tatsache trivial ist, bestehen häufig Defizite. So kann eine Einzelzimmerpflege oder Mehrbettpflege mit Umkehrisolation bei Weaningzentrum:Personal, AnforderungenIntensivpatienten nur mit ausreichendem Personal durchgeführt werden. Barrierepflege innerhalb eines Patientenzimmers bedeutet eine enorme zeitliche Belastung (durch Schutzkleidungswechsel) für das Personal. Daher führt jeder Personalmangel zu Defiziten bei der Durchsetzung des Hygieneregimes. Die in diesem Zusammenhang vom Kostenträger hinterfragten wirtschaftlichen Kennzahlen lassen sich nicht oder nur unzureichend von der Intensivmedizin auf den therapeutischen Aufwand bei der Entwöhnung langzeitbeatmeter Patienten übertragen (Schönhofer et al. 2008b).
Regelmäßige Schulungen des Personals und die ständige Kommunikation im Team (hierzu gehören alle Mitarbeiter aus der Pflege, dem Arztbereich, der Physiotherapie u. a. m.) sowie mit den Hilfsdiensten auf der Station (Administration, Reinigung, Modulversorgung) zu infektiologischen Besonderheiten der Patienten sind unverzichtbarer Bestandteil der täglichen Arbeit.
Empfehlenswert ist ein monatlicher Abstrich der Nasenhöfe auf MRSA-Besiedlung aller Mitarbeiter im Team bei transparentem Umgang mit den Ergebnissen (Sanierung, zusätzliche Schutzmaßnahmen bei Tätigkeit am Patienten, ggf. zeitweilige Freistellung bzw. Arbeitsplatzwechsel).
Zu den Anforderungen an die personellen, räumlichen, organisatorischen und materiellen/apparativen Ausstattungen von Weaningstationen werden durch eine spezielle Arbeitsgruppe der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin Empfehlungen erarbeitet, die im Rahmen der Akkreditierung solcher Zentren Beachtung finden. Die aktuelle Situation wurde jüngst detailliert ausgewertet (Schönhofer et al. 2008a).
5.16.7. Fazit
Es steht außer Frage, dass hygienische und infektiologische Probleme einen engen Zusammenhang mit dem klinischen Zustand der Patienten zeigen. Dieser hängt einerseits vom Patienten, von seinen Grunderkrankungen und der Gesamtkonstitution ab, wird jedoch andererseits durch eine Vielzahl intensivmedizinischer Maßnahmen beeinflusst. Angefangen vom Lagerungsmanagement über die Sedierung bis hin zur Medikation und Ernährung existieren eine Reihe direkter und indirekter Faktoren, die auf die Konstitution des Patienten Einfluss haben. Zu den einzelnen Sachverhalten existieren Empfehlungen, die jedoch mit eigenen Erfahrungen untersetzt werden müssen.
Diese Situation stellt sich in gleicher Weise auch für die Hygieneanweisungen auf einer Weaningstation dar. Erst durch praktisches Umsetzen werden die Grenzen sichtbar und es sind eigene Strategien zur lokal angepassten Umsetzung gefragt. So müssen auch für weniger typische Verrichtungen auf einer Intensivstation (wir verwenden sehr erfolgreich das therapeutische Puppenspiel) die Regeln der Infektionsvermeidung eingehalten werden. So konnten wir auf unserer Weaningstation Puppen aus dem Fundus unserer Therapeutin nur bei nicht mit Problemerregern kolonisierten oder infizierten Patienten einsetzen. Jetzt sind wir dazu übergegangen, bei besiedelten oder infizierten Patienten die Puppen direkt im Zimmer mit ihnen zusammen zu fertigen, und haben somit die psychologischen Ansätze mit den Aspekten der Entwicklung der Feinmotorik verbunden. Diese Aspekte sind auch bei verschiedenen anderen Gesellschaftsspielen von Belang, wobei die verwendeten Materialien immer abwaschbar, d. h. desinfizierbar sein müssen (teilweise kann man sie selbst gummieren, um das zu erreichen).
Die Umsetzung ethischer und medizinisch-qualitativer Anforderungen an ein Weaningzentrum spiegeln sich auch in der Einhaltung hygienischer Standards wider.
5.17. Internistische Endoskopie
ttmar Leiß und Heike Martiny ![]() Online-Ergänzung 5.17.
Online-Ergänzung 5.17.
„The endoscopist tends to see the hole of the patient but not the whole patient and tends to see the whole instrument but not the hole Weaningzentrum\"\r\"Weaningzentrum of the instrument“ – dieses Wortspiel bringt das Dilemma bei der Übertragung von Infektionserregern durch endoskopische Untersuchungen auf den Punkt. Die Betrachtung des „ganzen“ Patienten, d. h. die Berücksichtigung von Alter, Abwehrlage, vorliegenden Begleiterkrankungen usw., wurde bei den infektionsbegünstigenden Faktoren im Rahmen endoskopischer Untersuchungen (Kap. 4.6) erörtert. Auf den zweiten Aspekt, die konstruktiven Besonderheiten von Endoskopen und die daraus resultierenden Probleme bei der Aufbereitung, wird nachfolgend eingegangen. Die detaillierte Erörterung konstruktiver Besonderheiten erscheint insbesondere deshalb geboten, weil die Mehrzahl der Übertragungen von Infektionserregern bei endoskopischen Untersuchungen durch ein nicht korrekt aufbereitetes Endoskop oder endoskopisches Zusatzinstrumentarium erfolgt (Leiß 2002, Nelson und Muscarella 2006).
5.17.1. Das Endoskop als komplexes Medizinprodukt
Zum schematischen Aufbau eines flexiblen Endoskops Abbildung 5.4 . Da sich die Kanalsysteme eines flexiblen Endoskops der direkten Betrachtung entziehen, können sowohl das Ausmaß einer Kontamination (Anreicherung mit Mikroorganismen) nach erfolgter Untersuchung als auch der Endoskop(e)Effekt der Reinigung und Desinfektion (Abreicherung von Mikroorganismen) nicht direkt beurteilt werden. In Untersuchungen zur Beurteilung der Effizienz des Reinigungsschritts werden daher dünne PTFE-Schläuche mit Durchmesser und Länge entsprechend dem Instrumentierkanal eines flexiblen Endoskops verwendet (Zühlsdorf et al. 2002, 2004, DIN ISO/TS 15883-5 2006). Nach Durchspülung der PTFE-Schläuche mit NaCl-Lösung und anschließender Befüllung mit Nähragar können die Reinigungsleistung visuell beurteilt und die bestehende mikrobielle Belastung kulturell analysiert werden.
Abb. 5.4.

Schematische Darstellung des Kanalsystems eines flexiblen Endoskop(e):flexibleEndoskops (Olympus).
Konstruktive Besonderheiten flexibler Endoskope wie die Zugänglichkeit der Instrumentierkanäle haben Einfluss auf die Effizienz der Reinigung (Dietze et al. 2001). Scheinbar marginale technische Änderungen am Endoskop, wie z. B. der Kappe des Biopsiekanals, können mit der Reinigung, der Desinfektion oder der Trocknung interferieren und Ursache von Ausbrüchen nosokomialer Infektionen sein (Kirschke et al. 2003). Das Design von Konnektoren, die ein flexibles Endoskop an ein RDG für Endoskope (RDG-E) ankoppeln, kann die Aufbereitung verbessern und die Versagerquote reduzieren (Ishino et al. 2003). Eine neuartige Lösung zur Ausschaltung der Innenkontamination sind an lumenlose flexible Endoskope gekoppelte Einwegkanalsysteme (![]() Online-Ergänzung 5.17).
Online-Ergänzung 5.17).
Prinzipiell kann ein Endoskop sowohl manuell als auch maschinell hygienisch korrekt aufbereitet werden (Frazer et al. 1993, Bradley und Babb 1995, Bader et al. 2002). Die maschinelle Aufbereitung ist wegen der Validierbarkeit des Prozesses zu bevorzugen (Bader et al. 2002).
5.17.2. Bioburden
Experimentelle Untersuchungen haben Daten zum Bioburden, d. h. der mikrobiologischen Belastung flexibler Endoskope nach der Untersuchung, ergeben. Unmittelbar nach Gastroskopie von Patienten mit H. pylori-Gastritis ließ sich aus Spüllösungen des Absaug- und Instrumentierkanals H. pylori mittels PCR in 61 % (Fantry 1995) und Bioburden:Endoskop(e)kulturell in 42 % (Nürnberg et al. 2003) nachweisen. Chu et al. (1998) konnten in Spüllösungen aus dem Instrumentierkanal von Gastroskopen unmittelbar nach Anwendung einen Bioburden von 7 × 109 KbE feststellen. Zühlsdorf et al. (2002) haben den Reinigungseffekt kommerzieller Reiniger in RDG-E getestet. Bei den nach Herstellerangaben angewendeten Prozessparametern war der Reinigungseffekt mancher Reinigungsprozesse unzulänglich.
Nach Gastroskopien von 17 HBsAg-positiven Patienten wurden in 5 Arbeitskanälen 6,5 × 104 bis 1,3 × 106 Viruskopien/Kanal, in 3 Luftkanälen 2,5 × 103 bis 2,8 × 104 Viruskopien/Kanal und in einem Wasserkanal 2,5 × 103 Viruskopien/Kanal gefunden, und zwar trotz Vorreinigung mit 200 ml Reinigungslösung (Ishino et al. 2005).
Die mikrobielle Belastung von Koloskopen ist ungleich höher. Da 1 g Stuhl 1012–14 Mikroorganismen enthält, stellt ein mit Stuhlresten kontaminierter Instrumentierkanal erhöhte Anforderungen an die Aufbereitung. Die alleinige Reinigung führt zu unzureichender Reduktion der Mikroorganismen, nur ein koordiniertes und aufeinander abgestimmtes Zusammenspiel von Reinigung, Spülung und nachfolgender Desinfektion kann die Kontamination so drastisch reduzieren bzw. komplett beseitigen, dass von dem Koloskop keine Gefahr der Übertragung von Infektionserregern auf den nachfolgenden Patienten ausgeht.
5.17.3. Anforderungen an die Aufbereitung flexibler Endoskope
Bei der Aufbereitung eines Endoskops muss immer davon ausgegangen werden, dass eine Kontamination mit einem Krankheitserreger stattgefunden hat. Nach der Reinigung flexibler Endoskope sind deshalb Desinfektionsmittel anzuwenden, die gegen alle durch Endoskope übertragbaren Mikroorganismen wirksam sind.
Anforderung an Reinigung und Reinigungslösungen
Zur Vorreinigung und Reinigung flexibler Endoskope können Lösungen oberflächenaktiver Substanzen (Tenside) oder enzymatische Reiniger verwendet werden.
Kombiniert reinigende und desinfizierende Lösungen dürfen nur verwendet werden, wenn eine fixierende Wirksamkeit ausgeschlossen werden kann (Alvarado und Reichelderfer 2000, Anforderungen an die Hygiene bei der Aufbereitung flexibler Endoskope 2002, Rey und Kruse 2003b, Zühlsdorf et al 2004).
Fixierende Wirkungen sind sowohl von Glutaraldehyd (Glutaral) als auch von peressigsäurehaltigen Produkten und Alkoholen beschrieben (Kampf et al. 2004). Reinigung:EndoskopeDie Reinigungslösung sollte zudem nicht schäumend sein.
Das Ziel des Reinigungsschritts, die möglichst rückstandsfreie Entfernung organischen Materials und chemischer Substanzen, konnte in Untersuchungen mit radioaktiv markierten kontaminierten Medizinprodukten nicht erreicht werden (Roth et al. 1999). Eine vergleichende Untersuchung mit verschiedenen Reinigern bezüglich Effizienz, Reproduzierbarkeit und Standardisierbarkeit des Reinigungsschritts bei Aufbereitung von Endoskopen im RDG-E ergab, dass die Effizienz des Reinigungsschritts im RDG-E nicht ohne Optimierung der jeweiligen Prozessparameter erreichbar ist (Zühlsdorf et al. 2002). Bei unzureichender Reinigung sind Wirksamkeit und Effektivität der nachfolgenden Desinfektion nicht gewährleistet – nur was sauber ist, kann auch desinfiziert werden (Chaufour et al. 1999).
Anforderungen an Desinfektionsmittel für Endoskope
Ein flexibles Endoskop besteht aus vielen unterschiedlichen thermolabilen Materialien. Nach Rutala und Weber (1999) sollte ein ideales Desinfektionsmittel für Endoskope ein breites Wirkungsspektrum haben, schnell wirken, für Personal und nachfolgend untersuchte Patienten nicht toxisch und frei Desinfektionsmittel:Endoskopevon Nebenwirkungen, materialschonend, nicht korrosiv, umweltfreundlich und leicht abbaubar sein (Tab. 5.28 ). Die europäische Gesellschaft für gastroenterologische Endoskopie hat eine Empfehlung für die Auswahl eines Desinfektionsmittels publiziert (Rey und Kruse 2003a).
Tab. 5.28.
Anforderungen an ein ideales Desinfektionsmittel zur Desinfektion flexibler Endoskope.
| Geforderte Eigenschaft | Spezifikation |
|---|---|
| Hohe Effizienz | Sollte virozid, bakteriozid, tuberkulozid und fungizid sein |
| Schnelle Wirksamkeit | Sollte in der Lage sein, eine Desinfektion schnell zu erreichen |
| Materialverträglichkeit | Auch nach mehrfacher Anwendung nur vernachlässigbare Veränderungen in Aussehen oder Funktion, keine schädigenden Wirkungen für Metall (Korrosivität), Gummi, Plastik oder andere Materialien |
| Fehlende Toxizität | Keine Gesundheitsrisiken für Anwender und Patienten, umweltverträglich |
| Geruchlosigkeit | Keine Geruchsbelästigung |
| Fehlende Färbbarkeit | Keine Verfärbung von Haut, Schutzkittel, MP und Arbeitsflächen |
| Kein Eiweißfehler | Kein Wirkungsverlust bei Kontamination mit organischem Material |
| Möglichkeit des Monitorings | Möglichkeit der Kontrolle der minimalen effektiven Konzentrationen mit einfachen Verfahren |
| Benutzerfreundlichkeit | Einfach anwendbar ohne aufwändiges Training |
| Lange Nutzungszeit | Sollte bei manuellem Vorgehen wiederholt und über einen längeren Zeitraum genutzt werden können |
| Lange Haltbarkeit | Sollte vor Gebrauch lange und ohne Wirkungsverlust gelagert werden können |
| Einfache Entsorgung | Sollte ohne spezielle Maßnahmen (wie z. B. vorherige Neutralisation oder Sammlung in Spezialgefäßen) entsorgbar sein |
(mod. nach Rutala und Weber 1999)
Die derzeit zur Aufbereitung flexibler Endoskope verwendeten Desinfektionsmittel haben gewisse Limitationen und Nebenwirkungen, die der Anwender kennen und berücksichtigen sollte. Den Vorteilen von Glutaral bezüglich breiten Wirkungsspektrums und Materialverträglichkeit stehen allergische und toxische Nebenwirkungen gegenüber. Nach Desinfektion mit Glutaral müssen Desinfektionsmittelreste abgespült werden, um allergische Komplikationen wie Pharyngitis, blutige Diarrhöen und Bauchkrämpfe zu vermeiden (Leiß 2002). Als thermolabile Instrumente können flexible Endoskope nicht großer Hitze und metallhaltiges endoskopisches Zusatzinstrumentarium nicht korrodierenden, materialschädigenden Desinfektionsmitteln ausgesetzt werden. Oxidationsmittel haben korrodierende Eigenschaften und sind für metallhaltige Instrumente nicht geeignet. Quaternäre Ammoniumverbindungen haben bei Raumtemperatur Wirkungslücken insbesondere gegen M. tuberculosis und hydrophile Viren und sind für die Endoskopaufbereitung nicht empfehlenswert. Die sorgfältige Zubereitung der Reinigungs- und Desinfektionsmittellösungen und Einhaltung der Wechselintervalle (Standzeiten) muss beachtet werden.
Biofilmbildung in Endoskopkanälen kann die Reinigung und Desinfektion beeinträchtigen. Ein Vorteil enzymatischer Reiniger bezüglich Abbau/Beseitigung eines Biofilms ist nicht belegt. Da Mikroorganismen im Biofilm vor der Einwirkung von Desinfektionsmitteln geschützt sind, können sie im Biofilm überleben und nachfolgend Infektionen verursachen. Künftige Testungen der Wirksamkeit von Desinfektionsmitteln sollten daher die Besonderheiten der Biofilmbildung in Endoskopkanälen berücksichtigen (Alfa und Howie 2009).
Bei der Aufbereitung flexibler Endoskope ist in Deutschland nach wie vor Glutaral das am häufigsten verwendete Desinfektionsmittel (Nelson und Muscarella 2006, Leiß et al. 2008), während z. B. in Frankreich (aufgrund ministerieller Regelung) Peressigsäure dominiert (Leiß et al. 2008).
Anforderungen an RDG-E
Die Aufbereitung im geschlossenen System des RDG-E reduziert die Desinfektionsmittelbelastung für das Personal und die zeitliche Bindung des Personals, erleichtert die Aufbereitung, standardisiert das Aufbereitungsverfahren und erlaubt sowohl eine rückverfolgende Dokumentation der Aufbereitung als auch einen validierbaren Aufbereitungsprozess.
Anforderungen an RDG-E (ESGE guideline committee 2000, Höller et al. 2005, DIN EN ISO 2009) beinhalten einen integrierten Dichtheitstest, die Aufbereitung des Wassers zur Schlussspülung (z. B. thermische Desinfektion, Sterilfiltration) und wählbare Programme mit detaillierter RDG-EFehlermeldung. Da RDG-E z. B. mit Pseudomonaden kontaminiert sein können, sollten Anforderungen an moderne RDG-E auch Programmschritte zur Desinfektion des RDG-E selbst beinhalten, bei der alle möglicherweise kontaminierten RDG-E-Bereiche desinfiziert werden. Ferner sind folgende Kriterien für die Geräteauswahl von Bedeutung:
-
•
Unabhängigkeit des RDG-E vom Fabrikat/Hersteller der eingesetzten Endoskope,
-
•
Unabhängigkeit des RDG-E vom Hersteller der eingesetzten Chemie,
-
•
Erfüllung der Anforderungen der DIN ISO/TS 15883-5; die Wirksamkeit soll gemäß Norm im Gesamtprozess (Reinigung und Desinfektion) 9 log-Stufen betragen,
-
•
Einzelkanalprüfung,
-
•
keine Totstrecken in der Überwachung der Endoskopkanäle.
Qualität des Schlussspülwassers
Ein lange vernachlässigter und im internationalen Vergleich unterschiedlich gehandhabter Aspekt (Leiß et al. 2002) betrifft die hygienischen Anforderungen an das zur Schlussspülung zwecks Entfernung von Desinfektionsmittelrückständen verwendete Wasser (Muscarella 2002). Es muss frei von Krankheitserregern sein. Bei Verwendung von Trinkwasser z. B. im Rahmen der manuellen Endoskopaufbereitung kann eine Rekontamination eintreten. RDG-E, in denen das zur Schlussspülung verwendete Wasser durch Erhitzen desinfiziert und anschließend gekühlt wird, sind zu bevorzugen (Bader et al. 2002, Höller et al. 2005).
5.17.4. Prävention der Erregerübertragung in der Endoskopie
Die Endoskop(e):Aufbereitung\"\r\"EndoskopeAufbereitungentscheidende Maßnahme ist die hygienisch korrekte Aufbereitung von Endoskopen und Medizinprodukteaufbereitung:Endoskope\"\r\"EndoskopeAufbereitungendoskopischem Zusatzinstrumentarium. Die hygienisch korrekte Aufbereitung komplexer MP wie flexibler Endoskope ist nicht durch eine einzelne Maßnahme erreichbar.
Der Prozess der Abreicherung von Mikroorganismen beinhaltet ein aufeinander abgestimmtes mehrstufiges Verfahren, das bei der Aufbereitung flexibler Endoskope aus den Teilschritten Vorreinigung, Reinigung, Desinfektion, Schlussspülung und Trocknung besteht.
Das Endoskop darf – wie andere MP – nur von Personen angewendet und aufbereitet werden, die die dafür erforderliche Ausbildung, die Kenntnisse und Erfahrungen haben.
Die Aufbereitung muss mit einem validierten Verfahren erfolgen, die angewandten Verfahrensweisen müssen dokumentiert (Anforderungen an die Hygiene bei der Aufbereitung von Medizinprodukten 2002) und z. B. im Hygieneplan festgehalten werden.
Die Einhaltung der Empfehlungen der KRINKO und gastroenterologischer Fachgesellschaften zur Aufbereitung von Endoskopen liegen in der direkten Verantwortung aller in der Endoskopie Tätigen. Das ist nur durch Teamarbeit in enger Kooperation von Endoskopiepersonal, endoskopierenden Ärzten und dem Hygienefachpersonal erreichbar (![]() Online-Ergänzung 5.17).
Online-Ergänzung 5.17).
Baulich-strukturelle Voraussetzungen
Anforderungen der Hygiene an baulich-strukturelle Planung von Endoskopieeinheiten sind in der KRINKO-Richtlinie (2002) ausführlich dargestellt. Die wesentliche Forderung besteht in einem separaten Raum für die (manuelle oder maschinelle) Aufbereitung mit funktioneller Trennung in einen unreinen und reinen Bereich, um eine Endoskopieeinheit(en), baulich-strukturelle VoraussetzungenRekontamination aufbereiteter Geräte zu vermeiden. In allen Räumen der Endoskopieeinheit sollen Waschbeckenspender für Seife und Händedesinfektionsmittel verfügbar sein. Wegen der Raumbelastung mit Desinfektionsmitteldämpfen sollte der Aufbereitungsraum zur Vermeidung allergisch-toxischer Erkrankungen beim Endoskopiepersonal gut lüftbar sein.
Praxis der Aufbereitung und Qualitätssicherung
Eine EndoskopaufbereitungVorreinigung Medizinprodukteaufbereitung:Endoskope(mehrfaches Durchsaugen sämtlicher Kanäle mit Reinigungslösung, Abwischen des Außenmantels des Endoskops mit feuchtem, flusenfreiem Einwegtuch) hat unmittelbar im Anschluss an die endoskopische Untersuchung zu erfolgen, während das Endoskop noch an Lichtquelle und Absaugpumpe angeschlossen ist.
Hierdurch soll ein Antrocknen von organischem Material und chemischen Rückständen im Kanalsystem oder an Außenteilen des Endoskops vermieden und eine Kontamination des Umfelds verhindert werden. Alle weiteren Aufbereitungsschritte erfolgen räumlich getrennt vom Untersuchungsraum in der unreinen Zone des separaten Aufbereitungsraums. Alle Reinigungsschritte sind unter der Flüssigkeitsoberfläche im Reinigungsbecken durchzuführen, um Spritzeffekte mit kontaminierten Flüssigkeiten zu vermeiden.
Die Reinigung des Endoskops und aller zugänglichen Endoskopkanäle ist unabdingbarer Bestandteil der korrekten Aufbereitung. Die manuelle Reinigung der Kanäle des Endoskops mit einer desinfizierten, dem Kanaldurchmesser entsprechenden Reinigungsbürste ist derzeit grundsätzlich noch immer durchzuführen, auch bei nachfolgender Aufbereitung im RDG-E.
Verwendete Reinigungsbürsten sind nach jeder Benutzung im Ultraschallbad zu reinigen und anschließend zu desinfizieren oder als „single-use“ zu verwenden. Durch manuelle Bürstenreinigung der Endoskopkanäle kann die Koloniezahl um bis zu 4 log-Stufen reduziert werden (Chu et al. 1998, Alfa et al. 1999).
Für die manuelle Aufbereitung sind zertifizierte Desinfektionsmittel einzusetzen, die z. B. in den Listen des VAH oder des RKI aufgeführt sind. Prinzipiell ist sowohl bei manuellen als auch bei maschinellen Verfahren die Anwendung der viroziden Konzentration bzw. eines viroziden Verfahrens erforderlich (Empfehlung von RKI, DVV und Desinfektionsmittelkommission 2004). Für die maschinelle Aufbereitung steht derzeit keine Liste mit zertifizierten Desinfektionsmitteln zur Verfügung. Es sind daher nur Reinigungs- und Desinfektionsmittel zu verwenden, deren Eignung und Wirksamkeit in Gutachten der Präparate- bzw. Gerätehersteller nachgewiesen wurde.
Da Rückstände von Desinfektionsmitteln im Endoskop chemische Irritationen und allergische Schleimhautreaktionen (Lippenschwellung, Pharynxödem, hämorrhagische Kolitis u. a.) beim nachfolgend untersuchten Patienten auslösen können, muss die Desinfektionsmittellösung durch intensives Nachspülen der Kanäle und des Außenmantels des Endoskops sorgfältig entfernt werden.
Im Anhang der KRINKO-Empfehlung (Anforderungen an die Hygiene bei der Aufbereitung flexibler Endoskope 2002) sind Checklisten angeführt, die eine korrekte Durchführung des Aufbereitungsprozesses sicherstellen helfen.
Aufbewahrung und Transport flexibler Endoskope
Endoskope sollten hängend in einem geschlossenen Endoskopschrank arbeitsplatznah aufbewahrt werden. Eine Aufbewahrung bis zu 7 Tagen gilt als sicher; eine Wiederverkeimung nach nachweislich sachgemäßer Aufbereitung konnte bisher nicht nachgewiesen werden. Zu endoskopischen Untersuchungen außerhalb der Endoskopieabteilung (z. B. auf Intensivstation) sollte das Endoskop kontaminationsgeschützt in geschlossenen Behältnissen (Wanne mit Deckel) oder in sterile Tücher eingeschlagen transportiert werden.
Aufbereitung des endoskopischen Zusatzinstrumentariums
Endoskopisches Zusatzinstrumentarium muss ebenfalls korrekt aufbereitet werden. Optikspülflasche und Anschlussschlauch sind nach Gebrauch zu leeren, arbeitstäglich zu desinfizieren, zu sterilisieren und anschließend trocken und kontaminationsgeschützt zu lagern. Die Optikspülflasche ist bei Benutzung mit sterilem Wasser zu füllen (Bader et al. 2002). Absaugsysteme einschließlich Adapter und Schlauchverbindungen müssen arbeitstäglich gereinigt und desinfiziert werden und sind zwischen den Arbeitstagen trocken und kontaminationsgeschützt aufzubewahren.
Bei der Bürstenreinigung wiederaufbereitbarer Biopsiezangen muss sorgsam vorgegangen werden, um Verletzungen und Infektionen (z. B. durch HCV) zu vermeiden. Es wird empfohlen, schnittfeste Handschuhe zu tragen. Endoskopisches Zusatzinstrumentarium wird in einem Ultraschallbad gereinigt, die Branchen der Biopsiezangen sollten dabei durch spezielle Clips offen gehalten werden (Jung et al. 2003). Biopsiezangen und Polypektomieschlingen sowie Reinigungsbürsten für die Endoskopkanäle können anschließend – parallel zur Desinfektion flexibler Endoskope – im RDG-E desinfiziert werden. Eine alleinige Desinfektion von Biopsiezangen ist unzureichend (Bronowicki et al. 1997), als die Mukosa penetrierende Instrumente sind Biopsiezangen und Polypektomieschlingen zu sterilisieren. Nur bei standardisiertem Vorgehen ist eine korrekte Aufbereitung von Biopsiezangen nachgewiesen (Jung et al. 2003). Zur Sterilisation sind nachweislich wirksame (validierte) Verfahren für thermostabile bzw. thermolabile Instrumente unter Beachtung der Herstellerangaben sowie nationaler und internationaler Richtlinien zu wählen. Nach Abschluss der Sterilisation sind die Sterilisationsindikatoren zu kontrollieren, zu dokumentieren und die Sterilgutverpackung auf Beschädigung zu prüfen. Sterilisierte Instrumente sollen geschützt vor Staub, Feuchtigkeit und Temperaturschwankungen sowie vor Sonnenbestrahlung und mechanischer Beanspruchung gelagert werden (z. B. in geschlossenem Schrank).
Injektionsnadeln (z. B. zur Sklerosierungsbehandlung von Ösophagusvarizen oder zur Unterspritzung blutender Läsionen) sind wegen des hohen Verletzungs- und Infektionsrisikos nur als Einmalprodukt einzusetzen.
Endoskopisches Zusatzinstrumentarium, das bei therapeutischen Eingriffen an Gallengängen oder Pankreasgang verwendet wird, muss steril sein. Mit Wasser oder Kontrastmittel gefüllte Ballons können nicht sicher sterilisiert werden, daher sind Ballonkatheter für solche Eingriffe nach Gebrauch nicht aufzubereiten und nicht wiederzuverwenden (Anforderungen an die Hygiene bei der Aufbereitung flexibler Endoskope 2002).
Mikrobiologische Überprüfung der Endoskopaufbereitung
Da die Aufbereitung flexibler Endoskope ein mehrstufiges Verfahren der Abreicherung darstellt und die Einzelschritte, insbesondere bei der manuellen Aufbereitung, nicht validierbar sind, d. h. eine gesicherte Prozessqualität nicht gewährleistet ist, sind mikrobiologische Kontrollen der Ergebnisqualität unabdingbar.
Multizentrische Untersuchungen belegen, dass die hygienische Aufbereitung von Endoskopen in knapp der Hälfte der Fälle nicht den Empfehlungen gastroenterologischer Fachgesellschaften entsprach (Kaczmarek et al. 1992, Orsi et al. 1997, Cronmiller et al. 1999) und Endoskopaufbereitung:Überprüfunginfolge fehlerhafter und/oder nie überprüfter Aufbereitungsverfahren kontaminierte Geräte zum Einsatz kamen (Bader et al. 2002, Srinivasan et al. 2003, Corne et al 2005, DiazGranados et al. 2009). Um Schwachstellen der Aufbereitung zu erkennen und beseitigen zu können, sind mikrobiologische Kontrollen in allen Endoskopieeinheiten in Klinik und Praxis zu etablieren (Merighi et al. 1996, Anforderungen an die Hygiene bei der Aufbereitung flexibler Endoskope 2002, Leiß et al. 2008, Hygienisch-mikrobiologische Überprüfung von flexiblen Endoskopen nach ihrer Aufbereitung 2010). Auch standardisierte RDG-E sollen mikrobiologisch überprüft werden, nach verfahrenseingreifenden Reparaturen wird eine Überprüfung mit kontaminierten Dummies empfohlen. Die Anforderungen an RDG-E sind in den letzten Jahren gestiegen (z. B. Einzelkanalüberprüfung des Desinfektionsmittelflusses). Eine maschinelle Endoskopaufbereitung, die alle Teilaspekte des komplexen, aufeinander abgestimmten Aufbereitungsverfahrens überprüft und eine fehlerfreie Aufbereitung sicherstellt, ist realisierbar (Zühlsdorf und Kampf 2006). Da solchen modernen Anforderungen gerecht werdende maschinelle Aufbereitungsverfahren derzeit erst in wenigen Zentren zur Verfügung stehen und auch hier devicebedingte Fehler (z. B. Perforation des Endoskopiekanals mit nachfolgender Kontamination des Endoskopinnenraums, Konnektionsprobleme), die zu einem fehlerhaften Aufbereitungsergebnis führen können, nicht ausgeschlossen werden können, soll die Aufbereitung flexibler Endoskope durch mikrobiologische Kontrollen überprüft werden (Leiß et al. 2008, Hygienisch-mikrobiologische Überprüfung von flexiblen Endoskopen nach ihrer Aufbereitung 2010).
Heudorf et al. (2004) haben bei einer infektionshygienischen Überwachung von Endoskopieeinheiten festgestellt, dass insbesondere in kleineren Praxen im Vergleich zu Krankenhäusern relevante Hygienemängel zutage traten wie Fehlen eines Ultraschallbads zur Aufbereitung der Zusatzinstrumente, keine arbeitstägliche Aufbereitung der Optikspülflasche bzw. keine Befüllung mit sterilem Wasser. Die Sterilisation der Zusatzinstrumente war nicht sichergestellt, da z. B. kein Sterilisator vorhanden war oder eine mikrobiologische Testung fehlte.
Zur Gewährleistung des internen Qualitätsmanagements in der Endoskopie müssen Kenntnisse zur hygienischen Aufbereitung flexibler Endoskope, Verhaltensmaßnahmen zur Verhinderung nosokomialer Infektionen und zur Vermeidung desinfektionsmittelbedingter gesundheitlicher Schäden sowie Maßnahmen zum Selbstschutz vor Infektionen durch regelmäßige Schulungen des Endoskopiepersonals aktualisiert werden. Die Umsetzung in die tägliche Praxis ist Aufgabe des gesamten Teams. Hygienisch korrektes Verhalten sollte integraler Bestandteil eines professionellen Selbstverständnisses aller in der Endoskopie Tätigen sein.
Darüber hinaus können durch externe Qualitätssicherungsmaßnahmen eine flächendeckende Implementierung von Leitlinien zur Endoskopaufbereitung und eine drastische Verringerung der mikrobiologischen Beanstandungsquote aufbereiteter Endoskope erreicht werden. So konnte durch die Qualitätssicherungsvereinbarung von 2002 im Rahmen der Einführung der Vorsorgekoloskopie, die die Erbringung von Koloskopien an fachliche Qualifikationen des Untersuchers und an den Nachweis der korrekten Endoskopaufbereitung gekoppelt hat, die in der HYGEA-Studie beschriebene Beanstandungsquote von knapp 50 % sukzessive auf inzwischen unter 4 % gesenkt werden (Fröhlich et al. 2009, Leiß et al. 2010).
5.17.5. Maßnahmen zum Schutz des Endoskopiepersonal
Alle Mitarbeiter der Endoskopie-Abteilung sollten gegen Hepatitis B geimpft sein, der Impferfolg ist regelmäßig zu überprüfen und ggf. durch erneute Impfung aufzufrischen. Zur Vermeidung einer Übertragung von Infektionserregern von Patienten auf Endoskopiepersonal müssen allgemeine Schutzmaßnahmen (Händehygiene, Schutzkittel, Handschuhe, Mund-Nasen-Schutz) strikt eingehalten werden. Bei Bronchoskopien von Patienten mit offener Lungentuberkulose sollten FFP-2-Masken getragen werden. Chirurgische Masken schützen nicht vor der Inhalation von mikroorganismenhaltigem Aerosol. Bezüglich empfohlener Maßnahmen zum Schutz des in Endoskopieabteilungen arbeitenden Personals Tabelle 5.29 (Leiß et al. 1995).
Tab. 5.29.
Schutzmaßnahmen für das in Endoskopie-Abteilungen arbeitende Personal.Personal:Endoskopie-Abteilungen, Schutzmaßnahmen
| Zeitpunkt | Art der Maßnahme |
|---|---|
| Vor Aufnahme der Tätigkeit |
|
| Während der Tätigkeit |
|
(mod. nach Leiß et al. 1995)
5.18. Geriatrie
Rüdiger Thiesemann und Ingo Füsgen, mit einem Teilkapitel von Thomas Kocher und Axel Kramer
Die Versorgung geriatrischer Patienten erfolgt in Deutschland in Hausarztpraxen, Facharztpraxen, nicht spezialisierten Krankenhausabteilungen, Spezialabteilungen für Geriatrie und in den Einrichtungen der ambulanten und stationären Altenhilfe.
Geriatrischer Patient: Folgende Endoskopie:internistische\""\r""EndoskopieinternistischeMerkmale kennzeichnen den geriatrischen Patienten in besonderem Maße aus (zentraleuropäische Arbeitsgemeinschaft gerontologisch geriatrischer Gesellschaften, Deutsche Bundesregierung 1990):
-
•
biologisch höheres Alter,
-
•
Multimorbidität,
-
•
Patient(en):geriatrischeGefährdung durch altersbedingte Funktionseinschränkung einerseits und Erkrankung andererseits sowie Vorliegen eines Handlungsbedarfs, der über den kurativ-medizinischen Bereich hinausgeht und insbesondere rehabilitative, somatopsychische und psychosoziale Aspekte zu berücksichtigen hat.
Geriatrische Medizin:
Geriatrische Medizin:geriatrischeMedizin ist eine medizinische Spezialdisziplin, die sich mit den körperlichen, mentalen, funktionellen und sozialen Bedingungen der akuten, chronischen, rehabilitativen und präventiven Behandlung und Pflege – auch am Lebensende – befasst.
Die Patienten werden mit einem hohen Grad von Vulnerabilität und aktiven Mehrfacherkrankungen assoziiert, was einen ganzheitlichen Behandlungsansatz erfordert.
Die Erkrankungen im Alter können sich unterschiedlich präsentieren, sind oft sehr schwierig zu diagnostizieren, das Ansprechen auf die Behandlung erfolgt verzögert, und es besteht regelmäßig Bedarf für soziale Unterstützung.
Geriatrische Medizin überschreitet daher die organmedizinisch orientierte Medizin und bietet zusätzliche Therapieangebote in einer multidisziplinären Team-Umgebung mit dem Hauptziel der Optimierung des funktionellen Status der Person und der Verbesserung von Lebensqualität und Autonomie.
Geriatrische Medizin ist nicht spezifisch altersdefiniert, sie behandelt jedoch die typische Morbidität älterer Patienten. Die meisten Patienten sind über 65 Lebensjahre alt. Die Gesundheitsprobleme, die durch Geriatrie als eine Spezialdisziplin am besten angegangen werden können, werden in der Altersklasse > 80 Jahre viel häufiger (European Union Geriatric Medicine Society Conensus Panel 2008).
Zu den genannten Merkmalen des funktionellen Status geriatrischer Patienten gehören insbesondere die Fähigkeiten/Aktivitäten des täglichen Lebens (Essen, Kleiden, Selbstversorgung u. a.).
Hygienerelevant sind dabei
-
•
die Fähigkeiten, den Handlungsbedarf in der eigenen Körperhygiene zu erkennen (Hirnleistung, Riech-/Sehfähigkeit, Patient(en):geriatrischesensible Perzeption),
-
•
die ausreichenden motorischen Fähigkeiten zur Durchführung der Hygienemaßnahmen (ausreichende Kraft in Armen und Händen, ausreichende Feinmotorik, stabile Rumpfmuskulatur, Erreichbarkeit der Füße),
-
•
erforderliche Umgebungsbedingungen zur Durchführung der Hygiene wie Einkaufsmöglichkeit für z. B. Zahnpasta und andere Körperpflegemittel.
5.18.1. Immunologie, Physiologie und Infektionsanfälligkeit im Alter
Infektionsanfälligkeit:
Das Infektionsanfälligkeit:AlterVorhandensein mehrerer Erkrankungen und Krankheitsfolgen und die Immunoseneszenz prädisponieren ältere Menschen für Infektionserkrankungen, einige Erkrankungen führen selbst zu Superinfektionen durch bakterielle und virale Erreger.
Die sog. Immunoseneszenz ist nicht als globale reduzierte Immunität, sondern als Dysregulation der Immunantwort auf mehreren Ebenen zu bezeichnen. Einige Immunfunktionen sind erhöht, andere herabgesetzt. So ist die Produktion von Zytokinen und Zelloberflächenbestandteilen in einigen Bereichen reduziert (IL-2, ILImmunoseneszenz-3, IL-2-Rezeptor und CD28 sowie GM-CSF, MIF), andere sind wiederum erhöht (CRP und IL-6). Nachgewiesen sind ferner die verminderte natürliche Killerzellenaktivität und die Reduktion der Hautreaktionen vom verzögerten Typ. Die Serumimmunglobulinspiegel verhalten sich uneinheitlich: die Spiegel von IgG und IgA zeigen eine steigende Tendenz, die Spiegel von IgM und IgE eine fallende Tendenz (Peter und Pichler 1996). Polymorphkernige Granulozyten zeigen ein reduziertes chemotaktisches Migrationsverhalten und eine verminderte mikrobielle Phagozytose.
Obwohl die Immunoseneszenz unzweifelhaft existiert, ist die klinische Rolle dieses Phänomens bei der Entwicklung der Prädisposition für Infektionserkrankungen weiterhin unklar. Obwohl seit mehr als einem Jahrzehnt große Anstrengungen unternommen werden, die Immunoseneszenz in multizentrischen Studien zu untersuchen, sind die Befunde oft gegenläufig und nicht eindeutig (Castle 2000).
Die Datenlage in Deutschland bzw. systematische Untersuchungen zu geriatrischen oder altersbezogenen Studien zum Stichwort Inflammation sind übersichtlich. Von 1.301 systematischen Studien sind lediglich 19 Studien aus Deutschland verzeichnet. Hiervon sind 7 älter als 10 Jahre, eine aus dem Bereich der Geriatrie, jeweils 5 aus dem Bereich der Pulmonologie und der Orthopädie, 3 aus dem Bereich der Chirurgie und die weiteren 3 Studien aus der Zahnmedizin, Onkologie, Rheumatologie und Urologie. Die im Rahmen der systematischen Untersuchungen behandelten Entitäten umfassen Pneumonien, infizierte Kniearthroplastien, epidurale Neurolysen, primär operativen Ellenbogenersatz bei Frakturen, Dekubitalulzera, vaskuläre Komplikationen bei intravenös Drogenabhängigen, zahnmedizinische Foci, SSI, Divertikulitis, Komplikation von zementlosen Hüftendoprothesen oder intramedulären Marknägeln, Inhalationstraumata, eitrige Sakroileitis, Prostatitis und fokale Spinalerkrankung. Aus diesen Studien mit hochspezialisierten Einzelthemen lassen sich keine wegweisenden Ableitungen zur Infektionsprävention durch Primärprävention ableiten.
Manifestationsformen von Infektionen im Alter: Infektionen sind bei geriatrischen Patienten schwieriger zu diagnostizieren und zu behandeln als bei jüngeren Patienten. Anamnese und körperlicher Befund sind gekennzeichnet durch mehrere Besonderheiten, die am Beispiel der Harnwegsinfektion (HWI) aufgezeigt werden:
-
•
Oligosymptomatik (Werner 2000),
-
•
verminderter bis fehlender Flankenschmerz/Dysurie (Gleckmann 1982, Juthani-Mehta 2009),
-
•
fehlendes Fieber bei mindestens 11 % und verminderte Basistemperatur bei weiteren 47 % (Castle et al. 1991, Juthani-Mehta et al. 2009),
-
•
keine Erhöhung der Entzündungszeichen, insbesondere fehlende Leukozytose (Tunkel und Kaye 1994),
-
•
allotope Erstmanifestation: Das Leitsymptom entspricht nicht dem klassischen Lehrbuch-Symptom „Dysurie“, sondern zeigt sich als Verwirrtheit, Inappetenz oder auch Husten (Barkham et al. 1996, Werner 2000).
Aspekte zur Diagnostik und Therapie von Infektionen im Alter am Beispiel von HWI:
Eines der häufigsten Infektions- und Hygieneprobleme sind HWI bei geriatrischen Patienten. Mehr als drei Viertel der Klinik-Antibiogramme aus Urinisolaten stammen von Patienten über 60 Jahre (Thiesemann et al. 2006), sodass dieser Patientengruppe wegen des häufigen Auftretens, der klinischen Relevanz der Grunderkrankung, des klinischen Outcomes und aus Kostengründen besondere Bedeutung zukommt. HWI verlängern die Verweildauer im Krankenhaus um 1–4 Tage und verursachen z. B. in den USA zusätzliche Kosten von ca. 500–600 Dollar pro Patient (Jarvis 1996). Bei gebrechlichen älteren Patienten führt eine HWI mit Bakteriämie in 5–23 % der Betroffenen zum Tod (Nicolle et al. 1996).
Die Verweildauer:KrankenhausMikrobiologie bei geriatrischen Patienten scheint sich bei HWI signifikant zu unterscheiden. Klebsiellen werden ebenso wie P. aeruginosa, Proteus spp. und KNS häufiger als in anderen Kohorten/Settings gefunden. Dabei wurden die absoluten und relativen Häufigkeiten des Vorkommens von neun verschiedenen uropathogenen Erregern in einem rein geriatrischen Krankenhaus mit denen anderer Autoren/Settings verglichen (Thiesemann et al. 2009). Das gehäufte Vorkommen von Klebsiellen im geriatrischen Krankenhaus bzw. in den Isolaten geriatrischer Urinkulturen ist noch nicht abschließend geklärt. Eine Hypothese verbindet die Themenkomplexe „Stuhlinkontinenz und mangelnde Alltags-Selbstpflege-Fähigkeiten bei geriatrischen Patienten“ und die Bedingungen der Abnahmetechniken der Urinproben. Es besteht die Frage, inwieweit die funktionellen Einschränkungen geriatrischer Patienten zu Kontaminationen beitragen. Ansätze zu interdisziplinären Leitlinien zur Diagnostik und Behandlung von nosokomialen HWI geriatrischer Patienten sind formuliert, aber nicht weiterverfolgt worden (Thiesemann 2004).
Einer der bedeutendsten Risikofaktoren für Zystitis, Pyelonephritis, Bakteriämie und Urosepsis ist das Vorhandensein eines transurethralen Dauerkatheters (KRINKO 1999), der schnellstmöglich entfernt werden sollte. Die Forderung leitet sich aus dem Risikoprofil und den Komplikationen ab. Tal et al. (2005) beschrieben hohe Sterblichkeitsquoten bei geriatrischen Patienten, die an HWI litten: bei Klebsiellen-HWI 30,8 %, bei Proteus-HWI 62,5 %, bei Staphylokokken-HWI 31,3 %.
Signifikant mit letalem Ausgang assoziiert waren
-
•
der Gebrauch eines Dauerkatheters,
-
•
der funktionelle Status,
-
•
das Vorhandensein einer Urininkontinenz,
-
•
die Anzahl der Diagnosen,
-
•
die Verweildauer.
Nicht signifikant waren die Variablen Alter, Geschlecht, Pflegeheimzuweisung, Nachweis eines bestimmten Erregers und Diabetes mellitus als Komorbidität.
Ob neuere Leitlinien die Probleme bei katheterassoziierten HWI (Tenke et al. 2008) vermindern können oder der Wechsel auf vermehrte suprapubische (statt transurethrale) Ableitungen einen Fortschritt bringt (McPhail et al. 2006), bleibt abzuwarten (Kap. 4.3). Wünschenswert wäre, dass auch geriatrische Patienten, sofern sie ausreichende feinmotorische und visuelle Fähigkeiten besitzen, in die Technik der selbstgeführten intermittierenden Einmalkatheterisierung unterwiesen werden. Diese Therapie der progredienten Blasenentleerung wurde von Guttmann (1976) bereits in den 1970er Jahren bei Patienten mit Läsionen des Spinalkanals beschrieben. Der selbstgeführte intermittierende Einmalkatheterismus stärkt insbesondere die Eigenverantwortlichkeit der Patienten, reduziert Kosten und ist in hygienischer Hinsicht unproblematisch, sofern er fachgerecht geschult und durchgeführt wird.
Die Anwendung von Pharmaka bei älteren Patienten setzt diese einem – im Vergleich zu jüngeren Patienten – höheren Risiko unerwünschter Arzneimittelwirkungen (UAW) aus (Borchelt und Steinhagen-Thiessen 1996), die ihrerseits Kaskadeneffekte auslösen können, die ggf. weitere Behandlungen begründen (Durchfall, Exsikkose → Verwirrtheit → Delir → kardiovaskuläre/neurologische Erkrankungen, Sturz, Fraktur → Pflegebedürftigkeit, Tod).
Die Ursachen hierfür sind u. a. Verminderung des intravasalen Volumens, herabgesetzte renale Clearance, erhöhte Wirksamkeit lipophiler Substanzen sowie Interaktion mehrerer Pharmaka. Bei der Einnahme von 5–6 Pharmaka hatte sich das Risiko einer UAW verdoppelt, bei mehr als 8 Präparaten sogar verdreifacht (Field et al. 2001). Daher bedarf es im Alter einer besonders engen Indikationsstellung von Pharmaka.
Die Anwendung von Antibiotika ist immer wieder als zu aktualisierendes Thema präsent (Wagenlehner et al. 2008). In eigenen Untersuchungen (Thiesemann 2007) zeigten die Kombinationen der fünf häufigsten Erreger mit den fünf häufigsten Wirkstoffen bei mehr als der Hälfte der möglichen Therapieentscheidungen in der Geriatrie eine deutlich eingeschränkte antibiotische Wirksamkeit (Resistenzquote > 10 %, gemäß Infectious Diseases Society of America dann nicht mehr empfohlen). Für eine Antibiotikatherapie ist zwingend eine absolut sauber entnommene Urinprobe erforderlich; bei Rezidivinfektionen betagter Männer wird eine Mitbehandlung durch einen Urologen empfohlen. Eine Infektionssanierung bei pathologischem Restharn ist ohne suffiziente Ableitung nicht möglich.
5.18.2. Infektionen in der stationären Altenpflege
Das Harnwegsinfektion(en):Alter\"\r\"HWIAlterManagement von Infektionen in der Infektion(en):Alter\"\r\"AlterInfektionenstationären Altenpflege ist ein enormes Problem, da nur wenige der in Heimen tätigen ÄrzteAlter\"\r\"Alter eine geriatrische Ausbildung aufweisen. Insgesamt sind nur 2.087 Geriater in Deutschland tätig (Bundesverband Geriatrie 2010), das entspricht 0,66 % aller von der Infektion(en):AltenpflegeBundesärztekammer gelisteten Ärzte. Zu dem quantitativen Problem kommen die o. g. Besonderheiten der geriatrischen Symptomatik (Oligosymptomatik usw.).
Die Problemlage ist so hochkomplex, dass die Infectious Diseases Society of America eine eigene Leitlinie (High et al. 2009) für den Umgang in Pflegeheimen erstellt hat, deren Wiedergabe den hier zur Verfügung stehenden Rahmen sprengen würde. Analog hat die KRINKO schon 2005 eine Empfehlung zur Infektionsprävention in Heimen herausgegeben (Kap. 7.6).
Als Orientierungshilfe für diesen Bereich seien folgenden Aspekte aufgelistet: Die MRSA-Prävalenzen im Pflegeheimen betragen in Deutschland (bei steigender Tendenz zwischen 1,1 und 2,4 % (Anonymus 2009), in US-amerikanischen Pflegeheimen bis zu 10 % (O'Fallon et al. 2009). Als Präventionsmaßnahmen werden ein kontrollierter Umgang mit Antibiotika und eine intensivierte MRSA:Altenpflegehygienische Händedesinfektion als Basismaßnahmen empfohlen (Kap. 2.1). Es ist davon auszugehen, dass die von Pittet et al. (2000, Pittet 2010) beschriebenen Ziele/Vorzüge der Händedesinfektion auch für Pflegeheimbewohner gelten.
Über die Notwendigkeit von Isolierungsmaßnahmen im Pflegeheimsektor herrscht vielerorts Unkenntnis und Verunsicherung. Während die Empfehlung der KRINKO (2005) explizit festhält: „Einzelzimmer sind nicht generell erforderlich …“ sind die Heimträger durch konkurrierende Rechtsordnungen (Heimrecht, SGB XI, Qualitätsmanagement etc.) manchmal zu strikterem Verfahren angehalten. Die fehlende Kenntnis und Aufklärung von Angehörigen hat bei einer Gutachtenpatientin der Verfasser zu dem Missstand geführt, dass sie sich in der eigenen Wohnung jedes Mal „MRSA-üblich“ eingekleidet hat (mit Mund-Nasen-Schutz, Kittel und Haube), bevor sie ihrem betagten Ehemann das Frühstück in das Pflegezimmer der Wohnung gebracht hat. Dieser war 2 Wochen zuvor aus einem Krankenhaus entlassen worden und die ambulante Pflegedienstmitarbeiterin hatte die 89-jährige Ehefrau dann „geschult“.
5.18.3. Multiresistente Erreger bei geriatrischen Patienten
Es gelten grundsätzlich die gleichen Regeln wie für den Umgang mit innerklinischen MRSA-Konstellationen (Kap. 3.7). Eigene Untersuchungen aller Isolate aus einem 300-Betten-Krankenhaus und einer MRE:geriatrische Patientengeriatrischen Klinik zeigten nur eine geringe Anzahl von MRE sowohl in interdisziplinären (Thiesemann et al. 2007) als auch in rein geriatrischen Erhebungen (Thiesemann et al. 2008). In einer gerade fertiggestellten Untersuchung an der Geriatrischen Klinik in Velbert wurde festgestellt, dass der prozentuale Anteil von MRSA-positiven Patienten bei 6,7 % lag, das entspricht einem altersunabhängigen Durchschnitt (Schütz 2010) und dem Durchschnitt bei Intensivpatienten (Lucet 2003). Im Allgemeinen werden geriatrische Patienten u. a. aufgrund von Multimorbidität, häufigerem Vorkommen chronischer Wunden, eingeschränkter Fähigkeit zur Körperhygiene (Daeschlein et al. 2006) und höherer Hospitalisierungsraten in größeren Maße als MRSA-Träger vermutet (Johnston 2009). Unbeantwortet ist aber die Frage, warum trotz des Vorhandenseins einschlägiger Risikofaktoren kein höherer Anteil an MRSA-Trägern auch unter den alten Patienten festzustellen ist. Zu vermuten ist, dass der Übertragungsweg eine nicht unerhebliche Rolle bezüglich der Verbreitung spielt. Bezogen auf geriatrische Patienten, müssen also auch die Übertragungswege kritisch erfasst werden.
Die MRSA-Sanierung (Kap. 2.2) bleibt ein zunehmendes Problem, da sie erhebliche negative Auswirkungen auf die Arbeit mit geriatrischen Patienten und Rehabilitanden hat (KRINKO 2005). Für geriatrische Reha-Kliniken sind daher Adaptationen empfohlen worden (Ekeles und Just 2006). Für die klinische Praxis ist zu beachten, dass seit 2009 der Nachweis von MRSA aus Blutkulturen und Liquor nach § 7 IfSG an das Gesundheitsamt meldepflichtig ist (Kap. 11).
5.18.4. Infektionsprävention bei geriatrischen Patienten
Zur Infektionsprävention sind komplementär zu den allgemein empfohlenen Maßnahmen (u. a. Kap. 2, Kap. 3, Kap. 5, Kap. 6, Kap. 7, Kap. 8, Kap. 9) folgende „pflegebasierte“ Empfehlungen zur Erkennung und Minimierung von Infektionen in Praxis und Klinik umzusetzen:
-
1.Anamnese (Befragung des Patienten, seiner Angehörigen und des Hausarztes):
-
a.Kommt der Patient aus Einrichtungen mit hohem Risiko für das Vorliegen einer Besiedelung mit MRE (Dialysepraxen, Infektionsabteilung usw.)?
-
b.Wie oft und welche antibiotischen Therapien wurden in den letzten 3 Monaten durchgeführt?
-
c.Wann wurden intrakorporale Fremdkörper (Dauerkatheter, Venülen, ZVK usw.) entfernt bzw. liegen sie noch?
-
a.
-
2.Körperlicher Befund:
-
a.Gibt es Zeichen für erhöhtes Re-Infektionsrisiko (unverheilte Wunden, Hämatome, Zustand nach Phlebitisläsionen, Zeichen der Malnutrition, Gewichtsabnahme > 5 % vom Ausgangsgewicht)?
-
b.Gibt es (zusätzlich zu a) weitere potenzielle Infektionsherde?
-
–Kariöse Zähne und Parodontitiden,
-
–orale Prothesenstomatitis,
-
–Furunkulose (insbesondere bei Diabetikern),
-
–Onychomykosen.
-
–
-
a.
-
3.Geriatrischer Funktionsstatus (Auswahl in Hinblick auf Hygiene):Ist der Patient in der Lage
-
–Hautpflege selbst durchzuführen,
-
–Zahn- und Prothesenpflege selbst durchzuführen,
-
–Nagelpflege selbst durchzuführen (→ Inspektion auf Speise-/Stuhlrestverschmutzungen),
-
–seine Nahrungsaufnahme selbst vollständig durchzuführen,
-
–sein Essen unbehindert aufzunehmen, oder liegt eine unerkannte Schluckstörung vor (Eisenstadt 2010),
-
–seine Ausscheidungsfunktionen selbst vollständig durchzuführen (einschließlich der Hygienemaßnahmen), oder liegt eine Inkontinenz vor.
-
–
Sofern auffällige Befunde aus dem o. g. Bereich der Anamnese vorliegen, ist die sorgsame Überwachung/watchful waiting des Betagten zu organisieren. Bei Auffälligkeiten im körperlichen Befund ist der behandelnde Arzt hinzuziehen und eine Sanierung anzustreben (inklusive Facharzt, Zahnarzt usw.). Bei Malnutrition ist die Ergänzung der Nahrung durch Nährstoffsupplemente durchzuführen (seit 2004 verordnungsfähig). Ist im geriatrischen Funktionsstatus eine Verschlechterung der o. g. Funktionen festzustellen, kann eine geriatrische Akutbehandlung, eine akutmedizinische Frührehablitation (OPS 8-550.1 via Hausarzteinweisung) oder eine geriatrische Rehabilitation (via Bewilligung der Kostenträger) erwogen werden. Eine geriatrische Rehabilitation ist seit 2009 auch für pflegebedürftige Betagte möglich. Die genannten Maßnahmen verbessern nachweislich die Funktion, vermindern das Risiko der Pflegeheimeinweisung und mindern das Mortalitätsrisiko – wie kürzlich von Bachmann et al. (2010) in einer Metaanalyse beschrieben wurde.
An der Schnittstelle von körperlicher Hygiene, geriatrischen Funktionsstörungen und abzuwendenden Infektionserkrankungen ist das Wirkfeld der Hygienemaßnahmen in Krankenhaus, Arztpraxis und anderen Settings anzusiedeln. Durch konsequente Anwendung der Hygienemaßnahmen kann das Eintreten von Krankheiten bei geriatrischen Patienten erfolgreich verzögert/vermieden werden.
Weiterführende Inhalte sind bei Füsgen (2000) sowie Halter et al. (2009) zu finden.
5.18.5. Mund- und Zahnpflege
Thomas Kocher und Axel Infektionsprävention:Patient(en), geriatrische\""\r""GeriatrPatInfProphylKramer
Als Beispiel für die Infektionsprävention durch Gewährleistung der persönlichen Hygiene soll die Mundhöhlenhygiene ausgewählt werden. Ein strukturiertes Mundhygienesystem mit regelmäßigem Zähneputzen und regelmäßiger Prothesenpflege ist die Voraussetzung zur Karies-, Gingivitis-, Parodontitisprophylaxe sowie zur Vermeidung einer Prothesenstomatitis mit Erhalt der physiologischen Mundhöhlenflora. Dadurch wird dem Risiko von Infektionen in der Mundhöhle einschließlich davon ausgehender weiterer Infektionen (z. B. Endokarditis, bei apparativer Beatmung, Pneumonie) entgegengewirkt (Pitten et al. 2001).
Da körperliche oder geistige Behinderung im fortgeschrittenen Lebensalter die regelmäßige suffiziente mechanische Plaqueentfernung und Mundhöhlenhygiene erschweren, überrascht es nicht, dass bei Erhebung des Plaqueindexes in einem Altenheim (n = 212) im Mittel aller Zähne folgender Befund erhoben wurde: keine sichtbare Plaque in 1 %, dünner Plaquefilm in 18 %, mäßige Plaque der gesamten Zahnoberfläche in 39 % und dicke Plaque unter Einbeziehung des Interdentalraum in 42 %. Auf Prothesen ergab sich ein ähnliches Bild: keine sichtbare Plaque in 11 %, dünner Plaquefilm in 28 %, mäßige Plaque in 31 % und dicke Plaque in 29 % (Kramer A, unveröff.).
Epidemiologische Studien weisen auf einen Zusammenhang zwischen oraler Gesundheit und Pneumonien bei älteren Menschen hin, die sich in ambulanter oder stationärer medizinischer Pflege und in Pflegeinstitutionen befinden (Azarpazhooh und Leake 2006). Selbst kariöse Zähne als Bakterienreservoir erhöhen das Pneumonierisiko um 20–23 % (Terpenning et al. 2003).
Eine professionelle Zahn-, Mund- und Prothesenpflege durch das Pflegepersonal scheint auch die Häufigkeit respiratorischer Infektionen und die Mortalität durch Pneumonien bei geriatrischen Patienten zu reduzieren (Abe et al. 2005, Fanello et al. 2006). Bei japanischen Senioren konnten durch einfache professionelle Zahn- und Prothesenreinigung das Pneumonierisiko und die Mortalität durch Pneumonien deutlich gesenkt werden, bei bezahnten Senioren mussten 12 Personen behandelt werden, um einen Fall von Pneumonie zu vermeiden (Yoneyama et al. 2002). Bei Patienten auf Intensivstationen konnte das Vorkommen respiratorischer Erkrankungen durch tägliche Applikation von 0,2-prozentigem Chlorhexidin-Gel die NI-Rate im Vergleich zur Standardprozedur auf ein Viertel gesenkt werden (Fourrier et al. 2000).
Zurzeit wird heftig diskutiert, ob sich als Folge einer chronischen Parodontitis das Risiko für manifeste koronare Herzerkrankung (KHK) und Schlaganfall erhöht (Bahekar et al. 2007, Humphrey et al. 2008). Parodontitis ist als Risikofaktor unabhängig von anderen „klassischen“ Risikofaktoren mit einer bis zu 1,35-fach erhöhten Wahrscheinlichkeit mit einer KHK Parodontitis, chronischeassoziiert (Humphrey et al. 2008). In einer Übersicht waren Prävalenz und Inzidenz der KHK bei Patienten mit Parodontitis signifikant erhöht (Bahekar et al. 2007). Erst kürzlich wurde das orale Gesundheitsverhalten (Zähneputzen) mit dem Risiko für kardiovaskuläre Mortalität in Verbindung gebracht (de Olveira et al. 2010). Allerdings sind weitere, prospektive Studien notwendig, um kausale Zusammenhänge zwischen Parodontitis und KHK zu bestätigen; insbesondere sind randomisierte Therapiestudien notwendig, um den Einfluss oraler Interventionen auf die kardiale Gesundheit festzustellen.
Einige größere, epidemiologische Studien weisen auch auf einen Zusammenhang von Parodontitis mit zerebrovaskulären Erkrankungen hin. So ging z. B. im amerikanischen Gesundheitssurvey (NHANES) bei einer longitudinalen Untersuchung von fast 10.000 Personen eine Parodontitis mit einem bis zu 2,1-fach erhöhten Risiko für nicht hämorrhagische Schlaganfälle einher (Wu et al. 2000). Ähnliche Ergebnisse zeigte eine weitere Studie an 50.000 im Gesundheitswesen tätigen Männern im Verlauf von 12 Jahren (Joshipura et al. 2003). Beide Studien sind allerdings nicht unumstritten (Friedewald et al. 2009).
Bei eingeschränkter Fähigkeit zur Mundhygiene wird die Anwendung einer antiseptischen Mundspüllösung zur Plaquehemmung (Karies- und Gingivitisprophylaxe) empfohlen (Pitten et al. 2001, Clavero et al. 2003). Wichtig ist, dass auch Prothesen und die orale Prothesen tragende Mukosa gereinigt werden.
Für längerfristige bzw. Daueranwendung sind Meridol (Arweiler et al. 2001, Brecx et al. 1990, 1992, 1993) und Listerine (Gordon et al. 1985, Lamster et al. 1993, Mankodi et al. 1987, Santos 2003) geeignet, für die eine Reduzierung von Plaque- und Gingivitisindizes nachgewiesen wurde.
Bei schmerzhaften, akuten Gingivitiden kann kurzfristig eine 0,12- bis 0,2-prozentige Chlorhexidin-Lösung eingesetzt werden (Clavero et al. 2003, Lang et al. 1998, Lucas et al. 1999, Montiel-Company und Almerich-Silla 2002, Zhang et al. 2002). Allerdings sollen chlorhexidinhaltige Präparate aus toxikologischen Gründen nicht länger als 2 Wochen angewendet werden (Splieth und Kramer 2000).Zahnpflege, Patient(en):geriatrische\"\r\"GeriatrPatMundpflege
5.19. Dialyse
Matthias Girndt
Die Therapie des endgradigen Nierenversagens erfolgt in unterschiedlichen organisatorischen Formen. Die Mehrzahl der Geriatrie\"\r\"GeriatriePatienten wird in ambulanten Hämodialyseeinrichtungen i. d. R. 3-mal wöchentlich behandelt. Etwa 5 % der Patienten, die auf ein dauerhaftes Nierenersatzverfahren angewiesen sind, werden mittels NierenversagenPeritonealdialyse behandelt. Während die chronische Hämodialyse in > 90 % als Zentrumdialyse und nur noch selten als Heimhämodialyse durchgeführt wird, erfolgt die Peritonealdialyse in der Mehrzahl der Fälle als Heimbehandlung in Eigenregie des Patienten. Daneben erfolgen Dialysebehandlungen unter stationären Bedingungen, hier sind v. a. die intermittierenden und kontinuierlichen Behandlungsverfahren in der Intensivmedizin zu berücksichtigen.
Der Verlust der Nierenfunktion führt zur schwerwiegenden Funktionseinschränkung des Immunsystems mit gestörter Abwehr gegen bakterielle und virale Erreger (Vanholder et al. 1996). Nierenkranke sind daher eine infektiologische Risikogruppe.
Alle Dialyseverfahren führen zu erhöhten Anforderungen an die Hygieneprozesse mit Bezug auf den Einzelpatienten, da ein großvolumiger Zugang entweder zum Gefäßsystem oder zum Peritoneum benötigt wird. Die extrakorporale Blutreinigung führt außerdem zu Transmissionsgefahren zwischen den Patienten in einer Behandlungseinrichtung durch Blutspritzer und Kontaminationen.
5.19.1. Planung einer Dialyseeinheit
Bauliche Voraussetzungen
An eine Hämodialyseeinrichtung ergeben sich aus den funktionellen Abläufen zahlreiche bauliche Anforderungen. Wandflächen und Fußböden sollen in Behandlungsräumen glatt, flüssigkeitsdicht, abwaschbar und desinfizierbar sein. Auch die Einrichtungsgegenstände im Behandlungsraum müssenHämodialyseeinrichtung\t\"Siehe Dialyseeinheit zu reinigen und zu desinfizieren sein, weil jederzeit mit Kontamination durch Blutspritzer oder Körperflüssigkeiten zu rechnen ist. Viele Voraussetzungen für die technische Ausgestaltung von Dialyseräumen sind durch Normen des Arbeitsschutzes geregelt (TRBA 250).
Für Heimdialyseverfahren (Heimhämodialyse, Peritonealdialyse) gibt es keine formalisierten Hygienevorschriften. Die Patienten sollten sich jedoch einen sauberen, ausreichend großen Platz in ihrem Wohnumfeld einrichten, der gut staubfrei zu halten und desinfizierend zu reinigen ist. Besondere Anforderungen an die Beschaffenheit von Wänden oder Böden werden nicht gestellt.
Bereitstellung von Dialyseflüssigkeiten
Hämodialyseeinheiten benötigen eine Wasseraufbereitungsanlage mit Umkehrosmose zur Herstellung von deionisiertem Wasser, das über eine Ringleitung zu den Behandlungsplätzen geführt wird. Dialyseflüssigkeit(en), BereitstellungSowohl die Wasseraufbereitung als auch die Ringleitung mit allen Komponenten müssen desinfizierbar sein, offene Wasseraufbereitungsanlage, DialyseeinheitFlüssigkeitsspeicher sind ungeeignet. Die Leitungen sollten totraumfrei sein und einen möglichst geringen Querschnitt aufweisen, um hohe Flussraten zu erreichen. In der Regel sind die Dialysemaschinen heute mit Wasservorfiltern ausgestattet, die eine ultrareine Wasserqualität für die Dialyse gewährleisten. Eine regelmäßige, mindestens halbjährliche mikrobiologische Überwachung der wasserführenden Systeme ist dennoch erforderlich, um einer Biofilmbildung entgegenzuwirken (Tab. 5.30 ). Zwar führt die gefürchtete Bildung eines Biofilms in den Wasserleitungen nicht mehr unmittelbar zu einer Belastung des Patienten, z. B. mit Endotoxin, es kann jedoch zur Überlastung der Filtersysteme und damit ihrem Versagen kommen.
Tab. 5.30.
Mikrobiologische Analyse des Reinwassers zur Dialyse.Dialyse:Reinwasser, Analyse
| Entnahmebedingungen | Grenzwerte |
|---|---|
| Probenmenge 0,2 mlKulturmedium Caseinpepton-Glukose-Fleischextrakt-AgarKultivierungstemperatur 22 ± 2 °CAblesung: nach 3 und 7 Tagen | Maximale Anzahl KbE 102/mlKein Nachweis von Pseudomonas spp.Kein Nachweis von ColiformenEndotoxingehalt max. 0,25 IE/ml |
Neben deionisiertem Wasser benötigt die Dialysemaschine Säure- und Bikarbonatkonzentrat zur Herstellung der Dialyseflüssigkeit. Die Verteilung von Säurekonzentrat kann über zentrale Ringleitungssysteme ähnlich den Reinwasserleitungen erfolgen und ist mikrobiologisch eher unkritisch. Stand der Technik für die Bikarbonatversorgung ist heute die Verwendung von Trockenkonzentrat an der einzelnen Dialysemaschine, um eine Biofilmbildung zu verhindern, alternativ können Konzentratkanister verwendet werden.
Kritische Stellen der Flüssigkeitsversorgung sind die Konnektoren zwischen Ringleitungssystemen und Dialysemaschinen. Sie sollten möglichst selten geöffnet werden, ein häufiger Standortwechsel der Geräte ist ungünstig. Dennoch ist das mitunter gerade im Bereich der Intensivmedizin unvermeidlich. Dann ist auf die ausreichende Sprühdesinfektion der Konnektoren vor dem Anschluss zu achten.
Für den Einzelplatzeinsatz wie auch für die Heimdialyse werden mobile Kleinosmosegeräte verwendet, die an das Trinkwassernetz angeschlossen werden. Auch diese Geräte müssen regelmäßig desinfiziert werden.
Organisatorische Voraussetzungen
Die Verantwortung für die Hygiene in einer Dialyseeinrichtung liegt beim Betreiber. Dieser muss sicherstellen, dass alle Mitarbeiter in Hygienefragen geschult sind, somit Schulungen neu eintretender Mitarbeiter und auch regelmäßige Nachschulungen des Stammpersonals durchführen.
Ein Dialysezentrum benötigt einen Hygieneplan:DialyseHygieneplan, hierfür besteht eine gesetzliche Verpflichtung aus dem IfSG.
Dieser legt die Verantwortlichkeiten und die Durchführung von Hygienemaßnahmen in der Einrichtung verbindlich fest.
Die Dialysematerialien (Kanülen, Schläuche, Dialysatoren) sind Einmalmaterial, eine Wiederverwendung auch für den gleichen Patienten ist abzulehnen.
5.19.2. Praktischer Betrieb einer Dialyseeinheit
Allgemeine Hygienemaßnahmen
Patientenbehandlung
Drei Schutzziele verfolgt die Hygiene bei der Nierenersatztherapie:
-
•
Der einzelne Dialysepatient soll ohne Infektionskomplikationen behandelt werden.
-
•
Im Behandlungszentrum muss der Gefahr einer endemischen Ausbreitung begegnet werden.
-
•
Die Mitarbeiter einer Einrichtung sind im Sinne des Nierenersatztherapie, SchutzzieleArbeitsschutzes vor berufsbedingten Erkrankungen zu schützen.
Standardhygienemaßnahmen
Die Basis für eine hygienisch einwandfreie Nierenersatztherapie legen die Standardhygienemaßnahmen.
Standardhygienemaßnahmen in der Dialyse
-
•
Hygienische Händedesinfektion vor/nach jedem Patientenkontakt oder Kontakt mit infektionsgefährdendem Material,
-
•
Tragen von Einmalhandschuhen und Schutzkitteln bei jeder Maßnahme am Patienten, bei der die Möglichkeit des Kontakts mit Blut oder Körpersekreten besteht,
-
•
Wechsel der Handschuhe vor jedem neuen Patienten,
-
•
Reinigung und Desinfektion aller Geräte und Maschinen und patientennahen Oberflächen nach jeder Behandlungsschicht,
-
•
Minimierung der gemeinsamen Benutzung von Gerätschaften (Stauschläuche, Blutdruckmanschetten etc.) für verschiedene Patienten.
Diese sind immer und unabhängig von zusätzlichen, besonderen Risiken (Infektionspatienten) anzuwenden. Überragende Bedeutung kommt dabei der Händehygiene zu, da die Hände der Pflegenden die Standardhygienemaßnahmen:DialyseMehrzahl der infektiösen Erreger übertragen.
Hygieneinformationen für den Patienten
Dialyse:Standardhygienemaßnahmen
Die Patienten sind über hygienisches Verhalten innerhalb und außerhalb des Behandlungszentrums zu instruieren. In der Regel erfolgt auch eine Schulung der Partner des Patienten.
Hierzu gehören die regelrechte persönliche Hygiene, adäquates Verhalten während der Behandlung, Händedesinfektion bei evtl. Toilettenbesuchen etc. Heimdialyse- und Peritonealdialysepatienten werden umfangreich geschult, um die spezifischen Prozeduren Patient(en):Dialyse, Hygieneinformationenwährend der Behandlung selbst zu erlernen.
Dialysezugang
Die Hämodialyse wird meist über eine operativ angelegte arteriovenöse Fistel (Shunt) aus körpereigenen Gefäßen (V. cephalica auf A. radialis am Unterarm, V. cephalica auf A. brachialis in der Ellenbeuge) durchgeführt. Die Punktion erfolgt mit zwei großlumigen (15–17 G, Außendurchmesser 1,4–1,8 mm) Kanülen. Bei Patienten mit ungünstigen Gefäßverhältnissen können arteriovenöse Kunststoffinterponate oder zentralvenöse Dialysekatheter verwendet werden. Infektiologisch sind die nativen Fisteln vorzuziehen. Sind zentralvenöse Katheter unvermeidbar, sollen sie mit einem langen s. c. Tunnel durch die Haut ausgeführt werden, um die Erregeraszension entlang dem Plastikmaterial zu erschweren. Ungetunnelte Katheter sind nur für eine kurze Verweilzeit von 1–2 Wochen geeignet. Der Blutfluss während der Dialysebehandlung beträgt 200–400 ml/min. Bei jeder Shuntpunktion ist auf hygienisch einwandfreies Arbeiten zu achten.
Unverzichtbare Hygienemaßnahmen bei Verwendung von Dialyseshunts
Hygienemaßnahmen:Dialyseshunts Dialyseshunt(s), Hygienemaßnahmen
-
•
Händedesinfektion durch das Pflegepersonal,
-
•
Verwendung keimarmer Einmalhandschuhe,
-
•
großflächige Hautantiseptik am Shuntarm unter Beachtung der erforderlichen Einwirkzeiten,
-
•
nach Kanülenentfernung Abdrücken der Punktionsstelle mit sterilen Kompressen,
-
•
Desinfektion der Abdrückhilfen nach jedem Gebrauch,
-
•
keine Verwendung von Hautsalben im Shuntbereich.
Shuntinfektionen gehören zu den häufigen und schwerwiegenden Komplikationen beim chronisch Nierenkranken.
Bei dauerhaft verwendeten zentralvenösen Kathetern sind die Infektionsrisiken erheblich höher als bei nativen Fisteln.
Während bei nativen Fisteln mit 2,5 Infektionen pro 1.000 Dialysen zu rechnen ist, liegt die Infektionsrate bei Dialyse:Shuntinfektionengetunnelten ZVK bei ca. 14/1.000 Dialysen (Stevenson et al. 2000). Shuntinfektion(en):DialyseBereits bei der Katheteranlage müssen Fehler vermieden werden.
Dialysekatheter sollten, soweit es die Gefäßverhältnisse zulassen, an der oberen Körperhälfte angelegt werden, Femoralkatheter sind nur im Ausnahmefall akzeptabel (Zaleski et al. 1999).
Bei der Katheteranlage sollen Kopfhaube, Mund-Nasen-Schutz, langärmeliger, steriler Kittel sowie sterile Handschuhe getragen werden.
Die Einstichstelle muss großflächig antiseptisch benetzt und das Umfeld mit einem sterilen Tuch abgedeckt werden (Raad et al. 1994, KRINKO 2002). Die Dialysekatheter:AnlageKatheteraustrittsstelle soll steril verbunden werden. Verbandswechsel nach jeder Dialyse sind empfehlenswert, hierbei kann die Austrittsstelle mit octenidinhaltigen Präparaten behandelt werden. Von der routinemäßigen Anwendung antiseptischer Salben ist jedoch abzuraten.
Beim Anschluss der Dialysemaschine an einen ZVK ist größte Sorgfalt vonnöten.
Vorgehen bei der Konnektion am Dialysekatheter
Dialysekatheter:Konnektion
-
•
Händedesinfektion durch das Pflegepersonal.
-
•
Verwendung keimarmer Einmalhandschuhe.
-
•
Verwendung eines Mund-Nasen-Schutzes durch Pflegekraft.
-
•
Patient soll das Gesicht abwenden und nicht sprechen.
-
•
Sprühdesinfektion der Konnektoren, Einwirkzeiten beachten!
-
•
Beim Abstöpseln sind Blutreste am Konnektor mit Desinfektionsmittel und sterilen Kompressen zu entfernen.
-
•
Bei Nichtbenutzen wird der Katheter gegen mechanische Belastung geschützt verbunden.
Die offenen Konnektoren dürfen nicht mit der Hand berührt werden (Non-touch-Technik). Wichtig ist auch, dass die großlumigen Katheter ausschließlich für die Dialysebehandlung, nicht aber für evtl. Infusionen zu verwenden sind.
Um eine Thrombosierung des Katheters zwischen den Dialysen zu vermeiden, wird das Lumen nach Abschluss der Behandlung häufig mit verdünnter Heparinlösung gefüllt. Diese hat allerdings keine antimikrobielle Wirksamkeit, sodass mikrobielles Wachstum und Biofilmbildung im Inneren des Katheters möglich sind. Inzwischen liegen zahlreiche Studien vor, die einen Vorteil antibakteriell wirkender Locklösungen belegen (Jaffler et al. 2008).
Die Verwendung ausschließlich von Heparin ist nicht mehr als Standard anzusehen.
Antibiotikalösungen sind aufgrund der konsekutiv auftretenden Resistenzen abzulehnen. Verwendet werden können konzentrierte Citratlösungen (30- oder 45-prozentig) sowie Taurolidin-Citratlösungen (Betjes et al. 2004). Hoch dosierte Citratlösungen müssen aufgrund der Gefahr schwerwiegender kardialer Arrhythmien von fachkundigem Personal streng nach Herstellervorschrift angewandt werden, weisen gegenüber Taurolidin aber einen Kostenvorteil auf.
Parenteralia-Gabe und POC-Diagnostik
Relativ häufig werden während oder am Ende einer Dialyse parenterale Medikamente verabreicht (Heparin, Erythropoetin, Eisen). Es Dialysezugang\"\r\"Dialysezuganghat sich aus Kostengründen etabliert, hierfür Medikamente aus Multidose-Gebinden zu verwenden. Das ist akzeptabel, sofern die Vorbereitung der Parenteralia an einem sauberen desinfizierten Arbeitsplatz erfolgt, an dem Medikament(e):parenterale, Dialyseein Kontakt mit bereits am Patienten angewandten Kanülen, Dialysatoren, Schlauchsystemen oder anderen potenziell kontaminierten Gegenständen ausgeschlossen ist. Es ist strikt darauf zu achten, dass parenteral zu applizierende Medikamente zunächst am Parenteraliaplatz in geeigneten Spritzen aliquotiert und diese dann auf die Behandlungsplätze verteilt werden. Keinesfalls darf die Multidose-Ampulle von einem zum anderen Patienten im Dialyseraum kreisen.
Dialysezentren führen häufig Point-of-Care-Diagnostik (POC-Diagnostik) aus Blutproben durch, vor allem Blutzuckermessungen oder Blutgasanalytik/Ionometrie. Hierbei besteht Kontaminationsgefahr durch Messgeräte, Lanzetten oder Teststäbchen bei der Blutzuckermessung. Einmalmaterialien müssen sofort nach Einsatz in sichere Abfallbehälter POC-Diagnostik, Dialyseeinheitentsorgt werden. Der Einsatz von Blutzuckermessgeräten, die von einem Patienten zum anderen durch das Dialysezentrum kreisen, ist kritisch zu bewerten. Hier ist eine Wisch- oder Sprühdesinfektion beim Wechsel von einem Patienten zum nächsten erforderlich. Der Säure-Base-Analysator steht i. d. R. an einer zentralen Stelle im Dialysezentrum. Die Blutproben müssen dorthin gebracht, gemessen und dann fachgerecht entsorgt werden. Die Pflegekraft muss vor Verlassen des Messplatzes die Handschuhe ausziehen und darf erst nach Händedesinfektion in den Behandlungsbereich zurückkehren. Sowohl für die Vorbereitung von Multidose-Medikamenten als auch die POC-Diagnostik sind in einem Dialysezentrum detaillierte Verfahrensanweisungen zu erstellen, die Bestandteil der Hygieneplans sind.
Problemerreger im Dialysezentrum
Bei Dialysepatienten, die mit sog. Dialyseeinheit:Hygienemaßnahmen\"\r\"DialyseeinheitHygmassProblemerregern besiedelt sind, müssen im Dialysezentrum in unterschiedlicher Abstufung Hygienemaßnahmen:Dialyseeinheit\"\r\"DialyseeinheitHygmasszusätzliche Hygienemaßnahmen durchgeführt werden (Tab. 5.31 ). Hierzu kann eine Separierung von kolonisierten Patienten gehören.
Im ambulanten Dialysezentrum unterscheidet man die organisatorische, räumliche und zonale Separierung.
Tab. 5.31.
Schutzmaßnahmen bei Problemerregern in der Dialyse.VRE:Dialysepatient(en)Virushepatitis:DialysepatientenNoroviren:DialysepatientenMRSA:DialysepatientenHIV:DialysepatientenESBL:Dialysepatient(en)Clostridium difficile:Dialysepatienten
| Erreger | Routinescreening | Separierung | Eigene Maschine |
|---|---|---|---|
| Hepatitis B | Ja | Ja | Ja |
| Hepatitis C | Ja | Nein | Ja |
| HIV | Ja∗ | Nein | Ja |
| MRSA | Nein | Ja, evtl. zonal | Nein |
| VRE | Nein | In besonderen Situationen | Nein |
| ESBL | Nein | In besonderen Situationen | Nein |
| C. difficile | Nein | In besonderen Situationen | Nein |
| Norovirus | Nein | Ja | Nein |
Individuelles Einverständnis des Patienten erforderlich.
Die organisatorische Separierung erfolgt durch Behandlung kolonisierter Patienten zu unterschiedlichen Zeiten oder in unterschiedlichen Behandlungsschichten. Die räumliche Separierung bezeichnet die Behandlung in einem in der Regel durch eine Tür abgetrennten Raum. Als Erweiterung der durch die Richtlinien der KRINKO vorgegebenen Separierungskategorien wurde für die Behandlung MRSA-kolonisierter Patienten in der ambulanten Dialyse zusätzlich der Begriff der zonalen Trennung eingeführt (Deutsche Arbeitsgemeinschaft für klinische Nephrologie 2008). Dieser beschreibt eine Abgrenzung innerhalb eines Behandlungsraums z. B. durch eine mobile Trennwand. Bei Betreten des zonal abgegrenzten Bereichs sind alle Maßnahmen wie bei Betreten eines Isolierzimmers (Händedesinfektion, Handschuhe, Schutzkittel, Mund-Nasen-Schutz) zu treffen. Bei der zonalen Trennung ist auf ausreichende Größe des abgetrennten Bereichs zu achten, um darin die notwendigen hygienischen Arbeitsprozesse durchführen zu können.
Virushepatitis
Infektionsrisiken: Die chronischen Virushepatitiden B und C spielen heute in der Dialyse keine zahlenmäßig große Rolle mehr. Es wird geschätzt, dass Hepatitis B\t\"Siehe auch Virushepatitisetwa 1 % aller Dialysepatienten an einer chronisch replizierenden Hepatitis C\t\"Siehe auch VirushepatitisHepatitis B leidet, die Prävalenz der Hepatitis C liegt bei etwa 2,4 % (Frei und Schober-Halstenberg 2007). Diese niedrigen Zahlen sind das Ergebnis einer fortgesetzten präventiven Anstrengung. In der Frühzeit der Dialyse kam es zu endemischen Ausbrüchen in Dialysezentren. Die Prävalenz der Hepatitis B lag 1980 bei über 12 %.
Die gemeinschaftliche Behandlung von Patienten mit einem Therapieverfahren, das ein hohes Risiko der Entstehung von Blutspritzern bedingt, führt zu idealen Bedingungen der nosokomialen Hepatitistransmission. Hinzu kommt, dass der Abwehrdefekt der chronisch Nierenkranken in der Mehrzahl der Fälle die Ausheilung der Hepatitis-B-Infektion verhindert. Die kontinuierliche Aufrechterhaltung optimaler Hygienemaßnahmen gegen die viralen Hepatitiden ist auch wegen der hohen Prävalenz der Infektion in anderen Weltregionen erforderlich. Urlaubsdialysen im Ausland oder ausländische Dialysepatienten ermöglichen die Einschleppung der Viren in deutsche Dialysezentren.
Die Infektionsrisiken unterscheiden sich zwischen Hepatitis B und C. Die Kopienzahl im Blut und damit die Infektiosität von Blutspritzern ist bei der Hepatitis B mindestens um den Faktor 10 höher. Es wird daher eine Abstufung der gesonderten Hygienemaßnahmen zwischen Trägern der Hepatitis B und solchen der Hepatitis C empfohlen.
Screening: Ausgangspunkt der Präventionsbemühungen für blutübertragene Erreger ist die Erkennung chronisch infizierter Patienten. Bei Eintritt in ein Dialyseprogramm soll ein Patient daher auf Hepatitis B und C getestet werden (Tab. 5.32 ). Jährliche Verlaufskontrollen helfen, eventuelle Serokonversionen zu erkennen. Aufgrund des Immundefekts chronisch Nierenkranker mündet eine Hepatitisinfektion nicht zwingend in eine klinisch symptomatische Hepatitis. Oftmals wird die Erkrankung nur serologisch diagnostiziert. Für Screeningzwecke reicht die Untersuchung auf HBsAg aus, ein HBV-DNA-Nachweis ist lediglich zur Steuerung einer evtl. Therapie der Infektion erforderlich. Moderne Anti-HCV-Assays weisen eine hohe Sensitivität auf und reichen in Deutschland als Routinescreening für die Infektion aus. Es kommen bis zu 1 % falsch negative serologische Befunde vor, in diesen Fällen kann das Virus nur durch HCV-RNA-Nachweis diagnostiziert werden. Eine PCR-Diagnostik als Routinemaßnahme ist nur in Hochprävalenzgebieten sinnvoll. Ein generelles PCR-basiertes Screening wird allgemein dann empfohlen, wenn die Hintergrundpopulation eine so hohe HCV-Prävalenz (etwa ab 5 %) aufweist, dass die Entdeckung okkulter Infektionen mehr nützt als falsch positive Befunde schaden. Dies ist in Deutschland nicht der Fall, die Prävalenz der HCV-Infektion in der Allgemeinbevölkerung wird auf 0,4 % (Bundesgesundheitssurvey 1998: Thierfelder et al. 1998) geschätzt. Im Rahmen von endemischen Ausbrüchen der Hepatitis C in Dialyseeinrichtungen war es sehr hilfreich, auf Rückstellproben der diagnostischen Labors aus dem serologischen Screening zurückgreifen zu können und Infektionsquellen zu eruieren.
Tab. 5.32.
Durchführung des Hepatitis-Screenings.
| Eingangsuntersuchung | Jährliche Kontrolle | Urlaubsrückkehrer∗ | |
|---|---|---|---|
| HbsAg | + | + | + |
| Anti-HBs | + | + | – |
| Anti-HBc | + | + | – |
| HBV-DNA | Nur zur Steuerung einer evtl. Therapie | – | – |
| Anti-HCV | + | + | – |
| HCV-RNA | Nur wenn Anti-HCV positiv | – | + |
| Anti-HIV | + | – | – |
Nach Dialyse in Endemiegebieten.
Bei Urlaubsrückkehrern, die in Hochprävalenzgebieten dialysiert haben, ist ein zusätzlicher Test auf HBsAg sowie eine HCV-PCR sinnvoll. Die serologischen Tests sprechen hier nicht rasch genug an, um eine frische Infektion zu detektieren.
Besondere Hygienemaßnahmen: Als Basis des Hepatitisschutzes müssen die Standardhygienemaßnahmen umgesetzt werden. Grundsätzlich würde das für eine nahezu vollständige Verhinderung nosokomialer Infektionen ausreichen (Jadoul et al. 1998). Allerdings ist erfahrungsgemäß die Adhärenz des Personals zu Hygieneregeln dauerhaft in kaum mehr als 50 % gegeben (Arenas et al. 2005). Um dennoch eine ausreichende infektiologische Sicherheit zu garantieren, werden zusätzliche Präventionsmaßnahmen empfohlen, wenn Patienten mit viralen Hepatitiden dialysiert werden. Infizierte sollen mit individuell zugewiesenen Dialysemaschinen behandelt werden. Das soll eine akzidentelle Transmission über Blutspritzer an der Oberfläche der Geräte von einem Patienten zum nächsten verhindern. Das Ziel der separaten Dialysemaschine ist dabei nicht, die Übertragung durch das Geräteinnere, durch Schlauchsysteme und Ventile des hydraulischen Systems zu verhindern. Dieses Risiko ist ausgesprochen gering, da durch eine intakte Dialysemembran keine infektiösen Viruspartikel ins Dialysat übertreten können. Selbst bei Membranruptur und Kontamination der Dialysatseite würden die Viren in den Abwasserteil der Maschine gelangen, eine Infektion des nächsten Patienten wäre höchst unwahrscheinlich.
Aufgrund der hohen Infektiosität und der Umweltresistenz vor allem von HBV wird zusätzlich eine Behandlung der Patienten in separaten Räumen, getrennt von für die Infektion anfälligen Patienten, empfohlen (Deutsche Arbeitsgemeinschaft für Klinische Nephrologie 2008). Diese Räume können nach desinfizierender Reinigung der patientennahen Oberflächen in der nächsten Schicht wieder für nicht infizierte Patienten genutzt werden.
Rückführung von Dialysegeräten: Eine Rückführung von Dialysegeräten aus der Hepatitis-Nutzung in den Routinebetrieb ist möglich. Hierzu ist eine gründliche, über das normale Maß hinausgehende Oberflächenreinigung erforderlich, ferner wird eine Dialysegerät(e):Rückführung, Virushepatitisentkalkende Desinfektion der inneren Leitungssysteme empfohlen. Um größtmögliche Virushepatitis:Dialysegeräte, RückführungSorgfalt bei der Oberflächendesinfektion zu erreichen, sollte eine Rückführung als ein definierter Prozess verstanden werden, für den ein Mitarbeiter der Dialyseeinrichtung persönlich verantwortlich zeichnet.
Hepatitis-B-Impfung:
Die Impfung sollte spätestens bei Eintritt in ein Dialyseprogramm für alle Patienten Standard sein. Aufgrund besserer Ansprechraten in früheren Stadien der Niereninsuffizienz wird i. d. R. bereits ab einer GFR < 25 ml/min geimpft.
Wegen des deutlich reduzierten Ansprechens nierenkranker Patienten wird mit doppelter Impfstoffdosis und erweiterten Impfschemata vakziniert. Dennoch gibt es etwa 20–30 % der Patienten, die keine Seroprotektion entwickeln. Für diese ist die Einhaltung der Hygienemaßnahmen von besonderer Bedeutung.
HIV
Die Prävalenz HIV-Dialysepatient(en):Virushepatitis\""\r""VirushepatitisDialyseinfizierter Patienten ist in deutschen Virushepatitis:Dialysepatienten\""\r""VirushepatitisDialyseDialyseeinrichtungen sehr gering. Die meisten Dialysezentren haben hiermit keine Erfahrung. Die hygienischen Risiken sind im Vergleich mit den Virushepatitiden als geringer HIV:Dialysepatienteneinzuschätzen. Die Kopienzahl im Blut ist niedriger, die Dialysepatient(en):HIVUmweltresistenz des Erregers geringer. In Deutschland wird derzeit noch häufig die Verwendung separater Dialysemaschinen für HIV-infizierte Patienten favorisiert, ein separater Raum ist nicht erforderlich. Die Empfehlungen der amerikanischen Centers for Disease Control (2001) sehen selbst die Maschinentrennung nicht mehr vor. Grundsätzlich sind Standardhygienemaßnahmen ausreichend, eine nosokomiale Übertragung zu verhindern.
MRSA
Bei > 5 % der Dialysepatienten wurde 2005 MRSA diagnostiziert (Frei und Schober-Halstenberg 2007). Da im Dialysezentrum eine nosokomiale Verbreitung erfolgen kann, sind präventive Maßnahmen unverzichtbar. Das ist umso wichtiger, als Staphylokokken zu den häufigsten Erregern bakterieller Infektionen bei chronisch Nierenkranken gehören und Infektionen des Gefäßzugangs ein besonderes Gefahrenpotenzial darstellen.
Screening: Für Patienten, die erstmals in ein Dialyseprogramm eintreten, ist ein Screening auf MRSA nur erforderlich, wenn sie aus Behandlungseinrichtungen kommen, in denen ein MRSA-Risiko besteht oder wenn eine MRSA-Kolonisation in der Dialyse:MRSA-ScreeningVergangenheit bereits vorgelegen hatte. Kommt ein Patient MRSA-Screening:Dialysehingegen aus seinem häuslichen Umfeld, ist ein Screening nicht erforderlich. Ebenso wird kein Routinescreening des Dialysepersonals durchgeführt. Ein regelmäßig wiederholtes Screening von Patienten im Dialyseprogramm wird nicht empfohlen, zumal hierfür aufgrund des ambulanten Charakters der Therapie keine sinnvollen Intervalle zu definieren wären. Ein Screening sollte allerdings durchgeführt werden bei Wiederaufnahme von Patienten nach stationärem Aufenthalt aus Behandlungseinrichtungen mit bekanntem MRSA-Vorkommen. Wird in einem Dialysezentrum bei mehr als 2 Patienten im zeitlichen Zusammenhang eine MRSA-Kolonisation festgestellt, sollten alle Patienten und das medizinische Personal der Behandlungseinheit untersucht werden, um mögliche nosokomiale Transmissionswege aufzudecken.
Maßnahmen bei Kolonisation: Da die Dialyse in der Mehrzahl der Fälle nicht unter stationären Krankenhausbedingungen stattfindet, sind hinsichtlich des Umgangs mit MRSA-besiedelten Patienten Besonderheiten zu beachten, weil im Gegensatz zum stationär behandelten Krankenhauspatienten das (infektiologische) Umfeld des Dialyse:MRSA-KolonisationDialysepatienten außerhalb der Dialyse nicht kontrollierbar ist. Der Patient kann zwischen zwei Dialysen in anderen medizinischen Einrichtungen MRSA akquirieren, viele Patienten leben in Alten- und Pflegeheimen und sind dort potenziell gefährdet. Die Basis gegen die Verbreitung von MRSA ist wiederum die optimale Einhaltung der Standardhygiene mit dem Schwerpunkt der Händedesinfektion. Zusätzlich ist die Übertragung via Aerosol, Staub oder Oberfläche gemeinsam genutzter Gerätschaften durch geeignete Maßnahmen zu unterbrechen.
Hygienemaßnahmen bei MRSA-kolonisierten oder -infizierten Dialysepatienten
Dialysepatient(en):MRSA-kolonisierte/-infizierte, Hygienemaßnahmen
-
•
Räumliche, zonale oder organisatorische Trennung von anderen Dialysepatienten,
-
•
separate Dialysemaschine nicht erforderlich,
-
•
strikte Einhaltung der Standardhygienemaßnahmen,
-
•
patientenbezogener Schutzkittel, Mund-Nasen-Schutz für das Personal,
-
•
gut erreichbarer Dialyseplatz ohne Durchquerung des ganzen Dialysezentrums,
-
•
Eradikationsversuch anstreben,
-
•
Anfahrt per Einzeltransport im normalen Taxi,
-
•
normale Sozialkontakte außerhalb der Dialyse.
Sanierung:
MRSA-Sanierung:DialysepatientenGrundsätzlich ist auch beim Dialysepatient(en):MRSA-SanierungDialysepatienten eine Sanierung der MRSA-Besiedlung möglich und anzustreben (Lederer et al. 2007), wenngleich keine Daten über die Dauerhaftigkeit der Elimination vorliegen.
Die Sanierung wird durch die Tatsache erschwert, dass viel Eigeninitiative des Patienten erforderlich ist. Die 3-mal tägliche Applikation antiseptischer Nasensalbe kann vom Patienten selbst vorgenommen werden, ebenso die antiseptische Körperwaschung. Allerdings werden diese Maßnahmen derzeit nicht von den Kostenträgern bezahlt.
Andere multiresistente Erreger
VRE und ESBL erlangen zunehmend epidemiologische Bedeutung in Dialysezentren. Hinzu kommen Gastroenteritiden durch C. difficile. Bei Dialyse:MRSA\""\r""MRSADialyseDialysepatienten werden sie vor allem wegen des häufigen Einsatzes von MRSA:Dialyse\""\r""MRSADialyseAntibiotika relativ häufig gefunden. Die Weiterverbreitung kann fäkal-oral erfolgen.
VRE: Es wird kein Screening unauffälliger ambulanter Dialysepatienten auf VRE empfohlen. Somit wird auch die Kolonisation in vielen Fällen nicht festgestellt. Ein Übertragungsrisiko besteht bei Durchfallerkrankungen oder VRE-infizierten Wunden. In diesen Fällen sind spezielle VRE:Dialysepatient(en)Hygienemaßnahmen erforderlich. Diese entsprechen in Art und Umfang denen bei MRSA-Kolonisation, d. h. neben akribisch durchgeführter Standardhygiene räumliche oder organisatorische Separierung bei der Dialyse und Mund-Nasen-Schutz bei übertragungsgefährdeten Tätigkeiten am Patienten. Eine zonale Separation wie für MRSA-Patienten ist ebenfalls adäquat. Die Separationsmaßnahmen können beendet werden, sobald kein Durchfall mehr vorliegt bzw. die infizierte Wunde kein Verbreitungsrisiko mehr darstellt. Die Maßnahmen werden somit durch die hygienische Handhabbarkeit, nicht jedoch durch den Keimnachweis getriggert. Eine Sanierung enteral VRE-kolonisierter Patienten ist kaum möglich. Bei asymptomatischen Patienten können daher die i. d. R. sehr lange positiv bleibenden rektalen Kontrollabstriche unterbleiben.
ESBL-Erreger: Für diese Erreger gilt im Wesentlichen die gleiche Vorgehensweise wie für VRE. Allerdings werden ESBL-Erreger häufig nicht nur bei Durchfall im Stuhl gefunden, sondern auch als Erreger von Harnwegs- oder Wundinfektionen. In diesen Fällen soll durch antibiogrammgerechte Therapie eine Sanierung ESBL:Dialysepatient(en)angestrebt werden. Die zusätzlichen Hygienemaßnahmen entsprechen denen bei MRSA. Eine Eradikation aus dem Darm ist nahezu unmöglich. Daher sollten auch keine Rektalabstriche erfolgen. Waren andere Körperregionen infiziert, werden nach Abschluss der antibiotischen Behandlung drei Kontrollabstriche jeweils im Abstand einer Woche abgenommen. Bleiben diese negativ, wird die Eradikation angenommen und die zusätzlichen Hygienemaßnahmen werden aufgehoben.
Clostridium difficile: Ähnlich wie bei Besiedlung mit VRE und ESBL-Erregern ist auch mit Patienten zu verfahren, die an einer Kolitis mit C. difficile leiden. Solange Durchfälle bestehen, sind zusätzliche Hygienemaßnahmen sinnvoll, eine Separation zur Dialysebehandlung ist zu empfehlen. KlingtClostridium difficile:Dialysepatienten die klinische Symptomatik ab, verringert sich bei Patienten mit normaler Körperhygiene das Transmissionsrisiko deutlich. Isolationsmaßnahmen können daher aufgehoben werden, auch wenn der Nachweis der Erregerelimination noch nicht geführt ist. Hierzu sind drei im Wochenabstand abgenommene Rektalabstriche mit negativem Ergebnis zu fordern.
Hochkontagiöse Erreger
Im Zusammenhang mit der ambulanten Dialysebehandlung kommen Infektionen mit Noroviren oder Influenza vor, die aufgrund der hohen Ansteckungsgefahr besondere hygienische Maßnahmen erfordern.
Patienten mit akuten Durchfallerkrankungen sollten insbesondere in der typischen Jahreszeit (Wintermonate) in separaten Räumen dialysiert werden.
Ergibt die Diagnostik eine Norovirusinfektion, müssen die besonderen Hygienemaßnahmen bis mindestens 2 Tage nach Abklingen der Symptomatik beibehalten werden. Bei Noroviren:DialysepatientenNoroviruserkrankung ist die zonale Trennung nicht ausreichend, hier besteht das Erfordernis eines separaten Raums (Einzelzimmer oder Kohortenisolierung). Vor Betreten des Raums sind in jedem Fall patienten- oder kohortenbezogen Schutzkittel und Handschuhe anzulegen, bei Tätigkeiten mit Gefahr der Aerosolbildung (Patienten mit Erbrechen, beim Betten oder bei der Körperpflege), zusätzlich Mund-Nasen-Schutz. Der Patient kann nicht die Gemeinschaftstoilette einer Dialyseeinrichtung aufsuchen und benötigt, falls keine separate Toilette verfügbar ist, einen Toilettenstuhl im Isolierzimmer. Zum Schutz vor Noroviren muss die Händedesinfektion mit viroziden Desinfektionsmitteln erfolgen. Raum und Dialysemaschine können nach der desinfizierenden Reinigung mit viroziden Mitteln wieder für nicht infizierte Dialysepatienten verwendet werden.
Bei akuten Erkältungskrankheiten mit typischer Symptomatik werden üblicherweise nur allgemeine Schutzmaßnahmen angewandt (hygienisches Husten, Abstand halten zum Infizierten, hygienische Entsorgung von Einmaltaschentüchern). Bei epidemischem Auftreten der Influenza kann es erforderlich werden, dass sich Patienten bereits vor Eintreten in eine Dialyseeinrichtung als erkrankt identifizieren, damit ihnen ein separater Dialyseplatz zugewiesen werden kann. Kontakte zu anderen Patienten sind möglichst zu vermeiden, eine Kohortenisolierung ist Influenza:Dialysepatientenmöglich. Besondere Schutzmaßnahmen umfassen den patientenbezogenen Schutzkittel, Mund-Nasen-Schutz und Handschuhe, separate Dialysegeräte sind nicht erforderlich. Die Isolierungsmaßnahmen können nach Abklingen der klinischen Symptomatik aufgehoben werden.
5.19.3. Dialysegeräte
Problemerreger:Dialyseeinheit\"\r\"DialyseeinheitProblemerrerger Auf- und Abrüsten, Abfallmanagement: Alle Dialyse:Problemerreger\"\r\"DialyseeinheitProblemerrergerDialysegeräte werden mit Dialyseeinheit\"\r\"DialyseeinheitSchlauchsystemen und Filtern ausgestattet, die zur einmaligen Verwendung konzipiert sind. Die steril verpackten Schlauchsysteme werden i. d. R. vor Eintreffen des Patienten an das Dialysegerät gesteckt und mit Kochsalzlösung gefüllt.
Fertig aufgerüstete Systeme müssen innerhalb von 12 Stunden angewendet werden, ansonsten müssen die Schlauchsysteme und Filter verworfen werden.
Bei Geräten für die Dialysegerät(e):Aufrüstenambulante intermittierende Hämodialyse wird die Dialysierflüssigkeit i. d. R. in einem hydraulischen System im Innern der Maschine aus Reinwasser und Salzkonzentraten zubereitet. Diese Systeme müssen nach Herstellervorgaben in regelmäßigen Abständen gespült bzw. desinfiziert werden. Hierzu kommen Heißdesinfektion oder chemische Desinfektion in Betracht. Geräte, die auf Intensivstationen zur kontinuierlichen Dialyse angewandt werden, verfügen meist nicht über solche hydraulischen Kreisläufe im Innern. Hier wird die Dialysierflüssigkeit steril verpackt in Beuteln angeliefert, alle Flüssigkeit führenden Teile werden aus Einmalmaterialien zusammengesetzt.
Entscheidend für die hygienische Sicherheit der Dialysemaschine ist die adäquate Oberflächendesinfektion. Blutspritzer und Verunreinigungen an der Oberfläche, an Schaltern und Bedienelementen, an Blutpumpen oder Anbauteilen stellen ein hohes Risiko für die Behandlung nachfolgender Patienten dar.
Schon bei der technischen Konzeption von Dialysegeräten ist auf eine für Reinigung und Desinfektion geeignete Gestaltung zu achten. Im Alltagsbetrieb sind regelmäßige Desinfektionen unter Beachtung der Einwirkzeit essenziell für die Sicherheit der Behandlung. Im Verhältnis zur Wahrscheinlichkeit einer Erregerübertragung über die äußeren Oberflächen von Dialysemaschinen ist die Transmission über eine Kontamination der hydraulischen Systeme im Innern theoretischer Natur und nahezu zu vernachlässigen.
Nach Abschluss einer Dialysebehandlung verbleiben in den Schlauchsystemen und Filtern kleine Mengen an Blut (< 1 ml pro Behandlung bei adäquater Durchführung). Beim Abrüsten der Dialysemaschine müssen die Schlauchsysteme daher an den Enden verschlossen oder das arterielle und venöse Ende dicht miteinander verbunden werden, damit keine Flüssigkeit auslaufen kann. Die Einmalmaterialien sind am Dialyseplatz in dichte Abfallbehälter zu verpacken. Dialysegerät(e):AbrüstenHierbei kann es sich um reißfeste Abfallsäcke, besser um feste Abfallcontainer handeln. Diese werden verschlossen aus dem Dialyseraum zu einer zentralen Abfallsammelstelle gebracht. Die Dialysekanülen werden separat in stichfesten Sicherheitseinwegbehältern Dialysegerät(e):Abfallmanagementgesammelt und entsorgt. Die sicher verpackten Abfälle werden ohne zusätzliche Behandlung im Hausmüll entsorgt, eine stoffliche Weiterverwertung ist jedoch nicht möglich.
Zuordnung zum Patienten: Üblicherweise erfolgt keine feste Zuordnung von Dialysemaschinen zu einzelnen Patienten. Es ist jedoch ratsam, Patienten möglichst immer an den gleichen Maschinen zu behandeln und die Rotation der Geräte zu begrenzen.
Es sollte für jede einzelne Behandlungssitzung dokumentiert werden, welche Maschine beim Patienten zum Einsatz kam. In der Infektionsdialyse ist eine Zuordnung der Geräte entweder zum einzelnen Patienten oder zu Patientenkohorten mit gleicher Infektionsproblematik erforderlich.Dialysegerät(e)\""\r""Dialysegeraete
5.19.4. Dialyse in der Intensivmedizin
In derDialysegerät(e):Patientenzuordnung Intensivmedizin werden neben den auch für die ambulante Hämodialyse eingesetzten Dialysemaschinen mit interner Dialysatzubereitung auch Geräte für die kontinuierliche Dialyse und Hämofiltration eingesetzt. Diese unterscheiden sich Intensivmedizin:Dialysevor allem im Fehlen eines eingebauten Dialyse:IntensivmedizinFlüssigkeitsproportioniersystems. Sie beziehen die Dialysier- oder Substituatlösungen aus steril verpackten Flüssigkeitsbeuteln. Alle Flüssigkeit führenden Komponenten sind Einmalmaterial und nach Gebrauch zu entsorgen. Besonderes Augenmerk ist auf die desinfizierende Reinigung der Geräteoberflächen zu legen.
Intensivpatienten werden überwiegend über zentralvenöse Katheter dialysiert. Die Hygienemaßnahmen unterscheiden sich nicht von Patienten der ambulanten Dauerdialyse, sie sind jedoch unter den Bedingungen der Intensivmedizin häufig nicht leicht umzusetzen. Zur Behandlung des akuten Nierenversagens werden temporäre Katheter in der V. jugularis verwendet, die nicht über einen langen s. c. Tunnel verfügen (Shaldon-Katheter). Die üblichen Maßnahmen zur Pflege zentralvenöser Katheter gemäß RKI-Richtlinie (2002) spielen für die sehr großkalibrigen, 2- bis 3-lumigen Katheter eine besondere Rolle.
Auch auf Intensivstationen werden Patienten mit Virushepatitiden oder Problemerregern dialysiert. Hinsichtlich MRSA, VRE oder ESBL-Erregern sind die Behandlungs- und Hygienerichtlinien für die stationäre Therapie einzuhalten, zusätzliche Maßgaben für die Dialyse sind nicht erforderlich. Nicht immer liegt vor Einsatz einer Dialyse auf der Intensivstation das serologische Hepatitisprofil des Patienten vor. Im Zweifelsfall sowie bei Hepatitis-B- oder -C-infizierten Patienten sollten bevorzugt Dialysemaschinen verwendet werden, bei denen die Flüssigkeitsführung komplett in Einmalmaterial-Schlauchsystemen erfolgt. Diese Geräte müssen vor Einsatz bei anderen Patienten besonders gründlich oberflächendesinfiziert werden. Grundsätzlich ist eine feste individuelle Zuweisung der Geräte nicht erforderlich und oft auch nicht praktikabel. Sollen Geräte mit internen hydraulischen Systemen verwandt werden, ist vor Verwendung an einem nicht hepatitisinfizierten Patienten eine förmliche „Rückführung“ des Geräts durchzuführen und zu dokumentieren.
5.19.5. Peritonealdialyse
Die Peritonealdialyse wird über einen operativ ins Peritoneum implantierten Kunststoffkatheter (15 French, 5 mm Außendurchmesser) durchgeführt. Der Anschluss der Dialysatbeutel erfolgt über spezielle Konnektoren, die eine Kontamination erschweren. Über den Katheter werden 3- bis 5-mal täglich 1,5–2,5 l PeritonealdialyseDialysat in die Bauchhöhle eingefüllt und wieder entleert.
Die Dialyse wird mit steril und pyrogenfrei verpackten Fertiglösungen durchgeführt. Der Anwender muss sich vor dem Einsatz von der Unversehrtheit der Verpackung überzeugen, ansonsten liegt die Hygieneverantwortung hierfür beim Hersteller. Hygienisch kritisch sind bei diesem Verfahren die Konnektionsvorgänge zwischen Dialysatbeutel und Peritonealkatheter. Der Peritonealdialysepatient erlernt die hygienische Handhabung der Konnektoren im Rahmen einer ausführlichen Schulung. Zum Beutelwechsel ist ein sauberer, zugfreier und ausreichend großer Platz erforderlich. Die Verwendung eines Mund-Nasen-Schutzes durch den Patienten ist zwar nicht evidenzbasiert, jedoch sinnvoll geübte Praxis zur Vermeidung von Aerosolkontaminationen. Nach Händedesinfektion erfolgt eine Konnektion in „Non-touch-Technik“. Es stehen verschiedene patentierte Konnektionssysteme zur Verfügung, die eine Kontamination des Katheterlumens erschweren sollen. Tatsächlich konnte mit den modernen Anschlussverfahren die Peritonitisrate deutlich gesenkt werden.
Alternativ zur intermittierenden Peritonealdialyse, bei der der Patient 3–5 Beutelwechsel pro Tag durchführt (jeweils 1 Anschluss und 1 Abschluss eines über Y-Stück verbundenen Systems aus leerem Ablaufbeutel und gefülltem Dialysatbeutel), kann die automatisierte Peritonealdialyse durchgeführt werden. Hierzu erfolgt einmal täglich vor der Nachtruhe ein Anschluss an ein automatisiertes Cyclergerät, das über Nacht Dialysierflüssigkeit ins Peritoneum und wieder herauspumpt. Am Morgen diskonnektiert der Patient das System und lässt seinen Peritonealkather bis zum nächsten Abend verschlossen. Durch die verminderte Zahl der Konnektionsvorgänge ist dieses Verfahren hygienisch etwas einfacher zu handhaben.
5.20. Dermatologie und Venerologie
Harald Löffler und Axel Kramer
Betrachtet man die Krankenhaushygiene unter dem Gesichtspunkt der Dermatologie, fallen einige Besonderheiten auf.
Infektiöse Dermatosen sind ohne Barrierepflege ein Infektionsrisiko für die Umgebung.
Im Gegensatz zu anderen Organsysteme steht die Haut – und damit Dialyse\"\r\"Dialyseauch die infizierte Haut – in direktem Kontakt zur Umgebung. Hygienemaßnahmen sind daher zur Verhinderung der Weiterverbreitung von Infektionen in der Dermatologie von höchster Relevanz.
Zum anderen tragen die Mitarbeiter mit der mikrobiellen Besiedelung ihrer eigenen Haut relevant zur Verbreitung von NI bei.
Die Vermeidung und Reduktion dieser Besiedelung bei gleichzeitiger Aufrechterhaltung einer guten Hautqualität ist daher von essenzieller Bedeutung.
In dem speziellen Bereich der Dermatochirurgie ist die Prävention von SSI ein zusätzliches Präventionsanliegen. Die SSI-Raten differieren zwischen 0,7 % nach mikroskopisch kontrollierter Chirurgie, 1,5 % nach dermatologisch-onkochirurgischen Eingriffen, 7,6 % nach Laser Skin Resurfacing (LSR) mit CO2-Laser und 8,7 % nach Hauttransplantationen (Bellmann et al. 1998, Manuskiatti et al. 1999, Mühlstädt et al. 2009).
5.20.1. Mikrobielle Besiedelung der Haut
Wir unterscheiden zwischen der dauerhaften normalen Standortflora (residente Flora), der meist kurzfristigeren Kontamination mit anderen Erregern (transiente Flora) und der Infektionsflora.
Residente Flora
Die Standortflora\t\"Siehe Flora, residenteStandortflora sichert das mikroökologische Gleichgewicht innerhalb der episomatischen Biotope, verbunden mit einer Schutzfunktion vor der Kolonisation durch transiente Mikroorganismen bzw. durch Krankheitserreger nach erfolgter Kontamination.
Die Wechselbeziehung Mensch–Standortflora–Umwelt hat eine elementare Funktion für die Erhaltung des Gleichgewichts von physiologischer Besiedlung und Abwehr ständig auf Haut, Schleimhaut bzw. Wunden gelangender transienter Organismen. Nur so war es dem Menschen in seiner Entwicklungsgeschichte möglich, als „Gast“ in einer mikrobiellen Umwelt mit dieser zu koexistieren. Die residente Flora existiert in einem physiologischen Gleichgewicht mit dem Gesamtorganismus in Form eines Mutualismus (Cogen et al. 2008). Bakterien und Pilze nutzen die Körperflüssigkeiten und -oberflächen, z. B. Hautschuppen, als Nahrung und Habitat. Sie finden in ausreichendem Maße Aminosäuren, Fette, Eiweiße, Mineralien und profitieren vom feuchtwarmen Milieu mancher Körperregionen. Auch der Organismus profitiert von dieser Symbiose, da das Immunsystem regelmäßig gezielt stimuliert wird, Stoffwechselprodukte der Mikroorganismen direkt genutzt werden und durch die bestehenden Kolonien residenter Bakterien die Neuansiedelung von Pathogenen erschwert wird. Die physiologische Flora besteht vor allem aus KNS (wie S. epidermidis), Streptokokken und Propionibakterien, aber auch aus Corynebakterien (Tab. 5.33 ) und findet sich in besonders großer Dichte am Kopf, in den Intertrigines und anogenital (Jarvis 1996). Hat sich eine stabile residente Flora ausgebildet, ändern auch Hygienemaßnahmen wie Waschung oder Desinfektion nur kurzfristig etwas an der Zusammensetzung. Innerhalb weniger Stunden stellt sich i. d. R. wieder eine komplette Rekolonisierung ein.
Tab. 5.33.
Häufigkeit und Pathogenität der Standortflora der Haut.
| Spezies | Vorkommen | Pathogenität |
|---|---|---|
| Staphylococcus aureus | Gelegentlich | Hoch |
| Staphylococcus epidermidis | Häufig | Gering |
| Staphylococcus warneri | Gelegentlich | Gering |
| Streptococcus pyogenes | Gelegentlich | Hoch |
| Streptococcus mitis | Häufig | Gering |
| Propionibacterium acnes | Häufig | Gering |
| Corynebacterium spp. | Häufig | Gering |
| Actinetobacter johnsonii | Häufig | Gering |
| Pseudomonas aeruginosa | Gelegentlich | Gering |
| Pityrosporum (Malassezia spp.) | Häufig | Gering |
(nach Cogen et al. 2008)
Bei eingeschränkter Immunabwehr, z. B. bei Intensivtherapiepatienten, immunsuppressiver Therapie, Diabetes mellitus, großen operativen Eingriffen oder konsumierenden Erkrankungen, kann sich die Zusammensetzung der Standortflora verändern und die Eubiose in eine Dysbiose mit Vermehrung potenziell pathogener Erreger übergehen.
Transiente Flora
Die nicht zur Standortflora gehörenden Organismen werden in ihrer Gesamtheit als transiente Flora bezeichnet.
Sie ist einem ständigen Wechsel unterworfen, wobei eine Unterscheidung zwischen residenter und transienter Flora nicht immer möglich ist, was bei langfristiger Kolonisierung mit S. aureus deutlich wird. Noble (1981) hat hierfür den Terminus „temporär residente Flora“ eingeführt.
Die transiente Flora besteht aus pathogenen oder apathogenen Erregern, die nur kurzfristig auf der Haut verweilen, weil sie i. d. R. nicht über längere Zeit auf Haut oder Schleimhäuten überleben können. Selten können sie länger als wenige Stunden auf der Haut nachgewiesen werden. Findet sich dennoch eine Besiedelung von Pathogenen über längere Zeit, spricht man von Trägern (Carrier). Häufige transiente Organismen sind S. aureus (mit Hauptreservoir in der Nasenhöhle), S. pyogenes, E. coli, P. aeruginosa, Proteus, Clostridium und Candida spp. (Dohmen 2006). Wenige Viren wie humane Papillomaviren oder HSV können aufgrund ihrer Fähigkeit zur Adhäsion ebenfalls kurzfristig an der Hautoberfläche anhaften. Nimmt die Anzahl der transienten Erreger auf der Haut zu, kann das unterschiedliche Gründe haben. In Gesundheitseinrichtungen kann ein verändertes Erregerspektrum in der Umgebung zu einem veränderten Spektrum auf der Haut führen. Daneben gibt es endogene Faktoren wie Erkrankungen (Diabetes mellitus, hämatologische Erkrankungen, Tumorleiden, Vitaminmangelzustände, Alkoholismus) sowie iatrogene Gründe (Immunsuppression, antimikrobielle Therapie), die zu einer veränderten Flora auf der Haut beitragen (Elsner 2006).
Abgesehen von der Möglichkeit der Weiterverbreitung ist die transiente Flora jedoch zunächst nicht gefährlich für den Organismus, weil das antimikrobielle Bollwerk der Haut – die „körpereigene Hygiene“ –, solange es intakt ist, eine Infektion verhindert.
In den obersten Schichten der Epidermis befindet sich ein komplexes Abwehrsystem des Körpers. Neben dem physiologischen pH-Wert und den Hautoberflächenlipiden besteht dieses zunächst aus einer von Keratinozyten und interzellulären Lipiden gebildeten hocheffektiven Wasserpermeabilitätsbarriere (Proksch et al. 2008, Jensen und Proksch 2009), die auf physikalischer und chemischer Basis die Invasion von Mikroorganismen verhindert (Boguniewicz und Leung 2010). Durch die regelmäßige Abschilferung der oberflächlichen Squamae wird eine ständige Erneuerung dieser Barriere sichergestellt. Auf chemischer Basis wird die Haut (und die Schleimhäute) bereits an der Oberfläche durch antimikrobielle Substanzen geschützt, z. B. durch sekretorisches IgA und Lysozym auf den Schleimhäuten oder Sphingosin, Dermcidin und antimikrobielle Proteine auf der Haut (Schittek et al. 2008). Es konnte in den letzten Jahren gezeigt werden, dass die Keratinozyten essenziell für die unspezifische Abwehr sind. In die Haut eingedrungene pathogenassoziierte molekulare Muster (pathogen-associated molecular patterns, PAMPs) binden an Toll-like-Rezeptoren der Keratinozyten. Dadurch wird das evolutionär sehr alte angeborene Abwehrsystem aktiviert, das direkt über die Produktion verschiedener antimikrobiell wirksamer Substanzen (z. B. Defensine) einen Beitrag zur Abwehr der Infektion leistet. Zum anderen produzieren derart aktivierte Keratinozyten einen Zytokincocktail (u. a. IL-1, IL-6, IL-8 und TNFα), der das „antigenspezifische erworbene Immunsystem“ (antigen-specific acquired immunity) einleitet und moduliert (Schröder 2010, Kalali et al. 2010).
Infektionsflora
Unter der Haut:InfektionsfloraInfektionsflora wird das Vorkommen von Krankheitserregern in episomatischen Biotopen verstanden, die ihr Habitat in bestehenden klinisch manifesten Infektionen des Wirtsorganismus (z. B. Abszess, Panaritium, Paronychie, infiziertes Ekzem, eitriger Schnupfen, Angina) haben.Haut:mikrobielle Besiedlung\"\r\"Hautbesiedlung
5.20.2. Hygieneaspekte dermatologischer Erkrankungen
Neben den Besonderheiten spezifisch dermatologischer Infektionserkrankungen gilt es, die besondere Situation dermatologischer Stationen zu berücksichtigen. Hier liegt häufig ein gemischtes Patientengut vor: Erkrankung(en):Haut\t\"Siehe DermatosenPatienten mit konservativen entzündlichen, aber nicht infektiösen (wohl aber Haut:Erkrankungen\t\"Siehe Dermatosenkontaminierten) Hautaffektionen wie Psoriatiker, Patienten nach OP (septisch wie aseptisch) und Patienten mit dermatologischen Infektionserkrankungen. Bei mangelnder Hygiene ist die Gefahr einer Erregerverschleppung mit nachfolgender NI aufgrund der häufig hohen mikrobiellen Belastung dermatologischer infektiöser Erkrankungen mit offen daliegenden Erregern hoch. Zum Schutz der Weiterverbreitung sind daher suffiziente Hygienemaßnahmen von höchster Relevanz. Wichtige Hygieneaspekte dermatologischer Erkrankungen Tabelle 5.34 .
Der potenzelle Kontamination von Externa (insbesondere in von mehreren Patienten verwendeten Kruken) muss wegen des Risikos der raschen Erregervermehrung durch geeignete Maßnahmen (eigene Externagebinde für jeden Patienten, Aufbewahrung außerhalb der Patientenzimmer, Entnahme nur mit Einmalartikeln z. B. Holzspatel) entgegengewirkt werden.
Tab. 5.34.
Infektionsprophylaxe bei relevanten dermatologischen Erkrankungen mit Patientenkontakt.Zoster:InfektionsprophylaxeVarizellen:InfektionsprophylaxeStreptokokkenpyodermie, InfektionsprophylaxeStaphylokokkenpyodermie, InfektionsprophylaxeSkabies:InfektionsprophylaxePediculosis capitis, InfektionsprophylaxeParvovirus-B19-Infektion(en):InfektionsprophylaxeMRSA-Kolonisation:Haut, InfektionsprophylaxeMRSA-Infektion(en):Haut, InfektionsprophylaxeMolluscum-contagiosum-Virus, Infektion(en):ProphylaxeLymphogranuloma inguinale, InfektionsprophylaxeImpetigo contagiosa:InfektionsprophylaxeGonorrhö, InfektionsprophylaxeErysipeloid, InfektionsprophylaxeDermatosen:InfektionsprophylaxeDermatomykose(n), Infektionsprophylaxe
| Erkrankung | Einzel-/Kohortenpflege | Mund-Nasen-Schutz | Schutzhandschuhe | Schutzkittel X oder -schürze (X) | Schlussdesinfektion | Meldepflicht |
|---|---|---|---|---|---|---|
| Dermatomykosen, Erysipeloid, Erythema infectiosum, Gonorrhö, Lymphogranuloma inguinale | – | – | (X) | (X) | – | – |
| HSV-Infektion | X7 | – | – | – | – | – |
| Impetigo contagiosa | X8 | X9 | X | (X) | – | X3 |
| Lues | – | – | – | – | – | X5 |
| MRSA-Kolonisation/-Infektion | x | X | X | X | X | X4 |
| Molluscum contagiosum | – | – | X | (X) | – | – |
| Pediculosis capitis | – | – | – | – | – | X1 |
| Skabies | x2 | – | – | – | – | X3 |
| Staphylokokkenpyodermie | X7 | (X) | X | (X) | – | – |
| Streptokokkenpyodermie | X7 | (X) | X | (X) | – | – |
| Varizellen | X | X | X | X | – | X1, 6 |
| Zoster10 | – | – | X | – | – | – |
keine ärztliche Meldepflicht, Meldepflicht der Erkrankung mit personenbezogenen Angaben für die Leitung von Ausbildungseinrichtungen
Wechsel der Leib- und Bettwäsche 1- bis 2-mal täglich
keine ärztliche Meldepflicht, Meldepflicht des Verdachts einer Erkrankung mit personenbezogenen Angaben für die Leitung von Ausbildungseinrichtungen
das gehäufte Auftreten von NI, bei denen ein epidemischer Zusammenhang wahrscheinlich ist oder vermutet wird, ist unverzüglich dem Gesundheitsamt als Ausbruch zu melden
Meldung einer akuten Infektion durch Laborleiter
das Auftreten von zwei oder mehr Erkrankungen, bei denen ein epidemiologischer Zusammenhang vermutet wird, ist meldepflichtig, sofern eine Gefahr für die Allgemeinheit besteht (bei Varizellen z. B. im Umfeld immungeschwächter Personen).
keine gemeinsame Unterbringung mit Patienten mit Immunschwäche, generalisiertem Ekzem, großflächigen Hautdefekten oder ausgedehnten Verbrennungen
bis 48 h nach wirksamer Therapie
bei Scharlach sowie großflächigen Haut- und Wundinfektionen
Nicht verkrustete Hautläsionen beim Zoster sind mit einem sterilen Verband vollständig abzudecken. Kein Kontakt zu Immunsupprimierten!
Pilzerkrankungen: Eine gewisse Besiedlung mit Pilzen ist beim Menschen normal. Das kann auch potenzielle Pathogene wie Candida spp. betreffen. Bei gesunden Menschen kann man im Genitalbereich und im Dermatosen:PilzeGastrointestinaltrakt regelmäßig Candida spp. nachweisen, ohnePilz(e):Dermatosen dass dem eine pathologische Bedeutung zukommt (Jarvis 1996). Selbst intertriginös können Candida spp. isoliert werden, ohne dass eine Infektion Candida:Hautvorliegt.
Die Übertragung von Candida spp. auf immunsupprimierte Immunsuppression:Candida Candida:ImmunsuppressionPatienten kann eine schwerwiegende generalisierte Infektion zur Folge haben, sodass neben Einhaltung der Standardhygiene identifizierte Carrier von Risikopatienten separiert und zumindest die Hautoberfläche behandelt werden sollte.
Die Tinea-Erkrankungen (oberflächliche Infektion der Haut mit Dermatophyten) spielen im Krankenhaus eine eher untergeordnete Rolle, jedoch kommen tiefe pustulöse Formen vor (tiefe Trichophytie), die sich gern als Mischinfektion präsentieren (Marcoux et al. 2009, Ameen Tinea2010). Regelmäßig kommt die Fragestellung der Relevanz einer Pilzinfektion im geplanten OP-Gebiet auf. Bei oberflächlicher Tinea ohne klinisch apparente bakterielle Superinfektion reichen normale peri- und Trichophytieintraoperative Hygienemaßnahmen aus, da eine systemische Infektion durch Dermatophyten nicht befürchtet werden muss. Sollte jedoch eine ekzematöse Reaktion vorliegen, kann eine Superinfektion mit Bakterien angenommen werden, die präoperativ eine topische und ggf. auch systemische antimikrobielle Therapie initiieren muss.
Virale Erkrankungen: Bei Patienten mit massiv gestörter Hautbarriere vermögen Viren lebensgefährliche Superinfektionen zu verursachen, z. B. das Eczema herpeticatum bei Patienten mit atopischem Ekzem, aber auch Viren:Dermatosendas (nicht gefährliche) Eczema molluscatum (Dermatosen:viraleBoguniewicz und Leung 2010).
Die Distanzierung von Personen mit floriden dermatologisch relevanten Viruserkrankungen von Risikopatienten mit gestörter kutaner Barriere ist ebenso notwendig wie die gewissenhafte Händehygiene.
Bakterielle Erkrankungen: Viele Eczema herpeticatumDermatosen sind bakteriell superinfiziert. Das Spektrum reicht von einer klinisch Eczema molluscatumirrelevanten Besiedelung (z. B. bei Psoriatikern) über die massiv besiedelte, aber für den Patienten meist ungefährliche Bakterien:DermatosenSuperinfektion von chronischen Ulzera bis zu hochinfektiösen Impetigoerkrankungen oder Dermatosen:bakteriellesuperinfizierten Ekzemen (Plettenberg und Meigel 2004). Gerade schwere Ekzemerkrankungen (wie bei atopischer Dermatitis) neigen aufgrund ihrer Barriereschädigung schnell zu einer massiven Superinfektion, sodass von ihnen die Gefahr einer Weiterverbreitung ausgeht (Baker 2006, Boguniewicz und Leung 2010). Vor und nach jedem Patientenkontakt ist eine Händedesinfektion erforderlich (Kap. 2.1). Bei Ekzempatienten ist die Händedesinfektion besonders sorgfältig durchzuführen (Benetzungslücken vermeiden).
Bei Infektionen mit Erregern, die sich nicht auf der Körperoberfläche befinden bzw. nur über Blut oder Körperflüssigkeiten übertragen werden, bedarf es keiner verschärften Hygienemaßnahmen. Leider findet sich aus Unkenntnis bei Syphilispatienten gelegentlich ein „Betreten des Patientenzimmers nur nach Rücksprache mit dem Pflegepersonal“.
5.20.3. Dermatologische Aspekte der Händehygiene
Waschen der Hände
Die Händehygiene ist ein Kernelement zur Infektionsprävention und Erkrankung(en):dermatologische\"\r\"Erkrankugnenderamtolgverdient besondere Beachtung (Boyce und Pittet 2002). Gemeinhin verbindet man mit dem Säubern der Hände das Händewaschen. Die transiente Flora lässt sich durch das Waschen lediglich um ca. 2–3 log10-Stufen reduzieren. Das gilt auch für Hände:WaschenBakteriensporen (Weber et al. 2003). Die Wirksamkeit antimikrobieller Seifen ist bei der oft kurzen Waschdauer kaum besser als die einfacher Seifen (Weber et al. 2003), sodass im klinischen Alltag die Anwendung einfacher Seifen zur Händewaschung ausreichend ist. Die residente Flora lässt sich selbst durch minutenlanges Waschen kaum reduzieren, sodass die Händewaschung im Krankenhaus eine Ausnahme sein sollte. Ihr Sinn liegt nur in der Entfernung sichtbarer Verschmutzung, aber nicht oder nur zu einem deutlich geringeren Teil in einer Reduktion der mikrobiellen Besiedlung der Haut.
Die Indikationen zur Händewaschung sind deutlich seltener als im Allgemeinen angenommen: Vor Arbeitsbeginn, nach Arbeitsende sowie nach Toilettenbesuch ist die Händewaschung sinnvoll. In allen anderen klinischen Situationen, in denen eine Maßnahme zur Händehygiene erforderlich ist, ist wegen besserer Wirksamkeit und Hautverträglichkeit die hygienische Händedesinfektion durchzuführen (Kampf und Kramer 2004).
Häufiges Händewaschen kann zu trockener Haut sowie zur Schädigung der Hautbarrierefunktion führen. Das hat zur Folge, dass kontinuierlich Fette sowie wasserbindende Faktoren der Haut verloren gehen und umgekehrt Schadstoffe leichter durch die Epidermis eindringen können. Nach der häufig sichtbaren trockenen Haut kann sich langsam ein klinisch manifestes irritatives Handekzem ausbilden (Löffler et al. 2000, Kramer et al. 2003).
Da die Risiko-Nutzen-Bewertung sehr zuungunsten der Händewaschung ausfällt, ist diese lediglich bei einer Kontamination mit bakteriellen Sporenbildnern wie C. difficile als zweiter Schritt nach der Händedesinfektion sinnvoll. Dies liegt daran, dass Bakteriensporen gegenüber Alkohol eine natürliche Resistenz aufweisen und in Gegenwart von Alkoholen sporulieren.
Hygienische Händedesinfektion
Im Gegensatz zur Händewaschung werden durch alkoholische Händedesinfektionsmittel innerhalb der deklarierten Einwirkungszeit Bakterien, Hefepilze wie Candida spp. oder Rhodotorula spp. sowie behüllte Viren praktisch vollständig abgetötet (Kampf und Hollingsworth 2004, Händedesinfektion:hygienische Kap. 2.1).
Entgegen seinem Ruf ist das irritative Potenzial alkoholischer Händedesinfektionsmitteln sehr gering.
Händedesinfektionsmittel weisen i. d. R. eine deutlich bessere Verträglichkeit auf als die Händewaschung mit waschaktiven Substanzen (Löffler et al. 2007). Selbst bei intensiver, häufiger Händedesinfektion werden die Hautbarriere nur minimal beeinträchtigt und die Hautfeuchtigkeit nur geringfügig reduziert (Kramer et al. 2002). Das liegt auch am Zusatz von Hautpflegestoffen, die üblicherweise in Händedesinfektionsmitteln vorhanden sind. Kontaktekzeme aufgrund von Allergien gegenüber Inhaltsstoffen aus Händedesinfektionsmitteln sind extrem selten (Kampf und Kramer 2004).
Handekzeme durch Hygienemaßnahmen
Hygienemaßnahmen zählen zu den Risikofaktoren für beruflich verursachte Handekzeme mit der Folge, dass die Krankenpflege und verwandte Gebiete unter die Risikoberufe für den Erwerb von Berufsdermatosen fallen (Stingeni et al. 1995). Ein Großteil der Pflegekräfte hält traditionell raue und schuppige Hände für normal in ihrem Beruf und realisiert nicht, dass sie ein erstes Zeichen eines beginnenden Handekzems sein können (Abb. 5.5 ). In einer Fragebogenstudie der Deutschen Kontaktallergiegruppe (DKG) wurde herausgefunden, dass über 70 % der Pflegekräfte von irritativen Hautveränderungen innerhalb eines Jahres berichten, 46 % empfanden diese als beeinträchtigend für ihren Alltag (Stutz et al. 2008).
Abb. 5.5.
Das interdigitale Ekzem(e), interdigitalesEkzem als klinische Erstmanifestation einer irritativen Schädigung durch Feuchtarbeit und (falsche) Händehygiene.
Die meisten Pflegekräfte halten die alkoholische Händedesinfektion noch immer für schädlicher für ihre Haut als die Händewaschung (Stutz et al. 2008). Alkoholische Präparate sind jedoch im Vergleich zur Händewaschung erheblich hautschonender, da sie die kutane Barriere (gemessen am transepidermalen Wasserverlust) sowie die kutane Feuchtigkeit (gemessen durch Corneometrie) weniger beeinträchtigen (Löffler et al. 2007). Interessanterweise kann die Applikation von Alkoholen nach einer Händewaschung sogar die Irritation durch die Waschung mit Detergenzien vermindern, was an der zusätzlichen Entfernung von auf der Haut verbliebenen Detergenzienmonomeren liegen dürfte. Dennoch vermuten viele Anwender, dass Händedesinfektionsmittel ihre Haut schädigen. Das liegt häufig an den brennenden Sensationen, die Alkohole auf vorgeschädigter Haut verursachen, da sie die Schmerzrezeptoren der Haut reizen. Reflektorisch wird hier gern die alkoholische Händedesinfektion für die Hautprobleme verantwortlich gemacht („es brennt ja nur beim Alkohol“) und die Desinfektion wird zugunsten der Waschung vernachlässigt. Diese brennt dann zwar nicht mehr auf der Haut, führt jedoch zu einer beschleunigten Hautschädigung. Es beginnt ein Circulus vitiosus, an dessen Ende ein manifestes Handekzem (Abb. 5.6 ) sowie im schlimmsten Fall die Berufsunfähigkeit stehen kann (Lübbe et al. 2000, Löffler et al. 2007).
Das Brennen beim Händedesinfizieren Händedesinfektion:Brennen der Hautstellt ein wichtiges Warnsignal für eine gestörte Hautbarriere dar. In der Konsequenz müssen hautschädigende Tätigkeiten (Waschen, Arbeiten unter Okklusion, Kontakt mit Seifen, direkter Hautkontakt mit reizenden Flächendesinfektionsmitteln) gemieden und die Applikation von Hautschutz- und Hautpflegepräparate intensiviert werden.
Abb. 5.6.

Ein beruflich verursachtes irritatives Handekzem durch Feuchtarbeit bei gleichzeitiger Vernachlässigung des Hautschutzes und der Hautpflege.
Von manchen Anwendern wird alkoholischen Händedesinfektionsmitteln eine sensibilisierende Wirkung zugeschrieben. Bei 50 Mitarbeitern, die aufgrund des Verdachts einer Unverträglichkeit gegen ein alkoholisches Händedesinfektionsmittel allergologisch getestet wurden, konnte eine Sensibilisierung gegen einen Alkohol ausgeschlossen werden. Allerdings wurde eine Überempfindlichkeit gegenüber dem Hilfsstoff Cetearyloctanoat nachgewiesen (Stutz et al. 2008).
Die Aufrechterhaltung einer suffizienten Hautbarriere ist nicht nur für den kosmetischen und funktionellen Aspekt von Relevanz. Ekzematöse Hände weisen auch eine stärkere Besiedlung mit Pathogenen auf als gesunde Hände und sind damit ein Risikofaktor für NI (Dave et al. 1994, Larson 1999, Wang et al. 2001).
Die Vermittlung dieser Erkenntnisse ist eine wichtige Aufgabe in der Ausbildung aller Mitarbeiter im Gesundheitsdienst und sollte in einem Ausbildungscurriculum enthalten sein (Löffler et al. 2006).
Hygiene und Hautpflege sowie Hautschutz
Der richtige Umgang mit potenziell irritativen Substanzen im Gesundheitsdienst kann Hautschäden vermeiden. Zudem sind für die Aufrechterhaltung einer guten Hautbarriere der Hautschutz sowie eine suffiziente Hautpflege eminent wichtig.
Hautpflege und Hautschutz sind Händehygiene:Handekzeme\"\r\"Haendehygekzemein den Arbeitsalltag zu integrieren und könnenHandekzem(e):Händehygiene\"\r\"Haendehygekzeme (richtig durchgeführt) die Hände schützen, ohne Desinfektionsmaßnahmen zu beeinträchtigen. Dazu sollten Hautschutzpläne erarbeitet werden, die über die zur Verfügung Hautpflegestehenden Produkte und deren Anwendung informieren (TRGS 401). Für die Hautschutzverwendeten Präparate sollten ein Wirksamkeitsnachweis sowie Informationen über die Anwendungsgebiete vorliegen (siehe Leitlinie der AG für Berufs- und Umweltdermatologie [ABD] „Berufliche Hautmittel“; Fartasch et al. 2008). Hautschutzpräparate sollten vor Arbeitsbeginn und nach jeder längeren Arbeitspause aufgetragen werden, wodurch die Austrocknung und Barriereschädigung der Haut durch Feuchtarbeit verringert werden soll. Nach der Arbeit sollen Hautpflegecremes helfen, die Regeneration der Haut zu beschleunigen. Da manche Hautpflegecremes durch deren Inhaltsstoffe eine Penetration von Irritanzien unterstützen können, sollten diese Pflegecremes vorzugsweise nach der Arbeit aufgetragen werden (Fartasch et al. 2008).
Bei einer klinisch manifesten Irritation der Haut müssen die Mitarbeiter einem Dermatologen oder Arbeitsmediziner vorgestellt werden, damit dieser ggf. ein Hautarztverfahren mit Meldung an den Unfallversicherungsträger einleiten kann (Skudlik et al. 2008).Händehygiene:dermatologische Aspekte\"\r\"Harnblasenkathtransurethral
5.20.4. Antiseptische Indikationen
Eine Vielzahl von Dermatosen weist eine veränderte Hautflora mit erhöhter Infektionsanfälligkeit der Haut auf. So können S. aureus und Malassezia spp. beim atopischen Ekzem als Trigger an der Entzündung beteiligt sein (Bielnska-Warezak und Nowicki 2005, Takahata et al. 2007a, Roll et al. 2004). Auch die Psoriasis ist mit einer Staphylococcus aureus:DermatosenDysbiose assoziiert (Solntseva et al. 2000, Takahata et al. 2007b). Malassezia, DermatosenInwieweit eine Beeinflussung der Erkrankungsschwere bei Dermatosen mit veränderter Hautflora durch präventive Antiseptik möglich ist, ist Gegenstand aktueller Untersuchungen. Durch mit Silber ausgerüstete Textilien konnte die Erkrankungsschwere bei atopischer Dermatitis reduziert werden (Gauger et al. 2003, Jünger et al. 2006, Kramer et al. 2006). Tierexperimentell konnte bei Mäusen mit genetisch bedingter hoher Rate ekzematöser Läsionen ähnlich der Situation bei atopischer Dermatitis durch chlorhexidinhaltige Salben eine Dermatitis, atopische, Antiseptiksignifikante Sanierung S.-aureus-kolonisierter Ekzeme nachgewiesen werden (Kondo et al. 2006).
Der therapeutische Einsatz von Antiseptika ist indiziert bei mikrobiellen und viralen Dermatitiden, sofern es sich um eine lokalisierte Manifestation handelt, die der externen antiseptischen Therapie zugängig ist.
Typische Erkrankungen sind Dermatomykosen, Pyodermien, leichte Formen der Staphylokokkenimpetigo, leichte bis mittelschwere Formen der Acne papulopustulosa, Follikulitis, Erythrasma und Herpes labialis. In einer prospektiven Studie erwies sich die Behandlung mit Octenidin bei mild bis moderat verlaufender Akne als Alternative zur Antibiotikaanwendung (Mayr-Kanhauser et al. 2008). Auch Nagelinfektionen durch Pseudomonas spp. wurden mit octenidinbasierter Lösung erfolgreich therapiert (Rigopoulos et al. 2009).
Die Grundlagen für die Anwendung von Antiseptika bei infizierten Wunden sind in einer Expertenempfehlung zusammengefasst (Dissemond et al. 2009). Bei chronischen Ulcera cruris hat die antiseptische Begleittherapie mit polihexanidgetränkten Auflagen maßgeblich zum Therapieerfolg beigetragen. Voraussetzung für die antiseptische Therapie ist deren Integration in einen überwachten klinischen Behandlungspfad (Roth und Kramer 2009). Auch bei neoplastischen Ulzera bestätigte sich die antiseptische Effektivität von Octenidin (Sopata et al. 2008).
Bei bestimmten Infektionen kann nach chirurgischer Intervention (z. B. Furunkel, Bulla repens, Molluscum contagiosum) durch nachfolgende Antiseptik die Heilung unterstützt werden. Antiseptika sind nicht indiziert bei Infektionen des oberen und tieferen Koriums (Furunkel/Karbunkel, Erysipel, Phlegmone, Abszesse, Hidradenitis) sowie bei Infektionen durch Mykobakterien, Borrelien oder Bartonellen (Höger 1998).
5.20.5. Peri- und postoperative Antibiotikaprophylaxe bei Laser Skin Resurfacing (LSR)
Durch Dermatosen:Antiseptik\"\r\"AntiseptikHautLSR entsteht quasi Antiseptik:Dermatosen\"\r\"AntiseptikHauteine oberflächliche Verbrennung 2. Grades mit Infektionsgefährdung durch Bakterien, Pilze und HSV-1-Reaktivierung. Präoperativ empfiehlt sich die Identifikation Laser Skin Resurfacingnasaler Träger von S. aureus bzw. von MRSA, um bei Kolonisierung zunächst die Antibiotikaprophylaxe:Laser Skin Resurfacingantiseptische Sanierung vorzunehmen. Mittel der Wahl ist Octenidin 0,05 % (Hübner et al. 2009).
Die Auffassungen zur perioperativen Antibiotikaprophylaxe sind aufgrund der Studienlage (Fehlen einer RCT) nicht einheitlich (Tanzi und Bader 2009). Gaspar et al. (2001) schlussfolgern, dass eine Antibiotikaprophylaxe gegen S. aureus nützlich, aber nicht essenziell ist, weil sorgfältige Wundversorgung und tägliches Patientenmonitoring mit bakteriologischem Abstrich die frühe Infektion detektieren. Bei Ganzgesicht- und Regional-LSR empfehlen Ross et al. (1998) die perioperative Antibiotikaprophylaxe mit Schmalspektrumantibiotika mit Wirkungsspektrum gegen grampositive Bakterien. Conn und Nanda (2000) empfehlen Fluconazol von Tag 3–8 postoperativ und zusätzlich prä- und postoperativ Aciclovir bzw. Valaciclovir (Beeson und Rachel 2002). In jedem Fall ist die sorgfältige postoperative Überwachung auf erste Anzeichen einer Infektion unerlässlich. Im Gegensatz dazu kommen Gilbert et al. (2007) zu der Schlussfolgerung, dass gegenwärtig noch keine definitive Empfehlung zur antiviralen Prophylaxe der HIV-Reaktivierung bei minimalinvasiven Eingriffen gegeben werden kann. Im Fall erster Anzeichen einer SSI sind polihexanidbasierte Antiseptika bzw. Wundauflagen als Mittel der Wahl anzusehen (Hübner und Kramer 2010).
5.21. Rehabilitationseinrichtungen
Georg Daeschlein, Axel Kramer, Reiner Caspari und Peter Rudolph
Ziel der rehabilitativen Medizin ist die Wiederherstellung körperlicher, psychischer und geistiger Leistungsfähigkeit der Rehabilitanden, um die Wiedereingliederung in das Berufsleben und die Rückkehr in den sozialen Alltag so weit wie möglich sicherzustellen. Rehabilitationen werden meist bei Menschen mit Medizin:rehabilitativechronischen Erkrankungen bzw. im Anschluss und zur Bewältigung schwerer akuter Krankheiten wie z. B. Krebs, Herzinfarkt und Unfällen durchgeführt. Rehabilitationsleistungen können aber auch bereits im Vorfeld, d. h. bei drohender Gefährdung der Gesundheit, erbracht werden, um das Auftreten gesundheitlicher Probleme und daraus resultierender Einschränkungen bei der Teilnahme am beruflichen und sozialen Leben zu verhindern. Auf der anderen Seite erfolgt ein kontinuierlich zunehmender Anteil der Rehabilitationsleistungen als sog. Anschlussrehabilitation (AHB) im unmittelbaren Anschluss an eine akutmedizinische Behandlung. Der Zeitabstand zwischen Abschluss der Akutbehandlung und Beginn der Rehabilitation soll dabei 14 Tage nicht überschreiten. Zunehmend erfolgen aber insbesondere nach ausgedehnten operativen Therapien auch Direktverlegungen vom Akutkrankenhaus in die Rehabilitationsklinik. Die Risiken einer Infektion mit MRE zwischen diesen verschiedenen Patientengruppen unterscheiden sich verständlicherweise erheblich, was zu einer differenzierten Betrachtung des Hygienemanagements in unterschiedlichen Rehabilitationseinrichtungen führen muss.
Eine besondere Problemstellung besteht bei der neurologischen Frührehabilitation (sog. Phase B). Die möglichst sofortige Übernahme von Patienten in die Rehabilitation mit Beginn der therapeutischen Maßnahmen ist hier wesentliche Voraussetzung für den Therapieerfolg. Das bedeutet, dass die Patienten unmittelbar nach klinischer Stabilisierung und Frührehabilitation, neurologischeWegfall einer Beatmungspflichtigkeit vom Reha-Team übernommen werden. Diese Schnittstelle der integrativen Versorgung überlässt der Rehabilitationsmedizin die unmittelbar postintensivmedizinische Versorgung mit allen Konsequenzen der Infektionsgefährdung und potenziellen Erregerverbreitung. Die Besonderheit der Schnittstelle Frührehabilitation – Akutmedizin hat dazu geführt, dass einige Reha-Kliniken selbst mit einer Intensivtherapieeinheit ausgestattet sind, andererseits Akutkliniken ihre Intensivstation teils als Frührehabilitation auslegen. Eine räumliche und personelle Trennung von Intensivstation und Rehabilitation ist dann wegen der möglichst früh zu beginnenden Rehabilitation oft nicht sinnvoll. Eine derartige Zusammenführung ist aber bisher in der Praxis z. B. aus baulichen Gründen oft nicht umsetzbar. Als Folge zeigt sich in den letzten Jahren der nicht nur krankenhaushygienisch wenig vorteilhafte Trend, dass Reha-Kliniken zunehmend intensivmedizinische Aufgaben übernehmen müssen, für die sie i. d. R. weder personell noch materiell noch baulich vorbereitet sind.
5.21.1. Bauliche Besonderheiten
Von Krankenhäusern der Akutversorgung unterscheiden sich Reha-Kliniken in baulicher Hinsicht in einigen wesentlichen Punkten. Als Besonderheit der neurologischen Frührehabilitation besteht ein besonders hoher Platzbedarf in den Patientenzimmern, bedingt durch Transport- und Lagerungshilfen (Lifter, Rollstuhl, Stehbrett) sowie durch die personalintensive Therapie (besonders Physiotherapie) und den Besucherverkehr.
Die Bundesarbeitsgemeinschaft medizinisch-beruflicher Rehabilitationszentren empfiehlt daher eine Mindestgröße von 20 m2 für Einbett- und 30 m2 für Zweibettzimmer.
In den Therapieräumen einer Reha-Klinik finden therapeutische Maßnahmen i. d. R. in Gruppen statt, was Raum erfordert und besondere Risiken der Erregerverbreitung mit sich bringt. Zum Rehabilitationskonzept gehört weiter die besondere Ausstattung der Patientenzimmer und Therapieräume. Hierbei wird das Ambiente anders als in der Akutklinik dem häuslichen Milieu angepasst. Es finden sich häufig Vorhänge vor den Fenstern – was hygienisch kein Risiko darstellt (Daeschlein et al. 2004) – und durch Auswahl des Mobiliars und Raumgestaltung soll das rein funktionale Ambiente z. B. einer Intensiveinheit möglichst vermieden werden. Vielerorts werden Holzoberflächen als desinfizierbares Imitat eingesetzt. Meist werden lediglich Überwachungs- und Isolierungszimmer von diesen Maßnahmen ausgenommen. Diese therapeutisch begründeten Abweichungen von der in Krankenhäusern üblichen Raumplanung und -ausstattung stellen eine Herausforderung für die Hygieneüberwachung dar. Hier finden Isolierungsmaßnahmen häufig ihre baulich und therapeutisch bedingten Einschränkungen.
5.21.2. Personelle Voraussetzungen, Berufskleidung und Organisation der Patientenbetreuung
Das Rehabilitationskonzept basiert wesentlich auf multidisziplinärer Zusammenarbeit. Krankenhaushygienisch wichtig ist, dass die verschiedenen Teams oft parallel und in großen gemeinsam genutzten Räumen mit den Patienten trainieren, wodurch sich mannigfaltige und aus der Nicht-Reha-Medizin unbekannte Verbreitungsmöglichkeiten für Problemerreger ergeben. Anders als im Akutkrankenhaus, wo die Besucher eher eine passive Rolle wahrnehmen, werden diese in der Reha-Medizin so weit wie möglich in therapeutische und betreuende Abläufe einbezogen, wodurch sich therapeutische Vorteile ergeben. Hierdurch modifiziert sich die Risikoeinschätzung der potenziellen Erregereinträge und -verbreitung. Das gilt nicht nur wegen der therapeutischen Mitarbeit der Angehörigen, sondern auch wegen der bewusst zivil gehaltenen Kleiderordnung auf den Stationen.
Die Gewährleistung des Personalbedarfs in der neurologischen Rehabilitation und insbesondere in der Frührehabilitation (http://www.dgpmr.de/PhysMed+Rehab/Rehabilitation/Fruehrehan.pdf) ist eine wichtige Voraussetzung für die Realisierung der Präventionsmaßnahmen.
Der enge und vergleichsweise lange Patientenkontakt der Physiotherapeuten ist ein Frührehabilitation, neurologische:personelle Voraussetzungenspezieller Risikofaktor für die Erregerverbreitung. Dem kann folgendermaßen begegnet werden:
-
•
Reihenfolge der Patientenbehandlung präventiv festlegen,
-
•
enge Anbindung an das Hygieneteam mit schneller Information bei infektiösen Patienten,
-
•
eng anliegende Arbeitskleidung mit Bedeckung freier Körperpartien, Schutzkleidung mit Bein- und Armschluss, Haarschutz, Schutzhandschuhe bei verbreitungsrelevanten Erregern,
-
•
hygienische Händedesinfektion vor und nach jedem Patienten sowie nach Kontamination.
Jede Reha-Klinik sollte eine HFK – ggf. in Teilzeit – beschäftigen. Mindestens ein Arzt sollte zum Hygienebeauftragten weitergebildet werden. Ihm obliegt das Infektionsmanagement.
5.21.3. Risikofaktoren für die Verbreitung von Problemerregern
Je mehr Organsysteme eines Patienten betroffen sind, desto höher ist das Risiko nosokomialer Kolonisation und Infektion.
Neurologische Reha-Hygienefachkraft:RehabilitationseinrichtugenPatienten der Phasen B (neurologische Frühreha) und C (Rehabilitation im Anschluss an Phase B) sind besonders gefährdet, da neben den übrigen Dysfunktionen eine Schädigung des ZNS nicht nur motorisch, sondern auch reflektorisch und immunologisch zur Rehabilitationspatienten, neurologische, InfektionsgefährdungHerabsetzung der Infektionsabwehr führt. Die Infektionsgefährdung ergibt sich durch das i. A. gleichzeitige Vorliegen weiterer Risikofaktoren wie Devices, Durchblutungsstörungen und chronischer Wunden (meist und nicht selten mehrere Dekubitalulzera).
Wirbelsäulenverletzungen sind aufgrund der herabgesetzten Aktivität, der häufigeren Harninkontinenz und chronischer respiratorischer Erkrankungen ein unabhängiger Risikofaktor, sodass die NI-Prävalenzrate mit 21,8 % signifikant höher war als bei Rehabilitationspatienten der gleichen Kliniken ohne diesen Risikofaktor (4,3 %). Das Vorliegen eines Harnblasenkatheters konnte als zusätzlicher unabhängiger Risikofaktor identifiziert werden (Girard et al. 2006).
Fast alle Patienten der neurologischen Frührehabilitation haben zuvor in intensivmedizinischen Einheiten (ITS) eine antibiotische Prophylaxe bzw. bei Vorliegen einer Infektion eine mehr oder weniger gezielte antibiotische Therapie erhalten. Hier liegt eine der Ursachen für die häufige Einschleppung von Frührehabilitation, neurologische:InfektionsgefährdungMRE in die Reha-Klinik (Santus et al. 2005). Hinzu kommt, dass, wenn überhaupt Antibiotika-Richtlinien vorliegen, diese sich häufig zwischen Frührehabilitation und ITS unterscheiden, wodurch es zu Selektionen von MRE kommen kann. Hieraus ist zu folgern, dass jede Reha-Einrichtung über ständig zu aktualisierende Antibiotika-Richtlinien verfügen sollte und diese Empfehlungen mit den vor- und nachgeschalteten Einrichtungen abgestimmt werden sollten.
Durch fehlende oder unvollständige Übermittlung wichtiger Infektionsdaten (Erregerart, Besiedlungsstatus, Resistenzmuster, Therapie, Vorbehandlung, Hygienemaßnahmen) des Patienten bei Aufnahme und Verlegung kommt es immer wieder zu vermeidbarer „stiller“ Einschleppung von Problemerregern in die Reha-Klinik.
Weitere Risikofaktoren für nosokomiale Kolonisation/Infektion stellen wie in Akutkrankenhäusern die Erregerquellen in den Reha-Abteilungen selbst dar. Das Besondere hinsichtlich des Infektionsrisikos im Vergleich zu anderen Krankenhäusern ist die Stellung zwischen der Primärversorgung (Akutmedizin) und den verschiedenen, sich an die Rehabilitation anschließenden therapeutischen Einrichtungen (z. B. Pflegeheime). Patienten werden aus Reha-Kliniken bei diagnostischen und therapeutischen Interventionen gelegentlich in die verschiedenen akutmedizinischen Abteilungen zurückverlegt. So kann ein Pool z. B. von MRE mit ständigem Nachschub in Richtung Reha-Abteilung und Akutstation mit perpetuiertem Selektionsdruck (Ping-Pong-Effekt) entstehen. Stammt der Input aus Akutabteilungen mit besonders hoher Kolonisationsfrequenz, z. B. aus einer neurochirurgischen Abteilung, kann sich die Rehabilitation zu einer Erregerdrehscheibe für die vor- und nachgeschalteten medizinischen Einrichtungen entwickeln.
Besonders in der neurologischen Frührehabilitation imponiert qualitativ und quantitativ eine im Abteilungsvergleich hohe Kolonisierungsrate bei den Patienten.
Bei eigenen Untersuchungen waren bis zu 90 % der Patienten mit mindestens einem Erreger besiedelt. Zu den häufigsten Erregern gehören P. aeruginosa, K. pneumoniae, E. coli, S. marcescens, P. mirabilis, S. epidermidis, Enterococcus spp. und S. aureus einschließlich MRSA. Pilze spielen eine untergeordnete Rolle. Häufig werden zwei oder mehrere Spezies gleichzeitig nachgewiesen. Bezüglich eines typischen Kolonisationsmuster Tabelle 5.35 .
Tab. 5.35.
Typische Kolonisation in der neurologischen Frührehabilitation.Frührehabilitation, neurologische:Kolonisation
| Lokalisation | Menge | Spezies |
|---|---|---|
| Rachenabstrich | +++ | P. aeruginosa, K. pneumoniaeE. coli |
| Trachealkanüle | ++++++ | P. aeruginosaS. epidermidisS. aureus |
| PEG | ++ | P. aeruginosa, S. aureus |
| Urin/Urethra | ++++++ | P. aeruginosaKlebsiella (K.) pneumonie, K. oxytocaE. coli, P. mirabilis, diverse Enterokokken |
| Dekubitalulkus | ++ | E. coli, P. aeruginosa, K. pneumoniae, S. aureus, Enterokokken |
+++: massenhaft, ++: reichlich, +: mäßig
MRE werden häufig bereits bei Aufnahme mit übernommen, im Therapieverlauf in der Reha-Abteilung akquiriert oder entwickeln sich unter Antibiose.
Besondere Bedeutung kommt bei Reha-Patienten insbesondere auf Frührehabilitationsstationen dem Nachweis von P. aeruginosa als Kolonisations- oder Infektionserreger zu, ohne dass immer typische Verbreitungsquellen wie Feuchträume, kontaminierte Waschbecken, Siphons u. Ä. als Ursache verantwortlich zu machen sind. Vielmehr scheinen patientenbezogene Faktoren bereits im Pseudomonas aeruginosa:RehabilitationseinrichtungenVorfeld der Akutversorgung eine Rolle zu spielen.
Insgesamt sind im Frührehabilitationsbereich erheblich mehr Patienten kolonisiert als infiziert.
Das gilt auch für MRE. Wir fanden P. aeruginosa in Reha-Kliniken mit einer Kolonisationsfrequenz von 55 %, wobei jede zweite Kolonisation in eine nosokomiale Pseudomonasinfektion überging. Davon waren 48 % respiratorische Infektionen, 25 % HWI und 11 % Sepsisfälle. Während die Kolonisationsfrequenz je nach Abteilung zwischen 30 und 90 % liegen kann, liegt die Häufigkeit von NI Pseudomonas aeruginosa:Rehabilitationseinrichtungenzwischen 5 und 13 Infektionen pro 1.000 Liegetage. Die häufigsten NI sind respiratorische Infektionen (meist Tracheobronchitis), gefolgt von Harnwegs- und Wundinfektionen (Dekubitalulzera). Seltener werden Sepsis, SIRS und Augeninfektionen diagnostiziert. In anderen Untersuchungen lagen die Harnwegsinfektionen vorn, gefolgt von Wundinfektionen, C.-difficile-Enteritis, Sepsis und respiratorischen Infektionen. Auch an Infektionen mit komplizierender Abszessbildung nach Implantation von Pumpen zur intrathekalen antispastischen Therapie sowie Shuntinfektionen ist im Frührehabilitationsbereich zu denken. Hier finden sich nicht selten MRSA-Reservoire, die zu länger unentdeckter Verbreitung führen.
Für den klinisch tätigen Kollegen stellen NI oft eine Herausforderung dar, weil die klassischen Diagnosekriterien einschließlich Labordiagnostik oft wenig hilfreich sind. Die Diagnose muss hauptsächlich über die klinische Verlaufsbeobachtung unter Berücksichtigung besonderer Kriterien wie Tachykardie und vermehrte Unruhe der Patienten erfolgen. Hierbei hat es sich bewährt, den klinischen Mikrobiologen und die HFK einzubeziehen.
Bei neurologisch schwerstgeschädigten Patient(en):neurologisch schwerstgeschädigte Infektion(en):Patient(en), neurologisch schwerstgeschädigtePatienten können
-
•
klassische Infektionszeichen unzuverlässig sein bzw. fehlen („zentral“ bedingtes Fieber),
-
•
infektiologische Laboruntersuchungen unspezifisch bzw. negativ ausfallen (fehlende Leukozytose, fehlender CRP-Anstieg),
-
•
schwere Infektionen oft nur anhand sekundärer Infektionszeichen diagnostiziert werden (Unruhe und Tachykardie).
Es wurden auch Ausbrüche in der neurologischen Frührehabilitation beschrieben, z. B. durch einen ESBL-K.-pneumoniae-Stamm. Es handelte sich um leichte bzw. symptomlose Verläufe (n = 10) mit Kolonisation von Nase, Trachea und in einem Fall des Darms (Holländer et al. 2001). Ein MRSA-Ausbruch in einem Reha-Zentrum konnte erst nach Implementierung strenger Standardhygiene, Mitarbeiterschulung und Infektionsüberwachung beherrscht werden (Curry et al. 1993). Zwischen dem Vorkommen von MRSA auf den Händen des Personals und der Bedside Compliance der Händedesinfektion war erwartungsgemäß eine strenge Korrelation nachweisbar (Girou et al. 2006).nosokomiale Infektion(en):Rehabilitationseinrichtungen\"\r\"RehabEinrProblemerr
5.21.4. Krankenhaushygienische Überwachung und Organisation
Hygienisches Ziel ist die rehabilitationsgerechte Infektionsprävention:rehabilitationsgerechteInfektionsprävention. Hierzu dienen insbesondere
-
•
der Aufbau einer internen Referenzstatistik im Rahmen der Surveillance,
-
•
das Monitoring von Problemerregern und deren Resistenz,
-
•
die Etablierung des Multibarrierensystems der Infektionsprophylaxe und dessen Festschreibung im Hygieneplan:RehabilitationseinrichtungenHygieneplan,
-
•
die Festlegung zusätzlicher Schutzmaßnahmen bei Auftreten von MRE,
-
•
die Betreuung durch kompetentes Hygienepersonal mit regelmäßiger Hygieneschulung für alle Mitarbeiter.
Häufiges Problem ist Rehabilitationseinrichtungen:Problemerreger\"\r\"RehabEinrProblemerrdie unzureichende Investitionsmöglichkeit der Häuser in die Krankenhaushygiene, soweit es die Problemerreger:Rehabilitationseinrichtugen\"\r\"RehabEinrProblemerrBestellung von Fachkompetenz und Schulungsangebote betrifft. Da budgetbedingt die Anstellung eines Krankenhaushygienikers auch in Teilzeit i. d. R. unrealistisch ist, kommt die zentrale Aufgabe der koordinierenden Kompetenz den HFK in Zusammenarbeit mit geschulten Ärzten und den Therapeuten des Teams zu. Derartige Schulungskonzepte werden bereits in einigen Bundesländern angeboten. Unabhängig davon muss die Forderung zur mindestens Teilzeitanstellung eines Krankenhaushygienikers aufrechterhalten werden.
Für folgende Tätigkeiten sind geeignete Organisationsformen zu entwickeln:
-
•
Dokumentation von nosokomialen Infektions- und Kolonisationsbefunden,
-
•
bei Direktverlegungen Hygieneepikrise für jeden Patienten seitens der einweisenden Klinik: Dokumentation von Infektionen, relevanter Kolonisation, antimikrobieller Chemotherapie (Art und Umfang) und krankenhaushygienischer Maßnahmen, z. B. als „Hygienesteckbrief“,
-
•
Übermittlung von Hygienebefunden und -maßnahmen an nachgeschaltete therapeutische Einrichtungen mit Bestätigung (Uhrzeit, Name, Telefonnummer, Unterschrift),
-
•
aktualisierte Antibiotika-Richtlinien mit Abstimmung der wichtigsten zuweisenden Einrichtungen.
Speziell für die neurologische Frührehabilitation hat Krankenhaushygieniker:Rehabilitationseinrichtungensich die Infektionserfassung in Kombination mit mikrobiologischem Monitoring bewährt. Dadurch werden frühzeitig eingeschleppte Problemerreger und eine nosokomial Frührehabilitation, neurologische:Surveillanceakquirierte relevante Besiedlung mit der Möglichkeit präventiver Maßnahmen erkannt. Zudem Surveillance:Frührehabilitation, neurologischewird die aktuelle Resistenzlage erfasst (Resistenzmonitoring), wodurch die kalkulierte antibiotische Chemotherapie fundiert wird. Auswertung und Dokumentation der Befunde sollten täglich erfolgen. Bei differenzialdiagnostischen Problemfällen ist es hilfreich, Hygieniker und Mikrobiologen hinzuzuziehen, die idealerweise auch an klinischen Visiten teilnehmen sollten. Die verbreitete kostengünstige Variante der Betreuung „par distance“ ist keine Alternative.
Die Infektionssurveillance obliegt den Stationsärzten in Zusammenarbeit mit der HFK.
Es hat sich bewährt, einen Oberarzt mit der Koordination von Surveillance und Hygienemanagement einschließlich Supervision der Abteilung zu betrauen. Er sichtet die eingehenden Befunde und entscheidet bei wichtigen Ereignissen (Auftreten von MRE, schwere Infektionen) gemeinsam mit dem Team und dem beratenden Hygieniker und Mikrobiologen über weitere diagnostische, therapeutische und hygienische Maßnahmen.
Die Daten der Patienten werden fortlaufend in die Infektionserfassung eingespeist, die Ergebnisse vom Hygieneteam aufbereitet und in monatlichen Besprechungen im gesamten Team ausgewertet.
Die Durchführung eines Basisprogramms für ein mikrobiologisches Monitoring empfiehlt sich
-
•
in den ersten Stunden nach Patientenaufnahme,
-
•
alle 14 Tage bei allen Patienten der Frührehabilitation, engmaschiger bei besonderen Vorbefunden und bei Verdacht auf Ausbruch,
-
•
am Tag der Verlegung,
-
•
nach Absprache z. B. bei auffälligen Infektionsraten auch auf anderen Abteilungen.
Je früher eine (noch) klinisch inapparente oder apparente NI bzw. deren Vorstufe, die Kolonisation, diagnostiziert wird, desto bessere Chancen bestehen für eine effektive Therapie und desto geringer sind die Folgekosten. Anhand der Erreger- und Resistenzstatistik mit Trendbeobachtung wird eine abteilungsbezogene kalkulierte antibiotische Chemotherapie möglich, das Infektionsrisiko für einzelne Patienten sowie für die Abteilungen wird besser einschätzbar und mit anderen Einrichtungen vergleichbar (interne und externe Qualitätskontrolle). Im Besonderen werden Einschleppungen aus einweisenden Kliniken mit der Möglichkeit einer raschen Reaktion erfasst, sodass die Monitoring-Ergebnisse den Folgekliniken in der Risikobewertung zur Verfügung stehen. Ob und wieweit das Monitoring nach Einführung weiterbestehen soll, muss abteilungsindividuell im Ergebnis der Risikobewertung der Infektionsgefährdung unter Berücksichtigung der Kosten-Nutzen-Relation entschieden werden.
Für das Monitoring hat sich nach unseren Erfahrungen die Abstrichuntersuchung von Nase, Rachen, Trachealkanüle, Urin und Wunden bewährt. Bei Kolonisation oder Infektion mit relevanten Erregern kann zur weiteren Risikoeinschätzung ein Perianal- oder Rektalabstrich durchgeführt werden, wodurch Carrier erkannt werden können.
Ergibt sich beim Monitoring ein relevanter Erregernachweis, ist die telefonische Übermittlung des Befunds Voraussetzung für die rasche Reaktionsmöglichkeit des Klinikers. Jetzt kann entschieden werden, ob und welche Weiteruntersuchung erfolgen soll, z. B. Ausdifferenzierung, Typisierung, Resistenzbestimmung.
Bei Nachweis von MRE kommt es immer wieder zur Einleitung unbegründeter Maßnahmen mit negativen Auswirkungen auf die Therapie.
Schutzmaßnahmen bei Auftreten von MRSA: MRSA werden in der neurologischen Surveillance:Rehabilitationseintichrungen\"\r\"RehaEinrSurvellanceRehabilitation häufig als Kolonisationserreger v. a. im Tracheostomabereich, in Wunden (z. B. Hautwunden bei Rehabilitationseinrichtungen:Surveillance\"\r\"RehaEinrSurvellancePEG-Sonden), im Urin (und Urethralabstrich) sowie perianal/rektal nachgewiesen. Besonders häufig kommt es, wenn kein Screening durchgeführt wird, zur stillen Verbreitung in die zwischen- und nachgeschalteten Abteilungen von Akutkrankenhäusern bis zum Pflegeheim. Deshalb ist ein Screening auf MRSA-Vorkommen schon vor Aufnahme in die Reha-Einrichtung anzustreben, um ggf. schon vor der Aufnahme eine Sanierung durchzuführen oder zumindest bei der Aufnahme die Schutzmaßnahmen und die Sanierung einleiten zu können. Bei Nachweis von MRSA wird anhand weiterer Abstriche das Kolonisationsausmaß geprüft. Hierbei werden Carrier mit u. U. schwierig sanierbarer Besiedlung wie z. B. im Darm erkannt.
Bei MRSA-Nachweis sind folgende Maßnahmen zu treffen:
-
•
Information von Pflegeteam, Ärzten, Angehörigen (Merkblatt) mit Hinweis auf Einhaltung der Standardhygiene,
-
•
Beratung im Team über protektive Maßnahmen (Isolierung, ggf. Zuordnung eigener PflegeMRSA:Rehabilitationseinrichtungen, Maßnahmen- und Therapieteams für den Patienten, Mund-Nasen-Schutz, Schutzkittel, Haarschutz, Besucherverkehr, antiseptische Sanierung),
-
•
Überprüfung aller Maßnahmen und Verrichtungen am Patienten in Hinblick auf das Verbreitungsrisiko,
-
•
Händedesinfektion nach jedem Patientenkontakt und akkurate Wundpflege,
-
•
Untersuchung der Mitpatienten auf MRSA,
-
•
Kontrollabstriche bis zum negativen MRSA-Nachweis an drei aufeinanderfolgenden Untersuchungstagen unter Berücksichtigung der wichtigsten Nachweislokalisationen (Nasen-Rachen-Raum, Perinealbereich, Stuhl, ggf. Urin).
Prinzipiell besteht das Gebot der Patientenisolierung (Nußbaum 2009).
Oft sind in Reha-Kliniken jedoch die Räumlichkeiten hierfür weder geplant noch praktisch nutzbar. Das setzt von allen Beteiligten ein hohes Maß an Hygieneverständnis und Schulung mit entsprechendem Verhalten bei allen Maßnahmen am Patienten und in seiner Umgebung voraus.
Kann ein Patient mit MRSA nicht isoliert/kohortiert werden, entscheidet das Team über die Schutzmaßnahmen angepasst für jeden Patienten:
-
•
Isolierung/Kohortierung ist notwendig, wenn mit starker aerogener Verbreitung zu rechnen ist, z. B. bei MRSA-Kolonisation auf ausgedehnten Hautläsionen und bei Patienten mit Tracheostoma.
-
•
Verlassen des Einzelzimmers ist möglich, wenn Hautläsionen/offene Wunden sicher verbunden sind, das Tracheostoma oder der Zugang zur PEG-Sonde abgedeckt ist, geschlossene Harnableitungssysteme genutzt werden und der Patient kooperativ ist und selbst die Händedesinfektion durchführen kann oder eine Händedesinfektion durch das Pflegepersonal zulässt.
Folgende Maßnahmen unterstützen die Prävention:
-
•
Räumlichkeiten zur Unterbringung von MRSA-Kolonisierten/-Infizierten sollen ohne Teppichböden und ohne textilbezogene Sitzgelegenheiten ausgestattet sein, um die tägliche Flächendesinfektion zu ermöglichen.
-
•
Diagnostische und MRSA-Prävention, Rehabilitationseinrichtungentherapeutische Maßnahmen sollten, soweit vertretbar, mindestens in den ersten 7 Tagen nach Bekanntwerden der Besiedlung und Start der Sanierungsmaßnahmen im Zimmer des Rehabilitanden durchgeführt werden.
-
•
Schutzkittel und Mund-Nasen-Schutz sollen bei der Behandlungspflege und wenn der Patient nasal besiedelt/infiziert ist und Auswurf hat oder hustet, angelegt werden.
-
•
Technische Hilfsmittel wie Rollstühle, Lifter usw. sind nach Inanspruchnahme an den Kontaktflächen einer Wischdesinfektion zu unterziehen.
-
•
Nach Teilnahme an Gruppentherapien sind die Kontaktflächen/benutzten Gegenstände einer Wischdesinfektion zu unterziehen. Gleiches gilt nach Nutzung des Stationsbads (umgehende Wischdesinfektion von Dusche, Wanne, Hocker, Boden und Spritzbereich).
-
•
Wäsche und Textilien werden im Zimmer des Rehabilitanden gesammelt und einem Desinfektionswaschverfahren zugeführt. Das gilt auch für persönliche Wäsche, wenn sie in der Einrichtung gewaschen wird.
-
•
Essgeschirr geht auf direktem Weg in die Geschirrspülmaschine und wird bei mindestens 65 °C gespült.
-
•
MRSA-haltige Sekrete und Ausscheidungen werden auf direktem Weg in der Toilette oder im Steckbecken-RDG entsorgt.
-
•
Abfall wird im Zimmer gesammelt und im geschlossenen Kunststoffsack auf direktem Weg in den Container entsorgt.
-
•
Die Patienten selbst sind, soweit möglich, über ihre MRSA-Problematik aufzuklären, in besonderem Maß über die Notwendigkeit der regelmäßigen Händedesinfektion vor Verlassen des Zimmers, über die Benutzung von Einmalpapiertüchern bei nasaler Besiedelung und das Abdecken von Tracheostoma, Trachealkanüle, Wunden, Katheter/Sonden.
Bei MRSA-Nachweis sind die Mitpatienten im Zimmer ebenfalls auf MRSA zu untersuchen. Wird eine Häufung nachgewiesen, werden auch die Mitarbeiter untersucht.
Besonders problematisch gestaltet sich die MRSA-Eradizierung (Kap. 3.7) bei Patienten mit Carrierstatus im Darm. Die Gefahr liegt in der Verbreitungsmöglichkeit bei inkontinenten Patienten. Sorgsame täglich mehrfache antiseptische Pflege besonders der Perianal- und Urogenitalregion bei Einhaltung der Grundsätze der Händedesinfektion sind die wichtigsten Schutzmaßnahmen. Die Patienten werden mindestens alle 2 Tage in der Wanne gebadet, wobei mit antiseptischen Präparaten gewaschen werden sollte und die Wanne nach der Nutzung zu desinfizieren ist.
Beim Nachweis von MRE in Reha-Einrichtungen gilt: Rehabilitation geht vor Patientenisolierung.
In neurologischen Reha-Kliniken werden in der Phase B neben MRSA häufig weitere MRE mit einem Anteil von bis zu 30 % gefunden. Sie sind potenzielle Infektionserreger für Reha-Patienten und für Patienten der Zwischen- und Nachversorgung. Treten sie sporadisch auf, genügt speziesabhängig die Einhaltung der Standardhygiene ohne Isolierung. Eine Ausnahme können nachgewiesene Infektionserreger bei erheblicher und v. a. respiratorischer (Trachealkanüle) Kolonisation sein, aber auch hier bedarf jede Isolierung der eingehenden Prüfung. Kommt es zu Ausbrüchen, sollten die Patienten kohortenisoliert werden.
Bei mit verschiedenen MRE an mehreren Lokalisationen besiedelten Patienten ist es häufig schwierig, bei Auftreten fraglicher oder sicherer Infektionszeichen die richtige Entscheidung zu Therapie und Präventionsmaßnahmen zu treffen. Hier helfen die Monitoringvorbefunde in der klinischen und mikrobiologischen Verlaufsbeobachtung meist weiter, zumindest die der resistenzbasierten kalkulierten Antibiose. Das Problem der Entscheidungsfindung ist eine der Hauptindikationen zur Etablierung eines kompetenten kooperativen klinisch-krankenhaushygienischen Teams, das sowohl als „Hotline“ als auch am Krankenbett präsent sein sollte.
In der neurologischen Frührehabilitation ist das Zusammenwirken des Teams mit der HFK/dem Hygieniker und Mikrobiologen Voraussetzung für eine effektive Infektionsprävention und damit für den Rehabilitationserfolg. Diesem Umstand muss personell einschließlich Schulung Rechnung getragen werden. Dieser Aufwand verringert präventiv die infektionsbedingten Folgekosten.
Für das Gros der übrigen Reha-Kliniken liegen bislang keine ausreichenden Daten zur Prävalenz und Relevanz von MRE vor. Die Ergebnisse der durch das EUREGIO MRSA-net durchgeführten größten Studie zu dieser Fragestellung sind noch nicht publiziert. Eine kleinere Studie im Kreis Höxter fand in 3 Rehabilitationskliniken unterschiedlicher Indikationen eine MRSA-Prävalenz von 1,2 %, wobei MRE:Rehabilitationseinrichtungenes sich überwiegend um Kolonisationen handelte (Woltering et al. 2008). Die Autoren ziehen aus ihren Ergebnissen die Schlussfolgerung, dass ein generelles MRSA-Screening für entsprechende Kliniken nicht sinnvoll erscheint, empfehlen dieses aber für definierte Risikogruppen (z. B. Hämodialysepatienten, bekannte MRSA-Infektion innerhalb der letzten 6 Monate). Auch die Autoren eines Positionspapiers zum Umgang mit MRSA in der stationären Rehabilitation sprechen sich gegen ein generelles MRSA-Screening aus, empfehlen dieses aber bei Vorliegen entsprechender Risikofaktoren (Eichhorn et al. 2008). Als Risikofaktoren, speziell bei Patienten in der onkologischen Rehabilitation, benennen die Autoren offene Wunden, Störungen der Hautintegrität wie ausgedehnte Ekzeme und Ulzera, das Vorhandensein von Stomata, venösen bzw. Blasenkathetern und PEG-Sonden, vorangegangene längerfristige Intensivtherapien bzw. komplizierte Krankheitsverläufe, eine Vorgeschichte mit MRSA-Besiedlungen bzw. -Infektonen sowie den Kontakt zu MRSA-Patienten während des (Akut-)Klinikaufenthalts. Im Unterschied dazu empfahlen Manian et al. (2002) nach dem Erlebnis eines MRSA-Ausbruchs ein generelles Aufnahmescreening außer bei Aufnahme direkt aus dem häuslichen Milieu; allerdings war die MRSA-Rate in dieser US-Studie hoch, wobei die Autoren einen signifikanten Anstieg der MRSA-Besiedelung von 5 % (1987–1988) auf 12 % (1999–2000) feststellten. Aus eigenen Erfahrungen erscheint uns ein generelles MRE-Aufnahmescreening einschließlich rückverlegter Patienten nur bei Patienten in der neurologischen Frührehabilitation sinnvoll. Bei dem Screening werden neben MRSA besonders die häufig vorkommenden multiresistenten Pseudomonaden- und Acinetobacterstämme entdeckt, wodurch die Hygienemaßnahmen frühzeitig eingeleitet werden können.
Während sich in den meisten Reha-Kliniken selten Patienten mit entsprechendem Risikoprofil finden, treten sie regelmäßig in Kliniken auf, die Anschlussrehabilitationen, gastroenterologischeAnschlussrehabilitationen wegen gastroenterologischer bzw. gastroenterologisch-onkologischer Krankheitsbilder durchführen. Erschwerend kommen hier zudem oft Komorbiditäten wie Diabetes mellitus oder Adipositas hinzu, die eine weitere Risikoerhöhung bedingen. Das Hygienemanagement in der gastroenterologischen Anschlussrehabilitation sollte sich daher an den Empfehlungen für die neurologische Frührehabilitation orientieren. Dringend zu fordern ist zudem die Intensivierung von Untersuchungen zur Prävalenz von MRE bei Patienten in der gastroenterologischen Rehabilitationseinrichtungen:MRSA\"\r\"RehaEinrMRSAAHB.Rehabilitationseinrichtungen\"\r\"Rehabilitationseinrichtungen
5.22. Radiologie und Nuklearmedizin
Gerhard Kirsch
5.22.1. Strahlenrisiken und Infektionsrisiken
In der Radiologie, der Strahlentherapie und der Nuklearmedizin sind der Infektions- und der Strahlenschutz gleichermaßen zu realisieren.
Genehmigungspflichtige bautechnische Voraussetzungen, Gerätetechnik, Qualitätskontrollen, standardisierte Untersuchungsabläufe und fachkundiges Personal sichern den Strahlenschutz. Die mittlere jährliche Strahlenbelastung der Bevölkerung in der BRD beträgt 4 mSv (BfS 2008). Knapp die Hälfte (1,9 mSv) ist auf die Anwendung ionisierender Strahlung in der Medizin zurückzuführen. Bei 148 Millionen Untersuchungen pro Jahr erhält jede Person etwa 2 Röntgenaufnahmen und jede Zehnte ein CT.
Strahlenbelastung:mittlere jährlicheVom prophylaktischen Ansatz ähneln sich Strahlenschutz und Hygiene. Das ALARA(„As Low As Reasonably Achievable“)-Prinzip zur Minimierung der Strahlenbelastung mit vertretbarem Aufwand findet sein hygienisches Pendant bei der Keimzahlreduktion durch die Multibarrierenstrategie. Allerdings wird hygienischen Risiken im Routinebetrieb geringere Aufmerksamkeit gewidmet als dem ALARA-PrinzipStrahlenschutz, weil die einfach nachweisbare Strahlenbelastung:ALARA-Prinzipionisierende Strahlung einen höheren Warncharakter gegenüber der schwerer nachweisbaren oder nur vermuteten Infektiosität besitzt. Das Gros der nichtinvasiven radiologischen und nuklearmedizinischen Untersuchungen ist mit einem geringen Strahlen- und Infektionsrisiko behaftet. Zunehmend werden jedoch invasive Verfahren mit höherem Infektionsrisiko durchgeführt. Durch vermehrte Anwendung von Röntgenverfahren in den operativen Fächern wird die Koordinierung von Hygiene und Strahlenschutz für breite Kreise relevant. In modernen OP- und Behandlungsräumen mehrerer klinischer Disziplinen gehören ortsfeste oder mobile Röntgeneinrichtungen zur Grundausstattung. Hier wird das Infektionsrisiko überwiegend durch die Eingriffsart bestimmt. Intraoperativer Ultraschall und Radionuklid-Sondenmessungen werden zunehmend zur Lokalisation von Tumoren und Wächterlymphknoten eingesetzt. Strahlentherapie und Nuklearmedizin betreiben eigene Therapiestationen. In der stationären Strahlentherapie überwiegen ältere, immungeschwächte Patienten mit schweren Krankheitsbildern und langen Verweilzeiten.
Zur Infektionsgefährdung in der Radiologie tragen folgende Faktoren bei:
-
•
hohe Untersuchungszahlen, Patienten aus allen Fachrichtungen,
-
•
häufig fehlende Trennung von stationären und ambulanten Patienten,
-
•
breites Untersuchungsspektrum am gleichen Arbeitsplatz,
-
•
häufig fehlende Informationen zum Infektionsrisiko,
-
•
häufig injektion von Kontrastmitteln und Radiopharmaka,
-
•
häufig WC-Nutzung (Blasenentleerung) im Untersuchungsablauf,
-
•
Kontakt bei Patientenuntersuchung, -lagerung und bei Eingriffen.
In den Richtlinien des RKI werden radiologische Einrichtungen in Bereiche mit mittlerem Infektionsrisiko eingestuft.
Durch Anwendung von Standardhygienemaßnahmen:RadiologieStandardhygienemaßnahmen (Händehygiene, PSA, desinfizierende Reinigung der Patientenumgebung, sichere Injektionstechnik, regelkonforme Handhabung von MP) lassen sich in der Radiologie Infektionsrisiken einfach und weitgehend reduzieren.
Sinnvoll hat sich die Integration der Hygienemaßnahmen in die für alle (häufigen) Untersuchungen und Therapieverfahren leitlinienbasiert erstellten SAA erwiesen. Optimierte Untersuchungsabläufe (kurze Wege und Wartezeiten) sind meist auch unter hygienischen Aspekten vorteilhaft. Der Händedesinfektion kommt die größte Bedeutung zu. Sie soll in der Radiologie immer vor und nach infektionsgefährdenden Tätigkeiten, direktem Patientenkontakt, nach Handschuhablegen, Toilettenbenutzung und Naseputzen erfolgen. Die ausreichende Anzahl von Desinfektionsmittelspendern an den richtigen Stellen der Untersuchungsräume und Schleusen ist hierfür begünstigend, die Vorbildwirkung durch leitende Ärzte, MTA und Schwestern eine weitere wesentliche Voraussetzung. Handschuhe sollten auch bei kleinen invasiven Handlungen (Blutentnahmen, Legen von Venenkathetern) regelhaft getragen werden. Die Desinfektion angelegter Handschuhe anstelle des zeitaufwändigen Handschuhwechselns ist unter günstigen Voraussetzungen (fehlende Hinweise auf vorliegende Infektion, handschuhkompatible Desinfektionsmittel) vertretbar (Pitten und Kramer 2001).
Ein breiter Impfschutz der Mitarbeiter, besonders gegen Hepatitis B, ist anzustreben.
Bei radiologischen Untersuchungen von Patienten mit bekannten oder vermuteten krankenhaushygienisch bedeutsamen Infektionen bzw. Erregern müssen die Basishygienemaßnahmen mit besondere Sorgfalt erfolgen und gezielt durch spezielle Vorsichtsmaßnahmen erweitert werden.
Krankenhausinformationssysteme erlauben mit der Online-Untersuchungsanforderung Einsicht in Anamnese und Vorbefunde und ermöglichen mit einem „Cave“-Feld (Information bei Infektionsgefährdung), die Untersuchungsbedingungen aus hygienischer Sicht zu optimieren (Gruppierung).
Besiedlungen mit MRSA oder anderen MRE haben zugenommen, somit auch MRSA-Besiedlung, Radiologieradiologische Untersuchungen dieser Patienten. Zur Infektionsverhütung tragenMRE-Besiedlung, Radiologie bei (AWMF-Leitlinien-Register Nr. 029/019, 2009):
-
•
MRSA:Infektionsverhütung, RadiologieDirekttransport zum/vom Untersuchungsraum, Kontaktreduktion,
-
•
MRE:Infektionsverhütung, RadiologieFolienabdeckung von Liegen und Untersuchungstisch, Schutzkittel,
-
•
ggf. Mund-Nasen-Schutz für Patient und Personal,
-
•
technische Assistenz ggf. getrennt für Patient und Gerät,
-
•
Desinfektion der Kontaktflächen,
-
•
Inraum-Entsorgung (erregerdichter Abfallsack).
Zusätzliche Maßnahmen zur Infektionsverhütung bei offener Lungen-Tbc sind die Untersuchung möglichst zu Schichtende, Mund-Nasen-Schutz für Patient, FFP-2-Maske für Personal im Untersuchungsraum, bei Klimaanlage Umschalten auf Unterdruck im Untersuchungsraum, Raumbelüftung nach der Untersuchung und Flächendesinfektion (AWMF-Leitlinien-Register Nr. 029/036, 2009).Strahlenrisiko, Radiologie/Nuklearmedizin Radiologie:Strahlenrisiko\"\r\"RadiologieStrahlenrisiko Infektionsrisiko:Radiologie/Nuklearmedizin
5.22.2. Infektionsprophylaxe in der diagnostischen Radiologie
Radiologie:Infektionsrisiko\"\r\"RadiologieStrahlenrisiko Konventionelles Röntgen: Die Nuklearmedizin:Strahlenrisiko\"\r\"RadiologieStrahlenrisikohäufigsten Röntgenuntersuchungen erfolgen am Skelett (35 %), am Thorax (15 %) und im Zahnbereich (33 %). Im Untersuchungsablauf kommt es zum Kontakt der Personalhände mit der Patientenkörperoberfläche, mit Lagerungshilfen, Bedienelementen der Röntgen, konventionelles, InfektionsprophylaxeRöntgenapparate, Filmkassetten, Türklinken und PC-Tastaturen. Die hygienische Händedesinfektion ist die entscheidende Maßnahme zur Vermeidung von Kreuzinfektionen, Schutzhandschuhe sind bei Infektionsgefährdung angezeigt. Eine gezielte Apparatedesinfektion ist nach Kontamination mit Sekreten, Exkreten und Blut erforderlich. Ein direkter Kontakt des Patienten mit dem Untersuchungsgerät ist durch Papierabdeckung, bei Hautläsionen durch folienbeschichtete Einmaltücher zu vermeiden. Zahnfilme erfordern Handschuhschutz bei oraler Platzierung und Nachbehandlung.
Röntgenuntersuchungen von Gastrointestinal- und Harntrakt (4 %) werden nach Kontrastmittelapplikation (KM) durchgeführt. Rektale KM-Applikation (Einwegkatheter/-applikatoren) erfordert Vorkehrungen (Stuhlabgang) und gründliche Desinfektion/Säuberung von Arbeitsflächen und WC. Untersuchungsliegen und Lagerungshilfen werden überwiegend durch Einwegabdeckungen vor Verschmutzung geschützt, ebenso Filmkassetten bei der Röntgenaufnahme am Patientenbett. KM-Darstellungen von Körperhohlräumen werden durch Einwegkatheter und -materialien im Arbeitsablauf erheblich vereinfacht und minimieren Infektionsrisiken. Intravenös (händisch) applizierte KM bei der Urographie werden direkt vor der Untersuchung aufgezogen und als Einmaldosis verwendet.
CT, MRT: Aus hygienischer Sicht bieten die Großgeräte durch desinfizierbare glatte Vollverkleidungen und Lagerungstische kaum Probleme. Werden Kontrastmittel durch Injektoren über intravenöse Zugänge automatisiert zum CT, InfektionsprophylaxeUntersuchungsablauf appliziert, kann es durch unzureichende MRT, InfektionsprophylaxeHändehygiene, Verwendung offener KM-Nachfüllsysteme, lange KM-Standzeiten, unsachgemäßen Umgang mit Mehrdosisflaschen und KM-Rückflussen zur Infektionsgefährdung kommen.
Kontrastmittelinjektoren: Bei Kolbenspritzeninjektoren werden mit einem Medium (KM, NaCl) gefüllte Kolben (Fertigspritzen 50–125 ml: single dose oder aus Großgebinden befüllbare 200-ml-Leerkolben: potenzielles Kontaminationsrisiko, verstärkt bei Multi-Dosing) eingesetzt. Die MedienKontrastmittelinjektoren, Infektionsprophylaxe werden dem Patienten über ein Schlauchsystem injiziert. Bei Rollenpumpeninjektoren werden Medienbehälter (gängige KM-Gebindegrößen) auf das System aufgesteckt. Eine integrierte Pumpe injiziert die Medien über ein zweiteiliges Schlauchsystem. Der Patientenschlauch wird nach jedem Patienten ausgetauscht (Multi-Dosing). Die rasante Entwicklung der CT- und MR-Scanner führt zu kürzeren Untersuchungszeiten, sodass Rüstzeiten, Aufwand und Fehleranfälligkeit ökonomische und sicherheitsrelevante Faktoren werden. Hier besitzen Rollenpumpensystem Vorteile. KM-Flaschen sind nach dem AMG Eindosisbehälter. Restbestände nach der Untersuchung eines Patienten sind zu entsorgen. Ist das verwendete KM-Applikationssystem als MP für eine Mehrfachverwendung zugelassen, kann der Inhalt einer KM-Flasche für mehrere Patienten unter Beachtung der hygienischen Kautelen und der Zeitgrenze verwendet werden (AWMF-Leitlinien-Register Nr. 029/017, 2007).
Interventionelle Radiologie: Invasive diagnostische und therapeutische Verfahren unter Sichtkontrolle im Röntgen und CT haben in den letzten Jahren deutlich zugenommen. Damit ergeben sich höhere Ansprüche an Hygienestandards und Strahlenschutz. Mit zunehmender Dauer und Komplexität der Radiologie:interventionelle, InfektionsprophylaxeEingriffe nehmen Strahlenbelastung und Infektionsgefährdung zu. Interventionelle Verfahren mit Gefäßfreilegung, Implantation von Stents, Prothesen, Filtern und Embolisaten sowie bildgesteuerte Biopsien verlangen chirurgische Händedesinfektionen, sterile Schutzkleidung, Kopfbedeckung, Mund-Nasen-Schutz, bei zu erwartenden Blutspritzern Schutzschirm oder Schutzbrille sowie adäquate Patienten-und Apparatepräparation. Bei direktem perkutanem Gefäßzugang (Punktion) ist eine hygienische Händedesinfektion ausreichend. Gefäßkatheter und Materialien sind erst kurz vor Nutzung der Sterilverpackung zu entnehmen. Gefäßzugänge sollten nur so lange wie unbedingt nötig belassen werden. Bei KM-Applikationen sind Eindosisbehälter die hygienisch sicherste Variante.
5.22.3. Infektionsprophylaxe und Strahlenschutz in der Nuklearmedizin
Radiologie:Infektionsprophylaxe\""\r""RadiologieInfektionsprophyl Belange der Hygiene sind in der Nuklearmedizin eng verbunden mit dem Strahlenschutz. Das Infektionsprophylaxe:Radiologie\""\r""RadiologieInfektionsprophylfindet Ausdruck in Arbeits- und Verhaltensinstruktionen in diesen Arbeitsbereichen, die beide Aufgaben berücksichtigen müssen (Muster für einen Hygieneplan ![]() Online-Ergänzung 5.22).
Online-Ergänzung 5.22).
Nuklearmedizinische Funktionsdiagnostik: Bei Anwendung offener Radionuklide wird der Arbeitsablauf durch die Kontaminationsmöglichkeit prävalent vom Strahlenschutz bestimmt. Kontaminationen von Haut, Gegenständen und Messgeräten führen nicht nur zu vermehrter Strahlenexposition, sondern könnenFunktionsdiagnostik, nuklearmedizinische:Strahlenschutz sich als Fehlerquellen in der Diagnostik auswirken. Das Gros der Radiopharmaka wird i. v. appliziert.
Der Kontaminationsvermeidung bei Radiopharmakainjektion (undichte Spritzen-Kanülen-Verbindung, Blutaktivität an benutzten Tupfern, kontaminierte Spritzen und Transportbehältnisse) ist besondere Aufmerksamkeit zu widmen.
Initiales Spülen der Hände unter fließendem Wasser und Kontaminationskontrollen sind Erstmaßnahmen bei Verdacht auf Radionuklidkontamination noch vor der Händedesinfektion, die eine Kontamination auf der Haut verteilen würde.
Radionuklidinhalationen vor Lungenwegszintigraphie sind mit Einweginhalationssystemen (Exhalationsfilter) möglichst an RadionuklidkontaminationExhausterboxen durchzuführen, um Aktivitätskontaminationen und Infektionsgefährdung (Hustenreiz) zu verringern. Intraartikuläre und intrathekale Radiopharmakaapplikationen vor RadionuklidinhalationenRadiosynoviorthesen und Liquorraumszintigraphien verlangen aseptische Arbeitsbedingungen mit vorausgehender Hautantiseptik.
Besondere Bedeutung für den Strahlen- und Infektionsschutz des Patienten kommt optimierten Arbeitsabläufen zu. Wegen der erforderlichen Radiopharmakonanreicherung in den Targetorganen sind nach Injektion häufig längere Wartezeiten erforderlich. Illustrierte Darstellungen der Untersuchungsabläufe Funktionsdiagnostik, nuklearmedizinische:Infektionsprophylaxeunterstützen die Patientenaufklärung. Diureseförderndes Trinken und mehrfache Miktionen sind Bestandteile vieler Untersuchungsabläufe. Sie erfordern leicht zugängliche „gepflegte Sanitäreinrichtungen“ und eine für den Patienten nachvollziehbare Erklärung (Aktivitätsausscheidung im Urin) des geforderten „betont hygienischen“ Verhaltens (Vermeiden von Urinkontamination an Händen und Unterwäsche, gründliches Händewaschen) auch noch für die ersten Stunden nach Beendigung der Untersuchung.
Periodische Weiterbildung des Personals und kritische Analyse von Strahlenschutz und Hygiene sind qualitätssichernde Aufgaben in nuklearmedizinischen Einrichtungen. Schwachstellen sind die in vielen Einrichtungen „ausgelagerten“ Reinigungsarbeiten (Reinigungsfirmen, Arbeitskräftefluktuation). Hier sind detaillierte Arbeitsinstruktionen und Kontrollen besonders wichtig.
Radiopharmakaanwendung: Bei der Anwendung und Qualitätssicherung radioaktiver Arzneimittel sind neben Strahlenschutz und Hygiene Verordnungen des AMG und des MPG gleichermaßen zu beachten.
Neben gebrauchsfertigen Arzneimitteln werden in der Nuklearmedizin vorwiegend kurzlebige Radiopharmaka Radiopharmakaanwendungangewendet, die bei Bedarf im „aktiven“ radiochemischen Labor mit Hilfe von Markierungsbestecken hergestellt werden. Diese nach Arzneimittelrecht zugelassenen Markierungskits („Technetium-Kits“) enthalten fertige Reagenziensätze in lyophilisierter Form. Durch Zugabe des aus einem Radiopharmakasterilen Radionuklidgenerator gewonnenen Radiotracers erhält man ein applikationsfertiges Radiopharmakon, das ggf. chromotographisch auf radiochemische Reinheit zu überprüfen ist (bei Antikörpermarkierung, Markierung unter Erwärmung; Kits mit geringer Reduktionsmittelmenge und bei Abweichung von der Markierungsvorschrift). 99mTc ist das am Radiotracerhäufigsten angewandte gebrauchsfertige Radiopharmakon und gleichzeitig Tracer für die Markierungskits. Es wird täglich aus dem Molybdän/Technetium-Generator (Nutzungsdauer 2–3 Wochen) in abgeschirmte Teilvakuum-Durchstechflaschen eluiert und steht (bei Kühllagerung ca. 8 Stunden) zur Pharmakonmarkierung zur Verfügung. Die Markierungsanleitungen beschreiben Prozedere, Markierungsbedingungen, Aktivitäts- und Substanzmengen, Qualitätsparameter, Verwendungsdauer und Lagerungsbedingungen. Eluierung und Präparation erfordern aus Strahlenschutzgründen sorgfältiges rasches Handeln hinter bleiglasgeschützten Arbeitsflächen bei Beachtung hygienischer Prinzipien (Händedesinfektion, Handschuhe, Durchstichflächendesinfektion mit Steriltupfer, steriler Konusverschluss bei Aktivitätsmessung/Spritzentransport, Einwegtransportschale, Abschirmung, Beschriftung).
Sonstige Radiopharmaka umfassen radioaktiv markierte körpereigene (Blut-)Bestandteile und Markierungen mit kurzlebigen (z. B. am Zyklotron) hergestellten Positronenstrahlern für die PET. Hier ist der Anwender für den Gesamtprozess und die Qualitätssicherung verantwortlich, die er gemäß den Anforderungen des Arzneimittelrechts durchzuführen hat.
Radionuklidtherapie: Für die meisten Radionuklidtherapien sind in Deutschland kurze stationäre Aufenthalte in speziell ausgestatteten Radionuklidtherapiestationen vorgeschrieben. Schilddrüsenfunktionsstörungen und -malignome stellen das Hauptkontingent. Sie werden mit Radioiod, einem Beta-Gamma-Strahler, behandelt. Die sorgfältige RadionuklidtherapieSammlung und Lagerung von Stuhl, Urin und Sekreten in geschlossenen, überwachten Abklinganlagen, dekontaminierende Säuberungen von Sanitäranlagen und Einrichtungen sowie Kontaminationskontrollen sind gleichsam antiinfektiös ausgerichtet, ebenso wie die Minimierung von Direktkontakten zwischen Personal und Patienten.
Nach eigenen Erfahrungen bei etwa 8.000 Radioiodtherapien beträgt die während des stationären Aufenthalts erworbene Infektionsrate (nasopharyngeal und bronchopulmonal) etwa 2–3 %.Strahlenschutz, Nuklearmedizin\"\r\"NuklearmedizinInfprophyl Nuklearmedizin:Strahlenschutz\"\r\"NuklearmedizinInfprophyl Nuklearmedizin:Infektionsprophylaxe\"\r\"NuklearmedizinInfprophyl
5.23. Physiotherapie
Frank-Albert Pitten, Axel Kramer, Julian Exner und Martin Exner
Patienten mit hoher Infektionsgefährdung sollten – sofern das möglich ist – nicht in der physiotherapeutischen Abteilung, sondern im Patientenzimmer physiotherapeutisch behandelt werden. Gleiches gilt für isolierte Patienten. Selbstverständlich haben auch MRSA-Patienten bei gegebener Indikation Anspruch auf physiotherapeutische Maßnahmen!
Sowohl der überweisende Arzt als Radiologie\"\r\"Radiologieauch der Physiotherapeut müssen unter Beachtung dieses Nuklearmedizin\"\r\"RadiologieGrundsatzes über die Durchführbarkeit der physiotherapeutischen Maßnahme im Krankenzimmer oder in der Physiotherapie entscheiden. Es empfiehlt sich, in der Hygieneordnung infektiologische Ausschlusskriterien bzw. spezielle Schutzmaßnahmen festzulegen (Tab. 5.36 ). In der Physiotherapie-Abteilung ist aufgrund des Patientendurchgangs das Risiko für Kreuzinfektionen zu berücksichtigen, zumal sich Patienten aus den unterschiedlichsten Fachdisziplinen begegnen.
Tab. 5.36.
Beispiele für Indikationseinschränkungen bei physiotherapeutischen Maßnahmen aufgrund lokaler oder systemischer Infektionen.Infektion(en):physiotherapeutische Maßnahmen, Einschränkung
| Beispiel | Indikationseinschränkung |
|---|---|
| Meldepflichtige Erkrankungen nach IfSG, sofern hohes Übertragungsrisiko | Keine Behandlung in der Physiotherapie-Abteilung |
| Infektion oder Besiedlung mit MRE, sofern Übertragung zu befürchten | |
| Wundinfektion | Keine Balneotherapie, keine Lokaltherapie (z. B. Elektrotherapie) im Wundgebiet |
| Manifeste Fußpilzerkrankung | Keine Balneotherapie |
Für die Physiotherapie-Abteilung soll kurzärmlige Bereichskleidung zur Verfügung gestellt werden; der tägliche Wechsel ist selbstverständlich.
5.23.1. Physikalische Therapie im Trockenbereich
Alle zur äußerlichen Anwendung am Patienten bestimmten Geräte und HilfsmittelHilfsmittel müssen desinfizierbar sein und vor ihrem Einsatz gereinigt und, falls erforderlich, desinfiziert werden.
Eine Ausnahme von diesem Grundprinzip kann nur gemacht werden, wenn sichergestellt ist, dass das Hilfsmittel (z. B. Inhaliergerät oder Packungsmasse) ausschließlich an einem Patienten angewendet wird.
Die desinfizierende Reinigung von Liegen, Matten, Massagebänken, Knierollen usw. ist täglich ausreichend, wenn jedem Patienten eine frische Textil- oder Papierauflage zur Verfügung gestellt wird. Voraussetzung sind leicht zu reinigende, desinfektionsmittelbeständige Materialien; naturholzbelassene Gegenstände sind ungeeignet. Aus dem gleichen Grund sowie aus allergologischen Gesichtspunkten sind textile Fußbodenbeläge ungeeignet. Sofern Vorhänge zum Separieren von Raumeinheiten eingesetzt werden, müssen sie im Desinfektionswaschverfahren aufbereitbar sein.
Massage und Krankengymnastik: Neben jeder Patientenliege ist ein Desinfektionsmittelspender erforderlich, um die Händedesinfektion zu gewährleisten. Verbände sollen nicht abgenommen werden. Beim Ablegen von Gipsschalen oder Prothesen ist Krankengymnastik:HygienemaßnahmenVorsicht geboten. Falls unbeabsichtigt eine Wunde freigelegt wird, ist die Krankengymnastik:Massagesofortige Wundversorgung auf der Herkunftsstation des Patienten zu gewährleisten und die geplante physiotherapeutische Maßnahme auszusetzen.
Elektrotherapie: Elektroden, Schallköpfe und sonstige Gegenstände, die direkten Kontakt mit der Haut des Patienten haben, sind nach jeder Anwendung zu desinfizieren und am Ende des Arbeitstags mit sauberen Textilien abzudecken, die mindestens wöchentlich im Desinfektionswaschverfahren Elektrotherapie, Hygienemaßnahmenaufzubereiten sind. Bei Verzicht auf textile Abdeckung ist vor Inbetriebnahme am folgenden Tag eine alkoholische Wischdesinfektion der Patientenkontaktflächen vorzunehmen.
Zur Befestigung der Elektroden werden gewöhnlich Einwegpapierblättchen oder textile Materialien verwendet. Für Letztere ist ein Waschen in Seifenlösung genauso inakzeptabel wie das Einlegen in eine Desinfektionslösung (Gefahr toxischer oder sensibilisierender Nebenwirkungen durch Desinfektionsmittelrückstände). Zuverlässig ist allein die Behandlung im Desinfektionswaschverfahren.
Werden Ulzera mit der Galvanisationsmethode behandelt, sind zur Abdeckung sterile Materialien (z. B. Mullkompressen) zum Einmalgebrauch einzusetzen.
Inhalationstherapie: Nur wenn sichergestellt ist, dass ein Gerät nur von einem Patienten benutzt wird, ist es vertretbar, von einem Mundstückwechsel vor jeder neuen Anwendung abzusehen. Das Mundstück sollte dann mindestens 2-mal/d und das Inhalat nach Angaben des Geräteherstellers Inhalationtherapie, Hygienemaßnahmengewechselt werden. Zur Zubereitung des Inhalats muss steriles Aqua dest. verwendet werden. Das Inhalat selbst braucht nicht steril zu sein, muss aber die Anforderungen des Europäischen Arzneibuchs in der aktuellen Fassung erfüllen, d. h. < 102 Bakterien und Pilze/ml, < 101 Enterobakterien und andere gramnegative Bakterien/ml und keine P. aeruginosa, S. aureus oder Inhalat(e), AnforderungenLegionellen in 100 ml.
Inhalieren verschiedene Patienten (nacheinander) am selben Gerät, sind für jeden Patienten ein desinfiziertes Mundstück (je nach System auch ein aufbereiteter Schlauch) und frisch zubereitete Inhalatlösung bereitzustellen.
Die für die Inhalation verwendete Druckluft muss die im Europäischen Arzneibuch aufgeführten Anforderungen erfüllen: < 10 KbE/m3, Freisein von Krankheitserregern und sichtbaren Feststoffverunreinigungen (orientierende Prüfung durch Aufleiten der Druckluft auf weißes Papier ≥ 10 s) mit einem Ölgehalt < 0,1 mg/m3.
Vorsicht ist bei Patienten mit chronischen Atemwegserkrankungen geboten. Für Mukoviszidosepatienten ist belegt, dass bei gemeinsamem Aufenthalt in geschlossenen Räumen gehäuft Kreuzinfektionen mit Pseudomonaden auftreten können (Botzenhart und Junger 1992). Besondere Beachtung verdienen die von Patienten mit Atemwegserkrankung(en), chronische, Inhalationstherapiechronisch-obstruktiver Lungenerkrankung verwendeten Mikroinhaliergeräte zur Applikation von β-Sympathikomimetika oder Kortikosteroiden: Die vielfach ohne Verpackung in Jacken-, Hand- oder Hosentasche mitgeführten Geräte werden nur selten desinfiziert (z. B. abgekocht), sodass eine gefährliche Erregerquelle entstehen kann. An die Inhalationstherapie sind bei diesen Patienten hohe Hygieneanforderungen zu stellen. Wir konnten bei stationär behandelten Intensivtherapiepatienten mehrere Fälle pulmonaler Candidosen nach Inhalation von Glukokortikoiden aus einem mit Candida besiedelten Spacer aufklären, die aufgrund längerfristiger immunsuppressiver Therapie erst spät als solche erkannt wurden. Auch andere Geräte, die zur häuslichen Inhalationstherapie verwendet werden, z. B. mechanische Vernebler, werden aus Unkenntnis über diese Risiken vielfach nicht effektiv gereinigt und desinfiziert (Kober et al. 1996).
5.23.2. Physikalische Therapie im Nassbereich
Infektionsrisiken im Badewasser: Bei Infektionsrisiken ist physikalische Therapie:Trockenbereich\""\r""PhysTherTrockenzwischen Erkrankungen, die durch Erreger im Badewasser (Tab. 5.37 ), und Erkrankungen, die über den Feuchtbereich außerhalb des Badewassers übertragen werden, zu unterscheiden.
Grundsätzlich sollten infektiöse Patienten sowie Patienten mit offenen Wunden nicht in Schwimm-, Therapie- oder Bewegungsbecken behandelt werden.
Tab. 5.37.
Durch Badewasser übertragbare Infektionen.Salmonelleninfektion(en), BadewasserRotavireninfektion(en):BadewasserPicornaviren:Infektion(en), BadewasserNorovireninfektion(en):BadewasserMykobakterien:Infektion(en), BadewasserKryptosporidien, Infektion(en), BadewasserInfektion(en):BadewasserGiardia lamblia:Infektion(en), BadewasserEnterokokken:Infektion(en), BadewasserEnterobakterien:Infektion(en), BadewasserECHO-Viren:Infektion(en), BadewasserCoxsackieviren:Infektion(en), BadewasserChlamydia trachomatis:Infektion(en), BadewasserAdenovirusinfektion(en):Badewasser
| Erreger | Krankheitsbild |
|---|---|
| Adenoviren | Keratoconjunctivitis epidemica, fieberhafte Infekte |
| ECHO-, Coxsackie-, Rota-, Picornaviren, Noroviren | Konjunktivitis, Nasopharyngitis, fieberhafte Infekte (insbesondere bei Kindern), Gastroenteritiden |
| P. aeruginosa | Otitis externa, Pyodermie, Whirlpool-Dermatitis |
| S. aureus, C. trachomatis | Pyodermie, Schwimmbadkonjunktivitis |
| L. pneumophila (Warmwasserbereich, Whirlpool oder Dusche) | Legionellose, Pontiac-Fieber |
| Enterokokken, Salmonellen und andere Enterobakterien | Gastrointestinale Infektionen (geringe Wahrscheinlichkeit, da hohe Infektionsdosis) |
| atypische Mykobakterien (z. B. M. marinum) | Hautulzerationen |
| Kryptosporidien und Giardia intestinalis | Gastroenteritiden |
Ein Badewasser:Infektionsrisikohöheres Risiko zur Entwicklung schwerer Otitiden besteht für Infektionsrisiko:BadewasserDiabetiker nach Exposition mit Pseudomonaden. Exner (1983) fand in 49 von 147 Krankenhausbewegungsbädern (18 %) Pseudomonaden. Durch atypische Mykobakterien können im Bereich von Bagatellverletzungen granulomatöse, ggf. zentral ulzerierende Effloreszenzen entstehen (Schwimmbadgranulom). Augeninfektionen durch H. influenzae, Herpesviren oder Akanthamöben im Badewasser sind als Rarität anzusehen.
Zur Herabsetzung des Infektionsrisikos in Warmsprudelbecken und Unterwassermassagewannen fordert die DIN 19643 einen Mindestchlorgehalt von 0,7 mg/l im Reinwasser.
Für die Übertragung von AIDS spielt Badewasser, das den o. g. physikalisch-chemischen Vorgaben entspricht, keine Rolle, da HIV unter diesen Bedingungen inaktiviert werden.
S. aureus kann sich über längere Zeit im unzureichend gechlortem Badewasser halten. Exner und Thofern (1981) konnten S. aureus in Krankenhausbädern in 6,8 % der Badewasserproben nachweisen. Vor dem Hintergrund der Zunahme von MRSA kommt daher der einwandfreien Aufbereitung und Durchströmung des Badebeckens erhebliche Bedeutung zu. Da Kryptosporidien und Giardia nicht durch die im Badewasser zulässigen Chlorkonzentrationen abgetötet werden, kommt der Vermeidung einer fäkalen Verunreinigung durch inkontinente Badegäste neben einer guten Durchströmung ebenso Bedeutung zu.
Infektionsrisiken im Feuchtbereich: Außerhalb des Badewassers sind Fußmykosen und Plantarwarzen die häufigsten erworbenen Infektionen (Tab. 5.38 ).
Sowohl Personal als auch Patienten können durch konsequentes Tragen von Badeschuhen im gesamten Feuchtbereich das Infektionsrisiko deutlich vermindern.
Tab. 5.38.
Im Feuchtbereich übertragbare Infektionen.Trichonomas vaginalis:Infektion(en), FeuchtbereichStaphylokokken:Infektion(en), FeuchtbereichPapillomaviren, Infektion(en), FeuchtbereichMolluscum-contagiosum-Virus, Infektion(en):FeuchtbereichInfektion(en):FeuchtbereichDermatophyten, Infektion(en), Feuchtbereich
| Erreger | Krankheitsbild |
|---|---|
| Papillomaviren, Molluscum-contagiosum-Virus | Plantar-, Dellwarzen |
| Pseudomonaden, Staphylo- und Streptokokken | Lokalinfektionen, Pyodermien |
| L. pneumophila (Duschaerosol) | Legionellose, Pontiac-Fieber |
| Dermatophyten (Trichophyton, Epidermophyton spp.) | Fußmykosen |
| T. vaginalis (auf Sitzbänken) | Möglicherweise Urogenitalinfektionen (Vaginalinfektionen) |
Patienten mit offensichtlichen Dermatomykosen, Plantar- oder Dellwarzenbefall sollten bis zur Sanierung nicht balneotherapiert werden.
Die Wirksamkeit fest installierter Fußdesinfektionsmittelspender ist fraglich, weil durch die von den Füßen abgesprühten Pilze gerade in diesem Bereich die Infektionsgefahr deutlich erhöht und die für eine effektive Desinfektion erforderliche Einwirkungszeit nur selten eingehalten wird (Effendy und Schirrmeister 1985). Vielmehr sind das sorgfältige Abtrocknen insbesondere der Interdigitalräume und ggf. die Anwendung von Hautcremes präventiv wirksam. Die Verpflichtung zur täglichen Flächendesinfektion bleibt davon unberührt.
Neben Kontaminationen mit Pseudomonaden, Staphylo- und Streptokokken können auf Sitzgelegenheiten Trichomonaden eine Rolle spielen: Eine Frau mit florider Trichomonadeninfektion kann den Sitz mit Vaginalsekret kontaminieren und die Erreger an weitere Frauen oder Männer, die sich mit kontaminierten Badetüchern abtrocknen (was bei Handtuchwechsel ausgeschlossen ist), weitergeben (Krieger und Kimmig 1995).
Infektionsprävention: Für den Nassbereich muss der Hygieneplan Forderungen enthalten, deren patientenrelevanter AnteilInfektionsprävention:physikalische Therapie, Nassbereich gut sichtbar z. B. in Umkleidekabinen oder im Wartezimmer ausgelegt werden soll.
Sofern es dem Patienten möglich ist, sollte er vor Beginn balneotherapeutischer Maßnahmen auf der Krankenstation oder in der Hygieneplan:PhysiotherapieBadeabteilung duschen. Er sollte ferner auf die Verwendung hautfreundlicher Waschlotionen hingewiesen werden, da ansonsten im Verlauf einer Behandlung mit täglich 1–2 Wasseranwendungen ein Austrocknen der Haut, verbunden mit erhöhter Infektionsanfälligkeit, resultieren kann. Bis zum Betreten des Bads sind eigene Bade- oder Turnschuhe zu tragen. Von der Badeabteilung wird jedem Patienten ein eigenes Handtuch zur Verfügung gestellt; das Mitbringen der Handtücher vom Krankenzimmer ist mit dem Risiko der Erregerverschleppung verbunden.
Bei Unterwassermassage und anderen balneotherapeutischen Maßnahmen mit dem Risiko eines Eintrags von Haaren in das Therapiewasser sollen Badekappen zur Verfügung gestellt werden.
Badewannen für Unterwasserdruckmassage, hydroelektrische Therapie, Moor- oder Pelosebäder sind nach jeder Behandlung mit einem Desinfektionsreiniger zu reinigen und am Ende des Tags mit einem VAH-gelisteten Flächendesinfektionsmittel zu desinfizieren. Bei erhöhter Infektionsgefährdung (ärztliche Entscheidung) ist u. U. eine Zwischendesinfektion nach der Patientenbehandlung erforderlich; z. B. konnten wir nach Benutzung durch verhaltensgestörte Kinder eine massive Kontamination des Wassers im Therapiebecken mit gramnegativen Darmbakterien nachweisen, verursacht durch unkontrollierte nicht bemerkte Badewasserverunreinigung.
Anforderungen an die Wasserqualität von Schwimm-, Bade- und Therapiebecken: Nach Steuer (1971) gibt ein gesunder Badender nach vorherigem Duschen ca. 3 × 108 Mikroorganismen bei einem Bad Wasserqualität, Anforderungen:Schwimmbeckenins Wasser ab. Pro Badegast werden durchschnittlich 30–50 ml Urin ins Wasserqualität, Anforderungen:BadebeckenBadewasser abgegeben (Exner 1978, Tilkes 1995). In medizinischen Badeabteilungen ist zu Wasserqualität, Anforderungen:Therapiebeckenberücksichtigen, dass es insbesondere bei neurologischen Patienten zu unwillkürlichen Urin- und Kotabgängen ins Wasser kommen kann.
Gemäß § 37 IfSG muss Schwimm- oder Badebeckenwasser in öffentlichen Bädern gesundheitlich unbedenklich sein.
Die hygienisch-mikrobiologischen, physikalischen und chemischen Anforderungen sind in DIN 19643 formuliert. Es werden folgende Wasserarten unterschieden:
-
•
Füllwasser = dem öffentlichen Trinkwassersystem zur Erst- und Nachfüllung entnommenes Trinkwasser,
-
•
Beckenwasser = das Wasser im Becken,
-
•
Rohwasser = das der Aufbereitung Füllwasserzugeführte Beckenwasser,
-
•
Reinwasser = aufbereitetes Wasser nach Filtration, Zugabe von BeckenwasserDesinfektionswirkstoffen und Füllwasser vor seinem Eintritt ins Becken,
-
•
Filtrat = RohwasserWasser nach Filtration und vor Zugabe des Desinfektionsmittels.
Für Coliforme und E. coli Reinwassergelten im Badewasser die Grenzwerte wie im Trinkwasser. Zusätzlich ist für P. aeruginosa ein Grenzwert von 0/100 ml und für L. pneumophila von 100/ml vorgeschrieben. Für Reinwasser Filtratgelten für die Gesamtkoloniezahl (max. 20/ml bei 20 °C und 36 °C) und für L. pneumophila (kein Nachweis in 100 ml) höhere Anforderungen (DIN 19643).
Zu den wichtigsten Parametern mit Indikatorfunktion für die Belastung des Wassers mit organischen Verunreinigungen Tabelle 5.39 (weiterer Details siehe DIN 19643). Bei hoher organischer Belastung des Beckenwassers sinkt durch Chlorzehrung der Anteil des antimikrobiell wirksamen freien Chlors bei gleichzeitiger Zunahme der Konzentration an organischen Chlorverbindungen, die teilweise im Verdacht stehen, kanzerogen zu sein. Der Richtwert der DIN für Trihalogenmethan (gemessen als Chloroform) wird in öffentlichen Bädern häufig überschritten und kann wahrscheinlich erst nach Erweiterung der Badewasseraufbereitungsschritte Flockung, Filtration und Desinfektion um eine Oxidationsstufe und anschließende Aktivkornkohlefilterung sicher erzielt werden (Schössner und Koch 1995). Für Therapiebecken wird eine Verfahrenskombination von Ozonung und Aktivkornkohlefilterung empfohlen.
Tab. 5.39.
Physikalisch-chemische Parameter (Auswahl) des Badewassers (DIN 19643).Badewasser:physikalisch-chemische Parameter
| Parameter | Reinwasser | Beckenwasser |
|---|---|---|
| Nitratkonzentration (NO3) über der Konzentration des Füllwassers | Nicht definiert | 20 mg/l |
| Oxidierbarkeit Mn VII → Mn II über dem Wert des Füllwassers als 02 | 0 mg/l | 0,75 mg/l |
| pH-Wert | 6,5–7,6 | 6,5–7,6 |
| Freies Chlor | mindestens 0,3 mg/l | 0,3–0,6 mg/l |
| Gebundenes Chlor | maximal 0,2 mg/l | maximal 0,2 mg/l |
| Trihalogenmethan | Nicht definiert | maximal 0,02 mg/l |
Ein wichtiger Parameter für die Beantwortung der Frage, ob dem Badewasser unter Berücksichtigung der aktuellen Belastung mit organischen Verunreinigungen genügend Desinfektionsmittel zugesetzt wurde, ist die Bestimmung des Redoxpotenzials. Die Mindesthöhe ist abhängig vom Konzentrationsverhältnis des Oxidationsmittels (Chlor) zum Reduktionsmittel (Verunreinigung) und ist unter Berücksichtigung des aktuellen pH-Werts in DIN 19643 festgelegt.
Auch Wasser für Wannenbäder muss den mikrobiologischen Kriterien der DIN 19643 entsprechen. Nach jeder Patientenbehandlung ist das Wasser abzulassen und eine Reinigung und Desinfektion der Wanne vorzunehmen.
Wasseraufbereitungsanlagen mit kontinuierlichem Umlauf von Badewasser sind aus hygienischen und psychologischen Gründen abzulehnen.
Je nach Ausstattung ist das Volumen des stagnierenden Restwassers im Zulauf bzw. in der Mischbatterie der Wanne unterschiedlich groß. Da das Restwasser massiv verkeimen kann, sollte das Physiotherapiepersonal dieses Volumen kennen und (insbesondere nach Wochenenden oder Feiertagen) vor dem Einlassen des eigentlichen Badewassers ablaufen lassen.
Peloidtherapie: Da die natürlichen Ressourcen insbesondere hochwertiger Peloide begrenzt sind, wird vielerorts „abgebadeter“ Torf nach mehr als 5-jähriger Lagerung und Zusatz von Frischtorf wiederverwendet. Dagegen ist hygienisch nichts einzuwenden, da es sehr unwahrscheinlich ist, dass PeloidtherapieKrankheitserreger, die durch das Moorbad in den Torf gelangt sind, in nennenswerter Zahl über diesen Zeitraum infektiös bleiben. Allerdings müssen bei der Lagerung Schädlingsbefall und mikrobielle Besiedlung aus der Umgebung verhindert werden.
Vor dem Einsatz bereits verwendeten organischen Materials muss eine hygienisch-mikrobiologische Kontrolle erfolgen.
Soll Fango mehrfach verwendet werden, wird er nach Gebrauch gesammelt und über Nacht in einem Rührwerk bei 140 °C (trockene Heißluft) gelagert. Bei vorübergehender Nichtbenutzung kann er auch bei 50–60 °C auf Blechen aufbewahrt werden; regelmäßige (z. B. halbjährliche) Hygienekontrollen sind erforderlich (Botzenhart und Junger 1992).
Tretbecken: Tretbeckenwasser wird im Allgemeinen täglich abgelassen und nach sorgfältiger Reinigung und Desinfektion des Beckens am Folgetag frisch eingefüllt. Patienten mit Dermatomykosen oder Wundverbänden im Fuß- und Unterschenkelbereich sind für diese Therapieform wegen des Infektionsrisikos (für sie und andere) nichtTretbecken geeignet. Das Problem der Verkeimung stagnierenden Restwassers ist auch beim Auffüllen des Tretbeckens zu beachten.
Sauna: Aufgrund des Schwitzens mit Verdünnung des Säurefilms ist von erhöhter Infektionsempfänglichkeit der Haut auszugehen. Daher ist für die Sauna eine spezielle Hygieneordnung zu erarbeiten. Darin ist zu fordern, dass alle Oberflächen innerhalb und außerhalb der Saunakabine mindestens täglich desinfiziert werden. Ausstattung mit naturbelassenem Holz ist im Krankenhausbereich abzulehnen. Jeder Saunabenutzer erhält zwei Badetücher, von denen eins der Vor- und Nachreinigung dient und außerhalb der Saunakabine verbleibt, während das andere in der Saunakabine als Auflage verwendet wird. Das direkte Sitzen oder Liegen auf Saunarosten ist abzulehnen. Das Saunatauchbecken wird täglich geleert und vor Neufüllung gereinigt; pro Besucher werden mindestens 60 l Frischwasser zugesetzt. Das Beckenwasser wird laufend desinfiziert, eine Aufbereitung, wie sie für das Wasser von Badebecken vorgeschrieben wird, ist nicht erforderlich (DIN 19643).
5.23.3. Therapiemaßnahmen auf Krankenstationen
Bei Tätigkeit des Personals der physikalische Therapie:KrankenstationenPhysiotherapie in anderen Abteilungen ist die Hygieneordnung der jeweiligen Abteilung einzuhalten.
Dazu gehören die hygienische Händedesinfektion vor und nach jedem Patientenkontakt sowie ggf. das Tragen von Schutzkleidung, die vor der Rückkehr in die physikalische Therapie:Nassbereich\"\r\"PhystheraNassPhysiotherapie-Abteilung abgelegt wird. Handelt es sich um infektiologische Risikobereiche, müssen mitgeführte Therapiemittel möglichst noch im Risikobereich desinfiziert werden. Andernfalls ist der Transport in geeigneter Schutzverpackung vorzunehmen und die Desinfektion vor der Weiterverwendung in der Physiotherapie zu gewährleisten.
Die z. T. beobachtete Praxis, dass Personal der Physiotherapie-Abteilung in sportlich geschnittener Bereichskleidung Patienten auf Normalstationen, die aufgrund einer chronisch-obstruktiven Lungenerkrankung oder Pneumonie der Inhalations- und Atemtherapie bedürfen, behandelt und dabei nicht nur mit dem infektiösen Aerosol, sondern auch mit dem Bett in Kontakt kommt, ist mit erhöhtem Übertragungsrisiko verbunden.
5.23.4. Qualitätssicherung
Für die Physiotherapie-Abteilung ist ein Hygieneplan zu erstellen (Steuer et al. 1999). Wenn auch eine separate Infektionserfassung nicht möglich ist, sollte dennoch versucht werden, durch Informationsaustausch zwischen Patienten, Stationsärzten, Pflegepersonal und Physiotherapie-Abteilung etwaige Physiotherapie:QualitätssicherungZusammenhänge zwischen physiotherapeutischen Maßnahmen und dem Entstehen von NI rechtzeitig zu erkennen.
Es sind folgende Kontrolluntersuchungen durchzuführen bzw. zu empfehlen: Rein- und Beckenwasser monatlich physikalisch-chemisch und mikrobiologisch (DIN 19643 und DIN 38402), Duschen, Inhaliergerät (Abstriche vom Mundstück, Überprüfung des Inhalts) und Druckluft halbjährlich.
Einmal jährlich empfiehlt sich die Begehung der Abteilung durch den Hygienebeauftragten (Arzt) gemeinsam mit dem Krankenhaushygieniker und der HFK.Physiotherapie\"\r\"Physiother
5.24. Zahnarztpraxis
Wolfgang Sümnig, Holger Donath, Axel Kramer und Rajko Lippert
Zur Spezifizierung der Hygieneanforderungen in der Zahnmedizin wird seit 1989 vom Deutschen Arbeitskreis für Hygiene in der Zahnmedizin (DAHZ) der Hygieneleitfaden erarbeitet. Er hat die gesetzlichen Anforderungen und die Empfehlungen insbesondere der KRINKO zur Grundlage, unterliegt ständiger Aktualisierung und berücksichtigt darüber hinaus die neuesten wissenschaftlichen Erkenntnisse.
Der Leitfaden bietet eine praxisbezogene Hilfe für das Zahnarztteam. Die letzte Aktualisierung erfolgte 2010.
1998 wurde erstmals von der KRINKO die Empfehlung zu den Anforderungen an die Hygiene in der Zahnmedizin verfasst und 2006 aktualisiert. Weitere Empfehlungen der KRINKO mit besonderer Relevanz für die Zahnarztpraxis sind Anforderungen der Hygiene beim ambulanten Operieren (1997), Händehygiene (2000), Anforderungen der Hygiene bei Operationen und anderen invasiven Eingriffe (2000), Anforderungen an die Hygiene bei der Aufbereitung von Medizinprodukten (2001), Abschlussbericht der Task Force vCJK (RKI 2002), Anforderung an die Hygiene bei der Reinigung und Desinfektion von Flächen (2004), Empfehlungen zur Prävention postoperativer Infektionen im Operationsgebiet (2007), Anforderung der Krankenhaushygiene und des Arbeitsschutzes an die Hygienebekleidung und persönliche Schutzausrüstung (2007) sowie Anforderungen an die Hygiene bei der medizinischen Versorgung von immunsupprimierten Patienten (2010). Unabhängig davon sind die sich durch das IfSG ergebenden Verpflichtungen (z. B. Hygieneplan, Meldepflicht), die Forderungen des MPG (Kap. 2.9), des Arbeitsschutzgesetzes, der Gefahrstoff-VO, der Biostoff-VO (Kap. 5.29), der Trinkwasser-VO (Kap. 6.6) und der Regeln der Berufsgenossenschaft BGW (Kap. 5.29) einzuhalten.
Beim Vergleich des Hygienestatus in deutschen Zahnarztpraxen 2002/2003 mit 2009 ergab sich eine erhebliche Verbesserung der Realisierung der Infektionsprävention und der Ausstattung mit Hygienetechnik (Kramer et al. 2008, Meyer und Jatzwauk 2010). Diese positive Entwicklung dürfte maßgeblich auf die Empfehlungen der KRINKO und die Anstrengungen der Zahnärztekammern zurückzuführen sein. Ein prägnantes Beispiel dafür ist der „Leitfaden für die Organisation der Hygienemaßnahmen in der zahnärztlichen Praxis“ der Zahnärztekammer Mecklenburg-Vorpommern (2007), der die Rahmenbedingungen und die Organisation der Hygienemaßnahmen detailliert aufführt und als Hilfsmittel Formulare, Arbeitsanweisungen, Hygieneplan, Adressen und Checklisten zur Verfügung stellt. Trotzdem wurde deutlich, dass in bestimmten Bereichen nach wie vor Optimierungspotenzial besteht (Kramer und Ryll 2010).
5.24.1. Infektionsgefahren, Erregerreservoire und Übertragungswege
Hygienemaßnahmen sind zum Schutz von Patienten und Mitarbeitern integraler Bestandteil des einrichtungsinternen Qualitätsmanagements (QM) innerhalb der vertragszahnärztlichen Versorgung (Richtlinie des Gemeinsamen Bundesausschusses [GBA] 2006).
In der Zahnmedizin sind durch Kontakt des Behandlungsteams und der Instrumente mit der residenten Flora der Mundhöhle des Patienten Infektionsgefahren gegeben. Dadurch stellt auch der gesunde Patient eine Infektionsquelle dar, zusätzlich zu ggf. systemischen Erkrankungen und Behandlungen mit Durchtrennung der Schleimhautbarriere bzw. dem Kontakt mit Blut. Weitere Besonderheiten sind die z. T. aufwändig zu Zahnarztpraxis:Infektionsgefahrendekontaminierenden zahnärztlichen MP und die Aerosolbildung während der Behandlung unter Verwirbelung der Mikroflora des Patienten mit der Atemluft des Praxisteams und des Sprühnebels der gekühlten Übertragungsinstrumente (Barben et al 2009, Cristina et al. 2009).
Das räumliche Ausmaß der Aerosolwolke variiert in Abhängigkeit von der behandelten Mundregion und breitet sich konzentriert etwa 80 cm vor und seitlich vom Patientenmund mit einer Reichweite von bis zu 1,5 m aus (Hilger 1998, Sümnig et al. 2001). Zur Aerosolbildung kommt es auch bei Verwendung von Pulver-Wasserstrahl- und Ultraschallgeräten zur Zahnsteinentfernung. Die im Aerosol befindlichen Mikroorganismen können abhängig von Partikel- oder Tröpfchengröße bis zu mehreren Stunden in der Raumluft schweben (Pitten et al. 2001). Durch Absaugtechnik lässt sich die Erregerbelastung deutlich reduzieren (Hilger 2007). Durch das Aerosol, aber auch durch direkten Kontakt, können z. B. Behandlungseinheit und Mobiliar kontaminiert werden, sodass bei nicht durchgeführter Desinfektion von hier aus eine Rekontamination möglich ist.
Als Infektionsquellen kommen schließlich auch der Zahnarzt und sein Team in Betracht.
Folgende Übertragungswege sind von Bedeutung:
-
•
direkte Übertragung Patient zu Personal, Personal zu Patient via Blut, Speichel u. a. potenziell infektiöse Sekrete,
-
•
indirekte Übertragung z. B. über kontaminierte MP, Abformungen, herausnehmbare zahnmedizinische Versorgungen bzw. Zahnarztpraxis:ÜbertragungswegeWerkstücke, durch Aerosolbildung von kontaminiertem Wasser aus der Dentaleinheit (Kumar et al. 2010), über Abfälle und über Kontaktflächen.
Zu den durch Blut übertragbaren Erregern zählen vor allem HBV, HCV und HIV (Younai 2010). Überwiegend durch direkten und indirekten Kontakt werden z. B. HSV, Staphylokokken, Streptokokken, M. tuberculosis, Pseudomonaden, Legionellen und respiratorische Viren übertragen (Heim 2003, Cleveland et al. 2009, Feller et al. 2009). Maßnahmen zum Infektionsschutz nehmen in der zahnärztlichen Praxis daher einen hohen Stellenwert ein (Kramer et al. 2008). Die dabei entstehenden Sach- und Personalkosten haben sich in den letzten Jahren deutlich erhöht (Meyer und Buthz 1998, Nowak et al. 2008).
Während die Infektionsrisiken in der Zahnarztpraxis bekannt sind, trifft das für die Abschätzung des Erkrankungsrisikos nicht zu, da epidemiologische Studien zu Übertragungshäufigkeiten und zum Erfolg infektionspräventiver Maßnahmen selten sind (Podbielski 2007).
5.24.2. Infektionspräventive Maßnahmen
Anamnese
Durch eine gezielte und regelmäßig aktualisierte Anamnese können Infektionsrisiken vor der zahnärztlichen Behandlung erfasst und dadurch die organisatorischen und die schutznotwendigen Maßnahmen für die Behandlung getroffen werden.
Schwerpunkte sind Fragen zu
-
•
infektiösem Status, z. B. MRSA, HAV, Virushepatitis, HIV, Tbk, Diarrhö, sonstige Infektionskrankheiten, Oberbauchbeschwerden, Inappetenz, Erbrechen, Obstipation,
-
•
bestehenden Erkrankungen, z. B. Exantheme (Masern, Röteln, Ringelröteln), Ikterus, chronischer Husten, Nachtschweiß (Hinweis auf Tbk, Legionärskrankheit, Pertussis),
-
•
Medikamenteneinnahme einschließlich Schmerz- und Schlafmitteln (Hinweis auf Hepatitis),
-
•
Intoleranzen und Allergien (z. B. Alkohol, Latex, Antibiotika),
-
•
Ulzera und Erosionen/Beläge in Mundhöhle und Vestibulum nasi (Candida, HSV, A-Streptokokken, Haarzunge, Diphtherie, HPV, VZV),
-
•
Abklärung des CJD-Risikos,
-
•
Piercings, Tatoos, die kürzlich durchgeführt wurden,
-
•
Immunsuppression, Versorgung mit Endoprothesen (Kap. 4.9), Endokarditisrisiko.
Patienten, deren Anamnese auf ein erhöhtes Infektionsrisiko für Personal und andere Patienten schließen lässt, sollten – abgesehen von Notfällen – so einbestellt werden, dass eine umfangreiche Desinfektion und ggf. Sterilisation von Instrumenten unmittelbar im Anschluss an die Behandlung erfolgen kann, ohne den organisatorischen Ablauf der Praxis zu stören.
Mundhöhlenantiseptik und Antibiotikaprophylaxe
Zahnreinigung und Schleimhautantiseptik führen zu einer signifikanten Reduktion der Mikroflora im Speichel und auf der Schleimhaut. Dadurch wird auch die mikrobielle Konzentration im Aerosol vermindert. Deshalb empfiehlt die KRINKO (2006) die Schleimhautantiseptik vor der zahnärztlich-chirurgischen/oralchirurgischen Behandlung bei Patienten mit erhöhtem Infektionsrisiko und bei allen zahnärztlich-chirurgischen Eingriffen mit nachfolgendem speicheldichtem Wundverschluss.
Aus der grundsätzlichen Überlegung der höheren Sicherheit empfiehlt sich die Antiseptik vor Parodontal- und endodontischen Behandlungen, vor Zahnextraktionen u. a. oralchirurgischen Eingriffen, obwohl die epidemiologische Evidenz noch unklar ist. Eine Übersicht über MundhöhlenantiseptikWirkstoffe und Präparate liefert das Dental Vademekum (2009). Bevorzugt werden als antiseptische Wirkstoffe in der Mundhöhle Octenidin, Chlorhexidin, Polihexanid, etherische Öle und Cetylpyridiniumchlorid eingesetzt (Kap. 2.2).
Vor intraoraler Injektion wird die Antiseptik im Injektionsbereich mit einem Schleimhautantiseptikum bzw. Oberflächenanästhetikum mit nachgewiesener antiseptischer Wirksamkeit befürwortet (Pitten et al. 2001).
Eine weitere Indikation ist die Reduktion der Bakteriämierate bei zahnärztlichen Eingriffen, auch wenn die klinische Bedeutung dieser Bakteriämien kontrovers diskutiert wird (Pitten et al 2001). Für die Kombination eines Phenolderivats mit ätherischen Ölen und Ethanol ist die Senkung der Postextraktionsbakteriämierate belegt (Fine et al. 1996).
Bei Patienten mit Endokarditisrisiko wird eine effiziente Mundhöhlenantiseptik in Verbindung mit einer Antibiotikaprophylaxe als sinnvoll angesehen (Pitten et al 2001).
Die Schleimhautantiseptik ersetzt nicht die ggf. indizierte Antibiotikaprophylaxe:ZahnarztpraxisAntibiotikaprophylaxe (KRINKO 2006, Naber et al. 2007, Nkenke 2007). Die Deutsche Gesellschaft für Zahn-, Mund- und Kieferheilkunde betrachtet die antibiotische Prophylaxe in der zahnärztlichen Implantologie, bei Augmentationen und bei orthognather Chirurgie als indiziert (Nkenke 2007, www.dgzmk.de, Kap. 2.10.8).
Zahnärztliche Behandlungen konnten nicht als Risikofaktor einer implantierten Hüft- oder Knieendoprothese identifiziert werden, sodass bei diesen Patienten keine Antibiotikaprophylaxe vor zahnärztlichen Behandlungen indiziert ist (Berbari et al. 2010).
Grundsatz der Nonkontamination, Händehygiene und Personalschutz
Nonkontamination: Durch gezieltes Verhalten soll bei der Behandlung die Kontaminationsgefahr reduziert werden. Dazu gehören das Tragen persönlicher Schutzausrüstung (Hand schuhe, Mund-Nasen-Schutz, Schutzbrille, Kopfbedeckung) sowie ggf. Schutz- über der Berufskleidung und die Anwendung weiterer NonkontaminationBarrieremaßnahmen, z. B. Kofferdam, Verwendung von Instrumenten bei intraoralen Tätigkeiten anstelle der Hände, Schutz von Instrumenten durch abgedeckte Lagerung oder in Behältnissen/Schränken, Abdeckung nicht benötigter oder schwierig desinfizierbarer Flächen und die räumliche Trennung der direkten zahnärztlichen Behandlung von anderen Arbeitsbereichen. Des Weiteren sind eine effektive Absaugtechnik und die unfallsichere Entsorgung von Abfall erforderlich.
Händehygiene: Die Händehygiene gehört zu den wichtigsten Maßnahmen der Infektionsprävention (Kap. 2.1). Für die Händewaschung sind verträgliche flüssige Seifen auszuwählen. Hautschutz und -pflege sind im Hautschutzplan festzulegen, der auch als Bestandteil des Hygieneplans geführt werden kann. Händehygiene:ZahnarztpraxisWasserhähne müssen ohne Handberührung bedienbar sein. Es sind ausschließlich Handtücher (Textil oder Papier) zum Einmalgebrauch zu verwenden.
Die Hände werden vor Arbeitsbeginn, bei Verschmutzung, nach Toilettenbenutzung, vor Essenpausen und bei Arbeitsende gewaschen. Die hygienische Händedesinfektion ist vor jeder Behandlung, bei Handschuhwechsel und nach Behandlungsende erforderlich. Die chirurgische Händedesinfektion wird vor zahnärztlich-chirurgischen Eingriffen durchgeführt.
Schutzhandschuhe: Als Schutz vor Kontamination müssen bei der zahnärztlichen Behandlung generell keimarme medizinische Schutzhandschuhe getragen werden. Diese sind i. d. R. nach jedem Patienten zu wechseln, ebenso beim Wechseln der Tätigkeit oder beim Verlassen des Behandlungszimmers. Ist sicher davonSchutzhandschuhe:Zahnarztpraxis auszugehen, dass die Integrität des Handschuhs erhalten geblieben ist, kann auf den Wechsel unter der Voraussetzung der Durchführung der Desinfektion der behandschuhten Hand mit einem viroziden Händedesinfektionsmittel und der gutachterlich bestätigten Desinfizierbarkeit des Handschuhtyps verzichtet werden (Pitten und Kramer 2001). Es sind ferner Handschuhe zu tragen, wenn mit Körperflüssigkeiten oder Sekreten kontaminierte Oberflächen berührt werden.
Bei Entsorgungs- und Reinigungsarbeiten müssen Schutzhandschuhe getragen werden, die gegen die verwendeten Reinigungsmittel beständig sind.
Für zahnärztlich-chirurgische Eingriffe mit nachfolgendem speicheldichtem Wundverschluss sind sterile Handschuhe zu tragen. Für die Zahnextraktion ist kein Unterschied in der SSI-Rate in Abhängigkeit davon belegt, ob keimarme oder sterile Handschuhe getragen wurden (Cheung et al. 2001). Da die Materialqualität steriler Handschuhe besser ist (z. B. geringere Perforation), minimiert ihre Verwendung das Übertragungsrisiko von Mikroorganismen der Hände ins Wundgebiet und ebenso eine Kontamination der Haut der Behandler mit Blut oder Körperflüssigkeiten des Patienten.
Mund-Nasen- und Augenschutz: Außer bei operativen Eingriffen wird der Mund-Nasen-Schutz vornehmlich zum Selbstschutz des zahnärztlichen Personals vor Kontamination getragen. Er muss mehrlagig, der Nase z. B. durch Metallstreifen Mund-Nasen-Schutz:Zahnarztpraxisanformbar sein und so angelegt werden, dass er an allen Rändern der Haut dicht Augenschutz, Zahnarztpraxisanliegt. Einmal vom Gesicht abgezogen, wird er verworfen. Ein Herunter- und wieder Hochstreifen des Mund-Nasen-Schutzes unterläuft jede Schutzwirkung, die der Mund-Nasen-Schutz vor dieser Aktion hatte.
Der Augenschutz soll die Augen auch seitlich abdecken und außerdem vor Augenverletzungen schützen, z. B. durch hochtourig entfernte Restaurationen und Füllungen. Er ist nach sichtbarer Kontamination und zumindest täglich zu reinigen und zu desinfizieren.
Schutzkleidung: Eine zumindest die Körpervorderseite bedeckende Schutzkleidung soll über der Berufskleidung getragen werden, wenn die Berufsbekleidung bei der Behandlung kontaminiert werden kann. Bei umfangreichen chirurgischen Behandlungen soll eine das gesamte Kopfhaar abdeckende Schutzkleidung:ZahnarztpraxisKopfbedeckung getragen werden. Der Patient soll zum Schutz seiner Bekleidung vor Verschmutzung und Kontamination einen Patientenumhang tragen. Empfohlen sind Einmalumhänge (DAHZ 2010). Die Freizeitbekleidung des Personals darf in der Umkleide nicht zusammen mit der Berufsbekleidung gelagert werden, um einen Erregertransfer zu verhindern.
Impfprophylaxe:
Die Impfprophylaxe:ZahnarztpraxisMitarbeiter sind über die für sie infrage kommenden Impfungen insbesondere bei Neueinstellung aufzuklären und bestätigen die Aufklärung sowie ihr Einverständnis mit bzw. ggf. ihre Ablehnung der jeweiligen Impfung durch Unterschrift (Kap. 2.12).
Alle Angehörigen einer Zahnarztpraxis sollten die Impfungen nach den Empfehlungen der STIKO und § 15(4) BioStoffV und § 3(1) ArbSchG in Anspruch nehmen und dahingehend motiviert werden. Der Erfolg der Grundimmunisierung gegen Hepatitis B ist zu überprüfen. Trotz der Tatsache, dass Schutzimpfungen für Mitarbeiter mit direktem Patientenkontakt kostenfrei, gut verträglich und einfach umzusetzen sind sowie zu den bedeutsamsten und zugleich einfachsten Maßnahmen der Prävention zählen, werden die Empfehlungen der StIKO nur unzureichend eingehalten. Das betrifft vor allem Impfungen gegen die klassischen Kinderkrankheiten und die Virusgrippe.
Arbeitsmedizinische Vorsorgeuntersuchungen:
Bei Vorsorgeuntersuchung(en), arbeitsmedizinische:ZahnarztpraxisAufnahme (Erstuntersuchung gem. § 4 BGV A4) der beruflichen Tätigkeit in einer Zahnarztpraxis, in regelmäßigen Abständen und am Ende der Tätigkeit sind arbeitsmedizinische Vorsorgeuntersuchungen durchzuführen (BGV A4, Stand 2007).
Beschäftigungsbeschränkungen: Gemäß Mutterschutzgesetz dürfen werdende oder stillende Mütter nicht mit Arbeiten beschäftigt werden, bei denen sie Gesundheits- oder erhöhten Unfallgefahren ausgesetzt sind (Kap. 5.29).
Da Übertragungen von HBV und HIV durch Zahnärzte auf Patienten bekannt wurden, ist insbesondere bei HBV-, HCV- und HIV-Infizierten zu prüfen, ob die Tätigkeit weiter ausgeübt werden darf (KRINKO 2006, Williams 2009).
Vor der Entscheidung, ob ein Virusträger Einschränkungen seinerBeschäftigungseinschränkungen:Zahnarztpraxis beruflichen Tätigkeit hinnehmen muss, soll ein Expertengremium gehört werden. Zum Schutz von Patienten und ihres Umfelds sind ggf. Untersuchungen zur Rückverfolgung bei Patienten zu veranlassen, die von Virusträgern behandelt wurden (KRINKO 2006).
Folgende Überlegungen helfen bei der Beurteilung der Übertragungsgefahr (KRINKO 2006):
-
•
Akut erkrankte Zahnärzte und Teammitglieder sollen keine Patienten behandeln. Ausnahmen sind – nach Abwägung der Umstände – Infektionen, bei denen der Betreffende arbeitsfähig ist und durch Schutzmaßnahmen das Übertragungsrisiko minimiert werden kann.
-
•
Informationen zu den wichtigsten Infektionskrankheiten enthalten die Ratgeber/Merkblätter des RKI (www.rki.de → Infektionskrankheiten A–Z). Auch Gesundheitsämter geben Auskunft. Die Beurteilung, ob die Beschäftigung im Rahmen der bisherigen Tätigkeit auch während einer Erkrankung weiterhin möglich ist oder ggf. Beschäftigungsbeschränkungen einzuhalten sind, obliegt im Zweifelsfall dem behandelnden Arzt oder Betriebsarzt.
-
•
Gemäß § 31 IfSG kann die zuständige Behörde die Berufsausübung ganz oder teilweise untersagen, wenn die Gefahr der Weiterverbreitung von Infektionserregern besteht.
Aufbereitung von Medizinprodukten
Der Praxisinhaber muss die Zuständigkeiten und Verantwortlichkeiten für die Aufbereitung einschließlich Instandhaltung und Freigabe der aufbereiteten MP unter Berücksichtigung der Mitarbeiterqualifikation namentlich festlegen. Verantwortlich für den Infektionsschutz ist eine Person mit zahnärztlicher Approbation, auch wenn einzelne Hygienemaßnahmen an Mitarbeiter delegiert werden können (DAHZ 2010).
Mit der Aufbereitung dürfen nur Mitarbeiter betraut werden, die aufgrund ihrer Ausbildung und Tätigkeit über die notwendige Sachkenntnis verfügen. Das ist im Allgemeinen bei Zahnmedizinischen Fachangestellten (ZFA), Zahnarzthelferinnen und Stomatologischen Schwestern der Fall. Diese in § 4 MPBetreibV geforderte Sachkenntnis muss durch kontinuierliche Fortbildung untermauert sein.
Mitarbeiter ohne abgeschlossene Ausbildung zur ZFA, Zahnarzthelferin oder Stomatologischen Schwester dürfen nicht mit der Aufbereitung und Freigabe von MP ab kritisch B betraut werden (DAHZ 2010), es sei denn, die Sachkunde kann in geeigneter Form nachgewiesen werden, z. B. durch den Erwerb der Sachkunde zur Aufbereitung von MP (Kap. 8.7).
Das für die Aufbereitung ausgewählte Personal muss vom Praxisinhaber in seinen Verantwortungsbereich eingewiesen werden. Es ist zu beachten, dass veränderte Arbeitsbedingungen, neue Verfahren und wissenschaftliche Erkenntnisse sowie die Einführung neuer MP die ständige Anpassung der Kenntnisse und Fähigkeiten des Personals erforderlich machen.
Alle Unterweisungen sind schriftlich zu dokumentieren.
Einstufung und Aufbereitung entsprechend der Einstufung
Für die Einstufung der MP (Tab. 5.40 ) in unkritische, semikritische und kritische MP, die Festlegung der Art und die Durchführung der Aufbereitung ist der Betreiber unter Berücksichtigung der Herstellerangaben verantwortlich (Kap. 2.9).
Tab. 5.40.
Einstufung und Aufbereitung von MP in der Zahnarztpraxis.
| Einstufung | Beschreibung | Reinigung/Desinfektion | Aufbereitungsverfahren |
|---|---|---|---|
| Unkritisch | Kontakt nur mit intakter Haut | X | Manuell nach SOP möglichEmpfohlen: maschinell – thermisch (RDG) |
| Semikritisch A | MP im Kontakt mit Schleimhaut oder krankhaft veränderter Haut für nichtinvasive, allgemeine, präventive, restaurative oder kieferorthopädische Maßnahmen | XVorreinigungoptional | Manuell nach SOP, abschließend Dampfdesinfektion möglichEmpfohlen: validierbares Verfahren maschinell – thermisch (RDG) |
| Semikritisch B | Rotierende oder oszillierende MP und deren Übertragungsinstrumente mit Kontakt zu Schleimhaut oder krankhaft veränderter Haut für nichtinvasive, allgemeine, präventive, restaurative oder kieferorthopädische Maßnahmen | XVorreinigung unmittelbar nach Anwendung | Manuell nach SOP, bei manueller Aufbereitung abschließende Dampfdesinfektion erforderlich (unverpackt im Dampfsterilisator)Empfohlen: validierbares Verfahren maschinell – thermisch (RDG) |
| Kritisch A | MP für invasive, die Haut oder Schleimhaut durchdringende chirurgische, parodontologische oder endodontische Maßnahmen | XVorreinigung optional | Manuell nach SOP möglichEmpfohlen: validierbares Verfahren maschinell – thermisch (RDG),anschließend Dampfsterilisation im verpackten Zustand (Sterilisationszyklus N ausreichend) |
| Kritisch B | Rotierende oder oszillierende MP und deren Übertragungsinstrumente, für die Haut oder Schleimhaut durchdringende chirurgische, parodontologische oder endodontische Maßnahmen | XVorreinigung unmittelbar nach Anwendung | Manuell nach SOP möglichEmpfohlen: validierbares Verfahren maschinell – thermisch (RDG),anschließend Sterilisation im verpackten Zustand (Sterilisationszyklus B, Sterilisationszyklus S unter Berücksichtigung von Herstellerangaben möglich) |
| Kritisch C | MP, die zum Einsatz bei der Behandlung von Patienten mit Verdacht auf bzw. klinischer Erkrankung übertragbarer spongiformer Enzephalopathie kommen oder MP zur Anwendung von Blut, Blutprodukten und anderen sterilen Arzneimitteln und MP | XVorreinigung unmittelbar nach Anwendung | Aufbereitung nur in Einrichtungen mit extern zertifiziertem QM nach DIN ISO 13485 und13488 (i. d. R. nicht in der Zahnarztpraxis) |
(mod. nach KRINKO 2006)
MP, die nur mit intakter Haut in Berührung kommen (Messinstrumente, äußere Teile des Gesichtsbogens, Kofferdamzange und dergleichen) werden als unkritisch eingestuft.
In der Regel sind zahnärztliche MP, die mit Schleimhaut oder krankhaft veränderter Haut in Berührung kommen können, für nichtinvasive allgemeine, präventive, restaurative oder kieferorthopädische Maßnahmen (Kap. 5.25) als semikritisch A einzustufen, rotierende oder oszillierende MP und deren Übertragungsinstrumente für diese Behandlungen als semikritisch B mit erhöhten Anforderungen an die Aufbereitung.
MP für invasive, die Haut oder Schleimhaut durchdringende chirurgische, parodontologische oder endodontische Maßnahmen sind als kritisch A, rotierende oder oszillierende Instrumente für diese Bestimmung und deren Übertragungsinstrumente als MP kritisch B mit erhöhten Anforderungen an die Aufbereitung einzustufen.
MP, die zum Einsatz bei der Behandlung von Patienten mit Verdacht oder klinischer Erkrankung auf übertragbare spongiforme Enzephalopathie (TSE) kommen, oder MP zur Anwendung von Blut, Blutprodukten und anderen sterilen Arzneimitteln oder MP werden als kritisch C eingestuft und stellen besonders hohe Anforderungen an die Aufbereitung. Patienten mit Verdacht auf oder Erkrankung an TSE sollten in Spezialeinrichtungen behandelt werden, die über die erforderliche Sterilisationsausrüstung und ein extern zertifiziertes QM (DIN ISO 13485 und 13488) verfügen. Ist das nicht möglich, sollte auf Einwegprodukte zurückgegriffen werden. Zur differenzierten Bewertung zahnärztlicher MP-Gruppen mit Hinweisen zur Aufbereitung siehe DAHZ (2010).
Für Reinigung, Desinfektion, Spülung und Trocknung der MP sind manuelle und maschinelle Verfahren zugelassen. Aus Gründen der besseren Standardisierbarkeit und des Arbeitsschutzes sind validierte maschinelle Verfahren zu bevorzugen (KRINKO 2006). Nach dem Programmschritt der Vorreinigung im RDG ist die alkalische Reinigung mit pH > 11 durch Einsatz eines alkalischen Reinigers – möglichst mit automatischer Dosierung – bzw. einer alkalisierenden Tablette zu gewährleisten.
Voraussetzung für die manuelle Aufbereitung ist die Festlegung der Aufbereitung in einer SOP mit zugelassenen, auf das MP abgestimmte Mittel und Verfahren unter Einhaltung des Arbeitsschutzes (KRINKO 2006).
In der SOP zur manuellen Aufbereitung sind folgende Teilschritte festzulegen (KRINKO 2006):
-
•
kontaminationsgeschützter Transport vom Behandlungs- zum Aufbereitungsbereich,
-
•
Entfernung grober organischer Verschmutzungen,
-
•
Auseinandernehmen zerlegbarer Instrumente unter Beachtung des Arbeitsschutzes,
-
•
sofortiges blasenfreies Einlegen zunächst in Reinigungslösung oder reinigende Desinfektionslösung, ggf. im Ultraschallbad, danach in nicht fixierende Desinfektionsmittellösung, die das Instrument innen und außen vollständig benetzen und bedecken muss (Herstellerangaben zur Materialverträglichkeit beachten), nach Ablauf der Einwirkzeit Schlussspülung mit geeignetem Wasser (Kap. 6.6) und Trocknung,
-
•
Prüfung auf Sauberkeit und Unversehrtheit, Pflege, Instandsetzung, Funktionsprüfung,
-
•
danach bei MP semikritisch B abschließende thermische Desinfektion im Dampfsterilisator und, falls erforderlich, Kennzeichnung der Anzahl der Aufbereitungen,
-
•
dokumentierte Freigabe zur Anwendung bzw. zur staubgeschützten Lagerung (keimarme MP) oder Verpackung, Kennzeichnung und Sterilisation, Freigabe zur Anwendung bzw. zur staubgeschützten Lagerung der verpackten MP (sterile MP).
Zwar wird die fehlende Lumenaufbereitung bei manueller Aufbereitung durch die abschließende Dampfsterilisation im unverpackten Zustand kompensiert, aber bezüglich der Prionensicherheit ist die Aufbereitung im Kombinationsautoklaven mittels Reinigung mit lauwarmem alkalinisiertem strömendem Wasser und nachfolgender Dampfdesinfektion bzw. -sterilisation oder im Thermodesinfektor die Methode der Wahl.
Unkritische MP werden vorzugsweise der maschinellen Reinigung und Desinfektion im RDG unterzogen. Möglich ist auch ein manuelles Vorgehen nach SOP.
Semikritische MP Medizinprodukteaufbereitung:unkritische Medizinprodukte, Zahnarztpraxiswerden vorzugsweise der maschinellen Reinigung und Medizinprodukteaufbereitung:semikritische Medizinprodukte, ZahnarztpraxisDesinfektion in einem RDG unterzogen. Ist das nicht im validierten Verfahren möglich, hat daraufhin eine thermische Behandlung (Desinfektion) im unverpackten Zustand im Dampfsterilisator zu erfolgen.
MP kritisch A und B sind nach der Reinigung und Desinfektion im verpackten Zustand im Medizinprodukteaufbereitung:kritische Medizinprodukte, ZahnarztpraxisDampfsterilisator zu sterilisieren. Als Verpackung kommen Dentalkassetten, Sterilisierbehälter, Sterilisationspapier oder versiegelbare Klarsichtbeutel aus Kunststofffolie/Papier in Betracht (DAHZ 2010).
Diese Vorgehensweisen treffen auch für die abnehmbaren Teile von Apparaturen zu. Das Hauptgerät wird einer manuellen Reinigung und Wischdesinfektion unterzogen.
Bei Neuanschaffung sind Dampfsterilisator:ZahnarztpraxisDampfsterilisatoren auszuwählen, die die sichere Innensterilisation von Hohlkörpern gewährleisten und eine automatische Kontrolle und ggf. auch automatische Dokumentation ermöglichen. Dampf-Kleinsterilisatoren mit Sterilisationszyklus B (für verpacktes massives sowie hohles oder poröses Sterilisiergut) erfüllen dieses Anforderungsprofil.
Bei Dampf-Kleinsterilisatoren mit Sterilisationszyklus S muss die schriftliche Bestätigung des Herstellers über das individuell geforderte Leistungsspektrum eingeholt werden. Dampf-Kleinsterilisatoren mit Sterilisationszyklus N sind nur für feste, massive MP in unverpacktem Zustand geeignet (Kap. 2.8).
Zur Verhinderung der Übertragung von Creutzfeldt-Jakob-Krankheit:ZahnarztpraxisvCJD bzw. CJD muss der Zahnarzt vor jedem elektiven Eingriff beurteilen, ob ein Risiko für eine vCJD/CJD erkennbar ist (typische klinische Kriterien sind fortschreitende Demenz und Myoklonien).
Bei Verdacht auf Vorliegen einer vCJD oder erhöhtem familiärem Risiko, eine CJD zu haben oder zu entwickeln, ist die spezielle Aufbereitung Voraussetzung für die Wiederverwendung der MP, die als kritisch C eingestuft sind (DAHZ 2010).
Sofern MP mit Bestandteilen des Zentralnervensystems in Kontakt kommen (Wurzelkanalinstrumente), liegt der Schwerpunkt bei der Medizinprodukteaufbereitung:Medizinprodukte, kritisch C, ZahnarztpraxisAufbereitung potenziell mit Prionen belasteter Instrumente in der dem Sterilisationsprozess vorangehenden Aufbereitung mit der Zielsetzung der möglichst weitgehenden Entfernung von am Aufbereitungsgut anhaftenden Eiweißresten.
Für die Aufbereitung gelten folgende Prinzipien (Simon und Pauli 1998, Task Force 2002, Kap. 3.3):
-
•
Unmittelbar nach Gebrauch erfolgt eine nicht fixierende Vorspülung; die Verwendung fixierender Substanzen in der Vorreinigung (Aldehyde, Alkohole) erschwert die anschließende Dekontamination und ist daher obsolet.
-
•
Am effektivsten zur Eiweißentfernung ist nach der Vorspülung im zweiten Schritt die alkalische Vorreinigung im RDG bei pH-Wert > 11. Danach muss neutralisiert werden. Bei Verwendung von Bohrerbädern entfällt die Neutralisierung.
-
•
Ab (ursprünglicher) Risikokategorie semikritisch B soll die Aufbereitung im RDG ggf. nach Ultraschallvorreinigung erfolgen.
Für kritische MP erfolgt im letzten Schritt die Dampfsterilisation bevorzugt bei 134 °C für mindestens 5 Minuten.
Aufbereitung spezieller zahnärztlicher MP
Übertragungsinstrumente: Nach dem Einsatz sind Hand- und Winkelstücke sowie Turbinen außen und innen als mikrobiell kontaminiert zu betrachten (Chin et al. 2009). Trotz technischer Sicherheitsvorkehrungen ist eine Innenkontamination der Mikromotoren und Turbinenkupplungen nicht zu Übertragungsinstrumente, Aufbereitungvermeiden (DAHZ 2006). Bei unwirksamer Wasserdekontamination in der Behandlungseinheit kann die Kontamination zusätzlich aus dem Kühlwasser der Behandlungseinheit selbst stammen (Barben et al 2009).
Nur die Aufbereitung nach jeder Behandlung sorgt für hinreichende Sicherheit, dass in das Innere gelangte Pathogene abgetötet werden und damit als Ursache für eine mögliche Infektion ausscheiden.
Für die maschinelle thermische Aufbereitung stehen verschiedene Geräte zur Verfügung (Dürr et al. 2008). Bei der Auswahl sind Herstellerangaben und Kosten zu berücksichtigen (Nowak et al. 2006).
Hand- und Winkelstücke sowie Turbinen dürfen gemäß Herstellerangaben nicht im Tauch- oder Ultraschallbad gereinigt werden. Die manuelle Aufbereitung beginnt mit Außenreinigung und anschließender Wischdesinfektion (alkoholbasiertes Instrumentendesinfektionsmittel), gefolgt von Innenpflege mit Öl und abschließender Dampfdesinfektion bzw. Dampfsterilisation (s. o.).
Wurzelkanalaufbereitungsinstrumente: Als präventiver Grundsatz muss die Aufbereitung von MP eine Verbreitung unerkannter Prionenerkrankungen ausschließen. Sie werden zuerst manuell vorgereinigt und dann üblicherweise im Bohrerbad desinfiziert. Sofern handelsübliche Bohrerbäder einen pH-Wert > 11 Wurzelkanalaufbereitungsinstrumente, Aufbereitungaufweisen, erfüllen sie die Anforderungen an die alkalische Aufbereitung. Für Wurzelkanalaufbereitungsinstrumente kommt nach manueller Vorreinigung idealerweise die Aufbereitung im RDG oder die weitere manuelle Aufbereitung mit einem alkalischen Reiniger bzw. mit Guanidinthiocyanat infrage. Letzteres wurde sowohl von rostfreiem Edelstahl als auch von Nickeltitan toleriert (Manuelidis 1997, Bachfeld 2009, Kramer und Ryll 2010).
Absaugung: Wird die Absaugkanüle durch angesaugtes Weichgewebe verschlossen, kann danach kontaminierte Flüssigkeit aus dem Absaugschlauch zurück in die Mundhöhle gelangen. Gleiches ist möglich, wenn der Absaugschlauch bei geringer Saugleistung oberhalb des Patienten geführt wird. Bei allen Absaugkanüle, Zahnarztpraxis, AufbereitungBehandlungen muss daher darauf geachtet werden, dass durch die Haltung von Sauger und Saugschlauch ein Rückfluss in den Mund verhindert wird. Zur Vermeidung werden außerdem refluxsichere Absaugkanülen empfohlen, und die Saugwirkung sollte erst einige Sekunden nach dem Zurückhängen in den Instrumentenköcher automatisch abschalten. Die Absaugung muss aufgrund gesetzlicher Anforderungen – wie z. B. die Indirekteinleiterverordnung – über eine Abscheidevorrichtung für Amalgam verfügen (DAHZ 2010).
Wasser führende Systeme: Die mikrobiologische Qualität des Wassers in den Wasser führenden Teilen zahnärztlicher Einheiten ist sowohl für die konservierende als auch insbesondere für die chirurgische Behandlung relevant, da Patienten und zahnmedizinisches Personal ständig dem Wasser führende Systeme, Zahnarztpraxis, AufbereitungAerosol der Behandlungseinheit ausgesetzt sind. Hierbei ist zu berücksichtigen, dass Behandlungseinheiten durch langes, enges Schlauchmaterial und längere Stagnation des Wasserflusses für Biofilmbildung besonders anfällig sind (Walker et al. 2000, 2004, 2007). Sind Patient und Behandler gesund, ist das Risiko einer Erkrankung infolge Kontamination des Kühl- und Spülwassers gering, falls nicht eine massive Kontamination mit Legionella spp. vorliegt (Oppenheim et al. 1987). Bereits 1985 stellten Fotos et al. fest, dass bei Personal einer Zahnklinik spezifische Antikörper für Legionellen nachweisbar sind und diese mit steigender Expositionszeit (= Arbeitszeit) zunehmen. Reinthaler et al. bestätigten 1988, dass zahnärztliches Personal ein erhöhtes Risiko für Legionelleninfektionen besitzt. Eine Studie aus dem Jahr 2007 ergab, dass die Gefahr einer Legionelleninfektion für zahnmedizinisches Personal nach wie vor besteht. Napoli et al. (2007) bezeichnet diese Gefahr als „Berufsrisiko“. Der bedeutendste und häufigste Vertreter der Legionellen ist L. pneumophila. Die Legionelleninfektion, ZahnarztpraxisInfektion mit dieser Legionellenart kann das Pontiac-Fieber oder die Legionellose auslösen.
Die Grundsätze der Infektionsprävention sehen deshalb vor, ausschließlich mikrobiologisch unbedenkliches Wasser zu verwenden, um das Risiko gesundheitlicher Legionella pneumophila:ZahnarztpraxisSchäden gering zu halten, sog. Vorsorgeprinzip (Hennighausen 2001, Pederson et al. 2002), zumal bei eingeschränkter Immunabwehr die Infektionsanfälligkeit erhöht wird. Die Feststellung sowie der Verdacht auf eine durch Wasser übertragene Infektion muss eine außerplanmäßige Nachuntersuchung zur Konsequenz haben (IfSG).
Wasser:DentaleinheitenWasser in Dentaleinheiten muss der Trinkwasser-VO entsprechen und sollte jährlich mikrobiologisch überwacht werden. Jede Dentaleinheit soll über eine wirksame Einrichtung zur Dauerentkeimung verfügen.
Vor dem täglichen Betrieb ist das Durchspülen aller Instrumente (Hand- und Winkelstücke, Turbine, Speibecken, Wasserzulauf, Mundspülbechereinlauf, Multifunktionsspritze) für mindestens 2 Minuten mit gleichzeitigem Funktionstest durchzuführen, ebenfalls das Durchspülen der Einheit für mindestens 20 Sekunden nach jedem Patienten. Um die Wartung der Behandlungseinheit zu gewährleisten, empfiehlt sich die Führung eines Wartungsbuchs zur Protokollierung der vom Hersteller vorgegebenen Maßnahmen zur Prävention der Biofilmentstehung (z. B. Purgen, Intensivsanierung). Bei umfangreichen zahnärztlich-chirurgischen Eingriffen und zahnärztlicher Behandlung von Patienten mit erhöhtem Infektionsrisiko soll zur Kühlung sterile physiologische Kochsalzlösung benutzt werden. Übertragungsinstrumente und Kühlsysteme sollen mit rückschlagsicheren Ventilen und die Einheiten mit Desinfektionsanlagen ausgerüstet sein oder nachgerüstet werden (KRINKO 2006). Vor Neuanschaffung von Dentaleinheiten ist durch den Hersteller zu bestätigen, dass die verwendeten Materialien keine Biofilmbildung begünstigen, d. h. die Prüfung nach DVGW Arbeitsblatt W 270 bestanden haben (Kap. 6.6).
Abformungen, zahntechnische Werkstücke und Wasserbäder: Aus der Mundhöhle stammende Abformungen und Werkstücke sind mikrobiell kontaminiert. Die Reinigung von Abformungen erfolgt unmittelbar nach Abformungen, aus Mundhöhle, AufbereitungEntnahme aus dem Mund durch Abspülen unter fließendem, kaltem Leitungswasser (DAHZ zahntechnische Werkstücke, Aufbereitung2006). Um eine geschlossene Hygienekette beim Transport in das Wasserbad, Zahnarztpraxis, Aufbereitungzahntechnische Labor und zurück zu gewährleisten, wird die sich anschließende Desinfektion als unverzichtbar im hygienischen Gesamtkonzept der Zahnarztpraxis betrachtet (Dürr et al. 2008). Ebenso sind aus dem Labor eintreffende Werkstücke und Restaurationen zu reinigen und zu desinfizieren. Das Labor hat zudem ein eigenes Hygienemanagement zur Vermeidung einer Erregerverschleppung zwischen Praxis und zahntechnischem Labor zu betreiben.
Zur Desinfektion von Abformungen oder zahntechnischen Werkstücken sind Mittel aus der VAH-Liste mit zusätzlich deklarierter Wirksamkeit gegen M. tuberculosis und mit begrenzt virozider Wirksamkeit auszuwählen. Es ist unbedingt darauf zu achten, dass die verwendeten Mittel die Desinfektion:zahntechnische WerkstückeAbformung nicht verfälschen.
Wasserbäder zur Temperierung von Wachsplatten oder Abformmaterialien sind dann nach jedem Patienten zu erneuern, wenn eine Kontamination mit Speichel oder Blut erfolgte. Der Wasserbehälter ist vor erneuter Befüllung zu desinfizieren (KRINKO 2006).
Röntgen: Kontaminierte Teile der Röntgeneinrichtung sind nach jedem Patienten zu desinfizieren. Die Schutzhüllen enoraler Röntgenfilme bzw. Röntgenfolien werden nach Entnahme aus der Mundhöhle desinfizierend abgewischt bzw. die Schutzhülle wird mit Handschuhen abgezogen und Röntgeneinrichtung, Zahnarztpraxis, Aufbereitungentsorgt.
Flächendesinfektion
Im Verlauf zahnärztlicher Medizinprodukteaufbereitung:Zahnarztpraxis\"\r\"ZahnarztMPAufberBehandlungen werden die Flächen im Behandlungsraum durch manuellen Kontakt und vor allem durch Aerosole kontaminiert. Die Beseitigung sichtbarer Verunreinigungen Flächendesinfektion:Zahnarztpraxiserfolgt mit einem mit Desinfektionsmittel getränktem Einwegtuch oder Zellstoff mit anschließender Zahnarztpraxis:FlächendesinfektionWischdesinfektion (VAH-Liste). Für die Durchführung der Wischdesinfektion ist zu beachten, dass das Präparat gut verteilt wird. Sprühapplikation ist wegen inhalativer Gefährdung nur für schlecht zugängliche Flächen zu wählen. Bei jeder Desinfektion sind die vom Hersteller angegebenen Schutzmaßnahmen einzuhalten (Kap. 2.5). Der Einsatz von Aldehyden ist abzulehnen (Kap. 2.7).
Nach jeder Behandlung sind folgende patientennahe Oberflächen zu desinfizieren:
-
•
Zahnarzt-, Assistenzelement, medizinisch-technische Geräte und Einrichtungsgegenstände im Bereich der Patientenversorgung, Griffe der OP-Leuchte,
-
•
Absauganlage (Schläuche, Kupplung, Köcher) im Griffbereich,
-
•
gezielt bei sichtbarer Kontamination mit Blut, Speichel oder anderen potenziell infektiösen Sekreten oder Exkreten oder bei besonderer Risikosituation auch auf patientenfernen Flächen (einschließlich Fußboden).
Für Fußböden im Behandlungsraum empfiehlt sich am Ende des Arbeitstags eine desinfizierende Reinigung, weil dadurch eine – wenn auch ungezielte – Inaktivierung ansonsten auf der Fläche kumulierender MRE u. a. Erreger erreicht wird. Für Flächen außerhalb der Behandlungs- und Funktionsräume ist die Reinigung ausreichend.
Aufbereitung von Berufs- und Schutzkleidung
Berufskleidung kann in der Praxis, im Privathaushalt oder in Wäschereien gewaschen werden.
Schutzkleidung darf nicht zur Reinigung mit nach Hause genommen werden (TRBA 250).
Berufskleidung:Aufbereitung, ZahnarztpraxisSchutzkleidung, kontaminierte Berufskleidung und textile Praxismaterialien (z. B. Schutzkleidung:Aufbereitung, ZahnarztpraxisAbdecktücher bei OP) sind in widerstandsfähigen, dichten Behältern (z. B. Plastiksäcke) getrennt nach der Art des Waschverfahrens zu sammeln. Die Aufbereitung kann praxisintern oder extern, thermisch (> 90 °C) oder chemothermisch (Verfahrensauswahl aus VAH-Liste, Durchführung nach Herstellerangaben) erfolgen. Die Lagerung aufbereiteter Wäsche erfolgt sortiert und hygienisch geschützt in Schränken.
Abfallentsorgung
Spitze/scharfe Gegenstände können in durchstichsicheren Behälter oder in feste Masse (z. B. Gips) eingebettet entsorgt werden. In der Regel bedingen in Zahnarztpraxen anfallende Mengen keine Zuordnung zu Abfallschlüsseln. Ausnahmen gelten für Körperteile (nicht Zähne), Abfallentsorgung:ZahnarztpraxisRöntgenchemikalien und Amalgamabfälle (Kap. 6.7). Die Entsorgung soll durch ein zertifiziertes Entsorgungsunternehmen durchgeführt und die Abgabe dorthin nachgewiesen werden.
Bauliche Voraussetzungen
Für die Aufbereitung von MP ist ein eigener Bereich mit Trennung unrein/rein festzulegen (Kap. 9.3). Der Behandlungsbereich ist vom Aufbereitungsbereich zu trennen (DAHZ 2010). Fest installierte MP müssen im Behandlungsraum aufbereitet werden. Die Räume zur Aufbereitung ebensoZahnarztpraxis:Voraussetzungen, bauliche wie die Behandlungsräume sollten über ausreichend natürliche Lichtquellen und Lüftungsmöglichkeiten verfügen (Kap. 9.7).
5.24.3. Infektionsschutz und Antiseptik bei Patienten mit Immunsuppression, Chemo- und Strahlentherapie, Mukoviszidose und Behinderungen
Zahnarztpraxis:Infektionsprävention\"\r\"ZahnarztInfPraevKann bei einem hochgradig Immunsupprimierten die Infektionsprävention:Zahnarztpraxis\"\r\"ZahnarztInfPraevzahnärztliche Intervention nicht aufgeschoben werden, bis sich die Infektionsabwehr des Antiseptik:ZahnarztpraxisPatienten erholt hat, soll die Maßnahme zusammen mit dem Infektionsprävention:Immunsupprimierte, Zahnarztpraxisbehandelnden Arzt geplant werden.
Zu dieser Gruppe gehören Patienten mit z. B. hochgradiger Immunsuppression:Infektionsschutz, ZahnarztpraxisNeutropenie bei Induktionsbehandlung einer Leukämie, eines Lymphoms, Patienten unter intensiver Chemotherapie bei soliden Tumoren oder Strahlentherapie im Kopfbereich, Patienten unmittelbar vor oder in den ersten 100 Tagen nach Stammzelltransplantation, nach Organtransplantation mit hoch dosierter Gabe von Steroiden oder anderen Immunsuppressiva, HIV-infizierte Patienten im AIDS-Stadium.
Eine ggf. erforderliche PAP soll an die Besiedlung des Patienten mit resistenten Isolaten angepasst werden, sofern diese bekannt sind. Der verantwortliche Arzt muss das mit der Intervention verbundene Risiko abwägen und sich für oder gegen den Einsatz steriler Spüllösungen zur Kühlung rotierender Instrumente entscheiden. Behandlungszentren, die regelhaft hochgradig Immunsupprimierte betreuen, sollten spezielle zahnärztliche Behandlungseinheiten mit sterilem Kühlwasser für die Übertragungsinstrumente vorhalten.
Da i. d. R. die Mehrfunktionsspritzen der Behandlungseinheit nicht an sterile Spüllösungen angeschlossen werden können, müssen Behandlungseinheiten, mit denen regelmäßig hochgradig immunsupprimierte Patienten behandelt werden, mit Desinfektionsanlagen für die Wasser führenden Systeme ausgestattet sein.
Im Wasser der Dentaleinheit vorhandene Pseudomonas spp. finden auf der Schleimhaut und in den Atemwegen immunsupprimierter Patienten günstigere Bedingungen zur dauerhaften Kolonisation mit nachfolgender Infektion als bei Gesunden. Da nosokomiale Ausbrüche durch mit gramnegativen Erregern kontaminierte Pseudomonas aeruginosa:ZahnarztpraxisMundspüllösungen beschrieben wurden, muss Wasser aus zahnärztlichen Anlagen zur Behandlung hochgradig immunsupprimierter Patienten frei von Pseudomonaden, Kryptosporidien und Legionellen sein (Literatur in KRINKO 2006).
Da bei Patienten mit Mukoviszidose der Zeitpunkt der Mukoviszidose-Patienten:Infektionsschutz, Zahnarztpraxis Mukoviszidose-Patienten:Antiseptik, Zahnarztpraxis Infektionsprävention:Mukoviszidose-Patienten, ZahnarztpraxisBesiedlung mit Pseudomonas spp. für die Langzeitprognose von Antiseptik:Mukoviszidose-Patienten, Zahnarztpraxiserheblicher Bedeutung ist, muss vermieden werden, dass der Patient im Verlauf medizinischer Interventionen infiziert wird. Das gilt auch für bereits mit Pseudomonas spp. besiedelte Patienten, da eine Superinfektion durch andere Serotypen möglich ist. Jensen et al. (1997) konnten Pseudomonas-Stämme desselben Genotyps im Kühlwasser einer Dentaleinheit und bei einem an Mukoviszidose erkrankten, zahnärztlich behandelten Patienten nachweisen. Daher muss auch bei Patienten mit Mukoviszidose steriles Kühlwasser zur Anwendung kommen. Bei Verwendung eines Wasser-Luft-Gemischs aus den Mehrfunktionsspritzen soll die Isolierung durch Kofferdam erfolgen (Literatur in KRINKO 2006).
Bei unzureichender Fähigkeit zur Mundhygiene (z. B. Einschränkung der Mundöffnung, Patienten mit eingeschränktem Allgemeinzustand) ist die Mundhöhlenantiseptik eine wichtige ergänzende Maßnahme (Kap. 5.18, Splieth und Gottschalk 2003). Bei Krankenhauspatienten oder Pflegeheimbewohnern mit Krankenhauspatienten:Infektionsschutz. zahnärztlichereingeschränkter Fähigkeit zur Mundhygiene sollte die Mundhygiene von geschultem Krankenhauspatienten:Antiseptik. zahnärztlichePflegepersonal übernommen werden. Es sind sowohl Hygienemaßnahmen des Pflegeheimbewohner:Infektionsschutz. zahnärztlicherherausnehmbaren Zahnersatzes (mechanische Reinigung, Reinigungstabletten, Sichtkontrolle des Pflegeheimbewohner:Antiseptik. zahnärztlicheZahnersatzes z. B. auf Pilzbesiedlung an weich bleibenden Unterfütterungen) als auch der Mundhöhle (Kontrolle des Prothesenlagers z. B. auf entstehende Druckulzera und ggf. deren medikamentöse Behandlung) und der Zähne zu beachten. Wenn möglich, sollen eine mechanische Reinigung der Zähne, der Zunge, eine leichte Massage des Zahnfleischs und eine antiseptische Mundspülung vorgenommen werden.
Essenziell ist die Mundhöhlenantiseptik bei Mukositisrisiko aufgrund von Immunsuppression:MundhöhlenantiseptikImmunsuppression, Chemo- oder Strahlentherapie, Mundhöhlenantiseptik Chemotherapie, MundhöhlenantiseptikStrahlentherapie.
In diesen Fällen müssen besonders langzeitig verträgliche Antiseptika z. B. auf Basis von Amin- und Zinnfluorid angewendet werden (Pitten et al. 2003, Welk et al. 2007). Als noch besser verträgliche Alternative zeichnet sich die Kombination von Polihexanid mit Lipofundin ab (Müller und Kramer 2011).
5.24.4. Postexpositionsprophylaxe
Jeder Patient ist als potenziell infektiös zu betrachten. Wenn es bei der Behandlung zu einer Exposition gekommen sein könnte, sind Maßnahmen der Postexpositionsprophylaxe durchzuführen.
Insbesondere kommen hierbei Maßnahmen nach Nadelstichverletzungen mit Blutkontakt oder Kontakt von Blut oder infektiösem Sekret mit Schleimhaut, Haut oder Augen zur Anwendung (DAHZ 2010). Das Unfallgeschehen ist zu dokumentieren (Kap. 5.29).
5.24.5. Qualitätssicherung
Postexpositionsprophylaxe:Zahnarztpraxis
Die Verantwortung Zahnarztpraxis:Qualitätssicherungfür die Praxishygiene obliegt dem Inhaber. Er kann Maßnahmen der Praxishygiene je nach Qualifikation an die Mitarbeiter delegieren. Ein Hygieneplan muss für die Beschäftigten zur Einsichtnahme ausliegen oder ausgehängt werden.
Hygieneplan: Der Rahmenhygieneplan der Bundeszahnärztekammer und des DAHZ entspricht der BiostoffV. Er ist für die Praxis zu übernehmen, dem eigenen Tätigkeitsbereich anzupassen, regelmäßig auf Aktualität zu prüfen und bei Bedarf zu ändern. Beschäftigte müssen bei Einstellung, Hygieneplan:ZahnarztpraxisVeränderungen im Aufgabenbereich und Einführung neuer Arbeitsmittel oder -verfahren in den Hygieneplan eingewiesen werden. Diese Unterweisung muss regelmäßig – mindestens jährlich (DAHZ 2010) – wiederholt und dokumentiert werden. Die Qualitätssicherung der Hygienemaßnahmen in der Praxis hängt entscheidend von der konsequenten und ständigen Umsetzung der im Hygieneplan festgelegten Vorgehensweisen ab.
Aufbereitung: Die einfachste und unverzichtbare Prüfung nach der Aufbereitung von MP ist deren visuelle Kontrolle. Die Qualität der maschinellen Aufbereitung wird sichergestellt durch die Abnahmeprüfung des RDG (Kap. 2.4, Kap. 8.11). Die Sterilisation der MP wird durch möglichst automatische Aufzeichnung und Kontrolle der relevanten Prozessparameter durch den Sterilisator sichergestellt. Die Messergebnisse sind im Sterilisationstagebuch mit der Beschreibung des Sterilisationsguts und der Zeit zu dokumentieren (chargenbezogene Dokumentation). Außerdem erfolgen periodische Prüfungen und Wartung, i. d. R. halbjährlich oder jährlich durch eine vom Hersteller autorisierte Fachfirma.
Das Outsourcen der Sterilisation in eine ZSVA ist eine kosteneffektive Möglichkeit zur Qualitätsverbesserung (Smith et al. 2009; zur Überwachung der Sterilisation Kap. 2.8).
Leider ist die gemäß MPG vom Hersteller verlangte genaue Beschreibung der Aufbereitung in der Herstellerinformation zum MP vielfach unzureichend, was in einer schottischen Studie für 90 % (!) der MP zutraf (Roebuck et al. 2008).
5.25. Infektionsprävention in der kieferorthopädischen Praxis
Tomasz Gedrange
5.25.1. Infektionsrisiken
Während in der Literatur die Infektionsrisiken und Zahnarztpraxis\""\r""Zahnarztdie daraus abgeleiteten Hygienemaßnahmen in der zahnärztlichen Praxis beschrieben sind, finden sich keine Untersuchungen, die die Hygiene in kieferorthopädischen PraxenInfektionsrisiko:kieferorthopädische Praxis thematisieren. Daher lassen sich nur aus dem Vergleich zwischen dem kieferorthopädische Praxis:Infektionsrisikenzahnärztlichen und kieferorthopädischen Behandlungsalltag Hygieneanforderungen ableiten.
Die Kieferorthopädie unterscheidet sich hinsichtlich der Infektionsrisiken von der allgemeinzahnärztlichen Tätigkeit vor allem durch folgende Gegebenheiten:
-
•
Es findet nur in Ausnahmefällen Aerosolbildung am Behandlungsplatz statt.
-
•
Bei der kieferorthopädischen Behandlung werden i. d. R. keine zahnerhaltenden und/oder chirurgischen Eingriffe durchgeführt, bei denen die Körperintegrität durchdrungen wird.
-
•
Apparative schwer dekontaminierbare Keimreservoire wie Kühlwasserleitungs- und Absaugsysteme werden in kieferorthopädischen Praxen selten benutzt und sind weniger zu finden als in allgemeinzahnärztlich oder chirurgisch ausgerichteten Praxen.
-
•
Da kieferorthopädische Behandlungen vorwiegend bei Kindern und Jugendlichen durchgeführt werden, ist die Wahrscheinlichkeit geringer, sog. Risikopatienten mit unerkannten bzw. ungenannten Krankheiten zu betreuen.
-
•
Aufgrund des niedrigen Durchschnittsalters der Patienten ist die Wahrscheinlichkeit geringer, Patienten mit chronisch entzündlichen Prozessen des Zahnhalteapparats und/oder des Mund- und Rachenraums zu behandeln. Darüber hinaus sind akute Infektionen der Zähne, des Zahnhalteapparats und des Mundraums kein Grund, den Kieferorthopäden, sondern vielmehr den Zahnarzt aufzusuchen.
Damit stellen sowohl die Gefahr der direkten aerogenen Erregerübertragung als auch die hämatogene Infektionsgefahr andere Anforderungen an die hygienische Arbeitsweise des Kieferorthopäden als an die des Zahnarztes.
Der direkte Kontakt mit Speichel, gefolgt von Nasen-Rachen-Sekreten und seltener Blut, ist bei der kieferorthopädischen Tätigkeit sicher die am häufigsten auftretende Infektionsmöglichkeit.
Noch eher als im allgemeinzahnärztlichen Tätigkeitsfeld sind für den Kieferorthopäden die Finger das „Hauptarbeitsinstrument“. Bedenkt man zusätzlich die im Vergleich zu zahnärztlichen Praxen erhöhte Patientenfrequenz, wird die Bedeutung dieser Kontaktmöglichkeit deutlich.
Eine weitere Übertragungsquelle ist der indirekte Kontakt bei Berührung von kontaminierten Instrumenten, Gegenständen oder Materialien, die sog. Schmierinfektion.
Besonders bei festsitzenden Behandlungsgeräten wie Multiband-Bracketapparaturen kommen häufig Zangen und ähnliche Instrumente auch intraoral zum Einsatz. Solche Behandlungssituationen sind z. B. die Aktivierung eines Drahtelements oder der Wechsel eines Drahtbogens. Die in kieferorthopädischen Praxen häufig durchgeführten Kieferabformungen gehören auch zu dieser Übertragungsmöglichkeit.
Dem Infektionsweg über Erreger beladenes Aerosol sowie über kontaminiertes Kühlwasser kommt nur eine untergeordnete Rolle zu, da wassergekühlte rotierende Instrumente in der Kieferorthopädie kaum zum Einsatz kommen. Die Ausnahme sind kleinere Okklusionskorrekturen sowie die Entfernung von Kunststoffresten nach Bracketentfernung. Nicht selten findet man in Praxen nur einen Behandlungsplatz mit Übertragungsinstrumenten (Winkelstücke, Turbinen) ausgestattet.
5.25.2. Anforderungen an die Hygiene in der kieferorthopädischen Praxis
Die Kieferorthopädie und die allgemeine Zahnmedizin verlangen prinzipiell die gleichen Hygienemaßnahmen.
Die oben beschriebene nichtinvasive Tätigkeit des Kieferorthopäden macht jedoch manche in der Zahnarztpraxis selbstverständliche Arbeitsschritte in der rein kieferorthopädischen Praxis überflüssig:
-
•
Da am Behandlungsplatz kein Aerosol entsteht, kann aus hygienischen Gründen auf Trennwände zwischen den Behandlungsplätzen verzichtet werden.
-
•
Ebenso ist keine antiseptische Mundspülung vor der Behandlung erforderlich, denn es folgt i. d. R. weder eine Injektion noch ein chirurgischer Eingriff.
Da bei einem Großteil der Patienten die Mundhygiene durch eine festsitzende Behandlungsapparatur erschwert ist, können in solchen Fällen Mundhöhlenantiseptika einen Beitrag zur Karies- und Gingivitisprophylaxe leisten. Die Anwendung beschränkt sich allerdings auf das häusliche Umfeld des Patienten.
Da die Hand das Hauptarbeitsinstrument des Kieferorthopäden ist, besitzt die Einhaltung der Händehygiene hohen Stellenwert.
Handschuhe geeigneter Qualität können nach jeweils erfolgter Desinfektion ggf. mehrfach weiterverwendet werden. Speziell in der Kieferorthopädie besteht ein großer Teil des Praxisalltags in planender und beratender Tätigkeit. Daher ist die Tragezeit der Handschuhe i. d. R. kürzer als in der allgemeinen Zahnmedizin. Somit ist ein Handschuhwechsel nach einer fixen Zeitspanne nicht sinnvoll. Vielmehr liegt es in der Verantwortung des Kieferorthopäden, aufgrund individueller Gegebenheiten den Zeitpunkt des Handschuhwechsels bedarfsorientiert festzulegen. Im Fall einer Kontamination mit Blut oder einer Perforation ist jedoch gemäß KRINKO-Empfehlung ein Handschuhwechsel erforderlich.
Für kieferorthopädische Zangen und Basisinstrumentarium ist die sachgerechte Desinfektion ausreichend.
Instrumente, die die Körperintegrität nicht durchdringen und nicht mit Wunden in Berührung kommen, müssen bei der Anwendung nicht steril sein. Die Art der Aufbereitung ist abhängig vom MP (Tab. 5.41 ). Für jedes aufzubereitende MP bzw. jede aufzubereitende Produktgruppe müssen gemäß RKI-Empfehlung eine Risikobewertung und eine Einstufung vorgenommen werden, aus der hervorgeht, ob, wie oft und mit welchem Verfahren die Aufbereitung durchzuführen ist (Kap. 2.9). Bei der Auswahl des Verfahrens sind die Herstellerangaben zu berücksichtigen, weil bei einem Abweichen die Produkthaftung erlischt. Wegen der Validierbarkeit und der Sicherheit der Aufbereitungsqualität ist RDG der Vorzug vor der manuellen Aufbereitung zu geben. Bei der Beschaffung von Instrumentarium ist die Aufbereitbarkeit im RDG zu beachten!
In kieferorthopädischen Praxen, in denen spezielle Therapien wie z. B. der Einsatz von Minischrauben oder Implantaten zur Verankerung angewandt werden, müssen die Hygieneanforderungen für einen chirurgischen Eingriff im Oropharynx eingehalten werden (Kap. 5.26).
Tab. 5.41.
Aufbereitung kieferorthopädisch relevanter Instrumente.Instrumente, kieferorthopädisch relevante, Aufbereitung
| Was | Wann und Wie |
|---|---|
| Kieferorthopädische Zangen, Spiegel, Sonden, Pinzetten | Vorwiegend im RDG, bei manueller Aufbereitung nach Gebrauch Vorreinigung in Reinigungslösung unter Beachtung des Personalschutzes, danach Einlegen in Instrumentendesinfektionslösung, nach Ablauf der Einwirkungszeit unter fließendem Wasser (Entnahme über endständigen Sterilfilter am Wasserauslass) abspülen, auf Rückstände kontrollieren, nach Trocknung staubgeschützt lagern |
| Bänder | Nach Anprobe vor Wiedereingliederung Einlegen für 15 Minuten in alkoholbasiertes Instrumentendesinfektionsmittel |
| Hand- und Winkelstücke | Nur die Aufbereitung im RDG gibt eine ausreichende Sicherheit, die Innenkontamination auszuschalten, thermische Verfahren mit nachgewiesener Wirksamkeit gegen Viren und vegetative Erreger sind das Verfahren der Wahl |
| Polierer, Bürstchen, Schleifer | Vorwiegend im RDG, bei manueller Aufbereitung reinigende Desinfektion im Ultraschallbad unter Verwendung spezieller Desinfektions- und Reinigungsmittel (Beachtung der Herstellerangaben) oder in einem Bohrerbad |
| Abformungen | Einlegen in Reinigungs-Desinfektions-Lösung, aufgrund von Materialproblemen sind hierzu die Angaben der Hersteller von Abformmaterialien zu beachten, nur Einsatz VAH-gelisteter Instrumentendesinfektionsmittel |
| Herausnehmbare kieferorthopädische Geräte | Werkstücke und Hilfsmittel dürfen aus dem zahnärztlichen Bereich erst nach Desinfektion im RDG oder mit einem geeigneten Desinfektionsmittel abgegeben werden. Gleiches gilt für die Abgabe aus dem Dentallabor |
Dafür ist die erforderliche Aufbereitungstechnik vorzuhalten, d. h. möglichst RDG und Sterilisator vom Typ B.
Sofortmaßnahmen nach Verletzungen mit kontaminierten kieferorthopädischen Materialien sind in Verbindung mit einer Risikoanalyse analog wie Nadelstichverletzungen zu versorgen.
In kieferorthopädischen Praxen ergibt sich durch das Risiko von Stichverletzungen z. B. mit kontaminiertem Draht ein erhöhtes Gefahrenpotenzial für Behandler und Personal. Das Team muss über das Vorgehen informiert sein. Es empfiehlt sich, die Erstmaßnahmen nach akzidenteller Kontamination mit dem Team zu trainieren. Über die Notwendigkeit einer Chemoprophylaxe muss abhängig von der jeweiligen Kasuistik entschieden werden.
5.26. Mund-Kiefer-Gesichts-Chirurgie
kieferorthopädische Praxis:Hygieneanforderungen\""\r""Kieferorthopaediehyganford Hans-Robert Metelmann und Claudia Metelmann
Mund-Kiefer-Gesichts(MKG)-Chirurgie ist einerseits als kieferorthopädische Praxis:Infektionsprävention\""\r""Kieferorthopaediezahnärztliche Chirurgie Teilgebiet der Zahnheilkunde und hat mit ihr alle Infektionsquellen, Übertragungswege und antiinfektiösen Schutzmaßnahmen gemeinsam, die durch die mikrobielle Besiedlung des Mund- und Rachenraums gegeben sind (DAHZ 2006, Kramer et al. 2008, IDZ 2010). Als Kopf-Hals-Chirurgie und mit den plastischen Operationen andererseits stellt das Fachgebiet jedoch besondere Anforderungen an die Realisierung des antiinfektiösen Regimes, denn es werden Patienten mit hohem Risiko für NI operiert, z. B. Tumor- und Unfallpatienten mit multiplen Vorerkrankungen, langen Eingriffzeiten und langer Krankenhausverweildauer. Auch gibt es eine Reihe von Eingriffen, die strenge Aseptik erfordern, z. B. Kiefergelenk- und ästhetische Operationen (Tab. 5.42 ).
Tab. 5.42.
Operationen mit erhöhten Anforderungen an das antiinfektiöse Regime.Operation(en):Mund-Kiefer-Gesichts-Chirurgie
| Eingriff | Häufige Risikofaktoren |
|---|---|
| Resektion und Rekonstruktion bei Malignomen im Kopf-Hals-Bereich |
|
| Rekonstruktion bei Polytraumata |
|
| Verschlussplastik bei Lippen-Kiefer-Gaumen-Spalten |
|
| Korrektur bei kraniofazialen Fehlbildungen |
|
| OP des Kiefergelenks |
|
| Ästhetische Operationen |
|
5.26.1. Spezielle Hygieneprobleme
MKG-Eingriffe sind v. a. durch folgende infektionsbegünstigende Risikofaktoren gekennzeichnet: schwierige Abdeckung des Gesichts als OP-Gebiet, ungünstige Positionierung des Beatmungstubus transnasal oder transoral, intraoperative Integration von Fixturen, ungedeckte, transkutane Implantation von Fremdkörpern, lange OP-Zeiten, lange Krankenhausliegezeiten
Abdeckung: Die OP-Gebiete Gesicht, Hals und insbesondere die Mundhöhle sind schwierig abzudecken, gerade wenn der Operateur bei der Planung rekonstruktiver Eingriffe oder bei ästhetisch orientierten Operationen den Blick auf die Symmetrie des gesamten Gesichts behalten muss. Die Abdeckung des Gesichts an der Stirn-Haar-Grenze oder im Bereich der behaarten Kopfhaut ist ein besonderes Problem, wenn man nicht von vornherein die Haare des Kopfs entfernt. Das ist gerade bei ambulanten Eingriffen unerwünscht und aus infektiologischer Sicht nicht erforderlich. Problematisch ist nicht zuletzt die Abdeckung im Bereich der vielen Übergänge der äußeren Gesichtshaut zu den Körperhöhlen.
Eine besondere Gefährdung besteht bei arthroskopischen und offenen Operationen des Kiefergelenks durch die Nähe des OP-Gebiets zur Haargrenze und durch die Notwendigkeit, während der OP zur Führung des Gelenks auch in die Mundhöhle einzugehen.
Positionierung des Beatmungstubus: Hierin besteht ein zweites Problem, weil der Tubus bei Intubationsnarkose i. d. R. intranasal oder intraoral liegt, also mitten im OP-Gebiet. Gelegentlich ist es sogar erforderlich, auch die Zu- und Abluftschläuche im Gesichtsbereich und damit im OPBeatmungstubus, Positionierung, Mund-Kiefer-Gesichts-Chirurgie-Gebiet anzuordnen, wenn eine Tubusverlängerung wegen der Totraumbelastung für den Patienten nicht zumutbar ist.
Kontaminationsrisiko: Viele operative Eingriffe sind dadurch gekennzeichnet, dass während des Vorgehens Fixturen wie Zahnersatzstücke, kieferorthopädische Geräte oder Drahtschienen in das OP-Feld und speziell in die Mundhöhle integriert werden müssen. Viele dieser Apparaturen sind Mund-Kiefer-Gesichts-Chirurgie:Kontaminationsrisikowährend der OP ggf. nach jeweiliger Zwischendesinfektion mehrfach ein- und auszubauen. Dabei ist auch an das Risiko von Stichverletzungen für das Behandlungsteam zu denken.
Zur Befestigung von Ersatzstücken im Gesicht (Epithesen) oder Kiefer (Prothesen) kommen heute vielfach hautperforierende Implantate zur Anwendung, die als Halteelemente in die Kieferknochen, die Periorbita oder das Mastoid eingeschraubt werden und damit mindestens in der späteren Anwendungszeit und manchmal schon während der Einheilungsphase eine offene Verbindung durch die Haut- oder Schleimhautoberfläche zum tragenden Knochen herstellen.
OP-Dauer: Mit zunehmender OP-Dauer wächst das Infektionsrisiko durch Wundkontamination, Gewebetraumatisierung, zunehmende Beeinträchtigung lokaler und systemischer Abwehrmechanismen infolge von Blutverlust und langer Anästhesie sowie abnehmende Wirksamkeit initialer antiinfektiöser Mund-Kiefer-Gesichts-Chirurgie:OperationsdauerMaßnahmen (Verrutschen und Durchfeuchten von Abdeckungen, Wirkungsverlust der Antisepsis). Tumoroperationen und rekonstruktive Eingriffe bei Unfallverletzungen sind extreme Langzeitoperationen mit bis zu 12 Stunden Dauer. Zusätzliche Risiken treten bei diesen Operationen auf, wenn mehrere Behandlungsteams gleichzeitig in verschiedenen Regionen des Patienten operieren müssen, z. B. wenn die Entfernung eines Malignoms der Mundhöhle (kontaminierter Eingriff) parallel mit der Hebung eines osteokutanen Beckenlappens (aseptischer Eingriff) zur späteren Defektdeckung erfolgt.
Aufenthaltsdauer: Lange Krankenhausliegezeiten, wie sie in der Behandlung von Unfallverletzten oder Tumorpatienten auftreten, stellen eine zunehmende Schwierigkeit bei der Einhaltung des antiinfektiösen Regimes dar.
5.26.2. Hygienebewusste Operationstechnik
Neben dem Operationstechnik, hygienebewusste, Mund-Kiefer-Gesichts-Chirurgieanerkannten Maßnahmenkatalog zur Realisierung des antiinfektiösen Regimes (Distanzierung, Sterilisation, Desinfektion, Antiseptik/Reinigung, Chemoprophylaxe und -therapie, Keimzahlverminderung der Raumluft, Geräteaufbereitung) ist die OP-Technik maßgeblich für gute Behandlungsergebnisse.
Dabei steht die Gewebeschonung mit dem wesentlichen Kriterium der Blutperfusion des Gewebes im Vordergrund. So zeigen mikrovaskulär Mund-Kiefer-Gesichts-Chirurgie:Hygieneprobleme\"\r\"MKGChirHYgproblemeanastomosierte freie Lappentransplantate und Stiellappen mit guter Durchblutung nach ihrer Einpflanzung in Vernarbungsareale oder bestrahlte Gewebe deutlich geringere Wundinfektionsraten als lokale Verschiebelappen (Metelmann et al. 1990).
Zu den schonenden OP-Techniken, die eine gute Gewebedurchblutung gewährleisten, gehören geringe Traumatisierung der Wundränder (schonendes Greifen von Hautlappen, Haltefäden), spannungsarme Wundnaht, Anlage breitbasiger Hautlappen und Vermeidung von Austrocknungen oder Überwärmungen im Wundgebiet. Besonders wichtig ist die Vermeidung hyperthermer Schäden durch heißlaufende ungekühlte Bohrer beim Setzen von enossalen Implantaten und Knochenschrauben. Wärmeschäden können auch bei der flächenwirksamen Elektrokoagulation und durch mehrstündige Einwirkung zu starker OP-Lampen auf sehr dünne Hautlappen (gefürchtete Komplikationen bei der Gesichtshautstraffung) entstehen.
5.26.3. Distanzierung
Die Intention des Distanzierungsmaßnahmen:Mund-Kiefer-Gesichts-ChirurgieDistanzierungsprinzips besteht darin, Maßnahmen mit erhöhtem Infektionsrisiko aus dem eigentlichen Eingriff herauszuhalten und in einer möglichst prästationären Vorbereitungsphase durchzuführen.
Ziel ist es, insbesondere die erregerbelasteten Vorbereitungsschritte aus dem OP-Vorgang herauszunehmen und diese möglichst außerhalb des Krankenhauses durchzuführen (Tab. 5.43 ). Dadurch wird zwar nicht das Risiko für die Behandler reduziert, die diese Maßnahmen i. d. R. an einer zahnärztlichen Einheit vornehmen, es wird aber die Infektionsgefährdung des Patienten unter der OP deutlich reduziert. Auch für alle Maßnahmen, bei denen Schwermetallschlamm aus Amalgam anfällt, ist dieses Vorgehen zu empfehlen, weil in der OP-Einheit i. d. R. kein Amalgamabscheider installiert ist.
Tab. 5.43.
Beispiele zur Reduzierung des postoperativen Infektionsrisikos im Rahmen der OP-Vorbereitung.
| Zeitpunkt | Risikofaktor | Beispiele |
|---|---|---|
| Prästationär | Zahnärztliche Maßnahmen mit hoher Aerosolbelastung | Trennen von Brückenkonstruktionen, Zahnsteinentfernung |
| Septische Maßnahmen | Wurzelkanalaufbereitung, Parodontaltherapie | |
| Maßnahmen, auf die die OP-Einheit technisch nicht vorbereitet ist | Füllungsentfernung mit Anfall von Amalgamschlamm, Fräsung und Politur von Kunststoffprothesen | |
| Behandlung kleiner Infektionen der Gesichtshaut | Furunkel, Herpes, ältere und infizierte Wunden | |
| Präoperativ | Entfernung von Haaren | |
| Vor Schnitt | Festnähen von Abdecktüchern | Behaarter Kopf |
| Unterlage von wasserdichten Kunststofffolien unter Abdecktücher | Durchfeuchtungsschutz |
Die Entfernung von Haaren im OP-Gebiet wird differenziert gesehen und nach Möglichkeit vermieden. Im Bereich der Augenbrauen werden niemals Haarentfernungen vorgenommen. Bei Versorgung von Kopfplatzwunden wird ein haarfreier Hof angelegt, bei der hochtemporalen Inzision im Zusammenhang mit Gesichtshautstraffungen ein haarfreier Korridor. Nur bei Bügelschnittführung wird der gesamte Kopf rasiert. Dabei gilt das Prinzip, die Haut möglichst zu schonen (Clipping anstatt Rasur) und die Haarentfernung möglichst unmittelbar vor der OP vorzunehmen (Kramer et al. 2008a).
Ein Distanzierungsproblem, das besonders bei Langzeitoperationen, schwieriger Abdeckung des OP-Gebiets und großen Mengen von Spülflüssigkeit, Aerosol oder Blut anfällt, ist das Abrutschen und Durchfeuchten der Abdecktücher. Hier hilft das Festnähen (besonders am behaarten Kopf) bzw. Festkleben der Tücher oder das Unterlegen einer wasserdichten antiseptischen Inzisionsfolie unter die Abdeckung.
5.26.4. Antiseptik
Antiseptik:Mund-Kiefer-Gesichts-ChirurgieEine sorgfältige mechanische Vorreinigung der Mundhöhle und der Zähne führt am wirkungsvollsten zur Reduktion der Mikroflora.
Das gilt besonders dann, wenn auf den Zähnen kieferorthopädische Apparaturen oder Frakturfixationsschienen befestigt worden sind oder prothetische Arbeiten festsitzend in die Mundhöhle eingegliedert wurden.
Bei operativen Eingriffen durch die Mundhöhle hindurch oder in Kombination von extra- und intraoralem Vorgehen muss die Erregerverschleppung in zwei Richtungen vermindert werden:
-
•
Aus der Mundhöhle in tiefere anatomische Regionen, z. B. beim transoralen Zugang zur mittleren Schädelgrube im Rahmen neurochirurgischer Indikationen. Eine besondere Gefährdung gilt für Operationen an der Rachenhinterwand mit ihrer häufigen Schleimhautbesiedlung durch S. aureus.
-
•
Durch Aerosole aus der Mundhöhle heraus mit Sedimentation auf extraorale Wundflächen. Diese Gefährdung entsteht z. B. regelmäßig im Rahmen von umfangreichen Tumoroperationen, wenn eine Halslymphknotenausräumung zu großen Wundflächen der äußeren Haut geführt hat und im unmittelbar anschließenden OP-Schritt der intraoralen Ausräumung des Primärtumors eine Unterkieferresektion unter Wasserkühlung und Aerosolbildung erfolgt.
Zu den wichtigsten Maßnahmen der Antiseptik, wie sie in der Greifswalder MKG-Chirurgie praktiziert werden, Tabelle 5.44 .
Tab. 5.44.
Maßnahmen zur Unterstützung der Antiseptik im Schleimhautbereich.Antiseptik:Schleimhaut
| Prinzip | Maßnahmen |
|---|---|
| Reduktion der Mikroflora | Präoperative Reinigung der Mundhöhle und der Zähne, insbesondere bei Fixturen mit Unterstützung durch Fachschwester für Dentalhygiene.Chemisch-mechanisches Ausschäumen der Mundhöhle mit 3-prozentiger H2O2-Lösung vor Schnitteröffnung.Wiederholtes „Fluten“ der Mundhöhle (in Intubationsnarkose!) zu Beginn und während der OP mit Antiseptika1 und Kochsalzlösung |
| Verbesserung der Antiseptikaremanenz | Einlegen antiseptikagetränkter1 Kompressen in die Mundhöhle |
| Reduzierung von Aerosolbildung | Träufeln mit antiseptischen Lösungen zur Kühlung und Spülung während des Fräsens von Zahnhartsubstanz und Knochensubstanz (Osteosynthese, Knochenresektionen, Osteotomien, modellierende Eingriffe) |
| Vermeidung des Aerosolniederschlags auf extraoralen Wundflächen | Sofortige Rücklagerung von Hautlappen außerhalb der eigentlichen OP-Aktivitäten und Abdeckung mit wasserdichten Folien |
| Verminderung postoperativer Erregerausbreitung | Tägliche Spülung der Wundflächen bis zur Nahtentfernung mit Antiseptika1 |
Chlorhexidin und Octenidin werden derzeit als Wirkstoffe der Wahl in der Mundhöhle angesehen.
5.26.5. Chemoprophylaxe
Grundsätzlich ist beim Gesunden eine Antibiotikaprophylaxe zur Beherrschung der nach chirurgischen Eingriffen in der Mundhöhle in bis zu 86 % nachweisbaren Bakteriämie bei Fehlen weiterer Risikofaktoren und bei unkomplizierten Operationen nicht notwendig.
In der MKG-Chirurgie werden häufig septische Eingriffe in infizierten Geweben oder kontaminierte Eingriffe bei Eröffnung der Schleimhaut des Respirations- oder Gastrointestinaltrakts durchgeführt. Bei einer Reihe von Eingriffen ist unter Berücksichtigung der Schwere des Krankheitsbilds und der operativen Behandlungsplanung im Einzelfall zu klären, ob eine Chemoprophylaxe vorausgehen soll (Tab. 5.45 ). Dabei ist zu berücksichtigen, ob die OP-Technik eine wirksame Antibiotikakonzentration im Wundgebiet erwarten lässt.
Tab. 5.45.
Mögliche Indikationen einer Chemoprophylaxe.
| Kontaminierte Eingriffe | Septische Eingriffe |
|---|---|
|
|
Bei osteoplastischem Unterkieferersatz ist z. B. den gefäßanastomosierten freien Beckenkamm- oder Skapulatransplantaten vor Knocheninterponaten ohne Gefäßanschluss wegen ihrer aufrechterhaltenen Blutperfusion und damit kontinuierlichen Antibiotikaanreicherung der Vorzug zu geben (Riediger et al. 1988). Freie Knochentransplantate ohne Gefäßanschluss sollten dem Unterkiefer immer mit Zugang von extraoral mit dem Ziel einer aseptischen OP eingefügt werden, da der Kontamination durch Mundhöhlenflora keine kontinuierliche intraossäre Chemoprophylaxe entgegenstehen kann.
Ist eine PAP geboten (s. u., Kap. 2.10.8), werden Antibiotika empfohlen, die neben Streptokokken auch Staphylokokken erfassen. Die Dosierung entspricht der therapeutischen Dosis. Die Prophylaxe wird 1–2 Stunden vor dem geplanten Eingriff begonnen und für 48 Stunden durchgeführt.
Eine PAP ist bei folgenden diagnostischen Risikokonstellationen für eine lokale SSI geboten:
-
•
Diabetes mellitus,
-
•
Hämophilie,
-
•
hämatologische Erkrankungen mit Leukopenie oder Leukozytose (z. B. Leukämie),
-
•
generalisierte Erkrankungen des lymphatischen Systems (z. B. Morbus Hodgkin),
-
•
Zytostatika- oder Steroidmedikation,
-
•
Radiatio im Kiefer-, Gesichts- oder Halsbereich,
-
•
Dialyse,
-
•
AIDS,
-
•
Zustand nach Organtransplantation.
Von der PEG wird bei Patienten ohne Allergie ein Aminopenicillin + ein β-Lactamase-Inhibitor empfohlen. Im Fall einer vermuteten oder gesicherten Allergie sollte die Therapie mit Clindamycin begonnen werden (Tab. 5.46 ).
Tab. 5.46.
Antibiotika der Wahl in der Chemoprophylaxe.
| Situation | Antibiotikum | Einzeldosis 30–60 min vor dem Eingriff |
|
|---|---|---|---|
| Erwachsene | Kinder | ||
| Orale Einnahme | Amoxicillin/β-Lactamasehemmer | 2 g p. o. | 50 mg/kg p. o. |
| Orale Einnahme nicht möglich | Ampicillin/β-Lactamasehemmer | 2 g i. v. | 50 mg/kg i. v. |
| Penicillin- oder Ampicillinallergie | |||
|
Clindamycin | 600 mg p. o. | 20 mg/kg p. o. |
|
Clindamycin | 600 mg i. v. | 20 mg/kg i. v. |
(nach Naber et al. 2007)
Besondere Aufmerksamkeit muss bei Risiko einer infektiösen Endokarditis gelten. Für die Effektivität der Antibiotikaprophylaxe liegt nur unzureichende Evidenz vor. Dennoch empfiehlt die Leitlinie der American Heart Association eine auf definierte Endokarditis, AntibiotikaprophylaxeHochrisikopatienten und -konstellationen beschränkte Prophylaxe (Wilson et al. 2007). Antibiotikaprophylaxe:EndokarditisAktuell orientiert sich die Empfehlung zur Endokarditisprophylaxe mehr an der Frage, welche Patienten mit hoher Wahrscheinlichkeit von einer Antibiotikaprophylaxe profitieren werden (Kap. 2.10.8).
Dazu zählen folgende Patienten, die Risikopatienten für einen schweren Verlauf einer infektiösen Endokarditis sind:
-
•
Patienten mit Klappenersatz (mechanische und biologische Prothesen),
-
•
Patienten mit rekonstruierten Klappen unter Verwendung von alloprothetischem Material in den ersten 6 Monaten nach OP∗ ,
-
•
Patienten mit überstandener Endokarditis,
-
•Patienten mit angeborenen Herzfehlern,
-
–zyanotische Herzfehler, die nicht oder palliativ mit systemisch-pulmonalem Shunt operiert sind,
-
–operierte Herzfehler mit Implantation von Conduits (mit oder ohne Klappe) oder residuellen Defekten, d. h. turbulenter Blutströmung im Bereich des prothetischen Materials,
-
–
-
•
alle operativ oder interventionell unter Verwendung von prothetischem Material behandelten Herzfehler in den ersten 6 Monaten nach OP∗,
-
•
herztransplantierte Patienten, die eine kardiale Valvulopathie entwickeln.
Mit dieser Überlegung lässt sich der bisherige Einsatz der Prophylaxe sinnvoll eingrenzen und die Effizienz der Prophylaxemaßnahmen steigern, ohne Hochrisikopatienten einer möglicherweise vermeidbaren Gefährdung durch Unterlassung auszusetzen.
5.27. Transfusionsmedizin∗∗
Gregor Caspari, Andreas Antibiotikaprophylaxe:Mund-Kiefer-Gesichts-Chirurgie\"\r\"MKGChirAntibiotikaprophylGreinacher
5.27.1. Infektionsgefährdung durch Blut und Blutprodukte
Aus menschlichem Blut gewonnene Blutkomponenten und Plasmaderivate sind Arzneimittel. Herstellung und Anwendung unterliegen den Vorschriften des Gesetzes zur Regelung des Transfusionswesens (Transfusionsgesetz, TFG), des AMG, der Arzneimittel- und Wirkstoffherstellungsverordnung (AMVHV, 2006), den Hämotherapie-Richtlinien (2010), den Querschnitts-Leitlinien zur Therapie mit Blutprodukten (2009) sowie weiteren Richt- und Leitlinien.
Bei der Entnahme von Blut könnenMund-Kiefer-Gesichts-Chirurgie\"\r\"MKGChir Viren, Bakterien, Protozoen (Shulman und Heimowitz 2002) und Helminthen, die sich im Spenderblut befinden, in die Blutkonserve gelangen und bei der Transfusion der daraus hergestellten Produkte dem Patienten übertragen werden (Caspari et al. 2010). Es gibt bisher keinen epidemiologischen oder experimentellen Hinweis auf die Übertragbarkeit der CJD durch Bluttransfusion (Arbeitskreis Blut 1998a, Heinemann et al. 2007, Zou et al. 2008). Für die vCJD gibt es experimentelle Übertragungen bei Säugetieren (Bons et al. 2002, Hunter et al. 2002). Auch beim Menschen gilt die Übertragbarkeit durch buffy-coat-haltige Erythrozytenkonzentrate (EK) als gesichert (z. B. Zou et al. 2008).
Der erste Erreger, für den die Übertragbarkeit durch Blut erkannt wurde, war Treponema (T.) pallidum. Zwischen den 40er und 80er Jahren des 20. Jh. standen die Hepatitiserreger im Fokus der Aufmerksamkeit. In den frühen 1980er Jahren wurde die Übertragbarkeit von HIV durch Treponema pallidum, Übertragung durch Blut(produkte)Blutprodukte und Plasmaderivate nachgewiesen. Durch die Erfahrungen mit HIV gilt jetzt auch anderen Viren, die man zuvor nicht beachtet hatte, z. B. Parvovirus B19 (HIV:Übertragung durch Blut(produkte)Arbeitskreis Blut 1998b, Jordan et al. 1998, Azzi et al. 1999, Blümel et al. 2002, Soucie et al. 2004) und HAV (Robertson et al. 1998, Choudy et al. 1999, Richardson und Evatt 2000), erhöhte Aufmerksamkeit.
Transfusionszwischenfälle durch die Parvovirus B19, Übertragung durch Blut(produkte)Übertragung von Viren sind selten, können aber im Einzelfall sowie bei besonderen Patientengruppen (Immunsupprimierte, Schwangere) schwerwiegende Folgen haben.
Die Übertragungswahrscheinlichkeit von Viren durch Blut wird, vorbehaltlich Labortestung und Inaktivierung durch zugelassene Methoden, beeinflusst durch
-
•
Häufigkeit der Infektion im Spenderkollektiv,
-
•
Häufigkeit einer schützenden Immunität beim Blutempfänger,
-
•
Dauer der Virämie,
-
•
Krankheitszeichen bei Spendern mit Virämie.
Viren: Transfusionsmedizinisch besonders bedeutsam sind daher Viren, die chronische Infektionen verursachen können, ohne dass der Spendewillige erkennbar krank ist. Für die Produktion von Plasmaprodukten werden Plasmen von bis zu 50.000 Spendern vereint, wodurch sich das Infektionsrisiko Viren:Übertragung durch Blut(produkte)zunächst deutlich erhöht. Die Viren werden bei der Verarbeitung entweder in weiterzuverarbeitendem oder in nicht weiterzuverarbeitendem Material angereichert, wodurch sich die Infektiosität erhöht oder erniedrigt.
Die Produktion jedes Plasmaderivats beinhaltet einen oder mehrere Schritte zur Virusinaktivierung, die in Modellen sorgfältig evaluiert werden (Caspari et al. 2010). Dadurch wird eine sehr hohe Sicherheit erreicht; vollständige Sicherheit kann jedoch nicht garantiert werden.
Bakterien: Sie können
-
•
schon im Spenderblut vorhanden sein, z. B. während der Inkubationszeit einer Infektion, bei klinisch inapparenten oder bereits abgelaufenen Infektionen (Gastroenteritis durch Yersinia (Y.) enterocolitica, Viren:Übertragung durch Blut(produkte)chronische Osteomyelitis, chronische Brucellose, Syphilis), durch zahnärztliche Eingriffe, Sigmoidoskopie oder
-
•
während der Blutspende oder ihrer Verarbeitung das Blut kontaminieren (Hautflora, kontaminierte Stabilisator- oder Yersinia enterocolitica, Übertragung durch Blut(produkte)Aphereseflüssigkeiten [Heltberg et al. 1993], Beschädigung des Beutels, Kontamination beim Waschen, Auftauen oder Anwärmen).
Bei 4 °C, der Lagertemperatur für Erythrozytenkonzentrate, können sich nur wenige Bakterien vermehren. Unterbrechungen der Kühlkette ermöglichen aber die Vermehrung weiterer Bakterienspezies. Bei 22 °C, der Lagertemperatur für Thrombozytenkonzentrate, ist mit raschem Wachstum zahlreicher Spezies zu rechnen (Neff et al. 1999, Blajchman et al. 2004). Eigenblutkonserven sind gleichermaßen durch bakterielle Kontamination gefährdet wie die Fremdblutspende (z. B. Benavides et al. 2003). Schwere Zwischenfälle und Todesfälle durch bakterielle Kontamination von Blutprodukten sind insgesamt häufiger als solche durch virale Kontamination (Blajchman et al. 2004, Funk et al. 2010).
Im Folgenden werden spezielle Aspekte der Hygiene für die Transfusionsmedizin in der Reihenfolge der Herstellung eines Blutprodukts oder Plasmaderivats zusammengefasst. Zu Grundregeln der Desinfektion von Arbeitsflächen und Reinräumen sowie des Schutzes von medizinischem Personal Kapitel 2.5 bzw. Kapitel 2.12.
5.27.2. Identifizierung und Ausschluss infektiöser Spender
Blut:Infektionsgefährdung\"\r\"BlutInfGefaehrd
Als infektiös erkannte Blutspender müssen von der Spende ausgeschlossen werden. Im Zweifel wird der Spender schon bei der anamnestischen Möglichkeit einer transfusionsrelevanten Infektion ausgeschlossen, auch wenn bei diesem Vorgehen der größte Teil der ausgeschlossenen Spender nicht wirklich infektiös ist. Blutspenden mit auffälliger Infektionsdiagnostik dürfen nicht transfundiert werden.
Durch Anamnese sollen Spendewillige von der SpendeBlutprodukte:Infektionsgefährdung\""\r""BlutInfGefaehrd ausgeschlossen Infektionsgefährdung:Blut(produkte)\""\r""BlutInfGefaehrdwerden, die
-
•
die Infektionen mit Erregern haben könnten, auf die die Spende im Labor bisher nicht getestet werden kann (z. B. vCJD) bzw. nicht getestet wird (z. B. Malaria),
-
•
die eine frische Infektion mit Erregern haben,Blutspender, infektiöse:Ausschluss die die in der Blutspende verwendeten Labortests erst nach einiger Zeit anzeigen,
-
•
die eine Infektion haben, deren Ausheilung nicht oder nur schwer nachweisbar ist.
Tropische Infektionen, vor allem Malaria, Blutspende, AusschlussMalaria, werden dadurch ausgeschlossen, dass alle Tropenheimkehrer von der Spende ausgeschlossen werden, bis sicher ist, dass sie keine Malaria entwickeln werden (6 Monate, bei Auftreten von Fieber länger).
Bei diesen und anderen anamnestischen Ausschlüssen wird bewusst in Kauf genommen, dass nur der kleinste Teil der ausgeschlossenen Spender wirklich mit dem Erreger der Malaria infiziert ist – aber anders lässt sich Malariasicherheit von Blut in Deutschland nicht gewährleisten.
Ebenso werden Personen, die von Frühsommer bis Spätherbst aus Kanada, den USA oder Mexiko heimkehren, wegen der Möglichkeit der West-Nil-Virusinfektion für 4 Wochen von der Spende zurückgestellt (Paul-Ehrlich-Institut 2004), Spender aus Chikungunya-Endemiegebieten für 2 Wochen (Paul-Ehrlich-Institut 2007, Petersen 2010).
Die meisten Ausschlussgründe haben das Ziel, die Übertragung von HBV, HCV und HIV zu verhindern (Tab. 5.47 ). Dem Schutz vor Bakterien dienen Fragen nach kürzlichen Gastroenteritiden, Zahnarztbesuch, Endoskopie (Sigmoidoskopie!) und endoskopisch durchgeführten OPerationen, bekannter Tuberkulose und bekannter Osteomyelitis (Hämotherapie-Richtlinien 2010).
Tab. 5.47.
Ausschlüsse und Rückstellungen von der Blutspende wegen des Risikos der Übertragung von Infektionen (Hämotherapie-Richtlinien, 2. Richtlinienanpassung 2010).Blutspende:zeitlich begrenzt zurückzustellende SpenderBlutspende:Ausschlusskriterien
| Von der Blutspende auszuschließen sind Personen |
|
| Von der Blutspende zeitlich begrenzt zurückzustellen sind Personen |
|
| Erkrankungen, nach deren medizinisch dokumentierter Heilung Fristen bis zur nächsten Blutspende einzuhalten sind, sind |
|
| Expositionen sind |
|
Nicht alle Erkrankungen können durch Anamnese und körperliche Untersuchung ausgeschlossen werden, z. B. die in Südeuropa (Griechenland, Italien) autochthon auftretenden West-Nil-Virus-Infektionen (Busani et al. 2010, Calistri et al. 2010, Papa et al. 2010), die in Südfrankreich im Jahr 2010 erstmals autochthon aufgetretenen Denguevirusinfektionen (La Rouche et al. 2010) oder autochthone HEV-Infektionen (Caspari 2009).
Jede Blutspende:AnforderungenBlutspende muss eindeutig frei sein von HBs-Antigen, Antikörpern gegen das Core-Antigen von HBV (Anti-HBc), Antikörpern gegen HCV, HIV und T. pallidum sowie in einem HCV- und HIV-1-Nukleinsäure-Amplifikationstest mit definierter Mindestempfindlichkeit (z. B. PCR) negativ sein (Hämotherapie-Richtlinien 2010).
Nach der Infektion vergeht jedoch einige Zeit, bis die Labortests die betreffenden Infektionen anzeigen können (sog. diagnostisches Fenster). Sie beträgt für den HBs-Antigen-Test 1–4 Monate, für den HCV-Antikörper-Test der neuesten Generation im Mittel etwa 11 Wochen und für HIV-Antikörpertests 3–4 Wochen (Tab. 5.48 ). Die Länge des diagnostischen Fensters hängt Blutspende:diagnostisches Fensteru. a. von der Infektionsdosis und der Ähnlichkeit des verwendeten Testantikörpers bzw. -antigens mit dem beim Spender vorliegenden Virus ab. Durch die zusätzlich durchzuführenden Nukleinsäure-Amplifikationstests für HCV und HIV verkürzen sich deren serologische Fenster auf 10–14 Tage. Sowohl für die Antikörper- bzw. Antigentests als auch für die Nukleinsäure-Amplifikationstests kann das diagnostische Fenster bei seltenen Virusvarianten deutlich verlängert sein. Spender im diagnostischen Fenster lassen sich, wenn überhaupt, nur durch sorgfältige Anamnese identifizieren. Die Testung auf Anti-HBc dient der Erkennung HBsAg-negativer, sog. okkulter, HBV-Infektionen (Candotti et a. 2009, Raimondo et al. 2010), nicht aber früher HBV-Infektionen im diagnostischen Fenster.
Tab. 5.48.
Restrisiko der Übertragung von Viruserkrankungen durch Blutprodukte trotz infektionsserologischer Untersuchungen für Deutschland (Pool-Präparate und Präparate, die einem Virusinaktivierungsverfahren unterzogen wurden, sind nicht berücksichtigt).Viruserkrankung(en), Übertragungsrisiko, BlutprodukteHIV:Übertragung durch Blut(produkte)Hepatitis-C-Virus:Übertragung, Blutprodukte
| Erreger | „Diagnostisches Fenster“ | Restrisiko |
|---|---|---|
| HBV | 5–8 Wochen | Ca. 1 : 400.000 ohne Anti-HBc-Testung |
| Mit PCR weniger | Mit Anti-HBc-Testung deutlich geringer | |
| HCV | Mit PCR ca. 10 Tage | < 1 : 5 Mio. |
| HIV | Mit PCR ca. 10 Tage | Ca. 1 : 4 Mio. |
Besondere Vorsichtsmaßnahmen erfordert die Blutübertragung bei immuninsuffizienten bzw. immunsupprimierten Patienten, z. B. bei Frühgeborenen oder Patienten nach Knochenmarktransplantation und Schwangeren. Bei diesen Patienten kann eine üblicherweise harmlose CMV-Erstinfektion zu schweren Erkrankungen wie der Immunsuppression:Bluttransfusioneninterstitiellen Pneumonie führen. Von den Hämotherapie-Richtlinien (2010) wird die CMV-Testung von Blut und die Verwendung CMV-negativer Präparate nicht mehr empfohlen, da die Spender während der Serokonversion zu seropositiv zumindest theoretisch besonders infektiös sind. Zelluläre Blutpräparate müssen leukozytendepletiert sein, was zur Verringerung des Risikos einer transfusionsassoziierten CMV-Infektion bei Risikopatienten um ca. 90 % führt.
Ein negatives Testergebnis trotz Infektion des Spenders ist sehr selten. Es kann vorkommen bei
-
•
seltenen Blutpräparate, zelluläreSerotypen und Mutanten des jeweiligen Virus (Humpe et al. 1999),
-
•
Fehlern bei der Testdurchführung und Probenvertauschung bei der Spende bzw. im Labor (Busch et al. 2000) sowie Fehlern bei der Übermittlung der Testergebnisse (Linden 2000),
-
•
Spende im diagnostischen Fenster der jeweiligen Infektion (Delwart et al. 2004, Schmidt et al. 2009, Funke et al. 2010).
Die Wahrscheinlichkeit einer Spende im diagnostischen Fenster wird bei sonst gleichen Spendecharakteristika von der Inzidenz der Infektion im jeweiligen Blutspenderkollektiv und der Länge des diagnostischen Fensters bestimmt. Ist die Inzidenz 1 : 100.000 Spender pro Jahr und die Länge des diagnostischen Fensters ein Vierteljahr, beträgt die Wahrscheinlichkeit einer Spende im diagnostischen Fenster 1 : 400.000. Zu beachten ist: Wenn der Spendeabstand die Länge des diagnostischen Fensters deutlich unterschreitet (z. B. bei der Plasmapheresespende), können durch einen infektiösen Spender mehrere infektiöse Spenden geleistet werden, bevor der Labortest positiv wird.
Spenden von Erstspendern sind deutlich häufiger infektionsmarkerpositiv als Spenden von Mehrfachspendern (Glück et al. 1998). Die Daten von beiden Gruppen sind jedoch nicht direkt vergleichbar. Während der Erstspender sein ganzes bisheriges Leben Zeit hatte, die Infektion zu erwerben, war der Mehrfachspender bei Erstspenderder letzten Spende vor 3–6 Monaten noch nicht infiziert; ein positiver Infektionsmarker ist also auf eine Infektion in einem sehr viel kürzeren Zeitintervall zurückzuführen. Die Häufigkeit von Infektionsmarkern bei Erstspendern entspricht also der Prävalenz, während die Häufigkeit von Infektionsmarkern bei Mehrfachspendern Ausdruck der Inzidenz ist.
Seit Einführung der HCV-PCR in Deutschland 1999 ist bei über 50 Millionen transfundierten Blutpräparaten ein einziger Fall einer Übertragung des Virus durch Blut oder Blutprodukte bekannt geworden (Funke et al. 2010). Zu fragen ist allerdings, ob in den Rückverfolgungsverfahren die Möglichkeit einer Infektionsübertragung durch HCV-Antikörper- und -Pool-PCR-negative Präparate (Schüttler et al. 2000) ausreichend berücksichtigt wurde.
Seit der Einführung der HIV-PCR wurden 3 HIV-Übertragungen durch Blutpräparate beobachtet (Schmidt et al. 2009, Funke et al. 2010 sowie noch nicht publizierte Fälle).
Die am wenigsten sicheren Daten für die Abschätzung des Restrisikos gibt es für HBV. Erkrankungen des Empfängers durch Transfusionsblut, die den HIV:Übertragung durch Blut(produkte)Kriterien für eine wahrscheinliche oder sichere Übertragung genügen, werden dem Paul-Ehrlich-Institut etwa 2–3 pro Jahr gemeldet (Funke et al. 2010). Theoretische Berechnungen und Einzelbeobachtungen deuten auf ein um den Faktor 5–8 höheres Risiko hin (z. B. Glück 1998). Risikoabschätzungen, die die zusätzliche Testung auf Anti-HBc berücksichtigen, sind noch nicht publiziert. Ob HBV-Erkrankungen nicht als transfusionsbedingt erkannt und/oder gemeldet werden, die übertragenen Infektionen ohne klinische Symptome verlaufen oder ob die Hypothesen, auf denen die theoretischen Berechnungen beruhen, falsch sind, lässt sich nur schwer entscheiden.
Da bisher kein Test zum Ausschluss von CJD bzw. vCJD im Blut zur Verfügung steht, sind derzeit folgende Personen als Blutspender auszuschließen: Personen,
-
•
bei denen der Verdacht auf eine CJD oder vCJD besteht oder diese bestätigt wurde,
-
•
die jemals mit Creutzfeldt-Jakob-Krankheit:BlutspenderausschlussHypophysenhormonen (z. B. Wachstumshormonen) humanen Ursprungs behandelt wurden,
-
•
bei denen in der Familie (Blutsverwandte, nicht aber z. B. Ehefrau) CJD aufgetreten ist,
-
•
die Dura-mater- und Korneatransplantate erhalten haben,
-
•
die sich im Zeitraum von 1980 bis 1996 ≥ 6 Monate in Großbritannien und/oder Nordirland aufgehalten haben,
-
•
die seit dem 1.1.1980 in Großbritannien oder Nordirland operiert wurden oder Bluttransfusionen erhalten haben.
Um eine eigenständige Kette von Reinfektionen zu vermeiden, wurden bereits früher in Frankreich und werden seit 2004 in Großbritannien Personen, die eine Bluttransfusion erhalten haben, von der Blutspende ausgeschlossen. Dieser Ausschluss ist in Deutschland nicht eingeführt, da verschiedene Studien zeigen, dass ein wesentlicher Teil der Blutspender über frühere Transfusionen keine zuverlässige Auskunft geben kann (Caspari et al. 2005). Noch schwieriger wäre der Ausschluss aller Empfänger von Plasmaderivaten (hierzu gehören auch Passivimpfstoffe wie Tetanus-Immunglobulin), der zudem zu einem immensen Verlust an Blutspendern führen würde.
Die Möglichkeit einer iatrogenen Übertragung von vCJD durch kontaminierte chirurgische Instrumente rückt zumindest für Länder mit mehreren Erkrankten in den Brennpunkt des Interesses.
5.27.3. Hygienische Grundregeln für die Blutentnahme
Die Blutspende muss aseptisch ohne Kontamination des Konserveninhalts durchgeführt werden.
Durch die Verwendung von industriell vorgefertigten, strahlensterilisierten Einweg-Abnahmebeuteln kann das Blut in ein geschlossenes System abgenommen und hierin ohne Blutspender, infektiöse\"\r\"Blutspenderweitere Öffnung des Systems verarbeitet werden. Die Punktionsstelle ist die einzige Pforte, an der Mikroorganismen in das geschlossene System eindringen können, z. B. S. epidermidis. Unerlässlich ist daher die umsichtige Auswahl der Punktionsstelle und der Antiseptika (Kap. 2.2). In Bereichen mit Hautveränderungen (Hauterkrankungen, Vernarbungen) ist von der Punktion abzusehen. In einem ersten Reinigungsschritt wird das Antiseptikum auf die Punktionsstelle aufgetragen und mit einem Tupfer abgewischt. Hochprozentige ethanolische Präparate verdunsten schnell und sind daher für die Hautantiseptik bei der Blutspende gut geeignet. Beim zweiten Auftragen des Antiseptikums wird die Lufttrocknung (> 30 s) abgewartet. Wird nach der zweiten Applikation nochmals ein Tupfer verwendet, z. B. um überschüssiges Antiseptikum wegzuwischen, muss dieser steril sein, weil sonst im Tupfer vorhandene Erreger in das Arzneimittel Blutkonserve gelangen können (s. a. Ramirez-Arcos et al. 2010). Im Ergebnis einer Cochrane-Analyse zur Hautantiseptik vor der Blutspende konnte kein Unterschied zwischen einmaliger Alkoholapplikation und Applikation eines zweiten Hautantiseptikums nach der Alkoholapplikation festgestellt werden. Im Ergebnis des Expertenkonsens wurde die Empfehlung gegeben, zur Hautantiseptik die Kombination von 2-prozentigem Chlorhexidinglukonat mit 70-prozentigem Propan-2-ol anzuwenden und zu beachten, dass das Hautareal mindestens 30 Sekunden benetzt ist; danach sollte eine Trocknungszeit von 30 Sekunden gewährt werden (WHO guidelines on drawing blood: best practices in phlebotomy, whqlibdoc.who.int/publications/2010/9789241599221_eng.pdf). Die Kombination von 70-prozentigem Propan-2-ol mit Octenidin dürfte aufgrund der höheren Wirksamkeit von Octenidin (Koburger et al. 2010) mindestens mit der gleichen Sicherheit verbunden sein.
Die bakterielle Belastung des Vollbluts kann durch Ableitung der ersten Blutportion in einen separaten Beutel, aus dem dann die Untersuchungsproben gewonnen werden, deutlich vermindert werden (de Korte et al. 2002). Dieses Verfahren ist als „predonation sampling“ bundesweit eingeführt.
Das Personal im Spendebereich soll nach hygienischer Händedesinfektion Schutzhandschuhe anlegen. Diese müssen nicht nach jeder Punktion gewechselt werden, sofern sie unversehrt sind. Vor Punktion des nächsten Spenders ist in diesem Fall die Desinfektion der angelegten Handschuhe indiziert (Pitten et al. 1999). Hierzu sind aber nicht alle Einmalhandschuhe Schutzhandschuhe:Blutentnahmegleichermaßen geeignet. Um eine Kontamination durch die Vermehrung der Hautflora in der „feuchten Kammer“ Handschuh zu vermeiden, sollten die Handschuhe etwa halbstündlich gewechselt und jeweils eine hygienische Händedesinfektion durchgeführt werden.
Um das Risiko der bakteriellen Kontamination nicht zu erhöhen, sollte beim vorzeitigen Versiegen des Blutflusses mit dem gleichen Beutelsystem keine Zweitpunktion vorgenommen werden.
Bei der isovolämischen Hämodilution (Kap. 5.27.9) ist es üblich, den Blutbeutel an einen bereits liegenden Venenkatheter anzukoppeln. Dieses Vorgehen ist wegen möglicher bakterieller Kontamination der Verbindungsstelle zwischen Katheter und Beutelsystem für die länger zu lagernden Vollblute bzw. die daraus hergestellten Blutprodukte ungeeignet.
5.27.4. Hygienische Grundregeln bei der Blutfraktionierung
Die Auftrennung Hygienemaßnahmen:Blutfraktionierungdes Blutes in seine Komponenten (Fraktionierung) erfolgt im geschlossenen Abnahmesystem.
Erythrozyten, Thrombozyten und Blutentnahme\"\r\"BlutentnahmePlasma können im geschlossenen System mit mehreren Beuteln sterilHygienemaßnahmen:Blutentnahme\"\r\"Blutentnahme getrennt und aus dem Primärbeutel in Satellitenbeutel überführt werden. Der einzige Grund, das System zu eröffnen, ist die Umfüllung des Transfusionsguts in Perfusorspritzen für Blutfraktionierungspezielle Anwendungen in der Pädiatrie. Die Indikation für gewaschene Erythrozytenkonzentrate ist sehr selten und wird fast ausschließlich für Patienten mit anaphylaktischen Reaktionen auf IgA bei IgA-Mangel benötigt. Sie werden, ebenso wie die „Austauschkonserven“ für Neugeborene (0-Erythrozyten und AB-Plasma), im funktionell geschlossenen System mittels steril arbeitender Schlauchschweißgeräte hergestellt (Querschnitts-Leitlinien 2009).
Auch die seit 2001 obligatorische starke Verminderung der Leukozyten durch Filterung (Leukozytendepletion) erfolgt im geschlossenen System entweder als Filtration des Vollbluts oder der einzelnen Blutkomponenten. Damit reduziert sich neben dem Risiko einer Immunisierung gegen leukozytäre Antigene des Spenders auch das Risiko einer Übertragung von in Leukozyten vorhandenen Bakterien (z. B. Mettille et al. 2000), Viren (Rawal et al. 1991, Gong et al. 1994) und leukozytengebundenen Prionen (Gregori et al. 2004).
5.27.5. Lagerung von Blutprodukten
Erythrozytenkonzentrat(e):LagerungErythrozytenkonzentrate werden bei Temperaturen von 4 ± 2 °C in erschütterungsfreien, temperaturüberwachten Kühlschränken gelagert.
Nur wenige Bakterienspezies können sich bei 4 °C zu hohen Konzentrationen vermehren. Zu diesen zählt Y. enterocolitica, für die eine Temperatur von 4 °C sogar ein positives Selektionskriterium ist (Blajchman 1998, Arbeitskreis Blut 1999). Nach anfänglicher Adaptationsphase erfolgt eine exponentielle Vermehrung dieser Erreger. Unterbrechungen der Kühlkette verbessern die Vermehrungsbedingungen und ermöglichen die Vermehrung weiterer Bakterienspezies.
Deshalb sollte innerhalb von 30 Minuten nach Unterbrechung der Kühlkette entweder mit der Transfusion begonnen oder nicht benötigte Blutkonserven, wenn laut hauseigener Transfusionsordnung zulässig, ins Depot zurückgebracht werden (Petz und Swisher 1989).
Die Lagertemperatur von Thrombozytenkonzentrat(e):LagerungThrombozytenkonzentraten beträgt 22 ± 2 °C.
Die Funktion von Thrombozyten würde im Kühlschrank irreversibel geschädigt. Durch die relativ hohe Lagertemperatur sind Thrombozytenkonzentrate hinsichtlich bakterieller Vermehrung besonders gefährdet.
Die Lagerdauer von Thrombozytenkonzentraten ist daher auf maximal 4 Tage begrenzt.
Mittlerweile sind Verfahren marktreif, die durch biochemische oder biophysikalische Prozesse in Thrombozytenkonzentraten eine breite Palette von Pathogenen mit unterschiedlicher Wirksamkeit inaktivieren können (Council of Europe 2001, McCluskey et al. 2009). Für jedes einzelne Verfahren ist sorgfältig zu prüfen, ob die durch das Verfahren bedingte mögliche verminderte Wirksamkeit, Neoantigenität und/oder Kanzerogenität das extrem geringe Restrisiko durch die zu verhindernden Infektionen aufwiegen (Kerkhoffs et al. 2010). Die Empfehlungen des Europarats zur Pathogeninaktivierung sind daher diesen Verfahren gegenüber sehr kritisch (Caspari et al. 2005). Einen möglichen Vorteil bieten diese Verfahren vor allem bei Auftreten neuer Erreger, die durch Anamnese und Labortestung nicht zu erfassen sind und zu hoher Morbidität und Mortalität beim Blutempfänger führen.
Die begrenzte Haltbarkeit macht eine Quarantänelagerung von Thrombozytenkonzentraten unmöglich.
Frischplasma:LagerungFrischplasma wird innerhalb weniger Stunden nach der Blutentnahme tiefgefroren und bei Temperaturen ≤ 30 °C gelagert.
Unter diesen Bedingungen scheint ein Bakterienwachstum nahezu ausgeschlossen. Beschreibungen bakterieller Kontaminationen durch Frischplasma einschließlich publizierter Todesfälle sind zitiert bei Montag et al. (1999). Das Plasma muss entweder einem anerkannten Verfahren der Virusinaktivierung unterzogen werden, wofür zurzeit das Solvens-Detergens-Verfahren infrage kommt, oder 4 Monate quarantänegelagert werden (Arbeitskreis Blut 2003), d. h., der Spender muss frühestens 4 Monate nach der Spende nochmals untersucht werden und die virusserologischen Screeningtests (Anti-HIV, Anti-HCV, HBs-Antigen, HCV-RNA, HIV-RNA, ggf. ALT) müssen unauffällig sein.
Die Lagerung von Blut und Blutprodukten darf keine bakterielle Besiedlung der Präparate von außen zulassen. Eine akzidentelle Kontamination der Konserven von außen kann unter geeigneten Umständen zur Verbreitung von Bakterien führen, die schwerwiegende nosokomiale Infektionen auslösen können, z. B. aus dem Labor in das OP-Feld.
In vielen Krankenhäusern werden vor größeren Operationen vorsorglich Erythrozytenkonzentrate aus dem Blutdepot in den OP-Saal gebracht und nach der OP nicht benötigte Blutkonserven wieder zurück in das Blutdepot geschickt. Von dort werden die Blutkonserven dann an den nächsten Patienten ausgegeben. Eine Möglichkeit, die bakterielle Kontamination der Blutbeutel von außen zu vermeiden, besteht darin, diese in eine Plastiktüte verpackt vom Blutdepot auszugeben (z. B. alle EK für einen Patienten) und diese Umverpackung bei Rücknahme der Blutkonserven zu vernichten.
Industriell hergestellte Plasmafraktionen, z. B. Gerinnungsfaktorenkonzentrate, müssen nach den Vorschriften des Herstellers gelagert und aufbereitet werden.
5.27.6. Sterilitätstestung von Blutkomponenten
Der Nachweis der Sterilität von Blutkomponenten, SterilitätstestungBlutkomponenten (Erythrozyten- und Thrombozytenkonzentrat(e):Sterilitätstestung Frischplasma:Sterilitätstestung Erythrozytenkonzentrat(e):SterilitätstestungThrombozytenkonzentrate; quarantänegelagertes Frischplasma) kann nur stichprobenartig erfolgen. Bei einer Charge aus gepooltem Plasma vieler Spender, das dann wieder in Einzelportionen abgefüllt wird, wie dem Solvens-Detergens-inaktivierten Plasma, ist eine Chargenkontrolle möglich.
Die Blutbestandteilkonserven müssen anhand von Stichproben mit geeigneten Methoden auf Abwesenheit von Bakterien und Pilzen getestet werden. Der Probenumfang Blutprodukte:Lagerung\"\r\"BlutprodLagerungbeträgt 0,4-mal Wurzel aus der Gesamtzahl der Monatsproduktion jeder Blutkomponente pro Betriebsstätte. Dabei müssen evtl. nachgewiesene Mikroorganismen differenziert werden. Das kann wichtige Hinweise auf den Ursprung der Kontamination geben, z. B. Hautflora (mangelnde Antiseptik der Punktionsstelle). Y. enterocolitica (mangelnde Spenderuntersuchung/-anamnese), „exotische Bakterien“ (Verdacht auf Kontamination des Antikoagulans bzw. der additiven Lösung im Erythrozytenkonzentrat).
5.27.7. Thermische Behandlung von Blutprodukten
Gefrorenes Frischplasma:gefrorenes, AuftauenFrischplasma (GFP) ist das Blutprodukte:thermische Behandlungeinzige Standardblutprodukt, das vor der Transfusion möglichst schnell bei maximal 37 °C aufgetaut werden muss. Thrombozytenkonzentrate sollten grundsätzlich nicht gewärmt werden. Erythrozytenkonzentrate sind i. d. R. nicht zu erwärmen (s. u.).
Jede Erwärmung von Blutprodukten erhöht die Vermehrungsmöglichkeit für Bakterien. Erwärmen von Erythrozytenkonzentraten ist i. d. R. nicht erforderlich. Ausnahmen sind Massivtransfusionen mit Zufuhr von mehr als 50 ml EK/min bei bereits vor der Transfusion unterkühlten Patienten, Patienten mit einer Blutprodukte:Erwärmungchronischen Kälteagglutininkrankheit und hochtitrigen Kälteantikörpern, Patienten, die auf den Kältereiz durch gekühltes Blut mit Vasospasmus reagieren, sowie Transfusionen und Austauschtransfusionen bei Neugeborenen (Querschnitts-Leitlinien 2009). Für die Erwärmung dürfen nur zugelassene Blutwärm- und Plasmaauftaugeräte verwendet werden. Diese unterliegen den Vorschriften des MPG (2002). Die Erwärmung von Blut oder Blutbestandteilen mit anderen Hilfsmitteln, z. B. das Eintauchen in heißes Wasser, lässt sich nicht kontrollieren. Sie birgt die Gefahr der Hämolyse bzw. Proteindenaturierung und ist deshalb abzulehnen.
In temperaturgeregelten Wasserbädern wird das Transfusionsgut direkt oder durch einen Kunststoffbeutel geschützt in Wasser gelegt. Da das Temperiermedium nicht im geschlossenen System zirkuliert, besteht das Risiko der massiven Anreicherung pathogener Mikroorganismen. Deshalb sind offene Wasserbäder in OP-Einheiten und Stationsräumen abzulehnen. Auch in Laborräumen können durch besiedelte Wasserbäder Hospitalerreger von außen auf die Blutbeutel übertragen und weiterverbreitet werden. Ein Zusatz von Desinfektionsmitteln o. Ä. zum Temperiermedium ist problematisch, da diese Mittel mit den Kunststofffolien der Blutbeutel reagieren können.
In Trockenwärmegeräten wird das Transfusionsgut zwischen elektrisch beheizten Metallplatten oder mit warmem Wasser durchströmten Kissen erwärmt. Hierdurch ist die Gefahr einer bakteriellen Kontamination stark vermindert.
Einer guten Validierung bedürfen Diathermiegeräte (Mikrowellengeräte), da bei diesen Geräten eine gleichmäßige Temperaturverteilung von vielen Faktoren abhängt.
In Durchflusserwärmern wird das Blut während der Transfusion im Transfusionsschlauch erwärmt. Dieser ist entsprechend länger und liegt zwischen Wärmeelementen. Es sind Geräte für normale und hohe Fließgeschwindigkeiten im Handel (Ciavarella und Snyder 1988, Dietz und Behne 1993).
5.27.8. Applikation von Blut- und Blutbestandteilkonserven
Vor Transfusion(en):Durchführungder Blutkonserven:Applikation Blutbestandteilkonserven, ApplikationVorbereitung einer Blutkonserve zur Transfusion ist eine hygienische Händedesinfektion durchzuführen.
Jede Transfusion muss über ein steriles Transfusionsbesteck mit Filter erfolgen. Die Standardfilter haben eine Porengröße von 170–230 μm und sind damit für Bakterien durchlässig. Sie sind für die Transfusion von Erythrozyten, Thrombozyten und Plasma geeignet. Die Transfusionsbestecke werden industriell hergestellt und strahlensterilisiert. Sie sind nur zur einmaligen Verwendung deklariert. In den Filtern sammeln sich größere Proteinmengen, die ein idealer Nährboden für Bakterien sind. Deshalb sollen Filter nicht länger als 4 Stunden benutzt werden.
Beim Einführen des Einstichdorns des Transfusionsbestecks in den präformierten Stichkanal des Blutbeutels sollte besonders umsichtig vorgegangen werden. Berührungen des Einstichdorns mit der äußeren Beuteloberfläche sind zu vermeiden. Wird der Blutbeutel nach Einführen des Dorns geknickt, kann die Spitze des Dorns die Beutelfolie perforieren und so das geschlossene System zerstören.
5.27.9. Autologe Transfusion
Für die Gewinnung autologen Blutes gibt es neben der ambulanten präoperativen Eigenblutspende und Eigenplasmapherese auch die Möglichkeiten der präoperativen isovolämischen Hämodilution sowie der maschinellen Autotransfusion (Koscielny et al. 1995).
Für die präoperative Eigenblutspende und Eigenplasmapherese sowie die EigenblutspendeRetransfusion autologer Erythrozytenkonzentrate und Plasmen gelten die EigenplasmaphereseAbschnitte 5.27.1 bis 5.27.8 in vollem Umfang.
Häufig werden Patienten zur präoperativen Eigenblutspende vorgestellt, die entsprechend ihrem Alter, ihrer physischen Konstitution, ihrer Vorerkrankungen und Begleitmedikationen nicht mehr die Eignungskriterien eines Fremdblutspenders gemäß den Hämotherapie-Richtlinien (2010) erfüllen. Mit einem Risikoscore kann die EigenblutspendeEigenblutspendetauglichkeit zügig beurteilt werden (Leimkühler et al. 1995). Entscheidend für den Entschluss zur Eigenblutspende ist der Nachweis einer positiven Nutzen-Risiko-Bilanz (Kretschmer et al. 1994).
Patienten, bei denen eine HBV-, HCV- oder HIV-Infektion besteht, sollten von der Eigenblutspende ausgeschlossen werden, da durch sie im Fall einer Verwechslung des Patienten bei der Retransfusion diese schwerwiegenden Infektionen übertragen werden würden. Ist die Spende aus transfusionsmedizinischen Gründen unvermeidlich, z. B. bei sehr seltenen Blutgruppen, soll die Spende getrennt von anderen Spenden gelagert und deutlich als infektiös gekennzeichnet werden.
Die Zahl der Verwechslungen, die zur Transfusion von Blutkonserven an einen nicht dafür vorgesehenen Empfänger führt, wird zwischen 1 : 500 und 1 : 30.000 geschätzt.
Die geringere Häufigkeit leitet sich von retrospektiv erfassten, klinisch in Erscheinung getretenen Komplikationen bei bzw. nach i. d. R. AB0-inkompatiblen Transfusionen ab. Bei prospektiver Erfassung z. B. von Blutgruppenveränderungen von Patienten bei aufeinanderfolgenden Proben durch Vertauschung gelangt man eher zu den höheren Schätzwerten.
Bei der präoperativen isovolämischen Hämodilution nimmt der Anästhesist dem Patienten unmittelbar vor dem Eingriff Vollblut in einer Menge von 10–20 ml/kg KG ab (Bormann und Friedrich 1993). Gleichzeitig werden kontralateral Plasmaexpander infundiert. Der Hämatokrit sinkt auf einen Wert zwischen 25 und 30 %. Hämodilution, isovolämische, präoperativeSo verringert sich der intraoperative Erythrozytenverlust. Wenn das so gewonnene Eigenblut bei Raumtemperatur gelagert wird, können sich Bakterien vermehren. Das sollte vor allem bei Eingriffen, die länger als 4 Stunden dauern, berücksichtigt werden. In der Regel wird das präoperativ gewonnene Vollblut unmittelbar postoperativ retransfundiert.
Bei der maschinellen Autotransfusion, maschinelleAutotransfusion darf das Wundblut nur aus sog. sterilen OP-Feldern entnommen werden, z. B. bei der Implantation einer totalen Hüftendoprothese oder gefäßchirurgischen Eingriffen.
Der Operateur sammelt Wundblut aus dem OP-Feld in ein steriles System (Schleinzer et al. 1995, Seyfert et al. 1995). In diesem „cell saver“ werden die Erythrozyten mit isotoner NaCl-Lösung gespült und so von Zellfragmenten und Wundflüssigkeit befreit. Intra- oder postoperativ erfolgt die Retransfusion der gewaschenen autologen Erythrozyten. Der Plasmaersatz kann mit autologem Plasma der Eigenblutspende bzw. Eigenplasmapherese erfolgen.
5.27.10. Entsorgung von Transfusionsgut
Bei der Produktion von Blut- und Blutbestandteilkonserven sowie deren Anwendung entsteht Abfall in Form von Abnahme- und Transfusion(en):autologeTransfusionssystemen sowie leeren und z. T. gefüllten Blutbeuteln.
Das Abfallrecht wurde in den letzten 10 Jahren durch europäische Richtlinien und Transfusionsgut, EntsorgungVerordnungen sowie Bundesgesetze neu gestaltet (Abfallrecht 2003). Die ländereinheitliche Umsetzung des Abfallrechts für medizinische Abfälle dient als Orientierung, gilt aber nur insoweit, als Länder und Kommunen keine anderen Regeln zur Umsetzung treffen. Sie soll die relevanten Gesetze, Verordnungen und Verwaltungsvorschriften konkretisieren, ist aber rechtlich nicht verbindlich. die Zuordnung der Abfälle erfolgt zu einzelnen Abfallschlüsseln entsprechend der Abfallverzeichnisverordnung (Pilz und Juditzki 2003, Kap. 6.7).
Unter den Abfallschlüssel (AS) 180102 (früher E-Müll) fallen neben Körperteilen und Organen auch teilgefüllte oder gefüllte (verfallene) Blutkonserven. Diese sind am Abfallort gesondert zu erfassen und dürfen nicht mit anderen Abfällen vermischt werden. Sammlung und Transport erfolgen in verbrennbaren, bauartzugelassenen Einwegbehältnissen, die mit dem Entsorgungsunternehmen bzw. der Entsorgungsanlage abzustimmen sind. Die Entsorgung erfolgt in einer zugelassenen Verbrennungsanlage. Alternativ ist die Leerung einzelner Beutel unter Beachtung hygienischer und infektionspräventiver Gesichtpunkte sowie der kommunalen Abwassersatzung in die Kanalisation möglich. Die leeren Blutbeutel sind dann nach AS 180104 einzuordnen. Infektiöse Blutkonserven (AS 180103, früher C-Müll) werden i. d. R. durch Sterilisation zu Abfällen, an deren Sammlung und Entsorgung aus infektionspräventiver Sicht keine besonderen Anforderungen zu stellen sind (AS 180104).
5.28. Pathologie, Neuropathologie, Rechtsmedizin und Anatomie
Stefan Koch, Wolfgang J. Schulz-Schaeffer, Britta Bockholdt und Axel Kramer
Waren früher die Infektionsrisiken (z. B. Tuberkulose, Transfusionsmedizin\"\r\"TransfusionsmedSyphilis, Tetanus) für in der Pathologie beschäftigtes Personal fast ausschließlich mit der Obduktionstätigkeit verbunden, ergeben sich heutzutage zusätzlich Risiken bei der Beurteilung von Frischmaterial oder noch nicht vollständig fixierten Zell- und Gewebepräparaten. Durch die Einführung neuer Diagnose- und Therapieverfahren und im Rahmen von Kostenbegrenzung, Verweildauerreduktion und Fallzahlsteigerung sollen die Untersuchungsergebnisse immer kurzfristiger nach Materialentnahme vorliegen. Das darf jedoch nicht zur Vernachlässigung des Arbeits- und Infektionsschutzes führen. Vielmehr ist es erforderlich, die Arbeitsabläufe permanent hinsichtlich der Anforderungen an den Infektionsschutz zu überprüfen.
5.28.1. Infektionsrisiken
In Pathologie, Neuropathologie, Rechtsmedizin und Anatomie besteht ein Infektionsrisiko für Obduzenten, Sektionsmitarbeiter und Studenten, aber auch für Teilnehmer an autoptischen Befunddemonstrationen, für Personen, die mit dem Leichnam umgehen wie Bestatter, Krematoriumsmitarbeiter, Einbalsamierer und Angehörige, beim Umgang mit Sektionsasservaten sowie bei chemischen Analysen von Organproben, Blut, Liquor, Urin und Kot.
Infektionsgefährdung ist möglich durch Einatmen, Verschlucken, Verletzung, Einbringen in vorbestehende Hautwunden und Aufnahme über Schleimhäute (Augen, Nase, Mund). Risiken gehen von einer Tbk-, HCV-, HBV-, HIV- und Prioninfektion des Leichnams oder entnommener Gewebeproben aus. Erhöhte Vorsichtsmaßnahmen gelten auch bei Meningokokkeninfektion und Infektionen durch MRE.
Tuberkulose, Virushepatitis, HIV-Infektion/AIDS: Im Sektionssaal geht die größte Infektionsgefahr von Tbk aus. Das Personal nachgeordneter Laborbereiche ist deutlich weniger gefährdet. Hauptsächliche Infektionsquelle sind mykobakterienhaltige Aerosole oder Gewebeversprengungen, die besonders beim Abspülen und Aufschneiden von Organen mit ungeeigneten Messern (zu kurze Klingen) und stumpfen Scheren (Spritzgefahr durch kleine Tröpfchen), Sägen von Knochen mit oszillierenden Sägen (Aerosole) sowie Herstellung von Gefrierschnitten (Umherfliegen statisch aufgeladener Gewebepartikel) entstehen können. Neben der inhalativen Aufnahme von Krankheitserregern ist die Infektion über akzidentelle Hautverletzungen bei der Eviszeration des Leichnams, der Bearbeitung von Sputumproben, beim Schneiden einzelner Organe und bei der makroskopischen Untersuchung frischer OP-Präparate möglich.
Der gleiche Personenkreis ist durch HBV-, HCV- und HIV-Infektion gefährdet. Eintrittspforten sind Hautschnittverletzungen, Wunden und Stichverletzungen sowie die Augen, z. B. bei Kontamination mit Blut, Körperflüssigkeiten und Spülmedien. 2008 gab es ca. 3.000 HIV-Neuinfektionen in Deutschland (RKI 2009). Bisher ist allerdings nur eine berufsbedingte HIV-Infektion eines Pathologen dokumentiert (Johnson et al. 1997), sodass das Berufsrisiko einer HIV-Infektion für Mitarbeiter in der Pathologie als gering einzuschätzen ist (Ruggiero et al. 2009). Während HIV-Antikörper in Leichen und Blutproben jahrelang stabil bleiben können, war die Virusisolierung aus Vollblut nur bis maximal 36 Stunden postmortaler Leichenliegezeit erfolgreich (Püschel et al. 1991).
Prionerkrankungen: Die verschiedenen Formen der TSE wie CJD, letale familiäre Insomnie (FFI), das hereditäre Gerstmann-Sträussler-Scheinker-Syndrom (GSS) und vCJD (Kap. 3.3) sind nach derzeitigem Kenntnisstand nur durch aktives Einbringen des Erregers in den Körper, nicht aber durch soziale und sexuelle Kontakte übertragbar (Simon und Pauli, 1998, Rudolph et al. 2001). Für die Gefährdungseinschätzung ist zu beachten, dass bei sporadischen und genetischen Prionkrankheiten nur das ZNS, bei vCJD auch das periphere lymphatische Gewebe hohe Erregermengen enthalten kann (Task Force vCJK 2002).
Für bioptische und autoptische Untersuchungen sollten sämtliche Materialien von Patienten mit ungeklärten Demenzen, insbesondere in Kombination mit Myoklonien, Ataxie und auffälligen EEG-Befunden, als CJD-Verdachtsfälle gelten (Schulz-Schaeffer et al. 1998, AWMF 2007). Insbesondere in der Rechtsmedizin bleibt allerdings ein generell erhöhtes Risiko bei Sektionen von Personen mit unbekannter Anamnese und in den Fällen, in denen die Obduktion sehr kurze Zeit nach dem Todeseintritt durchgeführt wird.
Meningokokkeninfektionen, SARS, ESBL: Bei Meningokokkeninfektionen SARS:Infektionsrisiko Meningokokkeninfektion(en), Infektionsrisikobesteht bei Autopsien kurz nach Todeseintritt Ansteckungsgefahr (Healing et al. 1995). Das gilt prinzipiell auch für das schwerere akute Atemnotsyndrom durch Coronaviren (SARS-CoV), obwohl bislang kein Übertragungsfall durch Umgang mit diagnostischen Proben oder bei Autopsien bekannt geworden ist (CDC-SARS Guidance 2004). Von längerzeitig beerdigten Verstorbenen geht dagegen keine Infektionsgefahr aus. Das gilt auch für Pest, Cholera, Typhus, Tbk und Pocken, da diese Erreger unter den Bedingungen des Erdgrabs kein Langzeitüberleben zeigen. Eine Ausnahme bildet der Milzbranderreger, der noch nach Jahrzehnten im Boden lebensfähig ist. Auch Salmonellen können bis zu 2 Jahre im Boden infektiös bleiben. Schimmelpilzsporen können bei Exhumierungen ein gesundheitliches Risiko darstellen (Healing et al. 1995), z. B. bei der Untersuchung von Mumien oder anderen postmortal veränderten Leichen.
Vogelgrippe und andere Influenzaarten: Das Risiko im Umgang mit Gewebeproben oder bei Autopsien von Patienten mit Vogelgrippe oder anderen Influenzaarten ist nicht höher als der Umgang mit daran erkrankten Patienten. Influenzaviren sind empfindlich gegen die üblichen Desinfektionsmittel, überleben üblicherweise bis 2 Tage (Kramer et al. 2006). Vogelgrippeviren können in Abhängigkeit von pH-Wert, Feuchtigkeit, Temperatur und Salzgehalt 120–180 Tage persistieren (Brown et al. 2007, 2009). Auch hier stellen Obduktionen, die zeitnah nach dem Todeseintritt durchgeführt werden, eine besondere Gefährdung dar.Neuropathologie:Infektionsrisiken\"\r\"PathologieInfektionsrisiken Infektionsrisiko:Pathologie\"\r\"PathologieInfektionsrisiken Infektionsrisiko:Neuropathologie\"\r\"PathologieInfektionsrisiken Infektionsrisiko:Anatomie\"\r\"PathologieInfektionsrisiken Anatomie:Infektionsrisiken\"\r\"PathologieInfektionsrisiken
5.28.2. Verletzungsrisiken
Infektionsrisiko:Gerichtsmedizin\"\r\"PathologieInfektionsrisikenBei der Obduktion Verletzungsrisiko:Pathologie Verletzungsrisiko:Neuropathologie Pathologie:Verletzungsrisiko Pathologie:Infektionsrisiken\"\r\"PathologieInfektionsrisiken Neuropathologie:Verletzungsrisiko Gerichtsmedizin:Infektionsrisiken\"\r\"PathologieInfektionsrisikenbesteht die Gefahr der Stich- oder Schnittverletzung an Anatomie:Verletzungsrisikoscharfkantigen Knochenbrüchen bei Unfallopfern oder Opfern von Verletzungsrisiko:AnatomieTötungsdelikten und an scharfkantigen Gegenständen im Körper des Rechtsmedizin:VerletzungsrisikoLeichnams. Diese können auf verschiedenste Weise in den Körper eingebracht wordenVerletzungsrisiko:Rechtsmedizin sein: Metallteile im Rahmen von Explosionen, Projektilfragmente, abgebrochene Messerklingen bei Suizid und Tötungsdelikten und im Körper verbliebene MP. Bei letzteren kann es sich um im Körper verbliebene Injektionsnadeln, z. B. bei i. v. Drogenabhängigen, die HIV-/HBV-/HCV-Risikopatienten sind (Hutchins et al. 2001), oder implantierte MP wie spitzkantige Vena-cava-(Greenfield-)Filter (Abraham und Greenfield 1995) oder vergleichsweise stromstarke Defibrillatoren (Prahlow et al. 1997) handeln. Auch das Vorgehen bei der Obduktion birgt Verletzungsgefahren. Scharfkantige Knochenfragmente können z. B. bei Eröffnung des Brustkorbs und des Schädels entstehen oder infolge von Unfallverletzungen vorliegen. Die Obduzenten sollten bei zu stark gekühlten oder partiell gefrorenen Leichen (Rechtsmedizin) besondere Vorsicht walten lassen. Mit kalten Fingern sind scharfe Kanten meist erst spät spürbar. Die Verletzungsgefahr ist deutlich erhöht.
5.28.3. Gefährdung durch chemische Noxen und radioaktive Strahlen
Chemische Risiken gehen von folgenden häufig verwendeten Stoffen aus: Phenol, Xylol, aromatische Amine, Methacrylate, Aldehyde, Diaminobenzidin, Natriumazid, Nitrite, Bleisalzverbindungen, sublimathaltige Fixanzien, Aceton, Trichlorethylen.
Die Möglichkeit der Strahlenexposition besteht bei vor dem Tod vorgenommener Radioiodtherapie mit 131I, Afterloadingtherapie mit 125I sowieStrahlenexposition:Rechtsmedizin Schmerztherapie von Skelettmetastasen mit 89Sr (Adrion und Pira Strahlenexposition:Pathologie1994). Obwohl die meisten eingesetzten Radionuklide eine Strahlenexposition:NeuropathologieHalbwertszeit < 6 Stunden besitzen, empfiehlt sich die Dosimetrie des Leichnams bei entsprechender Anamnese. Bei Überschreitung des 5 × 102-Fachen, bei umschlossenen radioaktiven Stoffen des 5 × 103-Fachen der Freigrenzen muss die Sektion bei Einhaltung der Schutzvorschriften für beruflich Strahlenexponierte gemäß Richtlinie Strahlenschutz in der Medizin (BMU 2002) in einem gekennzeichneten Kontrollbereich mit Strahlenschutzvorrichtungen durchgeführt und von einem Strahlenschutzbeauftragten, der nicht Arzt zu sein braucht, beaufsichtigt werden.
Leichenkonservierung und Schutz vor Formaldehydbelastung: Es empfiehlt sich, den Anteil von Formaldehyd in der Konservierungslösung auf < 1 Vol. % zu reduzieren bzw. komplett auf Formaldehyd zu verzichten (Koch et al. 2001, Nicholson et al. 2005, Whitehead und Savoia 2008).
SofernFormaldehyd:Anatomie noch Formaldehyd verwendet wird, kann zur Minimierung der Leichenkonservierunginhalativen Exposition über jedem studentischen Präpariertisch eine LAF-Decke mit zentraler Absaugung der Abluft aus dem Raum installiert werden (realisiert im Institut für Anatomie der Universitätsmedizin Greifswald); mit Fensterbelüftung oder Ventilatoren gelingt es nicht, die MAK-Werte einzuhalten.
5.28.4. Grundsätzliche Hygienemaßnahmen bei Autopsien
Der obligatorische Personenschutz Hygienemaßnahmen:Autopsien Autopsie(n):Hygienemaßnahmenumfasst das Tragen von 2 Paar Gummihandschuhen bzw. sicherer von schnittfesten Schutzhandschuhen (Fritzsche et al. 2008), flüssigkeitsdichtem Schutzkittel oder Einwegschürze, beschlagfreier (Schutz-)Brille und Mund-Nasen-Schutz als Spritzschutz.
Bei der Obduktion sollen folgende Grundsätze beachtet werden:
-
•
Im Obduktionssaal halten sich nicht mehr Personen als notwendig auf.
-
•
Der gemäß Strafprozessordnung berechtigte Kreis anwesender Personen bei gerichtlichen Sektionen (Staatsanwalt, Kriminalbeamte) muss über das Autopsie(n)Verhalten im Autopsieraum unterrichtet werden. Bei Arbeiten an Leichen durch Nichtmediziner (Foto, Asservierung von Kleiderproben und Fingerabdrücken) gelten die gleichen Hygienevorschriften wie für das Sektionspersonal (Schutzkleidung, Schutzhandschuhe [Fritzsche et al. 2008, Saternus und Madea 2007], Händedesinfektion bei Verlassen des Sektionssaals).
-
•
Die Obduktion wird so durchgeführt, dass Blutantrocknungen an Leiche, Sektionstisch und Fußbodenflächen vermieden werden. Dazu wird eine ruhig fließende, Spritzwasser- und Aerosolbildung vermeidende Tischbewässerung empfohlen.
-
•
Zum Schutz vor Schnittverletzungen wird nur unter Sicht und mit scharfen Skalpellen oder Messern präpariert.
-
•
Entnommene Organe werden bis zur klinischen Demonstration auf hierfür vorgesehene Tabletts abgelegt.
-
•
Gewebeproben zur histologischen Untersuchung sollen nicht in Glasgefäßen asserviert werden. Die Gefäße müssen dicht verschließbar sein und sollen mindestens 5-mal mehr Volumen an Fixierungsflüssigkeit als zu fixierendes Gewebe enthalten. Ggf. wird die Fixierungsflüssigkeit gewisse Zeit nach der Erstasservierung gewechselt.
-
•
Beim Sägen von Schädel und Rückenmarkkanal müssen Aerosole vermieden werden. Das gelingt effektiv nur durch Verwendung von Handsägen. Bei Verwendung oszillierender Sägen muss eine FFP2-Maske getragen werden bzw. die oszillierende Säge mit einer Absaugvorrichtung ausgestattet sein. Bei Patienten mit Verdacht auf Tbk (unklarer Lungenbefund reicht als Verdacht aus), Virushepatitis, AIDS oder CJD birgt der Einsatz oszillierender Sägen immer eine Gesundheitsgefahr für die Mitarbeiter, auch für jene, die erst später den Sektionssaal betreten. Bei Verwendung von Handbügelsägen zur Schädeleröffnung oder zum Heraustrennen anderer Skelettteile entstehen große, nicht erheblich schwingungsfähige Partikel in geringerer Zahl (Kernbach-Wighton et al. 1998, Saternus und Madea 2007), sodass die Infektionsgefahr gering ist. Die Verwendung oszillierender Sägen erhöht die Menge kleiner schwebefähiger Partikel, die im Umkreis von 6–8 m über viele Stunden nachweisbar waren (Kernbach-Wighton und Saternus 1997) und teilweise bis in die Lungenalveolen eingeatmet werden können.
-
•
Nach abgeschlossener Obduktion wird eine Raum- und Flächenreinigung und -desinfektion vorgenommen. Die Instrumentenaufbereitung erfolgt nach den Grundsätzen zur Aufbereitung von MP (Task Force vCJD 2002).
5.28.5. Besondere Schutzmaßnahmen bei Verdacht auf Tbk, HIV, HBV, HCV und weitere problematische Infektionserreger
Zur Prävention von Verletzungen darf bei der Organentnahme stetsAutopsie(n):Schutzmaßnahmen nur eine Person mit Sektionsinstrumenten am Leichnam arbeiten. Sofern sich während der Obduktion ein Tbk-Verdacht ergibt, soll auf die klinische Demonstration unfixierter Organe verzichtet werden. Der Sektionssaal ist unmittelbar nach der Obduktion der HIV:Schutzmaßnahmen, Autopsiengründlichen Desinfektion und Reinigung zu unterziehen. Asservate sind mit dem Hinweis der Tbk-Gefährdung zu kennzeichnen. Für die Dauer der Obduktion und des nachfolgenden Aufenthalts im Obduktionssaal müssen alle Anwesende eine partikelfiltrierende Halbmaske gemäß EN 149 der Schutzstufe FFP2 anlegen. Bei Hinweis auf multiresistente Tbk-Erreger empfiehlt sich Schutzstufe FFP3 (Kramer et al. 1997, Saternus und Madea 2007).
Zum Schutz nachfolgender Kontaktpersonen sollte bei HIV, analog wie bei Virushepatitis, TSE, SARS, ESBL u. a. meldepflichtigen Infektionserkrankungen, die Leiche als „infektiös“ gekennzeichnet und dem Bestatter in einer Schutzhülle (Leichensack, „bodybag“) übergeben werden.
5.28.6. Besondere Schutzmaßnahmen bei Verdacht auf Prionerkrankung
Obduktion bei Verdacht auf Prionerkrankungen: Zusätzlich zu den gleichen Vorkehrungen wie bei Verstorbenen mit HIV-Infektion bzw. AIDS werden folgenden Schutzmaßnahmen empfohlen (Schulz-Prionerkrankung(en):AutopsienSchaeffer et al. 1998, 2006, Meyermann 2005, Mitglieder-Handbuch des Autopsie(n):PrionerkrankungenBerufsverbandes Deutscher Pathologen e. V.):
-
•
Die Obduktion\t\"Siehe Autopsie(n)Obduktion kann prinzipiell in jeder Pathologie/Rechtsmedizin stattfinden. Der Sektionssaal muss ausreichend geräumig sein, sodass die handelnden Personen sich frei und ohne Gefahr akzidenteller Kontamination bewegen können. Nicht benötigte Einrichtungsgegenstände wie der Sektionstischaufsatz werden aus dem Raum entfernt.
-
•
Bei der Sektion sind mindestens zwei, besser drei Personen anwesend. Eine Person bleibt sauber, dokumentiert und kann zur Not helfend eingreifen.
-
•
Es wird empfohlen, schnittfeste Kevlar-Handschuhe (oder Kettenhandschuhe) unter den üblichen Sektionshandschuhen zusätzlich zum obligatorischen Personenschutz zu tragen.
-
•
Die Sektion erfolgt als In-situ-Obduktion auf einem mit Plastikfolien abgedeckten Sektionstisch ohne Verwendung von Wasser und mit Aufnahme aller Flüssigkeit mit Zellstoff.
-
•
Hirn- und ggf. Rückenmarkentnahme erfolgen als letzter Sektionsschritt nach Aufsägen von Schädelkalotte und Wirbelsäule ohne Verletzung von Hirn und Rückenmark mittels Handsäge.
-
•
Verbrauchsmaterialien (Tischabdeckung, Zellstoff, Einmalmaterial) werden nach der Obduktion in dichten, nicht wieder zu öffnenden, bruchsicheren Plastiktonnen mit der Kennzeichnung „biohazard“ (6.2) UN 3373 zur Entsorgung durch Verbrennen abgegeben (AS 180103). Gemäß der Richtlinie über die ordnungsgemäße Entsorgung von Abfällen aus Einrichtungen des Gesundheitsdienstes können TSE-haltige Abfälle nur durch Verbrennen entsorgt werden (LAGA 2002).
-
•
Die Instrumentenaufbereitung erfolgt durch Einlegen in 2 M NaOH-Lösung für 2-mal 30 Minuten mit zwischenzeitlichem Lösungswechsel oder über Nacht mit anschließendem Sattdampfautoklavieren bei 134 °C für 1 Stunde (Prionprogramm).
-
•
Der Leichnam wird nach Sektion mit 1–2 N NaOH gereinigt; die Abgabe des Leichnams erfolgt im Bodybag mit der Kennzeichnung „infektiös“.
-
•
Kontaminierte Haut sollte für 5 Minuten mit 1 N NaOH gewaschen und danach unter fließendem Wasser abgespült werden. Gleiches gilt für Hautverletzungen mit infektiösen Gegenständen.
-
•
Kontaminationen auf Oberflächen und Boden sollen mehrfach mit 2 N NaOH gewischt werden, um eine längere Einwirkzeit zu gewährleisten. NaOH kann nicht auf Aluminium- oder Zinkoberflächen verwandt werden. Alternativ kann NaOCl mit einem Gehalt an freiem Chlor von mindestens 20.000 ppm eingesetzt werden (Vorsicht, die Lösung enthält reizende Gase; sie muss immer frisch angesetzt werden).
Histologische Untersuchungen bei Verdacht auf Prionerkrankungen: Zunächst sollten aus einer Großhirnhemisphäre je ein etwa 1 cm dicker Frontalschnitt in Höhe des Corpus mamillare, dem Frontalpol und dem Okzipitalpol sowie ein parasagittaler Schnitt durch eine Kleinhirnhemispäre bei –20 bis –80 °C eingefroren werdenPrionerkrankung(en):histologische Untersuchungen, Vorgehen. Der Rest wird in 4-prozentigem Formalin fixiert. Proben innerer Organe werden wie üblich in Formaldehydlösung fixiert bzw. tiefgefroren. Da durch Formaldehydfixierung keine effektive Gewebedesinfektion erreichbar ist, muss die Fixierungslösung als infektiös angesehen und mit dem Verbrennungsabfall entsorgt werden. Für die Genanalyse werden bei CJD-Verdacht 2 Röhrchen Blut bei –20 °C asserviert. Die Hirnsektion wird nach mindestens zweiwöchiger Formaldehydfixierung vorgenommen. Dabei wird das Gehirn auf einem mit Plastikplanen und Zellstoff (Sandwich-Verfahren) abgedeckten Tisch zerlegt. Die oberste Plastikplane enthält Löcher zur Flüssigkeitsaufnahme durch den darunterliegenden Zellstoff. Nach dem Zuschnitt der Gewebeproben werden die Gewebekapseln für 1 Stunde in konzentrierter 98- bis 100-prozentiger Ameisensäure dekontaminiert und für 24–48 Stunden in frischer Formaldehydlösung nachfixiert. Zur verlässlichen Gewebeinfiltration sollen die Histozuschnittblöcke nicht dicker als 3–4 mm sein. Nach Dekontamination des Gewebezuschnitts mit Ameisensäure kann dieser in der Routine aufgearbeitet werden. Unter Beachtung der vorgenannten Vorsichtsmaßnahmen bestehen keine Bedenken gegen Obduktionen bei CJD-Verdacht in normal ausgestatteten Sektionsräumen der Pathologie oder Rechtsmedizin (AWFM 2007).
5.28.7. Allgemeine Hygienemaßnahmen bei der Biopsiediagnostik
Hauptproblem ist Hygienemaßnahmen:Biopsiediagnostik Biopsiediagnostik:Hygienemaßnahmender Umgang mit unfixiertem oder nicht vollständig fixiertem Zell- und Gewebematerial. Bis zur vollständigen Fixierung muss prinzipiell von einer potenziellen Infektionsgefahr des Materials ausgegangen werden. Bei den nachfolgenden Arbeitsschritten Einblocken, Schneiden, Entparaffinisieren, Färben und Eindecken besteht keine Infektionsgefahr für HBV, HCV, HIV und nach Vorbehandlung mit Ameisensäure auch nicht für CJD. Ebenso geht von mikroskopischen Dauerpräparaten fixierter Gewebe keine Infektionsgefahr aus.
Schutzmaßnahmen:
-
•
Tragen von Schutzhandschuhen (auch für medizinisch-technische Assistentinnen) mit Prionerkrankung(en):Schutzmaßnahmen\"\r\"PathologieprionerkrschutzHandschuhwechsel bei Defekt und nach Kontakt mit besonders gefährlichem und unfixiertem Material sowie mit angetrocknetem Blut (AWMF 2004) und Schutzkleidung,
-
•
Ausstattung des Zuschnittplatzes im Arbeitsbereich mit einer Unterflurabsaugung zur Abführung von Formaldehyddämpfen,
-
•
Einsatz funktionsfähiger Instrumente mit scharfen Einwegklingen; Arbeitsplatz mit dekontaminierbarer Oberfläche und dekontaminierbarer Zuschnittflächen; die mehrfache Verwendung z. B. von nicht dekontaminierbaren Korkzuschnittflächen ist nicht akzeptabel,
-
•
Vermeidung von Aerosolbildung beim Abspülen von Untersuchungsmaterial und beim Sägen (keine oszillierenden Sägen verwenden!); Mund-Nasen-Schutz und Schutzbrille sind obligat,
-
•
Beachtung der Verletzungsgefahr durch liegende chirurgische Klammern und Markierungssonden sowie beim Anbringen von Nadelmarkierungen,
-
•
vorzugsweise maschinelle Aufbereitung aller eingesetzten Instrumente und wiederverwendbarer Schalen. Desinfizierende Reinigung von Arbeitsplatz, Arbeitsplatten und Pinsel, mit denen Farbmarkierungen angebracht wurden, nach Abschluss des Zuschnitts.
Große OP-Präparate von Hohlorganen werden in Formaldehydlösung übersandt. Im Eingangslabor der Pathologie wird das Präparat von dem für den Zuschnitt Verantwortlichen (Arzt) an geeigneter Stelle eröffnet und der Befund beschrieben. Anschließend wird das eröffnete Präparat bis zum Abschluss der Fixierung wieder in das Einsendegefäß gegeben. Präparate, die zur eindeutigen Befundbeurteilung vom Operateur aufgespannt übersandt werden, sollen auf einer festen Schaumstoffplatte aufgenadelt werden. Zur Gewährleistung der erforderlichen Fixierung müssen diese Platten umgedreht auf der Formaldehydoberfläche schwimmen (aufgenadeltes Präparat taucht in Formaldehyd ein). Die Schaumstoffplatten werden anschließend entsorgt.
5.28.8. Besondere Schutzmaßnahmen bei der Biopsiediagnostik
Biopsien bei Verdacht auf CJD: Mit Biopsieproben bei Verdacht auf CJD wird genauso verfahren wie mit dem histologischen Zuschnitt bei CJD-Autopsien (Kap. 5.28.6). Ist eine Probe nativ eingegangen, sollte etwas Biospiediagnostik:Creutzfeldt-Jakob-ErkrankungGewebe für biochemische Analysen eingefroren werden.
Gefrierschnittdiagnostik: Bei Creutzfeldt-Jakob-Krankheit:BiopsiediagnostikVerdacht auf HIV-Infektion bzw. AIDS, floride HCV-Infektion und Tbk muss die Notwendigkeit der Gefrierschnittuntersuchung gut begründet und im Vorfeld mit den Untersuchern abgestimmt sein. Der obligatorische Personenschutz muss unbedingt eingehalten werden (Kap. 5.28.4). GefrierschnittdiagnostikDas Gefrierschnittgerät muss unmittelbar anschließend der gründlichen Desinfektion mit Abbau und Zerlegung der Schneideeinrichtung unterzogen werden. Eine Gefrierschnittuntersuchung bei Verdacht auf Vorliegen einer Prionerkrankung kann nur an Geräten erfolgen, die ausschließlich für diesen Zweck eingesetzt werden. Diese sind in Forschungseinrichtungen mit Prionschwerpunkt vorhanden.
5.28.9. Versand von Probenmaterial und Abfallentsorgung
Der Biopsiediagnostik:Schutzmaßnahmen\"\r\"BiospiediagnostikSchutzmVersand von infektiösen Materialien und Abfallentsorgung:Rechtsmedizin Abfallentsorgung:Pathologie Abfallentsorgung:Neuropathologie Abfallentsorgung:AnatomieAbfällen sowie Körperteilen muss entsprechend den „Recommendations of theProbenversand:Rechtsmedizin United Nations Committee of Experts on the Transport of Probenversand:PathologieDangerous Goods“ erfolgen. Ansteckungsgefährliche Materialien werden in Probenversand:NeuropathologieKlasse 6 („toxic and infectious substances“), Division 2 („Probenversand:Anatomieinfectious substances“) eingeordnet und entsprechend deklariert. Das gilt auch für den Postversand von Probenmaterial.
Entsprechend der Abfallklassifikation (LAGA 2002) gehören Materialien aus bioptischen und autoptischen Arbeitsbereichen zu Abfällen des Abfallschlüssels (AS) 180102 „Körperteile und Organe, einschließlich Blutbeutel und Blutkonserven“. Diese Materialien müssen bereits am Anfallort getrennt erfasst und der gesonderten Beseitigung (zugelassene Verbrennungsanlage) ohne vorherige Vermischung mit Siedlungsabfällen zugeführt werden. Durch autorisierte Entsorgungsunternehmen werden sicher verschlossene Sammelgefäße (vgl. Nr. 6.2.2. der Technischen Anleitung Abfall) bereitgestellt, die bis zur Abholung in gesonderten Räumen aufbewahrt werden und keinesfalls umgefüllt werden dürfen.
Abfälle, an deren Sammlung und Entsorgung aus infektionspräventiver Sicht besondere Anforderungen gestellt werden (AS 180103), werden unmittelbar am Ort ihres Anfallens in reißfesten, feuchtigkeitsbeständigen und dichten Behältnissen (z. B. bauartgeprüfte Gefahrgutverpackung) gesammelt und ohne Umfüllen oder Sortieren in sicher verschlossene Behältnisse als „biohazard“ gekennzeichnet zur zentralen Sammelstelle befördert und in einer zugelassenen Anlage verbrannt. Eine vorherige Desinfektion und nachfolgende Zuordnung zu AS 180104 ist nicht gestattet. Unter diese Klassifikation fallen z. B. folgende Erkrankungen: AIDS/HIV-Infektion, Virushepatitis, CJD, vCJD, Tbk, Meningitis/Enzephalitis, Lepra, Milzbrand, Pest, Tollwut und Tularämie (LAGA 2002).
5.28.10. Materialtransport
Beim Materialtransport sind folgende Grundsätze einzuhalten:
-
•
Einsatz Materialtransport:Rechtsmedizinbruchsicherer, verschließbarer Proben- bzw. Versandgefäße, die eine Materialtransport:Pathologieeindeutige Patientenzuordnung aufweisen,
-
•
Hinweis auf Materialtransport:Neuropathologiespezielle Gefährdungen (Tbk, HIV, HBV, CJD etc.) auf dem Proben- bzw. Materialtransport:AnatomieVersandgefäß,
-
•
Einsatz geschlossener, desinfizierbarer Transportbehälter,
-
•
bei Transport von Frischmaterial Tragen von Handschuhen, Frischmaterial nur persönlich an Mitarbeiter übergeben, damit Weiterarbeitung sofort eingeleitet werden kann,
-
•
vorschriftsmäßige Verpackung und Deklaration des Materials beim Versand gemäß EU-Vorschriften (s. o.).
5.29. Betriebsärztliche Betreuung, arbeitsmedizinische Vorsorge und Personalschutz
Pathologie\"\r\"PathologieMargrit Wittig
5.29.1. Rechtsgrundlagen
Gesetzliche Regelungen
Rechtsmedizin\"\r\"PathologieRechtsgrundlage aller Anatomie\"\r\"Pathologiegesetzlichen Regelungen ist die Verfassung. Im Art. 2 findet sich das Grundrecht auf Leben und körperliche Unversehrtheit. Die Regelungen des Europarechts stehen nach Art. 23 des Grundgesetzes (GG) über dem Grundgesetz, müssen jedoch einen dem Grundgesetz gleichwertigen Grundrechtsschutz gewährleisten. Gemäß Art. 74 GG erstreckt sich die konkurrierende Gesetzgebung auch auf den Erlass von Gesetzen zum Arbeitsschutz. Nachgeordnet dienen das Arbeitsschutzgesetz (ArbSchG) und das Arbeitssicherheitsgesetz (ASiG) dazu, Sicherheit und Gesundheitsschutz der Beschäftigten durch Maßnahmen des Arbeitschutzes zu sichern und zu verbessern.
Der Arbeitgeber hat nach §1 ASiG Betriebsärzte und Fachkräfte für Arbeitssicherheit zu bestellen, die ihn beim Arbeitsschutz und bei der Unfallverhütung unterstützen.
Die Aufgaben des Betriebsarztes umfassen gemäß § 3 ASiG arbeitsmedizinische Beratungen des Arbeitgebers, der Personalvertretungen und der ArbeitssicherheitsgesetzBeschäftigten, Betriebsbegehungen, die Beobachtung und Auswertung des Unfallgeschehens, die arbeitsmedizinischen Untersuchungen und Beurteilungen der Arbeitnehmer sowie die Mitwirkung und Beratung bei der Organisation der Ersten Hilfe und im Arbeitsschutzausschuss.
Arbeitgeber im Sinne des ASiG § 2 (3) sind natürliche und juristische Personen sowie rechtsfähige Personalgesellschaften, die Personen arbeitsrechtlich beschäftigen. Als Betriebe im Sinne dieses Gesetzes gelten für den Bereich des öffentlichen ArbeitgeberDienstes die Dienststellen. Im Sinne der Unfallverhütungsvorschrift DGUV-Vorschrift 2 ist ein Betrieb eine geschlossene Einheit, die durch organisatorische Eigenständigkeit mit eigener Entscheidungscharakteristik geprägt ist.
Betrieb(e) Beschäftigte im Sinne des ASiG § 2 (2) sind Arbeitnehmer/innen, die zu ihrer Berufsausbildung Beschäftigten, arbeitnehmerähnliche Personen im Sinne des § 5 (1) des Arbeitsgerichtsgesetzes, Beamte/Beamtinnen, Richter/Richterinnen, Soldaten/Soldatinnen sowie die in Werkstätten für Behinderte Beschäftigten. BeschäftigteWährend Auszubildende als Beschäftigte in der Aufzählung ausdrücklich erwähnt werden, trifft das für Studierende nicht zu.
Vorschriften/Regeln der Unfallversicherungsträger
Den Mitgliedern des Spitzenverbandes „Deutsche Gesetzliche Unfallversicherung“ (DGUV) – gewerbliche Berufsgenossenschaften und Unfallversicherungsträger der öffentlichen Hand – wird zusammen mit den Krankenkassen in der Sozialgesetzgebung ein erweiterter Präventionsauftrag zugewiesen. Dieser ist auf der Grundlage der Festlegungen in § 20 SGB V und § 14 SGB VII durch ein gemeinsames Mitwirken bei der Verhütung von Arbeitsunfällen, Berufskrankheiten (BK) und arbeitsbedingten Erkrankungen sowie bei der betrieblichen Gesundheitsförderung zu erfüllen. Die Arbeitsunfälle, VerhütungIntegration des Betriebsarztes ist dabei unerlässlich.
Berufskrankheit(en), VerhütungUnfallversicherungsträger erlassen nach § 15 SGB VII Vorschriften über Erkrankung(en):arbeitsbedingte, VerhütungMaßnahmen, die der Arbeitgeber zur Erfüllung der gesetzlichen Forderungen zu treffen hat. Für Krankenhäuser sind i. d. R. die BG Gesundheitsdienst und Wohlfahrtspflege (BGW), für Kliniken in öffentlicher Hand die Unfallkassen der zuständige Träger der Unfallversicherung.
Im Folgenden wird Bezug auf die Vorschriften der BGW genommen. Für Unternehmer und Versicherte stellen Unfallverhütungsvorschriften des zuständigen Unfallversicherungsträgers verbindlich geltendes Recht dar. Es ist zu beachten, dass die Vorschriften den aktuellen Erfordernissen angepasst werden.
Die UVV „Grundsätze der Prävention“UVV \„Grundsätze der Prävention\“ (BGV A1) ist die Basisvorschrift für die berufsgenossenschaftliche Prävention. Sie enthält die Grundpflichten für Unternehmer und Versicherte.
Die BGV A1 verzahnt das berufsgenossenschaftliche Satzungsrecht mit dem staatlichen Arbeitsschutzrecht, sodass eine Anpassung der Grundlagenvorschrift an das SGB VII, die Umsetzung des mit der Abwehr arbeitsbedingter Gesundheitsgefahren erweiterten Präventionsauftrags in das berufsgenossenschaftliche Satzungsrecht und die Straffung des berufsgenossenschaftlichen Vorschriftenwerks erreicht werden. Die höhere Eigenverantwortung des Unternehmens für den betrieblichen Arbeitsschutz wird durch das neue Konzept der BGV A1 gestärkt. Praktische Hilfen zur Umsetzung der BGV A1 werden in der BG-Regel für Sicherheit und Gesundheit bei der Arbeit (BGR A1) vom Okt. 2005 i. d. F. von Jan. 2009 gegeben.
Zu den Grundpflichten des Unternehmers gehören nach §2 BGV A1 die Maßnahmen zur Verhütung von Arbeitsunfällen, BK, arbeitsbedingten Gesundheitsgefahren und für die Erste Hilfe. Die zu treffenden Maßnahmen sind insbesondere in staatlichen Arbeitsschutzvorschriften wie Arbeitsschutzgesetz, Arbeitsstätten-, Betriebssicherheits-, Biostoff-, Gefahrstoff- und Lastenhandhabungsverordnung sowie in weiteren Unfallverhütungsverordnungen näher bestimmt.
Die Versicherten sind über Sicherheit und Gesundheitsschutz bei der Arbeit gemäß § 4 BGV A1 mindestens jährlich aktenkundig zu unterweisen. § 15 BGV A1 verpflichtet die Versicherten, nach ihren Möglichkeiten sowie gemäß Unterweisung und Weisung des Unternehmers für ihre Sicherheit und Gesundheit bei der Arbeit sowie für Sicherheit und Gesundheitsschutz derjenigen zu sorgen, die von ihren Handlungen oder Unterlassungen betroffen sind.
Die nach ASiG übergeordnet geltende Bestellpflicht von Betriebsärzten und Fachkräften für Arbeitssicherheit wird in § 19 aufgegriffen und als Kernelement des betrieblichen Arbeitsschutzes in der berufsgenossenschaftlichen Grundlagenvorschrift BGV A1 verankert.
Zum 1.1.2011 ist die neue DGUV-Vorschrift 2 (bisher BGV A2) „Betriebsärzte und Fachkräfte für Arbeitssicherheit“ in Kraft getreten.
Die Aufgabenfelder der betriebsärztlichen betriebsärztliche Betreuung:AufgabenBetreuung ergeben sich detailliert aus der DGUV-Vorschrift 2; die Grundbetreuung nach vorgegebenen Einsatzzeiten, die betriebsspezifische Betreuung zusätzlich in Abhängigkeit vom Gefährdungspotenzial der Arbeitsplätze.
Auf Verlangen des Unfallversicherungsträgers hat der Unternehmer nachzuweisen, dass er seine Pflicht nach § 2 Abs. 1 zur Bestellung von Betriebsärzten und Fachkräften für Arbeitssicherheit erfüllt hat.
BetriebsarztBetriebsärzte können als ständig oder zeitweise tätige Kräfte bestellt, eingestellt oder freiberuflich tätig sein. Sie können auch einem überbetrieblichen arbeitsmedizinischen Dienst angehören, den der Unternehmer nach § 19 BGV A1 verpflichtet hat.
Die Einsatzzeit ist die Arbeitszeit, die Betriebsärzten und Fachkräften für Arbeitssicherheit zur Erfüllung ihrer Aufgaben im Betrieb mindestens zur Verfügung stehen muss. Für die Grundbetreuung gelten feste Einsatzzeiten als Summenwerte für Betriebsarzt und Fachkraft für Arbeitssicherheit. Sie betragen z. B. für Krankenhäuser/Hochschulkliniken 1,5 h/Jahr je Arbeitnehmer. Die Einsatzzeiten sind auf Betriebsärzte und Fachkräfte für Arbeitssicherheit aufzuteilen, wobei jedoch nicht weniger als 0,2 h/Jahr je Arbeitnehmer angesetzt werden dürfen. Der Bedarf an betriebsspezifischer Betreuung ist vom Unternehmer durch Prüfung aller Arbeitsplätze und Tätigkeiten gemäß Anlage 2 DGUV-Vorschrift 2 unter Berücksichtigung der Auslöse- und Aufwandkriterien zu ermitteln.
Arbeitsmedizinische Vorsorgeuntersuchungen, die nach speziellen Rechtvorschriften vorgeschrieben sind, und Wegezeiten sind nicht auf die Einsatzzeit anzurechnen. Diese müssen zusätzlich zur Einsatzzeit erbracht werden.
Staatliche Verordnungen zur arbeitsmedizinischen Vorsorge
Mit der Rechtsvereinfachung wurde nach der Unfallversicherungsträger, Vorschriften/Regelungen\"\r\"UnfallversicherungNovellierung der Gefahrstoffverordnung vom 23.12.2004 die arbeitsmedizinische Vorsorge, die sich im Wesentlichen auf die §§18 und 19 ArbSchG stützt, in der „Verordnung zur Rechtsvereinfachung und Stärkung der arbeitsmedizinische Vorsorge, Verordnungenarbeitsmedizinischen Vorsorge“ vom 18.12.2008 – „Verordnung zur arbeitsmedizinischen Vorsorge“ (ArbMedVV) – neu gefasst.
Vorschriften zur speziellen arbeitsmedizinischen Vorsorge waren bisher in verschiedenen staatlichen Verordnungen und in der UVV „Arbeitsmedizinische Vorsorge“ (BGV A4, ehemals VBG 100) der Unfallversicherungsträger Verordnung zur arbeitsmedizinischen Vorsorge (ArbMedVV)festgelegt.
Die ArbMedVV fasst die Regelungen zur speziellen arbeitsmedizinischen Vorsorge aus Gefahrstoff-, Biostoff-, Gentechniksicherheits-, Lärm- und Vibrations-Arbeitsschutz-, Druckluft- und Bildschirmarbeitsverordnung zusammen. Gegenstand der Verordnung ist die arbeitsmedizinische Sekundärprävention (Giesen 2009). Die arbeitsmedizinische Vorsorge soll einen Beitrag zum Erhalt der Beschäftigungsfähigkeit und zur Fortentwicklung des betrieblichen Gesundheitsschutzes leisten. Untersuchungen nach Röntgen- und Strahlenschutzverordnung (RöV, StrSchV), die als Tätigkeitsvoraussetzung zu veranlassen sind, und Untersuchungen bei Schicht- und Nachtarbeit, die nach Arbeitszeitgesetz den Arbeitnehmern anzubieten sind, wurden nicht in die neue Verordnung integriert.
5.29.2. Betriebsärztliche Betreuung
Um als BetriebsarztBetriebsarzt bestellt werden zu können, bedarf es neben der Approbation als Arzt der arbeitsmedizinischen Fachkunde. Die Fachkunde kann als gegeben betrachtet werden bei Fachärzten mit der Gebietsbezeichnung „Arbeitsmedizin“ oder anderen Fachärzten mit der Zusatzbezeichnung „Betriebsmedizin“.
Bei der Anwendung seiner arbeitsmedizinischen Fachkunde ist der Betriebsarzt weisungsfrei. Er unterliegt nur seinem ärztlichen Gewissen und muss die gesicherten arbeitsmedizinischen Erkenntnisse beachten. Die Zusammenarbeit mit dem Betriebsrat und den Fachkräften für Arbeitssicherheit ist in §§ 9 und 10 ASiG vorgeschrieben.
Aufgaben des Betriebsarztes
Die betriebsärztliche Tätigkeit umfasst die Aufgabenfelder der Grundbetreuung, darunter die
-
•
Unterstützung des Arbeitgebers bei Arbeitsplatzbegehungen, Gefährdungsbeurteilungen, Arbeitsgestaltung,
-
•
Untersuchungen von Unfallereignissen und Schwerpunkten arbeitsbedingter Erkrankungen, Arbeitnehmerberatung,
-
•
Arbeitgeberberatung, Arbeitsschutzausschuss, Fortbildung.
Weitere betriebsspezifische Aufgaben können sich aus den betrieblichen Erfordernissen und der Gefährdungsbeurteilung ergeben.
BetriebsbegehungenBetriebsbegehungen zur Beurteilung der Arbeitsbedingungen und der mit der Arbeit verbundenen Gefährdungen gehören zu den wichtigsten Aufgaben des Betriebsarztes.
Sie sind Voraussetzung für die Einstufung biologischer Arbeitsstoffe in Risikogruppen und die Gefährdungsbeurteilung von Gefahrstoffen sowie für die Festlegung der Schutzmaßnahmen nach dem Schutzstufenkonzept der Biostoff- und Gefahrstoffverordnung zur Sicherheit und zum Gesundheitsschutz der Beschäftigten.
Ausgehend vom ihrem Infektionsrisiko, werden biologische Arbeitsstoffe in 4 Risikogruppen eingeteilt (BioStoffV):
-
•
Risikogruppe 1: biologische Arbeitsstoffe, bei denen es unwahrscheinlich ist, dass sie beim Menschen eine Krankheit verursachen.
-
•
Risikogruppe 2: biologische Arbeitsstoffe, die eine Arbeitsstoff(e), biologische:RisikogruppenKrankheit beim Menschen hervorrufen und eine Gefahr für Beschäftigte darstellen können. Eine Verbreitung des Stoffs in der Bevölkerung ist unwahrscheinlich; eine wirksame Vorbeugung oder Behandlung ist normalerweise möglich.
-
•
Risikogruppe 3: biologische Arbeitsstoffe, die eine schwere Krankheit beim Menschen hervorrufen und eine ernste Gefahr für Beschäftigte darstellen können. Die Gefahr einer Verbreitung in der Bevölkerung kann bestehen, doch ist normalerweise eine wirksame Vorbeugung oder Behandlung möglich.
-
•
Risikogruppe 4: biologische Arbeitsstoffe, die eine schwere Krankheit beim Menschen hervorrufen und eine ernste Gefahr für Beschäftigte darstellen. Die Gefahr einer Verbreitung in der Bevölkerung ist u. U. groß; normalerweise ist eine wirksame Vorbeugung oder Behandlung nicht möglich.
Die BiostoffverordnungBiostoffverordnung fordert bei Tätigkeiten mit biologischen Arbeitsstoffen die Festlegung von Schutzmaßnahmen in den Schutzstufen 1 bis 4 in Abhängigkeit von der Tätigkeit, der Risikogruppe der Erreger, der Dauer und Art der Exposition sowie der Übertragungswege.
Die erforderlichen Sicherheitsmaßnahmen sind den Anhängen der BioStoffV zu entnehmen. Während Schutzstufe 1 allgemeine Hygienemaßnahmen umfasst, müssen die Maßnahmen der Schutzstufen 2–4 dem steigenden Gefährdungsgrad Rechnung tragen.
Die Häufigkeit der Betriebsbegehungen richtet sich nach dem Gefährdungsgrad der Arbeiten. Bei maßgeblichen Veränderungen ist die Gefährdungsbeurteilung zu aktualisieren.
Die BG-Regel BGR 250, entspricht der Technischen Regel für Biologische Arbeitsstoffe (TRBA 250); sie erläutert die Umsetzungsmöglichkeiten der BioStoffV. Beachtet der Arbeitgeber die in dieser Regel gegebenen Empfehlungen, kann er davon ausgehen, dass er die in der UVV geforderten Schutzziele erreicht. Eine Hilfestellung zur Gefährdungsbeurteilung auch anhand von Beispielen gibt die TRBA 400 „Handlungsanleitung zur Gefährdungsbeurteilung bei Tätigkeiten mit biologischen Arbeitsstoffen“. Hilfreich für die Beurteilung von Reinigungsarbeiten ist die BGR 208 „Reinigungsarbeiten mit Infektionsgefahr in medizinischen Bereichen“.
Neben der spezifischen Aufgabe der Gefährdungsbeurteilung sind im Rahmen betriebsärztlicher Begehungen im Krankenhaus folgende Präventionsschwerpunkte besonders zu beachten:
-
•
bauliche und technische Schutzmaßnahmen – leicht erreichbare Handwaschplätze mit fließendem kaltem und warmem WasserKrankenhaus:Betriebsbegehungen, Händedesinfektionsmittelspender, hautschonende Flüssigseifen, Betriebsbegehungen:KrankenhausHautschutz und -pflegemittel, Einmalhandtücher; separate Toiletten für Personal und Patienten (außer bei Bestandschutz); leicht zu reinigende, gegen Reinigungs- und Desinfektionsmittel beständige Oberflächen; Verwendung sicherer medizinischer Instrumente; stich- und bruchsichere Abfallbehälter für Kanülen;
-
•
organisatorische und hygienische Maßnahmen – Einhaltung von Beschäftigungsbeschränkungen für Jugendliche, werdende oder stillende Mütter (Jugendarbeitsschutz-, Mutterschutzgesetz, -richtlinienverordnung); getrennte Aufbewahrung von Schutz- und anderer Kleidung; Verzicht auf Schmuck, der die Händedesinfektion behindert;
-
•
persönliche BeschäftigungsbeschränkungenSchutzausrüstungen – Schutzkleidung und sonstige persönliche Schutzausrüstungen, insbesondere dünnwandige, flüssigkeitsdichte, allergenarme Handschuhe in ausreichender Stückzahl; Festlegungen für die regelmäßige Desinfektion, Reinigung und Instandhaltung der Schutzausrüstungen und Arbeitskleidung;
-
•
Verhalten bei Unfällen – Sofortmaßnahmen bei Stich- und Schnittverletzungen und Postexpositionsprophylaxe nach sonstigen Infektionskontakten (Details
 Online-Ergänzung 5.29); Dokumentation von Arbeits- und Wegeunfällen einschließlich Nadelstichverletzungen;
Online-Ergänzung 5.29); Dokumentation von Arbeits- und Wegeunfällen einschließlich Nadelstichverletzungen; -
•
Unterrichtung der Versicherten – regelmäßige Unterweisungen zu Fragen des Arbeits-, Gesundheits- und Brandschutzes mit Dokumentation; Vorhandensein von Betriebsanweisungen für Tätigkeiten mit biologischen Arbeitsstoffen und mit Gefahrstoffen; Vorhandensein von Hygiene- und Hautschutzplänen.
Es hat sich als sinnvoll erwiesen, wenn an den Begehungen ein Vertreter der Pflegedienstleitung, der Krankenhaushygieniker, die Hygienefachkraft und ein Mitarbeiter der Personalvertretung teilnehmen. Ebenso hat sich im Interesse der Bündelung der Anliegen die parallele Bewertung von Arbeits- und Infektionsschutz nach Arbeitsschutz- und GefahrstoffV sowie IfSG bewährt (Details ![]() Online-Ergänzung 5.29).Betriebsarzt:Aufgaben\"\r\"Betriebsarztaufg
Online-Ergänzung 5.29).Betriebsarzt:Aufgaben\"\r\"Betriebsarztaufg
Arbeitsmedizinische Untersuchung und Beratung der Arbeitnehmer
Die Untersuchung der Ursachen arbeitsbedingter Erkrankungen durch Erfassung und arbeitsplatzbezogene Auswertung von Untersuchung(en):arbeitsmedizinischeGesundheitsdaten trägt dazu bei, in der betriebsärztlichen Arbeit Arbeitnehmer:arbeitsmedizinische UntersuchungSchwerpunkte für gezielte Maßnahmen zu setzen. Neben allgemeinen arbeitsmedizinischen Arbeitnehmer:arbeitsmedizinische BeratungUntersuchungen wird der Betriebsarzt im Interesse der umfassenden Aufgabenwahrnehmung auch die speziellen arbeitsmedizinischen Vorsorgeuntersuchungen wegen besonderer Gefährdungen/Belastungen auf der Grundlage staatlicher Rechtsvorschriften durchführen.
Die speziellen arbeitsmedizinischen Vorsorgeuntersuchungen sind unter bestimmten Voraussetzungen als Pflichtuntersuchungen vorzunehmen bzw. den Beschäftigten in regelmäßigen Abständen anzubieten. Die Arbeitnehmer sind über das Ergebnis in Hinblick auf die ausgeübte Tätigkeit zu unterrichten. Wunschuntersuchungen sind dem Beschäftigten nach §11 ArbSchG zu ermöglichen. Zur arbeitsmedizinischen Beratung gehört auch das Angebot von Schutzimpfungen bei Kontakt zu impfpräventablen Krankheitserregern.
Weitere Informationen Kapitel 5.29.3.
Arbeitgeberberatung, Arbeitsschutzausschuss, Fortbildung
Der Betriebsarzt soll den Arbeitgeber in allen Fragen der Arbeitssicherheit und des Arbeitsschutzes beraten. Die Beratung betrifft die Mitwirkung bei Planung, Ausführung und Unterhalt von Neu- und Umbauten, Betriebsanlagen sowie bei Einsatz und Beschaffung technischer Arbeitsmittel, Arbeitsverfahren sowie bei der ArbeitgeberberatungAuswahl und Erprobung von persönlichen Schutzausrüstungen (einschließlich Körperschutzmittel).
Liegt eine Gefährdung vor, sind Schutzmaßnahmen in folgender Reihenfolge zu treffen:
-
•
Ersatz des gefährlichen Produkts durch ein ungefährliches,
-
•
Änderung des Arbeitsverfahrens zum Ausschluss der schädigenden Einwirkung,
-
•
Anwendung persönlicher Schutzausrüstungen,
-
•
Durchführung arbeitsmedizinischer Vorsorgeuntersuchungen.
Ein weiterer wichtiger Aspekt der Beratungstätigkeit des Betriebsarztes beinhaltet die Unterstützung der im Betrieb Verantwortlichen bei der Lösung arbeitsphysiologischer, -hygienischer, -psychologischer und ergonomischer Probleme. Der Betriebsarzt berät bei Fragen des Arbeitsplatzwechsels und der Eingliederung Leistungsgeminderter und Behinderter in den Arbeitsprozess und führt u. a. ergänzende Arbeitsplatzanalysen unter besonderer Berücksichtigung der verbliebenen Fähigkeiten des Arbeitnehmers sowie bei der Gestaltung der Arbeit durch.
Im Rahmen seiner Beratungstätigkeit nimmt der Betriebsarzt regelmäßig an den Sitzungen der Arbeitsschutzgremien und an betrieblichen Besprechungen teil.
Die Bildung des ArbeitsschutzausschussArbeitsschutzausschusses ist bei > 20 Beschäftigten erforderlich (§ 11 ASiG).
Die ständigen Mitglieder des Arbeitschutzausschusses sind der Arbeitgeber oder dessen Vertreter, zwei Beauftragte des Betriebsrats, die Fachkraft für Arbeitssicherheit, der Betriebsarzt und die Sicherheitsbeauftragten der Einrichtung.
Der Arbeitsschutzausschuss tritt mindestens 4-mal im Jahr zusammen, um die Anliegen von Arbeitsschutz und Unfallverhütung zu besprechen und den Arbeitgeber zu beraten.
Gemäß ärztlicher Berufsordnung besteht für jeden Arzt die Pflicht zur Fortbildung. Der Arbeitgeber ist verpflichtet, dem Betriebsarzt Fortbildung unter Berücksichtigung betrieblicher Belange zu ermöglichen. Angestellte Betriebsärzte sind zur Fortbildung freizustellen, die Kosten sind vom Arbeitgeber zu tragen.
5.29.3. Arbeitsmedizinische Vorsorge
Einstellungsuntersuchung
Die Einstellungsuntersuchung ist eine ärztliche Untersuchung vor betriebsärztliche Betreuung\"\r\"Betreibsartzbetrder Einstellung. Als personalärztliche Aufgabe gehört sie nicht zu den eigentlichen Aufgaben des Betriebsarztes (Details ![]() Online-Ergänzung 5.29). Die Veranlassung von Einstellungsuntersuchungen liegt im Ermessen des EinstellungsuntersuchungArbeitgebers. Er kann sie grundsätzlich oder nur bei Tätigkeiten mit besonderer Exposition oder Belastung verlangen. Die Einstellungsuntersuchung findet vor Abschluss des Arbeitsvertrags statt. Der Arbeitgeber kann den Abschluss des Arbeitsvertrags vom Ergebnis der Einstellungsuntersuchung abhängig machen. Daher ist das Einverständnis des Bewerbers zur Untersuchung faktisch nicht erforderlich.
Online-Ergänzung 5.29). Die Veranlassung von Einstellungsuntersuchungen liegt im Ermessen des EinstellungsuntersuchungArbeitgebers. Er kann sie grundsätzlich oder nur bei Tätigkeiten mit besonderer Exposition oder Belastung verlangen. Die Einstellungsuntersuchung findet vor Abschluss des Arbeitsvertrags statt. Der Arbeitgeber kann den Abschluss des Arbeitsvertrags vom Ergebnis der Einstellungsuntersuchung abhängig machen. Daher ist das Einverständnis des Bewerbers zur Untersuchung faktisch nicht erforderlich.
Der Zweck der Einstellungsuntersuchung ist ein anderer als der der arbeitsmedizinischen Vorsorgeuntersuchung nach dem Arbeitsschutzrecht. Der Arzt hat die Frage zu beantworten, ob
-
•
der allgemeine Gesundheitszustand des Bewerbers eine Arbeitsunfähigkeit unmittelbar oder später erwarten lässt,
-
•
die gesundheitliche Eignung für die vorgesehene Tätigkeit in vollem Umfang gegeben ist,
-
•
Hinweise auf eine Erkrankung vorliegen, die eine Gefahr für Dritte in sich birgt (z. B. Infektionsgefährdung).
Da der Betriebsarzt die Bedingungen am künftigen Arbeitsplatz im Allgemeinen kennt, führt er oft neben der allgemeinen und speziellen arbeitsmedizinischen Vorsorgeuntersuchung auch die Einstellungsuntersuchung durch. Eine Verknüpfung der Vorsorgeuntersuchung mit Untersuchungen zur Feststellung der Eignung für berufliche Anforderungen soll nicht erfolgen, es sei denn, betriebliche Gründe erfordern das [§ 3 (3) ArbMedVV].
Ein Nachteil der Durchführung der Einstellungsuntersuchung durch den Betriebsarzt kann ggf. darin bestehen, dass das Vertrauensverhältnis zum Arbeitnehmer Schaden nimmt und die Trennung der Fragestellung zur speziellen arbeitsmedizinischen Vorsorge bzw. Einstellungsuntersuchung schwierig sein kann, wenn z. B. das Ergebnis der speziellen arbeitsmedizinischen Untersuchung „keine gesundheitlichen Bedenken“ lautet, bei der Einstellungsuntersuchung abweichend aber „geeignet unter bestimmten Voraussetzungen“ geäußert werden muss. Das ist dem Arbeitnehmer nur schwer zu vermitteln.
Arbeitsmedizinische Vorsorgeuntersuchungen
Allgemeine arbeitsmedizinische Vorsorgeuntersuchung: Sie gehört zu den Aufgaben des Betriebsarztes gemäß § 3 (1) ASiG, dient der Feststellung der individuellen Eignung des Beschäftigten für den speziellen Arbeitsplatz, ist tätigkeitsbezogen vorzunehmen, ist eine freiwillige Untersuchung und darf nicht Vorsorgeuntersuchung(en), arbeitsmedizinische:allgemeinezu Nachteilen des Arbeitnehmers führen.
Spezielle arbeitsmedizinische Vorsorgeuntersuchung: Sie dient der Untersuchung von Beschäftigten, die durch ihre Tätigkeit besonderen Expositionen oder Belastungen ausgesetzt sind, sodass gesundheitliche Gefährdungen nicht auszuschließen sind. Die Untersuchungen werden auf der Grundlage Vorsorgeuntersuchung(en), arbeitsmedizinische:speziellestaatlicher Rechtsvorschriften durchgeführt.
Neben den bisher gebräuchlichen Pflicht- und Angebotsuntersuchungen wurden in die ArbMedVV Wunschuntersuchungen aufgenommen. Pflichtuntersuchungen sind arbeitsmedizinische Vorsorgeuntersuchungen, die bei besonders gefährdenden Tätigkeiten zu veranlassen sind [§ 2 (3) ArbMedVV]). Angebotsuntersuchungen sind arbeitsmedizinische Vorsorgeuntersuchungen, die bei bestimmten gefährdenden Tätigkeiten anzubieten sind [§ 2 (4) ArbMedVV]. Wunschuntersuchungen sind arbeitsmedizinische Vorsorgeuntersuchungen, die der Arbeitgeber den Verordnung zur arbeitsmedizinischen Vorsorge (ArbMedVV)Beschäftigten nach § 11 ArbSchG zu ermöglichen hat [§ 2 (5) ArbMedVV]. Die Untersuchungen erfolgen als Erstuntersuchung vor Aufnahme einer bestimmten Tätigkeit, als Nachuntersuchungen während dieser Tätigkeit oder anlässlich ihrer Beendigung. Nachgehende Untersuchungen werden nach Beendigung bestimmter Tätigkeiten, bei denen nach längeren Latenzzeiten Gesundheitsstörungen auftreten können, durchgeführt.
Arbeitsmedizinische Vorsorgeuntersuchungen sollen während der Arbeitszeit stattfinden.
Die ArbMedVV) regelt in ihrem Anhang die Pflicht- und Angebotsuntersuchungen sowie die weiteren Maßnahmen der arbeitsmedizinischen Vorsorge für Tätigkeiten mit Gefahrstoffen, mit biologischen Arbeitsstoffen einschließlich gentechnischer Arbeiten mit Verordnung zur arbeitsmedizinischen Vorsorge (ArbMedVV)humanpathogenen Organismen, Tätigkeiten mit physikalischen Einwirkungen und sonstigen Tätigkeiten, z. B. Tragen von Atemschutzgeräten und Bildschirmarbeit.
Nach § 3 Abs. 2 hat der Arbeitgeber mit der Durchführung der arbeitsmedizinischen Vorsorge einen Arzt zu beauftragen, der berechtigt ist, die Gebietsbezeichnung „Arbeitsmedizin“ oder die Zusatzbezeichnung „Betriebsmedizin“ zu führen. Ist ein Betriebsarzt bestellt, soll der Arbeitgeber diesen mit der arbeitsmedizinischen Vorsorge beauftragen. Die für Arbeitsmediziner von der DGUV herausgegebenen Grundsätze für arbeitsmedizinische Vorsorgeuntersuchungen haben empfehlenden Charakter.
In Krankenhausbereichen sind hinsichtlich spezieller arbeitsmedizinischer Vorsorgeuntersuchungen die nachfolgenden Rechtvorschriften anzuwenden.
Tätigkeiten mit Gefahrstoffen: Die speziellen arbeitsmedizinischen Vorsorgeuntersuchungen umfassen i. d. R. die
-
•
Begehung oder Kenntnis des Arbeitsplatzes durch den Arzt,
-
•
arbeitsmedizinische Befragung und Untersuchung des Beschäftigten,
-
•
Beurteilung des Gefahrstoffe:Vorsorgeuntersuchungen, arbeitsmedizinischeGesundheitszustands des Beschäftigten,
-
•
individuelle arbeitsmedizinische Beratung,
-
•
Dokumentation der Untersuchungsergebnisse.
Existieren anerkannte Verfahren für ein Biomonitoring und Grenzwerte für die Beurteilung, ist das Biomonitoring in die arbeitsmedizinische Vorsorgeuntersuchung einzubeziehen.
Spezielle arbeitsmedizinische Vorsorgeuntersuchungen sind für Beschäftigte im Krankenhaus gemäß Anhang „Arbeitsmedizinische Pflicht- und Angebotsuntersuchungen sowie weitere Maßnahmen der arbeitsmedizinischen Vorsorge zur ArbMedVV“, Teil 1 „Tätigkeiten mit Gefahrstoffen“ als Pflichtuntersuchung zu veranlassen bzw. als Angebotsuntersuchung zu ermöglichen,
-
•
wenn regelmäßig ≥ 4 h/d die ausgeübten Tätigkeiten den Kriterien der Feuchtarbeit (TRGS 401) entsprechen, betrifft z. B. das Tragen flüssigkeitsdichter Handschuhe.
-
•
Dauert die Feuchtarbeit regelmäßig > 2, aber < 4 Stunden, sind Untersuchungen nach (2) anzubieten. Die Untersuchung orientiert sich an dem DGUV-Grundsatz G24 „Hauterkrankungen – außer Hautkrebs“.
-
•
Werden Arbeitsplatzgrenzwerte nach der Gefahrstoffverordnung für in der Anlage genannte Gefahrstoffe (z. B. Methanol, Xylol) nicht eingehalten oder sind die genannten Gefahrstoffe hautresorptiv bzw. besteht Gesundheitsgefährdung durch direkten Hautkontakt, sind Pflichtuntersuchungen zu veranlassen.
-
•
Werden die Grenzwerte eingehalten, besteht aber eine Exposition zu den genannten Gefahrstoffen, sind Untersuchungen anzubieten.
-
•
Üben Beschäftigte z. B. im Rahmen der Forschung Tätigkeiten mit einer Exposition mit Gesundheitsgefährdung durch Labortierstaub in Tierhaltungsräumen und -anlagen aus, sind Pflichtuntersuchungen zu veranlassen.
-
•
Werden Tätigkeiten mit krebserzeugenden oder erbgutverändernden Stoffen oder Zubereitungen der Kategorie 1 oder 2 im Sinne der GefStoffV ausgeübt, sind nach ArbMedVV Vorsorgeuntersuchungen anzubieten.
Tätigkeiten mit Gefahrstoffen aus dem Anhang der ArbMedVV kommen innerhalb von Kliniken in verschiedenen Laborbereichen bzw. in Forschungslaboren vor.
Anlässe für nachgehende Untersuchungen nach Beendigung bestimmter Tätigkeiten, bei denen nach längeren Latenzzeiten Gesundheitsstörungen auftreten können, ergeben sich aus einer Exposition gegenüber krebserzeugenden oder erbgutverändernden Stoffen oder Zubereitungen der Kategorie 1 oder 2 im Sinne der GefStoffV. Hinweise zur Durchführung der Untersuchung gibt der DGUV-Grundsatz G40 „Krebserzeugende Gefahrstoffe – allgemein“.
Tätigkeiten mit biologischen Arbeitsstoffen:
Auf Arbeitsstoff(e), biologische:Vorsorgeuntersuchungen, arbeitsmedizinischeGrundlage einer spezifischen Gefährdungsbeurteilung ist der Arbeitgeber verpflichtet, Tätigkeiten, bei denen Umgang mit biologischen Arbeitsstoffen vorkommt, einer Schutzstufe zuzuordnen. Daraus sind die technischen, organisatorischen und persönlichen Sicherheitsmaßnahmen entsprechend der Gefährdung abzuleiten, zu veranlassen und auf Wirksamkeit zu überprüfen.
Als biologische Arbeitsstoffe werden Mikroorganismen, einschließlich gentechnisch veränderter Mikroorganismen, Zellkulturen und humanpathogener Endoparasiten sowie Erreger der TSE eingeordnet, wenn sie zur Vermehrung und Weitergabe von genetischem Material fähig sind. Sensibilisierende und toxische Wirkungen sind zusätzlich zu berücksichtigen und auch hierfür geeignete Schutzmaßnahmen festzulegen.
Bei allen Tätigkeiten wird zwischen gezielten und nicht gezielten unterschieden. Um gezielte Tätigkeiten handelt es sich, wenn die biologischen Arbeitsstoffe mindestens der Art nach bekannt sind, die Tätigkeit auf die biologischen Arbeitsstoffe unmittelbar ausgerichtet und die Exposition im Normalfall bekannt oder abschätzbar ist. Bei nicht gezielten Tätigkeiten wird mindestens eine der vorgenannten Voraussetzungen nicht erfüllt, das sind in der Praxis mehr als 90 % der Expositionsbereiche.
Die speziellen arbeitsmedizinischen Vorsorgeuntersuchungen umfassen
-
•
Begehungen oder Kenntnis des Arbeitsplatzes,
-
•
arbeitsmedizinische Befragung und Untersuchung des Beschäftigten,
-
•
Beurteilung des Gesundheitszustands des Beschäftigten,
-
•
individuelle arbeitsmedizinische Beratung,
-
•
Dokumentation der Untersuchungsergebnisse.
Die Anzeige von gezielten Tätigkeiten mit einem biologischen Arbeitsstoff der Risikogruppe 2, 3 oder 4 bei der zuständigen Behörde obliegt dem Arbeitgeber, ebenso die Aufbewahrung des Verzeichnisses über die Beschäftigten, die gezielte Tätigkeiten mit biologischen Arbeitsstoffen der Risikogruppe 3 oder 4 ausüben.
Die Entscheidungskriterien für Pflicht- und Angebotsuntersuchungen beim Umgang mit biologischen Arbeitsstoffen ergeben sich aus dem Anhang zur ArbMedVV, Teil 2 (1) und (2).
Pflichtuntersuchungen sind bei gezielten Tätigkeiten mit Erregern der Spalte 1 der Tabelle der ArbMedVV, bei nicht gezielten Tätigkeiten der Schutzstufe 4 der BioStoffV oder mit den in der Tabelle genannten biologischen Arbeitsstoffen in den in Spalte 2 bezeichneten Bereichen unter den Expositionsbedingungen der Spalte 3 zu veranlassen (Tab. 5.49 ).
Tab. 5.49.
Verpflichtende arbeitsmedizinische Vorsorgeuntersuchungen (Details ![]() Online-Ergänzung 5.29).Vorsorgeuntersuchung(en), arbeitsmediziniche:verpflichtende
Online-Ergänzung 5.29).Vorsorgeuntersuchung(en), arbeitsmediziniche:verpflichtende
| Biologischer Arbeitsstoff | Bereich nicht gezielter Tätigkeiten | Expositionsbedingungen |
|---|---|---|
| HBV (impfpräventabel)HCV | Einrichtungen zur medizinischen Untersuchung, Behandlung und Pflege von Menschen und Betreuung behinderter Menschen einschließlich der Bereiche, die der Versorgung bzw. der Aufrechterhaltung dieser Einrichtungen dienen:
|
|
Im Rahmen der Pflichtuntersuchung ist für impfpräventable biologische Arbeitsstoffe nach ärztlicher Beratung ein Impfangebot zu unterbreiten. Die Ablehnung der Impfung berechtigt nicht dazu, gesundheitliche Bedenken gegen die Ausübung einer Tätigkeit auszusprechen, da in Deutschland keine Impfpflicht besteht.
Die Durchführung der Pflichtuntersuchung ist Voraussetzung für die Beschäftigung oder Weiterbeschäftigung mit der entsprechenden Exposition.
Eine Pflichtuntersuchung muss nicht durchgeführt werden, wenn bei dem Beschäftigten bereits ein ausreichender Immunschutz gegen den biologischen Arbeitsstoff besteht.
Angebotsuntersuchungen werden auf gezielte Tätigkeiten mit biologischen Arbeitsstoffen der Risikogruppe 3 und nicht gezielte Tätigkeiten der Schutzstufe 3 bezogen. Das gilt auch für nicht gezielte Tätigkeiten der Risikogruppe 2 bzw. Schutzstufe 2, es sei denn, es ist nach der Gefährdungsbeurteilung und den getroffenen Schutzmaßnahmen nicht von einer Infektionsgefährdung auszugehen.
Angebotsuntersuchungen sind den Beschäftigten außerdem zu ermöglichen, wenn als Folge einer Exposition gegenüber biologischen Arbeitsstoffen
-
•
mit einer schweren Intoxikation oder Erkrankung gerechnet werden muss und Maßnahmen der Postexpositionsprophylaxe möglich sind oder
-
•
eine Infektion erfolgt ist, und
-
•
am Ende einer Tätigkeit, bei der eine Pflichtuntersuchung zu veranlassen war. Das gilt nicht für Tätigkeiten mit impfpräventablen biologischen Arbeitsstoffen.
Der DGUV-Grundsatz G42 „Infektionsgefährdung“ gibt Hinweise für den Untersuchungsumfang für die einzelnen biologischen Arbeitsstoffe.
Gentechnische Arbeiten: Pflicht- und Angebotsuntersuchungen gelten nach ArbMedVV, Anlage Teil 2 (3) bei gentechnischen Arbeiten mit humanpathogenen Organismen. Sie werden mit den Untersuchungen wegen Tätigkeit mit biologischen Arbeitsstoffen verbunden.
Tätigkeit an Bildschirmgeräten: Sie Arbeiten, gentechnische, Vorsorgeuntersuchungen, arbeitsmedizinischeumfasst Tätigkeiten mit überwiegend administrativen Funktionen, aber auch zur Steuerung von Bildaufnahmen, Aufbereitung von Bilddaten und Befundung, Steuerung und Überwachung von Bestrahlungen sowie das Führen elektronischer Bildschirmarbeit, Vorsorgeuntersuchungen, arbeitsmedizinischePatientenakten.
Die Pflicht zum Angebot der Untersuchung beschränkt sich gemäß ArbMedVV, Anlage Teil 4 (2) auf eine angemessene Untersuchung der Augen und des Sehvermögens. Erweist sich im Ergebnis eine augenärztliche Untersuchung als erforderlich, ist diese zu ermöglichen. Das gilt auch für Sehbeschwerden. Den Beschäftigten sind im erforderlichen Umfang spezielle Sehhilfen für ihre Arbeit an Bildschirmgeräten zur Verfügung zu stellen, wenn die Untersuchung ergibt, dass normale Sehhilfen nicht geeignet sind.
Tätigkeiten mit Exposition gegenüber ionisierenden Strahlen (Röntgenstrahlen …): Die §§ 37–41 RöV und §§ 60–64 StrSchV sehen zum Schutz der Gesundheit beruflich strahlenexponierter Personen die arbeitsmedizinische Vorsorge durch hierfür ermächtigte Ärzte vor.
Die „Richtlinie für die Arbeitsmedizinische Vorsorge beruflich strahlenexponierter Personen durch Strahlenexposition:Vorsorgeuntersuchungen, arbeitsmedizinischeermächtigte Ärzte“ trat am 1.3.2004 in Kraft.
Die Untersuchungen sind verpflichtend vom Arbeitgeber zu veranlassen. Sie stellen eine Tätigkeitsvoraussetzung dar.
Die Untersuchungen nach RöV und StrSchV wurden nicht in die neue ArbMedVV übernommen, da sie keine Untersuchungen nach Arbeitsschutzgesetz darstellen. Abweichend von den Untersuchungen nach ArbMedVV sind die Untersuchungen beruflich strahlenexponierter Personen von hierfür ermächtigten Ärzten durchzuführen.
Tätigkeiten mit Nacht- und Schichtarbeit: Um Gesundheitsstörungen, die durch Nachtarbeit, insbesondere durch Wechselschicht, entstehen können, zu verhindern oder frühzeitig zu erkennen, haben Nachtarbeit, Vorsorgeuntersuchungen, arbeitsmedizinischeNachtarbeitnehmer das Recht, sich vor Beginn der Beschäftigung und danach in regelmäßigen Schichtarbeit, Vorsorgeuntersuchungen, arbeitsmedizinischeAbständen arbeitsmedizinisch untersuchen und beraten zu lassen (§ 6 ArbZG).
Anhaltspunkte zur Durchführung der Untersuchungen von Nachtarbeitnehmern wurden vom Ausschuss Arbeitsmedizin beim ehemaligen Hauptverband der gewerblichen Berufsgenossenschaften in Zusammenarbeit mit dem Länderausschuss für Arbeitsschutz und Sicherheitstechnik (LASI) erarbeitet.
Der Arbeitnehmer soll vom untersuchenden Arzt über allgemeine und individuelle Gesundheitsgefahren und deren Vorbeugung beraten werden. Der Arbeitgeber ist in Fragen der Einsetzbarkeit von Arbeitnehmern, bei denen Bedenken gegen einen Einsatz bei Nachtarbeit bestehen, vom Betriebsarzt zu beraten. Eine Mitteilung gesundheitlicher Bedenken an den Arbeitgeber erfolgt jedoch nur auf Wunsch des Arbeitnehmers.
Untersuchungen für Beschäftigte mit Nacht- und Schichtarbeit wurden nicht in die neue ArbMedVV überführt, da das Arbeitszeitgesetz nicht durch eine Verordnung geändert werden kann.
Tätigkeiten mit hoher physischer Belastung: Die neue ArbMedVV enthält keine Regelungen zu Untersuchungen für Beschäftigte, deren Tätigkeit mit hoher physischer Belastung verbunden ist. Untersuchungen nach der Lastenhandhabungsverordnung (LasthandhabV) wurden nicht festgeschrieben.
Beschäftigte, die eine gesundheitliche Gefährdung befürchten, haben gemäß § 11 ArbSchG das Recht, eine arbeitsmedizinische Vorsorgeuntersuchung durchführen zu lassen. Das entspricht der Wunschuntersuchung nach § 2 (5) ArbMedVV. Ziel der Einbeziehung von § 11 ArbSchG in die Verordnung zur Arbeitsmedizinischen Vorsorge ist es, für Bereiche arbeitsbedingter Erkrankungen (z. B. Muskel-Skelett-Erkrankungen) Kriterien für eine Untersuchung ermitteln zu lassen.
Die Konkretisierung der Verordnung nach dem Stand der Arbeitsmedizin wird ein Ausschuss für Arbeitsmedizin übernehmen (§ 9 ArbMedVV). Zu den Aufgaben des Ausschusses gehört auch die Erarbeitung von Empfehlungen für Wunschuntersuchungen.
Pflichten des Arztes bzgl. der arbeitsmedizinischen Vorsorge (§§ 6–7 ArbMedVV): Unbeschadet anderer Bestimmungen für einzelne Untersuchungsanlässe muss der Arzt berechtigt sein, die Gebietsbezeichnung „Arbeitsmedizin“ oder die Zusatzbezeichnung „Betriebsmedizin“ zu führen. Er darf keine Arbeitgeberfunktion gegenüber den zu untersuchenden Vorsorge, arbeitsmedizinische, ArztpflichtenBeschäftigten ausüben. Bei der arbeitsmedizinischen Vorsorge hat der Arzt die Vorschriften dieser Verordnung einschließlich des Anhangs und die dem Stand der Arbeitsmedizin entsprechenden Regeln und Erkenntnisse zu beachten. Im Ergebnis der Untersuchung sind
-
•
der Untersuchungsbefund schriftlich festzuhalten,
-
•
die untersuchte Person darüber zu beraten,
-
•
ihr eine Bescheinigung mit Angaben über Untersuchungsanlass, Tag der Untersuchung sowie die ärztliche Beurteilung, ob und inwieweit bei Ausübung einer bestimmten Tätigkeit gesundheitliche Bedenken bestehen, auszuhändigen.
Der Arbeitgeber erhält nur im Fall einer Pflichtuntersuchung eine Kopie der Bescheinigung.
Ergibt die Auswertung der Untersuchung Anhaltspunkte für unzureichende Schutzmaßnahmen, hat der Arzt das dem Arbeitgeber mitzuteilen und Schutzmaßnahmen vorzuschlagen.Vorsorgeuntersuchung(en), arbeitsmedizinische\"\r\"Vorsorgeuntesuchungarbeitsm
Maßnahmen bei gesundheitlichen Bedenken (§ 8 ArbMedVV)
Ist dem Bedenken, gesundheitliche, MaßnahmenArbeitgeber bekannt, dass bei einem Beschäftigten gesundheitliche Bedenken gegen die Ausübung einer Tätigkeit bestehen, hat er die Gefährdungsbeurteilung zu überprüfen und unverzüglich die erforderlichen zusätzlichen Schutzmaßnahmen zu treffen.
Hält die untersuchte Person oder der Arbeitgeber das Untersuchungsergebnis für unzutreffend, entscheidet auf Antrag die zuständige Behörde [§ 8 (2) ArbMedVV].
Erfolgt die betriebsärztliche Tätigkeit im vertrauensvollen Zusammenwirken aller für den Arbeits- und Gesundheitsschutz zuständigen Personen im Betrieb, trägt sie zu einem positiven Betriebsergebnis bei.
Der hohe Bedarf von Frühgeborenen in Bezug auf bestimmte Elektrolyte (z. B. Kalzium, Phosphat), Eiweiß und Kalorien wird z. T. durch den Zusatz spezieller Präparate zur Muttermilch gedeckt.
![]() Online-Ergänzung 5.27
Online-Ergänzung 5.27
Nach 6 Monaten wird eine suffiziente Endothelialisierung der Prothesen angenommen.


