Das normale Thoraxröntgenbild
Technische Betrachtungen
Einleitung
Eine korrekt belichtete Röntgenaufnahme des Thorax zu erstellen ist wesentlich schwieriger, als Röntgenbilder anderer Teile des Körpers anzufertigen, da der Brustkorb Gewebe mit einem sehr großen Kontrastumfang beinhaltet. Dieses Spektrum reicht von den Gefäßen in der luftgefüllten Lunge bis zu den hinter dem Herzen liegenden dichten Knochenstrukturen. Ein korrekt belichteter Film sollte zumindest ermöglichen, die Gefäße bis zum äußeren Lungendrittel, die paravertebralen Weichteilschatten beidseits sowie das linke Hemidiaphragma hinter dem Herzen zu erkennen.
Überbelichtung macht das Bild dunkel; in einem solchen Fall sieht man Brustwirbelsäule, Mediastinalstrukturen, retrokardialen Bereich, eine Magensonde und einen Trachealtubus gut, man kann aber kleine noduläre Veränderungen und die Feinstrukturen der Lungen nicht erkennen (Abb. 3-1A ). Wurde die Aufnahme mittels digitaler Radiographie erstellt, kann man sie an der Auswertekonsole anders „fenstern”, was zu einem befundbaren Bild führt.
Abb. 3-1.

Auswirkung von Über- und Unterbelichtung einer Thoraxröntgenaufnahme. A. Eine Überbelichtung macht es recht einfach, die Region hinter dem Herzen sowie Schlüsselbeine und Brustwirbelsäule einzusehen, doch kann man die Lungengefäße nicht mehr erkennen. B. Eine Unterbelichtung betont die Lungengefäße, im Gegenzug kann man aber nicht hinter das Herz oder die Zwerchfellhälften sehen.
Eine Unterbelichtung macht das Bild ziemlich „weiß”. Dies macht eine angemessene Befundung schwierig. So treten kleine Blutgefäße der Lunge auffällig in Erscheinung, was zu dem falschen Befund generalisierter Infiltrate führen kann. Weiterhin macht es eine Unterbelichtung unmöglich, anatomische Details von Mediastinum, Retrokardialraum oder Wirbelsäule zu sehen (Abb. 3-1B). Selbst bei einer digitalen Aufnahme kann eine unterbelichtete Aufnahme nicht nachträglich verbessert werden.
Vergleich männlicher und weiblicher Thorax
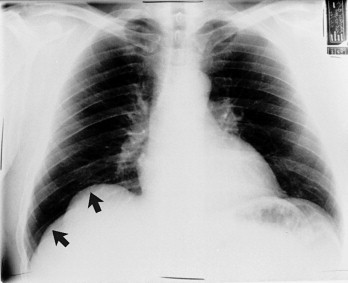
Der Hauptunterschied zwischen dem Thoraxbild des Mannes und der Frau ist die unterschiedliche Menge an Mammagewebe. Im Allgemeinen ist dies nur bei der Befundung der posterior-anterioren (p.-a.) oder der anterior-posterioren (a.-p.) Aufnahme von Belang, nicht aber in der seitlichen. Das Brustgewebe absorbiert einen Teil der Röntgenstrahlung, was eine Unterbelichtung der im Strahlengang dahinter liegenden Gewebe verursacht und dazu führt, dass die hinter den Mammae liegende Lunge weißer und die Lungengefäßzeichnung der gleichen Region auffälliger erscheint. Bei schlaffen Brüsten können in der p.-a. wie der a.-p. Projektion scheinbare basale Infiltrate sichtbar sein.
Bei FrauenmitZustandnacheinseitiger Mastektomie ist die Lungendichte asymmetrisch. Auf der Seite der Mastektomie erscheint die Lunge dunkler als auf der gesunden Seite. Die Mastektomie muss erkannt werden, um nicht aufgrund der relativ höheren Dichte der Seite mit der verbliebenen Mamma die Fehldiagnose eines Infiltrats oder eines Pleuraergusses zu stellen (Abb. 3-2 ).
Abb. 3-2.

Mastektomie links. Die verbliebene rechte Mamma lässt die Lungengefäße in der rechten Lungenbasis akzentuiert erscheinen, was man mit einem Unterlappeninfiltrat verwechseln kann. Im Gegensatz dazu erscheint die linke Lunge transparenter als die rechte, was als Überblähung fehlgedeutet werden kann.
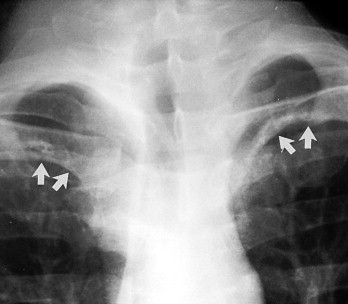
Ein einzelnes scharf berandetes „Knötchen” im Lungenunterfeld in einer p.-a. oder a.-p. Aufnahme des Thorax kann einen Mamillenschatten darstellen und darf in diesem Fall nicht mit einem echten Lungenrundherd verwechselt werden. Mamillenschatten sieht man bei Männern und bei Frauen recht häufig. Zur Überprüfung eines solchen Befundes betrachte man zunächst die Gegenseite und prüfe, ob auch hier ein vergleichbarer Schatten vorliegt (Abb. 3-3 ). Anschließend muss ausgeschlossen werden, dass sich ein solches „Knötchen” in der Seitenaufnahme auf die Lunge projiziert. Findet man in der p.-a. Projektion ein Knötchen, nicht aber in der seitlichen, so kann man einen metallischen Mamillenmarker über die Mamille kleben, die p.-a. Aufnahme wiederholen und dadurch prüfen, ob es sich um eine Mamille handelt.
Abb. 3-3.

Mamillenschatten. Bei Männern und Frauen kann man im rechten und linken Lungenunterfeld auffällige Mamillenschatten in Höhe der Medioklavikularlinie sehen (Pfeile). Sie sollten beidseits vorhanden sein. Auch in der Seitenaufnahme sind diese Schatten manchmal in den vorderen Thoraxweichteilen zu sehen.
p.-a. und a.-p. Röntgenaufnahme
Bei ambulanten Patienten werden Thoraxaufnahmen meist so angefertigt, dass der Patient mit dem Brustkorb zum Filmkassettenhalter oder dem Detektor steht. Die Röntgenröhre befindet sich im Rücken des Patienten, so dass der Strahl im Rücken einund durch die Thoraxvorderwand wieder austritt. Man bezeichnet dies als p.-a. (posterioranteriore oder dorsoventrale) Projektion. Liegt der Patient auf dem Rücken, fertigt man normalerweise das Bild so an, dass der Strahl in der vorderen Brustwand eintritt und die Röntgenkassette oder der Detektor unter dem Patienten liegt. Dies bezeichnet man als a.-p. (oder anterior-posteriore) Thoraxaufnahme.
Bei der Befundung ist der wichtigste Unterschied, dass das Herz bei der a.-p. Projektion stärker vergrößert wird (Abb. 3-4 ), weil bei diesem Strahlengang das Herz weiter von der Filmkassette oder dem Detektor entfernt ist und die Röntgenstrahlen auf ihrem Weg von der Röhre weg weiter auseinander laufen (= divergieren). Folglich erscheint der Herzschatten in einer a.-p. größer als in einer p.-a. Aufnahme. Meist wird der Strahlengang auf dem Anforderungsschein oder auch (besser) auf dem Bild gekennzeichnet.
Abb. 3-4.

Einfluss der Lagerung auf das Thoraxbild. A: Die p.-a. Aufnahme im Stehen ermöglicht eine tiefere Inspiration als die in Rückenlage. Die kleinen runden Objekte über dem unteren Thoraxbereich links sind Druckknöpfe in der Kleidung des Patienten. B. In der a.-p. Aufnahme in Rückenlage presst der Bauchinhalt die Zwerchfellhälften nach oben, so dass das Bild einer unzureichenden Inspiration entsteht. Ferner vergrößert diese Projektion verglichen mit einer p.-a. Aufnahme das Herz stärker.
Aufnahme im Stehen und in Rückenlage
Aus zahlreichen Gründen wird die Thoraxuntersuchung bei Patienten, die steh- oder sitzfähig sind, meist auch in dieser Position durchgeführt. Die Inspirationstiefe ist hierbei größer, die Lungengefäße verlaufen weiter voneinander entfernt und erlauben eine bessere Einsicht. Es ist auch leichter, einen Vogel im Baum zu sehen, wenn die Zweige entfaltet sind als wenn sie eng gedrängt stehen. Ein weiterer Grund, eine Untersuchung bei aufrechtem Oberkörper zu bevorzugen, ist die Tatsache, dass kleine Pleuraergüsse sich dann in den normalerweise scharfen Randsinus sammeln, so dass man bereits relativ kleine Ergüsse nachweisen kann. Ein kleiner Pneumothorax steigt meist zum Lungenapex auf und kann so in einer Aufnahme im Stehen/Sitzen leicht erkennbar werden.
Ein im Bett und auf dem Rücken liegender Patient, bei dem das typische Röntgenbild mit der Kassette unter dem Patienten angefertigt wird, kann nicht vollständig einatmen. Leber und Bauchinhalt drängen Lungen und Herz nach oben, weshalb die Lungengefäße zusammengedrängt werden. In Rückenlage werden die Lungenoberfelder gleich stark durchblutet wie die Unterfelder, was eine Lungenstauung vortäuscht. In der Rückenlageaufnahme bewirkt die a.-p. Standardprojektion zusammen mit dem Druck der Bauchorgane nach oben, dass ein normal großes Herz vergrößert erscheint. Ferner sammeln sich bei einem Patienten in Rückenlage kleine Pleuraergüsse im dorsalen Pleuraraum, und ein kleiner Pneumothorax gelangt unter die vordere Thoraxwand, so dass einem beide Befunde leicht entgehen können. Infolgedessen muss man bei der Befundung einer Rückenlageaufnahme mit fahrbarem Röntgengerät weitaus zurückhaltender und vorsichtiger sein.
Inspirations- und Exspirationsaufnahme
Die Einatmungstiefe ist nicht nur wichtig, um Qualität und Grenzen der Untersuchung zu bestimmen, sondern auch für die Diagnose unterschiedlicher Krankheiten. Im Stehen können die meisten Erwachsenen mühelos so tief Luft holen, dass die Zwerchfellkuppeln bis in Höhe der dorsalen Anteile der 10. Rippe zu stehen kommen. Sitzt oder liegt der Patient, wird oft nur eine Höhe zwischen 8. und 10. Rippe erreicht. Zeigt das Bild die Zwerchfellkuppel nur in Höhe der 7. Rippe dorsal, müssen die Lungen als unzureichend entfaltet betrachtet werden und man sollte mit der Annahme einer basalen Pneumonie oder einer Kardiomegalie vorsichtig sein (Abb. 3-5 ). Man sollte sich der Hauptunterschiede von Röntgenaufnahmen des Thorax als Folge der zuvor erwähnten Faktoren bewusst sein. Dadurch lassen sich falsche Befunde wie Kardiomegalie, Lungeninfiltrat und Stauungsinsuf fizienz des Herzens bei einem eigentlich normalen Thorax vermeiden (Abb. 3-6 ).
Abb. 3-5.

Einfluss der Atemtiefe. A. Eine tiefe Inspiration lässt in einer Thoraxaufnahme das Zwerchfell tiefer treten (bis zur Höhe des dorsalen Anteils der 10.–11. Rippe). Zu beiden Seiten ist der Mammaschatten klar gezeichnet, wobei das Mammagewebe die Lungengefäße darunter hervorhebt. B. In einer Exspirationsaufnahme stehen die Zwerchfellhälften höher. Sie lassen das Herz breiter erscheinen und drängen die basalen Lungengefäße zusammen. Diese Befunde können zu der Annahme verleiten, es könnten beidseits basale Unterlappeninfiltrate vorliegen, obwohl es sich um einen normalen Thorax handelt.
Abb. 3-6.

Summationswirkung von Lagerung, Projektion und Atmung. A. Normales p.-a. Thoraxröntgenbild im Stehen. B. Eine Minute später wurde bei diesem völlig gesunden Studenten eine weitere Aufnahme in a.-p. Projektion bei Rückenlage und in Ausatmung durchgeführt. Der breite Herzschatten und die starke Lungengefäßzeichnung könnten als Zeichen einer Herzinsuffizienz fehlgedeutet werden.
Aufnahmen in Exspiration sind manchmal durchaus sinnvoll. Bei Vorliegen eines kleinen Pneumothorax macht eine Aufnahme in Ausatmung die Lungen kleiner und dichter und gleichzeitig den Pneumothorax größer und leichter sichtbar. Ist also das Hauptanliegen, einen kleinen Pneumothorax nachzuweisen, wird eine Aufnahme im Stehen mit Exspiration angefordert. Bei einem in einen größeren Bronchus eingeklemmten Fremdkörper sollte man sowohl eine Inspirations- als auch eine Exspirationsaufnahme anfertigen lassen. So kann man entweder eine postobstruktive Atelektase oder einen Ventilmechanismus erkennen. Beim Ventilmechanismus kann Luft bei der Einatmung am Fremdkörper vorbeigelangen, bei Ausatmung (mit hierbei kleiner werdendem Bronchus) aber nicht mehr am Fremdkörper vorbei austreten. Deshalb wird man in einer Exspirationsaufnahme in der betroffenen Lunge ein „air trapping” und ein zur gesunden Seite abgedrängtes Mediastinum sehen.
Bevor man in einer Thoraxaufnahme eine Überblähung diagnostiziert, sollte man die seitliche Aufnahme betrachten: Bei einer echten Lungenüberblähung sollten die Zwerchfellhälften abgeflacht sein. Viele junge Erwachsene können normalerweise sehr tief einatmen, bieten aber dennoch in der Seitenaufnahme keinen vergrößerten sagittalen Thoraxdurchmesser oder abgeflachte Hemidiaphragmen. Bei einer langjährigen chronisch obstruktiven Lungenkrankheit (engl. COPD) dagegen können Befunde wie ein erhöhter Sagittaldurchmesser und ein aufgeweiteter Raum zwischen Brustbein und Aorta ascendens (= Retrosternalraum) vorliegen.
Hartstrahl- und Rippentechnik
Bei einer typischen Thoraxaufnahme verwendet man Röntgenstrahlen mit einer Energie, die Lungengefäße, Weichteile und Knochen gleichzeitig darstellen kann. Eine gute Beurteilung des Knochens ist jedoch erst dann möglich, wenn eine relativ niedrige Röhrenspannung gewählt wird. Dann ist allerdings die Lungenzeichnung schwer erkennbar (Abb. 3-7 ). Sind Frakturen von Rippen oder der Wirbelsäule oder andere Knochenveränderungen von Interesse, sollte statt einer normalen Thoraxaufnahme eine „Rippen”- (Hemithoraxaufnahme) oder eine „Wirbelsäulen”- Untersuchung angefordert werden, die die Knochendetails besser herausarbeitet.
Abb. 3-7.

Hartstrahl- und Rippentechnik im Vergleich. A. Die normale Thoraxaufnahme wird mit hoher Röhrenspannung (> 100 kV) angefertigt, wodurch man Herz, Lungengefäße und Knochenstrukturen erkennen kann. B. Bei geringerer Röhrenspannung sind die Lungengefäße viel schwerer zu erkennen, dagegen wird der Knochen besser sichtbar.
Anatomie und Normvarianten
Es ist wichtig, die Anatomie so, wie das Röntgenbild sie wiedergibt, zu verstehen. Wichtige Strukturen sind in Abb. 3-8 dargestellt. Eine Methodik, die Thoraxaufnahme zu befunden, findet sich in Tab. 3-1 . Die angemessenen bildgebenden Untersuchungen in verschiedenen klinischen Situationen zeigt Tab. 3-2 . Einige Situationen, in denen die Thoraxaufnahme nicht indiziert ist, gibt Tab. 3-3 an.
Abb. 3-8.

Normale Anatomie im Röntgen-Thoraxbild. Thoraxbild einer Frau im Stehen im p.-a. (A) und im seitlichen (B) Strahlengang.
Tab. 3-1.
Wie befundet man ein Röntgenbild des Thorax?
| Parameter | Beschreibung |
|---|---|
| Alter und Geschlecht des Patienten; Anamnese | |
| Projektion und verwendete Technik | a.-p., p.-a., seitlich, Liegendaufnahme mit fahrbarem Gerät oder Standardentfernung |
| Position des Patienten | Stehend, Rückenlage, Seitenlage, Lordoseaufnahme |
| Inspirationstiefe | Angemessen, zu flach oder zu tief eingeatmet |
| Herzgröße | Zu groß oder normal |
| Herzform | Vergrößerung einzelner Kammern |
| Kontur des oberen Mediastinums | |
| Atemwege | Trachealabweichung |
| Lungensymmetrie | Ist das Mediastinum verlagert? Position der Hili |
| Lungen | Infiltrate, Raumforderungen oder Knoten |
| Lungengefäßzeichnung | Vermehrt, vermindert oder normal; im Unterfeld größer als im Oberfeld |
| Pleuraergüsse | Stumpfer Randsinus |
| Rippen, Klavikula, Brustwirbelsäule | Fraktur oder andere Läsionen |
| Lage eines Trachealtubus | |
| Typische „blinde Stellen” und Fehlerquellen | Hinter dem Herzen, hinter den Zwerchfellhälften, in den Lungenspitzen, ist ein Pneumothorax vorhanden?, kostophrenischer Winkel (= Randsinus), Thoraxwand, Osteolysen der Rippen, Schultern |
| Vergleich mit allen alten Aufnahmen | |
| Sammeln der Befunde und ihrer Lokalisation | |
| Sammeln häufiger Differenzialdiagnosen im Zusammenhang mit der Anamnese |
a.-p.: anterior-posterior; p.-a.: posterior-anterior
Tab. 3-2.
Bildgebende Verfahren bei Erkrankungen des Thoraxraumes
| Klinik | Diagnostisches Verfahren der Wahl |
|---|---|
| Pneumonie (klinische Diagnose) | Röntgenthoraxaufnahme (zur Bestätigung) |
| COPD (akut exazerbiert) | Röntgenthoraxaufnahme |
| Linksherzinsuffizienz (neu aufgetreten oder akut verschlechtert) | Röntgenthoraxaufnahme, EKG |
| Trauma | Röntgenthoraxaufnahme, CT |
| Thoraxschmerz (bei Erwachsenen > 40 J. oder auffälligem | Röntgenthoraxaufnahme (Zusatzuntersuchungen hängen von Verdachtsdiagnose ab) |
| körperlichen Untersuchungsbefund) | |
| Atemnot (schwer oder lang dauernd oder Erwachsener > 40 J.) | Röntgenthoraxaufnahme |
| Asthma (Verdacht auf überlagerte Krankheit oder Therapieresistenz) | Röntgenthoraxaufnahme |
| Interstitielle Lungenkrankheit | Röntgenthoraxaufnahme, Lungenfunktionsuntersuchung |
| Immunsupprimierter Patient (mit Fieber, Husten oder Dyspnö) | Röntgenthoraxaufnahme |
| Fremdkörper | Röntgenthoraxaufnahme in In- und Exspiration |
| Aspirationspneumonie | Röntgenthoraxaufnahme |
| Mediastinale Raumforderung | CT mit Kontrastmittel |
| Solitärer Lungenrundherd | Röntgenthoraxaufnahme p.-a. und seitlich (evtl. mit Mamillenmarkern), hochauflösende CT des Rundherds, normale Thorax-CT (sollte bis zu den Nebennieren reichen) |
| Lungentumor | Röntgenthoraxaufnahme und CT oder Bronchoskopie |
| Pleuraflüssigkeit oder -tumor | CT |
| Abgekammerter Pleuraerguss zur Pleurapunktion | Auskultation; Sonographie |
| Verdacht auf Pneumothorax | Röntgenthoraxaufnahme (evtl. auch mit Exspirationsaufnahme) |
| Hämoptysen | Röntgenthoraxaufnahme/Bronchoskopie |
| Perikarderguss | Echokardiographie |
| Wandstärke des Myokards | Echokardiographie |
| Herzwandbewegung | Echokardiographie |
| Kardiale Ejektionsfraktion | Szintigraphie (getriggerte Blut-Pool-Untersuchung oder Sonographie/MRT) |
| Lungenembolie | Röntgenthoraxaufnahme, CT oder Szintigraphie (Ventilations- Perfusionsszintigraphie) |
| Koronarischämie | Belastungs-EKG; Belastungsszintigraphie (Myokardperfusions- szintigraphie), Echokardiographie/Koronarangiographie jeweils unter Belastung |
| Aortenaneurysma | CT mit KM oder transösophageale Sonographie |
| Aortenruptur | CT oder Angiographie |
| Aortendissektion | CT mit KM oder transösophageale Sonographie |
COPD: chronische obstruktive Lungenkrankheit; CT: Computertomographie; p.-a. posterior-anterior; KM: Kontrastmittel; EKG: Elektrokardiographie
Tab. 3-3.
Situationen, in denen keine Röntgenaufnahme des Thorax indiziert ist
| Pränatale Thoraxaufnahme |
| Routine bei stationärer Krankenhausaufnahme bzw. präoperativ bei Patienten unter 65 Jahren (ohne Herz- oder Thorax- probleme) |
| Routine vor Berufsantritt |
| Screening auf okkultes Bronchialkarzinom |
| Screening auf Tuberkulose |
| Unkomplizierter Asthmaanfall |
| Chronische obstruktive Lungenkrankheit ohne akute Exazerbation |
| Dyspnoe von kurzer Dauer und geringer Intensität bei Erwachsenen unter 40 J. |
| Thoraxschmerz bei einem Erwachsenen unter 40 J. mit normalem Befund der körperlichen Untersuchung bzw. ohne Trauma in der Anamnese |
| Unkomplizierte Hypertonie |
| Chronische Bronchitis |
| Akute respiratorische Erkrankung bei einem Erwachsenen unter 40 J. mit normalem Befund der körperlichen Untersuchung und ohne weitere Symptome oder Risikofaktoren |
Es soll hier mit der Beurteilung des Herzens begonnen werden. In der p.-a. Aufnahme des Herzens ist der linke Rand prominenter als der rechte. Die Herzhöhlen liegen etwas verdreht im Thorax, so dass sich in der p.-a. und in der Seitenaufnahme die Herzkammern weitgehend aufeinander projizieren. Als Faustregel gilt: Ist die rechte Herzhälfte stärker vergrößert als die linke, dann liegt eine Läsion der rechten Herzkammer vor, und umgekehrt.
In der p.-a. Aufnahme des Thorax im Stehen sollte der größte Querdurchmesser des Herzens kleiner sein als der halbe Querdurchmesser der Thoraxhöhle an deren weitester Stelle (Abb. 3-9 ). Man bestimmt dies, indem man den am weitesten rechts und links liegenden Punkt des Herzens sucht. Diese beiden Punkte müssen nicht in gleicher Höhe liegen. Man bestimme jeweils den horizontalen Abstand beider Punkte zur Mittellinie und addiere die Abstände. Manchmal findet man eine Dextrokardie oder einen Situs inversus (Abb. 3-10 ). Bevor man letztere Diagnose stellt, sollte man sich vergewissern, ob nicht die Bleibuchstaben zur Seitenmarkierung verwechselt wurden.
Abb. 3-9.

Vermessung einer Kardiomegalie. Die Breite eines normalen Herzens (A, Summe der breitesten Ausladung rechts und links von der Mittellinie) sollte die Breite eines Hemithorax, gemessen von der Wirbelsäulenmitte bis zum am weitesten entfernten Rippeninnenrand (B), nicht überschreiten.
Abb. 3-10.

Situs inversus. Herz, Magen und Leber liegen seitenverkehrt. Bevor die Diagnose gestellt werden kann, muss kontrolliert werden, ob die Bleibuchstaben für rechts und links korrekt angebracht waren.
Die im oberen Mediastinum sichtbaren Strukturen sind rechts die Vena brachiocephalica dextra, die V. azygos und die aufsteigende Aorta; den Beginn des rechten Randes der Aorta ascendens kann man unterhalb des rechten Hilus sehen. Den Aortenbogen sieht man zumeist links der Trachea. Von der Pars descendens der Aorta sieht man häufig nur deren linken Rand dort, wo er an die Lunge angrenzt. Die Luftröhre sollte mittelständig sein; man kann sie bis zur Carina verfolgen. Auch rechter und linker Hauptbronchus sind zu erkennen. Der Ösophagus ist dagegen in einer normalen Thoraxröntgenaufnahme nicht sichtbar.
Hili und Lungen
Die Hili setzen sich aus den Lungenhauptarterien und den Stammbronchien zusammen. Der rechte Hilus steht meist etwas tiefer als der linke; er sollte nicht auf gleicher Höhe oder höher gelegen sein. Die Lungenvenen sind meist schwerer erkennbar als die Arterien. Sie konvergieren in einer Höhe von 2,5–7,5 cm unterhalb der Pulmonalarterien zum linken Vorhof. (Gesunde) Lymphknoten der Hilus- und Mediastinalregion sieht man normalerweise in einer Thoraxaufnahme nicht.
Hauptvolumenbestandteil der Lunge ist Luft, weshalb sich im Normalfall außer Blutgefäßen wenig abbildet. Diese sollten klar auf ihrem Weg zum Hilus hin erkennbar bleiben. Sind hilusnah keine klar gezeichneten Blutgefäße zu sehen, kann ein perihiläres Infiltrat oder Flüssigkeit vorhanden sein (wie bei Linksherzinsuffizienz). Normale Hili sind in Aufnahmen mit fahrbaren Geräten manchmal unscharf, weil die Belichtungszeit größer ist und die Gefäße bewegungsunscharf werden.
Die Blutgefäße in der Lunge sind meist bis zu einem Abstand von 2–3 cm zur Thoraxwand klar sichtbar. Die Aussage, im äußeren Lungendrittel erkennbare Gefäße seien abnorm, ist nicht richtig. Ob dort Gefäße erkannt werden, hängt von der Qualität des Films und von der Genauigkeit des Betrachters ab. Linien, die weniger als 2 cm von der Thoraxwand entfernt sind, sind abnorm und stellen wahrscheinlich ein Ödem, eine Fibrose oder metastatische Veränderungen dar. Sekundäre Bronchien sieht man normalerweise nicht, außer in Hilsunähe, wo sie sich manchmal orthograd getroffen darstellen. Die Wände der sichtbaren Bronchien sollten normalerweise nicht breiter als ein zarter Bleistiftstrich sein.
Man kann mitunter im rechten Lungenoberlappen eine Lubus venae azygos genannte Variante sehen. In der p.-a. Aufnahme zeigt sich eine zarte gekrümmte Linie, die vom rechten Lungenapex in Richtung Mediastinum zieht (Abb. 3-11 ); an ihrem Unterrand ist sie tränenförmig. Embryologische Ursache ist die von der Lungensitze ausgehende Wanderung der Azygosvene, bei der sie in einen medial liegenden Teil der Lunge „einschneidet”.
Abb. 3-11.

Magnetresonanztomographie (MRT) des Gehirns.. Eline Vielzahl von Bildparametern kann das Hirngewebe auf MRTBildern sehr unterschiedlich aussehen lassen. Die beiden häu.gsten Darstellungen sind T1-Bilder und T2-Bilder. A. T1-Bild: Fett erscheint weiß, Wasser und Liquor cerebrospinalis (CSF) schwarz, Gehirn und Muskel grau. In fast allen MRT-Bildern gibt Knochen kein Signal und erscheint deshalb schwarz. B. In T2-Bildern erscheint Fett dunkel, Wasser und Liquor hell oder weiß, weil sie ein sehr starkes Signal geben. Gehirn und Weichteile erscheinen wie im T1-Bild grau.
Man denke daran, dass in einer p.-a. oder a.-p. Aufnahme Lungenanteile hinter dem Herzen, hinter und unterhalb der Zwerchfellkuppeln und hinte und vor den Mediastinalstrukturen liegen. 40% der Lungenprojektionsfläche und 25% des Lungenvolumens werden von diesen Strukturen überlagert. betrachtet man diese Regionen nicht sorgfältig, kann eine erhebliche Menge signifikanter pathologischer Befunde übersehen werden.
Zwerchfell
Die Zwerchfellhälften sind typischerweise kuppelförmig, bei vielen Menschen findet sich aber auch ein mehrfach bogiges Zwerchfell, das aus mehreren Kuppeln besteht. Dies ist eine wichtige Normvariante und nicht mit einem Pleura- oder Zwerchfelltumor zu verwechseln; es sollte auch nicht als Hernie verkannt werden (Abb. 3-12 ). Die rechte Zwerchfellhälfte steht meist höher als die linke. Dies liegt nicht daran, dass die Leber das rechte Hemidiaphragma hochdrücken würde; die Leber, die ja etliche Pfund wiegt, kann bei einer stehenden Person nicht nach oben in die Lungen drängen. Die Zwerchfellhälften stehen unterschiedlich hoch, weil das Herz die linke Hälfte nach unten drückt. Die Ränder beider Zwerchfellhälften bilden mit der Thoraxwand spitze Winkel. Sind diese stumpf, sollte man an einen Pleuraerguss denken.
Abb. 3-12.
Mehrbogiges Zwerchfell. Bei dieser häufigen Normvariante zeigt das Zwerchfell nicht eine große, sondern mehrere kleine Kuppeln.
Es ist schwierig, in der seitlichen Aufnahme das rechte vom linken Hemidiaphragma zu unterscheiden. Es gibt verschiedene Unterscheidungskriterien: Das rechte Hemidiaphragma steht meist höher als das linke und man kann es von den vorderen bis zu den hinteren Rippenanteilen verfolgen. Das linke Hemidiaphragma ist meist nur von der Rückfläche des Herzens bis zu den dorsalen Rippenanteilen sichtbar. Ferner ist die linke Zwerchfellhälfte diejenige, unter der eine Gasblase (Magen oder Kolon) gelegen ist.
Knochenstrukturen
Zu den Skelettstrukturen des Thorax zählen im Röntgenbild die Rippen, das Sternum, Wirbelsäule und Schultergürtel.
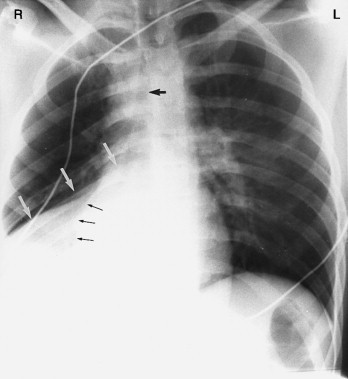
Zwölf Rippen sollten sichtbar sein, man sieht jedoch im p.-a. Röntgenbild nur die oberen vollständig. In der Seitenaufnahme sind die Rippen sehr schwer zu beurteilen, da sich die rechten und die linken Rippen sowie die vielenWeichteilstrukturen überlagern. Die Beurteilung sollte die Suche nach Halsrippen (Abb. 3-13 ), Frakturen, Fehlbildungen, fehlenden Rippen (nach Operation) und osteolytischen (destruierenden) Läsionen einschließen. Den Rippenoberrand sieht man zumeist gut, da die Rippen dort gerundet sind; der untere Rand ist hingegen meist sehr dünn und somit ist die untere Kortexgrenze eventuell schwer beurteilbar. Vergleicht man die Rippen der rechten und linken Seite auf gleicher Höhe, sollten sie im Normalfall s mmetrisch sein. An ihrem vorderen Ende verbindet Knorpel die Rippen mit dem Brustbein. Bei älteren Menschen können Rippenknorpel erheblich verkalken; dies ist aber ein Normalbefund (Abb. 3-14 ).
Abb. 3-13.

Halsrippen. Angeborene Anomalie, bei der seitlich vom 7. Halswirbel kleine Rippen abgehen (Pfeile). Gelegentlich werden Halsrippen symptomatisch.
Abb. 3-14.

Rippenknorpelverkalkungen. Verkalkungen zwischen den Enden der knöchernen Rippen und dem Brustbein sind insbesondere bei älteren Menschen recht häufig und können sehr auffällig sein (Pfeile). Ferner findet sich bei diesem Patienten eine Magensonde vom Typ Dobbhoff.
Das Sternum sieht man nur in der seitlichen Thoraxaufnahme gut. In dieser Ansicht sollte man auch auf Thoraxdeformitäten, Frakturen und Osteolysen achten. Eine Thoraxdeformität (z.B. Trichterbrust) kann eine scheinbare Kardiomegalie vortäuschen, da das Sternum eingezogen ist und so das Herz gegen die Wirbelsäule drängt; das Herz sieht dann in einer p.-a. Aufnahme breiter als normal aus (Abb. 3-15 ). Mitunter können überbelichtete Thoraxschrägaufnahmen das Brustbein gut darstellen; gelingt dies nicht, muss evtl. eine Computertomographie (CT) mit Knochenfenster angefordert werden.
Abb. 3-15.

Trichterbrust. Angeborene Anomalie, bei der das Brustbein eingezogen ist. Da das Herz zwischen Sternum und Wirbelsäule eingeengt wird, erscheint es in der p.-a. Aufnahme des Thorax (A) groß. Der rechte Herzrand ist unscharf, was an ein Mittellappeninfiltrat denken lässt. Die seitliche Aufnahme (B) zeigt die Sternumeinziehung sehr deutlich (Pfeile).
Klavikula und Schultergürtel sollten routinemäßig beurteilt werden. Oft erscheinen die Schlüsselbeine medial am Unterrand ausgehöhlt; man nennt dies eine Fossa rhomboidea, die beidseitig vorkommt und nicht als pathologische Knochenveränderung verkannt werden sollte (Abb. 3-16 ). Der mediale Skapularand projiziert sich auf die lateralen Lungenanteile und kann mitunter mit einer pathologischen Linie, wie bei einem Pneumothorax, verwechselt werden. Daher sollte man sich, bei Verdacht auf einen Pneumothorax, vergewissern, dass die „Linie” nicht dem Skapularand entspricht. Man verfolge die Kontur des Schulterblatts. Der Skapulainnenrand verläuft gewöhnlich eher geradlinig als gekrümmt.
Abb. 3-16.
Fossa rhomboidea (Rautengrube). Normalbefund, bei dem an der Innen- und Unterseite der Schlüsselbeine „Einziehungen” sichtbar sind (Pfeile), die immer beidseitig vorhanden sein sollten. Sie haben keine klinische Bedeutung.
Die Brustwirbelsäule (BWS) sieht man in einer Standardröntgenaufnahme des Thorax nur unvollständig, weil sie im p.-a. und im a.-p. Bild von Herz und Mediastinalstrukturen verdeckt wird. Bei älteren Menschen können erhebliche degenerative Veränderungen oder Knochensporne (Spondylophyten) von der Seite der Wirbelkörper abgehen. Oft kann man diese in der p.-a. Aufnahme erkennen (Abb. 3-17 ). Sie können in der Seitenaufnahme wie Lungenrundherde aussehen. Zur Differenzierung ist zu beachten, dass sich die Spondylophyten in der Seitenaufnahme auf die Bandscheiben projizieren und in der p.-a. Aufnahme nicht wie echte Rundherde aussehen.
Abb. 3-17.

Degenerative Sporne oder Osteophyten. Diese Sporne entstehen in Diskushöhe und können zu einem ungewöhnlichen Aussehen des seitlichen Rands der Brustwirbelsäule (BWS) führen. Im seitlichen Thoraxbild können diese Sporne Rundherde, die sich auf die BWS projizieren, vortäuschen.
Weichteile
Auch die Weichteile sollten beurteilt werden. Wie oben erwähnt, können infolge einer Mastektomie oder durch den Mamillenschatten Schwierigkeiten bei der Beurteilung auftreten. Doch auch andere Weichteile sind wichtig. Es ist notwendig, auf eine Asymmetrie von Weichteilen oder auf Gas bzw. Kalk in Weichteilen zu achten. Man muss bei älteren Menschen eine Verkalkung in den Karotisarterien oder anderen großen Gefäßen erkennen (Abb. 3-18 ). Ein häufiges verwirrendes „Artefakt” können Haare verursachen (v.a. Zöpfe). Ist das Haar fettig und zum Zopf geflochten, kann man sehr dichte Schatten sehen (Abb. 3-19 ), die mit Lungenspitzeninfiltraten verwechselt werden könnten.
Abb. 3-18.

Karotiskalk. Bei älteren Patienten kann man oft als Folge der Atherosklerose Verkalkungen von Aortenbogen und großen Gefäßen sehen. In diesem Fall erkennt man Kalkablagerungen in den Karotisarterien (Pfeile).
Abb. 3-19.

Haarzopf. Dicht geflochtenes oder fettiges Haar kann streifige Artefakte bewirken, die einem Oberlappeninfiltrat ähneln können. Solche Artefakte ziehen allerdings über den Lungenapex hinweg und projizieren sich auch auf die Halsweichteile.
Normalerweise sollten zwischen der belüfteten Lungenperipherie und den Rippen nicht allzu viele Weichteile (oder die Dichte von Wasser) vorhanden sein. Die Pleura sieht man normalerweise an den Lungenaußenrändern nicht. Bei einigen Erwachsenen erscheint aber längs der Thoraxwand zwischen Lunge und Rippen Fett; dies ist extrapleurales Fett, das man meist nur in der p.-a. Aufnahme des Thorax und nahezu immer im oberen äußeren Bereich der Thoraxhöhle erkennt (Abb. 3-20 ). Dieser Befund darf nicht als ein Pleuraerguss verkannt werden. Liegen keine weiteren Ergusszeichen vor (wie ein stumpfer Randsinus), ist der Befund beidseitig vorhanden, sieht man ihn nahe den oberen äußeren Lungenfeldern und ist er nicht breiter als 3–4 mm, dann handelt es sich nahezu sicher um extrapleurales Fett und nicht um einen Pleuraerguss.
Abb. 3-20.

Extrapleurales Fett. Dieser im oberen und lateralen Hemithorax sichtbare normale Befund ist seitensymmetrisch und sollte nicht mit einem Pleuraerguss verwechselt werden.
Anatomie in der Computertomographie (CT)
Es ist wichtig, dass man die Querschnittsanatomie des Thorax versteht, da die CT sehr häufig zur Beurteilung pathologischer Thoraxveränderungen eingesetzt wird. Man kann die CT-Untersuchung des Thorax mit oder ohne Kontrastmittelgabe vornehmen. Die meisten Standardprotokolle liefern CT-Schnittbilder („Scans”) von unter 8 mm Schichtdicke. Um einen Lungenknoten zu beurteilen, verwendet man schmalere Schichten und benötigt kein Kontrastmittel. Zur Beurteilung eines Aneurysma dissecans der Aorta ist eine intravenöse Bolusinjektion von Kontrastmittel ganz wesentlich. Die Anforderung der Untersuchung sollte in Absprache mit dem Radiologen und unter Angabe der vollständigen klinischen Informationen vorgenommen werden, damit die korrekte Technik eingesetzt werden kann. Wenn verfügbar, fertigt man eine Spiral- oder besser noch Multidetektor- oder Mehrzeilen-CT an, weil man dadurch den gesamten Thorax in wenigen Sekunden abbilden kann, während der Patient den Atem anhält. Nach Ende der „Spirale” werden die Computerdaten auf Film übertragen und dafür ein Mediastinal-(oder Weichteil-) und ein Lungenfenster gewählt. Dies verschafft eine gute Übersicht über das Lungenparenchym und ermöglicht die Unterscheidung der mediastinalen Strukturen (Abb. 3-21 ).
Abb. 3-21.

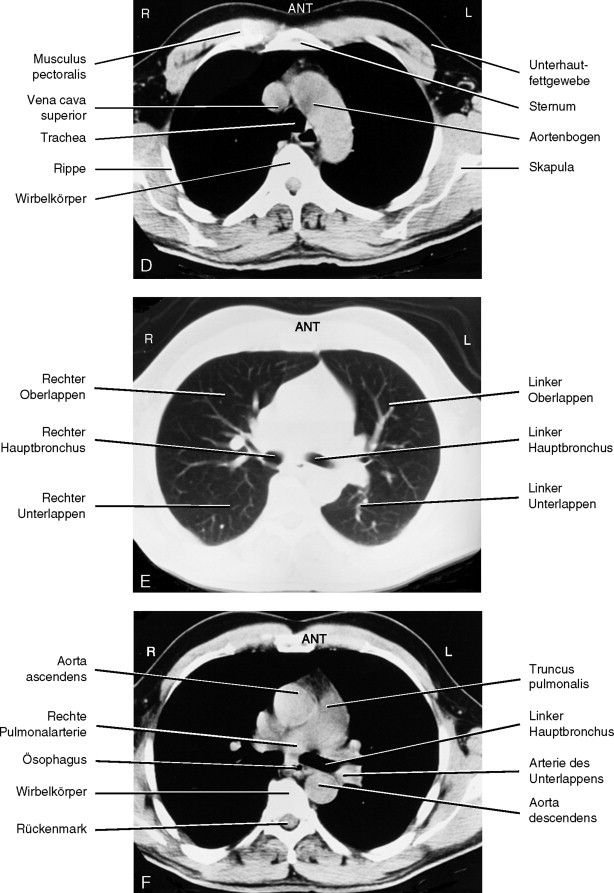


Normale Anatomie des Thorax in axialen Computertomographiebildern (CT). Es sind jeweils paarweise Schnitte gleicher Höhe in Lungen- und Weichteilfenster abgebildet (A-L).
Unter bestimmten Umständen möchte man feinere Details der Lunge darstellen. Dann kann man eine hochauflösende CT (high-resolution CT oder HRCT) durchführen. Die hierbei gewonnenen Schichten sind 1–2 mm stark. Meist wird nicht die gesamte Lunge untersucht, um nicht zu viele Bilder zu erhalten. Es ist für die Diagnosestellung nicht notwendig und eine viel zu hohe Strahlenbelastung. Deshalb „fährt” man oftmals eine reguläre CT mit schmalen Schichten in ausgewählten Höhen (Abb. 3-22 ).
Abb. 3-22.

Normale und hochauflösende Computertomographie (CT) der Lungen. A. Die normale Schichtdicke eines CT-Bilds der Lunge beträgt 8 mm. B. Der hochauflösende (high-resolution) CT-Schnitt in exakt gleicher Höhe hat eine Dicke von 1,5 mm und zeigt wesentlich mehr Details von Gefäßen und Bronchien.
Das abnorme Thoraxbild
Thoraxaufnahme bei Einweisung und präoperativ
Routineaufnahmen des Thorax bei Krankenhausaufnahme haben eine geringe Ausbeute und sind damit nicht indiziert. Bei der Krankenhausaufnahme eines Patienten mit einem kardiothorakalen Problem, Karzinom oder fieberhaften Leiden ist die Röntgenaufnahme des Thorax angemessen. Routinemäßige präoperative Aufnahmen sind ebenfalls nicht indiziert (z.B. vor einer Fuß- oder Knieoperation). Hingegen besteht die Indikation vor einer Operation von Hals oder Thorax und bei Patienten, die anamnestisch ein Problem mit Atemwegen oder Herz haben, die fiebern, immunsupprimiert sind, eine Bewusstseinsstörung, ein akutes Abdomen, ein bekanntes oder vermutetes Karzinomleiden haben oder älter als 65 Jahre sind. Ferner ist eine Thoraxaufnahme bei Kindern angebracht, die auf eine Intensivstation aufgenommen werden.
Thoraxaufnahme in der Arbeitsmedizin
Röntgenuntersuchungen des Thorax bei Berufseinstellung und Versetzung sollten selektiv auf der Grundlage zugehöriger Faktoren von Anamnese, Krankengeschichte, klinischer Untersuchung und vorgesehener Art der Tätigkeit gemacht werden. Patienten, die mit Stoffen umgehen oder ihnen ausgesetzt sein könnten, die die Lungenfunktion negativ beeinflussen oder Lungenkrankheiten verursachen, sollte man mit Röntgenuntersuchungen des Thorax überwachen, wenn dies das diagnostische Vorgehen mit der größten Genauigkeit und dem frühesten Nachweis ist. Die Untersuchungsintervalle hängen von den jeweiligen Umständen des Falls ab.
Silhouettenzeichen
Das Silhouettenzeichen ist bei der Interpretation einer Röntgenthoraxaufnahme eines der nützlichsten Zeichen; es hilft den Ort einer Veränderung im räumlichen Bezug zu normalen Strukturen zu erkennen. Zum Verlust einer normalen Randkontur kommt es, wenn eine pathologische Veränderung flächig und direkt mit dieser in Kontakt steht. Weist man z.B. in einer p.-a. oder a.-p. Aufnahme im rechten Lungenunterfeld ein Infiltrat nach, so kann dieses entweder im Mittel- oder im Unterlappen gelegen sein. Findet man den normalerweise deutlich erkennbaren rechten Herzrand ausgelöscht, dann muss das Infiltrat an das Herz angrenzen und liegt somit im medialen Mittellappensegment. Ist dagegen die Kontur der rechten Zwerchfellhälfte verloren gegangen, liegt das Infiltrat nahezu sicher im rechten Unterlappen. Man kann das Silhouettenzeichen auch in umgekehrter Weise anwenden. Projiziert sich in einem p.-a. Bild des Thorax eine Raumforderung auf den Aorten„knopf” und ist dieser scharf begrenzt sichtbar, muss die Raumforderung entweder ventral oder dorsal davon liegen.
Aufnahme in der Intensivstation mit fahrbarem Gerät
Es wurde viel geschrieben über Nutzen oder übermäßigen Einsatz von Röntgenaufnahmen des Thorax in der Intensivstation. Im Allgemeinen sollte man fortlaufende oder Routineaufträge zur „Intensivlunge” vermeiden. Allerdings sind die Patienten in einer Intensivstation definitionsgemäß schwer krank, liegen meist einen Großteil des Tages auf dem Rücken und atmen nicht normal. Nahezu alle diese Patienten haben Tuben oder Zugänge, die häufig gewechselt oder korrigiert werden. Tägliche Thoraxaufnahmen sind bei Patienten mit einem Endotrachealtubus oder einem erst kürzlich angelegten Tracheostoma indiziert. Bei diesen Patienten decken über 60% der täglichen Thoraxaufnahmen keine neuen wichtigen Befunde und ca. 20% neue, aber wenig wichtige Befunde auf. Es werden allerdings in 20% der Fälle neue wesentliche Befunde nachgewiesen, die klinisch unverdächtig und nur in der Thoraxaufnahme erkennbar sind. Ferner sind Aufnahmen indiziert, nachdem eine Pleuradrainage oder ein zentralvenöser Katheter gelegt wurde, um die Lage und einen evtl. vorhandenen Pneumothorax zu sehen. Die Veränderungen, auf die man bei einem Patienten nach Operation oder Trauma achten sollte, zählt Tab. 3-4 auf.
Tab. 3-4.
Prüfung von veränderten Befunden im Thoraxröntgenbild bei Zustand nach Eingriff oder Trauma
| Lage von Trachealtubus, Pleuradrainagen, Venenkatheter |
| Verbreitertes oberes Mediastinum |
| Linksseitiges pleurales „apical-cap”-Zeichen |
| Aorten„knopf” oder a.-p. Fenster (Zeichen der Aortenruptur) unscharf |
| Pneumothorax (apikal, abgekammert oder basal) |
| Mediastinalemphysem |
| Subkutanes Emphysem |
| Infiltrate (Veränderungen?) |
| Mediastinalverlagerung |
| Atelektase (Lappen- oder herdförmige Atelektase) |
| Pleuraerguss |
| Rippen- oder Sternumfraktur(en) |
| Wirbelsäulenfrakturen (inkl. verbreiterte paravertebrale Weichteile) |
| Schulterfrakturen und -luxationen |
| Freie Luft unter dem Zwerchfell |
Tubus, Kabel und Zugänge im Röntgenbild des Thorax
Häufiger Grund, eine Röntgenthoraxaufnahme machen zu lassen, ist die Beurteilung von Position und Begleitkomplikationen verschiedener Tuben, Kabel und venöser Zugänge. Bei Schwerkranken und Intensivpflegepatienten sieht man häufig auf dem mit fahrbarem Gerät angefertigten Thoraxbild viele Tuben, venöse Zugänge und Kabel. Man muss unterscheiden, welche Teile der Tuben und Kabel im Patienten und welche auf dem Patienten lagen. Bei den Zugängen und Tuben, die im Körperinneren liegen, muss geprüft werden, ob diese am richtigen Ort und in richtiger Höhe liegen.
Endotrachealtubus
Ein Endotrachealtubus (ET) ist leicht identifizierbar, da er im Luftschatten der Luftröhre liegt. Beim Erwachsenen wie beim Kind sollte die Spitze des ET mindestens einen Zentimeter oberhalb der Carina, besser aber höher liegen. Ein tiefer platzierter ET kann die Luftzufuhr zu einer Lunge verlegen und eine Atelektase (Kollaps) einer Lunge oder eines Lungenanteils verursachen. Ein zu tief liegender ET gerät meist in den rechten Hauptbronchus, da dieser steiler nach unten abgeht als der linke Hauptbronchus (Abb. 3-23 ). Höchste tolerable Lage der ET-Spitze ist das Jugulum, welches mittig zwischen den medialen Schlüsselbeinenden liegt.
Abb. 3-23.

Atelektase der linken Lunge. Der Endotrachealtubus liegt mit seiner Spitze im rechten Hauptbronchus zu tief platziert. Der linke Hauptbronchus ist dadurch vollständig verlegt, so dass die Luft in der linken Lunge resorbiert wurde; man erkennt den Volumenverlust der linken Lunge sowie das nach links verzogene Mediastinum.
Magensonde
Eine Magensonde (MS) sollte in einer a.-p. oder p.-a. Aufnahme dem Verlauf der Speiseröhre folgen. In der seitlichen Aufnahme sollte sie dorsal der Luftröhre liegen und an der Rückfläche des Herzens verlaufen (Abb. 3-24 ). Die korrekte Spitzenlage einer Magensonde muss sichergestellt werden, bevor man Flüssigkeiten über die Sonde zuführt. Oft lässt sich die Position ohne Röntgenbild klinisch bestimmen. Dazu wird häufig über den Magenschlauch Luft eingegeben und über dem Magen mit dem Stethoskop auskultiert.
Abb. 3-24.

Normaler Verlauf einer nasalen Magensonde. A. In dieser p.-a. Aufnahme des Thorax verläuft die Magensonde direkt hinter der Luftröhre; unterhalb der Carinahöhe zieht sie leicht bogig nach links zum gastroösophagealen Übergang. B. In der Seitenaufnahme kann man die Magensonde dorsal der Luftröhre (T) und dann hinter dem Herzen entlang ziehen sehen.
Magensonden haben zwei bevorzugte Fehllagen. Häufigste Fehllage ist, dass die Magensonde nur einen Teil der Speiseröhre herabzieht oder sich in ihr aufrollt. Über die Magensonde applizierte Flüssigkeit kann dann zurückfließen und in die Lungen aspiriert werden. Seltener kann die Magensonde beim Platzieren anstelle des Ösophagus in die Luftröhre geraten. In diesem Fall verläuft sie dann eher den rechten Stammbronchus entlang nach unten (wie ein zu weit vorgeschobener Trachealtubus). Da Magensonden steif sein können und ein starres Ende haben, können sie, weit vorgeschoben, die Lunge perforieren und in den Pleuraraum gelangen (Abb. 3-25 ). Viele Patienten bedürfen der Ernährung über eine Ernährungs-/Duodenalsonde, was dann am besten funktioniert, wenn die Spitze im distalen Duodenum nahe dem Treitz-Band liegt.
Abb. 3-25.

Endobronchial liegende nasale Magensonde (MS). A. Wenn die Magensonde in die Luftröhre gerät, gelangt sie meist in den rechten Hauptbronchus. B. Magensonden sind relativ starr und können beim Vorschieben die Lunge perforieren und in den Pleuraraum eindringen.
Jugularis- oder Subklavia-ZVK
Dies ist ein sehr häufig verwendeter venöser Zugang. Die Katheterspitze sollte am besten in der oberen Hohlvene (VCS) liegen. Im p.-a. oder im a.-p. Bild des Thorax sollte sie ca. 1–4 cm unterhalb der Höhe der rechten Klavikulamitte liegen (Abb. 3-26 , besser in Höhe der Carina; Anm. des Übers.). Häufigste Fehllagen des Katheterendes sind das Umschlagen eines Subklavia-ZVK nach oben in die Jugularvene anstatt nach unten in die VCS (Abb. 3-27A ) und das Überschreiten der Mittellinie zur Gegenseite bis in die V. subclavia (Abb. 3-27B).
Abb. 3-26.

Normaler Verlauf eines Subklaviakatheters. Der Subklaviakatheter (Sc) sollte nach medial und dann nach kaudal zum Schlüsselbein ziehen, wobei die Spitze in der oberen Hohlvene liegen soll. Zusätzlich zum Katheter finden sich bei diesem Patienten eine nasale Magensonde (NG) und ein Endotrachealtubus (ET). Die restlichen aufgerollten Drähte sind EKG-Kabel.
Abb. 3-27.

Häufige abnorme Verläufe eines Subklaviakatheters. A. Nach oben in die Jugularvene umschlagende Katheterspitze. B. Über die V. brachiocephalica in die V. subclavia der Gegenseite umschlagende Katheterspitze. Zusätzlich zum Katheter sieht man bei diesem Patienten eine Magensonde (NG), eine Pleuradrainage (CT) und EKG-Kabel (EKG). Man beachte die außerhalb der Rippen gelegene Unterbrechung der strahlendichten Linie der Pleuradrainage. Diese Unterbrechung stellt eine Seitenöffnung dar, die anzeigt, dass die Pleuradrainage nicht tief genug vorgeschoben wurde.
Swan-Ganz- oder pulmonalarterieller Katheter
Solche zentralen Zugänge werden meist dazu verwendet, den kardialen oder pulmonalarteriellen Druck zu kontrollieren. Normalerweise projiziert sich der Verlauf des Katheters nahezu kreisförmig: die VCS hinunter durch rechten Vorhof und Ventrikel, dann in den Truncus pulmonalis und in die peripheren Lungenschlagadern. Der häufigste natürliche Weg, dem der Katheter folgt, führt eher in die rechte als in die linke Lungenhauptschlagader (Abb. 3-28 ). Einige Venenkatheter werden auch in der Leistenregion eingelegt. In diesem Fall beschreibt der Katheter eine sanfte S-Kurve durch die untere Hohlvene (VCI) in rechten Vorhof und Ventrikel und schließlich in die Pulmonalarterie (Abb. 3-29 ). Ein zu weit in die Pulmonalarterien vorgebrachter Zentralvenenkatheter kann den Blutstrom verlegen und zu einem Lungeninfarkt führen (Abb. 3-30 ). Die Spitze eines pulmonalarteriellen Katheters zur Messung des zentralvenösen Drucks (Verschlussdruck) sollte die Mitte zwischen Hilus und Lungenperipherie nicht überschreiten, da sonst ein Lungeninfarkt entstehen kann. Ein weiteres Problem kann die Passage des Katheters von der oberen in die untere Hohlvene anstatt in den rechten Ventrikel sein (Abb. 3-31 ).
Abb. 3-28.

Normaler Verlauf eines Swan-Ganz-Katheters. Der von rechts eingeführte Swan-Ganz-Katheter zieht über die V. subclavia (Sc), die V. cava superior (SVC), den rechten Vorhof (RA), den rechten Ventrikel (RV) und die rechte Pulmonalhauptarterie (MPA) in diesem Fall in die rechte Unterlappenarterie (RLL PA).
Abb. 3-29.

Transfemoral eingebrachter Swan-Ganz-Katheter. Der Katheter zieht durch die untere Hohlvene (IVC), beschreibt eine sanfte S-förmige Krümmung durch rechtes Atrium (RA) und rechten Ventrikel (RV) und zieht in diesem Fall in die linke Lungenhauptarterie (PA). Außerdem kann man eine nasale Magensonde, einen Subklaviavenenkatheter links und zahlreiche EKG-Kabel erkennen.
Abb. 3-30.

Lungeninfarkt durch Swan-Ganz-Katheter. A. Ein Swan-Ganz-Katheter wurde zu weit in die rechte Unterlappenarterie vorgebracht. B. Mehrere Stunden später zeigt sich in dieser Region ein Infiltrat infolge eines Lungeninfarkts, weil der Katheter den Blutstrom blockiert hatte.
Abb. 3-31.

Abnormer Verlauf eines Swan-Ganz-Katheters. Dieser Katheter wurde über die rechte V. subclavia eingesetzt. A. Im p.-a. Thoraxbild sieht man den Verlauf längs des rechten Wirbelsäulenrands bis unterhalb der Zwerchfellkontur (Pfeile). B. In der Seitenaufnahme erkennt man, wie der Katheter durch das Herz nach unten bis in die V. cava inferior reicht (Pfeile). Außerdem liegt ein linksseitiger Subklaviavenenkatheter mit der Spitze in der oberen Hohlvene.
Pleurasaugdrainagen
Im typischen Fall legt man eine Pleuradrainage (PD) ein, um damit einen Pneumothorax zu entlasten oder eine pleurale Flüssigkeitsansammlung zu drainieren. Pleuradrainagen haben ein relativ großes Kaliber und werden lateral in mittlerer und unterer Thoraxhöhe eingelegt. Eine häufige Frage zu diesen Drainagen betrifft die Lage von End- und Seitenöffnung. Die Spitze sollte nicht dem Mediastinum anliegen. Die Seitenöffnung, die innerhalb der Thoraxhöhle (und nicht etwa in den Weichteilen der Thoraxwand außerhalb) liegen sollte, kann man als Unterbrechung der strahlendichten Markierung der PD sehen (vgl. Abb. 3-27B). Weitere Fragen beziehen sich darauf, ob die PD abgeknickt ist und ob sie ihren Zweck, einen Pneumothorax oder einen Pleuraerguss zu verringern, erfüllt. Mit einer dorsal platzierten PD wird es kaum oder erst nach langer Dauer gelingen, bei einem auf dem Rücken liegenden Patienten und damit einer ventralen Gasansammlung einen Pneumothorax zu beseitigen.
Herzschrittmacher
Herzschrittmacher bestehen aus Drahtsonden, die vom Schrittmachergehäuse aus via obere Hohlvene in den rechten Vorhof und zur Spitze des rechten Ventrikels ziehen (Abb. 3-32 ). Sie sind gut im Thoraxröntgenbild zu beurteilen. Bei einem Schrittmacherausfall achte man besonders auf einen Kabelbruch.
Abb. 3-32.

Herzschrittmacher. A. In der p.-a. Thoraxaufnahme liegt der Schrittmachergenerator unter der Haut und projiziert sich auf das linke Lungenoberfeld. Das Kabel zieht in die V. brachiocephalica und herab zum rechten Atrium (RA). Die Spitze liegt im rechten Ventrikel (RV). B. Verlauf in der Seitenaufnahme.
Überlagerung durch EKG-Kabel und Schläuche
Elektrokardiographiekabel sind Metalldrähte und deshalb dichter als die meisten Tuben und Katheter. Man kann sie daran erkennen, dass sie in der Regel an ihrem Ende einen Druckknopf oder eine Klemme tragen, zumeist im oberen Thoraxbereich liegen und keinen wichtigen anatomischen Strukturen (wie z.B. großen Venen) folgen (vgl. Abb. 3-27B). Häufige den Betrachter irritierende, auf oder unter dem Thorax liegende Gegenstände sind Sauerstoffschläuche, die zu Masken oder Nasenkathetern führen. Sie können wie Katheter aussehen, folgen aber ebenfalls nicht den normalen Gefäßen oder sonstigen anatomischen Wegen in Thorax und Hals. Bleibt ein Fall unklar, muss das Problem auf jeden Fall am Patienten untersucht werden, bevor weitere Röntgenaufnahmen angeordnet werden.
Trauma
Oft wird bei Patienten mit schweren Verletzungen bereits in der Notaufnahme ein Thoraxröntgenbild angefordert. Dieses erlaubt es, sehr schnell einen mäßig großen bis großen Pneumothorax und Pleuraergüsse nachzuweisen. Da die Patienten zumeist auf dem Rücken liegen, kann ein kleiner ventraler Pneumothorax oder eine dorsale Flüssigkeitsansammlung leicht übersehen werden. Diese Diagnosen werden dann erst in der späteren CT-Untersuchung des Thorax als „Zufallsbefunde” bemerkt (vgl. Abb. 3-75 ). Bei einem schweren Thoraxtrauma können mögliche Verletzungen von Sternum und Brustwirbelsäule zusätzliche Röntgenaufnahmen erforderlich machen. Meist werden keine speziellen Rippenaufnahmen gebraucht, weil sich bei einer unkomplizierten Rippenfraktur die Behandlung nicht ändern würde. Ein in der Thoraxaufnahme verbreitertes Mediastinum wirft die Frage nach einer Gefäßverletzung auf, so dass eine CT mit Kontrastmittel indiziert ist. Röntgenaufnahmen lassen oft das Ausmaß von Weichteilverletzungen unterschätzen, weshalb Unfallchirurgen häufig eine CT von Thorax, Abdomen und Becken in Auftrag geben. Diese wird sehr viel häufiger durchgeführt, um lebensbedrohende Verletzungen, die eine sofortige operative Versorgung erfordern, zu identifizieren.
Abb. 3-75.

Kleiner ventraler Pneumothorax. Die Thoraxaufnahme dieses Patienten, der ein Trauma erlitten hatte, wurde als normal befundet. Die nachfolgende Computertomographie des Thorax zeigte aber einen kleinen rechtsseitigen ventralen Pneumothorax (Pfeile), den man als schmales sichelförmiges Band erkennt.
Nach einem Thoraxtrauma sind Lungeninfiltrate häufig. Lungenkontusionen können auch ohne Rippenfrakturen vorkommen und sind binnen Stunden nach einem Trauma sichtbar. Etwa 50% dieser Patienten haben Hämoptysen. Kontusionen erkennt man im Röntgenbild als unscharf begrenzte Infiltrate des Lungenparenchyms, die durch Einblutung und Ödem entstehen. Im unkomplizierten Fall lösen sie sich normalerweise während einer Zeitspanne von 4–5 Tagen auf. Lungenhämatome werden durch Einblutung infolge von Scherverletzungen des Lungenparenchyms verursacht. Sie können als Knoten oder Raumforderungen auftreten und evtl. einschmelzen. Es dauert Wochen, bis sie vollständig resorbiert werden. Ein Pneumomediastinum oder ein subkutanes Emphysem sollten ebenfalls erkannt werden. Letzteres bedeutet mit hoher Wahrscheinlichkeit das Vorhandensein von Rippenfraktur(en), eines Pneumothorax oder einer offenen Verletzung. Die verschiedenen mit einem Trauma verbundenen krankhaften Veränderungen werden später in diesem Kapitel anhand von Beispielen besprochen.
Eine posttraumatische Anomalie, die zu beidseitigen unscharfen Infiltraten führen kann, ist die Fettembolie. Sie kommt ausschließlich bei Frakturen eines großen Knochens (wie des Femurs) vor, die operativ versorgt worden sind. Die Patienten zeigen anfangs meist einen normalen Thoraxbefund und erleiden dann kurze Zeit später eine plötzlich einsetzende Dyspnoe. Die Diagnose stellt man, indem man Fettkügelchen im Urin sucht.
Erkrankungen der Atemwege
Die Themen Epiglottitis und retropharyngealer Abszess wurden in Kapitel 3 diskutiert.
VerlegteAtemwege
Das Bronchialkarzinom kann einen Bronchus einengen oder gänzlich verlegen. Wenn der Atemweg nur teilweise okkludiert ist, wird der Abtransport von Schleim behindert, und es kann zu einer poststenotischen Pneumonie kommen. Bei jedem älteren Patienten mit einer Herdpneumonie sollte man sorgfältig den nahe gelegenen Bronchus betrachten. Bei einem Erwachsenen mit einem Pneumonierezidiv am gleichen Ort sollte man einen Lungentumor in Betracht ziehen und die Indikation zur Bronchoskopie stellen.
Verlegen ein Tumor oder ein Schleimpfropf einen Atemweg vollständig, so geht die Resorption der Luft distal davon mit einem Volumenverlust einher. Ist ein größerer Bronchus verlegt, kann eine sehr schnell entstehende (weiße) Verschattung der Lunge auftreten, die als Folge des Volumenverlusts von einer Verziehung der Luftröhre und des Mediastinums in Richtung der betroffenen Seite begleitet wird. Die Verlegung eines größeren Bronchus kann man oft in der p.-a. Aufnahme nachweisen. Weitere Untersuchungen wie die CT können dabei helfen, Tumorausmaß und Vorliegen vergrößerter Lymphknoten zu bestimmen (Abb. 3-33 ). Wenn der Patient jung oder schwer krank ist, ist ein Schleimpfropf die wahrscheinlichere Ursache einer Bronchusverlegung und eines Volumenverlusts als ein Tumor. In diesem Fall wäre eher eine Bronchoskopie oder Behandlung der Lunge indiziert als eine CT des Thorax.
Abb. 3-33.

Tumorverschluss des rechten Hauptbronchus. Man erkennt eine abrupt abbrechende Luftsäule (Pfeil). Die Verlegung hat ein poststenotisches Infiltrat verursacht. Die Luft aus der rechten Lunge wurde resorbiert, es zeigt sich ein Volumenverlust der rechten Lunge und ein in der Folge nach rechts verzogenes Mediastinum.
Fremdkörper sind meist das Ergebnis einer Aspiration oder eines „Verschluckens” von Gegenständen, die im Mund waren. Bei einer Aspiration kann man je nach Dichte des jeweiligen Objekts dieses in der Thoraxaufnahme erkennen. Metallische Gegenstände erkennt man leicht (Abb. 3-34 ). Dinge wie Plastikspielzeug und Erdnüsse sind nicht so leicht von der Dichte der Weichteile zu unterscheiden. Typischer Aspirationsort für Fremdkörper sind wegen des im Vergleich zur linken Seite steileren Verlaufs der rechte Hauptbronchus oder der rechte Unterlappenbronchus. Wie schon erwähnt, sollte man, wenn man einen nichtmetallischen Fremdkörper vermutet, eine p.-a. Aufnahme des Thorax in Inspiration und Exspiration anfordern. Bei Kindern, die kooperationsunfähig sind, verwendet man manchmal Aufnahmen in Rechts- und Linksseitenlage. Die Seite, deren Volumen bei der Exspiration oder, wenn sie unten liegt, nicht abnimmt, ist die Seite mit der Okklusion.
Abb. 3-34.

Aspiration eines nicht obstruierenden Fremdkörpers. Man kann sowohl in der p.-a. (A) als auch in der seitlichen Thoraxröntgenaufnahme (B) einen geraden Nagel im rechten Unterlappen erkennen.
Chronische obstruktive Lungenkrankheit (COPD)
Das Thoraxröntgenbild kann erst eine mäßige oder fortgeschrittene chronische obstruktive Lungenkrankheit (COPD) nachweisen. In den Frühstadien ist die Aufnahme noch normal, so dass man, um die Diagnose zu stellen, auf Lungenfunktionstests zurückgreifen muss. In fortgeschrittenen Stadien sind die Zeichen der Überblähung deutlich. Im p.-a. Bild können die Zwerchfellkuppeln bis herab in Höhe der dorsalen Anteile der 12. Rippe zu liegen kommen, wobei oft die Randsinus abgestumpft sind. Bei der COPD sieht man einen vermehrten Sagittaldurchmesser des Thorax in der Seitenaufnahme, einen breiten und transparenten Raum zwischen Brustbein und Aorta ascendens sowie ein deutlich abgeflachtes oder invertiertes (nach unten konvexes) Zwerchfell (Abb. 3-35 ). Begleitbefunde können Bullae oder große Lufthöhlen infolge zerstörter Alveolen sein. Bei einer weit fortgeschrittenen COPD kann man auch die sog. Säbelscheidenluftröhre sehen. Damit meint man eine beidseits von den Lungen eingeengte Trachea, die im p.-a. Bild eng, aber im Seitenbild weit erscheint. Da die COPD meist bei Rauchern auftritt, muss auch nach einem okkulten Bronchialkarzinom gesucht werden.
Abb. 3-35.

Chronische obstruktive Lungenkrankheit (COPD). A. Die p.-a. Aufnahme zeigt die Zwerchfelloberfläche in gleicher Höhe wie den dorsalen Anteil der 12. Rippe. B. In der Seitenaufnahme erkennt man die Überblähung anhand des vergrößerten Sagittaldurchmessers und des abgeflachten Zwerchfells.
Asthma bronchiale
Bei einem unkomplizierten Asthmaanfall ist in der Regel keine bildgebende Diagnostik notwendig. Eine Thoraxaufnahme fordert man nur bei Verdacht auf eine überlagerte Krankheit oder bei Therapieresistenz des Asthmaanfalls an. Die Befunde des Asthmas reichen in der Thoraxaufnahme von einem normalen Aussehen (in ca. 3/4 aller Fälle) bis zu Zeichen leichter Überblähung (z.B. ein leicht erhöhter Sagittaldurchmesser oder ein Zwerchfell, dessen höchster Punkt in Höhe des dorsalen Anteils der 10. oder 11. Rippe liegt, Abb. 3-36 ). Beim Asthma kommt es nur selten vor, dass das Zwerchfell entweder tiefer als oben genannt steht oder deutlich abgeflacht ist (sichtbar in der Seitenaufnahme). Eine akute Asthmaattacke kann ein Pneumomediastinum, selten auch einen Pneumothorax verursachen. Bei Patienten mit wiederholten Asthmaanfällen können aufgrund von Narben eine vermehrte interstitielle Zeichnung und gering verdickte Bronchuswände vorliegen. Man suche ferner nach einem fokalen Infiltrat oder einer Pneumonie im Sinne eines Auslösers des Asthmaanfalls.
Abb. 3-36.

Asthma bronchiale. A. Bei einem schweren Asthmaanfall kann man eine Überblähung ähnlich wie bei der chronischen obstruktiven Lungenkrankheit (COPD) sehen. In diesem Fall erkennt man die Überblähung am Zwerchfelltiefstand in Höhe des dorsalen Anteils der 11. Rippe; der sagittale Thoraxdurchmesser ist leicht vergrößert, das Zwerchfell gering abgeflacht. B. Der Thorax des Patienten hat nicht die Fassform wie bei der COPD (vgl. Abb. 3-35 B). Die meisten Asthmapatienten bieten normale Röntgenbefunde des Thorax.
Bronchiektasen
Bronchiektasen sind diffus oder umschrieben aufgeweitete Bronchien. Meist sind sie Folge einer chronischen oder kindlichen Infektion mit anschließendem Knorpelschaden. Man sieht sie auch bei Patienten mit seltenen Krankheiten wie zystischer Fibrose und allergischer bronchopulmonaler Aspergillose. Symptome sind chronischer Husten, eitriges Sputum und evtl. Hämoptysen. Bronchiektasen betreffen im typischen Fall die medialen Anteile von rechtem und linkem Unterlappen. Man erkennt sie in einer Röntgenaufnahme des Thorax an der begleitenden Bronchuswandverdickung, die eine Infektionsfolge ist.
Bronchiektasen im Frühstadium können ein normales Röntgenbild aufweisen. In späteren Stadien verursacht die verbreiterte Bronchuswand das Bild eines streifigen oder honigwabenartigen Infiltrats (grobmaschiges Netz) in der Lungenbasis beidseits. Außerdem kann man ein „tram-tracking” (Aussehen wie Straßenbahnschienen) sehen. Dies beinhaltet zwei zueinander parallele, strichförmige Verdichtungen, die man als weiße Linien sieht und die verbreiterte Bronchuswände darstellen. Sie sind in der Regel nur über 2–3 cm Länge sichtbar (Abb. 3-37A + B ). Fortgeschrittene Bronchiektasen zeigen sich als Hohlräume oder Honigwabenbild in der Lungenbasis. Zwar sind Bronchiektasen im Thoraxröntgenbild schwer zu erkennen, aber in Dünnschicht-oder High-resolution-CT-Bildern (Abb. 3-37C) kann man sie deutlich abbilden. Man sollte jedoch keine CT in Auftrag geben, wenn keine Auswirkung auf Therapie oder Prognose zu erwarten ist.
Abb. 3-37.

Bronchiektasen. A. Das p.-a. Thoraxbild zeigt bei einem Patienten mit Bronchiektasen verbreiterte Bronchuswände, am deutlichsten an der Lungenbasis. Dies wird oft als „tram tracking” bezeichnet; die parallel verlaufenden Linien stellen verdickte Bronchialwände dar (Pfeile). B. Bei fortgeschrittenen Bronchiektasen können grobe basale Lungeninfiltrate wie Einschmelzungen aussehen. C. Viel besser als im Röntgenbild sieht man Bronchiektasen im CT-Bild. Man findet dilatierte Bronchien mit verbreiterten Wänden (Pfeil).
Atelektase
Als Atelektase bezeichnet man den Kollaps einer Lunge oder eines Lungenanteils infolge der Resorption der Luft in den Alveolen. Ursächlich können obstruierende bronchiale Läsionen, Kompression von außen (durch Pleuraerguss oder Bullae), Fibrose oder der Verlust der Oberflächenspannung in den Alveolen (wie bei der Hyaline-Membranen-Krankheit) sein. Die Atelektase kann einen kleinen subsegmentalen Lungenbezirk oder die gesamte Lunge erfassen. Da Atelektasen sehr häufige Befunde sind und klinische Auswirkungen haben, sollte man das unterschiedliche Erscheinungsbild sowie die fortschreitenden Befunde kennen, die mit einem fokalen oder generalisierten Volumenverlust in einer Lunge einhergehen.
Lineare oder Plattenatelektasen sieht man nahezu ausschließlich im Lungenmittel- oder Lungenunterfeld als horizontale oder nahezu horizontale Linie vermehrter Dichte (weiß im Röntgenbild). Zumeist findet man diese Minimalform eines subsegmentalen Kollapses bei Patienten mit erschwerter Atmung, wie z.B. kurz nach einer Operation oder bei Rippenfrakturen. Eine solche Atelektase kann sehr schnell auftreten (binnen Stunden) und ebenso schnell wieder verschwinden, nachdem der Patient aufgefordert wurde, tief zu atmen, oder beatmet wird (Abb. 3-38 ).
Abb. 3-38.

Plattenatelektase. A. Dieses direkt postoperativ angefertigte a.-p. Thoraxbild ist mit Ausnahme des Endotrachealtubus und auf dem Brustkorb liegender Schläuche und EKGKabel unauffällig. B. Wenige Stunden später nach der Extubation des Patienten zeigt sich eine geradlinige Atelektase (Pfeil). Sie kann sich sehr schnell auflösen, wenn der Patient eine geeignete Atemtherapie erhält.
Die Atelektase bzw. der Kollaps eines gesamten Lungensegments tritt typischerweise infolge eines Schleimpfropfs, eines Tumors oder eines fehlplatzierten Endotrachealtubus auf. Eine frühe Oberlappenatelektase der rechten Seite sieht man im a.-p. oder p.-a. Röntgenbild als eine verschwommene Verdichtung im rechten Lungenoberfeld. Bei der Resorption der Luft aus dem rechten Oberlappen kann man eine ansteigende Dichte bei abnehmendem Volumen des rechten Oberlappens sehen. Während dieses Vorgangs bewegt sich die kleine Fissur aus ihrer normalen horizontalen Position heraus und biegt nach oben aus. Sie ähnelt einem auf dem Kopf stehenden weißen Dreieck am rechten Lungenapex. Bei einem vollständig kollabierten rechten Oberlappen kann eine weißliche Verdichtung erscheinen, die am rechten Hilus beginnt und längs des rechten oberen Mediastinalrandes nach oben zieht, um sich dann in der Lungenspitze zu krümmen. In diesem späten Stadium (komplett kollabierter rechter Oberlappen) kann die Diagnose sehr schwer zu stellen sein. Meist weisen allerdings weitere Zeichen des Volumenverlusts auf den rechten Oberlappen hin; dazu zählen Verlagerung oder Verziehung der Luftröhre nach rechts und der Hochstand des rechten Hilus. (Man denke daran, dass der rechte Hilus normalerweise etwas tiefer steht als der linke.) Stehen beide Hili etwa in gleicher Höhe, muss ein Volumenverlust des rechten Oberlappens als mögliche Ursache eines solchen Befunds erwogen werden.
Eine Atelektase des (rechtsseitigen) Mittellappens ist im a.-p. Bild oft schwer zu erkennen, erscheint aber in der Seitenaufnahme als leicht erhöhte Dichte (weiß) im unteren Bereich der rechten Lunge und als Auslöschung der ansonsten scharfen Kontur des rechten Herzrands. Im seitlichen Röntgenbild projiziert sich ein schmales weißes Dreieck auf das Herz. Dieses entsteht durch Annäherung der kleinen Fissur und der unteren Hälfte der großen Lappenspalte.
Bei einer Unterlappenatelektase rechts nimmt die Dichte der rechten Lungenbasis zu, die Kontur des rechten Hemidiaphragmas geht verloren und der rechte Hilus ist nach unten verzogen. Im seitlichen Thoraxbild erscheint die große Fissur nach dorsal und unten verzogen, ferner ist die Dichte über der unteren Brustwirbelsäule erhöht (weiß, Abb. 3-39 ).
Abb. 3-39.
Atelektase des rechten Unterlappens. Kompletter Kollaps des rechten Unterlappens mit Volumenverlust, erkennbar an der Verziehung von Luftröhre und rechtem Herzrand nach rechts (schwarze Pfeile). Die Luft im rechten Unterlappen wurde resorbiert, Folge ist ein diffuses Infiltrat (weiße Pfeile).
Eine Lappenatelektase oder ein Kollaps der Lappen der linken Lungen kann schwer erkennbar sein. In der a.-p. oder p.-a. Aufnahme des Thorax erscheint ein Unterlappenkollaps als vermehrte Dichte von linker Lungenbasis und Retrokardialraum. Eine retrokardiale Verdichtung ist mit höherer Wahrscheinlichkeit eine Atelektase als eine Pneumonie, insbesondere direkt nach einer Thoraxoperation. Bei einer Atelektase des linken Unterlappens kann der linke Hilus herabgezogen sein und mit dem rechten auf gleicher Höhe stehen. Ferner wird das linke Hemidiaphragma schwer erkennbar sein. In der Seitenaufnahme bemerkt man eine leicht nach dorsal und unten verzogene Lappenspalte. Wie beim Kollaps des rechten Unterlappens sieht man eine vermehrte Dichte über der unteren Brustwirbelsäule.
Ein Pleuraerguss kann sowohl eine rechtsals auch eine linksseitige Unterlappenatelektase vortäuschen. Zur Unterscheidung muss ein Pleuraerguss ausgeschlossen werden. Dazu kann man in einer Aufnahme im Stehen im sagittalen Strahlengang den Herz-Zwerchfell-Winkel betrachten, um zu prüfen, ob dieser abgeflacht ist oder Pleuraflüssigkeit längs der lateralen Thoraxwand nach oben zieht. Sieht man einen Volumenverlust (angezeigt durch einen nach unten verlagerten Hilus oder eine Mediastinalverziehung zur betroffenen Seite), sollte man einen Kollaps annehmen. Bei einem großen Pleuraerguss kommt es infolge der direkten Kompression oft zu einer begleitenden Atelektase der benachbarten Lunge. Man darf also nicht davon ausgehen, dass nur eine der beiden Entitäten vorliegen kann.
Eine linksseitige Oberlappenatelektase sieht man in der Aufnahme im sagittalen Strahlengang als allgemein erhöhte Dichte der linken oberen Lungenhälfte. In den Frühstadien tritt eine Verdichtung in der Seitenaufnahme ventral des Interlobärspalts auf. Mit dem Fortschreiten der Oberlappenatelektase links zur vollständigen Atelektase legt sich der kollabierte Oberlappen wie ein Pfannkuchen an die vordere Thoraxwand und kann nur noch als dichte weiße Linie oder als 1–2 cm breiter Streifen im Retrosternalraum sichtbar sein (Abb. 3-40 ).
Abb. 3-40.

Oberlappenatelektase links. A. Oft sieht man eine Atelektase des rechten oder linken Oberlappens als eine diffuse Dichtezunahme mit nach oben gebogener kleiner (rechts) oder großer Fissur (links). Ferner hebt der Volumenverlust den Hilus der betroffenen Seite an. B. Das CT-Bild zeigt ebenfalls die Atelektase mit diffus erhöhter Dichte des betroffenen Lungensegments oder -lappens (Pfeil).
Die schwerste Form eines Volumenverlusts ist die chirurgische Entfernung einer Lunge. Nach einer Pneumonektomie füllt sich über mehrere Wochen hinweg die leere Thoraxhöhle mit Flüssigkeit. Die zugehörige Zwerchfellhälfte steigt an, das Mediastinum wandert zur betroffenen Seite, die verbliebene Lunge wird überbläht und überschreitet oft die Mittellinie (Herniation). Sind die Mediastinalstrukturen von der Seite der Lungenresektion abgedrängt, muss an einen postoperativen malignen Erguss oder an ein Empyem gedacht werden.
Blasen (blebs) und Bullae
Blasen und Bullae sind Lungenanteile, in denen man Lufteinschlüsse ohne Alveolen vorfindet. Auch wenn es keine eindeutigen Unterscheidungsmerkmale zwischen diesen beiden Entitäten gibt, wird eine Blase meist als relativ kleine lufthaltige Höhle in der Größenordnung von bis zu 1 cm im Durchmesser beschrieben. Eine Bulla ist größer, evtl. sogar bis zu 10 cm im Durchmesser. Sowohl Blasen als auch Bullae haben sehr dünne und klar definierte Wände (wenn diese überhaupt sichtbar sind) (Abb. 3-41 ). Ist eine dicke Wand vorhanden, sollte man eher an entzündliche oder neoplastische einschmelzende Läsionen denken. Da die Wände von Blase und Bulla so dünn sind, ist die Sensitivität einer Röntgenthoraxaufnahme zum Nachweis dieser Läsionen recht gering. Hingegen sind sie in einem CT-Bild leicht zu erkennen. Manchmal kann man in einem Thoraxröntgenbild auf eine Bulla schließen, wenn man eine Lungenregion bemerkt, die offensichtlich keine Gefäße besitzt.
Abb. 3-41.

Bullae. A. Manchmal erkennt man im Thoraxbild kleine Bullae, weil deren dünne Wände sichtbar sind. B. Große Bullae erkennt man manchmal nur an einem gefäßfreien Areal im Thoraxröntgenbild (Pfeile) und an in der Peripherie der Bulla zusammengedrängten Gefäßen der normalen Lunge.
Pathologisch veränderte Gasaustauschräume
Infiltrate und Pneumonien
Um eine angemessene Diagnose bei einer fleckig oder diffus vermehrten Dichte der Lungen zu stellen, muss man das röntgenologische Erscheinungsbild charakterisieren und mit Klinik und Anamnese in Zusammenhang bringen. Die meisten Radiologen beschreiben ein Infiltrat als alveolär, interstitiell, knotig oder gemischt und geben an, ob es fokal (z.B. im rechten Oberlappen) oder diffus vorhanden ist. Die Begriffe alveolär oder interstitiell sind für den Neuling und auch den erfahrenen Radiologen oft schwierig zu unterscheiden und festzuleglen.
Alveolär bedeutet, dass die Alveolenräume mit Material, also mit Eiter, Blut, Flüssigkeit oder Zellen, gefüllt sind. Es ist röntgenologisch nicht möglich zu sagen, ob ein alveoläres Infiltrat auf einer Pneumonie (Eiter), einer Lungeneinblutung (Blut), einem Lungenödem (Flüssigkeit) oder intraalveolären Tumorzellen beruht (Abb. 3-42 ). Die meisten aveolären Infiltrate sind unscharf begrenzt oder stellen Bereiche vollständiger Konsolidierung dar. Mit zunehmender Ausfüllung der Alveolen bleiben nur noch die Bronchien mit Luft gefüllt, so dass man ein „Luftbronchogramm” sehen kann (Abb. 3-43A ). Wenn man einen mit Luft gefüllten Bronchus sehen kann, der von erhöhter Dichte umgeben ist, handelt es sich mit Sicherheit ueinen alveolären Prozess.
Abb. 3-42.

Lungenblutung. Das flaue alveoläre Muster wird durch Flüssigkeit erzeugt, die die Bronchien ausfüllt.
Abb. 3-43.
Alveoläre und interstitielle pulmonale Infiltrate. A. Alveoläre Infiltrate erkennt man anfangs als fleckige Verschattungen, die im Verlauf konfluieren und zunehmend die Gasaustauschräume ausfüllen, so dass nur noch in den Bronchien Luft verbleibt. Dies führt zum so genannten (positiven) Bronchogramm oder Luftbronchogramm (Pfeile). B. Ein interstitielles Infiltrat erkennt man im Röntgenbild anhand zahlreicher sehr weißer, dünner Linien. Normalerweise sind in der äußersten Lungenperipherie keine Lungengefäße zu sehen, weshalb die hier durch weiße Pfeile angezeigten Linien einen interstitiellen Prozess darstellen.
Interstitielle Infiltrate werden durch Krankheitsprozesse verursacht, die das Gewebe außerhalb der Alveolen betreffen. Interstitielle Prozesse sind meist diffus und als schmale weiße Linien sichtbar (Abb. 3-43B). Mitunter können sie honigwabenartig aussehen. Die Differenzialdiagnose hängt oft davon ab, ob das interstitielle Infiltrat akut oder chronisch ist. Der Befund einer interstitiellen Infiltration ist unspezifisch. Man kann vermehrte Flüssigkeit in Interstitium und interlobulären Septen bei der chronischen Linksherzinsuffizienz sehen, aber auch bei der gemeinhin als Lymphangiosis carcinomatosa bezeichneten Tumorstreuung oder bei der idiopathischen Lungenfibrose, bei Kollagenosen und anderen Entitäten. Auch eine Kombination sowohl interstitieller als auch alveolärer Zeichen in einem Röntgenbild ist nicht ungewöhnlich. Viele Prozesse, wie die Linksherzinsuffizienz, können beides verursachen (d.h. interstitielles Ödem und Lungenödem mit Ausfüllung der Alveolen).
Ambulant erworbene Pneumonie beim Erwachsenen
Die Diagnose einer Pneumonie sollte klinisch anhand der Kriterien Fieber, Husten, Dyspnö, pleuritischer Thoraxschmerz, Rasseln, umschrieben abgeschwächtes Atemgeräusch, Abschwächung bei der Perkussion oder der Egophonie bei der Auskultation gestellt werden. Die Thoraxaufnahme liefert die Bestätigung und hilft, eine Pneumonie von anderen Zuständen, die ähnliche Symptome haben können, zu unterscheiden (z.B. bronchiale Obstruktion). Sie kann ferner Befunde aufzeigen, die einen komplizierten Verlauf oder eine prolongierte Erholung nahe legen, wie z.B. Verteilung in vielen Lappen und Pleuraergüsse.
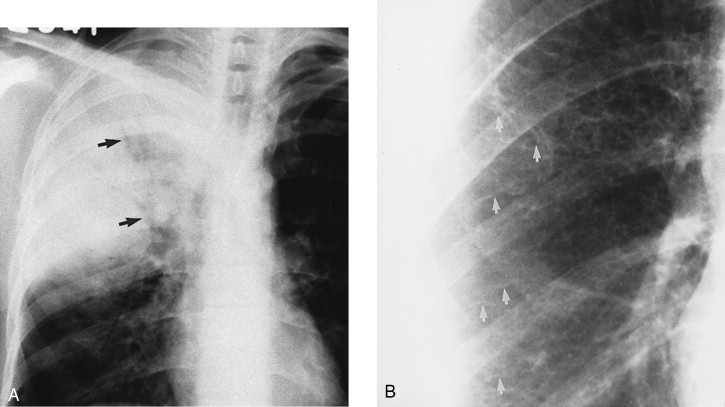
Die meisten bakteriellen Pneumonien verursachen lobäre, segmentale oder fleckige Infiltrate, bei denen es sich zwar um alveoläre Infiltrate handelt, aber die Füllung der Alveolen meist nicht so stark ist, dass man ein ausgeprägtes Bronchogramm sehen kann. Die genaue Lokalisation einer Pneumonie auf ein Lungensegment erfordert sowohl eine p.-a. als auch eine seitliche Röntgenthoraxaufnahme. Ist die Konsolidierung ziemlich dicht, kann man ein Infiltrat recht einfach orten. Meist sieht man ein Infiltrat des rechten oder linken Oberlappens in der a.-p. oder p.-a. Aufnahme als erhöhte Dichte in den oberen Lungenanteilen; die seitliche Aufnahme ist dann zur Diagnose meist nicht erforderlich (Abb. 3-44 ).
Abb. 3-44.

Oberlappenpneumonie rechts. A. In der p.-a. Röntgenaufnahme des Thorax ist der rechte Herzrand gut sichtbar. Man sieht im Lungenmittelfeld ein Infiltrat. B. In der Seitenaufnahme ist die Lokalisation recht einfach, wenn man die mutmaßliche Lage von großer und kleiner Fissur beachtet. Man kann hier das Infiltrat (Pfeil) oberhalb der Fissura minor erkennen, also liegt es im Oberlappen.
Eine Infiltration oder Pneumonie des (rechten) Mittellappens kann sich im medialen oder lateralen Segment oder in beiden befinden.
Ein Infiltrat im medialen Mittellappensegment löscht in der Aufnahme im sagittalen Strahlengang den rechten Herzrand aus und erscheint im seitlichen Bild als dreieckige Verdichtung, die vom Hilus in den vorderen und unteren Thoraxbereich zieht (Abb. 3-45 ).
Abb. 3-45.

Mittellappenpneumonie rechts. A. In der p.-a. Aufnahme verdeckt das alveoläre Infiltrat den rechten Herzrand. Dieses Silhouettenzeichen bedeutet, dass der pathologische Prozess dem rechten Herzrand direkt anliegt, weshalb er im Mittellappen liegen muss. B. Die Seitenaufnahme bestätigt dies. Man kann erkennen, dass die Konsolidierung ventral der großen Fissur und unterhalb der kleinen Fissur liegt.
Infiltrate des rechten oder linken Unterlappens kann man anhand von drei Zeichen erkennen. Sie können in der sagittalen Aufnahme die rechte oder linke Zwerchfellkontur auslöschen. In einer a.-p. oder p.-a. Aufnahme sind die Zwerchfellkonturen normalerweise vom lateralen Randsinus nahezu über die gesamte Länge bis zur Wirbelsäule zu sehen (selbst hinter dem Herzen, Abb. 3-46A ). In der Seitenaufnahme kann man Unterlappeninfiltrate anhand ihrer Lage dorsal der großen Fissuren erkennen (Abb. 3-46B). Alternativ kann man diese aber auch durch das „Wirbelsäulenzeichen” identifizieren. Normalerweise werden die Brustwirbelkörper von oben nach unten dunkler. Sind die Wirbelkörper etwa in Höhe der mittleren Brustwirbelsäule dunkler und werden sie weiter unten weißer bzw. heller, sollte man an ein Unterlappenin filtrat denken (Abb. 3-46C). Die Entscheidung, ob es rechts oder links gelegen ist, erfordert den Vergleich mit der p.-a. Röntgenaufnahme.
Abb. 3-46.

Unterlappenpneumonie rechts. A. In der p.-a. Thoraxaufnahme erkennt man das Infiltrat in der rechten Lungenbasis. Die Tatsache, dass der rechte Herzrand klar erkennbar ist, legt nahe, dass sich das Infiltrat nicht im Mittellappen, sondern wahrscheinlich im Unterlappen befindet. B. Die Seitenaufnahme zeigt, dass das Infiltrat dorsal der Fissura major und im anterobasalen Unterlappensegment liegt. C. Die Seitenaufnahme eines anderen Patienten zeigt ebenfalls ein Infiltrat des rechten Unterlappens. In diesem Fall gibt das „Wirbelsäulenzeichen” Hinweise auf ein frühes Infiltrat. Die Wirbelkörper der BWS sollten von oben nach unten immer dunkler werden; hier aber werden die mit schwarzen Pfeilen gekennzeichneten Wirbelkörper heller und zeigen so die Überlagerung durch ein Infiltrat an.
Pneumonien müssen nicht immer segmental oder lobär, sie können auch rund oder diffus sein. Runde Pneumonien können raumfordernde Läsionen, wie ein Neoplasma, vortäuschen, allerdings mit gänzlich anderem klinischen Bild. Runde Pneumonien kommen bei Kindern häufiger als bei Erwachsenen vor. In der Regel werden sie durch Streptokokken verursacht.
Man kann einige Charakteristika von Pneumonien heranziehen, um den ursächlichen Keim herauszufinden, doch ist keines davon spezifisch. Lobärpneumonien werden durch Streptokokken, Staphylokokken und gramnegative Erreger verursacht. Ein vergrößerter Lappen mit einem Infiltrat ist für Klebsiellen charakteristisch. Einschmelzungen bei einer akuten Pneumonie findet man bei Staphylokokken und virulenten Streptokokken. Chronische Kavernisierung kommt bei Tuberkulose (Tbc), Histoplasmose und Pilzpneumonien vor.
Interstitielle und symmetrisch diffus über beide Lungen verteilte Pneumonien sind oft atypische Pneumonien; dazu zählen Pneumonien durch Mykoplasmen, Viren oder Pneumozystis carinii. Virus- und Pneumozystis-carinii-Pneumonien (PCP) sind bei immungesunden Erwachsenen selten. Wahrscheinlichste Ursache einer interstitiellen Pneumonie ist bei einem Erwachsenen mit intakter Immunlage die Mykoplasmeninfektion. Das severe acute respiratory syndrome (SARS) ist eine atypische Pneumonie. Die Bildbefunde des SARS sind unspezifisch und beinhalten fokale und fleckige interstitielle Verschattungen und ein- oder beidseitige Konsolidierungsbereiche.
Bei Pneumonien ist eine CT nicht indiziert, es sei denn, das Röntgenbild zeigt nach zweiwöchiger Therapie keine Besserung oder man findet nach zwei verschiedenen Antibiotikaregimes bei grampositiven Keimen in Sputum und Blutkultur keine Besserung. Indiziert ist die CT auch bei einem Patienten mit einem Pneumonierezidiv binnen 6 Monaten in gleicher Lokalisation.
Pneumonie bei immunschwachen Patienten
Bei immunschwachen Patienten mit Fieber ist eine Röntgenuntersuchung des Thorax indiziert. Bei positivem Befund wird der Patient behandelt und klinisch kontrolliert. Ist die Thoraxaufnahme bei einem symptomatischen oder hypoxämischen Patienten negativ, kann eine CT indiziert sein, wobei auch die Bronchoskopie ausreichende Informationen zu Diagnose und Management liefert. Bei Patienten mit AIDS (acquired immunodeficiency syndrome) ist es am besten, die Verteilung der krankhaft veränderten Gasaustauschräume als diffus, umschrieben oder multipel zu beschreiben.
Lappen- oder Segmentinfiltrate sind bei einem immunschwachen Patienten mit größter Wahrscheinlich durch Bakterien oder Pilze verursacht. Das Thoraxröntgenbild kann bei einem solchen Patienten Infiltrate aufdecken (Abb. 3-47A ), wobei aber ein Patient mit einer Pneumozystis-carinii-Pneumonie (PCP) ein relativ normales Röntgenbild aufweisen kann. Unter solchen Umständen kann eine Galliumszintigraphie gesteigerte Aktivität nachweisen (Abb. 3-47B). Eine diffuse Krankheit der Gasaustauschräume beruht bei immunschwachen Patienten auf einer Pneumozystis-carinii-Pneumonie mit oder ohne Zytomegalievirusinfektion. Die frühe Pneumozystis-carinii-Infektion kann man als interstitielles Infiltrat sehen, eine weiter fortgeschrittene Krankheit kann auch diffuse alveoläre Verschattungen mit einem Luftbronchogramm zeigen; diese gehen innerhalb weniger Tage in eine Konsolidierung über.
Abb. 3-47.

Komplikation des acquired immunodeficiency syndrome (AIDS). A. Die p.-a. Aufnahme eines HIV-positiven Patienten zeigt beiderseits ein perihiläres diffuses Infiltrat, verursacht durch Pneumocystis carinii. Bei vielen Patienten mit AIDS kann die Thoraxaufnahme trotz Pneumozystiscarinii-Infektion unauffällig sein. B. Die Galliumszintigraphie kann dann oft eine vermehrte Anreicherung in den Lungen zeigen. C. Die Thoraxaufnahme eines weiteren Patienten mit AIDS zeigt beidseitige, dichte, fleckige, alveoläre Infiltrate, die hier einem Kaposi-Sarkom entsprechen.
Mitunter entwickeln sich mit Gas gefüllte Zysten zu einem Pneumothorax oder einer bronchopleuralen Fistel weiter. Letzterer Befund kann eine Tuberkulose imitieren, wobei bei der PCP eine Lymphknotenschwellung und ein Pleuraerguss selten sind. Bei AIDS-Patienten sind Pilzinfektionen eher ungewöhnlich.
Bei AIDS-Patienten kann man einen diffusen oder knotigen Lungenbefall bei einem malignen Lymphom oder einem Kaposi-Sarkom sehen (Abb. 3-47C). Im Gegensatz zu den meisten anderen Infektionen und auch beim malignen Lymphom ist bei Patienten mit einem Kaposi-Sarkom die Galliumszintigraphie nicht positiv. Bei AIDS-Patienten beruht eine isolierte Hiluslymphknotenschwellung eher auf einem malignen Lymphom als auf Infektionen durch Mykobakterien.
Aspirationspneumonie
Eine häufige Indikation zur Röntgenthoraxaufnahme ist der Ausschluss einer Aspirationspneumonie. Die Frage nach aspiriertem Mageninhalt kann sich als Folge eines Krampfanfalls, einer Reanimation oder eines Alkoholexzesses stellen. Bei einer Aspiration ist die Röntgenaufnahme innerhalb der ersten Stunde oft normal. Erhält man beim Verdacht auf eine frische Aspiration als Resultat einen normalen Thoraxbefund, sollte man nach circa 12 Stunden eine Kontrollaufnahme anfordern. Oft dauert es mehrere Stunden, bis der Mageninhalt mit der Lunge reagiert und ein Flüssigkeitsexsudat und ein alveoläres Infiltrat verursacht (Abb. 3-48 ). Eine Anzahl weiterer toxischer Stoffe wie Wasser (Ertrinken), Kohlenwasserstoff, Rauch, Heroin und Aspirin und auch die Strahlentherapie können alveoläre Infiltrate bewirken. Einige Medikamente, z.B. Busulfan, Bleomycin und Cyclophosphamid, verursachen eine toxische interstitielle Krankheit. Amiodaron kann Ursache einer großen Vielfalt von Lungenveränderungen sein, wobei der charakteristischste und in CT-Bildern sichtbare Befund eine wegen des Jodgehalts dieses Medikaments vermehrte Lungendichte ist.
Abb. 3-48.

Aspirationspneumonie. A. Die sofort nach Aspiration angefertigte Thoraxaufnahme kann häufig normal sein. B. Eine chemische Pneumonie verursacht nach 6–12 Stunden ein alveoläres Infiltrat (Pfeil).
Tuberkulose (Tbc)
Als Screeningmaßnahme zur Feststellung einer Tbc sind routinemäßige Röntgenthoraxaufnahmen nicht indiziert. Bei Personen, die einen positiven Hauttest (auf gereinigte Proteinderivate, PPD) hatten, werden häufig Thoraxröntgenaufnahmen durchgeführt. Diese sind in über 99% der Fälle normal. Es gibt Leitlinien für den Einsatz von Röntgenstrahlen zum Tuberkulosenachweis bei beschwerde- und symptomfreien Patienten. Bei älteren Patienten, die in Altersheime aufgenommen werden (und die evtl. nicht auf einen Kutantest reagieren), sollte man das Ergebnis einer kurz zurückliegenden Thoraxuntersuchung prüfen. Ferner ist die Röntgenaufnahme bei einer Person, die erstmals einen positiven Tuberkulintest oder eine Serumkonversion bietet, indiziert, damit man bestimmen kann, ob eine Prophylaxe oder eine Mehrfachkombination begonnen werden muss. Es sei betont, dass eine normale Röntgenthoraxaufnahme eine aktive Tbc nicht ausschließt. Die Tbc, die einen positiven Hauttest bedingt, muss sich nicht unbedingt in den Lungen manifestieren, sondern kann auch in den Nieren oder der Wirbelsäule lokalisiert sein.
Sieht man in einer Thoraxröntgenaufnahme Zeichen einer Tuberkulose, sind folgende Vorgänge üblich: Am häufigsten sieht man eine Primärtuberkulose als fokale Konsolidierung von Mittel- oder Unterlappen mit Lymphadenopathie und evtl. Pleuraerguss. Einschmelzungen kommen dabei nur selten vor. Bei ca. 85% der Fälle sieht man vergrößerte Hiluslymphknoten, bei Kindern häufiger als bei Erwachsenen. In etwa 10% der Fälle ist ein Pleuraerguss vorhanden. Die Reaktivierung eines Primärherds verursacht Infiltrate im posterioren Segment der Ober- und im apikalen Segment der Unterlappen. Folgen davon sind Miliartuberkulose, Einschmelzung (40%) (Abb. 3-49 ) und Empyem. Im Vergleich zur Primärinfektion ist dabei die Lymphadenopathie selten. Eine ausgeheilte Tbc kann anfangs als fibröse Veränderung der Lungenspitzen oder als Verkalkungen entweder im Lungenparenchym oder in der Region der Hilusbzw. der Mediastinallymphknoten erscheinen. Meistens beruhen allerdings (in den USA) solche fokalen Verkalkungen eher auf einer alten Histoplasmose als auf einer Tbc.
Abb. 3-49.

Tuberkulose. A. Das klassische Erscheinungsbild einer reaktivierten Tuberkulose ist ein Oberlappeninfiltrat mit Kavernen. Im Lauf der Zeit treten Heilung und Fibrosierung ein, die dann den Hilus der betroffenen Seite nach oben raffen. B. Bleibt die Frage offen, oft das Infiltrat Kavernen besitzt, so kann eine CT hilfreich sein.
Die Miliartuberkulose sieht man als diffusen beidseitigen Prozess mit sehr kleinen und über beide Lungen disseminierten Knötchen. Diese Knötchen haben etwa die Größe von Hirsekörnern. Patienten mit der Erstmanifestation einer Miliartuberkulose im Röntgenbild sind meist schwerstkrank. Zahlreiche sehr kleine Lungenknötchen kann man auch bei Histoplasmose, Varizellenpneumonie und Metastasen des Schilddrüsenkarzinoms sehen.
Pilzinfektionen
Die Lunge kann durch ein breites Spektrum von Pilzinfektionen befallen sein. Sie können in Form von herdförmigen Infiltraten odervon Einzelläsionen auftreten. Mitunterkann man eine Pilzkugel (oder Myzetom) innerhalb einer Lungenkaverne beobachten (Abb. 3-50 ). Kryptokokkeninfektionen können sich als kleine, einschmelzende Läsionen in der Lunge und als benachbarte kleine Satellitenknötchen äußern.
Abb. 3-50.

Pilzinfektion. Pilzinfektionen der Lunge kann man anfangs als alveoläre Infiltrate sehen (A), die nach mehreren Tagen einschmelzen können (B). In der Kaverne kann sich zentral eine bewegliche Raumforderung, ein Pilzball (Myzetom), darstellen.
Lungenabszess
Eingeatmete Partikel oder nekrotisierende Pneumonien können zu einem Lungenabszess führen. Typisches Erscheinungsbild ist eine Läsion von mehreren Zentimetern Durchmesser, die entweder solide aussieht (Abb. 3-51 ) oder ein transparentes (= dunkles), mit Flüssigkeit und Gas gefülltes Zentrum und eine unregelmäßige dicke Wand zeigt, die im typischen Fall mehr als 5 mm dick ist. Wichtigste Differenzialdiagnosen einer dickwandigen Höhlenläsion der Lunge sind der Lungenabszess und ein einschmelzendes Neoplasma (meist ein Plattenepithelkarzinom). Lungenabszesse können, ebenso wie einschmelzende Neoplasmen, im zentralen Bereich einen Luft-Flüssigkeits-Spiegel zeigen. Meist verwendet man die CT, um eine Nadelbiopsie solcher Läsionen zu steuern, um Material für Mikrobiologie und Pathologie zu gewinnen. Manchmal kann man einen Lungenabszess mit einem Empyem verwechseln, wobei Abszesse meist kugelförmig sind und die Lungengefäße in normaler Position verlaufen. Ein Luft-Flüssigkeits-Spiegel eines Abszesses hat in der p.-a. und der seitlichen Aufnahme jeweils gleiche Ausdehnung. Das Empyem ist meist ellipsoid und verdrängt umgebende Lunge und Blutgefäße oder komprimiert sie. Sieht man einen Luft-Flüssigkeits-Spiegel, hat dieser oft in p.-a. und Seitenaufnahme unterschiedliche Ausdehnung.
Abb. 3-51.

Lungenabszess. A. Im Thoraxröntgenbild kann ein Lungenabszess als solide runde Läsion erscheinen (A) oder durch einen Luft-Flüssigkeits-Spiegel in einer breitwandigen Höhle auffallen, wenn er mit einem Bronchus in Verbindung steht. B. Man kann die Computertomographie einsetzen, um damit die Läsion zu lokalisieren und eine Kanüle zum Zweck von Drainage und Aspiration für eine mikrobiologische Materialgewinnung einzubringen.
Adult Respiratory Distress Syndrome (ARDS)
Die Ätiologie des Adult Respiratory Distress Syndrome (ARDS) ist unsicher. Die Schädigung entsteht durch die Leckage von Flüssigkeit aus dem alveolären Kapillarbett. Typischerweise sind Patienten betroffen, die mehrere Tage auf einer Intensivstation lagen und intubiert waren. Das ARDS kann postoperativ bei Patienten vorkommen, die in der direkten postoperativen Phase eine normale Lungenfunktion zeigten, bei denen sich dann aber Tachypnoe, Angstgefühl und respiratorische Insuffizienz entwickeln. Es können auch nicht-pulmonale Infektionen das Lungenparenchym schädigen und ein ARDS hervorrufen.
Gewöhnliches Muster sind diffuse oder fleckige alveoläre Infiltrate in beiden Lungen (Abb. 3-52 ). Hauptschwierigkeit bei der Beurteilung dieser Patienten ist der Ausschluss einer gleichzeitigen bakteriellen Pneumonie oder einer Linksherzinsuffizienz (LHI). Am besten erstellt man die Differenzialdiagnose anhand klinischer Fakten. Bei sehr schneller Änderung eines alveolären Infiltrats (binnen Stunden oder eines Tages) ist dieses am wahrscheinlichsten auf eine LHI oder eine Flüssigkeitsüberlastung zurückzuführen. Bei Patienten mit Linksherzinsuffizienz sieht man meist Kerley-B-Linien, Pleuraergüsse, ein vergrößertes Herz und perihiläre oder basale Infiltrate. Beim ARDS sollten keine Kerley-B-Linien vorhanden sein, Pleuraergüsse treten erst spät auf, die Herzgröße ist oft normal und die alveolären Infiltrate reichen häufig bis in die Lungenperipherie.
Abb. 3-52.

Adult respiratory distress syndrome (ARDS). Die bei diesem Patienten nach einer koronaren Bypass-Operation sichtbaren Befunde eines ARDS sind diffuse, beidseitige alveoläre Infiltrate. Ähnliche Befunde können aber auch auf einer diffusen Pneumonie oder einem Lungenödem beruhen, so dass die Differenzialdiagnose von den klinischen Befunden abhängt.
Bakterielle Pneumonien brauchen meist einen Tag oder länger, bis sich ihr Erscheinungsbild ändert. Patienten mit ARDS zeigen dagegen oft tagelang ein relativ stabiles Erscheinungsbild. Die Diagnose einer Pneumonie stellt man auf der Grundlage von Bakterienkulturen. Man sollte aber ebenfalls bedenken, dass sich auch bei Patienten mit ARDS durch Änderungen der Röntgentechnik oder der Überdruckbeatmung das Aussehen von Infiltraten erheblich verändern kann.
Chronische interstitielle Lungenkrankheiten
Es gibt ein breites Spektrum von chronischen Anomalien der Lunge. Bronchiektasen und COPD wurden bereits weiter oben beschrieben. Bei unspezifischen röntgenologischen Befunden und unterschiedlichem Aussehen der interstitiellen Lungenkrankheiten stellt man die Diagnose am besten anhand von Anamnese und klinischem Befund. Ist der Patient nicht akut krank, muss oft keine bildgebende Diagnostik erfolgen. Bei Symptomen oder verminderter Diffusionskapazität, restriktiver Lungenkrankheit in Lungenfunktionstests und vermehrter interstitieller Zeichnung im Röntgenbild des Thorax kann man eine hochauflösende CTUntersuchung des Thorax durchführen, um nach einer frühen infiltrativen Lungenkrankheit (z.B. im Gefolge einer Unusual Interstitial Pneumonitis = UIP) zu fahnden. Ist der Patient akut krank und vermutet man eine atypische Pneumonie oder eine Herzerkrankung, bedarf es keiner CT.
Krankheiten, die bevorzugt die Oberlappen erfassen, sind Silikose, Sarkoidose und eosinophiles Granulom. Die Silikose kann neben einförmig verteilten kleinen (Durchmesser: 1–10 mm) Knötchen „eierschalenartig” verkalkte Hiluslymphknoten zeigen (Abb. 3-53, Abb. 3-54 ).
Abb. 3-53.

Silikose. 20 Jahre auseinander liegende Thoraxaufnahmen eines Patienten. A. Die Erstaufnahme des Thorax zeigt einen unauffälligen linken Oberlappen. B. Nach langjähriger Arbeit des Patienten in einem Steinbruch sieht man in der linken Hilusregion rundliche Verkalkungen sowie knotige Läsionen im Lungenparenchym und eine fibrosierte linke Lungenspitze.
Abb. 3-54.

Spätstadium der Silikose. A. Die Thoraxaufnahme zeigt eine erhebliche Parenchymveränderung überwiegend in den Oberlappen infolge einer progressiven massiven Fibrose. Normales (B) und hochauflösendes CT-Bild (C) zeigen grobe interstitielle und knotige Veränderungen.
Die Sarkoidose ist eine Krankheit unbekannter Ätiologie, die am häufigsten bei Afroamerikanern vorkommt. Manifestationen im Röntgenbild sind Lymphadenopathie von Hili und Mediastinum sowie eine Erkrankung des Lungenparenchyms. Etwa ein Drittel der Patienten hat beidseits vergrößerte Hiluslymphknoten und gelegentlich vergrößerte Azygoslymphknoten. Ebenfalls etwa ein Drittel zeigt einen Befall des Lungenparenchyms in Form interstitieller oder alveolärer Infiltrate, und bei einem weiteren Drittel findet man sowohl eine Lymphadenopathie als auch parenchymatöse Lungenveränderungen (Abb. 3-55 ). In den Spätstadien entwickelt sich das Muster einer interstitiellen Fibrose.
Abb. 3-55.

Sarkoidose. A. Bei der Form mit Lungenbeteiligung sieht man diffuse Infiltrate in beiden Lungen. Viele dieser Patienten haben begleitend Lymphknotenvergrößerungen in der Hilusgegend und paratracheal. B. Das hochauflösende CT-Bild zeigt auffällig verbreiterte Bronchuswände (Pfeile).
Krankheiten, die bevorzugt die Unterlappen erfassen, sind Kollagenosen, Lungenkrankheiten durch Schadstoffe oder Medikamente, Asbestose, interstitielle Fibrose und UIP (Unusual Interstitial Pneumonia).
Einige Gedächtnishilfen: BADAS für Unterlappenkrankheiten (Bronchiektasen, Aspiration, Drogen/Medikamente, Asbestose und Sklerodermie oder andere Kollagenosen), CASSET P für Krankheiten der Oberlappen (Cystische Fibrose, Ankylosierende Spondylitis [M. Bechterew], Silikose, Sarkoidose, Eosinophiles Granulom, Tuberkulose und Pneumozystis carinii), LIFE für diffuse chronische interstitielle Krankheiten (Lymphangiosis carcinomatosa, Infektion, Fibrose und Edema [Ödem]) und HEP für akute interstitielle Infiltrate (Hypersensitivität [allergische Alveolitis], Edema und virale Pneumonie).
Lymphangiosis carcinomatosa und Sarkoidose können sehr kleine Knötchen aufweisen, die um Bronchien und Blutgefäße konzentriert sind, während die meisten anderen Entitäten Knötchen zeigen, die sich in die Lungenperipherie ausbreiten. Die meisten Kollagenosen können interstitielle (feine Linien), retikuläre (netzartige) oder honigwabenartige (honeycombing) Veränderungen des Lungenparenchyms bewirken. Man kann dies auch bei rheumatoider Arthritis, systemischem Lupus erythematodes und einer Zahl weiterer Krankheiten sehen.
Einige chronische Lungenkrankheiten können diffuse interstitelle Veränderungen, ein Honeycombing oder herdförmige fleckige Infiltrate erzeugen. Die Sarkoidose wurde bereits erwähnt, weitere solche Erkrankungen sind u.a. die extrinsische allergische Alveolitis (verursacht durch Antigene wie Pollen oder Vogelproteine), das eosinophile Granulom, die Bronchiolitis obliterans und die eosinophile Lungenkrankheit. Wegen der Unspezifität der radiologischen Befunde bei diesen Krankheiten muss man die Diagnose mittels Anamnese und klinischer Befunde stellen. Röntgenthoraxaufnahme und High-resolution-CT können dabei zusätzliche Informationen liefern und zur Verlaufskontrolle der jeweiligen Krankheit genutzt werden.
Erkrankungen durch „Biowaffen”
Bioterroristische Agenzien passen schlecht in die Kategorien der Bildgebung. Sie werden hier erwähnt, da sie infektiös sind und viele Lungenveränderungen verursachen können, insbesondere solche der Gasaustauschräume. Wenige dieser Agenzien (z.B. inhalierbarer Anthrax) haben charakteristische röntgenologische Befunde. Andere, z.B. Pocken oder virale Erreger von hämorrhagischem Fieber, bieten auffällige klinische Bilder. Im Bildbefund zeigt Anthrax eine mediastinale Lymphadenopathie ohne interstitielles Ödem, herdförmige Konsolidierung oder eine diffuse Erkrankung der Gasaustauschräume. Pocken können nach Erscheinen der Hautläsionen eine segmentale oder lobäre Konsolidierung bedingen, mitunter kommen bei immunisierten Personen auch Lungenknötchen vor, nicht aber interstitielles Ödem und Lymphadenopathie. Eine diffuse Beteiligung der Gasaustauschräume ist selten. Die Pest führt häufig zu segmentaler oder lobärer Konsolidierung, manchmal auch zu Lymphknotenschwellung und diffuser alveolärer Verschattung. Einschmelzungen sind selten. Die Tularämie zeigt oft Segment- oder Lappeninfiltrate, manchmal eine Lymphadenopathie und Einschmelzung. Interstitielles Ödem und diffus verlegte Gasaustauschräume sind selten. Das Q-Fieber zeigt in der Bildgebung häufig segmentale oder lobäre Konsolidierung, aber keine weiteren thorakalen Manifestationen. Das amerikanische Hantavirus bedingt oft ein interstitielles Ödem und diffus verschattete Gasaustauschräume ohne vergrößerte Lymphknoten oder Segment-/Lappenin filtrate. Virale hämorrhagische Fieber können ein leichtes interstitielles Ödem verursachen, zeigen aber keine weiteren Manifestationen im Röntgenbild.
Hämoptysis
Blutungen aus dem Gastrointestinaltrakt und dem Nasopharynx sind häufiger als echte Hämoptysen, weshalb man zuerst diese möglichen Ursachen bei Beschwerden des Patienten ausschließen sollte. Erstes bildgebendes Verfahren bei Hämoptysen ist die normale Röntgenuntersuchung des Thorax in zwei Ebenen. Häufigste Ursache ist die Bronchitis, aber man sollte auch eine endobronchiale Läsion oder eine Lungenembolie bedenken. Fällt die Thoraxaufnahme normal aus und hat der Patient ein geringes Risiko eines Bronchialkarzinoms, so ist die hochauflösende CT zum Ausschluss von Bronchiektasen die nützlichste bildgebende Untersuchung. Ist die Thoraxröntgenaufnahme normal, hat der Patient jedoch ein hohes Risiko eines Bronchialkarzinoms (> 10 pack years als Zigarettenraucher) oder eines andernorts lokalisierten malignen Tumors, sollte man eine Bronchoskopie durchführen oder eine CT veranlassen. Sieht man in der Thoraxröntgenaufnahme eine Veränderung, so hängt der Einsatz von CT oder Bronchoskopie von der Art der Veränderung ab. Wenn sie peripher liegt, ist eine CT hilfreicher als die Bronchoskopie. Bei einem Unfallpatienten mit Hämoptysen sollte man auch an einen Bronchusabriss denken, der operiert werden muss. In diesem Fall kann die Röntgenaufnahme des Thorax ein begleitendes Mediastinalemphysem aufdecken.
Bronchialkarzinom und Lungenrundherde
Solitärer Lungenrundherd
Ein solitäres Knötchen der Lunge ist eine kleine Raumforderung, die weniger als 3 cm im Durchmesser misst. Ist ein Rundherd größer als 3 cm, wird er als Raumforderung bezeichnet. Alle Läsionen mit der ungefähren Größe eines Golfballs sind in meinen Augen auf eine Neoplasie sehr verdächtig. In der Thoraxaufnahme leicht erkennbare Läsionen von hoher Dichte mit maximal 5 mm Durchmesser sind höchstwahrscheinlich Granulome. Auch das Alter ist ein wichtiges Unterscheidungskriterium: Bei einem Patienten unter 40 Jahren kann zwar auch ein Bronchialkarzinom vorkommen, aber eher sehr selten.
Ein solitäres Lungenknötchen hat viele Differenzialdiagnosen. Wie bereits erwähnt, kann es ein Granulom oder ein Bronchialkarzinom darstellen. Andere mögliche Ursachen sind eine solitäre Metastase, ein septischer Embolus, eine arteriovenöse Malformation, ein Hamartom oder eine kleine Rundatelektase (Tab. 3-5 ). Wenn man ein solitäres Lungenknötchen entdeckt hat, muss man zunächst bestimmen, ob es tatsächlich in der Lunge liegt, und ausschließen, dass es sich um einen Mamillenschatten oder eine Warze an der Hautoberfläche handelt. Man erkennt den Mamillenschatten in der sagittalen Aufnahme auf die Lunge projiziert, und zwar meist in Höhe der Medioklavikularlinie. Die Mamille projiziert sich auf die untere Lungenhälfte. Kleine Mamillenmarkierungen können in einer Wiederholungsaufnahme zur Identifizierung von Nutzen sein.
Tab. 3-5.
Differenzialdiagnose von Lungenrundherden
| Solitär und kleiner als 3 cm | Granulom (v. a. ein verkalktes), Bronchialkarzinom, einzelner Mamillenschatten, Hautwarze, benigner Lungentumor, Metastase, Rundatelektase, septische Embolie |
| Solitär und größer als 3 cm | Bronchialkarzinom, „runde” Pneumonie, große Solitärmetastase, Lungenabszess |
| Multipel | Granulome, Metastasen, septische Embolien |
| Einschmelzend | Septische Embolien, Tuberkulose, Pilzinfektion, Plattenepithelkarzinom |
| Benigne Charakteristika | Klein (< 3 cm), rund, scharf begrenzt, langsam wachsend (in 2 J. kaum wahrnehmbar), zentrale Verkalkung, solide (keine Einschmelzung) |
| Maligne Charakteristika | Groß (> 3 cm), unregelmäßige Form, unscharf begrenzt, sichtbares Wachstum binnen 2 Jahren, asymmetrische/fehlende Verkalkung, einschmelzend, aktive Anreicherung von Fluor-18-FDG in der PET- Szintigraphie |
FDG Fluorodeoxyglucose; PET Positronenemissionstomographie
Das Knötchen wird zunächst in der Röntgenaufnahme in einer Horizontalebene (z.B. in Aortenbogenhöhe) geortet und dann in der seitlichen Aufnahme (wiederum in Höhe des Aortenbogens) gesucht, um zu prüfen, ob es in beiden Aufnahmen in gleicher Höhe im Thorax zu finden ist. Im Zweifel können Schrägaufnahmen angefertigt werden. Liegt das Knötchen tatsächlich innerhalb der Thoraxhöhle, sollte es weniger stark rotieren als die vorderen und hinteren Rippenanteile.
In einem zweiten Schritt beschreibt man das Knötchen. Ist es scharf abgrenzbar und rund, so ist es eher benigne als ein unregelmäßiges oder unscharf begrenztes Knötchen. Eine sehr dichte (Abb. 3-56 ) und innerhalb des Knötchens liegende Verkalkung spricht mit größter Wahrscheinlichkeit für ein Granulom (Abb. 3-57 ), wobei die Verkalkung zentral im Knötchen liegen sollte. Liegt die Verkalkung exzentrisch, ist an ein Neoplasma zu denken.
Abb. 3-56.
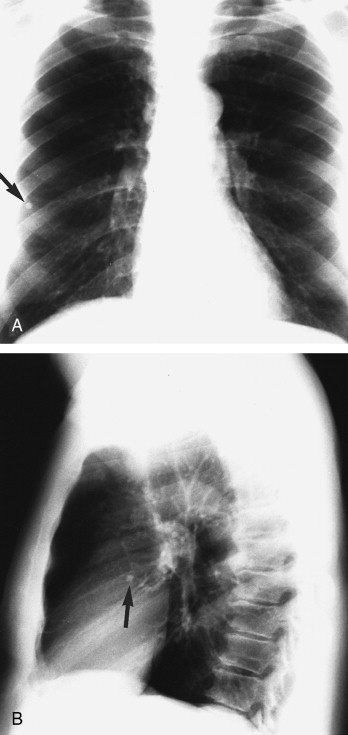
Solitäres verkalktes Granulom. Man sieht in der p.-a. (A) wie auch in der seitlichen Aufnahme (B) ein dichtes Knötchen in der Lunge, das man mit Sicherheit als Granulom bezeichnen kann und das nicht weiter abgeklärt werden muss, da es deutlich dichter als die umgebende Rippe und folglich eindeutig verkalkt ist.
Abb. 3-57.

Zentral verkalktes Granulom. A. Die dorsale Läsion in der seitlichen Thoraxaufnahme hielt man zunächst für eine pleurale Raumforderung (Pfeile). Man erkennt im Röntgenbild nicht sicher eine Verkalkung. B. Das Computertomographiebild zeigt hingegen deutlich die zentrale Verkalkung dieser Läsion (Pfeil). Bei einer exzentrischen Verkalkung in einer Raumforderung muss man ein Neoplasma ausschließen.
In einem dritten wichtigen Schritt bestimme man, ob das Knötchen neu aufgetreten oder ein alter Befund ist. Man sollte alle verfügbaren Thoraxröntgenaufnahmen sorgfältig durchsehen und auch Kliniken oder Praxen, die den Patienten im Vorfeld betreut haben und betreuen, anrufen, bevor man teure oder invasive Untersuchungen in Auftrag gibt. Ein Knötchen, dessen Größe zwei Jahre lang unverändert geblieben ist, kann man als benigne ansehen. Stabilität über ein Jahr reicht nicht aus, weil sich langsam wachsende Tumoren binnen zwölf Monaten nur kaum wahrnehmbar verändern können. Verdoppelt ein Knötchen mit 1 cm Durchmesser seine darin enthaltene Zellzahl, so steigt der Durchmesser lediglich auf 1,2 cm an, also um eine so kleine Differenz, dass sie in der Thoraxaufnahme schwer wahrzunehmen ist.
Weiter abklären kann man ein Knötchen mittels CT. In diesem Fall fordert man Dünnschichten in Höhe des jeweiligen Knötchens an und lässt darüber hinaus die gesamte Lunge darstellen. Da die CT beim Nachweis von Knötchen sensitiver ist als die Röntgenaufnahme des Thorax, kann es durchaus sein, dass sich im CTBild zahlreiche Knötchen zeigen. In diesem Fall ändert sich die Differenzialdiagnose rasch.
Die Positronenemissionstomographie (PET) verwendet man, um zu bestimmen, ob ein Knötchen oder eine Raumforderung benigne oder maligne ist. Meist führt man die Untersuchung dann durch, wenn eine Feinnadelaspiration schwer durchführbar ist oder der Patient bereits ein bekanntes Karzinom und zusätzlich neue Raumforderungen in Lunge oder Mediastinum hat. Es wird das Radioisotop Fluor-18 als Fluorodeoxyglucose (FDG) verwendet. Maligne Läsionen sind metabolisch hochaktiv und nehmen den Tracer auf (Abb. 3-58 ). Allerdings müssen maligne Läsionen einen Durchmesser von mindestens ca. 8 mm haben, damit sie im PETScan sichtbar werden.
Abb. 3-58.

Bronchialkarzinom in CT und PET. A. Das Computertomographiebild zeigt eine 2 cm große Weichteilraumforderung im Lungenmittelfeld. B. Eine Ganzkörper-Positronenemissionstomographie (PET) von Thorax und Oberbauch mit radioaktiv markierter Glucose zeigt eine stark erhöhte Aktivität am gleichen Ort, was eine hohe metabolische Aktivität und damit eine hohe Wahrscheinlichkeit für eine maligne Läsion bedeutet.
Bronchialkarzinom-Screening
Es war bereits vor vielen Jahren klar, dass jährliche Röntgenthoraxaufnahmen selbst bei Rauchern wenig oder nichts dazu beitragen, die Mortalität durch das Bronchialkarzinom zu senken. Zum Zeitpunkt, wo man die Läsionen eindeutig nachweisen konnte, waren sie schon so weit fortgeschritten, dass viele von ihnen Metastasen gestreut hatten. In den letzten Jahren wurde viel öffentliches Interesse geweckt, Werbung betrieben und etliche Forschungsprojekte zur Wirksamkeit der jährlichen CT-Thoraxuntersuchung zum Nachweis des Bronchialkarzinoms gefördert. Es ist klar, dass sich kleinere Läsionen mit der CT nachweisen lassen, wobei die Erfahrung bislang zeigt, dass bei einem Screening von Rauchern etwa 70% einen oder mehr sichtbare „Knötchen” haben. In einigen der hinsichtlich des Designs b sseren Längsstudien sind 99% dieser Veränderungen keine Karzinome, was die Frage offen lässt, wie man mit diesen Patienten umgehen soll. Viele Läsionen sind zu klein, um eine genaue perkutane Feinnadelbiopsie durchzuführen, und die Segmentresektion beinhaltet ein Letalitätsrisiko von mindestens etwa einem Prozent (Abb. 3-59 ). Meist macht man bei solchen Veränderungen nach drei Monaten eine Folgeuntersuchung, um Veränderungen festzustellen. Bei fehlender Veränderung wiederholt man nach 6 Monaten und bei wiederum konstantem Befund nach 12 und 24 Monaten die Kontrollen. Derzeit werden vom National Cancer Institute, der American Cancer Society oder dem American College of Radiology CTUntersuchungen zum Screening für den Nachweis eines Bronchialkarzinoms nicht empfohlen.
Abb. 3-59.

Unklares winziges Knötchen. In der aus anderer Ursache vorgenommenen Computertomographie (CT) des Thorax fand man ein 2 mm großes Knötchen im vorderen linken Lungenabschnitt (Pfeil). Ein solches Knötchen ist für eine Nadelbiopsie zu klein und wird mittels CT-Kontrollen überwacht. Über 99 % solcher Zufallsherde sind benigne.
Bronchialkarzinom
Die Pathologie der Bronchialkarzinome ist schwierig, weil manche Tumoren mehr als einen histopathologischen Typus bieten und andere undifferenziert sind. Dabei hängt die Inzidenz des jeweiligen Zelltyps vom zitierten Studientyp ab (Operation vs. Autopsie). Etwa 40% der Bronchialkarzinome sind Adenound 30% Plattenepithelkarzinome. Unter den restlichen stellen kleinzelligeKarzinome (darunter die „Haferzelltypen”) die Mehrzahl.
Man könnte annehmen, ein 1 cm großes Knötchen, das sich als Bronchialkarzinom herausstellt, sei eine Läsion in einem frühen Stadium. Dies ist aber bei weitem nicht der Fall. Ein Knötchen von 1 cm Größe beinhaltet bereits eine Milliarde Zellen. Gemessen an seinen Verdoppelungszeiten hat es auf dem Weg, den gesamten Hemithorax auszufüllen, bereits zwei Drittel hinter sich gebracht!
Primäre Bronchialkarzinome bieten zahlreiche Erscheinungsformen. Das Adenokarzinom tritt peripher auf, dagegen liegen einige Formen des Plattenepithelkarzinoms zentral oder peripher. Plattenepithelkarzinome jeglicher Herkunft neigen zur Einschmelzung (Kavernisierung). Kleinzellige Karzinome erscheinen anfangs oft als unscharfe hiläre oder perihiläre Raumforderung. Bei einer einseitigen Hilusraumforderung oder einem persistierenden Infiltrat bei einem Erwachsenen, der älter als 40 Jahre ist, sollte man immer den Verdacht auf ein Bronchialkarzinom haben.
Wertvollstes bildgebendes Verfahren für das anfängliche und örtliche Staging des Bronchialkarzinoms ist die CT. Oft verwendet man intravenöses Kontrastmittel, damit man den Tumor, Lymphknotenvergrößerungen und Lungengefäße unterscheiden kann. Zur Analyse der CT sollten nicht nur Ort und Größe der Lungenläsion gehören, sondern auch die Beurteilung, ob diese Pleura oder Thoraxwand infiltriert und ob die Lymphknoten von Hilus oder Mediastinum betroffen sind (Abb. 3-60 ). Die Genauigkeit der CT in der Darstellung einer Infiltration der Thoraxwand beträgt nur ca. 50%, doch sprechen für die Infiltration eine verdickte Pleura, eine Kontaktzone von Tumor und Pleura größer als 3 cm, stumpfe Winkel zwischen Tumor und Pleura und eine gesteigerte Dichte des extrapleuralen Fetts. Meist zeigt ein Pleuraerguss die schlechte Prognose an, allerdings machen erst die Pleurapunktion und der (zyto)pathologische Nachweis maligner Zellen im Erguss den Tumor unresezierbar. Das Staging der Bronchialkarzinome hinsichtlich Mediastinal- und Fernmetastasen erfolgt am besten nuklearmedizinisch mittels Ganzkörper-PET (wie bereits erwähnt).
Abb. 3-60.
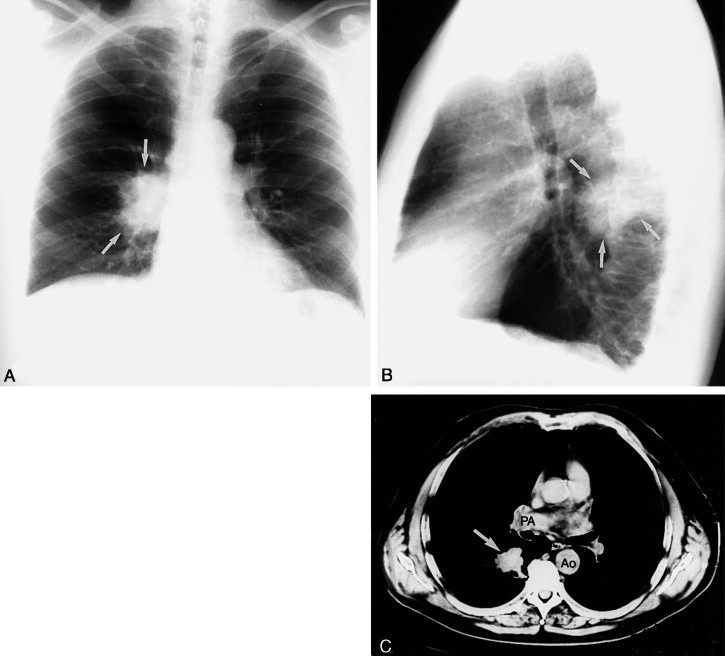
Bronchialkarzinom in Röntgen und CT. A. Man erkennt im p.-a. Bild eine unscharf begrenzte Raumforderung (Pfeile), die zwar hilusnah gelegen scheint, in der seitlichen Aufnahme (B) allerdings dorsal des Hilus sitzt. Ihre unscharfe fransige Oberfläche spricht für ein Karzinom. C. Die weitere Abklärung mittels CT zeigt dann die Lagebeziehung der Raumforderung zu den Mediastinalstrukturen, z. B. zu Pulmonalarterie (PA) und Aorta (Ao).
Im Röntgenbild des Thorax kann man zwei klassische, aber ungewöhnliche Erscheinungsformen des Bronchialkarzinoms sehen. Das erste ist das „S-Zeichen nach Golden”. Es entsteht bei einem Hilustumor, der eine periphere Atelektase verursacht (meist des rechten Oberlappens). Wenn der rechte Oberlappen kollabiert, erscheint normalerweise eine vom Hilus bis zur lateralen Thoraxwand nach kranial konvex gebogene kleine Fissur. Bei einer Hilusraumforderung sieht man aber eioen hilusnah nach unten und lateral konvex gebogenen kleinen Spalt, was dem Unterrand des kollabierten rechten Oberlappens die Form eines „S” verleiht (Abb. 3-61 ). Zweites klassisches Erscheinungsbild ist der Pancoast-Tumor, ein Oberlappenkarzinom, das Pleura und Nachbarstrukturen, wie die Rippen, infiltriert (Abb. 3-62 ).
Abb. 3-61.

„S”-Zeichen nach Golden bei Bronchialkarzinom. Wo eine Raumforderung im Hilusbereich den Oberlappenbronchus verlegt, kollabiert die Fissura minor nach oben. Während bei einer unkomplizierten Atelektase die kleine Fissur einfach nach kranial ausgebogen wird, nimmt der Unterrand des Oberlappens bei einer hilusnahen Raumforderung (M) die Form eines „S” an, weil er um die Raumforderung herum liegt.
Abb. 3-62.
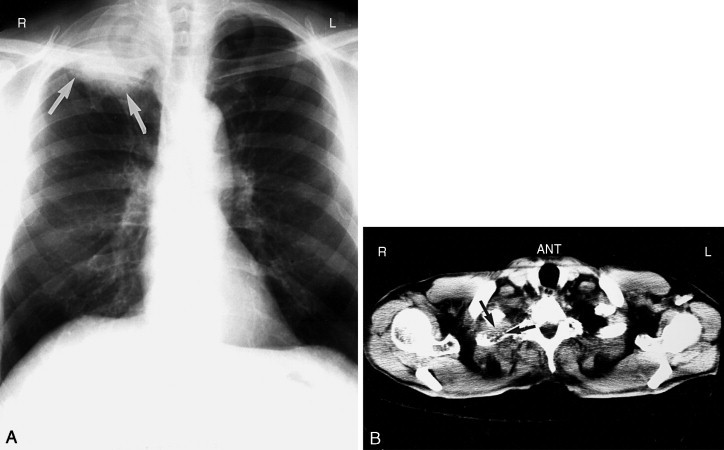
Pancoast-Tumor. A. Bei diesem Patienten mit Schulterschmerz sieht man eine unscharf begrenzte Raumforderung im rechten Lungenapex (weiße Pfeile). B. Im axialen Computertomographiebild des oberen Thorax wird die durchdringende Zerstörung des dorsalen Anteils der ersten Rippe durch den Tumor nachgewiesen (schwarze Pfeile).
Bronchialkarzinome metastasieren üblicherweise in die Lunge der Gegenseite, in Leber, Knochen, Gehirn und Nebennieren. Häufigster Ort ist die Leber, die Nebennieren sind bei 30% der Patienten betroffen. Aus diesem Grund sollte man bei Verdacht auf ein Bronchialkarzinom die Thorax-CT weit genug nach kaudal reichen lassen, damit man diese Organe sehen kann. Knochenmetastasen sind meist rein osteolytisch oder destruierend.
Bei peripheren Läsionen (die sich bronchoskopisch nicht erreichen lassen) kann man entweder durchleuchtungs- oder CT-gesteuerte perkutane Biopsien mit dünner Kanüle vornehmen. Häufigste Komplikation dieses Verfahrens ist der Pneumothorax (ca. in 25% der Fälle); etwa 5–10% dieser Patienten benötigen in Folge eine Pleuradrainage. Immunsupprimierte AIDS-Patienten haben eine höhere Inzidenz des Kaposi-Sarkoms. Dieses erscheint meist als unscharfe herdförmige Infiltration und nicht als scharf begrenzte Raumforderung (vgl. Abb. 3-47 C).
Vergrößerter Hilus
Eine Hilusvergrößerung kann man im Röntgenbild sehen. Die drei wichtigsten Ursachen sind verbreiterte Pulmonalarterien, Lymphadenopathie und das Bronchialkarzinom. Ist die Ursache unbekannt oder besteht die Möglichkeit einer wirksamen Behandlung, so ist zur weiteren Beurteilung eine Thorax-CT mit Kontrastmittel indiziert.
Maligne Lymphome, insbesondere den Morbus Hodgkin, sieht man in der Thoraxaufnahme meist entweder als große Raumforderung im vorderen Mediastinum oder als Lymphadenopathie des Hilus. Ist das Lymphom groß und reicht es kranial bis an die Aorta, kann man es mit einem Aortenaneurysma verwechseln. Die Hiluslymphadenopathie ist oft schwer von verbreiterten zentralen Pulmonalarterien zu unterscheiden. Man kann eine ausgedehnte Lymphknotenvergrößerung eher anhand zahlreicher Kanten und Kurven als an der einzelnen Auftreibung erkennen, die man bei dilatierten zentralen Pulmonalarterien erwarten würde. Auch können vergrößerte Lymphknoten die normale Konkavität zwischen linker Lungenhauptarterie und Aortenbogen ausfüllen. Bleiben Fragen offen, kann eine CT leicht die Unterschiede aufzeigen (Abb. 3-63 ). Maligne Lymphome und Morbus Hodgkin können Infiltrate oder Knoten in der Lunge verursachen, allerdings ist dies relativ selten. Die Stadieneinteilung der meisten malignen Lymphome kann man mittels F18-FDG-PET-Scans durchführen.
Abb. 3-63.

Morbus Hodgkin. A. Bei diesem 20 Jahre alten Mann mit leichtem Fieber zeigt das p.-a. Thoraxbild ein deutlich verbreitertes mittleres und oberes Mediastinum (Pfeile). B. In der seitlichen Aufname erkennt man eine unscharf begrenzte Raumforderung des vorderen Mediastinums, die den Retrosternalraum einnimmt (Pfeile). C. Das axiale, kontrastmittelverstärkte CT-Bild durch den oberen Thoraxbereich zeigt V. anonyma (In V), Pars ascendens und descendens der Aorta (Ao) sowie die Trachea (T), die von der knotigen Raumforderung (Pfeile) umwachsen sind.
Lungenmetastasen
Das Lungenparenchym ist häufig Sitz von Metastasen, da die Lungen als Filter für Teilchen und Zellen fungieren. Die meisten Metastasierungen zeigen in der Lunge zwei vorherrschende Muster:
Eines dieser Muster ist die knotige Läsion. Die Läsionen werden im typischen Fall als hämatogene Metastasen bezeichnet. Die Metastasen in der Lunge variieren von sehr kleinen Knötchen bis zu extrem großen Raumforderungen („Kanonenkugeln”). Lungenmetastasen des Schilddrüsenkarzinoms erzeugen im typischen Fall ein Schneegestöberbild aus sehr kleinen knotigen Läsionen. Andere Tumoren, wie Kolonund Nierenzellkarzinom, bedingen im typischen Fall Metastasen von einem bis mehreren Zentimetern Durchmesser. Sind extrem große (etwa tennisballgroße) und zahlreiche Raumforderungen vorhanden, sollte man auch an Sarkommetastasen denken. Die CT deckt häufig wesentlichmehrMetastasen auf, als man nach derRöntgenaufnahme des Thorax vermutet (Abb. 3-64 ).
Abb. 3-64.

Hämatogene Metastasen eines Nierenzellkarzinoms. A. Die Thoraxaufnahme zeigt einige wenige Rundherde. B. Im Computertomogramm sind im Vergleich zum Röntgenbild wesentlich mehr Metastasen zu sehen (z.T. mit Pfeilen markiert).
Eine zweite Variante der Metastasierung sieht man in Form streifiger oder geradliniger Infiltrate überall in den Lungen verteilt. Man bezeichnet dies als lymphogene Tumorstreuung; es handelt sich dabei nicht um eine Streuung über die Lymphgefäße, sondern um ein zweites Erscheinungsbild der hämatogenen Streuung. Dieses besondere „lymphangitische” Muster tritt recht häufig beim Magenkarzinom auf (Abb. 3-65 ). Das Mammkarzinom kann entweder rundliche hämatogene Metastasen oder solche des „lymphangitischen” Musters hervorrufen. Bei der Suche nach Lungenmetastasen muss man immer auch Mediastinal- und Hilusregion sorgfältig nach Zeichen einer Lymphadenopathie und die Knochenstrukturen nach Zeichen lytischer (Löcher) und sklerotischer Läsionen (Areale unscharf verdichteten Knochens) absuchen.
Abb. 3-65.

Lymphangiosis carcinomatosa. Die streifige Zeichnung im Lungenparenchym beruht auf Metastasen (in diesem Fall eines Magenkarzinoms). Es handelt sich um hämatogene Metastasen im Interstitium der Lunge (im Amerikanischen fälschlich als „lymphangitic” metastases bezeichnet).
Häufig stellt sich die Frage, in welchen Intervallen man bei einem Patienten mit einem bekannten Karzinom Röntgenaufnahmen des Thorax anfertigen soll, um Lungenmetastasen auszuschließen. Nur selten ist es sinnvoll, jeden Monat Aufnahmen zu machen. Die meisten Onkologen geben auch nur dann eine Thoraxaufnahme im Abstand von 6 Monaten oder jährlich in Auftrag, wenn deren Ergebnis die Therapie beeinflussen kann.
Arterielle Hypertonie
Die meisten arteriellen Hypertonien sind idiopathischer Natur; nur ein kleiner Prozentsatz beruht auf einer Nierenarterienstenose. Bei Patienten mit Hypertonie ist eine Röntgenaufnahme des Thorax nicht indiziert, weil die Ausbeute positiver Befunde sehr gering ist. Thoraxschmerz kann bei Hypertoniepatienten entweder an ein thorakales Aortenaneurysma oder eine koronare Herzkrankheit denken lassen. Diese Krankheiten werden neben der Abklärung einer durch Nierenarterienstenose bedingten Hypertonie in Kapitel 5 abgehandelt.
Thoraxschmerz und Dyspnoe
Sowohl Thoraxschmerz als auch Dyspnoe können auf einer Vielzahl von Ursachen beruhen, z.B. traumatischen, infektiösen, neoplastischen und kardiovaskulären. Es ist immer dann eine Röntgenaufnahme des Thorax indiziert, wenn bei dem Patienten ein pathologisches Ergebnis der körperlichen Untersuchung vorliegt, er ein Trauma erlitten hat, Fieber, Gewichtsverlust oder ein Herzleiden angibt. Bei einem Patienten über 40 Jahren wird meist eine Röntgenaufnahme des Thorax gemacht, selbst wenn die körperliche Untersuchung normal ausfällt; für Patienten unter 40 Jahren und mit einem normalen körperlichen Untersuchungsbefund gibt es hingegen keinen Konsens, ob die Anfertigung einer Thoraxröntgenaufnahme angezeigt ist. Vorgehensweisen zu Herzleiden und Angina pectoris werden in Kapitel 5 diskutiert.
Chronische Linksherzinsuffizienz und Lungenödem
In aufrechter Körperhaltung fließt wesentlich mehr Blut durch die Lungenbasis als durch die Lungenspitzen. Betrachtet man eine Thoraxaufnahme im Stehen, muss man diesen normalen Unterschied der Lungengefäßzeichnung berücksichtigen. Die Gefäße sollten vom peripheren Lungendrittel bis zurück zu den Hili einzeln klar erkennbar sein und in den Lungenunterfeldern deutcher in Erscheinung treten als in den Oberfeldern.
Bei der chronischen Linksherzinsuffizienz (LHI) findet man in Thoraxaufnahmen im Stehen unterschiedliche Befunde je nach Schweregrad der Insuffizienz. In den Frühstadien kann man eine Kardiomegalie und eine Umverteilung der Lungengefäßzeichnung sehen (= Kranialisation), bei der die Durchblutung von Oberund Unterfeldern nahezu gleich stark ist (bei einem mittleren Kapillarverschlussdruck von 15–25 mmHg). Zu diesem Zeitpunkt gleicht der Durchmesser der Oberfeldgefäße, in gleicher Entfernung zum Hilus gemessen, dem der Unterfeldgefäße. Weiteres diagnostisches Zeichen sind im ersten Interkostalraum erkennbare Lungengefäße von mehr als 3 mm Durchmesser. Diese Zeichen sind in einer Aufnahme in Rückenlage nicht verwertbar, da sich hier die Lungendurchblutung bei einem Gesunden infolge der Schwerkraft verändert.
Mit zunehmender Linksherzinsuffizienz kann man in den Interlobulärsepten lateral an der jeweiligen Lungenbasis Flüssigkeit sehen (25–30 mmHg), die man als Kerley-B-Linien bezeichnet. Diese kommen immer direkt an der Innenseite der Rippen vor und verlaufen horizontal (Abb. 3-66 ). Es können keine Blutgefäße sein, da diese normalerweise im peripheren Viertel der Lunge nicht sichtbar sind.
Abb. 3-66.

Frühbefunde bei Linksherzinsuffizienz. A. Die Kardiomegalie und die Umverteilung der Lungengefäßzeichnung sind die wichtigsten Zeichen im p.-a. Röntgenbild im Stehen. Normalerweise sind die Unterlappengefäße kräftiger als die Oberlappengefäße, hier erscheinen sie aber zumindest von gleichem Kaliber. B. In der Zielaufnahme kann man am besten in der äußersten Lungenperipherie kleine horizontale Linien erkennen (Pfeile), die als Kerley B-Linien bekannt sind und durch Flüssigkeit aufgetriebene Interlobulärsepten darstellen.
Mit fortschreitender LHI werden die hilusnahen Gefäße unscharf, da sich im Interstitium Flüssigkeit ansammelt. Eine symmetrische und beidseitige Hilusunschärfe sollte immer an eine LHI denken lassen (Abb. 3-67A ). Es können Pleuraergüsse vorhanden sein, was man an stumpf werdenden kostophrenischen Winkeln erkennt. Bei einer fortgeschrittenen LHI sammelt sich Flüssigkeit im Alveolenraum an und es wird ein „freies” Lungenödem sichtbar (Abb. 3-67B). Man sieht dieses auf beiden Seiten als vorwiegend in der Lungenbasis und perihilär gelegene alveoläre Infiltrate (> 30 mmHg). Allerdings ist hier Vorsicht angebracht, da die Veränderungen einer minimalen Kardiomegalie und der Gleichförmigkeit der Lungengefäßzeichnung in einer Aufnahme in Rückenlage Normalbefunde sind. In einer Liegendaufnahme kann die Diagnose einer minimalen LHI nicht gestellt werden.
Abb. 3-67.

Lungenödem. A. Das Lungenödem kann sich als Unschärfe der Gefäße, die fächerartig vom Hilus ausgehen, manifestieren. Manchmal wird dies „Fledermausflügel”-Infiltrat genannt. B. Wenn sich das Lungenödem verschlimmert, füllt Flüssigkeit die Alveolen aus und es erscheint ein sog. „Luftbronchogramm” (Pfeile).
Es können einige häufige Varianten einer LHI auftreten. Bei Patienten, die auf der rechten oder linken Seite lagen, sieht man, dass sich relativ mehr Lungenödem auf der schwerkraftabhängigen Seite sammelt, weil hier der Flüssigkeitsdruck höher ist (Abb. 3-68 ). Patienten mit Niereninsuffizienz bieten oftmals ein Bild wie bei einer LHI, v. a. mit perihilärer Unschärfe und einem schmetterlings- oder fledermausflügelartigen Infiltrat, das um die Hili zentriert ist. Im typischen Fall sieht man dies vor der Dialyse, wobei die Infiltrate nach der Dialyse verschwinden (Abb. 3-69 ). Man denke auch daran, dass ein Lungenödem auch durch andere als kardiale Ursachen entstehen kann. Ohne Herzvergrößerung kommen Medikamentenüberdosierung, Schädel-Hirn-Trauma (mit Dämpfung des ZNS) und akute Inhalation schädlicher Stoffe als mögliche Ursachen in Frage.
Abb. 3-68.

Schwerkraftabhängiges Lungenödem. Bei geschwächten Patienten, die auf der Seite liegen, kann der auf der zuunterst liegenden Seite erhöhte hydrostatische Druck ein einseitiges Lungenödem verursachen. Bei diesem Patienten auf einer Intensivstation beruht das rechtsseitige alveoläre Infiltrat auf einem schwerkraftabhängigen Lungenödem.
Abb. 3-69.

Flüssigkeitsüberlastung bei Niereninsuffizienz. A. Die direkt vor der Dialyse angefertigte p.-a. Aufnahme des Thorax zeigt im Hilusbereich vermeintlich zahlreiche unscharfe Lungengefäße. Tatsächlich handelt es sich aber meist nicht um Gefäße, sondern um interstitielle Flüssigkeit. B. Die eine Stunde nach der Dialyse angefertigte Thoraxaufnahme zeigt, dass die Veränderungen verschwunden sind.
Pleuraerkrankungen
Pneumothorax
Als Pneumothorax bezeichnet man Luft im Pleuraraum. Meist entsteht er durch ein Trauma (wie z.B. Pfählungsverletzung oder Verkehrsunfall), häufig aber auch durch den Versuch, einen Subklaviavenenkatheter zu legen, oder nach einer Leberbiopsie (der Pleuraraum reicht zwischen Leber und lateraler sowie hinterer Bauchwand ziemlich weit nach kaudal). Ein Pneumothorax kann spontan auftreten (infolge der Ruptur einer Bulla) oder infolge einiger seltener Tumoren, wie der Histiozytosis X oder durch Metastasen eines Osteosarkoms.
Da der Pleuraraum kontinuierlich beide Lungen umfasst, steigt die Luft im Pleuraraum bei aufrechter oder halbaufrechter Position im typischen Fall in Richtung Lungenapex auf. Deshalb suche man einen Pneumothorax zu allererst im rechten und linken oberen Hemithorax (Abb. 3-70 ). Häufigstes Erscheinungsbild ist ein Bereich neben den Rippen, wo man keine Lungengefäßzeichnung sieht und wo eine zarte weiße Linie die Pleura visceralis darstellt, die durch Luft von der Pleura parietalis abgehoben wurde. Man suche sorgfältig nach dieser Linie, weil sie oft nur schwer vom Kortex der benachbarten Rippen zu unterscheiden ist. Ist der Pneumothorax klein und liegt die Pleuralinie hinter der Rippe, kann es nahezu unmöglich werden, sie zu sehen. Unter solchen Bedingungen kann es nützlich sein, neben der normalen Aufnahme in Inspiration eine Thoraxaufnahme in Exspiration anzufertigen. In der Exspirationsaufnahme wird die Lunge etwas dichter und kleiner. Das Gas im Pleuraraum verändert zwar nicht sein Volumen oder seine Dichte, aber der Pneumothorax wird bei Ausatmung relativ größer erscheinen (Abb. 3-71 ).
Abb. 3-70.

Apikaler Pneumothorax. Man sieht die dünne helle Linie der Pleura visceralis von der seitlichen Thoraxwand abgehoben (Pfeile). Man beachte, dass jenseits dieser Linie keine Lungengefäße sichtbar sind und die Linie gebogen verläuft. Die Pleuralinie ist weiß. Auf beiden Seiten der Linie – im Bereich des Pneumothorax und im Bereich des Lungengewebes – ist die Helligkeit annährend gleich.
Abb. 3-71.

Akzentuierung eines Pneumothorax. A. Bei diesem jungen Mann mit Thoraxschmerz ist in einer typischen Inspirationsaufnahme kein Pneumothorax nachweisbar. B. Bei der Exspiration wird die Lunge kleiner, während der Pneumothorax seine Größe beibehält (Pfeile). Deshalb erscheint er jetzt in der Relation größer und ist manchmal leichter sichtbar.
Wie stark die Lunge kollabiert, hängt davon ab, wie viel Luft in den Pleuraspalt gelangen kann. Bei Patienten mit Verklebungen zwischen Pleura visceralis und Pleura parietalis als Folge früherer entzündlicher Krankheiten oder Vernarbungen ist ein vollständiger Lungenkollaps gar nicht möglich, selbst wenn sich große Luftmengen im Pleuraspalt befinden. Gleiches gilt für Patienten mit diffuser Lungenkrankheit, weil deren relativ steife Lungen keinen vollständigen Kollaps zulassen.
Zu einer vollständig kollaptischen Lunge kann es folglich bei Patienten mit normalen Lungen und ohne Adhäsionen im Pleuraraum kommen. Dies kann mit einer Mediastinalverdrängung einhergehen. Wenn ein solcher Mediastinal-Shift eintritt, das Hemidiaphragma tief steht und Herz und Trachea zur Gegenseite abgedrängt sind, ist der Patient in einem möglicherweise lebensgefährlichen Zustand, dem so genannten Spannungspneumothorax (Abb. 3-72 ).
Abb. 3-72.

Spannungspneumothorax. A. In der p.-a. Thoraxaufnahme ist der linke Hemithorax sehr dunkel (oder transparent), weil die Lunge vollständig kollabiert ist (weiße Pfeile). Den Pneumothorax kann man daran erkennen, dass das Mediastinum und das Herz nach rechts abgedrängt sind (schwarze Pfeile) und das linke Hemidiaphragma abgeflacht ist und tief steht. B. Das CT-Bild eines anderen Patienten mit Spannungspneumothorax zeigt eine komplett kollabierte rechte Lunge (Pfeile). Das Mediastinum ist nach links abgedrängt.
Manchmal kommt es auch bei einem Pleuraerguss zu einem Pneumothorax. Dies ergibt in der Aufnahme im Stehen eine recht charakteristische geradlinige, horizontale Linie in Form eines Luft-Flüssigkeit-Spiegels in der Pleurahöhle. Man nennt dies einen Fluido- oder Seropneumothorax. Erkennt man eine geradlinige, horizontale Linie, die bis zur Thoraxwand reicht, sollte man an einen Seropneumothorax denken (Abb. 3-73 ). Manchmal sieht man einen Luft-Flüssigkeit-Spiegel infolge eines Abszesses innerhalb der Lunge selbst, doch ist dieser fast immer von einer breiten Wand umgeben und sollte somit leicht von einem Seropneumothorax zu differenzieren sein.
Abb. 3-73.

Seropneumothorax. Befinden sich im Pleuraraum Flüssigkeit und Gas, so erstreckt sich in einer Aufnahme im Stehen eine durch den Luft-Flüssigkeits-Spiegel verursachte, vollkommen gerade horizontale Linie über die gesamte Breite von der Wirbelsäule bis zum lateralen Rand der Pleurahöhle (Pfeile). Bei diesem Patienten ist ein abgekammerter basaler Pneumothorax vorhanden. Bei einem Lungenabszess nimmt der Spiegel meist nicht die gesamte Breite des Hemithorax ein.
Auch eine Hautfalte kann einem Pneumothorax ähneln. Dieses „Artefakt” wird durch die Haut des Patienten verursacht, die in Falten gelegt ist und gegen die Röntgenkassette gepresst wird. Am häufigsten sieht man diesen Effekt bei Patienten, die flach oder halb aufgerichtet auf dem Rücken liegen. Meist erscheint die Hautfalte als nahezu senkrechte Linie längs des äußeren Drittels der Lungenoberfelder. Man sollte in der Lage sein, dieses Artefakt zu erkennen, um nicht unnötigerweise eine Pleuradrainage bei solchen Patienten einzulegen. An folgenden Zeichen kann man dieses Artefakt erkennen:
-
▪
Oft zieht eine Hautfalte über die Lungenspitze hinweg in die Gewebe der Supraklavikulargrube.
-
▪
Vom Hilus ausgehend in Richtung Lungenperipherie wird bereits vor der Linie, die für einen möglichen Pneumothorax gehalten werden kann, eine zunehmende Verschattung (im Bild weiß) sichtbar. Liegt eine solche Verdichtung vor, der eine abrupte Dichteabnahme lateral der Linie folgt, handelt es sich wahrscheinlich um eine Hautfalte (Abb. 3-74 ). Bei einem kleinen Pneumothorax sind sowohl Lunge als auch Pneumothorax dunkel und sie werden voneinander durch eine schmale weiße Linie getrennt, bei der es sich um die Pleura visceralis handelt.
-
▪
Eine Hautfalte verläuft oft relativ gerade, während die Pleuralinie der Krümmung der Innenfläche der Thoraxwand folgt.
Abb. 3-74.

Hautfalten imitieren einen Pneumothorax. Man sieht, wie sich eine nahezu vertikale Linie auf den linken Hemithorax projiziert (Pfeile). Dies ist eine Hautfalte, die dadurch entsteht, dass der Patient gegen die Filmkassette gepresst wird. Eine Hautfalte kann man daran erkennen, dass sie über die Grenzen der Lunge hinwegzieht, jenseits der Linie Lungengefäße zu sehen sind oder, wie in diesem Fall, die Lunge vom Hilus bis zu dieser Linie immer dichter (oder weißer) wird und lateral der Linie dunkel erscheint. Bei einem Pneumothorax erscheinen medial und lateral der weißen Linie dunkle Flächen.
Da die Luft dazu neigt, in die jeweils höchste Position aufzusteigen, die sie im Pleuraspalt finden kann, kann es schwierig sein, einen kleinen oder mäßig großen Pneumothorax in einer a.-p. Aufnahme bei Rückenlage des Patienten nachzuweisen. Bei der Liegendaufnahme des Thorax verläuft der Strahl vertikal und der Pneumothorax sammelt sich horizontal im vorderen Thoraxbereich an. Für den Nachweis muss der Pneumothorax mindestens 500 ml groß sein. Bei auf dem Rücken liegenden Säuglingen und Kleinkindern ist der ventrale Pneumothorax häufig. Oft besteht die einzige Möglichkeit, den Pneumothorax zu sehen, darin, dass man eine Seitenaufnahme in Rückenlage vornimmt und in der retrosternalen Gegend nach einer Aufhellung (einem dunklen Bereich auf dem Film) sucht. Wie bereits erwähnt, findet man auch bei Schwerverletzten in der CT häufig einen kleinen vorderen Pneumothorax, der in der vorangehenden Röntgenaufnahme nicht erkennbar war (Abb. 3-75).
In der Rückenlageaufnahme des Thorax eines Erwachsenen ist eines der zuverlässigsten Zeichen des Pneumothorax der tiefe Randsinus (deep sulcus sign). Normalerweise sind die lateralen kostophrenischen Winkel ziemlich spitz. Der Pleuraraum reicht aber längs der Leber- und Milzaußenfläche tief herab. Befindet sich Gas im Pleuraraum, kann es leicht nach kaudal ziehen und den kostophrenischen Winkel oder Sulkus tiefer und den Randsinuswinkel spitzer erscheinen lassen, als er normalerweise ist. Wichtige Zeichen sind also ein extrem scharfer oder tiefer kostophrenischer Winkel oder ein Randsinus, der in Verlaufskontrollen des Thorax in Rückenlage immer tiefer und spitzer wird. In diesem Fall ist wahrscheinlich ein Pneumothorax vorhanden (Abb. 3-76 ). Es muss eine weitere Thoraxaufnahme am aufrecht sitzenden Patienten angefertigt werden, in der man dann oft einen apikalen Pneumothorax sieht. Die Luft verteilt sich bei Lageänderung typischerweise vom Sulkus in den Apexbereich um.
Abb. 3-76.
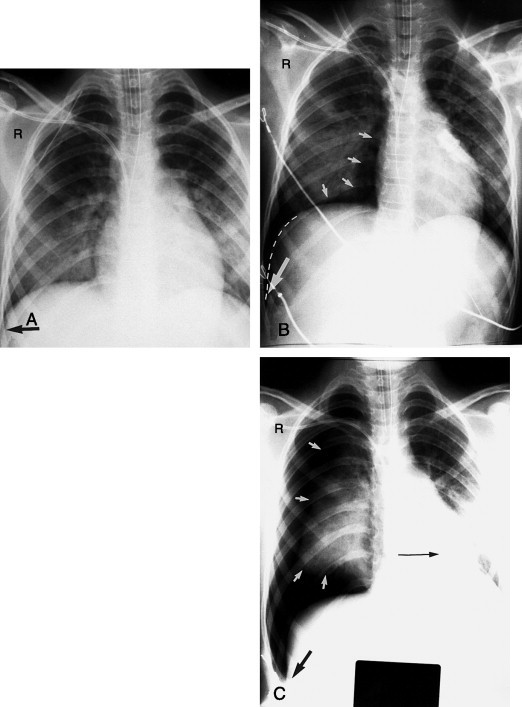
Deep sulcus sign bei Pneumothorax. A. In der p.-a. Aufnahme des Thorax ist der kostophrenische Randsinus normal spitzwinklig (Pfeil). B. Bei Rückenlage des Patienten befindet sich ein Pneumothorax oft ventral, medial und basal. In dieser Aufnahme desselben Patienten erscheinen der dunkle Bereich entlang des rechten Herzrands und der Lungenbasis größer (kleine Pfeile) sowie der kostophrenische Winkel viel tiefer als normal (großer Pfeil). C. Diese Befunde wurden nicht erkannt, weshalb sich bei dem Patienten ein Spannungspneumothorax mit extrem tiefem kostophrenischemWinkel (dicker schwarzer Pfeil), nahezu vollständigem Lungenkollaps (kleine weiße Pfeile) und Mediastinalverschiebung nach links (dünner schwarzer Pfeil) entwickelte.
Die meisten der beschriebenen Zeichen finden sich bei Situationen, in denen sich die Luft im Pleuraraum frei bewegen kann. Bei Patienten mit Zustand nach entzündlichen Prozessen und Adhäsionen im Pleuraraum kann sich die Luft möglicherweise nicht mehr frei bewegen, so dass man einen abgekammerten Pneumothorax vorfinden kann. Dieser kann schwer erkennbar sein. Bemerkt man einen (im Bild dunklen) Aufhellungsbereich an der Lungenoberfläche oder längs des Herzrands, muss man an die Möglichkeit eines abgekammerten Pneumothorax denken (Abb. 3-76B).
Hinsichtlich des angemessenen klinischen Managements eines Pneumothorax gibt es mehrere Ansätze. Oft wollen Kliniker wissen, wie groß ein Pneumothorax ist. Wenige Radiologen geben das Volumen als Prozentsatz an, dies ist jedoch sehr ungenau. Ich spreche den Klinikern gegenüber von einem kleinen, mittelgroßen oder großen Pneumothorax und einem Spannungspneumothorax. An Leichen durchgeführte Experimente zeigen, dass nach Einbringen von 50 ml Luft in den Pleuraraum der Lungenapex bis etwa zur Höhe des dorsalen Anteils der zweiten oder dritten Rippe absinkt. Ein Raum von 1 cm Breite lateral der Lunge stellt einen Pneumothorax von 10% dar. 2,5 cm Abstand zwischen lateraler Thoraxwand und Lungenrand bedeuten bereits einen Pneumothorax von ca. 30%.
Nach Einlegen einer Pleuradrainage achte man nicht nur auf die Größe des verbliebenen Pneumothorax und die Lage der Drainagenspitze, sondern auch auf die Seitenöffnung der Drainage, falls eine solche vorhanden ist. Man erkennt es als Unterbrechung der schattengebenden Linie in der Drainage. Diese sollte sich auf das Innere der Thoraxhöhle projizieren und nicht außerhalb in den Weichteilen liegen (vgl. Abb. 3-27B). Wurde eine Pleuradrainage sorgfältig platziert und an das Sauggerät angeschlossen, ist sie nicht verlegt und besteht der Pneumothorax dennoch fort, muss man an die Möglichkeit einer bronchopleuralen Fistel denken, die meist Folge eines stumpfen Traumas mit einer Ruptur im Verlauf eines größeren Bronchus ist. Weitere Möglichkeiten sind ein mehrfach gekammerter Pneumothorax oder ein ventraler Pneumothorax (bei dorsal liegender Pleuradrainage und Rückenlage des Patienten).
Nach der vollständigen Ausdehnung der Lunge kann man bei noch liegender Pleuradrainage eine leichte Kompressionsatelektase in den Lungenanteilen, die der Pleuradrainage anliegen, sehen. Auch ein bis zwei Tage nach Entfernen der Pleuradrainage kann dort noch eine geradlinige Verschattung zu sehen sein. Dies ist völlig normal und wird im Laufe etwa eines Tages verschwinden.
Pneumomediastinum
Luft im Mediastinum geht oft (wenn auch nicht immer) mit einem Pneumothorax einher. Bei einem Pneumomediastinum verlaufen die Luftansammlungen typischerweise senkrecht und befinden sich im oberen Mediastinal- und im unteren Halsbereich. In der Seitenaufnahme kann man manchmal Luft ventral oder dorsal der Luftröhre finden (Abb. 3-77 ). Ein Pneumomediastinum kann die Folge einer Ruptur von Trachea oder Bronchien sein, ein Krankheitsbild, das unbehandelt eine Letalität von bis zu 50% besitzt. Bei einem Patienten nach Trauma, der eine abnorme Luftansammlung im Thorax zeigt, die nach Platzieren einer Pleuradrainage nicht verschwindet, ist ein Pneumomediastinum zu vermuten.
Abb. 3-77.

Pneumomediastinum. A. Die vertikal verlaufenden dunklen (transparenten) Linien stellen Gas im Mediastinum dar. Meist kann man solche Linien oberhalb der Höhe des Aortenbogens sehen. In dieser p.-a. Aufnahme reichen sie bis in Höhe der unteren Halsweichteile (Pfeile). B. In der Seitenaufnahme kann man eine Ansammlung dunkler strichförmiger Luft ventral und dorsal der Luftröhre erkennen (Pfeile).
Manchmal ist es schwierig, zwischen einem Pneumomediastinum und einem Pneumoperikard zu unterscheiden. Bei einem Erwachsenen ist ein Pneumoperikard sehr selten und entsteht meist durch eine Stichverletzung. Man denke daran, dass das Perikard das Herz umhüllt und nach kranial nur bis in Hilushöhe reicht. Es breitet sich nicht um die Lungenwurzeln oder um die Pars ascendens der Aorta aus. Folglich sollte bei einem Pneumoperikard das Gas auf die Ränder der Herzhöhlen begrenzt sein und nicht weiter nach oben reichen (siehe Kapitel 5 und Abb. 5-4).
Subkutanes Emphysem
Luft in den Weichteilen der Thoraxwand wird oft durch ein stumpfes Trauma mit Pneumothorax und einigen Rippenfrakturen oder durch eine offene Verletzung, wie eine Durchspießung oder das Platzieren einer Pleuradrainage, verursacht. Gas in den Weichteilen erkennt man als dunkle geradlinige oder ovale Bereiche. Ein subkutanes Emphysem kann sich bis in die Supraklavikulargrube und die untere Halsregion ausbreiten. In einem solchen Fall muss man sich vergewissern, dass ein subkutanes Emphysem und nicht ein Pneumomediastinum vorliegt, das bis zum unteren Halsbereich aufgestiegen ist. Ein ausgedehntes subkutanes Emphysem kann den Pektoralismuskel durchsetzen und so ein bizarres fächerartiges Bild erzeugen, in dem die Luft Muskelfaserbündel konturiert (Abb. 3-78 ).
Abb. 3-78.
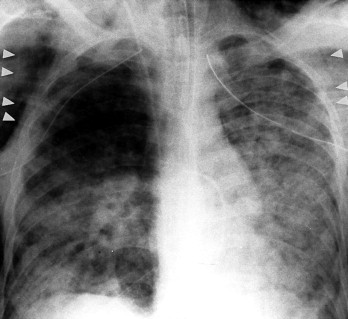
Subkutanes Emphysem. Man sieht hier Luft längs der lateralen Thoraxweichteile außerhalb des Rippenniveaus, die auch in den M. pectoralis eindringt und so die fächerförmigen dunklen Linien über dem oberen Thoraxbereich verursacht (Pfeilspitzen).
Pleuraerguss
Das Aussehen von Pleuraergüssen oder anderen Flüssigkeitsansammlungen hängt von deren Größe und Sitz ab. Pleuraergüsse sind in der Regel mindestens 100 ml groß, wenn man sie in einer Routineaufnahme des Thorax im Stehen erkennt. Typischer Ort eines Ergusses sind die schwerkraftabhängigen Anteile des Pleuraraums. Deshalb sieht man ihn am besten in Thoraxaufnahmen im Stehen. Abgestumpfte Randsinus erkennt man in der p.-a. oder a.-p. Aufnahme; einen verkürzten dorsalen Recessus costodiaphragmaticus sieht man in der seitlichen Aufnahme. Etwas größere Ergüsse können in den unteren Bereich der großen Lappenspalten hineinziehen (Abb. 3-79 ), sehr große Ergüsse verlagern und komprimieren das Lungengewebe.
Abb. 3-79.

Mäßig großer Pleuraerguss. A. Der abgestumpfte rechte Randsinus (Pfeile) in dieser Thoraxaufnahme im Stehen beruht auf einem Pleuraerguss. B. In der seitlichen Aufnahme sieht man, wie die Flüssigkeit in den großen Lappenspalt aufsteigt (schwarze Pfeile) und den dorsalen kostophrenischen Winkel ausfüllt (weiße Pfeile).
Die Erscheinungsbilder größerer Ergüsse variieren je nach der Position des Patienten während der Röntgenaufnahme. Bei der Thoraxaufnahme im Stehen bemerkt man eine zur Basis hin zunehmende Dichte sowie den Verlust der Grenzfläche zwischen normaler Lunge und dem Zwerchfell (Abb. 3-80A ). Es kann schwierig sein, sich festzulegen, ob man einen großen basalen Pleuraerguss oder basale alveoläre Infiltrate sieht. Liegt der Patient bei der Röntgenaufnahme auf dem Rücken, sammelt sich der Erguss typischerweise im dorsalen Pleuraraum. Da der Röntgenstrahl bei einer Rückenlageaufnahme vertikal verläuft, sieht man lediglich eine im Vergleich mit der Gegenseite relativ erhöhte Dichte des betreffenden Hemithorax (Abb. 3-80B). In Zweifelsfällen oder wenn man entscheiden möchte, ob ein Pleuraerguss frei beweglich ist, kann man eine Seitenlageaufnahme des Thorax anfertigen. Vermutet man einen rechtsseitigen Pleuraerguss, fordert man eine Rechtsseitenlageaufnahme an, d. h., der Patient liegt bei der Röntgenaufnahme auf der rechten Seite (Abb. 3-80C). Pleuraergüsse sind in CT-Bildern leicht erkennbar und gehen oft mit Krankheiten der Gasaustauschräume oder mit Atelektasen einher, die in Röntgenaufnahmen nicht einfach zu erkennen sind (Abb. 3-81 ).
Abb. 3-80.

Pleuraerguss abhängig von der Lagerung des Patienten. A. In einer p.-a. Aufnahme im Stehen verschattet ein großer Pleuraerguss das linke Hemidiaphragma, den linken lateralen Randsinus und den linken Herzrand. B. In der a.-p. Aufnahme in Rückenlage läuft die Flüssigkeit nach dorsal und bewirkt so eine diffuse Verschattung der beiden unteren Lungendrittel links; die linke Zwerchfellkontur bleibt erhalten. Dieser Befund kann leicht als Infiltrat oder Atelektase des linken Unterlappens fehlgedeutet werden. C. Bei der Aufnahme in Linksseitenlage bewegt sich der Pleuraerguss frei und verteilt sich längs der lateralen Thoraxwand (Pfeile). D. Die verschiedenen Befunde sind hier schematisch analog zu A-C für einen rechtsseitigen Pleuraerguss dargestellt.
Abb. 3-81.

Pleuraerguss in der Computertomographie. Das CT-Bild zeigt eine beidseitige dorsale Flüssigkeitsansammlung (Pfeile). Die Flüssigkeit ist weniger dicht als die Weichteile und die Pleura ist nicht verbreitert. Dies legt den Schluss nahe, dass es sich eher um Ergüsse als um ein Empyem handelt. Man beachte die Verdichtung der benachbarten Lungenareale durch eine Atelektase, ein bei mäßig großen oder großen Ergüssen häufiger Begleitbefund.
Pleuraergüsse bieten zwei weitere Erscheinungsformen, die so häufig sind, dass man sie kennen sollte: zunächst der subpulmonale Erguss, der nach meiner Erfahrung auf der rechten Seite häufiger ist. Typisch für einen solchen Erguss ist, dass das rechte Hemidiaphragma etwas höher als normal steht und der höchste Punkt der Kuppel weiter lateral als gewöhnlich liegt. Normalerweise befindet sich der höchste Punkt der Zwerchfellkuppel in Höhe der Medioklavikularlinie oder leicht medial von dieser. Liegt der höchste Punkt weiter lateral, muss man einen subpulmonalen Pleuraerguss vermuten (Abb. 3-82 ).
Abb. 3-82.

Subpulmonaler Erguss. A. Es kann das einzige Zeichen eines subpulmonalen Ergusses in einer Aufnahme im Stehen/Sitzen sein, dass der höchste Punkt der rechten Zwerchfellkuppel etwas weit lateral gelegen ist. In dieser Aufnahme kann man die tatsächliche Zwerchfellposition und damit den Erguss darüber erkennen, weil der Patient freie Luft unter dem Hemidiaphragma (Pneumoperitoneum) hat. B. Die normale Dicke des Zwerchfells kann man auf diesem Bild sehen, weil der Patient ein Pneumoperitoneum, aber keinen Pleuraerguss zeigt.
Ein in einer Lappenspalte abgekammerter Pleuraerguss ist mit einer intrapulmonalen Läsion verwechselbar (Pseudotumor). Bei sorgfältiger Untersuchung sind in einer Fissur abgekammerte Ergüsse typischerweise linsenförmig oder oval (nicht aber kreisrund) und liegen in der erwarteten Position in einer großen oder kleinen Fissur (Abb. 3-83 ).
Abb. 3-83.

Abgekammerter Pleuraerguss. Manchmal kann ein Pleuraerguss in Lappenspalten abgekammert sein. Man kann das in der p.-a. (A) und in der seitlichen Thoraxaufnahme (B) sehen. Die Pleuraergüsse sind spindelförmig, ihre Längsachsen verlaufen parallel zur großen bzw. kleinen Fissur.
Man kann Röntgenaufnahmen des Thorax nicht dafür heranziehen, zwischen Transsudat und Exsudat zu unterscheiden, doch lässt sich manchmal die Ursache eines Pleuraergusses ergründen. Sehr große Pleuraergüsse sind meist maligner Natur. Die Pankreatitis geht mit linksseitigen, die Leberzirrhose mit rechtsseitigen Ergüssen einher. Die meisten kardial bedingten Ergüsse sind beidseitig und mit einer Kardiomegalie sowie weiteren Zeichen der chronischen Linksherzinsuffizienz verbunden. Etwa 40% aller Pneumonien sind mit kleinen Pleuraergüssen vergesellschaftet. Kommt es bei einer Pneumonie zu einem mäßigen oder großen Pleuraerguss, sollte man an ein Empyem oder ein malignes Neoplasma denken.
Pleuraempyem
Bei einem Empyem befindet sich Eiter innerhalb der Pleurahöhle, und in 60% aller Fälle ist es Folge eines postinfektiösen Vorgangs, in 20% Folge einer Operation und in weiteren 20% traumatisch bedingt. Im Röntgenbild des Thorax kann ein Empyem einem Pleuraerguss oder einer Pleuraverbreiterung ähneln, es bewegt sich aber nicht frei und verteilt sich in der Seitenlageaufnahme nicht anders. Oft sieht ein Empyem elliptisch aus, wobei die Längsachse parallel zur Thoraxwand verläuft und die Lunge komprimiert oder abgedrängt wird. Empyeme sind oft gekammert und haben Septen in ihrem Inneren. Einfachste Art, Empyeme abzubilden und wegen einer eventuellen Drainage zu lokalisieren, ist die CT (Abb. 3-84 ). Mitunter kann ein Empyem Gas oder Luft enthalten; meist ist dies die Folge einer bronchopleuralen Fistel und wesentlich seltener durch gasbildende Bakterien oder vorausgehende Pleurapunktion bedingt. Im KM-verstärkten CT-Bild kann man ein Empyem auch anhand der verdickten oder Kontrastmittel aufnehmenden Pleura erkennen.
Abb. 3-84.

Empyem. Das CT-Bild zeigt eine links dorsal gelegene Flüssigkeitsansammlung (Pfeil), die (dunkles) Gas enthält und von verbreiterter Pleura umgeben ist. Die verbreiterte Pleura erscheint durch diese linsenförmige Flüssigkeitsansammlung gespalten (split pleura sign).
Pleuraverkalkung und Pleuratumor
Die meisten Pleuraverkalkungen sind Folge eines alten Empyems oder einer Asbestose. Die Verkalkung durch ein Empyem ist fast immer einseitig und kann recht dicht sein, wogegen nach Asbestexposition die Pleuraverkalkungen oft beidseitig vorkommen und nicht so dicht sind (Abb. 3-85 ). Ferner kann die Asbestose ein interstitielles bzw. retikulonoduläres Muster des Lungenparenchyms hervorrufen, mitunter auch ein „fransig” aussehendes Herz. Nach Asbestexposition können Mesotheliome entstehen, so dass eine fokale Raumforderung oder Verdickung der Pleura den Verdacht auf diesen Tumor lenken sollte. Man bedenke allerdings, dass der häufigste Tumor nach Asbestbelastung nicht das Mesotheliom, sondern das Bronchialkarzinom ist.
Abb. 3-85.

Asbestose. Sowohl die p.-a. (A) als auch die seitliche Thoraxaufnahme (B) zeigen Bereiche plaqueartiger Verkalkungen längs der Pleura und der Zwerchfellkontur (Pfeile). Oft projizieren sich Pleuraveränderungen auf das Lungenparenchym.
Krankheiten des Mediastinums
Eine große Zahl von Krankheiten nimmt ihren Ausgang im Mediastinum und ist in der p.-a. Thoraxaufnahme als Verbreiterung oder Vorwölbung in den zentralen Weichteilen des Thorax zu sehen. Die Differenzialdiagnose wechselt je nach Lokalisation der Läsion im Mediastinum. Zunächst muss man bestimmen, ob der pathologische Prozess im vorderen, mittleren oder hinteren Mediastinum liegt. Dabei kann das Silhouettenzeichen helfen, das bereits weiter oben beschrieben wurde.
Der einfachste Weg, eine Läsion zu lokalisieren, ist die Betrachtung des seitlichen Thoraxbilds. Es gibt mehrere Einteilungsschemata zu den Anteilen des Mediastinums und zu seinem Inhalt. Ich verwende vorderes, mittleres und hinteres Mediastinum, einige Autoren schließen auch einen oberen Teil mit ein. Ist der Raum hinter dem oberen Sternum und der Pars ascendens aortae ausgefüllt, handelt es sich höchstwahrscheinlich um eine Läsion des vorderen Mediastinums.
Grundsätzlich kommen vier Arten von Läsionen im vorderen Mediastinum vor: retrosternale Struma, Thymusläsionen, Keimzelltumoren (viel häufiger bei männlichen Patienten, Abb. 3-86 ) und maligne Lymphome. Manchmal vergrößern sich die retrosternalen Lymphknoten und die der Mammaria-interna-Kette durch Metastasen eines Mammakarzinoms oder bei Leukämie. Man kann sich die vorderen Mediastinaltumoren anhand der „vier T” merken, die für Thymom (Abb. 3-87 ), Läsionen der Thyreoidea, Teratom (Abb. 3-88 ) und T-Zell-Lymphom stehen. Eine benigne Normvariante ist das perikardiale Fettpolster (Abb. 3-89 ), das man fast immer im rechten Herz-Zwerchfell-Winkel vorfindet.
Abb. 3-86.

Seminommetastase. A. In der p.-a. Aufnahme eines 25 Jahre alten Patienten mit vergrößertem Hoden kann man deutlich einen Tumor (M) erkennen. Man beachte die erhaltene Kontur des hinteren Aortenbogens (AO), die anzeigt, dass dieser Tumor entweder vor oder hinter dem Aortenbogen, aber nicht direkt am Aortenbogen liegt. B. Die Seitenaufnahme zeigt einen Tumor des vorderen Mediastinums (M), in diesem Fall Metastasen eines Seminoms.
Abb. 3-87.

Thymom. A. Die Thoraxaufnahme lässt eine ungewöhnliche Kontur über dem linken Hilus erkennen (Pfeile). Dass der Hilus nicht ausgelöscht ist (kein Silhouettenzeichen), zeigt an, dass die Raumforderung entweder vor oder hinter dem Hilus liegen muss. B. Das CT-Bild weist eine Raumforderung direkt links des Truncus pulmonalis nach (Pfeil). Dies ist der häufigste Sitz eines Thymoms.
Abb. 3-88.

Mediastinales Teratom. A. Die Thoraxaufnahme zeigt eine große Raumforderung im rechten oberen Mediastinum (Pfeile). Es ist jedoch keine spezifische Binnenstruktur vorhanden. B. Das CT-Bild weist nach, dass der Tumor (Pfeil) zahlreiche Arten von Gewebeanteilen enthält, darunter Fett (dunkel), Weichteile (grau) und Calcium (weiß). Dies ist im Wesentlichen bereits für ein Teratom beweisend.
Abb. 3-89.

Perikardiales Fettpolster. Man sieht im p.-a. Thoraxbild (A) einen Weichteiltumor im rechten Herz-Zwerchfell-Winkel (Pfeile), den man auch in der seitlichen Aufnahme (B) erkennt. In diesem Bild sind vorderes (A), mittleres (M) und hinteres (P) Mediastinum eingezeichnet.
Zu den Läsionen des mittleren Mediastinums zählen das thorakale Aortenaneurysma, Hämatome, Neoplasien, Lymphadenopathie (Abb. 8-90), Ösophagusläsionen, Zwerchfellhernien (Hiatus- oder Morgagni-Typ) und Duplikationszysten. Morgagni-Hernien bevorzugen die rechte Seite. Jede Läsion des mittleren Mediastinums direkt neben der Aorta sollte bis zum Beweis des Gegenteils als Aortenaneurysma gelten.
Die dorsalen Mediastinalläsionen sieht man in der seitlichen Aufnahme auf die Wirbelsäule projiziert und in der sagittalen Projektion paravertebral gelegen. Die meisten Läsionen des hinteren Mediastinums sind neurogen (90%). Es kann sich bei Kindern um Neuroblastome, bei Erwachsenen eher um Neurofibrome, Schwannome oder Ganglionneurome handeln. Weitere Läsionen des hinteren Mediastinums sind Hernien (Hiatus- oder Bochdalek-Hernie), Neoplasien, Hämatome oder eine extramedulläre Hämatopoese. Bochdalek-Hernien finden sich meist auf der linken Seite.
Zwerchfellruptur
Nach einem stumpfen Bauchtrauma kann es zu einer Zwerchfellruptur kommen. Dabei reißt das Zwerchfell meist auf der linken Seite, vermutlich weil die Leber die Kräfte nach dem Schlag gegendenBauch rechts mindert und so dieWahrscheinlichkeit einer rechtsseitigen Zwerchfellruptursenkt. HäufigsteManifestation sind Darmschlingen, die in den unteren Brustkorb übertreten, wobei die normale kuppelförmige Struktur des Hemidiaphragmas fehlt (Abb. 3-91 ). Ein Zwerchfellriss kann sich auch spät manifestieren, manchmal tritt der Darm erst ein bis zwei Wochen nach dem Trauma als Hernie in den Thoraxraum über. Dabei kann der Patient Monate bis Jahre beschwerdefrei bleiben.
Abb. 3-90.
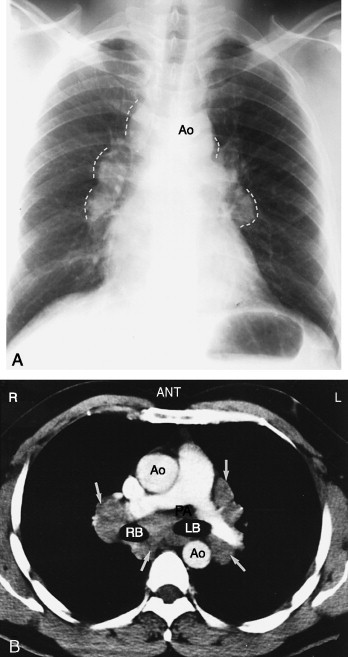
Sarkoidose. A. Man sieht beidseits in der Hilusregion wie auch paratracheal rechts eine ausgedehnte Lymphadenopathie. B. Das kontrastmittelverstärkte axiale CT-Bild des oberen Thoraxbereichs zeigt deutlich Aorta ascendens und descendens (Ao), Pulmonalarterie (PA), obere Hohlvene und beide Stammbronchien (RB, LB). Pfeile markieren die ausgedehnte Lymphadenopathie (vgl. auch Abb. 3-55 zur alveolären Form der Sarkoidose).
Abb. 3-91.

Zwerchfellruptur. Sechs Tage nach einem Autounfall kann man hier Darmschlingen im linken unteren Thoraxbereich sehen (Pfeile). Zwechfellrupturen kommen häufiger auf der linken als auf der rechten Seite vor.
Lehrbuchempfehlungen zum Thema
- Fraser RS, Muller C, Pare PD. Fraser and Pare's Diagnosis of Diseases of the Chest. 3rd ed. WB Saunders; Philadelphia: 1999. [Google Scholar]
- Muller NL, Fraser RS, Coleman N, Pare PD. Radiologic Diagnosis of Diseases of the Chest. 1st ed. WB Saunders; Philadelphia: 2001. [Google Scholar]
- Naidich DP, Webb R, Muller NL, Zerhouni EA, McGuiness G, Webb WR, Krinsky GA, Siegelman SS. Computed Tomography and Magnetic Resonance Imaging of the Thorax. 3rd ed. Lippincott Williams & Wilkins; Philadelphia: 1999. [Google Scholar]
- Reed JC. Chest Radiology: Plain Film Pattern and Differential Diagnosis. 5th ed. WB Saunders; Philadelphia: 2003. [Google Scholar]
- Webb WR, Muller NL, Naidich DP. High Resolution CT of the Lung. Lippincott Williams & Wilkins; Philadelphia: 1999. [Google Scholar]
- Lange S. Radiologische Diagnostik der Thoraxorgane. 3. Aufl. Thieme; Stuttgart: 2004. [Google Scholar]
- Gurney JW, Winer-Muram HAT. PocketRadiologist Thorax – Die 100 Top-Diagnosen. 1. Aufl. Elsevier Urban & Fischer; München: 2003. [Google Scholar]


