Abstract
朗格汉斯细胞组织细胞增生症在临床上以颅骨多见,较少发生于下颌骨。本文报道1例下颌骨朗格汉斯细胞组织细胞增生症,并结合文献探讨朗格汉斯细胞组织细胞增生症的病因、临床病理表现、诊断及治疗。
Keywords: 朗格汉斯细胞组织细胞增生症, 下颌骨, 临床病理
Abstract
Langerhans cell histiocytosis is commonly found in cranial bones and rarely found in the mandible. This article presents a case of mandibular Langerhans cell histiocytosis and discusses its pathogeny, clinical features, diagnosis, and treatment.
Keywords: Langerhans cell histiocytosis, mandibule, clinicopathology
朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)在各年龄段均可发生,以儿童及青少年多见,临床表现多样,可为从单一脏器病变至危及生命的多脏器损害,最易累及颅骨等骨组织,较少发生于下颌骨。本文报道下颌骨朗格汉斯细胞组织细胞增生症1例,并结合文献探讨朗格汉斯细胞组织细胞增生症的病因、临床病理表现、诊断及治疗。
1. 病例报道
患者,男,5岁,2018年2月以左侧下颌后牙疼痛1月、面部肿痛2周就诊。患者1月前自觉左侧下颌后牙疼痛就诊于成都市某诊所,口服消炎药(具体药名及剂量不详),自觉疼痛略好转。2周前患者疼痛反复发作,于当地诊所行冲洗治疗,症状无好转,左侧面部开始肿胀。3 d前于外院行输液治疗,无明显改善,肿胀疼痛加重。患者2018年2月28日就诊于四川大学华西口腔医院急诊,螺旋CT提示“左侧下颌骨骨质溶解破坏”,以“左侧下颌骨包块(骨髓炎?)”收治入院。患者一般情况尚可,饮食睡眠佳,体重无明显改变。
体格检查:体温36.9 °C,呼吸19次·min−1,脉搏112次·min−1,血压14.67/10.53 kPa。患者发育正常,营养中等,神志清楚,皮肤及巩膜无黄染,头颅正常,耳眼鼻未见明显异常,气管居中,胸廓对称无畸形,两肺呼吸音清,心律齐,腹部平软,肝脏脾脏未触及肿大,肠鸣音正常,脊柱四肢查体未见特殊。
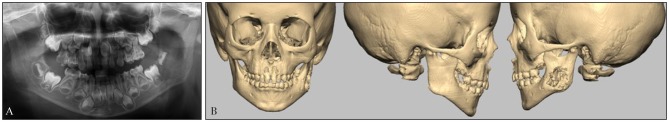
专科检查:患者面部不对称,左侧面颊部明显肿胀,累及腮腺咬肌区(图1A),皮肤紧张,质硬,按压疼痛。口内见覆 覆盖正常,55、65、75、85牙龋坏,开口度小于一横指(图1B),开口型正常。双侧面部及颈部未扪及淋巴结肿大。
覆盖正常,55、65、75、85牙龋坏,开口度小于一横指(图1B),开口型正常。双侧面部及颈部未扪及淋巴结肿大。
图 1. 术前面部观.
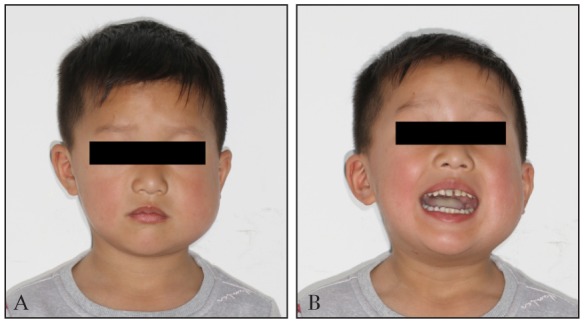
Fig 1 Preoperative facial view
A:患者面部不对称,左侧面颊部明显肿胀,累及腮腺咬肌区。B:患者开口度小于一横指,开口型正常。
曲面断层片及螺旋CT示:左下颌角及升支骨质见类圆形透射区,边界不清,边缘粗糙,波及D67牙胚,牙囊壁不完整,D6牙根似有吸收,D7牙胚向远中移位,左下颌神经管影像局部消失。左下颌骨下后缘密质骨未见确切骨膜反应征像。影像诊断:左下颌骨破坏征象,考虑骨髓炎改变,不排除嗜酸性肉芽肿,请结合临床(图2)。
图 2. 术前全景片及CT.
Fig 2 Preoperative panoramic radiograph and CT
A:全景片;B:颅面部CBCT,左下颌角及升支骨质见类圆形透射区,边界不清,边缘粗糙,波及D6、D7牙胚。
治疗:在全身麻醉下行“左侧下颌骨病灶清除活检术”,术中刮除病变区组织,术后给予抗感染、消肿及支持治疗,之后转至四川大学华西医院肿瘤科行放射治疗。
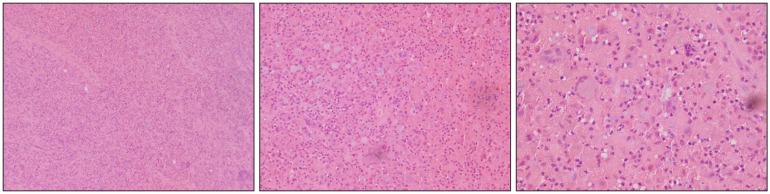
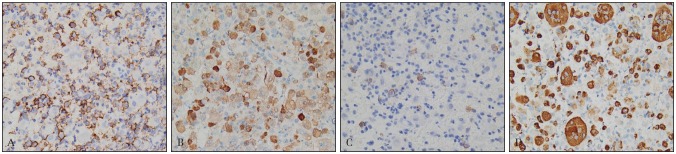
术后组织病理学检查示:左下颌骨富含巨细胞的增生性病变,多核巨细胞及嗜酸性粒细胞呈灶性浸润,倾向LCH,建议进行免疫组织化学染色后进一步确诊(图3)。免疫组织化学染色:CD68/磷酸葡萄糖变位酶1(phosphoglucomutase 1,PGM-1)(+)、S-100(+)、CD1a(部分+)、朗格汉斯细胞特异性凝集素Langerin(少数+)。BRAF基因突变检测:15号外显子点突变(V600E)(图4)。诊断:左下颌LCH。
图 3. 术后病理 苏木精-伊红.
Fig 3 Postoperative pathology hematoxylin-eosin
从左到右的放大倍数分别为100、200、400倍,可见大量的组织细胞呈肿瘤样增生,细胞核呈不规则扭曲状、牙瓣状、肾形和胚胎形等,胞质较宽,呈淡粉染或透明状。
图 4. 术后病理 免疫组织化学 × 400.
Fig 4 Postoperative pathology immunochemistry staining × 400
A:CD1a(定位于细胞膜,部分+);B:S-100(定位于细胞核,少数在细胞浆,+);C:Langerin/CD207(定位于细胞浆或者细胞膜,少数+);D:CD68/ PGM-1(定位于细胞浆或者细胞膜,+)。
2. 讨论
LCH,原称组织细胞增生症X,世界卫生组织分类(2016版)中将LCH划归为造血与淋巴组织肿瘤中的组织细胞和树突细胞肿瘤范畴[1]。根据病变累及范围和临床表现,LCH可分为3种基本类型:单灶性LCH、单系统多灶性LCH、多系统多灶性LCH。
LCH的病因尚不清楚,多认为与吸烟、免疫功能异常、病毒感染、代谢性紊乱性疾病有关,也有研究[2]–[3]表明LCH中细胞呈克隆性生长,认为LCH为肿瘤性起源。LCH中BRAF癌基因突变频率高,其突变率为48.5%[4],该基因突变被认为在LCH发病中发挥着重要的作用。BRAF是一种由RAS偶联的受体络氨酸激酶活化的蛋白激酶,在RAS-RAF-MEK-ERK信号通路中发挥着重要作用,参与细胞分裂周期、增殖及凋亡等生物学功能的调节。研究[5]发现,BRAF癌基因的点突变多位于第15和11外显子上, 其中80%~90%突变是发生在第15外显子1 799位的核苷酸。多种良恶性肿瘤(痣、甲状腺乳头状癌、毛细胞星形细胞瘤、恶性黑色素瘤等)中均存在高频率的BRAF V600E突变[6]。在临床上,BRAF抑制剂作为治疗LCH的靶向药物开始应用[7]。但关于BRAF激酶抑制剂靶向治疗LCH的研究较少,因此尚需要大样本数据进一步支持其治疗的有效性及安全性。
LCH的组织病理学特点是朗格汉斯细胞异常增生,伴嗜酸性粒细胞和其他炎细胞浸润。不同病变类型中,各细胞数量不等,也可出现泡沫细胞和多核巨细胞。异常增生的朗格汉斯细胞呈圆形或卵圆形,体积较大,不具备树突状凸起,核呈圆形或不规则,有核沟凹痕或分叶。LCH的诊断常需结合临床表现、影像学检查及病理学检测进行,美国组织细胞学会协作组提出了LCH三级诊断标准,即初步诊断、明确诊断和最终诊断[8]。最终诊断是在前面诊断的基础上,电镜查到朗格汉斯细胞中的Birbeck颗粒或CD1a阳性、Langerin(CD207)阳性。目前分子病理学及超微结构病理学的诊断技术在LCH的最终诊断中占有重要地位。Birbeck小体是朗格汉斯细胞独特的细胞超微结构,具有很重要的诊断价值。该颗粒在电镜下为长度不一的小管状或网球拍状结构,本质为细胞膜内陷,功能尚不清楚。但即使在电镜下典型的朗格汉斯细胞也并非全部都能够查见Birbeck小体,研究显示仅2%~69%的朗格汉斯细胞查见典型的Birbeck小体[9]。因此,即使电镜下未查见Birbeck小体,只要表现出典型的苏木精-伊红染色表现及免疫表型仍可诊断为LCH。由于电镜检测阳性率不高、费用高昂、需要特殊仪器、容易出现组织固定欠佳等问题,在临床上应用并未广泛开展。
目前用于LCH诊断的主要标志物包括:Langerin、CD1a、S-100、CD68/PGM-1等。Langerin是朗格汉斯细胞产生的特异性凝集素,是选择性表达于表皮内朗格汉斯细胞的分子,通过与细胞膜甘露醇结合,诱导细胞内Birbeck颗粒形成,属于高度特异的朗格汉斯细胞标志物[10]。正常情况下Langerin表达于朗格汉斯细胞聚集的组织,包括表皮、支气管黏膜、淋巴结等,位于细胞膜和细胞质[11]。Langerin可能只表达于未成熟的朗格汉斯细胞,但在非朗格汉斯细胞也有表达[12]。CD1a抗原是一种糖蛋白,可以在朗格汉斯细胞、真皮的树突细胞和皮质胸腺细胞等中表达,定位于细胞膜。CD1a可以在不同部位及不同阶段的LCH被检测到,被认为最具有诊断特异性,但其也存在一定的假阴性率[13]。S-100属于钙结合蛋白,定位于细胞浆和细胞核,其阳性的朗格汉斯细胞往往呈灶状或片状分布,阳性率高,敏感性接近100%,但由于特异性差,其他细胞亦可呈阳性表达,因此仅仅S-100阳性并不能诊断为LCH,因此仅具有初步诊断价值,尚需结合其他标志物分析。CD68/PGM-1(+)属于Ⅰ型跨膜糖蛋白,位于吞噬体或溶酶体中,在细胞表面较少表达。CD68是髓单核细胞标志,在单核细胞和巨噬细胞表达,朗格汉斯细胞中可表达于细胞质或细胞膜,CD68可起到辅助LCH的诊断[14]。
根据LCH的临床表现、组织病理特征,结合电镜及免疫组织化学技术,可以对口腔颌面部的LCH做出诊断,但仍需要注意与相关颌面部疾病进行鉴别。骨LCH在影像学及临床表现上应与骨髓炎、原发性骨肿瘤以及其他类型的组织细胞增生性疾病相鉴别。1)骨髓炎与LCH在临床及影像学表现上较难以区分,在病理学上骨髓炎表现为炎症细胞浸润,常可见死骨成分,嗜酸性粒细胞及典型的朗格汉斯细胞少见,而LCH的死骨并不多见。本文病例在入院时曾诊断为颌骨骨髓炎,术后病理确诊为LCH。2)原发性骨肿瘤。原发性骨肿瘤在X线片上可以表现出骨质破坏及骨膜反应等,有时与骨LCH难以区分,但通过组织病理学及特异的免疫组化检查可将二者鉴别。LCH镜下常有多少不等的多核巨细胞,因此须与颌骨的巨细胞病变加以鉴别诊断。1)巨细胞肉芽肿。巨细胞肉芽肿好发于20~30岁,女性稍多,下颌骨前牙区多见。X线表现为界限清楚的密度减低区。镜下可有多个出血坏死灶或新骨形成区,周围聚集多核巨细胞,巨细胞较小,但无典型的朗格汉斯细胞。2)骨巨细胞瘤。骨巨细胞瘤少见,好发于25岁以上成年人,表现为生长迅速的肿块,伴疼痛或下唇麻木。X线多为多囊性骨破坏。组织病理特征为体积较大的巨细胞,分布均匀,但细胞核向中心聚集。3)甲状旁腺机能亢进。颌骨肿大、牙松动移位、肾病为诊断甲状旁腺机能亢进的重要三组表现,同时血清学检查可见血清钙和血清碱性磷酸酶增加。镜下见较多的多核巨细胞、血管外细胞聚集和含铁血黄素沉积,吸收区可见反应性新骨形成。
目前LCH的治疗手段主要包括手术、放疗及化疗,主要依据病变部位及受累范围选择不同的治疗手段[15]。单骨LCH的预后良好,可有自愈倾向,病灶可以手术刮除或局部放疗;骨多病灶损害的LCH患者,可采用放疗、局部化疗或联合使用;累及多脏器者可行全身化疗,对于顽固性病变可采用骨髓移植辅以高剂量放疗及化疗的方法[14]。
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 2.Willman CL, Busque L, Griffith BB, et al. Langerhans'-cell histiocytosis (histiocytosis X): a clonal proliferative disease[J] N Engl J Med. 1994;331(3):154–160. doi: 10.1056/NEJM199407213310303. [DOI] [PubMed] [Google Scholar]
- 3.Allen CE, Li LN, Peters TL, et al. Cell-specific gene expression in Langerhans cell Histiocytosis lesions reveals a distinct profile compared with epidermal Langerhans cells[J] J Immunol. 2010;184(8):4557–4567. doi: 10.4049/jimmunol.0902336. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Bubolz AM, Weissinger SE, Stenzinger A, et al. Potential clinical implications of BRAF mutations in histiocytic proliferations[J] Oncotarget. 2014;5(12):4060–4070. doi: 10.18632/oncotarget.2061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.许 霞, 聂 秀. 朗格汉斯细胞组织细胞增生症发病机制的研究进展[J] 临床与实验病理学杂志. 2015;31(12):1392–1395. [Google Scholar]; Xu X, Nie X. Progress on the pathogenesis of Langerhans cell histiocytosis[J] Chin J Clin Exp Pathol. 2015;31(12):1392–1395. [Google Scholar]
- 6.Davies H, Bignell GR, Cox C, et al. Mutations of the BRAF gene in human cancer[J] Nature. 2002;417(6892):949–954. doi: 10.1038/nature00766. [DOI] [PubMed] [Google Scholar]
- 7.Haroche J, Cohen-Aubart F, Emile JF, et al. Dramatic efficacy of vemurafenib in both multisystemic and refractory Erdheim-Chester disease and Langerhans cell Histiocytosis harboring the BRAF V600E mutation[J] Blood. 2013;121(9):1495–1500. doi: 10.1182/blood-2012-07-446286. [DOI] [PubMed] [Google Scholar]
- 8.Chou T, D'Angio GJ, Favara BE, et al. Histiocytosis syndromes in children. Writing group of the histiocyte society[J] Lancet. 1987;1(8526):208–209. [PubMed] [Google Scholar]
- 9.Brabencova E, Tazi A, Lorenzato M, et al. Langerhans cells in Langerhans cell granulomatosis are not actively proliferating cells[J] Am J Pathol. 1998;152(5):1143–1149. [PMC free article] [PubMed] [Google Scholar]
- 10.Valladeau J, Ravel O, Dezutter-Dambuyant C, et al. Langerin, a novel C-type lectin specific to Langerhans cells, is an endocytic receptor that induces the formation of Birbeck granules[J] Immunity. 2000;12(1):71–81. doi: 10.1016/s1074-7613(00)80160-0. [DOI] [PubMed] [Google Scholar]
- 11.Chikwava K, Jaffe R. Langerin (CD207) staining in normal pediatric tissues, reactive lymph nodes, and childhood histiocytic disorders[J] Pediatr Dev Pathol. 2004;7(6):607–614. doi: 10.1007/s10024-004-3027-z. [DOI] [PubMed] [Google Scholar]
- 12.Lau SK, Chu PG, Weiss LM. Immunohistochemical expression of Langerin in Langerhans cell histiocytosis and non-Langerhans cell histiocytic disorders[J] Am J Surg Pathol. 2008;32(4):615–619. doi: 10.1097/PAS.0b013e31815b212b. [DOI] [PubMed] [Google Scholar]
- 13.Krooks J, Minkov M, Weatherall AG. Langerhans cell histiocytosis in children: diagnosis, differential diagnosis, treatment, sequelae, and standardized follow-up[J] J Am Acad Dermatol. 2018;78(6):1047–1056. doi: 10.1016/j.jaad.2017.05.060. [DOI] [PubMed] [Google Scholar]
- 14.Krooks J, Minkov M, Weatherall AG. Langerhans cell histiocytosis in children: history, classification, pathobiology, clinical manifestations, and prognosis[J] J Am Acad Dermatol. 2018;78(6):1035–1044. doi: 10.1016/j.jaad.2017.05.059. [DOI] [PubMed] [Google Scholar]
- 15.周 云, 刘 秋玲. 朗格汉斯细胞组织细胞增生症的发病机制及诊治进展[J] 中华灾害救援医学. 2017;5(2):106–110. [Google Scholar]; Zhou Y, Liu QL. Progress on Langerhans cell Histiocytosis: pathogenesis, diagnosis and treatment[J] Chin J Disaster Med. 2017;5(2):106–110. [Google Scholar]