Abstract
目的
系统评价干细胞对面神经缺损的修复效果。
方法
在Pubmed、Cochrane Library、Web of Science、Embase、Scopus及中国生物医学文献数据库检索关于评价干细胞对动物面神经再生效果的所有原始研究,2名专业人员独立完成文献筛选、数据提取及偏倚风险评估。使用RevMan 5.3软件及随机效应模型进行统计分析,分析结果以均数差(MD)及95%可信区间(CI)的形式呈现。对面神经的功能性评估(胡须运动评分、面瘫评分)及组织学评估(有髓纤维密度、纤维直径、髓鞘厚度、G比值)结果进行Meta分析。
结果
从6个数据库共检索出4 614篇文献,15篇被纳入了Meta分析。干细胞组的胡须运动评分、面瘫评分、有髓纤维密度、髓鞘厚度均高于非干细胞组(P<0.05),G比值小于非干细胞组(P=0.001),纤维直径二者无统计学差异(P=0.08)。
结论
干细胞具有促进面神经再生的潜能。
Keywords: 干细胞, 面神经, 神经组织工程, 系统评价
Abstract
Objective
To systematically evaluate the repairing effect of stem cells on facial nerve defects.
Methods
Articles regarding the regenerating effect of stem cells on facial nerves in animals were collected from the databases of Pubmed, Cochrane Library, Web of Science, Embase, Scopus, and CBM. Two professionals independently completed the article screening, data extraction, and bias risk assessment. RevMan 5.3 and random-effects models were used for the statistical analysis, and the results were presented in the form of mean differences (MD) with a 95%CI. The results of functional evaluation (vibrissae movement, facial paralysis) and histological evaluation (density of myelinated fibers, diameter of fibers, thickness of myelin sheath, G ratio) of facial nerve were Meta-analyzed.
Results
A total of 4 614 articles were retrieved from the 6 databases, and 15 of these articles were included in the Meta-analysis. For vibrissae movement and facial paralysis, the stem cell group scored significantly higher than the non-stem cell group (P<0.05). The density of myelinated fibers and thickness of the myelin sheath in the stem cell group were higher than those in the non-stem cell group (P<0.05). The G ratio in the stem cell group was smaller than that in the non-stem cell group (P=0.001). There was no significant difference in fiber diameter (P=0.08).
Conclusion
Stem cells have potential in promoting facial nerve regeneration.
Keywords: stem cell, facial nerve, neural tissue engineering, systematic review
面神经是以运动神经为主的混合神经,主要支配面部表情肌和传导舌前2/3的味觉及支配舌下腺、下颌下腺和泪腺的分泌[1]。面神经损伤是颌面部较常见的损伤类型之一。腮腺肿瘤手术、创伤和岩骨手术等均有可能伤及面神经[2]。面神经损伤可引起面部肌肉运动障碍,导致额纹消失、眼睑闭合不全、鼻唇沟消失、鼓腮无力、口角下垂及流涎等功能障碍[1],给患者带来极大的心理压力。面神经断裂后,可通过吻合神经断端的方式对其进行修复。然而,当神经缺损较多、缝合张力过大时,首先是要缩小缺损间隙。虽然许多现代显微外科技术可用于面神经修复,但其对面部功能的修复效果有时仍不能令人满意,甚至有可能产生骨性麻痹综合征[3]。自体神经移植一直都是修复神经缺损的金标准[4]。然而,自体神经移植技术也存在供体神经数量有限、瘢痕形成、伤口感染、伤口疼痛、手术时间相对较长等局限性。因此,为临床医务人员及患者提供行之有效的修复面神经缺损的方法是一个亟待解决的问题。
基因和组织工程的应用使学者们联想到使用神经组织工程技术进行面神经修复。神经组织工程主要包括三个方面:人工神经导管、神经生长因子和细胞[5]。在过去的二十年里,使用干细胞修复周围神经损伤持续受到学者们的关注[6]。干细胞是一类具有多向分化潜能和自我复制能力的原始未分化细胞,是形成哺乳类动物各组织器官的原始细胞[7]。干细胞主要通过发挥抗炎作用,分泌生长因子,替代雪旺细胞(Schwann cells,SCs)和运动神经元等方式促进神经再生[6]。神经干/祖细胞(neural stem/progenitor cells,NS/PCs)在治疗神经性疾病(如脊髓损伤,脑损伤,周围神经损伤)方面具有应用前景[8]–[9]。神经干细胞(neural stem cells,NSCs)具有以下特征:1)具有多向分化潜能及可形成3种成熟的神经细胞(神经元、星形胶质细胞和少突胶质细胞);2)在神经组织损伤后产生同源的新细胞;3)可以被连续移植;4)可以自我更新[10]。由于SCs能够促进髓鞘的形成,因此其在神经再生过程中起着重要的作用[11]。间充质干细胞(mesenchymal stem cells,MSCs)是一种能分化为雪旺样细胞的多能成体干细胞[12]–[14],常见的为脂肪间充质干细胞(adipose-derived stem cells,ADSCs)和骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),分别是来源于脂肪组织和骨髓的多能成体干细胞。充足的来源、易获得性、能快速增殖、可多向分化及易于与宿主整合等特点,使得其成为促进神经再生的一个理想的细胞来源[12],[14]。脂肪来源、骨髓来源、海马神经来源的干细胞促进周围神经再生的实验已取得理想的结果[15]–[16]。其他来源的干细胞,如牙髓干细胞(dental pulp stem cells,DPSCs)、牙龈间充质干细胞(gingiva-derived mesenchymal stem cells,GMSCs)、人类嗅黏膜干细胞(human olfactory stem cells,HOSCs)、基质血管成分细胞(stromal vascular fraction,SVF)在动物模型上也收到了令人满意的神经再生效果[7],[17]–[20]。
虽然关于干细胞促进面神经再生的基础实验取得了令人满意的结果,但人们仍不能确定干细胞是否能够真正有效地促进面神经再生,是否有必要对这一领域进行进一步探索,且需要后效评估以往实验中动物模型的使用是否得当,降低将动物实验所获得的结果引入临床的风险。因此,有必要针对干细胞是否能够促进动物面神经再生这一问题进行系统的评价。本文的主要目的即为系统地评价干细胞对面神经缺损的组织学修复效果。
1. 材料和方法
本研究系统评价是遵照系统评价和Meta分析优先报告的条目(Preferred Reporting Items for Systematic Reviews and Meta Analyses,PRISMA)的规范来制定的[21]。
1.1. 注册
参与研究的人员在实施系统评价前制定了详细的计划书,于2018年10月25日在PROSPERO网站(https://www.crd.york.ac.uk/prospero/)提交注册申请,11月16日注册成功。注册编号是CRD42018113065。
1.2. 纳入及排除标准
根据本系统评价的目的,研究人员制定了如下标准来选择合适的研究。纳入标准:1)关于干细胞促进面神经再生的研究;2)主要干预措施为干细胞;3)神经完全断裂的研究;4)动物实验。排除标准:1)未达到纳入要求的研究;2)主要干预措施不是干细胞;3)神经拉伤等无缺损的研究;4)主要修复对象不仅为面神经,还包括周围组织的研究;5)动物实验以外的研究(病例报告、综述、评论等);6)体外研究;7)无法获得全文的研究;8)数据结果不可靠的研究;9)重复报告。
1.3. 检索策略
为了全面广泛地搜集原始资料,研究人员在Pubmed、Cochrane Library、Web of Science、Embase、Scopus及中国生物医学文献数据库检索了2018年10月25日前的所有原始研究。在英文数据库中,将干细胞与面神经及面神经缺损的各种英文表达方式作为关键词,使用布尔逻辑“AND”进行检索。中文检索式:干细胞和面神经。同时,研究人员手工检索了所纳入研究的参考文献。
1.4. 数据提取及合成
由2名专业的筛选者各自独立完成文献筛选工作。首先运用EndNote X8软件查找并排除重复文献;再由2名筛选者阅读文献的题目和(或)摘要,行初步筛选;最后,2名筛选者阅读剩余文献全文行进一步筛选,同时标注文献排除的理由。当2人对文献是否纳入(或排除)存在争议时,通过征求第三方专业人员的意见达成了共识。对所有纳入的研究进行了描述性分析,将实验组使用导管和干细胞、对照组(非干细胞组)仅使用导管,且2组均含有可用数据的研究纳入Meta分析。针对有多个随访时间的研究,仅提取最后时间点的数据。当结果以图形而非具体数据的形式展现出来的时候,使用GetData Graph Digitizer 2.26软件提取出了所需数据。当原始研究中未给出具体的标准差信息时,使用给定的标准误、可信区间、t值、P值等信息进行标准差的推断[22]。对于使用各种方法仍无法获得标准差、均数及各组样本量等具体信息的研究,不纳入Meta分析。当研究设立多个以干细胞为干预措施的实验组时,将各实验组视为亚组,并对亚组数据进行整合形成一个实验组。若出现一个以上对照组,按同样方法处理[22]。使用四舍五入法保留两位小数。
1.5. 偏倚风险评估与质量评价
2名研究人员采用动物实验系统评价研究中心(the Systematic Review Centre for Laboratory Animal Experimentation,SYRCLE)的动物实验偏倚风险评估工具[23],按照低风险、高风险及不确定风险对每一篇纳入的研究独立进行偏倚风险评估及质量评价。
1.6. 数据分析
采用RevMan 5.3软件及随机效应模型进行统计分析,结果以均数差(MD)及95%可信区间(confidence interval,CI)的形式呈现。
对面神经的功能性评估(胡须运动评分、面瘫评分)及组织学评估(有髓纤维密度、纤维直径、髓鞘厚度、G比值)结果进行Meta分析,其中有髓纤维密度是指在100 000 mm2下有髓纤维的数目。使用I2对异质性的大小进行分析,I2<25%被视为低异质性,I2<50%异质性可以被接受,I2>75%被视为高异质性。
2. 结果
2.1. 检索结果
从6个数据库中共检索出4 614篇文献,去除重复研究后剩余3 580篇。阅读题目和(或)摘要去除3 534篇,另有7篇研究无法获取全文而排除,剩余39篇文献,阅读全文后排除7篇,其中2篇未详细报告实验方法,2篇数据雷同而不真实,1篇研究结果无数据及图片等证据,1篇为人体研究,1篇为网状神经缺损。剩余32篇文献被纳入研究,通过手工检索纳入研究的参考文献,未发现32篇研究以外符合纳入标准的研究。32篇中,15篇研究被纳入Meta分析。
2.2. 研究特征
各研究的基本情况存在明显的差异。32篇原始研究使用了不同动物类型的面神经缺损模型。大鼠是最受青睐的动物(SD大鼠11篇,Lewis大鼠7篇,Wistar大鼠3篇),其次是兔子(新西兰白兔8篇,家兔1篇),最后是狗和豚鼠(各1篇)。在32篇研究中,可以确定的动物数目为1 032只,其中有2篇研究未明确报道动物数目。在各研究中,动物的年龄、性别、体重等存在差异,有一些研究未报道动物基线特征的完整信息。各研究人为地去除部分面神经主干或分支以形成动物面神经缺损模型。其中多以面神经颊支的破坏为主(23篇),其次依次为面神经主干(5篇)、面神经下颌缘支(2篇)、面神经颞支(1篇)及混合型破坏(1篇)。动物模型中神经间隙的长度在零至十几毫米不等,以5~10 mm为最多(20篇),另有7篇未明确缺损长度或只给出了所切除神经的长度而非神经切除并收缩之后所留下的间隙长度。其中,0 mm表示神经切断后进行的是神经吻合术。32篇研究主要采用了3种神经修复方法。神经导管修复神经缺损是最常用的方法(27篇),其他方法有神经吻合修复(3篇)、神经移植修复(1篇)、自体筋膜修复(1篇)。使用的导管有硅胶导管(10篇),聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)导管(3篇),去细胞动脉导管(2篇),静脉导管、去细胞坐骨神经导管、壳聚糖导管、胶原导管、聚乙醇酸(polyglycolic acid,PGA)导管、Gore-Tex导管、AxoGuard导管、羟磷灰石(hydroxyapatite,HA)-胶原导管、PGA-胶原导管和3D打印导管(各1篇),另有2篇未注明使用的导管类型。干细胞的类型包括:脂肪源性细胞(9篇),BMSCs、神经源性细胞、牙髓干细胞(各6篇),MSCs(2篇),SVF、神经引导的人间充质干细胞(neural-induced human mesenchymal stem cells,N-iHMSCs)(各1篇)。使用的细胞剂量以1×105~10×105(15篇)为最多,另有1篇使用了1×103、1×105、1×107作为实验组细胞剂量,7篇未报道细胞剂量(7篇)。回访时间数天到数月不等,以8~16周(23篇)为最多,另有1篇未报道随访时间。所进行的组织学评估包括有髓纤维密度、纤维直径、髓鞘厚度、G比值。纳入研究的基本信息见表1。
表 1. 纳入研究的基本信息.
Tab 1 The basic information of the included studies
| 作者及年份 | 动物种类 | 基线情况 | 总样本量 | 神经类型 | 间隙长度/mm | 修复材料或方法 | 细胞类型 | 细胞剂量 | 随访时间 |
| Abbas 2016[24] | SD大鼠 | 雄性 | 12 | 面神经主干,颊支 | 坐骨神经 | ADSCs | 1×106 | 90 d | |
| Batioglu-Karaaltin 2016[7] | Wistar大鼠 | 雌性,350~380 g | 27 | 面神经主干 | 2 | 导管 | HOSCs | 8×106 | 10周 |
| Chen 2018[25] | 新西兰兔 | 7~8月,雄性,(3.0±0.5)kg | 45 | 颊支 | 导管 | DPSCs | 5×106 | 10周 | |
| Cho 2010[26] | 豚鼠 | 32 | 面神经主干 | 0 | 神经缝合 | N-iHMSCs | 1×105 | 6周 | |
| Costa 2013[27] | Wistar大鼠 | 成年,雄性,250~300 g | 35 | 下颌缘支 | 5 | PGA导管 | BMSCs | 4×105 | 6周 |
| Ghoreishian 2013[28] | 伊朗杂种犬 | 20~25 kg | 7 | 颞支 | >7 | Gore-Tex导管 | ADSCs | 2×107 | 12周 |
| Guo 2009[16] | 家兔 | 任何性别,2~3 kg | 36 | 颊支 | 10 | 壳聚糖导管 | NSCs | 1×106 | 12周 |
| Kwon 2009[29] | SD大鼠 | 20 | 面神经主干 | >5 | 硅胶导管 | ADSCs | 8周 | ||
| Ma 2017[30] | SD大鼠 | 成年,雌性,200~220 g | 100 | 颊支 | 8 | 胶原导管 | NS/PCs | 1×106 | 12周 |
| Matsumine 2014[31] | Lewis大鼠 | 8周,200~250 g | 25 | 颊支 | 7 | 硅胶导管 | DFATs | 5×104 | 13周 |
| Matsumine 2017[32] | Lewis大鼠 | 8周,雄性,200~250 g | 30 | 颊支 | 7 | 硅胶导管 | SVF | 1×103 | 13周 |
| 1×105 | |||||||||
| 1×107 | |||||||||
| Salomone 2013[33] | Wistar大鼠 | 雄性,250~300 g | 48 | 下颌缘支 | 3 | 硅胶导管 | BMSCs | 4×105 | 6周 |
| Sasaki 2008[18] | Lewis大鼠 | 8周 | 38 | 颊支 | 7 | 硅胶导管 | DPSCs | 1×105 | 12 d |
| Sasaki 2011[34] | Lewis大鼠 | 8周 | 10 | 颊支 | 7 | PLGA导管 | DPSCs | 5×105 | 5 d |
| Sasaki 2014[17] | Lewis大鼠 | 成年,雄性 | 34 | 颊支 | 7 | 硅胶导管 | DPSCs | 1×105 | 13周 |
| Satar 2009[35] | SD大鼠 | 12~16周,雌性,220~228 g | 15 | 颊支 | 0 | 神经缝合 | BMSCs | 6月 | |
| Satar 2010[36] | SD大鼠 | 12~16周,雌性,220~228 g | 3 | 颊支 | 0 | 神经缝合 | BMSCs | 9月 | |
| Shi 2009[5] | SD大鼠 | 成年,雌性,200~250 g | 96 | 颊支 | 8 | PLGA导管 | NSCs,SCs | 1×105 | 12周 |
| Shi 2012[37] | SD大鼠 | 雌性,200~250 g | 20 | 颊支 | >5 | PLGA导管 | NSCs | 12周 | |
| Shimizu 2018[20] | Lewis大鼠 | 8周,雄性,200~250 g | 24 | 颊支 | 7 | PGA-胶原导管 | ADSCs,SVF | 1×105 | 13周 |
| Sun 2011(1) [15] | SD大鼠 | 5~6周,雌性,100~150 g | 40 | 颊支 | 8 | 去细胞动脉导管 | ADSCs | 1×105 | 8周 |
| Sun 2011(2) [38] | SD大鼠 | 年轻,雌性,100~120 g | 60 | 颊支 | 8 | 去细胞动脉导管 | ADSCs,SCs | 5×105 | 8周 |
| Sun 2018[39] | 新西兰兔 | 4月,雌性,3.0~3.5 kg | 32 | 颊支 | 10 | 去细胞坐骨神经 | ADSCs | 2×104 | 8周 |
| Wang 2011[40] | 新西兰兔 | 成年,雌性,2.5~3.2 kg | 54 | 颊支 | 10 | 自体静脉导管 | BMSCs | 3×106 | 16周 |
| Wang 2012[41] | 新西兰兔 | 任意性别,2.5~3.0 kg | 16 | 颊支 | 7 | 硅胶导管 | DPSCs | 1×104 | |
| Watanabe 2017[42] | Lewis 大鼠 | 8周,雄性 | 77 | 颊支 | 7 | 硅胶导管 | ADSCs,SCs | 1×105 | 13周 |
| Yan 2004[43] | 新西兰兔 | 任意性别,2.0~3.0 kg | 22 | 面神经主干 | 6 | 自体筋膜 | NSCs | 6周 | |
| Yu 2005[44] | 新西兰兔 | 15 | 颊支 | >12 | 硅胶导管 | BMSCs | 1.6×104 | 16周 | |
| Zhang 2008[45] | 新西兰兔 | 成年,2.0~2.5 kg | 39 | 面神经主干 | 5 | HA-胶原导管 | NSCs | 4×106 | 12周 |
| Zhang 2014[46] | 新西兰兔 | 成年,2.5~3.5 kg | 20 | 颊支 | 硅胶导管 | DPSCs | 3月 | ||
| Zhang 2018(1) [47] | SD大鼠 | 成年,雌性,200~250 g | 颊支 | 6 | AxoGuard导管 | GMSCs,iNCSCs | 5×105 | 12周 | |
| Zhang 2018(2) [19] | SD大鼠 | 8周,雌性,200~250 g | 颊支 | 5 | 3D打印导管 | GMSCs | 12周 |
注:DFATs为脂肪来源转分化的脂肪细胞;iNCSCs为引导的神经嵴样干细胞。
2.3. 偏倚风险评估
偏倚风险评估的结果见图1。
图 1. 偏倚风险评估.

Fig 1 Risk of bias assessment
多数研究缺乏保证动物实验质量的关键信息。所有研究均未提到“分配隐藏”和“随机分组”,存在高风险。个别研究提到“实施者施盲”、“随机结果评估”及“评估者施盲”等,但未详细阐述具体方法。仅少数研究阐述了“随机序列产生”的具体方法。关于“基线特征”,多数研究对其做了交代,但其中一些研究未同时报道年龄、性别和体重三者的信息。一些研究未报告术后动物存活情况,结局数据不完整。“选择性结果报告”这一方面较为理想,多数研究不存在这一隐患。多数研究提到了伦理、基金支持、利益冲突其中之一,在“其他风险”这一方面存在着不确定风险。
2.4. Meta分析
15篇研究被纳入Meta分析,可确定的动物总量为719只。由于并不是所有的动物都会做每一项检测,因此Meta分析以该项检测对应的动物数目为相应组分的样本量。
2.4.1. 胡须运动评分
5篇文献使用了胡须运动评分量表对面神经的功能进行了评估。Meta分析结果显示,实验组的胡须运动评分高于对照组(MD=0.81,95%CI 0.25~1.37,P=0.005),但存在明显的异质性(I2=86%,P<0.000 1)(图2)。
图 2. 2组胡须运动评分的Meta分析.
Fig 2 Meta-analysis of the score of vibrissae movement
2.4.2. 面瘫评分
3篇文献使用了面瘫评分量表对面神经的功能进行了评估。Meta分析结果显示,实验组的面瘫评分高于对照组(MD=1.39,95%CI 1.20~1.58,P<0.000 01),无明显异质性(I2=0,P=0.56)(图3)。
图 3. 2组面瘫评分的Meta分析.
Fig 3 Meta-analysis of the score of facial paralysis
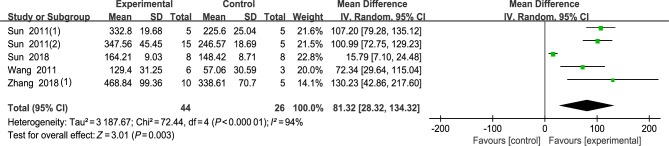
2.4.3. 有髓纤维密度
5篇文献对有髓纤维密度进行了评估。Meta分析结果显示,实验组的有髓纤维密度高于对照组(MD=81.32,95%CI 28.32~134.32,P=0.003),但异质性过大(I2=94%,P<0.000 01)(图4)。
图 4. 2组有髓纤维密度的Meta分析.
Fig 4 Meta-analysis of the density of myelinated fibers
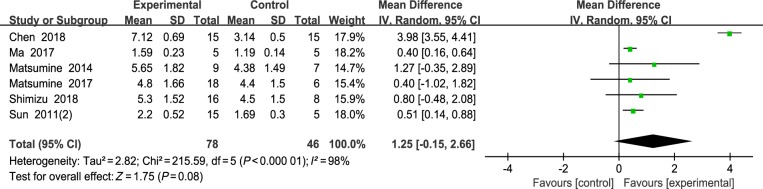
2.4.4. 纤维直径
6篇文献对纤维直径进行了评估。Meta分析结果显示,实验组和对照组的纤维直径无统计学差异(MD=1.25,95%CI -0.15~2.66,P=0.08),且同时存在明显的异质性(I2=98%,P<0.000 01)(图5)。
图 5. 2组纤维直径的Meta分析.
Fig 5 Meta-analysis of the diameter of fibers
2.4.5. 髓鞘厚度
11篇文献对髓鞘厚度进行了评估。Meta分析结果显示,实验组的髓鞘厚度大于对照组(MD=0.16,95%CI 0.10~0.23,P<0.000 01),但存在明显的异质性(I2=88%,P<0.000 01)(图6)。
图 6. 2组髓鞘厚度的Meta分析.
Fig 6 Meta-analysis of the myelination thickness
2.4.6. G比值
7篇文献对G比值进行了评估。Meta分析结果显示,实验组的G比值小于对照组(MD=-0.06,95%CI -0.10~-0.02,P=0.001),但存在一定的异质性(I2=43%,P=0.10)(图7)。
图 7. 2组G比值的Meta分析.
Fig 7 Meta-analysis of the G ratio
3. 讨论
关于干细胞促进面神经再生的研究现还局限于动物模型及体外研究,鲜有关于干细胞促进面神经再生的临床研究。人们仍不能够确定干细胞对面神经的修复效果究竟如何,其是否有希望被应用于临床,如何加快其应用于临床的进程。目前除了Euler de Souza Lucena等[2]写过一篇关于干细胞与组织工程修复面神经的系统评价外,并没有关于此方面的其他系统性总结。受当时文献数目的限制,Euler de Souza Lucena等[2]仅进行了定性描述,而无定量分析。其后有许多新的基础研究被报道出来,因此有必要针对干细胞对面神经再生的效果进行一次新的系统性评价。
动物模型中评估面神经再生情况的方法主要为功能性评估、电生理学评估及组织学评估。本研究中发现,关于面神经再生的电生理学评估研究非常有限,且测量方法存在不容忽视的差异。因此,本系统评价仅对面神经的功能性评估(胡须运动评分,面瘫评分)及组织学评估(有髓纤维密度,纤维直径,髓鞘厚度,G比值)结果进行Meta分析。其中,G比值代表纤维成熟的程度,在一定范围内越小代表纤维的成熟度越高。本研究结果显示,干细胞组的胡须运动评分、面瘫评分、有髓纤维密度、髓鞘厚度均高于非干细胞组(P<0.05),G比值小于非干细胞组(P=0.001)。无论是功能性评估结果,还是组织学评估结果,都支持干细胞促进面神经再生的这一理论,证实了干细胞在促进面神经再生方面具有潜在的作用。
面神经再生的关键在于新轴突及髓鞘形成、神经重新支配靶器官。其中SCs是神经再生及功能恢复中不可或缺的重要角色[48]–[49]。它们产生包括神经生长因子、脑源性神经营养因子及grial-cell-line源性神经营养因子在内的营养因子及轴突再生不可或缺的黏性细胞外基质[50]。神经损伤后,SCs由髓鞘型转化为生长型,进而增殖并形成Bungner带以引导轴突再生到原来的位置[51]。神经完全断裂要比非完全断裂难以修复得多,因为神经离断后,断端会向两端收缩从而形成间隙[52]–[53],炎症细胞迁移到损伤部位,并在局部缺氧的情况下分泌血管内皮生长因子,刺激早期内皮细胞的生长[54]–[56]。之后SCs脱离神经干并利用新形成的血管网引导轴突由一端向另一端生长[34]–[36]。然而,提取过程产生的疼痛、供体部位的发病及体外细胞培养的难度无一不限制了SCs在临床的应用[57]。目前干细胞被视为神经再生的重要替代来源。
NSCs被视为一种有前途的细胞,其由胚胎或成年哺乳动物的脑分离而来,并能够分化为成熟神经元、星形胶质细胞或少突胶质细胞[11],[58]–[59]。然而,NSCs的应用受到宿主组织中细胞存活率低的限制。有学者将NS/PCs移植到宿主损伤部分,在最初的几周里其活细胞的数量竟降低至4%以下[60]–[61]。ADSCs和BMSCs均为多能间充质干细胞,可分化为中胚层或外胚层来源的组织[62]–[65]。ADSCs和BMSCs可以通过较小的侵入性程序获得,以较高的增殖率培养,转分化为SCs,促进髓鞘形成,是细胞移植及促进周围神经再生的优先选择[63],[66]。通过重组成体细胞形成的多能干细胞(induced pluripotent stem cells,iPSCs)是干细胞领域的另一项重要技术[67]–[68]。有学者已经利用iPSCs细胞系获得了功能和表型正常的运动神经元[67],[69]–[73]。
人们对其他来源干细胞的研究也在不断完善,不断地有新的理论及观点涌出。近年来,3D打印技术在组织修复领域内的应用变得逐渐广泛,也不乏使用3D打印技术结合干细胞成功进行神经再生的案例[19],[74]。Zhang等[19]通过3D打印无纤维神经导管结合GMSCs实现了大鼠缺损面神经的再生。使用GMSCs细胞团引导生成的3D神经导管,不仅表达了神经标志物β-微管蛋白Ⅲ和SCs标志物S-100β,而且表现出接近于自体神经移植的缺损面神经修复效果。然而,使用3D打印技术进行面神经修复仍然存在一些的问题,例如需要:优化细胞团培养的时间及培养基,对该技术所修复的神经进行功能性评估,验证该技术是否具有可重复性,对细胞的作用进行追踪,评估该技术结合各种神经导管对神经的修复效果[19]。因此未来的研究有必要针对以上问题进行探索,尤其是需要比较3D打印神经导管与自体神经移植的功能性修复效果。
本文的系统评价研究结果表明,干细胞具有促进面神经再生的趋势。然而想要得出确切的结论,尚需要对这一领域进行进一步探索。建议今后的研究设计,应兼顾对神经修复的功能性、组织学及电生理学方面的评估;设立阳性对照(如自体神经移植)、阴性对照(如不进行神经缺损的修复)及其他实验组(如合成导管等);重视动物实验的质量以及数据的完整性等。同时,为了最大程度地增加干细胞应用于临床的安全性,今后还需要在干细胞应用的安全性及副作用方面加以探索。
Funding Statement
[基金项目] 重庆高校创新团队建设计划(CXTDG201602006)
Supported by: Program for Innovation Team Building at Institutions of Higher Education in Chongqing (CXTDG201602006).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.王 美青. 口腔解剖生理学[M] 7版. 北京: 人民卫生出版社; 2012. pp. 153–156. [Google Scholar]; Wang MQ. Oral anatomy and physiology[M] 7th ed. Beijing: People's Medical Publishing House; 2012. pp. 153–156. [Google Scholar]
- 2.Euler de Souza Lucena E, Guzen FP, Lopes de Paiva Cavalcanti JR, et al. Experimental considerations concerning the use of stem cells and tissue engineering for facial nerve regeneration: a systematic review[J] J Oral Maxillofac Surg. 2014;72(5):1001–1012. doi: 10.1016/j.joms.2013.11.006. [DOI] [PubMed] [Google Scholar]
- 3.Kerrebijn JD, Freeman JL. Facial nerve reconstruction: outcome and failures[J] J Otolaryngol. 1998;27(4):183–186. [PubMed] [Google Scholar]
- 4.Millesi H. Techniques for nerve grafting[J] Hand Clin. 2000;16(1):73–91. [PubMed] [Google Scholar]
- 5.Shi Y, Zhou L, Tian J, et al. Transplantation of neural stem cells overexpressing Glia-derived neurotrophic factor promotes facial nerve regeneration[J] Acta Otolaryngol. 2009;129(8):906–914. doi: 10.1080/00016480802468153. [DOI] [PubMed] [Google Scholar]
- 6.Wang TV, Delaney S, Pepper JP. Current state of stem cell-mediated therapies for facial nerve injury[J] Curr Opin Otolaryngol Head Neck Surg. 2016;24(4):285–293. doi: 10.1097/MOO.0000000000000292. [DOI] [PubMed] [Google Scholar]
- 7.Batioglu-Karaaltin A, Karaaltin MV, Oztel ON, et al. Human olfactory stem cells for injured facial nerve reconstruction in a rat model[J] Head Neck. 2016;38(Suppl 1):E2011–E2020. doi: 10.1002/hed.24371. [DOI] [PubMed] [Google Scholar]
- 8.Kim SU, de Vellis J. Stem cell-based cell therapy in neurological diseases: a review[J] J Neurosci Res. 2009;87(10):2183–2200. doi: 10.1002/jnr.22054. [DOI] [PubMed] [Google Scholar]
- 9.Fu KY, Dai LG, Chiu IM, et al. Sciatic nerve regeneration by microporous nerve conduits seeded with glial cell line-derived neurotrophic factor or brain-derived neurotrophic factor gene transfected neural stem cells[J] Artif Organs. 2011;35(4):363–372. doi: 10.1111/j.1525-1594.2010.01105.x. [DOI] [PubMed] [Google Scholar]
- 10.Parker MA, Anderson JK, Corliss DA, et al. Expression profile of an operationally-defined neural stem cell clone[J] Exp Neurol. 2005;194(2):320–332. doi: 10.1016/j.expneurol.2005.04.018. [DOI] [PubMed] [Google Scholar]
- 11.Bunge RP. Expanding roles for the Schwann cell: ensheathment, myelination, trophism and regeneration[J] Curr Opin Neurobiol. 1993;3(5):805–809. doi: 10.1016/0959-4388(93)90157-t. [DOI] [PubMed] [Google Scholar]
- 12.Zuk PA, Zhu M, Ashjian P, et al. Human adipose tissue is a source of multipotent stem cells[J] Mol Biol Cell. 2002;13(12):4279–4295. doi: 10.1091/mbc.E02-02-0105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Meliga E, Strem BM, Duckers HJ, et al. Adipose-derived cells[J] Cell Transplant. 2007;16(9):963–970. doi: 10.3727/096368907783338190. [DOI] [PubMed] [Google Scholar]
- 14.Gomillion CT, Burg KJ. Stem cells and adipose tissue engineering[J] Biomaterials. 2006;27(36):6052–6063. doi: 10.1016/j.biomaterials.2006.07.033. [DOI] [PubMed] [Google Scholar]
- 15.Sun F, Zhou K, Mi WJ, et al. Repair of facial nerve defects with decellularized artery allografts containing autologous adipose-derived stem cells in a rat model[J] Neurosci Lett. 2011;499(2):104–108. doi: 10.1016/j.neulet.2011.05.043. [DOI] [PubMed] [Google Scholar]
- 16.Guo BF, Dong MM. Application of neural stem cells in tissue-engineered artificial nerve[J] Otolaryngol Head Neck Surg. 2009;140(2):159–164. doi: 10.1016/j.otohns.2008.10.039. [DOI] [PubMed] [Google Scholar]
- 17.Sasaki R, Matsumine H, Watanabe Y, et al. Electrophysiologic and functional evaluations of regenerated facial nerve defects with a tube containing dental pulp cells in rats[J] Plast Reconstr Surg. 2014;134(5):970–978. doi: 10.1097/PRS.0000000000000602. [DOI] [PubMed] [Google Scholar]
- 18.Sasaki R, Aoki S, Yamato M, et al. Tubulation with dental pulp cells promotes facial nerve regeneration in rats[J] Tissue Eng Part A. 2008;14(7):1141–1147. doi: 10.1089/ten.tea.2007.0157. [DOI] [PubMed] [Google Scholar]
- 19.Zhang QZ, Nguyen PD, Shi SH, et al. 3D bio-printed scaffold-free nerve constructs with human gingiva-derived mesenchymal stem cells promote rat facial nerve regeneration[J] Sci Rep. 2018;8:6634. doi: 10.1038/s41598-018-24888-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Shimizu M, Matsumine H, Osaki H, et al. Adipose-derived stem cells and the stromal vascular fraction in polyglycolic acid-collagen nerve conduits promote rat facial nerve regeneration[J] Wound Repair Regen. 2018;26(6):446–455. doi: 10.1111/wrr.12665. [DOI] [PubMed] [Google Scholar]
- 21.Moher D, Liberati A, Tetzlaff J, et al. Preferred reporting items for systematic reviews and Meta-analyses: the PRISMA statement[J] Ann Intern Med. 2009;151(4):264–269. doi: 10.7326/0003-4819-151-4-200908180-00135. [DOI] [PubMed] [Google Scholar]
- 22.刘 鸣. 系统评价、Meta-分析设计与实施方法[M] 北京: 人民卫生出版社; 2011. pp. 85–90. [Google Scholar]; Liu M. The design and implementation method of systematic review and Meta-analysis[M] Beijing: People's Medical Publishing House; 2011. pp. 85–90. [Google Scholar]
- 23.Hooijmans CR, Rovers MM, de Vries RB, et al. SYRCLE's risk of Bias tool for animal studies[J] BMC Med Res Methodol. 2014;14:43. doi: 10.1186/1471-2288-14-43. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Abbas OL, Borman H, Uysal ÇA, et al. Adipose-derived stem cells enhance axonal regeneration through cross-facial nerve grafting in a rat model of facial paralysis[J] Plast Reconstr Surg. 2016;138(2):387–396. doi: 10.1097/PRS.0000000000002351. [DOI] [PubMed] [Google Scholar]
- 25.陈 彪, 张 睿, 张 文娟, et al. 牙髓干细胞对兔面神经损伤的修复作用及其机制[J] 吉林大学学报(医学版) 2018;44(3):504–509, 695. [Google Scholar]; Chen B, Zhang R, Zhang WJ, et al. Repair effect of dental pulp stem cells on facial nerve injury in rabbits and its mechanism[J] J Jilin Univ Med Ed. 2018;44(3):504–509, 695. [Google Scholar]
- 26.Cho HH, Jang S, Lee SC, et al. Effect of neural-induced mesenchymal stem cells and platelet-rich plasma on facial nerve regeneration in an acute nerve injury model[J] Laryngoscope. 2010;120(5):907–913. doi: 10.1002/lary.20860. [DOI] [PubMed] [Google Scholar]
- 27.Costa HJ, Bento RF, Salomone R, et al. Mesenchymal bone marrow stem cells within polyglycolic acid tube observed in vivo after six weeks enhance facial nerve regeneration[J] Brain Res. 2013;1510:10–21. doi: 10.1016/j.brainres.2013.03.025. [DOI] [PubMed] [Google Scholar]
- 28.Ghoreishian M, Rezaei M, Beni BH, et al. Facial nerve repair with gore-tex tube and adipose-derived stem cells: an animal study in dogs[J] J Oral Maxillofac Surg. 2013;71(3):577–587. doi: 10.1016/j.joms.2012.05.025. [DOI] [PubMed] [Google Scholar]
- 29.Kwon SK, Song JJ, Cho CG, et al. Regeneration of facial nerve using mesenchymal stem cells in facial nerve palsy animal model[J] Tissue Eng Regen Med. 2009;6(1):300–306. [Google Scholar]
- 30.Ma FK, Zhu TM, Xu F, et al. Neural stem/progenitor cells on collagen with anchored basic fibroblast growth factor as potential natural nerve conduits for facial nerve regeneration[J] Acta Biomater. 2017;50:188–197. doi: 10.1016/j.actbio.2016.11.064. [DOI] [PubMed] [Google Scholar]
- 31.Matsumine H, Takeuchi Y, Sasaki R, et al. Adipocyte-derived and dedifferentiated fat cells promoting facial nerve regeneration in a rat model[J] Plast Reconstr Surg. 2014;134(4):686–697. doi: 10.1097/PRS.0000000000000537. [DOI] [PubMed] [Google Scholar]
- 32.Matsumine H, Numakura K, Climov M, et al. Facial-nerve regeneration ability of a hybrid artificial nerve conduit containing uncultured adipose-derived stromal vascular fraction: an experimental study[J] Microsurgery. 2017;37(7):808–818. doi: 10.1002/micr.30060. [DOI] [PubMed] [Google Scholar]
- 33.Salomone R, Bento RF, Costa HJ, et al. Bone marrow stem cells in facial nerve regeneration from isolated stumps[J] Muscle Nerve. 2013;48(3):423–429. doi: 10.1002/mus.23768. [DOI] [PubMed] [Google Scholar]
- 34.Sasaki R, Aoki S, Yamato M, et al. PLGA artificial nerve conduits with dental pulp cells promote facial nerve regeneration[J] J Tissue Eng Regen Med. 2011;5(10):823–830. doi: 10.1002/term.387. [DOI] [PubMed] [Google Scholar]
- 35.Satar B, Karahatay S, Kurt B, et al. Repair of transected facial nerve with mesenchymal stromal cells: histopathologic evidence of superior outcome[J] Laryngoscope. 2009;119(11):2221–2225. doi: 10.1002/lary.20610. [DOI] [PubMed] [Google Scholar]
- 36.Satar B, Oztas E, Hidir Y. Promoted regeneration of transected facial nerve branches using mesenchymal stromal cells in relationship with apoptosis: 9-month results[J] J Int Adv Otology. 2010;6(2):160–166. [Google Scholar]
- 37.施 勇, 周 梁, 田 洁, et al. 神经干细胞移植到神经导管修复大鼠面神经缺损的研究[J] 临床耳鼻咽喉头颈外科杂志. 2012;26(22):1040–1042. [PubMed] [Google Scholar]; Shi Y, Zhou L, Tian J, et al. Transplanting neural stem cells in nerve conduit to promote rats facial nerve regeneration[J] J Clin Otorhinolaryngol Head Neck Surg. 2012;26(22):1040–1042. [PubMed] [Google Scholar]
- 38.Sun F, Zhou K, Mi WJ, et al. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats[J] Biomaterials. 2011;32(32):8118–8128. doi: 10.1016/j.biomaterials.2011.07.031. [DOI] [PubMed] [Google Scholar]
- 39.孙 妍娜, 张 荣明, 毛 旭, et al. 复合脂肪来源干细胞的脱细胞异种神经联合富血小板血浆修复兔面神经损伤的实验研究[J] 中国修复重建外科杂志. 2018;32(6):736–744. doi: 10.7507/1002-1892.201711079. [DOI] [PMC free article] [PubMed] [Google Scholar]; Sun YN, Zhang RM, Mao X, et al. Research of acellular xenogeneic nerve combined with adipose-derived stem cells and platelet rich plasma in repair of rabbit facial nerve injury[J] Chin J Reparat Reconstr Surg. 2018;32(6):736–744. doi: 10.7507/1002-1892.201711079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Wang XM, Luo E, Li YF, et al. Schwann-like mesenchymal stem cells within vein graft facilitate facial nerve regeneration and remyelination[J] Brain Res. 2011;1383:71–80. doi: 10.1016/j.brainres.2011.01.098. [DOI] [PubMed] [Google Scholar]
- 41.王 艳梅, 木合塔尔 霍加, 庄 友梅, et al. TGF-β3与牙髓干细胞联合应用对兔面神经损伤修复的作用[J] 国际生物医学工程杂志. 2012;35(3):160–164. [Google Scholar]; Wang YM, Muhetaer HJ, Zhuang YM, et al. Effects of TGF-β3 combined with dental pulp stem cells on the repair of rabbit facial nerve injury[J] Int J Biomed Eng. 2012;35(3):160–164. [Google Scholar]
- 42.Watanabe Y, Sasaki R, Matsumine H, et al. Undifferentiated and differentiated adipose-derived stem cells improve nerve regeneration in a rat model of facial nerve defect[J] J Tissue Eng Regen Med. 2017;11(2):362–374. doi: 10.1002/term.1919. [DOI] [PubMed] [Google Scholar]
- 43.闫 长祥, 安 沂华, 历 俊华, et al. 神经干细胞与自体筋膜联合修复家兔面神经损伤[J] 中国康复理论与实践. 2004;10(1):21–22. [Google Scholar]; Yan CX, An YH, Li JH, et al. Research on repairing facial nerve injury of rabbits by neural stem cells and autologous fasia[J] Chin J Rehabil Theory Pract. 2004;10(1):21–22. [Google Scholar]
- 44.余 国建, 胡 勤刚, 周 炳荣, et al. 兔骨髓间充质干细胞修复面神经缺损的初步研究[J] 口腔医学纵横. 2005;21(3):273–275. [Google Scholar]; Yu GJ, Hu QG, Zhou BR, et al. The pilot study of regeneration of facial nerve defect with rabbit bone marrow-derived mesenchymal stem cells[J] J Comprehen Stomatol. 2005;21(3):273–275. [Google Scholar]
- 45.Zhang H, Wei YT, Tsang KS, et al. Implantation of neural stem cells embedded in hyaluronic acid and collagen composite conduit promotes regeneration in a rabbit facial nerve injury model[J] J Transl Med. 2008;6:67. doi: 10.1186/1479-5876-6-67. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.张 晓莉, 玛衣努尔 艾赛提, 白尔娜 吾守尔, et al. TGF-β3和牙髓干细胞修复损伤面神经效果的评价[J] 口腔医学研究. 2014;30(6):504–508. [Google Scholar]; Zhang XL, Mayinuer EST, Baierna WSE, et al. Effects of TGF-β3 and dental pulp stem cells to repair of facial nerve injury[J] J Oral Sci Res. 2014;30(6):504–508. [Google Scholar]
- 47.Zhang QZ, Nguyen PD, Shi SH, et al. Neural crest stem-like cells non-genetically induced from human gingiva-derived mesenchymal stem cells promote facial nerve regeneration in rats[J] Mol Neurobiol. 2018;55(8):6965–6983. doi: 10.1007/s12035-018-0913-3. [DOI] [PubMed] [Google Scholar]
- 48.Fansa H, Keilhoff G. Comparison of different biogenic matrices seeded with cultured Schwann cells for bridging peripheral nerve defects[J] Neurol Res. 2004;26(2):167–173. doi: 10.1179/016164104225013842. [DOI] [PubMed] [Google Scholar]
- 49.Schmalenberg KE, Uhrich KE. Micropatterned polymer substrates control alignment of proliferating Schwann cells to direct neuronal regeneration[J] Biomaterials. 2005;26(12):1423–1430. doi: 10.1016/j.biomaterials.2004.04.046. [DOI] [PubMed] [Google Scholar]
- 50.Evans GR. Peripheral nerve injury: a review and approach to tissue engineered constructs[J] Anat Rec. 2001;263(4):396–404. doi: 10.1002/ar.1120. [DOI] [PubMed] [Google Scholar]
- 51.Fu SY, Gordon T. The cellular and molecular basis of peripheral nerve regeneration[J] Mol Neurobiol. 1997;14(1/2):67–116. doi: 10.1007/BF02740621. [DOI] [PubMed] [Google Scholar]
- 52.Nguyen QT, Sanes JR, Lichtman JW. Pre-existing pathways promote precise projection patterns[J] Nat Neurosci. 2002;5(9):861–867. doi: 10.1038/nn905. [DOI] [PubMed] [Google Scholar]
- 53.Jurecka W, Ammerer HP, Lassmann H. Regeneration of a transected peripheral nerve[J] Acta Neuropathol. 1975;32(4):299–312. doi: 10.1007/BF00696792. [DOI] [PubMed] [Google Scholar]
- 54.Cattin AL, Burden JJ, van Emmenis L, et al. Macrophage-induced blood vessels guide schwann cell-mediated regeneration of peripheral nerves[J] Cell. 2015;162(5):1127–1139. doi: 10.1016/j.cell.2015.07.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.McDonald D, Cheng C, Chen YY, et al. Early events of peripheral nerve regeneration[J] Neuron Glia Biol. 2006;2(2):139–147. doi: 10.1017/S1740925X05000347. [DOI] [PubMed] [Google Scholar]
- 56.Parrinello S, Napoli I, Ribeiro S, et al. EphB signaling directs peripheral nerve regeneration through Sox2-dependent schwann cell sorting[J] Cell. 2010;143(1):145–155. doi: 10.1016/j.cell.2010.08.039. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Terenghi G, Tohill M. Stem-cell plasticity and therapy for injuries of the peripheral nervous system[J] Biotechnol Appl Biochem. 2004;40(1):17. doi: 10.1042/BA20030173. [DOI] [PubMed] [Google Scholar]
- 58.Flax JD, Aurora S, Yang C, et al. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes[J] Nat Biotechnol. 1998;16(11):1033–1039. doi: 10.1038/3473. [DOI] [PubMed] [Google Scholar]
- 59.Johnson T, O'Neill A, Motarjem P, et al. Tumor formation following murine neural precursor cell transplantation in a rat peripheral nerve injury model[J] J Reconstr Microsurg. 2008;24(8):545–550. doi: 10.1055/s-0028-1088228. [DOI] [PubMed] [Google Scholar]
- 60.Piccini P, Pavese N, Hagell P, et al. Factors affecting the clinical outcome after neural transplantation in Parkinson's disease[J] Brain. 2005;128(Pt 12):2977–2986. doi: 10.1093/brain/awh649. [DOI] [PubMed] [Google Scholar]
- 61.Liu J, Huang HY. How to improve the survival of the fetal ventral mesencephalic cell transplanted in Parkinson's disease[J] Neurosci Bull. 2007;23(6):377–382. doi: 10.1007/s12264-007-0056-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Kim BJ, Seo JH, Bubien JK, et al. Differentiation of adult bone marrow stem cells into neuroprogenitor cells in vitro[J] Neuroreport. 2002;13(9):1185–1188. doi: 10.1097/00001756-200207020-00023. [DOI] [PubMed] [Google Scholar]
- 63.Kingham PJ, Kalbermatten DF, Mahay D, et al. Adipose-derived stem cells differentiate into a Schwann cell phenotype and promote neurite outgrowth in vitro[J] Exp Neurol. 2007;207(2):267–274. doi: 10.1016/j.expneurol.2007.06.029. [DOI] [PubMed] [Google Scholar]
- 64.Kopen GC, Prockop DJ, Phinney DG. Marrow stromal cells migrate throughout forebrain and cerebellum, and they differentiate into astrocytes after injection into neonatal mouse brains[J] Proc Natl Acad Sci USA. 1999;96(19):10711–10716. doi: 10.1073/pnas.96.19.10711. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Woodbury D, Schwarz EJ, Prockop DJ, et al. Adult rat and human bone marrow stromal cells differentiate into neurons[J] J Neurosci Res. 2000;61(4):364–370. doi: 10.1002/1097-4547(20000815)61:4<364::AID-JNR2>3.0.CO;2-C. [DOI] [PubMed] [Google Scholar]
- 66.Xu YF, Liu L, Li Y, et al. Myelin-forming ability of Schwann cell-like cells induced from rat adipose-derived stem cells in vitro[J] Brain Res. 2008;1239:49–55. doi: 10.1016/j.brainres.2008.08.088. [DOI] [PubMed] [Google Scholar]
- 67.Son EY, Ichida JK, Wainger BJ, et al. Conversion of mouse and human fibroblasts into functional spinal motor neurons[J] Cell Stem Cell. 2011;9(3):205–218. doi: 10.1016/j.stem.2011.07.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Vierbuchen T, Ostermeier A, Pang ZP, et al. Direct conversion of fibroblasts to functional neurons by defined factors[J] Nature. 2010;463(7284):1035–1041. doi: 10.1038/nature08797. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Amoroso MW, Croft GF, Williams DJ, et al. Accelerated high-yield generation of limb-innervating motor neurons from human stem cells[J] J Neurosci. 2013;33(2):574–586. doi: 10.1523/JNEUROSCI.0906-12.2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Du ZW, Chen H, Liu HS, et al. Generation and expansion of highly pure motor neuron progenitors from human pluripotent stem cells[J] Nat Commun. 2015;6:6626. doi: 10.1038/ncomms7626. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Karumbayaram S, Novitch BG, Patterson M, et al. Directed differentiation of human-induced pluripotent stem cells generates active motor neurons[J] Stem Cells. 2009;27(4):806–811. doi: 10.1002/stem.31. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Liu QY, Spusta SC, Mi RF, et al. Human neural crest stem cells derived from human ESCs and induced pluripotent stem cells: induction, maintenance, and differentiation into functional schwann cells[J] Stem Cells Transl Med. 2012;1(4):266–278. doi: 10.5966/sctm.2011-0042. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Rajanahalli P, Meyer K, Zhu L, et al. Conversion of mouse fibroblasts to sphere cells induced by AlbuMAXI-containing medium[J] Front Biosci (Elite Ed) 2012;4:1813–1822. doi: 10.2741/e502. [DOI] [PubMed] [Google Scholar]
- 74.Gu Q, Tomaskovic-Crook E, Lozano R, et al. Functional 3D neural mini-tissues from printed gel-based bioink and human neural stem cells[J] Adv Healthcare Mater. 2016;5(12):1429–1438. doi: 10.1002/adhm.201600095. [DOI] [PubMed] [Google Scholar]