Abstract
目的
探究黏着斑激酶抑制剂TAE226对人口腔鳞状细胞癌细胞上皮间质转化(EMT)过程的影响。
方法
不同浓度(0、1、5、10 µmol·L−1)的TAE226作用于人口腔鳞状细胞癌HSC-3和HSC-4细胞24、48、72 h后,实时定量聚合酶链反应检测EMT标志物E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)的mRNA表达;蛋白质印迹法检测E-cadherin、Vimentin在TAE226作用48 h后的蛋白表达。
结果
实时定量聚合酶链反应检测表明,随着TAE226作用时间和浓度的增加,E-cadherin mRNA的表达增加,Vimentin mRNA的表达降低(P<0.05)。蛋白质印迹法检测表明,随着TAE226浓度的增加,E-cadherin蛋白的表达增加,Vimentin蛋白的表达降低(P<0.05)。
结论
TAE226能有效抑制人口腔鳞状细胞癌细胞株的EMT进程,有望成为治疗口腔鳞状细胞癌的有效药物之一。
Keywords: 黏着斑激酶抑制剂TAE226, 上皮间质转化, 口腔鳞状细胞癌
Abstract
Objective
To study the effect of the focal adhesion kinase inhibitor TAE226 on epithelial-mesenchymal transition (EMT) in human oral squamous cell carcinoma (OSCC) cell line.
Methods
HSC-3 and HSC-4 cells were cultured with TAE226 under different concentrations (0, 1, 5, and 10 µmol·L−1) for 24, 48, and 72 h. Real-time quantitative polymerase chain reaction was performed to detect the mRNA expressions of E-cadherin and Vimentin. The protein expressions of E-cadherin and Vimentin were determined by Western blot assay after 48 h of TAE226 treatment.
Results
Real-time quantitative polymerase chain reaction showed that increasing the TAE226 dose and reaction time resulted in increased and decreased E-cadherin and Vimentin mRNA expressions, respectively (P<0.05). Western blot assays showed that increasing the TAE226 dose resulted in increased and decreased E-cadherin and Vimentin protein expressions, respectively (P<0.05).
Conclusion
TAE226, which is expected to be an effective drug for OSCC treatment, can effectively inhibit the EMT of the OSCC cell line.
Keywords: focal adhesion kinase inhibitor TAE226, epithelial-mesenchymal transition, oral squamous cell carcinoma
黏着斑激酶(focal adhesion kinase,FAK)是一种非受体酪氨酸激酶,通过整合来自胞外的压力、细胞黏着等方面的信号,参与肿瘤的增殖、迁移、侵袭和血管再生等有关的多条信号传导通路,目前已成为肿瘤诊断的分子标志物和恶性肿瘤治疗的重要靶点[1]–[2]。TAE226是一种针对FAK的强效抑制剂,可以有效阻断FAK信号通路[3]。随着研究的深入,人们发现TAE226对口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)具有明显的抗增殖、迁移和侵袭作用,但对发生在OSCC细胞转移阶段的上皮间质转化(epithelial-mesenchymal transition,EMT)进程的作用尚不清楚。本研究采用实时定量聚合酶链反应(polymerase chain reaction,PCR)和蛋白质印迹法(Western blot),探究TAE226在OSCC细胞EMT过程中的作用及其意义。
1. 材料和方法
1.1. 实验材料
人OSCC HSC-3、HSC-4细胞株(由四川大学口腔疾病研究国家重点实验室提供)。TAE226(上海蓝木化工有限公司),优质胎牛血清、PBS缓冲液(北京索莱宝生物科技有限公司),DMEM高糖培养基(赛默飞世尔生物化学制品北京有限公司),DMSO(AMRESCO公司,美国),RNA提取试剂盒(天根生化科技北京有限公司),逆转录试剂(TOYOBO公司,日本),QuantiFast SRBR Green PCR Kit(QIAGEN公司,德国),Anti-E-cadherin抗体、Anti-Vimentin抗体(Abcam公司,英国),二抗(北京博奥森生物技术有限公司),电化学发光(electrochemiluminescence,ECL)检测试剂盒(Millipore公司,美国)。
1.2. 实验方法
1.2.1. TAE226的配置及实验分组
用10.67 mL DMSO溶解5 mg TAE226,配成浓度为1 mmol·L−1的TAE226母液,分装后于-20 °C冰箱中保存。临用前按比例用培养液将其稀释,并使其中DMSO液的含量低于0.1%。本实验将1、5、10 µmol·L−1浓度的TAE226培养液作为实验组,将不含TAE226(0 µmol·L−1)的培养液作为对照组。
1.2.2. 细胞培养和铺板
HSC-3、HSC-4细胞株由含10%胎牛血清和1%双抗的DMEM高糖培养液常规培养,每2天换液1次,待细胞融合度80%~90%时,消化传代。将对数生长期的HSC-3细胞制备成细胞浓度为3×105个·mL−1的细胞悬液,按每孔2 mL接种于六孔板内。培养24 h至贴壁后,弃原培养液,PBS液洗2遍后分别加入含TAE226 0、1、5、10 µmol·L−1的培养液每孔3 mL,摇匀置于37 °C、5%CO2孵箱中培养,培养24、48、72 h时用于EMT标志物E-钙黏蛋白(E-cadherin)和波形蛋白(Vimentin)mRNA的检测,并对培养48 h的细胞进行E-cadherin和Vimentin蛋白检测。
1.2.3. 实时定量PCR检测
按RNA提取试剂盒的操作说明进行操作。分别在HSC-3和HSC-4细胞培养24、48、72 h时将其取出,置于显微镜下观察其生长情况并拍照,用PBS液洗2遍,按每孔1 mL向六孔板中加入Trizol液以裂解细胞,提取总RNA,并于微量分光光度计上检测RNA的纯度及浓度,逆转录合成cDNA,进而扩增E-cadherin和Vimentin的mRNA。反应体系:总RNA模板2 µL(1 µg),蒸馏水6.4 µL,SRBR Green Real time PCR Master Mix 10 µL,上游引物0.8 µL,下游引物0.8 µL。设置2个复孔,扩增条件为:95 °C预变性30 s,95 °C变性30 s,57 °C退火10 s,72 °C延伸15 s,共40个循环。实时定量PCR引物由上海生工生物工程股份有限公司设计并合成(表1)。以目的基因的相对表达量(2−ΔΔCT)计算出各基因相对表达水平,其中ΔCT=CT目的基因−CT内参基因,ΔΔCT=ΔCT实验组−ΔCT对照组。
表 1. 引物序列和产物.
Tab 1 Sequences of primers and products
| 引物名称 | 引物序列(5'-3') | 片段大小/bp |
| GAPDH | F-GACAGTCAGCCGCATCTTCT | 395 |
| R-AAATGAGCCCCAGCCTTCTC | ||
| E-cadherin | F-GAGTGCCAACTGGACCATTCAGTA | 106 |
| R-AGTCACCCACCTCTAAGGCCATC | ||
| Vimentin | F-CTCTCAAAGATGCCCAGGAG | 176 |
| R-GCACGATCCAACTCTTCCTC |
1.2.4. Western blot检测
培养HSC-3和HSC-4细胞48 h后取出六孔板于显微镜下观察细胞生长情况,拍照,将其用PBS液洗2遍,按每孔250 µL向六孔板中加入蛋白裂解液裂解细胞,提取细胞总蛋白,在蛋白液内加入适量的5×蛋白上样缓冲液(蛋白液︰5×蛋白上样缓冲液为4︰1),95~100 °C干锅浴5 min进行变性。聚丙烯酰胺凝胶电泳,切胶、转至PVDF膜。脱脂牛奶室温封闭2 h,4 °C孵育一抗过夜,TBST漂洗PVDF膜5次,每次5 min。室温孵育二抗1 h,TBST洗膜。ECL混合溶液避光孵育1 min,置于凝胶成像系统成像拍照。将拍摄的图片保存,用AlphaEase FC软件测量灰度值,并计算蛋白相对表达量。将目的蛋白的光密度值/内参的光密度值的比值作为目的蛋白的相对表达丰度。
1.3. 统计分析
采用SPSS 17.0软件进行统计学分析。多因素多组间的比较采用重复变量的方差分析,单因素多组间的比较采用单因素方差分析。
2. 结果
2.1. HSC-3和HSC-4细胞在TAE226作用下细胞形态的变化
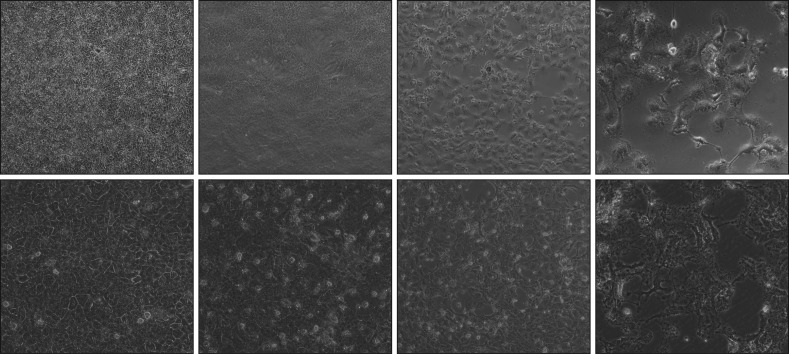
对照组细胞生长快速,彼此紧密贴壁生长,细胞呈短梭形或菱形,细胞膜和细胞核清晰可见,胞质饱满且透亮。加入了TAE226的HSC-3/HSC-4细胞培养后,随着TAE226浓度不断增加,细胞体积逐渐皱缩变小,细胞膜边界不清,细胞固缩成圆形、长梭形、椭圆形或镂空状,最后呈蜂窝样空洞性连接并出现大量脱落漂浮细胞,基本上无贴壁细胞(图1)。
图 1. 不同浓度的TAE226干预72 h后的HSC-3、HSC-4细胞 显微镜 × 200.
Fig 1 HSC-3 and HSC-4 cells were observed after 72 h intervention with TAE226 at different concentrations microscope × 200
上:HSC-3细胞;下:HSC-4细胞。从左到右TAE226的浓度依次为0、1、5、10 µmol·L−1。
2.2. TAE226作用下HSC-3和HSC-4细胞E-cadherin和Vimentin mRNA的表达
TAE226作用下HSC-3细胞E-cadherin和Vimentin mRNA的表达见表2、3。从表2、3可见,1)除对照组(0 µmol·L−1 TAE226)在TAE226作用24 h和48 h时,E-cadherin mRNA的表达无统计学差异外,其他不同浓度和不同时间的比较均有统计学差异(P<0.05),E-cadherin mRNA的表达随TAE226作用时间和浓度的增加而表达增加。2)对照组Vimentin mRNA的表达随时间增加而升高(P<0.05),实验组Vimentin mRNA的表达低于对照组(P<0.05),且随时间和浓度的增加而表达降低(P<0.05)。
表 2. TAE226作用下HSC-3细胞的E-cadherin mRNA表达.
Tab 2 The relative expression of E-cadherin mRNA in HSC-3 cells with TAE226
| TAE226浓度/µmol·L−1 | 作用时间 |
||
| 24 h | 48 h | 72 h | |
| 0 | 1.00±0.25aA | 1.01±0.10aA | 0.80±0.13bA |
| 1 | 1.98±0.66aB | 3.77±0.34bB | 6.41±0.16cB |
| 5 | 4.15±0.02aC | 8.08±0.12bC | 14.52±0.97cC |
| 10 | 10.10±0.84aD | 11.18±0.09bD | 20.58±0.32cD |
注:组内变量和组间变量交互作用F=13.649,P<0.05,二者存在交互作用。同一浓度不同时间比较,F=201.930,P=0.000;进一步两两比较,a、b、c、d字母相同为无统计学差异,字母不同为有统计学差异(P<0.05)。同一时间不同浓度比较,F=145.796,P=0.000;进一步两两比较,A、B、C、D字母相同为无统计学差异,字母不同为有统计学差异(P<0.05)。
表 3. TAE226作用下HSC-3细胞Vimentin mRNA的表达.
Tab 3 The relative expression of Vimentin mRNA in HSC-3 cells with TAE226
| TAE226浓度/µmol·L−1 | 作用时间 |
||
| 24 h | 48 h | 72 h | |
| 0 | 1.01±0.18aA | 1.61±0.12bA | 3.16±0.97cA |
| 1 | 0.90±0.13aB | 0.75±0.06bB | 0.55±0.21cB |
| 5 | 0.76±0.44aC | 0.51±0.03bC | 0.15±0.29cC |
| 10 | 0.25±0.18aD | 0.11±0.05bD | 0.08±0.00cD |
注:组内变量和组间变量交互作用F=55.420,P<0.05,二者存在交互作用。同一浓度不同时间比较,F=9.630,P=0.000;进一步两两比较,a、b、c、d字母相同为无统计学差异,字母不同为有统计学差异(P<0.05)。同一时间不同浓度比较,F=220.215,P=0.000;进一步两两比较,A、B、C、D字母相同为无统计学差异,字母不同为有统计学差异(P<0.05)。
TAE226作用下HSC-4细胞E-cadherin和Vimentin mRNA的表达见表4、5。从表4、5可见,1)对照组E-cadherin mRNA的表达随着时间增加而降低(P<0.05),实验组E-cadherin mRNA的表达高于对照组(P<0.05),且随TAE226作用时间和浓度的增加而表达增加(P<0.05)。2)对照组Vimentin mRNA的表达随着时间增加而增加(P<0.05),除实验组1 µmol·L−1 TAE226作用24 h时Vimentin mRNA的表达与对照组无统计学差异外,其他不同浓度和不同时间的比较均具有统计学差异(P<0.05),实验组Vimentin mRNA的表达低于对照组,且随时间和浓度的增加表达降低(P<0.05)。
表 4. TAE226作用下HSC-4细胞E-cadherin mRNA的表达.
Tab 4 The relative expression of E-cadherin mRNA in HSC-4 cells with TAE226
| TAE226浓度/µmol·L−1 | 作用时间 |
||
| 24 h | 48 h | 72 h | |
| 0 | 1.01±0.18aA | 0.71±0.09bA | 0.68±0.08cA |
| 1 | 1.40±0.10aB | 3.20±0.36bB | 10.01±0.29cB |
| 5 | 2.15±0.50aC | 11.42±1.22bC | 23.65±1.07cC |
| 10 | 3.70±0.34aD | 16.68±0.53bD | 27.08±1.02cD |
注:组内变量和组间变量交互作用F=51.639,P<0.05,二者存在交互作用。同一浓度不同时间比较,F=17.833,P=0.000,进一步两两比较,a、b、c、d字母相同为无统计学差异,字母不同为有统计学差异(P<0.05)。同一时间不同浓度比较,F=616.630,P=0.000,进一步两两比较,A、B、C、D字母相同为无统计学差异字母不同为有统计学差异(P<0.05)。
表 5. TAE226作用下HSC-4细胞Vimentin mRNA的表达.
Tab 5 The relative expression of Vimentin mRNA in HSC-4 cells with TAE226
| TAE226浓度/µmol·L−1 | 作用时间 |
||
| 24 h | 48 h | 72 h | |
| 0 | 0.98±0.10aA | 1.87±0.38bA | 3.22±0.65cA |
| 1 | 0.97±0.32aA | 0.73±0.68bB | 0.45±0.17cB |
| 5 | 0.75±0.27aB | 0.41±0.07bC | 0.20±0.09cC |
| 10 | 0.45±0.21aC | 0.07±0.20bD | 0.04±0.01cD |
注:组内变量和组间变量交互作用F=41.108,P<0.05,二者存在交互作用。同一浓度不同时间比较,F=17.576,P=0.000,进一步两两比较,a、b、c、d字母相同为无统计学差异,字母不同为有统计学差异(P<0.05)。同一时间不同浓度比较,F=106.251,P=0.000,进一步两两比较,A、B、C、D字母相同为无统计学差异,字母不同为有统计学差异(P<0.05)。
2.3. TAE226作用下HSC-3、HSC-4细胞E-cadherin、Vimentin蛋白的表达
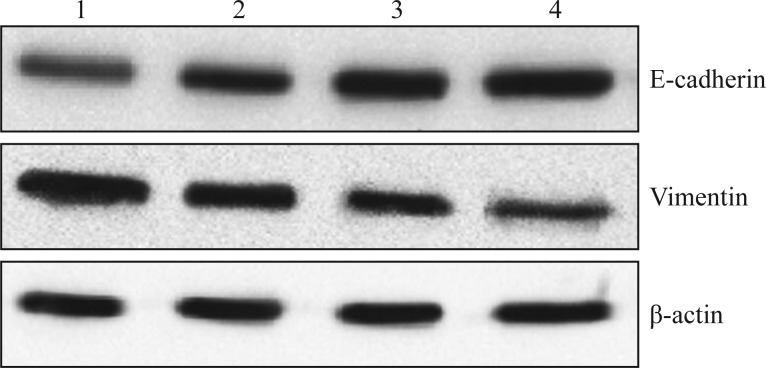
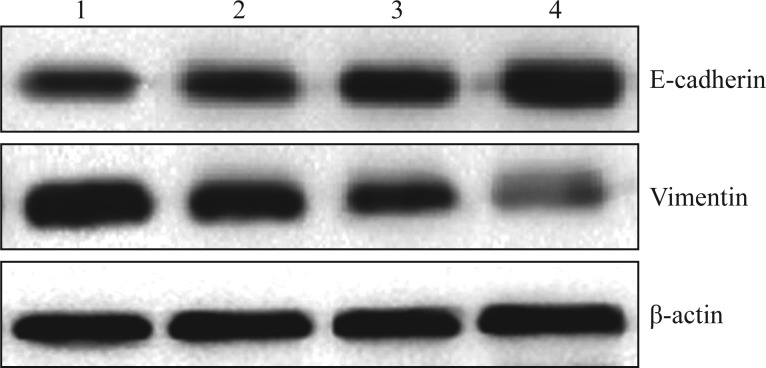
TAE226作用下HSC-3、HSC-4细胞的E-cadherin、Vimentin蛋白表达见图2、3和表6、7。HSC-3、HSC-4细胞的E-cadherin蛋白的表达随TAE226浓度的增加而增加(P<0.05),Vimentin蛋白的表达随TAE226浓度的增加而降低(P<0.05)。表明,TAE226对HSC-3细胞和HSC-4细胞的E-cadherin的蛋白表达有促进作用,对Vimentin的蛋白表达有抑制作用,且该效应具有剂量依赖性。
图 2. Western blot检测HSC-3细胞E-cadherin及Vimentin蛋白的表达.
Fig 2 Level of E-cadherin and Vimentin protein expression in HSC-3 cells by Western blot
1~4分别为0、1、5、10 µmol·L−1的TAE226。
图 3. Western blot检测HSC-4细胞E-cadherin及Vimentin蛋白的表达量.
Fig 3 Level of E-cadherin and Vimentin protein expression in HSC-4 cells by Western blot
1~4分别为0、1、5、10 µmol·L−1的TAE226。
表 6. HSC-3细胞E-cadherin及Vimentin蛋白的表达(灰度比值).
Tab 6 Grayscale ratio of E-cadherin and Vimentin protein in HSC-3 cells
| TAE226浓度/µmol·L−1 | E-cadherin | Vimentin |
| 0 | 0.63±0.15 | 1.54±0.02 |
| 1 | 0.95±0.04 | 1.12±0.12 |
| 5 | 1.13±0.02 | 0.79±0.19 |
| 10 | 1.28±0.10 | 0.57±0.15 |
注:不同浓度E-cadherin蛋白比较,F=15.683,P=0.001,进一步两两比较,各组间均有统计学差异(P<0.05)。不同浓度Vimentin蛋白比较,F=18.745,P=0.001,进一步两两比较,各组间均有统计学差异(P<0.05)。
表 7. HSC-4细胞E-cadherin及Vimentin蛋白的表达(灰度比值).
Tab 7 Grayscale ratio of E-cadherin and Vimentin protein in HSC-4 cells
| TAE226浓度/µmol·L−1 | E-cadherin | Vimentin |
| 0 | 0.57±0.12 | 1.39±0.12 |
| 1 | 0.95±0.04 | 1.13±0.03 |
| 5 | 1.17±0.47 | 0.96±0.04 |
| 10 | 1.34±0.06 | 0.51±0.27 |
注:不同浓度E-cadherin蛋白比较,F=65.291,P=0.001,进一步两两比较,各组间均有统计学差异(P<0.05)。不同浓度Vimentin蛋白比较,F=152.342,P=0.001,进一步两两比较,各组间均有统计学差异(P<0.05)。
3. 讨论
OSCC作为口腔颌面部最常见的恶性肿瘤,癌细胞易从原发部位经淋巴道、血管或体腔等途径,到其他部位生长、定植并最终形成新的肿瘤病灶,即OSCC早期即可发生转移,严重影响预后[4]–[5]。研究[6]表明,EMT在肿瘤转移,尤其是单个肿瘤细胞从肿瘤组织上脱离的过程中起着重要作用。EMT作为生物胚胎发生过程中最基本的过程,在许多慢性病及恶性肿瘤的发生、进展中亦发挥重要作用。当细胞发生EMT时,上皮细胞失去极性,细胞之间黏附连接能力下降,演变为具有间质细胞形态和特性的细胞,并获得了浸润性和游走迁移能力,进而增强了侵袭和转移的能力[7]。
FAK是一种非受体型酪氨酸蛋白激酶,是细胞内重要的骨架蛋白与多种信号通路的关键分子。FAK在整合生长和细胞基质黏附信号方面具有关键作用,是癌症侵袭和转移的主要驱动力,目前已成为研究抗肿瘤药物的重要靶点之一[8]。TAE226是针对FAK的一种ATP竞争性酪氨酸激酶抑制剂。Lietha等[9]在体外细胞实验以及体内动物模型诱癌实验中证实,TAE226可有效抑制肿瘤的生长及侵袭,延长胶质瘤或卵巢肿瘤植入小鼠的寿命。Hehlgans等[10]研究也发现,TAE226作用于三维细胞培养模型中的头颈部鳞状细胞癌(squamous cell carcinoma of the head and neck,HNSCC)细胞后,细胞的放射敏感性增强,这也说明TAE226在临床上可能会提高HNSCC放射治疗的有效性。Kurio等[11]研究发现,TAE226可抑制破骨前细胞RAW264.7转变为破骨细胞,抑制成熟破骨细胞的微核和肌动蛋白环的形成,提示TAE226在破骨前细胞、成熟破骨细胞、骨基质细胞中均参与了溶骨性转移和活化,可有效治疗肿瘤性骨转移。本课题组的前期研究发现,TAE226对OSCC细胞有明显的抗增殖、迁移、侵袭作用,本实验旨在研究TAE226对OSCC细胞转移阶段的EMT进程是否有抑制作用,探索TAE226的抗癌机制,以期为TAE226的临床应用提供依据,为口腔黏膜癌变的防治提供新的策略。
肿瘤细胞发生EMT时伴有多种上皮标志物的下调,如E-cadherin、β-连环蛋白(β-catenin)等,同时间质标记物上调,包括N-cadherin、Vimentin、纤连蛋白等[12]–[14]。E-cadherin是广泛分布于上皮组织的跨膜糖蛋白,是一种维持上皮细胞形态、结构的完整性和极性的细胞黏附分子,Hermiston等[15]发现E-cadherin表达水平的降低可显著増强小鼠卵巢癌细胞株体外迁移能力。Perl等[16]在Rip-Tag小鼠实验中证实了E-cadherin表达下调是腺瘤进展为浸润性癌的先决条件。E-cadherin的表达与肿瘤的分化程度、发展转移密切相关,E-cadherin表达缺失或降低可使肿瘤细胞黏附能力下降,促进上皮性肿瘤细胞顺利实现浸润及转移,是肿瘤转移的抑制因素,也是EMT发生的关键性蛋白,E-cadherin转录的抑制是EMT的主要机制[17]。Vimentin是一种进化上保守的中间纤维蛋白,作为一种重要的骨架蛋白以维持细胞的完整性,与细胞骨架构成和细胞黏附密切相关[18]。Vimentin主要表达于间充质,在正常上皮组织中不表达或低表达,是间质型细胞的标志蛋白之一。研究[19]表明,当Vimentin表达于上皮源性的肿瘤细胞时,赋予了上皮源性细胞成纤维细胞样的特征,使细胞更易迁移和运动,细胞间黏附能力下降,迁移、侵袭和转移能力增强,发生上皮-间质转变,因此E-cadherin、Vimentin的表达水平反映了肿瘤细胞EMT的发生程度。在已有的相关研究中,不同细胞所用的TAE226浓度不尽相同,从500 nmol·L−1至10 µmol·L−1不等[20]。本课题组的前期研究发现,1 µmol·L−1的TAE226对HSC-3细胞的增殖、迁移、侵袭已有明显的抑制效果,本实验为寻找适宜的浓度,设置1 µmol·L−1到10 µmol·L−1作为检测浓度。在本实验中,TAE226作用下的人OSCC HSC-3细胞的上皮标志物E-cadherin表达增加及间质标志物Vimentin表达下降,且该药物效应具有剂量和时间的依赖性,这说明HSC-3细胞的EMT水平随TAE226的增加而下降。Kurio等[21]研究发现,TAE226可抑制FAK pTYr(397)和AKT pSer(473)的表达,TYr(397)是FAK最主要的自磷酸化位点。Jones等[22]发现,磷酸化后的Tyr397通过与Src的SH2结构域结合,进而激活下游PI3K/Akt通路,而后者激活后可以参与诱导细胞EMT的发生,且经TAE226处理后的OSCC细胞,其黏附丧失速度下降,本实验结果与之相符,TAE226可能通过下调FAK pTYr(397)的表达而抑制HSC-3细胞EMT进程的。
综上,TAE226作为FAK的强效抑制剂之一,能有效抑制OSCC细胞EMT过程,从而发挥抑制肿瘤细胞侵袭转移能力,但具体分子机制还需进一步研究。单独使用TAE226或与其他药物联合使用可有望成为治疗OSCC的一种有效方法,为进一步探索口腔肿瘤的防治策略提供参考。
Funding Statement
[基金项目] 四川省科技计划(2018JY0401)
Supported by: Sichuan Science and Technology Program (2018JY0401).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Rustad KC, Wong VW, Gurtner GC. The role of focal adhesion complexes in fibroblast mechanotransduction during scar formation[J] Differentiation. 2013;86(3):87–91. doi: 10.1016/j.diff.2013.02.003. [DOI] [PubMed] [Google Scholar]
- 2.Wang YJ, Zhang ZF, Fan SH, et al. MicroRNA-433 inhibits oral squamous cell carcinoma cells by targeting FAK[J] Oncotarget. 2017;8(59):100227–100241. doi: 10.18632/oncotarget.22151. [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 3.Otani H, Yamamoto H, Takaoka M, et al. TAE226, a bis-anilino pyrimidine compound, inhibits the EGFR-mutant kinase including T790M mutant to show anti-tumor effect on EGFR-mutant non-small cell lung cancer cells[J] PLoS One. 2015;10(6):e0129838. doi: 10.1371/journal.pone.0129838. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Sathiyasekar AC, Chandrasekar P, Pakash A, et al. Overview of immunology of oral squamous cell carcinoma[J] J Pharm Bioallied Sci. 2016;8(Suppl 1):S8–S12. doi: 10.4103/0975-7406.191974. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Çankaya H, Güneri P, Epstein JB. Adjunctive methods and devices for clinical detection of oral squamous cell carcinoma[J] Oral Health Prev Dent. 2015;13(1):29–39. doi: 10.3290/j.ohpd.a32667. [DOI] [PubMed] [Google Scholar]
- 6.Zhang MX, Zheng SS, Jing CY, et al. S100A11 promotes TGF-β1-induced epithelial–mesenchymal transition through SMAD2/3 signaling pathway in intrahepatic cholangiocarcinoma[J] Future Oncol. 2018;14(9):837–847. doi: 10.2217/fon-2017-0534. [DOI] [PubMed] [Google Scholar]
- 7.Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J] Nat Rev Mol Cell Biol. 2014;15(3):178–196. doi: 10.1038/nrm3758. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Goñi GM, Epifano C, Boskovic J, et al. Phosphatidylinositol 4,5-bisphosphate triggers activation of focal adhesion kinase by inducing clustering and conformational changes[J] Proc Natl Acad Sci USA. 2014;111(31):E3177–E3186. doi: 10.1073/pnas.1317022111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Lietha D, Eck MJ. Crystal structures of the FAK kinase in complex with TAE226 and related bis-anilino pyrimidine inhibitors reveal a helical DFG conformation[J] PLoS One. 2008;3(11):e3800. doi: 10.1371/journal.pone.0003800. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Hehlgans S, Lange I, Eke I, et al. 3D cell cultures of human head and neck squamous cell carcinoma cells are radiosensitized by the focal adhesion kinase inhibitor TAE226[J] Radiother Oncol. 2009;92(3):371–378. doi: 10.1016/j.radonc.2009.08.001. [DOI] [PubMed] [Google Scholar]
- 11.Kurio N, Shimo T, Fukazawa T, et al. Anti-tumor effect in human breast cancer by TAE226, a dual inhibitor for FAK and IGF-IR in vitro and in vivo[J] Exp Cell Res. 2011;317(8):1134–1146. doi: 10.1016/j.yexcr.2011.02.008. [DOI] [PubMed] [Google Scholar]
- 12.Attramadal CG, Kumar S, Boysen ME, et al. Tumor budding, EMT and cancer stem cells in T1-2/N0 oral squamous cell carcinomas[J] Anticancer Res. 2015;35(11):6111–6120. [PubMed] [Google Scholar]
- 13.Natsuizaka M, Whelan KA, Kagawa S, et al. Interplay between Notch1 and Notch3 promotes EMT and tumor initiation in squamous cell carcinoma[J] Nat Commun. 2017;8(1):1758. doi: 10.1038/s41467-017-01500-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Palen K, Weber J, Dwinell MB, et al. E-cadherin re-expression shows in vivo evidence for mesenchymal to epithelial transition in clonal metastatic breast tumor cells[J] Oncotarget. 2016;7(28):43363–43375. doi: 10.18632/oncotarget.9715. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Hermiston ML, Wong MH, Gordon JI. Forced expression of E-cadherin in the mouse intestinal epithelium slows cell migration and provides evidence for nonautonomous regulation of cell fate in a self-renewing system.[J] Genes Dev. 1996;10(8):985–996. doi: 10.1101/gad.10.8.985. [DOI] [PubMed] [Google Scholar]
- 16.Perl AK, Wilgenbus P, Dahl U, et al. A causal role for E-cadherin in the transition from adenoma to carcinoma[J] Nature. 1998;392(6672):190–193. doi: 10.1038/32433. [DOI] [PubMed] [Google Scholar]
- 17.Zhou WH, Gong L, Wu QC, et al. doi: 10.1186/s13046-018-0890-4. Correction to: PHF8 upregulation contributes to autophagic degradation of E-cadherin, epithelial-mesenchymal transition and metastasis in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2018. doi.org/10.1186/s13046-018-0944-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Murakami M, Imabayashi K, Watanabe A, et al. Identification of novel function of vimentin for quality standard for regenerated pulp tissue[J] J Endod. 2012;38(7):920–926. doi: 10.1016/j.joen.2012.01.010. [DOI] [PubMed] [Google Scholar]
- 19.Li LF, Wei ZJ, Sun H, et al. Abnormal β-catenin immunohistochemical expression as a prognostic factor in gastric cancer: a meta-analysis[J] World J Gastroenterol. 2014;20(34):12313–12321. doi: 10.3748/wjg.v20.i34.12313. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Schultze A, Decker S, Otten J, et al. TAE226-mediated inhibition of focal adhesion kinase interferes with tumor angiogenesis and vasculogenesis[J] Invest New Drugs. 2010;28(6):825–833. doi: 10.1007/s10637-009-9326-5. [DOI] [PubMed] [Google Scholar]
- 21.Kurio N, Shimo T, Fukazawa T, et al. Anti-tumor effect of a novel FAK inhibitor TAE226 against human oral squamous cell carcinoma[J] Oral Oncol. 2012;48(11):1159–1170. doi: 10.1016/j.oraloncology.2012.05.019. [DOI] [PubMed] [Google Scholar]
- 22.Jones RJ, Brunton VG, Frame MC. Adhesion-linked kinases in cancer, emphasis on Src, focal adhesion kinase and PI 3-kinase[J] Eur J Cancer. 2000;36(13):1595–1606. doi: 10.1016/s0959-8049(00)00153-2. [DOI] [PubMed] [Google Scholar]