Samenvatting
Infectieziekten zijn ziekten veroorzaakt door levende micro-organismen. Infectieziekten zijn verantwoordelijk voor meer dan een kwart van alle sterfgevallen wereldwijd. Dit aantal kan toenemen door een vergrijzende bevolking, toenemend gebruik van immunosuppressiva, antibioticaresistentie en nieuwe epidemieën zoals meest recent ebola. Resistentie tegen antimicrobiële middelen is een probleem bij middelen gebruikt in de behandeling van hiv, tuberculose en malaria, en in toenememde mate is er ook sprake van multiresistente grampositieve en gramnegatieve bacteriën die een simpele urineweginfectie of ernstige sepsis veroorzaken. In dit hoofdstuk worden de belangrijkste infectieziekten besproken aan de hand van klinische problemen: koorts, sepsis, meningitis en encefalitis, infectieuze gastro-enteritis, infectieziekten met exanthemen, infecties gepaard gaand met lymfeklierzwelling, infecties met geelzucht, opportunistische infecties, ziekenhuisinfecties, bioterrorisme, protozoaire ziekten, worminfecties en tot slot importziekten. Ook wordt een overzicht gegeven van de belangrijkste antibiotica en antivirale middelen.
Elektronisch aanvullend materiaal
De online versie van dit hoofdstuk (doi:10.1007/978-90-368-1841-4_6) bevat aanvullend materiaal, dat beschikbaar is voor geautoriseerde gebruikers.
Inleiding
Kernpunten
Of een infectie ontstaat, hangt af van de pathogeniteit van het micro-organisme en de kwaliteit van de afweer.
Men kan de infectieziekten microbiologisch indelen naar de aard van de verwekkers.
Infectieziekten (synoniem: infecties) zijn ziekten veroorzaakt door levende micro-organismen. Niet alle ziekmakende micro-organismen kunnen van de ene op de andere mens worden overgedragen; in dat geval zijn patiënten niet besmettelijk. Een deel van de infectieziekten wordt veroorzaakt door micro-organismen die huid en slijmvliezen bewonen (koloniseren); zij kunnen infecties veroorzaken wanneer de verdedigingsmechanismen tegen deze micro-organismen falen. Intacte huid en slijmvliezen vormen het belangrijkste verdedigingsmechanisme tegen het binnendringen van micro-organismen. Sommige micro-organismen zijn in staat door deze intacte barrière te dringen, andere kunnen dat alleen door een beschadigd oppervlak. Of daarna al of niet ‘ziekte’ ontstaat, hangt af van de humorale en cellulaire verdedigingsmechanismen van de gastheer tegen de micro-organismen; die verdediging is deels genetisch bepaald, waardoor de één gevoeliger is voor het ziekmakend vermogen van een bepaald micro-organisme dan de ander (zie 10.1007/978-90-368-1841-4_5). Het genoemde ziekmakend vermogen van micro-organismen (ook wel pathogeniteit genoemd) kan worden gedefinieerd als het vermogen van een micro-organisme te concurreren met de omgevende microflora, weefsel te beschadigen en de verdedigingsmechanismen van de gastheer te doorbreken. De pathogeniteit van een micro-organisme wordt gerelateerd aan het aantal individuen dat ziek wordt na met het micro-organisme in contact te zijn gekomen. Het zal duidelijk zijn dat wanneer de verdedigingsmechanismen van de gastheer niet optimaal functioneren, ook weinig pathogene micro-organismen infecties kunnen veroorzaken. Zulke infecties noemen we opportunistische infecties.
De variatie in het ziekmakend vermogen van micro-organismen bij gezonde mensen is deels genetisch bepaald. Zo hebben mensen die heterozygoot zijn voor een deletie in het CCR-5-gen (een coreceptor voor de aanhechting van het humaan immunodeficiëntievirus) een aanzienlijk langere incubatietijd dan personen die deze genmutatie niet hebben.
Men kan de infectieziekten microbiologisch indelen naar de aard van de verwekkers (Figuur 6.1).

Voor dit hoofdstuk is grotendeels gekozen voor een klinische indeling. In ▶ par. 6.3 en verder zullen achtereenvolgens worden besproken: koorts, sepsis, meningitis en encefalitis, infectieuze gastro-enteritis, infectieziekten met exanthemen, infecties gepaard gaand met lymfeklierzwelling, infecties met geelzucht, opportunistische infecties, ziekenhuisinfecties, bioterrorisme, protozoaire ziekten, worminfecties en tot slot importziekten. Voor een bespreking van luchtweginfecties en urineweginfecties wordt verwezen naar 10.1007/978-90-368-1841-4_16#Sec143 en 10.1007/978-90-368-1841-4_14#Sec36.
Deze indeling heeft een aantal nadelen:
Een aantal infectieziekten is in meer dan één categorie onder te brengen (bijvoorbeeld meningitis kan gepaard gaan met exantheem).
De beschrijving van virusinfecties, bacteriële infecties enzovoort loopt door elkaar.
Niettemin sluit de gehanteerde indeling aan op de behoefte van de medicus practicus. In Tabel 6.1 zijn ten behoeve van de differentiële diagnostiek de potentiële verwekkers bij een aantal symptomen geplaatst.
| symptomen | ziekteverwekkers onder andere |
|---|---|
| (bovenste)luchtweginfectie |
(para-)influenzavirus adenovirus RS-virus rinovirus metapneumovirus coronavirus enterovirus hantavirus Coxiella burneti Mycoplasma pneumoniae Legionella sp. Chlamydia psittaci Chlamydia pneumoniae |
| angina, faryngitis |
epstein-barrvirus (para-)influenzavirus adenovirus RS-virus rinovirus enterovirus Chlamydia pneumoniae |
| meningitis serosa |
(para-)influenzavirus adenovirus RS-virus rinovirus enterovirus Mycoplasma pneumoniae |
| (meningo-)encefalitis |
bofvirus herpessimplexvirus varicellazostervirus mazelenvirus arbovirus (zoals Tick-borne encephalitis virus) hiv |
| huidexantheem (maculopapuleus) |
enterovirus mazelenvirus rubellavirus adenovirus parvovirus B19 humaan herpesvirus 6 hiv Rickettsiae |
| huidexantheem (vesiculeus) |
varicellazostervirus herpessimplexvirus Coxsackie A-virus enterovirus type 71 |
| artritis | parvovirus B19 |
| artralgie | rubellavirus |
| stomatitis, gingivitis | herpessimplexvirus |
| ulcera slijmvliezen |
Coxsackie A-virus varicellazostervirus |
| conjunctivitis, conjunctivale | herpessimplexvirus |
| vaatinjectie |
adenovirus denguevirus hantavirus rubellavirus mazelenvirus enterovirus type 70 Chlamydia trachomatis |
| (gastro-)enteritis kinderen |
enterovirus rotavirus adenovirus type 40 en 41 norovirus |
| hepatitis |
hepatitis A‑, B‑, C‑, D‑, E-virus cytomegalovirus epstein-barrvirus Coxiella burneti |
| lymfeklierzwellingen |
epstein-barrvirus cytomegalovirus adenovirus rubellavirus hiv |
| immuundeficiëntie | hiv |
| hemorragische cystitis | adenovirus |
| nierinsufficiëntie | hantavirus |
Voor veel infectieziekten bestaan voor de bestrijding richtlijnen die regelmatig worden geactualiseerd. Daar kan men ook vinden welke infectieziekten dienen te worden gemeld. Daarin staat ook de meest actuele informatie over uitbraken in Nederland en in het buitenland. Deze informatie is te vinden op de website van het Centrum Infectieziektebestrijding (www.rivm.nl/cib).
De principes van antimicrobiële therapie
Kernpunten
Antimicrobiële therapie is gericht tegen micro-organismen en is derhalve een causale therapie.
Om antimicrobiële therapie in te stellen, moet men de verwekker kennen of vermoeden.
Antimicrobiële therapie is gericht tegen micro-organismen en is derhalve een causale therapie. Voordat men antimicrobiële therapie instelt, dient men daarom aannemelijk te maken dat het om een infectieziekte gaat en of die met de betreffende antimicrobiële therapie effectief behandeld kan worden. Dit zal op grond van anamnestische en fysisch-diagnostische gegevens, alsmede op grond van de bevindingen bij aanvullend onderzoek (laboratoriumonderzoek en beeldvorming) moeten gebeuren.
Besluit men dat het om een infectie gaat en dat therapie mogelijk en zinvol is, dan wordt het vervolgens belangrijk vast te stellen wat de verwekker is. Dit betekent meestal dat men materiaal voor microbiologisch onderzoek afneemt en zich daarna bezint op een behandeling, gericht tegen de meest waarschijnlijke verwekker. Heeft men met een bacteriële infectie van doen, dan is er een uitgebreid aanbod aan antimicrobiële middelen (antibiotica). Wel zijn bacteriën in toenemende mate resistent tegen antibiotica. Nieuwe antibiotica zijn in de afgelopen 25 jaar nauwelijk ontwikkeld, terwijl het arsenaal aan middelen werkzaam tegen virussen en tegen schimmels sterk is toegenomen. Om historische redenen worden hierna eerst de antibiotica besproken.
[Historie]Intermezzo 6.1 Soms is de werkzaamheid van een nieuw geneesmiddel zonder meer duidelijk
Mold for infections
A marvelous mold that saves lives when sulfa drugs fail was described in the British Lancet last month by Professor Howard Walter Florey and colleagues of Oxford. The healing principle, called penicillin, is extracted from the velvety-green Penicillium notatum, a relative of the cheese mold. Although it does not kill germs, the mold stops the growth of streptococci and staphylococci with a power ‘as great or greater than that of the most powerful antiseptics known’. Once the germs are checked, the body’s white blood cells finish them.
Tried in ten different cases for a variety of infections, the mold produced effective results in nine.
(TIME, 15 september 1941)
De piramide van de antibiotische therapie
Kernpunten
Defecten in de afweermechanismen verhogen de risico’s op het ontstaan van infecties.
Kolonisatieresistentie is het vermogen van commensale micro-organismen om kolonisatie met andere, meestal potentieel pathogene micro-organismen tegen te gaan.
Antimicrobiële therapie brengt belangrijke verschuivingen in de microflora van de gastheer teweeg.
Bepaling van de antimicrobiële gevoeligheid geeft richting aan de behandeling.
Antimicrobiële therapie draagt bij aan resistentievorming.
Onderscheid resistentievorming van de flora van de patiënt en van de omgevingsflora.
Farmacokinetische parameters bepalen samen met de farmacodynamiek van het antimicrobiële middel het uiteindelijke effect op de infectie.
De toxiciteit van de antimicrobiële geneesmiddelen loopt sterk uiteen.
Men moet beseffen dat het bij antibiotische therapie om een aantal interacties gaat tussen de therapie, de verwekker van de infectie (het pathogeen), de gastheer (de patiënt) en de commensale flora. Tezamen vormen deze grootheden en hun interacties een piramide, zoals weergegeven in Figuur 6.2.

Een belangrijke interactie tussen verwekker en gastheer wordt gevormd door de virulentie van de verwekker. Virulentie of aanvalskracht hangt nauw samen met pathogeniteit. De gastheer stelt zich tegen micro-organismen te weer met behulp van de verdedigingsmechanismen (gastheerweerstand), zoals besproken in 10.1007/978-90-368-1841-4_5. Defecten in de afweermechanismen verhogen de risico’s op het ontstaan van infecties. Bovendien zullen infecties bij stoornissen in de afweer in het algemeen ernstiger verlopen. Dit is voor de keuze en de dosering van de antimicrobiële middelen van belang, aangezien deze middelen dan de defecten in de afweer moeten compenseren. Uit dierexperimenteel onderzoek is duidelijk dat in afwezigheid van functionerende granulocyten hogere doses antibiotica en andere doseringsschema’s nodig zijn voor een therapeutisch effect. Voor de keuze van de initiële antimicrobiële therapie is het van belang zich te realiseren dat bepaalde defecten in de afweer predisponeren voor bepaalde infecties (zie ▶ par. 6.11).
De interacties tussen pathogene en commensale micro-organismen kunnen worden omschreven als kolonisatie en kolonisatieresistentie . Kolonisatieresistentie is het vermogen van commensale micro-organismen om kolonisatie met andere, meestal potentieel pathogene micro-organismen tegen te gaan. Een goed voorbeeld van kolonisatieresistentie is het microbiologisch evenwicht in de dikke darm. De anaeroben in de darm kunnen uitgroeien tot concentraties van 1011 per gram darminhoud en laten niet toe dat de aeroben uitgroeien tot meer dan 107 of 108 per gram. Dit antagonisme berust waarschijnlijk op competitie om nutriënten. Dat de anaeroben de aeroben in hun uitgroei hinderen, blijkt wanneer de anaeroben met behulp van antibiotica worden geëlimineerd; in dat geval groeien de aeroben uit tot 1011 per gram. In dat geval kunnen ook aeroben vanuit het voedsel en de omgeving de darm koloniseren. Uit het voorgaande zal duidelijk zijn geworden dat we met het geven van antimicrobiële therapie belangrijke verschuivingen in de microflora van de gastheer teweeg kunnen brengen. De mate waarin de kolonisatieresistentie wordt aangetast, verschilt per antibioticum en dit kan van belang zijn voor bepaalde categorieën patiënten, zoals patiënten met een ernstig verminderde weerstand. In hoeverre beïnvloeding van de kolonisatieresistentie echter bijdraagt tot het probleem van de vorming van bacteriële resistentie tegen antibiotica, zowel in het ziekenhuis als daarbuiten, is niet duidelijk. Onze kennis over de darmflora (het microbioom van de darm) neemt op dit moment zeer sterk toe dankzij de nieuwe genetische technieken.
Activiteit van antimicrobiële middelen enerzijds en resistentie van micro-organismen tegen deze middelen anderzijds worden vaak met de resultante van beide aangeduid, dat wil zeggen gevoeligheid of ongevoeligheid. Bij de keuze van antimicrobiële therapie zullen we ons waar mogelijk laten leiden door gegevens van kweek en gevoeligheidsbepaling in vitro. Hierbij moet echter wel worden aangetekend dat de kwantitatieve gegevens van de gevoeligheidsbepaling (minimaal remmende concentraties of een afgeleide daarvan) niet zonder meer naar de in-vivosituatie mogen worden vertaald. Slechts voor weinig infecties zijn de noodzakelijke effectieve concentraties van antibiotica in vivo bekend. Om deze kennis te vergroten, zijn goede dierexperimentele en klinische onderzoeken nodig. Niettemin zijn de in-vitrogegevens van groot belang voor het therapeutisch handelen.
Bij elke in te stellen antimicrobiële therapie moet de clinicus zich ervan bewust zijn dat hij bijdraagt aan de resistentievorming; niet alleen op het niveau van de flora van de patiënt, maar ook van de microflora in de omgeving. Voor een bespreking van de mechanismen van resistentievorming wordt verwezen naar de leerboeken over medische microbiologie. Hoewel over deze mechanismen de afgelopen jaren zeer veel bekend is geworden, is het relatieve belang van de verschillende mechanismen voor het resistentieprobleem zowel bij de patiënt als in zijn omgeving niet goed bekend. Wel is vast komen te staan dat er een relatie bestaat tussen het totale gebruik van een bepaald antibioticum in een ziekenhuis en de hoeveelheid resistente stammen die in de loop van de tijd worden geïsoleerd. Wereldwijd is er grote zorg over de toename van resistente bacteriën (Tabel 6.2 en ▶intermezzo 6.2). Inmiddels zijn er bacteriën die zo resistent zijn dat infecties ermee niet of nauwelijks meer behandelbaar zijn. Voorbeelden hiervan zijn carbapenemaseproducerende Enterobacteriaceae (ongevoelig voor carbapenems, die algemeen worden beschouwd als laatste redmiddelen) en de volledig ongevoelige stammen die NDM-1 (New Delhi metallobetalactamase-1) produceren.
| meticillineresistente Staphylococcus aureus |
| meticillineresistente coagulasenegatieve stafylokokken, bijvoorbeeld Staphylococcus epidermidis |
| penicillineongevoelige pneumokokken |
| vancomycineresistente enterokokken |
| multiresistente gonokokken |
| amoxicillineresistente Haemophilus influenzae |
| multiresistente Enterobacteriaceae |
| resistente Salmonellae |
| resistente Shigellae |
| multiresistente Mycobacterium tuberculosis |
Een restrictief antibioticabeleid leidt tot een minder snelle toename van resistentievorming.
Een belangrijke interactie tussen patiënt en antimicrobieel geneesmiddel vindt plaats in de vorm van farmacokinetiek . Om in vivo werkzaam te kunnen zijn, moet het toegediende antibioticum de plaats van de infectie in voldoende concentratie bereiken. Farmacokinetische parameters bepalen samen met de intrinsieke werkzaamheid van het antimicrobiële middel het uiteindelijke effect op de infectie. De hoogte van de dosering en de doseringsintervallen worden grotendeels op grond hiervan bepaald. Het is bij de behandeling van een infectie steeds nodig zich af te vragen of de infectie zich afspeelt in een zogenoemd diep compartiment (bijvoorbeeld de liquorruimte, de hersenen, het skelet, de prostaat); en men moet zich realiseren dat er wat dit betreft grote verschillen in werkzaamheid bestaan tussen de diverse antimicrobiële middelen. Ook voor de toxiciteit van geneesmiddelen is de farmacokinetiek van groot belang. De clinicus dient zo veel kennis van de farmacokinetiek te hebben dat hij bij een gestoorde nierfunctie of afwijkende lichaamssamenstelling veilig maar effectief kan doseren.
De toxiciteit van de antimicrobiële geneesmiddelen loopt sterk uiteen. Enerzijds zijn er de voor de bacterie selectief toxische penicillinen en cefalosporinen, anderzijds kennen we de voor de mens en bacterie zeer toxische aminoglycosiden (Tabel 6.3). Een gedetailleerde beschrijving van de potentiële bijwerkingen van de verschillende middelen valt buiten het bestek van dit hoofdstuk.
| antibiotische groep | representant | werkingsmechanisme | bacteriostatisch/-cide | belangrijke bijwerkingen |
|---|---|---|---|---|
| penicillinen | amoxicilline | remming celwandsynthese | bactericide | allergie |
| cefalosporinen | cefuroxim | remming celwandsynthese | bactericide | allergie |
| tetracyclinen | doxycycline | remming eiwitsynthese | bacteriostatisch | schade voor vrucht, groeiend gebit en bot |
| aminoglycosiden | gentamicine | remming eiwitsynthese | bactericide | ototoxiciteit, nefrotoxiciteit |
| macroliden | erytromycine | remming eiwitsynthese | bacteriostatisch | nausea |
| lincomycinen | clindamycine | remming eiwitsynthese | bacteriostatisch | pseudomembraneuze colitis |
| rifamycinen | rifampicine | remming eiwitsynthese | bactericide | hepatotoxiciteit |
| glycopeptiden | vancomycine | remming celwandsynthese | bactericide | rodeneksyndroom, ototoxiciteit |
| sulfonamiden | sulfamethoxazol | remming para-aminobenzoëzuur | bacteriostatisch | allergie, beenmergremming |
| trimethoprim | trimethoprim | remming dihydrofolaatreductase | bacteriostatisch | beenmergremming |
| chinolonen | ciprofloxacine | remming gyrase | bactericide | nausea, onrust, achillestendinitis |
| nitrofuranen | nitrofurantoïne | remming koolhydraatsynthese | bactericide | neuropathie |
| oxazolidinonen | linezolid | remming eiwitsynthese | bacteriostatisch | beenmergremming, neuropathie |
| lipopeptiden | daptomycine | verstoring celmembraan | bactericide | nausea, stijging CPK-waarden |
Voor antibioticavoorschriften waarover nationale consensus bestaat, wordt de lezer verwezen naar de website van de Stichting Werkgroep Antibioticabeleid (SWAB) (www.swab.nl > antibioticaboekje). In Tabel 6.3 zijn de eigenschappen van veelgebruikte antibiotica beknopt aangegeven. In Tabel 6.4 zijn de gebruikelijk te verwachten gevoeligheids- en resistentiegegevens voor een aantal belangrijke antibiotica weergegeven.
| bacterie | penicilline G | flucloxacilline | amoxicilline | amoxicilline- clavulaanzuur | cefuroxim | doxycycline | co-trimoxazol | ciprofloxacine | metronidazol |
|---|---|---|---|---|---|---|---|---|---|
|
S. aureus β-lactamase+ |
R | S | R | S | S | S/R | S | S/R | R |
|
S. aureus β-lactamase– |
S | S | S | S | S | S/R | S | S/R | R |
| MRSA | R | R | R | R | R | S/R | S/R | S/R | R |
| Streptococcus pneumoniae | S | S | S | S | S | S | S | I | R |
| S. pyogenes | S | S | S | S | S | S | S | S | R |
| Enterococcus faecalis | I | R | S | S | R | I | S/R | R | R |
| N. gonorrhoeae β-lactamase– | S | I | S | S | S | S/R | S/R | S | R |
| N. gonorrhoeae β-lactamase+ | R | I | R | S | S | S/R | S/R | S | R |
| H. influenzae | R | R | S/R | S | S | S | S | S | R |
| E. coli | R | R | S/R | S | S | S/R | S/R | S | R |
| Klebsiella spp. | R | R | R | S | S | S/R | S/R | S | R |
| Pseudomonas aeruginosa | R | R | R | R | R | R | R | S | R |
| Bacteroides fragilis | R | R | R | S | R | S | R | R | S |
β-lactamase+: β-lactamasevormend; β-lactamase–: niet- β-lactamasevormend; I: intermediair gevoelig; R: resistent; S: sensitief (gevoelig); MRSA: meticillineresistente Staphylococcus aureus.
Initiële antimicrobiële therapie en aanpassing ervan
De criteria voor de keuze van een antimicrobieel middel zijn weergegeven in Tabel 6.5.
| grampositieve kokken | |
| Streptococcus pneumoniae | benzylpenicilline* |
| hemolytische streptokokken | benzylpenicilline* |
| vergroenende streptokokken | benzylpenicilline |
| enterokokken | amoxicilline met aminoglycoside** |
| Staphylococcus aureus | flucloxacilline*** |
| gramnegatieve kokken | |
| Neisseria meningitidis | benzylpenicilline |
| Neisseria gonorrhoeae | |
| – penicillineongevoelig | 3e generatie cefalosporine of fluorochinolon |
| grampositieve staven | |
| Clostridium perfringens | benzylpenicilline |
| Clostridium tetani | benzylpenicilline |
| Clostridium difficile | metronidazol of vancomycine |
| Listeria monocytogenes | amoxicilline |
| gramnegatieve staven | |
| Haemophilus influenzae | |
| – geen β-lactamasevormer | amoxicilline |
| – β-lactamasevormer | amoxicilline-clavulaanzuur |
| Escherichia coli | amoxicilline-clavulaanzuur |
| Salmonella typhi/paratyphi | fluorochinolon |
| andere Enterobacteriaceae | afhankelijk van gevoeligheidsbepaling |
| Pseudomonas aeruginosa | ceftazidim en/of aminoglycoside, of ciprofloxacine |
| Bacteroides fragilis | metronidazol |
* Bij milde infecties kan met feneticilline (per os) worden behandeld.
** Bij milde infecties kan met amoxicilline (per os) worden behandeld.
*** Tenzij meticillineresistent (MRSA), dan vancomycine of teicoplanine.
| men kiest voor het middel dat |
| – actief is tegen de (vermoede) verwekker (Tabel 6.6) |
| – goed doordringt op de plaats van de infectie |
| – weinig toxisch is |
| – weinig aanleiding geeft tot het verschijnen van resistente micro-organismen bij de patiënt en in zijn omgeving |
| – op de gewenste wijze kan worden toegediend |
| – het goedkoopst is |
Deze keuzecriteria hebben niet alleen geldigheid voor de initiële therapie, maar ook – en wellicht a fortiori – voor de aanpassing van de therapie wanneer gegevens van kweek en gevoeligheid bekend worden. Dikwijls kan de initiële therapie al sterk worden vereenvoudigd op grond van de eerste kweekgegevens (deze aanpassing van de therapie wordt in de Angelsaksische literatuur streamlining genoemd).
Combinatie van antibiotica
Kernpunt
In een beperkt aantal omstandigheden heeft het zin antimicrobiële middelen te combineren.
Het combineren van antibiotica heeft een verbreding van het spectrum tot gevolg, waardoor de kans op het verschijnen van resistente micro-organismen wordt vergroot. Bovendien werken combinaties van antibiotica niet zelden antagonistisch. Hierbij moet men zich realiseren dat de kennis van synergisme en antagonisme van antimicrobiële middelen, vooral waar het de in-vivosituatie betreft, zeer beperkt is. Aangezien het combineren van antibiotica meestal niet tot dosisverlaging leidt, zal bij gebruik van combinaties de toxiciteit in het algemeen worden vergroot. Ook is het moeilijker te beoordelen welk middel voor een eventuele bijwerking (bijvoorbeeld een exantheem) verantwoordelijk is. Het heeft dus slechts in een beperkt aantal omstandigheden zin antimicrobiële middelen te combineren. Deze omstandigheden zijn:
indien synergisme tussen de middelen wordt beoogd. Onze kennis van synergisme in vivo is gering. Enkele voorbeelden van synergisme zijn: de combinatie van penicilline en een aminoglycoside bij infecties door enterokokken, de combinatie van trimethoprim en sulfamethoxazol (co-trimoxazol), de combinatie van amfotericine B en 5-flucytosine bij cryptokokkenmeningitis. Bij co-trimoxazol is dosisverlaging van de afzonderlijke componenten van de combinatie mogelijk;
indien we resistent worden van de verwekker van de infectie willen voorkomen. Het resistent worden van de verwekker van de infectie tijdens de behandeling kan het gevolg zijn van een eigenschap van de bacterie (bijvoorbeeld M. tuberculosis), van het antimicrobiële middel (bijvoorbeeld rifampicine, erytromycine, trimethoprim; dit zijn middelen die ‘eentrapsresistentie’ kunnen bewerkstelligen), of van een combinatie van beide (β-lactamase-inductie bij Enterobacter spp. onder invloed van nieuwere cefalosporinen);
bij ernstige infecties, voordat verwekker en antibiogram bekend zijn, ter verbreding van het spectrum;
bij menginfecties. Een voorbeeld is de aerobe en anaerobe mengflora in een intra-abdominaal of pulmonaal abces.
Beoordeling van het effect van de therapie
Indien het geïsoleerde micro-organisme inderdaad de verwekker van de infectie is, en de gevoeligheidsbepaling is juist, dan kan doorgaans binnen één tot drie dagen een gunstige reactie op de ingestelde therapie worden verwacht. De snelheid van de reactie hangt samen met gastheerfactoren, met de verwekker en met de gekozen therapie. Zo kan men bij een patiënt met een min of meer normale gastheerweerstand en een pneumokokkenpneumonie binnen 24 uur na het begin van penicillinetherapie een temperatuurdaling verwachten. De reactie op behandeling bij een stafylokokkensepsis of bij buiktyfus laat ondanks een juiste therapie veel langer op zich wachten.
De parameters voor het resultaat van de therapie verschillen uiteraard per patiënt. De subjectieve toestand van de patiënt, het klinische beeld, het temperatuurbeloop, de bezinking en het leukocytenaantal, resultaten van röntgenonderzoek en van microbiologisch onderzoek kunnen ons leiden bij de beoordeling. Aan de hand van deze parameters en van klinische ervaringen zal de behandelingsduur worden bepaald (zie verder). Indien het behandelingsresultaat niet in overeenstemming is met de verwachting, moet naar een oorzaak hiervoor worden gezocht en moet niet direct op een ander antibioticum worden overgegaan. De punten die men op dat moment moet overwegen, zijn weergegeven in Tabel 6.7.
| 1 de duur van de behandeling is te kort geweest voor een klinisch effect |
| 2 de klinische of microbiologische diagnose is onjuist |
|
3 de therapie is onjuist geweest: a verkeerd antibioticum gekozen b de infectie wordt onvoldoende bereikt, doordat – de dosis te laag is – de resorptie na orale toediening slecht is – de infectiehaard moeilijk bereikbaar is, als gevolg van • vascularisatiestoornis • abces of empyeem • corpus alienum • infectie in moeilijk bereikbaar compartiment |
De duur van de therapie
Kernpunten
Doorgaans kan binnen één tot drie dagen een gunstige reactie op de ingestelde therapie worden verwacht.
Klinische variabelen en ervaring bepalen de behandelingsduur.
De geadviseerde behandelingsduur is de laatste jaren korter geworden.
Met behulp van de reeds genoemde parameters en op grond van klinische ervaringen met soortgelijke infecties kan in het algemeen de duur van de behandeling worden bepaald. Slechts bij uitzondering zullen we ons laten leiden door resultaten van geavanceerde onderzoeksmethoden (zoals diagnostische beeldvormende technieken).
Wanneer men de behandelingsduur zoals die voor verschillende infectieziekten wordt aangegeven beziet, dan valt op dat voor een aantal infecties de geadviseerde behandelingsduur de laatste jaren korter is geworden (bijvoorbeeld vijf à zeven dagen in plaats van veertien dagen). In de preoperatieve antibiotische profylaxe is de korte duur een wezenlijk element: alleen kortdurende profylaxe is noodzakelijk en resistentievorming wordt zoveel mogelijk voorkomen.
Antivirale therapie
De afgelopen decennia zijn de mogelijkheden van antivirale therapie duidelijk uitgebreid, mede door het aidsonderzoek. Een overzicht van belangrijke antivirale middelen wordt gegeven in Tabel 6.8a-c. De recent ontwikkelde middelen voor hepatitis C worden besproken in 10.1007/978-90-368-1841-4_18#Sec62. Met de komst van deze nieuwe Direct Acting Antivirals (DAA’s) kan de duur van de behandeling van chronische hepatitis C aanzienlijk verkort worden en is de toevoeging van interferon meestal niet meer nodig.
| klasse | antiviraal middel | werking op virus door remming van | toxiciteit |
|---|---|---|---|
| hepatitis B | tenofovir | reverse transcriptase | diarree, exantheem, verhoogd serumcreatinine |
| entecavir | polymerase | hoofdpijn, vermoeidheid, misselijkheid | |
| lamivudine | reverse transcriptase | hoofdpijn, neuropathie, melkzuuracidose | |
| emtricitabine* | reverse transcriptase | hoofdpijn, diarree, bij kinderen: hyperpigmentatie | |
| interferon-α | immuunmodulatie** | CZS-toxiciteit, leukopenie, infecties, braken | |
| hepatitis C | |||
| HCV-proteaseremmers (NS3/4) | boceprevir | protease | CZS-toxiciteit, exantheem, diarree |
| simeprevir | protease | misselijkheid, exantheem, fotosensitiviteitsreactie | |
| paritaprevir | protease | misselijkheid, exantheem | |
| grazoprevir | protease | misselijkheid, exantheem | |
| HCV-polymeraseremmer (NS5B) | sofosbuvir | polymerase | hoofdpijn, vermoeidheid, exantheem |
| dasabuvir | polymerase | vermoeidheid, misselijkheid, jeuk | |
| NS5A remmer | daclatasvir | RNA-replicatie, eiwitsynthese | misselijkheid, vermoeidheid, hoofdpijn |
| ledipasvir | RNA-replicatie, eiwitsynthese | misselijkheid, vermoeidheid, hoofdpijn | |
| ombitasvir | RNA-replicatie, eiwitsynthese | misselijkheid, vermoeidheid, hoofdpijn | |
| velpatasvir | RNA-replicatie, eiwitsynthese | misselijkheid, vermoeidheid, hoofdpijn | |
| elbasvir | RNA-replicatie, eiwitsynthese | misselijkheid, vermoeidheid, hoofdpijn | |
| overig | ribavirine*** | mRNA en eiwitsynthese | CZS-toxiciteit, exantheem, anemie, neutropenie, infecties |
| interferon-α | immuunmodulatie** | CZS-toxiciteit, leukopenie, infecties, braken |
*Niet geregistreerd voor hepatitis B-behandeling;
**onderdrukking van de virusreplicatie in virusgeïnfecteerde cellen door immunomodulatie (o.a. verhoging van de fagocytose door macrofagen en toename van de specifieke cytotoxiciteit van lymfocyten);
***ribavirine is ook werkzaam tegen hepatitis E.
CZS: centraal zenuwstelsel; RNA: ribonucleïnezuur.
| antiviraal middel | herpessimplexvirus | varicellazostervirus | epstein-barrvirus | cytomegalovirus | influenza-A-virus | respiratoir syncytieel virus | werking op virus door remming van | toxiciteit |
|---|---|---|---|---|---|---|---|---|
| overige middelen | ||||||||
| (val)aciclovir | + | + | ± | DNA-polymerase | CZS-toxiciteit, diarree | |||
| (val)ganciclovir | + | + | ± | + | DNA-polymerase | leukopenie, trombopenie, anemie | ||
| famciclovir | + | + | ± | DNA-polymerase | hoofdpijn, misselijkheid | |||
| cidofovir | + | + | + | + | DNA-polymerase | nefrotoxiciteit, leukopenie | ||
| amantadine | + | ontmanteling virus-RNA | CZS-toxiciteit | |||||
| zanamivir | + | neuraminidase | gering (per inhalatie toegediend) | |||||
| oseltamivir | + | neuraminidase | hoofdpijn, misselijkheid | |||||
| ribavirine* | + | + | mRNA en eiwitsynthese | CZS-toxiciteit, exantheem, anemie, neutropenie, infecties | ||||
| foscarnet | + | + | + | + | DNA-polymerase en reverse transcriptase | nefrotoxiciteit, hypocalciëmie |
*Ribavirine is ook werkzaam tegen hepatitis E.
CZS: centraal zenuwstelsel; RNA: ribonucleïnezuur;
| klasse | antiviraal middel | werking op virus door remming van | toxiciteit |
|---|---|---|---|
| hiv-middelen | |||
| niet-nucleoside reverse transcriptaseremmers (NNRTI's) | efavirenz | reverse transcriptase | CZS-toxiciteit |
| etravirine | reverse transcriptase | exantheem, dyspepsie, diarree | |
| nevirapine | reverse transcriptase | exantheem, koorts | |
| rilpivirine | reverse transcriptase | hoofdpijn, vermoeidheid | |
| nucleoside en nucleotide analoge reverse transcriptaseremmers (NRTI's) | lamivudine | reverse transcriptase | hoofdpijn, neuropathie |
| abacavir | reverse transcriptase | anafylaxie | |
| zidovudine | reverse transcriptase | anemie, leukopenie, myopathie | |
| emtricitabine | reverse transcriptase | hoofdpijn, diarree, bij kinderen: hyperpigmentatie | |
| tenofovir | reverse transcriptase | diarree, exantheem, verhoogd serumcreatinine | |
| proteaseremmers | atazanavir | protease | hyperbilirubinemie |
| darunavir | protease | diarree, exantheem | |
| darunavir/cobicistat | protease | diarree, exantheem | |
| saquinavir | protease | dyspepsie, diarree | |
| lopinavir/ritonavir | protease | diarree, exantheem | |
| ritonavir | protease | braken, hyperlipoproteïnemie, lipodystrofie | |
| integraseremmers | raltegravir | integrase | diarree, exantheem |
| dolutegravir | integrase | diarree, exantheem, CZS-toxiciteit | |
| elvitegravir | integrase | diarree, exantheem | |
| CCR5-remmer | maraviroc | chemokinereceptor | exantheem, braken, CZS-toxiciteit |
| fusieremmer | enfuvirtide | gp41* | eosinofilie, perifere neuropathie, gewichtsverlies |
| Meestal wordt een combinatie van drie antiretrovirale middelen gebruikt, waarbij ter verhoging van het gebruiksgemak en de therapietrouw meerdere combinaties in één tablet beschikbaar zijn. | |||
* Blokkeert fusie van hiv met humane CD4-cel door extracellulair te binden aan hiv-1-viruseiwit gp41.
CZS: centraal zenuwstelsel.
Casuïstiek
Antifungale therapie
De afgelopen jaren is het arsenaal antifungale geneesmiddelen voor behandeling van diepe mycosen met de weinig toxische azolen fluconazol, itraconazol, voriconazol en met echinocandine uitgebreid (Tabel 6.9). De liposomale vormen van amfotericine B zijn minder toxisch dan het aloude amfotericine B; de prijs van deze middelen is zeer hoog, maar weegt wel op tegen de zeer grote kans op nefrotoxiciteit bij gebruik van amfotericine B.
| fungostaticum | Candida spp. | Cryptococcus neoformans | Aspergillus spp. | andere schimmels | toediening | toxiciteit |
|---|---|---|---|---|---|---|
| amfotericine B * | S | S | S | S | i.v. | nefrotoxiciteit, koorts, hypokaliëmie, anemie |
| 5-flucytosine | S** | S | R | R | i.v./os | beenmergremming |
| fluconazol | S** | S | R | R | i.v./os | hepatotoxiciteit (gering) |
| itraconazol | S | S | S | S/R | i.v./os | hepatotoxiciteit (gering) |
| voriconazol | S | R | S | R | i.v./os | hepatotoxiciteit (gering) |
| echinocandinen | S | R | S | R | i.v. | geringe toxiciteit |
* De liposomale preparaten zijn minder toxisch en hebben de voorkeur, maar zijn zeer kostbaar.
** C. glabrata weinig gevoelig.
S: gevoelig; R: ongevoelig.
[Toekomst]Intermezzo 6.2 Een somber toekomstperspectief?
Wereldwijd is er een sterke toename van de resistentie van micro-organismen tegen antimicrobiële middelen. Dit geldt niet alleen in ziekenhuizen, waar multiresistente gramnegatieve bacteriën, MRSA en vancomycineresistente enterokokken ernstige nosocomiale infecties veroorzaken, maar ook buiten het ziekenhuis. Resistente pneumokokken en ook MRSA komen daar nu als verwekkers van infecties voor. Er bestaat grote vrees voor verspreiding van voor vancomycine verminderd gevoelige Staphylococcus aureus. In ontwikkelingslanden zien we onder meer een toename van de resistentie van Salmonella spp. en verspreiding van de zeer resistente Mycobacterium tuberculosis.
Het probleem is des te nijpender, omdat er de laatste jaren vrijwel geen nieuwe antibiotica aan het therapeutisch arsenaal zijn toegevoegd. Hiervoor zijn enkele verklaringen. In de eerste plaats lijken de natuurlijke bronnen van antibiotica uitgeput. Ook de variaties op de bestaande middelen leveren niet veel meer op. De hoop was gevestigd op de ontdekking van nieuwe aangrijpingspunten door de kennis van microbiële en humane genomen, maar tot dusver is ook hier de opbrengst zeer gering. Belangrijker is wellicht het feit dat de meeste farmaceutische industrieën zich afwenden van de ontwikkeling van antibiotica. Dit heeft te maken met de geringe ‘return of investment’: men moet zeer grote (relatief kansarme) investeringen doen voor de ontwikkeling van geneesmiddelen die slechts voor kortdurende behandelingen worden ingezet. Uit commercieel oogpunt kan men dergelijke investeringen beter doen voor middelen die op grote schaal langdurig worden gebruikt (middelen tegen hart- en vaatziekten, antidiabetica, enz.).
Koorts bij infectieziekten, febris e.c.i. en auto-inflammatoire syndromen
Koorts is een toestand van verhoogde lichaamstemperatuur waarbij het setpoint in de hypothalamus verhoogd is. Toestanden van verhoogde lichaamstemperatuur waarbij het setpoint niet verhoogd is, worden aangeduid met de term hyperthermie. De pathogenese van koorts is weergegeven in Figuur 6.3. Exogene pyrogenen (koortsverwekkende stoffen), zoals bacteriële producten, stimuleren cellen van het mononucleaire fagocytensysteem (monocyten en macrofagen) en wellicht ook andere cellen (onder andere lymfocyten en naturalkillercellen) tot de secretie van endogene pyrogenen. De belangrijkste endogene pyrogenen zijn de cytokinen interleukine-1 (IL-1), interleukine-6 (IL-6) en de tumornecrosefactor (TNF), eiwitten die in staat zijn de prostaglandinesynthese in de area preoptica van de hypothalamus aan te zetten. Daarnaast stimuleren deze eiwitten de productie van de zogenoemde acutefase-eiwitten in de lever (onder andere C-reactieve proteïne, fibrinogeen en complementfactoren) en verhogen ze de functie van T- en B-lymfocyten en granulocyten. De verhoging van het setpoint in de hypothalamus geeft reflectoir aanleiding tot verminderde warmteafgifte (onder andere door vasoconstrictie in de huid) en verhoogde warmteproductie door rillen.

Klinisch is de registratie van de lichaamstemperatuur van groot belang; veel ziekten (niet alleen infectieziekten) hebben een kenmerkend koortstype. Voorbeelden hiervan zijn pel-ebstein-koorts bij de ziekte van Hodgkin en de koortstypen bij onder andere malaria, brucellose, buiktyfus, mazelen, sepsis en tuberculose. Bij de bespreking van de betreffende ziektebeelden wordt hierop nader ingegaan. Ook voor de beoordeling van het effect van een antimicrobiële therapie is observatie van het temperatuurbeloop van belang.
Of koorts een nuttige reactie is, is nog steeds niet geheel duidelijk. Waarschijnlijk verschilt het nuttig effect bij verschillende infectieziekten. In Nederland wordt terecht meer terughoudendheid betracht bij het voorschrijven van antipyretica dan elders. Aangezien koorts veelal op een virale infectie berust, is het voorschrijven van antibiotica bij koorts zonder begeleidende verschijnselen en zonder dat men een waarschijnlijke diagnose heeft gesteld niet geïndiceerd.
Febris e causa ignota
Koorts door onbekende oorzaak (febris e causa ignota , febris e.c.i.) is een belangrijk klinisch probleem. In het algemeen spreekt men pas van febris e.c.i. wanneer de koorts minstens drie weken bestaat en er na één week intensief onderzoek in het ziekenhuis geen oorzaak wordt gevonden. Uit grote onderzoeken blijkt in 20 tot 40% van de gevallen een infectie verantwoordelijk te zijn voor de koorts, in 5 tot 30% een neoplasma en in 10 tot 20% een niet-infectieuze inflammatoire ziekte (vasculitis, reumatische ziekte, sarcoïdose, ziekte van Crohn en de zogenoemde auto-inflammatoire ziekten). Febris factitia is een zeldzame oorzaak. Tegenwoordig blijft een steeds groter percentage (meer dan 30%) onverklaard; dit heeft ermee te maken dat de ‘gemakkelijke’ verklaringen tegenwoordig worden gevonden voordat de patiënt aan de voorgaande definitie voldoet. Figuur 6.4 toont de resultaten van een Nederlands onderzoek naar de oorzaken van febris e.c.i. Bij de diagnostiek moet men zich behalve door het koortstype ook door de eventuele begeleidende verschijnselen laten leiden. Een nauwgezette anamnese en herhaald lichamelijk onderzoek leiden nogal eens tot de oplossing van het probleem. De moderne beeldvormende technieken (echografie, PET-scintigrafie, computertomografie en MRI) zijn van grote waarde bij de diagnostiek van febris e.c.i.; overleg met de radioloog en nucleair geneeskundige is van waarde in de aanvullende diagnostiek.

Auto-inflammatoire ziekten
Kernpunten
Er is onderscheid tussen koorts en hyperthermie.
Koorts is een onderdeel van de acutefasereactie.
Veel ziekten hebben een kenmerkend koortstype.
Aan de begeleidende verschijnselen (potentially diagnostic clues) moet bij de analyse van febris e.c.i. veel aandacht worden besteed.
De auto-inflammatoire ziekten zijn zeldzame ziekten waarbij intermitterend of chronisch een ontstekingsreactie optreedt, meestal op basis van een triviale stimulus uit de buitenwereld. Er is bij deze aangeboren of verworven ziekten een te sterke productie van pro-inflammatoire cytokinen (met name IL-1β) of onvoldoende productie van remmers van de ontstekingsreactie. De moleculaire achtergronden van een aantal van deze ziekten zijn thans goed bekend (Tabel 6.10). Het zijn geen auto-immuunziekten, want er is geen sprake van autoagressieve T-lymfocyten of antistoffen.
| syndroom | overerving | afwijkend eiwit | begin van klachten | aanvallen | duur van aanvallen | andere symptomen naast koorts | behandeling |
|---|---|---|---|---|---|---|---|
| FMF | autosomaal recessief | pyrine | < 20 jaar | ja | 1-3 dagen |
peritonitis pleuritis pericarditis artritis |
colchicine (evt. anakinra) |
| TRAPS | autosomaal dominant | TNF R I | < 20 jaar | ja | 1-4 weken |
exantheem conjunctivitis periorbitaal oedeem peritonitis myalgie artritis |
anakinra (steroïden) |
|
CAPS – CINCA – Muckle Wells (MW) – familiair koude inflammatoir syndroom (FCAS) |
autosomaal recessief | cryopyrine | vroege jeugd |
CINCA/MW: continu FCAS: aanvalsgewijs |
FCAS: enkele uren |
CINCA/MW: – urticaria meningitis – doofheid – uveïtis – artralgie botdeformaties FCAS: urticaria artralgie/myalgie |
anakinra/anti-IL-1βmonoklonaal |
| hyper-IgD-syndroom (HIDS) | autosomaal recessief | mevalonaatkinase | zeer vroege jeugd | ja | 3-7 dagen |
lymfadenitis,aften, exantheem, artritis/artralgie peritonitis |
anakinra |
| DIRA | autosomaal recessief | IL-1-receptorantagonist | zeer vroege jeugd | continu | – |
exantheem pustulose artritis botdeformatie |
anakinra |
| syndroom van Schnitzler | verworven | paraproteïne (?) | > 4e decennium | vrijwel continu | – |
urticaria botpijn |
anakinra |
| ziekte van Behçet | verworven (genetische component) | ? | 2e decennium | ja, soms continu | weken | aften, uveïtis, genitale laesies, artritis, vasculaire pathologie | colchicine, immuunsuppressiva, anakinra |
| adult onset Still’s disease | verworven | ? | 2e decennium | ja | weken tot maanden |
exantheem, artralgie myalgie lymfadenopathie hepatitis |
NSAID’s, steroïden, anakinra |
Epidemiologie
Deze aandoeningen zijn soms sterk etnisch en geografisch bepaald. Dit geldt met name voor familiaire Middellandse Zeekoorts (FMF, van familial Mediterranean fever; vooral in Klein-Azië en rond Middellandse Zee met name bij joden, Turken, Arabieren, Armeniërs) en de ziekte van Behçet (langs de zijderoute vanaf Marokko tot Japan). Hyper-IgD-syndroom (HIDS) en TNF-receptor associated periodic syndrome (TRAPS) worden meer in Noord-Europa en de Verenigde Staten gezien.
Klinische verschijnselen
FMF, HIDS en TRAPS worden vooral gekenmerkt door aanvallen van koorts, gelokaliseerde ontsteking (steriele serositis, exantheem, artritis) en acutefasereactie; oorspronkelijk werden deze ziekten aangeduid als periodieke-koortssyndromen. Het koortspatroon en de duur van de aanval verschillen per ziektebeeld (Tabel 6.10). Bij een aantal ziekten zijn de ontstekingsverschijnselen (koorts, urticarieel exantheem, sereuze meningitis) veel meer continu aanwezig, zoals bij de meeste uitingen van CAPS (cryopyrin associated periodic syndrome, Tabel 6.10) en bij DIRA (deficiency of interleukin-1 receptor antagonist). Ook ziet men bij sommige vormen van CAPS en bij DIRA botdeformaties.
Laboratoriumdiagnostiek
De aanvallen bij de auto-inflammatoire syndromen gaan gepaard met een acutefasereactie (stijging van CRP; leukocytose). Voor de verschillende hereditaire syndromen is genetische diagnostiek mogelijk. Voor het stellen van de diagnose HIDS is bepaling van de IgD- en de IgA-concentratie in het serum zinvol. Hoewel er bij de meeste syndromen een overproductie van IL-1 is, is meting daarvan moeilijk en in de praktijk niet aangewezen. Voor het (verworven) syndroom van Schnitzler is onderzoek naar paraproteïnen geïndiceerd. In verband met mogelijk optreden van amyloïdose is jaarlijkse controle op proteïnurie en stijging van serumcreatinine verstandig.
Therapie
NSAID’s en steroïden werken over het algemeen onvoldoende. FMF reageert in het algemeen goed op colchicine oraal (2 à 3 × daags 0,5 mg); zwangerschap is geen reden deze medicatie te stoppen. De meeste auto-inflammatoire syndromen reageren zeer goed op de dagelijkse subcutane toediening van anakinra (recombinant IL-1-receptorantagonist). Bij de aanvalsgewijze ziekten met weinig frequente aanvallen kan de patiënt bij prodromen met toediening beginnen en meestal na drie tot vijf injecties stoppen. Bij de beelden met chronische ontstekingsreactie, zoals bij de meeste vormen van CAPS, en bij het syndroom van Schnitzler is dagelijkse toediening nodig. Langwerkende monoklonale antistoffen tegen IL-1β zijn inmiddels beschikbaar.
Complicaties
De serositis (peritonitis) bij FMF (en soms bij HIDS en TRAPS) wordt soms ten onrechte aangezien voor appendicitis, waarvoor dan ten onrechte een appendectomie wordt verricht. Recidiverende peritonitis kan leiden tot adhesies, waardoor buikklachten en zelfs ileus kunnen optreden. De belangrijkste complicatie bij de auto-inflammatoire syndromen is amyloïdose. Goede ontstekingsremming (bij FMF met colchicine) voorkomt deze complicatie goeddeels.
Sepsis
Kernpunten
Sepsis is een levensbedreigend orgaanfalen veroorzaakt door een gedysreguleerde respons van de gastheer op een infectie.
Septische shock is sepsis waarbij vasopressoren nodig zijn om de bloeddruk op peil te houden (mean arterial pressure (MAP) ≥ 65 mmHg) en het lactaat verhoogd is (> 2 mmol/l), dit in afwezigheid van andere oorzaken zoals hypovolemie.
De meest voorkomende oorzaken van sepsis zijn infecties van de luchtwegen, het abdomen, de urinewegen, de huid- en/of wekedelen en het cardiovasculair systeem.
Sepsis vereist snelle adequate diagnostiek en therapie (zie de ‘sepsis bundel’ van de Surviving Sepsis Campaign).
Snelle toediening van antibiotica, na afname van bloedkweken, is essentieel. De keuze van het antibiotisch regime hangt mede af van de bron van de infectie, de plaats waar de infectie is opgelopen (bijvoorbeeld buiten of binnen het ziekenhuis), de medische voorgeschiedenis en de lokale resistentiecijfers voor de belangrijkste bacteriële verwekkers van sepsis.
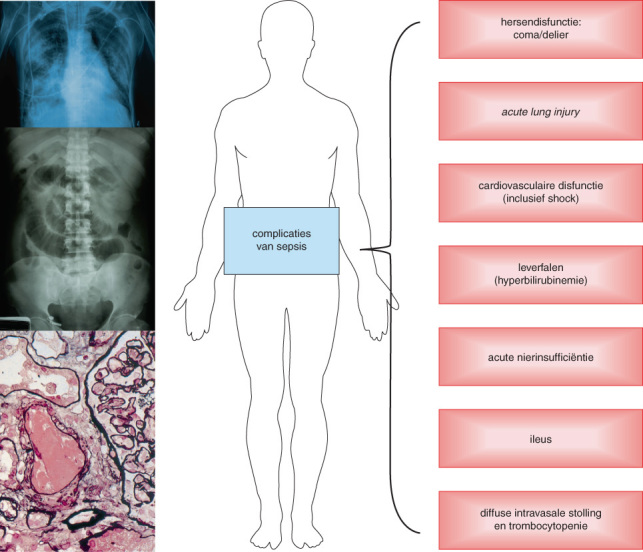
De belangrijkste complicaties van sepsis zijn respiratoir falen (acute respiratory distress syndrome), septische shock, coma/delier, nierfalen, diffuse intravasale stolling, ileus, bijnierschorsinsufficiëntie en critical illness polyneuropathy
Bij de afweer tegen binnendringende micro-organismen komen ontstekingsmediatoren vrij die klinische veschijnselen bij de gastheer veroorzaken, bijvoorbeeld koorts en tachycardie. Sepsis is een klinisch syndroom dat veroorzaakt wordt door een schadelijke respons van de gastheer op binnendringende micro-organismen of hun toxinen. Nagenoeg elke infectie kan resulteren in sepsis. Het is de meest voorkomende oorzaak van overlijden van patiënten die opgenomen zijn in het ziekenhuis. De afgelopen twee decennia is de incidentie van sepsis fors toegenomen, waarschijnlijk ten gevolg van een toenemend gebruik van immunosuppressiva (denk bijvoorbeeld aan het chronisch gebruik van TNF-α-remmers bij patiënten met inflammatoire darmziekten), de steeds ouder wordende bevolking en toenemende antibioticaresistentie. Sepsis gaat gepaard met een mortaliteit van 15 tot 50%. Onze kennis over de pathogenese van sepsis is in de afgelopen paar decennia fors toegenomen. Helaas heeft dit nog niet geleid tot effectieve en specifieke immuunmodulerende therapieën die naast antibiotica gegeven kunnen worden aan patiënten met sepsis. Toch is de overleving van sepsis de afgelopen jaren sterk verbeterd. Dit komt mede door een steeds beter wordende zorg op de intensive care en implementatie van de internationale sepsisbehandelrichtlijnen van de Surviving Sepsis Campaign.
In de dagelijkse klinische praktijk wordt sepsis vaak gebruikt als een wat aspecifieke diagnostische term om patiënten te beschrijven die lijden aan orgaanfalen in de context van een infectie. In een poging om meer precies te zijn werd in 1991 sepsis gedefinieerd als ‘een aangetoonde infectie of een sterk vermoeden daarop, plus de systemische respons op de infectie’, die het systemisch inflammatoire-responssyndroom (SIRS) werd genoemd. Om te voldoen aan SIRS dienden ten minste twee van de volgende criteria aanwezig te zijn: lichaamstemperatuur > 38 °C of < 36 °C; hartfrequentie > 90/min; tachypnoe (> 20 ademhalingen/min); arteriële PCO2 < 4,3 kPa of noodzaak tot mechanische beademing; leukocyten > 12 × 109/l of < 4 × 109/l of 10% staafkernige granulocyten. Op deze definitie, hoewel hij veel gebruikt is, kwam veel kritiek. Zo is SIRS zeker niet specifiek voor sepsis: niet-infectieziekten zoals trauma, pancreatitis of brandwonden zullen ook vaak met een SIRS gepaard gaan. Daarbij voldoen patiënten al wel erg snel aan deze criteria; bij een simpele verkoudheid zijn vaak al twee SIRS-criteria aanwezig. Om beter in staat te zijn die patiënten te beschrijven die ziekenhuisopname en directe behandeling nodig hebben, werd recent voorgesteld om alleen nog over sepsis te spreken indien er ook bewijs is van orgaanschade.
Sinds 2016 wordt sepsis klinisch gedefinieerd als levensbedreigend orgaanfalen veroorzaakt door een gedysreguleerde respons van de gastheer op een infectie. De Sepsis-related Organ Failure Assessment score, afgekort SOFA-score, kan hierbij op de intensive care gebruikt worden om de mate van orgaanfalen in te schatten. Deze score is gebaseerd op de optelsom van zes verschillende scores, om een inschatting te maken van respectievelijk de ademhaling, de bloedsomloop, de lever, het stollingssysteem, de nieren en de neurologische toestand (Tabel 6.11). Een hogere SOFA-score is gecorreleerd met een grotere kans op overlijden. Bij sepsis moet er sprake zijn van een totale SOFA-score met 2 of meer punten. Vaak zullen patiënten met sepsis zich echter presenteren in de eerstelijnszorg, op de Spoedeisende Hulp of op de afdeling. Eventueel kan dan gebruikgemaakt worden van de quick SOFA-score (qSOFA), die bestaat uit drie gemakkelijk te meten parameters: een ademhalingsfrequentie van ≥ 22/minuut, een veranderd bewustzijn en een systolische bloeddruk van ≤ 100 mmHg. Patiënten met een (verdenking op een) infectie bij wie deze drie parameters aanwezig zijn, hebben een grotere kans op een slechte uitkomst en hebben waarschijnlijk baat bij intensieve zorg. Het is dus niet nodig om een bacterie in de bloedbaan (een bacteriëmie) te hebben om de diagnose sepsis te stellen. Septische shock wordt gedefinieerd als sepsis waarbij vasopressoren nodig zijn om de bloeddruk op peil te houden (mean arterial pressure (MAP) ≥ 65 mmHg) en het lactaat verhoogd is (> 2 mmol/l), dit in de afwezigheid van andere oorzaken zoals hypovolemie.
| orgaansysteem | SOFA- score | |
|---|---|---|
| ademhaling | PaO2/FiO2 (mmHg) | |
| < 400 | 1 | |
| < 300 | 2 | |
| < 200 en kunstmatig beademend | 3 | |
| < 100 en kunstmatig beademend | 4 | |
| zenuwstelsel | Glasgow Coma Scale (GCS) | |
| 13-14 | 1 | |
| 10-12 | 2 | |
| 6-9 | 3 | |
| < 6 | 4 | |
| circulatie | mean arterial pressure (MAP) of noodzaak tot vasopressoren (µg/kg/min) | |
| MAP < 70 mm/Hg | 1 | |
| dopamine ≤ 5 of dobutamine (elke dosering) | 2 | |
| dopamine > 5 of epinefrine ≤ 0,1 of norepinefrine ≤ 0,1 | 3 | |
| dopamine > 15 of epinefrine > 0,1 of norepinefrine > 0,1 | 4 | |
| lever | bilirubine (μmol/L) | |
| > 20-32 | 1 | |
| 33-101 | 2 | |
| 102-204 | 3 | |
| > 204 | 4 | |
| stolling | trombocyten (×103/µl) | |
| < 150 | 1 | |
| < 100 | 2 | |
| < 50 | 3 | |
| < 20 | 4 | |
| nieren | creatinine (μmol/L) of urineproductie | |
| 110-170 | 1 | |
| 171-299 | 2 | |
| 300-440 of < 500 ml/d | 3 | |
| > 440 of < 200 ml/d | 4 | |
De Sepsis-related Organ Failure Assessment score, afgekort SOFA-score, wordt op de intensive care gebruikt om de mate van orgaanfalen in te schatten. De scores per orgaansysteem worden bij elkaar opgeteld.
Verwekkers
Sepsis wordt in circa 52% van de gevallen veroorzaakt door grampositieve bacteriën (m.n. Staphylococcus aureus en Streptococcus pneumoniae), 38% door gramnegatieve bacteriën (m.n. Escherichia coli, Klebsiella spp, en Pseudomonas aeruginosa), 5% door polymicrobiële infecties, 1% anaeroben en 4% schimmmels/gisten. De toename van het aantal gistinfecties is een verontrustende trend, aangezien deze vorm van sepsis een slechte prognose heeft. Risicofactoren voor een candidemie zijn het gebruik van immunosuppressieva, neutropenie, eerder intensief gebruik van antibiotica en bekende kolonisatie met Candida. Bij patiënten met meerdere comorbiditeiten en een lang verblijf op de intensive care worden vaker infecties gezien met moeilijk behandelbare Candida, Acinetobacter of Pseudomonas spp.
Men kan vermoedens omtrent de meest waarschijnlijke verwekkers formuleren op grond van de antwoorden op de volgende vragen.
Komt de patiënt van huis of betreft het een opgenomen patiënt? In het eerste geval zijn de meest waarschijnlijke verwekkers Staphylococcus aureus, streptokokken (inclusief pneumokokken), meningokokken en Escherichia coli. Bij de ziekenhuis- of verpleeghuispatiënt liggen behalve E. coli ook andere aerobe gramnegatieve staven voor de hand (zie ▶ par. 6.12).
Is er een waarschijnlijke porte d’entrée? Verwondingen of huidinfecties predisponeren voor stafylokokken- en streptokokkeninfecties. Bij ernstige huidinfecties dient rekening te worden gehouden met community-acquired meticillineresistente stafylokokken (c-MRSA) die een exotoxine, het panton-valentineleukocidine produceren. Vanuit de urinewegen ziet men vooral E. coli en andere aerobe gramnegatieve staven als verwekkers, vanuit de galwegen gramnegatieve staven en streptokokken (enterokokken), vanuit de darm en de vrouwelijke inwendige genitalia aerobe en anaerobe gramnegatieve staven en streptokokken (vaak als menginfecties) en vanuit de luchtwegen vooral pneumokokken.
Zijn er strooihaarden? Dit betreft vooral Staphylococcus aureus en Salmonellae en soms andere verwekkers.
Is er ernstig verminderde gastheerweerstand (bijvoorbeeld granulocytopenie)? In dat geval ziet men dat ook minder virulente verwekkers als Pseudomonas aeruginosa en schimmels tot sepsis aanleiding geven.
Is de patiënt recent met breedspectrumantibiotica behandeld? Als gevolg van de verstoring van de endogene flora kan de patiënt gekoloniseerd geraakt zijn met micro-organismen die resistent zijn tegen deze antibiotica. Ook hier moet men met ongewone verwekkers rekening houden (onder andere gisten of schimmels).
Zijn er andere risicofactoren? Heeft de patiënt in een buitenlands ziekenhuis gelegen? In dat geval zijn we beducht op meticillineresistente stafylokokken (ziekenhuis-MRSA). Is er contact met varkenshouderij (en eventueel andere veeteelt)? In dat geval moet rekening worden gehouden met de zogenoemde varkens-MRSA. Bij verdenking op MRSA worden de neus, de huid en eventueel verdachte plaatsen uitgestreken en onderzocht op MRSA (PCR en/of kweek) en wordt de patiënt in afwachting van de uitslagen geïsoleerd volgens de vigerende protocollen.
Klinische verschijnselen
De klinische presentatie, klachten en symptomen van sepsis zijn erg variabel en hangen af van de oorspronkelijke bron van de infectie, het veroorzakende pathogeen, de mate en type van orgaanfalen, de comorbiditeit van de patiënt en de tijd die verstreken is voorafgaand aan het starten van adequate therapie. De meest voorkomende oorzaken van sepsis zijn, in volgorde van afnemende incidentie: infecties van de luchtwegen, het abdomen, de urinewegen, huid- en/of wekedelen en het cardiovasculair systeem (Figuur 6.5). Uiteraard is dit de vaak de belangrijkste determinant van het klachtenpatroon van de patiënt. Risicofactoren voor het ontwikkelen van sepsis worden genoemd in Tabel 6.12.

| gastheerfactoren |
| oudere leeftijd (leeftijd > 65 jaar) |
| mannelijk geslacht |
| negroïde afkomst |
| slechte voedingsstatus |
| genetische polymorfismen (bepaalde mutaties in genen coderend voor toll-like receptoren, cytokinen of stollingseiwitten zijn geassocieerd met een verhoogde gevoeligheid voor sepsis) |
| comorbiditeit |
| diabetes |
| COPD |
| maligniteiten |
| chronische nierinsufficiëntie |
| chronisch leverlijden |
| hiv-infectie |
| gebruik van immunosuppressieve geneesmiddelen |
| omgevingsfactoren |
| lage sociaaleconomische status |
| recente reizen, tropenbezoek, seizoensinvloeden |
| ziekenhuisgerelateerde factoren |
| duur van ziekenhuisopname |
| antibioticaresistentie |
| gecompliceerd beloop na chirurgie |
| gebruik van katheters (urinekatheter, infusen etc.) |
Hoewel de meeste patiënten zich presenteren met koorts, is deze bij 9% tot 35% van de patiënten niet aanwezig. Dit wordt hypotherme sepsis genoemd en is geassocieerd met een slechtere uitkomst. Bij lichamelijk onderzoek zal er vaak sprake zijn van tachycardie, tachypnoe, een veranderd bewustzijn en oedeem. Een verminderde capillary refill kan passen bij een verminderde weefselperfusie. De capillary refill wordt getest door ten minste vijf seconden stevig op de huid te drukken, waardoor deze bleek wordt. Daarna laat men de huid los. Binnen twee tot drie seconden dient de kleur weer normaal te zijn. Een verlengde capillary refill kan passen bij verminderde weefselperfusie, zoals bij sepsis of septisch shock.
Kenmerkend voorPseudomonas-sepsis, zoals die bij de granulocytopenische patiënt voorkomt, zijn necrotiserende, door bloeding blauwzwarte huidinfiltraten en blaren (ecthyma gangraenosum ; Figuur 6.6).

Laboratoriumdiagnostiek
Het is essentieel om de verwekker van sepsis te achterhalen door goede microbiologische diagnostiek. Bloedkweken dienen afgenomen te worden vóór toediening van breedspectrumantibiotica. Het verdient de voorkeur voor het begin van de therapie hiertoe drie bloedmonsters af te nemen. Door de bacterie te isoleren is het mogelijk de gevoeligheid voor antimicrobiële middelen te bepalen. Als een porte d’entrée duidelijk lijkt, zal men ook daarvan materiaal opsturen voor het maken van een grampreparaat en het inzetten van een kweek. In het laboratoriumonderzoek vallen vaak de volgende zaken op: een leukocytose (of in het begin soms juist een leukopenie), een verhoogd C-reactieve proteïne (CRP), een (milde) hyperglykemie en verhoogde transaminasewaarden. De variabelen die een indicatie geven van mogelijk orgaanfalen, zoals trombocyten, stollingstijden (bijvoorbeeld de PTT), bilirubine en creatinine) dienen ook bepaald te worden (Tabel 6.11). Hyperlactatemie kan, net als een verminderde capillary refill, passen bij een verminderde weefselperfusie.
Therapie
Implementatie van de ‘sepsis bundel’, waarbij eenvoudige ‘evidence-based’ aanbevelingen worden gedaan over het beleid bij patiënten met sepsis, heeft geleid tot een verlaging van de mortaliteit (Tabel 6.13). Het snel herkennen van sepsis, adequate en vlotte volumeresuscitatie en antibioticatoediening zijn hierbij de belangrijkste uitgangspunten.
| resuscitatiebundel (zo snel mogelijk, binnen eerste 3 uur) |
| 1 Serumlactaat meten |
| 2 Bloedkweken afnemen vóór toediening van breedspectrumantibiotica |
| 3 Breedspectrumantibiotica zo snel mogelijk toedienen (binnen 3 uur als patiënt via de SEH naar de afdeling komt; binnen 1 uur bij directe IC -opname) |
| 4 Bij hypotensie en/of een verhoogd lactaat (> 4 mmol/l): 30 ml/kg crystalloïd bolus toedienen |
| resuscitatiebundel (zo snel mogelijk, binnen eerste 6 uur) |
| 5 Gebruik vasopressoren (voor hypotensie indien geen effect vochtresuscitatie om een MAP ≥ 65 mmHg te behouden) |
| 6 Bij persisterende hypotensie ondanks vochtresuscitatie en/of bij persisterend hoog lactaat streeft men naar een: CVD ≥ 8 mmHg en/of een ScvO2 ≥ 70% (of SvO2 ≥ 65%) |
| 7 Meet opnieuw serumlactaat indien initieel verhoogd |
| sepsismanagement bundel (binnen 24 uur) |
| lage dosering steroïden bij septische shock indien geen effect vochtresuscitatie en gebruik vasopressoren* |
| glucoseregulatie (streef naar max. glucose van 10 mmol/l bij patiënten met persisterende hyperglykemie)* |
| gemiddelde inspiratoire plateaudruk < 30 cm H2O bij mechanisch beademende patiënten* |
| overige aandachtspunten: bloedproducten, sedatie, analgesie en neuromusculaire blokkade, beademing bij ALI/ARDS, glucosecontrole, bicarbonaatcontrole, nierfunctievervangende therapie, tromboseprofylaxe, stressulcusprofylaxe en familiebegeleiding |
* Over de precieze invulling van deze interventie bestaan verschillen van inzicht, aangeraden wordt het lokale ziekenhuisprotocol te volgen.
SEH: Spoedeisende Hulp; MAP: ‘mean arterial blood pressure’; CVD: centraal veneuze druk, ScvO2: centraal veneuze zuurstofsaturatie; SvO2: gemengde veneuze zuurstofsaturatie; ALI: acute lung injury; ARDS: acute respiratory distress syndrome.
Het eerste doel is de ademhaling en circulatie zo snel mogelijk veiliggesteld te hebben en de schadelijke effecten van een infectie te verminderen. Hiertoe krijgt de patiënt direct vocht toegediend, tezamen met – indien nodig – vasopressoren en mechanische beademing. De infectie wordt aangepakt door snelle toediening van antibiotica. Vertraging in de toediening van empirische breedspectrumantibiotica, dat wil zeggen na één tot drie uur na presentatie, is geassocieerd met een slechtere overleving. De keuze van het antibiotisch regime hangt mede af van de bron van de infectie, de plaats waar de infectie is opgelopen (bijvoorbeeld buiten of binnen het ziekenhuis), de medische voorgeschiedenis en de lokale resistentiecijfers voor de belangrijkste bacteriele verwekkers van sepsis. Ook dient de oorzaak van de sepsis opgespoord te worden. Indien er pus is, dient dit gedraineerd te worden (ubi pus ibi evacua). Empirische antifungale therapie dient gereserveerd te blijven voor patiënten met een verhoogd risico op invasieve candidiasis.
Zodra de resultaten van de kweken bekend worden en een oorzakelijk pathogeen geïdentificeerd is, dienen de antibiotica versmald te worden. Dit is niet alleen veilig, maar heeft ook een gunstig effect op de verspreiding van resistentie, mogelijke bijwerkingen en de kosten. De Surviving sepsis campaign, die tot doel heeft de sterfte aan ernstige sepsis fors te doen verminderen door snelle diagnostiek en adequate behandeling, is instrumenteel geweest in de succesvolle wereldwijde implementatie van deze hier genoemde behandelrichtlijn.
Complicaties
De meest voorkomende en bedreigende complicaties van sepsis zijn respiratoir falen (acute lung injury) en cardiovasculaire disfunctie (Figuur 6.7). Respiratoir falen uit zich vaak als een acute respiratory distress syndrome (ARDS), gedefinieerd als hypoxemie en bilaterale infiltraten op de thoraxfoto die niet verklaard worden door hartfalen. Septische shock is de belangrijkste uiting van cardiovasculaire disfunctie. De hersenfunctie kan aangedaan zijn, zich uitend als een coma of delier. Acute nierinsufficiëntie wordt gekenmerkt door een verminderde urineproductie met een stijging van het serumcreatininegehalte. Tot slot zijn een ileus, bijnierschorsinsufficiëntie en diffuse intravasale stolling (DIS, in het Engels afgekort als DIC) ook bekende complicaties van sepsis. DIS wordt gekenmerkt door systemische activatie van het stollingssysteem, met als gevolg de vorming van intravasculaire stolsels en verminderde orgaanperfusie. Consumptie van bloedplaatjes en stollingsfactoren kan tegelijkertijd leiden tot ernstige bloedingen. Critical illness polyneuropathy is een complicatie die bij patiënten na een langdurig verblijf op de intensive care wordt gezien. Patiënten die sepsis overleven na een IC-opname hebben vaak nog lang last van cognitieve en lichamelijke beperkingen. Als men lijdt aan een chronische ziekte, verergert deze vaak na een septische episode. Ook is er een vergrote kans op vroegtijdig overlijden; sommige studies laten zelfs een vijfjaars mortaliteit van 75% zien.
Casuïstiek
Streptokokken-toxischeshocksyndroom
Kernpunten
Het streptokokken-toxischeshocksyndroom wordt veroorzaakt door exotoxines van de Streptococcus pyogenes en wordt gekenmerkt door sepsis en septische shock. De meest frequente portes d’entrée voor deze groep A-Streptococcus zijn de huid, vagina en farynx.
Necrotiserende fasciitis is een infectie van de fascie en wordt gekenmerkt door zich snel verspreidende, pijnlijke necrose van de huid. Ruim chirurgisch débridement is noodzakelijk.
Verwekker
Het ziektebeeld wordt veroorzaakt door een exotoxine ) dat wordt geproduceerd door groep A-streptokokken (GAS, Streptococcus pyogenes). De stammen van deze groep A zijn altijd β-hemolytisch. De exotoxines, ook wel superantigenen genoemd, kunnen leiden tot de massale vrijmaking van pro-inflammatoire cytokinen, omdat ze een aspecifieke binding tussen de antigeenpresenterende cel en de T-lymfocyt bewerkstelligen. Het ziektebeeld wordt gekenmerkt door sepsis en septische shock. Daarbij is de streptokokkeninfectie geassocieerd met necrotiserende fasciitis. Een soortgelijk, maar inmiddels zeldzamer ziektebeeld kan door een enterotoxine van Staphylococcus aureus worden veroorzaakt en is dan vaak geassocieerd met het gebruik van sterk adsorberende tampons (tamponziekte).
De meest frequente portes d’entrée voor de groep A-Streptococcus zijn de huid, vagina en farynx.
Epidemiologie
De incidentie van invasieve infecties veroorzaakt door groep A-Streptococcus is circa 3,5 per 100.000 mensen, waarbij de mortaliteit kan oplopen tot 50%. Bijna de helft van de patiënten met necrotiserende fasciitis heeft ook tekenen van het toxischeshocksyndroom.
Incubatietijd
Enkele uren tot dagen.
Klinische verschijnselen
Het streptokokken-toxischeshocksyndroom komt op alle leeftijden voor. Diabetes, alcoholisme en het gebruik van immuunsuppressieve geneesmiddelen zijn belangrijke risicofactoren. Daarnaast zijn kleine wondjes, recente chirurgie en de periode na de bevalling geassocieerd met het optreden van het streptokokken-toxischeshocksyndroom. Bij alle patiënten kenmerkt het syndroom zich door sepsis en septische shock. Indien er sprake is van een huid- of wekendeleninfectie dient men bedacht te zijn op de ernstige en zeer snel progressieve necrotiserende fasciitis. Necrotiserende fasciitis is een infectie van het subcutane weefsel en de fascie, gekenmerkt door extreme, zich snel verspreidende, pijnlijke necrose van de huid. De initiële laesie kan klein zijn en lijken op cellulitis, maar verspreidt zich binnen 24-72 uur in en onder de huid. Een spoedconsult chirurgie voor diagnostiek en zo nodig directe agressieve chirurgische therapie is dan aangewezen. Ook kan een ernstige groep A-streptokokkeninfectie voorkomen in het laatste trimester van de zwangerschap of in de eerste periode na de geboorte. Wereldwijd blijft dit een belangrijke oorzaak van perinatale sterfte.
Typisch is ten slotte het vervellen van handen en voeten na ongeveer veertien dagen (Figuur 6.8).

Laboratoriumdiagnostiek
Afname van kweken is, zoals bij elke vorm van sepsis, essentieel. Verder wordt onder meer gezien: leukocytose, een verhoogd creatinine en verhoogde creatininekinase(CK-)waarden, die kunnen passen bij necrotiserende fasciitis of myositis.
Het is van belang te benadrukken dat streptokokken- en stafylokokkeninfecties een groot aantal zeer verschillende ziektebeelden kunnen veroorzaken (zie Tabel 6.14 en Tabel 6.15 ).

| hemolytische streptokokken | vergroenende streptokokken | Streptococcus milleri | enterokokken | |
|---|---|---|---|---|
| immunologisch: | ||||
| – acuut reuma | + | |||
| – glomerulonefritis | + | |||
| – erythema nodosum | + | |||
| door toxinen teweeggebracht: | ||||
| – scarlatina | + | |||
| – erysipelas | + | |||
| – toxischeshocksyndroom | + | |||
| infectieus (etterig): | ||||
| – impetigo | + | |||
| – lymfangitis/-adenitis | + | |||
| – flegmone | + | + | ||
| – fasciitis necroticans | + | |||
| – wondinfectie/pyodermie | + | + | ||
| – endometritis | + | |||
| – bacteriëmie | + | + | + | + |
| – sepsis | + | (+)* | + | (+)* |
| – acute endocarditis | + | + | ||
| – subacute endocarditis | + | + | ||
| – strooihaarden | ||||
| • artritis | + | + | ||
| • osteomyelitis | + | + | ||
| • spondylodiscitis | + | + | ||
| • pyomyositis | + | + | ||
| • meningitis | + | + | (+) | |
| • abcessen in parenchymateuze organen | + | + | ||
| • mycotisch aneurysma | + | + | + | + |
| – pneumonie | +** | (+) |
* Bij verminderde weerstand.
** Zeldzaam, vooral postinfluenza.
| door toxinen teweeggebracht: |
| – voedselvergiftiging |
| – toxischeshocksyndroom |
| – syndroom van Kawasaki* |
| – staphylococcal scalded skin-syndroom* |
| – erysipelas |
| infectieus (etterig): |
| – impetigo |
| – furunkel, karbunkel |
| – paronychia |
| – panaritium |
| – flegmone |
| – mastitis |
| – wondinfectie/pyodermie |
| – bacteriëmie |
| – sepsis |
| – acute endocarditis |
| – strooihaarden: |
| • artritis |
| • osteomyelitis |
| • spondylodiscitis |
| • meningitis |
| • pyomyositis |
| • abcessen in parenchymateuze organen |
| • mycotisch aneurysma |
| – pneumonie (vooral na influenza) |
* Voornamelijk bij kinderen.
Therapie
Snelle antibiotische therapie is essentieel, in dit geval met de combinatie van benzylpenicilline en clindamycine. Clindamycine wordt mede gegeven omdat het de synthese van de bacteriële toxines kan remmen. Als er sprake is van fasciitis necroticans, is ruim chirurgisch débridement noodzakelijk. De meeste patiënten zullen op de intesive care behandeld moeten worden in verband met bewaking, shockbestrijding, enz. Er zijn aanwijzingen dat toediening van intraveneuze immuunglobulinepreparaten de prognose van het streptokokken-toxischeshocksyndroom gunstig beïnvloedt.
Complicaties
Bacteriëmie, nierinsufficiëntie, ARDS en DIS.
[Kliniek]Intermezzo 6.3 Een patiënte met koorts, sufheid, hypotensie en huidafwijkingen
Een 18-jarige vrouw voelt zich acuut ziek. Ze heeft koorts en is licht in het hoofd. Ze wordt snel zieker en kan niet meer op haar benen staan. Ze is ook wat suf. De huisarts die haar ziet, denkt aan een (virale) encefalitis en regelt opname. In het ziekenhuis maakt de patiënte een zeer zieke indruk. Ze is soporeus en niet nekstijf. De temperatuur is 39,8 °C, de bloeddruk 90/52 mmHg, de pols 108/min. Bij nauwkeurig lichamelijk onderzoek is er een subtiel erytheem van de huid met een ‘narcosekapje’ (bleekheid rond de neus en de mond), roodheid van handpalmen en voetzolen, en een enantheem.
De internist die haar opneemt denkt op grond van de hypotensie en de huidafwijking aan het toxische-shocksyndroom. De patiënte kan door de sufheid geen adequate anamnese leveren over haar menses; er blijkt echter een tampon in situ te zijn. Deze wordt verwijderd en ingestuurd voor bacteriologisch onderzoek.
De hypotensie wordt bestreden met infusietherapie. In het laboratoriumonderzoek is er sprake van een leukocytose (15,3 × 109/l) met linksverschuiving en aneosinofilie. Er is een trombocytopenie (60 × 109/l), een verhoogd creatininegehalte (195 µmol/l), een vijfmaal verhoogd CPK, een zesmaal verhoogd ALAT en een metabole acidose.
Onder de diagnose toxische-shocksyndroom bij tampongebruik (‘tamponziekte’) krijgt de patiënte gericht op een TSST-1-producerende Staphylococcus aureus 6 dd 1 g flucloxacilline i.v. toegediend. Zij herstelt in de loop van een week.
De tamponkweek blijkt Staphylococcus aureus op te leveren. Negen dagen na het begin van de ziekte vervellen handen en voeten. Enkele weken later is er aanzienlijke haaruitval en vallen ook de nagels af.
Casuïstiek
Drie zoönosen uitgelicht: Q-koorts, brucellose en ebola
Kernpunten
Een zoönose is een infectieziekte die van dier op mens kan overgaan.
De voorbeelden Q-koorts, brucellose en ebola illustreren de verscheidenheid aan ziekteverwekkers, overdrachtsroutes, reservoirs en ziekteverschijnselen van zoönosen.
Een zoönose is een infectieziekte die van dier op mens kan overgaan. Infectieziekten die alleen bij dieren voorkomen, zoals varkenspest, of infectieziekten die via een insect van mens op mens worden overgedragen, zoals malaria, worden niet tot de zoönosen gerekend. Er zijn meer dan 200 zoönosen beschreven. In dit hoofdstuk worden drie zeer uiteenlopende voorbeelden van zoönosen besproken: Q-koorts, brucellose en ebola. Dit illustreert de verscheidenheid aan ziekteverwekkers, overdrachtsroutes, reservoirs (diersoorten waarin de zoönoseverwekker zich kan vermenigvuldigen) en ziekteverschijnselen van zoönosen.
Q-koorts
Kernpunten
Q-koorts is een zoönose die tussen 2007 en 2010 veel voorkwam in Nederland.
Q-koorts kan asymptomatisch verlopen, zich als acute infectie met pneumonie presenteren en chronisch worden, meestal in de vorm van een endocarditis of een intravasculaire infectie.
Verwekker
Coxiella burneti,een intracellulaire gramnegatieve coccoïde bacterie.
Besmetting
Aerosol of via besmette melkproducten.
Epidemiologie
Oorspronkelijk is deze zoönose beschreven in Australië, als Query (= vraagteken) fever. Van 2007 tot 2010 was er een grote uitbraak van Q-koorts in Nederland, vooral in Noord-Brabant en Gelderland, waarbij bijna 4000 mensen ziek werden. Als bron van de besmetting in Nederland worden besmette dieren op geitenmelkbedrijven beschouwd. Ook andere dieren (schapen, koeien, maar ook paarden en katten) kunnen de bron zijn, waarbij vooral aerosolen, ontstaan tijdens nageboorte bij chronisch geïnfecteerde dieren, tot hoge concentraties bacteriën in de lucht leiden. Vruchtwater, melk en feces kunnen eveneens zeer besmettelijk zijn.
Incubatietijd
Ongeveer twee tot zes weken.
Klinische verschijnselen
In > 60% van de gevallen verloopt de infectie asymptomatisch; 20% bezoekt naar schatting de huisarts en bij ongeveer 3% is ziekenhuisopname nodig.
Bij een symptomatische acute infectie krijgt de patiënt een griepachtig ziektebeeld met koorts, soms voorafgegaan door een koude rilling. Er is malaise, vaak heftige hoofdpijn, spierpijn, dyspnoe en niet-productieve hoest. Op de thoraxfoto is er vaak een infiltraat, dat bij lichamelijk onderzoek meestal niet wordt opgespoord. Chronische Q-koorts komt bij 1-2% van de patiënten voor. Endocarditis (met negatieve kweken en weinig of geen vegetaties op de klep) is de meest voorkomende vorm (driekwart van de gevallen; vooral bij pre-existent kleplijden). Dit is een moeilijk diagnostisch en therapeutisch probleem. Andere uitingen van chronische Q-koorts zijn mycotisch aneurysma, vaatprothese-infectie, osteomyelitis en hepatitis. Q-koorts tijdens de zwangerschap zou geassocieerd zijn met meer obstetrische complicaties; ook chronische Q-koorts en eventueel een reactivatie tijdens een volgende zwangerschap komen voor.
Laboratoriumdiagnostiek
In het algemeen is er een acutefasereactie met vaak een stijging van de transaminasen en CK. De diagnose is microbiologisch niet altijd eenvoudig: serologie met behulp van een indirecte immunofluorescentietest en een complementbindingsreactie. De serologie wordt in het algemeen pas laat positief. Het is daarom verstandig een tweede serummonster pas na drie weken af te nemen. In de serologie wordt gebruikgemaakt van twee soorten antigenen van C. burneti (fase 1- en fase 2-antigenen); antistoffen tegen fase 2 zijn in de acute fase het hoogst, terwijl fase 1-antistoffen later verschijnen en passen bij chronische Q-koorts. De polymerasekettingreactie, waarvan de sensitiviteit nog niet geheel duidelijk is, kan worden gedaan op bloed, keeluitstrijk en eventueel andere materialen.
Therapie
De behandeling van eerste keuze bij acute symptomatische Q-koorts is doxycycline 200 mg eenmaal daags gedurende twee tot drie weken. Herstel wordt hiermee versneld en de kans op recidief verminderd. Bij patiënten met een pneumonie in endemisch gebied dient men rekening te houden met Q-koorts. Alternatief voor doxycycline is een chinolon. Bij zwangeren wordt co-trimoxazol geadviseerd.
Bij patiënten met Q-koortsendocarditis, mycotisch aneurysma of geïnfecteerde vaatprothese wordt langdurige behandeling met doxycycline en hydroxychloroquine geadviseerd.
Complicaties
De sterfte bij Q-koorts wordt geschat op rond de 1%. De complicaties in de zwangerschap, endocarditis en de vasculaire complicaties, hiervoor besproken, zijn hieraan debet.
Preventie
Van toediening van Q-koortsvaccin aan geiten en schapen alsmede een lokaal verbod op het uitrijden van mest in voorjaar en vroege zomer wordt een preventief effect verwacht.
Brucellose (ziekte van Bang of febris undulans; maltakoorts)
Verwekker
Brucella (verschillende typen, onder andere Brucella abortus, Brucella melitensis en Brucella suis).
Besmetting
Het is een zoönose; de mens loopt de infectie op door het drinken van besmette melk(producten) en door direct contact met geïnfecteerde dieren. Het is meestal een importziekte.
Epidemiologie
De (zeldzame) gevallen van febris undulans komen vooral voor bij dierenartsen en abattoir- en laboratoriumpersoneel. In een enkel geval ontstaat besmetting van de mens door consumptie van rauwe melk, room of kaas (praktisch altijd in het buitenland). Bij geïnfecteerde koeien ontstaat spontane abortus. Grote aantallen Brucellae zijn te vinden in de placenta, in geaborteerde foetussen, in vaginaal secreet en in urine en melk van geïnfecteerde dieren. De mens is niet besmettelijk en er is nimmer bewezen dat infectie bij zwangere vrouwen leidt tot abortus. De eradicatie van brucellosis onder het vee in Nederland is praktisch voltooid.
Incubatietijd
Vijf dagen tot drie weken, soms langer.
Klinische verschijnselen
Het begin kan acuut zijn met koorts, koude rillingen, sterk transpireren en algemene klachten met spierpijnen. De ziekte kan ook geleidelijk beginnen en lijkt dan op tyfoïd. De temperatuurverhoging, die een hoog continuüm kan zijn of onregelmatig is, duurt tien tot veertien dagen en daalt dan spontaan. Tijdens de koortsperiode kunnen lever, milt en lymfeklieren vergroot palpabel worden. Na een aantal dagen normale temperatuur kan opnieuw een koortsperiode optreden en dit herhaalt zich nog een aantal malen (febris undulans).
Laboratoriumdiagnostiek
In het acute stadium is het micro-organisme soms uit het bloed te kweken. De agglutinatiereactie wordt positief. Ook een complementbindingsreactie is in latere stadia positief.
Therapie
Doxycycline 200 mg per dag per os gedurende zes weken, gecombineerd met gentamicine 5 mg/kg/dg i.v. gedurende 14 dagen bij normale nierfunctie.
Complicaties
Spondylitis, artritis, zelden meningitis en endocarditis. Met name bothaarden kunnen de eerste klinische manifestatie zijn.
Ebola
Verwekker
Ebolavirus, een filovirus met verschillende subtypen. Ebola is een van de hemorragische koortsen.
Besmetting
Oorspronkelijk een zoönose (mogelijk vormen grote vleermuizen het natuurlijke reservoir van het ebolavirus); transmissie tussen mensen vindt plaats door nauw contact met een geïnfecteerde patiënt (huid, mucosa, sperma).
Epidemiologie
Veroorzaakt epidemieën met een hoge mortaliteit (50-90%). Tijdens de recente ebola-uitbraak in West-Afrika van 2013 tot 2015 zijn 28.646 ebolapatiënten gemeld, van wie 11.323 mensen zijn overleden. Waarschijnlijk lag het werkelijke aantal zieken veel hoger. Ebola blijft sporadisch uitbraken veroorzaken in Centraal-Afrika.
Incubatietijd
2 tot 21 dagen (gemiddeld 4 tot 10 dagen).
Klinische verschijnselen
De ziekte begint met koorts en klachten van malaise, braken, diarree, hoesten, keelpijn, fotofobie, lymfeklierzwellingen, conjunctivitis, geelzucht en soms pancreatitis. Na vijf tot zeven dagen ontstaat een maculopapulaire huiduitslag. In het laboratoriumonderzoek worden gezien: leukopenie, trombocytopenie, stijging van de transaminasen en tekenen van diffuse intravasale stolling (DIS). Deze aspecifieke symptomen gaan over in een fase met ernstige bloedingsstoornissen, zich uitend in petechiën, slijmvliesbloedingen, multiorgaanfalen en septische shock. De ernst van de bloedingen kan daarnaast leiden tot hypovolemische shock en uiteindelijk tot de dood.
Laboratoriumdiagnostiek
Vanwege de hoge besmettelijkheid van het virus dienen de gezondheidszorgautoriteiten direct gewaarschuwd te worden, zodra er een verdenking op ebola is. De diagnostiek bestaat uit een PCR en IgM/IgG-antistofbepalingen op bloed of – indien beschikbaar – andere lichaamsvloeistoffen.
Therapie
Er is geen specifieke antivirale therapie beschikbaar, dus de therapie is primair ondersteunend. Experimenteel wordt antistoftherapie toegepast. Een vaccin is in ontwikkeling. Het is essentieel dat de patiënt in zeer strikte isolatie verpleegd wordt.
Casuïstiek
Infectieziekten met afwijkingen van het centrale zenuwstelsel
Kernpunten
Onderzoek patiënten met koorts op verschijnselen van meningeale prikkeling.
De combinatie van koorts en nekstijfheid is een indicatie voor een lumbale punctie.
De verwekkers van purulente meningitis verschillen per leeftijdsgroep.
Infectieziekten kunnen zich in het zenuwstelsel uiten als meningitis, encefalitis en als ruimte-innemend proces. Ook infecties in de nabijheid van het zenuwstelsel (epiduraal abces , geïnfecteerde sinuscavernosustrombose ) veroorzaken vaak neurologische verschijnselen. Veel verwekkers van infecties kunnen zich in het zenuwstelsel manifesteren (Tabel 6.16).
| uitingsvorm meningitis | encefalitis | focaal | |
|---|---|---|---|
| virussen: | |||
| poliovirus | + | ||
| ECHO, coxsackievirussen en enterovirus type 71 | + | + | |
| adenovirus | + | + | |
| epstein-barrvirus | + | + | |
| herpessimplexvirus | + | + | + |
| cytomegalovirus (congenitaal) | + | + | |
| varicellazostervirus | + | + | |
| (para-)influenzavirussen | + | ||
| bofvirus | + | + | |
| arbovirussen (niet in Nederland) | + | ||
| rabiësvirus | + | ||
| mazelenvirus (subacute scleroserende panencefalitis) | + | ||
| papovavirus (progressieve multifocale leukencefalopathie) | + | ||
| humaan immunodeficiëntievirus (hiv-1 en hiv-2) | + | ||
| HTLV-1 | + | ||
| bacteriën: | |||
| meningokokken (meningitis cerebrospinalis epidemica, ‘nekkramp’) | + | ||
| pneumokokken | + | ||
| Haemophilus influenzae | + | ||
| stafylokokken | + | + | |
| hemolytische streptokokken | + | + | |
| leptospiren | + | ||
| Listeria monocytogenes | + | + | |
| Borrelia burgdorferi | + | + | |
| Treponema pallidum | + | + | |
| Mycobacterium tuberculosis | + | + | |
| Actinomyces israeli | (+) | + | |
| Nocardia asteroides | + | + | |
| diverse bacteriën na penetrerende schedelverwondingen, iatrogene infecties | + | + | |
| schimmels: | |||
| Cryptococcus neoformans | + | ||
| Candida spp. | + | + | |
| Aspergillus spp. | + | + | |
| Histoplasma capsulatum | + | + | |
| protozoa: | |||
| Toxoplasma gondii | + | ||
| Plasmodium falciparum | + | ||
| Trypanosoma | + | + | |
| wormen: | |||
| Taenia solium (neurocysticercose) | + | ||
| Strongyloides stercoralis | + | + | |
| postinfectieuze encefalomyelitis: | |||
| mazelen | + | ||
| waterpokken | + | ||
| bof | + | ||
| rubella | + | ||
| kinkhoest | + | ||
| immunisatie tegen kinkhoest | + |
Alle patiënten met koorts moeten nauwkeurig worden onderzocht op verschijnselen van meningeale prikkeling, met het oog op vroege herkenning van purulente meningitis; de prognose van deze aandoening is veel beter als ze snel wordt behandeld.
Bij oudere kinderen en volwassenen uit verhoogde hersendruk zich door nekstijfheid . In liggende houding verzet de patiënt zich tegen passief heffen van het hoofd. Als het hoofd toch voorovergebogen wordt, worden de knieën reflectoir gebogen (symptoom van Brudzinski ). Bij passief heffen kunnen de benen slechts een kleine hoek met het bed maken (symptoom van Kernig ). In zittende houding met de benen gestrekt op de onderlaag lukt het noch actief noch passief het hoofd zó voorover te buigen dat de kin bij gesloten mond de borst raakt. Deze tests hebben echter weliswaar een hoge specificiteit, maar een lage sensitiviteit (< 10%). Andere symptomen van verhoogde hersendruk zijn braken, langzame pols, convulsies en soms enigszins gestuwde papillae nervi optici.
Vindt men bij een patiënt koorts en nekstijfheid, dan bestaat een absolute indicatie tot een lumbale punctie.
Bij purulente meningitis is de liquordruk verhoogd (> 12 cm); de liquor is troebel door duizenden witte bloedcellen per mm3, voornamelijk granulocyten. Het eiwitgehalte is verhoogd, meestal > 1 g/l, en het glucosegehalte is, zelfs bij diabetici, verlaagd (< 2,4 mmol/l). De oorzaak is meestal bacterieel; met bacteriologisch onderzoek wordt in het grampreparaat naar bacteriën gezocht en een kweek ingezet. Er is een duidelijk verschil in verwekkers bij de verschillende leeftijdsgroepen (Tabel 6.17).
| pasgeborene |
Streptococcus agalactiae (groep B) Escherichia coli Listeria monocytogenes |
| baby, kleuter en schoolkind |
Haemophilus influenzae (type B)* meningokokken pneumokokken |
| adolescent en volwassene |
meningokokken pneumokokken (stafylokokken) (Haemophilus influenzae type B) |
| oudere |
pneumokokken meningokokken stafylokokken |
* Sinds vaccinatie zeldzaam.
Bij niet-purulente meningitis kan de liquordruk verhoogd zijn. De liquor is helder, maar bevat te veel cellen (tot ongeveer 1000 per mm3), voornamelijk lymfocyten en monocyten. Het eiwitgehalte is iets verhoogd (0,45-1 g/l) en het glucosegehalte is normaal of licht verlaagd (normaal 2,4-4,4 mmol/l; circa 65 tot 75% van de bloedglucose). De oorzaak is meestal viraal. Behalve een bacteriologisch onderzoek wordt bij niet-purulente meningitis derhalve virologisch onderzoek van de liquor ingesteld. Een purulente meningitis begint wel eens niet-purulent en anderzijds kan een niet-purulente meningitis een verschijnsel zijn bij een bacteriële ziekte: sepsis, leptospirose, bijholteontsteking en dergelijke. Bij alle meningitiden moeten ook bloedkweken worden ingezet.
Bij meningisme bestaat nekstijfheid met een geheel normale liquor. Men vindt het symptoom bij vele ziekten, zoals pneumonie, angina, lymfeklierzwellingen van de hals en afwijkingen van de (hals)wervelkolom.
Casuïstiek
Purulente meningitis
Kernpunten
Klinische verschijnselen van meningokokkenmeningitis: infectieuze verschijnselen, meningeale verschijnselen, cerebrale verschijnselen.
Bij meningokokkensepsis is er vaak geen meningitis.
Fulminante meningokokkensepsis uit zich door huidbloedingen en shock.
Bij fulminante meningokokkensepsis kan een acute bijnierschorsinsufficiëntie optreden.
Nauwe contacten krijgen chemoprofylaxe.
Meningitis purulenta door pneumokokken, H. influenzae en stafylokokken verloopt meestal even stormachtig als meningokokkenmeningitis.
Er zijn zeer effectieve conjugaatvaccins tegen meningokokkengroep C, Haemophilus influenzae type b en pneumokokken
Meningitis cerebrospinalis epidemica
Verwekker
Neisseria meningitidis (meningokok). Dit micro-organisme bereikt de meningen vanuit de keel via een bacteriëmie.
Besmetting
Druppelinfectie.
Epidemiologie
De meningokok kan bij 5 tot 10% van de bevolking uit de nasofarynx worden gekweekt. Overdracht vindt plaats via de lucht (druppels) van persoon naar persoon en leidt doorgaans tot een asymptomatische infectie (gezonde dragers) en een enkele keer tot de klinische symptomen van meningitis of sepsis. Gezonde dragers zijn de belangrijkste bron van besmetting. In Nederland ziet men meningokokkenziekte vooral in de winter, maar in de tropen vooral aan het einde van de droge tijd. Het risico op meningokokkenziekte is verhoogd bij dicht opeen levende groepen, zoals studenten gedurende de introductieweken. In ons land – en in andere geïndustrialiseerde landen – werden de meeste ziektegevallen veroorzaakt door meningokokken van de serogroepen B en C. Sinds de introductie van vaccinatie (2002-2003) tegen meningokokken groep C is de frequentie van dit serotype zeer sterk gedaald. In de tropen komen vooral meningokokken serotype A voor.
Meningokokkenziekte is vooral een ziekte van kleine kinderen tussen 3 maanden en 5 jaar. Een tweede, kleinere piek van ziektegevallen ziet men bij tieners. Pasgeborenen zijn tot de leeftijd van 3 maanden beschermd door maternale antistoffen. De leeftijdsverdeling verschilt overigens naar serotype: ziektegevallen veroorzaakt door serotype C en in mindere mate serotype A komen wat vaker voor bij ouderen in vergelijking met gevallen veroorzaakt door serotype B.
Incubatietijd
Kort, meestal drie à vier dagen.
Klinische verschijnselen
Deze zijn onder te verdelen in infectieuze verschijnselen, meningeale verschijnselen en vaak ook cerebrale verschijnselen (encefalitis). Meestal is er een zeer acuut begin met temperatuurverhoging, hoofdpijn, misselijkheid, braken, convulsies en bewustzijnsstoornissen. Bij onderzoek vindt men meningeale prikkelingsverschijnselen, hoge temperatuur, bradycardie, soms urineretentie. Het bewustzijn is gestoord; nu eens passiviteit en sopor, dan weer delier en motorische onrust. Door druk op de hersenzenuwen zijn voorbijgaande en blijvende uitvalsverschijnselen mogelijk: oogspierverlammingen, doofheid, facialisverlamming, hemianopsie, neuritis optica. Door druk op de hersenschors en een collaterale ontsteking in het hersenweefsel zelf kunnen pathologische reflexen en een- of dubbelzijdige spastische paresen ontstaan.
De ziekte uit zich soms als meningokokkensepsis; in dat geval is het beeld fulminanter en is er vaak geen meningitis, en hoofdpijn en nekstijfheid zijn geen belangrijke symptomen (Tabel 6.18). Een belangrijk kenmerk is het optreden van bloedinkjes in de huid, die in grootte uiteenlopen van petechiën tot ecchymosen (Figuur 6.10a en b). In het laatste geval hebben de rode vlekjes een blauw centrum. Ze moeten vooral gezocht worden op aan druk blootgestelde huidgedeelten, dus aan de enkels en op de billen. Gaat de meningokokkensepsis met bloedinkjes in de huid en met shock gepaard, dan spreekt men van het syndroom van Waterhouse-Friderichsen , dat samenhangt met intravasale stolling (Tabel 6.18).
| meningitis | meningitis met shock | fulminante meningokokkensepsis | |
|---|---|---|---|
| mediane duur van ziekte tot opname | 24 uur | 18 uur | 12 uur |
| leukocyten in liquor | hoog | hoog | laag |
| purpura | afwezig | variabel | aanwezig |
| diffuse intravasale stolling | afwezig | variabel | aanwezig |
| CRP | hoog | licht verhoogd | laag |
| sterfte | 1-5% | 10% | 30-70% |

Een zeldzaam ziektebeeld is de chronische meningokokkensepsis (chronische meningokokkemie ) met malaria-achtig verlopende koortsperiodes, die zich uitstrekken over weken tot maanden en spontaan genezen of uiteindelijk overgaan in een meningitis. Dit wordt vaak veroorzaakt door minder virulente meningokokkenstammen. Achter meningitis door ongebruikelijke serotypen (W135, X, Y, Z) gaat relatief vaak een complementdeficiëntie (C6‑, C7‑, C8- of C9-deficiëntie) schuil.
Laboratoriumdiagnostiek
Bloedkweek en onderzoek van de liquor : celgetal en differentiatie, grampreparaat en kweek, eiwit en glucose. Een grampreparaat en kweek van huidbloedinkjes leveren bij patiënten die reeds antibiotica kregen vaak nog de verwekker op; keelkweek.
Therapie
Antibiotica moeten direct gegeven worden. Penicilline: intraveneus in een 24-uursdosering van 12 miljoen E voor een volwassene, te verdelen over zes giften. Tijdens de therapie verdwijnt de koorts bij meningokokkenmeningitis en -sepsis in enkele dagen. Bij patiënten met meningokokkensepsis is opname op een intensive care aangewezen. Bij verdenking op eventuele bijnierschorsinsufficiëntie bij meningokokkensepsis (zie onder Complicaties) is glucocorticosteroïdsubstitutie aangewezen. In tegenstelling tot de situatie bij pneumokokken- en Haemophilus-meningitis is bij meningokokkenmeningitis standaard toediening van steroïden niet zinvol.
Bij meningokokkeninfecties kan men een tweede episode van koorts zien met artralgie of artritis (op basis van immuuncomplexen). Dit is geen reden de antibiotische therapie te veranderen.
Bij zuigelingen en kleine kinderen is neurologische nacontrole wenselijk in verband met het later tot uiting komen van blijvende hersenbeschadiging (hydrocefalie, doofheid en mentale retardatie).
Complicaties
Zie hiervoor. Voorts otitis media acuta, pericarditis, arthritis purulenta en immuuncomplexartritis. Bij de fulminante meningokokkensepsis kan een acute bijnierschorsinsufficiëntie optreden door bloeding in de bijnieren; bovendien kan er uitgebreide huidnecrose ontstaan.
Preventie
Aangezien gezinscontacten (en contacten die daarmee vergelijkbaar zijn, maar niet klasgenoten!) van een patiënt met een meningokokkenziekte een verhoogd risico lopen zelf deze infectieziekte te krijgen, wordt voor hen chemoprofylaxe aangeraden met rifampicine (2 dd 10 mg/kg p.o. gedurende twee dagen, maximaal 600 mg per dosis; bij kinderen jonger dan drie maanden: 2 dd 5 mg/kg p.o. gedurende twee dagen). Alternatieven zijn een eenmalige gift ceftriaxon of ciprofloxacine. Overigens moet ook de patiënt zelf vóór ontslag uit het ziekenhuis deze profylaxe krijgen: penicilline i.v. eradiceert niet de stammen in de keel. Ondanks profylaxe moet men bij (gezins)contacten alert zijn op symptomen die kunnen wijzen op een beginnende meningokokkenziekte.
Er zijn vaccins die bereid zijn op basis van polysacharideantigenen van serogroep A, C, Y en W-135. Deze vaccins zijn effectief gebleken en worden in de tropen gebruikt (ook voor bepaalde groepen reizigers naar landen waar deze infecties veel voorkomen). In Nederland zijn naar aanleiding van een toename van het aantal gevallen van meningitis door groep C-meningokokken in 2002 alle kinderen tot 18 jaar gevaccineerd. Het conjugaatvaccin is sinds januari 2003 opgenomen in het Rijksvaccinatieprogramma, met als gevolg dat de groep C-infectie vrijwel is verdwenen. Aan een groep B-vaccin wordt gewerkt.
Purulente meningitis door andere bacteriën
Deze aandoening ontstaat als lokalisatie van een sepsis, soms met een onduidelijke porte d’entrée of secundair aan ontstekingsprocessen in de buurt van de hersenvliezen: bij otitis, mastoïditis, sinusitis, osteomyelitis, hersenabces of na schedeltrauma.
Verwekkers
Veel bacteriën kunnen een purulente meningitis verwekken, maar het meest frequent wordt deze veroorzaakt door pneumokokken (vooral bij ouderen en bij een recent of oud schedeltrauma met liquorfistel, na splenectomie; bij kinderen is dit na invoering van de pneumokokkenvaccinatie in het Rijksvaccinatieprogramma tegenwoordig zeldzaam), Haemophilus influenzae type b (vooral bij kinderen jonger dan 10 jaar; tegenwoordig zeldzaam door het succes van Hib-vaccinatie), groep B-streptokokken en E. coli (bij neonaten, zie Tabel 6.17) en stafylokokken. Bij neurochirurgische patiënten ziet men soms meningitis door gramnegatieve darmbacteriën (E. coli, Pseudomonas aeruginosa). Bij patiënten met stoornissen van de cellulaire immuniteit, bijvoorbeeld niertransplantatiepatiënten en aidspatiënten, ziet men Listeria monocytogenes en ook gisten als Cryptococcus neoformans als verwekker van meningitis. Ook moet aan tuberculose als oorzaak van purulente meningitis worden gedacht (zie verder).
Klinische verschijnselen
Purulente meningitis door pneumokokken, H. influenzae en stafylokokken ontwikkelt zich meestal even stormachtig als meningokokkenmeningitis, met dezelfde klachten en verschijnselen. Vaak is een sepsis aantoonbaar. Huidbloedinkjes treden bij hoge uitzondering op. Onbehandeld verlopen deze infecties in drie à vijf dagen fataal. Meningitis door Listeria, cryptokokken en Lyme ontwikkelt zich vaak langzamer en wordt daardoor laat herkend.
Laboratoriumdiagnostiek
Liquoronderzoek: celgetal en differentiatie, eiwit en glucose. Grampreparaat van liquor, kweek. Voor de diagnose cryptokokkose is er een sensitieve test op cryptokokkenantigeen beschikbaar. Bij verdenking op tuberculose ook ziehl-neelsenpreparaat en PCR. Er moet ook altijd een bloedkweek worden ingezet.
Therapie
Op geleide van het klinische beeld en de eerste laboratoriumgegevens zal men zo snel mogelijk met antimicrobiële therapie beginnen. Als de uitslag van de kweek bekend is, kiest men het antibioticum in overeenstemming met het gevonden micro-organisme en het gevoeligheidsspectrum. Het tegelijk met de antibiotische therapie toedienen van glucocorticosteroïden (dexa-methason i.v. gedurende 4 dagen) voorkomt complicaties.
Haemophilus influenzae: de derdegeneratie cefalosporinen (cefotaxim, ceftriaxon) zijn thans eerste keus.
Pneumokokken: bij volwassenen penicilline, 12 miljoen E i.v. in zes doses verdeeld.
Staphylococcus aureus: bij volwassenen (flu)cloxacilline 12 g i.v. in zes doses verdeeld. Bij gebleken gevoeligheid voor penicillinebehandeling zoals bij pneumokokkenmeningitis.
Listeria monocytogenes: amoxicilline 12 g per dag in zes doses voor een volwassene.
Onbekende verwekkers: meningitis door onbekende verwekkers (negatief grampreparaat) wordt initieel behandeld met een brede antibiotische therapie: een cefalosporine van de derde generatie samen met amoxicilline om een eventuele Listeria mee te behandelen. Zodra de verwekker of de gevoeligheid in vitro bekend is, wordt de therapie aangepast.
Cryptokokken: een combinatie van amfotericine B i.v. en flucytosine per os of i.v. Vooralsnog lijken de resultaten met fluconazol, zeker initieel, minder goed.
Er is een zeer effectief polysacharideconjugaatvaccin tegen Haemophilus influenzae type b beschikbaar, dat vanaf 1993 (kinderen geboren na 1 april 1993) is opgenomen in het Rijksvaccinatieprogramma (op de leeftijd van 2, 3, 4 en 11 maanden). Sinds 2006 is ook een conjugaatvaccin tegen pneumokokken in het Rijksvaccinatieprogramma opgenomen. Zowel Haemophilus- als pneumokokkenmeningitis wordt sindsdien bij kinderen nauwelijks meer gezien.
[Kliniek]Intermezzo 6.4 Een patiënt die in enkele uren doodziek wordt
Een 15-jarige jongen komt ziek thuis van voetballen. Hij had in de kleedkamer een koude rilling gehad. Zijn lichaamstemperatuur is ruim 39 °C. Hij voelt zich gammel en gaat naar bed. Als hij drie uur later naar de wc moet, kan hij niet goed op zijn benen staan. Weer twee uur later ontdekt zijn moeder dat hij vlekjes op zijn armen en benen heeft. De huisarts wordt gewaarschuwd. Deze komt en stelt vast dat er diffuus petechiën en ecchymosen zijn (de vlekjes zijn niet wegdrukbaar met een waterglas). De bloeddruk is 95/55 mmHg, de pols 128/min. De acra zijn koud en cyanotisch. De patiënt is niet nekstijf.
De huisarts heeft als werkdiagnose fulminante meningokokkensepsis (FMS) op grond van de volgende overwegingen:
Er is een zeer korte ziekteduur (enkele uren).
Er is shock, de patiënt is niet nekstijf.
Er is een hemorragische diathese, waarschijnlijk op grond van vasculitis en diffuse intravasale stolling.
De huisarts vraagt direct opname aan en betreurt het dat hij geen parenteraal toedienbaar antibioticum in zijn dokterstas heeft.
Op de intensivecareafdeling in het ziekenhuis wordt eveneens de waarschijnlijkheidsdiagnose FMS gesteld. De shock wordt bestreden en na het afnemen van twee bloedkweken wordt onmiddellijk een antibioticum (penicilline G) intraveneus toegediend.
In verband met de mogelijkheid van een (relatieve of absolute) bijnierschorsinsufficiëntie krijgt de patiënt glucocorticosteroïdsubstitutie. Een huidbiopt wordt ingestuurd voor grampreparaat en kweek.
Casuïstiek
Meningitis tuberculosa
Kernpunten
De anamnese bij meningitis tuberculosa is langer dan die bij de andere meningitiden.
Resistentie van de tuberkelbacil maakt de behandeling moeilijk.
Verwekker
Mycobacterium tuberculosis.
Besmetting
Uitzaaiing van tuberculose elders: in longen, nier of als onderdeel van miliaire tuberculose.
Epidemiologie
Zie 10.1007/978-90-368-1841-4_16#Sec144.
Incubatietijd
Niet goed te bepalen, afhankelijk van de primaire tuberculeuze infectie.
Klinische verschijnselen
De anamnese is meestal langer dan die van de andere meningitiden: geleidelijk in een of twee weken toenemende lusteloosheid, hangerigheid, hoofdpijn, koorts, sufheid en andere psychische veranderingen. Ten slotte is de patiënt zwaar ziek, heeft hoge koorts en is nekstijf; dikwijls ziet hij dubbel door een abducensparese (basale meningitis). Vaak is bij verder onderzoek (bijvoorbeeld op de thoraxfoto) miliaire tuberculose of tuberculose elders te herkennen.
Laboratoriumdiagnostiek
De liquor cerebrospinalis is karakteristiek veranderd: verhoogde druk, kleurloos, helder met veel cellen (bijvoorbeeld 100-400/mm3), voornamelijk lymfocyten, verlaagd glucose- en chloridegehalte. Met kleuring volgens Ziehl-Neelsen wordt naar tuberkelbacteriën gezocht. De kweek van de liquor is niet altijd positief; daarom moeten ook sputum en urine worden gekweekt (eventueel ook leverbiopt en beenmerg). Liquor kan ook worden onderzocht met behulp van PCR om mycobacteriële nucleïnezuren aan te tonen. De mantouxreactie is meestal positief. Dat geldt ook voor in-vitrotests die productie van interferon-γ door bloedcellen onder invloed van mycobacteriële antigenen aantonen (Quantiferon-test).
Therapie
Isoniazide (INH), rifampicine parenteraal (of oraal), pyrazinamide per os en amikacine i.v. Als adjuvante behandeling worden corticosteroïden (dexamethason) gegeven. Wanneer multiresistente mycobacteriën worden verwacht (bijvoorbeeld bij eerdere partiële behandeling, of bij patiënten uit Oost-Europa), kan het moeilijk zijn een effectieve behandeling in te stellen. Overleg met deskundigen (de nationale tuberculoseconsulent van de KNCV) is dan aangewezen.
Complicaties
Hydrocefalie, hersenzenuwbeschadigingen, andere neurologische restverschijnselen en restverschijnselen van de tuberculose elders. Onbehandeld voert de ziekte vrijwel steeds tot de dood.
Preventie
Het BCG-vaccin geeft een in de tijd beperkte bescherming tegen tuberculeuze meningitis.
Casuïstiek
Niet-purulente meningitis
Kernpunt
Virale meningitis is meestal een goedaardig verlopende ziekte.
Niet-purulente meningitis kan door verschillende oorzaken worden teweeggebracht.
Virussen (virale meningitis, veelal het beeld van een meningo-encefalitis). Enterovirussen (onder andere poliomyelitisvirus), adenovirus, bofvirus, epstein-barrvirus en hiv zijn belangrijke verwekkers.
Bacteriën. De verwekkers van purulente meningitis kunnen initieel het beeld van niet-purulente meningitis geven. Daarnaast ziet men soms een niet-purulente meningitis bij lues in het tweede stadium, bij leptospirosen (zie ▶ par. 6.10.1) en bij de ziekte van Lyme (neuroborreliose) (zie ▶ par. 6.6.4).
Parasieten. Naegleria, een amoebe, kan een moeilijk te behandelen meningitis veroorzaken (zie ▶ par. 6.14.4). De meeste andere parasieten veroorzaken meer encefalitis, dan wel neurologische haardverschijnselen (zie Tabel 6.16).
Besmetting
Afhankelijk van de oorzaken, onder andere enterovirussen fecaal-oraal, adenovirus en bofvirus druppelinfectie.
Incubatietijd
Afhankelijk van de oorzaak.
Klinische verschijnselen
De patiënten worden vrij plotseling ziek met algemene verschijnselen van hoofdpijn, koorts, misselijkheid en soms braken. Bij onderzoek wordt nekstijfheid gevonden, soms met geringe neurologische afwijkingen als reflexverschillen en pathologische reflexen.
Berucht was poliomyelitis acuta anterior (‘kinderverlamming’): bij een klein deel van de patiënten ontstonden, na een griepachtig begin met pijn in de ledematen, opstijgende verlammingen van het perifere type, soms tot de dood leidend door ademhalings- en slikverlamming. Na genezing waren er vrijwel altijd restverschijnselen. Men moet, ook indien nog geen verlammingen bestaan, aan deze ziekte denken als een patiënt met sereuze meningitis geen kniepees- en achillespeesreflexen heeft. Nu deze ziekte in Nederland nauwelijks meer voorkomt, is sereuze meningitis door andere virussen gelukkig meestal een goedaardig verlopende ziekte: de koorts daalt in ongeveer drie tot vijf dagen en de verschijnselen en klachten verdwijnen geleidelijk in tien dagen tot drie weken.
Laboratoriumdiagnostiek
Viruskweken van liquor, keeluitstrijk, feces en urine. De PCR heeft geleidelijk de viruskweken vervangen. IgM-antistoffen tegen bof in één serummonster, IgG-antistoffen bepalen in twee bloedmonsters, afgenomen in respectievelijk de eerste en derde ziekteweek. Bacteriologisch onderzoek van liquor en bloed om bacteriële ziekten op te sporen die leiden tot niet-purulente meningitis en beginnende purulente meningitiden. Luesserologie en diagnostiek naar neuroborreliose in bloed en liquor.
Therapie
Omdat het syndroom meestal door virussen wordt veroorzaakt, zijn bedrust en symptomatische behandeling zonder antibiotica voldoende.
Epidemiologie en preventive
Door de consequent verrichte immunisatie van de jeugd met DKTP-vaccin is poliomyelitis acuta anterior in Nederland zeer zeldzaam geworden. De aandoening vlamt soms op in gemeenschappen waar (godsdienstige) bezwaren tegen inenting bestaan. Ondanks de wereldwijde uitroeiingscampagne circuleert het poliovirus in bepaalde tropische gebieden. Derhalve moeten reizigers naar deze streken met een boosterdosis poliovaccin (vaak in combinatie met difterie- en tetanustoxoïd, DTP) worden beschermd indien de laatste vaccinatie langer dan tien jaar geleden plaatsvond. Ouderen die nimmer werden gevaccineerd, wordt volledige immunisatie voor een dergelijke reis geadviseerd. Door de invoering van de vaccinatie tegen bof (BMR-vaccin) per 1 januari 1987 is de frequentie van bofmeningitis sterk afgenomen.
Casuïstiek
Lymeneuroborreliose
Kernpunt
Lymeneuroborreliose is een van de gedissemineerde manifestaties van de ziekte van Lyme.
Verwekker
Borrelia burgdorferi.
Besmetting
Borrelia burgdorferi wordt overgedragen door Ixodes teken, die endemisch zijn in grote gedeelten van het noordelijk halfrond. Een beet van een besmette teek kan leiden tot de ziekte van Lyme (lymeborreliose). De eerste manifestatie is doorgaans een lokale huidafwijking, erythema migrans genaamd. Lymeneuroborreliose is een van de gedissemineerde manifestaties van de ziekte van Lyme.
Epidemiologie
Zie ook ▶ par. 6.8.11. Het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) schat dat er per jaar in Nederland enkele duizenden gevallen van gedissemineerde lymeziekte worden gezien, waarvan enkele honderden gevallen van lymeneuroborreliose.
Incubatietijd
Een erythema migrans ontstaat gemiddeld één à twee weken na een tekenbeet (range 3 dagen tot 3 maanden). Lymeneuroborreliose ontstaat doorgaans enkele weken tot maanden na de tekenbeet.
Klinische verschijnselen
De meest voorkomende uiting van een vroege lymeneuroborreliose bij volwassenen is een pijnlijke meningoradiculitis, al dan niet gepaard gaand met gevoelsstoornmissen of neurologische uitval en/of hersenzenuwbetrokkenheid. De hevige pijn in de ledematen is doorgaans schietend van aard met nachtelijke verergering en is initieel meestal unilateraal. Andere manifestaties zijn een subacute meningitis, craniale of plexusneuritis en mononeuritis multiplex. Late lymeneuroborreliose, waarbij de ziekte meer dan zes maanden bestaat, is zeldzamer en wordt gekenmerkt door een chronische meningitis, (meningo-)encefalitis of (encefalo)myelitis of zeer zelden een cerebrale vasculitis. Tot slot, bij een late cutane vorm van de ziekte van Lyme, de zogenoemde acrodermatitis chronica atrophicans, wordt in tot wel 50% van de gevallen een sensorische (poly)neuropathie waargenomen.
Laboratoriumdiagnostiek
Antistoffen tegen Borrelia burgdorferi bepalen in serum is vaak de eerste stap. Naarmate de ziekte langer duurt (> 6-8 weken) neemt de gevoeligheid van serologie toe, wees dus beducht op fout-negatieve uitslagen bij een klinisch hoge verdenking en een kort bestaand ziektebeeld. De tweede stap is een lumbaalpunctie. Typisch zal hier sprake zijn van een celreactie (pleiocytose), verhoogd totaal eiwit en zogeheten intrathecale antistofproductie tegen Borrelia burgdorferi (de ratio van antistoffen in het hersenvocht versus serum). Indien er onduidelijkheid blijft bestaan over de diagnose lymeneuroborreliose, kan vroeg in het beloop een Borrelia burgdorferi PCR in de liquor en/of het bepalen van het chemokine CXCL-13 – een vroege biomarker van centraal-zenuwstelselontsteking – van toegevoegde waarde zijn. Bij perifere neurologische manifestaties, zoals een neuropathie bij acrodermatitis chronica atrophicans, hoeft er geen sprake te zijn van intrathecale antistofproductie of pleiocytose.
Therapie
De Nederlandse richtlijn adviseert voor volwassenen ceftriaxon i.v. 2000 mg 1 dd (2 weken voor vroege en 4 weken voor late neuroborreliose), maar er zijn ook aanwijzingen dat oraal doxycycline effectief zou kunnen zijn. Als er sprake is van perifere neurologische manifestaties, en er geen sprake is van een pleiocytose, kan in ieder geval worden volstaan met een behandeling van doxycycline 2 dd 100 mg gedurende 30 dagen.
Complicaties
Neurologische restverschijnselen en postinfectieuze klachten worden frequent waargenomen na antibiotisch behandelde lymeneuroborreliose en zijn deels afhankelijk van hoe lang de klachten bestonden alvorens behandeling wordt ingesteld. Doorgaans geldt: hoe eerder behandeld, hoe gunstiger de prognose. Het herstel van de kliniek en de biochemische veranderingen in het hersenvocht kan traag verlopen. Persisterende Borrelia burgdorferi-infectie na aanbevolen antibiotische therapie is uiterst zeldzaam bij lymeneuroborreliose.
Preventie
Er is momenteel geen humaan vaccin tegen de ziekte van Lyme.
Casuïstiek
Encefalitis
Kernpunt
Encefalitis is een alarmerend ziektebeeld met hoge koorts, convulsies, sopor en neurologische haardverschijnselen.
Oorzaken
Encefalitis en encefalomyelitis kunnen ontstaan tijdens of na infectieziekten zoals mazelen, waterpokken, bof, herpes simplex en herpes zoster en hiv. Een aantal andere virussen (bijvoorbeeld het ECHO-virus) kan een geïsoleerde meningo-encefalitis veroorzaken. In de Verenigde Staten kan encefalitis ook veroorzaakt worden door het westnijlvirus. Dit door vogels overgebrachte virus kan een meningo-encefalitis veroorzaken die tot de dood kan leiden. Het westnijlvirus werd in de Verenigde Staten in 1999 voor het eerst vastgesteld en heeft zich sindsdien over het hele land verspreid. Tot op heden is deze infectie in ons land nog niet gesignaleerd, wel in Zuid-Europa (Noord-Italië).
Epidemiologie
De epidemiologie van postinfectieuze encefalitiden wordt in belangrijke mate – maar zeker niet uitsluitend – bepaald door de epidemiologie van de infectieziekten die ze vergezellen. Zo vond men meer gevallen van postinfectieuze mazelenencefalitis tijdens de tweejaarlijkse epidemische verheffing van deze ziekte dan daarbuiten.
Incubatietijd
Afhankelijk van de verwekker; bij postinfectieuze encefalitis circa tien dagen.
Klinische verschijnselen
Plotseling ontstaan van een alarmerend ziektebeeld met hoge koorts, convulsies, sopor (tot coma toe) en bij onderzoek neurologische haardverschijnselen met uitval van functies, afhankelijk van de lokalisaties van de aandoening in de hersenen en het ruggenmerg (bijvoorbeeld uitval van hersenzenuwen, verlammingen, dwarslaesies met blaas- en darmledigingsstoornissen). Er hoeft geen nekstijfheid te bestaan, tenzij de encefalitis bij een sereuze meningitis optreedt. De koorts, die wel 40 °C kan bereiken, daalt vaak in een dag of vijf, waarna verbetering van de uitvalsverschijnselen kan optreden. De prognose is echter ernstig door uitval van vitale functies. Postinfectieuze encefalitiden doen zich in het verloop van een genezende infectieziekte voor.
Laboratoriumdiagnostiek
De liquor cerebrospinalis is helder en kleurloos en bevat meestal slechts iets te veel cellen, maar een duidelijk verhoogd eiwitgehalte en dikwijls een iets verhoogd glucosegehalte in vergelijking met de bloedglucose. Virusonderzoek is gericht op de in Nederland gebruikelijke ziekten, tenzij de anamnese uitwijst dat de patiënt recent in het buitenland is geweest. Met name herpes simplex moet uitgesloten worden, omdat dit snel behandeld moet worden met aciclovir.
Therapie
Zorgvuldige verpleging met het oog op de ademhalings- en slikverlammingen. Bij het vermoeden van herpesencefalitis wordt na het inzetten van de diagnostiek begonnen met aciclovir (zie ▶ par. 6.8.10). Antibiotica hebben geen invloed op het verloop.
Complicaties
Neurologische en psychische restverschijnselen: karakterveranderingen, retardatie, blijvende verlammingen en voorts myocarditis.
Preventie
Aangezien de oorzaak van de postinfectieuze encefalitiden onbekend is, kan de preventie slechts indirect zijn. Door consequente vaccinatie tegen bijvoorbeeld mazelen, bof en rubella zijn de postinfectieuze encefalitiden, als complicatie van de ‘natuurlijke’ ziekte, praktisch geheel verdwenen.
Casuïstiek
Tetanus (kaak- of wondklem)
Kernpunten
Tetanus ontstaat via verwondingen.
Kenmerkend bij tetanus zijn de rigiditeit en spierkrampen.
Verwekker
Clostridium tetani.
Besmetting
Wondinfectie. De Clostridia vermenigvuldigen zich lokaal; de exotoxinen verwekken de ziekteverschijnselen, nadat ze de motorische zenuwcellen via zenuwbanen hebben bereikt.
Epidemiologie
Tetanussporen komen zeer verspreid in de natuur voor. Als ze geschikte omstandigheden vinden (onder andere necrotisch weefsel en anaerobie) gaan ze in de vegetatieve vorm over, waarbij een exotoxine wordt gevormd. De meeste infecties ontstaan via verwondingen; soms kan geen porte d’entrée worden gevonden. Door de systematische immunisatie van zuigelingen, kleuters en schoolkinderen tegen onder andere tetanus is ook dit ziektebeeld in Nederland zeldzaam geworden en treft men het uitsluitend aan bij oudere, niet-geïmmuniseerde personen.
Incubatietijd
Twee dagen tot enkele weken.
Klinische verschijnselen
Deze ziekte heeft een slechte prognose als de incubatietijd korter is dan zeven dagen. Tetanus zal bovendien ernstiger verlopen indien het tijdsverloop tussen het begin van de symptomen en het ontstaan van de pijnlijke spierkrampen (de zogenoemde period of onset) korter is dan twee dagen.
De ziekte begint met een strak gevoel om de mond en in de kaakspieren. Door deze verhoogde spiertonus kan de mond al snel niet meer normaal worden geopend. Ongeveer tegelijkertijd ontstaat ook rigiditeit van de buikspieren en van de lange rugspieren. Bij onderzoek in dit stadium vindt men trismus, hard aanvoelende buikspieren en kan men de hand gemakkelijk onder de rug in het lendengebied van de liggende patiënt steken. Rigiditeit van deze spieren is soms het enige symptoom van de lichtere vormen van tetanus die in een aantal weken geleidelijk kunnen verdwijnen.
Verloopt de ziekte echter ernstiger, dan ontstaan bij de rigiditeit spierkrampen, het eerst in het gelaat: de risus sardonicus . Hierbij komen ten slotte aanvallen van zeer pijnlijke krampen in alle spieren van het lichaam voor, waarbij de extensoren overheersen: met achteroverhangend hoofd en een angstige, pijnlijke grijns op het gelaat trekt de patiënt de rug geheel hol, terwijl ook de buikspieren strak gespannen blijven en de extremiteiten in strekstand staan. Soms zijn hier ook de larynxspieren bij betrokken, zodat de patiënt cyanotisch wordt en dreigt te stikken. De aanvallen kunnen wisselen in frequentie. Tussen de aanvallen is de patiënt rigide en angstig in afwachting van de volgende aanval, maar verder geheel compos mentis.
Uiteindelijk kan ook autonome disregulatie ontstaan. De oorzaak van de dood kan een geleidelijk stijgende temperatuur tot 40-42 °C (hyperpyrexie ) zijn, met daling van de bloeddruk en collaps, waarschijnlijk door hersenstamintoxicatie. Is het verloop niet fataal, dan kan de krampperiode wel vier tot zes weken duren, met een geleidelijke vermindering van de frequentie.
Laboratoriumdiagnostiek
Geen. Uit eventueel uitgesneden wondmateriaal kan de bacterie worden gekweekt.
Therapie
Zo snel mogelijk inspuiten van menselijk antitetanusimmunoglobuline (MATIG) , 3000 E i.m. op twee achtereenvolgende dagen, ter binding van de tetanustoxine die op weg is naar het zenuwstelsel (in de cellen gebonden toxine wordt niet meer bereikt). Excisie van de geïnfecteerde wond, indien die nog aanwezig is, en penicilline om eventueel nog aanwezige Clostridia te vernietigen. De behandeling van de rigiditeit en de krampen moet onder constante observatie in een rustige omgeving plaatsvinden. De behandeling bestaat uit toediening van benzodiazepinen (midazolam) in hoge dosis, kunstmatig beademen via een tracheostomie, voeden met een maagsonde of intraveneus en handhaven van de blaasfunctie door een verblijfskatheter. Soms is meer neuromusculaire blokkade nodig.
Complicaties
Hyperpyrexie en vasomotorische collaps, verslikpneumonieën en collaps van longgedeelten door de spasmen, maagatonie en paralytische ileus. Voorts nog de complicaties als gevolg van de behandeling met beademing en katheterisatie.
Preventie
Bij elke verwonding bij een niet-geïmmuniseerde persoon bij wie een kans op besmetting met tetanussporen bestaat, moet als profylaxe MATIG worden gegeven (250 E i.m.). Tegelijkertijd moet (in de andere arm) de eerste tetanustoxoïdinjectie (0,5 ml i.m.) worden toegediend (de tweede een maand later en de derde zeven maanden na de tweede injectie). Voor tetanusprofylaxe bij verwondingen zie Tabel 6.19. Tetanus laat geen immuniteit achter; een van tetanus herstelde patiënt moet alsnog actief tegen de ziekte worden geïmmuniseerd.
| – personen van wie bekend is dat zij niet gevaccineerd zijn: dosis tetanusimmunoglobuline en vaccinatie volgens het schema 0, 1 en 7 maanden |
| – personen van wie bekend is dat zij geen volledige vaccinatie hebben doorlopen: dosis tetanusimmunoglobuline en aanvullen van ontbrekende vaccinaties |
| – vermoedelijk gevaccineerde personen van ouder dan 20 jaar: dosis tetanusvaccin, waarbij mannen geboren vóór 1936 en vrouwen geboren vóór 1950 bovendien een dosis tetanusimmunoglobuline krijgen |
| – volledig gevaccineerde personen bij wie de laatste vaccindosis langer dan tien jaar geleden werd gegeven: dosis tetanusvaccin |
| – hiv-geïnfecteerden met een slechte immuunrespons na vaccinatie en andere immuungecompromitteerden: dosis tetanusimmunoglobuline en vaccinatie volgens het schema 0, 1 en 6 maanden |
Casuïstiek
Infectieziekten met diarree
Kernpunten
Bij voedselvergiftigingen is een nauwkeurige anamnese nodig.
Inspectie van feces en laboratoriumonderzoek zijn essentieel.
In deze paragraaf worden onder andere de ziekten besproken die worden veroorzaakt door het nuttigen van besmet of op andere wijze verontreinigd(e) voedsel en drank. Hoewel ze strikt genomen niet in deze paragraaf thuishoren, wordt ook aandacht besteed aan enkele chemische en toxische oorzaken van voedselvergiftiging die aanleiding kunnen geven tot dezelfde klachten en verschijnselen als die door de veel frequenter voorkomende bacteriële besmettingen. Voor het onderscheid tussen de verschillende voedselvergiftigingen is een nauwkeurige anamnese nodig. Vergiftigingen door chemische stoffen en reeds in het voedsel gevormde bacteriële toxinen hebben in het algemeen een korte incubatietijd (minuten tot uren na de verdachte maaltijd; Tabel 6.20). De maaltijd hoeft zich overigens niet door uiterlijk, smaak of reuk te onderscheiden van normaal voedsel. De incubatietijd van bacteriële en virale darminfecties is langer (dagen), doordat de bacteriën in de mens tijd nodig hebben voor vestiging, vermeerdering en eventueel productie van toxinen (Tabel 6.21).
| oorzaak | voedsel waarin frequent aanwezig | symptomen | incubatietijd |
|---|---|---|---|
| toxische dierlijke en plantaardige producten | |||
| planktonsoorten | schelpdieren | in ernstige vormen paralysen, lichte vormen van krachteloosheid van spieren van armen, benen en nek, overgevoeligheid | 5-30 minuten, soms langer |
| falloïdine en andere alkaloïden | paddenstoelen (o.a. Amanita phalloides) | hypoglykemie en convulsies, hevige buikpijn, dorst, braken en diarree | 6-15 uur |
| oxaalzuur | rabarber (groene gedeelten) | krampachtige pijnen | 2-12 uur |
| chemicaliën | |||
| Na-monoglutamaat | chineesrestaurantsyndroom (vnl. door Chinees voedsel) | doof gevoel in nek, armen en handen, hevige spierpijn onder andere in nek en schouders, palpitaties, zweten | 20 minuten |
| nicotinezuur | vlees (o.a. gehakt) | vasodilatatie (erytheem), jeuk | 10-20 minuten |
| histamine | vissen uit de familie der Scombridae (o.a. makreel, tonijn, haring) | misselijkheid, buikkrampen, branderig gevoel in de mond, hoofdpijn, hartkloppingen | 5-45 minuten |
| zware metalen | |||
| cadmium, koper, tin, zink | voedsel/drank bewaard in pannen/ketels enzovoort gecoat met betreffende metaal | misselijkheid, braken, krampen, diarree | 5-15 minuten |
| oorzaak | bron | symptomen | incubatietijd |
|---|---|---|---|
| Staphylococcus aureus stafylokokkenenterotoxine (thermoresistent) | voedsel, veelal besmet door dragers (neus) of vanuit manifeste stafylokokkenlaesies | misselijkheid, braken, diarree, gevoel van ernstig ziek-zijn, soms ondertemperatuur en bloeddrukdaling | 2-4 uur |
| B. cereus | komt zeer verspreid in de natuur voor, onder andere op planten (aardappelen, erwten, rijst) | misselijkheid, braken, diarree of buikkrampen |
2-4 uur 8-16 uur |
| toxine van Cl. perfringens | vlees en vleesschotels (onvoldoende verhitting en te trage afkoeling) | koliekachtige buikpijnen, diarree, zelden koorts, zelden braken | 8-20 uur |
| toxine van Cl. botulinum (thermolabiel) | thuis geweckte, gezouten of gepekelde voedingsmiddelen, vis, worst | botulisme, heesheid van de stem, duizeligheid, dubbelzien, parese van andere hersenzenuwen, 50% sterfte door ademhalingsverlamming | 12-72 uur |
| toxine van Cl. difficile | darmkolonisatie, selectie door antibiotica (clindamycine e.a.) | diarree, koorts, buikpijn; pseudomembranen bij scopie | > 4 dagen na begin antibiotica |
| E. coli (enterotoxisch) | allerlei voedsel | waterdunne diarree (reizigersdiarree) | 0,5-3 dagen |
| E. coli (enterohemorragisch) | vlees | bloedingen, diarree, hemolytisch-uremisch syndroom | 0,5-3 dagen |
| Salmonellae | vlees en vleeswaren en veelal secundair besmette andere voedingsmiddelen | misselijkheid, buikkrampen, braken en diarree, koorts | 8-48 uur |
| Shigellae | besmette haarden, voedsel en water | acute koorts, tenesmi, diarree met bloed, slijm en etter, soms alleen wat brijige ontlasting | 1-7 dagen |
| Campylobacter jejuni | kippenvlees en vleeswaren (drinkwater) | misselijkheid, buikkrampen, koorts, hoofdpijn, diarree soms met bloedbijmenging | 2-4 dagen |
| Vibrio cholerae | via water en voedsel | braken, rijstwaterdiarree (ook mildere vormen) | 1-5 dagen |
| Yersinia enterocolitica | rauw en onvoldoende verhit varkensvlees | buikpijn, niet zelden rechtsonder (DD acute appendicitis), ‘infiltraat’ berustend op acute ileïtis terminalis, lymfadenitis | 3-7 dagen |
| Giardia lamblia | voedsel (drinkwater) fecaal/oraal | brijige ontlasting, bovenbuikklachten, soms vetdiarree | ca. 14 dagen |
| Cryptosporidium | onbekend, contact met landbouwhuisdieren, drink- en zwemwater | enteritis met slijm, lichte koorts, bij aids zeer hevig en hardnekkig | 3-7 dagen |
| Entamoeba histolytica | fecaal-oraal | bloederige diarree met slijm | |
| norovirussen | fecaal-oraal en via voedsel | braken, diarree | 1-3 dagen |
| andere virussen | fecaal-oraal | diarree, koorts, braken | 1-3 dagen |
In de anamnese moet worden gevraagd naar het vóórkomen van dezelfde ziekteverschijnselen bij andere leden van het gezin of disgenoten. Als dat het geval is, moet de plaatselijke GGD worden gewaarschuwd voor nader epidemiologisch onderzoek. Dit is van belang voor het opsporen van de bron en om herhalingen te voorkomen. Meestal worden bij een ziekteduur van een week of korter vooral virale en bacteriële verwekkers gevonden, bij een langere ziekteduur vaker parasitaire verwekkers. De epidemiologie van infectieuze diarree in Nederland wordt beschreven in Tabel 6.22.
| bacterieel – infectieus | gevallen | huisarts | opname |
|---|---|---|---|
| Campylobacter spp. | 100.000 | 24.000 | 1100 |
| STEC O157 | 7000 | 800 | 30 |
| Salmonella spp. | 28.000 | 4200 | 1100 |
| bacterieel – toxineproducerend | |||
| Bacillus cereus | 51.000 | 7000 | 200 |
| Clostridium perfringens | 169.000 | 31.000 | 300 |
| Staphylococcus aureus | 291.000 | 40.000 | 1500 |
| virussen | |||
| norovirus | 663.000 | 16.000 | 1900 |
| rotavirus | 298.000 | 18.000 | 5800 |
| protozoa | |||
| Cryptosporidium spp. | 28.000 | 1700 | 600 |
| Giardia spp. | 49.000 | 4300 | 400 |
Het is uiterst belangrijk vragen te stellen over plaats en duur van een eventueel verblijf in het buitenland en in de tropen, omdat bepaalde ziekten die in de (sub)tropen frequenter voorkomen dan in ons land (buiktyfus, dysenterie, giardiasis). De aan- of afwezigheid van macroscopisch bloed in de feces (dysenterie) en koorts of een normale lichaamstemperatuur geven een belangrijke richting aan het denken (Figuur 6.11).

Na het lichamelijk onderzoek van de patiënten is laboratoriumonderzoek vaak onmisbaar voor het bepalen van de etiologie. De diarree dient macroscopisch geïnspecteerd te worden, waarbij gelet wordt op consistentie, kleur, bijmenging van slijm, bloed en etter. In een direct preparaat kan men Giardia en Entamoeba histolytica aantonen. Bewijzend voor een bepaalde etiologie zijn de resultaten van het onderzoek van de feces (PCR of kweek) die men, gericht op de vermoedelijke verwekker van enteritiden, dient aan te vragen: Salmonellae, Shigellae, Yersiniae, Campylobacter, eventueel Clostridium perfringens, Vibriones voor cholera, bij zuigelingen enteropathogene Escherichiae coli en voor parasitaire verwekkers onderzoek op cysten. Bij koortsige, zeer zieke patiënten kweekt men ook het bloed (salmonellosen, shigellosen). Voor het opsporen van virologische oorzaken van darminfecties (norovirus, rotavirus) worden doorgaans moleculair-biologische methoden gebruikt (PCR). Om pseudomembraneuze colitis door Clostridium difficile aan te tonen, wordt onderzoek op de toxine uitgevoerd.
Casuïstiek
Voedselvergiftiging door chemische verontreiniging
Incubatietijd
Enkele minuten tot een half uur.
Klinische verschijnselen
Vaak plotseling begin met misselijkheid, braken en pijn in de bovenbuik (verschijnselen van gastritis), daarna diarree (Tabel 6.20).
Laboratoriumdiagnostiek
Chemisch onderzoek van eventueel overgebleven genuttigd voedsel, keukenmateriaal en excreta.
Therapie
Door de in het algemeen korte duur van de verschijnselen is zelden behandeling nodig.
Complicaties
In het algemeen geen.
Voedselvergiftiging door microbiële toxinen
Kernpunten
De meest voorkomende voedselvergiftiging wordt veroorzaakt door stafylokokkenenterotoxinen.
Norovirussen zijn een van de belangrijkste oorzaken van darminfecties
Oorzaken
Toxinen van stafylokokken, Clostridium perfringens , Bacillus cereus en Clostridium botulinum .
Besmetting
Via het voedsel dat de toxinen bevat.
Incubatietijd
Zie Tabel 6.21.
Klinische verschijnselen
De meest voorkomende voedselvergiftiging in deze groep wordt veroorzaakt door stafylokokkenenterotoxinen. Dit zijn exotoxinen die in grote hoeveelheden geproduceerd kunnen worden indien voedsel dat lang voor de maaltijd wordt bereid, toevallig besmet is met stafylokokken, bijvoorbeeld via de handen van een aan een steenpuist lijdende bereider, en daarna onoordeelkundig (onvoldoende gekoeld) wordt bewaard, zodat de stafylokokken zich sterk kunnen vermeerderen. De toxinen zijn thermostabiel; opnieuw opwarmen en verhitten voor het eten voorkomt de verschijnselen niet.
Plotseling ontstaat een ernstig ziektegevoel met geeuwen, speekselvloed, misselijkheid, pijn in de bovenbuik tot krampen toe, spoedig gevolgd door hevig braken, soms gepaard met diarree. De patiënten zien bleek, transpireren en tonen wel eens kenmerken van een lichte shock met een snelle, weke pols en lage bloeddruk. De buik is drukpijnlijk. De temperatuur is niet of nauwelijks verhoogd. De duur van de verschijnselen is kort: enkele uren tot een dag. Het massaal optreden van deze intoxicatie, kort na het deelnemen aan bijvoorbeeld een gezamenlijke maaltijd, is indrukwekkend en vormt een aanwijzing voor deze etiologie.
De voedselvergiftigingen door Clostridium perfringens en Bacillus cereus hebben ook ongeveer de hiervoor beschreven verschijnselen. Clostridium perfringens vormt, net als stafylokokken, een thermostabiel enterotoxine.
De voedselvergiftiging door de thermolabiele exotoxinen van Clostridium botulinum wordt botulisme genoemd. De besmetting van voedsel met sporen van deze micro-organismen is thans zeldzaam door de verbeterde technologie van het inblikken van voedingsmiddelen. Botulisme geeft geheel andere klinische verschijnselen dan de eerdergenoemde intoxicaties: een neurologisch ziektebeeld met lokalisatie in het verlengde merg: oogspierverlammingen, spraak- en slikstoornissen en vaak een fataal verloop door ademhalingsverlamming. Diarree behoort niet tot de kenmerken.
Infecties door bacteriën
Kernpunten
In Nederland zijn Salmonella typhimurium en Salmonella enteritidis de belangrijkste verwekkers van salmonellosen.
Zuigelingen en ouderen lopen bij salmonellosen het grootste gevaar.
Bij iedere diarree is orale rehydratievloeistof belangrijk bij de behandeling.
Buiktyfus is een importziekte met een kenmerkend klinisch beeld.
Shigellose is een sterk infectieuze ziekte.
Yersinia kan een pseudoappendicitis veroorzaken.
Campylobacter-infecties zijn de meest voorkomende voedselbesmettingen.
Enterotoxische E. coli veroorzaken reizigersdiarree.
Enteropathogene E. coli-typen veroorzaken een op dysenterie lijkend beeld.
De exotoxine van de Vibrio is verantwoordelijk voor rijstwaterdiarree.
Verschillende virussen kunnen enteritis veroorzaken.
Empirische behandeling is alleen nodig bij dysenterie of hoge koorts, en bij immuungecompromitteerde patiënten; azitromycine per os is dan eerste keus.
Ziekten in deze groep, veroorzaakt door met voedsel en drank opgenomen bacteriën, worden meestal geen voedselvergiftigingen genoemd, maar aangeduid met (gastro-)enteritis, naar het klinische beeld, of met namen die afgeleid zijn van het oorzakelijke micro-organisme (bijvoorbeeld salmonellose). In deze paragraaf worden eveneens enkele ziekten besproken die klinisch verlopen onder het beeld van een enteritis, ook berusten op fecaal-orale besmetting, niet altijd via voedingsmiddelen worden verkregen, maar vooral door direct contact: shigellose en cholera, enteritis door virussen.
In Tabel 6.21 is een overzicht opgenomen van de differentiële diagnostiek van darminfecties.
Salmonella-enteritis
Verwekker
Veel soorten Salmonellae, ingedeeld in groepen aangeduid met hoofdletters: groep B, groep C enzovoort, en onderverdeeld in ruim 2000 serotypen. Sommige serotypen zijn pathogeen voor zowel mens als dier.
Besmetting
Via voedsel, in mindere mate via water. Patiënten met hypochloorhydrie (verminderd maagzuur) worden gemakkelijker besmet.
Epidemiologie
Salmonella-infecties die worden veroorzaakt door andere Salmonellae dan S. typhi en S. paratyphi worden vaak aangeduid als ‘andere’ salmonellosen, omdat het ziektebeeld van deze infecties milder verloopt dan buiktyfus en zelden gepaard gaat met bacteriëmie. ‘Andere’ salmonellosen doen zich voornamelijk voor als voedselvergiftigingen (zie Tabel 6.21). Het belangrijkste type in Nederland is momenteel Salmonella typhimurium met een sterke stijging van het aandeel van Salmonella enteritidis (voornamelijk door gebruik van onvoldoende verhitte eiproducten, bijvoorbeeld bavarois). Vertegenwoordigers van het geslachtSalmonella komen zeer verspreid in de dierenwereld voor. Voor de mens zijn besmet vlees en vleeswaar en eieren de belangrijkste infectiebron. Salmonellae kunnen bij praktisch elke diersoort (bijvoorbeeld hond, kat, pluimvee, andere vogels, reptielen en insecten) worden aangetroffen. Ook kunnen talloze producten secundair worden besmet: plantaardige (katoenschroot, kopra) en dierlijke voederproducten (vismeel, diermeel, beendermeel; voornamelijk voor varkens, kalveren en pluimvee) worden door onder andere knaagdieren verontreinigd. Deze voedergrondstoffen zorgen op hun beurt weer voor – veelal symptoomloze – dragers onder slachtdieren en pluimvee. In een beperkt aantal gevallen ontstaat besmetting via manueel contact (onder andere bij zuigelingen), maar patiënten spelen bij de verspreiding van de infectie maar een beperkte rol. Het bacteriedragerschap is veelal van beperkte duur.
Incubatietijd
Acht uur tot twee dagen.
Klinische verschijnselen
Meestal een acuut begin met buikkrampen en frequente diarree, spoedig gevolgd door ziektegevoel, rillerigheid en temperatuurverhoging die wel kan oplopen tot 39-40 °C. De beginfase gaat nogal eens gepaard met misselijkheid en braken: een gastro-enteritis. De diarree is vaak groen van kleur, kan slijm bevatten en is soms bloedig tot zeer bloedig, doordat ook het colon in het ziekteproces is betrokken (enterocolitis ). Bij onderzoek in deze fase maakt de patiënt een zieke indruk en heeft hij bij palpatie van de buik diffuus drukpijn, vaak wat meer uitgesproken linksonder. Slijmvliezen en huid kunnen uitgedroogd zijn. Spoedig nemen de frequentie en de pijnlijkheid van de diarree af; de feces krijgen een brijachtige consistentie. De temperatuur daalt in drie tot vijf dagen tot de norm. De ziekte kan fataal verlopen door de soms extreme uitdroging, vooral bij zuigelingen en ouderen.
Laboratoriumdiagnostiek
Salmonellae zijn te kweken uit de feces; soms ook uit het bloed. Een PCR op feces kan ook de diagnose bevestigen.
Therapie
Dieet en streven naar herstel van de water- en zouthuishouding langs orale weg zijn meestal voldoende. Dit is mogelijk met behulp van zogenoemde orale rehydratievloeistof (ORS, Tabel 6.23). Bij hevig brakende en bij zeer zieke patiënten is men aangewezen op intraveneuze infusen. Bij hinderlijke diarree mag loperamide alleen bij diarree zonder bloed en zonder koorts worden gebruikt (dosering 4-8 capsules à 2 mg per dag gedurende maximaal twee dagen). Antibiotica hebben geen invloed op de duur van de verschijnselen en verlengen mogelijk de periode van bacterie-uitscheiding na genezing. Bij zeer zieke patiënten, die een sepsis (lijken te) hebben, wordt ciprofloxacine (2 dd 400 mg i.v) geadviseerd.
| – NaCl | 3,5 g |
| – NaHCO3 | 2,5 g |
| of | |
| – Na-citraat | 2,9 g |
| – KCl | 1,5 g |
| – glucose | 20 g |
| – aqua ad | 1 l |
Complicaties
Extreme uitdroging en shock door water- en zoutverlies. Septische strooihaarden: osteomyelitis, meningitis, endocarditis, long. Na genezing kan een patiënt bacteriedrager worden (meestal niet langer dan drie tot zes maanden). Een gecompliceerd en atypisch verloop wordt vooral gezien bij patiënten met een verminderde cellulaire immuniteit.
Preventie
Gezien de sterke besmettingsgraad van een groot deel van onze varkens en ons pluimvee is bestrijding van salmonellose aan de bron een zeer complex vraagstuk. Voorlopig zal het zwaartepunt van de preventie moeten liggen op een goede voorlichting van de consument (‘eet geen rauw vlees of rauwe eieren’), op een zorgvuldige behandeling en koeling van vlees, goede desinfectie in slagerijen en hygiëne in de keuken, waardoor veel ziektegevallen kunnen worden voorkomen. De uiteindelijke preventie ligt in het produceren van Salmonella-vrij vlees.
Buiktyfus (febris typhoidea, paratyfus)
Verwekker
Salmonella typhi (uit Salmonella groep D) en sommige paratyfusbacteriën zoals Salmonella paratyphi A, Salmonella paratyphi B, Salmonella paratyphi C.
Besmetting
Via voedsel en drank besmet door een bacillendrager of patiënt. S. typhi en S. paratyphi zijn uitsluitend pathogeen voor de mens. Patiënten met hypochloorhydrie worden gemakkelijker geïnfecteerd (dus ook bij gebruik van protonpompremmers).
Epidemiologie
Buiktyfus door Salmonella typhi enSalmonella paratyphi A, B en C zijn klinisch niet van elkaar te onderscheiden en komen uitsluitend voor bij de mens. Voedsel of water wordt via de handen met feces en/of urine besmet. In India, Pakistan en Bangladesh komen de meeste gevallen van buiktyfus voor.
Verreweg de meeste buiktyfusgevallen in Nederland zijn importgevallen van reizigers die naar (sub)tropische gebieden zijn gegaan waar de hygiënische omstandigheden suboptimaal zijn.
Incubatietijd
Tien tot veertien dagen, maximaal drie weken.
Klinische verschijnselen
Diarree is geen belangrijk symptoom bij buiktyfus. Het begin is sluipend met geleidelijk toenemende rillerigheid, hoofdpijn, vage spier- en gewrichtsklachten en slechte eetlust. Klachten van de buik zijn ongewoon: soms is er wat diarree, soms vanaf het begin obstipatie. Vaak kucht de patiënt wat alsof hij een infectie van de bovenste luchtwegen heeft. De temperatuur stijgt geleidelijk in deze eerste dagen, en kan ten slotte 39-40 °C bereiken (Figuur 6.12). De koorts blijft voortduren en vormt een continuüm. De patiënt is in dit stadium geobstipeerd. De patiënt maakt een matte, wat suffe indruk; soms echter is hij juist onrustig en ijlt hij (koortsdelier). Het is van groot belang te informeren naar het verblijfsoord in de laatste vakantie en het tijdstip van terugkeer uit dat land.

De huid voelt warm en droog aan; de turgor is verlaagd. De pols is opvallend langzaam in verhouding tot de temperatuur (relatieve bradycardie ). De tensie kan laag zijn. Vaak is er een vergroting van de milt. De klinische diagnose staat vrijwel vast indien roseolae worden gevonden: 2-4 mm kleine roze, wegdrukbare maculae op de huid van de buik, de onderste helft van de borst, de bovenbenen of de rug-lendenstreek. Ze zijn soms zeer spaarzaam aanwezig en – zeker bij mensen met een dondere huid – moeilijk te zien (Figuur 6.13). Bij niet-herkennen of -behandelen van deze ziekte blijft de koorts ongeveer veertien dagen een continuüm, waarna een geleidelijke daling van de temperatuur optreedt. De ziekte neigt tot recidieven.

De verschijnselen berusten op een vermeerdering van de binnengedrongen Salmonella typhi in het lymfatische weefsel van de dunne darm tijdens de incubatietijd. In het begin van de ziekte bereiken de Salmonellae via de lymfe en de ductus thoracicus de bloedbaan: er ontstaat een sepsis. Aan het einde van de eerste en tijdens de tweede ziekteweek prolifereren de Salmonellae in de macrofagen van lever en milt en in de plaques van Peyer, met ulceratie van het dunnedarmslijmvlies. Septische recidieven zijn te verklaren doordat bacteriën die niet door de macrofagen worden gedood, weer in het bloed terechtkomen. Uiteindelijk ontwikkelt zich een zodanige T-celimmuniteit dat macrofagen worden geactiveerd die de bacteriën doden.
Laboratoriumdiagnostiek
Klassiek is de leukopenie met linksverschuiving. Salmonella typhi is te kweken uit bloed, beenmerg, duodenaal vocht, feces en urine. De beenmergkweek is zinvol bij patiënten die reeds een (inadequate) antibiotische behandeling kregen. Het onderzoek naar antistoffen heeft geen waarde.
Therapie
Eerste keus zijn azitromycine per os gedurende zeven dagen, en wanneer intraveuze therapie nodig is ceftriaxon 2 g i.v.
Complicaties
Darmbloeding (behandelen met bloedtransfusies), perforatie (chirurgisch behandelen), veneuze trombose, osteomyelitis, mycotisch aneurysma. Sommige patiënten worden tijdelijk of permanent bacteriedrager. De feces blijven dan positief voor S. typhi en soms ook de urine. Een belangrijke haard voor dragerschap is de galblaas. De behandeling hiervan is specialistisch (langdurig antibiotisch, soms chirurgisch).
Preventie
Voor sommige reizigers naar (sub)tropische gebieden is vaccinatie tegen buiktyfus aan te bevelen. Vaccinatie kan geschieden met een parenteraal vaccin (twee injecties met ongeveer een maand tussentijd). De beschermingsgraad is 70 tot 80%. Revaccinatie na ongeveer drie jaar. Buiktyfus is een meldingsplichtige ziekte, zodat onderzoek naar de bron gedaan kan worden door de GGD. Patiënten werkzaam in de gezondheidszorg of voedselsector mogen pas weer aan het werk als de feceskweken negatief zijn gebleken.
[Kliniek]Intermezzo 6.5 Een patiënte met koorts na een bezoek aan Indonesië
Een 65-jarige vrouw bezoekt Indonesië. Bij een vorige gelegenheid, ruim drie jaar geleden, heeft zij een orale tyfusvaccinatie en een DTP-booster gekregen. Als kind heeft zij geelzucht gehad en ze hoefde dus niet tegen hepatitis A te worden ingeënt. Ze slikt malariaprofylaxe. Wegens een hiatushernia met reflux gebruikt ze een protonpompremmer.
Twee weken na terugkeer in Nederland wordt de patiënte geleidelijk aan ziek. Zij hoest wat en heeft een dag wat diarree. De temperatuur loopt in enkele dagen op tot 39 °C. Zij reageert wat afwezig en klaagt over een opgezette buik. Zij is geobstipeerd. De huisarts denkt aanvankelijk aan een bronchitis, maar vertrouwt het niet en stuurt haar in voor opname.
Bij lichamelijk onderzoek is de patiënte wat bradyfreen, matig ziek. De temperatuur is 39,8 °C, de pols is 78/min regulair. De bloeddruk is 130/80 mmHg, de CVD R-4. Ze heeft een beslagen tong. De buik is opgezet met weinig peristaltiek. De lever is palpabel en de milt lijkt percutoir vergroot, maar is niet te voelen.
De superviserende internist onderzoekt de patiënte bij daglicht en wijst de coassistent en de zaalarts op de vage roze vlekjes die vooral op de buik te zien zijn.
In het laboratorium is er een leukopenie 3,2 × 109/l, een granulopenie (46%) met 10% staven en 44% lymfo’s. In een door de machine gelezen differentiatie worden geen eo’s gezien (10.000 cellen geteld). Er is een lichte trombopenie (110 × 109/l).
De ervaren internist zal zonder veel moeite de diagnose buiktyfus stellen op grond van de volgende gegevens:
verblijf in een hoogendemisch land;
het slikken van een protonpompremmer: de hypochloorhydrie maakt iemand buitengewoon vatbaar voor een Salmonella-infectie, doordat de maagzuurbarrière ontbreekt;
het beeld is klassiek: bronchitis, initiële diarree gevolgd door obstipatie, de geleidelijk oplopende temperatuur, uitmondend in een febris continua en de bradyfrene toestand. Voorts de kenmerkende relatieve bradycardie, de ‘tyfustong’, de opgezette buik en de vergrote lever en milt. De roseolae die door de onervaren onderzoeker worden gemist en het kenmerkende laboratoriumonderzoek maken het klinische beeld rond.
Shigellose (bacillaire dysenterie)
Verwekker
Shigella . Men onderscheidt vier species: S. dysenteriae (12 serotypen), S. flexneri (8 serotypen), S. boydii (18 serotypen) en S. sonnei (1 serotype). Vooral dit laatste serotype veroorzaakt in Nederland kleine epidemieën van ziektegevallen, bijvoorbeeld in kindertehuizen. De andere ziet men meer als importziekte , vooral bij kinderen van buitenlandse werknemers na bezoek aan het land van oorsprong.
Besmetting
Vrijwel altijd van mens op mens via de fecaalorale weg, hoewel ook indirecte besmetting via voedsel mogelijk is. De infectie kan ook via oroanaal seksueel contact worden overgedragen.
Epidemiologie
Deze sterk infectieuze ziekte kan zich vooral onder kleuters en bij een laag hygiënisch niveau (onder andere kamperen) snel verbreiden. Overdracht via handen en verontreinigde deurknoppen van toiletten, handdoeken en dergelijke speelt een grotere rol dan de verbreiding via voedsel. Toch zal men bij de bestrijding ook het gebruik van onder andere rauwe groenten en ongekookte melk afraden. Bij een explosie komt een groot aantal symptoomloze dragers voor die voor de verspreiding van betekenis zijn. Opsporing van hen kan daarom gewenst zijn.
Incubatietijd
Een tot drie dagen, soms tot zeven dagen.
Klinische verschijnselen
Ongeveer gelijk aan die van de enteritische vorm van de salmonellosen, met als verschil dat koorts en ziektegevoel vaak korte tijd aan de buikkrampen en diarree voorafgaan. De oppervlakkige ontsteking is vooral gelokaliseerd in het colon. De diarree is bruin van kleur en kan met slijm en bloed gemengd zijn. Shigella dysenteriae veroorzaakt vaak een ernstiger ziektebeeld.
Laboratoriumdiagnostiek
Shigellae zijn te kweken uit de feces, soms uit het bloed.
Therapie
Meestal niet nodig, in ernstige gevallen ciprofloxacine eenmalig 1000 mg per os. Een alternatief is 1 dd 500 mg azitromycine per os gedurende drie dagen. Daarnaast vochthuishouding regelen (zie onder Therapie van Salmonella-enteritis).
Complicaties
Uitdroging. Zelden hemolytisch-uremisch syndroom, reactieve artritis.
Preventie
De belangrijkste factor bij de preventie is een rigoureuze algemene hygiëne (handhygiëne!), niet alleen van personen, maar ook in toiletten en keukens.
Yersinia-infectie
Verwekker
Yersinia enterocolitica . Een aantal typen, in Nederland voornamelijk type 3 en 9.
Besmetting
Via de tractus digestivus. Patiënten met ijzerstapeling hebben een grotere kans op ernstige yersiniose.
Epidemiologie
Yersiniose is voor de mens een zoönose die hem via vlees, rauwe melk en ander voedsel bereikt.
Incubatietijd
Drie tot zeven dagen.
Klinische verschijnselen
Een enteritis met diarree die enige dagen tot enige weken kan duren. Ze kan gepaard gaan met diffuse buikpijn, maar ook met pijn rechtsonder in de buik, zodat een appendicitis wordt gediagnosticeerd. Bij operatie blijkt dan dat de appendix niet ontstoken is, maar worden een terminale ileïtis en een lymfadenitis van de mesenteriale klieren gevonden. Ongeveer 30% van de patiënten met enteritis heeft temperatuurverhoging. Ook meer geprotraheerde beelden met abcesvorming of febris e causa ignota komen voor.
Laboratoriumdiagnostiek
Yersiniae zijn te kweken uit de feces; de kweken van bloed en pus blijven meestal negatief. Een PCR op feces is gevoeliger dan een kweek. Bepaling van antistoffen kan worden verricht in gespecialiseerde laboratoria; de specificiteit hiervan laat te wensen over.
Therapie
De fluorochinolonen (bijvoorbeeld ciprofloxacine 2 dd 500 mg) lijken de meest effectieve therapeutica.
Complicaties
Zelden sepsis en orgaanlokalisaties met ettervorming; reactieve artritis.
Preventie
Preventie bestaat uit goede verhitting van vlees en zorgvuldige hygiëne in de keuken.
Campylobacter-infectie
Verwekker
Campylobacter jejuni.
Besmetting
Via de tractus digestivus, vooral door het manipuleren en gebruik van rauw of onvoldoende verhit kippenvlees en contact met jonge huisdieren.
Epidemiologie
Infectie met Campylobacter jejuni komt in Nederland frequent voor: infecties met Campylobacter zijn thans de meest voorkomende voedselbesmettingen. Pluimvee is vrijwel altijd besmet.
Incubatietijd
Ongeveer twee tot vier dagen.
Klinische verschijnselen
De ziekte begint acuut met koorts tot 39-40 °C, algemene klachten met hoofdpijn en soms verwardheid. Na enige dagen volgen buikkrampen, misselijkheid en diarree. De feces zijn waterdun, slijmerig, stinkend en in ongeveer de helft van de gevallen bloederig, vooral als het colon in het ziekteproces is betrokken. Dit ziektebeeld lijkt dus op een shigellose. Bij een derde van de patiënten verloopt de infectie vanaf het begin als een enteritis, zonder dat er koorts aan voorafgaat, en komt dan meer overeen met de enteritische vorm van salmonellosen. De duur van de verschijnselen kan variëren van enige dagen tot wel drie à zes weken.
Laboratoriumdiagnostiek
Campylobacter sp., een gramnegatief krom staafje, stelt speciale eisen aan de cultuurmedia en is te kweken uit de feces, soms uit het bloed. Een PCR op feces kan ook de diagnose bevestigen.
Therapie
Regeling van de vochthuishouding en dieet. Ernstige vormen behandelen met antibiotica: 1 dd 500 mg azitromycine per os gedurende drie dagen. Ook de fluorochinolonen zijn in principe effectief, maar helaas is 50% van de Campylobacter-stammen resistent.
Complicaties
Uitdroging, zelden sepsis, reactieve artritis en ziekte van Guillain-Barré.
Preventie
Preventie bestaat uit het zorgvuldig omgaan met mogelijk besmet vlees (rauw en bereid vlees gescheiden houden) en voldoende verhitten van vlees (vooral kip) voor consumptie.
Enterotoxinevormende Escherichia coli-darminfectie
Verwekker
Enterotoxische E. coli- typen (ETEC) produceren een thermolabiel en/of een thermostabiel exotoxine die een secretoire diarree veroorzaakt door een mechanisme dat te vergelijken is met dat van de toxine van V. cholerae (zie onder Cholera).
Besmetting
Door een relatief grote dosis E. coli in voedsel en drank, met andere woorden via fecaal-orale besmetting.
Epidemiologie
Het is een veelvuldig voorkomende infectie bij westerse reizigers naar tropische en subtropische gebieden.
Incubatietijd
12-72 uur.
Klinische verschijnselen
De enterotoxineproducerende E. coli-typen zijn de voornaamste verwekkers van ‘reizigersdiarree ’: het plotseling ontstaan van diarree, waterdun zonder bloed, met wat buikkrampen en zonder of met geringe temperatuurverhoging bij bezoekers uit West-Europa en Amerika van landen in subtropische en tropische gebieden. De duur van het syndroom is meestal kort: één tot drie dagen. Zelden is het ziektebeeld ernstig; het gaat gepaard met misselijkheid, braken en uitdroging.
Laboratoriumdiagnostiek
In Nederland is het slechts in een enkel gespecialiseerd laboratorium mogelijk E. coli te typeren en na te gaan of er sprake is van enterotoxineproductie.
Therapie
Regeling van de vochthuishouding per os en zo nodig loperamide is meestal voldoende (zie onder Salmonella-enteritis).
Complicaties
Zelden extreme uitdroging.
Overige Escherichia coli-darminfecties
Verwekker
Enterohemorragische E. coli -typen (EHEC) zijn invasief en kunnen ontstekingsverschijnselen veroorzaken van het slijmvlies van de dunne en de dikke darm. EHEC is een groep van E. coli die diarree, hemorragische colitis en hemolytisch-uremisch syndroom (HUS) kunnen veroorzaken, doordat ze een aantal specifieke virulentiekenmerken hebben en zogeheten ‘shigatoxinen’ (stx) produceren. Deze E. coli-stammen worden daarom ook shigatoxineproducerende E. coli (STEC) genoemd. Shigatoxinen zijn cytotoxinen die grote gelijkenis vertonen met de toxine van Shigella dysenteriae.
Besmetting
Fecaal-oraal (zie onder Epidemiologie).
Epidemiologie
Vee vormt het belangrijkste reservoir van STEC en transmissie geschiedt vooral via consumptie van besmet rundvlees, maar ook van door feces besmet water, rauwe groenten zoals sla en (rauwe) melk. STEC-infecties komen vrijwel alleen in de westerse wereld voor. Van de enterohemorragische E. coli-infecties zijn epidemietjes beschreven bij kinderen en in verpleeg- en verzorgingshuizen. In Nederland zijn er jaarlijks naar schatting 1850 gevallen van STEC-geassocieerde gastro-enteritis, en hiervan worden er 20 door HUS gecompliceerd; dit betreft vooral kinderen.
Incubatietijd
72-96 uur.
Klinische verschijnselen
Deze vaak invasieve E. coli-typen verwekken een meer op dysenterie lijkend ziektebeeld, waarbij de ontsteking van de dikke darm aanleiding kan geven tot hoge koorts en diarree met slijm- en bloedbijmenging.
Laboratoriumdiagnostiek
Op aanvraag kan deze verwekker in de meeste Nederlandse laboratoria aangetoond worden.
Therapie
Regeling van de vochthuishouding per os is meestal voldoende (zie onder Salmonella-enteritis). Antibiotica hebben geen effect op de duur van de diarree. Loperamide is strikt gecontra-indiceerd: dit lijkt de kans op systemische verschijnselen te vergroten.
Complicaties
Soms leidt de diarree tot extreme uitdroging. Bij infectie door enterohemorragische E. coli kan bloedverlies voorkomen; bij kinderen ontstaat soms het hemolytisch-uremisch syndroom.
Preventie
Naast een goede hygiënische voedselbereiding bestaat de preventie vooral uit goede hygiëne bij de verzorging van zuigelingen en kleuters.
Cholera
Verwekker
Vibrio cholerae .
Besmetting
Via drank en voedsel; soms ook direct van mens op mens.
Incubatietijd
Eén tot vijf dagen.
Epidemiologie
De ziekte wordt hier genoemd omdat ze betrokken moet worden in de differentiële diagnose van patiënten met diarree die uit de tropen afkomstig zijn. Incidentele importgevallen komen voor in geheel Europa, waaronder Nederland. De epidemiologie van cholera is in wezen dezelfde als die van de andere, reeds besproken ziekten die door water en voedsel op de mens kunnen worden overgedragen. Cholera verspreidt zich in epidemieën die doorgaans grote delen van de wereld omvatten (pandemieën). De ziekte begint zeer acuut met braken, hevige, voortdurende, waterige diarree (van bruin tot licht bruingrijs van kleur, rijstwaterachtig), snelle uitdroging en shock. Buikkrampen en belangrijke temperatuurverhoging behoren niet tot het ziektebeeld.
De waterdunne (‘rijstwaterdiarree ’), bijna met plasma isotone diarree wordt veroorzaakt door een exotoxine die door de vibrionen wordt geproduceerd. Deze toxine veroorzaakt een toename van cyclisch AMP intracellulair in de epitheelcellen van de dunne darm. Daardoor wordt de NaCl-resorptie geremd en de actieve Cl-uitscheiding naar het lumen van de dunne darm gestimuleerd, in een mate die resorptie in de dikke darm te boven gaat. Dit veroorzaakt de kenmerkende ‘rijstwaterdiarree’. Deze hevige, vaak dodelijke vorm zal niet snel worden miskend, maar ook lichter verlopende enteritiden, te vergelijken met salmonellosen en shigellosen, kunnen door choleravibrionen worden veroorzaakt. Bij deze patiënten dient men de diagnose cholera dus niet a priori te verwerpen indien de klassieke rijstwaterdiarree niet wordt gezien.
Laboratoriumdiagnostiek
Vibrionen (iets gekromde, gramnegatieve staven) zijn te vinden in het grampreparaat van braaksel en feces; ze zijn te kweken uit de feces.
Therapie
Een snel infuus van fysiologisch zout, aangevuld met kalium en bicarbonaat, leidt in enige uren tot verbetering van de klinische toestand. Als antibiotica wordt een eenmalige gift doxycycline, ciprofloxacine of azitromycine gegeven. Patiënten met minder ernstige verschijnselen kan men oraal rehydreren (zie Salmonella-enteritis). De orale rehydratievloeistof heeft een ware ommekeer gebracht in de slechte prognose die cholera in tropische landen had. Het principe van de behandeling is dat gebruik wordt gemaakt van het door glucose gefaciliteerde transport van natrium en water (dit transportmechanisme wordt niet door de infectie aangetast).
Complicaties
Zie hiervoor.
Preventie
Een goede sanitaire infrastructuur (schoon drinkwater!) is het beste wapen in de strijd tegen cholera. De thans ter beschikking staande vaccins tegen cholera hebben nauwelijks waarde: ze beschermen slechts een klein deel van de geïmmuniseerden gedurende korte tijd (slechts enkele maanden). Bijzonder belangrijk voor de verspreiding van de ziekte is het aantal symptoomloze dragers van choleravibrionen, vooral van de V. eltor-variëteit. Vaccinatie voorkomt het dragerschap niet.
Clostridium difficile-infectie
Verwekker
C. difficile is een grampositief, anaeroob, sporevormend staafje, dat behoort tot het geslacht Clostridium. Indien de betreffende stam toxinen produceert, kan dit resulteren in diarree. C. difficile produceert twee hittegevoelige toxinen: het enterotoxine (A) en het cytotoxine (B); beide zijn van belang bij de pathogenese van de infectie.
Besmetting
Via de tractus digestivus.
Epidemiologie
C. difficile is de belangrijkste oorzaak van diarree bij ziekenhuispatiënten en is direct geassocieerd met het gebruik van antibiotica, vooral clindamycine, cefalosporinen en chinolonen. Veranderingen in de intestinale flora door het gebruik van antibiotica maken het mogelijk dat er overgroei met C. difficile ontstaat. De diarree ontstaat door toxineproductie. Door patiënten uitgescheiden sporen van C. difficile kunnen lange tijd in het ziekenhuis aanwezig blijven en verantwoordelijk zijn voor ziekenhuisepidemieën. Een enkele keer komt C. difficile-geassocieerde diarree buiten het ziekenhuis voor, dan vooral bij immuungecompromitteerde patiënten.
Klinische verschijnselen
De klinische verschijnselen van een infectie met C. difficile variëren: sommige patiënten hebben geen klachten, vaak heeft de patiënt diarree en buikpijn, soms met koorts; in het ergste geval is er sprake van een zeer ernstige pseudomembraneuze colitis (PMC). Soms is er bloed bij de ontlasting. Bij de ernstiger verlopende gevallen bestaat er leukocytose en hypoalbuminemie.
Laboratoriumdiagnostiek
De diagnose wordt gesteld op grond van de aanwezigheid van toxinen. Deze kunnen worden aangetoond met met behulp van een ELISA, of een PCR op de toxinegenen.
Therapie
De behandeling bestaat uit het zo mogelijk staken van het antibioticum, het toedienen van metronidazol of vancomycine per os en ziekenhuishygiënische maatregelen tegen verspreiding. Een infectie met C. difficile recidiveert bij 15-20% van de patiënten. Als de infectie blijft recidiveren is een fecestransplantatie een effectieve behandeling: eenmalig wordt via een duodenumsonde een suspensie van feces van een gezonde donor toegediend. Dat leidt tot herstel van een gezonde darmflora en dat remt de overgroei van Clostridium in de darm.
Complicaties
Toxisch megacolon en colonperforatie zijn ernstige complicaties van een pseudomembraneuze colitis.
Preventie
Goede ziekenhuishygiëne: isolatie van patiënten met verdenking op of bewezen C. difficile. De sporen zijn niet gevoelig voor alcohol, zodat na contact met patiënten de handen met water en zeep moeten worden gewassen om eventuele sporen te verwijderen.
Enteritis door virussen
Verwekker
Norovirus , rotavirus en andere virussen zoals adeno- en enterovirussen.
Besmetting
Fecaal-oraal, ook via de voeding.
Epidemiologie
Norovirussen komen het gehele jaar voor, maar vooral in de winter. Het aantal norovirusinfecties in Nederland wordt geschat op meer dan een half miljoen per jaar en ze komen voor bij alle leeftijdsgroepen. Rotavirusinfecties komen vooral voor bij zuigelingen en jonge kleuters, vooral in de winter. Overdracht kan via direct contact, eventueel via voedsel of water. Vooral schelpdieren zijn een bron van virale voedselinfecties. Uitbraken treden gemakkelijk op in gesloten gemeenschappen (bijvoorbeeld cruiseschepen).
Incubatietijd
Afhankelijk van het virus meestal één tot vier dagen.
Klinische verschijnselen
Een acute ziekte met kortdurende koorts, braken en enkele dagen diarree. Bij zuigelingen soms zeer waterige diarree zonder koorts. Norovirusinfecties bij ouderen kunnen leiden tot uitdroging.
Laboratoriumdiagnostiek
PCR van feces.
Complicaties
Uitdroging.
Preventie
Ook hier bestaat de beste preventie uit een goede persoonlijke hygiëne (handhygiëne!) en een goede hygiëne van de omgeving.
Empirische behandeling van acute infectieuze diarree
De uitslag van diagnostiek naar de verwekker van acute diarree laat altijd even op zich wachten. Zo duurt het altijd minstens drie dagen voordat de uitslag van een feceskweek bekend is, al is deze periode tegenwoordig door het invoeren van nieuwe moleculaire technieken (bijv. PCR) korter geworden. Als de patiënt ernstig ziek is, wordt daarom, na het afnemen van feces voor microbiologische diagnostiek, begonnen met antibiotische therapie die de meest voorkomende verwekkers dekt: zogenoemde empirische therapie. Zo gauw de verwekker bekend is, wordt het antibiotische beleid zo nodig aangepast.
Zoals besproken, is Campylobacter de meest voorkomende bacteriële verwekker van acute diarree bij volwassenen, en ongeveer 50% van de humane Campylobacter-stammen in Nederland is resistent tegen fluorchinolonen. Erytromycine en azitromycine werken vrijwel altijd wel. Erytromycine is niet geschikt voor de behandeling van andere verwekkers van acute diarree dan Campylobacter, azitromycine is dat wel. Azitromycine kan echter alleen oraal gegeven worden.
De meeste vormen van acute infectieuze diarree zijn self-limiting; empirische antibiotische behandeling is alleen geïndiceerd bij aanhoudende of hoge koorts, bij dysenterie, of als de patiënt immuungecompromitteerd is. Geadviseerd wordt om dan 1 dd 500 mg azitromycine per os te geven gedurende drie dagen. Wanneer er een noodzaak bestaat om intraveneus te behandelen, lijkt de combinatie van ciprofloxacine en erytromycine in aanmerking te komen, gedurende vijf tot zeven dagen.
Bij patiënten die in Nederland terugkeren met reizigersdiarree en daarvoor medische hulp zoeken, zijn precieze getallen van verwekkers niet bekend, maar het is aannemelijk dat bijvoorbeeld ETEC, gezien de doorgaans korte ziekteduur, bij teruggekeerde reizigers relatief minder belangrijk is.
Om deze reden, en gezien de hoge resistentiepercentages tegen fluorchinolonen van reisgerelateerde Campylobacter-isolaten, lijkt het reëel om bij een in Nederland teruggekeerde ernstig zieke patiënt, die zich presenteert vanwege acute diarree na een buitenlandse reis, dezelfde adviezen te geven als opgesteld voor in Nederland opgelopen diarree, te weten azitromycine per os respectievelijk erytromycine/ciprofloxacine bij i.v. toediening.
Casuïstiek
Infectieziekten met exanthemen
Een aantal infectieziekten gaat gepaard met uitslag van de huid (exantheem ); wanneer de uitslag zich op de slijmvliezen manifesteert, noemt men het enantheem . Dergelijke huidaandoeningen kunnen ook manifestaties zijn van intoxicaties en overgevoeligheidsreacties en deze moeten steeds in de differentiële diagnose worden betrokken. Bij het opnemen van de anamnese moet daarom aandacht worden besteed aan mogelijke contacten met infectieuze patiënten, aan het gebruik van geneesmiddelen en aan expositie aan toxische stoffen en allergenen. Belangrijk is een nauwkeurige anamnese wat betreft duur en aard van de prodromale verschijnselen, het moment van uitbreken van de uitslag, de plaats waar het exantheem begint en de wijze van verspreiding over de huid en eventuele verandering in het verloop van de tijd.
De inspectie van het exantheem moet worden uitgevoerd bij een goede belichting; daarbij wordt gelet op de verdeling over huid en slijmvliezen, de dichtheid van de laesies en de aard en kleur van de laesies: erythemata (roodheid door capillairverwijding, wegdrukbaar), maculae (vlekken in het niveau van de huid), papulae (omschreven laesies, iets boven de oppervlakte verheven), vesiculae (blaasjes, gevuld met betrekkelijk helder vocht), pustulae (gevuld met troebel vocht of pus), bullae (grotere blaren), crustae (korsten, door indrogen van het exsudaat) en ten slotte petechiën en purpura (puntvormige of iets grotere, streperige bloedinkjes, niet wegdrukbaar).
Roodvonk (scarlatina)
Kernpunt
Roodvonk heeft een typisch exantheem.
Verwekker
Streptococcus pyogenes (= hemolytische streptokok groep A).
Besmetting
Meestal druppelinfectie, zelden wondinfectie (wondroodvonk bijvoorbeeld bij brandwonden en waterpokken).
Epidemiologie
Roodvonk uit zich meestal als een overwegend milde exanthemateuze kinderziekte, optredend als reactie op toxinevorming door S. pyogenes bij bijvoorbeeld faryngitis. In iedere gemeenschap – vooral onder kinderen – bestaat een zekere circulatie van deze toxineproducerende hemolytische streptokokken. Onder invloed van een aantal nog onbegrepen factoren kan het aantal ziektegevallen stijgen. Zo werd de laatste jaren in Noord-Amerika en Europa een toename gezien van ernstige invasieve infecties en het toxischeshocksyndroom veroorzaakt door hemolytische streptokokken groep A. De piek van de streptokokkeninfecties ligt in de winter. Bepaalde typen S. pyogenes kunnen daarnaast aanleiding geven tot acute poststreptokokkenglomerulonefritis (zie 10.1007/978-90-368-1841-4_14#Sec28); zo is type 12 bekend als nefritogeen.
Incubatietijd
Twee tot zeven dagen.
Klinische verschijnselen
Acuut begin met koorts, keelpijn en algemene klachten van hoofdpijn, misselijkheid en braken. De temperatuur kan 39-40 °C bereiken en daalt in een dag of drie tot de norm. Het exantheem verschijnt meestal op de tweede dag van de ziekte en wordt vooral gezien in de nek, op de borst, onder de oksels, bij de ellebogen, in de liezen en aan de binnenkant van de dijbenen. Het exantheem is kleinvlekkig en puntvormig (rood kippenvel). Bij druk op de huid wordt deze wit met kleine rode puntjes en voelt aan als schuurpapier. Het narcosekapje (het perinaso-orale gebied) blijft vrij. Daarnaast wordt vaak een frambozen- of aardbeientong (gezwollen tong met rode papillen, soms witte aanslag) gezien. Tegenwoordig wordt de schuurpapierachtige huid nogal eens zonder exantheem (of alleen in de elleboogplooien en liezen) gezien. Ook bij een ernstiger verlopende ziekte treedt herstel na maximaal tien dagen op als het exantheem aan het verbleken is. Men ziet dan dat de huid gaat vervellen, vooral aan de toppen van de vingers en de tenen.
Laboratoriumdiagnostiek
De streptokok kan vaak uit de keel worden gekweekt; de antistreptolysinetiter kan oplopen.
Therapie
Penicilline per os gedurende tien dagen, bijvoorbeeld viermaal 250 mg feneticilline bij kinderen tot en met 10 jaar; bij ouderen viermaal 500 mg.
Complicaties
Peritonsillitis, otitis media acuta, lymfadenitis colli, acuut reuma (zie 10.1007/978-90-368-1841-4_15#Sec85 en 10.1007/978-90-368-1841-4_22#Sec73), acute poststreptokokkenglomerulonefritis, streptokokken-toxischeshocksyndroom (zie ▶ par. 6.4.1).
Preventie
Bestrijding van infecties door toxineproducerende streptokokken is moeilijk, omdat veel gevallen niet als zodanig herkenbaar zijn en immunisatie niet mogelijk is. Bij kleine epidemieën, die bijvoorbeeld in een school optreden, kan het aanbeveling verdienen te zoeken naar ‘gemiste’ gevallen van streptokokkeninfecties (tonsillitis, otitis media, lymfadenitis) en deze te behandelen. Bij ernstige invasieve infecties door groep A-streptokokken (‘streptokokken-toxischeshocksyndroom’ of fasciitis necroticans) is het gebruikelijk gezinsleden of met hen gelijkstaande contacten vijf dagen te behandelen met azitromycine.
Erysipelas (wondroos, belroos)
Kernpunt
Erysipelas is een huidinfectie met een kenmerkend verheven scherpe begrenzing en wordt veroorzaakt door bètahemolytische streptokokken.
Verwekker
Streptococcus pyogenes (= hemolytische streptokok groep A). Erysipelas wordt veroorzaakt door het erytrogeen exotoxine van de bacterie.
Epidemiologie
In tegenstelling tot roodvonk is erysipelas een ziekte die voornamelijk bij oudere mensen voorkomt.
Incubatietijd
Een à twee dagen.
Klinische verschijnselen
Acuut begin, met een zich van de plaats van de invasie uitbreidend erytheem, vaak felrood van kleur en iets boven de oppervlakte verheven, zodat een verheven scherpe begrenzing kan worden waargenomen (Figuur 6.14). De huidaandoening veroorzaakt een pijnlijk strak gevoel bij de patiënt en is pijnlijk bij aanraken. Soms ontstaan slappe, vlakke, met troebel geel vocht gevulde blaren (erysipelas bullosa). De verschijnselen worden door een erytrogene toxine veroorzaakt. Zelden is de verwekker Staphylococcus aureus. Na genezing ontstaat er plaatselijk schilfering. Het begin van de infectie gaat vaak gepaard met hoge koorts en algemene ziekteverschijnselen, maar de temperatuur kan subfebriel zijn en bij oudere patiënten zelfs ontbreken. Predisponerend zijn oedemen, ulcera cruris en diabetes (bij lichamelijk onderzoek en laboratoriumonderzoek hierop letten!). Erysipelas recidiveert nogal eens op dezelfde plaats.

Laboratoriumdiagnostiek
Meestal leukocytose en linksverschuiving. Slechts zelden wordt de streptokok uit een huidlaesie of uit het bloed geïsoleerd.
Therapie
Penicilline, ten minste viermaal 500 mg feneticilline per os; bij een zieke patiënt parenteraal beginnen (viermaal 1 miljoen E benzylpenicilline i.v.). Erysipelas is een klinische diagnose. Vaak is het onderscheid tussen een erysipelas en cellulitis echter niet goed te maken en dient men ook rekening te houden met een penicillinasevormende Staphylococcus aureus als verwekker (therapie: viermaal 500 mg flucloxacilline per os of viermaal 1000 mg flucloxacilline i.v.).
Complicaties
Sepsis en streptokokken-toxischeshocksyndroom, abcesvorming, necrotiserende fasciitis (Figuur 6.15), acute glomerulonefritis (zie Tabel 6.14).

Preventie
Individuele preventie bestaat uit een goede verzorging van de huid. Bij frequent recidiverende erysipelas wordt een onderhoudsbehandeling met penicilline gegeven (bijvoorbeeld eenmaal per maand een peniduralinjectie).
Casuïstiek
Mazelen (morbilli)
Kernpunt
Mazelen hebben een typisch exantheem.
Verwekker
Mazelenvirus.
Besmetting
Aerogeen, dat wil zeggen door inademing van de zeer vluchtige kleine ingedroogde kernen van virusbevattende sputumdeeltjes afkomstig van patiënten. Andere besmettingswegen zijn direct contact, indirect contact (handen, deurknoppen).
Epidemiologie
Mazelen hebben een zo hoge mate van infectiositeit dat vóór de tijd van de vaccinatie 98% van de kinderen in Nederland de ziekte doormaakte voor de leeftijd van 10 jaar. In ontwikkelingslanden zijn mazelen nog altijd een infectieziekte die in belangrijke mate bijdraagt aan de kindersterfte. In Nederland wordt omstreeks 95% van de kinderen op de leeftijd van 14 maanden en 9 jaar met een levend verzwakt combinatievaccin tegen bof, mazelen en rodehond (BMR) gevaccineerd. Bij ongevaccineerden, zoals voorkomt onder bevindelijk gereformeerden en antroposofen, doen zich soms kleine en grote epidemieën voor. De laatste grote epidemie in Nederland (onder bevindelijk gereformeerden) was in 2013-2014, met ruim 2600 gerapporteerde gevallen en één sterfgeval. De ziekte is reeds infectieus vanaf het begin van het prodromale stadium (dat wil zeggen vanaf ongeveer vier dagen voor het uitbreken van het exantheem) tot circa vier dagen nadat het exantheem is verschenen.
Incubatietijd
Tien dagen.
Klinische verschijnselen
De eerste prodromale fase van mazelen duurt circa drie tot zeven dagen en begint plotseling met malaise, koorts, conjunctivitis, verkoudheid en hoesten. De koorts neemt geleidelijk toe tot meer dan 39 °C. Aan het einde van de prodromale fase, net voor het ontstaan van het exantheem, kunnen er op het mondslijmvlies kleine witte vlekjes (koplikvlekjes) ontstaan, die pathognomonisch zijn voor mazelen. Ze verdwijnen binnen enkele dagen. Daarna volgt de exanthemateuze fase (7-10 dagen), waarbij zich een gegeneraliseerd grofvlekkig exantheem ontwikkelt dat ruw aanvoelt (als schuurpapier). Het begint achter de oren en langs de haargrens en breidt zich in drie dagen uit via gezicht, nek, borst, romp naar de extremiteiten. Na enkele dagen verbleekt het weer.
Laboratoriumdiagnostiek
Specifieke antimazelen-IgM-bepaling. Voorts titerstijging in IgG-antistoffen, PCR of virusisolatie.
Therapie
Geen specifieke therapie mogelijk. Symptomatische behandeling.
Complicaties
Bronchopneumonie, otitis media en encefalitis die een ernstige prognose heeft.
Preventie
Toediening van normaal immunoglobuline (0,25 ml/kg lichaamsgewicht) kan – mits toegediend binnen zes à acht dagen na expositie – de ziekte mitigeren. Dit is aangewezen bij kinderen jonger dan 6 maanden die zijn geboren uit niet-immune moeders.
Immunisatie met een verzwakt levend mazelenvirusvaccin is opgenomen in het Rijksvaccinatieprogramma. Het vaccin wordt toegediend tegelijkertijd met een levend verzwakt vaccin tegen bof en rodehond (BMR-vaccin ) op de leeftijd van 14 maanden en 9 jaar.
Casuïstiek
Rodehond (rubella)
Kernpunten
Rubella is over het algemeen een mild ziektebeeld met koorts, lymfadenopathie en een gegeneraliseerde maculopapuleuze uitslag.
Rubella bij vrouwen in de eerste zestien weken van de graviditeit kan leiden tot congenitale misvormingen.
Verwekker
Rubellavirus.
Besmetting
Druppelinfectie.
Epidemiologie
De besmettelijkheid begint ongeveer vijf dagen voor het uitbreken van het exantheem; het virus is reeds een week voor het uitbreken van de huideruptie in de keel aantoonbaar. De besmettelijkheid duurt tot en met vijf dagen na het verschijnen van de vlekjes. Het percentage kinderen en volwassenen dat immuun is, stijgt met de leeftijd veel minder snel dan bij mazelen: rubella is minder infectieus, voornamelijk omdat – anders dan bij mazelen – hoest geen verschijnsel van de ziekte is. Door de algemene vaccinatie komt rodehond in Nederland vrijwel niet meer voor. Wel ziet men soms uitbraken onder ongevaccineerden. In 2004/2005 was er onder bevindelijk gereformeerden een grote uitbraak, waarbij ook 32 zwangere vrouwen werden geïnfecteerd, van wie dit bij elf tot congenitale afwijkingen bij het kind leidde.
Incubatietijd
Twee tot drie weken.
Klinische verschijnselen
Eén tot vijf dagen voor het uitbreken van het exantheem kunnen er – vooral bij adolescenten en volwassenen – lichte prodromen voorkomen. Deze kunnen bestaan uit anorexie, malaise, conjunctivitis, hoofdpijn en lichte temperatuurverhoging. De uitslag begint vaak in het gelaat met kleine, lichtroze vlekjes, op het voorhoofd spoedig wat ineenvloeiend, waarbij de patiënten lichte klachten hebben over een wat strak gevoel in de huid. De uitslag breidt zich snel uit, zodat ook kleine, ronde, vrij regelmatige vlekjes kunnen worden aangetroffen op de romp. Volwassenen klagen soms over pijn in de gewrichten zonder dat deze zichtbare afwijkingen of functiebeperking tonen. De conjunctivae zijn licht geïnjiceerd. Kleine lymfeklieren kunnen palpabel worden in de hals, in de nek, op de mastoideae en op het achterhoofd; het is een voorbeeld van een benigne lymfadenopathie. De patiënten zijn nauwelijks ziek en de temperatuur is vrijwel niet verhoogd, hoewel hierop uitzonderingen voorkomen. Na drie tot vijf dagen verdwijnt het exantheem. De uitslag heeft niet altijd deze klassieke kenmerken, maar kan ook elders op het lichaam wat ineenvloeien, zodat de vlekjes dan onregelmatiger van grootte zijn. Door virusonderzoek zijn de atypische gevallen te diagnosticeren. Rond de 50% van de infecties verloopt subklinisch (zonder exantheem).
Laboratoriumdiagnostiek
Serologisch onderzoek naar toename van specifieke IgG-antistoffen of eenmalige specifieke antirubella-IgM-bepaling. PCR keeluitstrijk, speeksel of urine.
Therapie
Geen.
Complicaties
Bij de patiënt treden zeer zelden complicaties op, zoals postinfectieuze encefalitis of purpura (ten gevolge van trombocytopenie). De ziekte ontleent haar belang aan het feit dat een primaire infectie bij vrouwen in de eerste zestien weken van de graviditeit congenitale misvormingen van de vrucht teweeg kan brengen (hart, hersenen, ogen, oren, achterblijven in groei, hepatosplenomegalie, e.d.). De kans op misvormingen is in de eerste vier weken van de zwangerschap het grootst.Ook kan het kind bij de geboorte gezond lijken, maar in een aantal gevallen ontstaan vanaf de leeftijd van 3 maanden tot 1 jaar toch nog ziekteverschijnselen (late-onset disease) zoals exantheem, interstitiële pneumonie, doofheid, chronische diarree en hypogammaglobulinemie. Neonaten die in utero met rubellavirus geïnfecteerd zijn, kunnen op hun beurt vaak gedurende vele maanden het virus verspreiden met de urine en via de keel.
Preventie
Postexpositie na een risicocontact van een seronegatieve zwangere met menselijk immunoglobuline is controversieel.
Sinds 1987 worden alle kinderen – zowel jongens als meisjes – op de leeftijd van 14 maanden en 9 jaar tegen rubella ingeënt, in combinatie met de vaccinatie tegen bof en mazelen (BMR). Door de hoge vaccinatiegraad circuleert het rubellavirus in Nederland niet meer. Zoals voor toediening van alle levende vaccins geldt, vormt zwangerschap in principe een contra-indicatie en dient tot twee maanden na de enting te worden voorkomen. Screening op rubella tijdens de graviditeit is als routine niet aangewezen.
Erythema infectiosum (vijfde ziekte)
Kernpunt
Parvovirus-B19-infectie is geassocieerd met de volgende syndromen: erythema infectiosum (vijfde ziekte), symmetrische artralgieën, aplastische crisis bij chronische hemolytische anemie of ernstig immuungecompromitteerden en intra-uteriene vruchtdood of (spontane) abortus.
Verwekker
Humaan parvovirus B19.
Besmetting
Druppelinfectie.
Epidemiologie
Erythema infectiosum is typisch een ziekte van het schoolgaande kind. De besmettelijkheid begint, naar men aanneemt, enkele dagen voor het verschijnen van het exantheem en duurt drie tot vijf dagen.
Incubatietijd
Ongeveer tien dagen.
Klinische verschijnselen
De ziekte begint bij kinderen met een exantheem dat zich het eerst manifesteert op de wangen als kleine rode vlekjes en zich spoedig uitbreidt en ineenvloeit tot een diffuus erytheem dat over de rand van de onderkaak heen reikt en vrij scherp begrensd is (slapped cheek); het laat de neusrug en de neuswortel vrij. De uitbreiding strekt zich in een dag of twee uit tot de bovenste ledematen aan de dorsale zijde, tot de bovenbenen vooral aan de voorzijde, en tot de nates. In het begin is het wat moeilijk te onderscheiden van roodvonk of rubella, omdat de eerste dag soms enkele vlekjes op de romp te zien zijn. De temperatuur kan verhoogd zijn tot ongeveer 38 °C. Lymfeklieren kunnen diffuus iets vergroot zijn. De ziekte geneest in drie tot vijf dagen. Zelden wordt het exantheem gevolgd door asymmetrische artralgieën en/of artritis. Bij volwassenen daarentegen wordt het exantheem minder vaak gezien; bij hen staan vooral symmetrische gewrichtsklachten op de voorgrond (komen frequenter voor bij vrouwen). Deze klachten kunnen, ook bij kinderen, binnen twee weken verdwijnen maar ook enkele maanden aanhouden en lijken op een seronegatieve reumatoïde artritis.
Laboratoriumdiagnostiek
Antistofbepaling (IgM).
Therapie
Geen.
Complicaties
Aplastische crisis bij patiënten met een chronische hemolytische anemie (bijvoorbeeld bij sikkelcelziekte) of bij patiënten die ernstig immuungecompromitteerd zijn (bijvoorbeeld na een stamceltransplantatie). Daarnaast zijn er aanwijzingen dat de infectie op de foetus kan worden overgedragen. Het gevolg hiervan zou een (spontane) abortus of intra-uteriene vruchtdood kunnen zijn.
Casuïstiek
Exanthema subitum (zesde ziekte)
Kernpunt
HHV-6 veroorzaakt het meest voorkomende exantheem bij het jonge kind.
Verwekker
Humaan herpesvirus type 6 (HHV-6 ).
Besmetting
Waarschijnlijk druppelinfectie.
Epidemiologie
Dit is het meest voorkomende exantheem bij het jonge kind.
Incubatietijd
Waarschijnlijk acht tot tien dagen.
Klinische verschijnselen
De aandoening komt voornamelijk voor bij kinderen tot 4 jaar. Zij worden acuut ziek met vrij hoge koorts; het algemeen welbevinden is weinig gestoord. Bij fysisch onderzoek zijn geen belangrijke afwijkingen vast te stellen. Deze fase kan tot drie dagen duren, dan daalt de koorts kritisch tot de norm en blijkt het kind plotseling onder het exantheem te zitten: een zeer kleinvlekkige, lichtroze uitslag, vooral op de romp, maar vaak ook enigszins zichtbaar op het gelaat en soms op de ledematen, tot de voetzolen toe. Dit exantheem verdwijnt in ongeveer drie dagen, waarna het kind genezen is. Deze ziekte wordt soms voor rubella gehouden. Andere virale verwekkers (ECHO-virussen, rubella) kunnen bij het jonge kind ook een op exanthema subitum lijkende ziekte veroorzaken.
Laboratoriumdiagnostiek
Antistofbepaling, geen routine.
Therapie
Geen.
Complicaties
Reactivatie van HHV-6 bij immuungecompromitteerde patiënten kan voorkomen, maar de klinische betekenis is onduidelijk.
Overige exanthemen
Er zijn exanthemen die niet bij de hiervoor beschreven ziekten kunnen worden ondergebracht. Ze komen vaak voor in epidemische golven van licht koortsende ziekten met griepachtige klachten (hoofdpijn, lichte spierpijnen, enige keelpijn). Virusonderzoek maakt het soms mogelijk een etiologie op te sporen. Deze exanthemen kunnen een gevolg zijn van infectie met verschillende enterovirussen (ECHO- en Coxsackie A-virussen en enterovirus type 71) en adenovirussen. Ongetwijfeld spelen ook andere virussen een rol.
Waterpokken (varicella)
Kernpunten
Kenmerkend voor waterpokken is het gelijktijdig bestaan van vlekjes, bultjes en blaasjes.
Patiënten met een gestoorde afweer kunnen ernstige varicella krijgen.
Verwekker
Varicellazostervirus (VZV).
Besmetting
Aerogeen en contact.
Epidemiologie
Varicella is besmettelijk en komt voornamelijk op de schoolleeftijd voor. Toch kunnen ook volwassenen (vooral mensen die uit de tropen afkomstig zijn en immuungecompromitteerden) door de ziekte worden getroffen. De besmettelijkheid begint ongeveer vijf dagen voor het uitbreken van het exantheem en duurt tot ongeveer een week na het verschijnen van de laatste groep nieuwe blaasjes.
Incubatietijd
Twee tot drie weken.
Klinische verschijnselen
Bij kinderen begint de ziekte meestal acuut met koorts en het typische exantheem op dezelfde dag. De vlekjes beginnen op hoofd of romp en ontwikkelen zich tot bultjes en daarna tot blaasjes. De blaasjes hebben een rode hof en een heldere inhoud. In vijf tot zeven golven ontstaan er steeds weer nieuwe jeukende vlekjes, bultjes en blaasjes. Conjunctivae en slijmvliezen van mond en keelholte kunnen aangedaan zijn; dit geeft soms pijnlijke zweertjes in de mond en keel. Binnen enkele dagen zijn alle blaasjes ingedroogd. De korstjes vallen na zeven tot tien dagen af. Kenmerkend voor waterpokken is het gelijktijdig bestaan van vlekjes, bultjes en blaasjes.
Langdurig verloop van de huidafwijkingen en ernstige ontstekingsverschijnselen van interne organen als longen, hart en hersenen zijn mogelijk bij patiënten met een gestoorde immunologische afweer (zoals bij de ziekte van Hodgkin (Figuur 6.16), bij behandeling met cytostatica of bijnierschorshormonen). Zwangeren hebben bij primaire infectie met varicellazostervirus meer kans op ernstige complicaties zoals een varicellapneumonie. Daarnaast komt een partus prematurus voor bij ongeveer 5% van de zwangeren met VZV-infectie.

Laboratoriumdiagnostiek
In de meeste gevallen is waterpokken een klinische diagnose. PCR-diagnostiek op blaasjesvocht uit een huidvesikel kan de diagnose bevestigen. De aanwezigheid van virusspecifieke IgG-antistoffen in serum toont een doorgemaakte infectie aan.
Therapie
Op de kinderleeftijd behoeft waterpokken geen therapie. Soms is lokaal mentholpoeder tegen de jeuk nodig. Ernstig verloop bij gestoorde cellulaire immuniteit: aciclovir i.v. of valaciclovir per os gedurende vijf tot zeven dagen (dosering zie bij herpes zoster).
Complicaties
Pneumonie, encefalitis. Superinfecties met huidflora (Streptococcus pyogenes of Staphylococcus aureus).
Preventie
Onder normale omstandigheden is individuele preventie niet aangewezen, maar bij hoogrisicopatiënten met een gestoorde cellulaire afweer (bijvoorbeeld bij de ziekte van Hodgkin of door therapeutisch gebruikte immuunsuppressiva bij de behandeling van acute leukemie bij kinderen) kunnen na expositie aan waterpokken antivaricella-immunoglobulines (ZIG ) gegeven worden, evenals aan neonaten van wie de moeder in de periode van vijf dagen voor tot en met twee dagen na de partus varicella doormaakt en premature neonaten met contact met waterpokken. Thans wordt in sommige landen aan deze risicogroep ook een levend verzwakt varicellavirusvaccin toegediend. Dit varicellavaccin is ook in Nederland verkrijgbaar, maar niet opgenomen in het Rijksvaccinatieprogramma.
Casuïstiek
Gordelroos (herpes zoster)
Kernpunten
Herpes zoster is een endogene herinfectie met varicellazostervirus.
Gegeneraliseerde herpes zoster komt voor bij personen met een verminderde afweer.
(Val)aciclovir is geïndiceerd bij patiënten met cellulaire immuundeficiënties en sterke generalisatie, bij patiënten met zoster van de voorhoofdstak en bij patiënten met hevige pijn.
Verwekker
Varicellazostervirus (VZV) .
Besmetting
Endogene herinfectie.
Epidemiologie
De ziekte kan waterpokken veroorzaken bij vatbare kinderen en volwassenen in de omgeving.
Klinische verschijnselen
De ziekte begint veelal met pijn in het huidsegment waar enige dagen tot een week later de typische afwijking ontstaat. Deze is vrijwel altijd eenzijdig gelokaliseerd en bestaat uit vesikels, gegroepeerd op een erythemateus gebied. De blaren zijn gevuld met wat troebel grijsgeel vocht en vloeien soms ineen tot vlakke pustels (Figuur 6.17), die secundair geïnfecteerd kunnen raken. Na enige dagen drogen de vesikels en pustels in tot korsten. Na afstoting van de korsten ontstaan soms vrij grote huiddefecten die slechts traag dichtgranuleren met vorming van littekens. De infectie ontleent haar naam ‘zona’, gordelroos, aan de lokalisatie als een gordel om de romp: scherp naar boven en beneden begrensd, zich uitstrekkend van de mediaanlijn voor tot de mediaanlijn achter. De aangedane huid is het verzorgingsgebied van sensibele zenuwen.

Het virus sluimert na een in de jeugd doorgemaakte waterpokkeninfectie in achterwortelganglia en in ganglia die daarmee te vergelijken zijn. Langs de gevoelszenuwen kan het virus de huid weer bereiken. De plaats en ook de uitgebreidheid van de aandoening variëren daarom. Een ernstige vorm is de herpes zoster in het gebied van de eerste tak van de nervus trigeminus. In het gebied van de tweede tak kunnen laesies worden aangetroffen op het slijmvlies van uvula, tonsil, palatum en bovenkaak.
Blaasjes en ulcera op de gingiva van de onderkaak en de mondbodem duiden op gordelroos in het gebied van de derde tak van de nervus trigeminus. Bij lokalisaties in deze laatste twee gebieden kunnen secundaire gevallen van waterpokken ontstaan wanneer – via aerosolvorming – het virus op niet-immune personen (onder andere kinderen) wordt overgebracht.
De pijn bij herpeszosterpatiënten kan zeer intens zijn. De duur kan uiteenlopen van het begin voor de huiduitslag tot weken en maanden na genezing ervan (zogenoemde postherpetische neuralgie ).
Laboratoriumdiagnostiek
In de meeste gevallen is gordelroos een klinische diagnose. PCR-diagnostiek op blaasjesvocht uit een huidvesikel kan de diagnose bevestigen.
Therapie
Pijnbestrijding indien nodig. Bij patiënten met cellulaire immuundeficiënties en sterke generalisatie, bij patiënten met zoster van de voorhoofdstak en bij patiënten met hevige pijn heeft (val)aciclovir een gunstige invloed. De toediening heeft alleen zin als er nog verse blaasjes zijn. Dosering: orale therapie met valaciclovir driemaal daags 1000 mg of i.v. therapie met aciclovir driemaal daags 10 mg/kg gedurende vijf tot zeven dagen. Eventuele postherpetische pijn wordt door valaciclovir niet of nauwelijks beïnvloed.
Complicaties
Postherpetische neuralgie, secundaire bacteriële infecties, periferere verlammingen van een arm of een been, meningitis. Oogcomplicaties bij herpes zoster van de nervus trigeminus: oogspierverlammingen, conjunctivitis, keratitis met ulceratie, iridocyclitis.
Preventie
Vaccinatie van gezonden > 60 jaar kan de kans op herpes zoster halveren en de ernst van postherpetische neuralgie doet afnemen. Dit wordt nog niet standaard gedaan.
Casuïstiek
Herpessimplexvirusinfectie
Kernpunten
Herpesencefalitis is een ernstig ziektebeeld.
Een primaire genitale infectie gaat vaak gepaard met algemeen ziek-zijn.
Bij ernstige primaire infecties en herpessimplexvirusinfecties bij patiënten met een vertraagde immuniteit is (val)aciclovir geïndiceerd.
Verwekker
Herpessimplexvirus (HSV) type 1 en 2.
Besmetting
Direct contact (primaire infectie) en endogene herinfectie; het virus sluimert in ganglioncellen.
Epidemiologie
Afgezien van de vaak zeer ernstig verlopende infectie van de neonaat, komen de meeste primaire besmettingen met herpessimplexvirus type 1 voor bij kinderen tussen 1 en 3 jaar. Bij ruim 90% van de patiënten verloopt deze primaire infectie echter symptoomloos. Op de leeftijd van 5 tot 6 jaar is ongeveer 50% geïnfecteerd met het virus. De kans op besmetting wordt mede bepaald door sociaaleconomische factoren. Infectie met type 2-virus wordt meestal door geslachtsverkeer overgedragen. Genitale herpes wordt meestal veroorzaakt door type 2, maar in toenemende mate door type 1.
Incubatietijd
Bij een primaire infectie tot twee weken.
Klinische verschijnselen
Kleine kinderen kunnen door type 1 een uitgebreide ontsteking van grote gedeelten van het mondslijmvlies en de kaakranden krijgen, met witte blaasjes en ulcera: gingivostomatitis. De pijn maakt het slikken vaak moeilijk. De aandoening gaat gepaard met koorts, die soms een week een febris continua kan zijn. De koorts neemt dan af, de pijn lijkt te verminderen, de genezing van het mondslijmvlies neemt daarna nog enige dagen in beslag. Velen kennen uit eigen ervaring de recidiverende ‘koortsuitslag ’: het ontstaan van een of meer groepjes zeer kleine met helder tot lichtgeel vocht gevulde blaasjes op een lichtrode ondergrond, meestal voorafgegaan door een korte tijd van onaangename sensaties in het aangedane lip- of huidgebied (Figuur 6.18).

De aandoening geneest via de vorming en afstoting van een korstje. Voor de functie van het oog zijn de recidiverende aandoeningen op de cornea (keratitis dendritica ) en de iridocyclitis gevaarlijk.
Bij volwassenen kan een infectie met het HSV zich voordoen als een lymfocytaire meningitis. Ook een veel gevaarlijker meningo-encefalitis komt voor (herpesencefalitis ). Hierbij is de temporale kwab de belangrijkste lokalisatie. Vrij opvallend is een insult vroeg in het ziektebeeld. De diagnose is moeilijk. Deze encefalitis heeft een ernstige prognose. Ook de secundaire HSV-infectie bij constitutioneel eczeem is een zeldzaam, maar ernstig ziektebeeld (eczema herpeticum ; Figuur 6.19). Boven het diafragma speelt vooral herpessimplexvirus type 1 een rol; eronder – in circa 80% van de gevallen – type 2. Herpes genitalis behoort tot de seksueel overdraagbare aandoeningen. De genitaal gelokaliseerde laesies bij de vrouw hebben vaak het karakter van kleine ulcera door het stukgaan van de blaasjes. Bij de vrouw vindt men laesies op de cervix (onpijnlijk), in de vagina of op de labia; bij de man op de penis, het preputium, het scrotum en op de huid van de anus en het slijmvlies in het rectum (bijvoorbeeld bij aidspatiënten). Een primaire genitale infectie gaat vaak gepaard met algemeen ziek-zijn en bij de vrouw met ernstige dysurie. De primo-infectie (Figuur 6.20) kenmerkt zich vaak door symmetrie van de laesies, terwijl de recidieven frequenter eenzijdig gelokaliseerd zijn.


Neonatale infecties met zowel HSV-1 als HSV-2 kunnen een zeer ernstig ziektebeeld veroorzaken met koorts, cyanose, icterus met hepatosplenomegalie, convulsies en coma door beschadiging van het centrale zenuwstelsel. De letaliteit is hoog. Het kan zowel een besmetting durante partu via een geïnfecteerd geboortekanaal betreffen, als een postnatale besmetting van de neonaat via niet-genitaal gelokaliseerde herpeslaesies bij personen die met de neonaat in contact komen.
Laboratoriumdiagnostiek
PCR van blaasje, mond-keeluitstrijk, liquor cerebrospinalis, bronchoalveolaire lavage (BAL-)vloeistof, en van biopten van slokdarm, rectum, longweefsel (bijvoorbeeld bij de longontsteking van aidspatiënten), vooral bij ernstige infecties (bijvoorbeeld bij een vermoeden van herpesencefalitis). Bepaling van antistoffen (toename van IgG-antistoffen of eenmalig IgM-anti-HSV) in serum bij het vermoeden van een primaire infectie.
Therapie
Ernstige primaire infecties en herpessimplexvirusinfecties bij patiënten met een verlaagde immuniteit: aciclovir i.v. (dosering zie herpes zoster) of valaciclovir per os. Herpes genitalis: oraal valaciclovirtabletten. Keratitis dendritica: plaatselijk acicloviroogzalf of TFT- (trifluorothymidine)zalf.
Complicaties
Bij primaire infectie oogbeschadiging, uitdroging bij stomatitis, ‘inklemming’ bij encefalitis, urineretentie bij primo-infectie van herpes genitalis bij de vrouw.
Preventie
Ter preventie van herpes neonatorum moet men bij de zwangerschapscontrole vragen naar het vóórkomen van genitale herpes bij de patiënte of haar partner. Bij zwangeren met een primaire symptomatische genitale HSV-infectie tijdens de laatste twee weken van de zwangerschap is een sectio geïndiceerd. Daarnaast moet voorlichting worden gegeven over de kans op een postnatale besmetting van de neonaat door personen met een niet-genitaal gelokaliseerde herpeslaesie (bijvoorbeeld herpes labialis). Het gebruik van condooms kan de transmissiekans van HSV verlagen. Er is geen vaccin tegen HSV-1 en -2 beschikbaar.
Casuïstiek
Erythema migrans (ECM) en lymeborreliose
Kernpunten
EM is een door een tekenbeet overgebrachte infectie met Borrelia.
Late manifestaties van de ziekte van Lyme zijn onder meer artritis, myocarditis, acrodermatitis chronica atrophicans en neuroborreliose.
Verwekker
Borrelia burgdorferi .
Besmetting
EM is een door een tekenbeet overgebrachte infectie met Borrelia. Het epidemisch vóórkomen van EM in de stad Lyme (Connecticut), waarbij vooral de algemene symptomen op de voorgrond stonden, heeft de aandoening de naam ‘ziekte van Lyme’ gegeven.
Epidemiologie
Lymeborreliose wordt overgedragen via de beet van een geïnfecteerde teek (Ixodes spp.). De transmissie vindt pas plaats nadat de teek zich enkele uren in de huid heeft ingeboord om zich met bloed te voeden. Tijdige en deskundige verwijdering van de teek is dan ook een belangrijke preventieve maatregel. In Nederland komt infectie van de tekenpopulatie frequent voor (vooral in bosrijke streken en in de duinen). De ziekte kan dan ook worden waargenomen bij recreanten en personen die zich beroepshalve in geïnfecteerde gebieden ophouden (zoals bosbouwers). Bij deze laatste groep werd in ons land een infectieprevalentie van ongeveer 20% vastgesteld. De frequentie van lymeborreliose is de laatste jaren gestegen. De huisartsen in Nederland worden tienduizenden malen per jaar geconsulteerd voor tekenbeten; EM wordt jaarlijks bij naar schatting 25.000 personen vastgesteld.
Incubatietijd
De incubatieperiode, van tekenbeet tot EM, is meestal één tot twee weken (spreiding enkele dagen tot 2-3 maanden).
Klinische verschijnselen
Na de beet van de met de spirocheet geïnfecteerde teek (Ixodes-soorten) ontstaat een chronisch verlopend, zich centrifugaal uitbreidend maculeus erytheem, dat een doorsnede van 50 cm kan bereiken. Aan de periferie bevindt zich vaak een actieve zone, terwijl men centraal de resten van de insectenbeet kan aantreffen. Het erytheem is voornamelijk gelokaliseerd op aan insectenbeten blootgestelde lichaamsdelen (vooral ledematen). De aandoening gaat in een deel van de gevallen gepaard met koorts, hoofdpijn, algehele malaise, verspringende artralgie en lymfadenopathie, die soms enkele weken kunnen aanhouden (stadium 1; Figuur 6.21).

Van de zijde van het zenuwstelsel ziet men soms meningopolyneuritis, aseptische meningitis, encefalitis en tick paralysis. Deze verschijnselen kunnen maanden aanhouden. Af en toe wordt een (peri)myocarditis met geleidingsstoornissen als complicatie gezien (stadium 2).
Weken of maanden na de infecterende tekenbeet kan artritis (voornamelijk in de knieën) ontstaan, die soms chronisch wordt (stadium 3). In zeldzame gevallen treden acrodermatitis chronica atrophicans en/of neuroborreliose (zie ▶ par. 6.6.4) op.
Laboratoriumdiagnostiek
EM is een klinische diagnose. Antistoftesten zijn de hoeksteen voor de diagnostiek bij eventueel late manifestaties van de ziekte van Lyme. Daarnaast: PCR en isolatie van de spirocheet in gespecialiseerde laboratoria.
Therapie
EM wordt behandeld met doxycycline (bij kinderen met amoxicilline). Voor de latere stadia worden intensievere behandelingen (ceftriaxon parenteraal) gedurende enkele weken geadviseerd.
Preventie
Preventieve maatregelen bestaan uit voorlichting over de risico’s die zijn verbonden aan tekenbeten, het dragen van goed sluitende kleding, een hoofddeksel en in sommige gevallen handschoenen. De waarde van insectenafstotende middelen is niet bewezen.
De teek wordt met een pincet zodanig uit de huid getrokken dat de ‘kop’ niet achterblijft. Daarna volgt desinfectie van de wond. De plaats van de tekenbeet dient enkele weken in de gaten gehouden te worden. Mocht zich roodheid voordoen, dan dient de huisarts geconsulteerd te worden. Er is momenteel geen humaan vaccin tegen de ziekte van Lyme.
Casuïstiek
Rickettsiosen: fièvre boutonneuse
Kernpunt
Koorts, exantheem en tache noir zijn typerend voor fièvre boutonneuse.
Verwekker
Rickettsia conori , een kleine intracellulaire bacterie uit de groep van de rickettsiosen.
Besmetting
Tekenbeet, in Europa voornamelijk door de hondenteek Rhipicephalus sanguineus.
Epidemiologie
De hondenteek komt voor in gebieden rond de Middellandse Zee, maar ook in Afrika (Krugerpark in Zuid-Afrika!) en India.
Incubatietijd
Vijf tot zeven dagen.
Klinische verschijnselen
Een licht tot ernstig verlopende koortsende ziekte met een eventueel zichtbare primaire laesie (tache noir , eschar ; Figuur 6.22b) op de plaats van de tekenbeet. Deze primaire laesie bestaat uit een klein ulcus met een doorsnede van 2-5 mm en een zwart centrum. De regionale lymfeklieren zijn vergroot.

Ongeveer op de vierde à vijfde ziektedag, na het verdwijnen van de koorts, ontstaat een gegeneraliseerd maculopapuleus exantheem, waarbij ook de handpalmen en voetzolen betrokken zijn (Figuur 6.22a); dit exantheem blijft ongeveer een week bestaan.
Laboratoriumdiagnostiek
Antistofbepaling (IgM, IgG). De antistofvorming kan laat op gang komen, zodat voor de diagnostiek in ieder geval een bloedmonster, vier weken na het begin van de ziekte, noodzakelijk is.
Therapie
Doxycycline per os 100 mg tweemaal daags gedurende zeven dagen.
Complicaties
Meningo-encefalitis, uveïtis, vasculitis.
Andere rickettsiosen die met een eschar gepaard kunnen gaan, zijn:
Queensland tick typhus, verwekker R. australis, overgebracht door teken;
North Asian tick typhus, verwekker R. sibirica, overgebracht door teken;
Rickettsial pox, verwekker R. akari, overgebracht door een mijt, voorkomend in de Verenigde Staten, de voormalige Sovjet-Unie, Korea en Afrika;
Rocky Mountain spotted fever, verwekker R. rickettsii, overgebracht door teken, voornamelijk voorkomend in de Verenigde Staten. Gaat niet gepaard met een eschar, maar kan heviger verlopen.
Casuïstiek
Infectieziekten met lymfeklierzwellingen en/of afwijkingen in de mond-keelholte, inclusief hiv, gonorroe en syfilis
Van de reeds besproken exanthematische infectieziekten gaan vele gepaard met lymfeklierzwellingen. Bij mazelen, rubella en ECHO-virusinfecties zijn deze klein, elastisch van consistentie en op multipele plaatsen te vinden: submandibulair, in de hals achter de musculus sternocleidomastoideus en in de nek. Bij roodvonk en erysipelas door Streptococcus pyogenes en bij geïnfecteerde verwondingen zijn ze vaak wat groter, pijnlijker en kunnen lokaal voorkomen: submandibulair of in de regionale lymfeklieren. Enkele andere infectieziekten die ook met lymfeklierzwellingen en mond-keelafwijkingen gepaard gaan, worden hierna beschreven.
Acute keelontsteking (tonsillitis, faryngitis, angina follicularis)
Kernpunt
Acute tonsillitis kan door diverse verwekkers worden veroorzaakt.
Verwekker
Streptococcus pyogenes en virussen (onder andere ECHO- en coxsackievirussen , adeno- en andere verkoudheidsvirussen, epstein-barrvirus).
Incubatietijd
Afhankelijk van de verwekker.
Klinische verschijnselen
De patiënt is meestal vrij plotseling ziek, rillerig, heeft koorts en keelpijn bij het slikken. Bij onderzoek zijn de tonsillen rood en gezwollen, soms met stipvormige of grotere witte beslagen. Ook de gehemeltebogen, de farynxachterwand, het palatum molle en de uvula kunnen rood geïnjiceerd zijn (na tonsillectomie is de infectie daar gelokaliseerd). Klinisch is de rode keel, met eventueel een beslag, veroorzaakt door Streptococcus pyogenes, niet met zekerheid te onderscheiden van die welke het gevolg is van een virusinfectie, tenzij de huid exantheem vertoont met bijvoorbeeld de kenmerken van roodvonk of meer maculopapuleus bij ECHO- en andere virusinfecties. Klierzwelling in de voorste halsdriehoek is een argument voor een streptokokkeninfectie. Hoestklachten pleiten vooral voor een virale genese. Er zijn nog enkele andere kenmerken die richting geven aan het laboratoriumonderzoek: een infectie door Coxsackie A-virus (herpangina ) is te herkennen aan zeer kleine vesikels met een rood hofje op de voorste gehemeltebogen, soms ook op het palatum molle en de uvula. Ze worden spoedig beschadigd en vormen dan kleine ulcera met wat geel beslag op de bodem.
De keelontsteking bij adenovirusinfecties gaat vaak gepaard met conjunctivitis en een infectie van de bovenste luchtwegen.
De angina van Plaut-Vincent wordt gekenmerkt door een eenzijdige ulceratie, een oppervlakkig defect, met een vuil witgroen beslag op de bodem, gelokaliseerd op één tonsil of zelden ook elders op farynxwand en palatum. Er bestaat een foetor ex ore, soms een lichte regionale lymfeklierzwelling en weinig algemene ziekteverschijnselen. Hoewel een gonokokkenfaryngitis niet zeldzaam is, zijn de klachten hiervan meestal gering of zelfs afwezig. Bij een ernstige keelontsteking moet aan agranulocytose en acute leukemie worden gedacht.
Laboratoriumdiagnostiek
Bacteriologische kweek van de keeluitstrijk, gericht op Streptococcus pyogenes, is mogelijk, maar meestal niet nodig. Het is mogelijk PCR op virussen in materiaal van de keel en feces te laten uitvoeren, maar dat wordt niet standaard gedaan, omdat virale keelontsteking self-limiting is en er geen klinische consequenties zijn. EBV en CMV worden met serologie aangetoond. Bij de angina van Plaut-Vincent ziet men in het grampreparaat massa’s fusiforme bacillen en spirocheten, die moeilijk te kweken zijn.
Therapie
Angina door Streptococcus pyogenes als bij roodvonk: weinig invloed van penicilline op de koortsduur in de acute fase. Symptomatische therapie (paracetamol) is in het algemeen voldoende. Wel wordt penicilline gegeven bij ernstig zieke patiënten en bij patiënten met een verminderde afweer. Virusinfecties: alleen symptomatische therapie; geen antibiotica. Plaut-Vincent: symptomatisch; bij niet vlot genezen wordt penicilline gegeven.
Complicaties
Bij angina door bacteriën peritonsillitis en peritonsillair abces: naar voren uitpuilende felrode voorste farynxboog, in het laatste geval met fluctuatie. Peritonsillitis verbetert meestal onder penicillinetherapie; een abces moet ingesneden worden. Andere complicaties: parafaryngeaal abces, lymphadenitis colli, acute glomerulonefritis en acuut reuma. Een bijzondere vorm van peritonsillitis/parafaryngeaal abces wordt veroorzaakt door Fusobacterium necrophorum . Deze infectie kan gepaard gaan met tromboflebitis van de vena jugularis (syndroom van Lemierre ). Virusangina: in het algemeen geen complicaties; de ziekte gaat soms gepaard met niet-purulente meningitis (zie ▶ par. 6.6.3).
Casuïstiek
Mononucleosis infectiosa (klierkoorts, ziekte van Pfeiffer)
Kernpunten
Bij mononucleosis infectiosa is er een atypische lymfocytose; vaak zijn er heterofiele antistoffen.
Amoxicilline leidt bij mononucleosis infectiosa in > 90% van de gevallen tot een exantheem.
Verwekker
Epstein-barrvirus (EBV).
Besmetting
Door intiem contact (kissing disease) via speeksel, meestal van asymptomatische virusdragers. Het virus nestelt zich in speekselklierepitheelcellen en B-lymfocyten.
Epidemiologie
Het epstein-barrvirus blijkt bij serologisch onderzoek veelvuldig te circuleren onder de bevolking, vooral daar waar nauw onderling contact bestaat, zoals de lagere leeftijdsklassen. Op jonge leeftijd verloopt de infectie in de overgrote meerderheid symptoomloos, op wat latere leeftijd vaak als een lichte tonsillitis, maar pas bij de adolescent manifesteert de infectie zich met het klassieke beeld van de mononucleosis. Van gezonde volwassenen is 15 tot 20% drager van het virus in de keel.
Incubatietijd
In incidentele gevallen door de geringe infectiositeit of vele subklinische infecties niet na te gaan; bij een epidemische verheffing in bijvoorbeeld scholen waarschijnlijk lang: vier tot zes weken.
Klinische verschijnselen
Na een of twee weken moeheid en malaise ontstaat koorts met keelpijn, vaak spoedig gevolgd door pijnlijke lymfeklierzwellingen. Deze zwellingen zijn niet beperkt tot de submandibulaire lymfeklieren, maar kunnen zich uitbreiden over alle stations: in de hals, nek, oksels, elleboogplooien en liezen. De eetlust is verminderd; vaak klagen de patiënten over een pijnlijk vol gevoel in de buik. De angina verdwijnt niet in een paar dagen en bij onderzoek vindt men meestal een jongvolwassene met koorts, wat oedemateus gezwollen bovenste oogleden, foetor ex ore, roodheid van de farynx en gezwollen tonsillen die bedekt zijn met vettig witte tot gele beslagen (Figuur 6.23). Soms zijn bloedinkjes op het palatum molle waar te nemen. De lymfeklieren zijn pijnlijk bij palpatie, niet onderling of aan de huid en onderlaag gefixeerd. De milt is meestal vergroot. De lever kan vergroot zijn, elastisch en pijnlijk bij palpatie. De temperatuur is meestal gedurende ongeveer drie weken verhoogd en daalt geleidelijk. De angina is meestal eerder verdwenen. De lymfeklierzwellingen en de miltvergroting kunnen wat langer blijven bestaan. De patiënten klagen na het acute stadium vaak nog wekenlang over moeheid. Bij bestudering van een groot aantal patiënten blijken groepen onderscheiden te kunnen worden met het volledige beeld en groepen waarbij de angina op de voorgrond staat, de klierzwellingen of de leveraandoening, soms zelfs met een meestal lichte icterus. De huid kan een exantheem tonen (Figuur 6.24), wisselend van rubelliform tot morbilliform en scarlatiniform, vooral wanneer ten onrechte amoxicilline of ampicilline wordt gegeven (dit is geen echte penicillineallergie).


Laboratoriumdiagnostiek
Er is meestal een leukocytose, tussen de 10 en 20 × 109/l. Een bloeduitstrijk toont overheersend lymfocyten (meestal meer dan 50%). Van deze lymfocyten is een groot aantal (bijvoorbeeld meer dan 10%) abnormaal van grootte, vorm en kleur, met donkerblauw, gevacuoliseerd protoplasma; de kernen zijn wisselend van grootte en vorm en vertonen uiterst zelden zelfs nucleoli. Zo vormen de lymfocyten een bont beeld. Er is vaak een lichte neutropenie en trombopenie. De rode bloedcellen zijn normaal: er is dus geen anemie. De leverbiochemie is bij 90% van de patiënten licht gestoord. Het kweken van EBV is geen routine; wel kan tegenwoordig de virusconcentratie in het bloed worden gemeten (PCR). Bij ongecompliceerde mononucleose is deze diagnostiek niet geïndiceerd. Heterofiele antistoffen zijn bij circa 70% van de patiënten aantoonbaar (de reactie van Paul-Bunnell ; in simpele vorm de monosticonreactie ). Bij een mononucleosisbeeld met een negatieve reactie van Paul-Bunnell heeft het zin een onderzoek naar EBV-specifieke antistoffen te verrichten (IgM-anti-EBV-VCA), evenals een onderzoek naar infectie met cytomegalovirus, hiv en Toxoplasma gondii. Ook deze laatstgenoemde infecties kunnen gepaard gaan met een soortgelijk bloedbeeld en met op mononucleosis infectiosa lijkende klinische verschijnselen. De aanwezigheid van anti-EBNA-antistoffen wijst op een infectie die langer dan zes maanden geleden plaatsvond. Hiermee kan men dus recente en oudere infecties van elkaar onderscheiden. Voor de diagnostiek van chronische EBV-infecties (inclusief burkittlymfoom en nasofaryngeaal carcinoom ) is PCR voor circulerend EBV-DNA aangewezen.
Therapie
Symptomatisch en eventueel bedrust in het acute stadium. Antibiotica hebben geen zin (amoxicilline bij mononucleosis infectiosa leidt in meer dan 90% van de gevallen tot een exantheem). Het bloedbeeld kan een halfjaar tot een jaar lang pathologische cellen tonen.
Complicaties
Niet-purulente meningitis, primaire atypische pneumonie, hemolytische anemie, trombocytopenie, syndroom van Guillain-Barré, zeer zelden myocarditis, uiterst zelden miltruptuur. Vooral in Afrika wordt het burkittlymfoom als complicatie aangetroffen (voornamelijk in endemische malariagebieden). Ook het nasofaryngeaal carcinoom is als complicatie op te vatten (voornamelijk in Zuid-China, Zuidoost-Azië en Noord- en Oost-Afrika).
Preventie
Tegen de ziekte bestaat geen specifieke profylaxe.
Casuïstiek
Toxoplasmose
Kernpunten
Primo-infectie van toxoplasmose in de zwangerschap kan aanleiding geven tot een intra-uteriene infectie.
Reactivatie van toxoplasmose bij een gestoorde immuniteit is een ernstige ziekte.
Verwekker
Toxoplasma gondii .
Besmetting
Toxoplasmose na de postnatale periode is vaak het gevolg van het eten van rauw vlees, doordat de veestapel in zekere mate geïnfecteerd is. De huiskat speelt een sleutelrol in de epidemiologie van toxoplasmose. Direct contact met kattenfeces waarin zich infectieuze oöcysten bevinden, vormt een belangrijke besmettingsweg.
Epidemiologie
Toxoplasma-infecties komen in de wereld zeer verspreid voor: naar men aanneemt maakt ongeveer de helft van de wereldbevolking een infectie door. Waarschijnlijk speelt de consumptie van cystebevattend (rauw) vlees bij de overdracht een grote rol, hoewel bij vegetariërs in India een even hoog besmettingspercentage werd gevonden als bij vleeseters. Geslachtelijke voortplanting van Toxoplasma is in het darmkanaal van de kat aangetoond. Oöcysten worden met de ontlasting geloosd en rijpen in ongeveer twee dagen. De mens wordt daardoor incidenteel besmet, maar landbouwhuisdieren en in de vrije natuur levende dieren worden vaak besmet door contact met infectieuze oöcystebevattende kattenfeces. De rol van de kat (en katachtigen) is bij het totale overdrachtsmechanisme essentieel. Besmetting van mens op mens is niet beschreven.
Incubatietijd
Onbekend (bij laboratoriumbesmetting ongeveer tien dagen).
Klinische verschijnselen
De primaire infectie van een vrouw gedurende de zwangerschap kan leiden tot intra-uteriene infectie van de vrucht, waardoor abortus, partus immaturus of partus prematurus kan volgen. Als het kind levend wordt geboren, kan het ernstig ziek zijn met koorts, hepatosplenomegalie, icterus, anemie, soms een exantheem en zwelling van enkele lymfeklieren. Ongeveer 80% heeft een chorioretinitis (de haarden zijn vaak aan de periferie van de fundus gelokaliseerd). In andere gevallen lijkt het kind bij de geboorte gezond, maar ontstaan na enige maanden tekenen van zware hersenbeschadiging: hydrocefalie, spasticiteit, verlammingen en/of convulsies. Ook deze kinderen hebben vaak een chorioretinitis. De ontstekingshaarden in de hersenen kunnen verkalken en zo zichtbaar worden op röntgenfoto’s van de schedel. De liquor kan afwijkingen vertonen in de zin van een meningo-encefalitis; de lever en milt kunnen vergroot zijn.
Postnataal verkregen toxoplasmose geeft slechts zelden verschijnselen: het meest herkend wordt een koortsige ziekte met malaise, in de hals gelokaliseerde of meer verspreide kleine lymfeklierzwellingen, enige vergroting van lever en milt en soms een maculeus exantheem. Het bloedbeeld toont vaak pathologische lymfocyten. Het ziektebeeld lijkt op mononucleosis infectiosa, maar de reactie van Paul-Bunnell is negatief. Koorts en klierzwellingen verdwijnen geleidelijk, de moeheid kan weken tot maanden duren. Na de infecties blijven cysten latent aanwezig in hersenen, retina en spieren. Chorioretinitis, uveïtis, pneumonitis, myocarditis, cerebrale haarden en meningo-encefalitis kunnen veroorzaakt worden door Toxoplasma gondii en worden vooral gezien bij patiënten met een verminderde weerstand (vooral aids). Bij dit type patiënten betreft het meestal een reactivatie van een latente infectie.
Laboratoriumdiagnostiek
Bepaling van de antistoffen. Ongeveer 60% van de volwassenen is seropositief, zonder klinisch herkende voorafgaande ziekte. Bewijzend voor de acute ziekte is de aanwezigheid van specifieke IgM-antistoffen, evenals een ten minste viervoudige titerstijging van IgG-antistoffen. De IgM-reactie wordt uiteindelijk negatief, terwijl de IgG-titer zeer lang, waarschijnlijk levenslang, positief blijft. Reactivaties kunnen in het algemeen niet serologisch worden aangetoond. Het vervolgen van antistoffen nadat de diagnose is gesteld, heeft geen zin. Na maanden tot jaren dalen deze tot een vrij stabiel niveau.
Bij zuigelingen met congenitale toxoplasmose zijn IgM-antistoffen – die de placenta niet passeren – bewijzend voor een actieve infectie. Een positieve PCR op vruchtwater is ook bewijzend voor infectie. Het aantonen van IgG-antistoffen heeft geen diagnostische waarde, omdat deze passief van moeder op kind worden overgedragen, maar als na één jaar nog steeds IgG-antistoffen aanwezig zijn, is dit wel zeer suggestief voor een congenitale infectie. Ook in de diagnostiek van andere ernstige Toxoplasma-infecties speelt de moleculaire diagnostiek (PCR) een steeds grotere rol. Andere hulpmiddelen voor de diagnose zijn pathologisch-anatomisch onderzoek van een lymfeklier of van ander weefsel, waarbij een min of meer karakteristiek beeld wordt gezien en het micro-organisme soms wordt gelokaliseerd (Figuur 6.25).

Therapie
Bij de verkregen vorm wordt de diagnose meestal zo laat gesteld dat de patiënt reeds aan het herstellen is. Behandeling is overbodig. Bij ernstige infecties (bijvoorbeeld chorioretinitis) geeft men een combinatie van een sulfonamidepreparaat en pyrimethamine, met suppletie van folinezuur. Ook clindamycine blijkt bij toxoplasmose werkzaamheid te hebben. Indien een aidspatiënt cerebrale toxoplasmose ontwikkelt, is na de initiële therapie onderhoudsbehandeling aangewezen.
Complicaties
Zie hiervoor.
Preventie
Bij de preventie lijkt het van belang geen (half)rauw vlees te eten en bij het hanteren van kattenontlasting en bij tuinieren hygiëne te betrachten. Dit is vooral voor zwangeren essentieel. Ter voorkoming van de gevolgen van een primaire infectie bij zwangeren kan therapie met sulfapreparaten en pyrimethamine worden overwogen. Eventueel volgende kinderen kunnen geen congenitale Toxoplasma-infectie krijgen, omdat zij door de verworven immuniteit van de moeder beschermd zijn. Wanneer men bij een vrouw de diagnose toxoplasmose eenmaal heeft gesteld, is er geen bezwaar daarna zwanger te worden.
Casuïstiek
Kattenkrabziekte
Kernpunten
De meest voorkomende manifestatie van kattenkrabziekte is lymfadenopathie.
Bij een gestoorde immuniteit ontstaan ernstige beelden.
Verwekker
Bartonella henselae , een gramnegatief, moeilijk kweekbare bacterie, voor het eerst geïdentificeerd met DNA-technieken.
Besmetting
Door een kattenkrab , zelden door een beet of lik.
Epidemiologie
Veel huiskatten en vooral zwerfkatten zijn asymptomatisch chronisch geïnfecteerd met de bacterie. De kattenvlo speelt bij de besmetting van katten een belangrijke rol.
Incubatietijd
Drie tot vijf dagen.
Klinische verschijnselen
Bij de normale gastheer is de meest voorkomende manifestatie een lymfadenopathie. Na het verstrijken van de incubatietijd ontwikkelt de patiënt een papel of pustel ter plaatse van de krab. Binnen één à twee weken ontstaat een regionale lymfadenitis. Afhankelijk van de initiële laesie bevindt de lymfadenitis zich axillair, cervicaal, pectoraal of inguïnaal. De lymfeklier kan na enige tijd veretteren. Algemene ziekteverschijnselen zijn beperkt (meestal geen koorts, wel malaise). De lymfadenitis persisteert enkele weken.
Een speciale vorm is het syndroom van Parinaud (conjunctivitis en preauriculaire lymfadenopathie), dat ontstaat na inoculatie in de conjunctivale zak.
Bij patiënten met aids en andere stoornissen van de cellulaire immuniteit kan de infectie zich manifesteren als bacillaire angiomatose, een cutane angiomateuze papel, nodus of zelfs een exofytisch groeiende tumor. De afwijking lijkt sterk op het kaposisarcoom. De micro-organismen kunnen bij deze patiënten dissemineren naar organen (lever, milt en CZS), beenmerg en lymfeklieren. In de lever en in de milt kan het beeld van peliosis (vaatmeren) ontstaan.
Laboratoriumdiagnostiek
De diagnose kan worden gesteld door serologie. Het lymfeklierbiopt vertoont een granulomateuze ontsteking en met de zogenoemde whartin-starrykleuring kan het micro-organisme zichtbaar worden gemaakt. Een kweek is zelden positief. Met behulp van de PCR kan de verwekker worden aangetoond. De diagnose bacillaire angiomatose kan histologisch worden gesteld (DD: kaposisarcoom).
Therapie
Over de effectiviteit van antibiotica bij de kattenkrabziekte lopen de meningen uiteen. De lymfadenitis verdwijnt meestal spontaan. Enig effect is gemeld van azitromycine gedurende vijf dagen.
Complicaties
Ook bij de normale gastheer komen uiterst zelden gedissemineerde infecties (meningo-encefalitis, myelitis transversa, granulomateuze hepatitis en andere orgaanlokalisaties) voor.
Preventie
Het voorkomen van infectie bij de kat door adequate vlooienbestrijding is in de praktijk moeilijk.
Casuïstiek
Cytomegalovirusinfectie
Kernpunten
Congenitale cytomegalie leidt tot ernstige afwijkingen.
Bij patiënten met cytomegalovirusinfectie met een verminderde cellulaire afweer ontstaan ernstige ziektebeelden.
Verwekker
Cytomegalovirus (CMV), een herpesvirus.
Besmetting
Via de placenta (intra-uterien) en tijdens (baringskanaal) of na de geboorte (borstvoeding). Op latere leeftijd door contact met CMV-geïnfecteerde urine, speeksel, sperma. Voorts via bloedtransfusies of transplantaties.
Epidemiologie
Primaire infectie van de aanstaande moeder met het CMV kan leiden tot een ernstig ziektebeeld bij het kind. Perinatale infecties komen veel voor, meestal zonder aanleiding te geven tot afwijkingen. Postnatale infecties verlopen in overgrote meerderheid symptoomloos, zodat op de leeftijd van 30 jaar ruim 50% van de bevolking antistoffen tegen het CMV blijkt te hebben. De infectie heeft de neiging tot persistentie en opvlamming vindt plaats bij immuundeficiëntie en -suppressie.
Incubatietijd
Onvolledig bekend; bij posttransfusiecytomegalie vier tot acht weken.
Klinische verschijnselen
De congenitale vorm wordt gekenmerkt door dezelfde ernstige afwijkingen als bij congenitale toxoplasmose en andere congenitale virusinfecties (infecties met rubella- en herpessimplexvirus): onder andere hepatosplenomegalie, trombocytopenie en cerebrale verschijnselen. De verkregen vorm kan verlopen als een mononucleosis infectiosa met een negatieve reactie van Paul-Bunnell. Ook koortsperiodes na openhartoperaties, waarbij veel bloedtransfusies worden toegediend, worden vaak veroorzaakt door een infectie met het cytomegalovirus. Na orgaantransplantaties (bijvoorbeeld nier- en beenmergtransplantaties), waarbij steeds immuunsuppressie bij immuungecompromitteerden nodig is, en bij aids worden dikwijls infecties met het CMV gezien. Het betreft hier meestal een reactivatie. Bij deze patiënten kan men een ernstig ziektebeeld zien met koorts, interstitiële longafwijkingen en soms afwijkingen in andere organen (nieren, lever, darm, bijnieren, hersenen en ogen).
Laboratoriumdiagnostiek
Aantonen van IgM-anti-CMV (ontbreekt vaak bij reactivatie) of van een toename van antistoffen in een serumpaar. Isolatie van het virus uit keel, bronchusspoelsel, urine en eventueel bloed. Een positieve viruskweek van urine of speeksel alléén verschaft niet altijd bewijzende informatie voor een etiologisch verband met de huidige ziekte, omdat na een doorgemaakte infectie de virusuitscheiding periodiek nog lang kan plaatsvinden. Het virus kan ook worden aangetoond met behulp van PCR; in het bijzonder bij patiënten met een ernstig gestoorde immuniteit (bijvoorbeeld na transplantatie) wordt de diagnose gesteld op grond van de bepaling van de hoeveelheid virus (viral load) in plasma of bloed.
Therapie
Algemeen symptomatisch. Aciclovir heeft geen invloed. Afgeleide verbindingen van dit middel, zoals ganciclovir , zijn werkzaam bij bepaalde ernstige CMV-infecties (zoals CMV-retinitis bij aids). Ganciclovir is aanzienlijk toxischer dan aciclovir (granulocytopenie). Een ander middel dat werkzaam is tegen CMV is foscarnet.
Complicaties
Zie hiervoor. Bij immuungecompromitteerde patiënten (onder andere aidspatiënten) een interstitiële pneumonie, colitis en retinitis. Afstoten van een niertransplantaat.
Preventie
Er bestaat geen specifieke preventie. Algemene hygiëne bij het wisselen van luiers en handenwassen, vermijden van transplantatie van organen van seropositieve donors naar seronegatieve recipiënten. Screening van zwangeren op een primaire CMV-infectie moet worden ontraden.
Humaan immunodeficiëntievirusinfecties, hiv (aids en met aids verwante ziektebeelden)
Kernpunten
Hiv verspreidt zich door seksueel contact, via bloed en bloedproducten, door gemeenschappelijk gebruik van naalden en spuiten en congenitaal.
Aids wordt gekenmerkt door een ernstige stoornis in de cellulaire immuniteit (CD4-lymfopenie) met opportunistische infecties.
cART heeft de prognose sterk verbeterd.
Verwekker
Humaan immunodeficiëntievirus (hiv) is een retrovirus, behorend tot de familie der lentivirussen. Men kent thans hiv-1 en hiv-2.
Besmetting
Door seksueel contact, via besmette injectienaalden, bloed en bloedproducten, congenitaal. Het virus heeft grote affiniteit met T-lymfocyten (met name de CD4-subset) en mononucleaire fagocyten. Het CD4-molecuul en de chemokinereceptoren CCR5 en CXCR4 vormen de receptoren voor het virus. Na besmetting met het hiv ontstaat twee tot acht weken later in een aantal gevallen een influenza-achtig, soms pfeifferachtig ziektebeeld (zie verder). Asymptomatische infectie kan jaren blijven bestaan; de infectie gaat uiteindelijk (vrijwel) altijd over in aids . De tijd die verloopt tussen besmetting en het uitbreken van aids kan variëren van zes maanden tot vijftien jaar of meer (mediane tijd circa acht tot tien jaar). Antistoffen tegen hiv (seropositiviteit) kunnen vrijwel altijd drie maanden na de infectie worden aangetoond. In de periode voorafgaande aan de seroconversie is de patiënt al besmettelijk en kan het hiv door middel van PCR in grote hoeveelheid in het bloed worden aangetoond. Deze window-periode (periode tussen besmetting en het moment dat antistoffen tegen het hiv kunnen worden aangetoond) is vooral van belang voor bloed- en orgaandonaties, aangezien gedurende deze periode overdracht van het virus mogelijk is. De besmettelijkheid is in deze periode relatief groot, omdat er veel virus aanwezig is. Ook na de seroconversie blijft het virus onder andere in het bloed aantoonbaar en is de patiënt besmettelijk. In de periode voordat klinische verschijnselen ontstaan, neemt de hoeveelheid hiv toe en daarmee ook de besmettelijkheid van de patiënt. Hiv-positieven die behandeld worden met antiretrovirale middelen en die een lage of onmeetbaar lage concentratie virus (viral load) in het bloed hebben, zijn veel minder besmettelijk (afhankelijk van de hoeveelheid virus).
Epidemiologie
Hiv verspreidt zich door seksueel contact, via bloed en bloedproducten en congenitaal. In Nederland wordt hiv-besmetting vooral gezien onder homo- en biseksuele mannen, migranten uit gebieden waar het virus epidemisch voorkomt (vooral Afrika ten zuiden van de Sahara) en drugsgebruikers. In grote delen van de wereld (onder andere Afrika en Zuidoost-Azië) verspreidt het hiv zich voornamelijk door heteroseksueel contact. Het aantal hiv-geïnfecteerden in Nederland wordt geschat op 22.000 personen. Het merendeel van hen betreft homoseksuele mannen. Bij heteroseksueel geïnfecteerden gaat het vooral om personen afkomstig uit endemische gebieden en hun seksuele contacten. Door de verbeterde therapie is het aantal nieuwe aidspatiënten sterk afgenomen, waardoor dit geen graadmeter meer is voor de verspreiding van het hiv.
Het hiv is aangetoond in veel lichaamsvloeistoffen. In de praktijk blijkt dat alléén transmissie optreedt via bloed, sperma, genitaal slijm van vrouwen en via moedermelk. In het normale maatschappelijke verkeer (ook in de gezinssituatie) is het virus niet overdraagbaar. Er is geen virusoverdracht vastgesteld door insecten, via voedsel of via de luchtwegen. Naast hiv-1-infecties in Centraal- en Oost-Afrika komen in West-Afrika hiv-2-infecties voor. Hiv-2 is minder virulent dan hiv-1; de incubatietijd tot aids is langer en ook de kans op transmissie is lager dan bij hiv-1.
Incubatietijd
Afhankelijk van het ziektebeeld ongeveer één maand (acute infectie) tot (ten minste) vijftien jaar (aids). De gemiddelde tijd tussen seroconversie en aids is acht tot tien jaar.
Klinische verschijnselen
Een acute hiv-infectie (rond het moment van verschijnen van IgG-antistoffen tegen hiv) verloopt in veel gevallen met milde symptomen (een griepachtig beeld). Tijdens dit ziektebeeld komen ook wel hoofdpijn, spierpijn, gewrichtsklachten, maculopapuleuze huidafwijkingen en trombocytopenie voor. Zowel de symptomatische als de asymptomatische acute fase van hiv-infectie kan (na een tijdsverloop variërend van een paar maanden tot een paar jaar) overgaan in een chronisch ziektebeeld, dat zich onder meer kan uiten als een persisterende lymfadenopathie. Sommige patiënten hebben ook andere verschijnselen, zoals nachtzweten, moeheid, splenomegalie, leukopenie, trombocytopenie, seborroïsch eczeem, gordelroos en hardnekkige candidiasis van het mondslijmvlies (Figuur 6.26). In landen waar endemisch tuberculose voorkomt is reactivatie van tbc vaak de eerste manifestatie. Dan zijn er meestal ook immunologische afwijkingen te vinden. Geleidelijk vermindert het aantal CD4-cellen in het bloed verder en ontstaan er ernstiger infecties (Figuur 6.27). Overigens hebben de meeste hiv-geïnfecteerden in de periode na seroconversie gedurende vele jaren geen of vrijwel geen klachten of symptomen, waardoor zij ook niet herkend worden.


Aids is een klinische diagnose en wordt gekenmerkt door een ernstige stoornis in de cellulaire immuniteit, die zich uit in ‘opportunistische’ tumoren, zoals het kaposisarcoom (Figuur 6.28) (zie 10.1007/978-90-368-1841-4_10#Sec52) en het non-hodgkinlymfoom, en ‘opportunistische’ infecties, zoals longontsteking door Pneumocystis jiroveci (vroeger P. carinii) (Figuur 6.29), cytomegalovirusinfectie en ernstige herpessimplexvirusinfectie. Daarnaast worden hardnekkige darminfecties gezien, veroorzaakt door onder andere Cryptosporidium , Mycobacterium avium en cytomegalovirus. Sommige opportunistische pathogenen (bijvoorbeeld Toxoplasma gondii en Cryptococcus neoformans ) geven aanleiding tot infectie van het centrale zenuwstelsel. Een directe infectie van het CZS door het hiv kan leiden tot een snel progressieve encefalopathie, en uiteindelijk ook tot ernstige dementie (aidsdementiecomplex: ADC). Ook tuberculose (zowel pulmonaal als extrapulmonaal) geldt als een aidsdefiniërende ziekte, evenals een recidiverende pneumonie (vooral bij drugsgebruikers) en cervixcarcinoom.


Tabel 6.24 geeft een overzicht van de aandoeningen die, bij hiv-geïnfecteerden, per definitie tot de diagnose aids leiden.
| bacteriële infecties, multipel of recidiverend (kinderen < 13 jaar) |
| candidiasis van bronchi, trachea, longen of slokdarm |
| cervixcarcinoom, invasief |
| coccidioïdomycose, extrapulmonaal of gedissemineerd |
| cryptokokkose, extrapulmonaal |
| cryptosporidiose, > 1 maand durend |
| cytomegalovirusinfectie (anders dan van lever, milt of lymfeklieren) |
| cytomegalovirusretinitis (met visusstoornis) |
| encefalopathie (hiv-gerelateerd) |
| herpes simplex, chronische ulceratie (> 1 maand), of bronchitis, pneumonitis, of oesofagitis |
| histoplasmose, gedissemineerd of extrapulmonaal |
| isosporiasis, > 1 maand durend |
| kaposisarcoom |
| lymfoïde interstitiële pneumonie en/of pulmonale lymfoïde hyperplasie |
| lymfoom, burkitttype, immunoblastair of primair in het CZS |
| Mycobacterium avium‑, Mycobacterium intracellulare- of Mycobacterium kansasi-infectie, gedissemineerd of extrapulmonaal |
| Mycobacterium tuberculosis-infectie, pulmonaal of extrapulmonaal |
| Pneumocystis jiroveci-pneumonie |
| recidiverende pneumonie |
| progressieve multifocale encefalopathie (papovavirus) |
| salmonellasepsis, recidiverend |
| toxoplasmose van het centrale zenuwstelsel |
| cachexie door hiv (wasting) |
Laboratoriumdiagnostiek
Tijdens een acute hiv-infectie zijn de antistoffen vaak nog niet aantoonbaar, en wordt de diagnose gesteld door het aantonen van p24 of HIV-RNA in het bloed. Het verschijnen van IgG-antistoffen tegen het hiv in het bloed (aangetoond met behulp van de ELISA-test) is bewijzend voor de aanwezigheid van een hiv-infectie. Ter uitsluiting van fout-positieve reacties moet een bevestigingstest (western blotting) worden uitgevoerd.
Laboratoriumtests geven een indicatie voor de prognose. De belangrijkste tests zijn de hoeveelheid virus in het bloed (viral load) en het aantal CD4+-T-lymfocyten. Ook kan gekeken worden naar de functie van de lymfocyten.
De opportunistische infecties worden gediagnosticeerd door kweken van onder andere biopten en longlavage (bijvoorbeeld bij infecties met Pneumocystis jiroveci, cytomegalovirus en herpessimplexvirus).
Therapie
Er is een aantal antiretrovirale middelen beschikbaar, die – in combinatie gebruikt – de prognose van een hiv-infectie gunstig beïnvloeden. Deze effectieve combinaties worden met combination antiretroviral treament (cART ) (vroeger: highly active antiretroviral treatment (HAART )) aangeduid. Door een combinatie met verschillende aangrijpingspunten te kiezen, wordt een sterk antiretroviraal effect bewerkstelligd en wordt resistentieontwikkeling van het hiv zoveel mogelijk tegengegaan. In Tabel 6.8a zijn de belangrijkste middelen met hun eigenschappen besproken.
Behandeling wordt thans geïndiceerd geacht voor iedereen met een hiv-infectie, ongeacht het CD4-getal. Bij patiënten met lage CD4-cellenconcentraties (< 0,2 × 109/l) wordt ook primaire profylaxe tegen pneumocystose gegeven (co-trimoxazol of inhalatie van pentamidine).
Preventie
Er is geen vaccin tegen het hiv beschikbaar. Beperking van de verspreiding is te verwachten door vermindering van het aantal seksuele partners, het vermijden van risicovol seksueel gedrag, het gebruik van condooms, het verstrekken van steriel injectiemateriaal aan injecterende drugsverslaafden, en screening van donorbloed ter vermijding van aan zieken toe te dienen besmette bloedproducten. De recente strategie om iedere hiv-patiënt te behandelen draagt ook bij aan daling van verspreiding: een goed behandelde hiv-patiënt is vrijwel niet besmettelijk meer (Treatment as prevention, TasP).
Casuïstiek
Gonorroe
Verwekker
Neisseria gonorrhoeae (gonokok), een gramnegatieve intracellulaire diplokok .
Besmetting
Vrijwel altijd van mens op mens via de genitale weg, kan ook bij anaal en oraal seksueel contact worden overgedragen. Zeldzaam bij neonaten: ooginfectie (via geïnfecteerd baringskanaal).
Epidemiologie
Deze sterk infectieuze ziekte kan zich onder seksuele partners snel verbreiden. Opsporing daarvan is gewenst. Overdracht via toiletten, handdoeken en dergelijke speelt geen rol, omdat de gonokok buiten de menselijke slijmvliezen niet overleeft.
Incubatietijd
Twee dagen tot twee weken (gemiddeld één week).
Klinische verschijnselen
Bij de man: 90% is symptomatisch met branderige mictie met groengele uitvloed (écoulement) uit de penis (‘druiper’). Bij de vrouw is het spectrum van de symptomatologie breder: asymptomatisch (circa 40%), ofwel mictieklachten met fluor, eventueel bartholinitis en bij ongeveer 10% het beeld van pelvic inflammatory disease (PID; koorts, algemeen ziek-zijn, pijn in de onderbuik eventueel met défense musculaire en slingerpijn bij het toucher), vroeger salpingitis genoemd. Het risico op PID is groter als gevolg van intra-uteriene ingrepen (plaatsen van spiraal en abortus provocatus). Faryngeale en anale gonorroe geven minder verschijnselen en genezen vaak ook zonder behandeling.
Laboratoriumdiagnostiek
In een grampreparaat van de uitvloed zijn de gramnegatieve intracellulaire diplokokken te zien. Materiaal voor gonokokkenkweek dient in een speciaal transportmedium te worden afgenomen, dan wel direct op de juiste platen te worden geënt. Tegenwoordig wordt vaak de voorkeur gegeven aan DNA-amplificatietechnieken, die een grote gevoeligheid hebben. Nadeel hiervan is dat men geen informatie over de antimicrobiële gevoeligheid van de stam krijgt. Dubbelinfectie met Chlamydia trachomatis is niet zeldzaam; hiervoor dient materiaal (pus, urine) in een apart transportmedium te worden vervoerd. Iemand die gonorroe krijgt, heeft onveilig seksueel contact gehad. Dat betekent dat men afhankelijk van de risico-inschatting ook serologie op syfilis en hiv moet inzetten.
Therapie
Gezien de toenemende resistentie van gonokokken voor penicillinen en chinolonen (bijna 40%) is het doen van een kweek en gevoeligheidsbepaling aangewezen. De behandeling van eerste keus is thans ceftriaxon i.m.
Complicaties
Een zeldzame complicatie van gonokokkeninfectie bij de vrouw is de perihepatitis bij PID (koorts, pijn in bovenbuik, eventueel schouderpijn; klassiek hoort men perihepatisch wrijven (syndroom van Fitz-Hugh-Curtis )). Dit laatste kan ook door Chlamydia veroorzaakt worden. Bij de man: prostatitis en epididymitis en bij langdurig onbehandelde infectie stricturen in de urethra. Eveneens zeldzaam is de gedissemineerde gonorroïsche infectie (DGI), waarbij er klassiek koorts is met tendinitis of artritis, met name van de knie, en discrete huidafwijkingen, meestal aan de acra. De gonokok wordt of in een biopt of in een bloedkweek aangetroffen. Infectie tijdens de zwangerschap kan leiden tot septische abortus, chorioamnionitis, te vroeg gebroken vliezen en endometritis.
Preventie
De belangrijkste factor bij de preventie is ‘veilige seks’. In de bestrijding zijn partneronderzoek en contactopsporing van belang.
Casuïstiek
Syfilis (syn.: lues)
Verwekker
Treponema pallidum , een gramnegatieve spirocheet die eruitziet als een kurkentrekker en niet kweekbaar is in vitro .
Besmetting
Vrijwel altijd van mens op mens via de genitale weg; kan ook bij anaal en oraal seksueel contact worden overgedragen. Ook overdracht op de huid is mogelijk. Verticale transmissie (lues congenita) komt sinds de invoering van de serologische screeningstest in de zwangerschap weinig voor. Overdracht via transfusie is mogelijk maar zeer zeldzaam.
Epidemiologie
Dit sterk infectieuze agens dringt binnen via kleine laesies ontstaan bij seksueel contact en kan zich onder seksuele partners snel verbreiden. De incidentie neemt de laatste jaren in de westerse wereld toe. Opsporing van patiënten is gewenst. Doordat bij patiënten met hiv-infectie gemakkelijker transmissie van syfilis optreedt en er bij hiv meer neurosyfilis optreedt, is aandacht voor syfilis bij hiv-geïnfecteerden van groot belang.
Incubatietijd
Gemiddeld drie weken (10-90 dagen). De infectie verloopt in stadia. Het tweede stadium ontstaat één tot zes maanden na de besmetting. Het derde stadium ontstaat 2-30 jaar na de besmetting.
Klinische verschijnselen
Eerste stadium: de infectie begint met een niet-pijnlijk ulcus op de geslachtsorganen (eventueel rectum, orofarynx); het ulcus heeft klassiek een harde bodem (ulcus durum, harde sjanker, zogenoemd primair affect) en gaat gepaard met een niet-pijnlijke zwelling van de regionale lymfeklieren (indolente bubonen). Dit stadium gaat, afhankelijk van behandeling of geen behandeling, sneller of langzamer (zes weken) voorbij. Hierop volgt bij onbehandelden een latente fase (lues latens). Secundaire syfilis ontstaat door hematogene verspreiding van de spirocheten. De belangrijkste manifestaties zijn niet-jeukende huidafwijkingen, meest klassiek als een gegeneraliseerd maculopapuleus exantheem, waarbij handpalmen en voetzolen betrokken zijn (dit laatste ziet men ook bij de primo-hiv-infectie). Soms zijn er slijmvliesafwijkingen en/of condylomata lata: verheven laesies aan anus en/of genitalia (niet te verwarren met condylomata acuminata, veroorzaakt door humaan papillomavirus). Alle laesies bevatten spirocheten en zijn besmettelijk, maar dat geldt in het bijzonder voor de condylomata. Een ander typisch verschijnsel is de pleksgewijze (moth-eaten) alopecia. Daarnaast is er vaak malaise, koorts, spierpijn en gegeneraliseerde lymfadenopathie. Zeldzamer zijn hepatitis, meningitis en botafwijkingen. Omdat secundaire syfilis qua manifestaties (vooral wat betreft de huidafwijkingen) zeer variabel is en op andere ziekten kan lijken, wordt het beeld klassiek la grande simulatrice genoemd. Zonder behandeling treedt er opnieuw een latentieperiode in die jaren kan duren. Uiteindelijk kan tertiaire syfilis ontstaan. De uitingsvormen hiervan zijn:
gummata: nodeuze nodulaire proliferatieve ontstekingen die in huid, slijmvliezen, botten en inwendige organen voorkomen en zich als ruimte-innemende processen gedragen;
neurosyfilis, met verschillende manifestaties, zoals meningitis, vasculitis, gummata, tabes dorsalis (uitval van de achterstreng met gevoelsstoornissen en pijnen) en dementia paralytica; tabes en dementia paralytica zijn zeer late manifestaties;
cardiovasculaire syfilis (na 20-30 jaar): vorming van een aneurysma van de aorta ascendens en aortaklepinsufficiëntie.
Laboratoriumdiagnostiek
Bij de verdenking op primaire syfilis worden de laesies uitgestreken en het materiaal bekeken met donkerveldmicroscopie en eventueel directe immunofluorescentie. Indien beschikbaar wordt een PCR gedaan. Zeker in het tweede en derde stadium is klinisch aan syfilis denken van groot belang. De serologie heeft een hoge specificiteit en sensitiviteit. De belangrijkste serologische reacties zijn:
TPPA (een specifieke, maar wat minder gevoelige test die 3-4 weken na infectie positief wordt; wordt gebruikt als opsporingstest);
FTA-Abs (specifieke test die vroeg positief wordt; wordt gebruikt als bevestigingsreactie);
westernblottest (immunoblot, kan ook als bevestigingstest worden gebruikt, antistoffen in serum worden aangetoond op een teststrip met T. pallidum-antigenen);
VDRL of RPR (een niet heel specifieke, maar wel gevoelige test; positief na 4-8 weken; fout-positiviteit bijvoorbeeld bij zwangerschap, antifosfolipidesyndroom en SLE). Deze test is maat voor de activiteit van de ziekte en wordt gebruikt om respons op therapie te vervolgen en ook om een recidief aan te tonen.
Therapie
Bij het eerste en tweede stadium en in de latente fase is behandeling van eerste keuze benzylpenicilline in de vorm van het depotpreparaat benzathinepenicilline. Bij neurosyfilis wordt intraveneus benzylpenicilline gegeven. De doseringsschema’s en behandelingsduur verschillen afhankelijk van de fase (en eventueel aanwezigheid van hiv-infectie) en vallen buiten het bestek van dit boek. Het alternatief doxycycline is duidelijk minder effectief. Het effect van de antibiotische behandeling wordt mede afgemeten aan het dalen en negatief worden van de titer in de VDRL-test. Controle is zeer belangrijk.
De penicillinebehandeling wordt bij vroege syfilis niet zelden gecompliceerd door de jarisch-herxheimerreactie, een door cytokinen gemedieerde reactie op vrijkomende bacteriële producten: binnen twee dagen ontstaat er koorts, spierpijn en leukocytose.
Complicaties
Syfilis in de zwangerschap kan leiden tot congenitale syfilis met abortus of intra-uteriene vruchtdood, of ernstige congenitale afwijkingen.
Preventie
De belangrijkste factor bij de preventie is ‘veilige seks’ (en advies daarover). In de bestrijding zijn partneronderzoek en contactopsporing van belang. Serologisch onderzoek van zwangeren en bloeddonors is aangewezen.
Casuïstiek
Difterie
Kernpunt
Difterie is in Nederland een zeer zeldzame importziekte, dankzij het Rijksvaccinatieprogramma.
Verwekker
Corynebacterium diphtheriae.
Besmetting
Druppelinfectie.
Epidemiologie
Door een consequent uitgevoerde immunisatie is difterie in Nederland een zeer zeldzame ziekte geworden; ze wordt nog een enkele keer aangetroffen bij (niet-geïmmuniseerde) kinderen van buitenlandse werknemers. Ook met importgevallen uit andere gebieden moet rekening worden gehouden, bijvoorbeeld uit Oost-Europa, waar zich de afgelopen jaren duizenden gevallen hebben voorgedaan. De epidemiologie werd bepaald door een groot aantal subklinische infecties en tijdelijke en chronische bacteriedragers.
Incubatietijd
Twee tot vijf dagen, soms langer.
Klinische verschijnselen
Keeldifterie: membraneus beslag met necrotiserende ontsteking in de oppervlakkige lagen van het epitheel van de tonsillen, farynxbogen, farynxachterwand en palatum. Het beslag is vuilgrijs van kleur, laat aan de randen wat los en bloedt enigszins bij pogingen tot afstrijken. De temperatuurverhoging is gering. De keelpijn is niet hevig. De halsklieren zijn gezwollen, soms met veel collateraal oedeem (‘burgemeesterskraag’). De difteriebacteriën vormen exotoxinen die gevaarlijke complicaties kunnen veroorzaken: myocarditis, verlammingen door uitval van hersenzenuwen en polyneuropathie. Larynxdifterie: geleidelijk toenemende heesheid, blafhoest, motorische onrust en stridor, vooral inspiratoir. Huiddifterie: wordt soms gezien bij patiënten (in het bijzonder zwemmers) met eczeem en met ulcera cruris. In de tropen komt huiddifterie veel voor. Ook jongeren op trektocht door de tropen acquireren – ondanks een goede immuniteit voor difterie – door het lopen op blote voeten in een enkel geval huiddifterie.
Laboratoriumdiagnostiek
Difteriebacteriën kunnen met behulp van speciale media worden gekweekt uit keel en neus, soms van de huid.
Therapie
10.000-20.000 E difterieantitoxine i.v. (na uitsluiten van overgevoeligheid door een huidtest met 0,2 ml intracutaan) en erytromycine 2 g/24 uur per os (30 mg/kg lichaamsgewicht voor kinderen). Bij levensbedreigende kroep: tracheotomie en stomen; verder als hiervoor. Bij myocarditis: zie 10.1007/978-90-368-1841-4_15#Sec105. Dragers: erytromycine gedurende veertien dagen.
Preventie
De preventie bestaat uit de reeds genoemde vaccinatie van daarvoor in aanmerking komende zuigelingen en oudere kinderen (op de leeftijd van 2, 3, 4 en 11 maanden één injectie van 1 ml DKTP-vaccin i.m.; op de leeftijd van 4 en 9 jaar volgt een DTP-herhalingsinjectie).
Casuïstiek
Bof (parotitis epidemica)
Kernpunt
Bofvaccinatie heeft het vóórkomen van bof sterk verminderd.
Verwekker
Bofvirus.
Besmetting
Aerogeen.
Epidemiologie
Wanneer er niet wordt gevaccineerd, wordt de epidemiologie van bof in belangrijke mate bepaald door een groot aantal subklinische infecties. Op de leeftijd van 4 jaar heeft dan reeds 40% van de kleuters aantoonbare antistoffen tegen bof. Naar men aanneemt, verloopt de infectie bij circa 35% zonder klinische verschijnselen. De besmettelijkheid is waarschijnlijk niet minder dan die van de andere infectieziekten op de kinderleeftijd.
Incubatietijd
Twee tot drie weken.
Klinische verschijnselen
De ziekte begint met koorts en pijn bij het kauwen, spoedig gevolgd door een pijnlijke zwelling van één of beide oorspeekselklieren. Ook de glandulae submandibulares zijn vaak gezwollen. De glandulae sublinguales zijn meestal niet bij het ziekteproces betrokken. Soms worden de klieren achtereenvolgens getroffen, steeds met een hernieuwde stijging van de lichaamstemperatuur. Bij inspectie van het wangslijmvlies zijn de uitmondingen van de ductus parotidei vaak als rode stipjes te zien en is daar wat sereus vocht uit te drukken. Soms is slechts één klier aangedaan. Betreft dit de glandula submandibularis, dan bestaat de kans dat ten onrechte een lymfadenitis wordt gediagnosticeerd, hoewel lymfeklieren in de hals meer naar achteren gelokaliseerd zijn bij de kaakhoek.
Laboratoriumdiagnostiek
Het bofvirus is met PCR of kweek aan te tonen in het speeksel en de keeluitstrijk, voorts in de urine en, als er een meningitis bestaat, ook in de liquor cerebrospinalis. De antistoffen in het bloed nemen toe en er zijn specifieke IgM-antistoffen aantoonbaar. Het amylasegehalte in bloed en urine kan verhoogd zijn.
Therapie
Symptomatisch.
Complicaties
Orchitis , meestal eenzijdig, bij ongeveer een kwart van door de ziekte getroffen adolescenten en volwassenen. De vruchtbaarheid lijdt er vrijwel nooit onder. Andere complicaties: strak aanvoelend, pijnlijk oedeem van de huid van de hals en bovenste gedeelte van de borst, lichte pancreatitis, oöforitis, zelden epididymitis, mastitis – ook bij mannen – myocarditis, eenzijdige blijvende doofheid en andere geïsoleerde hersenzenuwaandoeningen, frequent lymfocytaire meningitis, zeldzamer encefalitis.
Preventie
Vaccinatie tegen bof is mogelijk met een verzwakt levend virusvaccin. De door dit vaccin opgewekte immuniteit is waarschijnlijk van lange duur. Het bofvaccin kan worden gecombineerd met andere verzwakte levende vaccins, zoals die tegen mazelen en rubella. Sinds 1 januari 1987 worden via het Rijksvaccinatieprogramma kinderen op de leeftijd van 14 maanden en 9 jaar met een combinatievaccin tegen bof, mazelen en rubella geïmmuniseerd. Sindsdien is bof vrijwel verdwenen uit Nederland; men ziet af en toe nog uitbraken bij ongevaccineerden (antroposofen, bevindelijk gereformeerden) en een enkele keer bij andere groepen.
Casuïstiek
Kinkhoest (pertussis)
Kernpunten
Ondanks vaccinatie komt kinkhoest in Nederland voor, ook bij volwassenen.
Kenmerkend zijn de typische hoestbuien.
Verwekker
Bordetella pertussis .
Besmetting
Druppelinfectie, aerogeen.
Epidemiologie
Ondanks systematische vaccinatie met het DKTP-vaccin, komt kinkhoest in Nederland vrij veel voor. De verklaring voor dit voorkomen is complex. De immunogeniciteit van het whole-cell-vaccin dat tot voor kort werd gebruikt, is beperkt en B. pertussis heeft een mutatie van een van de virulentiefactoren (het pertactin) ondergaan, waardoor dit vaccin beperkte bescherming biedt. Inmiddels is een nieuw acellulair vaccin in gebruik en wordt een boosterinjectie aan vierjarigen gegeven. In Nederland zijn ziektegevallen veroorzaakt door Bordetella parapertussis zeer zeldzaam. Het gebruikte vaccin beschermt niet tegen deze bacterie.
Incubatietijd
Een tot drie weken, soms langer.
Klinische verschijnselen
Het kenmerkende van kinkhoest zijn de typische hoestbuien, waarin een reeks achtereenvolgende, krampachtige expiratiestoten wordt beëindigd door een gierende inspiratie of – bij een zuigeling – door klaaglijk huilen. Klassiek zijn drie klinische fasen te onderscheiden: de catarrale fase, de paroxismale fase en de reconvalescentiefase. Na een catarraal of prodromaal stadium, dat een à twee weken duurt, volgt het verscheidene weken durende stadium van paroxismaal hoesten, ook wel stadium convulsivum genoemd. Dit stadium wordt gekenmerkt door hevige, plotseling opkomende hoestbuien die gepaard gaan met gierende inspiraties en productie van veel slijm. Vaak braakt de patiënt ook. Tijdens de reconvalescentiefase verdwijnen de aanvallen geleidelijk.
Laboratoriumdiagnostiek
Bordetella pertussis is tijdens het catarrale stadium, dat drie à vier weken duurt, te kweken uit farynx- en diepe neusuitstrijken. De kweken vereisen speciale voedingsbodems. Een PCR is in deze fase gevoeliger en heeft daarom tegenwoordig de voorkeur. Het bloedbeeld vertoont een leukocytose, soms wel 30 × 109/l en meer, met een relatieve en absolute lymfocytose. De laatste jaren zijn de serologische methoden voor de diagnostiek verbeterd (specifieke IgA, IgM en IgG). Specifieke IgA-antistoffen ontstaan uitsluitend na het doormaken van een infectie met B. pertussis en niet na vaccinatie. Serologie is zowel vroeg als laat in de infectie bruikbaar.
Therapie
Antibiotica beïnvloeden het verloop niet. Belangrijk is het handhaven van een goede vochtbalans en voedingstoestand. Dit lukt meestal wel door voorzichtige, frequente toediening van vocht en een licht verteerbaar dieet in de periodes tussen de aanvallen. Stikbuien gaan meestal spontaan voorbij; de behandeling is symptomatisch.
Complicaties
Bronchopneumonie en longcollaps, encefalopathie.
Preventie
Met het DKTP-vaccin wordt een hoge vaccinatiegraad bereikt (zie onder Epidemiologie). In Nederland wordt bij de DKTP-vaccinatie op de leeftijd van 2, 3, 4 en 11 maanden en op vierjarige leeftijd een acellulair vaccin gebruikt.
Extrapulmonale tuberculose
Kernpunten
Extrapulmonale tuberculose is meestal een endogene reactivatie van postprimaire tuberculose.
De diagnostiek bij extrapulmonale tuberculose is moeilijk, maar duidelijk verbeterd door de beschikbaarheid van PCR.
Verwekker
Mycobacterium tuberculosis of Mycobacterium bovis.
Besmetting
De pathogenese van extrapulmonale tuberculose en pulmonale tuberculose komt grotendeels overeen (zie 10.1007/978-90-368-1841-4_16#Sec114). Extrapulmonale tuberculose ontstaat als primaire tuberculose wanneer tuberkelbacillen zich niet primair in de luchtwegen nestelen, maar via de mond de tonsillen, de halsklieren en/of de darm bereiken. Toen de veestapel nog niet vrij van tuberculose was en koemelk nog niet werd gepasteuriseerd, was deze vorm van tuberculose ook in Nederland niet zeldzaam; de verwekker was dan meestal M. bovis. Tegenwoordig is primaire extrapulmonale tuberculose zeldzaam.
Bij de meeste gevallen van extrapulmonale tuberculose gaat het om postprimaire tuberculose. Tijdens of na deprimaire tuberculose (pulmonaal of extrapulmonaal) hebben mycobacteriën zich langs hematogene of lymfogene weg verspreid naar andere organen. Een massale disseminatie treedt op tijdens miliaire tuberculose (zie 10.1007/978-90-368-1841-4_16#Sec114). Het gaat hierbij vooral om disseminatie naar lymfeklieren, pleuraholte, buikholte, hersenvliezen, skelet, gewrichten, nieren, uterus, epididymis, testis en prostaat.
Extrapulmonale tuberculose manifesteert zich vooral wanneer endogene reactivatie van tuberkelbacillen optreedt. Het is niet altijd duidelijk hoe deze reactivatie tot stand komt, maar niet zelden is een vermindering van de cellulaire immuniteit duidelijk aanwijsbaar. Immuunsuppressieve therapie, ondervoeding en infectie met het humaan immunodeficiëntievirus kunnen door vermindering van de cellulaire immuniteit reactivatie bewerkstelligen.
Epidemiologie
De laatste jaren is het aandeel van de postprimaire extrapulmonale tuberculose in de tuberculoseproblematiek toegenomen. De oorzaken zijn niet duidelijk, hoewel de hiv-epidemie een factor lijkt te zijn.
Klinische verschijnselen
Lymfekliertuberculose kan zich op vele plaatsen voordoen: soms als een gelokaliseerde lymfadenopathie (bijvoorbeeld aan de hals), soms op meer stations. De ontstekingsverschijnselen zijn meestal gering (‘koud abces’). Voor tuberculeuze pleuritis wordt verwezen naar 10.1007/978-90-368-1841-4_16#Sec114. Tuberculeuze peritonitis is een moeilijke diagnose. Koorts, algemeen ziek-zijn, vermagering en buikverschijnselen met enige ascites zijn de belangrijkste verschijnselen. Voor de diagnose is meestal een laparoscopie nodig. Voor tuberculeuze meningitis zie ▶ par. 6.6.2. Tuberculose van het skelet betreft meestal de wervelkolom (spondylodiscitis) en zeldzamer de metafysen van lange pijpbeenderen. Behalve pijn is de symptomatologie meestal beperkt. Ook bij tuberculeuze artritis is de symptomatologie meestal beperkt tot pijn en zwelling, met weinig algemene ziekteverschijnselen. Niertuberculose uit zich meestal met dysurie, hematurie en soms met een pijnlijke nierloge. Ureterobstructie is een gevreesde complicatie. Genitale tuberculose bij de vrouw uit zich met menstruatiestoornissen, pijn in het kleine bekken en infertiliteit. Bij de man is tuberculose van epididymis, testis of prostaat vaak zeer symptoomarm. Het is niet ongewoon dat de vaste epididymis of testis bij lichamelijk onderzoek toevallig wordt ontdekt.
Laboratoriumdiagnostiek
Het aantonen van mycobacteriën in een direct preparaat en in een löwensteinkweek is de hoeksteen van de diagnostiek. De diagnostiek is moeilijk, doordat het aantal bacteriën bij extrapulmonale tuberculose vaak laag is, maar de beschikbaarheid van moleculaire diagnostiek (PCR) heeft deze sterk verbeterd. Histologisch onderzoek is vaak onmisbaar. Het is soms nodig een biopsie te herhalen. Ascitesvocht heeft evenals pleuravocht een relatief lage opbrengst; de opbrengst van een biopt is aanzienlijk hoger. Ook een synoviabiopt heeft een hogere opbrengst dan onderzoek van het exsudaat. Wanneer de diagnose niet gemakkelijk blijkt te kunnen worden gesteld, is het aan te bevelen ook andere specimina (sputum, beenmerg, bloed, eventueel leverbiopt) op mycobacteriën te onderzoeken. De mantouxtest (tuberculine huidtest) is van belang, maar is vaak negatief bij een verminderde cellulaire immuniteit (anergie). De Interferon-Gamma Release Assay (IGRA) meet de in-vitrorespons van T-cellen op antigenen van het M. tuberculosis complex, behalve Mycobacterium bovis BCG. De IGRA-respons vertoont, in tegenstelling tot de mantouxtest, geen kruisreactiviteit met de BCG-vaccinatie voor tuberculosis. De IGRA-respons differentieert niet tussen latente infectie en actieve tuberculosis. Bij skelettuberculose en niertuberculose is het röntgenonderzoek dikwijls karakteristiek, maar gezien de lage frequentie van de ziekte is de overweging tuberculose bij de radioloog niet altijd vanzelfsprekend.
Therapie
Als bij longtuberculose. Bij werveltuberculose is vaak chirurgische therapie nodig voor een goed behandelingsresultaat. De hiervoor benodigde specialistische kennis is helaas schaars.
Preventie
Zie 10.1007/978-90-368-1841-4_16#Sec114.
Casuïstiek
Infectieziekten met geelzucht
Hepatitis als uiting van mononucleosis infectiosa en infecties met het cytomegalo‑, herpessimplex- en rubellavirus zijn reeds ter sprake gekomen. Vooral bij pasgeborenen kunnen deze laatste virussen oorzaak zijn van ernstige ziekten. Ook bij patiënten met en bij patiënten zonder stoornissen van het immuunsysteem leiden enkele van de hiervoor genoemde virussen tot leverontsteking. Daarnaast kan geelzucht met koorts een gevolg zijn van een infectie met het hepatitis A- of hepatitis B-virus en van hepatitis C, D en E. Deze ziekten worden door verschillende virussen veroorzaakt. Zie voor een gedetailleerde bespreking 10.1007/978-90-368-1841-4_18#Sec62. Bacteriële infecties veroorzaken zelden hepatitis; een uitzondering is leptospirose.
Leptospirosen
Kernpunten
Leptospirosen zijn zoönosen.
Hoofdpijn, hoge koorts, conjunctivitis en opvallende spierpijnen moeten aan leptospirose doen denken.
Leptospirosen zijn zoönosen; wij zullen hier de ziekte van Weil uitgebreider bespreken. Andere leptospiren die in Nederland ziekten kunnen verwekken, zijn Leptospira canicola, Leptospira grippotyphosa en Leptospira hardjo. De eerste is afkomstig van honden en varkens, de tweede van veldmuizen en de derde van runderen. Leptospira grippotyphosa veroorzaakt zogenoemde modderkoorts, met hoofdpijn en spierpijnen en soms met exanthemen. Er zijn wel leverbiochemiestoornissen, maar icterus is zelden zichtbaar. De nierfunctie kan eveneens gestoord zijn. Leptospira hardjo veroorzaakt een griepachtig beeld, voornamelijk bij veehouders en hun gezinsleden.
De ziekte van Weil
Verwekker
Leptospira icterohaemorrhagiae.
Besmetting
Het is een ziekte van de bruine rat. De leptospiren komen met de urine vrij in zoet water en dringen door de slijmvliezen van oog en neus en wellicht ook via (on)beschadigde huid de mens binnen.
Epidemiologie
De ziekte van Weil wordt verkregen door contact met oppervlaktewater dat is verontreinigd door leptospirenhoudende urine van ratten. Het aantal ratten dat leptospiren in de urine uitscheidt, varieert naar plaats en leeftijd en kan 50% bedragen. De ziekte komt het meest voor bij personen die in verontreinigd oppervlaktewater zwemmen, bij drenkelingen, rioolwerkers en landarbeiders (handen wassen in sloten).
Incubatietijd
Ongeveer tien dagen, soms korter.
Klinische verschijnselen
Meestal is het begin acuut met rillerigheid, hoofdpijn, hoge koorts en opvallende spierpijnen, vooral in de kuiten. De urine wordt donker en de hoeveelheid per 24 uur lijkt af te nemen. De koorts kan na twee tot vijf dagen verminderen, maar de patiënt wordt zieker, vaak wat suf en er ontstaat een icterus. Bij onderzoek in dit stadium maakt de patiënt een zieke indruk, heeft een snelle weke pols met lage tensie, een icterus met oranje bijtint, conjunctivale vaatinjectie, donkere urine met eiwit- en sedimentafwijkingen in de vorm van erytrocyten en cilinders, terwijl ook de reacties van urobiline en bilirubine positief zijn. De lever is drukpijnlijk en vergroot; slechts zelden is de milt palpabel. Vaak wordt ook nekstijfheid geconstateerd ten gevolge van een sereuze meningitis, die in de tweede ziekteweek altijd wordt gevonden. De huid kan vluchtige exanthemen vertonen, soms hemorragisch, vooral in de ernstige gevallen. De nieraandoening kan leiden tot anurie, hetgeen vaak de doodsoorzaak is. Wordt de anurie behandeld, dan kan de lever nog een rol spelen bij een fataal verloop.
Minder ernstige gevallen komen vaker voor; deze verlopen soms met het beeld van een koortsende ziekte met kuitpijnen, conjunctivale vaatinjectie, lymfocytaire meningitis en slechts geringe nier- en leverafwijkingen.
Laboratoriumdiagnostiek
In de eerste ziekteweek kunnen de leptospiren uit bloed gekweekt worden, vanaf de tiende ziektedag ook uit urine. Leptospiren kunnen eveneens uit liquor gekweekt worden (vanaf de vierde tot de tiende ziektedag). Na de eerste ziekteweek kan de diagnose gesteld worden met serologische tests, waarbij het aantonen van een titerstijging in twee serummonsters van belang is. Het eerste monster wordt bij voorkeur voor de tiende ziektedag afgenomen, het tweede een à twee weken later. Men vindt verder tekenen van nefritis met uremie, leverbiochemiestoornissen en trombocytopenie. De liquorafwijkingen zijn hiervoor reeds genoemd. Vaak bestaan ook een leukocytose (granulocytose) en een sterk en langdurig verhoogde bezinkingssnelheid van de erytrocyten.
Therapie
In de eerste ziektedagen geeft men penicilline, maar invloed hiervan op het ziekteverloop is niet bewezen. De prognose van de ernstige gevallen is verbeterd door behandeling van de nierinsufficiëntie met behulp van dialyse.
Complicaties
Anurie, leverinsufficiëntie en bloedingen. Na verbetering vanaf de derde ziekteweek vaak iridocyclitis, voorts myocarditis.
Preventie
Het aantal gevallen van de ziekte van Weil is de laatste jaren sterk gedaald. Men neemt aan dat een toenemende (chemische) verontreiniging van het oppervlaktewater de overlevingskans van de leptospiren nadelig beïnvloedt.
[Kliniek]Intermezzo 6.6 Een patiënt met koorts, spierpijn en geelzucht na een kanovakantie
Een 39-jarige man komt terug van een kampeer- en kanovakantie aan de Franse rivier de Tarn. Hij is tijdens de vier dagen van zijn vakantie ziek geworden, met koorts, hevige hoofdpijn en spierpijnen in de kuiten. Bij lichamelijk onderzoek maakt hij een zieke indruk. Hij heeft een lichte conjunctivitis en is licht icterisch. Hij is niet nekstijf. Aan huid en slijmvliezen worden verder geen afwijkingen gevonden. De lever is net palpabel.
Op grond van het klinische beeld wordt aan een leptospirose gedacht. Het laboratoriumonderzoek is hiermee compatibel: CRP 125 U/l. Er is een leukocytose (12,9 × 109/l met 80% granulocyten). Het Hb is 6,8 mmol/l. De trombocyten zijn 120 × 109/l. Het CPK is tweemaal verhoogd, het ALAT en het LDH ruim driemaal.
Het serumcreatinine bedraagt 203 µmol/l. De urine bevat eiwit met een enkele erytrocytencilinder. In een donkerveldpreparaat van de urine worden geen Leptospira aangetroffen. De patiënt wordt onder de diagnose leptospirose behandeld met benzylpenicilline. De serologie blijkt later bewijzend voor een infectie met Leptospira icterohaemorrhagiae.
Casuïstiek
Opportunistische infecties
Kernpunten
De opportunistische infecties zijn afhankelijk van de aard van het afweerdefect.
Een longinfiltraat met koorts bij een patiënt met een verminderde afweer is een moeilijk klinisch probleem.
Met opportunistische infecties worden de infecties aangeduid die men bij patiënten met een verminderde weerstand kan aantreffen. De veroorzakers zijn micro-organismen (opportunisten) die gebruik weten te maken van de stoornis in de afweer. Dit soort micro-organismen veroorzaakt over het algemeen geen (ernstige) infecties bij patiënten met een normale afweer.
De afweer tegen infecties kan door veel ziekteprocessen ernstig verstoord raken. Ook veel therapeutische interventies kunnen interfereren met de afweer. De verstoringen van de afweer zijn vaak discreet. Daardoor is de infectieproblematiek die daarvan het gevolg is vaak voorspelbaar. De relatie tussen type afweerstoornis en ziekteverwekker is weergegeven in Tabel 6.25. Figuur 6.30 en Figuur 6.6 tonen respectievelijk pneumonie door een Aspergillus-infectie en ecthyma gangraenosum, kenmerkende complicaties bij patiënten met neutropenie.
| afweerstoornis | infectieuze agentia |
|---|---|
| beschadiging oppervlak | koloniserende (endogene) flora, exogene flora |
| humorale afweerstoornis | |
| – complementdeficiëntie | |
| • C1-C4 | Haemophilus influenza |
| pneumokokken | |
| Staphylococcus aureus | |
| • C6-C9 | meningokokken |
| gonokokken | |
| – immunoglobulinedeficiëntie | Haemophilus influenzae |
| pneumokokken | |
| Campylobacter jejuni | |
| Salmonella spp. | |
| ECHO-virussen | |
| tekort aan fagocyterende cellen | grampositieve kokken |
| aerobe gramnegatieve staven | |
| fungi (Candida, Aspergillus) | |
| herpessimplexvirus | |
| gestoorde cellulaire immuniteit | herpessimplexvirus |
| varicellazostervirus | |
| cytomegalovirus | |
| Listeria monocytogenes | |
| Salmonella spp. | |
| Legionella sp. | |
| mycobacteriën | |
| Nocardia sp. | |
| Cryptococcus neoformans | |
| Histoplasma capsulatum | |
| Pneumocystis jeroveci | |
| Toxoplasma gondii | |
| Leishmania sp. | |
| Strongyloides stercoralis |

Afweerstoornissen zijn aangeboren of verworven. De aangeboren afweerstoornissen (primaire immuundeficiënties) zijn relatief zeldzaam. De verworven afweerstoornissen zijn het gevolg van virusinfecties (infectie met het humaan immunodeficiëntievirus, cytomegalovirus), van een onderliggende maligniteit (bijvoorbeeld de ziekte van Hodgkin) en andere ziekten (diabetes mellitus, reumatische ziekten), of van behandeling met immuunsuppressiva, bestraling of beenmergtransplantatie. Voedingstoestand, ijzerstatus en leeftijd (neonatale periode, ouderen) bepalen in belangrijke mate de kwaliteit van de afweer.
Welke aspecten van de afweer bij verschillende ziekten of behandelingen gestoord raken, is weergegeven in Tabel 6.26. In deze tabel zijn niet opgenomen stoornissen in de eerste verdedigingslinie: de intacte huid en slijmvliezen met de ondersteunende afweermechanismen. Stoornissen in de eerste verdedigingslinie komen echter veelvuldig voor. Vaak wordt ook iatrogeen schade toegebracht aan de eerste verdedigingslinie. Denk bijvoorbeeld aan hoestdemping en sedatie, intubatie en beademing. Bij alcoholisme lijkt het primair om de eerste verdedigingslinie te gaan: aspiratie, verminderde hoestreflex, slecht sluiten van de glottis en traumata dragen bij aan het optreden van infecties.
| complement | immunoglobulinen | fagocyten | cellulaire immuniteit | |
|---|---|---|---|---|
| ondervoeding | X | (X) | X | |
| leukemie ALL | X | X | ||
| leukemie AML | X | |||
| leukemie CLL | X | (X) | ||
| leukemie CML | X | |||
| beenmergtransplantatie* | X | X | X | |
| maligne lymfoom | (X) | X | ||
| splenectomie | X | X | ||
| diabetes mellitus | X1 | (X) | ||
| uremie | (X) | X | ||
| peritoneale dialyse** | X | X | ||
| alcoholisme | (X) | (X) | (X) | |
| cirrose | (X) | (X) | ||
| systemische lupus | (X) | (X) | (X) | |
| reumatoïde artritis | (X) | (X) | ||
| corticosteroïden | X | X | ||
| cyclofosfamide | (X) | X | X | |
| azathioprine | (X) | |||
| ciclosporine | X | |||
| TNF-α-remmers*** | X |
* De afweerstoornis is afhankelijk van de fase waarin de patiënt zich bevindt.
** De afweerstoornis is lokaal in de peritoneale holte.
*** Dit geldt ook voor veel andere 'smart-molecules' die ontwikkeld zijn om cytokines of andere pro-inflammatoire mediatoren selectief te remmen.
1 Door non-enzymatische glycosylering vermindert de functionele activiteit van complementfactoren.
X: afweerstoornis die dikwijls leidt tot infecties; (X): afweerstoornis waarvan de betekenis niet evident is; ALL: acute lymfatische leukemie; AML: acute myeloïde leukemie; CLL: chronische lymfatische leukemie; CML: chronische myeloïde leukemie.
Bij lang bestaande afweerstoornissen, waarbij recidiverende infecties optreden, ziet men als gevolg van deze infecties dikwijls anatomische afwijkingen ontstaan, die op zichzelf weer predisponeren tot infecties. De bronchiëctasieën die men veelvuldig aantreft bij patiënten met hypogammaglobulinemie zijn hiervan een goed voorbeeld.
Een veelvoorkomend moeilijk klinisch probleem is een longinfiltraat met koorts bij een patiënt met een verminderde afweer. In deze situatie is het van belang op zo simpel mogelijke wijze de aard van de verwekker te achterhalen en vervolgens zo snel mogelijk een adequate therapie in te stellen. Uit Tabel 6.26 blijkt duidelijk dat de differentiaaldiagnostische problemen het grootst zijn bij de patiënt met granulopenie en bij de patiënt met een gestoorde cellulaire immuniteit. Bij granulocytopenische patiënten met een pneumonie blijken bacteriële infecties zich vrijwel altijd met focale afwijkingen op de thoraxfoto te presenteren. Dergelijke afwijkingen worden vaak duidelijker bij herstel van de granulopoëse. Schimmelinfecties daarentegen kunnen zich zowel focaal als diffuus presenteren. Bij de patiënt met een gestoorde cellulaire immuniteit worden meestal diffuus fijnvlekkige afwijkingen gezien (die overigens niet zelden focaal beginnen). Zonder invasieve diagnostiek is meestal geen goede behandeling mogelijk. Bronchoalveolaire lavage (BAL) is de techniek bij uitstek om materiaal voor aanvullende diagnostiek (microbiologie en pathologie) te verzamelen, om te proberen een diagnose te stellen. Bij een Pneumocystis-pneumonie is de opbrengst hoog. Bij andere verwekkers moet soms toch een (transbronchiale) longbiopsie worden uitgevoerd. Ook voor andere infectieuze lokalisaties is vaak invasieve diagnostiek nodig wanneer de verwekker zich niet goed laat voorspellen.
Bij de patiënt met ernstige neutropenie is koorts een moeilijk te diagnosticeren probleem. Er kan sprake zijn van grampositieve (bijvoorbeeld Staphylococcus aureus, Streptococcus pneumoniae, enterokokken) of gramnegatieve (bijvoorbeeld Enterobacteriaceae, Pseudomonas spp., Actinobacter spp.) bacteriële verwekkers of van een Candida- of Aspergillus-infectie. Tenzij er duidelijke afwijkingen worden gevonden (zie Figuur 6.6 en Figuur 6.30), zijn de diagnostische mogelijkheden beperkt en wordt bij hoogrisicopatiënten – na afnemen van kweken – direct gestart met empirische antibiotische therapie (bijvoorbeeld met piperacilline/tazobactam ± aminoglycoside of meropenem monotherapie, afhankelijk van het ziekenhuis). De breedspectrumantibiotica worden gestopt na 72 uur bij klinisch stabiele patiënten met persisterende febriele neutropenie, indien er geen klinisch of microbiologisch bewijs voor infectie is. Bij deze patiënten moet orale profylaxe gericht op gramnegatieve micro-organismen gecontinueerd worden zolang de neutropenie duurt.
Casuïstiek
Ziekenhuisinfecties
Kernpunten
De frequentie van ziekenhuisinfecties is verschillend per afdeling.
Staphylococcus aureus, coagulasenegatieve stafylokokken, gramnegatieve bacteriën en Candida zijn belangrijke nosocomiale pathogenen.
Wees beducht op MRSA en neem voorzorgen (kweken, isolatie).
Handdesinfectie is een belangrijk middel om kruisinfecties te voorkomen.
Een ziekenhuisinfectie (nosocomiale infectie ; zie ook 10.1007/978-90-368-1841-4_16#Sec114) is een klinisch duidelijke of microbiologisch bewezen infectie die na het verstrijken van de incubatieperiode of (als de incubatietijd niet bekend is) minstens 48 uur na opname begint bij een in een ziekenhuis opgenomen patiënt. Deze definitie zou ook van toepassing kunnen zijn op verpleeginrichtingen, waar immers veel chronische patiënten en oudere zieken verblijven.
De frequentie van ziekenhuisinfecties loopt uiteen voor verschillende afdelingen. Voor algemene ziekenhuizen worden prevalentiecijfers aangegeven tussen 5 en 10%. Bij oudere patiënten zijn de cijfers hoger; zo komen urineweginfecties na transurethrale operatieve ingrepen voor bij 45% van de patiënten ouder dan 70 jaar tegenover 25% bij volwassenen jonger dan 60 jaar. Ook nosocomiale pneumonie komt frequent voor.
Ongeveer 1% van deze verworven infecties leidt tot sepsis (zie ▶ par. 6.4). In de jaren vijftig en zestig van de vorige eeuw was vooral Staphylococcus aureus een probleem bij wondinfecties, kruisinfecties en sepsis in ziekenhuizen. In de jaren zeventig en tachtig waren het vaak gramnegatieve micro-organismen die aanleiding gaven tot ziekenhuisinfecties bij patiënten. Inmiddels zijn daar opnieuw de grampositieve micro-organismen bijgekomen: niet alleen Staphylococcus aureus (vooral vanuit het buitenland de meticillineresistente stafylokok, de zogeheten MRSA), maar ook de minder virulente coagulasenegatieve stafylokokken (vooral bij gebruik van kunstmateriaal) en meer recent ook enterokokken. Bij patiënten met een ernstig verminderde weerstand (granulopenie) ziet men ook ernstige infecties veroorzaakt door vergroenende streptokokken en schimmelinfecties (Candida spp. en Aspergillus spp.). De toename van de problemen met deze micro-organismen hangt samen met een aantal factoren: infecties door bacteriën die door voorafgaand antibioticagebruik resistent zijn geworden tegen de gangbare middelen, lichtzinnig antibioticagebruik, veroudering van de ziekenhuispopulatie, frequenter gebruik van invasieve diagnostiek en langdurige operaties, uitbreiding van therapeutische mogelijkheden zowel medicamenteus (met een negatieve invloed op de afweer) als instrumenteel (langdurige infusen, verblijfkatheters, beademing, enz.), concentratie van patiënten op bepaalde afdelingen zoals urologische en intensivecareafdelingen waar vaak kruisinfecties optreden.
Therapie
Bij ziekenhuisinfecties komt men meestal niet meer met ‘eenvoudige’ antibiotica uit. Vaak moet men dan zijn toevlucht nemen tot breedspectrumantibiotica (cefalosporinen van de derde generatie, carbapenemantibiotica, fluorochinolonen). Gebruik van deze middelen leidt door selectiedruk weer tot meer resistentie bij de ziekenhuisflora. Protocollaire benadering van dit probleem is van groot belang (zie ook ▶ par. 6.2).
Preventie
Behalve een zorgvuldig antibioticagebruik is het voorkomen van (kruis)infecties een belangrijke preventieve maatregel. Bij dit laatste speelt de ziekenhuishygiëne met goede handdesinfectie en desinfectie van apparatuur een belangrijke rol. De ziekenhuisinfectiecommissie heeft een essentiële taak bij de regelgeving en de uitvaardiging van richtlijnen. Landelijk worden richtlijnen voor de preventie van ziekenhuisinfecties uitgegeven door de Werkgroep Infectie Preventie (WIP).
Een speciaal aandachtspunt is het voorkomen van verspreiding van MRSA (zie hiervoor). In veel ziekenhuizen in Europa heeft MRSA een vaste plaats veroverd. In Nederland is dit (nog) niet het geval door waakzaamheid en het nemen van intensieve maatregelen (kweken en PCR van neus- en huiduitstrijken, isolatiemaatregelen tot de uitslagen bekend zijn) bij patiënten die worden overgenomen uit een buitenlands ziekenhuis. In Nederland zien we wel de zogenoemde varkens-MRSA, een stafylokok die vooral infecties bij varkenshouders veroorzaakt. Deze stammen worden, in tegenstelling tot de ziekenhuis-MRSA, vooralsnog weinig van mens tot mens overgedragen. In de ziekenhuizen in de Verenigde Staten is er veel zorg over de verspreiding van vancomycineresistente enterokokken; in Europa is dit probleem vooralsnog veel kleiner.
Casuïstiek
Bioterrorisme
Bioterroristische infecties
Kernpunt
Bij meerdere gevallen van onbegrepen ziektebeelden moet men aan bioterrorisme denken.
Sinds 11 september 2001 is er wereldwijd een verhoogde waakzaamheid met betrekking tot terroristische aanslagen waarbij ziektekiemen worden gebruikt.
Hoewel terroristen voor dit doel een groot aantal micro-organismen zouden kunnen gebruiken, houden de experts het meest rekening met anthrax en pokken . Er zijn echter veel andere mogelijkheden. In Tabel 6.27 staan enkele manifestaties die aan de genoemde infecties moeten doen denken. In bredere zin geldt dat men bij onbegrepen ziektebeelden, zeker wanneer men meer dan één geval ziet, aan bioterrorisme moet denken.
| karakteristieken | inhalatieantrax | longpest | pokken |
|---|---|---|---|
| incubatie | 2-43 dagen | 1-6 dagen | ongeveer 12 dagen |
| klinische verschijnselen | koorts, hoest, dyspnoe, hoofdpijn, braken, buikpijn, thoraxpijn | koorts, hoest, thoraxpijn, hemoptoë; zelden halsklierzwelling (bubonen) | koorts ca. 3 dagen voor exantheem (pokken) en enantheem; hoofdpijn, rugpijn |
| epidemiologie | uitbraak van ‘griep’ met snel fataal verloop | uitbraak van ‘ernstige pneumonie’ met snel fataal verloop | uitbraak van huidafwijkingen met fataal verloop |
| microbiologie | grampositieve staven in bloedkweek | gramnegatieve staven in bloed- of sputumkweek | positieve PCR pokkenvirus |
| andere aanwijzingen | verbreed mediastinum op X-thorax | soms diffuse intravasale stolling | simultaan via blaasjes naar pustels (7 dagen) |
| behandeling | penicillinen, tetracyclinen, fluorochinolonen | gentamicine, fluorochinolonen, tetracyclinen | geen bewezen effectieve behandeling (cidofovir?) |
| vaccinatie | beschikbaar in VS | niet beschikbaar | vaccinatie van contacten volgens ringprincipe |
Casuïstiek
Ziekten door protozoën
Malaria
Kernpunten
Overweeg bij koorts na tropenbezoek altijd malaria, buiktyfus, leptospirose, rickettsiose en een amoebenleverabces.
Reizigers die ziek worden wanneer zij langer dan zes weken terug zijn uit een malariagebied, hebben geen malaria tropica, tenzij zij chemoprofylaxe gebruiken.
Verwekkers en epidemiologie
Malaria tropica wordt veroorzaakt door Plasmodium falciparum (overal in de tropen, vooral in Afrika), malaria tertiana door Plasmodium vivax (in tropen en subtropen) of Plasmodium ovale (voornamelijk in Afrika), malaria quartana door Plasmodium malariae (weinig frequent; in tropen en subtropen) en Plasmodium knowlesi (weinig frequent; in Zuidoost-Azië;Tabel 6.28 en Figuur 6.31). Aan Plasmodium knowlesi moet gedacht worden bij patiënten met ernstige manifestaties van malaria, bij wie de oorspronkelijke diagnose P. malariae was en die recent in Zuidoost-Azië, vooral op het eiland Borneo, zijn geweest. Malaria komt nog in 95 landen voor. De WHO schatte dat er in 2015 wereldwijd 214 miljoen gevallen van malaria waren, waarbij er 438.000 mensen overleden. In Nederland worden jaarlijks zo’n 150-300 gevallen van malaria gemeld bij reizigers uit tropische gebieden.
| verwekker | ziektebeeld | koortsbeloop | ernst |
|---|---|---|---|
| Plasmodium falciparum | malaria tropica | grillig | cave orgaanschade en overlijden |
| Plasmodium vivax | malaria tertiana | derdedaags koorts | orgaanschade komt minder frequent voor dan bij P. falciparum |
| Plasmodium ovale | malaria tertiana | derdedaags koorts | ernstige ziekte ongebruikelijk |
| Plasmodium malariae | malaria quartana | vierdedaags koorts | ernstige ziekte zeldzaam |
| Plasmodium knowlesi | (malaria quartana) | (vierdedaags koorts) | ernstige ziekte kan voorkomen |

Besmetting
Overbrenging door Anopheles-muggen .
Cyclus
De door de steeksnuit ingebrachte sporozoïeten ontwikkelen en vermenigvuldigen zich eerst in de parenchymcellen van de lever (het exo-erytrocytaire stadium), waaruit na ongeveer een week merozoïeten vrijkomen. Deze dringen erytrocyten binnen, waarin ze uitgroeien en de kern zich gaat delen. De rijpe delingsvormen vallen na 48 uur (bij Plasmodium malariae na 72 uur) weer in een aantal merozoïeten uiteen, waarna de erytrocytaire cyclus zich herhaalt en ziekteverschijnselen ontstaan. Bij malaria tertiana blijven de extra-erytrocytaire vormen (hypnozoïeten) de bron van recidieven (Figuur 6.32).

Klinische verschijnselen
Malaria tropica
Na een incubatieperiode van ongeveer tien dagen begint de ziekte met koorts; deze kan intermitterend of continu zijn en kent een grillig beloop, al dan niet met koude rillingen. Hoofdpijn, spierpijnen, misselijkheid, braken en diarree zijn vaak begeleidende verschijnselen. In het verdere beloop ontstaat miltvergroting en als gevolg van bloedafbraak anemie en soms een hemolytische icterus. Reeds binnen 24 uur kunnen zich ernstige symptomen voordoen. Deze zijn een gevolg van a acute nierinsufficiëntie, b hersenafwijkingen (‘cerebrale malaria’) met als voornaamste symptoom coma, soms verwardheid of delier, en c een toenemende circulatiestoornis met shock als eindtoestand. Het zijn deze onverwachte en snel optredende consequenties van een P. falciparum infectie die malaria tropica zo gevaarlijk maken.
De volgende patiënten hebben een hoger risico op een ernstig beloop:
Jonge kinderen in endemische gebieden, die nog geen beschermende immuniteit hebben ontwikkeld tegen de ernstigste vormen van malaria.
Zwangere vrouwen, aangezien malaria een miskraam kan veroorzaken en kan leiden tot maternale sterfte.
Hiv-geïnfecteerden.
Immigranten uit endemische gebieden die langdurig in niet-endemische gebieden wonen en terugkeren naar hun geboorteland voor familiebezoek lopen een risico vanwege een afgenomen immuniteit.
Wanneer iemand tijdens profylaxe besmet wordt met P. falciparum-parasieten die tegen het profylacticum (vooral chloroquine) resistent zijn, kan het ziektebeeld milder verlopen en daardoor moeilijker herkenbaar zijn. Bij koorts dient men altijd te vragen naar een recent bezoek aan de tropen. Bij westerse reizigers die langer dan zes weken terug zijn uit een malariagebied en dan pas ziek worden, kan het niet om malaria tropica gaan (aangezien er geen extra-erytrocytaire vormen zijn).
Malaria tertiana en quartana. Deze vormen worden gekenmerkt door regelmatig terugkerende koude rillingen, bij malaria tertiana om de 48 uur, bij malaria quartana om de 72 uur, overeenkomend met de duur van de erytrocytaire cyclus. Na enkele koortstoppen is de milt vergroot. Hoewel de patiënt zich tijdens de koortsaanvallen erg ziek kan voelen, zijn deze vormen van malaria, in tegenstelling tot malaria tropica, in het algemeen milder van karakter. Wel kunnen ze soms herhaaldelijk recidiveren, met intervallen van enkele maanden tot jaren. Bij malaria tertiana kunnen recidieven optreden tot ongeveer vier jaar na de eerste aanval; ze ontstaan vanuit hypnozoïeten (inactieve stadia) in de lever. P. knowlesi heeft een erytrocytaire cyclus van 24 uur. Het is een voornamelijk bij makaken voorkomende malaria, maar wordt de laatste jaren ook bij mensen gezien. De respiratoire insufficiëntie die in 10% gezien wordt, kan tot de dood leiden. De behandeling is die van P. vivax. Klinische recidieven van malaria quartana kunnen tot meer dan 25 jaar na de eerste aanval optreden (het mechanisme hiervan is onbekend).
Laboratoriumdiagnostiek
Onderzoek van dikkedruppelpreparaat en bloeduitstrijk. De parasitemie-index geeft het aantal door Plasmodium geïnfecteerde erytrocyten aan. Met nieuwe sneltests, waarmee antigeen van malariaparasieten in bloed wordt aangetoond, zijn infecties met P. falciparum, P. vivax of P. ovale redelijk betrouwbaar te diagnosticeren. P. knowlesi lijkt microscopisch op P. malariae, maar met een PCR kan het verschil aangetoond worden.
Therapie
Bij een niet-ernstige malaria tropica, gedefinieerd als een parasitemie-index < 2%, de afwezigheid van delingsvormen in het bloed, geen complicaties en een niet-brakende patiënt, kan volstaan worden met orale behandeling. Veelgebruikte opties zijn artemether/lumefantrine (Riamet®; artemether en 120 mg lumefantrine: 4 tabletten op T = 0, 8, 24, 36, 48 en 60 uur) en atovaquon/proguanil (Malarone®; atovaquon 250 mg/proguanil 100 mg: 4 tabletten eenmaal daags gedurende 3 dagen). Behandeling met mefloquine (Lariam®), kinine, clindamycine en doxycycline zijn alternatieven. De keuze is onder meer afhankelijk van beschikbaarheid en gebruikte chemoprofylaxe.
Bij een ernstige malaria tropica, gedefinieerd als een parasietenindex ≥ 5%, een parasietenindex < 5% maar met delingsvormen, één of meer complicaties of een brakende patiënt, wordt behandeld met artesunaat 2,4 mg/kg i.v. op tijdstip 0, 12, 24, 48 en 72 uur. Zodra mogelijk switch dan naar orale therapie zoals hiervoor beschreven. Tot enkele weken na toediening van artesunaat voor ernstige malaria is hemolyse beschreven. Daarom wordt geadviseerd wekelijks te controleren op hemolyse tot minimaal vier weken na het begin van de behandeling.
Bij contra-indicatie voor artesunaat/artemotil (zwangerschap): kininehydrochloride oplaaddosis 20 mg/kg in vier uur (max. 1800 mg); aansluitend 30 mg/kg per dag (max. 1800 mg/dag) per infuuspomp i.v. of in drie giften per infuus in vier uur inlopend. Zo snel mogelijk over op het orale schema (zie hiervoor).
Bij Plasmodium malariae-infectie: chloroquinebase, eerste twee dagen eenmaal daags 10 mg/kg, dag 3: eenmaal 5 mg/kg.
Bij Plasmodium vivax /ovale /knowlesi-infectie: chloroquinebase, eerste twee dagen eenmaal daags 10 mg/kg, dag 3: eenmaal 5 mg/kg, gevolgd door 30 mg primaquine eenmaal daags gedurende 14-21 dagen. Cave chloroquineresistente P.vivax in Zuidoost-Azië.
Bij iedereen die binnen zes weken na het verlaten van de tropen ziek wordt en koorts heeft, moet de mogelijkheid van malaria tropica worden overwogen, wat de andere symptomen ook mogen zijn (zoals braken, diarree of hoesten). De diagnose griep heeft in zulke gevallen menigeen het leven gekost. De enig juiste handelwijze bij deze patiënten die afkomstig zijn uit een gebied waar malaria voorkomt, is direct een dikke druppel te laten verrichten naar de aanwezigheid van malariaparasieten.
Preventie
Voor vertrek naar een gebied waar malaria voorkomt, dient men contact op te nemen met de GGD voor overleg over de actuele situatie ten aanzien van (resistente) malaria in het te bezoeken gebied. In veel gebieden is er voorkeur voor mefloquine of atovaquon/proguanil. Uitgebreide informatie over de te nemen maatregelen voor reizen naar de tropen is te vinden bij het Landelijk Coördinatiecentrum Reizigersadvisering (www.lcr.nl).
Casuïstiek
Viscerale leishmaniasis (kala-azar)
Kernpunten
Koorts, miltvergroting en pancytopenie passen bij viscerale leishmaniasis.
Koorts, vergrote, pijnlijke lever en hoogstand van het diafragma passen bij een amoebenabces.
Denk bij hardnekkige diarree aan giardiasis.
Verwekker
Viscerale leishmaniasis wordt veroorzaakt door Leishmania donovani en L. infantum (ook wel L. chagasi genoemd), kleine (2 tot 4 µm) intracellulaire parasieten (amastigoten) die zich in de cellen van het mononucleaire fagocytensysteem bevinden.
Besmetting en cyclus
Overbrenging door Phlebotomus-mugjes, waarin Leishmania species als promastigoot aanwezig zijn (Figuur 6.33).

Epidemiologie
De ziekte komt voor in India en China, Zuid-Amerika, Oost-Afrika en in landen rond de Middellandse Zee.
Klinische verschijnselen
De incubatietijd bedraagt enkele maanden tot een jaar (soms langer). Verschijnselen: koorts, miltvergroting, vaak lymfeklierzwellingen.
Laboratoriumdiagnostiek
Sterk verhoogde bezinkingssnelheid, pancytopenie door verdringing van amastigoten. Hiv-infectie is een belangrijke risicofactor voor viscerale leishmaniasis. Onbehandeld kan de ziekte tot de dood leiden. Aantonen van amastigoten in beenmerg of miltpunctaat. Kweek met PCR, serologie en moleculaire biologie.
Behandeling
Liposomaal amfotericine B is eerste keus in Nederland. Een vijfwaardige antimoonverbinding (Pentostam®), miltefostine en paromomycine zijn alternatieven.
Casuïstiek
Amoebiasis
Verwekker
Entamoeba histolytica . Deze komt voor in twee vormen: 1 de minutavorm (leeft als commensaal op het slijmvlies van het colon en vormt cysten die met de feces worden uitgescheiden), en 2 de histolyticavorm (bevindt zich als ulceraveroorzakende parasiet in het slijmvlies van de darm en soms in andere organen, vooral in de lever).
Epidemiologie
Klinische vormen van infecties met E. histolytica komen vooral voor in de tropen; in landen met een gematigd klimaat ziet men de infectie als importinfectie.
Besmetting
Alleen door de cysten: direct of indirect fecaal-oraal.
Klinische verschijnselen
Cystedragers (d.w.z. personen met alleen commensaal levende amoeben ): asymptomatisch. Hierbij is gebleken dat de cysten van de microscopisch gelijke maar onschuldige Entamoeba dispar tienmaal zo vaak voorkomen als die van de Entamoeba histolytica.
Amoebedysenterie: bloed en slijm bij meer of minder goed gevormde ontlasting, frequentie meestal niet meer dan tienmaal daags, zelden hevige diarree. Geen of lichte buikkrampen, koorts gering of afwezig.
Leveramoebiasis: soms worden amoeben naar de lever versleept, waar ze uitgebreide necrose kunnen veroorzaken: het leverabces. De inhoud hiervan bestaat voornamelijk uit vervloeid leverweefsel en heeft een bruine kleur (‘chocoladepus’). De symptomen zijn een geleidelijk toenemende, aanhoudende koorts, vergrote, pijnlijke lever, hoogstand van het diafragma, soms schouderpijn. Bij laboratoriumonderzoek: leukocytose en hoge bezinkingssnelheid. Bij perifeer gelegen abcessen wrijfgeruis door perihepatitis. Complicaties: perforatie in pleura of longen (ophoesten van chocoladepus), in de buikholte (peritonitis) of door de huid. Bij elke aanhoudende koorts met onbekende oorzaak bij mensen die in de tropen zijn geweest, moet men bedacht zijn op een amoebenabces. Diagnostiek met echo en/of CT-scan.
NB: bij gebruik van corticosteroïden kan een cystedrager patiënt worden; een reeds bestaande amoebencolitis kan verergeren.
Laboratoriumdiagnostiek
Microscopie van vers geproduceerde ontlasting en serologie. Het onderscheid tussen de cysten van de Entamoeba histolytica en de onschuldige Entamoeba dispar is niet microscopisch te maken, dus hiervoor zijn specifieke PCRs ontwikkeld.
Therapie
Men onderscheidt weefselamoebiciden (in Nederland metronidazol) werkzaam tegen de histolyticavormen, en contactamoebiciden (in Nederland clioquinol) werkzaam tegen de minutavormen. Amoebendysenterie en een amoebenabces behandelt men eerst met een weefselamoebicide (bijvoorbeeld metronidazol driemaal daags 750 mg gedurende 5 tot 10 dagen), gevolgd door een contactamoebicidemiddel (clioquinol driemaal daags 250 mg gedurende 10 dagen). Indien geen vlot herstel volgt, is aspiratie van het abces aangewezen.
Casuïstiek
Giardiasis (lambliasis)
Deze flagellaat leeft op het slijmvlies van het duodenum en vormt cysten die met de feces worden uitgescheiden.
Besmetting
Direct of indirect fecaal-oraal.
Epidemiologie
In principe komt Giardia lamblia wereldwijd voor. De infectie wordt nogal eens waargenomen bij personen die zijn teruggekeerd na een verblijf in de tropen onder slechte hygiënische omstandigheden (bijvoorbeeld na trektochten door India of Nepal). Ook in Nederland vindt besmetting plaats en dan vooral bij jonge kinderen. Giardiasis is een frequente oorzaak van chronische diarree.
Klinische verschijnselen
Meestal verlopen de infecties asymptomatisch, maar soms veroorzaken ze buikkrampen, boeren, flatulentie en misselijkheid. De diarree is dun of brijig, enkele malen per dag, zonder bloed of slijm.
Laboratoriumdiagnostiek
Fecesonderzoek op cysten, soms gecombineerd met PCR en antigeentest.
Therapie
Symptoomloos dragerschap komt veel voor en behoeft geen behandeling. Metronidazol 2000 mg eenmaal per dag gedurende drie dagen; alternatief is albendazol 400 mg per dag gedurende vijf dagen bij onvoldoende effect en recidief.
Ziekten door wormen
Nematodeninfecties van het darmkanaal
Oxyuriasis, enterobiasis
Verwekker
Enterobius vermicularis (aarsmade ), 1 cm lang, leeft op het slijmvlies van het colon. Levensduur: zes weken.
Besmetting
Door eieren, direct of indirect ano-oraal.
Epidemiologie
Komt wereldwijd voor en treft personen uit alle sociaaleconomische klassen. De prevalentie van de infectie is het hoogst bij schoolgaande kinderen.
Cyclus
Wijfjes kruipen meestal ’s nachts uit de anus en leggen hun eieren op de huid eromheen. Ontwikkeling van de wormen vindt plaats in het darmkanaal.
Klinische verschijnselen
Vaak asymptomatisch, soms ’s nachts anusjeuk. De wormen kruipen ook wel eens in de vulva, met irritatie of fluor als gevolg.
Complicaties
Zelden trekken oxyuren via de inwendige vrouwelijke geslachtsorganen tot in de buikholte. De langs deze weg gedeponeerde eieren worden omgeven door eosinofiele granulomen. Pijn in de onderbuik kan er het gevolg van zijn.
Laboratoriumdiagnostiek
Aantonen van eieren met anusplakbandmethode.
Therapie
Mebendazol (Vermox®), 1 tablet à 100 mg. Na veertien dagen herhalen. Denk eraan gezinsleden mee te behandelen.
Ascariasis
Kernpunten
Larvenpassage door de longen kan leiden tot longinfiltraten met bloedeosinofilie (syndroom van Loeffler).
Bij alle patiënten met anemie die in de voorafgaande jaren in de tropen zijn geweest, moet de ontlasting op mijnwormeieren worden onderzocht.
Bij een verminderde weerstand kan Strongyloides leiden tot hevige diarree, ileus of sepsis, met soms een dodelijk beloop.
Verwekker
Ascaris lumbricoides (spoelworm ), ongeveer 30 cm lang, verblijf houdend in het lumen van de dunne darm. Levensduur: ongeveer een jaar.
Besmetting
Door eieren, indirect fecaal-oraal via bodem waarin rijping van de eieren plaatsvindt.
Epidemiologie
Voorkomen ubiquitair, vooral in de tropen en subtropen.
Cyclus
In de darm vrijgekomen larven migreren via darmwand, lever, longen, luchtpijp en slokdarm naar het darmkanaal, waarin ze na ongeveer twee maanden volwassen worden.
Klinische verschijnselen
Buikkrampen, misselijkheid, soms diarree; lichte infecties zijn vaak asymptomatisch. Een dichte kluwen van wormen kan (sub)ileus veroorzaken. Tijdens larvenpassage door de longen ontstaan soms vluchtige longinfiltraten met bloedeosinofilie (syndroom van Loeffler ).
Complicaties
Door koorts of anderszins geprikkelde wormen kunnen gaan zwerven en via mond, neus of anus naar buiten komen. Zelden dringt een worm de galwegen binnen met galstuwing als gevolg; ook wel eens perforatie van darmwand, vooral langs verse operatienaden.
Laboratoriumdiagnostiek
Fecesonderzoek op wormeieren. Dit onderzoek moet als routine gebeuren bij de voorbereiding van operaties bij personen die kort tevoren in de tropen verbleven. Serologie is hierbij ook mogelijk, maar zal alleen positief zijn bij recente passage door de longen.
Therapie
Mebendazol (Vermox®), tweemaal daags 100 mg gedurende drie dagen; alternatief eenmalig 400 mg albendazol.
Trichuriasis
Verwekker
Trichuris trichiura (zweepworm ), 4 cm lang, bevindt zich op het slijmvlies van het colon, waar de worm met het voorste dunne gedeelte ligt ingegraven en een weinig bloed zuigt. Levensduur: ongeveer acht jaar.
Besmetting
Als bij Ascaris. Ontwikkeling vindt volledig plaats in het darmkanaal (dus geen inwendige larvenpassage).
Epidemiologie
Voorkomen ubiquitair, zeer frequent in de tropen.
Klinische verschijnselen
Meestal asymptomatisch. Slechts bij zware infecties van enkele honderden wormen ontstaan verschijnselen van colitis: buikkrampen, diarree (soms met bloed en slijm), meteorisme, anusprolaps, anemie. Dit wordt in Nederland wel eens waargenomen bij Surinaamse kinderen die hier pas kort zijn.
Laboratoriumdiagnostiek
Fecesonderzoek op wormeieren.
Therapie
Mebendazol, gedurende drie dagen 2 dd 100 mg.
Ankylostomiasis
Verwekkers
Vooral Ancylostoma duodenale en Necator americanus (mijnwormen ), ongeveer 1 cm lang. Ze hechten zich aan het slijmvlies van de dunne darm en grazen dit af, waarbij bloedende wondjes ontstaan. Levensduur: ongeveer acht jaar.
Besmetting en cyclus
Penetratie van de huid (meestal voetzool) door infectieve larven die zich in de vochtige bodem ontwikkeld hebben. Passage via longen en trachea naar darmkanaal (Figuur 6.34).

Epidemiologie
Komt voor in tropen en subtropen.
Klinische verschijnselen
Lichte infecties verlopen asymptomatisch. Bij infecties van tientallen of honderden wormen is een ijzergebreksanemie het voornaamste symptoom. Het bloedverlies door één Necator wordt geschat op 0,03 ml, door de iets grotere Ancylostoma op 0,1 ml per dag. In de tropen kan een mijnwormanemie zeer ernstige vormen aannemen. In Nederland dient men bij alle patiënten met anemie die in de voorafgaande jaren in de tropen zijn geweest, de ontlasting op mijnwormeieren te onderzoeken.
Laboratoriumdiagnostiek
Fecesonderzoek op wormeieren.
Therapie
Eerste keus is 1 dd 400 mg albendazol gedurende drie dagen. Alternatief is mebendazol (Vermox®), tweemaal daags 100 mg gedurende drie dagen. Bij anemie schrijft men bovendien een ijzerpreparaat voor.
Strongyloidiasis
Verwekker
Strongyloides stercoralis, 2 mm lang, geheel gelegen in slijmvlies van duodenum of jejunum. Levensduur: onbekend.
Epidemiologie
Komt voor in tropen en subtropen.
Besmetting en cyclus
Penetratie door huid en verdere passage als bij mijnwormen. Het wijfje produceert eieren die snel uitkomen. Deze larven worden met de feces uitgescheiden. Soms ontwikkelen deze larven zich reeds in het darmkanaal tot infectieve larven. Deze laatste kunnen via de darmwand of via de huid rond de anus de eigen gastheer opnieuw besmetten (auto-infectie). Hierdoor kan de infectie zich tientallen jaren handhaven (Figuur 6.35).

Klinische verschijnselen
Pijn in bovenbuik, chronische of intermitterende diarree. Kenmerkend is het optreden van migrerende urticariële strepen in het bekkengebied, soms ook op andere plaatsen, hetgeen vermoedelijk een reactie is op in de huid voortkruipende larven. Vaak is er een sterke bloedeosinofilie. De meeste infecties verlopen zonder klachten.
Complicaties
Bij gebruik van corticosteroïden of cytostatica en door andere weerstandsverminderende factoren kunnen, als gevolg van massale auto-infectie, ernstige ziektebeelden ontstaan met hevige diarree, ileus of sepsis, en soms een dodelijk beloop.
De sepsis wordt veroorzaakt door het vanuit de darm binnendringen van de worm in de bloedbaan, met als gevolg polymicrobiële bacteriëmie. Indien een langdurige behandeling met hiervoor genoemde middelen wordt voorgeschreven aan personen die in de tropen zijn geweest, moet men de feces tevoren laten onderzoeken (niet alleen op larven van Strongyloides, maar ook op cysten van Entamoeba histolytica; zie ▶ par. 6.14.3).
Laboratoriumdiagnostiek
Fecesonderzoek op larven met een kweek en volgens de methode van Baermann, Tevens bestaat er serologie die positief is bij interne passage.
Therapie
Ivermectine 200 µg/kg lichaamsgewicht per dag gedurende twee dagen; alternatief 2 dd 400 mg albendazol gedurende zeven dagen.
Casuïstiek
Nematodeninfecties van de weefsels
Toxocariasis
Kernpunten
Eosinofilie, vergrote lever, vluchtige longinfiltraten en subfebriele temperatuur passen bij toxocariasis.
Koorts, spierpijnen en hoge eosinofilie passen bij trichinosis.
Bij een filaria-aanval ziet men, naast chronische lymfeklierzwelling, lymfestuwing en een secundaire bacteriële infectie.
Een vluchtige zwelling op de extremiteiten met eosinofilie past bij loiasis.
Prurigo, dermatitis, oogafwijkingen, subcutane knobbels en eosinofilie passen bij onchocerciasis.
Verwekker
Larven van Toxocara canis (hondenspoelworm ). De volwassen wormen leven in het darmkanaal van honden, vooral bij puppy’s. De larven kunnen in verschillende organen van de mens als weefselparasiet verblijven.
Besmetting
Na ingestie van geëmbryoneerde eieren dringen de larven door de darmwand en worden met de bloedstroom naar de lever en andere organen vervoerd, waar ze worden ingekapseld in eosinofiele granulomen.
Epidemiologie
Ubiquitair.
Klinische verschijnselen
Bij massale infectie: vergrote lever, vluchtige longinfiltraten, subfebriele temperatuur. Hoge eosinofilie. Berucht is de lokalisatie van de larve in het oog, waarbij afwijkingen ontstaan die lijken op die van het retinoblastoom.
Laboratoriumdiagnostiek
Complementbindingsreactie of andere serologische reacties met Toxocara-antigeen.
Therapie
Goed werkzame geneesmiddelen zijn niet bekend. Bij asymptomatisch infecties wordt aangeraden niet te behandelen. Bij symptomatische infecties albendazol 2 dd 400 mg. Bij oculaire infecties naast albendazol ook lokale behandeling.
Trichinosis
Verwekker
Trichinella spiralis , 3 mm lang, leeft in de mucosa van de dunne darm. Levensduur: ongeveer een maand. De larven bevinden zich in dwarsgestreept spierweefsel. Levensduur: vele jaren.
Besmetting
Eten van besmet vlees (meestal varkensvlees).
Epidemiologie
Trichinose komt wereldwijd voor. De frequentie wordt mede bepaald door gebruiken rond de bereiding van (varkens)vlees.
Cyclus
De trichinen dringen de mucosa binnen. Vanaf de vijfde dag worden gedurende ongeveer één maand larven geproduceerd die met de bloedstroom naar de spieren worden vervoerd, waar ze worden ingekapseld.
Klinische verschijnselen
Alleen bij zware infecties ontstaan duidelijke ziekteverschijnselen. Men onderscheidt drie fasen:
intestinale fase: buikkrampen en diarree, enkele dagen tot weken durend;
spierinvasie: tweede tot vijfde week; kenmerkende trias: koorts, spierpijnen en hoge eosinofilie ; verder kunnen voorkomen: periorbitaal oedeem en splinterhemorragieën; bij ernstige infecties myocarditis en encefalitis, waardoor de ziekte soms dodelijk verloopt;
inkapseling en herstel: vijfde tot negende week en mogelijk nog veel langer; spierpijnen en spierzwakte.
Laboratoriumdiagnostiek
Spierbiopsie, serologisch onderzoek met trichineantigeen.
Therapie
Bij ernstige ziekteverschijnselen tijdens de spierinvasie: corticosteroïden, met albendazol of mebendazol.
Filariasis bancrofti
Verwekker
Wuchereria bancrofti en Brugia malayi. De volwassen worm (macrofilaria), draaddun, ongeveer 10 cm lang, leeft in de lymfevaten. In de worm leven als endosymbionten Wolbachia-bacteriën. De volwassen wormen produceren larven (microfilariae), 300 µm lang. Deze bevinden zich in het bloed, met een nocturne periodiciteit (d.w.z. dat ze alleen ’s nachts in het perifere bloed aanwezig zijn).
Besmetting en cyclus
Een mug krijgt bij een bloedmaal microfilariën binnen. In de mug ontwikkelen de microfilariae zich tot infectieve larven. Na binnendringen door de steekwond bij een volgende gastheer groeien ze uit tot volwassen wormen die zich overal in het lymfesysteem kunnen vestigen, maar vooral in de buurt van iliacale en para-aortale lymfeklieren (Figuur 6.36).

Epidemiologie
Lymfatische filariasis is de oorzaak van een enorme ziektelast in de wereld met veel morbiditeit. Verspreide haarden komen overal in de tropen voor.
Klinische verschijnselen
De infectie verloopt, ook al zijn er microfilariae aantoonbaar, vaak asymptomatisch. Wanneer er afwijkingen zijn, bevinden die zich vooral aan de benen en de mannelijke genitalia; soms aan armen of mammae. De verschijnselen kunnen in vier groepen worden ingedeeld.
Acute ontstekingsverschijnselen, vooral in de beginfase van de ziekte: lymfadenitis, lymfangitis, erysipelasachtige zwellingen, funiculitis of epididymitis, gepaard gaand met enkele dagen durende koorts. Dit zijn de zogenoemde filaria-aanvallen.
Chronische lymfeklierzwelling, chronische verdikking van funiculus of epididymis; hydrokèle.
Uitingen van lymfestuwing, vooral in een gevorderd stadium van de ziekte: lymfevarices, lymfoedeem, elephantiasis, chylurie . Het lymfoedeem is aanvankelijk indrukbaar, door subcutane fibroplasie later niet meer. Elephantiasis is lymfoedeem met veranderingen van de cutis: hypertrofie, sclerose, verrucose. Chylurie ontstaat door het scheuren van een lymfevat in de urinewegen (meestal nierbekken).
Secundaire bacteriële infectie: abcessen in onderhuids weefsel of in lymfeklieren. Filaria-aanvallen blijken wel eens geprovoceerd te worden door een streptokokkeninfectie .
Laboratoriumdiagnostiek
Onderzoek naar microfilariae (dikkedruppelpreparaat of -concentraat) in bloed omstreeks middernacht afgenomen, of overdag drie kwartier na provocatie met 100 mg di-ethylcarbamazine. Ze zijn in de beginfase van de ziekte lang niet altijd aantoonbaar, en in de late fase slechts zelden. Serologie biedt dan uitkomst, maar kan niet differentiëren tussen de verschillende soorten filaria.
Therapie
Doxycycline doodt de endosymbiont Wolbachia in de volwassen wormen: dit doodt de meeste wormen en geeft ook een afname van productie van microfilariën. De behandeling is doxycycline 1 dd 200 mg gedurende vier weken, gevolgd door ivermectine 200 µg/kg eenmalig. Bij lymfoedeem: elastische kousen. Hydrokèle en elephantiasis scroti: chirurgische verwijdering.
Loiasis
Verwekker
Loa loa , 6 cm lange worm , vrij bewegend in onderhuids bindweefsel. De microfilariae verblijven in het bloed, met een diurnale periodiciteit (dus alleen overdag aantoonbaar).
Besmetting
Overbrenging door bepaalde steekvliegen (Chrysops).
Epidemiologie
Nigeria, Kameroen, Zaïre.
Klinische verschijnselen
Vluchtige zwellingen op extremiteiten, lijkend op quincke-oedeem. Soms kruipt een worm duidelijk zichtbaar door de conjunctiva van het oog. Vaak bloedeosinofilie.
Laboratoriumdiagnostiek
Bloedonderzoek op microfilariae. Serologisch onderzoek.
Therapie
Albendazol 2 dd 400 mg, 21 dagen. Bij groot aantal microfilariën in bloed wordt plasmaferese aangeraden alvorens te behandelen. Daarna wordt di-ethylcarbamazine aangeraden.
Onchocerciasis
Verwekker
Onchocerca volvulus, 30 cm lang , levend in de subcutis, vaak in fibrotische knobbels. Ook hier leven, net als bij filariasis, Wolbachia in de wormen. De microfilariae migreren naar de huid, waar ze dermatitis en atrofie veroorzaken, en naar de conjunctiva en de cornea van het oog, wat uiteindelijk tot blindheid kan leiden (‘rivierblindheid’).
Besmetting
Kleine steekmugjes (Simulium ).
Epidemiologie
Tropisch Afrika (vooral West-Afrika) en Midden-Amerika.
Klinische verschijnselen
Prurigo, dermatitis, keratitis punctata en andere oogafwijkingen, subcutane knobbels (onchocercomen), eosinofilie.
Laboratoriumdiagnostiek
Onderzoek van huidsnipper op microfilariae. Serologisch onderzoek.
Therapie
Ivermectine 150 µg/kg eenmalig, gevolgd door doxycycline 100 mg eenmaal daags gedurende zes weken.
Casuïstiek
Trematodeninfecties
Schistosomiasis (bilharziasis)
Kernpunten
Acute schistosomiasis met eosinofilie wordt syndroom van Katayama genoemd.
Periportale fibrose en portale hypertensie zijn late complicaties.
Bij blaasschistosomiasis wordt hematurie gezien.
Verwekkers en epidemiologie
Schistosomiasis mansoni wordt veroorzaakt door Schistosoma mansoni (voorkomend in Afrika en Zuid-Amerika; in Nederland vooral bij Surinamers); blaasschistosomiasis door Schistosoma haematobium (in Afrika en Midden-Oosten; wordt in Nederland nogal eens waargenomen bij Marokkanen en Egyptenaren). De volwassen wormen, ongeveer 1 cm lang, leven in de venen van het colon, vooral van sigmoïd en rectum (Schistosoma mansoni) of in de venen van de blaas (Schistosoma haematobium ). Hun levensduur kan meer dan twintig jaar bedragen, maar is meestal ongeveer vijf jaar. De van een stekel voorziene eieren worden door darm- of blaaswand in het lumen gedreven; vele blijven echter steken of worden met de bloedstroom naar andere organen vervoerd, vooral naar de lever. Rond de in het weefsel achtergebleven eieren ontstaan granulomen en in een later stadium fibrose.
Besmetting en cyclus
Eieren die in zoetwater terechtkomen ontwikkelen zich in een tussengastheer: tropische zoetwaterslakken. In het water vrijgekomen cercariae dringen door de huid van de toekomstige gastheer naar binnen en worden naar de lever gevoerd, waar ze zich verder ontwikkelen. Vervolgens migreren ze via de poortader naar hun voorkeursplaatsen in darm of blaas (Figuur 6.37).

Klinische verschijnselen
Gedurende het invasiestadium kan, wanneer het niet-immune personen betreft, als reactie op de jonge wormen en hun eerste eiproductie, een ziektebeeld ontstaan dat wordt gekenmerkt door enkele weken durende koorts, leververgroting en een hoge bloedeosinofilie, vaak ook een urticariële eruptie (syndroom van Katayama ). In het verdere ziektebeloop zijn de infecties klinisch duidelijk te onderscheiden.
Schistosomiasis mansoni. De darmwandaandoening veroorzaakt in het algemeen geen ernstige klachten; soms chronisch of intermitterend geringe buikpijn, ontlasting gemengd met bloed of slijm, diarree. Van veel groter klinisch belang is het hepatoliënale stadium. Door voortdurende toevoer van eieren ontstaat in de lever periportale fibrose (symmersfibrose ) met portale hypertensie als gevolg. De verschijnselen hiervan zijn lever- en miltvergroting, slokdarmvarices (waaruit soms hevige bloedingen) en ascites als laat symptoom. Deze ernstige eindtoestand komt alleen voor bij zware infecties; lichte infecties verlopen asymptomatisch.
Blaasschistosomiasis. Het belangrijkste verschijnsel is hematurie, vooral op het einde van de mictie. Als gevolg van ureterstenose kan hydronefrose ontstaan. In een later stadium van zware infecties ontstaat soms verkalking van de blaaswand. Het hepatoliënale stadium komt bij infecties met Schistosoma haematobium slechts zelden voor.
Complicaties
Wanneer met de veneuze bloedstroom veel eieren in de longen terechtkomen, kunnen pulmonale hypertensie en cor pulmonale ontstaan. Soms worden eieren afgezet in het lumbale gedeelte van het ruggenmerg, met als gevolg verschijnselen van myelitis of radiculitis (ook bij schistosomiasis mansoni).
Laboratoriumdiagnostiek
Vooral serologie. Onderzoek naar eieren in feces, urine, rectumbiopt.
Therapie
Bij het syndroom van Katayama wordt aangeraden te behandelen met praziquantel 40 mg/kg, met corticosteroïden, gedurende drie dagen. Bij overige vormen van schistomiasis praziquantel : eenmaal 40 mg per kg lichaamsgewicht, herhalen na vier weken. Bij neuroschistosomiasis 2 dd 30 mg/kg, drie dagen met hoge dosis steroïden; herhalen na vier weken.
Casuïstiek
Cestodeninfecties
Taeniasis
Verwekkers
Taenia saginata (ongewapende lintworm ), enkele meters lang. De kop ligt vastgehecht in het slijmvlies van het duodenum. Dagelijks worden vijf à tien geledingen (proglottiden) afgestoten, die met de feces worden uitgescheiden of zelfstandig de anus verlaten. Eieren worden afgezet op de huid rond de anus. Tussengastheer is het rund, waar in spieren de blaasvormige larven (Cysticerci) tot ontwikkeling komen. De mens wordt dan besmet door eten van besmet en onvoldoende verhit ruindvlees.
Taenia solium (gewapende lintworm), in Nederland slechts als importinfectie. Vergeleken met de vorige worm zijn er twee belangrijke verschillen: 1 het varken is de tussengastheer, 2 ook bij de mens kunnen zich na een orale besmetting met eieren Cysticerci ontwikkelen, hetgeen ernstige verschijnselen (zie bij cysticercosis) tot gevolg kan hebben. De drager van deze lintworm is dus zowel een gevaar voor zichzelf als voor anderen in zijn omgeving.
Besmetting
Eten van onvoldoende verhit, cysticerceus vlees.
Epidemiologie
Lintwormen komen in principe wereldwijd voor, maar de frequentie van infectie wordt bepaald door hygiënische maatregelen bij het houden van vee en het al of niet eten van rauw of onvoldoende verhit vlees.
Klinische verschijnselen
Behalve het verlies van proglottiden zijn er vaak geen klachten. Soms misselijkheid, buikkrampen, diarree, prikkeling van de anus.
Diagnose
Herkennen van een proglottis. Aantonen van eieren met de anusplakbandmethode.
Therapie
Eerste keus is niclosamide eenmalig 2 gram per os. Alternatief is praziquantel eenmalig.
Cysticercosis
Kernpunten
Overweeg bij epilepsie en subcutane nodi neurocysticercosis.
Overweeg echinococcosis bij buitenlandse werknemers uit het Middellandse Zeegebied met een cysteus ruimte-innemend proces in lever of long.
Verwekker
Cysticercus cellulosae , de larve van Taenia solium. De Cysticerci bevinden zich vooral in het subcutane weefsel, de spieren en de hersenen. Auto- en heterobesmetting door direct of indirect fecaal-(ano-)oraal contact.
Klinische verschijnselen
Het voornaamste symptoom is epilepsie. Soms zijn er verschijnselen van verhoogde hersendruk; voorts erwt- tot boongrote subcutane noduli. Na enkele jaren kunnen de Cysticerci verkalken, waardoor ze röntgenologisch aantoonbaar zijn.
Diagnose
Beeldvorming van het cerebrum; excisiebiopt van een onderhuidse knobbel. Serologisch onderzoek.
Therapie
Bij epilepsie anti-epileptica; albendazol 2 dd 400 mg, tien dagen met daarbij een corticosteroïd.
Echinococcosis
Verwekker en cyclus
De volwassen Echinococcus granulosus is een kleine lintworm in het darmkanaal van de hond. Na ingestie van eieren ontwikkelen de larven zich in lever en longen van schapen en vele andere diersoorten tot cysten (hydatiden ), af en toe ook bij de mens. In de cysten worden scolexblaasjes gevormd; wanneer deze buiten de oorspronkelijke cysten geraken, kunnen ze tot secundaire Echinococcus-cysten uitgroeien. De cysten, die zeer groot kunnen worden (soms met een doorsnede van meer dan 20 cm), bevinden zich bij de mens vooral in de lever (ongeveer 65%; zie ook 10.1007/978-90-368-1841-4_18#Sec84) en in de longen (ongeveer 25%) en minder vaak in andere organen (ongeveer 10%) (Figuur 6.38).

Besmetting
Ingestie van eieren door direct of indirect contact met een besmette hond of zijn feces.
Epidemiologie
Autochtone gevallen komen de laatste jaren in Nederland nog maar zelden voor. De meeste gevallen betreffen buitenlandse werknemers uit het Middellandse Zeegebied.
Klinische verschijnselen
Afhankelijk van lokalisatie en toestand van de cyste. Gave cysten met een ongeschonden wand veroorzaken dikwijls geen of slechts geringe klachten; soms is er alleen een onpijnlijke zwelling in de leverstreek. Cysten in de long worden nogal eens bij toeval ontdekt bij röntgenologisch routineonderzoek van de thorax.
Gecompliceerde cysten, dat wil zeggen cysten met een geschonden buitenwand, zijn daarentegen vaak wél de oorzaak van verschijnselen. De cysten kunnen gaan lekken of scheuren, waardoor de inhoud van de cyste in het omgevende weefsel of in de lichaamsholten terechtkomt, wat een allergische reactie (eosinofilie, urticaria, anafylaxie) en ook de ontwikkeling van secundaire cysten tot gevolg kan hebben. Levercysten kunnen doorgroeien en perforeren in de galwegen, wat icterus en kolieken kan veroorzaken. Door een secundaire bacteriële infectie kan een cyste veretteren, waardoor koorts en verschijnselen van een leverabces ontstaan. Longcysten kunnen in de bronchi doorbreken, waardoor hoesten, soms bloederig sputum en een enkele maal ophoesten van inhoud van de cyste optreedt. Op den duur kunnen de cysten verkalken en kan de parasiet afsterven. Ze geven dan een typische ringschaduw op de röntgenfoto. Echografie geeft kenmerkende beelden, CT-scanning geeft de meeste informatie.
Laboratoriumdiagnostiek
Serologisch onderzoek op antilichamen. Het uitvoeren van een proefpunctie is wegens gevaar voor anafylactische shock en uitzaaiing niet geoorloofd. Cysten in de lever kunnen echografisch en scintigrafisch worden opgespoord.
Therapie
De behandeling van keuze is thans albendazol 5 mg/kg lichaamsgewicht, tweemaal daags gedurende drie maanden. Aspiratie van cyste-inhoud (onder albendazolbehandeling). Operatie eventueel met albendazol voor en na operatie.
Casuïstiek
Importziekten
Kernpunten
Vraag bij iedere patiënt met koortsende ziekte naar verblijf in de tropen (wanneer en waar).
Bij een patiënt met koorts na een verblijf in de tropen moet eerst aan malaria worden gedacht.
Toenemend internationaal verkeer en immigratie bevorderen de invoer van infectieziekten uit het buitenland . Het gaat hierbij dan vooral om:
infectieziekten waarvan de besmetting gebonden is aan de tropen (of subtropen), zoals malaria tropica, viscerale leishmaniasis, trypanosomiasis, filariasis, schistosomiasis, dengue, chikungunya, gele koorts, lassakoorts en ebola;
armoedegerelateerde infectieziekten waarvan de haarden zich momenteel buiten onze grenzen bevinden, bijvoorbeeld cholera, lepra;
infectieziekten die in eigen land ook wel eens autochtoon voorkomen, maar die vooral worden waargenomen bij personen die in het buitenland zijn geweest of daaruit afkomstig zijn, bijvoorbeeld amoebiasis of echinococcosis. Men kan hieraan nog andere ziekten toevoegen, zoals tuberculose, brucellose, buiktyfus, bacillaire dysenterie of virale hepatitis, omdat deze infecties relatief vaker voorkomen bij vluchtelingen, migranten of reizigers dan bij thuisblijvers. Van de vele mogelijke importinfecties is een beperkt aantal in eerdere paragrafen van dit hoofdstuk beschreven.
De ziekten waaraan men moet denken, worden voor een groot deel bepaald door het gebied waar de patiënten vandaan komen. Bij migranten uit Suriname moet men onder andere bedacht zijn op amoebiasis, andere parasitaire darminfecties, schistosomiasis mansoni, filariasis bancrofti, lepra, en histoplasmose; bij migranten uit het Middellandse Zeegebied op hepatitis A, amoebiasis, parasitaire darminfecties, tuberculose, brucellose, tyfoïd, blaasschistosomiasis (vooral personen uit Marokko en Egypte), echinococcosis, cysticercosis (personen uit Zuid-Europa), en familiaire mediterrane koorts. Bij Nederlandse vakantiegangers, backpackers of expats in de tropen dient men bedacht te zijn op de algemeen voorkomende infecties: malaria, amoebiasis, giardiasis, worminfecties van het darmkanaal, bacteriële darminfecties, hepatitis infectiosa en tuberculose. Bij mensen die uit tropisch Afrika komen bovendien op schistosomiasis, loiasis, onchocerciasis en trypanosomiasis en bij vakantiegangers uit het Middellandse Zeegebied op rickettsiosen en kala-azar.
Tot slot is in Tabel 6.29 een overzicht opgenomen van de voornaamste importziekten waaraan bij het vóórkomen van bepaalde symptomen moet worden gedacht.
| acute koorts |
eerste plaats: malaria verder: dengue, chikungunya, leptospirose, rickettsiosen, febris recurrens (bijvoorbeeld tick-borne relapsing fever), trypanosomiasis, arbovirusinfecties, lassakoorts, ebolakoorts bij langer durende koorts: leveramoebiasis, brucellose, buiktyfus, tuberculose, kala-azar, trypanosomiasis gambiense |
| vlekkig exantheem | rickettsiosen, dengue, trypanosomiasis |
| hevige diarree | cholera, Campylobacter-infectie, bacillaire dysenterie, Cyclospora-infectie, malaria tropica |
| matige diarree | giardiasis, amoebiasis, andere parasitaire darminfecties, schistosomiasis, tropische spruw |
| acute cerebrale verschijnselen | malaria tropica, trypanosomiasis |
| epilepsie | cysticercose |
| lymfeklierzwelling | filariasis bancrofti, lymphogranuloma venereum, tuberculose, kala-azar, trypanosomiasis, pest |
| geelzucht | malaria tropica, virale hepatitis, gele koorts, febris recurrens, sikkelcelcrisis |
| leververgroting | leveramoebiasis, echinococcosis, schistosomiasis mansoni, kala-azar |
| miltvergroting | malaria, tropische splenomegalie, kala-azar, brucellose, histoplasmose, schistosomiasis mansoni, levercirrose |
| longaandoeningen | tuberculose, histoplasmose, echinococcosis, paragonimiasis, amoebiasis, tropische pulmonale eosinofilie, syndroom van Loeffler |
| hematurie | blaasschistosomiasis, filariasis bancrofti |
| anemie | ankylostomiasis, ernstige trichuriasis, malaria, kala-azar |
| hypereosinofilie* | invasiestadium van schistosomiasis, strongyloidiasis, loiasis, onchocerciasis, tropische pulmonale eosinofilie, trichinosis, toxocariasis, fascioliasis |
| matige eosinofilie | allerlei worminfecties |
* Meer dan 3 × 109 eosinofielen per liter.
Risico’s voor reizigers
Gezondheidsproblemen bij reizigers komen veel voor. Van reizigers naar tropische landen meldt 22-64% dit. Problemen kunnen soms voorkomen worden door vaccinaties of andere preventieve maatregelen zoals malaria chemoprofylaxe en bescherming tegen muggensteken.
Reisbestemmingen ingedeeld naar regio’s geven verschillende risicoprofielen, ook wel geografische epidemiologie genoemd. Zo heeft een reiziger meer kans om malaria op te lopen in Afrika ten zuiden van de Sahara, vanwege de transmissie-intensiteit daar. Dengue en chikungunya komen echter vaker voor dan malaria bij reizigers met koorts uit Zuidoost-Azië. Risico op rickettsiose, met name Afrikaanse tekenkoorts, komt voor in Afrika en in Azië lopen reizigers meer risico op buiktyfus. Wat betreft reizigersdiarree is het risico op bacteriële oorzaken het grootst in Zuidoost-Azië (met name Campylobacter) en is Giardia de koploper wat betreft parasitaire oorzaken. In Azië is het risico op leptospirose groter dan in Afrika.
Het risico voor de reiziger wordt ook bepaald door aandoeningen die de reiziger heeft gehad of nog heeft.
Reizigers die corticosteroïden gebruiken of andere immuunsupprimerende therapie of met hiv-infectie, lopen meer risico op het krijgen van manifeste tuberculose en andere aandoeningen die cellulaire immuniteit vereisen. Ook levende vaccins zijn riskant en worden bij hen afgeraden. Het gebruik van (antivirale) therapie kan de werking van andere geneesmiddelen, bijvoorbeeld voor malaria chemoprofylaxe, beïnvloeden. Splenectomie geeft niet alleen een risico op bacteriële infecties met gekapselde bacteriën (zoals de pneumokok, de meningokok en Haemophilus influenzae), maar ook op ernstige malaria. Salmonellose loopt men eerder op bij het gebruik van protonpompremmers. Graviditeit geeft ook meer risico op onder andere malaria en meer problemen met de behandeling ervan met restricties voor de foetus. Zwangeren mogen geen levende vaccins ontvangen.
Gedrag van de reiziger bepaalt ook veelal het risico op aandoeningen. Seksuele (onbeschermde) contacten vergroten het risico op soa’s inclusief virale hepatitiden en hiv. Insecten en teken kunnen ziekten overdragen als dengue, malaria en rickettsiose. Grottenbezoek in met name Zuid-Amerika kan histoplasmose veroorzaken. Contact met zoetwater vergroot het risico op leptospirose, schistosomiasis en strongyloidiasis.
Casuïstiek
Elektronisch aanvullend materiaal
Hieronder vindt u de link naar het elektronische aanvullende materiaal.
Literatuur
- 1.Bennett JE, Dolin R, Blaser MJ. Mandell, Douglas, and Bennett’s Principles and practice of infectious diseases. 8. Edinburgh: Churchill-Livingstone; 2015. [Google Scholar]
- 2.Edmond RTD, Rowland HAK, Welsby PD. A colour atlas of infectious diseases. London: Mosby-Wolfe; 1995. [Google Scholar]
- 3.Hoepelman IM, Kroes ACM, Sauerwein RW, Verbrugh HA, Nouwen JL, editors. Leerboek microbiologie en infectieziekten. 4. Houten: Bohn Stafleu van Loghum; 2016. [Google Scholar]
- 4.Goering RV, Dockrell HM, Zuckerman M, et al. Mims’ Medical microbiology. 5. Elsevier; 2012. [Google Scholar]
- 5.Goering RV, Dockrell HM, Zuckerman M, et al. Mims’ Medical microbiology. 5. Elsevier; 2012. [Google Scholar]
- 6.van der Poll T, Wiersinga WJ. Sepsis. In: Cohen J, Powderly WG, Opal SM., editors. Infectious diseases. 4. Elsevier: 2016. [Google Scholar]
Links naar relevante websites
- 7.www.lcr.nl Landelijk Coördinatiecentrum Reizigersadvisering.
- 8.www.rivm.nl/cib Richtlijnen, protocollen en recente informatie over uitbraken.
- 9.www.swab.nl Richtlijnen over antibiotische therapie.


