Durante la actual pandemia por el virus SARS-CoV- 2, se está utilizando un amplio arsenal terapéutico que incluye medicamentos de uso infrecuente, por ello es importante conocer sus posibles efectos adversos.
Presentamos el caso de un paciente ingresado por infección respiratoria por COVID-19, que presentó en su evolución clínica una perforación cólica aguda, tras ser tratado con altas dosis de corticoides y con tocilizumab. Se han comunicado casos clínicos similares en pacientes con administración de tocilizumab y enfermedades autoinmunes, si bien la información relacionando perforaciones intestinales e infección por COVID-19 es muy escasa. Por otro lado, dado que el espectro clínico del virus es aparentemente amplio1, la posibilidad de que sea la única causa subyacente no puede ser del todo descartada.
Se trata de un varón de 66 años, con síndrome metabólico como único antecedente de interés y sin tratamiento habitual; en el contexto de un cuadro de insuficiencia respiratoria aguda secundaria a COVID 19, presentó dolor abdominal con defensa y aumento de leucocitosis y de PCR asociado. Tras la realización de una TC abdominopélvica se identifica abundante neumoperitoneo secundario a perforación de colon derecho. Se realizó una colectomía derecha, no observando signos de isquemia, ni divertículos en la pieza extraída.
Anteriormente había recibido tratamiento con metilprednisolona 100 mg/día (durante 5 días), tocilizumab (dosis única de 600 mg, correspondiente a 8 mg/kg) y 15 días previos a la intervención, azitromicina, hidroxicloroquina y lopinavir/ritonavir. La biopsia revela un área de necrosis con ulceración de la mucosa de 12 mm en cara anterior del ciego, sin signos de malignidad ni otras áreas de isquemia.
El tocilizumab es un anticuerpo monoclonal humanizado que bloquea tanto los receptores solubles como de membrana de interleucina 6, inhibiendo así la cascada inflamatoria generada por dicho mediador, y se emplea de forma habitual en enfermedades autoinmunes como parte del grupo de fármacos biológicos modificadores de enfermedad.
Este fármaco no ha sido todavía aprobado por la Food and Drug Administration para tratar la neumonía por COVID-19, sin embargo, su uso en casos graves se ha generalizado en el contexto de la pandemia.
Su seguridad fue evaluada en el ensayo clínico LITHE2. En él las complicaciones gastrointestinales graves se describieron como infrecuentes, y aparecieron en los pacientes en tratamiento concurrente con corticosteroides o AINE (fig. 1 ).
Figura 1.
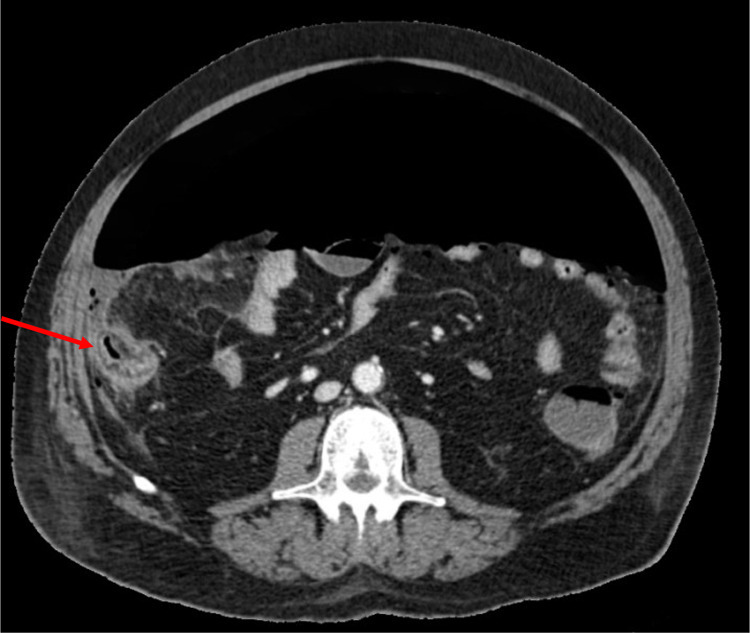
Corte axial de la tomografía computarizada con contraste del paciente en el que se observa abundante neumoperitoneo y cambios inflamatorios en ciego (flecha roja), hallazgos que sugieren perforación cecal.
Sin embargo, diversos estudios señalan mayor riesgo de perforación intestinal baja en pacientes en tratamiento con tocilizumab3, 4, 5, habiéndose descrito una incidencia cercana a 2/1.000 pacientes/año en los que se ha administrado al menos una dosis de tocilizumab6, especialmente cuando esta es de 8 mg/kg frente a 4 mg/kg7. Del mismo modo, el riesgo de perforación intestinal es mayor en comparación con el resto de fármacos biológicos moduladores de enfermedad3, 4, 8, 9. Estas perforaciones aparecen en los primeros 12 meses tras el tratamiento y no se incrementan con el tiempo5, 9, siendo siempre más frecuentes en los pacientes que han recibido corticoides5, 6. Una posible explicación podría ser el papel en la función de barrera intestinal de la IL-63, así como una menor intensidad en la respuesta inflamatoria inmediata5. Finalmente, señalar que la mortalidad tras perforación en estos casos puede llegar al 46%3, hecho que agravaría notablemente el pronóstico, ya de por sí incierto, de los pacientes con infección por COVID-1910.
Bibliografía
- 1.Kim J., Thomsen T., Sell N., Goldsmith A.J. American Journal of Emergency Medicine Abdominal and testicular pain?: An atypical presentation of COVID-19. Am J Emerg Med. 2020 doi: 10.1016/j.ajem.2020.03.052. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kremer J.M., Blanco R., Brzosko M., Burgos-Vargas R., Halland A., Vernon E. Tocilizumab inhibits structural joint damage in rheumatoid arthritis patients with inadequate responses to methotrexate: Results from the double-blind treatment phase of a randomized placebo-controlled trial of tocilizumab safety and prevention of structural joint damage at one year. Arthritis Rheum. 2011;63:609–621. doi: 10.1002/art.30158. [DOI] [PubMed] [Google Scholar]
- 3.Strangfeld A., Richter A., Siegmund B., Herzer P., Rockwitz K., Demary W. Risk for lower intestinal perforations in patients with rheumatoid arthritis treated with tocilizumab in comparison to treatment with other biologic or conventional synthetic DMARDs. Ann Rheum Dis. 2017;76:504–510. doi: 10.1136/annrheumdis-2016-209773. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Xie F., Yun H., Bernatsky S., Curtis J.R. Risk for Gastrointestinal Perforation among Rheumatoid Arthritis Patients receiving Tofacitinib Tocilizumab, or other Biologics. Arthritis Rheumatol. 2016;68:2612–2617. doi: 10.1002/art.39761. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Yamamoto K., Goto H., Hirao K., Nakajima A., Origasa H., Tanaka K. Longterm Safety of Tocilizumab: Results from 3 Years of Followup Postmarketing Surveillance of 5573 Patients with Rheumatoid Arthritis in Japan. J Rheumatol. 2015;42:1368–1375. doi: 10.3899/jrheum.141210. [DOI] [PubMed] [Google Scholar]
- 6.Schiff M.H., Kremer J.M., Jahreis A., Vernon E., Isaacs J.D., Vollenhoven R.F. Van. Integrated safety in tocilizumab clinical trials. Arthritis Res Ther. 2011;13:R141. doi: 10.1186/ar3455. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Emery P., Keystone E., Tony H.P., Cantagrel A., Vollenhoven Van R., Sanchez A. IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti-tumour necrosis factor biologicals: Results from a 24-week multicentre randomised placebo-controlled trial. Ann Rheum Dis. 2008;67:1516–1523. doi: 10.1136/ard.2008.092932. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Sepriano A., Kerschbaumer A., Smolen J.S., van Der Heijde D., Dougados M., van Vollenhoven R. Safety of synthetic and biological DMARDs?: A systematic literature review informing the 2019 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2019-216653. [DOI] [PubMed] [Google Scholar]
- 9.Monemi S., Berber E., Sarsour K., Wang J. Incidence of Gastrointestinal Perforations in Patients with Rheumatoid Arthritis Treated with Tocilizumab from Clinical Trial Postmarketing, and Real-World Data Sources. Rheumatol Ther. 2016;3:337–352. doi: 10.1007/s40744-016-0037-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Aminian A., Safari S., Razeghian-Jahromi A., Ghorbani M., Delaney C.P. COVID-19 Outbreak and Surgical Practice: Unexpected Fatality in Perioperative Period. Ann Surg. 2020 doi: 10.1097/SLA.0000000000003925. [DOI] [PMC free article] [PubMed] [Google Scholar]


