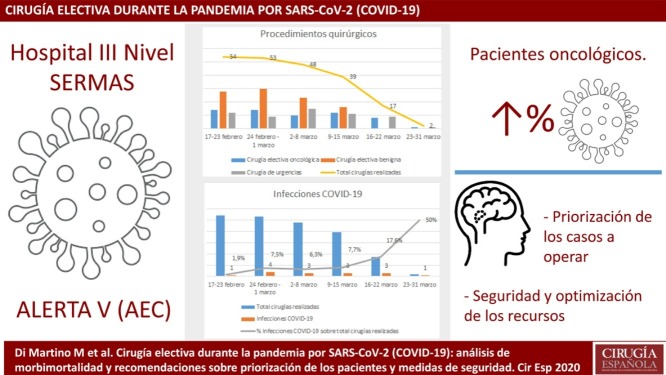
Graphical abstract
Palabras clave: COVID-19, SARS-CoV-2, Cirugía electiva, Cirugía oncológica
Abstract
Introducción
La expansión de la infección por SARS-CoV-2 (COVID-19) ha requerido la adaptación de los hospitales afectados por la pandemia, causando una reducción de la actividad quirúrgica electiva.
Métodos
Estudio retrospectivo de pacientes operados durante el mes previo y el pico de la pandemia. Se analizó la tasa de contagio por COVID-19, la gravedad de la infección respiratoria según la Brescia Respiratory COVID-19 Severity Scale, las medidas terapéuticas adoptadas y las complicaciones postoperatorias globales.
Resultados
Desde el 17 de febrero hasta el 31 de marzo de 2020 se produjo una reducción progresiva de la actividad quirúrgica, interviniéndose únicamente 213 pacientes: 59 (27,8%) de forma programada por patología tumoral, 97 (45,5%) por patología benigna y 57 (26,7%) de forma urgente.
Se produjo un aumento progresivo de la tasa de contagio por COVID-19 con un total de 15 (7%) casos. De los pacientes oncológicos, 10 (16,9%) resultaron afectos; en el grupo de cirugía electiva, un paciente (1%); y en el grupo de cirugía urgente, 4 (7%) (p < 0,001). Cinco pacientes presentaron una infección respiratoria grave de los cuales 4 estaban afectos por enfermedad oncológica. Hubo 3 (1,4%) fallecimientos, todos debidos a progresión de la infección respiratoria.
Conclusiones
Los pacientes sometidos a cirugía presentaron una elevada tasa de infección por COVID-19 y de complicaciones postoperatorias, sobre todo en los pacientes oncológicos. La puesta en marcha de la de la actividad quirúrgica debe basarse en una priorización de los casos a operar, respetando unas premisas de seguridad y optimización de los recursos disponibles.
Abstract
Introduction
The spread of the SARS-CoV-2 infection (COVID-19) has required adaptation by hospitals affected by the pandemic, which has caused a reduction in elective surgical activity.
Methods
Retrospective study of patients operated on in the previous month and during the peak of the pandemic. We analysed the COVID-19 infection rate, the severity of respiratory infection according to the Brescia respiratory COVID-19 severity scale, the adopted therapeutic measures and the overall postoperative complications.
Results
From 17th February to 31st March 2020, there was a progressive decrease in surgical activity, with only 213 patients operated on. This comprised 59 (27.8%) elective operations for oncological diseases, 97 (45.5%) elective operations for benign diseases and 57 (26.7%) as urgent procedures.
There was a progressive increase in the rate of infection by COVID-19, with a total of 15 cases (7%). This included 10 patients (16.9%) in the elective group for oncological disease, 1 (1%) in the elective surgery group for benign disease and 4 (7%) in the urgent surgery group (p < 0.001). Five patients presented with a severe respiratory infection, of which 4 were affected by oncological disease. There were 3 deaths (1.4%), which were all due to the worsening of a respiratory infection.
Conclusions
The patients undergoing the surgical procedures showed high rates of COVID-19 infection and postoperative complications, especially the patients with oncological diseases. Local resumption of surgical activity must be based on the prioritisation of the cases to be operated on, respecting certain premises of security and optimisation of the available resources.
Keywords: COVID-19, SARS-CoV-2, Elective surgery, Oncologic surgery
Introducción
Desde que se produjeron los primeros casos de infección por SARS-CoV-2 (COVID-19) a finales de diciembre de 2019 en Wuhan (China), el crecimiento exponencial de esta enfermedad ha llevado a una pandemia, declarada como tal por la Organización Mundial de la Sanidad (OMS) el 11 de marzo 20201, 2. España y, concretamente, la Comunidad de Madrid han sido unos de los lugares con mayores tasas de contagios declarados a nivel mundial3, lo que llevó a la declaración del estado de alarma el 14 de marzo de 2020.
En este periodo de tiempo, la expansión de la infección y el elevado consumo de recursos sanitarios, como camas de hospitalización y de Unidades Cuidados Intensivos (UCI), han requerido una adaptación del sistema sanitario3, 4. Para tratar de atender al mayor número de pacientes posibles, en muchos centros se ha reubicado al personal, al tiempo que se ha ampliado el número de camas de UCI. Todos estos cambios logísticos, junto al contexto epidémico, han llevado a la reducción o suspensión temporal de la actividad quirúrgica electiva en muchos centros afectados por la pandemia5.
La reducción o suspensión de la actividad quirúrgica ha conllevado retrasos en la programación de las intervenciones, lo que puede representar un serio problema en el caso de enfermedades oncológicas6. Si bien está claramente demostrado el empeoramiento del pronóstico oncológico en caso de demoras en los tratamientos7, 8, 9, no se puede ignorar el aumento de la morbimortalidad en los pacientes intervenidos, descritos por grupos europeos y asiáticos6, 10, 11. El estrés quirúrgico parece asociarse a un cambio en el perfil inmune, que favorecería la infección por SARS-CoV-2 y la gravedad de las manifestaciones de dicha infección12.
Existe muy escasa evidencia y limitadas recomendaciones en el momento actual por parte de las sociedades científicas sobre el manejo de pacientes a la espera de cirugía electiva13. Principalmente hay recomendaciones para cirugía urgente/emergente que valoran el riesgo de infección por el virus, frente al beneficio del tratamiento de su patología de base4, 14, 15, 16.
El objetivo de este estudio es realizar un análisis del impacto que ha tenido la pandemia por COVID-19 en los pacientes sometidos a cirugía en un servicio de Cirugía General y del Aparato Digestivo, en un hospital público de tercer nivel de la red de hospitales del Servicio Madrileño de Salud (SERMAS), España. Se estudiaron los pacientes operados desde el mes previo a la declaración del estado de alarma en España y durante el pico de la pandemia. Mediante el análisis de nuestros resultados y una revisión de la literatura disponible se proponen unas recomendaciones sobre la reintroducción de la actividad quirúrgica en los hospitales afectados por la pandemia.
Métodos
Análisis retrospectivo de los pacientes sometidos a intervención quirúrgica en un hospital universitario de tercer nivel del SERMAS, España, durante el periodo comprendido entre las 4 semanas previas a la declaración del estado de alarma (17 de febrero) y el 31 de marzo, con un seguimiento mínimo de 15 días.
Se trata de un hospital público que presentó un aumento gradual de los casos de COVID-19 y una suspensión progresiva de la actividad quirúrgica hasta alcanzar un escenario tipo V según la definición de la Asociación Española de Cirujanos (AEC)17, con un porcentaje de pacientes COVID-19 hospitalizados > 75% del total del hospital y un impacto significativo sobre la actividad clínica asistencial con limitación de la camas de la UCI. Al alcanzar dicho estado de alerta y coincidiendo con la declaración nacional del estado de alarma, el 14 de marzo de 2020, se procedió a la suspensión temporal casi total de la actividad quirúrgica electiva.
Para la confirmación de casos sospechosos de infección por SARS-CoV-2 con clínica compatible se utilizó el test de reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR), según la metodología disponible en el laboratorio de microbiología del hospital, mediante la realización de exudados nasofaríngeo y orofaríngeo. Se consideraron signos radiológicos compatibles con COVID-19 la aparición de infiltrados periféricos en vidrio deslustrado, patrón alveolar difuso, consolidaciones bilaterales y/o neumonía organizada18.
Durante el pico de la pandemia, se hizo necesaria una priorización de los recursos disponibles en función de una serie de criterios clínicos-éticos-epidemiológicos dictados por las autoridades locales competentes. Por lo tanto, a la hora de reportar la morbimortalidad de los pacientes quirúrgicos con infección por COVID-19 se indicará: por un lado, la gravedad de las complicaciones según la clasificación de Dindo-Clavien19, y por el otro, las medidas terapéuticas utilizadas en cada paciente según la clasificación de los tratamientos requeridos que se describe en la tabla 1 y la severidad respiratoria según la Brescia Respiratory COVID-19 Severity Scale (BRCSS)20.
Tabla 1.
Grupos de tratamientos en relación con la infección por COVID-19
| Grupo 0 | Tratamiento sintomático |
| Grupo I | Hospitalización con oxigenoterapia, antirretrovirales y/o inmunomoduladores (lopinavir/ritonavir, darunavir, cloroquina, hidroxicloroquina) |
| Grupo II | Hospitalización y necesidad de corticosteroides a alta dosis (dosis > 1 mg/kg/día de prednisolona o equivalentes), otros inmunomoduladores/inmunosupresores (tocilizumab, interferón, etc.) y medicamentos no incluidos en el grupo I |
| Grupo III | Ingreso en UCI o requerimiento de ventilación mecánica |
UCI: Unidad de Cuidados Intensivos.
Se analizaron la edad, el sexo, el estado funcional definido según la escala ECOG21, los antecedentes personales, el diagnóstico, el tipo de intervención quirúrgica, el momento en que se confirmó la infección por SARS-CoV-2, el tratamiento requerido para la misma (tabla 1), la gravedad de la infección respiratoria según la BRCSS20 y las complicaciones postoperatorias según la clasificación de Dindo-Clavien19.
El análisis estadístico se realizó con el programa SPSS® v.23 (SPSS®, Chicago, Illinois, EE. UU.). Las variables cualitativas se expresaron como número y porcentaje, y las variables cuantitativas mediante mediana con rango intercuartílico. Las variables categóricas se analizaron con la prueba exacta de Fisher. Las diferencias se consideraron significativas por valores de p < 0,05.
Resultados
Desde el 17 de febrero hasta el 31 de marzo de 2020 se operaron 213 pacientes: 59 (27,8%) de forma programada por patología tumoral, 97 (45,5%) de forma programada por patología benigna y 57 (26,7%) de forma urgente.
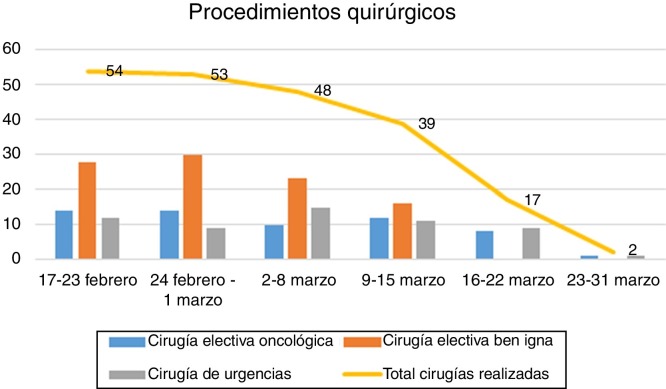
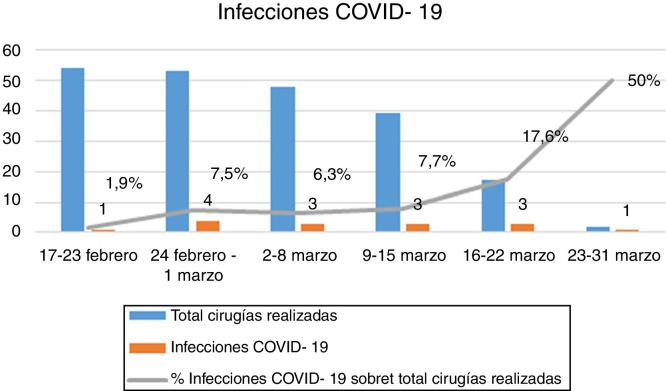
Hasta el día 6 de marzo se mantuvo la actividad asistencial habitual, que posteriormente fue disminuyendo inicialmente a expensas de procedimientos programados por patología benigna y, desde el 14 de marzo, con una suspensión casi total de la actividad quirúrgica. La figura 1 describe el nivel de actividad semanal del servicio. De los 213 pacientes intervenidos, 15 (7%) presentaron en el postoperatorio una infección confirmada por SARS-CoV-2. En la figura 2 se describe el número de infecciones por SARS-CoV-2 y el porcentaje de pacientes infectados sobre el total de las cirugías realizadas por semanas.
Figura 1.
Número de procedimientos quirúrgicos realizados por semanas.
Figura 2.
Número de infecciones por COVID-19 y porcentaje de infecciones sobre el total de procedimientos quirúrgicos realizados por semanas.
En el grupo de pacientes oncológicos, 10 (16,9%) presentaron una infección por SARS-CoV-2; en el grupo de pacientes intervenidos por patología benigna, uno (1%); y en el grupo de cirugía urgente 4 (7%), encontrando diferencias estadísticamente significativas en la tasa de contagio de los 3 grupos (p = 0,004) (tabla 2 ).
Tabla 2.
Incidencia de la infección por COVID-19 en pacientes sometidos a intervención quirúrgica
| Casos operados | Casos afectos (%) | p | |
|---|---|---|---|
| Cirugía programada oncológica | 59 | 10 (16,9%) | |
| Cirugía programada no oncológica | 97 | 1 (1%) | |
| Cirugía urgente | 57 | 4 (7%) | |
| Total | 213 | 15 (7%) | < 0,001 |
Cinco de los 15 contagios por COVID-19 se diagnosticaron durante la hospitalización, siendo el resto pacientes diagnosticados tras el alta sin poder especificar si el contagio tuvo lugar durante la hospitalización, las visitas postoperatorias o fuera del ámbito hospitalario.
Cinco pacientes presentaron una infección respiratoria grave que no respondía a tratamiento sintomático o a medicamentos del grupo I (tabla 1), precisando medidas adicionales. Cuatro de estos pacientes presentaban una patología tumoral de base: un colangiocarcinoma, un adenocarcinoma de páncreas y un linfoma en el grupo de los pacientes oncológicos intervenidos de forma programada y un linfoma en tratamiento activo que se sometió a drenaje de un absceso de forma urgente.
Se produjeron en total 3 (1,4%) fallecimientos, todos debidos a progresión de la enfermedad respiratoria por COVID-19: uno (1,7%) en el grupo de pacientes oncológicos y 2 (3,5%) en el grupo de pacientes intervenidos de forma urgente.
Cirugía oncológica
De los 59 pacientes sometidos a cirugía oncológica, 10 (16,9%) desarrollaron una infección por SARS-CoV-2 (tabla 3 ).
Tabla 3.
Paciente sometidos a cirugía oncológica y positivos para COVID-19 en el postoperatorio
| Edad/Sexo | ECOG | Antecedentes más relevantes | Intervención quirúrgica | Estancia (días) | Complicaciones (antes infección COVID-19) | Contagio COVID-19 | Grupo tratamiento COVID-19 | BCRSS | Complicaciones globales | |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 71 M | 1 | Obesidad, HTA, EPOC y SAOS, FA | DPC | 34 | IIIb (reintervención por fístula) | Hospitalización | II | 3 | V |
| 2 | 85 V | 3 | Obesidad, HTA, EPOC y SAOS, insuficiencia cardiaca | Hemicolectomía izquierda | 21 | IIIb (reintervención por evisceración) | Tras alta --> reingreso | I | 2 | IIIb |
| 3 | 62 M | 0 | HTA | DPC | 17 | IIIa (drenaje absceso) | Hospitalización | I | 1 | IIIa |
| 4 | 66 V | 3 | FA, insuficiencia cardiaca, cardiopatía isquémica | Resección anterior baja | 11 | II (hemorragia digestiva baja) | Tras alta --> reingreso | I | 1 | II |
| 5 | 51 V | 2 | HTA, retraso psicomotor, linfoma | Biopsia adenopatía | 22 | 0 | Hospitalización | II | 3 | II |
| 6 | 65 M | 0 | HTA, FA | Resección hepática y linfadenectomía | 4 | I | Tras alta --> reingreso | II | 3 | II |
| 7 | 70 M | 0 | HTA | Hemicolectomía derecha | 33 | II (hemorragia digestiva baja) | Hospitalización | I | 1 | II |
| 8 | 89 M | 2 | HTA, FA | Hemicolectomía derecha | 15 | II (íleo paralítico) | Tras alta --> tratamiento ambulatorio | 0 | 0 | II |
| 9 | 41 M | 0 | Segmentectomía mamaria | 0 | 0 | Tras alta --> tratamiento ambulatorio | 0 | 0 | 0 | |
| 10 | 62 M | 0 | Trastorno delirante crónico | Mastectomía | 2 | 0 | Tras alta --> tratamiento ambulatorio | 0 | 0 | 0 |
BCRSS: Brescia Respiratory COVID-19 Severity Scale; DPC: duodenopancreatectomía cefálica; ECOG: escala estado funcional; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; HTA: hipertensión arterial; M: mujer; SAOS: síndrome apnea obstructiva del sueño; V: varón.
La edad mediana fue de 65 años (57-78). Tres fueron varones; las comorbilidades más frecuentemente asociadas fueron cardiovasculares y respiratorias. Dos pacientes habían sido sometidos a duodenopancreatectomía cefálica, 5 a una resección colorrectal, 2 a resección mamaria y uno a una biopsia escisional de una adenopatía en un paciente con tratamiento activo por un linfoma. Tres pacientes (5%) presentaron complicaciones grado ≥ IIIa según Dindo-Clavien antes de la infección respiratoria.
Cuatro pacientes (6,7%) se contagiaron durante el ingreso, mientras que 6 (10,1%) fueron dados de alta y diagnosticados después. Tres pacientes requirieron un tratamiento puramente sintomático domiciliario, mientras que los otros 7 precisaron reingreso o prolongación de la hospitalización. De estos, 3 presentaron una neumonía grave que requirió tratamiento del grupo II.
Cuando comparamos los cambios en la gravedad de las complicaciones según la escala de Dindo-Clavien antes y después de la infección respiratoria, 3 pacientes presentaron una modificación en la gravedad de las complicaciones según la escala clínica y uno de ellos falleció.
Cirugía electiva no oncológica
De los 97 pacientes sometidos a cirugía electiva no oncológica, uno (1%) resultó positivo para COVID-19 (tabla 4 ). El paciente fue tratado de forma domiciliaria con un tratamiento sintomático.
Tabla 4.
Paciente sometido a cirugía electiva no oncológica y positivo para COVID-19 en el postoperatorio
| Edad/Sexo | ECOG | Antecedentes más relevantes | Intervención quirúrgica | Estancia (días) | Complicaciones (antes infección COVID-19) | Contagio COVID-19 | Grupo tratamiento COVID-19 | BCRSS | Complicaciones globales | |
|---|---|---|---|---|---|---|---|---|---|---|
| 11 | 34 V | 0 | HTA, miocardiopatía hipertrófica | Colecistectomía | 1 | 0 | Tras alta --> tratamiento ambulatorio | 0 | 0 | 0 |
BCRSS: Brescia Respiratory COVID-19 Severity Scale; ECOG: escala estado funcional; HTA: hipertensión arterial; M: mujer; V: varón.
Cirugía urgente
De los 57 pacientes sometidos a cirugía urgente, 4 (7%) resultaron positivos para COVID-19 (tabla 5 ). Un paciente (1,7%) presentó complicaciones grado ≥ IIIa según Dindo-Clavien antes de la infección respiratoria, requiriendo una reintervención debido a una obstrucción intestinal.
Tabla 5.
Pacientes sometidos a cirugía urgente y positivos para COVID-19 en el postoperatorio
| Edad/Sexo | ECOG | Antecedentes más relevantes | Intervención quirúrgica | Estancia (días) | Complicaciones (antes infección COVID-19) | Contagio COVID-19 | Grupo tratamiento COVID-19 | BCRSS | Complicaciones globales | |
|---|---|---|---|---|---|---|---|---|---|---|
| 12 | 82 V | 1 | HTA, diabetes tipo 2, FA | Piloroplastia (úlcera perforada) | 21 | IIIb (obstrucción intestinal) | Hospitalización | II | 3 | V |
| 13 | 61 V | 0 | HTA, linfoma | Drenaje absceso perianal | 1 | 0 | Tras alta --> reingreso | I | 3 | V |
| 14 | 82 V | 2 | EPOC, artritis seronegativa | Hernioplastia | 8 | 0 | Hospitalización | I | 1 | 0 |
| 15 | 69 M | 0 | HTA | Resección intestino delgado | 21 | 0 | Hospitalización | 0 | 0 | 0 |
BCRSS: Brescia Respiratory COVID-19 Severity Scale; ECOG: escala estado funcional; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; HTA: hipertensión arterial; M: mujer; V: varón.
Tres pacientes (5,2%) se diagnosticaron durante el ingreso, mientras que uno (1,7%) tras el alta, precisando un reingreso por la infección respiratoria. Un paciente necesitó un tratamiento sintomático, otro precisó tratamiento del grupo I y los 2 restantes, del grupo II.
Cuando comparamos los cambios en la gravedad de las complicaciones según la escala de Dindo-Clavien antes y después de la infección respiratoria, 2 pacientes, que finalmente fallecieron debido a la infección respiratoria, presentaron una modificación en la gravedad de las complicaciones según la escala clínica.
Discusión
Nuestro análisis confirma la elevada tasa de infección por SARS-CoV-2 en pacientes sometidos a intervención quirúrgica y su mayor incidencia en pacientes oncológicos. Nuestros datos respaldan las experiencias publicadas por autores asiáticos y europeos10, 11, 22 que han mostrado un incremento de la morbimortalidad en los pacientes intervenidos quirúrgicamente durante la pandemia.
Existen elementos fisiopatológicos y datos epidemiológicos que nos permiten suponer que agregar estrés quirúrgico a un paciente con COVID-19, o por el contrario desarrollar esta infección en un paciente operado, puede ser muy perjudicial, especialmente en la cirugía oncológica10, 11, 12. Un estudio publicado recientemente por un grupo asiático sugiere una mayor susceptibilidad a desarrollar una infección grave por SARS-CoV-2 en pacientes con neoplasia, probablemente debido a la inmunosupresión subyacente6. Los autores describen una tasa de infecciones respiratorias graves de hasta el 75% de los pacientes operados o tratados en el mes anterior a la infección por SARS-CoV-2. Nuestra casuística describe una tasa de infección del 16% y una tasa de mortalidad por insuficiencia respiratoria del 1,7% en pacientes oncológicos operados en el mes previo y durante el pico de la pandemia COVID-19. Además, de los 5 pacientes que presentaron una infección grave en nuestra serie necesitando un tratamiento del grupo II, 4 eran pacientes que presentaban una enfermedad oncológica de base. Aunque podría existir una mayor susceptibilidad a la infección en el grupo de pacientes oncológicos, también hay que considerar que estos pacientes fueron los que presentaron una mayor tasa de complicaciones postoperatorias y estancias hospitalarias más prolongadas; y por lo tanto, un mayor riesgo de contagio intrahospitalario. En definitiva, tanto las alteraciones fisiopatológicas debidas a la enfermedad tumoral como el aumento de la morbilidad secundario al procedimiento quirúrgico y a la prolongación de la estancia hospitalaria podrían contribuir a un aumento de la tasa de contagio por SARS-CoV-2.
En cuanto a la tasa de contagio, 5 pacientes fueron diagnosticados de COVID-19 estando ingresados en una planta a priori libre de infección. No se pudo determinar con claridad la fuente de la infección en los 10 pacientes que fueron diagnosticados tras el alta, sin poder descartar un contagio nosocomial. Dentro de las posibles causas de una infección nosocomial hay que considerar las limitaciones de los test diagnósticos y los falsos negativos documentados también por otros autores23. Por otro lado, es cuestionable la eficiencia real de las medidas de aislamiento establecidas durante la pandemia. A pesar de haber creado unas áreas dedicadas a pacientes sin síntomas respiratorios y/o sospecha de infección por COVID-19, puesto en marcha medidas adicionales tanto de limpieza como de protección de los profesionales y de los pacientes, aplicando restricción del tránsito en dichas zonas, puede que estas medidas no fuesen suficientes para garantizar la ausencia de contagios intrahospitalarios. Por lo tanto, habría que considerar el diseño de un circuito estanco que considere todas las etapas del proceso diagnóstico y terapéutico de los pacientes que vayan a ingresar durante el periodo de epidemia.
Es altamente probable que los meses siguientes al pico de la pandemia se tenga que vivir una época de «convivencia» más o menos prolongada con la enfermedad por COVID-19, generando el problema de la puesta en marcha de la actividad quirúrgica, sobre todo en pacientes oncológicos. Aunque la demora en el tratamiento de los pacientes oncológicos puede empeorar el pronóstico a largo plazo6, 10, 11, es muy importante considerar el aumento de la morbimortalidad postoperatoria de estos pacientes si son infectados por SARS-CoV-2. Con el fin de ofrecer el mejor tratamiento posible, se hace necesario, por un lado, la optimización adecuada de los recursos disponibles, y por el otro, la priorización de los pacientes a la espera de una intervención quirúrgica24.
En cuanto a la optimización de los recursos disponibles para la puesta en marcha de la actividad quirúrgica en hospitales que han estado tratando pacientes con COVID-19, habría que garantizar medidas de seguridad tanto para los pacientes como para los profesionales que los atienden16. De no poder realizar una coordinación nacional o regional con la creación de centros que se dediquen exclusivamente al tratamiento de pacientes positivos o sin enfermedad, creemos que hay unas premisas fundamentales que se deben respetar en cada centro. Estas medidas se basan en los siguientes puntos:
-
1)
Creación de programas de descontaminación en caso de infección probada o sospechosa. Diseño de áreas limpias estancas apropiadamente preparadas, posiblemente con códigos de colores (por ejemplo: verde, amarillo y rojo) y según el riesgo de contaminación ambiental de los pacientes que se prevé que vayan a alojar25, 26.
- 2)
-
3)
Garantía de la seguridad del paciente, detectando casos asintomáticos que podrían empeorar tras la intervención27, 28.
-
4)
Prevención de la contaminación de estas áreas protegidas para evitar brotes intrahospitalarios y así garantizar la seguridad de los pacientes y del personal29, 30.
En cuanto a la priorización de los pacientes en lista de espera quirúrgica, hay que tener en cuenta que durante el estado de «convivencia» con la pandemia es improbable que se pueda asegurar a los pacientes la ausencia completa de riesgo de contagio tras el procedimiento quirúrgico. La toma de decisiones sobre el tratamiento más adecuado para cada paciente deberá realizarse a través de un comité multidisciplinar, basándose en los siguientes factores:
-
a)
Riesgo de complicaciones relacionadas con el paciente (Clasificación anestésica preoperatoria ASA, ECOG)21, 31.
-
b)
Riesgo de complicaciones relacionadas con la enfermedad, su progresión y el procedimiento quirúrgico32, 33, 34, 35.
-
c)
Disponibilidad de alternativas terapéuticas a la cirugía de menor riesgo (quimioterapia, radioterapia, procedimientos endoscópicos, termoablación, etc.)36, 37, 38, 39.
-
d)
Momento en el que nos encontremos dentro de la evolución de la pandemia, presión asistencial y recursos disponibles en cada centro4.
Esta priorización de las indicaciones debe incluir sin duda alguna una información detallada a los pacientes y sus familiares de los riesgos y beneficios en cada caso, así como de la necesaria colaboración y soporte familiar en la recuperación en su domicilio, dada la importancia que adquiere el alta hospitalaria precoz para reducir el riesgo de contagio. Los pacientes deberían ser pormenorizadamente informados de los riesgos y beneficios de someterse a la intervención quirúrgica, en función de sus comorbilidades, las condiciones del centro en cada momento y las características de cada intervención. Debe exponerse al paciente de forma clara y concisa el riesgo que conlleva contraer infección por SARS-CoV-2, su repercusión en el desarrollo de complicaciones postoperatorias y la eventual mortalidad asociada. Por otro lado, el paciente debe conocer cuál es el riesgo de cambio pronóstico por la evolución de su patología y el beneficio que aporta el tratamiento quirúrgico en su caso.
Conclusiones
Los pacientes sometidos a cirugía electiva entre el mes previo al inicio de la pandemia por COVID-19 y los días de mayor incidencia de casos presentaron una elevada tasa de complicaciones postoperatorias con una tasa de infección por SARS-CoV-2 de hasta el 16% en pacientes sometidos a cirugía oncológica.
La puesta en marcha de la actividad quirúrgica en hospitales que han estado y siguen tratando enfermos COVID-19 debería basarse en una priorización de los casos a operar, respetando unas premisas de seguridad y optimización de los recursos disponibles, garantizando la seguridad tanto de los pacientes como de los profesionales.
Grupo colaborativo de trabajo
Elena Bermejo Marcos, Carlos Cerdán Santacruz, Jesús Delgado Valdueza, Beatriz Doblado Cardellach, Iñigo García Sanz, Alberto Gimeno Calvo, Cristina Marín Campos, José Luis Martín Álvarez, Teresa Pérez de la Fuente, Ana Rodríguez Sánchez, Mónica Sánchez Gallardo, Luis Sánchez-Urdazpal González, Emma Torres Mínguez, Álvaro Valdés de Anca, Francisco Eduardo Viamontes Ugalde, Jose María Lopesino González, Lara Blanco Teres, Álvaro Gancedo Quintana, Julia Revuelta Ramírez, Livia Delgado Burdalo, Rodrigo Tovar Pérez, Ramón Sanz Ongil.
Conflicto de intereses
Los autores certifican que no existe conflicto de intereses con ninguna organización financiera/de investigación/académica, con respecto al contenido que se analiza en el manuscrito.
Bibliografía
- 1.Guan W.J., Ni Z.Y., Hu Y., Liang W.H., Ou C.Q., He J.X. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020 doi: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Adams J.G., Walls R.M. Supporting the health care workforce during the COVID-19 global epidemic. JAMA. 2020 doi: 10.1001/jama.2020.3972. [DOI] [PubMed] [Google Scholar]
- 3.Ministerio de Sanidad, Consumo y Bienestar Social - Profesionales - Enfermedad por nuevo coronavirus, COVID-19 [Internet] [consultado 15 Abr 2020]. Disponible en: https://www.mscbs.gob.es/en/profesionales/saludPublica/ccayes/alertasActual/nCov-China/home.htm
- 4.Balibrea J.M., Badia J.M., Rubio Pérez I., Martín Antona E., Álvarez Peña E., García Botella S. Manejo quirúrgico de pacientes con infección por COVID-19. Recomendaciones de la Asociación Española de Cirujanos. Cir Esp. 2020 doi: 10.1016/j.ciresp.2020.03.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Iacobucci G. Covid-19: all non-urgent elective surgery is suspended for at least three months in England. BMJ. 2020;368:m1106. doi: 10.1136/bmj.m1106. [DOI] [PubMed] [Google Scholar]
- 6.Tao K.X., Zhang B.X., Zhang P., Zhu P., Wang G.B., Chen X.P. [Recommendations for general surgery clinical practice in 2019 coronavirus disease situation] Zhonghua Wai Ke Za Zhi. 2020;58:170–177. doi: 10.3760/cma.j.issn.0529-5815.2020.03.003. [DOI] [PubMed] [Google Scholar]
- 7.Biagi J.J., Raphael M.J., Mackillop W.J., Kong W., King W.D., Booth C.M. Association between time to initiation of adjuvant chemotherapy and survival in colorectal cancer: a systematic review and meta-analysis. JAMA. 2011;305:2335–2342. doi: 10.1001/jama.2011.749. [DOI] [PubMed] [Google Scholar]
- 8.Beck C., Weber K., Brunner M., Agaimy A., Semrau S., Grutzmann R. The influence of postoperative complications on long-term prognosis in patients with colorectal carcinoma. Int J Colorectal Dis. 2020 doi: 10.1007/s00384-020-03557-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Artinyan A., Orcutt S.T., Anaya D.A., Richardson P., Chen G.J., Berger D.H. Infectious postoperative complications decrease long-term survival in patients undergoing curative surgery for colorectal cancer: a study of 12,075 patients. Ann Surg. 2015;261:497–505. doi: 10.1097/SLA.0000000000000854. [DOI] [PubMed] [Google Scholar]
- 10.Aminian A., Safari S., Razeghian-Jahromi A., Ghorbani M., Delaney C.P. COVID-19 outbreak and surgical practice: unexpected fatality in perioperative period. Ann Surg. 2020 doi: 10.1097/SLA.0000000000003925. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Lei S., Jiang F., Su W., Chen C., Chen J., Mei W. Clinical characteristics and outcomes of patients undergoing surgeries during the incubation period of COVID-19 infection. EClinicalMedicine. 2020:100331. doi: 10.1016/j.eclinm.2020.100331. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Besnier E., Tuech J.J., Schwarz L. We asked the experts: Covid-19 outbreak: is there still a place for scheduled surgery? “Reflection from Pathophysiological Data”. World J Surg. 2020;44:1695–1698. doi: 10.1007/s00268-020-05501-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Local Resumption of Elective Surgery Guidance. American College of Surgeon [Internet] [consultado 17 Abr 2020]. Disponible en: https://www.facs.org/-/media/files/covid19/local_resumption_of_elective_surgery_guidance.ashx
- 14.Coccolini F., Perrone G., Chiarugi M., Di Marzo F., Ansaloni L., Scandroglio I. Surgery in COVID-19 patients: operational directives. World J Emerg Surg. 2020;15:25. doi: 10.1186/s13017-020-00307-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.SAGES and EAES Recommendations Regarding Surgical Response to COVID-19 Crisis - SAGES [Internet] [consultado 15 Abr de 2020]. Disponible en: https://www.sages.org/recommendations-surgical-response-covid-19
- 16.Brücher B.L.D.M., Nigri G., Tinelli A., Lapeña J.F.F., Espin-Basany E., Macri P. COVID-19: Pandemic surgery guidance. 4open. 2020;3 [Google Scholar]
- 17.Escala dinámica de Fases de Alarma y Escenarios durante la pandemia [Internet]. Asociación Española de Cirujanos; 2020 [consultado 15 Abr 2020]. Disponible en: https://www.aecirujanos.es/files/noticias/152/documentos/Fases_de_alerta___v_3.pdf
- 18.Wong H.Y.F., Lam H.Y.S., Fong A.H., Leung S.T., Chin T.W., Lo C.S.Y. Frequency and distribution of chest radiographic findings in COVID-19 positive patients. Radiology. 2019:201160. doi: 10.1148/radiol.2020201160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Dindo D., Demartines N., Clavien P.A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004;240:205–213. doi: 10.1097/01.sla.0000133083.54934.ae. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Piva S., Filippini M., Turla F., Catteneo S., Margola A., De Fulviis S. Clinical presentation and initial management critically ill patients with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection in Brescia, Italy. J Crit Care. 2020;58:29–33. doi: 10.1016/j.jcrc.2020.04.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Buccheri G., Ferrigno D., Tamburini M. Karnofsky and ECOG performance status scoring in lung cancer: a prospective, longitudinal study of 536 patients from a single institution. Eur J Cancer. 1996;32A:1135–1141. doi: 10.1016/0959-8049(95)00664-8. [DOI] [PubMed] [Google Scholar]
- 22.Segura-Sampedro J.J., Reyes M.L., García-Granero A., de la Portilla F. 2020. Recomendaciones de actuación patología colorrectal de la AECP ante COVID-19. Documento 1_V1_marzo [Internet] [consultado 15 Abr 2020]. Disponible en: https://aecpes.org/images/site/slider/Recomendaciones_de_actuacion_ante_COVID.pdf. [Google Scholar]
- 23.Tuech J.J., Gangloff A., Di Fiore F., Michel P., Brigand C., Slim K. Strategy for the practice of digestive and oncological surgery during the Covid-19 epidemic. J Visc Surg. 2020 doi: 10.1016/j.jviscsurg.2020.03.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Di Saverio S., Pata F., Gallo G., Carrano F., Scorza A., Sileri P. Coronavirus pandemic and colorectal surgery: practical advice based on the Italian experience. Colorectal Dis. 2020 doi: 10.1111/codi.15056. [DOI] [PubMed] [Google Scholar]
- 25.Le A.B., Biddinger P.D., Smith P.W., Herstein J.J., Levy D.A., Gibbs S.G. A highly infectious disease care network in the US Healthcare System. Health Secur. 2017;15:282–287. doi: 10.1089/hs.2016.0073. [DOI] [PubMed] [Google Scholar]
- 26.Bannister B., Puro V., Fusco F.M., Heptonstall J., Ippolito G., EUNID Working Group Framework for the design and operation of high-level isolation units: consensus of the European Network of Infectious Diseases. Lancet Infect Dis. 2009;9:45–56. doi: 10.1016/S1473-3099(08)70304-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Yu G.Y., Lou Z., Zhang W. [Several suggestions of operation for colorectal cancer under the outbreak of corona virus disease 2019 in China] Zhonghua Wei Chang Wai Ke Za Zhi. 2020;23:208–211. doi: 10.3760/cma.j.cn.441530-20200224-00074. [DOI] [PubMed] [Google Scholar]
- 28.Li R., Pei S., Chen B., Song Y., Zhang T., Yang W. Substantial undocumented infection facilitates the rapid dissemination of novel coronavirus (SARS-CoV2) Science. 2020 doi: 10.1126/science.abb3221. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Ti L.K., Ang L.S., Foong T.W., Ng B.S.W. What we do when a COVID-19 patient needs an operation: operating room preparation and guidance. Can J Anaesth. 2020 doi: 10.1007/s12630-020-01617-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Ran L., Chen X., Wang Y., Wu W., Zhang L., Tan X. Risk factors of healthcare workers with corona virus disease 2019: a retrospective cohort study in a designated hospital of Wuhan in China. Clin Infect Dis. 2020 doi: 10.1093/cid/ciaa287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Wolters U., Wolf T., Stutzer H., Schroder T. ASA classification and perioperative variables as predictors of postoperative outcome. Br J Anaesth. 1996;77:217–222. doi: 10.1093/bja/77.2.217. [DOI] [PubMed] [Google Scholar]
- 32.Di Martino M., Mora-Guzman I., Blanco-Traba Y.G., Diaz M.C., Khurram M.A., Martin-Perez E. Predictive factors of pancreatic fistula after pancreaticoduodenectomy and external validation of predictive scores. Anticancer Res. 2019;39:499–504. doi: 10.21873/anticanres.13140. [DOI] [PubMed] [Google Scholar]
- 33.Margonis G.A., Sasaki K., Gholami S., Kim Y., Andreatos N., Rezaee N. Genetic and morphological evaluation (GAME) score for patients with colorectal liver metastases. Br J Surg. 2018;105:1210–1220. doi: 10.1002/bjs.10838. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Sciuto A., Merola G., De Palma G.D., Sodo M., Pirozzi F., Bracale U.M. Predictive factors for anastomotic leakage after laparoscopic colorectal surgery. World J Gastroenterol. 2018;24:2247–2260. doi: 10.3748/wjg.v24.i21.2247. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Lin H.S., Watts J.N., Peel N.M., Hubbard R.E. Frailty and post-operative outcomes in older surgical patients: a systematic review. BMC Geriatr. 2016;16:157. doi: 10.1186/s12877-016-0329-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Heimbach J.K., Kulik L.M., Finn R.S., Sirlin C.B., Abecassis M.M., Roberts L.R. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology. 2018;67:358–380. doi: 10.1002/hep.29086. [DOI] [PubMed] [Google Scholar]
- 37.Di Martino M., Rompianesi G., Mora-Guzmán I., Martín-Pérez E., Montalti R., Troisi R.I. Systematic review and meta-analysis of local ablative therapies for resectable colorectal liver metastases. Eur J Surg Oncol. 2020;46:772–781. doi: 10.1016/j.ejso.2019.12.003. [DOI] [PubMed] [Google Scholar]
- 38.Dumoulin F.L., Hildenbrand R. Endoscopic resection techniques for colorectal neoplasia: Current developments. World J Gastroenterol. 2019;25:300–307. doi: 10.3748/wjg.v25.i3.300. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Dossa F., Chesney T.R., Acuna S.A., Baxter N.N. A watch-and-wait approach for locally advanced rectal cancer after a clinical complete response following neoadjuvant chemoradiation: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2017;2:501–513. doi: 10.1016/S2468-1253(17)30074-2. [DOI] [PubMed] [Google Scholar]