Samenvatting
In dit hoofdstuk wordt aandacht besteed aan een aantal onderwerpen die verband houden met het bloed, met infectie, met weerstand en met het milieu intérieur. Veel IC-patiënten hebben een verstoring van bloedwaarden, een infectie, een verminderde weerstand, of een verstoring van het milieu intérieur. Naast praktische aspecten, zoals het afnemen van bloed, worden in dit hoofdstuk ook de oorzaken en gevolgen van de betreffende verstoringen beschreven.
4.2 Stolling
4.2.1 Het normale stollingsmechanisme
De stolling valt in twee delen uiteen: de primaire en de secundaire hemostase. Bij de primaire hemostase gaat het om de aggregatie van trombocyten onder invloed van von-willebrand-factor (VWF). Bij een verwonding komen de trombocyten in contact met het subendotheel. Hierdoor treedt adhesie van de trom-bocyten aan het collageen op, wat wordt gemedieerd door VWF.
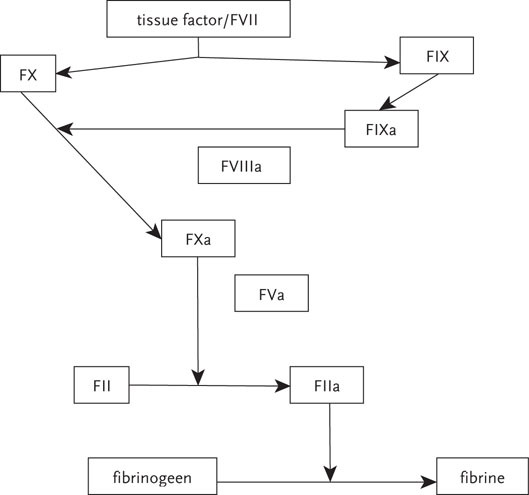
De secundaire hemostase leidt, via activatie van de stollingscascade, tot polymerisatie van fibrine en de vorming van een stolsel. Van belang is hierbij de zogenoemde tissue factor (TF), die vrijkomt bij endotheelbeschadiging. De klassieke intrinsieke en extrinsieke stollingswegen zijn klinisch niet van belang.
Deze TF vormt met geactiveerde stollingsfactor VII (FVIIa) een complex, dat via de activatie van FX protrombine omzet in trombine (FIIa). Deze trombine zet fibrinogeen om in fibrine, die onder invloed van FXIIIa polymeriseert tot een fibrineprop (figuur 4.1).
De primaire hemostase kan gestoord zijn door een reeds aanwezige (en soms onbekende) stollingsstoornis (ziekte van Von Willebrand) waarbij de VWF tekortschiet. De functie van de trombocyten kan gestoord zijn als gevolg van uremie (uremische trombopathie), of door het gebruik van sommige geneesmiddelen zoals trombocyten-aggregatieremmers (NSAID’s; salicylaten, clopidogrel, Plavix; dipyridamol, Persantin), en door een trombopenie (bloedverlies, hemodilutie).
De secundaire hemostase is gestoord bij stollingsstoornissen (aangeboren of verworven), gebruik van coumarines of heparine, synthesestoornissen van de lever, diffuse intravasale stolling (DIS ), heparinegeïnduceerde trombopenie (HIT), of een tekort aan stollingsfactoren door bloedverlies of hemodilutie. Bij een lichaamstemperatuur lager dan 36°C neemt de effectiviteit van de secundaire hemostase af.
Het verrichten van stollingsonderzoek is essentieel voor het analyseren van de werking van het stollingsmechanisme. De meest gangbare tests zijn trombocytentelling, PT (protrombinetijd) en APTT (geactiveerde partiële tromboplastinetijd). Een normaal aantal bloedplaatjes zegt niet altijd alles over de kwaliteit van de primaire hemostase (trombopathie, trombocyten-aggregatieremmers). De PT en de APTT testen de secundaire hemostase (fibrinevorming). Verlenging van deze stollingstijden geeft een indruk van de ernst van het tekort aan stollingsfactoren. Het bepalen van de PT en de APTT neemt veel tijd in beslag (ongeveer een uur) en is daarom als acute evaluatie van therapeutische interventie beperkt bruikbaar.
Bovendien worden de bloedmonsters tijdens de bepaling opgewarmd tot 37°C. In het geval van een onderkoelde patiënt (patiënt op straat gevonden, koude infusievloeistoffen, lange interventietijd) zeggen normale stollingstijden dus niets over de hemostase in de patiënt zelf. Het meten van individuele stollingsfactoren en afbraakproducten van fibrine heeft bij acuut ernstig bloedverlies geen toegevoegde waarde. Pas wanneer de APTT en de PT meer dan anderhalf keer verlengd zijn, neemt bloedverlies toe. De fibrinogeenwaarde daalt onder een kritische grens wanneer minstens anderhalf maal het circulerend volume verloren is gegaan. De kritische grens voor trombocyten wordt bereikt bij een bloedverlies van ruim tweemaal het circulerend bloedvolume. Er is hier echter een ruime spreiding.
4.2.2 Verschijnselen van stoornissen in het stollingsmechanisme
Abnormale bloedingsneiging
Een abnormale bloedingsneiging is in de volgende gevallen te herkennen of te voorspellen:
■ als herhaaldelijk een nabloeding is opgetreden na tandextractie, kleine chirurgische ingrepen of een bevalling, vooral als een bloedtransfusie nodig was;
■ als in de familie een bloedingsneiging voorkomt;
■ als regelmatig zonder duidelijke oorzaak (spontane) bloedingen zijn opgetreden op verschillende plaatsen van het lichaam (bloedneuzen, tandvleesbloedingen, hematomen zonder duidelijk trauma).
Het is soms mogelijk om te voorspellen of de bloedingsneiging veroorzaakt wordt door een tekort aan of defect van de bloedplaatjes of door een tekort aan stollingsfactoren.
Als de bloedplaatjes de oorzaak zijn van de bloedingsneiging, begint de bloeding meestal direct na een trauma. De bloeding is meestal oppervlakkig gelokaliseerd in huid, slijmvliezen, neus, spijsverteringskanaal of urinewegen. Een lokale behandeling is meestal voldoende.
De ziekte van Von Willebrand is een voorbeeld van een bloedingsneiging door niet goed functionerende bloedplaatjes. Ze komt in Nederland regelmatig voor en wordt veroorzaakt door een tekort aan of het niet goed functioneren van de von-willebrand-factor. De von-willebrand-factor is een koppelstukje van eiwit dat los in het bloed voorkomt en dat de bloed-plaatjes nodig hebben om zich aan de collagene vezels te hechten. Zonder een goed functionerende von-willebrand-factor is de adhesie van de bloedplaatjes gestoord en heeft de patiënt een bloedingsneiging.
De behandeling bestaat uit het toedienen van de von-willebrand-factor. In sommige gevallen kan het geneesmiddel desmopressinediacetaat een verlaagde eigen productie van de von-willebrand-factor tijdelijk stimuleren, bijvoorbeeld ter voorbereiding op een operatieve ingreep. Ten slotte kan deze behandeling nog ondersteund worden met de fibrinolyseremmer tranexaminezuur.
Als de stollingsfactoren de oorzaak zijn van de bloedingsneiging, treedt de bloeding meestal pas uren tot dagen na een trauma op. De bloeding is dan meestal in de diepte gelegen, zoals in de spieren, de gewrichten of retroperitoneaal. Er is meestal een langdurige behandeling nodig. Dit soort bloedingen kan bijvoorbeeld optreden bij overdosering van coumarinederivaten. Dan is er een tekort aan (vitamine K-afhankelijke) stollingsfactoren door een blokkering van de aanmaak.
Een voorbeeld van een aangeboren stollingsstoornis door een tekort aan of het niet goed functioneren van een stollingsfactor is hemofilie A (stoornis van factor VIII) of hemofilie B (stoornis van factor IX). De behandeling bestaat uit het zo nodig toedienen van de desbetreffende factor.
Abnormale stollingsneiging
In de volgende gevallen is een abnormale stollingsneiging te herkennen of te voorspellen:
■ bij een voorgeschiedenis van recidiverende embolieën zonder duidelijke oorzaak;
■ als in de familie trombose voorkomt;
■ als zich op jonge leeftijd trombose of embolie heeft voorgedaan.
Relatief zeldzaam zijn aangeboren stollingsneigingen die bijvoorbeeld berusten op deficiënties van antitrombine III, proteïne C of proteïne S. Vaker komt een afwijking van stollingsfactor V voor, factor V Leiden. Het gaat vaak niet om volledige deficiënties. Een totaal ontbreken van antitrombine III is waarschijnlijk niet met het leven verenigbaar.
Het antistollingseffect van heparine berust op versterking van de werking van antitrombine III. Heparine zal dus bij patiënten met antitrombine III-deficiëntie minder goed werken. Gelukkig reageren patiënten met deficiënties van antitrombine III, proteïne C, proteïne S en factor V Leiden wel goed op behandeling met coumarinederivaten. Toch komt het vaak voor dat patiënten trombose krijgen (zelfs recidiverend) zonder dat laboratoriumonderzoek enige afwijking kan aantonen. Deze patiënten moeten worden herkend en preventief worden behandeld met heparine (tegenwoordig laagmoleculaire heparine) of anticoagulantia.
Uit ervaring is gebleken dat vooral de volgende groepen een verhoogd risico hebben op het optreden van een diepe veneuze trombose met als mogelijke ernstige complicatie een longembolie:
■ bedlegerige patiënten;
■ patiënten die immobiel worden gehouden, bijvoorbeeld door een gipsverband;
■ patiënten die minder dan drie maanden geleden een operatie hebben ondergaan;
■ patiënten met een CVA bij gegeneraliseerde atherosclerose;
■ patiënten met een eerdere longembolie of diepe veneuze trombose;
■ patiënten met een bestaande maligniteit;
■ patiënten met ernstig hartfalen;
■ patiënten met obesitas;
■ patiënten die roken;
■ patiënten die orale anticonceptiva gebruiken/zwangere patiënten.
4.2.3 Stollingsonderzoek
Trombocytenaantal
Het normale aantal trombocyten in het bloed is 150–400 × 109/l. Daalt het trombocytenaantal tot ongeveer 50-100 × 109/l, dan treden alleen bij ernstig trauma bloedingen op. Tussen de 20 en 50 × 109/l komen gemakkelijk huid-en slijmvliesbloedingen voor. Onder de 20 × 109/l is er een grote kans op (spontane) ernstige bloedingen, vooral in de hersenen of het spijsverteringskanaal.
Trombocytopenie op de IC treedt op bij 30-50% van de patiënten, waarbij in 3-6% van de gevallen de trombocytopenie ernstig is. De volgende factoren spelen een rol bij het ontstaan van de trombocytopenie:
■ beenmergremming door sepsis;
■ infecties;
■ diffuse intravasale stolling;
■ heparinegeïnduceerde trombopenie;
■ geneesmiddelengeïnduceerde trombopenie;
■ idiopathische trombocytopenische purpura (ITP);
■ trombotische trombopenische purpura (TTP);
■ extracorporele circulatie;
■ massale bloeding.
Bloedingstijd
De bloedingstijd wordt gemeten om een indruk te krijgen van de interactie tussen de bloedplaatjes en de vaatwand (primaire hemostase), maar is onderhevig aan grote variaties. Leeftijd, toestand van de huid, temperatuur en bijkomende ziekten zijn alle van invloed op de bloedingstijd. Hierdoor is de bloedingstijd niet van waarde bij een oriënterend stollingsonderzoek. De bloedingstijd is verlengd bij een tekort aan bloedplaatjes (trombopenie) of bij niet goed werkende plaatjes (trombopathie). Een voorbeeld van dit laatste is de ziekte van Von Willebrand (zie paragraaf 4.2.2). Bij een bloedingstijd langer dan tien minuten bestaat er een kleine kans op een aanhoudende bloeding. Is de bloedingstijd vijftien tot twintig minuten, dan is die kans groot (normaalwaarde 120-240 seconden).
APTT
Een verdere test is de APTT (geactiveerde partiële tromboplastinetijd); deze wordt gebruikt om na te gaan of de stollingsfactoren (XII, XI, IX, VIII en X, V, II en I) goed functioneren en/of in voldoende mate aanwezig zijn. De APTT wordt bovendien gebruikt voor controle van de ongefractioneerde heparinedosering (normaalwaarde circa 25-35 s). Een verlengde APTT wijst op een gestoorde stolling door een tekort aan stollingsfactoren, ofwel door gestoorde aanmaak ofwel door verhoogd verbruik.
PT
De PT (protrombinetijd) is de tijd die verstrijkt tussen het toevoegen van weefseltromboplastine (weefselfactor) en calcium aan een door citraat onstolbaar gemaakt bloedmonster en het verschijnen van een stolsel. Een verlengde PT wijst op een gestoorde aanmaak van stollingsfactoren, verhoogd verbruik of verlies. De PT wordt gebruikt ter controle van het gebruik van coumarinederivaat (normaalwaarde 10-15 s).
INR
De international normalized ratio (INR) is een maat voor de stollingstijd en geeft aan hoeveel langzamer het bloed van een patiënt stolt ten opzichte van iemand zonder afwijkende stolling; een INR van 3,0 betekent dat het bloed drie keer zo langzaam stolt als bij iemand met een normale stolling. De INR is een gestandaardiseerde weergave van de meting van de PT.
Fibrinogeen
De test op fibrinogeen geeft een grove indruk van de aanmaak en het verbruik van fibrinogeen (normaalwaarde 1,5-4,5 g/l).
D-dimeren
D-dimeren zijn afbraakproducten van fibrine die ontstaan onder invloed van plasmine. De aanwezigheid van D-dimeren duidt altijd op fibrinolyse en daarmee op activatie van het stollingsmechanisme.
4.2.4 Geneesmiddelen die de stolling beïnvloeden
Het onderwerp geneesmiddelen wordt besproken in het hoofdstuk Farmacotherapie van deel 2 van het Leerboek intensive-care-verpleegkunde.
Acetylsalicylzuur
Acetylsalicylzuur (Aspirine®) remt irreversibel de productie van tromboxaan A2 door de bloedplaatjes. Dit voorkomt activatie van de trombocyt en daarmee de aggregatie van trombocyten. Tromboxaan A2 wordt door de bloedplaatjes gemaakt zodra ze geactiveerd worden. Het is de krachtigste plaatjesstimulator die we kennen; bovendien is het een krachtige vaatvernauwer. Acetylsalicylzuur wordt toegepast als secundaire preventie bij hart-en vaatziekten om afzetting van trombocyten op beschadigde endotheeloppervlakten en daarmee verdere vernauwing van arteriële vaten te voorkomen.
Clopidogrel
Clopidogrel remt de activatie van trombocyten en daarmee de trombocytenaggregatie door een irreversibele blokkade van de ADP (adenosinedifosfaat)-receptor. Het uiteindelijke gevolg is een remming van de ADP-afhankelijke GPIIb/IIIa-activatie, waardoor trombocyten niet meer aan elkaar kunnen kleven. Vaak wordt clopidogrel gecombineerd met acetylsalicylzuur.
Directe GPIIb/IIIa-activatieremmers
Deze blokkade duurt maximaal 12 uur. Het indicatiegebied ligt bij acute coronaire syndromen.
NSAID’s
Niet-steroïde anti-inflammatoire middelen (NSAID’s) hebben een reversibel effect op trombocyten en het effect is afhankelijk van de halfwaardetijd van het middel.
Dipyridamol
Dipyridamol remt het fosfodi-esterase in de trombocyt, waardoor het cAMP stijgt en de activatie wordt belemmerd. Het effect op de trombocyt is reversibel en het middel heeft een korte halfwaardetijd.
COX −2-remmers
Prostaglandine-synthetase-remmers hebben alleen bij hogere doseringen een nadelig effect op de trombocytenaggregatie.
Coumarinederivaten
De coumarinederivaten acenocoumarol (Sintrom®) en fenprocoumon (Marcoumar®) remmen de aanmaak van de factoren II, VII, IX en X die in de lever plaatsvindt. Hun dosering wordt bepaald op geleide van de INR. Het antidotum is vitamine K, dat echter pas na een tot twee dagen werkt. Kan daar niet op gewacht worden, dan moet het vier-stollingsfactorenconcentraat (II, VII, IX en X) intraveneus worden toegediend. Vier-stollingsfactorenconcentraat moet in ieder geval direct worden toegediend bij bloedingen in de keelholte of bij een hersenbloeding. Bij een bloeding in de keelholte bestaat acuut verstikkingsgevaar.
Coumarinederivaten worden kortdurend (van minder dan zes weken tot drie maanden) of langdurig (jaren, tot levenslang) toegediend, afhankelijk van de indicatie. Coumarinederivaten worden kortdurend toegediend:
■ bij diepe veneuze trombose met of zonder longembolie;
■ postoperatief ter profylaxe van trombose;
■ bij het – met cardioversie of geneesmiddelen – omzetten van atriumfibrilleren in een regulair sinusritme;
■ bij een bioprothese na een hartklepoperatie;
■ bij het acute hartinfarct, ter voorkoming van diepe veneuze en subendocardiale trombose.
Coumarinederivaten worden langdurig toegediend bij:
■ recidiverende veneuze trombose (waaronder deficiënties van antitrombine III, proteïne C en proteïne S);
■ recidiverende longembolieën;
■ boezemfibrilleren als het linkeratrium vergroot is, zoals bij een afwijkende mitralisklep;
■ een mechanische prothese na een hartklepoperatie.
Heparine
Er bestaan momenteel drie soorten heparine:
■ ongefractioneerde heparine, die neutraliseert via antitrombine de stollingsfactoren X en II; het effect is meetbaar via de APTT – heparine wordt gedoseerd op geleide van de APTT, waarbij de streefwaarde anderhalf tot tweemaal zo hoog is als normaal;
■ laagmoleculaire heparine (LMWH), die neutraliseert via antitrombine met name factor X en minder factor II in vergelijking met ongefractioneerde heparine; hierdoor is er ook minder effect op de APTT;
■ pentasachariden, zoals fondiparinux; dit zijn synthetische producten die selectief stollingsfactor X remmen; er is geen effect op de APTT.
Heparine wordt pre-en postoperatief in lage doses toegediend ter preventie van diepe veneuze trombose. Therapeutisch wordt het gebruikt bij diepe veneuze trombose en longembolie. Tegenwoordig wordt heparine meer en meer vervangen door laagmoleculaire heparine. Die lijkt als stollingsremmer even effectief te zijn, maar veroorzaakt minder bloedingen.
Protamine neutraliseert de werking van met name ongefractioneerde heparine doordat het zich daaraan bindt en een stollingscomplex vormt. Protamine antagoneert slechts 30-60% van de LMWH en heeft geen effect bij pentasachariden. Bij ernstige bloedingen als gevolg van LMWH en pentasachariden kan gebruikgemaakt worden van recombinantfactor VIIa. Plasma heeft geen heparine-antagonerend effect, maar bevat wel antitrombine, het substraat voor heparine.
Door toediening van heparine kan het aantal trombocyten afnemen en kan paradoxaal genoeg een arteriële of veneuze trombose ontstaan. Dit syndroom noemt men heparinegeïnduceerde trombocytopenie (HIT). De kans hierop is het grootst bij ongefractio-neerde heparine.
Trombolytica
Het geneesmiddel streptokinase activeert plasminogeen tot plasmine. Het kan dus stolsels oplossen. Plasmine breekt zowel fibrinogeen als fibrine af. Daardoor kunnen ernstige bloedingen ontstaan. Streptokinase kan slechts eenmaal worden toegediend, omdat bij herhaling allergische reacties kunnen optreden. Streptokinase heeft evenals urokinase meer effect op circulerend plasminogeen. De recombinant-plasminogeen-activatoren hebben meer effect op het plasminogeen dat rond het stolsel zit. Alteplase is een TPA (weefsel-plasminogeen-activator) verkregen door recombinant-DNA-techniek. Alteplase activeert, net als streptokinase, plasminogeen tot plasmine, maar heeft als voordeel dat het slechts zeer zelden antilichaamvorming veroorzaakt en dus meerdere keren kan worden toegediend. Streptokinase en alteplase worden gebruikt voor het oplossen van een trombus die bijvoorbeeld een coronairarterie afsluit en zo een myocard-infarct veroorzaakt.
Tranexaminezuur
Tranexaminezuur werkt tegengesteld aan trombolytica. Het remt de omzetting van plasminogeen in plasmine. Het wordt toegepast bij sommige vormen van bloedingsneiging en bij bloedingen ten gevolge van streptokinase of alteplase. In het laatste geval worden tevens fibrinogeenbevattende preparaten toegediend. Tranexaminezuur mag niet worden gegeven bij bloedingen in de urinewegen of in de hersenen omdat het de stolselvorming bevordert, waardoor obstructie van de urinewegen of verhoogde hersendruk zou kunnen ontstaan.
4.2.5 Bloedingen en trombose
Stoornissen in het stollingsmechanisme kunnen zich uiten in een abnormale bloedingsneiging of in een abnormale stollingsneiging.
Onderdelen van het stollingsmechanisme
Het stollingsmechanisme van het bloed is een zeer gecompliceerd systeem waarbij vaatwand, bloedplaatjes en stollingsfactoren nauw met elkaar samenwerken.
Vaatwand
De vaatwand trekt zich bij een verwonding samen en verkleint daardoor het ontstane gat. Hoe belangrijk dat is, blijkt als een bloedvat zich niet kan samentrekken, zoals bij een hemangioom. Bij een verwonding daarvan treedt een ernstige en langdurige bloeding op.
Trombocyten
Bloedplaatjes hebben drie belangrijke eigenschappen:
■ ze plakken vast aan een vreemd oppervlak (adhesie) of aan elkaar (aggregatie);
■ ze trekken samen als een spier;
■ ze scheiden stoffen uit die invloed hebben op de vaatwand, het stollingsproces en de wondgenezing.
Wordt een bloedvat beschadigd, dan komen collagene vezels vrij te liggen, die zich bij een intact bloedvat binnen de wand bevinden en geen contact met het bloed hebben. Daardoor komen ze in contact met de bloedplaatjes, die zich er binnen een seconde aan hechten. Aan deze bloedplaatjes kleven andere bloedplaatjes vast waardoor er een plug van plaatjes ontstaat die het gat afsluit.
Al snel wordt ter plaatse fibrine gevormd, het eindproduct van de inmiddels geactiveerde stollingsfactoren. Fibrine versterkt de plaatjesplug. Door dit alles stopt de bloeding. Vooral de plaatjes aan de wondrand zijn dan hun korrels kwijt, wat betekent dat ze hun chemische stoffen hebben uitgescheiden.
Fibrine is in het begin alleen aan de buitenzijde van de plug zichtbaar. Pas na ongeveer twintig uur bevindt zich veel fibrine in de plug. De wond is dan stevig afgesloten. Het stolsel is dan ook kleiner geworden, omdat de plaatjes zich hebben samengetrokken.
Stollingseiwitten
In het bloed bevinden zich opgeloste eiwitten die verschillende, onderling samenhangende functies hebben. Men onderscheidt eiwitten die:
■ betrokken zijn bij de fibrineaanmaak. Deze eiwitten maken van het oplosbare fibrinogeen onoplosbaar fibrine. Dit vormt stevige draden die de plaatjesplug versterken. Deze eiwitten worden stollingsfactoren genoemd.
■ de fibrineaanmaak remmen. Deze eiwitten hebben tot taak het stollingsproces tot de plaats van de verwonding te beperken en zo te voorkomen dat een kleine verwonding tot een enorme fibrineproductie leidt. De belangrijkste zijn antitrombine III, proteïne C en proteïne S.
■ fibrine oplossen. Deze eiwitten ruimen uiteindelijk het stolsel weer op. Van deze eiwitten is de weefselplas-minogeen-activator het belangrijkst. Die wordt op de plaats van het stolsel door de vaatwand gemaakt. Het eiwit werkt niet rechtstreeks, maar bindt zich aan fibrine en activeert dan het eveneens aan fibrine gebonden plasminogeen tot plasmine. Plasmine breekt zowel fibrinogeen als fibrine af tot afbraakproducten (fibrinogen/fibrin degradation products, FDP), die in het bloed zijn te meten. Plasmine dat buiten het stolsel in het bloed terechtkomt, wordt onmiddellijk onwerkzaam gemaakt door de in het bloed aanwezige α2-plasmineremmer. Als dat niet zou gebeuren, zou al het in het bloed aanwezige fibrinogeen snel worden afgebroken en ontstond een ernstige bloedingsneiging.
4.2.6 Longembolie
Het onderwerp longembolie wordt ook besproken in het hoofdstuk Respiratie van deel 2 van Leerboek intensive-care-verpleegkunde.
Longembolie is een potentieel levensbedreigende aandoening, maar wel vaak te voorkomen en afdoende te behandelen.
Oorzaak
Bij de meeste longembolieën komen de stolsels uit de diepe venen van de benen of het bekken. Soms is de rechter harthelft de bron van de longembolieën, zoals bij atriumfibrilleren of een infarct van het rechterventrikel. Uit retrospectief onderzoek is gebleken dat een ernstig beloop in de meeste gevallen te voorkomen was geweest door tijdige, preventieve antistolling. Dit betekent dat de preventie van longembolie van vitaal belang is. Verder is longembolie dermate levensbedreigend dat alleen al bij het vermoeden ervan direct met de behandeling met heparine moet worden begonnen. De verdere diagnostiek kan later plaatsvinden.
Pathofysiologie
De stolsels brengen met zich mee dat een gedeelte van de long wel geventileerd, maar niet doorbloed wordt. Blokkade van grotere takken van de arteria pulmonalis geeft een stijging in de arteriële pulmonaaldruk met snelle oppervlakkige ademhaling. Dit ontstaat door een reflexvasoconstrictie, vrijmaking van vasoactieve stoffen en door hypoxemie. In het niet-doorbloede gedeelte van de long daalt de PaCO2, waardoor er - waarschijnlijk reflectoir - een vernauwing van de plaatselijke luchtwegen optreedt. Daardoor wordt de dode ruimte weer kleiner. Verder wordt er in het niet-doorbloede gedeelte minder surfactant gevormd. Surfactant is een vloeistof die zich op de binnenzijde van de longblaasjes bevindt en die de longblaasjes openhoudt. Door gebrek aan surfactant klappen de longblaasjes uiteindelijk dicht. Dit verschijnsel heet atelectase. Door dit alles kan de PaO2 van het bloed dalen en de PaCO2 stijgen. De hartfrequentie loopt op en de cardiac output daalt.
Een longinfarct, het afsterven van longweefsel, komt na een longembolie waarschijnlijk slechts in minder dan 10% van de gevallen voor. Dat komt vermoedelijk doordat longweefsel langs drie wegen van zuurstof wordt voorzien: door de luchtwegen, door de arteria pulmonalis en door de arteriae bronchiales (zijtakken van de aorta).
Het stolsel dat in de long is terechtgekomen, kan weer oplossen of georganiseerd worden. Het oplossen begint na enkele dagen en is meestal na veertien dagen voltooid. Georganiseerd worden wil zeggen dat de trombus volgroeit met bindweefsel en in de wand van het bloedvat wordt ingebouwd. In de meeste gevallen treedt uiteindelijk volledig herstel op.
Een zeer ernstige vorm van longembolie kan optreden tijdens de bevalling of een keizersnede als vruchtwater in de circulatie komt. Vruchtwater is een sterk stollingsbevorderende vloeistof. Het veroorzaakt veel stolsels in de circulatie, die in de long terechtkomen. Dit is een ernstig ziektebeeld met shock en een hoge mortaliteit.
Symptomen
De belangrijkste en vaak enige uiting van een longembolie is plotselinge, onbegrepen kortademigheid. Pleuritische pijn - een heftige, stekende pijn die vastzit aan de ademhaling en kenmerkend is voor pleuraprikkeling - komt alleen bij een longinfarct voor. Dat geldt ook voor het ophoesten van bloed.
Bij een grote longembolie kan een drukkend gevoel op de borst optreden, waarschijnlijk veroorzaakt door rechterventrikelischemie. Een longembolie kan zich uiten in plotseling bewustzijnsverlies, zodat eerst aan een neurologische aandoening wordt gedacht. Verder kunnen supraventriculaire hartritmestoornissen voorkomen. Ten slotte moet aan een longembolie worden gedacht bij hyperventilatie of bij een plotseling verergerende decompensatio cordis of chronische bronchitis.
Tijdens lichamelijk onderzoek worden over de longen meestal geen afwijkingen gehoord. Wel bestaat vaak tachypnoe en tachycardie. Pleuraal wrijven komt alleen bij een longinfarct voor. Koorts wijst meestal op een longinfarct of op een complicerende infectie. In de helft van de gevallen worden in de benen aanwijzingen gevonden voor diepe veneuze trombose.
Aanvullend onderzoek
Het ecg is meestal normaal. Soms zijn er aanwijzingen voor overbelasting van het rechterventrikel. De thoraxfoto is veelal niet afwijkend. Alleen bij een longinfarct kunnen een infiltraat (meestal tegen de pleura aan) en een kleine hoeveelheid vocht in de pleuraholte worden gezien.
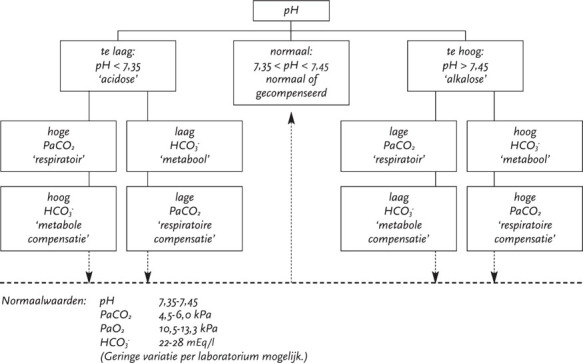
De bloedgassen tonen vaak een verlaagde PaO2, een verlaagde PaCO2 en een respiratoire alkalose. Een normale PaO2 sluit longembolie echter niet uit.
Bij een perfusiescan van de long worden radioactief gelabelde eiwitbolletjes ingespoten. Normaal verspreiden deze zich gelijkmatig over de longen. Ze worden met een speciale camera gefotografeerd. De grote waarde van een perfusiescan van de long is dat bij een gelijkmatige doorbloeding een longembolie van klinisch belang uitgesloten is. Het omgekeerde is echter niet het geval. Wordt een gebied gezien dat niet doorbloed wordt, dan kan dat duiden op een longembolie, maar bijvoorbeeld ook op een pneumonie of een longcarcinoom. Aanvullende informatie geeft dan een ventilatiescan van de long. Deze wordt gemaakt na het inademen van radioactief gas, bijvoorbeeld xenon−133. Een gebied dat wel wordt geventileerd maar niet wordt geperfundeerd, suggereert longembolie, vooral als de thoraxfoto ter plaatse normaal is. In de acute fase is deze vorm van diagnostiek niet de eerste keuze. De aanwezigheid van andere aandoeningen bemoeilijkt vaak de interpretatie van de perfusiescan en de ventilatiescan.
Echocardiografie kan een uitgezet rechterventrikel met verhoogde pulmonalisdrukken laten zien.
Angiografie van de arteria pulmonalis is de gouden standaard, maar CT-angiografie is de eenvoudigste en een nauwkeurige manier om een longembolie aan te tonen en is momenteel het onderzoek van eerste keuze.
Behandeling
De behandeling van longembolie bestaat uit ongefractioneerde heparine intraveneus of laagmoleculaire heparine subcutaan. Alleen bij gebruik van ongefractioneerde heparine is controle door middel van APTT noodzakelijk. De APTT behoort dan ongeveer anderhalf tot tweemaal zo lang te zijn als de normale waarde.
Bij ongefractioneerde heparine wordt na enkele dagen met een coumarinederivaat gestart. Als daarmee een goede INR is bereikt, wordt de ongefractioneerde heparine gestaakt. Het coumarinederivaat wordt ten minste drie maanden voortgezet. Deze periode kan verlengd worden als eventueel aanwezige risicofactoren daartoe aanleiding geven.
Bij een zeer ernstige longembolie kan behandeling met een fibrineoplossend geneesmiddel worden overwogen (trombolyse met alteplase). Dit geneesmiddel versnelt de afbraak van de trombus, maar kan ook grote bloedingen tot gevolg hebben. Bij recidiverende longembolieën kan het levensreddend zijn de vena cava tijdelijk te onderbinden tot de oorzaak van de longembolie, zoals septische embolieën uit het kleine bekken, is weggenomen.
Preventie
Omdat longembolie in 95% van de gevallen afkomstig is uit het diepe veneuze systeem van de benen, betekent preventie van longembolie preventie van diepe veneuze trombose. Bij patiënten met een verhoogde kans op diepe veneuze trombose moet daarom preventief antistolling worden overwogen. Men gebruikt hiervoor bij voorkeur laagmoleculaire heparine of een van de coumarinederivaten per os.
Vetembolie
Op longembolie gelijkende aandoeningen zijn vetembolieën. Vetembolie kan optreden na een fractuur van een lang pijpbeen. Na een periode van 12 tot 36 uur waarin de patiënt geen verschijnselen heeft, treedt plotseling een cardiopulmonale of neurologische verslechtering op. De patiënt wordt kortademig, er ontstaat tachycardie en er kan zich een acute respiratory distress syndrome (ARDS ) ontwikkelen. Verwardheid en coma kunnen optreden. Bloedonderzoek toont anemie en trombopenie. Alleen symptomatische behandeling is mogelijk. De mortaliteit is hoog.
Vasculitis
Bij intraveneuze drugsgebruikers komt vasculitis van de kleine longarteriën voor, waarschijnlijk ten gevolge van ingespoten materialen, zoals talk. Hierdoor treedt obstructie van de longarteriën op. Dit beeld is moeilijk van longembolie te onderscheiden. Het kan tot ernstige pulmonale hypertensie leiden.
4.2.7 Diffuse intravasale stolling
Diffuse intravasale stolling (DIS ) is een verworven, potentieel levensbedreigende aandoening, waarbij in de gehele microcirculatie intravasale stolling ontstaat door systemische excessieve activatie van het stollingssysteem met toegenomen trombinevorming en een tekort aan de normaal aanwezige stollingsremmers. Aanvankelijk is er secundaire fibrinolyse, maar door toename van plasminogeen-activator-remming wordt de fibrinolyse geremd. Er ontstaat een ernstige bloedingsneiging, omdat de stollingsfactoren uitgeput raken en de bloedplaatjes worden verbruikt. Bovendien remmen afbraakproducten van fibrine het stollingsmechanisme.
Oorzaken
Diffuse intravasale stolling doet zich het meest voor bij ernstige weefselbeschadiging en vetembolie door trauma, bij sepsis, bij obstetrische aandoeningen met intra-uteriene vruchtdood, vruchtwaterembolie of solutio placentae, bij incompatibele bloedtransfusie met hemolyse, bij massale transfusie en bij gemetastaseerde tumoren.
Symptomen
Het klinische beeld wordt gekenmerkt door een combinatie van bloedingsneiging, orgaanfunctiestoornissen en orgaanfalen. In het ernstigste geval ontstaan uitgebreide bloedingen in huid en slijmvliezen en verliest de patiënt bloed uit meerdere plaatsen -vooral uit recente operatielittekens, punctieplaatsen en katheteropeningen. Minder vaak treden acrocyanose (blauwe verkleuring van het uiteinde van de extremiteiten), trombose en pregangreneuze veranderingen aan vingers, tenen, genitaliën en neus op. In deze gebieden is dan de bloeddoorstroming sterk afgenomen door vaatvernauwing en microtrombi. Er zijn echter ook patiënten die geen enkel teken van trombose of bloedingsneiging vertonen en toch bij laboratoriumonderzoek tekenen van diffuse intravasale stolling blijken te hebben.
Laboratoriumonderzoek
Het belangrijkste criterium voor diffuse intravasale stolling is een verlaagd fibrinogeengehalte van het bloed. Dit correleert het best met de bloedingsverschijnselen. Verder zijn de D-dimeren in het bloed verhoogd, is het trombocytenaantal verlaagd en is er een verlengde PT.
Behandeling
De behandeling is in eerste instantie gericht op het wegnemen van de oorzaak. Bij solutio placentae betekent dat een snelle beëindiging van de zwangerschap, bijvoorbeeld door sectio caesarea. Bij een infectie moet onmiddellijk behandeling met antibiotica plaatsvinden.
Als bloeding het hoofdsymptoom is, worden vers bevroren plasma en trombocytenconcentraat toegediend om de verbruikte stollingsfactoren en trombocyten aan te vullen. Echter, als de oorzaak van de aandoening niet wordt weggenomen, worden ook deze weer verbruikt. Daarom blijft het wegnemen van de oorzaak van de diffuse intravasale stolling het hoofddoel van de behandeling.
Het toedienen van heparine kan gunstig zijn, maar dit is omstreden. Uit ervaring blijkt dat heparine waarschijnlijk alleen helpt als de tekenen van trombose prevaleren, zoals bij acrocyanose en beginnend gangreen.
4.2.8 Acuut ernstig bloedverlies
Acuut ernstig bloedverlies is een levensbedreigende situatie. Indien niet snel tot adequaat handelen wordt overgegaan, kan de patiënt in korte tijd overlijden. Een dergelijke situatie vereist een op elkaar afgestemd beleid van diagnostiek, chirurgisch ingrijpen (eventueel radiologische of endoscopische interventie), hemodynamische (en vaak ook respiratoire) controle, het garanderen van een minimaal noodzakelijk zuurstoftransport en agressieve controle van de hemostase.
Peroperatief acuut bloedverlies wordt gezien als een aparte entiteit vanwege de gecontroleerde setting waarin dit plaatsvindt.
Een ernstige bloeding is elke zichtbare bloeding die gepaard gaat met:
■ systolische bloeddruk ≤ 90 mmHg en/of
■ Hb ≤ 4,0 mmol/l en/of
■ daling van het Hb van > 1,5 mmol/l in 24 uur en/of
■ transfusiebehoefte > 2 EC (erytrocytenconcentraat);
■ intracraniële bloeding;
■ retroperitoneale bloeding;
■ intraoculaire bloeding.
Een massale bloeding is een ernstige bloeding met daarbij:
■ transfusiebehoefte > 10 EC per 24 uur, of
■ verlies > 1 × circulerend volume per 24 uur, of
■ verlies > 50% circulerend volume in 3 uur, of
■ bloedverlies > 150 ml/min.
Alle andere bloedingen zijn niet ernstig c.q. levensbedreigend.
Symptomen
De symptomatologie van acuut ernstig bloedverlies is goed omschreven: verschijnselen van hypovolemische shock (tachycardie, hypotensie, oligurie, koude acra, transpireren, klam aanvoelen, lethargie, coma).
Veel van deze verschijnselen treden echter pas op als er al een aanzienlijk volume aan bloed is verloren. Bovendien kunnen veel factoren de symptomen maskeren (leeftijd, geneesmiddelen). Naar aanleiding van de aard van een trauma of een andere recente gebeurtenis (bevalling, operatie) is te anticiperen op de mogelijkheid van ernstig bloedverlies (bekkentrauma, femurfractuur enz.) en de mogelijke focus. Ditzelfde geldt voor uitwendig bloedverlies (arteriële bloeding, haematemesis, fluxus post partum). Een complicerende factor kan het gebruik van orale anticoagulantia zijn.
De hoeveelheid bloedverlies bij een acute bloeding is in de praktijk meestal niet te meten of zelfs maar te schatten. De 4-5-6-flexinorm is bij acuut bloedverlies niet toepasbaar.
Oorzaken voor acuut ernstig bloedverlies zijn velerlei. Soms is het bloedverlies zichtbaar, of te verwachten, maar dit is lang niet altijd het geval. Met name de ‘verborgen’ bloedingen worden vaak laat onderkend (bloedverlies in pleuraholte, buikholte, retroperitoneum, darm, bekken, bovenbeen). Snelle en adequate diagnostiek is dan noodzakelijk (echo, CT).
Behandeling van acuut ernstig bloedverlies op de intensive care
De behandeling is primair gericht op het stoppen van het bloedverlies door een chirurgische, radiologische of obstetrische interventie met herstel van een adequate weefselperfusie en weefseloxygenatie door volumeresuscitatie, bloeddrukregulatie en erytrocytentoediening; tevens moet hypothermie worden voorkomen, alsmede een acidose.
Volwassenen kunnen met behulp van compensatiemechanismen een verlies tot 30% van het circulerend volume opvangen zonder bloeddrukdaling. Bij voortgaand bloedverlies kan plotseling een bloeddrukdaling optreden. De hematocriet geeft de mate van bloedverlies niet goed weer, omdat vasoconstrictie en intercompartimentale vochtverschuivingen een beoordeling bemoeilijken. Pas wanneer de infuustherapie gestart is en het circulerend volume op peil is, is het Hb of Ht een betrouwbare parameter.
Massale infusie van kristalloïden (NaCl 0,9%) en plasmavervangingsmiddelen leidt tot een lagere concentratie stollingsfactoren (hemodilutie), waardoor het bloedverlies nog verder kan toenemen. Toediening van meer dan 1000 ml synthetische plasmavervangers vermindert de primaire hemostase, waarschijnlijk door afname van de functie van de von-willebrand-factor (VWF). Vandaar dat per uur niet meer dan 500 ml synthetische plasmavervangers gegeven mag worden. Kristalloïden (NaCl 0,9%) mogen ongelimiteerd worden toegediend, waarbij vanzelfsprekend rekening moet worden gehouden met eventueel pre-existent hartfalen. Bij het in grote hoeveelheden toedienen van NaCl 0,9% of synthetische plasmavervangers (bevatten dezelfde hoeveelheden NaCl als NaCl 0,9%) zal een hyperchloremische acidose ontstaan, en is er het gevaar voor onderkoeling.
Ter voorkoming van een hyperchloremische acidose kan eventueel natriumbicarbonaat 1,4% worden gebruikt. Om onderkoeling tegen te gaan, kunnen de vloeistoffen voorverwarmd worden toegediend. Voorkomen moet worden dat patiënten de zogenoemde lethal triad van hypothermie, acidose en stollingsstoornissen ontwikkelen. Deze lethal triad is een onafhankelijke risicofactor voor een slechte prognose. Vasoactieve medicatie is in principe niet geïndiceerd.
Men zal het verloren bloed aanvullen met erytrocytenconcentraat (EC). Hoewel dit het intravasculaire volume doet toenemen, mogen EC’s nooit worden gebruikt voor volumetherapie! Overigens moet men het zuurstoftransporterende vermogen van geïnfundeerde erytrocyten niet overschatten. Erytrocyten die meer dan enkele dagen zijn bewaard in een bewaarvloeistof, verliezen vrijwel al hun 2,3-difosfoglyceraat (2,3-DPG). Dit 2,3-DPG is noodzakelijk voor de afgifte van zuurstof aan de weefsels. Pas na uren (soms 12-24 uur bij oudere erytrocyten) bevatten de getransfundeerde erytrocyten weer voldoende 2,3-DPG voor een adequate zuurstofafgifte. Voor acute verhoging van de zuurstofafgiftecapaciteit zouden eigenlijk erytrocyten moeten worden gebruikt die niet ouder zijn dan drie dagen.
Suppletie van alleen erytrocyten zonder bloedplaatjes of stollingsfactoren verergert de stollingsstoornissen (hemodilutie van trombocyten en stollingsfactoren, citraat en dextranen in bewaarvloeistof).
Bij langdurige hypotensie, acidose, ischemie, sepsis, beschadigd weefsel (met name hersenweefsel), of bij bepaalde obstetrische complicaties komt een weef-selactivator of een weefsel-plasminogeen-activator vrij en kan DIS ontstaan. Deze factoren stimuleren de stolling en consumeren trombocyten en stollingsfactoren. Plasmine activeert de fibrinolyse, waardoor in het bloed fibrineafbraakproducten vrijkomen die weer bijdragen tot verdere verslechtering van de hemostase door onder andere inhibitie van de trombocytenaggregatie en preventie van stabilisatie van de gevormde fibrine.
Toediening van plasma of trombocytenconcentraten corrigeert in dit geval niet de coagulopathie. Het is van groot belang om de circulatie te herstellen en met name de leverperfusie te optimaliseren (afbraak van fibrinedegradatieproduct (FDP) en geactiveerde stollingsfactoren) om de progressie van de DIS een halt toe te roepen en de hemostase te herstellen. Frequent stollingsonderzoek (PT, APTT, fibrinogeen, trombocyten) is belangrijk voor de diagnostiek van DIS en het beoordelen van het effect van de behandeling.
Toediening van bloedproducten
Een hanteerbaar transfusieprotocol bij acuut ernstig bloedverlies is:
■ eenheden erytrocytenconcentraat bij aanvang;
■ erytrocytenconcentraat bij Hb < 5,0 mmol/l;
■ 2 eenheden trombocytenconcentraat (5 donoren) bij Thr < 50 × 109/l;
■ 3 FFP bij aanvang;
■ 1 FFP per 3 EC;
■ 1 FFP bij APTT > 1,5 maal verlengd.
Bij het gebruik van trombocyten-aggregatie-remmers, of bij het vermoeden op een uremische trombopathie (ureum > 40 mmol/l), kan een trombocytentransfusie worden gegeven (1 zakje = opbrengst van 5 donoren). Bij trombopenie (T < 50 × 109/l) worden trombocyten van 2 × 5 donoren gegeven.
In geval van massaal bloedverlies bij trauma wordt een verhouding erytrocytenconcentraat en FFP van 1:1 geadviseerd.
Stollingsfactoren
Recombinant geactiveerde factor VII (rFVIIa, NovoSeven) heeft als belangrijkste eigenschap dat die de stollingscascade alleen daar activeert waar die zich kan binden met tissue factor (TF). Dat is dus uitsluitend bij de bloedingsplaats, waar TF vrijkomt uit de beschadigde endotheelcellen. Het toedienen van rFVIIa is uitsluitend geïndiceerd voor persisterend ernstig bloedverlies ondanks adequate suppletie van stollingsfactoren en adequate damage control, of bij diffuus bloedverlies als damage control niet mogelijk is.
De dosering is 90 μg/kg i.v., zo nodig eenmaal te herhalen. In de praktijk zal eenmalig 7,2 mg = 360 kIE worden gegeven (3 ampullen à 120 kIE), bij geen of onvoldoende effect te herhalen. Het effect van rFVII hangt overigens wel af van de aanwezigheid van de andere stollingsfactoren. rFVIIa is zelfs effectief gebleken bij hypothermie (in ieder geval tot 33°C), ondanks het bekende negatieve effect van hypothermie op de stolling. Acidose reduceert echter de activiteit van de proteasen in het stollingssysteem (leidt tot verminderde activatie van de stollingsfactoren). Afname van de pH van 7,4 naar 7,0 reduceert het effect van rFVIIa met meer dan 90%. De zuur-basenstatus van de patiënt moet bekend zijn alvorens besloten wordt rFVIIa toe te dienen, evenals de PT en APTT. Het hemostatisch effect van rFVIIa wordt vrijwel direct na toediening bereikt. Dat betekent dat wanneer na vijftien tot twintig minuten er nog geen adequate hemostase heeft plaatsgevonden, een tweede dosis kan worden overwogen. Slechts in 1-4% van de patiënten traden trombo-embolische complicaties op.
Indien en sprake is van een ernstige bloeding bij een patiënt die coumarinederivaten gebruikt, dienen deze te worden gestaakt. Tevens dient vitamine K te worden gesuppleerd (1 dd 10 mg i.v. gedurende 5 dagen). Bij een PTT > 1,5 INR moeten tevens de vier vitamine K-afhankelijke stollingsfactoren worden gesuppleerd, waarna direct opnieuw controle van de PTT dient plaats te vinden.
Hemostatica
Naast bloedproducten kunnen ook hemostatica worden toegediend. Desmopressine verbetert de primaire hemostase. Het wordt ingezet bij pre-existent gebruik van salicylaten en NSAID’s, in een dosering van 0,4 μg/kg i.v. (eenmalig, in 100 ml NaCl 0,9%, inlopen in 20 min). Tranexaminezuur remt de fibrinolyse. Het kan worden toegediend in een dosis van 3 dd 1 g i.v.
Streefwaarden
Er dient te worden gestreefd naar een Hb > 4,5-5 mmol/l, APTT en PT < 1,5 maal verlengd, trombocyten > 50 × 109/l en fibrinogeen > 0,8 g/l. Daarnaast moeten hemodynamische en respiratoire waarden zo veel mogelijk fysiologisch zijn, net als de zuurgraad en de lichaamstemperatuur.
4.7 Infectie en weerstand
Levensbedreigende infecties zijn zowel de oorzaak als een gevolg van ernstige ziekte. Het optreden van ernstige infecties of sepsis komt door een toename van patiënten met een verhoogd risico op infecties steeds meer voor. Er is een toename van oudere patiënten, van patiënten met een gestoorde immuunrespons, van patiënten met een maligniteit en behandeling hiervoor, van patiënten met een chronische ziekte, van patiënten met trauma, enzovoort.
Veel patiënten op de IC-afdeling hebben een gestoorde afweer tegen infecties. De aanwezigheid van een onderliggende ziekte, zoals een hematologische maligniteit (chronische vormen van leukemie, maligne lymfomen), een recente behandeling met chemotherapie of medicatie die afstoting van een orgaantransplantaat moet voorkomen, zijn voorbeelden die reeds bij opname bekend zijn. Bij andere patiënten is het minder voor de hand liggend dat de afweer tegen infecties verminderd is, maar ook bij een groot trauma of sepsis en bij behandeling met corticosteroïden is de afweer tegen infecties veranderd. Niet alleen kan de gestoorde afweer de infectie veroorzaken waarvoor patiënt wordt opgenomen, maar ook is de patiënt door de gestoorde afweer veel gevoeliger voor het oplopen van infecties tijdens het verblijf op de IC-afdeling.
De grote gevolgen van een tekortschietend immuunsysteem benadrukken het belang van een goede infectiepreventie en hygiëne in een ziekenhuis. Ook een goed controlesysteem op het naleven van alle infectiebeperkende maatregelen is van essentieel belang.
De werking van het immuunsysteem in ernstig zieke patiënten
Het verdedigingsmechanisme van het lichaam bestaat uit drie onderdelen, die binnendringende micro-organismen eerst moeten overwinnen om een (ernstige) infectie te kunnen veroorzaken.
Allereerst de fysieke barrière die bestaat uit de huid en de slijmvliezen. Een intacte huid voorkomt het binnendringen van micro-organismen. Indien huid of slijmvliezen een defect vertonen, kan een micro-organisme makkelijker naar binnen gaan. Ook een stoornis in de functie van de cilia op de slijmvliezen van de luchtwegen die ingeademde partikels naar boven vervoeren en via hoesten verwijderen, kan leiden tot een beschadiging van de slijmvliezen en aldus een porte d’entrée creëren. Ook de zuurtegraad van de maag vormt een barrière tegen binnendringende bacteriën. De normale bacteriële flora in de mond en het darmstelsel is ook een beschermend factor tegen vreemde bacteriën. Ongeveer 99% van alle micro-organismen kan de bestaande barrières niet passeren.
De aangeboren immuunrespons is de tweede verdedigingsring in het lichaam. Het lichaam kan reageren op vreemde antigenen zonder eerdere blootstelling aan dit antigeen. Het is een snel werkende, niet-specifieke afweer tegen binnendringende micro-organismen. Het bestaat uit fagocyterende cellen die door cytokinen worden geactiveerd, uit natural-killer-cellen (een lymfocytensubgroep) en uit het complementsysteem. De acute-fase-reactie met een stijging van CRP (C-reactief proteïne) en daling van albumine is een uiting van de aangeboren respons. Als er in dit systeem aangeboren afwijkingen zitten, is er sprake van een immuundeficiëntie of een autoimmuunziekte. Als het systeem tekortschiet, treedt het verworven immuunsysteem in werking, de derde verdedigingsring.
Het verworven, specifieke immuunsysteem berust op lymfocyten die in staat zijn om specifieke vreemde antigenen te herkennen. De vreemde antigenen worden door speciale cellen (antigeenpresenterende cellen) naar lymfoïde weefsels, zoals lymfeklieren en milt, gebracht. Daar wordt het specifieke vreemde antigeen in contact gebracht met T-lymfocyten. Geactiveerde helper-T-lymfocyten produceren cytokinen die de afweerreactie op gang brengen. Andere geactiveerde lymfocyten worden geheugencellen die gereed zijn om bij een volgend contact met een specifiek antigeen snel te kunnen reageren. Er worden ook cytotoxische T-lymfocyten geactiveerd, die door bacteriën en virussen geïnfecteerde cellen binden en vernietigen door direct cel-celcontact.
B-lymfocyten hebben antilichamen op hun oppervlak en worden door oplosbare vreemde antigenen geactiveerd. Als het antigeen in contact komt met een passende B-lymfocyt, wordt deze gestimuleerd om grote hoeveelheden antilichamen (immunoglobulinen) aan te maken. Het gevormde antigeen-antilichaamcomplex maakt het binnendringende micro-organisme onschadelijk. B-lymfocyten ontwikkelen zich tot plasmacellen meestal na activatie door een T-helpercel. Naast antilichaamproducerende cellen (plasmacellen) ontstaan ook geheugencellen, die in het lichaam aanwezig blijven.
Het afweersysteem maakt gebruik van pro-inflammatoire cytokinen (TNF (tumornecrosefactor), interleukine 1, interleukine 6 en interferon gamma) om een goede afweer op gang te brengen; maar om een gezonde balans te houden, maakt het lichaam onder andere ook anti-inflammatoire stoffen aan, waaronder TGF (transforming growth factor), interleukine 10 en interleukine 13 en interferon alfa. Een overmatige productie van anti-inflammatoire stoffen leidt echter tot een slechtere uitkomst bij sepsis door blokkering van de pro-inflammatoire stoffen. Corticosteroïden remmen via receptoren het vrijkomen van de proinflammatoire cytokinen en zijn hierdoor immunosuppressief. De uitkomst van een ernstige infectie is mede afhankelijk van de balans tussen pro-inflammatoire cytokinen en anti-inflammatoire stoffen.
Veel medicijnen die op de IC worden gebruikt hebben subtiele effecten op de immuunrespons. Onduidelijk is wat het effect op morbiditeit en mortaliteit is.
Immunosuppressie
Onderdrukking van een goed functionerend immuunsysteem vindt plaats door een onderliggende ziekte (hiv) of door medicijnen zoals chemotherapie en cortiosteroïden. Op zich veroorzaakt immunosuppressie geen ziekte, maar het maakt de patiënt gevoeliger voor het oplopen van een infectieziekte. Het is ook geen alles-of-nietsfenomeen; de immuunstatus kan gedurende het beloop van een ziekte ook veranderen. Er is geen goede test om de mate van immunosuppressie vast te leggen.
Een absoluut tekort aan neutrofiele leukocyten (neutropenie) door beenmergremming is een belangrijke voorspeller van het infectierisico. Bij een aantal van < 1,0 × 106/l stijgt het risico op bacteriële, virale en schimmelinfecties duidelijk.
Een laag aantal lymfocyten is ook een belangrijke voorspeller van met name virale infecties; specifiek de verdeling van lymfocyten (T-helpercellen of CD4-aantal) is samen met de virus load een prognostische indicator in hiv-infectie en aids.
Neutropenie
Een belangrijke bijwerking van de chemotherapiebehandeling bij maligniteiten is een daling van het aantal neutrofiele leukocyten. Die ontstaat door het cytotoxische effect op het beenmerg. Het voorkomen en de ernst van een infectie zijn omgekeerd evenredig met het aantal neutrofiele leukocyten. Het risico is met name hoog als het aantal daalt onder 0,1 × 106/l. Belangrijk is om bij temperatuurstijging snel te starten met initieel breed-spectrum-antibiotica en onderzoek te doen naar de verwekker door bloedkweken af te nemen en een X-thorax te maken. Verder aanvullend onderzoek moet gericht plaatsvinden op basis van symptomen en bevindingen bij lichamelijk onderzoek. In ongeveer 80% van de patiënten met neutropenie en koorts is er sprake van een infectie, maar slechts in 50% van de gevallen wordt een micro-organisme gekweekt.
Infectie en hiv
Hiv (human immunodeficiency virus) is een behandelbare aandoening geworden door het beschikbaar komen van HAART (highly active antiretroviral therapy) als behandelcombinatie. Patiënten met hiv houden evenwel een toegenomen gevoeligheid voor specifieke infecties met virussen, bacteriën, protozoën en schimmels. Tijdige behandeling en opsporing van de verwekker is bij koorts en tekenen van infectie noodzakelijk, omdat de natuurlijke afweer door de HAART wordt onderdrukt. Een aantal specifieke verwekkers is mede afhankelijk van de progressie van het hiv. Het aantal helper-T-lymfocyten (CD4) is hierbij een aanwijzing om welke verwekker het kan gaan (tabel 4.2).
| CD4-aantal | Infectie |
|---|---|
| 50-500 × 106/l | multi-drugresistente tuberculose, bacteriële pneumonie, orale candidiasis |
| 150-200 × 106/l | herpesvirus 8 (kaposi-sarcoom), lymfoom |
| 75-125 × 106/l | Pneumocystis, cerebrale toxoplasmose, cryptokokkenmeningitis, atypische mycobacteriën |
| < 50 × 106/l | cytomegalovirus |
Immunosuppressie na splenectomie
Na verwijdering van de milt hebben patiënten een verminderde afweer tegen gekapselde bacteriën zoals Neisseria meningitidis, Streptococcus pneumoniae en Haemophilus influenza. Patiënten die een miltextirpatie hebben ondergaan, moeten door vaccins worden geïmmuniseerd tegen de genoemde verwekkers.
Infectie na orgaantransplantatie
Patiënten na een orgaantransplantatie gebruiken immunosuppressieve medicatie om afstoting van het donororgaan te minimaliseren. Door deze noodzakelijke immunosuppressie is ook de afweer tegen infecties gestoord. In de eerste maanden na transplantatie worden de meeste infecties veroorzaakt door chirurgische en technische complicaties. Bacteriële wondinfecties en wondinfecties met Candida, pneumonieën, urineweginfecties en lijninfecties komen het meest voor. Na de eerste maanden krijgen minder gebruikelijke verwekkers door de immunosuppressieve medicatie de kans om infecties te veroorzaken. Cytomegalovirus, Pneumocystis, Aspergillus en andere schimmelsoorten en tuberculose zijn bij deze patiënten gangbare oorzaken van ernstige infecties.
Vanaf zes maanden na succesvolle transplantatie is de onderhoudsmedicatie van immunosuppressiva relatief beperkt en treden minder infectieuze complicaties op.
Anamnese en lichamelijk onderzoek
Het is belangrijk om bij opname zo snel mogelijk te weten of de patiënt een mogelijk verminderde afweer tegen infecties heeft. Infecties zijn de meest voorkomende oorzaak van morbiditeit en mortaliteit op een IC-afdeling bij patiënten met een gestoorde en verminderde afweerreactie tegen infecties.
Bij het afnemen van de anamnese bij de patiënt of verwanten is het van belang te vragen naar reeds aanwezige onderliggende ziekten, medicijngebruik, drugs-en alcoholgebruik, recente buitenlandse reizen en ook naar de medische voorgeschiedenis zoals een miltverwijdering.
Ook bij verzorging en verpleging kunnen afwijkingen opvallen. Een oud litteken kan soms veel onduidelijkheden in het beloop van een ziekte alsnog verklaren. Ook een slechte voedingstoestand is een belangrijke factor bij een verminderde afweer tegen infecties.
Vitale functies en infectie
De reactie van het lichaam op een lokale ontsteking blijft veelal beperkt tot roodheid, lokale temperatuurstijging (warme huid), pijnlijkheid, zwelling en een beperkte functie zoals bij een ontsteking van een gewricht. De lokale infectie kan zich verder uitbreiden door een tekortschietende lokale afweer van de patiënt door een onderliggende ziekte of door gebruik van immunosuppressieve medicijnen. Ook kan de lokale infectie zich uitbreiden door een verwekker die te agressief is voor de lokale afweer of die zich sneller verspreidt dan de afweer op gang komt. In deze gevallen treedt een systemische reactie op van het lichaam die gekenmerkt wordt door:
■ een koortsreactie met temperatuurstijging > 38°C of een temperatuurdaling < 36°C;
■ stijging van de hartfrequentie > 90/min;
■ ademhalingsfrequentie > 20/min bij een spontaan ademende patiënt;
■ een stijging van leukocyten bij bloedonderzoek > 12 × 109 of een daling < 4 × 109.
Bij twee of meer verschijnselen is er sprake van een SIRS (systemisch inflammatoir responssyndroom). Als er een aanwijsbare of sterk verdachte bacteriële oorzaak is, spreken we van een sepsis. Als er ook tekenen zijn van orgaanfunctiestoornis is er sprake van een ernstige sepsis, en bij hypotensie die niet op vulling reageert is er een septische shock.
Specifiek aanvullend onderzoek
Het is belangrijk om de bron van de infectie te vinden en de verwekker vast te stellen.
Radiologisch onderzoek
Om de focus van de infectie te vinden, kan gebruikgemaakt worden van radiologisch onderzoek. Een X-thorax en een echografie van de buik zijn onderzoeken die naast het bed kunnen gebeuren. Voor een CT-of MRI-onderzoek moet de patiënt vervoerbaar zijn en moet het risico van transport opwegen tegen de voordelen van opname in het ziekenhuis.
Microbiologisch onderzoek
De verwekker van een infectie wordt door microbiologisch onderzoek vastgesteld. In een aantal gevallen is het resultaat binnen enkele uren bekend: gramkleuring van puspreparaten (sputum, liquor), Legionella-sneltest in urineportie of toxinebepaling in feces bij Clostridium.
In veel gevallen is een incubatietijd nodig voor groei en verdere determinatie van de verwekker, zoals na afname van kweken (sputum, bloed, urine, liquor). Bij mycobacteriën zoals tuberculose kan een kweek pas na enkele weken positief worden. Tegenwoordig zijn voor een aantal bacteriën en virussen moleculaire technieken (DNA polymerase chain reaction; PCR-technieken) beschikbaar waarmee in korte tijd kan worden aangetoond of een bepaalde verwekker aanwezig is. De gevoeligheid voor bepaalde antibiotica of antivirale middelen kan hiermee niet worden vastgesteld; anders gezegd: resistentiebepalingen voor bepaalde middelen kosten minimaal enkele dagen.
PCR-technieken zijn beschikbaar voor cytomegalovirus, epstein-barr-virus, herpes simplex, hiv en tuberculose.
Ook kunnen in serum antistoffen tegen een aantal verwekkers worden gemeten. Een acute infectie kan alleen maar achteraf worden vastgesteld indien er een stijging van antistoffen wordt gevonden in twee afnames die met een tussenpoos van twee weken zijn afgenomen.
Behandeling
Bij een ernstig zieke patiënt kan op grond van een goede anamnese, uitgebreid lichamelijk onderzoek en gericht aanvullend onderzoek een infectie als oorzaak zeer waarschijnlijk zijn. Een infectiebron kan aangetoond worden en nader onderzoek naar een verwekker kan ingezet zijn. Maar het is belangrijk om zo snel mogelijk met behandeling van de infectie te starten. De keuze van antibiotica wordt door de volgende gegevens bepaald.
■ Het verwachte micro-organisme en de plaats van infectie. De meest voorkomende oorzaken van levensbedreigende infecties bij volwassen patiënten zijn de lagere luchtwegen, de buikholte en de bloedvaten. Infecties in het subcutane weefsel die zich snel uitbreiden en infecties van het centrale zenuwstelsel zijn ook levensbedreigend en vaak klinisch duidelijk aanwezig. Het is belangrijk om bij de keuze van antibiotica ook het vermogen om ter plaatse door te dringen te laten meewegen. Niet alle antibiotica kunnen de bloed-hersenbarrière gemakkelijk passeren.
-
■ Uitslag van een gramkleuring van materiaal uit het geïnfecteerde gebied. Hiermee kunnen bepaalde groepen van bacteriën worden onderscheiden:
- grampositieve kokken in groepjes (stafylokok-ken), in paren of ketens (streptokokken, enterokokken), grampositieve staafjes (Clostridium, Listeria, Bacillus);
-
gramnegatieve kokken (Haemophilus, Moraxella, Acinetobacter), gramnegtieve staafjes (Escherichia coli, Klebsiella, Pseudomonas).Natuurlijk is het essentieel om de resultaten van de kweek af te wachten alvorens de antibioticatherapie aan te passen.
-
■ Resistentie voor antibiotica. Bacteriën kunnen geleidelijk resistent worden voor bepaalde antibiotica door aanpassingen in hun structuur. Er zijn factoren die erop kunnen wijzen dat specifieke bacteriën minder gevoelig of zelfs ongevoelig zijn voor gangbare antibiotica:
- eerdere isolatie van ongevoelige bacteriën bij dezelfde patiënt;
- eerdere antibiotische behandeling;
- langdurig verblijf in het ziekenhuis of op een IC-afdeling, waardoor de kans op het krijgen van resistente bacteriën groter is;
- bekende resistentie van bacteriën in een ziekenhuis (meticillineresistente Staphylococcus aureus (MRSA), vancomycineresistente Enterococcus (VRE), multiresistente Pseudomonas);
-
afweerverlagende ziekten of medicatie.Een aantal veelvoorkomende bacteriën blijkt steeds vaker verminderd gevoelig te zijn voor tevoren heel goed werkende antibiotica. Streptococcus pneumoniae als verwekker van een longinfectie is steeds minder gevoelig voor penicilline of ceftriaxon; Enterococcus faecium is toenemend ongevoelig voor ampicilline en vancomycine; Staphylococcus aureus is in een aantal gevallen ongevoelig voor meticilline (MRSA). Gramnegatieve bacteriën zoals E. coli en Klebsiella produceren een enzym (extended-spectrum β-lactamase; ESBL) dat antibiotica onwerkzaam maakt.Het is belangrijk om het resistentiespectrum van de verschillende bacteriën te weten op elke IC-afdeling om een goede initiële keuze te kunnen maken voor antibiotica.
■ Bekende aandoeningen die tegelijkertijd voorkomen, zoals een nierinsufficiëntie, waarbij de dosering van een aantal antibiotica moet worden aangepast om geen toxische schade te veroorzaken (nefrotoxiciteit), of gehoorstoornissen (oto-toxiciteit), zwangerschap.
■ Bekende overgevoeligheid voor bepaalde antibiotica.
Op grond van bekende gevoeligheden en het lokale resistentiepatroon wordt gekozen voor een breed-spectrum-behandeling tegen een waarschijnlijke verwekker. Dit wordt empirische antibioticatherapie genoemd. Het antibiotische beleid wordt aangepast indien een definitieve verwekker wordt geïsoleerd en het gevoeligheidspatroon is vastgesteld. Dit is mede van belang om het optreden van resistentie te beperken en het risico op bijwerkingen te verkleinen.
Indien er binnen 48 uur geen gunstig effect van de ingestelde antibiotische therapie wordt waargenomen, moet opnieuw onderzoek en diagnostiek plaatsvinden. De antibioticakeuze kan worden heroverwogen en er kan gestart worden met behandeling tegen gisten en schimmels in patiënten met een hoog risico op het krijgen van een infectieziekte.
Naast antibiotische behandeling is het ook nodig om, indien mogelijk, de infectiebron te behandelen: wondbehandeling met excisie van geïnfecteerde delen, percutane of chirurgische drainage van abcessen, verwijdering van vreemde lichamen (intravasale lijnen) en gerichte operatieve chirurgische behandeling, bijvoorbeeld cholecystectomie of appendectomie.
4.8 Koorts bij de intensive-care-patiënt
Koorts is een veelvoorkomende bevinding bij patiënten op een IC-afdeling. Een verhoogde lichaamstemperatuur, > 38°C axillair gemeten, is een alarmsignaal en betekent dat het afweermechanisme van de patiënt is geactiveerd.
Oorzaken van koorts
De oorzaak van koorts bij een kritiek zieke patiënt kan infectieus zijn, maar ook niet-infectieus of zelfs veroorzaakt worden door een combinatie van beide. Een bacteriële of virale infectie is een infectieuze oorzaak van koorts. Niet-infectieuze oorzaken van koorts kunnen chemische ontstekingen zijn zoals een pancreatitis of een pneumonitis door inhalatie van toxische gassen. Maar ook trombo-embolieën of een trauma kunnen leiden tot koorts als symptoom van een herstelreactie van het lichaam. In veel gevallen is er een gecombineerde oorzaak, bijvoorbeeld een pancreatitis met een secundaire bacteriële ontsteking, of een secundaire longinfectie bij de genoemde chemische pneumonitis. Ook geïnfecteerde wonden na een trauma zijn voorbeelden van niet-infectieuze en infectieuze oorzaken.
De bron van de koorts bij een patiënt op de IC-afdeling is vaak lastig vast te stellen. Uitgebreide diagnostiek is in de meeste gevallen nodig om de oorzaak van de koorts op te sporen. Onderscheid tussen de verschillende oorzaken is van groot belang omdat de behandeling en de prognose zeer verschillend en uiteenlopend kunnen zijn. De keuze om te behandelen en met name welke medicijnen gegeven moeten worden, is afhankelijk van de vraag of er een infectie is en wat de aard van de infectie is.
Op een IC-afdeling kan ook de ingezette behandeling of de gebruikte monitoring een oorzaak zijn van het ontstaan van koorts. Dit noemen we iatrogene (door de arts veroorzaakte) koorts. Een geïnfecteerde centrale lijn is een infectieuze oorzaak, maar een allergische huidreactie op geneesmiddelen is een niet-infectieuze oorzaak.
Koorts is altijd een alarmsignaal. Bij een temperatuur vanaf 39°C is een infectieuze oorzaak meer waarschijnlijk dan een niet-infectieuze oorzaak. Hoe hoger de koorts, des te meer kans dat een infectie de bron is; een temperatuur > 41°C kan echter ook een neurologische oorzaak hebben en veroorzaakt worden door een stoornis in de thermoregulatie.
Risicofactoren voor infectie
Vaak zijn er bij kritiek zieke patiënten risicofactoren aanwezig die een infectieuze oorzaak zeer waarschijnlijk maken en de kans op een niet-infectieuze oorzaak minder aannemelijk.
Risicofactoren voor een bacteriële infectie die op de IC wordt opgelopen, zijn:
■ hoge leeftijd;
■ ernstige onderliggende ziekten, zoals COPD, diabetes mellitus, chronische nierziekten, levercirrose;
■ neutropenie (tekort aan witte bloedcellen);
■ afweeronderdrukkende medicatie (immunosuppressiva) zoals bij behandeling van een maligniteit of aids;
■ chemotherapie en/of radiotherapie bij maligniteiten;
■ gebruik van immunosuppressieve medicijnen, bij voorbeeld bij orgaantransplantatie;
■ intravasculaire katheters;
■ intubatie en mechanische beademing;
■ langdurig verblijf op een IC-afdeling;
■ prothesemateriaal;
■ voorafgaande operatieve ingreep;
■ blaaskatheters en wonddrains;
■ maagsondes;
■ verlaagd bewustzijn bij neurologische aandoeningen;
■ multitrauma;
■ overmatig alcoholgebruik;
■ status na miltextirpatie;
■ slechte voedingstoestand;
■ corticosteroïdgebruik;
■ brandwonden.
Tijdens opname op een IC-afdeling maakt 30% van de patiënten een periode met een bacteriële infectie door. Nieuw ontstane koorts tijdens opname wordt in meer dan de helft van de gevallen veroorzaakt door een bacteriële infectie die in het ziekenhuis opgelopen wordt, een ziekenhuisinfectie (nosocomiale infectie). Vaak voorkomende oorzaken zijn lijnsepsis, beademingsgerelateerde pneumonie en sinusitis bij een neussonde. Hierbij is in toenemende mate sprake van bacteriële verwekkers die door antibioticagebruik binnen het ziekenhuis minder gevoelig of zelfs ongevoelig zijn voor de standaard gebruikte antibiotica (resistente bacteriën) en via andere patiënten of door handencontact worden overgedragen.
Infecties die buiten het ziekenhuis worden verkregen, noemen we community-acquired infecties. Deze infecties zijn in het algemeen nog goed gevoelig voor de standaard gebruikte antibiotica. Dit zijn de infecties waarmee patiënten van buiten in het ziekenhuis worden opgenomen.
Onderzoek bij koorts
Het is belangrijk dat er bij het vaststellen van koorts adequaat onderzoek naar een mogelijke focus plaatsvindt. Aanvullend onderzoek moet plaatsvinden op indicatie. Een ongecoördineerde inzet van allerlei afbeeldend onderzoek, laboratoriumonderzoek en microbiologische diagnostiek heeft weinig nut.
Bij recentelijk ontstane koorts moet men zich afvragen of de temperatuurstijging een relatie heeft met een ingezette behandeling, zoals een pneumonie bij een langer beademde patiënt of een centrale lijn die al vele dagen wordt gebruikt. Daarnaast zijn bevindingen bij de verpleging en verzorging van patiënten erg belangrijk. Is er een herkenbare en aanwijsbare infectiefocus, zoals uitzuigen van purulent sputum bij een beademde patiënt, een nieuwe decubituswond? Is de inbrengopening van een centrale lijn geïnfecteerd? Zijn er risicofactoren voor een nosocomiale infectie aanwezig? Is er recentelijk ontstane diarree?
Vitale functies
Behalve een stijging van de lichaamstemperatuur treden ook veranderingen op in de parameters waarmee de vitale functies worden vervolgd. Bij een systemische reactie op een infectieuze en op een niet-infectieuze oorzaak gaat de ademfrequentie bij spontaan ademende patiënten omhoog, evenals de polsfrequentie (SIRS-kenmerken). Bij een SIRS met een grote verdenking op of een aangetoonde infectie als bron spreekt men van een sepsis. Bij een voortschrijdend proces treden er ook geleidelijk stoornissen op in orgaanfunctie (ernstige sepsis) en uiteindelijk een voor vulling refractaire shock (septische shock).
Meting lichaamstemperatuur
Het onderwerp lichaamstemperatuur wordt ook besproken in het hoofdstuk De regulatie van de lichaamstemperatuur in deel 2 van het Leerboek intensive-careverpleegkunde. oudere patiënten kunnen moeilijker hun lichaamstemperatuur reguleren dan jongere volwassenen. Bij de categorie van oudere patiënten is de temperatuurreactie op een infectieus of een niet-infectieus probleem vaak gestoord. Dit is veelal de oorzaak van het feit dat het niet direct duidelijk is dat er een nieuw probleem bestaat. Het uitblijven van temperatuurstijging heeft een relatie met een lagere weerstand, een vertraagd herstel en een slechtere uitkomst.
Meting van de kerntemperatuur via een katheter in de arteria pulmonalis is de gouden standaard. Op een IC-afdeling wordt vaak temperatuur gemeten in de oksel (axillair), in het rectum of tympanisch. Rectale temperatuur is een goede meting van de centrale temperatuur maar reageert trager op veranderingen in de kerntemperatuur. Axillair gemeten temperatuur onderschat de centrale temperatuur en is slecht te reproduceren. Tympanisch gemeten temperatuur onderschat ook de centrale temperatuur met enkele tienden van een graad. Hierbij is ook belangrijk dat het meetapparaat op de juiste wijze wordt gebruikt en gericht wordt op het trommelvlies. Maar het belangrijkste is het om de trend in het temperatuurbeloop vast te leggen.
Laboratoriumonderzoek
Routinematig onderzoek is niet specifiek voor het opsporen van de bron van de temperatuurstijging. Wel kan een infectieuze oorzaak waarschijnlijker worden en kunnen bijkomende orgaanfunctiestoornissen worden vastgesteld. Een stijging van de leukocyten en het CRP zijn indicatief voor een infectieuze oorzaak. Een leukocytose kan echter ook postoperatief optreden, bij corticosteroïdgebruik, bij massale transfusie en bij trauma. Ook een laag aantal leukocyten kan een uiting zijn van een ernstige infectie, speciaal bij oudere patiënten. Procalcitonine is een gevoelige marker bij een beginnende infectie.
Een daling van het aantal trombocyten is een teken van een ernstige infectie; tekenen van diffuse intravasale stolling (verlengde APTT en PT, verhoogd D-dimerengehalte en een gedaald fibrinogeen) passen bij een ernstige sepsis. Bij een ernstige sepsis is er ook een verhoogd serumlactaat door tekortschietende perifere perfusie en oxygenatie. Leverfuncties laten meestal een cholestase zien. Bij hypovolemie en septische shock is er een verslechtering van de nierfunctie te vinden.
Aanvullend onderzoek
Afhankelijk van waar een mogelijke bron van koorts aanwezig is, kan specifiek onderzoek worden aangevraagd. Indien er verdenking is op een oorzaak in het centrale zenuwstelsel, kan een liquorpunctie worden verricht. Bij verdenking op cerebrale abcessen een CT-of MRI-scan en bij verdenking op een sinusitis een CT van de sinussen.
Specifiek onderzoek van de thorax kan bestaan uit een X-thorax, een CT-scan of bij verdenking op een endocarditis een echo cor, bij voorkeur met de probe in de slokdarm (transoesofageaal echocardiogram, TEE).
Voor onderzoek van de buik verdient echografie of een CT-scan de voorkeur.
De voordelen van een CT-scan wegen in het algemeen ruimschoots op tegen het ongemak en het risico bij transport naar de radiologieafdeling. Bij voorkeur moet er wel sprake zijn van een respiratoir en hemodynamisch stabiele patiënt.
Microbiologisch onderzoek
Het afnemen van materiaal voor diagnostiek moet zo veel mogelijk gebeuren voor het starten van eventuele antibioticatherapie. Materiaal van de voor infectie verdachte plaatsen, zoals geïnfecteerde insteekopening, wonden en materiaal verkregen bij lumbaalpunctie, kan worden ingestuurd voor kweken, maar ook voor sneldiagnostiek zoals een gramkleuring.
Bloedweken worden bij voorkeur afgenomen via perifere venen op twee verschillende plaatsen of van dezelfde plaats, maar dan met een tijdsverschil van 30 minuten.
Sputumkweken worden bij een beademde patiënt afgenomen via het uitzuigsysteem of via bronchoalveolaire lavage. Urinekweken worden uit de urinekatheter afgenomen.
Bij vermoeden van een infectie van een intravasale katheter wordt deze bij voorkeur verwijderd en wordt de tip gekweekt. Indien de katheter niet verwijderd kan/mag worden, moeten er gepaarde kweken worden afgenomen uit perifere venen en uit de centraal liggende katheter. Ook zijn er specifieke sneltesten voor bijvoorbeeld Legionella (urinetest) of toxinen van Clostridium difficile bij diarree.
De micro-organismen die op de IC-afdeling de gebruikelijke oorzaak van ernstige infecties zijn, worden onderverdeeld in gramnegatieve bacteriën zoals Klebsiella, Pseudomonas, Acinetobacter, Serratia en Enterobacteriaceae, en in grampositieve bacteriën zoals coagulasenegatieve stafylokokken, Staphylococcus aureus. Tevens zijn gisten en schimmels (Candida-soorten) belangrijke verwekkers van koortsende ziekten bij patiënten met een verlaagde weerstand.
Virale infecties komen zelfs in ernstig zieke immuungecompromitteerde patiënten weinig voor. Herpesvirus, cytomegalovirus, adenovirus of Chlamydia-soorten zijn de meest voorkomende oorzaak van virale pneumonieën.
4.8.1 Infectieuze oorzaken van koorts op de intensive-care-afdeling
Beademingsgerelateerde pneumonie
Hoe langer een patiënt wordt beademd, des te groter het risico om een pneumonie te ontwikkelen (ventilator-associated pneumonia, VAP). Ook een sinusitis is een risicofactor voor het ontstaan van een VAP. Een VAP is in feite een complicatie van de behandeling met mechanische beademing of met beademingsondersteuning waarbij een endotracheale tube of tracheotomie aanwezig is. Het vóórkomen van een VAP ligt in de literatuur tussen de 5 en 25% bij patiënten die langer dan twee dagen op een IC liggen en beademd worden. VAP heeft een hoge morbiditeit en hoge mortaliteit (10-50%).
De diagnose wordt gesteld op een nieuw ontstaan infiltraat op de X-thorax, en daarnaast klinische koorts, verslechterende oxygenatie en purulent sputum verkregen bij trachea-aspiratie met een positief kweekresultaat.
Een aantal interventies om een VAP te voorkomen is samengevoegd in een ventilatiemanagementbundel. Hierbij is een bundel een samenvoeging van interventies passend bij een specifieke aandoening, die bij een IC-patiënt toegepast kunnen worden om te zorgen voor een beter behandelingsresultaat en minder complicaties; en waarbij het effect van de interventies afzonderlijk minder effect heeft.
De preventieve maatregelen voor een VAP zijn:
■ hoofdeinde in een 30°-positie;
■ dagelijks onderbreken van sedatie;
■ onderzoeken of patiënt kan starten met afwennen van de beademing;
■ mondtoilet met chloorhexidine;
■ stressulcusprofylaxe van diepe veneuze trombose;
■ cuffdrukmeting en aspiratie van vocht dat zich boven de cuff ophoopt.
Met deze preventieve maatregelen is het vóórkomen van een VAP in de afgelopen jaren duidelijk afgenomen.
Infecties gerelateerd aan de centrale lijn
Lijnsepsis is een vaak gebruikte term voor infectie van een intravasculaire katheter. De meeste infecties treden op bij een centraalveneuze katheter. Een aan een centraalveneuze katheter gerelateerde infectie kan ernstig verlopen en aanleiding geven tot een sepsis. Op basis van interventieprojecten in het buitenland is ook ter preventie van lijnsepsis een bundel met de belangrijke handelingen gedefinieerd.
De onderdelen van deze lijnsepsis-interventie-bundel zijn:
■ selectie van de optimale katheterplaats; de volgorde van voorkeur op basis van infectiepreventie is vena subclavia, vena jugularis en vena femoralis;
■ desinfectie van de huid met chloorhexidine;
■ goede handhygiëne;
■ maximale voorzorgsmaatregelen bij inbrengen katheter met een ruim steriel veld en met beschermende kleding, muts en mondmasker;
■ dagelijkse controle op indicatie voor centrale lijn; indien indicatie is vervallen, dient de katheter niet onnodig lang in situ te blijven (binnen 24 uur na vervallen van de indicatie voor een katheter verwijderen);
■ controleren van de insteekopening op ontstekingsverschijnselen.
De diagnose lijnsepsis wordt vermoed bij koorts of een positieve bloedkweek in de afwezigheid van een andere duidelijke infectiebron, bij een centrale lijn die langer dan drie dagen in situ is, waarbij de koorts verdwijnt na verwijderen van de katheter en er tekenen zijn van ontsteking ter hoogte van de insteekopening (roodheid en pus). De definitieve diagnose wordt gesteld als na verwijdering van de katheter de kweek van de tip van de katheter positief is en hetzelfde micro-organisme wordt gekweekt uit de gelijktijdig perifeer afgenomen bloedkweken.
Complicaties van een geïnfecteerde lijn kunnen naast sepsis en septische shock bestaan uit endocarditis, trombose met een geïnfecteerde trombus, en strooiabcessen.
Sinusitis
Nasogastrische sondes zijn een belangrijke risicofactor en moeten worden verwijderd bij de behandeling van de sinusitis. Sinusitis is ook een risicofactor voor VAP. Koorts en purulente neusuitvloed bij aanwezigheid van een neussonde zijn belangrijke aanwijzingen voor sinusitis. In de meeste gevallen zijn de sinus maxillares ontstoken, maar ook sinusitis van de sinus sphenoidales en ethmoidales wordt in toenemende mate herkend, vooral door een CT-scan van het aangezicht. Behandeling bestaat uit spoelen van de sinussen en antibiotische behandeling.
Urineweginfecties
Hoewel vrijwel alle patiënten op een IC een blaaskatheter hebben, is een urineweginfectie slechts zelden de oorzaak van koorts. Indien er behalve koorts, leukocytenstijging en pyurie ook hetzelfde micro-organisme wordt geïsoleerd uit de urinekweek als uit de bloedkweek, dan is er sprake van een systemische infectie. Belangrijk is om altijd de doorgankelijkheid van de urinekatheter te controleren.
| Infectieuze oorzaken | |
| • beademingsgerelateerde pneumonie | |
| • infectie gerelateerd aan de centrale lijn | |
| • bovenste-luchtweginfectie | |
| • sinusitis | |
| • darminfectie: Clostridium difficile | |
| • urineweginfectie | |
| • acalculeuze cholecystitis | |
| • endocarditis | |
|
Niet-infectieuze oorzaken aspiratie | |
| • postoperatieve koorts ( < 48 uur) | |
| • trauma | |
| • trombo-embolieën | |
| • gastro-intestinale bloeding | |
| • geneesmiddelenkoorts | |
| • koorts bij transfusie van bloedproducten | |
| • alcoholonttrekkingsverschijnselen | |
| • maligne neurolepticasyndroom | |
| • intracerebrale aandoeningen, inclusief subarachnoidale bloeding | |
| • jicht | |
| • maligniteit | |
| • myocard-infarct | |
| • acute bijnierschorsinsufficiëntie (addison-crises) | |
| • acute pancreatitis |
Acalculeuze cholecystitis
De galblaas kan ontstoken raken in de afwezigheid van galstenen na trauma, ernstige (veelal abdominale) sepsis en grote buikchirurgie. Men spreekt dan van een acalculeuze galblaasontsteking. Het komt slechts in een laag percentage voor. Mogelijk speelt hierbij een rol dat de verschijnselen vaak aspecifiek zijn, zoals pijn in de rechterbovenbuik en misselijkheid. Echografie van de bovenbuik laat een toegenomen wanddikte door de ontsteking zien met een verwijde galblaas en vaak een duidelijk sediment in de galblaas. Het grote risico is een (te) late diagnose met ischemie en perforatie van de galblaas. Bij een ernstig zieke patiënt heeft het puncteren en achterlaten van een galblaasdrain veelal de voorkeur boven cholecystectomie.
Pseudomembraneuze colitis
Deze infectie wordt veroorzaakt door Clostridium difficile. Vaak is diarree het eerste symptoom. Een aan Clostridium difficile gerelateerde infectie treedt regelmatig op bij ernstig zieke patiënten die met verschillende kuren breed-spectrum-antibiotica zijn behandeld. Deze infectie kan gecompliceerd worden door een acute buik met de noodzaak van een colectomie. Het gevaar is dat deze bacterie via de handen kan worden overgedragen. Een goede handhygiëne is bij deze categorie patiënten dan ook zeker noodzakelijk. De diagnose kan met een microbiologische sneltest op toxinen in de feces worden gesteld.
4.8.2 Niet-infectieuze oorzaken van koorts op de intensive-care-afdeling
Een deel van de koortsepisodes bij patiënten op een IC-afdeling heeft een niet-infectieuze oorzaak. De temperatuur stijgt hierbij veelal niet boven de 38,5°C. Een goede differentiaaldiagnose met aandacht voor recente interventies en bevindingen bij lichamelijk onderzoek zal infectieuze oorzaken kunnen uitsluiten.
Geneesmiddelenkoorts
Elk geneesmiddel kan door een overgevoeligheidsreactie koorts veroorzaken. Soms is er sprake van een lokale ontsteking op de plaats van toediening. In de meeste gevallen is er alleen sprake van een matige temperatuurstijging, hoewel de temperatuur soms doorstijgt tot 40°C. Bij lichamelijk onderzoek is er slechts in 5-10% van de gevallen sprake van een begeleidende vlekkige rode huiduitslag (maculopapulaire rash). Laboratoriumonderzoek geeft slechts zelden een perifere eosinofilie, leukocytenstijging of een stijging van de levercelfuncties te zien.
De tijd tussen de eerste toediening van een geneesmiddel en het optreden van een koortsreactie kan gemiddeld 21 dagen bedragen, met een mediaan van 8 dagen. Na het stoppen van het betreffende geneesmiddel verdwijnt de koorts meestal binnen 72 uur.
De geneesmiddelen die het meest aanleiding zijn voor geneesmiddelenkoorts zijn antibiotica, anti-epileptica, antiaritmica en diuretica.
Op IC-afdelingen met cardiochirurgische patiënten is een veelvoorkomende oorzaak van niet-infectieuze koorts een myocard-infarct, syndroom van Dressler met pericarditis, trombo-embolieën, bloedingscomplicaties na toepassing van trombolytica en behandeling met antiaritmica.
Op neurochirurgische IC-afdelingen wordt koorts mede veroorzaakt door het gebruik van anti-epileptica en door centrale koorts op basis van disregulatie van het temperatuurcentrum met als kenmerk het afwezig zijn van zweten.
4.8.3 Koorts in specifieke patiëntengroepen op de intensive care
Koorts in de heelkundige intensive-care-patiënt
De gebruikelijke reactie op trauma en operatie geeft een productie van pro-inflammatoire cytokinen en een temperatuurstijging tot gewoonlijk 38,5°C die enkele dagen aanhoudt, tenzij de operatieve behandeling plaatsvond voor een infectieuze oorzaak zoals een peritonitis. Een persisterende verhoging van de temperatuur na twee dagen of een stijging boven 38,5°C is een belangrijke aanwijzing dat zich alsnog een infectie en een sepsis hebben ontwikkeld. Ongeveer 10% van de patiënten met een trauma ontwikkelt een nosocomiale infectie. Trauma geeft zelf ook een immunosuppressief effect. Andere risicofactoren zijn leeftijd, onderliggende ziekte, de uitgebreidheid van het trauma of de operatie, hypotensie, bloedtransfusies en hematomen.
Niet alleen infectieuze oorzaken maar ook niet-infectieuze oorzaken zoals trombo-embolieën kunnen de oorzaak van de koorts zijn. Nauwkeurig onderzoek met verwijdering van alle verbanden is belangrijk om een infectieuze bron op te sporen.
In afnemende waarschijnlijkheid kunnen de infectieuze oorzaken van koorts zijn:
■ nosocomiale pneumonie;
■ urineweginfectie;
■ wondinfectie;
■ lijninfectie;
■ sinusitis;
■ gramnegatieve bacteriëmie;
■ overig.
Wondinfectie
Bij lichamelijk onderzoek zijn roodheid, pusuitvloed, zwelling en pijn kenmerken van een wondinfectie, met een piek in het voorkomen op ongeveer de zevende postoperatieve dag. Een vroege wondinfectie (binnen drie dagen) wordt vaak veroorzaakt door necrotiserende fasciitis, cellulitis, abcesvorming of gasgangreen. Verwekkers zijn hierbij de zeer virulente streptokokken, stafylokokken of Clostridium perfringens. Een wondinfectie door toxineproducerende stafylokokken of streptokokken kan een toxic-shock-syndroom veroorzaken.
Een geïnfecteerde wond moet altijd worden opengelegd en kweken moeten worden afgenomen. Een necrotiserende fasciitis is een spoedindicatie voor ruime excisie en drainage.
Gramnegatieve bacteriëmie en intra-abdominale sepsis
Na een primaire laparotomie kunnen persisterende koorts en leukocytose ondanks antibiotica en het ontbreken van duidelijke afwijkingen bij lichamelijk onderzoek hun oorzaak hebben in een intra-abdominale infectie. Belangrijk is om de vitale functies te blijven controleren en een mogelijk beginnende orgaandisfunctie bij sepsis vast te stellen. In patiënten met verdenking op een intra-abdominale sepsis na een eerdere laparotomie is vaak sprake van lekkage van een darm-anastomose en darmischemie met een mogelijke perforatie die leiden tot intraabdominale abcessen. In deze gevallen bestaat een indicatie voor (re)laparotomie.
Ook bij een shock door een sepsis die niet haar oorsprong vindt in de buik, kan een buikprobleem optreden door ischemie bij hypotensie met necrose en aansluitend perforatie van de darmdelen. Ook hiervoor is spoedlaparotomie nodig met resectie van avitale darmdelen en drainage. De meest voorkomende micro-organismen bij een intra-abdominale sepsis zijn gramnegatieve bacteriën.
Koorts in de immuungecompromitteerde patiënt
Patiënten met een hematologische aandoening of met immunosuppressieve medicatie zoals corticosteroïden of chemotherapie hebben een gestoorde immuunrespons en zijn immuungecompromitteerd. Ook patiënten die een miltextirpatie hebben gehad maar niet adequaat zijn gevaccineerd, hebben een immuundefect en een sterk verhoogd risico op een streptokokkensepsis en septische shock met vaak een fulminant beloop met een fatale afloop.
Patiënten met koorts en een neutropenie bij een behandeling met chemotherapie hebben minder klinisch duidelijke symptomen van een infectiebron. Vroegtijdige behandeling is bij deze categorie patiënten belangrijk, ook als nog niet duidelijk is wat de oorzaak van de infectie is. In de meeste gevallen is er evenwel sprake van een pneumonie die pas na enkele dagen op een X-thorax duidelijk wordt, of van een lijnsepsis.
Patiënten met hiv, al of niet gecompliceerd door aids, worden vaak op een IC opgenomen in verband met een respiratoire insufficiëntie bij een pneumonie. Deze pneumonie wordt meestal veroorzaakt door een infectie met Pneumocystis jiroveci. De diagnose wordt gesteld door materiaal via een bronchoalveolaire lavage af te nemen en in te sturen voor sneldiagnostiek. Andere vaker voorkomende opportunistische infecties bij hiv zijn tuberculose, atypische mycobacteriën, cytomegalovirus, histoplasmose en toxoplasmose.
Niet-infectieuze oorzaken van koorts kunnen ook lymfomen of tromboflebitiden zijn.
Koorts in de neurologische patiënt
Het onderwerp koorts in de neurologische patiënt wordt ook besproken in het hoofdstuk Het centrale zenuwstelsel in deel 2 van het Leerboek intensive-care-verpleegkunde.
Na een CVA of hoofdtrauma kan de lichaamstemperatuur oplopen. Een hogere temperatuur is vaak gerelateerd aan toegenomen hersenschade en een slechtere uitkomst. Een verhoogde zuurstofbehoefte van de hersenen doet ook de gevoeligheid voor hypoperfusie toenemen. Koorts bij de patiënt met een (ernstige) neurologische aandoening is een alarmerende situatie waarbij mogelijke infectieuze oorzaken zoals meningitis moeten worden onderzocht. Ook kan de koorts door een niet-infectieuze oorzaak worden veroorzaakt, zoals een disregulatie van het temperatuurcentrum in de hypothalamus door hersenschade. Slechts een klein deel van de patiënten met ernstige cerebrale schade en koorts heeft een aantoonbaar infectieuze focus.
Het is belangrijk om onafhankelijk van de oorzaak van de koorts bij een patiënt met een ernstige cerebrale aandoening de koorts met antipyretica (paracetamol) te behandelen om te streven naar een lagere cerebrale zuurstofbehoefte, waardoor minder secundaire hersenschade ontstaat en een betere neurologische uitkomst wordt verkregen.
Niet-infectieuze oorzaken van koorts
Maligne hyperthermie kan veroorzaakt worden door anesthetica zoals succinylcholine en inhalatiemid-delen in daarvoor gevoelige patiënten. Het maligne neurolepticasyndroom kan worden veroorzaakt door het gebruik van neuroleptica (onder andere door haloperidol) door blokkade van centrale dopaminereceptoren. In beide gevallen wordt de hypothalame warmteregulatie geblokkeerd met het ontstaan van hoge koorts, spierrigiditeit en hoge CPK-waarden in het bloed.
4.9 Preventie van infecties
Het doel van infectiepreventie is om overdracht van micro-organismen en ziekenhuisinfecties te voorkomen door maatregelen in te stellen die leiden tot een optimale hygiëne rond de patiënt bij zorg, onderzoek en behandeling. Ziekenhuisinfecties zijn infecties die optreden bij patiënten tijdens het verblijf in het ziekenhuis (nosocomiale infecties). Op een IC-afdeling vindt concentratie van ernstig zieke patiënten plaats die allen een gestoorde immuunrespons op infecties hebben. Deze patiënten lopen een groter risico op een infectie met een resistente bacterie. Resistente bacteriën kunnen zich in het ziekenhuis verder verspreiden, mede door wonden, infusen, katheters en een schilferende huid.
Door frequent gebruik van breed-spectrum-antibiotica worden resistente micro-organismen geselecteerd, die door onvoldoende hygiënische maatregelen overgedragen worden op juist die categorie van patiënten die door onderliggende ziekten, intravasale lijnen en operaties een verhoogd risico lopen op ernstige infecties.
Handhygiëne
De belangrijkste hygiëne-interventie is handhygiëne. Onder handhygiëne wordt verstaan: handreiniging, handdesinfectie en handverzorging met handcrème. Handreiniging is het verwijderen met water en zeep van vuil en een deel van de transiënte flora. De reductiefactor ligt duidelijk onder die van handdesinfectie. Handdesinfectie is het door middel van handalcohol snel reduceren van de transiënte en residente flora die op de handen aanwezig is. Handverzorging is datgene wat wordt gedaan om de handen in goede conditie te houden, zoals het kort houden en verzorgen van de nagels en het aanbrengen van handcrème om uitdroging en kloofvorming tegen te gaan. Desinfectie van niet-zichtbaar verontreinigde handen met handalcohol heeft de voorkeur boven reiniging. Handdesinfectie heeft de voorkeur boven handreiniging omdat het huidvriendelijker is en handalcohol een grotere kiemreductie geeft. Desinfectie met handalcohol heeft ook als voordelen dat het op de plek van verzorging gebruikt kan worden en dat men onafhankelijk is van de aanwezigheid van een wastafel. Tevens levert het hierdoor tijdwinst op. Wanneer de handen zichtbaar zijn verontreinigd of plakkerig aanvoelen, worden ze altijd gewassen met water en zeep. Alcohol heeft geen reinigende werking en kan dus ook niet voor handreiniging worden gebruikt.
Handen worden bij zichtbaar vuil, bij plakkerig aanvoelen en na bezoek van het toilet gewassen met water en zeep. Handen worden gedesinfecteerd voor contact met een patiënt in beschermende isolatie, voor contact/het werken met invasieve hulpmiddelen, ook bij gebruik van handschoenen, tijdens de verzorging van patiënten bij de overgang van ‘vuil’ naar ‘schoon’, bijvoorbeeld na het verwijderen van vuil verband en voor het opnieuw verbinden, na hoesten en niezen, na direct contact met patiënten en verpleegkundige handelingen en na het uittrekken van handschoenen. Na toiletbezoek, neus snuiten, nadat etenswaren zijn genuttigd e.d. en na ieder intensief contact met een patiënt, ook als hierbij handschoenen gedragen zijn, dienen de handen gereinigd c.q. gedesinfecteerd te worden. Bij patiënten met sterk verminderde weerstand (immuungecompromitteerde patiënten, zoals patiënten met leukopenie, hiv-patiënten, patiënten die bestraald worden, patiënten met brandwonden) moet dit ook vóór ieder contact gebeuren. Het dragen van sieraden aan handen en polsen vormt een ernstige belemmering voor optimale handenreiniging en is daarom verboden voor alle medewerkers in het ziekenhuis op de afdelingen waar gewerkt wordt met patiënten, patiëntenmateriaal, geneesmiddelen, voedsel en andere voor de patiënt bestemde zaken (bijvoorbeeld instrumentarium).
Hygiëne bij gebruik van apparatuur
Alle gebruikte apparaten en artikelen die hergebruikt kunnen worden, moeten altijd huishoudelijk schoongemaakt worden. Apparaten en artikelen moeten, als dat mogelijk is, eerst uit elkaar worden gehaald, voordat ze schoongemaakt kunnen worden. Wanneer apparatuur in aanraking is gekomen met de patiënt, moeten de apparaten met alcohol 70% worden afgenomen na de huishoudelijke reiniging. Ze mogen niet eerder opgeruimd of hergebruikt worden.
Infrastructuur van de intensive-care-afdeling
Een IC-afdeling is een reservoir van infectieuze micro-organismen. Gordijnen, wanden, vloeren en airconditioning zijn alle potentiële besmettingsbronnen. Belangrijk hierbij is de wijze en frequentie van schoonmaak en ontsmetting.
Isolatie
Onder isolatie wordt verstaan het geheel van (verpleegkundige) maatregelen dat nodig is om overdracht van micro-organismen te vermijden. Het nemen van isolatiemaatregelen is nodig om overdracht van micro-organismen (bijvoorbeeld bacteriën of virussen) te vermijden. Er zijn twee redenen om een patiënt te isoleren:
■ ter bescherming van medepatiënten, medewerkers en bezoekers; dit wordt bron-isolatie genoemd;
■ ter bescherming van de patiënt zelf; dit wordt beschermende isolatie genoemd.
Onder bron-isolatie vallen de volgende vormen van isolatie.
■ Contactisolatie is aangewezen bij patiënten bij wie door direct contact met excreta of secreta, zoals feces, bloed, wondvocht, sputum of urine overdracht van pathogene micro-organismen kan plaatsvinden.
■ Standaardisolatie is aangewezen bij de verpleging van patiënten bij wie door aerosolen (microscopisch kleine druppels) uit sputum, speeksel of blaasjesvocht overdracht van pathogene micro-organismen kan plaatsvinden, of bij specifiek aan te geven ziektebeelden of patiëntengroepen.
■ Respiratoire isolatie is een vorm van standaardisolatie waarbij alleen via aerosolen overdracht van micro-organismen plaats kan vinden. Voor respiratoire isolatie is een kamer voorzien van onderdruk en bij voorkeur met sluis nodig.
■ Strikte isolatie is aangewezen bij enkele zeldzame ziekten en ziekten waarvan de verspreiding ernstige gevolgen kan hebben, zoals MRSA. Voor strikte isolatie is altijd een kamer met een sluis en drukregulatie nodig.
Beschermende isolatie is het beschermen van patiënten met een sterk verminderde weerstand (patiënten met leukopenie, aidspatiënten, patiënten die bestraald worden, patiënten met ernstige brandwonden, enz.) tegen overdracht van micro-organismen. Voor beschermende isolatie is altijd een kamer met sluis en over-drukregulatie nodig.
Strikte isolatie voor meticillineresistente
Staphylococcus aureus
Sinds een tweetal decennia heeft een aantal stafylokok-kenstammen resistentie ontwikkeld tegen meticilline, cloxacilline en fludoxacilline. Dergelijke stammen noemen we meticillineresistente Staphylococcus aureus ofwel MRSA. Deze meticillineresistentie betekent dat alle antibiotica uit de b-lactamgroep (penicillinen en cefalosporinen) onwerkzaam zijn. Tevens gaat deze resistentie vaak gepaard met resistentie tegen andere antibiotica, met name aminoglycosiden. Het ziekmakend vermogen van de MRSA is niet groter dan dat van de voor β-lactamantibiotica gevoelige stafylokokken. Sommige stammen hebben de eigenschap zich snel te verspreiden.
Het bij zich dragen van MRSA is in Nederland nog steeds een uitzondering. Dit betekent dat hier voor profylaxe en therapie van stafylokokkeninfecties β-lactamantibiotica de eerste keuze zijn. Vanuit het buitenland worden af en toe door patiënten die in een buitenlands ziekenhuis opgenomen zijn geweest, MRSA-stammen meegenomen en in een Nederlands ziekenhuis geïntroduceerd. Om verspreiding van MRSA te voorkomen, worden patiënten die uit een buitenlands ziekenhuis komen, in strikte isolatie verpleegd omdat het overdragen van de Staphylococcus aureus niet alleen via direct contact plaats kan vinden, maar ook aerogeen. De strikte isolatie blijft gehandhaafd tot de uitslagen van de inventarisatiekweken bekend zijn. Bestrijding van MRSA in een ziekenhuis is nodig om te voorkomen dat profylaxe en behandeling van infecties met S. aureus niet meer mogelijk zijn, doordat de bacterie resistent is tegen vele of zelfs alle gangbare antibiotica. Wanneer geen maatregelen genomen zouden worden om de verspreiding van MRSA tegen te gaan, zou dit betekenen dat de prevalentie van het aantal MRSA-dragers geleidelijk zal toenemen. Achtereenvolgens zal men in de ziekenhuissituatie dan de volgende twee fasen doorlopen.
■ Eerste fase: zolang MRSA-kolonisatie nog zeldzaam is ( < 5%), zullen patiënten met een mogelijke (MR)SA-infectie met β-lactamantibiotica behandeld worden tot de resistentie van de stafylokok bekend is. Dit wil zeggen dat de eerste drie tot vijf dagen (tot het resistentiepatroon bekend is) de therapie bij patiënten met een MRSA-infectie ontoereikend is. Een aantal patiënten zal de verkeerde preoperatieve profylaxe krijgen. Wanneer zij drager zijn van MRSA faalt de profylaxe en is het risico van postoperatieve stafylokokkeninfectie even groot als wanneer men geen profylaxe zou geven.
■ Tweede fase: het percentage meticillineresistente Staphylococcus aureus zal waarschijnlijk oplopen tot 30 à 60% (dit is het percentage dat men bereikt heeft in landen waar geen maatregelen genomen worden). Dit zal consequenties hebben voor het hele antibioticabeleid; vancomycine zal het middel van eerste keuze worden ter behandeling van infecties waarbij S. aureus een rol zou kunnen spelen, tot de verwekker bekend is. Alle antimicrobiële profylaxe met β-lactamantibiotica zal vervangen moeten worden door vancomycine. Soms is een MRSA niet multiresistent. Dan is een behandeling met gentamicine of cotrimoxazol mogelijk. Zolang het percentage meticilline-resistente Staphylococcus aureus in Nederland op het huidige lage niveau blijft, is het de moeite waard om verspreiding van deze stammen tegen te gaan.
Bij verdenking op MRSA onderscheiden we twee categorieën:
-
■ MRSA-verdachte patiënten uit het buitenland; dit zijn alle patiënten die vanuit een buitenlands ziekenhuis of buitenlands verpleeghuis worden opgenomen. Deze patiënten zijn te verdelen in twee categorieën:
- patiënten met een verwaarloosbaar kleine kans op besmetting met MRSA; dit zijn patiënten die in een buitenlands ziekenhuis klinisch of poliklinisch zijn behandeld maar niet langer dan 24 uur opgenomen zijn geweest en niet in het buitenland zijn geopereerd en geen drains en/of katheters hebben en niet zijn geïntubeerd (geweest) en geen open wonden hebben of mogelijke infectiebronnen zoals abcessen of furunkels;
- patiënten met een grote kans op besmetting met MRSA of bij wie besmetting is aangetoond; dit zijn alle patiënten uit een buitenlands ziekenhuis of buitenlands verpleeghuis die langer dan 24 uur opgenomen zijn geweest of zijn geopereerd of een drain en/of katheter hebben of zijn geïntubeerd (geweest) of open wonden hebben of mogelijke infectiebronnen zoals abcessen of furunkels of aangetoond drager zijn van MRSA.
■ MrSA-verdachte patiënten uit Nederland; dit zijn patiënten die zijn overgenomen uit een (Nederlands) zieken-of verpleeghuis waar MRSA voorkomt of zijn overgenomen uit een ander Nederlands zieken-of verpleeghuis en daar als MRSA-verdacht, MRSA-positief of ex-MRSA bekend zijn.
Restrictie van gebruik van antibiotica
Preventie van antibioticaresistentie is erop gericht om bacteriële infecties te kunnen blijven behandelen. Antibioticaresistentie ontstaat doordat de bacterie zich aanpast als gevolg van antibioticagebruik. Niet alleen de hoeveelheid gebruikte antibiotica, maar ook de manier waarop antibiotica worden toegepast is van invloed op de resistentieontwikkeling. Onzorgvuldig gebruik van antibiotica, zoals een verkeerde indicatie of onjuiste doseringen (zowel te veel als te weinig), maar ook het gebruik van antibiotica die zich op meerdere bacteriën (breed spectrum) richten in een situatie waarin één antibioticum gericht op een specifieke bacterie voldoende zou zijn, kan leiden tot resistentie.
Routinesurveillance
Preventie van antibioticaresistentie betekent ook het anticiperen op nieuwe typen antibioticaresistente bacteriën door middel van een surveillancesysteem. Hierdoor is er steeds meer aandacht voor de opkomst van nieuwe typen antibioticaresistente bacteriën zoals de ESBL-producerende bacteriën. ESBL-bacteriën behoren tot de groep bijzonder resistente micro-organismen (BRMO). Dit zijn bacteriën die resistent zijn voor de meest gangbare antibiotica en steeds vaker ook voor de zogenoemde reservemiddelen (antibiotica die juist voor dit soort infecties achter de hand worden gehouden). Infecties met deze bacteriën zijn moeilijk te behandelen en vereisen specifieke hygiënische maatregelen wanneer patiënten in het ziekenhuis zijn opgenomen.
4.11 HIV/AIDS op de intensive-care-afdeling
Hiv (human immunodeficiency virus) is de veroorzaker van aids (acquired immunodeficiency syndrome). Wereldwijd is er een enorme epidemie gaande, waarbij Afrika en grote delen van Azië zwaar getroffen worden. In Nederland waren er per 1 juni 2010 13.035 mensen onder behandeling in de 25 verschillende hiv-behandelcentra in het land. De schatting is dat 8.000-10.000 mensen in Nederland rondlopen met een hiv-infectie terwijl zij dit niet weten. Mannen die seks hebben met mannen, maken in Nederland voor 58% deel uit van de hiv-populatie. Patiënten uit sub-Sahara-Afrika nemen 15% voor hun rekening. Er bestaan twee soorten: hiv 1 en hiv 2. Hiv 1 is het meest voorkomende hiv-type ter wereld. Hiv 2 komt met name in West-Afrika voor. Ook in Nederland wordt een kleine groep patiënten voor hiv 2 behandeld. Hiv 2 is minder virulent en hiv 1 verloopt derhalve progressiever dan een hiv 2-infectie. Tevens bestaan er ook subtypen van het virus.
Sinds 1996 bestaat de mogelijkheid een hiv-infectie adequaat met medicijnen te behandelen. Door de introductie van cART (combinatie antiretrovirale therapie) is het aantal sterfgevallen als gevolg van aids sterk teruggelopen. Veel mensen bij wie voor 1996 de diagnose aids is gesteld, worden nu behandeld met cART en voelen zich daar goed bij. Ze werken, kunnen zelfstandig hun dagelijkse activiteiten verrichten en hiv-negatieve kinderen krijgen.
Het is belangrijk om te weten dat niet overal ter wereld een goede behandeling tegen hiv/aids mogelijk is. Als er geen toegang is tot medicatie, is aids nog steeds een dodelijke ziekte. Dit kan effect hebben op hoe patiënten afkomstig uit deze landen op een in Nederland ontdekte hiv-infectie reageren; zij kunnen nauwelijks geloven dat in Nederland nu wordt gesproken over een chronische aandoening bij de diagnose hiv/aids.
Resistentie tegen cART komt voor. Patiënten zelf kunnen onder andere door slechte inname resistent worden tegen cART en dit resistente virus doorgeven aan anderen. Deze nieuw geïnfecteerden hebben bij aanvang veel minder behandelmogelijkheden. Tevens is cART vooral werkzaam tegen hiv 1. Mensen met hiv 2 hebben minder behandelmogelijkheden.
Momenteel worden veel minder patiënten opgenomen in het ziekenhuis dan aan het begin van de hiv-epidemie. Bij patiënten met hiv die op de IC worden opgenomen, hoeft niet altijd een hiv-gerelateerde aandoening het probleem te zijn. Omdat hiv nu een chronische aandoening is, is het goed mogelijk dat een ander medisch probleem de oorzaak is voor de opname van de patiënt. Het vermoeden bestaat dat het verouderingsproces van patiënten met hiv sneller verloopt. Zij hebben eerder en een grotere kans op het krijgen van ouderdomsziekten zoals hart-en vaatziekten, osteoporose, nierziekten, leverziekten en kanker.
De groep patiënten bij wie hiv in een late fase ontdekt wordt, loopt een verhoogd risico opgenomen te worden op de IC. Mogelijk is er sprake van late diagnose, anderzijds kunnen het patiënten zijn die niet therapietrouw zijn of zich aan de zorg hebben onttrokken. Tevens zal er een verschil zijn in patiënten die reeds bekend zijn met hiv en patiënten bij wie nog maar kort (mogelijk zelfs op de IC) de diagnose hiv/aids gesteld is.
In deze paragraaf zal het voornamelijk gaan over de patiënt met een opportunistische infectie bij een lage afweer. Tevens zal er aandacht besteed worden aan de patiënt bij wie de diagnose hiv/aids bij opname op de IC gesteld wordt.
4.11.1 Hiv en aids
Hiv tast diverse cellen aan, zoals lymfocyten, monocyten en cellen in het centrale zenuwstelsel. Hiv is een retrovirus dat bij vermenigvuldiging het RNA transformeert in DNA en zodoende in staat is om zich via het DNA van de cel te vermenigvuldigen, waarbij de cel verzwakt en afsterft. Met name de helper-T-lymfocyten (CD4), die een coördinerende functie hebben in het afweersysteem, worden aangetast door hiv. Door het te gronde gaan van de CD4-cellen vermindert de afweer. Binnen enkele jaren kunnen opportunistische infecties optreden.
Op het moment dat opportunistische aandoeningen optreden en tegelijkertijd antistoffen tegen hiv aanwezig zijn, wordt de diagnose aids gesteld. De Centers for Disease Control and Prevention (CDC) in de Verenigde Staten hebben een lijst gemaakt van deze specifieke aandoeningen.
Opportunistische infecties zijn infecties die bij een intacte afweer niet ziekteverwekkend zijn. Voorbeelden van opportunistische infecties zijn Pneumocystis jirovecipneumonie (PCP), cryptokokkenmeningitis, Candida-oesofagitis en toxoplasmose. Veel opportunistische infecties zijn reactivaties van eerder doorgemaakte infecties. Bij aids kan het verloop ernstig zijn. Ook bepaalde vormen van kanker, zoals kaposi-sarcoom en non-hodgkinlymfoom komen vaker voor.
De opportunistische infecties gaan vaak samen met een verlaagde afweer. Een normale afweer bevat 500-1500 CD4-cellen per mm3. Vooral bij < 200 CD4-cellen per mm3 in het bloed neemt de kans op een opportunistische infectie toe.
Het verloop van de infectie
De hiv-infectie verloopt ruwweg in een aantal fasen. Tabel 4.4 geeft de fasen weer die worden onderscheiden volgens het CDC-classificatiesysteem.
| Clinicial Categories CD4 T-cell Categories |
A Asymptomatic |
B Symptomatic |
C Aids Indicator Conditions |
|---|---|---|---|
| > 500/mm3 | A1 | B1 | C1 |
| 200-499/mm3 | A2 | B2 | C2 |
| < 200/mm3 | A3 | B3 | C3 |
Een hiv-infectie kan beginnen met een acute infectie. In de fase van de acute infectie is er meestal zeer veel virus in het bloed (viral load), waardoor het CD4-aantal een scherpe daling kan maken. Van de mensen die geïnfecteerd zijn, heeft 40-90% in de beginperiode griepachtige verschijnselen die niet direct met hiv in verband worden gebracht. In een enkel geval daalt de afweer dusdanig dat er zelfs opportunistische infecties optreden. Het griepachtige beeld is een reactie van het lichaam op het binnendringen van hiv. Er kan hoge koorts optreden, algehele malaise en exantheem van de huid. Er kan ook sprake zijn van lymfadenopathie.
Als iemand in deze fase getest wordt, zal de test niet per definitie uitwijzen dat deze persoon hiv heeft. De hiv-antistoffentest toont namelijk de aanwezigheid van antistoffen tegen hiv in het bloed aan, en deze kunnen in de acute fase nog niet volledig gevormd zijn. Een hiv-antistoffentest kan wel reactief reageren, maar hoeft nog niet volledig positief te zijn. Met de nieuwste tests kan een hiv-antistoffentest wel al na twee weken positief uitvallen.
Na de acute infectie volgt er een periode van asymptomatische infectie. Men is drager van hiv, maar er zijn geen ziekteverschijnselen. Dit kan vele jaren duren - sommige mensen krijgen sneller symptomen dan andere. Gemiddeld duurt deze periode acht jaar.
In de symptomatische fase kunnen er klachten optreden zoals vermoeidheid, huidklachten, onder andere gordelroos, nachtzweten, onverklaarbaar gewichtsverlies, vaak of gedurende langere tijd onbegrepen koorts, opgezette klieren en besmetting met Candida albicans. De symptomen kunnen erg algemeen zijn.
Vergevorderde hiv of aids treedt niet bij iedereen op. Tegenwoordig zijn er minder mensen die in deze fase terechtkomen, dit omdat hiv bij hen al in een eerder stadium is vastgesteld en reeds met de behandeling met cART begonnen is.
Behandeling van hiv/aids
Om zich te vermenigvuldigen moet hiv meerdere stappen doorlopen. Het hiv dringt de CD4-cel binnen en daar zorgt het ervoor dat de CD4-cel nieuwe hiv-virussen aanmaakt. Die nieuwe virussen kunnen vervolgens andere cellen infecteren en zo begint het hele proces opnieuw. Dit wordt de replicatiecyclus genoemd. cART verhindert een van de stappen in de replicatiecyclus. cART is onder te verdelen in verschillende klassen. Het verschil tussen de klassen zit hem in welke stap binnen de virusreplicatie verhinderd wordt. Het gevolg is dat de replicatie van het virus niet voltooid kan worden en de aanmaak van nieuw virus dus wordt geremd.
De medicamenteuze behandeling bij hiv bestaat uit het geven van medicijnen uit verschillende groepen. Het doel van cART is de replicatie van hiv zo veel mogelijk te verhinderen. Doordat het hiv in het bloed, de viral load, afneemt, zal het afweersysteem in staat zijn om zich te herstellen en kunnen de CD4 toenemen. Het risico op het krijgen van opportunistische infecties neemt daardoor af.
cART kan in groepen onderverdeeld worden al naar gelang de manier van hiv-remming.
■ De fusieremmer voorkomt dat hiv in contact komt met de coreceptor van de cel.
■ Hiv komt de cel binnen door contact te maken met de CD4-receptor en de coreceptor. De entree-remmer verhindert deze stap.
■ Integrase is een hiv-enzym dat helpt bij het inbouwen van het genetisch materiaal van hiv in het genetisch materiaal van de cel. Een integraseremmer zorgt ervoor dat dit proces afgeremd wordt.
■ Reverse transcriptase is een hiv-enzym. Als hiv een cel infecteert, wordt het genetisch materiaal van hiv in het genetisch materiaal van de cel ingebouwd. Voordat dat kan gebeuren moet het genetisch materiaal van hiv omgezet worden van RNA in DNA. Voor dit proces heeft hiv het enzym reverse transcriptase nodig. Een reverse-transcriptase-remmer remt dit proces.
■ Protease is een hiv-enzym. Bij vermenigvuldiging van hiv wordt eerst een sliert eiwit aangemaakt die door de protease in stukjes wordt geknipt.
■ Het nieuwe virus wordt uit deze stukjes opgebouwd. Proteaseremmers verhinderen dat het eiwit in stukjes wordt geknipt.
Therapietrouw bij het gebruik van cART is belangrijk. Er moet sprake zijn van 95% therapietrouw; dit betekent elke dag op hetzelfde tijdstip dezelfde hoeveelheid medicijnen innemen. Gebeurt dit niet, dan kan resistentie ontstaan. Bij resistentie kan kruisresistentie optreden, waarbij de behandelmogelijkheden voor de patiënt ernstig beperkt kunnen worden.
De verpleegkundige draagt op de IC de verantwoordelijkheid voor de therapietrouw. De verpleegkundige zal ervoor moeten zorgen dat de cART altijd op hetzelfde tijdstip verstrekt wordt. Sommige cART mag gemalen worden, het bestaat ook als drank. Overleg goed met de apotheek indien de patiënt de cART niet zelf kan innemen. Multifarmacokinetiek kan ook een probleem zijn op de IC. Veel vormen van cART hebben een wisselwerking met medicatie die veelvuldig op de IC gebruikt wordt. Een goede samenwerking tussen apotheker, IC-personeel en hiv-specialist is van belang om de behandeling goed te laten verlopen. De behandeling met cART kan levensreddend zijn.
Bijwerkingen cART
cART kent bijwerkingen op de korte en de lange termijn. Als een patiënt net start met cART kunnen er bijwerkingen optreden die van voorbijgaande aard zijn, bijvoorbeeld duizeligheid, diarree en misselijkheid. Bij sommige cART kan een huidreactie voorkomen.
Het geneesmiddel abacavir kan een algehele overgevoeligheidsreactie geven. Deze uit zich onder andere in exantheem, koorts, algehele malaise en leverfunctiestoornissen. Indien dit medicijn bij een vermoeden van overgevoeligheid is gestopt, mag het nooit weer worden hervat. Als een patiënt overgevoelig is, kan er bij een hernieuwde blootstelling aan het middel een levensbedreigende anafylactische allergie-reactie ontstaan. Er bestaat sinds 2009 een test die kan voorspellen of iemand overgevoelig is voor abacavir; het gevolg hiervan is dat een anafylactische reactie in de praktijk minder vaak voorkomt.
Ook het syndroom van Stevens-Johnson wordt vermeld als bijwerking van cART. Hierbij laat de opperhuid los en komen er over het hele lichaam blaren; het gevolg is een toestand die vergelijkbaar is met die van een patiënt met zeer ernstige verbrandingen. Het syndroom kan tot de dood leiden.
Met bovengenoemde complicaties kan een patiënt op de IC belanden.
Immune reconstitution inflammatory syndrome
Vooral in de eerste zes maanden na het starten van cART reageert een deel van de patiënten met een afweer lager dan CD4 200 per mm3 (10-25%) met een pathologische immuunrespons op infectieuze antigenen die zowel dood als levend of latent aanwezig zijn. Een hoge viral load en een snelle daling hiervan vergroot het risico op het krijgen van het immune reconstitution inflammatory syndrome (IMS ).
Een onverwachte verslechtering van de patiënt kan optreden. De klinische verschijnselen kunnen zeer atypisch zijn. Het maken van een onderscheid tussen IMS, een opportunistische infectie en geneesmiddelentoxiciteit is van belang om de juiste behandeling te kiezen.
4.11.2 Opportunistische infecties
In tabel 4.5 staan de meest voorkomende opportunistische infecties bij hiv/aids en hun verwekker. In deze paragraaf komen verder kort de volgende drie opportunistische infecties aan bod: toxoplasmose cerebri, Pneumocystis-pneumonie en cryptokokkenmeningitis.
| Plaats van infectie | Ziekte of symptoom | Verwekker |
|---|---|---|
| long |
• Pneumonie • tuberculose |
• Pneumocystis jiroveci, cytomegalovirus • Mycobacterium tuberculosis |
| mond |
• wit beslag • oral hairy leukoplakia (OHL) • ulcera |
• Candida albicans • epstein-barr-virus • herpes-simplex-virus −1, Histoplasma capsulatum |
| slokdarm |
• wit beslag • oesofagitis |
• Candida albicans • cytomegalovirus, herpes-simplexvirus 1 |
| darmen | • diarree | • Salmonella spp., Shigella spp., cytomegalovirus, Cryptosporidium parvum, Cystoisospora belli (oude naam: Isospora belli), Microsporidium, Giardia lamblia |
| centraal zenuwstelsel |
• Meningitis • hersenabces • progressieve multifocale leuko-encefalopathie (PML) |
• Cryptococcus neoformans • Toxoplasma gondii • JC-virus |
| ogen | • retinitis | • cytomegalovirus |
| huid |
• kaposi-sarcoom • herpes zoster • subcutane nodi |
• humaan herpesvirus 8 • varicella-zoster-virus • Cryptococcus neoformans |
| reticulo-endotheliaal systeem | • lymfadenopathie of splenomegalie | • Mycobacterium avium-complex, epstein-barr-virus |
4.11.2.1 Toxoplasmose cerebri
Toxoplasmose cerebri is een van de meest voorkomende opportunistische infecties. Het is bijna altijd een reactivatie van een latente infectie met de parasiet Toxoplasma gondii. Dit is een parasiet waarmee veel mensen geïnfecteerd zijn, maar die bij een goede afweer geen gevolgen heeft voor de gezondheid. Bij een lage afweer kan deze parasiet abcessen vormen in de hersenen. De opportunistische infectie komt voornamelijk voor bij mensen met een CD4 < 100/mm3.
De symptomen voor een toxoplasmose cerebri kunnen zijn: verwardheid, problemen met spreken en paresis, epileptische insulten, hoofdpijn (vaak met subfebriele verhoging van de temperatuur). De diagnose vindt plaats door middel van een CT of MRI, waarop ringvormige afwijkingen te zien zijn.
De behandeling is 4-6 weken met intraveneus sulfadiazine in combinatie met pyrimethamine. De behandeling dient samen te gaan met folinezuur in verband met een hoge kans op een beenmergdepressie bij de behandeling. Er moet goed geobserveerd worden op bijwerkingen, met name op een allergische reactie, omdat deze veelvuldig voorkomen. Cotrimoxazol intraveneus is een mogelijkheid als de patiënt de behandeling niet verdraagt.
De eerste twee weken na behandeling zal een klinische verbetering moeten optreden, anders is het mogelijk dat er een ander neurologisch probleem bij de patiënt bestaat. Significante verbeteringen van de laesies van toxoplasmose cerebri kun je pas na vier weken op de MRI zien.
cART zal snel gestart moeten worden. Een cART met een hoge kans op allergische reacties kan het beste vermeden worden omdat het moeilijk te onderscheiden zal zijn of de allergische reactie van de cART is of van de medicatie tegen de toxoplasmose.
Toxoplasmose cerebri is een levensbedreigende ziekte en de behandeling is gecompliceerd. Door een snelle behandeling kunnen blijvende schade aan de hersenen en restverschijnselen zoals hemiparese zo veel mogelijk voorkomen worden.
4.11.2.2 Pneumocystis-pneumonie
Pneumocystis-pneumonie (PCP) is de meest voorkomende opportunistische infectie. Ze wordt veroorzaakt door Pneumocystis jiroveci, een bijzonder soort schimmel. Deze opportunistische infectie komt voornamelijk voor bij een afweer met een CD4 < 200/mm3. Een PCP is een levensbedreigende ziekte met een mortaliteit tot 10%. Patiënten lopen meer risico op overlijden bij een laag Hb-gehalte, een hogere leeftijd en een lage saturatie. Vaak is invasieve beademing nodig.
Het kan lang duren voordat een PCP gediagnosticeerd is. Patiënten hebben last van gewichtsverlies, droge hoest, kortademigheid bij inspanning en een subfebriele temperatuur. Vooral patiënten die niet op de hoogte zijn van hun hiv-status en mensen die zich aan de zorg hebben onttrokken en/of therapieontrouw zijn, lopen een risico op deze opportunistische infectie. Soms kunnen er weken of maanden voorbijgaan voordat de diagnose is gesteld. De ontstekingswaarden in het bloed, zoals CRP, zijn niet altijd verhoogd. Vaak zijn de patiënten regelmatig behandeld met breed-spectrum-antibiotica voordat de diagnose gesteld wordt. Door een plotseling optredende verslechtering waardoor zij op de spoedeisende hulp terechtkomen, wordt dan de diagnose gesteld. Een X-thorax geeft niet altijd een duidelijk beeld. Een bronchoalveolaire lavage (BAL) kan duidelijkheid geven, maar met de behandeling zal niet moeten worden gewacht tot de uitslag van de BAL.
Behandeling bestaat uit cotrimoxazol. Afhankelijk van de lichamelijke conditie van de patiënt kan orale behandeling of intraveneuze behandeling gegeven worden, dit samen met prednisolon om een verslechtering van de algehele toestand te voorkomen. Er zal zo snel mogelijk met cART gestart moeten worden.
Patiënten met een CD4 < 200/mm3 dienen dan ook altijd preventief behandeld te worden met cotrimoxazol. Dit verkleint de kans op een PCP.
4.11.2.3 Cryptokokkenmeningitis
Cryptokokkenmeningitis wordt veroorzaakt door een gist, Cryptococcus neoformans, en heeft een mortaliteit van 6-25%. De cryptokok kan zich ook op andere plaatsen manifesteren, maar in 86% van de gevallen wordt een manifestatie in het centrale zenuwstelsel gezien, wat leidt tot een meningitis. De cryptokokkenmeningitis wordt voornamelijk gezien bij een CD4 < 100/mm3. Cryptokokkenmeningitis komt ook vaak voor als Iris.
Patiënten klagen over hoofdpijn en koorts, en verwardheid kan optreden met verlies van gezichtsen gehoorfunctie. De cryptokokkenmeningitis hoeft geen duidelijke symptomen te tonen van meningeale prikkeling zoals nekstijfheid. De MRI geeft niet altijd afwijkingen aan. Naast cryptokokkenantigenen in het bloed (titer > 1:8) is een lumbaalpunctie het belangrijkste diagnostische middel.
De behandeling bestaat uit een combinatie van antimycotica intraveneus in de acute fase van 4-6 weken. Over het starten van de cART bestaat momenteel nog geen consensus. Er zijn artsen die pleiten voor een start in de acute fase van de cryptokokkenmeningitis en er zijn artsen die de patiënt eerst willen stabiliseren alvorens cART te starten. Een reden om later te starten is de verhoogde kans op IRIS.
4.11.3 Diagnose van hiv/aids op de intensive care
Als een patiënt tijdens opname op de IC gediagnosticeerd wordt met hiv, dient het medisch personeel van de IC er bij het meedelen van de diagnose rekening mee te houden dat hiv een stigmatiserende chronische aandoening is. Het meedelen van de diagnose aan familieleden kan verstrekkende gevolgen hebben voor de patiënt. Uitsluiting en verstoting zijn hierbij geen uitzondering.
Belangrijk bij het vertellen van de diagnose aan de contactpersonen is dat er goede opvangmogelijkheden zijn in de vorm van consultatie van een verpleegkundige of arts die gespecialiseerd is in hiv. Zij kunnen actuele informatie geven over hiv. Indien de patiënt niet bij kennis is, kan hij niet zelf bepalen aan wie de diagnose verteld wordt. Indien de diagnose wordt meegedeeld aan anderen, is het van belang te benadrukken om vertrouwelijk met dit gegeven om te gaan. Tevens is het bieden van de mogelijkheid tot het direct testen van eventuele partner(s) gewenst.
Ook bij patiënten die reeds langer bekend zijn met hiv en opgenomen worden op de IC, kan het voorkomen dat familie niet op de hoogte is van de hiv-infectie.
4.11.4 Speciale aandacht bij de lichamelijke verzorging
De huid
De patiënt met hiv op de IC-afdeling kan in slechte toestand zijn. Huiddefecten genezen daardoor moeilijk. Een tijdig ingestelde behandeling kan complicaties voorkomen. Verpleegkundigen moeten in hun observaties zeer bedacht zijn op herpesinfecties, zowel herpes simplex als herpes zoster. Dit geldt zeker wanneer corticosteroïden worden toegediend. Aangezien deze infecties bij mensen met hiv zeer gecompliceerd kunnen verlopen, is het snel starten van een behandeling noodzakelijk. Veelal kan worden gewerkt met orale medicatie zoals valaciclovir. Wanneer dit niet mogelijk is, kan intraveneus aciclovir worden toegediend. Het werken met crème tegen herpes werkt bij een patiënt met een verlaagde weerstand onvoldoende en wordt afgeraden.
De mond
Als gevolg van de lage afweer raakt het mondslijmvlies van de patiënt met hiv snel geïnfecteerd, sneller nog dan bij de gemiddelde IC-patiënt. Bij patiënten met een CD4-waarde < 100/mm3 is een Candida albicans-infectie een aandoening die klachten geeft in de mond en vaak ook in de slokdarm. Antibioticagebruik verhoogt de kans op een dergelijke infectie nog eens extra, evenals het gebruik van corticosteroïden.
Een candida-infectie kan lokaal behandeld worden met zuigtabletten en suspensies. De behandeling is erop gericht de celwand van Candida albicans te beschadigen. De contacttijd tussen het middel en de Candida moet minimaal een minuut zijn. Indien dit niet mogelijk is of als de candida-infectie tot in de slokdarm is gedrongen, moet voor systemische therapie worden gekozen.
Hygiëne
In principe gelden uit het oogpunt van infectiepreventie geen extra maatregelen voor het verplegen van patiënten met hiv/aids. Wanneer volgens de geldende regels wordt gewerkt, is de medewerker op de IC-afdeling goed beschermd. Bron-isolatie is eigenlijk alleen nodig wanneer de patiënt hoest en er geen verwekker bekend is. Er kan dan immers sprake zijn van tuberculose. De preventie van tuberculose is de laatste jaren belangrijk geworden omdat er multiresistente tuberculosestammen worden gesignaleerd, vooral in Zuid-en Oost-Europa. Multiresistente tuberculose kan vooral bij mensen met een gestoorde afweer resulteren in overlijden. Zolang bij de hoestende patiënt met hiv de verdenking op tuberculose bestaat en het tegendeel niet is bewezen, moet de bron-isolatie worden voortgezet. Beschermende isolatie is alleen nodig als de arts een besmettingsrisico voor de patiënt aanwezig acht.
4.11.5 Accidenten en letsels
Als er ondanks alle hygiënische maatregelen toch een accident plaatsvindt waardoor bij prikken of snijden biologisch materiaal in de ontstane wond komt, dan dient men het protocol met betrekking tot prikaccidenten op te volgen dat in het eigen ziekenhuis geldt.
Ter voorkoming van een hiv-infectie kan PEP (post exposure profylaxe) worden gegeven. De mate van risico op een hiv-infectie moet door een specialist beoordeeld worden en hangt af van verschillende factoren, zoals de hoogte van de viral load van de patiënt, de dikte van het lumen van de naald en de diepte van de wond. De kans op overdracht van hiv bij een prikaccident met een hiv-positieve patiënt is 0,3%. Bij een hoge viral load en een laag CD4-aantal kan dit oplopen tot 5%. Een PEP-kuur bestaat uit cART die 28 dagen geslikt moet worden om een hiv-besmetting te voorkomen. Drie maanden na het incident kan bepaald worden of er een hiv-besmetting heeft plaatsgevonden.
Literatuur
- American College of Surgeons. Advanced trauma life support for doctors. Chicago: ACS, 2009.
- Barletta JF, Ahrens CL, Tyburski JG, Wilson RF. A review of recombinant factor VII for the refractory bleeding in nonhemophylic trauma patients. J Trauma. 2005;58:646–51. doi: 10.1097/01.TA.0000154561.97961.AD. [DOI] [PubMed] [Google Scholar]
- Bouwmeester FW, Jonkhoff AR, Verheijen RH, van Geijn HP. Successful treatment of life-threatening postpartum hemorrhage with recombinant activated factor VII. Obstet Gynecol. 2003;101:1174–6. doi: 10.1016/s0029-7844(03)00350-8. [DOI] [PubMed] [Google Scholar]
- Friederich PW, Henny CP, Messelink EJ. Effect of recombinant activated factor VII on perioperative blood loss in patients undergoing retropubic prostatectomy: a double-blind placebo-controlled randomised trial. Lancet. 2003;361:201–5. doi: 10.1016/S0140-6736(03)12268-4. [DOI] [PubMed] [Google Scholar]
- Frölke JPM, Kamphuisen PW, Geeraedts LMG., Jr ‘Blind’ transfusiebeleid bij patiënten met acuut ernstig bloedverlies. Ned Tijdschr Geneeskd. 2004;148:1901–6. [PubMed] [Google Scholar]
- Gras L, Sighem A van, Smit C, et al. Monitoring of human immunodeficiency virus (HIV) infection in the Netherlands. Amsterdam: Stichting HIV monitoring, 2010.
- Hoffman C, Rockstroh JK. HIV 2009. Hamburg: Medizin Fokus Verlag; 2009. [Google Scholar]
- Huang L, Quartin A, Jones D, Havlir DV. Intensive care of patients with HIV infection. N Engl J Med. 2006;355:173–81. doi: 10.1056/NEJMra050836. [DOI] [PubMed] [Google Scholar]
- Levi M. Effects of different plasma substitutes on blood coagulation: a comprehensive review. Crit Care Med. 2001;29:1261–7. doi: 10.1097/00003246-200107001-00028. [DOI] [PubMed] [Google Scholar]
- Kamphuisen PW, Levi M, van Kraaij MGJ. Diagnostische en farmacotherapeutische opties bij acuut ernstig bloedverlies. Ned Tijdschr Geneeskd. 2004;148:1907–11. [PubMed] [Google Scholar]
- Kopko PM, Marshall CS, Mackenzie MR. Transfusion-related acute lung injury: report of a clinical look-back investigation. JAMA. 2002;287:1968–71. doi: 10.1001/jama.287.15.1968. [DOI] [PubMed] [Google Scholar]
- Levi M, Friederich PW, van der Meer J. Behandeling en preventie van bloedingen met recombinant-geactiveer-de-factor VII, niet alleen bij hemofilie. Ned Tijdschr Geneeskd. 2002;146:2534–7. [PubMed] [Google Scholar]
- Levi M, Peters M, Büller HR. Efficacy and safety of recombinant factor VIIa for treatment of severe bleeding: a systematic review. Crit Care Med. 2005;33:883–90. doi: 10.1097/01.CCM.0000159087.85970.38. [DOI] [PubMed] [Google Scholar]
- Levinson W. Review of medical microbiology and immunology. 11. New York: McGraw-Hill; 2010. [Google Scholar]
- Meng ZH, Wolberg AS, Monroe DM, 3rd, Hoffman M. The effect of temperature and pH on the activity of factor VIIa: implications for the efficacy of high-dose factor VIIa in hypothermic and acidotic patients. J Trauma. 2003;55:886–91. doi: 10.1097/01.TA.0000066184.20808.A5. [DOI] [PubMed] [Google Scholar]
- Rose BD, Post TW. Clinical physiology of acid-base and electrolyte disorders. 5. New York: McGraw-Hill; 2000. [Google Scholar]
- Schadé A, Boenink AD, Danner SA. Handboek hiv en psychische klachten. Utrecht: De Tijdstroom, 2010.
- Smit C, Brinkman K, Rümke K, De Knecht-van Ekelen A. Oud worden met hiv. Amsterdam: Aidsfonds, 2009.
- Stein DM, Dutton RP, O’Connor J. Determinants of futility of administration of recombinant factor VIIa in trauma. J Trauma. 2005;59:609–15. [PubMed] [Google Scholar]
- Vervoort SCJM. Adherence to CART. A study of patients perspective and HIV nurse consultants strategies. Enschede: Gildeprint, 2009.
- www.nvab.org/richtlijnhiv/index.php/Hoofdpagina.
- www.rivm.nl/Bibliotheek/Professioneel_Praktisch/Draai-boeken/Infectieziekten/LCI_draaiboeken/Seksaccidenten.
- http://vchivaids.venvn.nl/Verpleegkundigezorg.aspx.