1. Rappel du contexte covid-19 et fin du confinement
Depuis le 16 mars 2020, la quasi-totalité des structures de soins en France ont vu leurs activités de soins, de dépistage et de recherche impactées par les mesures de confinement et de distanciation physique et sociale liées à la pandémie de SARS-CoV-2 (COVID-19) [1]. Toutes les activités de dépistage des cancers et les invitations au dépistage ont été stoppées. Les structures de coordination du dépistage ont dû également stopper leurs activités de seconde lecture.
Des recommandations de pratiques en période de COVID-19 ont été publiées par les sociétés savantes et par les tutelles pour les mesures d’hygiène et les pratiques de dépistage durant le pic pandémique [2], [3], [4]. Une sortie progressive du confinement a été annoncée par le Président de la République pour le 11 mai 2020 avec des modalités exactes actuellement non encore définies [5].
Nous proposons par ce travail collégial impliquant 6 sociétés savantes et associations professionnelles, des préconisations pratiques et une hiérarchisation, utiles pour la reprise des activités de diagnostic et dépistage en sénologie en France.
2. Les éléments de l’équation
-
•
l’arrêt du dépistage organisé du cancer du sein engendre un risque de retard au diagnostic du fait de la non-réalisation des mammographies et éventuelles échographies associées. Cependant, le cancer du sein présente dans la majorité des cas une croissance tumorale lente, et un décalage limité à deux à trois mois ne devrait donc pas majorer de façon importante le taux de cancer de stade avancé (stade 2 et plus) ni le taux de cancers d’intervalle en population générale. Le taux de cancer sans envahissement ganglionnaire est estimé à 78 % dans le dernier rapport d’évaluation du dépistage du cancer du sein publié par Santé Publique France en 2019 [2]. Ce taux est néanmoins plus élevé dans la classe d’âge 70–74 ans [2]. Concernant les cancers d’intervalle, leur taux augmente en fonction des caractéristiques de la population sous-jacente, mais également en fonction de l’intervalle entre deux mammographies [6], [7]. Cependant, là aussi, en population générale, un retard de moins de trois mois ne devrait pas augmenter le taux de cancers d’intervalle de façon majeure [7];
-
•
le retard à la réalisation des examens d’imagerie de dépistage peut avoir un impact beaucoup plus grave chez les femmes à très haut risque de cancers du sein en rapport avec une prédisposition génétique. Leur risque de cancer d’intervalle augmente très rapidement, et l’intervalle d’une année est le maximum acceptable en termes de rapport bénéfice-risque [8], [9];
-
•
l’arrêt des activités diagnostiques peut avoir beaucoup plus d’impact, chez des femmes symptomatiques en particulier, et tout doit être fait pour le limiter au maximum avec une reprise très rapide des activités [10], [11], [12]. Le confinement a été associé à une baisse majeure et rapide des consultations pour symptômes suspects. Les activités de dépistage et de seconde lecture ont été interrompues depuis la mi-mars 2020. Des retards diagnostiques de deux mois au maximum sont à attendre, qu’il faut tenter d’atténuer par une activité bien organisée, coordonnée et priorisée des centres d’imagerie, des structures de coordination du dépistage et des structures de soins;
-
•
il est nécessaire que les activités de dépistage (première et seconde lecture) et diagnostic (ainsi que prise en charge thérapeutique) soient réalisées dans des conditions respectant les mesures nécessaires d’hygiène (désinfection entre chaque consultant) et de distanciation physique (limitation de la fréquentation des salles d’attente, organisation drastique des plannings, limitation de la station en salle d’attente et dans le centre);
-
•
il est évidemment primordial de bien estimer les bénéfices et les risques de la reprise des activités de dépistage du cancer du sein. En effet, les invitations sont adressées aux femmes de la tranche d’âge 50–74 ans sans aucune notion de facteurs de risque associés (surcharge pondérale, pathologie cardio-respiratoire, traitement immunosuppresseur, etc.). Une individualisation de la priorisation de ces examens de dépistage doit ensuite être faite si possible par les praticiens, médecin généraliste, gynécologue ou radiologue;
-
•l’organisation des activités de dépistage doit prendre en compte de façon spécifique deux catégories de personnes:
-
∘celles particulièrement sensibles et à risque d’infection grave à COVID-19 (personnes âgées, contexte d’obésité ou d’insuffisances respiratoires),
-
∘celles ayant ou ayant eu le COVID-19 récemment (symptômes de moins de sept jours);
-
∘
-
•
enfin, l’activité de mammographie et d’échographie mammaire engendre des risques de contamination des personnels en raison du contact étroit et prolongé obligatoire pour la réalisation des actes. Il est nécessaire de prioriser la réalisation des examens en fonction de cet aspect également.
3. Règles d’hygiène et de distanciation physique [13], [14], [15], [16], [17], [18]
Les personnels des centres d’imagerie, comme des centres de soins, sont formés aux mesures d’hygiène en vigueur. Les mesures suivantes doivent être proposées en Imagerie du sein:
-
•maintien d’un circuit différencié dédié aux personnes porteuses du COVID-19 connues avec dernière PCR SARS-CoV-2 positive;
-
∘zone accueil et orientation,
-
∘identification claire des personnes atteintes lors de la demande d’examen,
-
∘accès séparés et plages de rendez-vous dédiées aux personnes COVID+ selon la définition précédente,
-
∘marquage au sol;
-
∘
-
•distribution d’un questionnaire à l’accueil du service pour identifier les patientes à haut risque d’être actuellement porteuses de COVID-19;
- ∘
-
∘Patiente asymptomatique avec entourage proche COVID-19 positif;
En cas de réponse positive, il est recommandé d’effectuer un test par PCR. Si l’examen sénologique reste nécessaire dans les 48 heures, il sera effectué au sein du circuit COVID+.
En cas de réponse négative, il sera nécessaire de prévoir:
-
•
organisation d’un circuit spécifique pour les personnes les plus à risque d’infection grave à SARS-CoV-2 [21];
-
•limiter les attentes et le passage en salle d’attente;
-
∘définir un nombre de places disponibles dans les espaces d’attente et le respecter,
-
∘sièges distants,
-
∘mise à disposition d’une solution hydro-alcoolique dans la salle d’attente,
-
∘adaptation/réduction du nombre de plages horaires,
-
∘absence d’accompagnant sauf pour patient dépendant,
-
∘réduction de la circulation de documents papier,
-
∘organisation au mieux d’un appel peu avant disponibilité de la salle d’examen pour limiter l’attente en salle d’examen,
-
∘éviter les attentes de compte rendus après les examens (envoi dématérialisé/courrier);
-
∘
-
•
port de masque chirurgical systématique pour le personnel d’imagerie et pour les patientes;
-
•
lavage des mains et utilisation de SHA systématisés avant l’entrée dans la salle d’examen et à la sortie, pour tous;
-
•
éviter le passage par la cabine de déshabillage si possible;
-
•
désinfection systématique (selon recommandations en vigueur) après chaque patient, de l’appareil et des zones de contact (fauteuils, lit d’examen), cabine de déshabillage s’il y a lieu;
-
•
les mesures en place seront communiquées et expliquées aux patients. Un ajustement du rythme de la programmation des examens d’imagerie est nécessaire pour permettre la désinfection des appareils.
4. Pratiques cliniques et priorisation
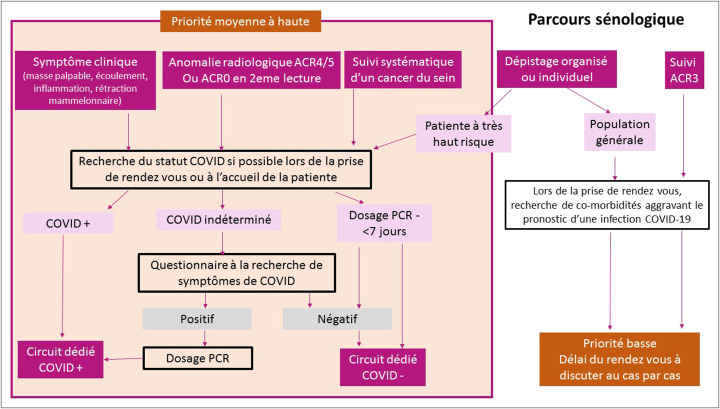
Afin de reprendre les activités de dépistage et diagnostic du cancer du sein de la façon la plus efficiente possible, en minimisant les risques de perte de chance pour retard diagnostique mais également celles d’une contamination virale lors d’un acte de dépistage; ce travail propose une hiérarchisation des actes à effectuer dans les semaines à venir (Tableau 1 et Fig. 1 ).
Tableau 1.
Dépistage et diagnostic du cancer du sein lors du déconfinement (COVID-19) - Hiérarchisation des actes à effectuer
| Priorité élevéea Rendez-vous très rapide | Priorité moyenne Rendez-vous dans les 3 moisb | Priorité basse Rendez-vous dans les 6 mois maximumb |
|---|---|---|
| Prise en charge d’imagerie diagnostique chez une personne présentant des symptômes mammaires ou axillaires suspects y compris les femmes enceintes | ||
| Prise en charge diagnostique chez une femme présentant une/des images ACR4 ou ACR5 ou ACR0 en 2nde lecture | Prise en charge d’imagerie de contrôle ou diagnostique chez une femme présentant une/des images ACR3 | IRM mammaire à la recherche d’une rupture d’implant mammaire |
| Dépistage IRM et mammographique des femmes à très haut risque de cancer du sein | Dépistage mammographique des femmes à haut risque de cancer du sein | Mammographie de dépistage en population générale sans symptôme |
| Exploration de toute anomalie détectée fortuitement en imagerie (TDM thorax ou autre) | Suivi systématique après cancer du sein | |
| Recherche d’un primitif mammaire |
Quel que soit le statut COVID-19. Si infection en cours, circuit spécifique. Si personne à haut risque d’infection grave, circuit spécifique.
Par rapport à la date théorique.
Fig. 1.
Parcours en dépistage et diagnostic des lésions du sein dans la période post-confinement COVID-19.
Une personnalisation de la prise en charge est nécessaire, même pour les actes de dépistage, en fonction des situations cliniques ou anamnestiques.
La prise de rendez-vous en imagerie du sein doit alors comporter des questions spécifiques et transitoires permettant d’orienter les personnes au mieux, elles incluent:
-
•
la personne présente-t-elle des symptômes mammaires la conduisant à demander un rendez-vous?
-
•
date de l’imagerie antérieure si dépistage;
-
•
la personne a-t-elle été atteinte du virus SARS-CoV-2? si oui date de fin des symptômes? Date du dernier test positif?;
-
•
la personne présente-t-elle actuellement des symptômes évocateurs du SARS-CoV-2?
-
•
la personne est-elle dans une situation considérée comme à risque d’infection grave par le SARS-CoV-2 à sa connaissance?
4.1. Patientes avec symptomatologie clinique mammaire
Comme préconisé dans les propositions émises par le travail collaboratif de St Paul et des sociétés savantes françaises [3], les personnes présentant une symptomatologie clinique évocatrice (masse–écoulement–déformation/modification du sein- inflammation mammaire) de cancer doivent être programmées en priorité dans un délai très court (moins de dix jours) (Tableau 1).
On rappelle que les mastodynies isolées ne nécessitent pas de prise en charge urgente en imagerie, mais une consultation ou téléconsultation de médecine générale ou gynécologie.
4.2. Bilan diagnostique d’une image suspecte bi-rad acr4 ou 5
Le bilan diagnostique d’une image identifiée comme suspecte de cancer doit être fait rapidement,: images ACR4 ou ACR5 en première ou seconde lecture, ou ACR0 en seconde lecture (Tableau 1). De la même façon, l’exploration diagnostique de toute anomalie suspecte détectée fortuitement en imagerie (TDM thorax ou autre) ou la recherche d’un primitif mammaire en cas de métastases ne peuvent pas attendre.
4.3. Dépistage du cancer du sein en population générale
-
•lors de la prise de rendez-vous (Tableau 1);
-
∘rassurer les femmes sur les délais de rendez-vous si ceux-ci sont allongés,
-
∘poser les questions listées précédemment afin d’organiser au mieux la prise en charge;
-
∘
-
•lors de la réalisation des examens;
-
∘respecter les règles de distanciation générale,
-
∘assurer de façon systématique le port de masque de la femme et du personnel lors de la réalisation des actes,
-
∘limiter au maximum les attentes: remise directe du compte rendu provisoire si faisable, sinon compte rendu disponible en ligne ou par courrier.
-
∘
4.4. Dépistage du cancer du sein chez des femmes a risque élevé ou très élevé
Chez les femmes à haut risque de type génétique ou équivalent selon les recommandations INCa nécessitant IRM annuelle [22], [23] (Tableau 1):
-
•
l’IRM et la mammographie selon indication doivent être programmées dès que possible;
-
•
si la personne est diagnostiquée COVID-19, attendre la guérison;
-
•
proposer une autopalpation d’attente si besoin.
Femmes à haut risque nécessitant une mammographie annuelle mais pas d’IRM:
-
•
la mammographie sera faite dès que possible;
-
•
une autopalpation et une palpation médicale d’attente peuvent être proposées.
4.5. Suivi systématique après cancer du sein
En imagerie mammaire la surveillance est relativement bien codifiée avec une surveillance clinique semestrielle les cinq premières années puis annuelle, et une surveillance annuelle en imagerie (Recommandations INCa 2012) [24] (Tableau 1).
La période écoulée a engendré un nombre de report d’examens relativement important qu’il va être nécessaire de reprogrammer de façon progressive. Un décalage de quelques semaines ne devrait pas engendrer de risques de retard de diagnostic et il semble utile de le rappeler aux femmes et aux correspondants.
On peut proposer une nouvelle convocation prioritaire (deux premiers mois) pour les patientes aux antécédents suivants:
-
•
tumeurs triple négatives et HER2-positives dans les trois à cinq premières années;
-
•
moins de 40 ans.
Les patientes âgées de plus de 75 ans ou à fort risque de COVID-19 grave, hors antécédents sus cités, se verront éventuellement proposer un suivi décalé de 6 mois au maximum.
En conclusion, les activités de dépistage et de diagnostic du cancer du sein peuvent et doivent reprendre à partir du 11 mai 2020, dans des conditions de sécurité pour les personnes et de hiérarchisation des priorités proposées dans ces recommandations avec une bonne coordination des acteurs et des activités, par les Agences Régionales de Santé et les Centres Régionaux de Dépistage des Cancers
Financements
Ce travail n’a pas fait l’objet de financement.
Déclaration de liens d’intérêts
LC déclare être coordonnateur et intervenant de FORCOMED. SD déclare que son institution a reçu des financements de recherche de General Electrics sans lien avec le présent travail. CB déclare que son institution a reçu des financements de recherche de General Electrics et Bracco sans lien avec le présent travail.
les autres auteurs déclarent ne pas avoir de liens d’intérêts.
Footnotes
Recommandations de la Société Française de Sénologie et Pathologie Mammaire, la Société Française de Radiologie, la Société Française d’Imagerie de la Femme, le Collège des Enseignants de Radiologie de France, FORCOMED et les Recommandations pour la Pratique Clinique de Nice-Saint Paul de Vence.
Références
- 1.Information coronavirus du gouvernement Français. [cité 27 avr 2020]. Disponible sur: https://www.gouvernement.fr/info-coronavirus.
- 2.Rapport d’évaluation du programme de dépistage de dépistage organisé du cancer du sein - Santé Publique France 2019. [cité 27 avr 2020]. Disponible sur: https://www.santepubliquefrance.fr/maladies-et-traumatismes/cancers/articles/evaluation-du-programme-de-depistage-du-cancer-du-sein.
- 3.Gligorov J., Bachelot T., Pierga J.-Y., Antoine E.-C., Balleyguier C., Barranger E. [COVID-19 and people followed for breast cancer: French guidelines for clinical practice of Nice-St Paul de Vence, in collaboration with the Collège Nationale des Gynécologues et Obstétriciens Français (CNGOF), the Société d’Imagerie de la Femme (SIFEM), the Société Française de Chirurgie Oncologique (SFCO), the Société Française de Sénologie et Pathologie Mammaire (SFSPM) and the French Breast Cancer Intergroup-UNICANCER (UCBG)] Bull Cancer. 2020 doi: 10.1016/j.bulcan.2020.03.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.2020. Recommandations de la direction Générale de la Santé « Prise en charge hors COVID ». [cité 27 avr 2020] https://solidarites-sante.gouv.fr/IMG/pdf/soins-hors-covid-19.pdf. [Google Scholar]
- 5.2020. Lignes directrices relatives à l’adaptation de l’organisation de l’offre de soins hospitalière dans l’attente et la préparation des mesures de déconfinement. [cité 27 avr 2020] https://solidarites-sante.gouv.fr/IMG/pdf/organisation_soins-hospitaliers_covid-19.pdf. [Google Scholar]
- 6.MacInnes E.G., Duffy S.W., Simpson J.A., Wallis M.G., Turnbull A.E., Wilkinson L.S. Radiological audit of interval breast cancers: Estimation of tumour growth rates. Breast. 2020;51:114–119. doi: 10.1016/j.breast.2020.03.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Houssami N., Hunter K. The epidemiology, radiology and biological characteristics of interval breast cancers in population mammography screening. NPJ Breast Cancer. 2017;3:12. doi: 10.1038/s41523-017-0014-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Riedl C.C., Luft N., Bernhart C., Weber M., Bernathova M., Tea M.-K.M. Triple-modality screening trial for familial breast cancer underlines the importance of magnetic resonance imaging and questions the role of mammography and ultrasound regardless of patient mutation status, age, and breast density. J Clin Oncol. 2015;33(10):1128–1135. doi: 10.1200/JCO.2014.56.8626. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Pilewskie M., Zabor E.C., Gilbert E., Stempel M., Petruolo O., Mangino D. Differences between screen-detected and interval breast cancers among BRCA mutation carriers. Breast Cancer Res Treat. 2019;175(1):141–148. doi: 10.1007/s10549-018-05123-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Sud A., Jones M.E., Broggio J., Loveday C., Torr B., Garrett A. Collateral damage: the impact on cancer outcomes of the COVID-19 pandemic. medRxiv (Preprint) 2020:2020. doi: 10.1016/j.annonc.2020.05.009. 04.21.20073833. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Otten J.D., van Schoor G., Peer P.G., den Heeten G.J., Holland R., Broeders M.J. Growth rate of invasive ductal carcinomas from a screened 50-74-year-old population. J Med Screen. 2018;25(1):40–46. doi: 10.1177/0969141316687791. [DOI] [PubMed] [Google Scholar]
- 12.Richards M.A., Westcombe A.M., Love S.B., Littlejohns P., Ramirez A.J. Influence of delay on survival in patients with breast cancer: a systematic review. Lancet. 1999;353(9159):1119–1126. doi: 10.1016/s0140-6736(99)02143-1. [DOI] [PubMed] [Google Scholar]
- 13.World Federation for Ultrasound in Medicine, Biology Safety Committee (Jacques S., Abramowicz, Iwaki Akiyama, David Evans J., Brian Fowlkes World Federation for Ultrasound in Medicine and Biology Position Statement: How to Perform a Safe Ultrasound Examination and Clean Equipment in the Context of COVID-19. Ultrasound Med Biol. 2020 doi: 10.1016/j.ultrasmedbio.2020.03.033. [In press] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Hirotsu Y., Maejima M., Nakajima M., Mochizuki H., Omata M. Environmental cleaning is effective for the eradication of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in contaminated hospital rooms: A patient from the Diamond Princess cruise ship. Infect Control Hosp Epidemiol. 2020:1–8. doi: 10.1017/ice.2020.144. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Cheng V.C.C., Wong S.-C., Chuang V.W.M., So S.Y.C., Chen J.H.K., Sridhar S. The role of community-wide wearing of face mask for control of coronavirus disease 2019 (COVID-19) epidemic due to SARS-CoV-2. J Infect [Internet]. 2020 doi: 10.1016/j.jinf.2020.04.024. [cité 27 avr 2020]; Disponible sur: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7177146/ [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Avis relatif aux conditions de désinfection des surfaces lors de la réalisation d’un scanner ou autres actes d’imagerie chez un patient COVID 19. Société Française d’Hygiène hospitalière (5 avril 2020) [cité 27 avr 2020]. Disponible sur: https://www.sf2 h.net/wp-content/uploads/2020/02/Avis-SF2H-05-avril-2020-D%C3 %A9sinfection-scanner-et-autres-appareils-dimagerie.pdf.
- 17.Giraud P., Monpetit E., Lisbona A., Chargari C., Marchesi V., Dieudonné A. [Covid-19 epidemic: guidelines issued by the French society of oncology radiotherapy (SFRO) for oncology radiotherapy professionals] Cancer Radiother. 2020 doi: 10.1016/j.canrad.2020.03.007. [In press] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Préconisations pour l’adaptation de l’offre de soins des établissements accueillant les patients atteints de cancer dans le contexte de l’épidemie de COVID-19 - INCa 2020. [cité 27 avr 2020]. Disponible sur: https://www.e-cancer.fr/Professionnels-de-sante/Coronavirus-COVID-19/Preconisations-pour-l-adaptation-de-l-offre-de-soins-des-etablissements-accueillant-les-patients-atteints-de-cancer.
- 19.Guan W.-J., Ni Z.-Y., Hu Y., Liang W.-H., Ou C.-Q., He J.-X. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020 doi: 10.1056/NEJMoa2002032. [In press] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Lescure F.-X., Bouadma L., Nguyen D., Parisey M., Wicky P.-H., Behillil S. Clinical and virological data of the first cases of COVID-19 in Europe: a case series. Lancet Infect Dis. 2020, march 27 doi: 10.1016/S1473-3099(20)30200-0. [In press] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054–1062. doi: 10.1016/S0140-6736(20)30566-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Haute Autorité de Santé; 2014. Dépistage du cancer du sein en France: identification des femmes à haut risque et modalités de dépistage. [cité 27 avr 2020]. https://www.has-sante.fr/jcms/c_1741170/fr/depistage-du-cancer-du-sein-en-france-identification-des-femmes-a-haut-risque-et-modalites-de-depistage. [Google Scholar]
- 23.Synthèse Femmes porteuses d’une mutation de BRCA1 ou BRCA2/Détection précoce du cancer du sein et des annexes et stratégies de réduction du risque. INCa. 2017 [cité 27 avr 2020] https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Synthese-Femmes-porteuses-d-une-mutation-de-BRCA1-ou-BRCA2-Detection-precoce-du-cancer-du-sein-et-des-annexes-et-strategies-de-reduction-du-risque. [Google Scholar]
- 24.Recommandations sur la prise en charge du cancer du sein infiltrant non métastatique. INCa. 2012 [cité 27 avr 2020]. http://affairesjuridiques.aphp.fr/textes/institut-national-du-cancer-inca-recommandations-sur-la-prise-en-charge-du-cancer-du-sein-infiltrant-non-metastatique-questions-dactualite-juillet-2012/ [Google Scholar]