Sr. Director:
Las manifestaciones renales más reconocidas de la actual pandemia COVID-19 son el fracaso renal agudo multifactorial, habitualmente prerrenal, asociado a los tratamientos utilizados en la enfermedad grave o a situaciones como la sepsis1, 2. Además, a medida que transcurre la infección aparece un estado procoagulante que aumenta el riesgo de eventos tromboembólicos. Los más referidos son los embolismos pulmonares y cerebrales. Exponemos el caso de un paciente con infarto renal.
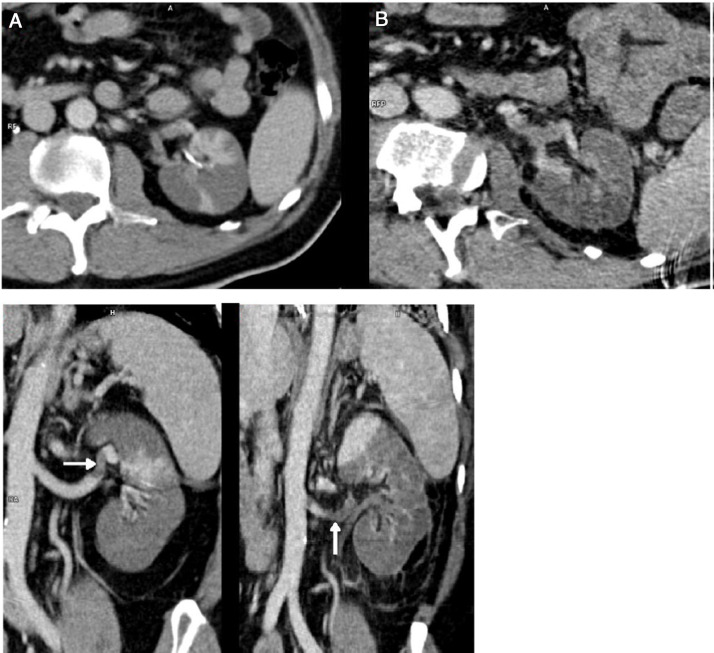
Varón de 56 años y origen peruano que ingresó desde urgencias el 31/03/2020 por intensa astenia con malestar general, fiebre termometrada de 38,5 °C, tos y diarrea de 5 días de evolución. Padecía diabetes mellitus tipo 2 bien controlada, dislipemia mixta de un año de evolución y diverticulosis no complicada. Seguía tratamiento con dapaglifozina/metformina, plantago ovata y dieta baja en grasas. A la exploración mostraba febrícula de 37,5 °C, normotensión, taquipnea moderada y escasos crepitantes bibasales. Talla de 174 cm, peso de 94 kg (IMC 31). Los principales datos analíticos se resumen en la tabla 1 . Radiografía de tórax con infiltrados alvéolo intersticiales bilaterales parcheados. Inició tratamiento con hidroxicloroquina, azitromicina, ceftriaxona, enoxaparina 0,5 mg/kg/día y soporte ventilatorio con gafas nasales a 2 lpm. A las 24 h se recibió el resultado positivo para SARS-CoV-2 mediante RT-PCR en exudado nasofaríngeo. La evolución fue desfavorable con mayor necesidad de oxígeno, fiebre continua y aumento de reactantes de fase aguda, por lo que al tercer día se iniciaron bolos de metilprednisolona i.v. 250 mg/día durante 3 días, continuando con 40 mg/día, y al cuarto día tocilizumab 600 mg i.v. en dosis única. Persistía el empeoramiento con progresión clínica, de laboratorio y radiológica (fig. 1 ). Al sexto día se aumentó la dosis de enoxaparina a 0,8 mg/kg/día. Se mantuvo estable hasta el noveno día en que volvió a empeorar. El décimo día empezó con dolor intenso en fosa iliaca izquierda, no irradiado, continuo, sin síndrome miccional acompañante. Se sospechó perforación intestinal en relación con el tratamiento antiinterleucina y se realizó TC abdominal con contraste intravenoso (fig. 2 ). Se identificó diverticulitis aguda y en riñón izquierdo, áreas hipodensas con morfología en cuña, hallazgos compatibles con extenso infarto renal, que asociaba trombosis de la arteria renal izquierda (flecha). La función renal solo mostró un leve deterioro (Crs: 0,9 a 1,1 mg/dL y FG estimado CKD EPI de mayor de 90 a 67 mL/min/1,73 m2) y el paciente, que 6 meses antes tenía una orina sin proteinuria ni hematuria y una microalbuminuria negativa, desarrolló microhematuria, proteinuria subnefrótica y microalbuminuria estadio A3. Ingresó en la unidad de cuidados intensivos, donde permanece a la hora de escribir este artículo. Ha precisado ventilación mecánica invasiva, tratamiento con noradrenalina y anticoagulación con heparina de bajo peso molecular. Diuresis espontánea mayor de 0,5 mL/kg/h y anticoagulación con enoxaparina. Desde el punto de vista respiratorio, mejora con lentitud.
Tabla 1.
Evolución analítica
| Valores/día | Ingreso | 2 | 3 | 4 | 5 | 6 | 8 | 10 | 11 | 12 | 13 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Leucocitos | 6,13 | 5,77 | 6,71 | 8,97 | 9,28 | 11,95 | 13,52 | 12,27 | 13,27 | 24,89 | 22,14 | 11,9 |
| Linfocitos | 400 | 600 | 400 | 500 | 300 | 400 | 300 | 300 | 200 | 600 | 100 | 700 |
| Hb | 16,5 | 14,6 | 15,9 | 14,9 | 14,9 | 14,4 | 16,5 | 15,5 | 15,2 | 16,5 | 15,6 | 12,4 |
| Plaquetas | 181 | 196 | 218 | 249 | 287 | 356 | 400 | 310 | 281 | 321 | 173 | 212 |
| Activ. PT | 82,3 | 78 | 76 | 73 | 81,9 | 79,9 | 71,2 | 79,4 | 75 | 65,8 | 78 | 99,6 |
| TPTA | 27,4 | 28,7 | 30 | 28,8 | 24,4 | 21 | 22 | 21,9 | 21,5 | 23,4 | 27,4 | 27,7 |
| Fibrinógeno | > 500 | > 500 | > 500 | > 500 | > 500 | 675 | 487 | 423 | 317 | 414 | 446 | > 500 |
| Creatinina | 1,17 | 1,01 | 1,14 | 1,01 | 1,04 | 0,94 | 0,91 | 0,90 | 1,17 | 0,95 | 1,08 | 0,97 |
| FGe CKD EPI | 69 | 83 | 72 | 83 | 80 | > 90 | > 90 | > 90 | 69 | 89 | 76 | 87 |
| Lactato | 2,47 | 2,06 | 3,49 | 2,44 | 3,09 | 1,62 | 1,68 | 0,99 | ||||
| CPK | 99 | 160 | 82 | 61 | 104 | 33 | 21 | |||||
| LDH | 245 | 248 | 311 | 405 | 418 | 450 | 552 | 698 | 1.718 | 461 | 1.975 | 773 |
| GPT (ALT) | 35 | 31 | 31 | 33 | 43 | 51 | 67 | 47 | 99 | 167 | 131 | 44 |
| GOT (AST) | 40 | 36 | 44 | 50 | 49 | 49 | 57 | 56 | 202 | 236 | 91 | 50 |
| PCR | 107,5 | 105 | 183 | 191 | 190 | 69 | 17 | 15 | 15 | 28 | 44 | 94 |
| Dímero D | 2.710 | 940 | 1.470 | 5.580 | 1.080 | 1.211 | 1.886 | 8.790 | 3.350 | |||
| Ferritina | 546 | 475 | 1.053 | |||||||||
| IL-6 | 99 | > 1.000 | ||||||||||
| Ac AFL | Negativos | |||||||||||
| SO | Microhem, PRT 100 mg/dL, leucocituria aislada | |||||||||||
| Orina espontánea: | MAu/Cru: 278 CPC: 1870 mg/gr Cr |
|||||||||||
| TT | AZT HCQ CEFT ENOX 0,5 mg/kg/d |
MPRN 250 × 3 | TOC | ENOX 1 mg/kg/12 h | MPRN 40 ANAK |
MEROP LINEZ |
ANK: anakinra; AZT: azitromicina; CEFT: ceftriaxona; CPC: cociente proteína creatinina en orina; ENOX: enoxaparina; HCQ: hidroxicloroquina; LINEZ: linezolid; Mau/Cru: microalbuminuria/creatinina en orina; MEROP: meropenem; MICROHEM: microhematuria; MPRN: metal prednisolona; PRT: proteinuria; TOC: tocilizumab.
Unidades: leucocitos *10E3/μL; linfocitos *10E3/μL; hemoglobina g/dL; plaquetas 10E3/μL; APTT (T. Cefalina) seg; activ protrombina (Activ PT) seg; fibrinógeno derivado mg/dL; creatinina mg/dl; lactato mmol/L; CPK U/L; LDH U/L; GPT (ALT) U/L; GOT (AST) U/L; filtrado glomerular estimado [CKD-EPI] ml/min/1,73 m2; proteína C reactiva (PCR) mg/L; dímero D mg/dL; ferritina mg/dL; interleucina 6 (IL-6) ng/mL; Ac SO: sistemático de orina, AFL: anticuerpos antifosfolípido (beta 2 glicoproteína 1 IgG UI/mL, beta 2 glicoproteína 1 IgM UI/mL, anticardiolipina IgG GPL/mL y anticardiolipina IgM MPL/mL).
Figura 1.
Rx tórax, evolución los días 1 (A), 2 (B), 3 (C), 6 (D), 9 (E) y 12 (F).
Figura 2.
TC abdominal días 10 (A) y 18 (B).
Los infartos renales son lesiones infrecuentes que pueden verse en diversas situaciones: tras hematoma intrarrenal3, disección de arteria renal en procedimientos instrumentales, dislipemias4, vasculitis ANCA PR3 positivas5, displasia fibromuscular, enfermedad aterosclerótica, enfermedades del tejido conectivo, cardiopatías embolizantes (fibrilación auricular, valvulopatías, aneurismas ventriculares, infartos, miocardiopatías dilatadas), idiopáticos6 y trombofilias como en la disfibrinogenemia7.
En diversas series8, 9 se reconocen como principales factores de riesgo: HTA, hábito tabáquico, fibrilación auricular, obesidad, enfermedad vascular periférica, evento tromboembólico previo, diabetes mellitus y terapia estroprogestínica. El tratamiento es controvertido entre la actitud conservadora con antiagregación y anticoagulación y la intervencionista con fibrinólisis y angioplastia.
El coronavirus puede infectar directamente las células endoteliales, plaquetas y megacariocitos al combinarse con su receptor CD1310, 11 induciendo daño plaquetario, endotelitis y apoptosis, que pone en marcha el reclutamiento de macrófagos y granulocitos que sintetizarán citoquinas proinflamatorias. Si la infección no se controla, la inflamación progresa, agrava el daño tisular y microvascular, estimula la vía extrínseca de la coagulación e inhibe la fibrinólisis, lo que podría desencadenar una coagulopatía por consumo agravada por la hipoxia que induciría agregación plaquetaria, síntesis de trombopoyetina, fibrinógeno, VEFG y trombina y descenso de factores anticoagulantes como la antitrombina III y el inhibidor del activador del plasminógeno12, 13, 14. El aumento del dímero D y la trombocitopenia serían el reflejo analítico de este mecanismo. El medio tromboinflamatorio y procoagulante propiciado12 desencadenaría eventos trombóticos en los distintos territorios afectados, 4,5% a nivel cerebral, 11,4% pulmonar y 20% de trombosis venosas profundas. Nuestro paciente mantuvo en todo momento estabilidad del filtrado glomerular y fue tratado mediante dosis anticoagulantes de enoxaparina. En nuestro conocimiento, se trata del segundo caso descrito de trombosis de arteria renal en este contexto15.
Bibliografía
- 1.Fanelli V., Fiorentino M., Cantaluppi V., Gesualdo L., Stallone J., Ronco C. Acute kidney injury in SARS-CoV-2 infected patients. Crit Care. 2020;24:155. doi: 10.1186/s13054-020-02872-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Richardson S., Hirsch J.S., Narasimhan M., Crawford J.M., McGinn T., Davidson K.W., The Northwell COVID-19 Research Consortium Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City Area. JAMA. 2020 doi: 10.1001/jama.2020.6775. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Park S., Lee G.H., Jin K., Park K.M., Kim Y.W., Park B.S. Renal infarction caused by isolated spontaneous renal artery intramural hematoma. Am J Case Rep. 2015;16:832–836. doi: 10.12659/AJCR.895285. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.El Barzouhi A., van Buren M., van Nieuwkoop C. Renal and splenic infarction in a patient with familial hypercholesterolemia and previous cerebral infarction. Am J Case Rep. 2018;19:1463–1466. doi: 10.12659/AJCR.911990. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Bottomley M.J., Gibson M., Alchi B. PR3 vasculitis presenting with symptomatic splenic and renal infarction: a case report and literature review. BMC Nephrol. 2019;20:84. doi: 10.1186/s12882-019-1266-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Eren Z., Koyuncu H. Renal infarction in a young man. Balkan Med J. 2019;36:290–291. doi: 10.4274/balkanmedj.galenos.2019.2019.1.73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Keinath K., Church T., Fogarty, Sadowski B., Perkins J. Acute renal artery infarction secondary to dysfibrinogenemia. BMJ Case Rep. 2017;2017 doi: 10.1136/bcr-2017-221375. bcr2017221375. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Mesiano P., Rollino C., Beltrame G., Ferro M., Quattrocchio G., Fenoglio R. Acute renal infarction: a single center experience. J Nephrol. 2017;30:103–107. doi: 10.1007/s40620-015-0259-0. [DOI] [PubMed] [Google Scholar]
- 9.Caravaca-Fontán F., Pampa Saico S., Elías Triviño S., Galeano Álvarez C., Gomis Couto A., Pecharromán de las Heras I. Acute renal infarction: Clinical characteristics and prognostic factors. Nefrologia. 2016;36:141–148. doi: 10.1016/j.nefro.2015.09.015. [DOI] [PubMed] [Google Scholar]
- 10.Han H., Yang L., Liu R., Liu F., Wu K.L., Li J. Prominent changes in blood coagulation of patients with SARS-CoV-2 infection. Clin Chem Lab Med. 2020 doi: 10.1515/cclm-2020-0188. [DOI] [PubMed] [Google Scholar]
- 11.Varga Z., Flammer A.J., Steiger P., Haberecker M., Andermatt R., Zinkernagel A.S. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395:1417–1418. doi: 10.1016/S0140-6736(20)30937-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Connors J.M., Levy J.H. Thromboinflammation and the hypercoagulability of COVID-19. J Thromb Haemost. 2020 doi: 10.1111/jth.14849. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Mei H., Hu Y. Characteristics causes, diagnosis and treatment of coagulation dysfunction in patients with COVID-19. Zhonghua Xue Ye Xue Za Zhi. 2020;41:E002. doi: 10.3760/cma.j.issn.0253-2727.2020.0002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Yin S., Huang M., Li D., Tang N. Difference of coagulation features between severe pneumonia induced by SARS-COV2 and non-SARS-CoV2. J Thromb Thrombolysis. 2020 doi: 10.1007/s11239-020-02105-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Lushina N., Kuo J.S., Shaikh H.A. Pulmonary, cerebral, and renal thromboembolic disease associated with COVID-19 infection radiology. 2020 doi: 10.1148/radiol.2020201623. [DOI] [PMC free article] [PubMed] [Google Scholar]