Abstract
Hintergrund
Im Rahmen der SARS-CoV-2 (Schweres Akutes Respiratorisches Syndrom Coronavirus 2) Pandemie wird dem Nachweis von virusspezifischen Antikörpern (AK) zunehmend eine wichtige Rolle eingeräumt. Potenziell können aus dem Vorhandensein oder Fehlen von solchen Antikörpern Überlegungen zu Infektion oder Immunität einer Person angestellt werden.
Fragestellung
Wie sicher kann von positiven bzw. negativen AK Testresultaten auf das tatsächliche Vorhandensein von SARS-CoV-2-spezifischen Antikörpern geschlossen werden?
Methodik
Darstellung der Wahrscheinlichkeit, mit der bei positiven bzw. negativen Testresultaten tatsächlich AK vorliegen bzw. nicht vorliegen, abhängig von der Vortestwahrscheinlichkeit (Prävalenz von SARS-CoV-2 Infektion) und der Testeigenschaften.
Ergebnisse
Sensitivität und Spezifität unterschiedlicher SARS-CoV-2 AK Testsysteme variieren zwischen 53% und 94% bzw. zwischen 91% und 99,5%. Bei Anwendung eines Tests mit hoher Testgüte liegt bei einer Vortestwahrscheinlichkeit von 1% bis 5%, wie sie derzeit für die allgemeine Bevölkerung in Österreich oder Deutschland angenommen werden kann, der positive prädiktive Wert (PPW) bei 42% bzw. 79%. Bei Personen mit einer erhöhten Vortestwahrscheinlichkeit von 20%, z.B. Personen aus Risikoberufen, liegt der PPW bei 95%. Bei einer Vortestwahrscheinlichkeit von 80% beträgt der PPW nahezu 100%. Der negative prädiktive Wert (NPW) beträgt mindestens 99,7% für Personen mit einer niedrigen Vortestwahrscheinlichkeit von bis zu 5% und 79% für Personen mit einer Vortestwahrscheinlichkeit von 80%. Bei Anwendung von Testsystemen mit geringerer Sensitivität und Spezifität nimmt die Aussagesicherheit beträchtlich ab. So liegt der PPW bei einer 1%iger Vortestwahrscheinlichkeit dann bei 6%.
Schlussfolgerungen
Eine ausreichend hohe Sensitivität und Spezifität sind Voraussetzung für eine Anwendung von AK Testsystemen. Bei geringer Vortestwahrscheinlichkeit sind positive Testresultate häufig falsch. Abhängig von der anzunehmenden Prävalenz für eine SARS-CoV-2 Infektion zeigen sich wesentliche Unterschiede in der Bedeutung eines konkreten Testresultats für die jeweils betroffenen Personen.
Schlüsselwörter: SARS-CoV-2, Antikörper, Positiver prädiktiver Wert, Negativer prädiktiver Wert, Vortestwahrscheinlichkeit
Abstract
Introduction
In the context of the severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) pandemic, the detection of virus-specific antibodies (AB) will play an increasing role. The presence or absence of such antibodies can potentially lead to considerations regarding immunity and infection.
Issue
How reliable are inferences from positive or negative test results regarding the actual presence of SARS-CoV-2 specific antibodies?
Methods
Calculation of the probability that, depending on the pretest probability (prevalence of SARS-CoV-2 infection) and test properties, antibodies are present or absent in the case of positive or negative test results.
Results
Sensitivity and specificity of different SARS-CoV-2 AB test systems vary between 53 % and 94 % and between 91 % and 99.5 %, respectively. When using a test with high test quality, the positive predictive value (PPV) is 42 % and 7 9%, respectively, with a pre-test probability of 1 % to 5 %, as can currently be assumed for the general population in Austria or Germany. For persons with an increased pre-test probability of 20 %, e. g. persons from high-risk professions, the PPW is 95 %, with a pre-test probability of 80 % the PPW is almost 100 %. The negative predictive value (NPV) is at least 99.7 % for persons with a low pre-test probability of up to 5 % and 79.1 % for persons with a pre-test probability of 80 %. When using test systems with lower sensitivity and specificity, the reliability of the results decreases considerably. The PPV is 5.9 % with a pre-test probability of 1 %.
Conclusions
A sufficiently high sensitivity and specificity are prerequisites for the application of antibody test systems. Positive test results are often false if the pre-test probability is low. Depending on the assumed prevalence of a SARS-CoV-2 infection, there are substantial differences in the significance of a concrete test result for the respective affected persons.
Keywords: SARS-CoV-2, Antibody, Positive predictive value, Negative predictive value, Pre-test probability
Hintergrund
Zur Feststellung einer akuten Infektion mit dem Severe Acute Respiratory Syndrome Coronavirus-2 (SARS-CoV-2) werden derzeit seitens der World Health Organisation (WHO) Polymerase-Kettenreaktion (PCR) Tests empfohlen [1]. Mit Hilfe dieser Tests erfolgt ein direkter Nachweis der Virus-Ribonukleinsäure (RNA). Im Gegensatz dazu werden bei Antikörper (AK) Tests virusspezifische Antikörper im Serum betroffener Personen nachgewiesen. Sind solche AK vorhanden, kann daraus geschlossen werden, dass die Person bereits mit dem Virus in Kontakt war [2].
Potenziell können aus dem Vorhandensein oder Fehlen von virusspezifischen AK auch Überlegungen zur Immunität oder Infektion einer Person angestellt werden [3]. AK Tests spielen auch in den Überlegungen zur Implementierung von zukünftigen Teststrategien und daraus abgeleiteten Maßnahmen im weiteren Verlauf der SARS-CoV-2 Pandemie eine Rolle. Maßnahmen, die auf falschen Annahmen hinsichtlich einer bestehenden Infektion oder Immunität beruhen, können zu falschem oder sorglosem Verhalten führen. Dies wiederum kann eine verstärkte Ausbreitung der Infektion und Gefährdung betroffener Personen zur Folge haben.
Ziel dieser Arbeit ist es daher, darzustellen, wie sicher, unter Berücksichtigung von Testeigenschaften und Vortestwahrscheinlichkeit, positive bzw. negative AK Testresultate auf das tatsächliche Vorhandensein oder Fehlen von SARS-CoV-2-spezifischen AK schließen lassen. Darüber hinaus soll diskutiert werden, welche Schlüsse aus den Testresultaten auch unter Berücksichtigung weiterer testunabhängiger Faktoren hinsichtlich einer potenzielle Immunität oder Infektion gezogen werden können.
Methoden
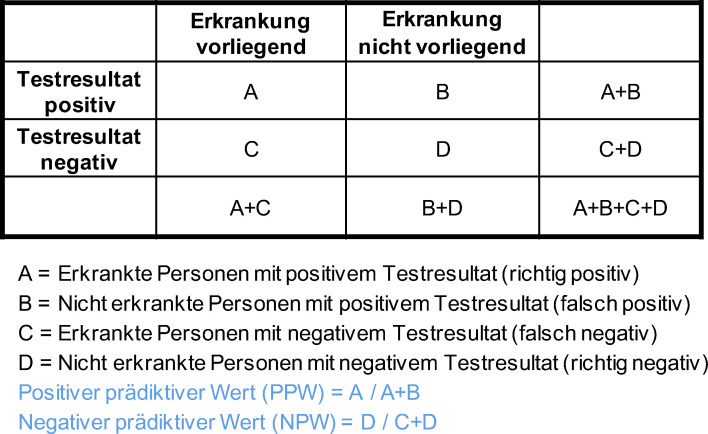
Da weitgehend alle zur Diagnose eingesetzten Tests nicht vollständig fehlerfrei funktionieren, ist auch bei der Testung auf Vorliegen von SARS-CoV-2 spezifischen AK damit zu rechnen, dass es einen Anteil von Personen gibt, der vom Test falsch klassifiziert wird. D.h. es wird Personen geben, bei denen keine AK vorliegen, die aber dennoch ein positives Testresultat erhalten (falsch positives Testresultat). Genauso wird es einen Anteil von Personen geben, bei denen trotz eines negativen Testresultats dennoch AK vorhanden sind (falsch negatives Testresultat). Eine Übersicht zu den möglichen Testergebnissen in Bezug auf das Vorliegen einer Erkrankung findet sich in Abbildung 1.
Abbildung 1.
Testeigenschaften, 4-Felder-Tafel.
Wie groß dieser jeweilig falsch klassifizierte Anteil an allen getesteten Personen ist, d.h. wie sicher ein positives oder negatives Testresultat ist, ist abhängig von der Sensitivität und Spezifität des jeweiligen Tests sowie von der gegebenen Vortestwahrscheinlichkeit.
Die Sensitivität berechnet sich aus dem Anteil der Personen mit positivem Testresultat an der Gesamtzahl der Personen, bei denen AK vorliegen. Sie gibt an wie gut der Test Personen mit SARS-CoV-2 spezifischen AK erkennt. Würde die Sensitivität 100% betragen, würde der Test alle Personen mit virusspezifischen AK erkennen und keine einzige Person mit virusspezifischen AK übersehen.
Die Spezifität berechnet sich aus dem Anteil der Personen mit negativem Testresultat an der Gesamtzahl der Personen, bei denen keine AK vorliegen. Sie gibt an wie gut der Test Personen, bei denen keine SARS-CoV-2 spezifischen AK vorliegen, erkennt. Würde die Spezifität 100% betragen, würden nur Personen, bei denen tatsächlich AK vorliegen, und keine einzige Person, bei der keine AK vorliegen, ein positives Testresultat erhalten.
Die Vortestwahrscheinlichkeit ist jene Wahrscheinlichkeit, mit der bereits vor Durchführung des Tests davon auszugehen ist, dass bei einer Person virusspezifische AK vorliegen. Sie entspricht der Häufigkeit, mit der in einer bestimmten Personengruppe mit einer (aktiven oder durchgemachten) SARS-CoV-2 Infektion zu rechnen ist. Die Vortestwahrscheinlichkeit ist z.B. bei Personen mit COVID-19 kompatiblen Symptomen, Aufenthalt in einer Region mit hoher Durchseuchung (jeweils aktuell oder in den letzten Wochen) und die ggf. in einem Risikoberuf tätig sind als höher anzunehmen als bei symptomlosen Personen im Homeoffice außerhalb eines Risikogebiets. Mit anderen Worten beschreibt die Vortestwahrscheinlichkeit das Risiko, dass bei einer bisher ungetesteten Person eine SARS-CoV-2 Infektion vorliegt bzw. bestand.
Über die Wahrscheinlichkeit, mit der bei einem positiven Testresultat davon ausgegangen werden kann, dass die gesuchte Erkrankung tatsächlich vorliegt, gibt der positive prädiktive Wert (PPW) Auskunft. Er berechnet sich aus dem Anteil der richtig positiven Testresultate an allen positiven Testresultaten (Abbildung 1).
Der negative prädiktive Wert (NPW) gibt darüber Auskunft, wie hoch die Wahrscheinlichkeit ist, dass eine Person mit einem negativen Testresultat tatsächlich nicht erkrankt ist. Der NPW berechnet sich aus dem Anteil der richtig negativen Testresultate an allen negativen Testresultaten (Abbildung 1 ).
Der PPW ist umso höher, je höher die Sensitivität und Spezifität und je höher die Prävalenz ist. Der NPW ist umso höher, je höher Sensitivität und Spezifität und je niedriger die Prävalenz ist.
Bei der Interpretation der Testresultate sind neben den angeführten Testeigenschaften auch weitere Faktoren wie z.B. der Testzeitpunkt im Verlauf einer Infektion zu berücksichtigen.
Resultate
Verschiedene Hersteller und Distributoren geben ihrerseits Sensitivitätswerte zwischen 80% und 100% und Spezifitätswerte zwischen 92,5% und 100% an [4], [5], [6], [7], [8], [9], [10]. Bei etablierten AK Tests zu anderen Virusinfekten (z.B. Epstein-Barr-Virus, Cytomegalie-Virus, Herpes-simplex-Viren) werden Werte für die Sensitivität von rund 86% bis 100% und für die Spezifität von rund 83% bis 100% angegeben [11]. In einer rezenten Untersuchung zu den Testeigenschaften von neun kommerziell erhältlichen SARS-CoV-2 AK Tests – sowohl Enzyme-linked Immunosorbent Assay (ELISA) als auch Point-of-Care-Testing (POC) konnten für die Sensitivität hingegen Werte von 67% bis 93% und für die Spezifität Werte von 80% bis 100% ermittelt werden [12]. Ein aktueller systematischer Review gibt für ELISA Testsysteme Sensitivitätswerte von 72,2% bis 94,4% und Spezifitätswerte von 96,7% bis 99,5% an. Für POC Testsysteme werden Werte von 52,8% bis 82,8% für die Sensitivität bzw. Werte von 91,4% bis 99,4% für die Spezifität angeführt [13].
Die Prävalenz von SARS-CoV-2 Infektionen in unterschiedlichen Personengruppen kann aus derzeit verfügbaren Daten nur abgeschätzt werden. Aus den Resultaten der aktuell vorliegenden Querschnittsstudien in Österreich kann abgeleitet werden, dass die Prävalenz von SARS-CoV-2 Infektionen in der allgemeinen Bevölkerung zum Zeitpunkt der Untersuchung (1. bis 4. April 2020) wahrscheinlich bei rund 1%, zumindest aber unter 5% liegt (abgesehen von Ausnahmen in Tirol) [14]. Eine zweite Prävalenzstudie, die Ende April 2020 durchgeführt wurde bestätigte diese niedrigen Werte [15]. Für Deutschland kann von einer ähnlichen Prävalenz ausgegangen werden. Diese Annahmen gelten auch für die Prävalenz aller bisher durchgemachten Infektionen, die für die Überlegungen zur Bedeutung der Testergebnisse zum Nachweis von IgG-AK relevant ist.
In der letzte Märzwoche betrug der Anteil positiv getesteter Personen an der Zahl aller getesteten Personen (jeweils PCR Test) in Österreich rund 20% [16]. Zu diesem Zeitpunkt erfolgte eine Testung anlassbezogen, d.h. bei Personen mit COVID-19 kompatiblen Symptomen, Personen mit Kontakt zu einem COVID-19 Fall, bei Personen aus Regionen mit vielen SARS-CoV-2 Infizierten (sogenannte Hotspots) oder bei Personen aus Risikoberufen. Diese Personengruppe würde dann einer Population mit erhöhter Prävalenz für eine SARS-CoV-2 Infektion entsprechen. Mitte April lag der Anteil der positiven Tests bei allen getesteten Proben bei rund 10%, wobei im Anteil der positiven Proben auch wiederholte Testungen von bereits bekannten COVID-19 Erkrankten inkludiert waren. Diese Proben wurden nach klinischer Heilung von COVID-19 Patienten entsprechend der behördlichen Definition einer Ausheilung von COVID-19 eingesandt.
In der Tabelle 1 werden der positive und negative prädiktive Wert von zwei AK Tests für jeweils unterschiedliche Vortestwahrscheinlichkeiten dargestellt. Grundlage waren die verfügbaren Angaben zu den Testeigenschaften im rezent publizierten systematischen Review [13]. Für die Berechnung wurde einerseits ein Testsystem (ELISA) mit den höchsten Sensitivitäts- und Spezifitätswerten (Best-Case: 93,5% bzw. 98,7%) und andererseits ein Testsystem (POC) mit den niedrigsten Sensitivitäts- und Spezifitätswerten (Worst-Case: 53,7% bzw. 91,4%) herangezogen.
Tabelle 1.
Positiver (PPW) und negativer prädiktiver Wert (NPW) in Abhängigkeit von Spezifität, Sensitivität und Vortestwahrscheinlichkeit.
| Testeigenschaften | Prävalenz | PPW | NPW |
|---|---|---|---|
| hohe Testgüte (ELISA): 93,5% Sensitivität / 98,7% Spezifität |
1% | 42,1% | 99,9% |
| 5% | 79,1% | 99,7% | |
| 20% | 94,7% | 98,4% | |
| 50% | 98,6% | 93,8% | |
| 80% | 99,7% | 79,1% | |
| geringe Testgüte (POC): 53,7% Sensitivität / 91,4% Spezifität |
1% | 5,9% | 99,5% |
| 5% | 24,7% | 97,4% | |
| 20% | 61,0% | 88,8% | |
| 50% | 86,2% | 66,4% | |
| 80% | 96,2% | 33,0% |
Best-Case
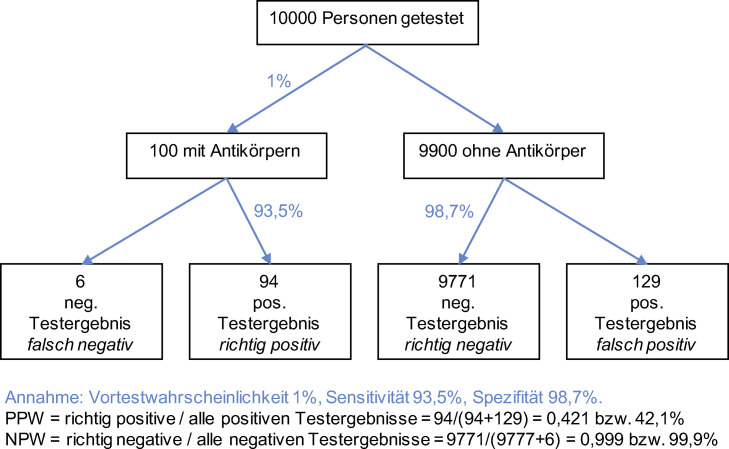
Bei einer Vortestwahrscheinlichkeit von 1% bis maximal 5%, dies entspricht der geschätzten aktuellen Prävalenz von SARS-CoV-2 Infektionen in der allgemeinen Bevölkerung in Österreich oder Deutschland, beträgt der PPW 42,1% bzw. 79,1%. Die Wahrscheinlichkeit, dass trotz des positiven Testresultats tatsächlich keine AK vorhanden sind, liegt demnach bei rund 58% bzw. 21%. Das heißt, dass bei einer Vortestwahrscheinlichkeit von 1% zumindest jede zweite positiv getestete Person ein falsch positives Testresultat erhält und somit AK angezeigt werden, obwohl tatsächlich keine vorhanden sind (Abbildung 2 ). Mit zunehmender Vortestwahrscheinlichkeit steigt die Wahrscheinlichkeit, dass bei einem positiven Testresultat tatsächlich AK vorhanden sind. Für jene Gruppe von Personen mit erhöhter Vortestwahrscheinlichkeit, angenommene Prävalenz einer SARS-CoV-2 Infektion 20%, beträgt der PPW 94,7%, bei einer Vortestwahrscheinlichkeit von 80% liegt er bei 99,7%.
Abbildung 2.
Bedeutung von Testresultaten für das Best-Case Szenario bei 1% Prävalenz.
Für eine Population mit niedriger Vortestwahrscheinlichkeit bis maximal 5%, beträgt der NPW zumindest 99,7%. Für eine Person, die ein negatives Testresultat erhält, beträgt daher die Wahrscheinlichkeit, dass tatsächlich keine AK vorliegen, nahezu 100%. Mit steigender Vortestwahrscheinlichkeit nimmt die Sicherheit eines negativen Testresultats ab. In der Gruppe von Personen mit erhöhter Vortestwahrscheinlichkeit, angenommene Prävalenz 20%, beträgt der NPW 98,4%. Bei einer Vortestwahrscheinlichkeit von 80% beträgt der NPW 79,1%.
Worst-Case
Bei einer Vortestwahrscheinlichkeit von 1% bis maximal 5%, beträgt der PPW in diesem Fall 5,9% bzw. 24,7%. Die Wahrscheinlichkeit, dass trotz des positiven Testresultats tatsächlich keine AK vorhanden sind, liegt demnach bei rund 94% bzw. 75%. Das heißt, dass bei einer Vortestwahrscheinlichkeit von 1% nahezu jede positiv getestete Person ein falsch positives Testresultat erhält. Bei Personen mit einer Vortestwahrscheinlichkeit von 20%, beträgt der PPW 61,0%, bei einer Vortestwahrscheinlichkeit von 80% liegt er bei 96,2%.
Der NPW beträgt bei niedriger Vortestwahrscheinlichkeit bis maximal 5%, zumindest 97,4%. Bei höherer Vortestwahrscheinlichkeit, angenommene Prävalenz 20%, beträgt der NPW 88,8%. Bei einer Vortestwahrscheinlichkeit von 80% beträgt der NPW nur noch 33,0%.
Alle angeführten Ergebnisse zu den PPW und NPW gelten nur unter der Voraussetzung, dass die verfügbaren Angaben zur Sensitivität und Spezifität korrekt sind.
Diskussion
Für die Bevölkerungen in Österreich und Deutschland sind derzeit geringe Prävalenzen von aktuellen oder durchgemachten SARS-CoV-2 Infektionen anzunehmen. Daher ist bei einer Testung von Personen, bei denen keine Hinweise auf eine Infektion und keine Risikofaktoren (enger Kontakt mit infizierten Personen, Aufenthalt in einem Risikogebiet, Risikoberuf) vorliegen, mit einer hohen Zahl an falsch positiven Ergebnissen zu rechnen. Bei einer Vortestwahrscheinlichkeit von 1% und einem positiven Ergebnis eines AK Tests beträgt die Wahrscheinlichkeit, dass tatsächlich AK vorliegen, abhängig vom eingesetzten Testsystem zwischen 6% bis maximal 42%. Bei Personen mit hoher Vortestwahrscheinlichkeit ist die Aussagekraft mit einem geringeren potenziellen Fehler behaftet.
Die Bedeutung eines positiven Testresultats für eine symptomlose Person, die sich nicht in einer Region mit hoher Durchseuchung aufhält (und für die beides auch in der Vergangenheit nicht der Fall war) und die auch nicht der Gruppe der Risikoberufe angehört, unterscheidet sich somit deutlich von der Bedeutung eines ebenfalls positiven Testresultats für eine Person mit COVID-19 kompatiblen Symptomen in einem Risikogebiet (jeweils aktuell und in der näheren Vergangenheit) und/oder Tätigkeit in einem Risikoberuf.
Negative Testresultate sind bei Personen mit geringer Vortestwahrscheinlichkeit weitgehend verlässlich. Sie bringen aber keine wesentliche zusätzliche Sicherheit, da die Wahrscheinlichkeit, dass keine SARS-CoV-2 Infektion vorliegt, schon vor Durchführung des Tests hoch ist.
Das Fehlen von SARS-CoV-2 spezifischen AK kann unterschiedliche Ursachen haben. Die AK können fehlen, weil tatsächlich keine Infektion stattgefunden hat oder weil zwar eine Infektion vorliegt, diese jedoch noch nicht lange genug besteht. Die Bildung von AK benötigt Zeit, deshalb sind sie in der Frühphase der Infektion noch nicht nachweisbar. Entsprechend einer Untersuchung erfolgt die Serokonversion bei 50% der Infizierten innerhalb der ersten 7 Tage. Erst nach 14 Tagen kann bei allen mit SARS-CoV-2 infizierten Personen mit dem AK Nachweis gerechnet werden [17]. Bei der SARS-CoV Infektion, die in den Jahren 2002/2003 auftrat, konnten bei infizierten Personen nach etwa 3 bis 6 Tagen IgM-AK und nach 8 Tagen IgG-AK nachgewiesen werden [18], [19]. Da SARS-CoV-2 zur gleichen Viren-Familie gehört und Genomstudien gezeigt haben, dass SARS-CoV-2 zu etwa 80% mit SARS-CoV identisch ist, kann davon ausgegangen werden, dass der Prozess der Antikörperbildung ähnlich verläuft. Eine aktuelle Untersuchung zum AK Profil von 34 an COVID-19 erkrankten Personen in China bestätigt diese Annahme [20]. Aus einem negativen AK Test bzw. dem Fehlen von AK kann somit nicht sicher auf eine nicht vorhandene Infektion geschlossen werden. Der alleinige Einsatz von AK Testsystemen zum Nachweis einer Infektion würde daher einer Fehlverwendung gleichkommen [21].
Die Beurteilung der Bedeutung von Testergebnissen für eine konkrete Person wird auch dadurch limitiert, dass eine ausreichende Datengrundlage zur Einschätzung der Vortestwahrscheinlichkeit fehlt. Dies ist aber für die Einschätzung des Ausmaßes einer potenziellen Fehlannahme essenziell. Zu bedenken ist auch, dass sich die Prävalenz einer SARS-CoV-2 Infektion und damit die Vortestwahrscheinlichkeit mit Fortschreiten der Pandemie ändern wird. Die zukünftig zu erwartende Zunahme bedingt, dass jeweils die für den Testzeitpunkt bestehende Prävalenz Grundlage der Beurteilung sein muss.
Ob selbst bei vorhandenen SARS-CoV-2 spezifischen AK auch eine Immunität besteht, gilt derzeit als nicht gesichert [22]. Ergebnissen von Tierversuchen sowie Erkenntnissen zu SARS-CoV geben jedoch Hinweise darauf, dass genesene Personen nur ein sehr geringes Reinfektionsrisiko haben. Beobachtungen von bisherigen Coronaviren-Infektionen deuten darauf hin, dass bis zu drei Jahre nach Erstinfektion eine Immunität bestehen könnte [23], [24].
In wie weit das Ausmaß einer potenziellen Fehlannahme akzeptabel ist, hängt vom Kontext der Fragestellung ab. Die fehlerhafte Annahme einer Immunität bei Angehörigen von Pflege- oder Medizinberufen kann schwerwiegende Auswirkungen haben. Für epidemiologische Fragestellungen kann der Fehler aber möglicherweise hingenommen oder in Modellen berücksichtigt werden. Gezielte Testungen ausgewählter Personengruppen mit vermutlich sehr hoher Vortestwahrscheinlichkeit könnten, eingebettet in strukturierte Prozesse mit nachfolgenden Handlungsanleitungen, sinnvoll sein.
Die verfügbaren Angaben zu den Testeigenschaften können nicht als gesichert angenommen werden. So basieren die aktuell vorhandenen Test-Evaluierungen vorwiegend auf Fall-Kontroll-Studien und weisen somit ein erhöhtes Verzerrungspotenzial auf. Zudem zeigen unabhängige Publikationen geringere Werte für Sensitivität und Spezifität als die von den Herstellern bzw. Distributoren angegebenen. Wie die Berechnungen zu PPW und NPW zeigen, ist jedoch eine ausreichend hohe Testgüte Voraussetzung für einen sinnhaften Einsatz von AK Testsystemen.
Dementsprechend sind qualitativ hochwertige Evaluierungsstudien der vorhandenen AK Testsysteme erforderlich. Ebenso werden weitere Studien zur Prävalenz einer SARS-CoV-2 Infektion in unterschiedlichen Populationen benötigt.
Eine unkontrollierte Anwendung von AK Tests zum aktuellen Zeitpunkt kann zu unerwünschten nachteiligen Effekten führen, wenn aus den Testresultaten falsche Schlussfolgerungen und daraus abgeleitete Handlungen resultieren. Personen, bei denen fälschlicherweise eine Immunität angenommen wird, können z.B. aus einem falschen Sicherheitsgefühl wieder vermehrt Kontakte aufweisen oder die Hygieneregeln weniger beachten. Das kann in Folge zu einer Gefährdung anderer und der eigenen Person führen und die Verbreitung von COVID-19 wieder erhöhen. Ebenso kann z.B. der fälschliche Ausschluss einer akuten Infektion bei Personen im Pflegeberufen zu weitreichenden negativen Konsequenzen führen. Anwendungen von AK Tests sind daher nur im Rahmen von organisierten, strukturierten Testprogrammen zu spezifischen Fragestellungen mit begleitender Evaluation der Daten zu empfehlen.
Schlussfolgerungen
Ausreichend hohe Sensitivität und Spezifität sind unabdingbare Voraussetzung für eine Anwendung von AK Testsystemen.
Auch bei nahezu idealen Testeigenschaften sind bei geringer Vortestwahrscheinlichkeit (wie sie bei der Testung von Personen ohne Symptome und Risikofaktoren für eine SARS-CoV-2 Infektion besteht) positive Testresultate häufig falsch.
Abhängig von der anzunehmenden Prävalenz für eine SARS-CoV-2 Infektion zeigen sich wesentliche Unterschiede in der Bedeutung eines konkreten Testresultats für die jeweils betroffenen Personen.
Zum Nachweis bzw. Ausschluss einer Infektion sind AK Tests alleine nicht geeignet.
Von einem positiven Testresultat kann nicht sicher auf das Vorliegen von AK und damit auf eine potenzielle Immunität geschlossen werden.
Interessenkonflikt
Die Autorin und die Autoren erklären, dass keine Interessenskonflikte bestehen. Die Durchführung der Studie erfolgte ohne finanzielle Unterstützung von Förderinstitutionen des öffentlichen, kommerziellen oder gemeinnützigen Bereichs.
Autorenschaft
KH: Konzeptionierung und Gestaltung des Artikels, Entwurf und Revision des Artikels
TS: Revision des Artikels, Mitarbeit bei der Konzeptionierung, Informationsbeschaffung
KJ: Revision des Artikels, Mitarbeit bei der Konzeptionierung, Informationsbeschaffung
RK: Revision des Artikels, Informationsbeschaffung
AS: Revision des Artikels, Mitarbeit bei der Konzeptionierung
Die Autorin und die Autoren erklären, dass keine Interessenskonflikte bestehen.
Die Durchführung der Studie erfolgte ohne finanzielle Unterstützung von Förderinstitutionen des öffentlichen, kommerziellen oder gemeinnützigen Bereichs.
Literatur
- 1.World Health Organisation (WHO). WHO Laboratory testing for coronavirus disease (COVID-19) in suspected human cases https://www.who.int/publications-detail/laboratory-testing-for-2019-novel-coronavirus-in-suspected-human-cases-20200117, 2020.(accessed 15.04.2020).
- 2.Murin C.D., Wilson I.A., Ward A.B. Antibody responses to viral infections: a structural perspective across three different enveloped viruses. Nat Microbiol. 2019;4(5):734–747. doi: 10.1038/s41564-019-0392-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Racine R., Winslow G.M. IgM in microbial infections: taken for granted? Immunol Lett. 2009;125(2):79–85. doi: 10.1016/j.imlet.2009.06.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Wang A., Yang S. Distributor: technomed GmbH. Clinical Data for Sample correlation Study in house https://technomed.at/rest/DO/Default.GetMediaStreamDOKUMENT(pi_DO_NR = ’139057’) 2020 (accessed 16.04.2020) [Google Scholar]
- 5.Hersteller: InTec PRODUCTS INC, Distributor: NanoRepro AG. SARS-CoV-2 Antikörper-Schnelltest (IgM/IgG). Rev. 03 https://www.nanorepro.com/media/pdf/Coronavirus_Schnelltest_PB_DE.pdf, 2020.(accessed 16.04.2020).
- 6.Hersteller: Beijing Wantai Biological Pharmacy Enterprise Co., Distributor: Szabo-Scandic HandelsgmbH. WANTAI SARS-CoV-2 Ab Rapid Test. Rapid Test for Detection of Total Antibodies to SARS-CoV-2. IFU VER: 20/01 https://www.szabo-scandic.com/shop/media/product_data/datasheet/WAN/WAN-DATA-WANWJ-2750.pdf, 2020.(accessed 16.04.2020).
- 7.Hersteller: Beijing Wantai Biological Pharmacy Enterprise Co., Distributor: Szabo-Scandic HandelsgmbH. WANTAI SARS-CoV-2 Ab ELISA. Diagnostic Kit for Total Antibody to SARS-CoV-2 (ELISA). V. 2020-01 https://www.szabo-scandic.com/shop/media/product_data/datasheet/WAN/WAN-DATA-WANWS-1096.pdf, 2020 (accessed 16.04.2020).
- 8.Hersteller: Beijing Wantai Biological Pharmacy Enterprise Co., Distributor: Szabo-Scandic HandelsgmbH. WANTAI SARS-CoV-2 IgM ELISA. Diagnostic Kit for IgM Antibody to SARS-CoV-2 (ELISA). V. 2020-01 https://www.szabo-scandic.com/shop/media/product_data/datasheet/WAN/WAN-DATA-WANWS-1196.pdf, 2020.(accessed 16.04.2020).
- 9.EUROIMMUN Medizinische Labordiagnostika AG. Anti-SARS-CoV-2-ELISA (IgA). Testanleitung. https://www.coronavirus-diagnostics.com/antibody-detection-tests-for-covid-19.html (Zusendung auf Anfrage), 2020 (accessed 17.04.2020).
- 10.EUROIMMUN Medizinische Labordiagnostika AG. Anti-SARS-CoV-2-ELISA (IgG). Testanleitung. https://www.coronavirus-diagnostics.com/antibody-detection-tests-for-covid-19.html (Zusendung auf Anfrage), 2020.(accessed 17.04.2020).
- 11.VIDIA Ltd. Product Catalogue http://www.vidia.cz/uk/images/katalog/Catalogue_2019_ENG_web.pdf, 2019 (accessed 21.04.2020).
- 12.Lassaunière R., Frische A., Harboe Z.B., Nielsen A.C.Y., Fomsgaard A., Krogfelt K.A. Evaluation of nine commercial SARS-CoV-2 immunoassays. medRxiv. 2020 doi: 10.1101/2020.04.09.20056325. [DOI] [Google Scholar]
- 13.Kontou P.I., Braliou G.G., Dimou N.L., Nikolopoulos G., Bagos P.G. Antibody tests in detecting SARS-CoV-2 infection: a meta-analysis. medRxiv. 2020 doi: 10.1101/2020.04.22.20074914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Ogris G, Hofinger C. COVID-19 Prevalence https://www.sora.at/uploads/media/Austria_COVID-19_Prevalence_BMBWF_SORA_20200410_EN_Version.pdf, 2020.(accessed 21.04.2020).
- 15.Statistik Austria. COVID-19 Prävalenz http://www.statistik.at/wcm/idc/idcplg?IdcService = GET_PDF_FILE&dDocName = 123050, 2020.(accessed 06.05.2020).
- 16.Österreichischer Rundfunk (ORF). Coronavirus in Österreich: Daten und Karten https://orf.at/corona/stories/3157533/, 2020 (accessed 21.04.2020).
- 17.Wolfel R., Corman V.M., Guggemos W., Seilmaier M., Zange S., Muller M.A. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020 doi: 10.1038/s41586-020-2196-x. [DOI] [PubMed] [Google Scholar]
- 18.Lee H.K., Lee B.H., Seok S.H., Baek M.W., Lee H.Y., Kim D.J. Production of specific antibodies against SARS-coronavirus nucleocapsid protein without cross reactivity with human coronaviruses 229E and OC43. J Vet Sci. 2010;11(2):165–167. doi: 10.4142/jvs.2010.11.2.165. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Wan Z.Y., Zhang X., Yan X.G. IFA in testing specific antibody of SARS coronavirus. South China Journal of Preventive Medicine. 2003;29(3):36–37. [Google Scholar]
- 20.Xiao D.A.T., Gao D.C., Zhang D.S. Profile of Specific Antibodies to SARS-CoV-2: The First Report. J Infect. 2020 doi: 10.1016/j.jinf.2020.03.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Abbasi J. The Promise and Peril of Antibody Testing for COVID-19. JAMA. 2020 doi: 10.1001/jama.2020.6170. [DOI] [PubMed] [Google Scholar]
- 22.World Health Organisation (WHO). “Immunity passports” in the context of COVID-19 https://apps.who.int/iris/rest/bitstreams/1275788/retrieve, 2020.(accessed 06.05.2020).
- 23.Flodgren G.M. Immunity after SARS-CoV-2 infection. Rapid review 2020. Oslo: Norwegian Institute of Public Health; 2020 [Google Scholar]
- 24.Robert Koch Institut (RKI). COVID-19 (Coronavirus SARS-CoV-2) https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/nCoV.html, 2020.(accessed 21.04.2020).