Resumen
Objetivo
El propósito de este estudio es investigar la evidencia científica sobre el efecto del ejercicio físico respecto al estado cognitivo y conductual como medida preventiva y terapéutica no farmacológica en la enfermedad de Alzheimer (EA).
Diseño
Revisión sistemática Fuentes de datos: Pubmed, Science Direct, Medline y Scopus, con las palabras clave: Alzheimer, Exercise, Neuroimaging, MRI, PET y Physical Activity. Selección de artículos: Se incluyeron aquellos estudios en los que se evaluaba el efecto del ejercicio físico en la evolución de la EA y que además contenían pruebas de imagen (resonancia magnética nuclear o tomografía por emisión de positrones) con marcador Pittsburg Compound B (PiB) analizando la atrofia cerebral o el aumento del depósito de beta-Amiloide respectivamente. Se excluyeron aquellos estudios en otros tipos de demencia que no fueran la EA, los que no incluían pruebas de neuroimagen, los casos únicos y aquellos de lengua no inglesa. Para la extracción de datos se utilizó la escala de calidad PRISMA para la lectura crítica de los estudios. Los investigadores evaluaron de forma independiente los artículos y las discrepancias se resolvieron por consenso.
Resultados
Se identificaron 75 artículos, de los cuales 23 fueron finalmente incluidos en la revisión.
Concusiones
La mayoría de los estudios incluidos no permiten conocer la repercusión del ejercicio físico a nivel cognitivo y sobre los cambios estructurales y funcionales cerebrales en pacientes con riesgo de desarrollar la EA o en pacientes que ya presentan la enfermedad. Sin poder descartase un posible efecto beneficioso, son necesarios más estudios con un mejor diseño y rigor metodológico que permitan un mejor conocimiento de esta asociación.
Palabras clave: Alzheimer, Ejercicio, Neuroimagen, Resonancia magnética nuclear, Tomografía por emisión de positrones y actividad física
Abstract
Objective
The objective of this review is to analyze through a the scientific evidence about the effects of physical activity in patients with Alzheimer's disease (AD) as a preventive and non-pharmacological treatment.
Design
Systematic review. Data sources: We have identified articles from Pubmed, Science Direct, Medline and Scopus databases, with the keywords Alzheimer, Exercise, Neuroimaging, MRI, PET y Physical Activity. Selected articles: We included those studies that evaluated the effects of physical activity on Alzheimer's disease and those which also included magnetic resonance imaging or positron emission tomography with Pittsburg Compound B marker (PiB) analyzing brain atrophy or increase of the beta-amyloid deposit respectively. We excluded studies including other types of dementia, different of AD. We also excluded articles which not included neuroimaging tests, single cases or non-English language articles. Data extraction: The PRISMA quality scale was used for the critical lecture of the studies. The researchers independently assessed the articles and the discrepancies were resolved by consensus.
Results
We identified 75 articles, of which 23 were finally included in the review.
Conclusions
Most of the studies included do not allow us to know the impact of physical exercise on cognition and the cerebral structural-functional changes in patients at risk of developing AD or in patients who already have the disease. Without being able to rule out a possible beneficial effect, more studies are needed with a better design and methodological rigor that allows a better known about this association.
Keywords: Alzheimer, Exercise, Neuroimaging, Magnetic resonance imaging, Positron emission tomography and physical activity
En el mundo existen aproximadamente 50 millones de personas que padecen demencia, registrándose cerca de 10 millones de casos nuevos cada año; el 60-70% de estos casos lo constituyen pacientes con enfermedad de Alzheimer (EA)1. La edad constituye el principal factor de riesgo para la EA al aumentar su incidencia con el paso de los años2, tiene más peso incluso que la portación del alelo apolipoproteína E4 (APOE4) y que la historia familiar3. Debido al envejecimiento de la población, la prevalencia de esta enfermedad se enfrenta a un crecimiento exponencial4, y se prevé que el número total de personas con demencia aumente de 82 millones en 2030 a 152 millones en 20501, considerándose la EA por su carácter irreversible5 un problema social y de gran impacto en los sistemas sanitarios de todo el mundo4, 6, 7. Al no existir un tratamiento curativo8, numerosas publicaciones han considerado el ejercicio físico como una herramienta alternativa, no farmacológica, beneficiosa en la evolución y prevención de la EA9.
Existen estudios que demuestran los efectos beneficiosos del ejercicio físico sobre la función cerebral, ya que puede disminuir el riesgo de deterioro cognitivo y retrasar el inicio de la demencia10. Fortaleciendo esta hipótesis, hay estudios que han demostrado que las personas que no realizan ejercicio físico incrementan notablemente el riesgo de deterioro cognitivo11. Por tanto, el ejercicio físico se propone como una medida de fácil acceso, bajo coste y pocos efectos secundarios12, 13; además no sería necesario realizar un ejercicio físico excesivo para obtener beneficios14. La práctica de ejercicio físico suele disminuir con la edad13, por lo que en el periodo en el que hay un mayor riesgo de sufrir la EA la realización de actividad física (AF) suele ser menor9. También es importante recomendar que se comience a hacer ejercicio desde una edad temprana en aquellas personas con factores de riesgo de padecer la EA15, pues algunos estudios establecen que con el inicio de la enfermedad aparecen limitaciones a la hora de realizar deporte11, 16.
Por otro lado, la EA es una enfermedad epigenética17, en la que la presencia del alelo 4 de la APOE4) del cromosoma 19 aumenta el riesgo de padecerla15, 17, 18; aunque hay que destacar que su presencia no es un criterio necesario ni suficiente para que se produzca su desarrollo15, 18. Algunos estudios en pacientes con carga genética de riesgo han demostrado que la AF puede no ser suficiente para impedir la aparición de la enfermedad17. Aparte de la influencia genética, hay que tener en cuenta los factores del estilo de vida, que al ser rectificables, actuando sobre ellos, podríamos conseguir efectos positivos en la evolución de la enfermedad, de ahí el reciente interés de describir la repercusión del ejercicio físico sobre la EA9.
Entre los mecanismos fisiológicos estudiados, la AF reduce el riesgo de EA al presentar un papel neuroprotector y proporcionar una mayor supervivencia neuronal17. Promueve una mayor angiogénesis y neurogénesis, disminuye la inflamación y de forma muy significativa reduce los factores de riesgo cerebrovasculares5, 10, 16, 18, 19, 20. Con relación a este último efecto hay que recordar que las enfermedades vasculares están íntimamente ligadas con la EA por lo tanto es importante su prevención y control9.
Otros estudios han demostrado que el ejercicio físico puede llevar a cambios en la estructura y función cerebral. En esta línea, algunos estudios que utilizan resonancia magnética nuclear (RMN) para la cuantificación de la atrofia o medición del volumen cerebral, constatan que la AF se relaciona con un volumen mayor del área hipocampal, proporcionando una mayor reserva cerebral capaz de aminorar el deterioro cognitivo2, 13, 16.
Además algunos estudios sostienen que el ejercicio físico disminuye la fosforilación de la proteína Tau y la producción de proteína beta-amiloide (Aβ)5, 10, 16, 18, 19, 20; esta última aparece depositada en mayor cuantía en la corteza cerebral de los pacientes con EA con respecto a la población general21, 22, 23, 24, incluso de forma preclínica23. Por ello algunos estudios hacen una valoración objetiva sobre el efecto de la AF y el grado de depósito de Aβ mediante pruebas de imagen como la tomografía por emisión de positrones (PET) junto al radiotrazador B de Pittsburgh marcado con carbono 11 (PiB), defendiendo que la AF es capaz de reducir el depósito de esta proteína teniendo un efecto directo sobre la fisiopatología de la enfermedad5, 10, 16, 18, 19, 20. Mediante PET también podremos estimar de forma objetiva el metabolismo de la glucosa a nivel cerebral, usando el radiotrazador 18-fluorodesoxiglucosa como se realizó en el estudio de Okonkwo et al.3.
El objetivo de esta revisión bibliográfica es encontrar la evidencia científica del impacto de la AF a nivel cerebral mediante test cognitivos y pruebas de neuroimagen como tratamiento no farmacológico en la EA5.
Material y métodos
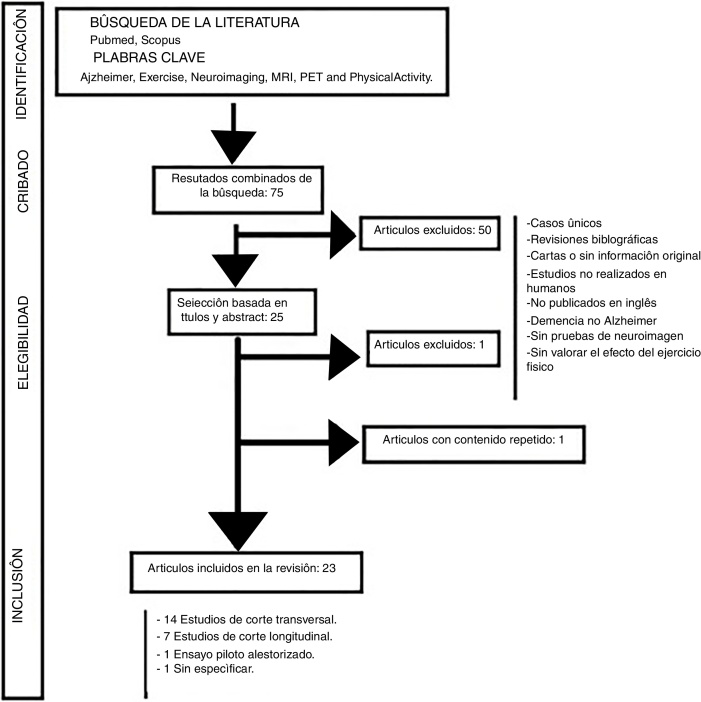
Se realizó una revisión sistemática mediante una búsqueda avanzada en las bases de datos The Cochrane Library Plus, Medline, Science Direct y Scopus, usando los descriptores MeSH: Alzheimer, Physical Activity, Exercise, Neuroimaging, MRI, PET y los operadores boleanos AND y OR. No se acotó por periodo cronológico y la búsqueda se complementó con una búsqueda manual de referencias bibliográficas de los documentos encontrados con el fin de localizar estudios no identificados con la búsqueda electrónica. La selección de los artículos se realizó a partir de la revisión de sus títulos y resúmenes. Además de una revisión crítica de cada resumen, se hizo una evaluación del texto completo en el caso de los trabajos cuyo resumen no fuera concluyente. Las publicaciones seleccionadas se examinaron detalladamente para su lectura crítica y se utilizó la escala PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses), mediante la lista de comprobación de 27 ítems, tratando de seguir las recomendaciones en cada fase del proceso25, 26. La evaluación de la elegibilidad de los estudios fue realizada por 2 revisores de manera independiente, estandarizada y no cegada. En caso de existir desacuerdo entre los revisores se resolvió mediante consenso. Se aplicaron los siguientes criterios de inclusión y exclusión: Se incluyeron aquellos estudios en los que se evaluaba el efecto del ejercicio físico sobre la EA y que además incluían pruebas de imagen mediante RMN, para evaluar el volumen cerebral, el PET-PiB, para analizar el depósito de Aβ cerebral, o la PET utilizando el radiotrazador 18-fluorodesoxiglucosa para valorar el metabolismo cerebral de la glucosa. Se excluyeron los estudios de casos únicos, las revisiones bibliográficas, las cartas u otros artículos que no contuvieran información original; así como los estudios no realizados en humanos y los publicados en un idioma diferente al inglés obteniéndose un total de 75 artículos. A continuación, se descartaron los estudios de otros tipos de demencia que no fueran la EA, los que no incluían pruebas de neuroimagen y los que no consideraban el efecto del ejercicio físico en la prevención o en la evolución de la ya instaurada EA, obteniendo 23 artículos que cumplían los criterios expuestos previamente tras una lectura completa. La figura 1 muestra el diagrama de flujo seguido para la identificación de los artículos relevantes para el trabajo, con especificación de los que fueron excluidos por no estar relacionados con el objetivo del trabajo, por estar duplicados, por no tener acceso al texto completo o por no cumplir los criterios de inclusión establecidos.
Figura 1.
Se muestra el flujograma de la estrategia de búsqueda.
Resultados
Los resultados obtenidos se resumen en la tabla 1, donde se incluyen los autores de cada estudio y su año de publicación, ordenados cronológicamente, también se indica el tamaño de la muestra, el tipo de estudio, los tipos de participantes que forman el grupo control (si lo hay), la presencia o no de APOE 4 o la historia familiar de EA, el tipo de ejercicio físico y la forma de medirlo, las pruebas de imagen empleadas y, finalmente, las conclusiones a las que llegaban los diferentes estudios. Ocho estudios presentaban una muestra formada exclusivamente por personas cognitivamente sanas con factores de riesgo para presentar EA. De aquellos que valoraban el depósito de PiB, 2 estudios demostraron que la AF se asociaba de forma significativa a un menor depósito de Aβ3, 19 mientras que el estudio de Schultz et al. no demostró una asociación significativa entre la AF y la carga de Aβ20. En la relación entre la AF y el volumen cerebral mediante RMN, 4 estudios no registraron resultados significativos13, 15, 21, 23 y 3 sí objetivaron resultados positivos con respecto al volumen cerebral en la zona temporal (Hashimoto et al.2 y Okonkwo et al.3 y finalmente el estudio de Boots et al. respecto a la sustancia blanca total27).
Tabla 1.
Estudios que evalúan el efecto de la AF sobre la EA mediante neuroimagen
| Autores y año de publicación | Diseño del estudio | Edad Media/rango (años) |
Factores de riesgo APOE4 o HF (N.o personas) |
Tipo de ejercicio | Medición del ejercicio | Pruebas complementarias | Resultados pruebas de imagen | Resultados test neurocognitivo |
|---|---|---|---|---|---|---|---|---|
| Morris et al.12, 2017 | N = 68 AF aeróbica vs. anaeróbica Todos con EAL |
72,9 |
Ejercicio aeróbico vs. estiramiento | VO2pico | RMN Cuestionario de escala de memoria, función ejecutiva, depresión y discapacidad |
La AF aeróbica se asoció a la preservación significativa del hipocampo en comparación con AF anaeróbica | El VO2pico se asoció con cambios en la memoria en el grupo de AF aeróbica | |
| Pentikäinen et al.14, 2017 | N = 68 ♀ (29) vs. ♂ (39) (todos con DCL) T |
61-75 | VO2pico | RMN | En ♂ con riesgo, el VO2pico se asoció a la preservación significativa de sustancia gris global | |||
| Dougherty et al.23, 2017 |
N = 86 ♀ vs. ♂ (todos con R y ND) T |
50-75 |
-7 portadores -40 con HF -39 con HF y portadores |
Ejercicio aeróbico con tapiz rodante | VO2pico, frecuencia cardiaca y desecho de CO2 | RMN, RAVLT | La AF se asoció a mayor volumen del hipocampo en ♀ asintomáticas no significativa | En ♂ hubo asociación positiva significativa entre AF y RAVLT |
| Dougherty et al.21, 2016 | N = 91 ND con AF vs. ND sin AF T |
64 | 46% portador 70% con HF |
Ejercicio aeróbico | Acelerómetro | RMN, MMSE | La AF se asoció a la preservación significativa del volumen del temporal inferior y anterior | |
| Hashimoto et al.2, 2016 | N = 213 ND con AF vs. ND sin AF T |
68,9 |
Ejercicio aeróbico | Cuestionario modificado de Baecke | RMN, MMSE, RBMT | La AF se asoció a la preservación significativa del volumen del temporal y memoria | La atrofia del hipocampo se correlacionó significativamente con la puntuación más baja de RBMT | |
| Perea et al.30, 2016 | N = 37 Seguimiento de EAL con AF T |
72,35 | Ejercicio aeróbico, evaluado con tapiz rodante | VO2pico | RMN, NINCDS-ADRDA y CDR para determinar severidad | La AF se asoció con la preservación de la integridad de sustancia blanca en el fascículo frontooccipital | AF no se relacionó con mejora cognitiva aunque sí tuvo una tendencia en velocidad de procesamiento | |
| Raji et al.9, 2016 | N = 876 ND vs. DCL vs. EA L (5 años) |
78,3 |
Natación, caminata, golf, bicicleta… | Gasto calórico y cuestionario de actividades físicas | RMN, IQCODE, MMSE | La AF se asoció a mayores volúmenes de sustancia gris (frontal, hipocampo el tálamo y los ganglios basales) | ||
| Tan et al.17, 2016 | N = 3.714 Bajo grado AF vs. alto grado AF Todos con EAL L (40 años) |
70 |
-797 (21,45%) portadores | Índice de actividad física | Menor AF se asocia a mayor riesgo en no portadores de APOE4 | |||
| Boots et al.27, 2015 | N = 315 ND con AF Vs. ND sin AF T |
40-60 | -122 (38,7%) portadores -193 no portadores |
Ejercicio cardiorrespiratorio | VO2pico | RMN, RAVLT, W ASI, Naming Test, Stroop color, TMT A y B, escala de inteligencia de Wechsler, MMSE,IQCODE |
ND con AF se asociaron a preservación de SB respecto controles sedentarios |
Mayor AF se asocia a mejor rendimiento visuoespacial y de velocidad de respuesta, menor número de quejas de memoria, IQCODE y menos síntomas depresivos |
| Boyle et al.5, 2015 | N = 963 ND (724) Vs. EAL(135) Vs. EA(104) L (10años) |
74,1 | -238 (24,7%) portadores -725 no portadores |
Caminar | Bloques caminados | RMN, 3 MSE, Benton Visual Retention Test, DSST y CES-D, IQCODE | La AF se asoció a la preservación significativa del volumen del parietal | |
| Schultz et al.20, 2015 |
N = 69 Alta AF vs. baja AF (Todos ND con riesgo) T |
63.54 ± 5,93 |
-33 (47,8%) portadores -36 no portadores -50 (72,5%) con HF |
Ejercicio aeróbico | VO2pico | PET-PiB Muestras de LCR, RAVLT, WAIS, Stroop color, TMT A y B, MMSE |
No hubo una asociación significativa entre el VO2pico y la carga de beta-amiloide | Asociación significativa entre VO2pico, memoria inmediata y el aprendizaje verbal |
| Tolppanen et al.36, 2015 | N = 3.559 EA (1511) vs. ND (2048) L (28 años) |
78,8 | -779 (67,6) no portadores - 373 (32,4) portadores |
Ejercicio aeróbico | RMN, MMSE para separar EA de ND | Baja AF en mediana edad se asoció con un mayor riesgo | ||
| Braskie et al.18, 2014 | N = 82 AF vs. controles -43 ND -39 con EAL L (9 años) |
ND: 79,3 EA: 81,9 |
-2 homocig -23heterocig -46 no portadores -10 no valorados |
Natación, caminata, ciclismo, golf, baile | Cuestionario Minnesota modificado | RMN, 3 MSE, escala de Benton | La intensidad de AF se correlacionó significativamente con el volumen cerebral total | |
| Okonkwo et al.3, 2014 | N = 317 ND con AF vs. ND sin AF T |
40-65 | -127 (40,1%) portadores -190 no portadores -234 (73,8%) con HF |
Baja, moderada y alta actividad aeróbica | Acelerómetro y pruebas de ejercicio graduada |
PET-PiB, PET-FDG, RMN, RAVLT, WAIS, Stroop color, TMT A y B, MMSE, escala de Benton |
Interacciones significativas de la AF para la carga de beta-amiloide, metabolismo de la glucosa y volumen del hipocampo | AF se asoció positivamente con memoria inmediata, capacidad visuoespacial y en velocidad y flexibilidad |
| Smith et al.15, 2014 | N = 97 Bajo riesgo/alta AF vs. bajo riesgo/baja AF vs. alto riesgo/alta AF vs. alto riesgo/baja AF (Todos ND) L (5 años) |
65-89 |
-39 portadores | Baja, moderada y alta actividad aeróbica | Encuesta de Stanford | RMN RAVLT, DRS, MMSE |
En el grupo de alto riesgo asociación significativa entre la AF alta y la memoria diferida | AF se correlacionó positivamente con el rendimiento de memoria episódica en portadores APOE4 físicamente activos |
| Wirth et al.19, 2014 | N = 92 ND sin controles T |
70-80 | Ciclismo, baile, natación, boliche | Cuestionario Minnesota modificado | RMN y PET-PiB Test cognitivos de memoria episódica y función ejecutiva |
La AF se asoció de forma significativa a una retención menor de PET-PiB | La AF se relaciona con una mejor cognición global | |
| Yu et al.4, 2014 | N = 90 EAL vs. EA moderada |
Ciclismo | VO2pico y frecuencia cardiaca máxima | RMN | Protocolo en marcha | Protocolo en marcha | ||
| Vidoni et al.10, 2013 | N = 34 EAL (16) vs. ND (18) T |
60-85 | Ejercicio aeróbico, evaluado con tapiz rodante | VO2pico | RMN, MMSE, CDR, Stroop | La AF se asoció inversamente con la actividad cingulada anterior en los ND | ||
| Woodard et al.13, 2012 | N = 78 Bajo riesgo/alta AF vs. bajo riesgo/baja AF vs. APOE4/alta AF vs. APOE4/baja AF (Todos ND) L (21años) |
73,1 | -25homocig -8heterocig |
Baja, moderada y alta actividad aeróbica |
Encuesta de Stanford |
RMN, DRS-2, RAVLT | La AF de alta intensidad se asociación significativa con la portación de APOE4 | La baja AF tuvo reducciones significativas en DRS-2 y RAVLT |
| Landau et al.29, 2012 | N = 86 ND (65) vs. EA (10) vs. C (11) T |
> 50 sanos > 60 con EA 20-30 controles |
-64 sanos -9 con EA -8 controles |
Ciclismo, caminar, baile, yoga | kcal |
PET-PiB | La AF en la vida temprana y media se asoció a captación reducida de PiB | Un mayor nivel cognitivo se asoció con una menor captación de PiB |
| Vidoni et al.11, 2012 | N = 90 -ND (53) con AF vs. sin AF - EAL (37) con AF vs. sin AF T |
> 60 | Ejercicio aeróbico (baile) | VO2pico | RMN, CDR, MMSE | La disminución de la AF en EA se asoció a atrofia del parahipocampo izquierdo, temporal y núcleos de la base | En los EA, la disminución de AF se asoció a la progresión de la severidad de la demencia |
|
| Honea et al.16, 2009 | N = 117 ND (56) vs. EAL (61) ± APOE4 T |
73,8 |
-7 homocig -36 heterocig -18 no portadores |
Ejercicio aeróbico con tapiz rodante | VO2pico Escala de actividad física |
RMN, CDR, MMSE | En EA la AF se asoció positivamente con la corteza frontal, temporal y occipital | El VO2pico no se relacionó con la gravedad de la demencia ni con el MMSE |
| Burns et al.28 2008 | N = 121 ND (64) vs. EAL (57) T |
> 60 | Tapiz rodante | VO2pico | RMN, CDR, WAIS, TMT A y B, MMSE, Stroop color | VO2pico se asoció con mantenimiento del volumen cerebral total y de la sustancia blanca | VO2pico se asoció con un mayor rendimiento cognitivo global. La AF se asoció con mejor rendimiento en TMT A y B y en Stroop |
AF: actividad física; C: controles; CDR: clasificación de demencia clínica; CES-D: escala de depresión del Centro de Estudios Epidemiológicos; DCL: deterioro cognitivo leve; DRS: escala de demencia de Mattis; DSST: test de Sustitución de Dígitos por Símbolos; EA: enfermedad de Alzheimer; EAL: enfermedad de Alzheimer leve; HF: historia familiar de EA; IQCODE: cuestionario informativo para la declinación cognitiva en los ancianos; L: longitudinal; ND: sin deterioro cognitivo; PET-FDG: tomografía por emisión de positrones utilizando el radiotrazador 18-fluorodesoxiglucosa; PET-PiB: tomografía por emisión de positrones utilizando el radiotrazador B de Pittsburgh marcado con carbono 11; RAVLT: prueba de aprendizaje verbal auditivo de Rey; RBMT: prueba de memoria conductual Rivermead; T: transversal; TMT: test de trazo; VO2pico: consumo máximo de oxígeno; WAIS: escala abreviada de inteligencia de Wechsler; ♀:hombres; ♂: mujeres.
Por otro lado, 7 artículos se basaron en la comparación del volumen cerebral en participantes sin deterioro cognitivo (ND), deterioro cognitivo leve o EA; algunos señalaban diferencias en el comportamiento cerebral en los distintos grupos como es el caso del estudio de Honea et al. en el que las personas con EA que realizaban AF se beneficiaban de una mayor preservación de la corteza frontal, temporal y occipital de forma significativa al compararlo con participantes ND16.En el estudio de Burns et al. se observó también una asociación positiva entre la realización de AF y el volumen cerebral total28 así como de la sustancia blanca en personas con EA26. El estudio de Vidoni et al. demostró que la disminución de la AF estaba relacionada con una mayor atrofia en el parahipocampo izquierdo, lóbulo temporal y núcleos de la base11 de personas con EA y en la corteza occipital y temporal de forma bilateral y del uncus derecho de personas sin EA11.
En cuanto a los artículos que no demostraban diferencias en el comportamiento cerebral entre los pacientes con EA, deterioro cognitivo leve o ND, se encontraron 3 estudios, donde la intensidad de AF se correlacionó positivamente con el volumen cerebral total independientemente del estado cognitivo5, 9, 18. Por otro lado, está el estudio de Landau et al., que a diferencia de los otros 3 utilizó la PET como prueba de imagen, y concluyó que la AF se asociaba a una captación reducida de PiB pero de forma exclusiva para las edades tempranas y medias, sin determinar que fueran participantes ND o pacientes con EA29.
Tres artículos se centraron en el estudio de pacientes con EA leve y todos ellos, mediante RMN, llegaron a la misma conclusión: la AF aeróbica se asoció a un aumento del volumen cerebral en etapas tempranas de la enfermedad, diferenciándose en cada estudio exclusivamente las áreas mejor preservadas, siendo el hipocampo en el estudio de Morris et al. (p = 0,02)12, el volumen cerebral total para el estudio de Tan et al.17 y el fascículo frontooccipital en el estudio de Perea et al.30.
Siete estudios obtuvieron resultados significativamente positivos entre la AF y mejoras en diferentes parámetros de la cognición: en el rendimiento cognitivo de tipo espacial3, en la memoria inmediata20, en el aprendizaje verbal20, en la función ejecutiva26, en la memoria diferida28, en la velocidad de respuesta27, en la velocidad de procesamiento28 y en la cognición global19, 28).
Varios estudios estudiaron la relación entre una disminución de la AF en pacientes con EA y la progresión de la enfermedad recogida mediante diferentes escalas: un aumento en la clasificación de demencia clínica (CDR)11, 31, reducciones significativas en la escala de calificación de demencia de Mattis (MDRS-2)32, 33, 34 y en la prueba de aprendizaje verbal auditiva de Rey (RAVLT)35 (p < 0,05)13. Respecto a los ND, se registró que al descender la AF disminuyó la cognición global11 y aumentó el riesgo de padecer EA36.
Cuatro estudios no se centraron en la mejora de la cognición en sí, sino que valoraron de forma principal la relación entre la atrofia cerebral o el depósito de Aβ con el deterioro cognitivo. Dos de ellos lo hicieron valorando el volumen cerebral, observando una puntuación más baja de la prueba de memoria conductual Rivermead (RBMT)37 junto a mayores grados de atrofia hipocampal2, 19 y otros 2 estudios apreciaron una relación inversa entre el nivel de retención de PiB y el estado cognitivo19, 29.
En subanálisis, 5 estudios consideraron la influencia de ser portador o no de la APOE4: registrando la mejora en la memoria episódica únicamente en portadores APOE 4 activos15 o la asociación de una menor práctica de AF y el mayor riesgo de padecer EA exclusivamente en no portadores APOE 417. Los otros 3 estudios concluyeron que la portación de APOE4 no tenía un papel modulador sobre el efecto de la AF y el mayor mantenimiento del volumen cerebral5, 16 o la reducción del depósito de PiB29.
Solo el estudio de Morris et al. se centró en comparar el ejercicio aeróbico respecto al ejercicio físico anaeróbico, pudiendo establecer diferencias significativas entre ambos: el ejercicio aeróbico se asoció a la preservación del hipocampo en etapas tempranas de EA12 en comparación con el grupo de AF anaeróbica que no mostró mejoría significativa12.
Dos estudios con muestras formadas por participantes con riesgo de EA obtuvieron diferencias significativas al observar los resultados teniendo en cuenta el sexo, observando una asociación significativa positiva en el sexo masculino entre la AF y el mantenimiento de la sustancia gris14 y la AF y la RAVLT23, 35
Respecto a la neuroimagen, podemos señalar que un total de 20 artículos empleaban la RMN como método principal para ver la evolución del volumen cerebral de los pacientes y así poder comparar los cambios producidos después de la realización de la AF. Por otro lado, fueron 4 estudios los que valoraban el depósito del PiB, y exceptuando uno en el que exclusivamente se realizaba este estudio, el resto añadían más pruebas complementarias; uno complementaba la PET-PiB con RMN, otro añadía a estas 2 pruebas la PET utilizando el radiotrazador 18-fluorodesoxiglucosa para ver el metabolismo de la glucosa a nivel cerebral, y un último estudio tomaba junto al PET-PiB muestras de LCR para ver el acúmulo de Aβ.
Discusión
La finalidad de esta revisión bibliográfica ha sido analizar la influencia del ejercicio físico sobre el deterioro cognitivo y cambios estructurales y funcionales cerebrales de las personas con EA o en personas con factores de riesgo de padecer la enfermedad. En general, los 23 estudios analizados demuestran que el ejercicio físico tiene una repercusión positiva sobre la función cognitiva. Gran parte de los estudios se centran en la disminución del volumen de la sustancia gris del hipocampo mediante RMN, encontrándose volúmenes más pequeños en personas con EA respecto a ND, considerándose la pérdida de volumen del hipocampo un marcador válido de la neuropatología de la EA; de hecho no se encontraron zonas del cerebro más disminuidas en ND que en enfermos de Alzheimer16. En contra de esta disminución de volumen podría actuar la AF, pues muchos estudios concluyen que el ejercicio físico favorece un mantenimiento del volumen cerebral respecto a los que no lo realizan2, 6, 9, 21, 27, 30.
Por otro lado, la mayoría de los estudios que se basan en el depósito de Aβ en personas con riesgo de padecer la EA ven que este también disminuye con el ejercicio. Por ello, podemos observar cómo los efectos positivos de la AF se cuantifican en las pruebas de neuroimagen. Sin embargo, otros artículos destacan que en la EA también se producen otros mecanismos que pueden no traducirse en cambios de volúmenes, ni depósitos de proteínas, que se escaparían de nuestra evaluación mediante pruebas de imagen, de ahí la necesidad de hacer también valoraciones con test cognitivos17.
Estas pruebas complementarias podrían ayudar a diferenciar la EA de las demencias vasculares, aunque muchas veces los pacientes presentan demencias mixtas (con lesiones de degeneración cerebral y de origen vascular). Esta es una de las mayores dificultades que se nos presenta a la hora de diagnosticar la EA; por ello muchos estudios analizados excluyen a aquellos pacientes con factores de riesgo vascular para evitar factores de confusión10, 11, 12, 23, 28, 30. Por otro lado, hay que mencionar la variabilidad del grado de afectación cognitiva de los pacientes en los diferentes estudios, que supone una limitación en función de los criterios diagnósticos utilizados para clasificarlos.
También, hay que tener en cuenta si la muestra puede ser considerada representativa de la población general a la hora de sacar una conclusión, pues por ejemplo, en un estudio, al tratarse de participantes voluntarios, un gran porcentaje eran familiares de pacientes con EA, por lo que la frecuencia de portadores de APOE4 subió aproximadamente al 30%, respecto al 20-25% esperado18.
Las diversas metodologías en los diferentes estudios dificultan la comparación entre ellos, como por ejemplo, la heterogeneidad del tamaño muestral, desde n = 3410 (el de menor tamaño), hasta n = 3.71417 (el de mayor). Dentro de las muestras también hay diferencias que pueden influir en los resultados por su gran variabilidad; por ejemplo, la media de edad de los participantes (que oscila entre los 40 y los 94 años) o el índice de masa corporal, ya que el estudio de Dougherty et al. pone de manifiesto que el aumento del índice de masa corporal es directamente proporcional a la atrofia en áreas de riesgo de la EA23.
En cuanto la medición del ejercicio físico realizado, en la mayoría de los estudios se evalúa a través del consumo máximo de oxígeno. Sin embargo, hay otros que usan cuestionarios sobre la cantidad de AF realizada en la vida cotidiana o la media del trayecto caminado. Estas últimas son medidas muy subjetivas que pueden hacer que la evaluación de la condición física de los participantes varíe mucho de un estudio a otro23.
Además de la cantidad, se debe valorar el tipo de ejercicio; casi todos los estudios se basan en la realización de AF aeróbica, por lo tanto no se puede determinar si el mismo efecto se puede lograr con cualquier tipo de ejercicio físico. Los estudios que sí comparaban el ejercicio aeróbico con respecto al anaeróbico vieron no solo un mantenimiento, sino incluso un aumento en el volumen hipocampal, así como una mejora en la capacidad funcional de los pacientes del primer grupo respecto a los del segundo2, 12.
Respecto a los estudios que no mostraban resultados positivos significativos sobre el efecto beneficioso del ejercicio físico en la cognición, podemos destacar los estudios de Schultz et al., en el que la muestra (n = 69) se caracterizaba por una edad media relativamente baja (63,5 años)20. Además, ninguno de ellos tenía afectación cognitiva y al ser un estudio transversal no era suficiente para poder señalar una gran diferencia en los volúmenes cerebrales secundaria a realizar una AF más o menos intensa. Dos estudios usaron la encuesta de actividad breve de Stanford (SBAS)38, 39 como medición del ejercicio físico, que probablemente, al no ser una forma objetiva de evaluar los resultados, estos no fueron los esperados13, 15.
Tres estudios demostraron diferencias significativas en los resultados según el sexo14, 23, 36. Así, algunos investigadores dieron respuesta a ello por una mejor respuesta del eje hormonal glucometabólico e hipotalámico-pituitario-adrenal en la mujer27. Sin embargo, para sacar esta conclusión habría que considerar el rango de edad y descartar que se tratara de una demencia tipo vascular, pues el nivel hormonal es cambiante en la mujer y esta se beneficiaría de una protección hormonal respecto al riesgo vascular durante la premenopausia. Esta heterogeneidad de los estudios analizados no permite establecer resultados concluyentes, por lo que son necesarios más estudios para poder establecer una causalidad entre la realización de ejercicio físico y el desarrollo de la EA, así como determinar la intensidad y duración adecuadas para mejorar el deterioro cognitivo o incluso especificar el tipo de ejercicio más beneficioso3.
Conclusiones
Esta revisión bibliográfica muestra que en la mayoría de los estudios incluidos la práctica de ejercicio físico como terapia no farmacológica no permite conocer la repercusión del ejercicio físico a nivel cognitivo y a cambios estructurales y funcionales cerebrales en pacientes con riesgo de desarrollar la EA o en pacientes que ya presentan la enfermedad. Sin embargo, no se descarta un posible efecto beneficioso, siendo escasos los estudios que muestran un resultado negativo de esta intervención. Debido a la heterogeneidad en el diseño de los estudios es difícil establecer cuáles son las áreas cognitivas y la topografía cerebral mejor preservadas. Por ello son necesarios estudios con un mejor diseño y rigor metodológico para determinar la efectividad de un programa de ejercicio físico concreto para evitar la progresión de la EA, así como para establecer qué tipo específico de ejercicio físico es más eficaz, la intensidad, la duración y la adyuvancia con otras terapias de intervención cognitiva.
Lo conocido sobre el tema
Los efectos beneficiosos del ejercicio físico sobre la cognición en general se han demostrado en numerosos estudios
Existen pocos estudios que demuestren su eficacia específica en la EA como terapia preventiva y/o estrategia terapéutica no farmacológica
Los efectos positivos del ejercicio físico sobre la cognición pueden medirse con herramientas de neuropsicológica (test cognitivos) y mediante neuroimagen (RMN y PET)
Qué aporta este estudio
El ejercicio físico puede ser una medida preventiva para desarrollar la EA en personas de riesgo
El ejercicio físico puede tener beneficios sobre la cognición como tratamiento no farmacológico para personas con EA
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- 1.Organización Mundial de la Salud. Demencia [Internet]. 2018 [citado 8 Abr 2018]. Disponible en: http://www.who.int/mediacentre/factsheets/fs362/es/
- 2.Hashimoto M., Araki Y., Takashima Y., Nogami K., Uchino A., Yuzuriha T. Hippocampal atrophy and memory dysfunction associated with physical inactivity in community-dwelling elderly subjects: The Sefuri study. Brain Behav. 2016;7:e00620. doi: 10.1002/brb3.620. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Okonkwo O., Schultz S., Oh J., Larson J., Edwards D., Cook D. Physical activity attenuates age-related biomarker alterations in preclinical AD. Neurology. 2014;83:1753–1760. doi: 10.1212/WNL.0000000000000964. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Yu F., Bronas U., Konety S., Nelson N., Dysken M., Jack C. Effects of aerobic exercise on cognition and hippocampal volume in Alzheimer's disease: Study protocol of a randomized controlled trial (The FIT-AD trial) Trials. 2014;15:394. doi: 10.1186/1745-6215-15-394. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Boyle C.P., Raji C.A., Erickson K.I., Lopez O.L., Becker J.T., Gach H.M. Physical activity, body mass index, and brain atrophy in Alzheimer's disease. Neurobiol Aging. 2015;36 Suppl 1:S194–S202. doi: 10.1016/j.neurobiolaging.2014.05.036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Li R. Physical activity and prevention of Alzheimer's disease. J Sport Health Sci. 2016;5:381–382. doi: 10.1016/j.jshs.2016.10.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Organización Mundial de la Salud. Demencia: una prioridad de salud pública [Internet]. 2018 [citado 21 Mar 2018]. Disponible en: http://www.who.int/mental_health/publications/dementia_report_2012/es/
- 8.Erickson K., Weinstein A., Lopez O. Physical activity brain plasticity, and Alzheimer's disease. Arch Med Res. 2012;43:615–621. doi: 10.1016/j.arcmed.2012.09.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Raji C.A., Merrill D.A., Eyre H., Mallam S., Torosyan N., Erickson K. Longitudinal relationships between caloric expenditure and gray matter in the cardiovascular health study. J Alzheimers Dis. 2016;52:719–729. doi: 10.3233/JAD-160057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Vidoni E., Gayed M., Honea R., Savage C., Hobbs D., Burns J. Alzheimer disease alters the relationship of cardiorespiratory fitness with brain activity during the stroop task. Physl Ther. 2013;93:993–1002. doi: 10.2522/ptj.20120465. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Vidoni E., Honea R., Billinger S., Swerdlow R., Burns J. Cardiorespiratory fitness is associated with atrophy in Alzheimer's and aging over 2 years. Neurobiol Aging. 2012;33:1624–1630. doi: 10.1016/j.neurobiolaging.2011.03.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Morris J., Vidoni E., Johnson D., van Sciver A., Mahnken J., Honea R. Aerobic exercise for Alzheimer's disease: A randomized controlled pilot trial. PLoS One. 2017;12 doi: 10.1371/journal.pone.0170547. e5470170. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Woodard J.L., Sugarman M., Nielson K., Smith J.C., Seidenberg M., Durgerian S. Lifestyle and genetic contributions to cognitive decline and hippocampal structure and function in healthy aging. Curr Alzheimer Res. 2012;9:436–446. doi: 10.2174/156720512800492477. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Pentikäinen H., Ngandu T., Liu Y., Savonen K., Komulainen P., Hallikainen M. Cardiorespiratory fitness and brain volumes in men and women in the FINGER study. Age Ageing. 2017;46:310–313. doi: 10.1093/ageing/afw191. [DOI] [PubMed] [Google Scholar]
- 15.Smith J., Nielson K., Woodard J., Seidenberg M., Durgerian S., Hazlett K. Physical activity reduces hippocampal atrophy in elders at genetic risk for Alzheimer's disease. Front Aging Neurosci. 2014;6:61. doi: 10.3389/fnagi.2014.00061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Honea R., Thomas G., Harsha A., Anderson H., Donnelly J., Brooks W. Cardiorespiratory fitness and preserved medial temporal lobe volume in Alzheimer disease. Alzheimer Dis Assoc Disord. 2009;23:188–197. doi: 10.1097/WAD.0b013e31819cb8a2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Tan Z., Spartano N., Beiser A., DeCarli C., Auerbach S., Vasan R. Physical activity brain volume, and dementia risk: The Framingham Study. J Gerontol A Biol Sci Med Sci. 2017;72:789–795. doi: 10.1093/gerona/glw130. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Braskie M.N., Boyle C.P., Rajagopalan P., Gutman B.A., Toga A.W., Raji C.A. Physical activity, inflammation, and volume of the aging brain. Neuroscience. 2014;273:199–209. doi: 10.1016/j.neuroscience.2014.05.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Wirth M., Haase C., Villeneuve S., Vogel J., Jagust W. Neuroprotective pathways: Lifestyle activity, brain pathology, and cognition in cognitively normal older adults. Neurobiol Aging. 2014;35:1873–1882. doi: 10.1016/j.neurobiolaging.2014.02.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Schultz S., Boots E., Almeida R., Oh J., Einerson J., Korcarz C. Cardiorespiratory fitness attenuates the influence of amyloid on cognition. J Int Neuropsychol Soc. 2015;21:841–850. doi: 10.1017/S1355617715000843. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Dougherty R., Ellingson L., Schultz S., Boots E., Meyer J., Lindheimer J. Meeting physical activity recommendations may be protective against temporal lobe atrophy in older adults at risk for Alzheimer's disease. Alzheimers Dement (Amst). 2016;4:14–17. doi: 10.1016/j.dadm.2016.03.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Chételat G. Multimodal neuroimaging in Alzheimer's disease: Early diagnosis, physiopathological mechanisms, and impact of lifestyle. J Alzheimers Dis. 2018;64(s1):S199–S211. doi: 10.3233/JAD-179920. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Dougherty R., Schultz S., Boots E., Ellingson L., Meyer J., Van Riper S. Relationships between cardiorespiratory fitness, hippocampal volume, and episodic memory in a population at risk for Alzheimer's disease. Brain Behav. 2017;7:e00625. doi: 10.1002/brb3.625. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Yuede C., Timson B., Hettinger J., Yuede K., Edwards H., Lawson J. Interactions between stress and physical activity on Alzheimer's disease pathology. Neurobiol Stress. 2018;8:158–171. doi: 10.1016/j.ynstr.2018.02.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Urrútia G., Bonfill X. Declaracion PRISMA: una propuesta para mejorar la publicación de revisiones sistemáticas y metaanálisis. Med Clin (Barc) 2010;135:507–511. doi: 10.1016/j.medcli.2010.01.015. [DOI] [PubMed] [Google Scholar]
- 26.Moher D., Tetzla J., Tricco A.C., Sampson M., Altman D.G. Epidemiology and reporting characteristics of systematic reviews. PLoS Med. 2007;4:e78. doi: 10.1371/journal.pmed.0040078. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Boots E.A., Schultz S.A., Oh J.M., Larson J., Edwards D., Cook D. Cardiorespiratory fitness is associated with brain structure, cognition, and mood in a middle-aged cohort at risk for Alzheimer's disease. Brain Imaging Behav. 2015;9:639–649. doi: 10.1007/s11682-014-9325-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Burns J., Cronk B., Anderson H., Donnelly J., Thomas G., Harsha A. Cardiorespiratory fitness and brain atrophy in early Alzheimer disease. Neurology. 2008;71:210–216. doi: 10.1212/01.wnl.0000317094.86209.cb. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Landau S.M., Marks S.M., Mormino E.C., Rabinovici G.D., Oh H., O’Neil J.P. Association of lifetime cognitive engagement and low β-amyloid deposition. Arch Neurol. 2012;69:623–629. doi: 10.1001/archneurol.2011.2748. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Perea R., Vidoni E., Morris J., Graves R., Burns J., Honea R. Cardiorespiratory fitness and white matter integrity in Alzheimer's disease. Brain Imaging Behav. 2015;10:660–668. doi: 10.1007/s11682-015-9431-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Morris J. The Clinical Dementia Rating (CDR): Current version and scoring rules. Neurology. 1993;43:2412–2414. doi: 10.1212/wnl.43.11.2412-a. [DOI] [PubMed] [Google Scholar]
- 32.Jurica PJ, Leitten CL, Mattis S. Dementia rating scale-2: Professional manual. Lutz FL: Psychological Assessment Resources; 2001.
- 33.Mattis S. Mental status examination for organic mental syndrome in the elderly patient. En: Bellak L, Karasu T, editores. Geriatric psychiatry: A handbook for psychiatrists and primary care physicians. New York: Grune and Stratton; 1976: p. 77-121.
- 34.Mattis S. Dementia rating scale professional manual. Odessa, Florida: Psychological Assessment Resources; 1988.
- 35.Rey A. L’examen clinique en psychologie. París: Presses Universitaires de France; 1958.
- 36.Tolppanen A., Solomon A., Kulmala J., Kåreholt I., Ngandu T., Rusanen M. Leisure-time physical activity from mid- to late life, body mass index, and risk of dementia. Alzheimers Dement. 2015;11:434–443.e6. doi: 10.1016/j.jalz.2014.01.008. [DOI] [PubMed] [Google Scholar]
- 37.Wilson B., Cockburn J., Baddeley A., Hiorns R. The development and validation of a test battery for detecting and monitoring everyday memory problems. J Clin Exp Neuropsychol. 1989;11:855–870. doi: 10.1080/01688638908400940. [DOI] [PubMed] [Google Scholar]
- 38.Taylor-Piliae R., Haskell W., Iribarren C., Norton L., Mahbouba M., Fair J. Clinical utility of the Stanford brief activity survey in men and women with early-onset coronary artery disease. J Cardiopulm Rehabil Prev. 2007;27:227–232. doi: 10.1097/01.HCR.0000281768.97899.bb. [DOI] [PubMed] [Google Scholar]
- 39.Taylor-Piliae R., Norton L., Haskell W., Mahbouda M., Fair J., Iribarren C. Validation of a new brief physical activity survey among men and women aged 60-69 years. Am J Epidemiol. 2006;164:598–606. doi: 10.1093/aje/kwj248. [DOI] [PubMed] [Google Scholar]