Resumen
Objetivo
Analizar el impacto de una intervención formativa/informativa sobre el tratamiento del dolor crónico no oncológico en atención primaria.
Diseño
Estudio cuasi experimental antes-después y seguimiento de la cohorte de pacientes.
Emplazamiento
Sesenta y cuatro equipos de atención primaria (770 médicos).
Participantes
Pacientes ≥ 14 años sin diagnóstico oncológico con: 1) fentanilo citrato, 2) opioides mayores y ≥ 2 ansiolíticos-hipnóticos, 3) opioides mayores y menores de forma crónica, 4) lidocaína transdérmica fuera de indicación.
Intervención
Difusión de recomendaciones del tratamiento del dolor crónico no oncológico y facilitación de las incidencias de sus pacientes a cada médico.
Mediciones Principales
Números de incidencias en 2 cortes transversales (junio 2017 y junio 2018). Número de incidencias en junio de 2017 y que se mantienen en junio de 2018 (cohorte prospectiva).
Resultados
De las 2.465 incidencias detectadas en 2017 se produjo una reducción del 21,1% tras la intervención. La reducción fue superior (61,8%; p ≤ 0,0001) en la cohorte prospectiva. En números absolutos, la reducción más importante fue en incidencias de parches de lidocaína fuera de indicación (1.032 incidencias). La indicación aprobada constaba en menos del 8% de los tratados.
Conclusiones
La intervención redujo el número de pacientes con incidencias y la disminución fue mayor en la cohorte prospectiva, lo que confirma la eficacia de enviar información sobre pacientes con incidencias. La incorporación de nuevos tratamientos durante el año de seguimiento ha sido importante, por lo que estas intervenciones deben perpetuarse en el tiempo.
Palabras clave: Intervención, Dolor crónico no oncológico, Opioide, Lidocaína transdérmica, Fentanilo citrato, Ansiolítico-hipnótico
Abstract
Objective
To analyse the impact of a formative / informative intervention on the treatment of non-oncological chronic pain in Primary Care.
Design
Quasi-experimental study before-after, and follow-up of the patient cohort.
Location
64 Primary Care teams/centres (770 physicians).
Participants
Patients ≥ 14 years without an oncological diagnosis on: 1) fentanyl citrate, 2) major opioids and ≥ 2 anxiolytics-hypnotics, 3) long-term major and minor opioids, 4) transdermal lidocaine, out of indication.
Intervention
Dissemination of recommendations for the treatment of non-oncological chronic pain and the reporting of the incidents of their patients to each doctor.
Main measurements
Number of incidents in 2 cross sections (June 2017 and June 2018). Number of incidents in June 2017, which were maintained in June 2018 (prospective cohort).
Results
Of the 2,465 incidents detected in 2017, there was a 21.1% reduction after the intervention. The reduction was higher (61.8%, p < .001) in the prospective cohort. In absolute values, the most important reduction was in incidences of lidocaine patches outside of indication (1,032 incidences). The approved indication was found in less than 8% of the treated patients.
Conclusions
The intervention reduced the number of patients with incidences, and this reduction was higher in the prospective cohort, confirming the efficacy of sending information about patients with incidences to their physicians. The incorporation of new treatments during the follow-up year was significant, so these interventions should be perpetuated over time.
Keywords: Intervention, Non-oncological chronic pain, Opioid, Lidocaine patch, Fentanyl citrate, Anxiolytic-hypnotic
Introducción
La presencia de dolor es frecuente y afecta significativamente a la calidad de vida. Según la encuesta de salud de Catalunya realizada en 2014, el 31% de los mayores de 15 años presentaba algún tipo de dolor (el 23,9% de los hombres y el 37,8% de las mujeres)1. Datos proporcionados por la iniciativa Pain Proposal indican que la población española presenta una prevalencia de dolor del 17%, similar a la media europea (19%)2.
La atención primaria de salud es la puerta de entrada de la mayoría de los pacientes con dolor y donde muchas veces se realiza su seguimiento. Es la segunda causa de consulta en atención primaria3, por lo que es fundamental adoptar estrategias adecuadas de tratamiento.
La utilidad de los analgésicos en el dolor crónico no oncológico (DCNO) presenta pocas evidencias4. Se postula que los tratamientos no farmacológicos (terapias cognitivo-conductuales o programas de rehabilitación) son la mejor opción en términos de seguridad y eficacia, ya que mejoran calidad de vida y reducen el dolor sin efectos secundarios3, 4.
La estrategia farmacológica de abordaje del DCNO cambia en función del tipo (nociceptivo, neuropático o mixto) y la intensidad4. El DCNO nociceptivo leve responde a antiinflamatorios no esteroideos y paracetamol, mientras que dolores más intensos responden a opioides. Fármacos antidepresivos y anticonvulsivantes se reservan para dolores de origen neuropático. Lidocaína transdérmica se emplea en dolores neuropáticos secundarios a infecciones por herpes zóster5.
El incremento del uso de opioides mayores en indicaciones no oncológicas en países industrializados es controvertido6, por la falta evidente de eficacia, el potencial de abuso, la presencia de efectos adversos y aumento de la mortalidad7, 8. En un estudio realizado en atención primaria9, un 3,6% de pacientes no oncológicos tenía prescrito opioides mayores, con un incremento del consumo de fentanilo transdérmico y tramadol, en detrimento de los antiinflamatorios no esteroideos6.
En Estados Unidos, el número de muertes atribuibles a opioides supera el de cocaína y heroína, y el número de personas que consumen opioides prescritos supera al de drogas ilegales10. En 2010 se notificaron 16.651 muertes relacionadas con opioides en dicho país11.
En el Ámbito de la Región Sanitaria de Barcelona, CatSalut elaboró un documento en 2016 con recomendaciones sobre el abordaje del DCNO4. En dicho documento se aborda los problemas de eficacia y seguridad de los opioides a largo plazo y destaca la necesidad de compartir decisiones con el paciente y valorar el riesgo de abuso o dependencia4.
Un problema añadido es el uso concomitante de benzodiacepinas8. En un estudio realizado en atención primaria9, 2 de cada 3 pacientes tratados con opioides mayores tomaban simultáneamente benzodiacepinas. Esta combinación aumenta el riesgo de muerte, que puede ser hasta 10 veces superior a los tratados únicamente con opioides7.
Otro aspecto a considerar es la prescripción de opioides mayores de acción ultrarrápida en DCNO. Su consumo ha aumentado, así como el riesgo de reacciones adversas, conductas de abuso e intoxicaciones12.
Con el fin de conocer el perfil de utilización de estos fármacos en pacientes con DCNO, se realizó un análisis del uso de opioides y lidocaína transdérmica en pacientes con DCNO en la Dirección de Atención Primaria de la Metropolitana Nord13, en el que se detectaron aspectos de mejora relacionados con la eficacia y seguridad. Por ello, se decidió llevar a cabo una intervención para mejorar el uso de opioides mayores y parches de lidocaína en pacientes con DCNO. El objetivo del estudio es analizar el impacto de esta intervención.
Material y métodos
Diseño y ámbito
Estudio cuasi experimental antes y después. Se realizó una intervención a los médicos de familia de la Dirección de Atención Primaria Metropolitana Nord del Institut Català de la Salut, que consta de 64 equipos de atención primaria, 770 médicos de familia y una población de 1.131.315 personas ≥ 14 años.
Sujetos de estudio
Se incluyeron pacientes ≥ 14 años sin diagnóstico oncológico, adscritos a los 64 equipos de atención primaria y que tuvieran prescripción activa en la historia clínica informatizada (ECAP) con alguna de las siguientes incidencias:
-
-
Fentanilo citrato (nasal, sublingual u oral transmucosa).
-
-
Opioides mayores durante más de 3 meses y uso concomitante de 2 o más fármacos ansiolíticos o hipnóticos durante más de 3 meses.
-
-
Lidocaína transdérmica fuera de indicación.
-
-
Opioides mayores y menores prescritos de forma crónica y concomitante.
Intervención
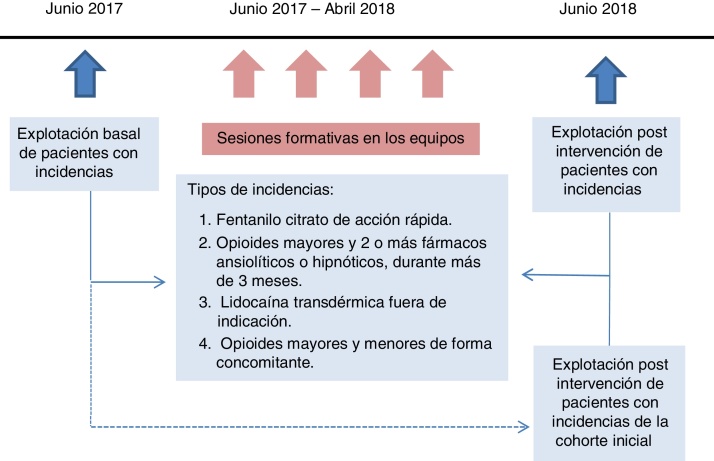
Farmacéuticos y farmacólogos de la Dirección de Atención Primaria difundieron las recomendaciones del documento elaborado por el departamento de Salud de la Generalitat de Catalunya Abordaje del dolor crónico no oncológico4 en una sesión formativa presencial en cada equipo de atención primaria, entre junio 2017 y abril 2018 (fig. 1). Durante este período se facilitó a cada médico de familia la información de sus pacientes con alguna incidencia, de forma homogénea con una explotación de datos centralizada.
Figura 1.
Cronograma del estudio.
Los datos se extrajeron de forma encriptada de los registros de la historia clínica informatizada (ECAP). Para evaluar la intervención se realizaron 2 cortes transversales antes (junio 2017) y después (junio 2018). Además se llevó a cabo un estudio de seguimiento prospectivo de la cohorte inicial de pacientes (junio 2017) y se analizó cómo varió el número de incidencias en esta cohorte.
Variables
Las variables principales del estudio fueron el número de incidencias:
-
-
En el momento basal (junio 2017) y después de la intervención (junio 2018).
-
-
En la cohorte inicial de junio de 2017 y el número de incidencias en dicha cohorte que continuaban en junio de 2018.
Las variables secundarias fueron edad y sexo de los pacientes; diagnósticos relacionados con las prescripciones (incluye la ausencia de diagnóstico); duraciones del tratamiento analgésico en cada tipo de incidencia y de los ansiolíticos-hipnóticos; principios activos de opioides mayores, opioides menores y ansiolíticos-hipnóticos.
Plan de análisis
Análisis descriptivo, con frecuencias para las variables cualitativas y medias y desviaciones estándar para las variables continuas, para conocer la evolución de las variables en ambos cortes transversales y en la cohorte de seguimiento (prospectiva).
Análisis bivariante mediante la prueba Chi-cuadrado en el caso de la comparación entre variables cualitativas y de la prueba t de Student para la comparación de medias independientes en los cortes transversales. También se calculó la variación porcentual del número de incidencias de un año respecto al anterior en los 2 tipos de estudios, y se comparó la variación en el estudio de la cohorte prospectiva respecto a la variación en ambos cortes transversales.
Se consideró estadísticamente significativos los valores de p < 0,05.
El procesamiento y análisis de los datos se realizaron mediante el paquete estadístico SPSS v15.0.
Aspectos éticos
El proyecto fue aprobado por el Comité de Ética de Investigación (CEI) de la IDIAP Jordi Gol.
Resultados
En junio de 2017 se detectaron 2.465 incidencias, siendo la más frecuente el uso de parches de lidocaína fuera de indicación (tabla 1). Con la intervención realizada se observó una reducción de incidencias del 21,1%. La menor reducción fue en el número de incidencias de fentanilo rápido.
Tabla 1.
Número de pacientes con incidencias de prescripción, en los cortes transversales y en el seguimiento de la cohorte inicial (prospectiva), de junio de 2017 y 2018
| Tipo de incidencia | Cortes transversales |
Cohorte prospectiva |
||||||
|---|---|---|---|---|---|---|---|---|
| Junio 2017 | Junio 2018 | Diferencia absoluta | % de variación | Junio 2017 | Junio 2018 | Diferencia absoluta | % de variación | |
| Fentanilo rápido | 118 | 117 | −1 | −0,8% | 118 | 61 | −57 | −48,3%* |
| Opioides potentes y ≥ 2 ansiolíticos/hipnóticos > 3 meses | 415 | 326 | −89 | −21,4% | 415 | 166 | −249 | −60%** |
| Opioides mayores y menores | 282 | 208 | −74 | −26,2% | 282 | 97 | −185 | −65,6%** |
| Parches de lidocaína fuera de indicación | 1.650 | 1.294 | −356 | −21,6% | 1.650 | 618 | −1.032 | −62,5%** |
| Total de incidencias | 2.465 | 1.945 | −520 | −21,1% | 2.465 | 942 | −1.523 | −61,8%** |
p = 0,0014.
p ≤ 0,0001.
*/** Significación estadística de la reducción de incidencias en el estudio de cohortes respecto al transversal.
Como se puede observar en la tabla 1, la reducción en 2018 de incidencias en la cohorte prospectiva fue superior (61,8%). Las reducciones de cada una de las 4 incidencias también fueron estadísticamente significativas.
El número de incidencias con mujeres fue superior en los 4 tipos. El porcentaje de mujeres en el grupo con fentanilo rápido fue inferior respecto a los grupos de opioides potentes con 2 o más ansiolíticos-hipnóticos (p < 0,0001), uso concomitante de opioides mayores y menores (p = 0,015) y lidocaína (p < 0,0001) (tabla 2).
Tabla 2.
Distribución por sexos, media de edad y duración de los tratamientos, de los 4 grupos de pacientes según el tipo de incidencia, en junio de 2017 y 2018
| Tipo de incidencia | Junio 2017 | Junio 2018 | Cohorte prospectiva |
|---|---|---|---|
| Fentanilo ultrarrápido | n = 118 | n = 117 | n = 61 |
| % de mujeres | 66,9% | 65,3% | 63,9% |
| Media de edad (DE) | 63 (15,5) | 62 (15,2) | 64 (13,8) |
| Media de edad en mujeres (DE) | 66 (16,2) | 65 (14,9) | 67 (13,9) |
| Media de edad en hombres (± desviación estándar) | 58 (12,7) | 57 (14,7) | 57 (11,4) |
| Duración del tratamiento (días) (DE) | 231 (243) | 193 (212,2) | |
| Opioides mayores + 2 o más ansiolíticos/hipnóticos > 3 meses | n = 415 | n = 326 | n = 166 |
| % de mujeres | 84,8% | 82,5% | 81,9% |
| Media de edad (DE) | 68 (14,3) | 69 (14,5) | 69 (14,1) |
| Media de edad en mujeres (DE) | 70 (14,1) | 69 (14,8) | 70 (14,1) |
| Media de edad en hombres (DE) | 62 (13,7) | 65 (12,3) | 65 (13,6) |
| Duración del tratamiento opioides (días) (DE) | 349 (334,8) | 446 (383,6) | |
| Duración del tratamiento ansiolíticos/hipnóticos (días) (DE) | 916 (902,8) | 869 (856,1) | |
| Opioides mayores + menores | n = 282 | n = 208 | n = 97 |
| % de mujeres | 80,5% | 77,9% | 82,5% |
| Media de edad (DE) | 67 (15,8) | 68 (15,3) | 68 (14,8) |
| Media de edad en mujeres (DE) | 69 (15,2) | 70 (15,1) | 71 (14,2) |
| Media de edad en hombres (DE) | 57 (14,5) | 61 (14,1) | 55 (10,2) |
| Duración del tratamiento opioides mayores (días) (DE) | 417 (517,8) | 537 (577,9) | |
| Duración del tratamiento opioides menores (días) (DE) | 761 (629,3) | 740 (647,6) | |
| Parches de lidocaína | n = 1.650 | n = 1.294 | n = 618 |
| % de mujeres | 81,1% | 79,4% | 81,4% |
| Media de edad (DE) | 71 (13,5) | 71 (13,9) | 71 (13,4) |
| Media de edad en mujeres (DE) | 72 (13,1) | 72 (13,5) | 72 (12,8) |
| Media de edad en hombres (DE) | 67 (14,6) | 68 (14,9) | 68 (15,1) |
| Duración del tratamiento opioides parches de lidocaína (días) (DE) | 414 (373,8) | 413 (412,8) | |
La media de edad de los hombres fue estadísticamente inferior a la de las mujeres en los cuatros tipos de incidencias (tabla 2).
Los pacientes con fentanilo rápido presentaron una media de edad menor respecto a los grupos de opioides potentes con 2 o más ansiolíticos-hipnóticos (p < 0,0001), uso concomitante de opioides mayores y menores (p = 0,03) y de lidocaína (p < 0,0001).
Los tratamientos con ansiolíticos o hipnóticos y con opioides menores fueron los más prolongados y los primeros mostraron una tendencia a disminuir en 2018, respecto a 2017 (p = 0,094 y p = 0,596), al igual que con las formas rápidas de fentanilo (p = 0,236).
Los diagnósticos asociados a especialidades de fentanilo de acción rápida aparecen en la tabla 3. Más de la mitad de los diagnósticos eran de patología osteomuscular y un elevado porcentaje no tenían diagnóstico asociado. En la cohorte prospectiva se observó un menor porcentaje de pacientes sin diagnóstico asociado a prescripción (p = 0,0004).
Tabla 3.
Descripción de los diagnósticos asociados a la prescripción de formas rápidas de fentanilo en 2017 y 2018
| Diagnósticos asociados a la prescripción de fentanilo rápido | Cortes transversales |
Cohorte prospectiva | |
|---|---|---|---|
| Junio 2017 | Junio 2018 | ||
| Problema de salud osteomuscular | 51,7% | 50% | 60,9% |
| Lumbalgia/ciática/lumbociática | 13,3% | 10% | 10,9% |
| Problemas del disco intervertebral | 8,3% | 5,8% | 9,4% |
| Fibromialgia | 2,5% | 5% | 4,7% |
| Osteoporosis | 6,7% | 4,2% | 7,8% |
| Otros problemas de salud | 35,8% | 36,7% | 29,7% |
| Sin diagnóstico | 12,5% | 13,3% | 9,4% |
Los diagnósticos asociados a lidocaína transdérmica fueron mayoritariamente de patología osteomuscular (tabla 4). En 2018 se redujo el porcentaje de tratamientos sin diagnóstico relacionado al 11,7% (p < 0,0001). El tratamiento se empleó para la única indicación aprobada (neuralgia postherpética) en un 3,7% en 2017. Se detectó un incremento en 2018 (7,6%) (p < 0,0001).
Tabla 4.
Descripción de los diagnósticos asociados a la prescripción de parches de lidocaína en 2017 y 2018. Se incluyen los diagnósticos de la cohorte prospectiva
| Diagnósticos asociados a la prescripción de lidocaína transdérmica | Cortes transversales |
Cohorte prospectiva | |
|---|---|---|---|
| Junio 2017 | Junio 2018 | ||
| Neuralgia postherpética | 2,6% | 6,6% | 5,3% |
| Infección herpes zóster | 1,1% | 1% | 0,9% |
| Problema osteomuscular | 56,8% | 60,5% | 68,7% |
| Lumbalgia/ciática/lumbociática | 11,6% | 11,3% | 11,8% |
| Gonartrosis | 6,1% | 4,5% | 6,4% |
| Problemas del disco intervertebral | 3,2% | 3,9% | 4,1% |
| Poliartrosis | 2,7% | 2,7% | 4,2% |
| Neuralgias y neuritis inespecíficas | 2,7% | 5% | 5% |
| Artrosis inespecíficas | 2,6% | 1,7% | 2% |
| Osteoporosis | 2,3% | 2,4% | 3,9% |
| Fibromialgia | 2,3% | 2,3% | 2,6% |
| Neuralgias (excluye neuralgia postherpética) | 2,7% | 4,9% | 6,4% |
| No consta diagnóstico | 22,5% | 11,7% | 2,3% |
| Otros diagnósticos | 14,4% | 15,2% | 16,4% |
En pacientes tratados con opioides mayores y 2 o más ansiolíticos-hipnóticos, la lumbalgia representó el porcentaje más importante (18,3% en 2017 y 16,3% en 2018), seguido de los problemas del disco intervertebral (8% en 2017 y 5,2% el 2018).
En 2017, el 48,2% de los pacientes tratados con un opioide mayor y menor de forma concomitante no tenía asociado diagnóstico a la prescripción del opioide menor. Este porcentaje se redujo al 22,6% en 2018. En la misma línea, en 2017 no constaba diagnóstico asociado al opioide mayor en el 13,5% de los pacientes, reduciéndose al 6,5% en 2018.
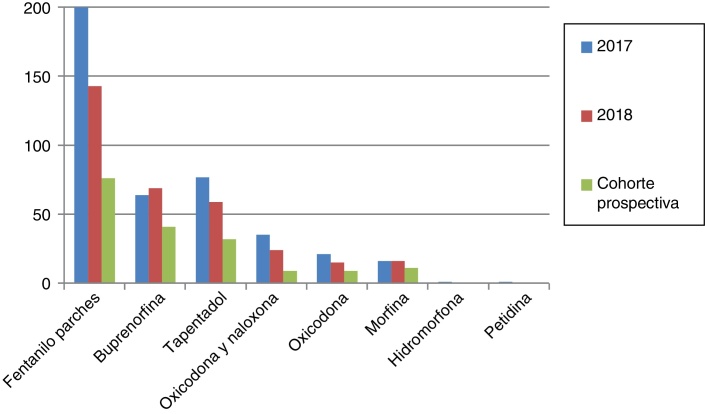
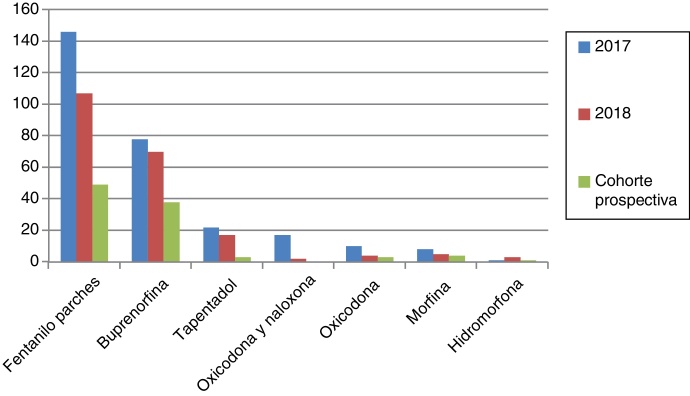
Los opioides mayores más prescritos con 2 o más ansiolíticos-hipnóticos o con opioides menores fueron fentanilo transdérmico y buprenorfina (Figura 2, Figura 3). En ambos grupos destaca la escasa prescripción de morfina. El opioide menor empleado fue tramadol en todos los pacientes en 2017 y 2018.
Figura 2.
Número de pacientes a los que se ha prescrito opioides mayores concomitantemente con 2 o más benzodiazepinas en 2017, 2018 y en la cohorte prospectiva.
Figura 3.
Número de pacientes a los que se ha prescrito opioides mayores concomitantemente con opioides menores en 2017, 2018 y en cohorte prospectiva.
Los ansiolíticos-hipnóticos más prescritos con opioides mayores fueron diazepam, lorazepam, alprazolam y lormetazepam, este último se incrementó en 2018 (p < 0,0001).
Discusión
La intervención basada en sesiones formativas para profesionales sanitarios con posterior retroalimentación de su propia prescripción ha reducido el número de incidencias. Las reducciones de incidencias se han producido especialmente en la cohorte prospectiva (más de la mitad). En los cortes transversales de junio de 2017 y 2018 se ha reducido aproximadamente en una quinta parte, debido a la incorporación de nuevos pacientes con incidencias entre ambos cortes. Estos resultados indican que se ha realizado una revisión de las incidencias enviadas, pero el mensaje no se ha interiorizado suficientemente en la práctica clínica habitual ya que han aparecido nuevas incidencias.
La eficacia de las intervenciones para mejorar la prescripción de medicamentos en atención primaria ha sido un tema ampliamente abordado. Se han analizado intervenciones educativas, alertas informáticas, incorporación de expertos en el medicamento, retroalimentación de la prescripción, etc. Según Zavala-González et al., las intervenciones informáticas son las más efectivas14. Magrini et al. consideran que la intervención focalizada en un solo fármaco tendría un impacto más relevante a largo plazo15. Otros autores consideran que las intervenciones con retroalimentación pueden mejorar resultados16. La mayor parte de los estudios realizados han incidido en la prescripción de antibióticos, antidiabéticos o novedades terapéuticas15, 16, 17. No hay estudios de este tipo en pacientes con DCNO. Sí se dispone de algunos ensayos clínicos para reducir el uso de opioides con un número reducido de pacientes, en los que se realizaron intervenciones psicológicas o de otros tipos18.
Las formulaciones de fentanilo de liberación ultrarrápida en pacientes no oncológicos presentan una relación beneficio riesgo desfavorable, habiéndose duplicado en España el consumo en 2016, respecto a 2010. También ha aumentado las notificaciones de casos de abuso y/o dependencia a nivel mundial en pacientes fuera de indicación (dolor disruptivo oncológico)19.
Diferentes autoridades sanitarias20, 21 y algunos organismos internacionales22 han alertado del problema del uso excesivo de opiáceos en los últimos años, especialmente las formulaciones de liberación rápida. En España, diversas sociedades científicas23 y organismos sanitarios2, 4 han elaborado recomendaciones de uso. Teniendo en cuenta que no hay evidencias sobre la existencia de dolor disruptivo en el DCNO24, resulta difícil justificar este tipo de fármacos en pacientes no oncológicos. Por ello la reducción a casi la mitad de la cohorte prospectiva de pacientes con estas formas puede considerarse como algo positivo, pero resulta preocupante el mantenimiento en los ya tratados y la incorporación de nuevos tratamientos, por lo que debe ser considerado en el futuro como un problema de salud grave.
En 2016, la Food and Drug Administration (FDA)25 alertó, en base a diversos estudios7, 26, de los graves efectos adversos de la toma conjunta de opioides y benzodiacepinas, como depresión respiratoria, somnolencia extrema, coma o incluso muerte. Las reducciones observadas en nuestro estudio han sido importantes, pero insuficientes, dado el elevado número de pacientes que continúan tomando opioides mayores con 2 o más ansiolíticos-hipnóticos, especialmente en mujeres de edad avanzada.
En la escala analgésica de la OMS no se recomienda el uso concomitante de opioides mayores y menores. No hay evidencias suficientes de un supuesto efecto aditivo, sinérgico o de rescate, siendo la bibliografía escasa y controvertida (con modelos experimentales, o en pacientes oncológicos con tamaños muestrales muy reducidos o en pacientes con DCNO sin mejora concluyente de la actividad analgésica)27, 28, 29, 30. El número de estas incidencias fue uno de los que más se redujo tras la intervención. El paciente tipo es mujer cercana a 70 años tratada con tramadol a largo plazo. La idea de usar el opioide menor como rescate del mayor quedaría en entredicho, dado que la duración media del menor es casi el doble de la del mayor.
El análisis de la prescripción de lidocaína en parches indica un uso indiscriminado para tratar cualquier tipo de dolor. La única indicación autorizada es la neuralgia postherpética, con resultados de eficacia modestos31. De hecho, distintas guías de práctica clínica32, 33 no la consideran como tratamiento de primera línea. En otros tipos de neuropatía periférica la evidencia científica es inconsistente.
Los pacientes tipo tratados con lidocaína son mujeres de unos 70 años, con más de un año de tratamiento por dolores osteomusculares. Pocos pacientes la tienen indicada para la indicación aprobada.
En nuestro estudio, el notable descenso de incidencias con lidocaína transdérmica posiblemente también se deba a medidas restrictivas en la prescripción llevadas a cabo por las autoridades sanitarias (asociación del diagnóstico a la prescripción y validación sanitaria).
Este estudio presenta diversas limitaciones, como la pérdida de incidencias entre pacientes oncológicos que también presenten dolores no relacionados con su proceso neoplásico. Se han excluido de forma sistemática para asegurar que el dolor no esté relacionado con un proceso oncológico.
Otra limitación del estudio es la falta de registro de diagnóstico relacionado con la prescripción o la presencia de diagnósticos poco verosímiles.
Paralelamente, los médicos recibieron información institucional relacionada con diferentes incidencias del uso de opioides y de lidocaína transdérmica sin diagnóstico correctamente asociado, que podría haber contribuido a la reducción de incidencias, independientemente de nuestra intervención.
Por otra parte, el estudio no es un ensayo clínico aleatorizado y carece de grupo control. La falta de este grupo es una limitación metodológica que puede generar dudas sobre la reducción del número de incidencias debidas a causas externas a la intervención, como fallecimientos, desplazamientos a otras zonas fuera del ámbito de estudio o recomendaciones institucionales sobre el uso de lidocaína transdérmica, especialmente en el seguimiento de la cohorte prospectiva. La razón por la que no se consideró la realización de un estudio con el diseño de un ensayo clínico fue de tipo ético, ya que de haberse realizado con esta metodología habría comportado no hacer una revisión de la medicación a un grupo de pacientes con prescripciones potencialmente peligrosas. La realización de un ensayo clínico con asignación aleatoria proporciona evidencias más concluyentes, pero en este caso se priorizaron los beneficios potenciales de aplicar una estrategia de mejora de prescripción a toda la población del territorio estudiado. En relación con el propio diseño, el estudio se ha analizado sin tomar como base al individuo, con la excepción de la cohorte prospectiva, por lo que una parte del estudio se asemeja más a una investigación con diseño de tipo ecológico.
Finalmente, otra limitación es la imposibilidad de asegurar que toda la medicación que consta en prescripción activa posteriormente se dispense y se consuma.
Conclusiones
La intervención contribuye a la reducción del número de pacientes con incidencias de prescripción, excepto en el total de las de fentanilo rápido. El seguimiento de la cohorte prospectiva mostró una mayor reducción de incidencias en 4 grupos de incidencias, incluida la de fentanilo rápido. No obstante, la incorporación de nuevas incidencias durante el año de seguimiento justifica la implementación de este tipo de medidas, mantenidas en el tiempo.
Lo conocido sobre el tema
-
•
En los últimos años se está produciendo un incremento del uso de opioides mayores en indicaciones no oncológicas en detrimento del uso de antiinflamatorios no esteroideos, con el consiguiente aumento de muertes atribuibles a opioides.
-
•
El uso concomitante de opioides y benzodiacepinas y la prescripción de opioides mayores de acción ultrarrápida en dolor crónico no oncológico aumenta el riesgo de reacciones adversas, conductas de abuso, intoxicaciones y mortalidad.
-
•
La utilización de lidocaína en parches resulta indiscriminada para tratar cualquier tipo de dolor, fuera de la indicación aprobada por ficha técnica.
Qué aporta este estudio
-
•
Una intervención consistente en la difusión de recomendaciones y en la facilitación de incidencias concretas de pacientes a cada médico de atención primaria reduce el número de incidencias de prescripción. Esta intervención debe mantenerse en el tiempo, ya que resulta más efectiva en la cohorte de pacientes que se sigue desde el inicio y a lo largo del tiempo se incorporan nuevos casos.
-
•
La utilización de formulaciones de fentanilo de liberación ultrarrápida en pacientes no oncológicos y la administración conjunta de opioides y benzodiacepinas deben ser considerados como graves problemas de salud.
-
•
Menos del 10% de los pacientes tratados con parches de lidocaína lo hacen para la indicación autorizada.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses
Bibliografía
- 1.Generalitat de Catalunya. Departament de Salut. Enquesta de Salut de Catalunya, 2014. Direcció General de Planificació i Recerca en Salut. Barcelona, 2.a ed. julio de 2015. [consultado 6 Mar 2017]. Disponible en: http://salutweb.gencat.cat/web/.content/home/el_departament/estadistiques_sanitaries/enquestes/onada09/esca2014_resultats.pdf
- 2.Torralba A., Miquel A., Darba J. Situación actual del dolor crónico en España: iniciativa “Pain Proposal”. Rev Soc Esp Dolor. 2014;21:16–22. [consultado 6 Mar 2017]. Disponible en: http://scielo.isciii.es/pdf/dolor/v21n1/original2.pdf. [Google Scholar]
- 3.SEMFYC. Documento de consenso. La atención al paciente con dolor crónico no oncológico (DCNO) en atención primaria (AP) [consultado 6 Dic 2017]. Disponible en: https://www.semfyc.es/wp-content/uploads/2016/06/DOCUMENTOCONSENSO-DOLOR-17-04-A.pdf
- 4.Generalitat de Catalunya. Departament de Salut. Direcció de Farmàcia de la Regió Sanitària Barcelona. Abordatge del dolor crònic no oncològic. Març de 2016. [consultado 1 Abr 2016]. Disponible en: http://catsalut.gencat.cat/web/.content/minisite/catsalut/catsalut_territori/barcelona/produccio_cientifica/2016/document-abordatge-DCNO-marc-2016.pdf
- 5.Deng Y., Luo L., Hu Y., Fang K., Liu J. Clinical practice guidelines for the management of neuropathic pain: A systematic review. BMC Anaesthesiology. 2016;16:12. doi: 10.1186/s12871-015-0150-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Celaya Lecea M.C., Malón Musgo M.M. Opioides en el tratamiento del dolor crónico no oncológico. Boletín Información Farmacoterapéutica Navarra. 2014;22:1–17. [Google Scholar]
- 7.Dasgupta N., Funk M.J., Proescholdbell S., Hirsch A., Ribisl K.M., Marshall S. Cohort study of the impact of high-dose opioid analgesics on overdose mortality. Pain Med. 2016;17:85–98. doi: 10.1111/pme.12907. [DOI] [PubMed] [Google Scholar]
- 8.Dowell D., Haegerich T.M., Chou R. Guideline for prescribing opioids for chronic pain-United States CDC, 2016. JAMA. 2016;315:1624–1645. doi: 10.1001/jama.2016.1464. [consultado 7 Abr 2017]. Disponible en: http://jamanetwork.com/journals/jama/fullarticle/2503508. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Tormo Molina J., Marín Conde L., González Urbano M., Ruiz Pérez dela Blanca M., Robles Martín J., Vivar Simón M. Prescripción de opioides mayores en pacientes con dolor no oncológico: descripción de sus características en una zona de salud de atención primaria. Rev Soc Esp Dolor. 2017;24:19–26. [Google Scholar]
- 10.García Espinosa M.V., Prieto Checa I. Dolor crónico no oncológico: dónde estamos y dónde queremos ir. Aten Primaria. 2018 doi: 10.1016/j.aprim.2017.12.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Dart R.C., Surratt H.L., Cicero T.J., Parrino M.W., Severtson S.G., Bucher-Bartelson B. Trends in opioid analgesic abuse and mortality in the United States. N Engl J Med. 2015;372:241–248. doi: 10.1056/NEJMsa1406143. [DOI] [PubMed] [Google Scholar]
- 12.Pergolizzi J.V., LeQuang J.A., Taylor R., Raffa R.B., NEMA Research Group Going beyond prescription pain relievers to understand the opioid epidemic: The role of illicit fentanyl, new psychoactive substances, and street heroin. Postgrad Med. 2018;130:1–8. doi: 10.1080/00325481.2018.1407618. [DOI] [PubMed] [Google Scholar]
- 13.Vallès R, García-Vicente JA, Vedia C, Martín JA, Franzi A, Reina MD. Abordaje farmacológico del dolor crónico no oncológico: detección de puntos de mejora. Póster del XXII Congreso de la SEFAP. Murcia, 8-10 Nov 2017.
- 14.Zavala-González M.A., Cabrera-Piraval C., Orozco-Valerio M.J., Ramos-Herrera I.M. Efectividad de las intervenciones para mejorar la prescripción de medicamentos en atención primaria. Aten Primaria. 2017;49:13–20. doi: 10.1016/j.aprim.2016.02.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Magrini N, Formoso G, Capelli O, Maestri E, Nonimo F, Paltrinieri B, et al. Long term effectiveness on prescribing of two multifaceted educational interventions: Results of two large scale randomized cluster trials. PLoS One. 2014; 9(10): e109915. doi:10.1371/journal.pone.0109915. [DOI] [PMC free article] [PubMed]
- 16.Saborido-Cansino C., Santos-Ramos B., Carmona-Saucedo C., Rodríguez-Rmero M.V., González-Martín A., Palma-Amaro A. Efectividad de una estrategia de intervención en el patrón de prescripción del biosimilar glargina en atención primaria. Aten Primaria. 2018 doi: 10.1016/j.aprim.2018.02.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Molina López T., Domínguez Camacho J.C., Santos Lozano J.M., Carbonell Carrillo A., Sánchez Acevedo J., Paz León M.L. Eficacia de las sesiones educativas para modificar la prescripción de fármacos nuevos. Aten Primaria. 2005;36:367–372. doi: 10.1157/13080299. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Eccleston C., Fisher E., Thomas K.H., Hearn L., Derry S., Stannard C. Interventions for the reduction of prescribed opioid use in chronic non-cancer pain. Cochrane Database Syst Rev. 2017;11:CD010323. doi: 10.1002/14651858.CD010323.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Agencia Española de Medicamentos y Productos Sanitarios. Observatorio del uso de medicamentos: Utilización de medicamentos opioides en España durante el periodo 2008-2015. [consultado 5 Dec 2018]. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/observatorio/informes.htm
- 20.Food and Drug Administration. Information by Drug Class: Opioid Medications. [consultado 5 Dic 2018]. Disponible en: http://www.fda.gov/Drugs/DrugSafety/InformationbyDrugClass/ucm337066.htm
- 21.Fischer B., Russell C., Murphy Y., Kurdyak P. Prescription opioids, abuse and public health in Canada: Is fentanyl the new centre of the opioid crisis? Pharmacoepidemiol Drug Saf. 2015;24:1334–1336. doi: 10.1002/pds.3901. [DOI] [PubMed] [Google Scholar]
- 22.Frieden T, Houry D. Reducing the Risks of relief -The CDC Opioid – Prescribing Guideline. N Engl J Med. 2016; 374; 16: 1501-1504. [DOI] [PMC free article] [PubMed]
- 23.Guía de consenso para el buen uso de analgésicos opioides. Gestión de riesgos y beneficios. Socidrogalcohol. SEMFyC, FAECAP, SECPAL. 2017.
- 24.Manchikanti L., Singh V., Caraway D.L., Benyamin R.M. Breakthrough pain in chronic non-cancer pain: Fact, fiction, or abuse. Pain Physician. 2011;14:E103–E117. [PubMed] [Google Scholar]
- 25.FDA warns about serious risks and death when combining opioid pain or cough medicines with benzodiazepines; requires its strongest warning. [consultado 5 Dic 2018]. Disponible en: https://www.fda.gov/downloads/Drugs/DrugSafety/UCM518672.pdf
- 26.Park T.W., Saitz R., Ganoczy D., Ilgen M.A., Bohnert A.S. Benzodiazepine prescribing patterns and deaths from drug overdose among US veterans receiving opioid analgesics: Case-cohort study. BMJ. 2015;350:h2698. doi: 10.1136/bmj.h2698. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Mercadante S., Villari P., Ferrera P., Casuccio A. Addition of a second opioid may improve opioid response in cancer pain: Preliminary data. Support Care Cancer. 2004;12:762–766. doi: 10.1007/s00520-004-0650-1. [DOI] [PubMed] [Google Scholar]
- 28.Romero A., Miranda H.F., Puig M.M. Analysis of the opioid–opioid combinations according to the nociceptive stimulus in mice. Pharmacol Res. 2010;61:511–518. doi: 10.1016/j.phrs.2010.02.011. [DOI] [PubMed] [Google Scholar]
- 29.Friedman Z., Katznelson R., Phillips S.R., Zanchetta C., Nistor O.I., Eisen L.B. A randomized double-blind comparison of a morphine-fentanyl combination vs morphine alone for patient-controlled analgesia following bowel surgery. Pain Pract. 2008;8:248–252. doi: 10.1111/j.1533-2500.2008.00212.x. [DOI] [PubMed] [Google Scholar]
- 30.Marcou T.A., Marque S., Mazoit J.X., Benhamou D. The median effective dose of tramadol and morphine for postoperative patients: A study of interactions. Anesth Analg. 2005;100:469–474. doi: 10.1213/01.ANE.0000142121.24052.25. [DOI] [PubMed] [Google Scholar]
- 31.Binder A., Bruxelle J., Rogers P., Hans G., Bösl I., Baron R. Topical 5% lidocaine (lignocaine) medicated plaster treatment for postherpetic neuralgia: results of a double-blind, placebo-controlled, multinational efficacy and safety trial. Clin Drug Investig. 2009;29:393–408. doi: 10.2165/00044011-200929060-00003. [DOI] [PubMed] [Google Scholar]
- 32.NICE. Neuropathic pain in adults: pharmacological management in non-specialist settings Clinical guideline [CG173]. Published date: November 2013 [última actualización: Feb 2017]. Disponible en: https://www.nice.org.uk/guidance/cg173/evidence/full-guideline-pdf-191621341
- 33.Moulin D., Boulanger A., Clark A.J., Clarke H., Dao T., Finley G.A. Pharmacological management of chronic neuropathic pain: Revised consensus statement from the Canadian Pain Society. Pain Res Manag. 2014;19:328–335. doi: 10.1155/2014/754693. [DOI] [PMC free article] [PubMed] [Google Scholar]