Abstract
目的
通过对特异性胆碱能受体α7nAChR进行干预,探讨胆碱能抗炎通路(CAP)在脓毒症早期对炎症与免疫的调控。
方法
采用SPF级SD大鼠64只,用随机数字表法分组,对照组8只:正常饲养,不做任何处理;假手术组8只:大鼠剖腹但不进行盲肠结扎穿刺法(CLP)制备脓毒症模型,并予哌拉西林(50 mg/kg,腹腔注射,3次/d,连续3 d);脓毒症组共48只,采用CLP脓毒症模型制备,制备成功后随机分为模型组16只:予哌拉西林(50 mg/kg,腹腔注射,3次/d,连续3 d)及生理盐水(1 mL/100 g,腹腔注射,3次/d,连续3 d);GTS-21组16只,哌拉西林使用同脓毒症组,并以GTS-21(4 mg/kg,腹腔注射,1次/d,连续3 d)进行干预;甲基牛扁亭(MLA)组16只:哌拉西林使用同脓毒症组,并以MLA(4.8 mg/kg,腹腔注射,1次/d,连续3 d)进行干预。记录各组大鼠MSS评分并进行短程HRV分析,3 d后处死大鼠采集血液,采用ELISA测定血清TNF-α、IL-1α、IL-10、IL-6、HMGB1、sCD14等细胞因子、采用细胞流式方法测定淋巴细胞CD4+CD25+ Treg与TH17阳性细胞比例。
结果
与对照组比较,脓毒症大鼠MSS评分明显升高,HRV指标(SDNN, RMSSD, HF, SD1, SD2)明显下降(P < 0.05);GTS-21明显改善了脓毒症MSS评分(P < 0.05),MLA较GTS-21明显增加MSS评分(P < 0.05),二者对HRV指标无显著影响(P > 0.05);脓毒症大鼠血清TNF-α、IL-1α、IL-10、IL-6、HMGB1、sCD14浓度、淋巴细胞CD4+CD25+ Treg与TH17淋巴细胞明显升高(P < 0.05),Treg/TH17较对照组明显降低(P < 0.05),GTS-21能明显降低脓毒症血清TNF-α、IL-1α、IL-6、HMGB1、sCD14浓度及TH17淋巴细胞百分比(P < 0.05);MLA增加脓毒症大鼠血清TNF-α、IL-1α、IL-10、IL-6、HMGB1、sCD14浓度与CD4+CD25+ Treg,TH17淋巴细胞百分比、降低模型组大鼠Treg/ TH17,与GTS-21组相比有显著差异(P < 0.05)。
结论
CAP对脓毒症早期炎症与免疫反应具有明显的负向调控作用,HRV部分指标能较好的反应CAP对炎症与免疫的调控效能。
Keywords: 胆碱能抗炎通路, 脓毒症, 促炎细胞因子, 免疫平衡, 心率变异性
Abstract
Objective
To investigate the role of cholinergic anti-inflammatory pathway (CAP) in neuro-regulation of inflammatory and immune response in the early stage of sepsis.
Methods
Sixty-four SD rats were randomly divided into control Group (n=8) with normal feeding without any treatment; sham operation group (n=8) with laparotomy but without cecal ligation and puncture (CLP), followed by intraperitoneal injection 50 mg/kg piperacillin 3 times a day for 3 consecutive days; and sepsis group (n=48) with CLP-induced sepsis. The rat models of sepsis were randomized into model groups (n=16) with intraperitoneal injection of piperacillin (50 mg/kg) and normal saline (1 mL/100 g) for 3 times a day for 3 days; GTS-21 group (n=16) with additional intraperitoneal injection of 4 mg/kg GTS-21 (once a day for 3 days); and methyllycaconitine (MLA) group (n=16) with intraperitoneal injection of MLA (4.8 mg/kg) in addition to piperacillin (once a day for 3 days). Murine Sepsis Score (MSS) of the rats and short-range HRV analysis were recorded. Three days later, the rats were sacrificed and serum levels of TNF-α, IL-1α, IL-10, IL-6, HMGB1, and sCD14 were measured with ELISA. The percentages of CD4+CD25+ Treg and TH17 lymphocytes and their ratios were measured using flow cytometry.
Results
Compared with the control rats, the septic rats had significantly increased MSS scores and lowered HRV indexes (SDNN, RMSSD, HF, SD1, and SD2; P < 0.05); treatment with GTS-21 significantly decreased while MLA increased MSS scores (P < 0.05), but neither of them obviously affected HRV of the rats. Serum levels TNF-α, IL-1α, IL-10, IL-6, HMGB1, and sCD14 and the percentages of CD4+CD25+ Treg and TH17-positive lymphocytes were significantly higher and Treg/TH17 ratio was significantly lower in the septic rats compared with those in the control group (P < 0.05); treatment with GTS-21 significantly decreased the levels of serum levels of TNF-α, IL-1α, IL-6, HMGB1, and sCD14 and TH17 lymphocyte percentage (P < 0.05), whereas MLA treatment significantly increased serum levels of TNF-α, IL-1α, IL-10, IL-6, HMGB1, and sCD14 and the percentages of CD4+ CD25+ Treg and TH17-positive lymphocytes and decreased Treg/TH17 ratio in the septic rats (P < 0.05).
Conclusion
CAP plays negative regulatory role in early inflammatory and immune response to sepsis, and some of the HRV indicators can well reflect the regulatory effect of CAP on inflammation and immunity in the septic rats.
Keywords: cholinergic anti-inflammatory pathway, sepsis, pro-inflammatory cytokines, immune balance, heart rate variability
近年来,抗感染治疗和器官功能支持技术取得了长足的进步,但脓毒症的病死率仍高达30%~70% [1]。根据2016年脓毒症和感染性休克国际共识(SCCM/ACCP)制定的Sepsis 3.0定义[2],强调了脓毒症是机体对感染的异常反应从而导致致命性的器官功能障碍,这一定义表明目前的研究与临床更应关注异常的炎症反应与免疫调节紊乱。
研究表明[3]:自主神经系统(ANS),尤其是迷走神经通过CAP在脓毒症病程中对免疫与炎症具有迅速而有效的调节作用。感染、创伤或者缺血等因素活化天然免疫细胞并促进释放细胞因子,如TNF-α,IL-1等。这些细胞因子被位于迷走神经感觉纤维上的相应受体识别后,信号经孤束核换元,投射到各迷走神经核团,继而通过CAP、下丘脑-垂体-肾上腺轴(HPA)轴和交感神经系统(SNY)发挥抗炎作用[4]。众所周知:脓毒症在早期即存在炎症与免疫的混乱,系统性炎症反应综合征、代偿性抗炎反应综合征及前抗炎反应综合征等错综复杂[5],炎症决定着患者病程的走向,甚至脓毒症患者的生存与否取决于于炎症的强度和促炎与抗炎之间的平衡[6]。因此,探索CAP在脓毒症病程中对系统性炎症与免疫调控的改变,探寻脓毒症早期炎症与免疫紊乱状态的神经调控的规律,是近年来脓毒症研究中的热点与难点。
心率变异性(HRV)是非侵入性的间接评价ANS功能的方法[7],为我们提供了体内交感及副交感神经对心脏及其他内脏的量化支配。无论是动脉粥样硬化[8],自身免疫性性疾病[9],还是感染[10]等炎症性疾病,都可导致HRV下降,表明自主神经能感知并调控炎症与免疫。脓毒症早期CAP对炎症与免疫的神经调控的研究尚未见相关报道。因此,本实验通过研究脓毒症早期大鼠HRV的改变及血清炎症分子,免疫分子的表达,以GTS-21及MLA对CAP进行干预,并对HRV中反映副交感神经的特定指标进行分析,从而探究CAP对早期脓毒症炎症与免疫的调控的改变,为脓毒症的神经调控提供理论依据。
1. 材料和方法
1.1. 实验动物
SPF级SD大鼠(周龄:6周)64只,许可证号:SYXK(鄂)2018-0104;购自三峡大学实验动物中心[出售许可证号:SCXK(鄂)2017-0012],动物饲养于贵州医科大学动物房。光照/黑暗时间为12/12 h。温度控制在22±2 ℃。湿度保持在(60±10)%。进食及饮水自由。大鼠适应性喂养7 d在后开始实验。所有操作均严格按照实验动物关爱和使用协定指南执行(IACUC),并得到贵阳市第一人民医院医学伦理委员会批准,批号:2019007。
1.2. 主要试剂
GTS-21,货号:29834(dihydrochloride MCE);甲基牛扁亭(MLA),货号:HY-N2332A/CS-0021211(MCE);Rat TNF-α,货号:E-EL-R0019c(elabscience);Rat IL-1α,货号:E-EL-R0011c(elabscience);Rat IL-6,货号:E-EL-R0015c(elabscience);Rat IL-10,货号:E-EL- R0016c(elabscience);Rat HMGB-1,货号:E- EL-R0505c(elabscience);Rat sCD14,货号:CSB-E11178r(cusabio);CD25 Monoclonal Antibody, PE(Invitrogen),货号:12-0390-82;CD4 Monoclonal Antibody, FITC(Invitrogen),货号:11-0040-82;IL-17A Monoclonal Antibody,PE(Invitrogen),货号:12-7177-81。
1.3. 主要仪器
BL-420F生物信号采集与分析系统(成都泰隆软件有限公司);FlexStation 3多功能酶标仪,型号:Flexstation3(Molecular Devices);流式细胞仪:型号:CytoFLEX(beckmancoulter)。
1.4. 研究方法
1.4.1. 动物及分组、处理方法
大鼠适应性喂养7 d后按照随机数字表分为3组并进行相应的干预。对照组8只:正常饲养,不做任何处理;假手术组8只:大鼠剖腹但不进行CLP脓毒症制备[11],并予哌拉西林(50 mg/kg,腹腔注射,3次/d);脓毒症组共48只,采用CLP脓毒症模型制备,制备成功后随机再分为3组,每组16只。模型组:予哌拉西林(50 mg/kg,腹腔注射,3次/d,连续3 d)及生理盐水(1 mL/100 g,腹腔注射,3次/d,连续3 d);GTS-21组,哌拉西林使用同脓毒症组,并以GTS-21(4 mg/kg[12],腹腔注射,1次/d,连续3 d)进行干预;MLA组:哌拉西林使用同脓毒症组,并以MLA(4.8 mg/kg[13-14],腹腔注射,1次/d,连续3 d)进行干预。3 d后处死大鼠自心脏取血进行ELISA及细胞流式检测。
1.4.2. 脓毒症严重程度评分
采用MSS(Murine Sepsis Score)评分系统[15],根据大鼠外观、意识水平、行为表现、对刺激的反应、睁眼反应、呼吸频率、呼吸质量等进行综合积分,分值越高,表明脓毒症越严重。采用3名实验人员进行单独评分,取平均值来评价各组大鼠在造模后1、2、3 d的病情严重程度。
1.4.3. 大鼠HRV动态监测
应用BL-420F生物信号采集与分析系统,记录大鼠在无束缚清醒条件下5 min心电信号[16]进行HRV时域,频域指标与非线性分析[17]。计算HRV时域参数包括所有RR间期标准差(SDNN),连续RR间期差的均方根差(RMSSD);频域指标HF及非线性参数包括SD1,SD2。
1.4.4. ELISA检测
大鼠实验结束后,各组大鼠采用异氟烷吸入麻醉[18]后剖开胸腔,自右心房采取血液2 mL进行ELISA及细胞流式检验。按照试剂盒说明书进行操作[19]。测定大鼠血清TNF-α、IL-1α、IL-10、IL-6、HMGB1、sCD14等细胞因子浓度;
1.4.5. 细胞流式检测
按照试剂盒说明书,采用流式双标对淋巴细胞表面抗原进行标记,计算CD4+CD25+ Treg与TH17阳性淋巴细胞百分比及Treg/TH17细胞比例。以CD4- FITC(fluorescein isothiocyanate)/IL-17A-PE(phycoerythrin)标记TH17细胞、以CD4-FITC/CD25-PE标记Treg细胞。进行孵育,离心,上流式细胞仪检测分析。
1.5. 统计处理
所有数据以均数±标准差表示,实验数据用SPSS 19.0软件包进行统计处理,计量资料采用方差分析,先进行Leven方差齐性检验,方差齐则以Bonferroni结果判定;方差不齐则以Tamhane结果判定;计数资料采用χ2检验。P < 0.05为差异具有统计学意义。
2. 结果
2.1. 各组大鼠死亡情况及MSS评分
术后第1天,脓毒症模型组,GTS-21组及MLA组死亡较多,第2、3天死亡数逐渐降低,脓毒症3组之间死亡率无统计学差异。对照组与假手术组均为0死亡,五组比较有显著差异(χ2=14.21,P < 0.01),但脓毒症模型组、GTS-21组及MLA组进行比较无显著差异(χ2=1.21,P > 0.05,图 1,表 1)。
1.
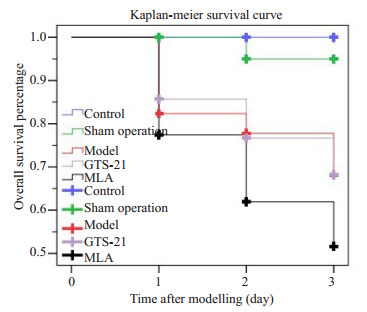
各组大鼠的Kaplan-Meier生存曲线
Kaplan-Meier survival curves of the rats.
1.
各组大鼠的生存率
The Survival Rate among groups
| Group | Survival rate | χ2/P Log rank (mantel-cox) |
| There was a significant difference in survival rate among the groups (χ2= 14.210, P < 0.01), but not among model group, GTS-21 group, and MLA group (χ2=1.21, P > 0.05). | ||
| Control | 1.000 | 14.210/0.000 |
| Sham operation | 0.950±0.049 | |
| Model | 0.681±0.113 | |
| GTS-21 | 0.682±0.107 | |
| MLA | 0.516±0.126 | |
按照MSS评分规则,脓毒症模型组,GTS-21组及MLA组评分明显高于对照组,且MLA组评分明显高于GTS-21组(P < 0.05,P < 0.05)。此外,3组大鼠中,同组在不同天数的评分也没有显著差异(表 2)。
2.
不同组别大鼠MSS
Murine Sepsis Score of the rats in different groups
| Group | 1st day | 2nd day | 3rd day | Average score | F/P |
| The average MSS scores of model group, GTS-21 group and MLA group were much higher than those of rats in control group, P value and 95%CI (Confidence interval) were respectively 0.000, -21.215~-17.745; 0.00, -19.064~-16.222; 0.00, -23.359~-18.841. The average MSS score of MLA Group was much higher than that of rats in GTS-21 Group, P value and 95%CI was respectively 0.003, 0.906~6.009; The average MSS scores of GTS-21 Group was much lower than that of Model Group, P value and 95% CI was respectively 0.039, -3.621~-0.054. ▲P < 0.05 vs control group; ★P < 0.05 vs model group; ◆P < 0.05 vs GTS-21 group. | |||||
| Control | 0.00 | 0.00 | 0.00 | 0.00 | |
| Sham operation | 1.25±0.49 | 1.38±0.65 | 0.00 | 0.88±0.29 | |
| Model | 19.40±3.34▲ | 18.63±2.23▲ | 20.57±2.51▲ | 19.48±2.82▲ |
F=505.175 P=0.000 |
| GTS-21 | 18.00±2.72▲ | 17.33±1.50▲ | 17.50±3.16▲★ | 17.64±2.47▲★ | |
| MLA | 20.33±3.91▲◆ | 21.33±3.27▲◆ | 22.20±1.30▲◆ | 21.10±3.19▲◆ | |
2.2. 大鼠血清炎症分子的表达
模型组,GTS-21组及MLA组大鼠的炎症指标(包括TNF-α、IL-1α、IL-10、IL-6、HMGB1、sCD14)较对照组和假手术组均明显增高(P < 0.05);GTS-21 组血清TNF-α、IL-1α、IL-6、HMGB1较模型组明显降低(P < 0.05);所有炎症指标在MLA组进一步升高,与GTS-21组相比有显著性差异(P < 0.05),且TNF-α与sCD14明显高于模型组(P < 0.05,图 2)。
2.
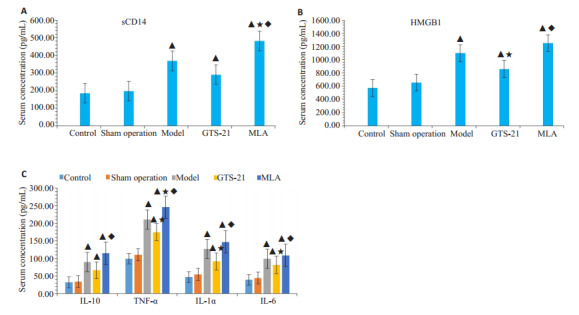
各组大鼠血清促炎细胞因子浓度
Serum levels of proinflammatory cytokines of the rats. sCD14: soluble CD14, precepsin; HMGB-1: High mobility group box-1; IL-10: Interleukin 10; TNF-α: Tumor necrosis factor alpha; IL-1α: Interleukin 1 alpha; IL-6: Interleukin 6. A: Serum sCD14 concentration(ng/mL) among different groups, it is a marker of inflammation in early stage of sepsis; B: Serum concentration of HMGB1 (pg/mL), it is a marker of inflammation in late stage of sepsis; C: Serum concentration (pg/mL) of IL-10, TNF-α, IL-1α, IL-6 among groups. ▲P < 0.05 vs control group; ★P < 0.05 vs model group; ◆P < 0.05 vs GTS-21 group.
2.3. 大鼠血清CD4+CD25+Treg与TH17阳性细胞百分比
模型组,GTS-21组及MLA组大鼠淋巴细胞CD4+ CD25+Treg与TH17阳性细胞比例明显高于对照组和假手术组(P < 0.05);GTS-21组TH17细胞比例较模型组明显降低(P < 0.05);在MLA组,Treg和TH17细胞比例明显高于GTS-21组(P < 0.05);从Treg/TH17来看,脓毒症组较正常组明显降低,GTS-21组较脓毒症模型组明显升高,而MLA组较GTS-21组明显降低(图 3)。
3.
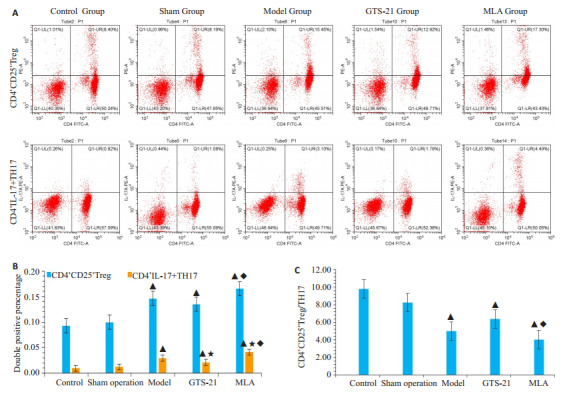
胆碱能抗炎通路(CAP)对免疫调控的研究
Role of cholinergic anti-inflammatory pathway (CAP) in immune regulation in septic rats. A: Flow cytometry of CD4+ CD25+Treg and TH17 lymphocytes in different groups; B: Double positive percentage of CD4+ CD25+ Treg and TH17 lymphocyte in different groups; C: Ratio of CD4+CD25+Treg/TH17 in the groups. ▲P < 0.05 vs control group; ★P < 0.05 vs model group; ◆P < 0.05 vs GTS-21 group
2.4. 大鼠HRV监测结果
脓毒症模型组,GTS-21组及MLA组HRV部分指标如SDNN,RMSSD,HF,SD1,SD2较对照组和假手术组均明显降低(P < 0.05),但3组间并无统计学差异(表 3)。进一步的亚组分析中,3组脓毒症大鼠以不同天数的指标进行比较,同一组大鼠的HRV指标在不同天数也没有统计学差异(P > 0.05)。
3.
不同组别大鼠HRV分析
The analysis of HRV in different groups of rats (Mean±SD)
| Group | SDNN | RMSSD | HF | SD1 | SD2 |
| SDNN: The standard deviation of all NN intervals; RMSSD: The root mean square successive difference; TP: Total power; HF: High frequency; SD1: Width of a scatterplot of successive pairs of RR intervals' standard deviation. SD2: Length of a scatterplot of successive pairs of RR intervals' standard deviation. ▲P < 0.05 vs control group. | |||||
| Control | 3.96±0.89 | 4.25±1.75 | 42.56±17.63 | 3.00±1.23 | 4.64±1.04 |
| Sham operation | 4.08±0.90 | 4.34±1.26 | 48.56±13.06 | 3.07±0.89 | 4.78±1.42 |
| Model | 1.59±0.83▲ | 1.69±1.00▲ | 30.75±5.82▲ | 1.19±0.71▲ | 1.87±1.01▲ |
| GTS-21 | 1.93±0.74▲ | 2.20±0.96▲ | 29.83±6.44▲ | 1.56±0.68▲ | 2.20±0.92▲ |
| MLA | 1.89±0.72▲ | 2.32±1.03▲ | 33.67±11.17▲ | 1.64±0.73▲ | 2.08±0.77▲ |
3. 讨论
脓毒症大鼠MSS评分及死亡率明显增加,与假手术组及对照组比较,具有统计学差异。GTS-21能降低脓毒症MSS评分及大鼠短期死亡率;MLA则增加了脓毒症大鼠MSS评分,提高死亡率。既往研究证实[20-21]:与MSS评分相关的大鼠病态疲乏与中枢神经内胶质细胞的激活,血清IL-1等细胞因子升高密切相关;通过磁共振波普检测,系统性炎症导致延髓背侧炎症标记物升高,伴随HRV中HF的下降。这些研究提示了大鼠较高的MSS评分可能与较强的系统性炎症和脑局部的炎症,导致自主神经对炎症的调节紊乱有关。CAP被激活后,可以同时抑制多种细胞因子的释放,如TNF-α,IL-1β,IL-6,从而降低系统性炎症反应[22-23],有利于纠正脓毒症早期过强的炎症风暴及免疫的过度活化。本实验表明,MSS评分越高,疾病的严重程度越重,短期期死亡率越高;GTS-21能改善脓毒症的MSS评分,而MLA则相反,GTS-21和MLA对脓毒症的死亡率无显著性影响,表明通过激活CAP,能够改善脓毒症早期病情,对脓毒症预后影响有限。同时也提示:CAP在脓毒症病程中可能被抑制。
通过ELISA测定多种细胞因子可以看出,脓毒症大鼠血清多种炎症分子明显升高,包括与天然免疫相关的TNF-α、IL-1α以及与适应性免疫相关的IL-6等促炎淋巴细胞因子均明显升高;同时抗炎淋巴细胞因子IL-10也明显升高。sCD14作为脂多糖-脂多糖结合蛋白复合体的受体,借助Toll样受体4(TLR4)引起“瀑布式炎症反应”,其血清水平升高与细菌感染引发的细胞吞噬作用有关[24],可作为脓毒症早期炎症标记物。HMGB1是一种核蛋白,由激活的单核细胞和坏死组织释放,HMGBl可以激活单核细胞和巨噬细胞,形成炎症的正反馈效应[25],可以加重和延长炎症反应,是一种重要的晚期促炎细胞因子。多种作用方向和机制不同的细胞因子在脓毒症早期同步升高提示了脓毒症大鼠免疫系统调控的复杂性和敏感性。GTS-21组血清TNF-α、IL-1α、IL- 6、HMGB1等水平较模型组明显降低(P < 0.05),表明CAP对多种促炎细胞因子调控的同步性和方向的一致性;而IL-10、sCD14水平也有所下降但未达到显著性差异,可能因IL-10为炎症的负性调控因子,与CAP作用协同一致;而sCD14为早期促炎细胞因子,血清浓度主要与单核巨噬细胞吞噬相关,与CAP的调控关系较小等有关,彰显了CAP对于炎症因子的作用具有一定的选择性,对促炎细胞因子抑制作用更强,而对抗炎细胞因子抑制作用较弱,具体机制需进一步研究。相反,MLA组TNF-α、IL-1α、IL-6、HMGB1、IL-10、sCD14血清水平明显高于GTS-21组,均达到显著性差异(P < 0.05)。可见,CAP对细胞因子的调节具有早期、同步和相对选择性的特点,对天然促炎和特异性炎症反应,对早期炎症和晚期炎症反应均能迅速进行调控,是对系统性炎症强有力的负向调控的重要机制;也提示了CAP具有强大的功能储备,在脓毒症中可能被抑制。
幼稚型CD4+T细胞进一步分化成熟与mTOR (雷帕霉素靶蛋白)的存在密切相关[26],在无感染及mTOR信号缺失时,CD4+T细胞分化为Treg,介导免疫抑制反应;在感染及mTOR信号存在时,CD4+ T细胞分化为Th1和Th17,促进免疫增强。Th17及Treg细胞在功能上相互拮抗,以维持机体的免疫平衡与免疫稳态[27-28]。本研究中,CD4+CD25+Treg与TH17淋巴细胞在脓毒症早期即同步上升,体现了促炎反应与抗炎反应同步启动,支持了脓毒症早期系统性炎症反应综合征(SIRS)和代偿性抗炎反应综合征并存而形成的混合抗炎症反应综合征[29]。CD4+CD25+Treg与TH17淋巴细胞百分比同时被GTS-21所抑制,被MLA所提升,进一步支持了CAP对免疫系统的早期负性调控,与CAP对促炎与抗炎同步抑制的研究结果相符。虽然两种调控淋巴细胞均被抑制,但从Treg/TH17的比例来看,模型组较正常对照组明显降低,表明脓毒症早期仍以抗炎反应占优势,GTS-21组比例较模型组升高,MLA组较模型组降低,同样验证了CAP对脓毒症早期免疫的负向调控,表明CAP对天然免疫和适应性免疫均具有调控作用。
为进一步验证自主神经对炎症与免疫的调控,我们设计了5组大鼠的HRV短程的分析,包括时域分析(SDNN, RMSSD)、频率分析中的HF与非线性分析(SD1, SD2)。SDNN反映交感和迷走神经活性,能反映总的HRV变化[30];HF,RMSSD反映迷走神经活性,与心率快速变化有关[31];脓毒症导致HRV部分指标如SDNN,RMSSD,HF,SD1和SD2明显降低,对于GTS-21和MLA干预并无明显改变。HF,RMSSD在脓毒症组均下降,表明了迷走神经调控的低下;SD1与SD2同步明显降低表明两个相邻的RR间期变异小,散点图明显集中,体现了较高的交感神经兴奋与迷走张力的降低,本研究直接证实脓毒症导致迷走张力明显下降,因此也证实了脓毒症导致CAP功能低下,与脓毒症早期炎症及免疫变化具有内在的一致性,充分说明自主神经中枢借助炎症反射弧对系统性炎症与免疫的调控。鉴于外周炎症与免疫对特异性α7nAChR激动剂和拮抗剂反应的敏感性和HRV证实迷走张力过低,提示CAP外周功能正常,脓毒症诱导的CAP功能低下的原因可能源自自主神经中枢而非外周,具体的机制将在以后的研究中进一步明确。HRV在脓毒症3组之间没有达到统计学差异,表明在脓毒症中,仅通过CAP的终端进行干预,对CAP的输出并无明显影响;同时也可能与HRV涉及到交感与迷走的双重支配,仅有的CAP干预对HRV参数影响有限。
总之,本研究表明脓毒症在早期即同步激活了机体的系统性炎症与抗炎反应,自主神经能对炎症与免疫快速调控,尤其是迷走神经介导的CAP在脓毒症早期对炎症与免疫具有明显的负性调控作用。本研究初步证实脓毒症可诱导CAP功能低下,可能是脓毒症早期炎症反应亢进和免疫过度激活的重要机制,其具体的调控机制可能涉及到自主神经中枢相关的改变[32]。深入研究脓毒症的神经调控机制,以便对CAP进行适当干预可能会成为脓毒症治疗的靶点之一。HRV部分指标能较好的反应CAP的调控效能,但尚不能作为一个精确的指标,可能HRV也受交感神经影响有关,需要在以后的研究中进一步证实。
Biography
李红兵,博士,副主任医师,E-mail: mrbright789@sina.com
Funding Statement
贵州省科学技术基金(黔科合基础[2019]1005)
Contributor Information
李 红兵 (Hongbing LI), Email: mrbright789@sina.com.
李 媛 (Yuan LI), Email: 806491940@qq.com.
References
- 1.陶 永康, 张 国强. 脓毒症与内质网应激. 中华急诊医学杂志. 2017;26(4):367–9. doi: 10.3760/cma.j.issn.1671-0282.2017.04.001. [DOI] [Google Scholar]
- 2.Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for Sepsis and septic shock (Sepsis-3) JAMA. 2016;315(8):801–10. doi: 10.1001/jama.2016.0287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Chavan SS, Pavlov VA, Tracey KJ. Mechanisms and therapeutic relevance of neuro-immune communication. Immunity. 2017;46(6):927–42. doi: 10.1016/j.immuni.2017.06.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.邓 晓红, 黄 建华, 董 竞成. 胆碱能抗炎通路及其在中医药抗炎中的研究进展. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgyyxb201704080 中华中医药杂志. 2017;32(4):1680–3. [Google Scholar]
- 5.Huet O, Chin-Dusting JP. Septic shock: desperately seeking treatment. Clin Sci. 2014;126(1):31–9. doi: 10.1042/CS20120668. [DOI] [PubMed] [Google Scholar]
- 6.Fernandez R, Nardocci G, Navarro C, et al. Neural reflex regulation of systemic inflammation: potential new targets for Sepsis therapy. http://cn.bing.com/academic/profile?id=c613bdba066be2a2e6490072b8027455&encoded=0&v=paper_preview&mkt=zh-cn. Front Physiol. 2014;5:489. doi: 10.3389/fphys.2014.00489. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Sassi R, Cerutti S, Lombardi F, et al. Advances in heart rate variability signal analysis: joint position statement by the e-cardiology ESC working group and the european heart rhythm association coendorsed by the asia pacific heart rhythm society. Europace. 2015;17(9):1341–53. doi: 10.1093/europace/euv015. [DOI] [PubMed] [Google Scholar]
- 8.Rupprecht S, Finn S, Hoyer D, et al. Association between systemic inflammation, carotid arteriosclerosis, and autonomic dysfunction. Transl Stroke Res. 2020;11(1):50–9. doi: 10.1007/s12975-019-00706-x. [DOI] [PubMed] [Google Scholar]
- 9.Koopman FA, Chavan SS, Miljko S, et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proc Natl Acad Sci USA. 2016;113(29):8284–9. doi: 10.1073/pnas.1605635113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Forsberg A, Lampa J, Estelius J, et al. Disease activity in rheumatoid arthritis is inversely related to cerebral TSPO binding assessed by [11C]PBR28 positron emission tomography[J]. J Neuroimmunol, 2019, 334: 577000.
- 11.郝 军舰, 冯 智明, 才 新, et al. 血必净对盲肠结扎穿孔手术诱导的脓毒症模型大鼠肺损伤的治疗作用. 中华实验外科杂志. 2019;36(6):1141. doi: 10.3760/cma.j.issn.1001-9030.2019.06.052. [DOI] [Google Scholar]
- 12.周 文海, 李 建国. 脓毒症和胆碱能抗炎通路模型的建立. http://d.old.wanfangdata.com.cn/Periodical/hubeiykdxxb201605013 武汉大学学报:医学版. 2016;37(5):748–51, 771. [Google Scholar]
- 13.苗 珍花, 王 银, 田 建英, et al. α7nACh受体竞争性拮抗剂甲基牛扁亭对昆明小鼠认知功能的损伤. 解剖学杂志. 2010;33(6):764–7. doi: 10.3969/j.issn.1001-1633.2010.06.017. [DOI] [Google Scholar]
- 14.江 秀慧, 张 子莘, 张 信鸽. α7nAchR烟碱型乙酰胆碱受体拮抗剂对高氧保护脓毒症小鼠效应的影响. http://d.old.wanfangdata.com.cn/Periodical/zwjkwz201403037 中外健康文摘. 2014;(3):44–6. [Google Scholar]
- 15.Shrum B, Anantha RV, Xu SX, et al. A robust scoring system to evaluate Sepsis severity in an animal model. BMC Res Notes. 2014;7:233. doi: 10.1186/1756-0500-7-233. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.刘红 夺儿, 朱 逸, 湛 萍, et al. 短时非线性方法用于心率变异性分析. 中国生物医学工程学报. 2015;34(2):229–36. doi: 10.3969/j.issn.0258-8021.2015.02.014. [DOI] [Google Scholar]
- 17.石 萍, 喻 洪流. 心率变异性的线性参数和非线性图形特征在自主神经功能评价中的应用研究. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=swyxgcx201402013. 生物医学工程学杂志. 2014;31(2):302–7. [PubMed] [Google Scholar]
- 18.Li HB. Restorative effect of modified Dioscorea pills on the structure of hippocampal neurovascular unit in an animal model of chronic cerebral hypoperfusion. Heliyon. 2019;5(4):e01567. doi: 10.1016/j.heliyon.2019.e01567. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Aziz N, Detels R, Quint JJ, et al. Biological variation of immunological blood biomarkers in healthy individuals and quality goals for biomarker tests. http://cn.bing.com/academic/profile?id=363cc8e23c8a47a1d6ee3d2a9c854fc9&encoded=0&v=paper_preview&mkt=zh-cn. BMC Immunol. 2019;20(1):33. doi: 10.1186/s12865-019-0313-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Dantzer R. Cytokine, sickness behavior, and depression. Immunol Allergy Clin North Am. 2009;29(2):247–64. doi: 10.1016/j.iac.2009.02.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Lekander M, Karshikoff B, Johansson E, et al. Intrinsic functional connectivity of insular cortex and symptoms of sickness during acute experimental inflammation. Brain Behav Immun. 2016;56:34–41. doi: 10.1016/j.bbi.2015.12.018. [DOI] [PubMed] [Google Scholar]
- 22.Santos-Almeida FM, Domingos- Souza G, Meschiari CA, et al. Carotid sinus nerve electrical stimulation in conscious rats attenuates systemic inflammation via chemoreceptor activation. http://cn.bing.com/academic/profile?id=e4bbcf57e71be98453056d9ca393ca2c&encoded=0&v=paper_preview&mkt=zh-cn. Sci Rep. 2017;7(1):6265. doi: 10.1038/s41598-017-06703-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Fonkoue IT, Marvar PJ, Norrholm S, et al. Symptom severity impacts sympathetic dysregulation and inflammation in post-traumatic stress disorder (PTSD) Brain Behav Immun. 2020;83:260–9. doi: 10.1016/j.bbi.2019.10.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Maldeghem VI, Nusman CM, Visser DH. Soluble CD14 subtype (sCD14-ST) as biomarker in neonatal early-onset sepsis and lateonset sepsis: a systematic review and meta-analysis. https://link.springer.com/article/10.1186%2Fs12865-019-0298-8. BMC Immunol. 2019;20(1):17. doi: 10.1186/s12865-019-0298-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.吕 聪, 孙 麟, 冯 皓宇, et al. 减少氧糖剥夺/复氧后脊髓星形胶质细胞凋亡:抑制高迁移率族蛋白B1/核转录因子κB通路的作用. 中国组织工程研究. 2019;23(33):5353–9. doi: 10.3969/j.issn.2095-4344.1811. [DOI] [Google Scholar]
- 26.蒋 政宇, 卞 金俊, 邓 小明. 免疫反应代谢调控:脓毒症研究的新方向. 中华危重病急救医学. 2019;31(1):122–5. doi: 10.3760/cma.j.issn.2095-4352.2019.01.025. [DOI] [PubMed] [Google Scholar]
- 27.Noack M, Miossec P. Th17 and regulatory T cell balance in autoimmune and inflammatory diseases. Autoimmun Rev. 2014;13(6):668–77. doi: 10.1016/j.autrev.2013.12.004. [DOI] [PubMed] [Google Scholar]
- 28.王 颖超, 刘 满菊, 朱 桂英, et al. Th17/Treg细胞比例失衡在儿童原发性免疫性血小板减少症中的意义. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgddekzz201603010. 中国当代儿科杂志. 2016;18(3):238–42. doi: 10.7499/j.issn.1008-8830.2016.03.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.宋 振举, 郦 珊珊, 童 朝阳, et al. 脓毒症患者血清促炎和抗炎细胞因子的变化. 中华急诊医学杂志. 2008;17(11):1191–4. doi: 10.3760/j.issn:1671-0282.2008.11.016. [DOI] [Google Scholar]
- 30.Williams DP, Koenig J, Carnevali L, et al. Heart rate variability and inflammation: a meta-analysis of human studies. Brain Behav Immun. 2019;80:219–26. doi: 10.1016/j.bbi.2019.03.009. [DOI] [PubMed] [Google Scholar]
- 31.Young HA, Benton D. Heart-rate variability: a biomarker to study the influence of nutrition on physiological and psychological health[J]? Behav Pharmacol, 2018, 29(2 and 3-Spec Issue): 140-51.
- 32.Brognara F, Castania J A, Dias D P M, et al. Baroreflex stimulation attenuates central but not peripheral inflammation in conscious endotoxemic rats. Brain Res. 2018;1682:54–60. doi: 10.1016/j.brainres.2018.01.003. [DOI] [PMC free article] [PubMed] [Google Scholar]


