Abstract
Ocrelizumab ist ein monoklonaler Antikörper, der sich gegen das Differenzierungsantigen CD20 richtet und zu einer effektiven längerfristigen Depletion von Lymphozyten, insbesondere von B‑Zellen, führt. Unlängst publizierte Phase-3-Studien belegen, dass Ocrelizumab sowohl bei der Behandlung der schubförmigen als auch der primär progressiven Multiplen Sklerose (MS) wirksam ist. Darauf basierend wurde Ocrelizumab als erstes Medikament zur Behandlung der primär chronisch-progredienten MS zugelassen. Um diesen Durchbruch besser in den Kontext des heutigen MS-Therapiekanons einordnen zu können, lohnt sowohl ein Blick zurück auf die Entwicklung der antikörpervermittelten CD20-Depletion als auch auf die der Zulassung zugrunde liegenden Studien sowie deren Extensionsphasen. Diese Übersichtsarbeit diskutiert die verfügbaren Daten zur Wirksamkeit und Sicherheit der langfristigen B‑Zell-Depletion bei MS-Patienten und erörtert den aktuellen Kenntnisstand zur Rolle von B‑Lymphozyten in der Immunpathogenese der MS.
Schlüsselwörter: B‑Zell-depletierende monoklonale Antikörper, B‑Zellen, Immunsuppression, Klinische Neuroimmunologie, Neuroinflammation
Abstract
Ocrelizumab is a monoclonal antibody directed against the differentiation antigen CD20, which leads to an effective long-term depletion of lymphocytes, in particular B cells. Recently published phase 3 studies confirmed that ocrelizumab is effective in the treatment of both relapsing multiple sclerosis (RMS) and primary progressive multiple sclerosis (PPMS). Based on these results, ocrelizumab was the first drug to be approved for primary chronic progressive MS. To place this therapeutic breakthrough in the context of the current MS therapeutic landscape, it is worthwhile taking a look back at the development of antibody-mediated CD20 depletion, the studies underlying the approval of ocrelizumab and their open extension phases. This review article discusses the available data on the efficacy and safety of long-term B‑cell depletion in MS patients and reviews current knowledge on the role of B‑lymphocytes in the immunopathogenesis of MS.
Keywords: B cell depleting monoclonal antibodies, B cells, Immunosuppression, Clinical neuroimmunology, Neuroinflammation
Hintergrund
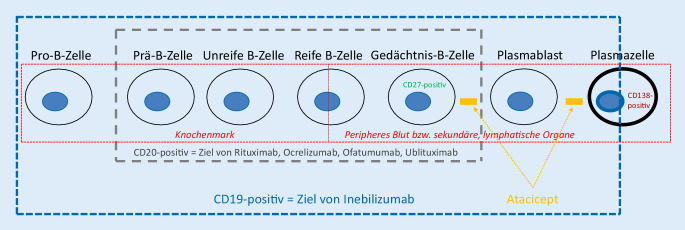
Die Multiple Sklerose (MS) ist mit weltweit ca. 2,5 Mio. Betroffenen die häufigste immunvermittelte, chronisch-entzündliche Erkrankung des zentralen Nervensystems (ZNS). Der Krankheitsverlauf ist entweder schubförmig (RMS) – mehrheitlich im Verlauf mit Übergang in die sekundär progrediente Form (SPMS) oder primär progredient [1]. Trotz jahrzehntelanger Forschung sind die eigentlichen Ursachen der Erkrankung nicht geklärt. Derzeitigen Hypothesen zufolge handelt es sich um eine komplexe Genese, zu der sowohl genetische als auch immunologische und umweltbedingte Faktoren beitragen. Eine Heilung der MS ist bis dato nicht möglich. In den letzten zwei bis drei Dekaden gab es jedoch eine erfreuliche Entwicklung zahlreicher immunmodulatorischer Therapieoptionen [1–3]. Mechanistisch neuartig ist die Depletion von CD20-positiven Zellen, ein Therapieprinzip, das sich bei anderen Autoimmunerkrankungen in Form von Rituximab bereits länger bewährt hat [4, 5]. Das CD20-Molekül ist ein Mitglied der „membrane spanning 4A family“ und wird vom MS4A1-Gen auf Chromosom 11 kodiert [6]. Mittels CD20-Depletion konnte nicht nur der schubförmige (RMS bzw. RRMS), sondern erstmals auch der primär chronisch-progrediente Krankheitsverlauf (PPMS) positiv beeinflusst werden. Abb. 1 veranschaulicht die Entwicklungsstadien der B‑Zell-Linie, die von einer gegen das CD20-Differenzierungsantigen gerichteten Therapie betroffen sind (adaptiert aus [7]). Dieser therapeutische Ansatz ist hoch effektiv und es spricht für sich, dass sich aktuell Nachfolgepräparate mit ähnlichem Wirkprofil [8] in der klinischen Entwicklung befinden bzw. gerade zugelassen wurden (z. B. der oral applizierte Bruton-Tyrosin-Kinase-Hemmer Evobrutinib [9] NCT04032158 und die monoklonalen Antikörper Ofatumumab [10] NCT02792218 bzw. NCT02792231, Ublituximab NCT03277261 bzw. NCT03277248 und NCT04032171). Die Ergebnisse der Ofatumumab-Zulassungsstudien wurden 2019 auf dem ECTRIMS-Kongress präsentiert. Ofatumumab führte zu einer relativen Risikoreduktion von 50,5 % (ASCLEPIOS I) bzw. 58,5 % (ASCLEPIOS II) der auf ein Jahr umgerechneten Schubrate im Vergleich zu Teriflunomid [11]. Die Substanz wurde gut vertragen.
Interessanterweise führen niedrig dosierte intrathekale Gaben von Rituximab zu einer kompletten CD20-Depletion im peripheren Blut [12], jedoch zu keiner vollständigen CD20-Depletion im ZNS [13]. Diese therapeutischen Entwicklungen haben dazu beigetragen, unsere Konzepte der pathophysiologischen Rolle der Immunzellen in der MS wesentlich zu wandeln [14].
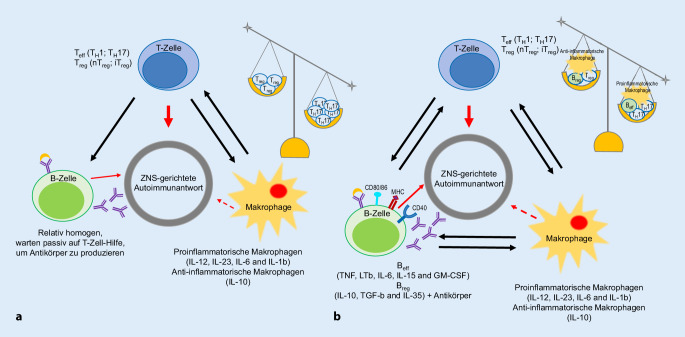
Aktuell geht man davon aus, dass B‑Zellen – und nicht mehr ausschließlich oder dominant T‑Zellen – eine zentrale Bedeutung in der MS zukommt (Abb. 2, adaptiert aus [14]). Tab. 1 fasst die Rolle von B‑Zellen in der Pathophysiologie der MS zusammen.
| Intrathekale Produktion von Immunglobulinen (oligoklonale Banden) |
| Produktion von Antikörpern gegen Myelinbestandteile in Blut und Liquor |
| B‑Zell- und Komplementablagerungen in Hirnläsionen |
| Meningeale B‑Zell-Aggregate bei SPMS |
| Expandierte Plasmablasten in Blut und Liquor |
| Antigenpräsentation, Zytokinproduktion, Förderung des „homing“ autoreaktiver T‑Zellen ins ZNS |
| Induktion und Regulation der Proliferation autoreaktiver, proinflammatorischer T‑Zellen (u. a. TH17-Zellen) |
| Induktion der Apoptose von Neuronen und Oligodendrozyten |
SPMS Sekundär progrediente Multiple Sklerose
Rituximab bei RRMS und PPMS: Fallberichte und -serien
Die ersten Berichte über den Einsatz von CD20-Depletion bei Patienten mit Multipler Sklerose stammen aus den Jahren 2005 und 2006. In einer ersten Fallserie von PPMS-Patienten wurde zunächst das B‑Zell-Muster sowohl im peripheren Blut als auch im Liquor vor und nach Gabe von Rituximab untersucht. Erwartungsgemäß depletierte Rituximab B‑Zellen im peripheren Blut rasch, effektiv und längerfristig, die Wirkung auf B‑Zellen im Liquor war jedoch gering ausgeprägt. Auch konnte gezeigt werden, dass die Kinetik der B‑Zell-Repopulation individuell bei Patienten deutlich schwanken kann [15]. Diese Ergebnisse stehen teilweise im Widerspruch zu einer weiteren Fallserie, bei der Rituximab als Zusatztherapie bei RRMS-Patienten verabreicht wurde: Bei diesen Patienten zeigte sich ein Abfall von sowohl B‑ als auch T‑Lymphozyten im Liquor [16]. Bei einem anderen RRMS-Patienten mit fulminantem Krankheitsverlauf kam es nach intravenöser Gabe von Rituximab nicht nur zum Stillstand der Erkrankung, sondern auch zu Besserungen des klinischen Funktionsstatus [17–19].
Rituximab bei RRMS: Phase-1- und -2-Studien
Eine nichtkontrollierte „Open-label“-Phase-1-Studie mit 26 RRMS-Patienten belegte ein günstiges Sicherheitsprofil von Rituximab über 72 Wochen. Der Antikörper verminderte die Anzahl neu aufgetretener Hirnläsionen zwischen Woche 4 und 72 und reduzierte die Schubrate im Vergleich zum Jahr vor Studienbeginn [20]. Die anschließende, doppelblinde, placebokontrollierte Phase-2-Studie (HERMES, Tab. 2) konnte dokumentieren, dass Rituximab nicht nur im primären magnetresonanztomographischen (MRT-)Endpunkt, sondern auch in den sekundären klinischen Zielkriterien gegenüber Placebo überlegen war [21].
| Studie | Primärer Endpunkt Ergebnis |
Sekundärer Endpunkt Ergebnis |
|---|---|---|
|
Phase-2-RRMS Hauser et al. [21] (HERMES) n = 104 Patienten |
Summe der Anzahl der gadoliniumpositiven T1-Läsionen in Serien-MRTs des Gehirns in den Wochen 12, 16, 20, 24 → Rituximab Placebo überlegen |
Anteil der Patienten mit Schüben Auf das Jahr umgerechnete Schubrate Absolute Anzahl von neuen gadoliniumpositiven T1-Läsionen in Serien-MRTs des Gehirns in den Wochen 12, 16, 20, 24 und Änderung des T2-Läsionsvolumens im Vergleich zum Ausgangswert → Rituximab Placebo überlegen |
|
Phase-2/3-PPMS Hawker et al. [22] (OLYMPUS) n = 439 Patienten |
Zeit bis zum Einsetzen von CDP Prozentsatz der Patienten mit CDP → Kein Hinweis für einen signifikanten Unterschied |
Änderung des absoluten T2-Läsionsvolumens in Woche 96 im Vergleich zum Ausgangswert Änderung des Hirnvolumens in Woche 96 im Vergleich zum Ausgangswert → Patienten, die Rituximab erhalten haben, hatten eine signifikant geringere Zunahme an T2-Läsionsvolumen |
MRT Magnetresonanztomographie, CDP „confirmed disability progression“ (bestätigte Krankheitsprogression)
Rituximab bei PPMS: Phase-2/3-Studie
Aufgrund der überraschend guten Wirksamkeit der CD20-Depletion bei Patienten mit schubförmiger Multipler Sklerose wuchs die Hoffnung, dass dieser therapeutische Ansatz ebenfalls einen positiven Einfluss auf den primär chronisch-progredienten Krankheitsverlauf haben könnte. Die randomisierte, doppelblinde, placebokontrollierte Phase-2/3-OLYMPUS-Studie bei PPMS (Tab. 2) verfehlte jedoch den primären klinischen Endpunkt: Es konnte kein signifikanter Unterschied in der Wirksamkeit auf die bestätigte Behinderungsprogression nachgewiesen werden. Doch der sekundäre radiologische Endpunkt, die signifikante Reduktion der T2-Läsionslast, wurde erreicht und Subgruppenanalysen zeigten, dass insbesondere jüngere Patienten, die im MRT aktive entzündliche Läsionen aufweisen, auch klinisch von einer Therapie mit Rituximab profitierten [22, 23].
Ocrelizumab: RRMS-Phase-2-, RRMS-Phase-3- und PPMS-Phase-3-Studien sowie Folgestudien nach Zulassung
In den folgenden Studien zur Wirksamkeit der CD20-Depletion bei MS-Patienten wurde nun nicht mehr der chimäre monoklonale Antikörper Rituximab, sondern der strukturell humanisierte Antikörper Ocrelizumab verwendet (Tab. 3). Die randomisierte, doppelt verblindete Phase-2-Studie mit Interferon‑β1a (IFN‑β1a 30 μg pro Woche intramuskulär) als aktivem Komparator zeigte die Überlegenheit von Ocrelizumab hinsichtlich des radiologisch definierten primären Endpunktes (Anzahl der gadoliniumaufnehmenden T1-Läsionen im der zerebralen MRT). Hinsichtlich der Nebenwirkungen zeigte sich kein relevanter Unterschied zwischen den einzelnen Gruppen [24].
| Studie | Primärer Endpunkt Ergebnis |
Sekundärer Endpunkt Ergebnis |
|---|---|---|
|
Phase-2-RRMS Kappos et al. [24] |
Anzahl der gadoliniumpositiven T1-Läsionen zwischen Woche 12 und 24 → Ocrelizumab Placebo überlegen |
Auf das Jahr umgerechnete Schubrate Prozentsatz der schubfreien Patienten Änderung des absoluten T2-Läsionsvolumens Anzahl der neuen gadoliniumpositiven T1-Läsionen zwischen Woche 4 und 24 Anzahl der gadoliniumpositiven T1-Läsionen zwischen Woche 4 und 24 → Ocrelizumab Placebo in allen Punkten überlegen außer Prozentsatz der schubfreien Patienten und Änderung des absoluten T2-Läsionsvolumens |
|
Phase-3-RMS Hauser et al. [25] (OPERA I und II) |
Auf das Jahr umgerechnete Schubrate → Ocrelizumab IFN‑β1a überlegen |
Zeit bis zum Einsetzen von CDP Anzahl der gadoliniumpositiven T1-Läsionen Anzahl der neuen und/oder vergrößerten T2-Läsionen Prozentsatz der Patienten mit CDI Anzahl der T1-Läsionen Änderung des MSFC im Vergleich zum Ausgangswert Prozentsatzänderung des Hirnvolumens Änderung des Short Form Health Survey-36 (SF-36) Physical Component Summary (PCS) im Vergleich zum Ausgangswert Prozentsatz der Patienten mit NEDA → Ocrelizumab überlegen in allen sekundären Endpunkten außer MSFC und SF-36 in OPERA I und überlegen in allen sekundären Endpunkten außer CDI und Prozentsatzänderung des Hirnvolumens in OPERA II |
|
Phase-3-PPMS Montalban et al. [26] (ORATORIO) |
Zeit bis zum Einsetzen von anhaltender CDP für mindestens 12 Wochen → Ocrelizumab Placebo überlegen |
Zeit bis zum Einsetzen von anhaltender CDP für mindestens 24 Wochen Prozentsatzänderung des T25-FW im Vergleich zum Ausgangswert Prozentsatzänderung des absoluten T2-Läsionsvolumens im Vergleich zum Ausgangswert Prozentsatzänderung des Hirnvolumens Änderung im Physical Component Summary Score (PCS) und SF-36 Health Survey Prozentsatz der Patienten mit mindestens einem unerwünschten Ereignis → Ocrelizumab überlegen in Bezug auf Zeit bis zum Einsetzen von anhaltender CDP für mindestens 24 Wochen, Prozentsatzänderung des T25-FW im Vergleich zum Ausgangswert; Prozentsatzänderung des absoluten T2-Läsionsvolumens im Vergleich zum Ausgangswert, Prozentsatzänderung des Hirnvolumens |
T25FW Timed 25-Foot Walk, MSFC Multiple Sclerosis Functional Composite, NEDA „no evidence of disease activity“ (kein Anhalt für Krankheitsaktivität), CDP „confirmed disability progression“ (bestätigte Krankheitsprogression), CDI „confirmed disability improvement“ (bestätigte Verbesserung des Behinderungsgrads), IFN Interferon
Zur Zulassung von Ocrelizumab bei RMS und PPMS führten die anschließenden Phase-3-Studien, die alle ihre primären klinisch definierten Endpunkte erreichten: die beiden identisch designten Studien OPERA I und II zu Ocrelizumab vs. Interferon‑β1a (intramuskulär) bei RMS [25] sowie die Studie ORATORIO zu Ocrelizumab vs. Placebo bei früher PPMS [26] definiert über Alter (18 bis 55 Jahre) und Erkrankungsdauer (<15 Jahre bei EDSS >5,0 bzw. <10 Jahre bei EDSS <5,0).
In den OPERA-Zwillingsstudien bei RMS reduzierte Ocrelizumab die jährliche Schubrate gegenüber IFN‑β1a um 46 % bzw. 47 % (jeweils p < 0,0001). Zudem wurden alle sekundären Endpunkte erreicht, darunter die Reduktion der Behinderungsprogression bzw. die Besserung der Behinderung (jeweils mit Bestätigung nach 12 und 24 Wochen) und magnetresonanztomographische Wirksamkeitskriterien, wobei die Reduktion der prozentualen Veränderung des Hirnvolumens nur in OPERA I statistisch signifikant war. Den Status NEDA über 2 Jahre erreichten in beiden Studien 48 % der Patienten in der Ocrelizumab-Gruppe gegenüber 29 % bzw. 25 % unter der aktiven Vergleichstherapie.
Eine jüngst veröffentlichte Post-hoc-Analyse belegte eine bestätigte Verbesserung der Armfunktion, erfasst in 12-wöchigen Abständen mit dem 9 Hole Peg Test (9HPT). In der Intention-to-treat-Analyse war auch der Anteil von Patienten mit bestätigter Verschlechterung im 9HPT geringer in der Ocrelizumab-behandelten Gruppe [27].
In einer kürzlich veröffentlichen Analyse der Krankheitsprogression in den OPERA-Studien, zeigt sich, dass in der gesamten RMS-Population der größte Anteil der erworben Behinderung schubunabhängig erfolgt [28].
In der 120-wöchigen PPMS-Studie ORATORIO erreichte Ocrelizumab sowohl den primären Endpunkt (Reduktion des Risikos einer nach 12 Wochen bestätigten Behinderungsprogression) als auch die sekundären Endpunkte. Der Anteil der Patienten mit bestätigter Krankheitsprogression im EDSS-Score nach 12 Wochen war gegenüber Placebo um 24 % reduziert. Subanalysen der Handfunktion (9HPT) und Gehfähigkeit (T25FW) bestätigten die Überlegenheit von Ocrelizumab in diesen Teilbereichen der motorischen Funktion [26].
Es ist zu erwähnen, dass in der PPMS-Studie nur Patienten eingeschlossen wurden, die eine relativ kurze Erkrankungsdauer – definiert über Alter (18 bis 55 Jahre) und Erkrankungsdauer (Symptomdauer <15 Jahre bei Patienten mit einem EDSS-Wert von >5,0 oder <10 Jahre bei Patienten mit einem EDSS von <5,0 zum Zeitpunkt des Screenings) – hatten.
Das Volumen von T2-Hirnläsionen nahm in der Ocrelizumab-Gruppe um 3,4 % ab, während es unter Placebo um 7,4 % anstieg. Die Anzahl neuer T2-Läsionen war unter Ocrelizumab gegenüber Placebo um 92 % reduziert [26]. Auch die Abnahme des Gehirnvolumens war in der Gruppe mit aktiver Therapie signifikant vermindert. Subgruppenanalysen zufolge war das Ansprechen auf Ocrelizumab nicht von der Präsenz gadoliniumaufnehmender Läsionen zu Beginn der Studie abhängig [26].
Bei Neuromyelitis-optica-Spektrumerkrankungen (NMOSD), einer Gruppe schubförmig verlaufender chronisch-entzündlicher ZNS-Erkrankungen mit pathognomonischer Astrozytopathie, konnte gezeigt werden, dass eine B‑Zell-Repopulation mit einem Anstieg der Schubrate assoziiert ist [29]. Inwiefern sich dieser Zusammenhang auf die RMS übertragen lässt, ist bislang allerdings unklar.
In den Zulassungsstudien kam es bei 20,7 % der RMS-Patienten und bei 26,3 % der PPMS-Patienten zu einem Abfall der absoluten Lymphozyten unterhalb des unteren Normalwertes [30]. Die Mehrheit der Patienten entwickelte eine Grad-1- oder -2-Lymphopenie, die Rate der Grad-3-Lymphopenien lag bei 1 % und bereits nach 2 Wochen ließen sich keine CD19-positiven Zellen mehr im Blut nachweisen [22, 26, 30]. Nach 2,5 Jahren (Median 72 Wochen) Ocrelizumab-Therapiepause hat sich bei 90 % der Patienten die Lymphozytenpopulation erholt [30]. Im Vergleich dazu hat sich die Lymphozytenpopulation in der Rituximab-Phase-2/3-Studie (OLYMPUS) nach 48 Wochen bei 35 % der Patienten erholt [22]. In den Folgestudien nach Marktzulassung am 12.01.2018 ([30]; Indikationen siehe Tab. 4; Anwendungsschema siehe Tab. 5) konnte der Nutzen von Ocrelizumab weiter bestätigt werden: 66,4 % der RMS-Patienten unter Ocrelizumab und 24,3 % der Patienten unter Interferon‑β1a zeigten keinen Hinweis für klinische oder radiologische Krankheitsaktivität („no evidence of disease activity“, NEDA; [31]). Da direkte Vergleichsstudien von Ocrelizumab gegen andere MS-Therapien fehlen, wurde eine Metaanalyse durchgeführt, die zeigte, dass der Nutzen einer Ocrelizumab-Therapie insbesondere bei Patienten mit hochaktiver RMS gegeben ist [32]. Ferner lieferten zahlreiche retrospektive Analysen und eine Subgruppenanalyse Hinweise dafür, dass Rituximab sowohl effektiv bei aggressiver RMS bzw. progressiver MS sein kann [33–39] als auch den MS-Therapien der 1. Generation (i.e. Interferon‑β und Glatirameracetat) überlegen ist [40, 41]. Ob Rituximab allerdings eine gleichwertige Alternative zu Ocrelizumab darstellt, bleibt in Abwesenheit einer Kopf-an-Kopf-Phase-III-Studie Gegenstand von Diskussionen [42–45]. Direkte Vergleichsstudien zwischen Rituximab und anderen Therapieoptionen wären sinnvoll, um diese Wissenslücken zu schließen [46].
| Ocrelizumab ist angezeigt zur Behandlung erwachsener Patienten mit schubförmiger Multipler Sklerose (RMS) mit aktiver Erkrankung, definiert durch klinischen Befund oder Bildgebung |
| Ocrelizumab ist angezeigt zur Behandlung erwachsener Patienten mit früher primär progredienter Multipler Sklerose (PPMS), charakterisiert anhand der Krankheitsdauer und dem Grad der Behinderung sowie mit Bildgebungsmerkmalen, die typisch für eine Entzündungsaktivität sind |
| Infusionsmenge Ocrelizumab | Infusionsgeschwindigkeit und -dauer | ||
|---|---|---|---|
| Initialdosis (600 mg) aufgeteilt auf 2 Infusionen | Infusion 1 | 300 mg in 250 ml |
Infusionseinleitung mit einer Geschwindigkeit von 30 ml/h über 30 min Die Geschwindigkeit kann in Schritten von 30 ml/h alle 30 min bis auf einen Höchstwert von 180 ml/h gesteigert werden Die Infusionsdauer sollte jeweils ca. 2,5 h betragen |
| Infusion 2 (2 Wochen später) | 300 mg in 250 ml | ||
| Folgedosen (600 mg) einmal alle 6 Monate | Einmalinfusion | 600 mg in 500 ml |
Infusionseinleitung mit einer Geschwindigkeit von 40 ml/h über 30 min Die Geschwindigkeit kann in Schritten von 40 ml/h alle 30 min bis auf einen Höchstwert von 200 ml/h gesteigert werden Die Infusionsdauer sollte jeweils ca. 3,5 h betragen |
Um das Ansprechen der PPMS-Patienten auf eine Immuntherapie besser charakterisieren zu können, wird seit kurzem der Summenparameter mit dem Akronym NEPAD – „no evidence of progression or active disease“ – verwendet. In der ORATORIO-Studie erhöhte Ocrelizumab den Anteil der PPMS-Patienten mit NEPAD nach 120 Wochen im Vergleich zu Placebo um das Dreifache [47]. Eine Analyse der gepoolten Daten aus den Phase-2- und -3-Studien legt nahe, dass Ocrelizumab die MRT-Läsionsaktivität innerhalb von 4 Wochen und klinische Krankheitsaktivität innerhalb von 8 Wochen effektiv unterdrückt [48]. Eine MR-Spektroskopie-Studie mit sequenzieller Messung über 96 Wochen eines Markers des „neuronal-myelin coupling“ (NAA, tCr, tCho und NAA/tCr) zeigt, dass Ocrelizumab das Ausmaß einer zerebralen Gliose im Vergleich zu Interferon‑β reduziert [49]. Die klinische Progression scheint bei PPMS-Patienten mit chronischer Läsionsaktivität in der weißen Substanz assoziiert zu sein [50].
Ocrelizumab: Nebenwirkungen
Akute Infusionsreaktionen
Als relevante Nebenwirkungen traten unter Ocrelizumab gegenüber Placebo häufiger akute Infusionsreaktionen und Infektionen auf. Die Häufigkeiten der schwerwiegenden Nebenwirkungen in den Zulassungsstudien sind in Tab. 6 zusammengefasst. Weitere laufend aktualisierte Daten – insbesondere zu Infektionen und Neoplasien – werden regelmäßig auf Kongressen vorgestellt und ergaben bislang keine neuen Sicherheitsaspekte [51].
| Studie | Anzahl | Davon Infektionen |
|---|---|---|
| OPERA I | 28 (6,9 %) | 5 (1,2 %) |
| OPERA II | 29 (7,0 %) | 6 (1,4 %) |
| ORATORIO | 99 (20,4 %) | 30 (6,2 %) |
Eine retrospektive Studie konnte zeigen, dass das Auftreten von infusionsassoziierten Reaktionen durch die zusätzliche Gabe von Histaminantagonisten und oraler Flüssigkeitszufuhr deutlich reduziert werden kann [52].
Malignome
Im klinischen Studienprogramm wurde bei Patienten, die mit Ocrelizumab behandelt wurden, eine verglichen mit den Kontrollgruppen höhere Anzahl maligner Erkrankungen (einschließlich Mammakarzinom) beobachtet [53, 54].
In der 2:1 randomisierten Zulassungsstudie zur PPMS wurden unter Ocrelizumab (486 Patienten) in der placebokontrollierten Phase 11 Neoplasien verzeichnet, (Mammakarzinom 4, Basalzellkarzinom 3, endometrioides Adenokarzinom 1, anaplastisches großzelliges Lymphom 1, fibröses Histiozytom 1, Pankreaskarzinom 1), während in der Placebogruppe (239 Patienten) in der kontrollierte Studienphase 2 Neoplasien auftraten (Basalzellkarzinom 1, zervikales Adenokarzinom in situ 1; [26]).
Bei den RMS-Patienten unter Ocrelizumab traten in den 2‑jährigen kontrollierten Phasen der OPERA-Studien insgesamt 4 maligne Erkrankungen auf (Mammakarzinom 2; Nierenzellkarzinom 1, malignes Melanom 1) und in der mit IFN‑β1a behandelten Gruppe 2 (Mantelzell-Lymphom 1 und pulmonales Plattenepithelkarzinom 1; [25]).
Jährlich aktualisierte Analysen (aktueller Stand Januar 2019) zur Inzidenzrate von malignen Erkrankungen (ohne nichtmelanotische Hautmalignome) bei den weiter beobachteten Patienten des klinischen Studienprogramms zu Ocrelizumab zeigen, dass die alters- und geschlechtsstandardisierten Raten pro 100 Patientenjahre in der exponierten Population über die Zeit stabil blieben und keinen zeitabhängigen Expositionseffekt zeigen. Des Weiteren ergaben Vergleiche der standardisierten Inzidenzraten für alle maligne Erkrankungen und für Mammakarzinome mit der US-amerikanischen SEER-Datenbank (Allgemeinbevölkerung) und dem dänischen MS-Register, dass die beobachteten Inzidenzraten im gesamten bisherigen Beobachtungszeitraum innerhalb der epidemiologischen Referenzbereiche lagen [55].
Infektionen
Fallberichte weisen auf das Risiko einer Hepatitisreaktivierung unter CD20-Depletion hin [56, 57], daher ist eine Risikostratifizierung vor Therapiebeginn sinnvoll [58]. Ferner wurden als Risiken eine Late-onset-Neutropenie [59, 60] und das Auftreten tumefaktiver, demyelinisierender Läsionen beschrieben [61]. Es sind wenige Fälle einer „carry-over“ progressiven multifokalen Leukenzephalopathie (PML) bekannt geworden. Diese traten nach vorangegangener Therapie mit anderen Immunmodulatoren mit bekannt erhöhtem PML-Risiko auf (7 Fälle Stand Ende 2019) [62, 63]. Aktuell ist eine nichtinterventionelle Studie geplant, die das Langzeitrisikoprofil von Ocrelizumab besser erfassen soll [64]. Die Ergebnisse dieser Studie in Deutschland fließen auch in globale Sicherheitsregister ein [65].
Dieser Kontext ist ähnlich wie bei den Fällen einer PML in Assoziation mit dem Vorläuferpräparat Rituximab in anderen Nicht-MS-Indikationen, wie z. B. rheumatoider Arthritis [66]. Die Auswertung eines Rituximab-Therapieregisters ergab keine neuen Aspekte hinsichtlich des Nebenwirkungsprofils von CD20-Depletion [67]. Es gibt Hinweise dafür, dass ein sekundärer Immunglobulinmangel das Auftreten schwerer Infektionen begünstigen kann [68]. In einem Review über das Risiko einer Hypogammaglobulinämie bzw. Infektion unter Rituximab konnten jedoch keine klaren Risikofaktoren herausgearbeitet werden [69]. Wie unter Rituximab sollte unter Ocrelizumab regelmäßig der IgG-Spiegel kontrolliert werden [70]. Dies ist insbesondere relevant, da die Infektionsrate unter CD20-Depletion bei MS-Patienten am höchsten zu sein scheint [71].
Bei einer 78 Jahre alten Patientin, mit niedrigen CD4+- und CD8+-Lymphozytenzahlen vor Therapiebeginn und vermuteter Immunseneszenz wurde eine PML unter Ocrelizumab ohne Vorexposition gegenüber anderen immunologischen Therapien gemeldet [72].
Bezüglich anderer infektiöser Komplikationen wurden einzelne Fallberichte von Patienten publiziert, die unter einer Ocrelizumab-Behandlung eine Herpes-simplex-Typ-2-Enzephalitis [73], eine Parvovirus-B19-Infektion [74] und in 2 Fällen eine Meningitis entwickelten. In einem Fall verlief die Meningitis aseptisch, bei der anderen konnte eine vermutete Borreliengenese nicht verifiziert werden [75]. Ein Fallbericht legt nahe, dass Ocrelizumab zwar B‑Zellen depletiert, jedoch nicht die T‑Zell-Immunantwort auf Varizella Zoster beeinflusst [76].
Kürzlich wurde unter Ocrelizumab das Auftreten einer Endokarditis berichtet [77].
Die Therapie mit Ocrelizumab ist wahrscheinlich nicht mit einem erhöhten Risiko einer Tuberkuloseinfektion assoziiert [78].
Es ist zu beachten, dass es bei RMS-Patienten unter Ocrelizumab im Vergleich zu Interferon‑β1a mehr Infektionen mit Varizella-Zoster-Viren (n = 17 vs. 8 [25]) auftraten und bei PPMS-Patienten unter Ocrelizumab im Vergleich zu Placebo mehr Episoden mit oralem Herpes simplex (2,3 % vs. 0,4 %; [25]). In der Zusammenschau sind regelmäßige Verlaufskontrollen bei MS-Patienten unter CD20-depletierenden Therapien sinnvoll [79].
Obwohl sowohl eine retrospektive Analyse von Patienten mit neuroimmunologischen Erkrankungen unter 7‑jähriger Rituximab-Therapie [80] als auch eine Metaanalyse von Patienten mit rheumatoider Arthritis [81] ein günstiges Sicherheitsprofil bestätigen konnten, ist der Einfluss einer Langzeit-B-Zell-Depletion auf Malignom- und Infektionsrisiken nicht vollständig charakterisiert [82, 83]. Für Ocrelizumab liegen aktuell aus klinischen Studien Daten von Patienten mit bis zu 6 Jahren Exposition vor, mit einer Gesamtexposition von über 14.000 Patientenjahren (Stand Mai 2019; [55]).
Schwangerschaften unter CD20-gerichteter Therapie
Es zeigten sich keine klaren Sicherheitssignale (i.e. Spontanaborte oder kindliche Fehlbildungen) bei Schwangeren, die in den ersten 6 Schwangerschaftsmonaten eine CD20-Depletion mittels Rituximab erfahren haben [84]. Die Auswertung der bisher dokumentierten Schwangerschaften mit Ocrelizumab-Exposition ergab keine Auffälligkeiten [85]. Weitere Daten werden im Ocrelizumab-Schwangerschaftsregister erhoben [86].
Die Datenlage bezüglich intrathekaler Applikation von CD20-depletierenden monoklonalen Antikörpern ist gering [87]. Ferner ist hervorzuheben, dass es bei RMS-Patienten unter Ocrelizumab im Vergleich zu Interferon‑β1a zu mehr Varizella-Zoster-Infektionen (17 vs. 8 [25]) und bei PPMS-Patienten unter Ocrelizumab im Vergleich zu Placebo zu mehr oralen Herpesinfektionen (2,3 % vs. 0,4 %; [26]) gekommen ist.
Pathomechanistische Aspekte der Rolle von B-Zellen in der MS
Die rasch einsetzenden tiefgreifenden Effekte einer CD20-B-Zell-gerichteten Therapie haben zu einer Neubewertung der humoralen Immunantwort bei MS geführt. Nach ursprünglicher Vorstellung würde eine B‑Zell-Depletion vermutlich wesentlich über eine Verminderung der Produktion von Autoantikörpern wirken.
Die Wirkungsweise von CD20-Depletion bei MS und den autoimmunen Tiermodellen ist allerdings bisher nicht vollständig verstanden [88]. Die aktuelle Datenlage hinsichtlich der B‑Zell-Rolle bei MS wurde rezent mehrfach zusammengefasst [7, 14, 89–92] und die Interaktion von B‑ und T‑Zellen diskutiert [93]. Die Effektivität der B‑Zell-Depletion bei MS unterstützt die Hypothese, dass mit Epstein-Barr-Viren latent infizierte B‑Zellen eine wichtige Rolle bei der Pathogenese der MS spielen könnten [94, 95]. Aus tierexperimentellen Studien gibt es Hinweise, dass eine CD20-Depletion die Aktivierung von Mikrogliazellen und die Rekrutierung von T‑Lymphozyten reduziert [96]. Die pathogene CD40-vermittelte NF-κB-Aktivierung in B‑Zellen ist bei MS-Patienten verstärkt [97]. Zusätzlich werden B‑Zell Aggregate in lymphfollikelähnlichen Strukturen im Subarachnoidalraum, insbesondere bei Patienten mit sekundär chronisch-progredienter Verlaufsform, als erkrankungsrelevant diskutiert [98, 99]. Eine tierexperimentelle Studie konnte diesbezüglich zeigen, dass eine intrathekale Gabe von Anti-CD20-Antikörpern zu einer relevanten Depletion von B‑Zellen in etablierten ZNS-Läsionen führt [100]. Des Weiteren gibt es Hinweise dafür, dass es bei MS-Patienten einen Transit zwischen dem ZNS und der Peripherie von insbesondere immunaktiven B‑Zellen gibt, die einen Immunglobulinklassenwechsel erfahren haben [101], und dass B‑Zellen von MS-Patienten vermehrt Antigene präsentieren [102]. Diese Immunzellen müssen dabei mittels komplexer, mehrschrittiger Kaskaden Immunbarrieren überwinden [103], um dort klonal zu expandieren [104] und spezifische Immunglobuline zu produzieren [105] und Lymphangiogenese zu fördern [106]. Die Reifung der ZNS-ständigen B‑Zellen bei MS-Patienten erfolgt nach aktuellem Wissenstand in den drainierenden zervikalen Lymphknoten [107]. B‑Zellen von RRMS-Patienten sind in der Lage, komplement- und immunglobulinunabhängige Faktoren zu produzieren, die in vitro toxisch für Neurone und Oligodendrozyten sind [108]. Bei Patienten mit Myelitis als klinisch isoliertem Syndrom, die sich somit im Anfangsstadium einer möglichen MS befinden, konnte sowohl eine expandierte und mutierte Plasmablastensubgruppe [109] als auch eine bestimmte Verteilung von Interleukin-6/-10-produzierenden B‑Lymphozyten differenziert werden [110], was im Einklang mit dem aktuellen Verständnis über die Rolle der Zytokine bei autoimmunen Erkrankungen steht [111]. Somit scheint es, dass B‑Zellen sowohl zu Beginn als auch bei der Aufrechterhaltung der MS-Erkrankung eine wichtige Rolle spielen [112]. Wichtig dabei scheint die Regulierung des „Macrophage-migration-inhibitory-factor“(MIF)-Signalwegs zu sein, da ein supprimiertes CD74 und ein hochreguliertes CXCR4 mit einer frühen MS-Diagnose assoziiert sind [113]. Ferner wird diskutiert, dass nicht alle B‑Lymphozyten pathophysiologisch relevant sind, sondern insbesondere eine bestimmte Subgruppe, und zwar „Granulocyte-macrophage-colony-stimulating-factor“(GM-CSF)-exprimierende humane B‑Gedächtnis-Zellen [114], bzw. verschiedene B‑Lymphozyten-Subgruppen im Liquor entscheidend sind für den Erkrankungsphänotyp [115]. Basierend auf den Erkenntnissen über die phasenabhängige Oberflächenexpression von Differenzierungsantigenen in der B‑Zell-Reifung und der Diskussion einer aktuellen Phase-2/3-Studie von Inebilizumab, ein gegen CD19 gerichteter monoklonaler Antikörper, bei NMOSD [116] muss zwischen CD20- und CD19-Depletion unterschieden werden (Abb. 1): CD20 wird nicht auf der Oberfläche von Plasmazellen exprimiert, wohingegen CD19 auf der Mehrheit von Plasmazellen in sekundären lymphatischen Organen (z. B. Milz, Tonsillen), auf allen Plasmazellen im Blut und bei mehr als 50 % der Plasmazellen im Knochenmark nachgewiesen werden kann [117, 118]. Zusätzlich muss beachtet werden, dass CD19 nur von Plasmazellen, CD20 jedoch auch von einer Untergruppe CD-positiver T‑Zellen exprimiert wird [119]. In der Zusammenschau sind B‑Zellen allerdings nicht alleinig für die Entstehung und Aufrechterhaltung der MS verantwortlich: Es gibt Hinweise dafür, dass (Gedächtnis‑)B-Zellen autoreaktive, autoproliferative [120], proinflammatorische T‑Zellen (u. a. TH17-Zellen) induzieren, die wiederum eine entscheidende Rolle in den Entzündungskaskaden im ZNS spielen [121–123], und dass „polymorphonuclear myeloid-derived suppressor cells“ (PMN-MDSCs) selektiv die Akkumulierung von B‑Zellen im ZNS kontrollieren [124]. Nichtsdestotrotz war es bis heute nicht möglich, ein bestimmtes Zielantigen dieser Immunzellen zu identifizieren [125]. Zusätzlich ist bislang unklar, welche Rolle die kleine Subgruppe der CD20-positiven T‑Zellen bei der MS spielt [126]. So zeigte eine Phase-2a-Studie mit dem CD20-depletierenden Antikörper Ublituximab eine Veränderung des T‑Zell-Profils bei MS-Patienten unter Therapie [127].
Ocrelizumab: Indikationen, praktische Aspekte und Therapiehinweise
Die Indikationen von Ocrelizumab sind in Tab. 4, das Anwendungsschema in Tab. 5 und der detaillierte Infusionsablauf im Handbuch Ocrelizumab des Kompetenznetzes Multiple Sklerose [128] dargestellt: Hinsichtlich der Indikationen ist zu beachten, dass Ocrelizumab auch für die Behandlung einer sekundär chronisch-progredienten MS zugelassen ist, sofern weiterhin aufgelagerte Schübe vorliegen. Diese relativ breite Zulassung liegt ebenfalls für die hochaktive Therapie mit Cladribin, jedoch formal nicht für Fingolimod, Natalizumab und Alemtuzumab vor.
Je nach Vortherapie sollte vor Ocrelizumab-Therapiebeginn ein Sicherheitsabstand zur Vortherapie eingehalten werden. Nach Interferon‑β, Dimethylfumarat oder Glatirameracetat sollten mögliche Effekte auf Laborwerte abgeklungen sein, Teriflunomid sollte ausgewaschen und nicht mehr im Blut nachweisbar sein, bei Fingolimod beträgt der Sicherheitsabstand mindestens 4 Wochen, bei Natalizumab 6 bis 8 Wochen, bei Cladribin 6 Monate und bei Alemtuzumab 6 bis 12 Monate. Laborchemische Untersuchungen vor Ocrelizumab-Infusion sind erforderlich. Wichtig ist, dass in Einzelfällen ggf. von oben genannten Sicherheitsabständen abgewichen werden muss, basierend auf einer individuellen Risiko-Nutzen-Bewertung. Es wird ein Differenzialblutbild, ein IgG-Spiegel im Serum, CRP, Urinstatus und ggf. ein Schwangerschaftstest empfohlen. Infektiologisch sollte vor Ocrelizumab-Therapiebeginn eine Hepatitis-B/C-, HIV-, VZV-Serologie sowie bez. Tuberkulose ein Interferon-γ-Freisetzungstest (z. B. Quantiferon) erfolgen. Patienten mit ausgeheilter, nicht mehr aktiver Hepatitis B können ggf. Ocrelizumab erhalten, jedoch ist analog zu dem Vorgehen bei Rituximab eine Vorstellung in einem Leberzentrum zur Diskussion einer prophylaktischen Therapie mit Tenofovir und engmaschige Kontrollen der HBV-DNA im Blut sinnvoll [129–131]. Alle 6 Monate sollte unter Therapie das Differenzialblutbild und ein IgG-Serumspiegel kontrolliert werden. Ocrelizumab kann zu einem erniedrigten IgG-Spiegel führen [132]. Bei erhöhter Infektanfälligkeit und erniedrigtem IgG-Serumspiegel kann eine intravenöse IgG-Substitution nach internistischer Maßgabe erfolgen. Immunphänotypisierungen vor und während der Therapie sind nicht obligat, sondern fakultativ.
Vor Ocrelizumab-Infusion sollte eine Vortherapie mit 100 mg Methylprednisolon intravenös und ein Antihistaminikum verabreicht werden, um eine mögliche Infusionsreaktion zu minimieren. Das medizinische Personal, das Ocrelizumab verabreicht, sollte für die Behandlung schwerer anaphylaktischer Reaktionen geschult sein, ferner ist ein uneingeschränkter Zugang zu intensivmedizinscher Versorgung in der eigenen oder nächstliegenden Einrichtung sinnvoll. Patienten sollten nach Ocrelizumab-Infusion für mindestens 1 h nachbeobachtet werden. Eine klinisch-neurologische Behandlungskontrolle ist nach dem ersten Behandlungsmonat und im Verlauf einmal im Quartal sinnvoll. Ferner sollte nach einem Jahr Therapie eine kritische Prüfung der Therapieindikation nicht nur hinsichtlich des Effekts auf den Krankheitsverlauf, sondern auch hinsichtlich Nebenwirkungen und paraklinischer Befunde erfolgen. Eine MRT des Schädels ist 3 Monate („baseline“ nach Einsetzen der therapeutischen Wirkung) nach Therapiebeginn und im Verlauf einmal jährlich sinnvoll. Auf eine Kontrastmittelgabe kann dabei verzichtet werden [133]. Sollte es notwendig sein, die Ocrelizumab-Therapie umzustellen, ist eine 6‑ bis 12-monatige Therapiepause sinnvoll, ferner sollte eine Zytopenie möglichst abgeklungen sein.
Sollte es bei einer schubförmigen MS zu Krankheitsaktivität unter Ocrelizumab kommen, kann eine Umstellung auf eine andere hochaktive Therapie sinnvoll sein. Der Einsatz von Ocrelizumab ist bei PPMS-Patienten im frühen Krankheitsstadium mit entzündlicher Aktivität sinnvoll [134]. Da Ocrelizumab das einzige zur Behandlung der primär chronisch-progredienten MS zugelassene Medikament ist, kann bei PPMS-Progression unter Ocrelizumab mangels zugelassener Therapiealternativen keine Empfehlung zur Umstellung erfolgen, sondern die Therapie wird in den meisten Fällen fortgeführt werden. Patienten, die bereits vor Zulassung von Ocrelizumab auf Rituximab eingestellt sind und keine Krankheitsaktivität und Nebenwirkungen zeigen, können aus medizinischer Sicht die Rituximab-Therapie fortsetzen. Da dies „off label“ ist, empfiehlt sich die vorherige Einholung einer Kostenübernahmeerklärung der Krankenversicherung.
Hinsichtlich viraler Epidemien (wie z. B. aktuell SARS-CoV-2/COVID19) besteht laut einer Stellungnahme der Deutschen Multiple Sklerose Gesellschaft (DMSG) ein erhöhtes Risiko, unter Ocrelizumab zu erkranken [135]. Da bei Ocrelizumab das Infektionsrisiko unmittelbar nach Infusion am größten ist, kann eine Streckung des Intervalls individuell diskutiert werden [136] und die Indikation zur Ersteinstellung ist kritisch zu stellen. Laut Kompetenznetz Multiple Sklerose (KKNMS) besteht bei Patienten unter Ocrelizumab insbesondere in den ersten Wochen nach Anwendung eine größere Infektionsgefahr, daher sollte in dieser Zeit besonders sorgfältig auf die Vermeidung von Infektionserkrankungen geachtet werden. Bei älteren Patienten oder Patienten mit begleitenden Herz- oder Lungenerkrankungen sollte die Einleitung einer Ocrelizumab-Therapie ggf. verschoben werden [137]. Die Schweizerische Multiple Sklerose Gesellschaft empfiehlt Ocrelizumab-Patienten in der Schweiz, die in einem Gebiet mit vielen SARS-CoV-2-Fällen leben, sich so weit wie möglich zu isolieren, um ihr Infektionsrisiko zu verringern, und den Beginn einer Ocrelizumab-Therapie sorgsam abzuwägen [138]. Die Multiple Sclerosis International Federation rät Patienten unter Therapie, sich bei Verdacht auf, oder bei einer bestätigten Infektion mit SARS-CoV‑2 nach vorheriger telefonischer Absprache, beim behandelnden Arzt vorzustellen. Das Risiko einer schwerwiegenden SARS-CoV-2-Infektion wird unter Glatirameracetat, Interferon‑β oder Natalizumab als am geringsten eingeschätzt [139]. Eine verzögerte Ocrelizumab-Gabe kann auch aus Sicht des Multiple Sclerosis Trust und der Association of British Neurologists erwogen werden, um ein Infektionsrisiko zu reduzieren [140, 141].
Um Infektionskrankheiten vorzubeugen, sollten alle Patienten, die Ocrelizumab bekommen, vor Erstgabe nach den Empfehlungen der Ständigen Impfkommission (STIKO) für immunsupprimierte Patienten inkl. jährlicher Grippeschutz- und Pneumokokkenimpfung vakziniert werden. Zwischen Impfung und Ocrelizumab-Infusion sollte ein Abstand von 6 Wochen liegen, Lebendimpfungen sind unter Ocrelizumab kontraindiziert.
Ocrelizumab darf während der Schwangerschaft und Stillzeit nicht angewendet werden, weswegen eine wirksame Empfängnisverhütung unter Ocrelizumab für mindestens 12 Monate nach jeder Ocrelizumab-Gabe von der EMA empfohlen wird. Neue Daten legen nahe, dass dieser Sicherheitsabstand in Zukunft möglicherweise verkürzt werden kann [85].
Schlussfolgerung
In der Zusammenschau hat man bei der Behandlung der Multiplen Sklerose in den letzten Jahren viel erreicht; die Zulassung von Ocrelizumab war ein weiterer wichtiger Schritt in die Richtung einer effektiven Behandlung von MS-Patienten. Dieser humanisierte anti-CD20-monoklonale Antikörper, zweimal jährlich intravenös verabreicht, zählt zu den Hochwirksamkeitsmedikamenten zur Behandlung der schubförmigen MS mit einem bislang guten Sicherheitsprofil bei halbjährlicher Anwendung.
Hervorzuheben ist, dass Ocrelizumab das erste Medikament mit Wirksamkeit bei PPMS ist. Wichtig, wie bei jeder immunmodulierenden Substanz, sind eine rigorose Pharmakovigilanz, die Analyse von Registerdaten und die Ergebnisse von Phase-4-Studien (Beispiel die in Deutschland aktuell rekrutierende CONFIDENCE-Studie [64]). Weitere mechanistische Studien zur Aufklärung der Wirkweise der CD20 B‑Zell-Depletion sind angezeigt.
Funding
Open Access funding provided by Projekt DEAL.
Einhaltung ethischer Richtlinien
Interessenkonflikt
J. Graf hat Kongress- und Fortbildungsunterstützung von Biogen, Merck Serono, Sanofi-Genzyme, Grifols sowie ein Forschungsstipendium von der Deutschen Forschungsgemeinschaft (Projektnummer 438899010) erhalten. P. Albrecht erhielt Forschungsförderung durch den Europäischen Fonds für Regionale Entwicklung (EFRE, FKZ 0801739) sowie Allergan, Biogen, Celgene, Ipsen, Merz, Merck, Novartis, Roche, Sanofi-Genzyme sowie Honorare und Reisekostenunterstützung durch Allergan, Bayer Healthcare, Biogen, Celgene, Ipsen, Merck, Merz, Novartis, Roche, Sanofi-Genzyme und Teva. N. Goebels hat Forschungsförderung, Reisekostenunterstützung und/oder Honorare erhalten von BMBF, HHU-Forschungskommission, Progressive MS Alliance, Wellcome Trust, Biogen, Novartis, Roche und Sanofi-Genzyme. O. Aktas erhielt Forschungsförderung durch das Bundesministerium für Bildung und Forschung (BMBF, NationNMO im KKNMS, FKZ 01GI1602B) sowie Bayer Healthcare, Biogen, Novartis, Sanofi-Genzyme und Teva sowie Honorare und Reisekostenunterstützung durch Almirall, Bayer Healthcare, Biogen, Celgene, Medimmune, Merck, Novartis, Roche, Sanofi-Genzyme, VielaBio und Teva. H.-P. Hartung hat Honorare erhalten für Tätigkeit in Steering und Data Monitoring Committees von Bayer Healthcare, Biogen, Celgene Receptos, Geneuro, Medimmune, Merck, Novartis, Roche, Sanofi Genzyme, Teva, TG Therapeutics, VielaBio.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Thompson AJ, Baranzini SE, Geurts J, Hemmer B, Ciccarelli O. Multiple sclerosis. Lancet. 2018;391:1622–1636. doi: 10.1016/S0140-6736(18)30481-1.. [DOI] [PubMed] [Google Scholar]
- 2.Lublin FD, Reingold SC, Cohen JA, Cutter GR, Sørensen PS, Thompson AJ, et al. Defining the clinical course of multiple sclerosis: the 2013 revisions. Neurology. 2014;83:278–286. doi: 10.1212/WNL.0000000000000560. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Lublin FD. New multiple sclerosis phenotypic classification. Eur Neurol. 2014;72(Suppl 1):1–5. doi: 10.1159/000367614. [DOI] [PubMed] [Google Scholar]
- 4.Kinzel S, Weber MS. B cell-directed therapeutics in multiple sclerosis: rationale and clinical evidence. CNS Drugs. 2016;30:1137–1148. doi: 10.1007/s40263-016-0396-6. [DOI] [PubMed] [Google Scholar]
- 5.Gingele S, Skripuletz T, Jacobs R. Role of CD20+ T cells in multiple sclerosis: implications for treatment with ocrelizumab. Neural Regen Res. 2020;15:663–664. doi: 10.4103/1673-5374.266913. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Beers SA, Chan CHT, French RR, Cragg MS, Glennie MJ. CD20 as a target for therapeutic type I and II monoclonal antibodies. Semin Hematol. 2010;47:107–114. doi: 10.1053/j.seminhematol.2010.01.001. [DOI] [PubMed] [Google Scholar]
- 7.Greenfield AL, Hauser SL. B-cell therapy for multiple sclerosis: entering an era. Ann Neurol. 2018;83:13–26. doi: 10.1002/ana.25119. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Butler LA, Tam CS, Seymour JF. Dancing partners at the ball: rational selection of next generation anti-CD20 antibodies for combination therapy of chronic lymphocytic leukemia in the novel agents era. Blood Rev. 2017;31:318–327. doi: 10.1016/j.blre.2017.05.002. [DOI] [PubMed] [Google Scholar]
- 9.Montalban X, Arnold DL, Weber MS, Staikov I, Piasecka-Stryczynska K, Willmer J, et al. Placebo-controlled trial of an oral BTK inhibitor in multiple sclerosis. N Engl J Med. 2019;380:2406–2417. doi: 10.1056/NEJMoa1901981. [DOI] [PubMed] [Google Scholar]
- 10.Bar-Or A, Grove RA, Austin DJ, Tolson JM, VanMeter SA, Lewis EW, et al. Subcutaneous ofatumumab in patients with relapsing-remitting multiple sclerosis: The MIRROR study. Neurology. 2018;90:e1805–e1814. doi: 10.1212/WNL.0000000000005516. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Hauser SL, Bar-Or A, Cohen J, Comi G, Correale J, Coyle PK, Cross AH, de Seze J, Montalban X, Selmaj K, Wiendl H, Goodyear A, Häring DA, Kerloeguen C, Tomic D, Willi R, Ramanathan K, Merschhemke M, Kappos L (2019) Efficacy and safety of ofatumumab versus teriflunomide in relapsing multiple sclerosis: results of the phase 3 ASCLEPIOS I and II trials. https://onlinelibrary.ectrims-congress.eu/ectrims/2019/stockholm/279581/stephen.hauser.efficacy.and.safety.of.ofatumumab.versus.teriflunomide.in.html. Zugegriffen: 30.01.2020
- 12.Svenningsson A, Bergman J, Dring A, Vågberg M, Birgander R, Lindqvist T, et al. Rapid depletion of B lymphocytes by ultra-low-dose rituximab delivered intrathecally. Neurol Neuroimmunol Neuroinflamm. 2015;2:e79. doi: 10.1212/NXI.0000000000000079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Komori M, Lin YC, Cortese I, Blake A, Ohayon J, Cherup J, et al. Insufficient disease inhibition by intrathecal rituximab in progressive multiple sclerosis. Ann Clin Transl Neurol. 2016;3:166–179. doi: 10.1002/acn3.293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Li R, Patterson KR, Bar-Or A. Reassessing B cell contributions in multiple sclerosis. Nat Immunol. 2018;19:696–707. doi: 10.1038/s41590-018-0135-x. [DOI] [PubMed] [Google Scholar]
- 15.Monson NL, Cravens PD, Frohman EM, Hawker K, Racke MK. Effect of rituximab on the peripheral blood and cerebrospinal fluid B cells in patients with primary progressive multiple sclerosis. Arch Neurol. 2005;62:258–264. doi: 10.1001/archneur.62.2.258. [DOI] [PubMed] [Google Scholar]
- 16.Cross AH, Stark JL, Lauber J, Ramsbottom MJ, Lyons J-A. Rituximab reduces B cells and T cells in cerebrospinal fluid of multiple sclerosis patients. J Neuroimmunol. 2006;180:63–70. doi: 10.1016/j.jneuroim.2006.06.029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Stüve O, Cepok S, Elias B, Saleh A, Hartung H-P, Hemmer B, Kieseier BC. Clinical stabilization and effective B-lymphocyte depletion in the cerebrospinal fluid and peripheral blood of a patient with fulminant relapsing-remitting multiple sclerosis. Arch Neurol. 2005;62:1620–1623. doi: 10.1001/archneur.62.10.1620. [DOI] [PubMed] [Google Scholar]
- 18.Leussink VI, Lehmann HC, Meyer zu Hörste G, Hartung H-P, Stüve O, Kieseier BC. Rituximab induces clinical stabilization in a patient with fulminant multiple sclerosis not responding to natalizumab. Evidence for disease heterogeneity. J Neurol. 2008;255:1436–1438. doi: 10.1007/s00415-008-0956-x. [DOI] [PubMed] [Google Scholar]
- 19.Stüve O, Leussink VI, Fröhlich R, Hemmer B, Hartung H-P, Menge T, Kieseier BC. Long-term B-lymphocyte depletion with rituximab in patients with relapsing-remitting multiple sclerosis. Arch Neurol. 2009;66:259–261. doi: 10.1001/archneurol.2008.551. [DOI] [PubMed] [Google Scholar]
- 20.Bar-Or A, Calabresi PAJ, Arnold D, Arnlod D, Markowitz C, Shafer S, et al. Rituximab in relapsing-remitting multiple sclerosis: A 72-week, open-label, phase I trial. Ann Neurol. 2008;63:395–400. doi: 10.1002/ana.21363. [DOI] [PubMed] [Google Scholar]
- 21.Hauser SL, Waubant E, Arnold DL, Vollmer T, Antel J, Fox RJ, et al. B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. N Engl J Med. 2008;358:676–688. doi: 10.1056/NEJMoa0706383. [DOI] [PubMed] [Google Scholar]
- 22.Hawker K, O’Connor P, Freedman MS, Calabresi PA, Antel J, Simon J, et al. Rituximab in patients with primary progressive multiple sclerosis: Results of a randomized double-blind placebo-controlled multicenter trial. Ann Neurol. 2009;66:460–471. doi: 10.1002/ana.21867. [DOI] [PubMed] [Google Scholar]
- 23.Hartung H-P, Aktas O. Bleak prospects for primary progressive multiple sclerosis therapy: downs and downs, but a glimmer of hope. Ann Neurol. 2009;66:429–432. doi: 10.1002/ana.21880. [DOI] [PubMed] [Google Scholar]
- 24.Kappos L, Li D, Calabresi PA, O’Connor P, Bar-Or A, Barkhof F, et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet. 2011;378:1779–1787. doi: 10.1016/S0140-6736(11)61649-8. [DOI] [PubMed] [Google Scholar]
- 25.Hauser SL, Bar-Or A, Comi G, Giovannoni G, Hartung H-P, Hemmer B, et al. Ocrelizumab versus interferon beta-1a in relapsing multiple sclerosis. N Engl J Med. 2017;376:221–234. doi: 10.1056/NEJMoa1601277. [DOI] [PubMed] [Google Scholar]
- 26.Montalban X, Hauser SL, Kappos L, Arnold DL, Bar-Or A, Comi G, et al. Ocrelizumab versus placebo in primary progressive multiple sclerosis. N Engl J Med. 2017;376:209–220. doi: 10.1056/NEJMoa1606468. [DOI] [PubMed] [Google Scholar]
- 27.Fox EJ, Markowitz C, Applebee A, Montalban X, Wolinsky JS, Belachew S, et al. Ocrelizumab reduces progression of upper extremity impairment in patients with primary progressive multiple sclerosis: findings from the phase III randomized ORATORIO trial. Mult Scler. 2018;24:1862–1870. doi: 10.1177/1352458518808189. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Kappos L, Wolinsky JS, Giovannoni G, Arnold DL, Wang Q, Bernasconi C, Model F, Koendgen H, Manfrini M, Belachew S, Hauser SL. Progression independent of relapse activity in patients with typical relapsing multiple sclerosis: pooled analysis of 2 randomized clinical trials. JAMA Neurol. 2020 doi: 10.1001/jamaneurol.2020.1568. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Nosadini M, Alper G, Riney CJ, Benson LA, Mohammad SS, Ramanathan S, et al. Rituximab monitoring and redosing in pediatric neuromyelitis optica spectrum disorder. Neurol Neuroimmunol Neuroinflamm. 2016;3:e188. doi: 10.1212/NXI.0000000000000188. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.European Medical Agency (EMA) (2018) Ocrelizumab: Zusammenfassung der Merkmale des Arzneimittels. https://www.ema.europa.eu/en/documents/product-information/ocrevus-epar-product-information_de.pdf. Zugegriffen: 01.02.2020
- 31.Havrdová E, Arnold DL, Bar-Or A, Comi G, Hartung H-P, Kappos L, et al. No evidence of disease activity (NEDA) analysis by epochs in patients with relapsing multiple sclerosis treated with ocrelizumab vs interferon beta-1a. Mult Scler J Exp Transl Clin. 2018;4:2055217318760642. doi: 10.1177/2055217318760642. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.McCool R, Wilson K, Arber M, Fleetwood K, Toupin S, Thom H, et al. Systematic review and network meta-analysis comparing ocrelizumab with other treatments for relapsing multiple sclerosis. Mult Scler Relat Disord. 2019;29:55–61. doi: 10.1016/j.msard.2018.12.040. [DOI] [PubMed] [Google Scholar]
- 33.Alcalá C, Gascón F, Pérez-Miralles F, Gil-Perotín S, Navarré A, Boscá I, et al. Efficacy and safety of rituximab in relapsing and progressive multiple sclerosis: a hospital-based study. J Neurol. 2018;265:1690–1697. doi: 10.1007/s00415-018-8899-3. [DOI] [PubMed] [Google Scholar]
- 34.Durozard P, Maarouf A, Boutiere C, Ruet A, Brochet B, Vukusic S, et al. Efficacy of rituximab in refractory RRMS. Mult Scler. 2018 doi: 10.1177/1352458518772748. [DOI] [PubMed] [Google Scholar]
- 35.Naegelin Y, Naegelin P, von Felten S, Lorscheider J, Sonder J, Uitdehaag BMJ, et al. Association of Rituximab treatment with disability progression among patients with secondary progressive multiple sclerosis. JAMA Neurol. 2019 doi: 10.1001/jamaneurol.2018.4239. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Turner B, Cree BAC, Kappos L, Montalban X, Papeix C, Wolinsky JS, et al. Ocrelizumab efficacy in subgroups of patients with relapsing multiple sclerosis. J Neurol. 2019 doi: 10.1007/s00415-019-09248-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.D’Amico E, Zanghì A, Chisari CG, Lo Fermo S, Toscano S, Arena S, et al. Effectiveness and safety of Rituximab in demyelinating diseases spectrum: an Italian experience. Mult Scler Relat Disord. 2019;27:324–326. doi: 10.1016/j.msard.2018.09.041. [DOI] [PubMed] [Google Scholar]
- 38.Zecca C, Bovis F, Novi G, Capobianco M, Lanzillo R, Frau J, et al. Treatment of multiple sclerosis with rituximab: A multicentric Italian-Swiss experience. Mult Scler. 2019 doi: 10.1177/1352458519872889. [DOI] [PubMed] [Google Scholar]
- 39.Salzer J, Svenningsson R, Alping P, Novakova L, Björck A, Fink K, et al. Rituximab in multiple sclerosis: A retrospective observational study on safety and efficacy. Neurology. 2016;87:2074–2081. doi: 10.1212/WNL.0000000000003331. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Spelman T, Frisell T, Piehl F, Hillert J. Comparative effectiveness of rituximab relative to IFN-β or glatiramer acetate in relapsing-remitting MS from the Swedish MS registry. Mult Scler. 2018;24:1087–1095. doi: 10.1177/1352458517713668. [DOI] [PubMed] [Google Scholar]
- 41.Granqvist M, Boremalm M, Poorghobad A, Svenningsson A, Salzer J, Frisell T, Piehl F. Comparative effectiveness of rituximab and other initial treatment choices for multiple sclerosis. JAMA Neurol. 2018;75:320–327. doi: 10.1001/jamaneurol.2017.4011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Cree BA. Rituximab is an acceptable alternative to ocrelizumab for treating multiple sclerosis—commentary. Mult Scler. 2018;24:1161–1162. doi: 10.1177/1352458518760717. [DOI] [PubMed] [Google Scholar]
- 43.Piehl F, Hillert J. Rituximab is an acceptable alternative to ocrelizumab for treating multiple sclerosis—Yes. Mult Scler. 2018;24:1157–1159. doi: 10.1177/1352458518757930. [DOI] [PubMed] [Google Scholar]
- 44.Wallin MT. Rituximab is an acceptable alternative to ocrelizumab for treating multiple sclerosis—No. Mult Scler. 2018;24:1159–1161. doi: 10.1177/1352458518757931. [DOI] [PubMed] [Google Scholar]
- 45.Graf J, Aktas O, Rejdak K, Hartung H-P. Monoclonal antibodies for multiple sclerosis: an update. BioDrugs. 2019;33:61–78. doi: 10.1007/s40259-018-0327-9. [DOI] [PubMed] [Google Scholar]
- 46.Ineichen BV, Moridi T, Granberg T, Piehl F. Rituximab treatment for multiple sclerosis. Mult Scler. 2019 doi: 10.1177/1352458519858604. [DOI] [PubMed] [Google Scholar]
- 47.Wolinsky JS, Montalban X, Hauser SL, Giovannoni G, Vermersch P, Bernasconi C, et al. Evaluation of no evidence of progression or active disease (NEPAD) in patients with primary progressive multiple sclerosis in the ORATORIO trial. Ann Neurol. 2018 doi: 10.1002/ana.25313. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Barkhof F, Kappos L, Wolinsky JS, Li DKB, Bar-Or A, Hartung H-P, et al. Onset of clinical and MRI efficacy of ocrelizumab in relapsing multiple sclerosis. Neurology. 2019 doi: 10.1212/WNL.0000000000008189. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.MacMillan EL, Schubert JJ, Vavasour IM, Tam R, Rauscher A, Taylor C, et al. Magnetic resonance spectroscopy evidence for declining gliosis in MS patients treated with ocrelizumab versus interferon beta-1a. Mult Scler J Exp Transl Clin. 2019;5:2055217319879952. doi: 10.1177/2055217319879952. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Elliott C, Belachew S, Wolinsky JS, Hauser SL, Kappos L, Barkhof F, et al. Chronic white matter lesion activity predicts clinical progression in primary progressive multiple sclerosis. Brain. 2019;142:2787–2799. doi: 10.1093/brain/awz212. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Hauser S, Kappos L, Montalban X, Koendgen H, Li C, Marcillat C et al (2018) Safety of ocrelizumab in multiple sclerosis: updated analysis in patients with relapsing and primary progressive multiple sclerosis (S36.001). https://n.neurology.org/content/90/15_Supplement/S36.001. Zugegriffen: 10. Febr. 2020
- 52.Conte WL, Arndt N, Cipriani VP, Dellaria A, Javed A. Reduction in ocrelizumab-induced infusion reactions by a modified premedication protocol. Mult Scler Relat Disord. 2018;27:397–399. doi: 10.1016/j.msard.2018.11.027. [DOI] [PubMed] [Google Scholar]
- 53.Stahnke AM, Ocrelizumab HKM. A new B-cell therapy for relapsing remitting and primary progressive multiple sclerosis. Ann Pharmacother. 2018;52:473–483. doi: 10.1177/1060028017747635. [DOI] [PubMed] [Google Scholar]
- 54.Mayer L, Kappos L, Racke MK, Rammohan K, Traboulsee A, Hauser SL, et al. Ocrelizumab infusion experience in patients with relapsing and primary progressive multiple sclerosis: results from the phase 3 randomized OPERA I, OPERA II, and ORATORIO studies. Mult Scler Relat Disord. 2019 doi: 10.1016/j.msard.2019.01.044. [DOI] [PubMed] [Google Scholar]
- 55.Hauser SL, Kappos L, Montalban X, Hughes R, McNamara J, Pradhan A et al (2019) Safety of ocrelizumab in multiple sclerosis: updated analysis in patients with relapsing and primary progressive multiple sclerosis (P4.2-025). https://n.neurology.org/content/92/15_Supplement/P4.2-025. Zugegriffen: 10. Febr. 2020
- 56.Ciardi MR, Iannetta M, Zingaropoli MA, Salpini R, Aragri M, Annecca R, et al. Reactivation of hepatitis B virus with immune-escape mutations after ocrelizumab treatment for multiple sclerosis. Open Forum Infect Dis. 2019;6:ofy356. doi: 10.1093/ofid/ofy356. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Nicolini LA, Canepa P, Caligiuri P, Mikulska M, Novi G, Viscoli C, Uccelli A. Fulminant hepatitis associated with Echovirus 25 during treatment with ocrelizumab for multiple sclerosis. JAMA Neurol. 2019 doi: 10.1001/jamaneurol.2019.0522. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Graf J, Leussink VI, Dehmel T, Ringelstein M, Goebels N, Adams O, et al. Infectious risk stratification in multiple sclerosis patients receiving immunotherapy. Ann Clin Transl Neurol. 2017;4:909–914. doi: 10.1002/acn3.491. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Cohen BA. Late-onset neutropenia following ocrelizumab therapy for multiple sclerosis. Neurology. 2019;92:435–436. doi: 10.1212/WNL.0000000000006924. [DOI] [PubMed] [Google Scholar]
- 60.Zanetta C, Robotti M, Nozzolillo A, Sangalli F, Liberatore G, Nobile-Orazio E, et al. Late onset absolute neutropenia associated with ocrelizumab treatment in multiple sclerosis: A case report and review of the literature. J Neurol Sci. 2019;409:116603. doi: 10.1016/j.jns.2019.116603. [DOI] [PubMed] [Google Scholar]
- 61.Moreira Ferreira VF, Meredith D, Stankiewicz JM. Tumefactive demyelination in a patient with relapsing-remitting MS on ocrelizumab. Neurol Neuroimmunol Neuroinflamm. 2019 doi: 10.1212/NXI.0000000000000589. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Multiple Sclerosis Association of America (2017) First case of PML with Ocrevus is reported—MSAA: the multiple sclerosis association of America. https://mymsaa.org/news/first-case-of-pml-with-ocrevus-is-reported/. Zugegriffen: 5. Apr. 2019
- 63.Clifford DB, Gass A, Richert N, Tornatore C, Vermersch P, Hughes R, Koendgen H, Gold R (2019) Cases reported as progressive multifocal leukoencephalopathy in Ocrelizumab-treated patients with multiple sclerosis. https://onlinelibrary.ectrims-congress.eu/ectrims/2019/stockholm/279330/david.b.clifford.cases.reported.as.progressive.multifocal.leukoencephalopathy.html?f=listing%3D0%2Abrowseby%3D8%2Asortby%3D1%2Asearch%3Docrelizumab%2Bpml. Zugegriffen: 10.03.2020
- 64.Dirks P, Zingler V, Leemhuis J, Berthold H, Hieke-Schulz S, Wormser D, Ziemssen T. Design of a non-interventional post-marketing study to assess the long-term safety and effectiveness of ocrelizumab in German real world multiple sclerosis cohorts—the CONFIDENCE study protocol. BMC Neurol. 2020;20:95. doi: 10.1186/s12883-020-01667-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Ziemssen T, Berthold H, Dirks P, Evershed J, Gunzenhauser K, Leemhuis J Integration of ocrelizumab safety data from the German study CONFIDENCE into the global post-marketing safety studies MANUSCRIPT and VERISMO. 18.03.2020. https://onlinelibrary.ectrims-congress.eu/ectrims/2018/ectrims-2018/229464/tjalf.ziemssen.integration.of.ocrelizumab.safety.data.from.the.german.study.html. Zugegriffen: 18. März 2020
- 66.Focosi D, Tuccori M, Maggi F. Progressive multifocal leukoencephalopathy and anti-CD20 monoclonal antibodies: what do we know after 20 years of rituximab. Rev Med Virol. 2019;29:e2077. doi: 10.1002/rmv.2077. [DOI] [PubMed] [Google Scholar]
- 67.Rommer PS, Dörner T, Freivogel K, Haas J, Kieseier BC, Kümpfel T, et al. Safety and clinical outcomes of rituximab treatment in patients with multiple sclerosis and neuromyelitis Optica: experience from a national Online registry (GRAID) J Neuroimmune Pharmacol. 2016;11:1–8. doi: 10.1007/s11481-015-9646-5. [DOI] [PubMed] [Google Scholar]
- 68.Tallantyre EC, Whittam DH, Jolles S, Paling D, Constantinesecu C, Robertson NP, Jacob A. Secondary antibody deficiency: a complication of anti-CD20 therapy for neuroinflammation. J Neurol. 2018;265:1115–1122. doi: 10.1007/s00415-018-8812-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Christou EAA, Giardino G, Worth A, Ladomenou F. Risk factors predisposing to the development of hypogammaglobulinemia and infections post-Rituximab. Int Rev Immunol. 2017;36:352–359. doi: 10.1080/08830185.2017.1346092. [DOI] [PubMed] [Google Scholar]
- 70.Hallberg S, Boremalm M, Evertsson B, Lillvall E, Johansson F, Lycke J et al (2019) Risk of hypogammaglobulinemia in long-term treatment with rituximab in multiple sclerosis. https://onlinelibrary.ectrims-congress.eu/ectrims/2019/stockholm/279398/susanna.hallberg.risk.of.hypogammaglobulinemia.in.long-term.treatment.with.html. Zugegriffen: 23. März 2020
- 71.Luna G, Alping P, Burman J, Fink K, Fogdell-Hahn A, Gunnarsson M, et al. Infection risks among patients with multiple sclerosis treated with fingolimod, natalizumab, rituximab, and Injectable therapies. JAMA Neurol. 2019 doi: 10.1001/jamaneurol.2019.3365. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Roche Pharma AG . Important Information: Safety Update Ocrelizumab. 2019. [Google Scholar]
- 73.Dudek MIR, Thies K, Kammenhuber S, Bösel J, Rösche J. HSV-2-encephalitis in a patient with multiple sclerosis treated with ocrelizumab. J Neurol. 2019 doi: 10.1007/s00415-019-09391-0. [DOI] [PubMed] [Google Scholar]
- 74.Lattanzi S, Carlini G, Acciarri MC, Danni M, Silvestrini M. Parvovirus B19 infection in a patient with multiple sclerosis treated with ocrelizumab. Acta Neurol Belg. 2019 doi: 10.1007/s13760-019-01227-y. [DOI] [PubMed] [Google Scholar]
- 75.Theriault M, Solomon AJ. Two cases of meningitis associated with ocrelizumab therapy. Mult Scler Relat Disord. 2019;38:101866. doi: 10.1016/j.msard.2019.101866. [DOI] [PubMed] [Google Scholar]
- 76.Novi G, Ivaldi F, Sbragia E, Mikulska M, Pesce G, Inglese M, et al. Ocrelizumab does not impair B- and T-cell responses to primary VZV infection in a patient with MS. Neurol Neuroimmunol Neuroinflamm. 2020 doi: 10.1212/NXI.0000000000000695. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Faissner S, Schwake C, Gotzmann M, Mügge A, Schmidt S, Gold R. Endocarditis following ocrelizumab in relapsing-remitting MS. Neurol Neuroimmunol Neuroinflamm. 2020 doi: 10.1212/NXI.0000000000000680. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Epstein DJ, Dunn J, Deresinski S. Infectious complications of multiple sclerosis therapies: implications for screening, prophylaxis, and management. Open Forum Infect Dis. 2018;5:ofy174. doi: 10.1093/ofid/ofy174. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Zappulo E, Buonomo AR, Saccà F, Russo CV, Scotto R, Scalia G, et al. Incidence and predictive risk factors of infective events in patients with multiple sclerosis treated with agents targeting CD20 and CD52 surface antigens. Open Forum Infect Dis. 2019;6:ofz445. doi: 10.1093/ofid/ofz445. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Memon AB, Javed A, Caon C, Srivastawa S, Bao F, Bernitsas E, et al. Long-term safety of rituximab induced peripheral B-cell depletion in autoimmune neurological diseases. PLoS ONE. 2018;13:e0190425. doi: 10.1371/journal.pone.0190425. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Abushouk AI, Ahmed H, Ismail A, Elmaraezy A, Badr AS, Gadelkarim M, Elnenny M. Safety and efficacy of ocrelizumab in rheumatoid arthritis patients with an inadequate response to methotrexate or tumor necrosis factor inhibitors: a systematic review and meta-analysis. Rheumatol Int. 2017;37:1053–1064. doi: 10.1007/s00296-017-3675-8. [DOI] [PubMed] [Google Scholar]
- 82.Calabresi PA. B-cell depletion—A frontier in monoclonal antibodies for multiple sclerosis. N Engl J Med. 2017;376:280–282. doi: 10.1056/NEJMe1614717. [DOI] [PubMed] [Google Scholar]
- 83.Jakimovski D, Weinstock-Guttman B, Ramanathan M, Kolb C, Hojnacki D, Minagar A, Zivadinov R. Ocrelizumab: a B-cell depleting therapy for multiple sclerosis. Expert Opin Biol Ther. 2017;17:1163–1172. doi: 10.1080/14712598.2017.1347632. [DOI] [PubMed] [Google Scholar]
- 84.Das G, Damotte V, Gelfand JM, Bevan C, Cree BAC, Do L, et al. Rituximab before and during pregnancy: a systematic review, and a case series in MS and NMOSD. Neurol Neuroimmunol Neuroinflamm. 2018;5:e453. doi: 10.1212/NXI.0000000000000453. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Oreja-Guevara C, Wray S, Buffels R, Zecevic D, Vukusic S (2019) Pregnancy outcomes in patients treated with ocrelizumab. https://onlinelibrary.ectrims-congress.eu/ectrims/2019/stockholm/279140/celia.oreja-guevara.pregnancy.outcomes.in.patients.treated.with.ocrelizumab.html?f=listing%3D3%2Abrowseby%3D8%2Asortby%3D1%2Amedia%3D1. Zugegriffen: 10. Febr. 2020
- 86.Wormser D, Engel P, Hahn K et al (2018) Ocrelizumab pregnancy registry to assess maternal, fetal, and infant outcomes in women with multiple sclerosis exposed to Ocrelizumab during pregnancy (DX50). https://ijmsc.org/doi/pdf/10.7224/1537-2073-20.s1.1. Zugegriffen: 10. Febr. 2020
- 87.Bergman J, Burman J, Gilthorpe JD, Zetterberg H, Jiltsova E, Bergenheim T, Svenningsson A. Intrathecal treatment trial of rituximab in progressive MS: an open-label phase 1b study. Neurology. 2018;91:e1893–e1901. doi: 10.1212/WNL.0000000000006500. [DOI] [PubMed] [Google Scholar]
- 88.Wekerle H. B cells in multiple sclerosis. Autoimmunity. 2017;50:57–60. doi: 10.1080/08916934.2017.1281914. [DOI] [PubMed] [Google Scholar]
- 89.Rahmanzadeh R, Weber MS, Brück W, Navardi S, Sahraian MA. B cells in multiple sclerosis therapy—A comprehensive review. Acta Neurol Scand. 2018;137:544–556. doi: 10.1111/ane.12915. [DOI] [PubMed] [Google Scholar]
- 90.Sospedra M. B cells in multiple sclerosis. Curr Opin Neurol. 2018;31:256–262. doi: 10.1097/WCO.000000000000563. [DOI] [PubMed] [Google Scholar]
- 91.Baecher-Allan C, Kaskow BJ, Weiner HL. Multiple sclerosis: mechanisms and immunotherapy. Neuron. 2018;97:742–768. doi: 10.1016/j.neuron.2018.01.021. [DOI] [PubMed] [Google Scholar]
- 92.Rommer PS, Milo R, Han MH, Satyanarayan S, Sellner J, Hauer L, et al. Immunological aspects of approved MS therapeutics. Front Immunol. 2019;10:1564. doi: 10.3389/fimmu.2019.01564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 93.Ransohoff RM. Immune-cell crosstalk in multiple sclerosis. Nature. 2018;563:194–195. doi: 10.1038/d41586-018-07063-z. [DOI] [PubMed] [Google Scholar]
- 94.Márquez AC, Horwitz MS. The role of latently infected B cells in CNS autoimmunity. Front Immunol. 2015;6:544. doi: 10.3389/fimmu.2015.00544. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 95.Bar-Or A, Pender MP, Khanna R, Steinman L, Hartung H-P, Maniar T, et al. Epstein-Barr virus in multiple sclerosis: theory and emerging immunotherapies. Trends Mol Med. 2019 doi: 10.1016/j.molmed.2019.11.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 96.Anthony DC, Dickens AM, Seneca N, Couch Y, Campbell S, Checa B, et al. Anti-CD20 inhibits T cell-mediated pathology and microgliosis in the rat brain. Ann Clin Transl Neurol. 2014;1:659–669. doi: 10.1002/acn3.94. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Chen D, Ireland SJ, Remington G, Alvarez E, Racke MK, Greenberg B, et al. CD40-mediated NF-κB activation in B cells is increased in multiple sclerosis and modulated by therapeutics. J Immunol. 2016;197:4257–4265. doi: 10.4049/jimmunol.1600782. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.Haugen M, Frederiksen JL, Degn M. B cell follicle-like structures in multiple sclerosis-with focus on the role of B cell activating factor. J Neuroimmunol. 2014;273:1–7. doi: 10.1016/j.jneuroim.2014.05.010. [DOI] [PubMed] [Google Scholar]
- 99.Magliozzi R, Serafini B, Rosicarelli B, Chiappetta G, Veroni C, Reynolds R, Aloisi F. B-cell enrichment and Epstein-Barr virus infection in inflammatory cortical lesions in secondary progressive multiple sclerosis. J Neuropathol Exp Neurol. 2013;72:29–41. doi: 10.1097/NEN.0b013e31827bfc62. [DOI] [PubMed] [Google Scholar]
- 100.Lehmann-Horn K, Kinzel S, Feldmann L, Radelfahr F, Hemmer B, Traffehn S, et al. Intrathecal anti-CD20 efficiently depletes meningeal B cells in CNS autoimmunity. Ann Clin Transl Neurol. 2014;1:490–496. doi: 10.1002/acn3.71. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.Palanichamy A, Apeltsin L, Kuo TC, Sirota M, Wang S, Pitts SJ, et al. Immunoglobulin class-switched B cells form an active immune axis between CNS and periphery in multiple sclerosis. Sci Transl Med. 2014;6:248r. doi: 10.1126/scitranslmed.3008930. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 102.Mathias A, Perriard G, Canales M, Soneson C, Delorenzi M, Schluep M, Du Pasquier RA. Increased ex vivo antigen presentation profile of B cells in multiple sclerosis. Mult Scler. 2017;23:802–809. doi: 10.1177/1352458516664210. [DOI] [PubMed] [Google Scholar]
- 103.Michel L, Touil H, Pikor NB, Gommerman JL, Prat A, Bar-Or A. B cells in the multiple sclerosis central nervous system: trafficking and contribution to CNS-compartmentalized inflammation. Front Immunol. 2015;6:636. doi: 10.3389/fimmu.2015.00636. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Eggers EL, Michel BA, Wu H, Wang S-Z, Bevan CJ, Abounasr A, et al. Clonal relationships of CSF B cells in treatment-naive multiple sclerosis patients. JCI Insight. 2017 doi: 10.1172/jci.insight.92724. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 105.Lossius A, Tomescu-Baciu A, Holmøy T, Vedeler CA, Røsjø E, Lorentzen ÅR, et al. Selective intrathecal enrichment of G1m1-positive B cells in multiple sclerosis. Ann Clin Transl Neurol. 2017;4:756–761. doi: 10.1002/acn3.451. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 106.Stein J, Xu Q, Jackson KC, Romm E, Wuest SC, Kosa P, et al. Intrathecal B cells in MS have significantly greater lymphangiogenic potential compared to B cells derived from non-MS subjects. Front Neurol. 2018;9:554. doi: 10.3389/fneur.2018.00554. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 107.Stern JNH, Yaari G, Vander Heiden JA, Church G, Donahue WF, Hintzen RQ, et al. B cells populating the multiple sclerosis brain mature in the draining cervical lymph nodes. Sci Transl Med. 2014;6:248ra107. doi: 10.1126/scitranslmed.3008879. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 108.Lisak RP, Nedelkoska L, Benjamins JA, Schalk D, Bealmear B, Touil H, et al. B cells from patients with multiple sclerosis induce cell death via apoptosis in neurons in vitro. J Neuroimmunol. 2017;309:88–99. doi: 10.1016/j.jneuroim.2017.05.004. [DOI] [PubMed] [Google Scholar]
- 109.Rivas JR, Ireland SJ, Chkheidze R, Rounds WH, Lim J, Johnson J, et al. Peripheral VH4+ plasmablasts demonstrate autoreactive B cell expansion toward brain antigens in early multiple sclerosis patients. Acta Neuropathol. 2017;133:43–60. doi: 10.1007/s00401-016-1627-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 110.Guerrier T, Labalette M, Launay D, Lee-Chang C, Outteryck O, Lefèvre G, et al. Proinflammatory B-cell profile in the early phases of MS predicts an active disease. Neurol Neuroimmunol Neuroinflamm. 2018;5:e431. doi: 10.1212/NXI.0000000000000431. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 111.Shen P, Fillatreau S. Antibody-independent functions of B cells: a focus on cytokines. Nat Rev Immunol. 2015;15:441–451. doi: 10.1038/nri3857. [DOI] [PubMed] [Google Scholar]
- 112.von Büdingen H-C, Palanichamy A, Lehmann-Horn K, Michel BA, Zamvil SS. Update on the autoimmune pathology of multiple sclerosis: B-cells as disease-drivers and therapeutic targets. Eur Neurol. 2015;73:238–246. doi: 10.1159/000377675. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 113.Rijvers L, Melief M-J, van der Vuurst de Vries RM, Stéphant M, van Langelaar J, Wierenga-Wolf AF, et al. The macrophage migration inhibitory factor pathway in human B cells is tightly controlled and dysregulated in multiple sclerosis. Eur J Immunol. 2018;48:1861–1871. doi: 10.1002/eji.201847623. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 114.Li R, Rezk A, Miyazaki Y, Hilgenberg E, Touil H, Shen P, et al. Proinflammatory GM-CSF-producing B cells in multiple sclerosis and B cell depletion therapy. Sci Transl Med. 2015;7:310ra166. doi: 10.1126/scitranslmed.aab4176. [DOI] [PubMed] [Google Scholar]
- 115.Wurth S, Kuenz B, Bsteh G, Ehling R, Di Pauli F, Hegen H, et al. Cerebrospinal fluid B cells and disease progression in multiple sclerosis—A longitudinal prospective study. PLoS ONE. 2017;12:e0182462. doi: 10.1371/journal.pone.0182462. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 116.Cree BAC, Bennett JL, Kim HJ, Weinshenker BG, Pittock SJ, Wingerchuk DM, et al. Inebilizumab for the treatment of neuromyelitis optica spectrum disorder (N-MOmentum): a double-blind, randomised placebo-controlled phase 2/3 trial. Lancet. 2019;394:1352–1363. doi: 10.1016/S0140-6736(19)31817-3. [DOI] [PubMed] [Google Scholar]
- 117.Halliley JL, Tipton CM, Liesveld J, Rosenberg AF, Darce J, Gregoretti IV, et al. Long-lived plasma cells are contained within the CD19(-)CD38(hi)CD138(+) subset in human bone marrow. Immunity. 2015;43:132–145. doi: 10.1016/j.immuni.2015.06.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 118.Mei HE, Wirries I, Frölich D, Brisslert M, Giesecke C, Grün JR, et al. A unique population of IgG-expressing plasma cells lacking CD19 is enriched in human bone marrow. Blood. 2015;125:1739–1748. doi: 10.1182/blood-2014-02-555169. [DOI] [PubMed] [Google Scholar]
- 119.Schuh E, Berer K, Mulazzani M, Feil K, Meinl I, Lahm H, et al. Features of human CD3+CD20+ T cells. J Immunol. 2016;197:1111–1117. doi: 10.4049/jimmunol.1600089. [DOI] [PubMed] [Google Scholar]
- 120.Jelcic I, Al Nimer F, Wang J, Lentsch V, Planas R, Jelcic I, et al. Memory B cells activate brain-homing, autoreactive CD4+ T cells in multiple sclerosis. Cell. 2018;175:85–100.e23. doi: 10.1016/j.cell.2018.08.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 121.Fraussen J, Claes N, van Wijmeersch B, van Horssen J, Stinissen P, Hupperts R, Somers V. B cells of multiple sclerosis patients induce autoreactive proinflammatory T cell responses. Clin Immunol. 2016;173:124–132. doi: 10.1016/j.clim.2016.10.001. [DOI] [PubMed] [Google Scholar]
- 122.Ireland SJ, Guzman AA, Frohman EM, Monson NL. B cells from relapsing remitting multiple sclerosis patients support neuro-antigen-specific Th17 responses. J Neuroimmunol. 2016;291:46–53. doi: 10.1016/j.jneuroim.2015.11.022. [DOI] [PubMed] [Google Scholar]
- 123.Machado-Santos J, Saji E, Tröscher AR, Paunovic M, Liblau R, Gabriely G, et al. The compartmentalized inflammatory response in the multiple sclerosis brain is composed of tissue-resident CD8+ T lymphocytes and B cells. Brain. 2018;141:2066–2082. doi: 10.1093/brain/awy151. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 124.Knier B, Hiltensperger M, Sie C, Aly L, Lepennetier G, Engleitner T, et al. Myeloid-derived suppressor cells control B cell accumulation in the central nervous system during autoimmunity. Nat Immunol. 2018;19:1341–1351. doi: 10.1038/s41590-018-0237-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 125.Hohlfeld R, Dornmair K, Meinl E, Wekerle H. The search for the target antigens of multiple sclerosis, part 2: CD8+ T cells, B cells, and antibodies in the focus of reverse-translational research. Lancet Neurol. 2016;15:317–331. doi: 10.1016/S1474-4422(15)00313-0.. [DOI] [PubMed] [Google Scholar]
- 126.Gingele S, Jacobus TL, Konen FF, Hümmert MW, Sühs K-W, Schwenkenbecher P, et al. Ocrelizumab depletes CD20+ T cells in multiple sclerosis patients. Cells. 2018 doi: 10.3390/cells8010012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 127.Lovett-Racke AE, Gormley M, Liu Y, Yang Y, Graham C, Wray S, et al. B cell depletion with ublituximab reshapes the T cell profile in multiple sclerosis patients. J Neuroimmunol. 2019;332:187–197. doi: 10.1016/j.jneuroim.2019.04.017. [DOI] [PubMed] [Google Scholar]
- 128.Kompetenznetz Multiple Sklerose (2018) Qualitätshandbuch MS/NMOSD. https://www.kompetenznetz-multiplesklerose.de/wp-content/uploads/2018/11/KKNMS_Qualit%C3%A4tshandbuch-MS-NMOSD_2018_webfrei.pdf. Zugegriffen: 03.02.2020
- 129.Buti M, Manzano ML, Morillas RM, García-Retortillo M, Martín L, Prieto M, et al. Randomized prospective study evaluating tenofovir disoproxil fumarate prophylaxis against hepatitis B virus reactivation in anti-HBc-positive patients with rituximab-based regimens to treat hematologic malignancies: The Preblin study. PLoS ONE. 2017;12:e0184550. doi: 10.1371/journal.pone.0184550. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 130.National Institute of Diabetes and Digestive and Kidney Diseases . LiverTox: clinical and research information on drug-induced liver injury: ocrelizumab. Bethesda: National Institute of Diabetes and Digestive and Kidney Diseases; 2012. [Google Scholar]
- 131.Klotz L, Havla J, Schwab N, Hohlfeld R, Barnett M, Reddel S, Wiendl H. Risks and risk management in modern multiple sclerosis immunotherapeutic treatment. Ther Adv Neurol Disord. 2019;12:1756286419836571. doi: 10.1177/1756286419836571. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 132.Derfuss T, Weber MS, Hughes R, Wang Q, Sauter A, Koendgen H, Hauser SL, Bar-Or A, Hartung H‑P (2020) Serum immunoglobulin levels and risk of serious infections in the pivotal Phase III trials of ocrelizumab in multiple sclerosis and their open-label extensions ECTRIMS Online Library. Sep 11 2019; 279399. https://onlinelibrary.ectrims-congress.eu/ectrims/2019/stockholm/279399/tobias.derfuss.serum.immunoglobulin.levels.and.risk.of.serious.infecti. Zugegriffen: 12. März 2020
- 133.Rovira À, Wattjes MP, Tintoré M, Tur C, Yousry TA, Sormani MP, et al. Evidence-based guidelines: MAGNIMS consensus guidelines on the use of MRI in multiple sclerosis-clinical implementation in the diagnostic process. Nat Rev Neurol. 2015;11:471–482. doi: 10.1038/nrneurol.2015.106. [DOI] [PubMed] [Google Scholar]
- 134.Auguste P, Colquitt J, Connock M, Loveman E, Court R, Ciccarelli O, et al. Ocrelizumab for treating patients with primary progressive multiple sclerosis: an evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 2020 doi: 10.1007/s40273-020-00889-4. [DOI] [PubMed] [Google Scholar]
- 135.DMSG (Hrsg) (2020) Empfehlungen für Multiple Sklerose-Erkrankte zum Thema Corona-Virus/DMSG – Multiple Sklerose. https://www.dmsg.de/multiple-sklerose-news/dmsg-aktuell/news-article/News/detail/empfehlungen-fuer-multiple-sklerose-erkrankte-zum-thema-corona-virus/?no_cache=1&cHash=1f45cc65c79272dae37d6e2827278143. Zugegriffen: 12. März 2020
- 136.Ellrichmann G, Bolz J, Peschke M, Duscha A, Hellwig K, Lee D-H, et al. Peripheral CD19+ B-cell counts and infusion intervals as a surrogate for long-term B-cell depleting therapy in multiple sclerosis and neuromyelitis optica/neuromyelitis optica spectrum disorders. J Neurol. 2019;266:57–67. doi: 10.1007/s00415-018-9092-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 137.Kompetenznetz Multiple Sklerose (2020) Coronavirus SARS-CoV-2: Hinweise zur Anwendung von MS-Immuntherapeutika. https://www.kompetenznetz-multiplesklerose.de/coronavirus-sars-cov-2-hinweise-zur-anwendung-von-ms-immuntherapeutika/. Zugegriffen: 17. März 2020
- 138.Schweizerische Multiple Sklerose Gesellschaft (Hrsg) (2020) COVID-19: Globale Empfehlung für MS-Betroffene. https://www.multiplesklerose.ch/de/aktuelles/detail/globale-covid-19-empfehlung-fuer-ms-betroffene/. Zugegriffen: 17. März 2020
- 139.MS International Federation (2020) The coronavirus and MS—global advice. https://www.msif.org/news/2020/02/10/the-coronavirus-and-ms-what-you-need-to-know/. Zugegriffen: 17. März 2020
- 140.MS Trust (Hrsg) (2020) Update on coronavirus COVID-19 and multiple sclerosis. https://www.mstrust.org.uk/news/update-coronavirus-covid-19-and-multiple-sclerosis. Zugegriffen: 17. März 2020
- 141.Association of British Neurologists (2020) ABN guidance on the use of disease-modifying therapies in multiple sclerosis in response to the threat of A coronavirus epidemic. https://cdn.ymaws.com/www.theabn.org/resource/collection/6750BAE6-4CBC-4DDB-A684-116E03BFE634/ABN_Guidance_on_DMTs_for_MS_and_COVID19_APPROVED_11_March.pdf. Zugegriffen: 17. März 2020