a Überarbeitete, aktualisierte und inhaltlich auf die Situation in Deutschland, Österreich, der Schweiz und Luxemburg adaptierte Fassung des EAACI-Positionspapiers: Vultaggio et al. Considerations on Biologicals for Patients with allergic disease in times of the COVID-2 19 pandemic: an EAACI Statement. Allergy (submitted). bDie ersten fünf Autoren sind gemeinsame Erstautoren. cDie letzten vier Autoren sind gemeinsame Letztautoren.
Zusammenfassung
Hintergrund: Die Behandlung von Patienten mit Allergien und Atopie-assoziierten Erkrankungen wurde seit Beginn der Covid-19-Pandemie vor große Herausforderungen gestellt. Empfehlungen zum "social distancing" und die Angst der Patienten vor einer Infektion in medizinischen Einrichtungen haben zu einer drastischen Abnahme der persönlichen Arzt-Patienten-Kontakte geführt. Hiervon sind Akutversorgung und Behandlung chronisch Kranker gleichermaßen betroffen.
Die Immunantwort nach SARS-CoV-2-Infektion ist bislang nur unzureichend bekannt und könnte durch eine Therapie mit monoklonalen Antikörpern günstig, aber auch ungünstig verändert werden. Zum jetzigen Zeitpunkt bestehen keine Hinweise auf ein erhöhtes Risiko von Allergikern für einen schwereren Covid-19-Krankheitsverlauf. Zahlreiche Patientinnen und Patienten befinden sich unter laufender Therapie mit Biologika, die über verschiedene Ansätze Typ-2-Immunantworten inhibieren. Es besteht Unklarheit über mögliche immunologische Interaktionen und potenzielle Risiken dieser Biologika im Falle einer Infektion mit SARS-CoV-2.
Methodik: Für die vorliegende Publikation wurde eine selektive Literaturrecherche in Pubmed, Livivo und im World Wide Web für die zurückliegenden zehn Jahre (Zeitraum Mai 2010 bis April 2020) durchgeführt. Darüber hinaus wurden hier die aktuellen, dort nicht enthaltenen deutschsprachigen Publikationen analysiert. Auf Grundlage dieser Daten gibt dieses Positionspapier Empfehlungen für die Behandlung mit Biologika bei Patienten mit allergischen und Atopie-assoziierten Erkrankungen in der Covid-19-Pandemie.
Ergebnisse: Zur Aufrechterhaltung von Präsenzsprechstunden muss eine sichere und an die Pandemiesituation adaptierte Behandlungsumgebung geschaffen werden. Verlässliche Studiendaten zur Versorgung komplex erkrankter Atemwegs-, Atopie- und Allergiepatienten in Zeiten imminenter Infektionsgefahr durch SARS-CoV-2 fehlen bis dato. Typ-2-geprägte Immunreaktionen, wie sie bei Allergiepatienten oft vorliegen, könnten auf die verschiedenen Phasen von Covid-19 Einfluss nehmen, indem sie beispielsweise Immunreaktionen bremsen. Das könnte sich theoretisch in der frühen Phase der SARS-Cov-2-Infektion ungünstig, in der späten Phase schwerer Verläufe während eines Zytokinsturms günstig auswirken. Da es dafür bisher aber keine Belege gibt, sollten alle Daten von Patienten unter einem gegen Typ-2-Immunreaktionen gerichteten Biologikum, die an Covid-19 erkranken, in Registern gesammelt und ihre Krankheitsverläufe dokumentiert werden, um in Zukunft erfahrungsasierte Handlungsanweisungen geben zu können.
Schlussfolgerung: Die Therapie mit Biologika zur Behandlung von Asthma bronchiale, atopischer Dermatitis, chronischer Rhinosinusitis mit Nasenpolypen und spontaner Urtikaria sollte in der aktuellen Covid-19-Pandemie bei Patienten ohne Infektionsverdacht oder nachgewiesener SARS-CoV-2-Infektion unverändert fortgesetzt werden. Falls verfügbar ist es empfehlenswert, eine Formulierung zur Eigenapplikation zu bevorzugen und ein telemedizinisches Monitoring anzubieten.
Behandlungsziel sollte sein, schwer kontrollierbare allergische und atopische Erkrankungen durch angemessene Bedarfs- und Add-on-Therapie bestmöglich einzustellen und die Notwendigkeit systemischer Glukokortikoide zu vermeiden. Im Falle eines begründeten Verdachts oder einer nachgewiesenen Infektion mit SARS-CoV-2 sollte die Therapie individuell durch Abwägung von Nutzen und Risiken als Einzelfallentscheidung unter Einbeziehung des Patienten bestimmt werden. Hierbei ist zu bedenken, dass mögliche Einflüsse von Biologika auf die Immunantwort bei Covid-19 aktuell nicht genau bekannt sind. Telemedizinische Angebote sind insbesondere für akuten Beratungsbedarf bei geeigneten Patienten wünschenswert.
Einleitung
Die klinische Symptomatik der Infektion mit dem neuartigen Coronavirus SARS-CoV-2 ("severe acute respiratory syndrome-Coronavirus 2") wurde am 11. Februar 2020 als "Coronavirus-Krankheit 2019" (Covid-19) bekannt [1]. Das Internationale Komitee für die Taxonomie von Viren (ICTV) bezeichnete diese neuen humanpathologischen Viren als SARS-CoV-2 [1]. Die globale Ausweitung der SARS-CoV-2-Pandemie und Patienten mit schweren klinischen Verlaufsformen von Covid-19 stellen die Gesundheitssysteme weltweit vor große Herausforderungen.
Das Coronavirus SARS-CoV, das in den Jahren 2002/2003 das schwere akute Atemwegssyndrom SARS ausgelöst hatte, weist eine circa 80 %-ige Nukleotidsequenzidentität mit SARS-CoV-2 auf [1]. SARS-CoV-2 ist ein Betacoronavirus der Untergattung Sarbecovirus und der Unterfamilie Orthocorona viridae und das siebte Mitglied der Familie der Coronaviridae, das den Menschen infizieren kann. Es kann aus menschlichen Proben isoliert werden, die aus Atemwegssekreten, Nasen- und Rachenabstrichen gewonnen und auf Zellkulturen isoliert werden [1, 2, 3].
Es ist umhüllt von einer Lipidmembran, die durch Detergenzien zerstört werden kann, und unterscheidet sich vom Coronavirus des Nahen Ostens (MERS-CoV), vom Coronavirus des schweren akuten Atemwegssyndroms (SARS-CoV) und von den für die viralen "Erkältungskrankheiten" verantwortlichen Viren (229E, OC43, NL63 und HKU1) [1].
Nach einer Infektion mit SARS-CoV-2 kann es zu einer bis zu 14-tägigen Inkubationszeit kommen, in der die erkrankten Personen asymptomatische (Über)Träger des Virus sein können.
Bei einer großen Zahl von Patienten führt die Infektion nach der Inkubationszeit zu einer Erkrankung der oberen und unteren Atemwege, seltener auch anderer Organsysteme (Nervensystem, Gastrointestinaltrakt, Nieren, Blutgefäße), die im ungünstigen Fall zum Multiorganversagen und respiratorischer Insuffizienz führt, wie dies auch für andere Coronavirus-Infektionen (SARS-CoV-1, MERS-CoV) beschrieben wurde [4, 5, 6]. In schwereren Fällen kann eine Infektion mit SARS-CoV-2 zu Pneumonie, schwerem akutem Atemwegssyndrom, Nierenversagen und zum Tod führen [4, 7, 8, 9, 10]. In der veröffentlichten wissenschaftlichen Literatur zu Covid-19 werden ein höheres Alter und Komorbiditäten wie chronische Atemwegserkrankungen (insbesondere COPD), Diabetes mellitus, kardiovaskuläre Erkrankungen, Adipositas und Immunschwäche unterschiedlichen Ursprungs als Risikofaktoren für einen schweren Verlauf aufgeführt [4, 7, 8, 9]. Die Notwendigkeit von intensivmedizinischen Maßnahmen und invasiver Beatmung geht mit einer hohen Mortalität einher.
Wir stellen nachfolgend klinische und immunologische Aspekte vor, die bei Patienten unter Therapie mit Biologika gegen IgE und Typ-2-Entzündungsmediatoren im Kontext der Covid-19-Pandemie zu bedenken sind (Tab. 1).
| Empfehlungen zur Therapie mit Biologika bei nicht infizierten Patienten während der Covid-19-Pandemie oder bei Patienten, die eine Covid-19-Infektion überstanden haben | Empfehlungen zur Therapie mit Biologika für Covid-19-diagnostizierte Patienten oder Verdachtsfälle für SARS-CoV-2-Infektion |
|---|---|
| Eine Beendigung einer Biologikatherapie ist nicht generell notwendig und diese sollte speziell für schwere Erkrankungsformen im Sinne einer individuellen Risiko-Nutzen-Analyse regulär fortgeführt werden. | Bei leichtem bis mittelschwerem Verlauf einer Covid-19-Erkrankung oder Verdachtsfällen für eine SARS-CoV-2-Infektion kann in den hier behandelten Indikationen eine Fortführung der Biologikatherapie erfolgen, falls eine individuelle Abwägung von Nutzen und Risiken für den Patienten zu diesem Ergebnis kommt und der Patient nach sachgerechter Aufklärung über die eingeschränkte Datenlage diesem Vorgehen zustimmt. |
| Die Möglichkeit einer Verlängerung des Injektionsintervalls kann gemäß Fachinformation des jeweiligen Biologikums in Betracht gezogen werden, um notwendige Arzt-Patienten-Kontakte auf ein Mindestmaß zu beschränken. | Bei schwerem Verlauf einer Covid-19-Erkrankung sollte in den hier behandelten Indikationen eine Verlängerung des Injektionsintervalls gemäß Fachinformation des jeweiligen Biologikums oder eine Therapiepause in Erwägung gezogen werden. Diese Abschätzung sollte das Risiko einer potenziell erforderlichen systemischen Glukokortikoidtherapie einschließen. |
| Eine Biologikatherapie kann in der derzeitigen Covid-19-Pandemie auch fortgeführt werden bei asymptomatischen Patienten mit negativen PCR-Testergebnissen, bei Patienten ohne bekannte Exposition oder Kontakt zu SARS-CoV-2-positiven Personen oder nach Beendigung einer adäquaten Quarantäne. | Im Rahmen einer Quarantäne-Situation kann die medizinische Begleitung in Bezug auf die Biologikatherapie ggf. telemedizinisch erfolgen, insbesondere auch mit dem Ziel, die Basistherapie mit topischen Glukokortikoiden, inhalativen Bronchodilatatoren, Antihistaminika etc. gemäß entsprechender Leitlinienempfehlungen fortzusetzen oder bedarfsgerecht auszuweiten. |
| Der Beginn einer Biologikatherapie bei Patienten ohne Hinweis auf eine SARS-CoV-2-Infektion kann gemäß zugelassener Indikation erfolgen. | |
| Während der aktuellen Covid-19-Pandemie sollte generell eine Selbstverabreichung von Biologika bevorzugt werden, die bei Verfügbarkeit von anwendungsfreundlichen Pen-Systemen zur Selbstapplikation erleichtert ist. Dies setzt eine adäquate Schulung des Patienten voraus. | |
| Eine angemessene Vorbereitung von Praxen und Allergiezentren auf die Situation der derzeitigen Covid-19-Pandemie ist notwendig, die sich an den Empfehlungen der WHO und der nationalen und regionalen Behörden ausrichten sollte. | |
| Diese Empfehlungen sollten fortlaufend aktualisiert und an neue wissenschaftliche Erkenntnisse und behördliche Empfehlungen angepasst werden. | |
| CRSwNP, Chronische Rhinosinusitis mit nasalen Polypen | |
Immunantwort bei SARS-CoV-2- und anderen Coronavirus-Infektionen
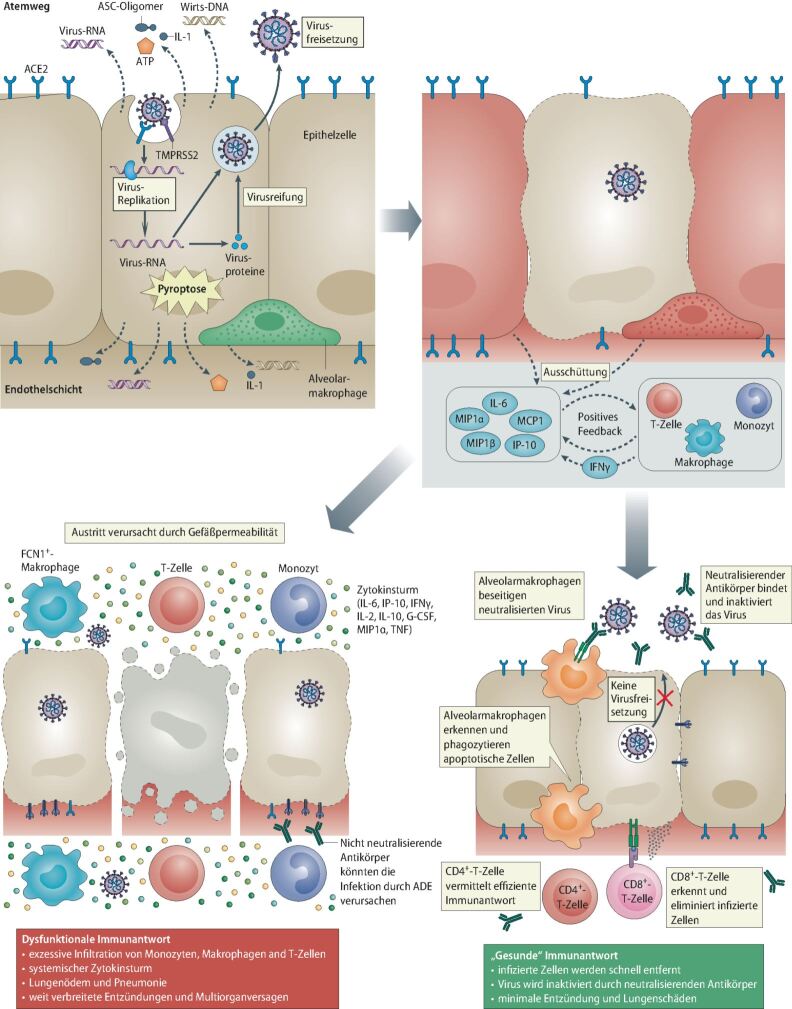
Die Charakteristika der Immunantwort nach Infektion mit SARS-CoV-2 sind noch unzureichend verstanden. Während verschiedene Verlaufsformen der Covid-19-Erkrankung und der Infektion mit dem Virus beschrieben sind, ist bislang unklar, welche immunologischen Hintergründe den Verlauf der Erkrankung beeinflussen. Dies gilt auch für die Bedeutung von angeborenem und adaptivem Immunsystem im Zusammenhang mit der Infektion. Während in der frühen Phase von Virusinfektionen klassischerweise natürliche Killer-Zellen (NK-Zellen) eine wesentliche Rolle spielen, greifen CD8+-T-Helfer-Zellen in der nachfolgenden Phase ein [11]. Die frühe Antikörpersekretion und -produktion im Mukosa-assoziierten lymphatischen Gewebe umfasst zunächst antigenspezifische Antikörper vom Typ IgM und IgA und später IgG und ist von zentraler Rolle für die Immunantwort [12, 13, 14]. Makrophagen werden aktiviert und sezernieren inflammatorische Zytokine, hierbei nehmen vor allem Typ-1-Interferone (Typ-1-IFN) eine Schlüsselposition ein. Bei Infektionen mit anderen Coronaviren (u. a. SARS-CoV-1) ist Typ-1-IFN für die adäquate Einleitung der Immunreaktion verantwortlich und Patienten mit verspäteter oder unzureichender IFN-Produktion zeigen einen schwereren Krankheitsverlauf [6].
Die Aktivierung von Apoptose oder Pyroptose in Epithelzellen dient der Virusabwehr, überschießende Immunreaktionen können durch synergistische Effekte, aber auch zur lokalen Gewebeschädigung beitragen [15]. Eine überschießende Produktion proinflammatorischer Zytokine wurde bereits bei SARS-CoV-1-, MERS-CoV- und kürzlich auch bei SARS-CoV-2-Infektionen beobachtet und als Zytokinsturm beschrieben [4, 5]. Natürliches IgM und wahrscheinlich Mannose-bindendes Lektin (MBL) werden als erste Verteidigungslinie gegen SARS-CoV-2 vermutet [16]. Diese Antikörper und MBL erkennen Glykane und sind bei Kindern und jungen Erwachsenen reichlich vorhanden, nehmen jedoch mit zunehmendem Alter dramatisch ab und sind im Alter von 60+ über 50-mal niedriger als im Alter von 20-30 Jahren [16]. Da sie Teil der angeborenen Immunität sind, sind sie die einzigen Antikörper, die SARS-CoV-2 vor Einleitung einer adaptiven Immunantwort erkennen [16]. Wenn das Virus die Lunge früh genug erreicht, kann es sich ungehindert vermehren, da keine oder nur geringe Resistenz vorliegt. Eine resultierende Entzündung mit massiver Aktivierung lokaler Mediatoren (Komplement- und Gerinnungskaskaden, Interleukin-6 [IL-6], Zytokinsturm) kann Schäden hervorrufen, die zu Komplikationen und bei einigen Patienten zum Tod führen [16].
Auch die Eigenschaft der SARS-CoV-2-Viren, über Rezeptoren wie ACE2 und TMPRRSS2 in die Zelle einzudringen, könnte unterschiedliche Ausprägungen von Covid-19 bei verschiedenen Patientengruppen erklären [17].
Ausgedehnte Schäden an der Lunge führen zu einer rapiden klinischen Verschlechterung und meistens zur Notwendigkeit einer intensivmedizinischen Behandlung, die typischerweise 7-14 Tage nach Infektion zu beobachten ist. Die Gefahr von Nieren-, Leber- und/oder anderer Organschädigungen sowie einer Verbrauchskoagulopathie ist hierbei stark erhöht. Betroffene Patientinnen und Patienten weisen in der Regel stark erhöhte Spiegel von IL-1-α, IL-6, IL-8 und TNF-α auf (Abb. 1) [18]. Die therapeutische Blockade von einem oder mehreren dieser Zytokine wird als potenzielle zukünftige Therapieoption für schwer betroffene Patienten diskutiert, bei denen das IL-6 massiv erhöht sein kann [19]. IL-6 spielt eine zentrale Rolle im Zytokinsturm und Tozilizumab wurde als Biologikum mit Anti-IL-6-Wirkung bereits bei Covid-19 eingesetzt [20, 21].
Zugelassene Indikationen von anti-IL-6 oder anti-IL-6R AK (wie Tocilizumab, Sarilumab) sind zurzeit zum Beispiel die rheumatoide Arthritis, die juvenile rheumatoide Arthritis (M. Still) und das Castleman-Syndrom. Die hier beschriebenen Immunreaktionen vom Typ-1 und Typ-3 werden durch andere Zytokine, wie zum Beispiel IL-10 und TGF-β eingedämmt, und auch Typ-2-Entzündungen könnten eventuell als Gegenspieler eines Zytokinsturms agieren. Erhöhten Werten von eosinophilen Granulozyten als einer der Schlüsselzellen der Typ-2-Inflammation wurde eine protektive Wirkung bei schweren Virusinfektionen zugeschrieben, wobei der Wirkungsmechanismus bislang nicht identifiziert werden konnte [22]. Andererseits können niedrige Eosinophilenzahlen im Blut auch schlicht nur die Schwere der Infektion abbilden. Weit besser untersucht ist die Interaktion von SARS-CoV-2 mit seinem Rezeptor auf den Zellen des respiratorischen Systems, dem membranständigen Angiotensin-Converting-Enzym-2 (ACE-2), die für seinen Eintritt in die Wirtszelle verantwortlich ist [17]. Daher wird eine reduzierte Expression von ACE-2 in Atemwegsepithelzellen von Patienten mit allergischem Asthma als möglicher schützender Faktor vor einer SARS-CoV-2-Infektion diskutiert [23]. Es ist anzunehmen, dass erst das Zusammenspiel der einzelnen Zytokinantworten zu einer adäquaten und effektiven Immunantwort bei Coronavirusinfektionen führt. Dysbalancen zwischen den Typ-1-, Typ-2- und Typ-3-Reaktionen sind aber wahrscheinlich in der Lage, den Verlauf einer Virusinfektion maßgeblich negativ oder positiv zu beeinflussen (Abb. 1).
Erfahrungen mit Covid-19 bei Erkrankungen mit Typ-2-Inflammation
Bislang gibt es nur unzureichende Hinweise darauf, welche Risikofaktoren bei SARS-CoV-2-Infizierten einen schweren Verlauf einer Covid-19-Erkrankung bedingen. Vorerkrankungen der Lunge gelten bislang als potenzieller Risikofaktor für eine Covid-19-Erkrankung und möglicherweise auch für einen schwereren Verlauf. Das Asthma bronchiale als wichtigste Indikation für anti-IgE und anti-Typ-2 gerichtete Biologika in der Allergologie zählt potenziell zu diesen Erkrankungen. Da aber viele Lungenerkrankte auch andere Komorbiditäten aufweisen, könnten sich im langfristigen Verlauf und im Zuge weiterer Studien einige der vermuteten Faktoren als Confounder herausstellen. Somit ist es bisher ungeklärt, ob Patienten mit einem Typ-2-assoziierten Asthma bronchiale in Abwesenheit weiterer möglicher Risikofaktoren als Risikopatienten für einen schweren Covid-19-Verlauf einzustufen sind. die aktuelle Datenlage spricht eher dagegen. Es existieren nur wenige und hinsichtlich ihrer prognostischen Aussagekraft eng limitierte Daten zu Covid-19 im Kontext einer Typ-2-assoziierten Erkrankung. Die zum aktuellen Zeitpunkt verfügbaren Studien geben keinen Anhalt für ein erhöhtes Risiko für Patienten mit Allergien, Asthma oder anderen Atopie-assoziierten Erkrankungen [8, 24, 25, 26, 27, 28, 29] (Tab. 2). Der Anteil der schwer erkrankten oder verstorbenen Covid-19-Patienten mit bekanntem Asthma bronchiale lag zum Beispiel in Wuhan und Italien weit unter der dortigen Prävalenz für Asthma [18]. Bisher ungeklärt ist auch, warum bei vielen Patienten neben einer Lymphopenie eine Eosinopenie zum Zeitpunkt der stationären Aufnahme festgestellt wurde [8]. Weder erniedrigte noch erhöhte Werte von Eosinophilen konnten bislang eindeutig mit bestimmten klinischen Verläufen einer SARS-CoV-2-Infektion in Verbindung gebracht werden.
| Studie/Referenz | Population |
|---|---|
| [26] (Wuhan) | Fallserie von elf Patienten mit Covid-19, davon drei mit allergischer Erkrankung in der Vorgeschichte (1 × allergische Rhinitis, 1 × atopische Dermatitis, 1 × Urtikaria) |
| [25] (Seattle, WA, USA) | Bericht dreier Patienten, die wegen Atembeschwerden bei Covid-19 und bekannter Asthmaerkrankung orale Glukokortikoide eingenommen hatten, und eine Woche später mit akuter respiratorischer Insuffizienz hospitalisiert wurden. |
| (27] (Wuhan) | zwei von insgesamt 69 Studienpatienten mit Asthma |
| [8] (Wuhan) | Studie mit 140 Patienten, von denen zwei chronische Urtikaria, einer Asthma und zehn eine nicht abgeklärte unerwünschte Arzneimittelwirkung hatten. |
| [29] (Lombardy, Italy) | Studie mit 1.591 Patienten, bei denen auf 205 in der Anamnese die Kategorie "other" zutraf (in "other" waren neben Asthma bronchiale enthalten: Anämie, entzündliche Darmerkrankungen, chronische respiratorische Insuffizienz, endokrine Störungen, chronische Pankreatitis, Erkrankungen des Binde- und Stützgewebes, Organtransplantation, Epilepsie, neurologische Erkrankungen). |
| [28] (Aachen, Germany) | Ergebnis: Covid-19-Patienten mit respiratorischer Vorerkrankung entwickeln häufiger ein Acute Respiratory Distress Syndrome (58 vs. 42 %, 14 vs. elf Patienten, davon mit Asthma vier vs. zwei Patienten; n = 50) |
Zulassungssituation für Biologika bei Typ-2- Entzündungen im deutschsprachigen Raum
In den vergangenen Jahren wurden in Europa mehrere Biologika zugelassen, die IgE-Antikörper oder die für eine Typ-2-Entzündung relevanten Interleukine IL-4, IL-5 und IL-13 beziehungsweise deren Rezeptoren blockieren [30, 31, 32, 33, 34, 35, 36, 37, 38, 39].
Omalizumab ist für die Behandlung des schweren allergischen Asthma bronchiale bei Erwachsenen und Kindern ab sechs Jahren zugelassen, wenn eine nachgewiesene Sensibilisierung gegenüber einem ganzjährig auftretenden Aeroallergen und eine reduzierte Lungenfunktion vorliegen. Eine weitere Indikation liegt bei Jugendlichen ab zwölf Jahren und Erwachsenen für die Antihistaminika-resistente, chronische spontane Urtikaria vor. Mit Mepolizumab, Benralizumab und Reslizumab stehen mehrere Vertreter der IL-5- beziehungsweise IL-5-Rezeptor-Blockade für Erwachsene und teilweise auch für Kinder für die Behandlung des Asthmas zur Verfügung.
Dupilumab ist für die Behandlung der atopischen Dermatitis für Jugendliche ab zwölf Jahren, für Erwachsene zur Behandlung des schweren, Typ-2-dominierten Asthmas und für die Behandlung Erwachsener mit chronischer Rhinosinusitis mit nasalen Polypen (CRSwNP) zugelassen.
Tab. 3 stellt einen Überblick zur Zulassungssituation im deutschsprachigen Raum dar. Die Selbstverabreichung durch den Patienten ist gesondert aufgeführt, da sie eine wesentliche Erleichterung zur Versorgung geeigneter Patienten während der SARS-CoV-2-Pandemie ist.
| Wirkstoff Handelsname | Target | Indikation | Eigenadministration |
|---|---|---|---|
| Omalizumab Xolair® | IgE | IgE-vermitteltes Asthma (≥ 6 Jahre) Chronische spontane Urtikaria (≥ 12 Jahre) | ja (Schweiz: nein) |
| Mepolizumab Nucala® | IL-5 | Asthma (≥ 6 J, Schweiz: > 12 Jahre) EGPA (nur in Schweiz: ≥ 18 Jahre) | ja |
| Reslizumab Cinqaero® | IL-5 | Asthma (≥ 18 Jahre) | nein |
| Benralizumab Fasenra® | IL-5-Rezeptor | Asthma (≥ 18 Jahre) | ja |
| Dupilumab Dupixent® | IL-4-Rezeptor (von IL-4 und -13 geteilter Rezeptor) | CRSwNP (≥ 18 Jahre) Atopische Dermatitis (≥ 12 Jahre) Asthma (≥ 12 Jahre) (Schweiz: im Zulassungsverfahren) | ja |
| CRSwNP, chronische Rhinosinusitis mit nasalen Polypen, EGPA, eosinophile Granulomatose mit Polyangiitis | |||
Typ-2-Blockade und Virusinfektionen
Virusinfektionen der oberen und unteren Atemwege wurden mit der Entstehung und Exazerbation allergischer Erkrankungen in Verbindung gebracht [40, 41, 42]. Die Infektion und Persistenz von Viruspartikeln in der Mukosa könnte das lokale, angeborene Immunsystem in seiner Effektivität hemmen und die Typ-2-Inflammation fördern. Die Blockade der Typ-2-Inflammation durch therapeutische Antikörper gegen IgE, IL-5 beziehungsweise den IL-5-Rezeptor oder den IL-4/-13-Rezeptor steht bisher nicht im Verdacht, das Risiko von Virusinfektionen zu erhöhen. IL-4 nimmt jedoch durch zwei unterschiedliche Haplotypen im IL-4-Gen eine duale Rolle bei Virusinfektionen ein und kann Infektionen mit Herpesvirus und Norovirus [43] sowie mit dem Corona-verwandten Ebolavirus [44] begünstigen. Andererseits kann IL-4 auch Virusinfektionen durch Promotion der angeborenen Immunität inhibieren [45, 46, 47].
Daher braucht es mehr Evidenz aus klinischen Beobachtungen, um klare Empfehlungen konkret in Hinblick auf Covid-19 geben zu können. Tab. 4 gibt eine Übersicht über die Häufigkeit von Virusinfektionen als unerwünschte Ereignisse im Rahmen von Studien mit diesen monoklonalen Antikörpern. Es existieren Berichte über ein selteneres Auftreten von Virusinfekten unter anti-IgE-Behandlung mit Omalizumab, da möglicherweise durch die Therapie die Funktion und Produktion von IFN-α durch die plasmozytoiden dendritischen Zellen (pDC) gestärkt wird. Dies führte zu einer gesteigerten Virusabwehr und zur Reduktion von Virus-induzierten Asthma-Exazerbationen [40, 48]. Auch für die Typ-2-Blockade mit anti- IL-5-Antikörpern (Mepolizumab, Reslizumab) beziehungsweise anti-IL-5-Rezeptor-Antikörpern (Benralizumab) lag das Risiko viraler Atemwegsinfektionen in den Studien-Verumgruppen gleich oder niedriger im Vergleich zur Placebogruppe (Tab. 4).
| Wirkstoff | Indikation | Intervall/Dosierung | Studie (n) | AEs Biologikum/Placebo (n/Gruppe) |
|---|---|---|---|---|
|
Benralizumab (anti-IL-5R) |
schweres, unkontrolliertes Asthma |
Q4W + Placebo, Q4W + Q4W, Q8W + Placebo, Q8W + Q8W |
Busse et al. (n = 1.576a) | VURTI 15-16 %/14-15 %b (1.030/546) URTI 6 %/7-8 % Pnx < 1-1 % |
|
Dupilumab (anti-IL-4Rα) |
atopische Dermatitis | verschiedene (QW, Q2W, Q4W, Q8W, Placebo) | Worm et al. (n = 422) | URTI 5,7-8,3/7,3 IFZ 0-5,7/1,2 HSV1 1,8-6/3,7 VURTI 0-1,2/3,7 |
| 200 (Jugendliche) / 300 mg Q2W, 300 mg Q4W, Placebo | Simpson et al. (n = 250) | URTI 7,2-12,2/17,6 HSV 1,2-4,8/3,5 | ||
|
300 mg QW / Q2W, Placebo |
Simson et al. (n = 1.379) | URTI 3-5/2 HSV 0-3/1 HSV1 2-4/2 HSV2 1/1 VZV 0-1/1 | ||
|
300 mg QW / Q2W, Placebo |
Blauvelt et al. (n = 740) | URTI 10-14/10 IFZ 3-4/5 HSV 2-3/1 VZV < 1-1/2 HSV1 4-5/3 | ||
| 300 mg Q2W (open label) | Faiz et al. (n = 241) | URTI 1,2 HSV < 2,4 | ||
| 300 mg Q2W | Deleuran et al. (n = 1.491) | VURTI 2,5 IFZ 2,1 HSV1 4,3 | ||
| CRSwNP | 300 mg Q2W, Placebo | Bachert et al. (n = 276) | URTI 5,4-6,7/12,7 | |
| moderates bis schweres, unkontrolliertes Asthma | 200/300 mg Q2W, Placebo | Castro et al. (n = 1.897) | VURTI 18,2/19,6 URTI 11,6/13,6 IFZ 5,9/8,0 | |
| schweres, steroidabhängiges Asthma | 300 mg Q2W, Placebo | Rabe et al. (n = 210) | VURTI 9/18 IFZ 3/6 | |
|
Mepolizumab (anti-IL-5) |
Schweres, eosinophiles Asthma | 75 mg i.v. Q4W / 100 mg s.c. Q4W | Ortega et al. (n = 576) | IFZ 5/3 (191/191), 3/3 (194/191) VURTI 1/< 1, 0/< 1 HSV1 < 1 alle HSV2 < 1/0, < 1/0 VZV < 1/0, 1/0 |
| 100 mg Q4W | Chupp et al. (n = 551) | IFZ 3/1 (273/278) HSV 1 < 1/0 VZV < 1/< 1 | ||
| Schweres, steroidabhängiges, eosinophiles Asthma | 100 mg s. c. Q4W | Bel et al. (n = 135) | IFZ 4/2 (69/66) VURTI ½ VZV 0/2 | |
|
Reslizumab (anti-IL-5) |
Schweres, eosinophiles Asthma | 3 mg/kg i. v. Q4W | Virchow et al. (n = 1.758) | URTI 9/9 (1.028/730) IFZ 3/5 |
|
Omalizumab (anti-IgE) |
Schweres, allergisches Asthma | Q2W / Q4W | Esquivel et al. (n = 327) |
Rhinovir. 3,3/3,4 (243/84) |
|
AE, Arzneimitteleinheiten; CRSwNP, chronische Rhinosinusitis mit nasalen Polypen; HSV, Herpes simplex-Virus; IFZ, Influenza; Pnx, Pneumonie; (V)URTI, (viral) upper respiratory tract infections; VZV, Varizella-zoster-Virus; QW, quaque once weekly amehrstufiges Design; Gesamtzahl aus allen drei Teilstudien bPatienten bekamen erst Placebo, dann Verum. Prozentwerte werden wegen stark differierender Gruppengröße angegeben. | ||||
Typ-2-Blockade bei SARS-CoV-2
Bislang ist nicht geklärt, ob die Blockade der Typ-2-Inflammation oder von IgE mit einem veränderten Risiko für eine Erkrankung oder den Verlauf von Covid-19 einhergeht. Im Falle eines Zytokinsturms sind mögliche nachteilige Effekte durch eine Blockade der Typ-2-Immunreaktionslage denkbar, die es jedoch zu untersuchen gilt. Erste Berichte zeigen zumindest keinen schlechteren Krankheitsverlauf bei Covid-19-Patienten mit eosinophilen Erkrankungen unter Biologikatherapie [24, 49], weitere Studienergebnisse sollten jedoch abgewartet werden, insbesondere auch vor dem Hintergrund, dass sich SARS-CoV-2 mittels Mutationen rasch weiterentwickelt [50].
In Metaanalysen von Agache et al. [51, 52, 53] wurde eine geringfügig erhöhte Rate (niedriges bis mittleres Risiko einer Assoziation) von unerwünschten Wirkungen beim Einsatz von anti-IL-5/5R, anti-IL-4/13R und anti-IgE bei schwerem Asthma unabhängig von Covid-19 gezeigt. Daher besteht keine eindeutige Empfehlung hinsichtlich der Entscheidungsfindung, eine Biologikatherapie während einer Infektion mit SARS-CoV-2 fortzuführen oder vorübergehend zu unterbrechen. Eine Therapieunterbrechung könnte mit dem Nachteil verbunden sein, keine optimale Kontrolle der allergischen Erkrankung gewährleisten zu können oder bei Exazerbationen systemische Glukokortikoide einsetzen zu müssen, für die ein erhöhtes Risiko für einen möglicherweise schwereren Verlauf von Covid-19 beschrieben wurde [54].
Empfehlungen zum Management allergischer/Atopie-assoziierter Erkrankungen unter anti-Typ-2-Therapie während der Covid-19-Pandemie
Zur Sicherstellung einer indikationsgerechten, qualitativ hochwertigen und akkuraten Versorgung von Patienten unter anti-Typ-2-Therapie bei zugrundeliegender atopisch-eosinophiler oder -allergischer Erkrankung sollte die Antikörpertherapie bei Patienten ohne Hinweis auf eine SARS-CoV-2-Infektion auch während der andauernden Pandemie unverändert fortgesetzt werden (Tab. 1). Um aktuellen Versorgungsengpässen im Krankenhaus und den erschwerten Hygienebedingungen gerecht zu werden, sollte das Follow-Up bei geeigneten Patienten und gegebenen technischen und medizinischen Voraussetzungen auch telemedizinisch oder telefonisch stattfinden. Eine umfassende Schulung der Patienten in Bezug auf Dokumentation der Krankheitsaktivität und gegebenenfalls Selbstverabreichung der Medikation ist hierfür wünschenswert. Dies wird durch die teilweise Verfügbarkeit von anwendungsfreundlichen Pen-Systemen zur Selbstapplikation erleichtert.
Generell gilt in Ländern mit niedrigen Infektionszahlen und einer damit verbundenen Lockerung der Covid-19-assoziierten Restriktionen keine Kontraindikation zum Beginn einer Biologikatherapie bei Patienten ohne Hinweis auf eine aktuelle SARS-CoV-2 Infektion.
Bei nachgewiesener SARS-CoV2-Infektion/Covid-19-Erkrankung mit leichtem bis mittelschwerem Verlauf kann nach derzeitiger Einschätzung die Biologikatherapie in den hier besprochenen Indikationen fortgeführt werden, insofern eine individuelle Abwägung von Risiken und Vorteilen für den Patienten hierfür spricht. Dies hat durch einen Spezialisten zu erfolgen und eine entsprechende Aufklärung der Patienten zur eingeschränkten Datenlage wird empfohlen.
Bei schwerem Verlauf der Covid-19-Erkrankung sollte eine Verlängerung des Dosierungsintervalls oder eine Therapiepause in Erwägung gezogen werden. Bei dieser Abwägung ist auch das Risiko einer potenziell erforderlichen systemischen Glukokortikoidtherapie zu berücksichtigen. Im Rahmen einer Quarantänesituation kann die medizinische Begleitung gegebenenfalls telemedizinisch erfolgen, insbesondere auch mit dem Ziel, die Basistherapie mit topischen Glukokortikoiden, inhalativen Bronchodilatatoren, Antihistaminika et cetera gemäß entsprechender Leitlinienempfehlungen fortzusetzen oder bedarfsgerecht auszuweiten [36, 37, 54, 55, 56, 57, 58, 59].
Sollten Krankenhausaufenthalte wegen Exazerbation von Asthma- oder anderer Typ-2-assoziierter Erkrankungen nötig sein, sind aktuelle Leitlinien hinsichtlich Diagnostik und Therapie zu befolgen. Operationen an den Nasennebenhöhlen für CRSwNP sollten bei Patienten mit Verdacht auf oder bestätigter Covid-19-Erkrankung möglichst aufgeschoben werden.
Bei dringend indizierter Systemtherapie für eine schwere atopische Dermatitis ist eine Abwägung zur Therapie mit Biologika, klassischen Immunsuppressiva oder systemischen Glukokortikoiden zu treffen, wobei systemische Glukokortikoide aufgrund ihrer breiten immunsupprimierenden Wirkung nicht empfehlenswert sind (siehe oben). Für Cyclosporin A (CyA) als zugelassene Therapieoption für die atopische Dermatitis (AD) haben In-vitro-Untersuchungen antivirale Eigenschaften nahegelegt [60]. Eine nach Organtransplantation durchgeführte T-Zell-gerichtete Immunsuppression (CyA, Tacrolimus) wird als möglicher protektiver Faktor vor schweren klinischen Komplikationen einer SAS-CoV-2 Infektion diskutiert [61] und CyA für eine Anwendung bei Covid-19 diskutiert [62, 63], belastbare klinische Daten sind bislang allerdings nicht publiziert. Zu beachten sind mögliche metabolische Interaktionen zwischen CyA und Lopinavir/Ritonavir (CYP3-Inhibitoren). Berichtet wurde über zwei Patienten mit AD, bei denen es unter der Therapie mit Dupilumab nicht zu einem schwereren Verlauf von Covid-19 kam [64].
Schlussfolgerung
Die derzeit verfügbaren Daten deuten darauf hin, dass wahrscheinlich kein erhöhtes Risiko eines schweren Covid-19-Verlaufs für Patienten mit Allergien und Atopie-assoziierten Erkrankungen vorliegt. Studienergebnisse mit speziellen Subgruppenanalysen zu besonders schwer erkrankten Atopiepatienten oder ihrer Therapie fehlen jedoch bisher. Die Auswirkungen einer Typ-2- oder IgE-Blockade auf eine Infektion mit SARS-CoV-2 sind bisher unklar.
Bei leichtem bis mittelschwerem Verlauf einer Covid-19-Erkrankung raten wir zur Fortführung der Biologikatherapie in den hier angesprochenen Indikationen, wenn eine individuelle Abwägung von Nutzen und Risiken für den Patienten hierfür spricht und der Patient - nach sachgerechter Aufklärung über die eingeschränkte Datenlage - zustimmt.
Bei schwerem Verlauf der Covid-19-Erkrankung sollte in den hier angesprochenen Indikationen eine Verlängerung des Dosierungsintervalls oder eine Therapiepause in Erwägung gezogen werden. Diese Abschätzung sollte individuell getroffen werden und das Risiko einer potenziell erforderlichen systemischen Glukokortikoidtherapie einschließen.
Bei allen anderen Patienten, bei denen weder der Verdacht auf eine SARS-CoV-2-Infektion noch eine nachgewiesene SARS-CoV-2-Infektion vorliegen, kann die Therapie mit Biologika zur Behandlung von Asthma bronchiale, AD, CRSwNP und spontaner Urtikaria in der aktuellen SARS-CoV-2-Pandemie unverändert fortgesetzt oder auch neu begonnen werden.
Der Einsatz von Telemedizin für die Therapiebegleitung und für Schulungen ist empfehlenswert und kann eine Fortsetzung der Biologikatherapie durch Selbstadministration von Injektionen erleichtern.
Abkürzungen.
ACE-2 Angiotensin-Converting-Enzym-2
AD Atopische Dermatitis
Covid-19 Coronavirus-Krankheit 2019
CRSwNP Chronischer Rhinosinusitis mit nasalen Polypen
CyA Cyclosporin A
ICTV Internationale Komitee für die Taxonomie von Viren
IL Interleukin
MBL Mannose-bindendes Lektin
MERS Middle East Respiratory Syndrome
NK-Zellen Natürliche Killer-Zellen
pDC Plasmozytoide dendritische Zellen
SARS Severe acute respiratory syndrome
SARS-CoV Severe acute respiratory syndrome-Coronavavirus
SARS-CoV-2 Severe acute respiratory syndrome-Coronavavirus 2
Typ-1-IFN Typ-1-Interferon
Prof. Dr. Ludger Klimek.
Zentrum für Rhinologie und Allergologie
An den Quellen 10
65183 Wiesbaden, Deutschland
E-Mail: ludger.klimek@allergiezentrum.org
Interessenkonflikt
R. Mösges hat Honorare und/oder Zuschüsse von Allergopharma, Allergy Therapeutics, Bencard, Leti, Lofarma, Stallergenes, Optima, Friulchem, Hexal, Klosterfrau, FAES, Meda, Novartis, UCB, BitopAG, Hulka, Ursapharm, Menarini, Mundipharma, Pohl-Boskamp, Inmunotek, Hikma, Sandoz, Lek, Cassella, SanofiGenzyme, Engelhard, SmartPeakFlow, Strathos außerhalb der eingereichten Arbeit.
M. Maurer erhielt Zuschüsse/Forschungsunterstützung und/oder Honorare für Beratung oder Vorträge von Amgen, Allakos, Celldex, CSL Behring, FAES, Genentech, Lilly, Merckle Recordati, Moxie, Novartis, Roche, Sanofi, Takeda, MSD, UCB. und Uriach, außerhalb der vorliegenden Arbeit.
P. Schmid-Grendelmeier hat außerhalb der vorliegenden Arbeit von AstraZeneca, GSK, Novartis Pharma und Sanofi-Genzyme Rednerhonorare und Honorare für Beiräte erhalten.
M. Worm erhielt Honorare und/oder Beratungsgebühren von folgenden Unternehmen: ALK-Abelló Arzneimittel GmbH, Mylan Deutschland GmbH, Leo Pharma GmbH, Sanofi-Aventis Deutschland GmbH, Regeneron Pharmaceuticals, DBV Technologies SA, Stallergenes GmbH, HAL Allergie GmbH, Allergopharma GmbH & Co.KG, Bencard Allergie GmbH, Aimmune Therapeutics UK Limited, Actelion Pharmaceuticals Deutschland GmbH, Novartis AG, Biotest AG., AbbVie Deutschland GmbH & Co. KG und Lilly Deutschland GmbH, außerhalb der vorliegenden Arbeit.
O. Pfaar erhielt Zuschüsse und/oder Honorare von ALK-Abelló, Allergopharma, Stallergenes Greer, HAL Allergy Holding BV / HAL Allergie GmbH, von Bencard Allergie GmbH/Allergietherapeutika, Lofarma, Biomay, Circassia, ASIT Biotech Tools SA, Laboratorios LETI / LETI Pharma, MEDA Pharma/MYLAN, Anergis SA, Mobile Chamber Experts (einem GA2LEN-Partner), Indoor Biotechnologies, Glaxo Smith Kline, Astellas Pharma Global, EUFOREA, Roxall, Novartis, Sanofi Aventis, Med Update Europe GmbH, streamedup! GmbH, außerhalb der eingereichten Arbeit.
H. Merk berichtet über Zuschüsse und/oder Honorare von Meda, Stallergenes, Sanofi, Bayer, BMS, J & J außerhalb der eingereichten Arbeit.
S. Lau ist im Advisory Board Sanofi Aventis.
S. Korn hat außerhalb der vorliegenden Arbeit Rednerhonorare und Honorare für Beiräte von AstraZeneca, GSK, Novartis und Sanofi erhalten.
U. Darsow war Referent, Prüfarzt und Berater für ALK Abello, Bencard and Novartis Pharma - außerhalb der vorliegenden Arbeit
O. Palomares erhielt außerhalb der vorliegenden Arbeit Forschungsstipendien und/oder Honorare von Allergy Therapeutics, Amgen, AstraZeneca, Diater, GlaxoSmithKline, S.A., Inmunotek S.L., Novartis, Sanofi-Genzyme und Stallergenes. Oscar Palomares hat an Beratungsgremien von Novartis und Sanofi-Genzyme teilgenommen.
T. Biedermann beriet oder erhielt ein Honorar für Vorträge oder Forschungsstipendien von folgenden Unternehmen: Alk-Abelló, Celgene-BMS, Lilly Deutschland GmbH, Mylan, Novartis, Phadia-Thermo Fisher, Sanofi-Genzyme, Regeneron.
R. Valenta erhielt Forschungsstipendien von Viravaxx, Wien, Österreich und von HVD Life Sciences, Wien, Österreich und fungiert als Berater für Viravaxx.
R. Buhl erhielt Honorare für Vorträge und/oder Beratung von AstraZeneca, Boehringer Ingelheim, Chiesi, Cipla, Novartis, Roche, Sanofi und Teva sowie Forschungsunterstützung der Universitätsmedizin Mainz durch Boehringer Ingelheim, GlaxoSmithKline, Novartis und Roche - außerhalb der vorliegenden Arbeit.
R. Brehler erhielt Honorare für Vortragstätigkeiten und/oder Beratertätigkeiten und/oder Klinische Studien von folgenden Firmen: ALK, Allergopharma, Almirall, Astra Zeneca, Bencard, Gesellschaft zur Förderung der Dermatologischen Forschung und Fortbildung e.V., Gesellschaft für Information und Organisation mbH, GSK, Dr. Pfleger, HAL, Leti, Merck, Novartis, Oto-Rhino-Laryngologischer Verein, Pierre Fabre, Pohl Boskamp, Stallergenes, Thermo-Fischer, Biotech Tools, Genentech, Circassia
A. Bossios berichtet über Honorare für Beratungs- und/oder Vortragstätigkeiten von Novartis, AstraZeneca, GSK, TEVA außerhalb der eingereichten Arbeit.
J. Bousquet berichtet über Honorare von Chiesi, Cipla, Hikma, Menarini, Mundipharma, Mylan, Novartis, Sanofi-Aventis, Takeda, Teva, Uriach, KYomed-Innov und Purina, außerhalb der vorliegenden Arbeit
J. Schwarze erhielt Honorare von MYLAN, F2F-Veranstaltungen und Unterstützung aus der Industrie für Bildungsaktivitäten der Scottish Allergy and Respiratory Academy und des Allergie Networtk Scotland für Kinder und Jugendliche, außerhalb der vorliegenden Arbeit. Unterstützung der Industrie für EAACI. Jürgen Schwarze ist EAACI-Generalsekretär 2019-2021.
J. Hagemann hat Rednerhonorare von Novartis Pharma erhalten
M. Wagenmann erhielt außerhalb der vorliegenden Arbeit Honorare für Beratung und / oder Vorträge von: ALK-Abelló, Allergopharma, AstraZeneca, Bencard-Allergie, Genzyme, HAL-Allergie, Infectopharm, LETI Pharma, MEDA Pharma, Novartis, Sanofi Aventis, Stallergenes, Teva.
L. Klimek berichtet über Zuschüsse und/oder Honorare von Allergopharma, MEDA / Mylan, HAL Allergie, ALK Abelló, LETI Pharma, Stallergenes, Quintiles, Sanofi, ASIT Biotech, Lofarma, Allergy Therapeut., AstraZeneca, GSK, Inmunotk, außerhalb der eingereichten Arbeiten; und Mitgliedschaft bei folgenden Organisationen: AeDA, DGHNO, Deutsche Akademie für Allergologie und klinische Immunologie, HNO-BV GPA, EAACI
T. Eiwegger, K.-C. Bergmann, M. Akdis, O. Spranger, N. Mülleneisen, A.-H. Fink-Wagner, K. F. Rabe, W. Czech, S. Wöhrl, J. Buters, F. Horak, W. Schlenter, I. Pali-Schöll, A. Matucci, A. Vultaggio, Z. Szepfalusi, C. Vogelberg, T. Werfel, U. Jappe, J.-P. Michel, P. Kauppi, A.Chaker, E. F. Knol, T. Chivato, K. Hoffmann-Sommergruber, A. R. Rosenkranz, W. Hötzenecker, M. Ollert, A. Kothari, W. Aberer, A. Kolios, D. Firinu, P.-V. Tomazic, E. Jensen-Jarolim, F. Hentges, E. Untersmayr, I. AgacheI, S. BavbekI, I. Casper, S. Chan, A. Chatzipetrou, , W. Pohl, T. Bieber, T. Keil, J. Kleine-Tebbe, J. Saloga, P. Staubach, U. Rabe, C. Vogelmeier, K. Jung, J. Ring, W. Wehrmann, S. Becker, L. Freudelsperger, K. Nemat, H. Wrede, T. Fuchs, V. Niederberger-Leppin, W. Pohl, R. Roller-Wirnsberger, P. M. Matricardi, F. Spertini, N. Khaltaev, L. Nicod, M. Idzko, E. Hamelmann, T. Jakob, C. Taube, L. O´Mahony, S. del Giacco, T. Zuberbier, C. Akdis und M. Jutel haben keine Interessenkonflikte.
Contributor Information
Ludger Klimek, Email: Ludger.Klimek@allergiezentrum.org.
Oliver Pfaar, Email: oliver@pfaar.org.
Margitta Worm, Email: margitta.worm@charite.de.
Jan Hagemann, Email: jan.hagemann@unimedizin-mainz.de.
Christian Vogelberg, Email: info@uniklinikum-dresden.de.
Oscar Palomares, Email: oscar.palomares@quim.ucm.es.
Karl-Christian Bergmann, Email: kcbergmann@hotmail.com.
Thomas Bieber, Email: Thomas.Bieber@ukb.uni-bonn.de.
Jeroen Buters, Email: buters@tum.de.
Jörg Kleine-Tebbe, Email: kleine-tebbe@allergie-experten.de.
Marcus Maurer, Email: maurer@charite.de.
Ralph Mösges, Email: Ralph@Moesges.de.
Joachim Saloga, Email: saloga@hautklinik.klinik.uni-mainz.de.
Uta Rabe, Email: rabe@johanniter-treuenbrietzen.de.
Claus Vogelmeier, Email: Claus.Vogelmeier@med.uni-marburg.de.
Kirsten Jung, Email: kirsten-jung@t-online.de.
Johannes Ring, Email: johannesring@web.de.
Sven Becker, Email: sven.becker@med.uni-muenchen.de.
Randolf Brehler, Email: r.brehler@uni-muenster.de.
Thomas Fuchs, Email: Fuchsth@med.uni-goettingen.de.
Stefan Wöhrl, Email: stefan.woehrl@faz.at.
Eckard Hamelmann, Email: eckard.hamelmann@evkb.de.
Thilo Jakob, Email: Thilo.Jakob@derma.med.uni-giessen.de.
Thomas Werfel, Email: werfel.thomas@mh-hannover.de.
Martin Wagenmann, Email: Martin.Wagenmann@uni-duesseldorf.de.
Christian Taube, Email: christian.taube@ruhrlandklinik.uk-essen.de.
Literatur
- 1.Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat Microbiol. 2020;5:536-44 [DOI] [PMC free article] [PubMed]
- 2.Li Q, Guan X, Wu P, Wang X, Zhou L, Tonget Y, et al. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia. N Engl J Med. 2020; 382:1199-207 [DOI] [PMC free article] [PubMed]
- 3.Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382:1708-20 [DOI] [PMC free article] [PubMed]
- 4.Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497-506 [DOI] [PMC free article] [PubMed]
- 5.Channappanavar R, Perlman S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Semin Immunopathol 2017;39:529-39 [DOI] [PMC free article] [PubMed]
- 6.Xu X, Gao X. Immunological responses against SARS-coronavirus infection in humans. Cell Mol Immunol. 2004;1:119-22 [PubMed]
- 7.Chen Y, Liu Q, Guo D. Emerging coronaviruses: Genome structure, replication, and pathogenesis. J Med Virol. 2020;92:418-23 [DOI] [PMC free article] [PubMed]
- 8.Zhang JJ, Dong X, Cao YY, Yuan YD, Yang YB, Yan YQ, et al. Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. Allergy. 2020; https://doi.org/10.1111/all.14238 [DOI] [PubMed]
- 9.Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395:1054-62. [DOI] [PMC free article] [PubMed]
- 10.WHO. World Health Organization. www.who.int. Published 2020. Accessed 26.05.2020
- 11.Aoshi T, Koyama S, Kobiyama K, Akira S, Ishii KJ. Innate and adaptive immune responses to viral infection and vaccination. Curr Opin Virol. 2011;1:226-32 [DOI] [PubMed]
- 12.Channappanavar R, Fehr AR, Vijay R, Mack M, Zhao J, Meyerholz DK, et al. Dysregulated Type I Interferon and Inflammatory Monocyte-Macrophage Responses Cause Lethal Pneumonia in SARS-CoV-Infected Mice. Cell Host Microbe. 2016;10;19:181-93 [DOI] [PMC free article] [PubMed]
- 13.Thevarajan I, Nguyen THO, Koutsakos M, Druce J, Caly L, van de Sandt CE, et al. Breadth of concomitant immune responses prior to patient recovery: a case report of non-severe COVID-19. Nat Med. 2020;26:453-5 [DOI] [PMC free article] [PubMed]
- 14.Guo L, Ren L, Yang S, Xiao M, Chang D, Yang F, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clin Infect Dis. 2020; https://doi.org/10.1093/cid/ciaa310 [DOI] [PMC free article] [PubMed]
- 15.To KK, Tsang OT, Leung WS, Tam AR, Wu TC, Lung DC, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis 2020;20:565-74 [DOI] [PMC free article] [PubMed]
- 16.Matricardi PM, Dal Negro RW, Nisini R. The first, holistic immunological model of COVID-19: implications for prevention, diagnosis, and public health measures. Pediatr Allergy Immunol. 2020; https://doi.org/10.1111/pai.13271 [DOI] [PMC free article] [PubMed]
- 17.Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181:271-280.e278. [DOI] [PMC free article] [PubMed]
- 18.Li X, Xu S, Yu M, Wang K, Tao Y, Zhou Y, et al. Risk factors for severity and mortality in adult COVID-19 inpatients in Wuhan. J Allergy Clin Immunol. 2020;S0091-6749(20)30495-4; https://doi.org/10.1016/j.jaci.2020.04.006 [DOI] [PMC free article] [PubMed]
- 19.Lagunas-Rangel FA, Chávez-Valencia V. High IL-6/IFN-γ ratio could be associated with severe disease in COVID-19 patients. J Med Virol 2020; https://doi.org/10.1002/jmv.25900 [DOI] [PMC free article] [PubMed]
- 20.Arnaldez FI, O'Day SJ, Drake CG, Fox BA, Fu B, Urba WJ, et al. The Society for Immunotherapy of Cancer perspective on regulation of interleukin-6 signaling in COVID-19-related systemic inflammatory response. J Immunother Cancer 2020;8:e000930 [DOI] [PMC free article] [PubMed]
- 21.Cunningham L, Kimber I, Basketter DA, McFadden JP. Why judiciously timed anti-IL 6 therapy may be of benefit in severe COVID-19 infection. Autoimmun Rev. 2020;102563; https:doi.org/10.1016/j.autrev.2020.102563 [DOI] [PMC free article] [PubMed]
- 22.Sabogal Pineros YS, Bal SM, Dijkhuis A, Majoor CJ, Dierdorp BS, Dekkeret T, et al. Eosinophils capture viruses, a capacity that is defective in asthma. Allergy. 2019;74:1898-909 [DOI] [PMC free article] [PubMed]
- 23.Jackson DJ, Busse WW, Bacharier LB, Kattan M, O'Connor GT, Wood RA, et al. Association of respiratory allergy, asthma, and expression of the SARS-CoV-2 receptor ACE2. J Allergy Clin Immunol. 2020;22:S0091-6749(20)30551-0 [DOI] [PMC free article] [PubMed]
- 24.Lindsley AW, Schwartz JT, Rothenberg ME. Eosinophil Responses During COVID-19 Infections and Coronavirus Vaccination. J Allergy Clin Immunol. 2020;25:S0091-6749(20)30569-8 [DOI] [PMC free article] [PubMed]
- 25.Bhatraju PK, Ghassemieh BJ, Nichols M, Kim R, Jerome KR, Nalla AK, et al. Covid-19 in Critically Ill Patients in the Seattle Region - Case Series. N Engl J Med. 2020;382:2012-22 [DOI] [PMC free article] [PubMed]
- 26.Dong X, Cao YY, Lu XX, Zhang JJ, Du H, Yanet YQ, et al. Eleven faces of coronavirus disease 2019. Allergy. 2020; https://doi.org/10.1111/all.14289 [DOI] [PMC free article] [PubMed]
- 27.Wang Z, Yang B, Li Q, Wen L, Zhang R. Clinical Features of 69 Cases with Coronavirus Disease 2019 in Wuhan, China. Clin Infect Dis. 2020; https://doi.org/10.1093/cid/ciaa272 [DOI] [PMC free article] [PubMed]
- 28.Dreher M, Kersten A, Bickenbach J, Balfanz P, Hartmann B, Cornelissen C, et al. The Characteristics of 50 Hospitalized COVID-19 Patients With and Without ARDS. Dtsch Arztebl International. 2020;117:271-8 [DOI] [PMC free article] [PubMed]
- 29.Grasselli G, Zangrillo A, Zanella A, Antonelli M, Cabrini L, Castelli A, et al. Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region, Italy. Jama. 2020;323:1574-81 [DOI] [PMC free article] [PubMed]
- 30.Agache I, Akdis CA. Precision medicine and phenotypes, endotypes, genotypes, regiotypes, and theratypes of allergic diseases. J Clin Invest. 2019;130:1493-503 [DOI] [PMC free article] [PubMed]
- 31.Boyman O, Kaegi C, Akdis M, Bavbek S, Bossios A, Chatzipetrou A, et al. EAACI IG Biologicals task force paper on the use of biologic agents in allergic disorders. Allergy. 2015;70:727-54 [DOI] [PubMed]
- 32.Breiteneder H, Diamant Z, Eiwegger T, Fokkens WJ, Traidl-Hoffmann C, Nadeau K, et al. Future research trends in understanding the mechanisms underlying allergic diseases for improved patient care. Allergy. 2019;74:2293-311 [DOI] [PMC free article] [PubMed]
- 33.Palomares O, Untersmayr E, Gutermuth J, Agache I, Ajeganova S, Bavbek S, et al. Biologicals in allergic diseases and asthma: Toward personalized medicine and precision health: Highlights of the 3rd EAACI Master Class on Biologicals, San Lorenzo de El Escorial, Madrid, 2019. Allergy. 2020;75:936-40 [DOI] [PubMed]
- 34.Pfaller B, Yepes-Nunez JJ, Agache I, Akdis CA, Alsalamah M, Bavbek S, et al. Biologicals in atopic disease in pregnancy: an EAACI position paper. Allergy. 2020; https://doi.org/10.1111/all.14282 [DOI] [PubMed]
- 35.Eyerich S, Metz M, Bossios A, Eyerich K. New biological treatments for asthma and skin allergies. Allergy. 2020;75:546-60 [DOI] [PubMed]
- 36.Zuberbier T, Aberer W, Asero R, Bindslev-Jensen C, Brzoza Z, Canonica GW, et al. The EAACI/GA(2)LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018;73:1393-414 [DOI] [PubMed]
- 37.Fokkens WJ, Lund V, Bachert C, Mullol J, Bjermer L, Bousquet J, et al. EUFOREA consensus on biologics for CRSwNP with or without asthma. Allergy. 2019;74: 2312-9 [DOI] [PMC free article] [PubMed]
- 38.Jonstam K, Swanson BN, Mannent LP, Cardell LO, Tian N, Wang Y, et al. Dupilumab reduces local type 2 pro-inflammatory biomarkers in chronic rhinosinusitis with nasal polyposis. Allergy. 2019;74:743-52 [DOI] [PMC free article] [PubMed]
- 39.Hassani M, Koenderman L. Immunological and hematological effects of IL-5(Ralpha)-targeted therapy: An overview. Allergy. 2018;73:1979-88 [DOI] [PMC free article] [PubMed]
- 40.Busse WW, Morgan WJ, Gergen PJ, et al. Randomized trial of omalizumab (anti-IgE) for asthma in inner-city children. N Engl J Med. 2011;364:1005-15 [DOI] [PMC free article] [PubMed]
- 41.Edwards MR, Strong K, Cameron A, Walton RP, Jackson DJ, Johnston SL. Viral infections in allergy and immunology: How allergic inflammation influences viral infections and illness. J Allergy Clin Immunol. 2017;140:909-20 [DOI] [PMC free article] [PubMed]
- 42.Jartti T, Smits HH, Bonnelykke K, Bircan O, Elenius V, Konradsen JR, et al. Bronchiolitis needs a revisit: Distinguishing between virus entities and their treatments. Allergy. 2019;74:40-52 [DOI] [PMC free article] [PubMed]
- 43.Maizels RM, William CG. How helminths go viral. Science 2014;345:517-8 [DOI] [PubMed]
- 44.Rogers KJ, Brunton B, Mallinger L, Bohan D, Sevcik KM, Chen J, et al. IL-4/IL-13 polarization of macrophages enhances Ebola virus glycoprotein-dependent infection. PLoS Negl Trop Dis. 2019;13:e0007819. [DOI] [PMC free article] [PubMed]
- 45.Lee A, Park SP, Park CH, Kang BH, Park SH, Ha SJ, et al. IL-4 Induced Innate CD8+ T Cells Control Persistent Viral Infection. PLoS Pathog. 2015;11:e1005193 [DOI] [PMC free article] [PubMed]
- 46.Lin S-J, Shu P-Y, Chang C, Ng A-K, Hu C-p. IL-4 suppresses the expression and the replication of hepatitis B virus in the hepatocellular carcinoma cell line Hep3B. J Immunol. 2003;171:4708-16 [DOI] [PubMed]
- 47.Portales-Cervantes L, Crump OM, Dada S, Liwski CR, Gotovina J, Haidl ID, et al. IL-4 enhances interferon production by virus-infected human mast cells. J Allergy Clin Immunol. 2020;S0091-6749(20)30264-5 [DOI] [PubMed]
- 48.Teach SJ, Gill MA, Togias A, Sorkness CA, Arbes SJ Jr, Calatroni A, et al. Preseasonal treatment with either omalizumab or an inhaled corticosteroid boost to prevent fall asthma exacerbations. J Allergy Clin Immunol. 2015;136:1476-85 [DOI] [PMC free article] [PubMed]
- 49.Carugno A, Raponi F, Locatelli AG, Vezzoli P, Gambini DM, Di Mercurio M, et al. No evidence of increased risk for COVID-19 infection in patients treated with Dupilumab for atopic dermatitis in a high-epidemic area - Bergamo, Lombardy, Italy. J Eur Acad Dermatol Venereol. 2020; https://doi.org/10.1111/jdv.16552 [DOI] [PMC free article] [PubMed]
- 50.Karamloo F, König R. SARS-CoV-2 immunogenicity at the crossroads. Allergy. 2020; https://doi.org/10.1111/all.14360 [DOI] [PMC free article] [PubMed]
- 51.Agache I, Song Y, Rocha C, Beltran J, Posso M, Steiner C, et al. Efficacy and safety of treatment with dupilumab for severe asthma: A systematic review of the EAACI guidelines-Recommendations on the use of biologicals in severe asthma. Allergy. 2020;75:1058-68 [DOI] [PubMed]
- 52.Agache I, Rocha C, Beltran J, Song Y, Posso M, Solà I, et al. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab and omalizumab) for severe allergic asthma. Allergy. 2020;75:1043-57 [DOI] [PubMed]
- 53.Agache I, Beltran J, Akdis C, Akdis M, Canelo-Aybar C, Canonica GW, et al. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. Allergy. 2020;75:1023-42 [DOI] [PubMed]
- 54.Klimek L, Forster-Ruhrmann U, Becker S, Chaker A, Huppertz T, Deitmer T, et al. Stellungnahme zur Anwendung von Glukokortikosteroiden bei entzündlichen Erkrankungen der oberen Atemwege (u. a. Allergische Rhinitis/chronische Rhinosinusitis) während der aktuellen COVID-19-Pandemie - Empfehlungen des Ärzteverbandes Deutscher Allergologen (AeDA), des Deutschen Berufsverbandes der HNO-Ärzte (BVHNO) und der AGs Klinische Immunologie, Allergologie und Umweltmedizin und Rhinologie und Rhinochirurgie der Deutschen Gesellschaft für HNO-Heilkunde, Kopf- und Halschirurgie (DGHNO-KHC). Laryngorhinootologie. 2020;99:280-1 [DOI] [PubMed]
- 55.Agache I, Lau S, Akdis CA, Smolinska S, Bonini M, Cavkaytar O, et al. EAACI Guidelines on Allergen Immunotherapy: House dust mite-driven allergic asthma. Allergy. 2019;74:855-73 [DOI] [PubMed]
- 56.Buhl R, Bals R, Baur X, Berdel D, Criée CP, Gappa M, et al. [Guideline for the Diagnosis and Treatment of Asthma - Guideline of the German Respiratory Society and the German Atemwegsliga in Cooperation with the Paediatric Respiratory Society and the Austrian Society of Pneumology]. Pneumologie 2017;71(12):e3 [DOI] [PubMed]
- 57.Pajno GB, Fernandez-Rivas M, Arasi S, Roberts G, Akdis CA, Alvaro-Lozano M, et al. EAACI Guidelines on allergen immunotherapy: IgE-mediated food allergy. Allergy. 2018;73:799-815 [DOI] [PubMed]
- 58.Roberts G, Pfaar O, Akdis CA, Ansotegui IJ, Durham SR, Gerth van Wijk R, et al. EAACI Guidelines on Allergen Immunotherapy: Allergic rhinoconjunctivitis. Allergy. 2018;73:765-98 [DOI] [PubMed]
- 59.Sturm GJ, Varga EM, Roberts G, Mosbech H, Bilò MB, Akdis CA et al. EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy. 2018;73:744-64 [DOI] [PubMed]
- 60.de Wilde AH, Pham U, Posthuma CC, Snijder EJ. Cyclophilins and cyclophilin inhibitors in nidovirus replication. Virology. 2018;522:46-55 [DOI] [PMC free article] [PubMed]
- 61.Romanelli A, Mascolo S. Immunosuppression drug-related and clinical manifestation of Coronavirus disease 2019: A therapeutical hypothesis. Am J Transplant. 2020; https://doi.org/10.1111/ajt.15905 [DOI] [PMC free article] [PubMed]
- 62.Rudnicka L, Goldust M, Glowacka P, Sikora M, Sar-Pomian M, Rakowska A, et al. Cyclosporine therapy during the COVID-19 pandemic is not a reason for concern. J Am Acad Dermatol. 2020. https://doi.org/10.1016/j.jaad.2020.04.153 [DOI] [PMC free article] [PubMed]
- 63.Tian L, Liu W, Sun L. [Role of cyclophilin A during coronavirus replication and the antiviral activities of its inhibitors]. Sheng Wu Gong Cheng Xue Bao. 2020;36:605-11 [DOI] [PubMed]
- 64.Ferrucci S, Romagnuolo M, Angileri L, Berti E, Tavecchio S. Safety of dupilumab in severe atopic dermatitis and infection of Covid-19: two case reports. J Eur Acad Dermatol Venereol. 2020; https://doi.org/10.1111/jdv.16527 [DOI] [PMC free article] [PubMed]
- 65.Tay MZ, Poh CM, Rénia L, MacAry PA, Ng LFP. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol. 2020;1-12; https://doi.org/10.1038/s41577-020-0311-8 [DOI] [PMC free article] [PubMed]