Abstract
目的
软骨损伤后自我修复能力有限,本研究通过对比血管基质组分(SVF)和脂肪间充质干细胞(ASCs)在体内促进软骨细胞成软骨能力的差异,为软骨再生筛选更加优秀的种子细胞。
方法
本研究首先构建聚-β-羟基丁酸(PHB)/3-羟基丁酸与3-羟基己酸共聚酯(PHBHHx)三维生物支架材料,然后分离培养兔脂肪/软骨细胞,检测培养于支架上的细胞的形态和增殖,最后建立兔膝关节软骨缺损修复模型,将SVF和ASCs分别与软骨细胞共培养于支架上,植入缺损部位,10周后对比评估原位软骨缺损修复的效果。
结果
接种在支架上的细胞在体外表现出更好的黏附和增殖。与软骨细胞共培养,脂肪源性SVF比ASCs更能促进体内软骨组织的生成。
结论
PHB/PHBHHx共混体系是一种优秀的软骨组织工程材料。新鲜的SVF比体外扩增培养的ASCs更能促进软骨细胞生成软骨基质。SVF有望成为一种更好的软骨修复的细胞来源。
Keywords: 软骨细胞, 血管基质组分, 共培养, 软骨再生
Abstract
Objective
This study aimed to compare the cartilage regeneration of the stromal vascular fraction (SVF) cells and adipose-derived mesenchymal stem cells (ASCs) cocultured with chondrocytes seeded on the scaffolds.
Methods
The cellular morphologies and proliferation capabilities on the scaffolds were evaluated. The scaffolds with the coculture of ASCs/SVF and chondrocytes were implanted into the full thickness cartilage defective rabbit joints for 10 weeks.
Results
The cells seeded into the scaffolds showed good adhesion and proliferation. Implantation with SVF and chondrocytes revealed desirable in vitro healing outcomes.
Conclusion
The SVF cells were better than ASCs in terms of the formation of cartilage matrix in a coimplantation model. Without in vitro expansion, the SVF cells are good cell sources for cartilage repair.
Keywords: chondrocytes, stromal vascular fraction, cocultures, cartilage regeneration
全层关节软骨缺损是骨科和运动医学中常见的损伤之一。它们通常会导致骨关节炎的发生,给患者造成严重的疼痛和运动障碍[1]。由于软骨组织再生能力有限[2],传统的治疗,如清创术、骨软骨移植和自体软骨细胞移植等都存在一定的局限性[3],关节软骨缺损修复依然面临很大的困难。
软骨组织工程为关节软骨缺损修复提供了新的选择。已有研究将经过扩增培养的骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)和脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ASCs)应用于软骨修复。尽管这些治疗取得了良好的短期效果,但仍非最佳选择。由于BMSCs的取材不仅会引起供区疼痛及并发症,而且抽取的骨髓中细胞数量较少。另外,在细胞取材和移植2个手术阶段中间需经历长达数周的细胞体外扩增过程,在此期间微生物污染的风险大大增加。在ASCs的分离过程中,经过消化和离心,血管基质组分(stromal vascular fraction,SVF)重悬接种于培养皿后贴壁培养得到ASCs亚群[4]。研究指出SVF和ASCs具有不同的特性[5],从临床应用角度来看,SVF比ASCs具有更加明显的优势,它可以直接在手术过程中获取且不需要经过实验室扩增培养就可以移植到患者体内。而且脂肪组织作为干细胞的丰富来源,能够为移植提供充足的细胞数量。
聚-β-羟基丁酸(poly-β-hydroxybutyrate,PHB)和3-羟基丁酸与3-羟基己酸共聚酯(3-hydroxybutyrate-co-3-hydroxyhexanoate,PHBHHx)在组织工程和医用材料领域备受关注。研究[6]–[7]表明,相比单纯的PHB和PHBHHx,PHB/PHBHHx共混体系有着更加出色的力学性能和生物相容性,使得这种材料在软骨组织工程中具有广阔的应用前景。
在本研究中,通过构建新西兰大白兔膝关节软骨缺损修复模型,将自体原位干细胞与软骨细胞共培养于PHB/PHBHHx支架上,比较ASCs和SVF在植入动物体内后软骨再生的差异。
1. 材料和方法
1.1. PHB/PHBHHx支架的制备
采用溶剂浇铸—粒子洗脱法制备PHB/PHBHHx支架。将氯化钠与PHB/PHBHHx(清华大学提供,PHB/PHBHHx重量比为1︰2)混合溶解于三氯甲烷中,室温下自然挥发24 h,得到复合物。用蒸馏水洗涤数次以完全洗脱氯化钠晶体。将支架在−70 °C急冻,真空冷冻干燥24 h后切成直径5 mm、厚度3 mm的柱形,γ射线(25 kGy)消毒后备用。
1.2. 细胞的获取及培养
本研究动物实验部分已经通过动物实验伦理审查。新西兰大白兔耳缘静脉注射戊巴比妥钠(麻醉剂量按30 mg·kg−1体重计算)麻醉、备皮、消毒。
1.2.1. 兔脂肪细胞的获取及培养
取颈后部正中皮下脂肪组织;PBS和青-链霉素双抗溶液交替冲洗,剪碎,0.075%的Ⅰ型胶原酶(Sigma公司,美国)消化,200目滤网过滤,300 g×3 min离心,重悬于MSC增殖培养基[改良型α-MEM培养基(Thermo Fisher Scientific公司,美国),10%胎牛血清(fetal bovine serum,FBS)(Sigma公司,美国),1%双抗溶液],按密度为每毫升1×105个进行接种。此初代细胞称之为SVF。然后将细胞置于37 °C、5%CO2孵箱中培养,当细胞铺满瓶底约80%以上时进行传代,经过传代后的细胞为ASCs。
1.2.2. 兔软骨细胞的获取及培养
取膝关节髌韧带内侧缘切口,无菌削取少量胫骨近端表面软骨组织;PBS和青-链霉素双抗溶液交替冲洗,将软骨组织剪碎、0.15%的Ⅱ型胶原酶(Sigma公司,美国)消化、过滤、离心,重悬于软骨细胞增殖培养基[DMEM高糖培养基(Thermo Fisher Scientific公司,美国),10%FBS,1%双抗溶液],并按密度为每毫升1×105个进行接种;细胞置于孵箱中培养、传代。
1.3. 支架材料上细胞的增殖及形态检测
将ASCs以密度为每毫升1×105个接种到96孔板中,其中对照组孔板中无支架,实验组有支架,对于每组设立3个平行孔。在培养基中培养2、4和8 h后,使用胰蛋白酶消化附着的细胞,按照产品说明书进行甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)检测,通过测定活细胞的数量以确定支架上细胞黏附的程度,用酶标仪测定在570 nm处的光密度(optical density,OD)值。在第1、3、5和7天,使用CCK-8试剂盒检测PHB/PHBHHx支架上活细胞的数量以确定细胞的增殖情况和支架的细胞毒性,用酶标仪测定在450 nm处的OD值。在第1、3、5和7天,细胞/支架使用PBS漂洗2次,2.5%戊二醛4 °C固定过夜,乙醇梯度脱水,低温真空干燥,表面喷金镀膜,扫描电镜(scanning electron microscope,SEM)观察。
1.4. 兔膝关节软骨缺损修复模型的建立
新西兰大白兔耳缘静脉注射戊巴比妥钠麻醉,固定,备皮,消毒铺巾。取膝关节髌韧带内侧缘切口(长度3~4 cm),显露股骨滑车关节面。使用慢速涡轮机,在关节面中央造出一个直径4 mm、深度2 mm的全层关节软骨缺损。将细胞/支架植入缺损部位,关节复位,逐层缝合。本部分实验采用自体细胞移植,分组如下。1)对照组:单纯支架;2)实验组一:支架+软骨细胞(每个支架1×107个);3)实验组二:支架+软骨细胞+ASCs(每个支架1×107个,细胞混合比例为1︰1);4)实验组三:支架+软骨细胞+SVF(每个支架1×107个,细胞混合比例为1︰1)。术后预防感染,10周后处死实验动物,截取膝关节标本。
1.5. 标本组织学染色及软骨修复评分
首先采用国际软骨修复协会(international cartilage repair society,ICRS)大体观察评分标准[8]对标本进行评分。然后标本经过4%多聚甲醛固定,10%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)低温脱钙,乙醇梯度脱水,二甲苯透明,常规石蜡包埋,切片,行苏木精-伊红(hematoxylin-eosin,HE)、阿辛蓝及番红O染色,根据ICRS组织学评分标准[9]评分。上述评分由10名盲于分组的评分者单独进行。
1.6. 统计分析
使用Stata/SE 12.1软件进行数据分析,ICRS评分结果以均数±标准差表示,多组间变量的差异采用单因素方差分析AVONA法,组间两两比较采用LSD和SNK检验方法,P<0.05为差异有统计学意义。
2. 结果
2.1. PHB/PHBHHx支架的表征和细胞在支架上的生长情况
细胞吸附在支架的结构表面生长,支架的表面及空间结构决定了细胞的生长环境。SEM下PHB/PHBHHx支架表面粗糙,内部疏松多孔,孔径大小不一,空隙呈多边形,分布均匀,相互连通。细胞在支架上培养1、3 d后,部分细胞分散在支架表面,但大部分细胞已渗入三维微结构中。随后细胞迅速迁移和增殖,5~7 d后在表面汇集。支架上的细胞单个或成团排列生长,细胞之间互相交织,细胞产生丰富的胞外基质填充孔隙,构建以自身基质为基础的生长表面(图1),这表明细胞和支架之间具有良好的生物相容性。
图 1. 不同时间ASCs在支架材料上的细胞形态 SEM ×600.
Fig 1 The cell morphologies of ASCs on the scaffolds at different days SEM ×600
从左至右依次为细胞培养1、3、5、7d。
2.2. 支架上细胞行为的体外检测
细胞接种后,通过测定活细胞的数量以确定支架上细胞黏附的程度。MTT结果显示:在培养2、4和8 h后,与对照组相比,支架上的细胞显示出更大的平均OD值(P<0.05)(图2左)。使用CCK-8试剂盒评估支架上细胞的增殖,结果显示:1 d后,支架上细胞的增殖率显著高于对照组(P<0.05)(图2右)。
图 2. ASCs在支架上的细胞黏附(左)和细胞增殖(右)情况.
Fig 2 Cell adhesion (left) and proliferation (right) of ASCs on the scaffolds
*P<0.05。
2.3. 软骨修复的体内评价
细胞共培养于支架上并原位植入兔膝关节软骨缺损部位10周后,在对照组中,植入物形成血管化的黄色组织,HE染色显示这些主要是纤维组织和未降解的支架材料,番红O和阿辛蓝染色均为阴性;在实验组一中,仅在一些区域中观察到番红O和阿辛蓝的阳性染色,在缺损中发现了软骨组织;在实验组二中,HE染色进一步显示分化的细胞产生不规则的细胞外基质,并在支架中观察到少量零星的腔隙样结构,番红O和阿辛蓝染色呈阳性;在实验组三中,植入物表现出类似于天然软骨的白色软骨样外观,软骨细胞特异性染色比实验组二更亮,软骨缺损仍可见,但没有支架材料残存(图3)。
图 3. 关节软骨修复组织的大体观察及组织病理学染色.
Fig 3 Gross view and histological staining of repaired knee articular cartilage
从左至右依次为对照组、实验组一、实验组二、实验组三。第一行:大体观察;第二行:HE染色 ×10;第三行:番红O染色 ×10;第四行:阿辛蓝染色 ×10。
2.4. ICRS软骨修复评价
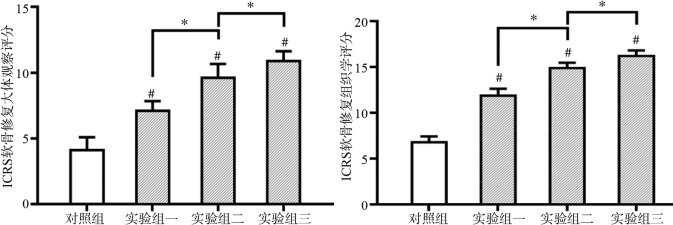
软骨修复组织的ICRS大体和组织学评分结果显示:各组间差异均有统计学意义(P<0.05),且实验组三修复效果优于其他组(P<0.05)(图4)。
图 4. ICRS软骨修复评价.
Fig 4 The ICRS cartilage repair assessment
左:大体观察评价;右:组织学评价。#与对照组相比,实验组有统计学差异;*实验组间相比有统计学差异,P<0.05。
3. 讨论
与PHB和PHBHHx相比,PHB/PHBHHx共混体系具有更好的表面性能,有利于Ⅱ型胶原纤维固定并向支架深层延伸[10]。另外,它还可促进软骨细胞的密集和胞外基质的合成[7]。通过调节PHB/PHBHHx共混体系的组成,改变材料的结晶性能和表面电荷分布,调节其表面自由能,进而调节材料对细胞作用力的平衡,可得到具有不同细胞黏附能力的材料表面。研究发现,1︰2和2︰1比例的PHB/PHBHHx三维支架更有利于软骨细胞的黏附和增殖[6],并且1︰2比例的支架也有利于人ASCs的生存、成软骨分化和糖胺聚糖合成[11]。PHB/PHBHHx支架不仅可激活再分化过程,使软骨细胞表达并产生Ⅱ型胶原[7],还能通过模拟软骨胞外基质来维持人ASCs的分化表型[11]。支架材料的降解速率影响了其上细胞的生长和活力[12],其降解产物3-羟基丁酸酯不仅无毒[13],而且与人ASCs具有良好的生物相容性[11]。
脂肪组织经胶原酶消化得到的细胞的表面标记物会随着传代而不断发生变化。SVF是一种混杂的、由多种同种异质细胞组成的细胞群,通过传代可获得较纯的ASCs。研究[14]发现,虽然SVF与ASCs可表达相似的干细胞特征,但是ASCs依然是一种更加单一的细胞类型,而SVF除包含间充质干细胞以外,还包含多种细胞亚群,如造血细胞、内皮细胞等。在与软骨细胞共培养的过程中,SVF多样化的细胞亚群在软骨形成中充当营养介质的作用[15],这些非间充质干细胞增强了MSCs的营养效应[16]。
本研究证明了PHB/PHBHHx支架能够支持细胞的黏附、生长和增殖,为体外软骨形成分化提供了有利的环境。与SVF共培养不仅可以减少软骨再生中对软骨细胞的需求,相比ASCs,SVF不仅减少了细胞体外扩增培养的时间和风险,而且更能促进软骨细胞形成软骨组织。这些结果支持了临床上将来源于脂肪组织的SVF与来源于非负重关节面的软骨细胞同时获取混合后重新移植入患处的单步手术治疗软骨损伤的可能。
Funding Statement
[基金项目] 国家自然科学基金(81500826);郑州大学第一附属医院青年基金
Supported by: The National Natural Science Foundation of China (81500826); The Youth Foundation of the First Affiliated Hospital of Zhengzhou University.
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Dell'accio F, Vincent TL. Joint surface defects: clinical course and cellular response in spontaneous and experimental lesions[J] Eur Cell Mater. 2010;20:210–217. doi: 10.22203/ecm.v020a17. [DOI] [PubMed] [Google Scholar]
- 2.Vincent T, Hermansson M, Bolton M, et al. Basic FGF mediates an immediate response of articular cartilage to mechanical injury[J] Proc Natl Acad Sci USA. 2002;99(12):8259–8264. doi: 10.1073/pnas.122033199. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Robert H. Chondral repair of the knee joint using mosaicplasty[J] Orthop Traumatol Surg Res. 2011;97(4):418–429. doi: 10.1016/j.otsr.2011.04.001. [DOI] [PubMed] [Google Scholar]
- 4.Lin Y, Liu L, Li Z, et al. Pluripotency potential of human adipose-derived stem cells marked with exogenous green fluorescent protein[J] Mol Cell Biochem. 2006;291(1/2):1–10. doi: 10.1007/s11010-006-9188-5. [DOI] [PubMed] [Google Scholar]
- 5.Jurgens WJ, van Dijk A, Doulabi BZ, et al. Freshly isolated stromal cells from the infrapatellar fat pad are suitable for a one-step surgical procedure to regenerate cartilage tissue[J] Cytotherapy. 2009;11(8):1052–1064. doi: 10.3109/14653240903219122. [DOI] [PubMed] [Google Scholar]
- 6.Deng Y, Zhao K, Zhang XF, et al. Study on the three-dimensional proliferation of rabbit articular cartilage-derived chondrocytes on polyhydroxyalkanoate scaffolds[J] Biomaterials. 2002;23(20):4049–4056. doi: 10.1016/s0142-9612(02)00136-9. [DOI] [PubMed] [Google Scholar]
- 7.Deng Y, Lin XS, Zheng Z, et al. Poly(hydroxybutyrate-co-hydroxyhexanoate) promoted production of extracellular matrix of articular cartilage chondrocytes in vitro[J] Biomaterials. 2003;24(23):4273–4281. doi: 10.1016/s0142-9612(03)00367-3. [DOI] [PubMed] [Google Scholar]
- 8.Getgood A, Henson F, Skelton C, et al. The augmentation of a collagen/glycosaminoglycan biphasic osteochondral scaffold with platelet-rich plasma and concentrated bone marrow aspirate for osteochondral defect repair in sheep: a pilot study[J] Cartilage. 2012;3(4):351–363. doi: 10.1177/1947603512444597. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Mainil-Varlet P, Aigner T, Brittberg M, et al. Histological assessment of cartilage repair: areport by the histology endpoint committee of the international cartilage repair society (ICRS)[J] J Bone Joint Surg Am. 2003;85A(Suppl 2):45–57. [PubMed] [Google Scholar]
- 10.Zheng Z, Bei FF, Tian HL, et al. Effects of crystallization of polyhydroxyalkanoateblend on surface physicochemical properties and interactions with rabbit articular cartilage chondrocytes[J] Biomaterials. 2005;26(17):3537–3548. doi: 10.1016/j.biomaterials.2004.09.041. [DOI] [PubMed] [Google Scholar]
- 11.Ye C, Hu P, Ma MX, et al. PHB/PHBHHx scaffolds and human adipose-derived stem cells for cartilage tissue engineering[J] Biomaterials. 2009;30(26):4401–4406. doi: 10.1016/j.biomaterials.2009.05.001. [DOI] [PubMed] [Google Scholar]
- 12.Middleton JC, Tipton AJ. Synthetic biodegradable polymers as orthopedic devices[J] Biomaterials. 2000;21(23):2335–2346. doi: 10.1016/s0142-9612(00)00101-0. [DOI] [PubMed] [Google Scholar]
- 13.Cheng S, Chen GQ, Leski M, et al. The effect of D,L-beta-hydroxybutyric acid on cell death and proliferation in L929 cells[J] Biomaterials. 2006;27(20):3758–3765. doi: 10.1016/j.biomaterials.2006.02.046. [DOI] [PubMed] [Google Scholar]
- 14.Crisan M, Yap S, Casteilla L, et al. A perivascular origin for mesenchymal stem cells in multiple human organs[J] Cell Stem Cell. 2008;3(3):301–313. doi: 10.1016/j.stem.2008.07.003. [DOI] [PubMed] [Google Scholar]
- 15.Wu L, Prins HJ, Leijten J, et al. Chondrocytes cocultured with stromal vascular fraction of adipose tissue present more intense chondrogenic characteristics than with adipose stem cells[J] Tissue Eng Part A. 2016;22(3/4):336–348. doi: 10.1089/ten.TEA.2015.0269. [DOI] [PubMed] [Google Scholar]
- 16.Zhang S, Ba K, Wu L, et al. Adventitial cells and perictyes support chondrogenesis through different mechanisms in 3-dimensional cultures with or without nanoscaffolds[J] J Biomed Nanotechnol. 2015;11(10):1799–1807. doi: 10.1166/jbn.2015.2112. [DOI] [PubMed] [Google Scholar]