Abstract
Durante la nueva pandemia causada por SARS-CoV-2 existe poca evidencia con relación a varios aspectos de la enfermedad, como es el caso de la coagulopatía e interpretación de los niveles de dímero D, su asociación con la coagulación intravascular diseminada (CID) y la controversia en cuanto al beneficio de la anticoagulación. Por ello, se ha hecho una revisión sistemática para definir el rol del dímero D en la enfermedad, la prevalencia y valor pronóstico de la CID y la utilidad del tratamiento anticoagulante en dichos pacientes. Se abordó una búsqueda bibliográfica y análisis de la literatura sobre pacientes con COVID-19. Se elaboraron 4 recomendaciones basadas en la opinión de expertos y en el conocimiento científico, según el sistema Grading of Recommendations Assesment, Development and Evaluation (GRADE). La presente revisión en pacientes con COVID-19 indica la presencia de mayor nivel de dímero D en aquellos con peor pronóstico, que puede haber un sobrediagnóstico de CID en el curso de la enfermedad y que no existe evidencia sobre el beneficio de iniciar tratamiento anticoagulante basándose únicamente en datos aislados de laboratorio.
Palabras clave: COVID-19, Dímero D, Coagulación intravascular diseminada, Anticoagulación
Abstract
During the new pandemic caused by SARS-CoV-2, there is short knowledge regarding the management of different disease areas, such as coagulopathy and interpretation of D-dimer levels, its association with disseminated intravascular coagulation (DIC) and controversy about the benefit of anticoagulation. Thus, a systematic review has been performed to define the role of D-dimer in the disease, the prevalence of DIC and the usefulness of anticoagulant treatment in these patients. A literature search was performed to analyze the studies of COVID-19 patients. Four recommendations were drawn based on expert opinion and scientific knowledge, according to the Grading of Recommendations Assessment, Development and Evaluation (GRADE) approach. The present review suggests the presence of higher levels of D-dimer in those with worse prognosis, there may be an overdiagnosis of DIC in the course of the disease and there is no evidence on the benefit of starting anticoagulant treatment based only on isolated laboratory data.
Keywords: COVID-19, D-dimer, Disseminated intravascular coagulation, Anticoagulation
Introducción
Desde diciembre de 2019, con la aparición del nuevo coronavirus SARS-CoV-2 y la posterior declaración de la pandemia1, hemos asistido a una gran cantidad de ingresos de pacientes graves en los hospitales y unidades de cuidados intensivos (UCI). Esto no solo ha puesto a prueba los recursos sanitarios existentes, sino que nos ha enfrentado con una elevada mortalidad ocasionada por la nueva enfermedad denominada COVID-192.
En este contexto de incertidumbre y ante la falta de un tratamiento específico para combatir esta entidad3, los profesionales de la salud hemos recurrido a aceptar la implementación de terapias con escasa evidencia científica. La indicación de anticoagulación precoz en la COVID-19 es un ejemplo de esta situación.
Estudios recientes4, 5 indican que las muertes por enfermedad grave por SARS-CoV-2 se asocian de forma frecuente a la presencia de coagulopatía y coagulación intravascular diseminada (CID), y que un valor elevado del dímero D (DD), superior a 1 μg/ml, se asocia con mayor mortalidad6. Diferentes publicaciones7, 8, así como diversos protocolos locales, proponen la implementación de diferentes pautas de anticoagulación empírica o tromboprofilaxis con dosis altas de heparina de bajo peso molecular solo con base en el nivel de DD, sin una clara evidencia científica que sostenga la implementación de dicha terapia, con el riesgo que podría conllevar en nuestros pacientes críticos.
En el actual manuscrito abordamos una revisión sistemática de la literatura para responder a 4 preguntas de interés clínico en formato PICO (paciente-intervención-comparación-outcome):
-
1.
¿Los niveles de DD se asocian con el pronóstico de pacientes con COVID-19?
-
2.
¿La CID en los pacientes con COVID-19 se asocia a mayor mortalidad?
-
3.
¿La administración de anticoagulación empírica en pacientes con COVID-19 y DD elevado mejora el pronóstico de la enfermedad?
-
4.
¿Deberíamos administrar anticoagulación en pacientes con COVID-19 y CID asociada?
Material y métodos
Conformación del grupo
El Servicio de Medicina Intensiva del Hospital Joan XXIII de Tarragona, en abril del 2020, llevó a cabo este proyecto con un grupo de trabajo de 4 investigadores clínicos, con el fin de revisar la evidencia científica y desarrollar recomendaciones de especial interés para la práctica clínica diaria de pacientes con enfermedad COVID-19.
Búsqueda de la literatura biomédica
Las diferentes fuentes de bibliografía las revisaron 2 investigadores de forma independiente. Para la elaboración de estas conclusiones se realizó una búsqueda de artículos publicados desde diciembre de 2019 hasta el 23 de abril de 2020 en las siguientes bases de datos: Medline (PubMed), Cochrane Library y ScienceDirect. Las palabras clave utilizadas de forma individual o combinada para dicha búsqueda fueron «COVID-19», «coronavirus», «dímero D», «coagulación intravascular diseminada» y «anticoagulación».
Tipo de estudios
Respecto a los criterios de inclusión, debido al desconocimiento actual sobre esta nueva infección grave, se revisaron metaanálisis, estudios observacionales, artículos de revisión y guías clínicas referentes a pacientes adultos hospitalizados por enfermedad COVID-19. Para evaluar la calidad de la evidencia solo se tuvieron en cuenta los artículos originales.
En cuanto a los criterios de exclusión, se excluyeron los estudios que evaluaran población pediátrica, aquellos en idiomas distintos al español o al inglés o realizados en animales.
Extracción de datos y análisis
Se extrajo información de los estudios relacionada con el diseño, periodo de estudio, variables clínicas, análisis estadístico, factores de riesgo y posibles sesgos. Por último, todos los artículos fueron revisados por los otros 2 clínicos del grupo, con amplia experiencia en investigación.
Desarrollo de las recomendaciones
Se decidió plantear 4 preguntas en formato PICO con interés clínico para obtener las conclusiones y la calidad de la evidencia se basó en el sistema Grading of Recommendations Assesment, Development and Evaluation (GRADE)9. En caso de desacuerdo, este fue resuelto mediante consenso del grupo.
Resultados
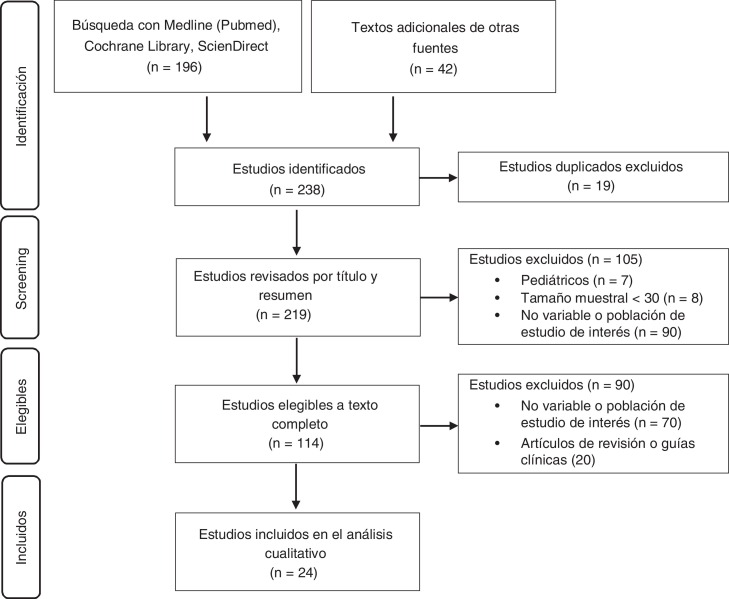
Tras la búsqueda bibliográfica se obtuvieron 238 estudios, de los cuales se incluyeron finalmente 24 estudios para su análisis cualitativo y la elaboración de las recomendaciones (fig. 1 ).
Figura 1.
Diagrama de la búsqueda bibliográfica.
PICO 1. ¿Los niveles de dímero D se asocian con el pronóstico de pacientes con COVID-19?
Conclusión 1: el DD en pacientes con COVID-19 se asocia a mayor gravedad, progresión de la enfermedad, síndrome de distrés respiratorio agudo (SDRA) y muerte (calidad de la evidencia baja).
Recomendación 1: Se recomienda monitorizar los niveles de dímero D al ingreso y cada 24-48 h como herramienta en la evaluación del pronóstico y de la progresión de la enfermedad (fuerza de la recomendación: débil a favor).
Cada vez es mayor el conocimiento sobre las alteraciones de la coagulación relativamente frecuentes en pacientes con COVID-19, en especial en aquellos casos más graves. La infección por SARS-CoV-2 parece producir un estado de hipercoagulabilidad sanguínea, ya que se han reportado alteraciones de la coagulación, nivel elevado de DD en gran proporción de pacientes10 e incremento gradual relacionados con la progresión de la enfermedad11. Todo ello podría ser explicado por la excesiva activación de la cascada de la coagulación y de las plaquetas, con la subsecuente formación de depósitos de fibrina intraalveolares (o microtrombos de fibrina sistémicos). Estos hallazgos son más característicos de pacientes con COVID-19 y SDRA. Esto es debido a la respuesta protrombótica, que intenta prevenir el daño alveolar difuso y evitar el escape del agente infeccioso a la circulación, pero en cambio, puede resultar en la formación de microtrombos pulmonares con efectos perjudiciales en la evolución del paciente12. No obstante, ciertas discrepancias pueden surgir de las acciones múltiples y a veces opuestas de la trombosis en el endotelio pulmonar después de la sepsis ya que, por un lado, la trombosis pulmonar leve favorece la reparación del endotelio dañado, mientras que la trombosis grave causa hipoxia y produce daño endotelial pulmonar13.
El DD es un producto de degradación de la fibrina que surge de 3 reacciones: la conversión de fibrinógeno a fibrina por la trombina, la reticulación de fibrina por factor XIII activado y por degradación de fibrina por plasmina14. Esto implica que los niveles dependen tanto de la coagulación como de la activación de la fibrinólisis. El DD tiene una elevada sensibilidad en la presencia de enfermedad tromboembólica, pero su especificidad es pobre, ya que se encuentra elevado en otras situaciones. La sepsis (igual que el SDRA)15 se caracteriza por una marcada inhibición de la fibrinólisis, por lo que es probable que los niveles de DD en pacientes sépticos no reflejen de forma adecuada el grado de formación de fibrina16, 17. De esta manera, se puede proponer que el uso aislado del DD para el diagnóstico de CID podría inducir a error. Asimismo, el DD se ha estudiado con anterioridad y se ha observado una alta prevalencia de valores elevados en casos de neumonía comunitaria18, sepsis grave o shock séptico19, lo que evidencia, además, su papel como predictor de mortalidad en sepsis20.
Estudios observacionales no ajustados
Con base en la literatura reciente, la incidencia observada de la elevación de DD en pacientes con infección por SARS-CoV-2 se encuentra en torno al 46,4%, que es mayor incluso en casos con enfermedad grave (59,6%)12. Diferentes estudios han encontrado un nivel elevado de DD de forma significativa en aquellos pacientes con COVID-19 graves en comparación con aquellos cuyos síntomas fueron más leves21 y con los sujetos sanos22 (tabla 1 ). En este último estudio22 además observaron un incremento gradual del DD con la progresión de la gravedad, lo que indica su posible rol en la progresión de la enfermedad. Estos hallazgos van en línea similar a los encontrados por Huang et al.23, quienes evidenciaron que el nivel de DD al ingreso en pacientes graves con COVID-19 fue hasta 5 veces superior que el de aquellos que no requerían ingreso en UCI. Sin embargo, hay que resaltar que el número de pacientes en UCI solo fue de 13 y, de ellos, solo 2 requirieron ventilación mecánica invasiva. Otros 2 estudios24, 25 también observaron nivel de DD al ingreso superior en pacientes de UCI respecto de los no críticos, aunque la mediana de los valores se encontraban dentro de la normalidad del rango de laboratorio y existían limitaciones metodológicas importantes en ambos estudios.
Tabla 1.
Estudios observacionales no ajustados relacionados con el nivel de dímero D y el pronóstico en pacientes con enfermedad COVID-19
| Dímero D y gravedad | |||||||
|---|---|---|---|---|---|---|---|
| Autor | Tipo y periodo de estudio | n | Objetivo | Pacientes | Hallazgos | Limitaciones | Calidad evidencia |
| Zheng et al.21 | Retrospectivo, unicéntrico 16 de enero-20 de febrero de 2020 |
99 | Descriptivo, comparación de críticos vs. no críticos | Críticos n = 32 vs. no críticos n = 67 | DD críticos vs. no críticos: 2,6 (±3,9) vs. 0,7 (±0,7) μg/ml; p < 0,001 | Posible sesgo de selección (heterogeneidad elevada entre grupos) Posible sesgo por factores de confusión (no realizan ajustes) |
Muy baja |
| Han et al.22 | Prospectivo, unicéntrico 31 de enero-10 de febrero de 2020 |
94 | Estudio de la coagulación según gravedad | Casos n = 94: Leves n = 49 Graves n = 35 Críticos n = 10 Sujetos sanos controles n = 40 |
DD mayores en casos vs. controles (10,3 ± 25,3 vs. 0,2 ± 0,1 mg/L); p < 0,001 Incremento gradual de DD con la progresión de la enfermedad (leves 2,1 ± 2,1, graves 19,1 ± 35,4 y críticos 20 ± 32,3 mg/L) |
Sesgo de selección: se desconocen diferencias entre grupos en cuanto a otras variables clínicas | Baja-moderada |
| Huang et al.23 | Prospectivo, unicéntrico 16 de diciembre de 2019-2 de enero de 2020 |
41 | Descriptivo, comparación de críticos vs. no críticos | UCI n = 13 vs. no UCI n = 28 | Nivel de DD 5 veces mayor en UCI vs. no UCI (2,4 [0,6-14,4] vs. 0,5 mg/L [0,3-0,8]; p = 0,004) | Pocos pacientes críticos Sesgo de selección Posible sesgo por factores de confusión (sin análisis multivariado) |
Muy baja |
| Wang et al.24 | Retrospectivo, unicéntrico 1-28 de enero de 2020 |
138 | Descriptivo, comparación de críticos vs. no críticos | UCI n = 36 vs. no UCI n = 102 | DD mayor en críticos vs. no críticos (414 [191-1.324] vs. 166 mg/L [101-285]; p < 0,001) | Posible sesgo de selección (SDRA (61,4 vs. 4,9%) Mediana de DD dentro del rango normal Al finalizar periodo de observación, 61,6% (n = 85) ingresados Sesgo por factores de confusión |
Muy baja |
| Zhang et al.25 | Retrospectivo, unicéntrico 2 de enero-10 de febrero de 2020 |
221 | Descriptivo, comparación por gravedad | Graves n = 55 vs. no graves n = 166 | DD mayor en graves vs. no graves (443 [211-1.404] vs. 184 mg/L [118-324]; p < 0,001) | Sesgo de selección (diferencias en función renal, hepática, miocárdica y SDRA entre grupos) Mediana de DD dentro del rango normal Sesgo por factores de confusión |
Muy baja |
| Tang et al.4 | Retrospectivo, unicéntrico 1 de enero-3 de febrero de 2020 |
183 | Describir características de coagulación, comparación según supervivencia | Vivos n = 162 vs. fallecidos n = 21 | DD mayos en fallecidos vs. supervivientes (2,12 [0,77-5,27] vs. 0,6 μg/mL [0,35-1,29]; p < 0,001) | Reporta pocas variables clínicas (posible sesgo de selección) Sin datos sobre porcentaje de pacientes críticos El 45,9% de los pacientes seguían ingresados en el momento de la publicación Posible sesgo por factores de confusión |
Muy baja |
| Chen et al.26 | Retrospectivo, unicéntrico 13 de enero-12 de febrero de 2020 |
274 | Descriptivo, comparación de pacientes graves/críticos según supervivencia | Vivos n = 161 vs. fallecidos n = 113 | DD mayor en los fallecidos mayores respecto a los que sobrevivieron (4,6 vs. 0,6 μg/mL; p < 0,05) | Sesgo de selección (fallecidos 100% por sepsis y SDRA vs. vivos 41 y 52%, respectivamente) Sesgo por factores de confusión (sin análisis multivariado) |
Baja |
| Lodigiani et al.27 | Retrospectivo, unicéntrico 13 de febrero-10 de abril de 2020 |
388 | Describir incidencia de complicación tromboembólica y CID | UCI n = 61 vs. hospitalizados en planta n = 327 | DD mayor en fallecidos respecto de supervivientes; DD al día 7-9 fallecidos UCI vs. vivos UCI (7.746 [2.914-12.578] vs. 3.137 ng/ml [1.486-6.571]) | Solo 16% de críticos Posible sesgo por factores de confusión, ya que no realiza ajuste |
Baja-moderada |
| Guan et al.28 | Retrospectivo, multicéntrico 11 de diciembre de 2019-29 de enero de 2020 |
1.099 | Comparación de pacientes según gravedad. End-point compuesto (ingreso UCI, VM y muerte) | Graves n = 173 vs. no graves n = 926 | Los pacientes con DD ≥ 0,5 mg/L mayor frecuencia de end-point vs. aquellos con DD < 0,5 mg/L (69,4 vs. 44,2%) | No se define enfermedad grave (solo 19% ingresos en UCI) End-point compuesto: requiere cautela en interpretación de datos Posible sesgo por factores de confusión |
Baja-moderada |
| Zhang et al.29 | Retrospectivo, unicéntrico 16 de enero-25 de febrero de 2020 |
95 | Comparación de pacientes según gravedad. End-point compuesto (ingreso en UCI, necesidad de VM y muerte) | Graves n = 32 vs. no graves n = 63 | Los pacientes con DD>1 mg/L mayor frecuencia de end-point vs. aquellos con DD≤ 1mg/L (71,9 vs. 3,2%) | Sesgo de selección (no se reportan datos sobre comorbilidades, scores de gravedad ni presencia de SDRA) End-point compuesto: requiere cautela en interpretación de datos |
Baja |
CID: coagulación intravascular diseminada; DD: dímero D; SDRA: síndrome de distrés respiratorio agudo; UCI: unidad cuidados intensivos; VM: ventilación mecánica.
Diversos estudios también han publicado un nivel más elevado de DD en aquellos pacientes fallecidos comparado con el de los supervivientes4, 26, 27. Sin embargo, hay que resaltar que dichos trabajos están sujetos a sesgo por factores de confusión tras no ajustar los resultados en poblaciones diferentes. Además, en un estudio4 casi la mitad de los pacientes seguían ingresados en el momento de la publicación, por lo que los datos finales podrían cambiar significativamente, de ahí que su interpretación deba ser cautelosa. Otros 2 estudios28, 29 publicaron que un nivel elevado de DD se encuentra más frecuentemente en los pacientes con mayor gravedad y mortalidad. El estudio multicéntrico de Guan et al.28 tiene un número elevado de pacientes. Sin embargo, no se especifica la definición de enfermedad grave. La principal limitación de estos 2 trabajos es que utilizan un end-point compuesto con variables de diferente impacto, con lo que su interpretación debe ser cuidadosa debido a que los 3 eventos finales pueden estar asociados a múltiples factores de confusión, como gravedad al ingreso, comorbilidades o presencia de SDRA.
Estudios observacionales ajustados
Múltiples estudios han incluido un análisis estadístico ajustado por diferentes factores que podrían explicar la asociación de un nivel elevado de DD con peor pronóstico (tabla 2 ). Gao et al.30 estudiaron la utilidad predictora del DD mediante la area under the receiver operating characteristics (AUROC) para diagnóstico de COVID-19 grave en 43 pacientes clasificados en leves o graves. El DD se asoció con mayor gravedad (OR 12,3; IC 95%: 1,71-85,8) con una AUROC para predecir la gravedad de la neumonía por COVID-19 de 0,75. Sin embargo, únicamente incluyeron en el modelo los niveles de DD y de interleucina 6. De similar forma, los niveles de DD > 1 mg/L también se han asociado a mayor gravedad de la enfermedad COVID-19, con un OR de 2,2 (IC 95%: 1,4-3,3)31.
Tabla 2.
Estudios observacionales ajustados relacionados con los niveles de dímero D como predictor independiente en pacientes con enfermedad COVID-19
| Autor | Tipo y periodo de estudio | n | Objetivo | Pacientes | Hallazgos | Limitaciones | Calidad de la evidencia |
|---|---|---|---|---|---|---|---|
| Gao et al.30 | Retrospectivo, unicéntrico 23 enero-2 de febrero de 2020 |
43 | Utilidad predictiva de gravedad de diferentes variables de laboratorio (DD) | Leves n = 28 y graves n = 15 | DD más elevado en casos graves respecto de leves (0,49 vs. 0,21 μg/L; p = 0,007). AUROC del DD para predecir la gravedad por COVID-19 de 0,75 (S 86,7% y E 82,1%; p = 0,005) DD se asoció con la gravedad (OR 12,3; 1,7-85,8; p = 0,012). |
Pequeño tamaño muestral No especifica criterios de gravedad No hay datos de ventilación mecánica, presencia de fallo orgánico ni otras variables relacionadas con la gravedad |
Muy baja |
| Li et al.31 | Retrospectivo, unicéntrico 26 de enero-5 de febrero de 2020 |
548 | Factores de riesgo de gravedad y mortalidad | No Graves n = 279 (50,9%) vs Graves n = 269 (49,1%) De los graves, críticos n = 46 (recibieron VM) |
DD > 1 mg/L más frecuente en graves respecto de no graves (56,4 vs. 31,1%; p < 0,001) DD > 1 mg/L se asoció con la gravedad de la enfermedad con un OR 2,2 (1,4-3,3) |
Sesgo de selección Posible sesgo por factores de confusión (modelo multivariado solo ajustado por edad, hipertensión y LDH) |
Baja-moderada |
| Wu et al.32 | Retrospectivo, unicéntrico 25 de diciembre de 2019-26 de enero de 2020 |
201 | Factores de riesgo asociados a SDRA y muerte | SDRA n = 84 vs. No SDRA n = 117. SDRA vivos n = 40 vs. SDRA fallecidos n = 44 |
Nivel inicial de DD mayor en SDRA respecto a no SDRA (1,16 [0,46-5,37] vs. 0,52 μg/ml [0,33-0,93]) DD mayor en SDRA fallecidos vs. SDRA vivos (3,95 [1,15-10,96] vs. 0,49 μg/ml [0,31-1,18]) DD se asoció al SDRA (HR 1,03; 1,01-1,04; p < 0,001) En SDRA, DD se asoció a mortalidad (HR 1,02; 1,01-1,04; p = 0,002) |
Posible sesgo de selección Posible sesgo por factores de confusión (solo análisis bivariado) |
Moderada |
| Zhou et al.6 | Retrospectivo, multicéntrico 29 de diciembre de 2019-31 de enero de 2020 |
191 | Factores riesgo de mortalidad hospitalaria | Vivos n = 137 vs. fallecidos n = 54 Sólo 32 pacientes con ventilación mecánica |
Nivel mayor de DD al ingreso en los que fallecieron respecto de supervivientes (5,2 [1,5-21,1] vs. 0,60 μg/ml [0,3-1,0]; p < 0,001) Pacientes en VM con mortalidad 97% El DD > 1,0 μg/ml(OR 18,4; 2,6-128,5; p = 0,003) |
Posible sesgo de atricción (76,5% de los pacientes excluidos) Posible sesgo por factores de confusión (modelo multivariado con solo 5 variables en función de la tendencia de publicaciones) |
Baja |
| Zhang et al.33 | Retrospectivo, unicéntrico 12 de enero-5 de marzo de 2020 |
343 | Utilidad predictiva del DD para mortalidad hospitalaria | Hospitalizados DD ≥2 μg/ml n = 67 vs. <2 μg/ml n = 267 |
AUROC DD para mortalidad 0,89 (S 92,3% y E 83,3%) DD asociado a mortalidad ajustada (HR 22,4; 2,86-175,7) |
Posible sesgo de selección Mortalidad baja Regresión de Cox no ajustada completamente |
Baja-moderada |
| Chen et al.34 | Retrospectivo, multicéntrico Diciembre de 2019-31 de enero de 2020 |
1.590 | Factores de riesgo de mortalidad | Vivos n = 1540 vs. fallecidos n = 50 al final del periodo de estudio | DD alterado en el 87% de los fallecidos y mayor que supervivientes Análisis multivariado sin incluir DD (posible no asociación con mortalidad) |
Posible sesgo de clasificación de comorbilidades Tasa mortalidad muy baja (3,1%) Pacientes aún ingresados al final de estudio, clasificados como vivos |
Baja |
| Wang et al.35 | Retrospectivo, unicéntrico 1 de enero-6 de febrero de 2020 |
339 | Factores pronósticos en ancianos con COVID-19 | Críticos n = 80 (23,6%), Graves n = 159 (46,9%) Moderados n = 100 (29,5%) |
DD más elevado en fallecidos respecto de vivos (4,38 [1,32-17,1] vs. 1,08 mg/L [0,52-2,05]) Análisis multivariado: DD no se asocia a mayor mortalidad |
Más de la mitad de pacientes (54%) aún ingresados al final del periodo de seguimiento, catalogados como supervivientes | Baja-moderada |
| Yao et al.36 | Retrospectivo, unicéntrico 30 de enero-11 de febrero de 2020 |
108 | Factores de riesgo a gravedad y mortalidad | Graves n = 25 (23,1%) No graves n = 83 (76,9%) |
DD más elevado en graves fallecidos vs. graves vivos vs. no graves (15,89 [2,75-81,59] vs. 2,16 [0,98-2,67] vs. 1,28 μg/mL [0,61-2,69]; p < 0,001) Predictores de gravedad: linfopenia y SOFA Predictor de mortalidad: SOFA |
Posible sesgo de selección Posible sesgo por factores de confusión (modelo multivariado solo con 2 variables por tener número bajo de eventos, n = 12) |
Baja |
APACHE: Acute Physiology and Chronic Health Evaluation; AUROC: area under the receiver operating characteristics; DD: dímero D; E: especificidad; HR: hazard ratio; LDH: lactato deshidrogenasa; OR: odds ratio; S: sensibilidad; SDRA: síndrome de distrés respiratorio agudo; SOFA: Sequential Organ Failure Assessment; UCI: unidad cuidados intensivos; VM: ventilación mecánica.
Wu et al.32 estudiaron la asociación del DD con el SDRA. En una cohorte de 201 pacientes con COVID-19, identificaron que el nivel inicial de DD fue mayor en aquellos con SDRA que el de los pacientes sin SDRA. Asimismo, tuvieron DD más elevado los pacientes con SDRA fallecidos que los supervivientes. En el análisis bivariado, observaron que el DD se asoció al SDRA (HR 1,03; IC 95%: 1,01-1,04; p < 0,001) y a mortalidad en aquellos con SDRA (HR 1,02; IC 95%: 1,01-1,04; p = 0,002), pero sin tener en cuenta otros factores de confusión. Cabe destacar que el 41,8% de la población desarrolló SDRA, pero solo uno de cada 4 pacientes ingresó en UCI y solo el 2,5% necesitó ventilación mecánica, lo que refleja, quizá, una población con SDRA diferente a la de nuestras UCI.
En el estudio multicéntrico de Zhou et al.6, con 191 pacientes hospitalizados por COVID-19, se evidenció que un valor de DD > 1,0 μg/ml fue fuertemente asociado a mayor mortalidad (OR 18,4; IC 95%: 2,6-128,5; p = 0,003). No obstante, se observaron diferencias significativas en otras muchas variables que no fueron incluidas en el modelo multivariado. Los autores reconocen que eligieron de forma arbitraria las 5 variables para incluir en el modelo, según la tendencia de las publicaciones hasta el momento. Esto dificulta la interpretación adecuada de los datos. Zhang et al.33 desarrollaron un estudio más riguroso para definir la utilidad del DD mediante AUROC para predecir mortalidad hospitalaria en COVID-19. Encontraron el punto de corte de 2 μg/mL para predecir mayor mortalidad con un AUROC de 0,89. Tras ajustar por posibles factores de confusión (edad, sexo y comorbilidades), reportaron que un nivel alto de DD se asocia a mayor mortalidad (HR 22,4; IC 95%: 2,86-175,7). No obstante, la mortalidad global fue solo del 3,8%, lo que refleja una población, quizá, menos grave. En cambio, algunos estudios34, 35, 36 en los que se han encontrado niveles más elevados de DD en pacientes fallecidos respecto de supervivientes, tras el ajuste por factores de confusión, no encontraron asociación independiente entre el nivel de DD y la mortalidad.
En resumen, el nivel de DD parece estar asociado con el pronóstico en pacientes con COVID-19. No obstante, dado que la mayoría de los estudios hasta el momento publicados fueron realizados en China y con población muy heterogénea en cuanto a la gravedad, con posible sesgo de selección y factores de confusión, se requiere mayor evidencia científica para confirmar dicha asociación.
PICO 2: ¿La coagulación intravascular diseminada en los pacientes con COVID-19 se asocia a mayor mortalidad?
Conclusión 2: pocos estudios informan sobre la incidencia de CID de acuerdo con los criterios de la International Society on Thrombosis and Haemostasis (ISTH) y existe poca evidencia de que su presencia se asocie a mayor mortalidad (calidad de la evidencia: baja).
Recomendación 2: Se recomienda vigilancia diaria de los parámetros de coagulación y desarrollo de clínica trombótica o hemorrágica asociada para un diagnóstico precoz de CID de acuerdo con los criterios de la ISTH (fuerza de la recomendación: débil a favor).
De acuerdo con el Comité Científico y de Estandarización de la ISTH, la CID se define como un síndrome adquirido en el que ocurre una activación intravascular de los sistemas de coagulación de manera sistémica, caracterizada por fenómenos trombóticos o hemorrágicos, junto con alteraciones características en valores de laboratorio, que se acompaña de desarrollo de disfunción orgánica como expresión de la activación de la coagulación37 (tabla 3 ). La CID ha demostrado ser un predictor de mortalidad en pacientes con sepsis grave y shock séptico38.
Tabla 3.
Criterios diagnósticos para coagulación intravascular diseminada de la ISHT
| Variables | Rango | ISTH score (CID ≥5) |
|---|---|---|
| Plaquetas (×109/L) | <50 | 2 |
| 50-100 | 1 | |
| >100 | 0 | |
| PDF/DD | Aumento fuerte | 3 |
| Aumento moderado | 2 | |
| No aumentado | 0 | |
| TP ratio (segundos) | ≥6 | 2 |
| 3-6 | 1 | |
| ≤3 | 0 | |
| Fibrinógeno (g/ml) | ≤100 | 1 |
| >100 | 0 |
CID: coagulación intravascular diseminada; DD: dímero D; ISTH: International Society on Thrombosis and Haemostasis; PDF: productos de degradación del fibrinógeno; TP: tiempo de protrombina.
Algunos estudios difieren en cuanto a la prevalencia de CID y su asociación con el pronóstico de la COVID-19 (tabla 4 ). Tang et al.4 observan que una gran proporción de pacientes fallecidos cumplían los criterios internacionales de CID según la ISTH (el 71,4% frente al 0,6% de los supervivientes). Se trata de un estudio con bajo nivel de evidencia, ya que el análisis se efectuó cuando una gran proporción de pacientes continuaban ingresados, sin reportar datos sobre la existencia de fallo multiorgánico, sepsis, SDRA ni clínica asociada de CID (trombosis o hemorragia). Por otro lado, Lodigiani et al.27 en su análisis objetivaron una incidencia de CID según los criterios de la ISTH mucho menor (2,2%), con mortalidad del 88% de los casos (n = 7). Otros trabajos26, 34, 39 han reportado incidencias entre el 6,4 y el 22%, aunque sin determinar el criterio que aplican para su diagnóstico. En cambio, Guan et al.28, en su estudio con 1.099 pacientes, 173 con enfermedad grave, solo reportaron un caso de CID (incidencia del 0,1%), sin tampoco definir los criterios empleados para su diagnóstico. Algunos de estos trabajos4, 26, 39 coinciden en reportar mayor incidencia de CID en aquellos pacientes que fallecieron, pero sin ajustar por factores de confusión.
Tabla 4.
Estudios relacionados con la incidencia de CID y su asociación con el pronóstico en la enfermedad COVID-19
| Autor | Tipo y periodo de estudio | n | Objetivo | Pacientes | Hallazgos | Limitaciones | Calidad de evidencia |
|---|---|---|---|---|---|---|---|
| Tang et al.4 | Retrospectivo, unicéntrico 1 de enero-3 de febrero de 2020 |
183 | Describir características de coagulación, comparación según supervivencia | Vivos n = 162 vs. fallecidos n = 21 | Mayor incidencia de CID en fallecidos respecto de supervivientes (71,4 vs. 0,6%; p < 0.05). Diagnóstico de CID por criterios ISTH |
Reporta pocas variables clínicas (posible sesgo de selección) No datos sobre porcentaje de pacientes críticos El 45,9% de pacientes seguían ingresados en el momento de la publicación Sesgo por factores de confusión (no se realiza ajuste) |
Muy baja |
| Lodigiani et al.27 | Retrospectivo, unicéntrico 13 de febrero-10 de abril de 2020 |
388 | Describir la incidencia de complicación tromboembólica y de CID | UCI n = 61 vs Hospitalizados en planta n = 327 |
Incidencia global de CID: 2,2% (n = 8) Mortalidad de CID: 88% (n = 7) Diagnóstico de CID por criterios ISTH |
Solo 16% pacientes críticos 50% de pacientes con CID tienen cáncer Posible sesgo por factores de confusión (no se realiza ajuste) |
BAJA |
| Tao Chen et al.26 | Retrospectivo, unicéntrico 13 de enero-28 de febrero de 2020 |
274 | Descriptivo, comparación de pacientes según supervivencia | Vivos n = 161 vs. fallecidos n = 113 | Incidencia global de CID: 8% Mayor incidencia de CID en fallecidos respecto de supervivientes (17 vs. 1%; p < 0,05) |
No determinan criterio diagnóstico de CID Heterogeneidad elevada entre grupo (sesgo de selección) Sin análisis multivariado (posible sesgo por factores de confusión) |
Muy baja |
| Chen et al.34 | Retrospectivo, multicéntrico Diciembre de 2019-31 de enero de 2020 |
1.590 | Factores de riesgo de mortalidad | Vivos n = 1540 vs. fallecidos n = 50 al final del periodo de estudio | Incidencia global de CID: 22% | No determina criterio diagnóstico de CID No aporta datos sobre incidencia de CID en fallecidos vs. supervivientes |
Muy baja |
| Deng et al.39 | Retrospectivo multicéntrico 1 de enero-21 de febrero de 2020 |
225 | Descripción y comparación de características clínicas según supervivencia | Fallecidos n = 109 vs. recuperados n = 116 | Incidencia global de CID: 6,4%. (100% de los fallecidos) Mayor en fallecidos que en supervivientes (6,4 vs. 0%) |
No determina criterio diagnóstico de CID Elevada mortalidad global (casi 50%) Posible sesgo por factores de confusión (no se realiza ajuste, cuando muestra que los fallecidos tenían más edad, comorbilidades y complicaciones) |
BAJA |
| Guan et al.28 | Retrospectivo, multicéntrico 11 de diciembre de 2019-29 de enero de 2020 |
1.099 | Comparación de pacientes según gravedad. End-point compuesto (ingreso UCI, VM y muerte) | Graves n = 173 vs. no graves n = 926 | Incidencia global de CID: 0,1% | No determina criterio diagnóstico de CID No se define enfermedad grave (solo 19% de ingresos en UCI) |
Muy baja |
CID: coagulación intravascular diseminada; ISTH: Society on Thrombosis and Haemostasis; UCI: unidad cuidados intensivos; VM: ventilación mecánica.
Es posible, por tanto, que exista un sobrediagnóstico de CID, puesto que en la mayoría de las publicaciones se describe la alteración de parámetros aislados de laboratorio como evidencia de coagulopatía asociada a la enfermedad, sin llegar a cumplir estrictamente el diagnóstico de CID. Lippi et al.40 han publicado un metaanálisis de 9 estudios sobre 1.779 pacientes con COVID-19, 399 de ellos (22,4%) con enfermedad grave. El análisis reveló que el recuento de plaquetas fue significativamente menor en pacientes más graves y menor aún en aquellos que fallecieron. En los 4 estudios (n = 1.427) que mostraron datos sobre la tasa de trombocitopenia, esta se asoció con un riesgo 5 veces mayor de COVID-19 grave (OR 5,1; IC 95%: 1,8-14,6), sin hacer referencia a otros datos sugestivos de CID. En referencia a los tiempos de coagulación, Huang et al.23 encontraron tiempos de protrombina más elevados en pacientes críticos. Sin embargo, en otros 2 trabajos22, 24 observaron niveles mayores de DD y fibrinógeno en los pacientes más graves, pero sin evidenciar alteraciones en los tiempos de coagulación. También se han analizado las anomalías de la coagulación a través de pruebas tradicionales y perfiles de tromboelastometría en un grupo de 22 casos ingresados en UCI por COVID-19 comparados con controles sanos5. Los casos mostraron niveles de fibrinógeno y DD significativamente más altos en comparación con los controles (p < 0,0001). Además, se observaron perfiles de tromboelastometría con hipercoagulabilidad, como lo refleja el menor tiempo de formación de coágulos y la mayor firmeza máxima del coágulo (p < 0,001). Con ello, concluyen que los pacientes con COVID-19 con hiperfibrinogenemia (que resulta en una mayor formación de fibrina y polimerización que puede predisponer a la trombosis) presentan una hipercoagulabilidad grave, en lugar de una coagulopatía de consumo, como es la CID.
Asimismo, como afirma la Sociedad Americana de Hematología41, a diferencia del patrón que se observa en la CID clásica por sepsis bacteriana o traumatismo, la coagulopatía observada en pacientes con COVID-19 se caracteriza por elevación de fibrinógeno y DD, lo que se correlaciona con un aumento paralelo en los marcadores de inflamación, alargamiento del tiempo de protrombina y del tiempo parcial de tromboplastina activada, y la trombocitopenia, si aparece, suele ser leve o moderada. Además, tanto en la sepsis como en el SDRA también se encuentra un aumento de la actividad procoagulante con microtrombosis vasculares pulmonares (inmunotrombosis) y un descenso de la actividad fibrinolítica, que contribuye a la formación de fibrina debido a disfunción endotelial tras la respuesta proinflamatoria excesiva a la infección vírica. Estos microtrombos pulmonares de fibrina se han encontrado tanto en presencia como en ausencia de CID15. Por lo tanto, es posible que los hallazgos de laboratorio de los pacientes con COVID-19, como el aumento de productos de degradación del fibrinógeno/DD, no siempre se deban atribuir a CID.
En consecuencia, la coagulopatía asociada a enfermedad COVID-19 parece tener un patrón de hipercoagulabilidad diferente al de la coagulopatía de consumo. Algunos pacientes con infección grave por SARS-CoV-2 pueden desarrollar una coagulopatía que cumpla los criterios de CID según la ISTH, con activación fulminante de la coagulación y consumo de factores de coagulación, con trombocitopenia moderada-grave, prolongación del tiempo de protrombina y del tiempo parcial de tromboplastina activada, elevación marcada del DD y disminución del fibrinógeno. Sin embargo, la CID comprende un diagnóstico clínico y de laboratorio complejo que no puede determinarse exclusivamente a partir de datos aislados de laboratorio42 y, por lo tanto, no es posible con los datos de los que disponemos actualmente inferir su incidencia ni su relación con el pronóstico de los pacientes con neumonía por SARS-CoV-2.
PICO 3: ¿La administración de anticoagulación empírica en pacientes con COVID-19 y dímero D elevado mejora el pronóstico de la enfermedad?
Conclusión 3: no existe evidencia de que la anticoagulación empírica a dosis plenas o intermedias se asocie a mejor evolución en los pacientes con COVID-19 y dímero D elevado (calidad de la evidencia: ninguna).
Recomendación 3: No se puede recomendar el tratamiento anticoagulante empírico en pacientes con COVID-19 en función del nivel de DD. Solo debería administrarse en el contexto de un ensayo clínico controlado (fuerza de la recomendación: fuerte en contra).
En la coagulopatía, independientemente de su causa, el tratamiento de la afección subyacente es primordial. En el caso de la infección de COVID-19, dada la ausencia de un tratamiento específico que haya demostrado beneficio3, el tratamiento de soporte es el único que en la actualidad puede mejorar el curso de la enfermedad. En la bibliografía reciente se halla que la COVID-19 puede predisponer al desarrollo de complicaciones tromboembólicas arteriales y venosas, debido a la inflamación excesiva, la hipoxia, la inmovilización y el posible desarrollo de CID. Klok et al.7 reportaron en una serie de 184 pacientes críticos con neumonía por SARS-CoV-2 una incidencia acumulada del 31%, incluyendo tromboembolia venosa y trombosis arterial.
Se ha descrito que la trombosis microvascular está implicada en la insuficiencia respiratoria hipoxémica en algunos pacientes con COVID-19. Los estudios de autopsia hasta la fecha son limitados, pero algunos indican trombosis microvascular en la circulación pulmonar43, 44. En consecuencia, se ha contemplado el posible beneficio de administrar anticoagulación terapéutica para el tratamiento de pacientes críticos graves con nivel alto de DD o parámetros de coagulación anormales (coagulopatía o CID)8, 45. Un claro ejemplo de ello son las recomendaciones de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC)46, que incluyen valorar la anticoagulación en pacientes con DD elevado (>2.000 ng/ml). De forma similar, el Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología47 ha elaborado un consenso basado en la opinión de los autores o en series con pocos casos de pacientes, en el que recomienda tratamiento anticoagulante en aquellos casos de COVID-19 grave con riesgo tromboembólico elevado, definido entre otros como nivel elevado de DD o parámetros proinflamatorios elevados.
Sin embargo, no existe a día de hoy evidencia científica que apoye la implementación de dicho tratamiento. De hecho, solo se ha encontrado en la búsqueda realizada el artículo de Tang et al.48, que incluye a 449 pacientes, y que compara a aquellos que recibieron heparina (7 días de heparina de bajo peso molecular o heparina no fraccionada) respecto de los que no la recibieron. La mortalidad fue del 29,8%, sin observar diferencias a los 28 días entre el grupo de heparina frente al de no heparina (30,2 vs. 29,7%). Los autores utilizan el sepsis-induced coagulopathy score (SIC)49 en lugar del CID score de la ISTH37. Con dicha clasificación, el 21,6% de los pacientes reunieron criterios de SIC score ≥ 4 y, en ellos, la administración de heparina se asoció a menor mortalidad (40,0 vs. 64,2%; p = 0,03), pero no en los pacientes con SIC score < 4. De forma similar, en los pacientes con DD > 3 μg/mL (6 veces el límite superior de la normalidad) la administración de heparina se asoció con una reducción del 20% en la mortalidad. Sin embargo, este estudio muestra limitaciones importantes, ya que no analiza el uso de tratamiento anticoagulante, sino que compara el uso de heparina como profilaxis (uso recomendado en pacientes hospitalizados, considerado como buena práctica clínica) con su no uso (mala praxis). Asimismo, se trata de un estudio retrospectivo, con posible sesgo de selección, que no presenta características de los grupos comparados en cuanto a gravedad y no elabora un análisis multivariado para evaluar SIC y mortalidad. Por todo ello, estos resultados deben interpretarse con mucha cautela.
De acuerdo con la mayoría de las publicaciones hasta la fecha50, no existe indicación para la anticoagulación empírica a dosis plenas en pacientes con enfermedad COVID-19, a menos que se haya documentado trombosis clínica o tromboembolia51 o exista otra indicación clásica para su uso (válvula protésica mecánica, fibrilación auricular, etc.). De hecho, hasta la fecha no existe evidencia publicada que justifique el aumento de dosis de heparina en el caso de pacientes con COVID-19 grave, por lo que solo debería utilizarse en el contexto de un ensayo clínico controlado. De otra forma se consideraría mala práctica clínica. En efecto, los nuevos tratamientos deben estudiarse en ensayos aleatorizados controlados para comprender realmente tanto sus beneficios como sus riesgos52. Muchas de las hipótesis fallidas en investigación clínica de los últimos 30 años han resurgido con la esperanza de proporcionar nuevos tratamientos para COVID-19. Mantener los principios de la medicina basada en la evidencia en la atención de pacientes críticos, como sí se demostró en ensayos aleatorizados multicéntricos, mejorará los resultados de estos pacientes con COVID-19 grave.
De forma similar, muchos protocolos institucionales, incluidos los de la Sociedad Española de Hematología53, han optado por administrar tromboprofilaxis de intensidad intermedia (es decir, la dosis diaria habitual de heparina de bajo peso molecular profiláctica 2 veces al día), y ha propuesto su uso en aquellos casos con riesgo elevado de trombosis7, aun sin evidencia científica que lo apoye. De hecho, tanto la Organización Mundial de la Salud54 como distintas sociedades50 continúan recomendando dosis habituales de tromboprofilaxis farmacológica.
Es evidente que la tromboprofilaxis debe administrarse a todos los pacientes ingresados en el hospital de acuerdo con las guías de práctica clínica actuales51, 55. En el caso de los pacientes hospitalizados con COVID-19, con mayor riesgo trombótico por sus condiciones y por el estado procoagulante asociado a la enfermedad, también se debe mantener la recomendación actual de utilizar heparina a dosis habitual profiláctica (heparina de bajo peso molecular diaria ajustada por peso y aclaramiento renal o fondaparinux, propuesto sobre la heparina no fraccionada para reducir el contacto), para prevenir eventos trombóticos46, 56. Un panel de expertos médicos de China y Europa han desarrollado un consenso basado en la evidencia sobre la profilaxis y el manejo de la enfermedad tromboembólica asociada con COVID-19 que lo confirma57. Se debe mantener la tromboprofilaxis, a pesar de las pruebas de coagulación anormales, en ausencia de hemorragia activa y se debería retirar solo si el recuento de plaquetas es inferior a 25-30 × 109/L. La tromboprofilaxis mecánica debe usarse cuando la farmacológica está contraindicada41, 46.
PICO 4: ¿Deberíamos administrar anticoagulación en pacientes con COVID-19 y coagulación intravascular diseminada asociada?
Conclusión 4: no existe evidencia que justifique el uso de anticoagulación en la CID asociada a COVID-19 (calidad de la evidencia: ninguna).
Recomendación: No se puede recomendar la administración de tratamiento anticoagulante en pacientes con CID asociada a COVID-19, excepto en casos con fenómenos trombóticos evidenciados (fuerza de la recomendación: débil en contra).
En el caso de CID confirmada asociada a la enfermedad por SARS-CoV2, como en la CID por cualquier otra causa, la efectividad de la terapia anticoagulante es controvertida a pesar de los múltiples ensayos controlados aleatorizados49. La resolución del evento desencadenante o enfermedad subyacente es el pilar fundamental en el tratamiento del síndrome, sin haberse demostrado que el tratamiento anticoagulante mejore el pronóstico de la enfermedad58. Por lo tanto, si no existe otra indicación para la anticoagulación (fenómenos isquémicos documentados o púrpura fulminans), en estos pacientes solo deberíamos administrar tromboprofilaxis50.
Conclusiones
Tras la revisión sistemática de la bibliografía publicada hasta el momento, podemos concluir que el nivel de DD puede ser un predictor de gravedad, incluso de mortalidad. Sin embargo, la evidencia que respalda dicha asociación es de baja calidad y se necesitan más estudios con ajuste de factores de confusión para confirmarla. La enfermedad COVID-19 puede asociarse a coagulación intravascular diseminada, aunque la incidencia en los estudios actuales es variable y, en caso de producirse, puede impactar en el pronóstico de nuestros pacientes; por lo tanto, sería recomendable monitorizar las pruebas de hemostasia para su reconocimiento precoz de acuerdo con los criterios de diagnóstico internacionales. En referencia a la anticoagulación empírica o a dosis intermedias, no existe evidencia que sustente su implementación en nuestros pacientes, aun con nivel elevado de DD, ya que, como en la sepsis o en el distrés respiratorio, puede verse alterado sin existencia de CID. La tromboprofilaxis está indicada en todos los pacientes hospitalizados por COVID-19 (excepto contraindicación) y la anticoagulación a dosis plenas debe administrarse solo en caso de indicación clásica, de enfermedad tromboembólica arterial o venosa documentada y, en caso de CID, siempre que se asocie a fenómenos isquémicos o púrpura fulminans.
Autoría/colaboración
AR, MB, RC y GM han contribuido en la concepción y el diseño del estudio, la adquisición de datos, el análisis y la interpretación de los datos.
RC y GM han participado en la confección del borrador del artículo y la revisión crítica del contenido intelectual.
AR y MB han contribuido en la aprobación definitiva de la versión que se presenta.
Financiación
Ninguna.
Conflicto de intereses
Ninguno.
Agradecimientos
A todos los profesionales sanitarios que siguen luchando cada día contra esta pandemia.
Bibliografía
- 1.World Health Organization . World Health Organization; Ginebra: 2020. Coronavirus disease (COVID-19) outbreak. [consultado 18 Abr 2020]. Disponible en: https://www.who.int/westernpacific/emergencies/covid-19. [Google Scholar]
- 2.Culp W.C. Vol. 14. World Health Organization; Ginebra: 2020. p. e01218. (Coronavirus disease 2019 (COVID-19) situation repor-91). [consultado 18 Abr 2020]. Disponible en: https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200420-sitrep-91-covid-19.pdf?sfvrsn = fcf0670b_4. A A Pract. 2020. [Google Scholar]
- 3.Bhimraj A., Morgan R.L., Shumaker A.H., Lavergne V., Baden L., Cheng V.C. Infectious Diseases Society of America; Estaods Unidos: 2020. Infectious Diseases Society of America Guidelines on the treatment and management of patients with COVID-19. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18:844–847. doi: 10.1111/jth.14768. https://doi.org/10.1111/jth.14768. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Spiezia L., Boscolo A., Poletto F., Cerruti L., Tiberio I., Campello E. COVID-19-related severe hypercoagulability in patients admitted to intensive care unit for acute respiratory failure. Thromb Haemost. 2020:4–6. doi: 10.1055/s-0040-1710018. https://doi.org/10.1055/s-0040-1710018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan China: A retrospective cohort study. Lancet. 2020;395:1054–1062. doi: 10.1016/S0140-6736(20)30566-3. https://doi.org/10.1016/S0140-6736(20)30566-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Klok F.A., Kruip M.J.H.A., van der Meer N.J.M., Arbous M.S., Gommers DAMPJ, Kant K.M. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020 doi: 10.1016/j.thromres.2020.04.013. https://doi.org/10.1016/j.thromres.2020.04.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Lin L., Lu L., Cao W., Li T. Hypothesis for potential pathogenesis of SARS-CoV-2 infection–a review of immune changes in patients with viral pneumonia. Emerg Microbes Infect. 2020;9:727–732. doi: 10.1080/22221751.2020.1746199. https://doi.org/10.1080/22221751.2020.1746199. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Sanabria A.J., Rigau D., Rotaeche R., Selva A., Marzo-Castillejo M., Alonso-Coello P. Sistema GRADE: Metodología para la realización de recomendaciones para la práctica clínica. Aten Primaria. 2015;47:48–55. doi: 10.1016/j.aprim.2013.12.013. https://doi.org/10.1016/j.aprim.2013.12.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Richardson S., Hirsch J.S., Narasimhan M., Crawford J.M., McGinn T., Davidson K.W. Presenting characteristics comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City area. JAMA. 2020;10022:1–8. doi: 10.1001/jama.2020.6775. https://doi.org/10.1001/jama.2020.6775. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Terpos E., Ntanasis-Stathopoulos I., Elalamy I., Kastritis E., Sergentanis T.N., Politou M. Hematological findings and complications of COVID-19. Am J Hematol. 2020 doi: 10.1002/ajh.25829. https://doi.org/10.1002/ajh.25829. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Giannis D., Ziogas I.A., Gianni P. Coagulation disorders in coronavirus infected patients: COVID-19, SARS-CoV-1 MERS-CoV and lessons from the past. J Clin Virol. 2020;127:104362. doi: 10.1016/j.jcv.2020.104362. https://doi.org/10.1016/j.jcv.2020.104362. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Evans C.E., Zhao Y.Y. Impact of thrombosis on pulmonary endothelial injury and repair following sepsis. Am J Physiol Lung Cell Mol Physiol. 2017;312:L441–L451. doi: 10.1152/ajplung.00441.2016. https://doi.org/10.1152/ajplung.00441.2016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Semeraro F., Ammollo C.T., Caironi P., Masson S., Latini R., Panigada M. Low D-dimer levels in sepsis: Good or bad? Thromb Res. 2019;174:13–15. doi: 10.1016/j.thromres.2018.12.003. https://doi.org/10.1016/j.thromres.2018.12.003. [DOI] [PubMed] [Google Scholar]
- 15.Ferrer R., Navas A., Adda M., Artigas A. Papel de la coagulación en la fisiopatología de la lesión pulmonar aguda. Paralelismo con la sepsis. Med Intensiva. 2008;32:304–311. doi: 10.1016/s0210-5691(08)70958-6. https://doi.org/10.1016/S0210-5691(08)70958-6. [DOI] [PubMed] [Google Scholar]
- 16.Semeraro N., Ammollo C.T., Semeraro F., Colucci M. Sepsis, thrombosis and organ dysfunction. Thromb Res. 2012;129:290–295. doi: 10.1016/j.thromres.2011.10.013. https://doi.org/10.1016/j.thromres.2011.10.013. [DOI] [PubMed] [Google Scholar]
- 17.Levi M., van der Poll T. Coagulation and sepsis. Thromb Res. 2017;149:38–44. doi: 10.1016/j.thromres.2016.11.007. https://doi.org/10.1016/j.thromres.2016.11.007. [DOI] [PubMed] [Google Scholar]
- 18.Milbrandt E.B., Reade M.C., Lee M., Shook S.L., Angus D.C., Kong L. Prevalence and significance of coagulation abnormalities in community-acquired pneumonia. Mol Med. 2009;15:438–445. doi: 10.2119/molmed.2009.00091. https://doi.org/10.2119/molmed.2009.00091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Bernard G.R., Vincent J.L., Laterre P.F., LaRosa S.P., Dhainaut J.F., Lopez-Rodríguez Á. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2011;345:219–225. doi: 10.1056/NEJM200103083441001. https://doi.org/10.1056/NEJM200103083441001. [DOI] [PubMed] [Google Scholar]
- 20.Schwameis M., Steiner M.M., Schoergenhofer C., Lagler H., Buchtele N., Jilma-Stohlawetz P. D-dimer and histamine in early stage bacteremia: A prospective controlled cohort study. Eur J Intern Med. 2015;26:782–786. doi: 10.1016/j.ejim.2015.10.024. https://doi.org/10.1016/j.ejim.2015.10.024. [DOI] [PubMed] [Google Scholar]
- 21.Zheng Y., Xu H., Yang M., Zeng Y., Chen H., Liu R. Epidemiological characteristics and clinical features of 32 critical and 67 noncritical cases of COVID-19 in Chengdu. J Clin Virol. 2020;127:104366. doi: 10.1016/j.jcv.2020.104366. https://doi.org/10.1016/j.jcv.2020.104366. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Han H., Yang L., Liu R., Liu F., Wu K.L., Li J. Prominent changes in blood coagulation of patients with SARS-CoV-2 infection. Clin Chem Lab Med. 2020 doi: 10.1515/cclm-2020-0188. https://doi.org/10.1515/cclm-2020-0188. [DOI] [PubMed] [Google Scholar]
- 23.Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506. doi: 10.1016/S0140-6736(20)30183-5. https://doi.org/10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Wang D., Hu B., Hu C., Zhu F., Liu X., Zhang J. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan China. JAMA - J Am Med Assoc. 2020;323:1061–1069. doi: 10.1001/jama.2020.1585. https://doi.org/10.1001/jama.2020.1585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Zhang G., Hu C., Luo L., Fang F., Chen Y., Li J. Clinical features and short-term outcomes of 221 patients with COVID-19 in Wuhan, China. J Clin Virol. 2020;127:104364. doi: 10.1016/j.jcv.2020.104364. https://doi.org/10.1016/j.jcv.2020.104364. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Chen T., Wu D., Chen H., Yan W., Yang D., Chen G. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: Retrospective study. BMJ. 2020:368. doi: 10.1136/bmj.m1091. https://doi.org/10.1136/bmj.m1091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Lodigiani C., Iapichino G., Carenzo L., Cecconi M., Ferrazzi P., Sebastian T. Venous and arterial thromboembolic complications in COVID-19 patients admitted to an academic hospital in Milan, Italy. Thromb Res. 2020;191:9–14. doi: 10.1016/j.thromres.2020.04.024. https://doi.org/10.1016/j.thromres.2020.04.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Guan W.J., Ni Z.Y., Hu Y., Liang W.H., Ou C.Q., He J.X. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020:1–13. doi: 10.1056/NEJMoa2002032. https://doi.org/10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Zhang G., Zhang J., Wang B., Zhu X., Wang Q., Qiu S. Analysis of clinical characteristics and laboratory findings of 95 cases of 2019 novel coronavirus pneumonia in Wuhan, China: A retrospective analysis. Respir Res. 2020;21:1–10. doi: 10.1186/s12931-020-01338-8. https://doi.org/10.1186/s12931-020-01338-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Gao Y., Li T., Han M., Li X., Wu D., Xu Y. Diagnostic utility of clinical laboratory data determinations for patients with the severe COVID-19. J Med Virol. 2020:0–1. doi: 10.1002/jmv.25770. https://doi.org/10.1002/jmv.25770. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Li X., Xu S., Yu M., Wang K., Tao Y., Zhou Y. Risk factors for severity and mortality in adult COVID-19 inpatients in Wuhan. J Allergy Clin Immunol. 2020 doi: 10.1016/j.jaci.2020.04.006. https://doi.org/10.1016/j.jaci.2020.04.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Wu C., Chen X., Cai Y., Xia J., Zhou X., Xu S. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med. 2020:1–10. doi: 10.1001/jamainternmed.2020.0994. https://doi.org/10.1001/jamainternmed.2020.0994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Zhang L., Yan X., Fan Q., Liu H., Liu X., Liu Z. D-dimer levels on admission to predict in-hospital mortality in patients with Covid-19. J Thromb Haemost. 2020:0–3. doi: 10.1111/jth.14859. https://doi.org/10.1111/JTH. 14859. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Chen R., Liang W., Jiang M., Guan W., Zhan C., Wang T. Risk factors of fatal outcome in hospitalized subjects with coronavirus disease 2019 from a nationwide analysis in China. Chest. 2020 doi: 10.1016/j.chest.2020.04.010. https://doi.org/10.1016/j.chest.2020.04.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Wang L., He W., Yu X., Hu D., Bao M., Liu H. Coronavirus disease 2019 in elderly patients: Characteristics and prognostic factors based on 4-week follow-up. J Infect. 2020;11:20. doi: 10.1016/j.jinf.2020.03.019. https://doi.org/10.1016/j.jinf.2020.03.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Qingchun Y., Peng W., Xingguang W., Guoqiang Q., Mei M., Xiwen T. Retrospective study of risk factors for severe SARS-Cov-2 infections in hospitalized adult patients. Polish Arch Intern Med. 2020 doi: 10.20452/pamw.15312. https://doi.org/10.20452/pamw.15312. [DOI] [PubMed] [Google Scholar]
- 37.Wada H., Gabazza E.C., Asakura H., Koike K., Okamoto K., Maruyama I. Comparison of diagnostic criteria for disseminated intravascular coagulation (DIC): Diagnostic criteria of the International Society of Thrombosis and Hemostasis (ISTH) and of the Japanese ministry of health and welfare for overt DIC. Am J Hematol. 2003;74:17–22. doi: 10.1002/ajh.10377. https://doi.org/10.1002/ajh.10377. [DOI] [PubMed] [Google Scholar]
- 38.Singh B., Hanson A.C., Alhurani R., Wang S., Herasevich V., Cartin-Ceba R. Trends in the incidence and outcomes of disseminated intravascular coagulation in critically Ill patients (2004-2010): A population-based study. Chest. 2013;143:1235–1242. doi: 10.1378/chest.12-2112. https://doi.org/10.1378/chest.12-2112. [DOI] [PubMed] [Google Scholar]
- 39.Deng Y., Liu W., Liu K., Fang Y.Y., Shang J., Zhou L. Clinical characteristics of fatal and recovered cases of coronavirus disease 2019 (COVID-19) in Wuhan China: A retrospective study. Chin Med J (Engl). 2020:2019. doi: 10.1097/CM9.0000000000000824. https://doi.org/10.1097/CM9.0000000000000824. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Lippi G., Plebani M., Henry B.M. Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: A meta-analysis. Clin Chim Acta. 2020;506:145–148. doi: 10.1016/j.cca.2020.03.022. https://doi.org/10.1016/j.cca.2020.03.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.American Society of Hematology. COVID-19 and coagulopathy: Frequently asked questions. Estados Unidos: American Society of Hematology; 2020 [consultado 20 Abr 2020]. Disponible en: https://www.hematology.org/covid-19/covid-19-and-coagulopathy.
- 42.Wada H., Thachil J., Di Nisio M., Mathew P., Kurosawa S., Gando S. Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines. J Thromb Haemost. 2013;11:761–767. doi: 10.1111/jth.12155. https://doi.org/10.1111/jth. 5 1215. [DOI] [PubMed] [Google Scholar]
- 43.Dolhnikoff M., Duarte-Neto A.N., de Almeida Monteiro R.A., Ferraz da Silva L.F., Pierre de Oliveira E., Nascimento Saldiva P.H. Pathological evidence of pulmonary thrombotic phenomena in severe COVID-19. J Thromb Haemost. 2020. doi: 10.1111/jth.14844. https://doi.org/10.1111/jth. 41484. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Magro C., Mulvey J.J., Berlin D., Nuovo G., Salvatore S., Harp J. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: A report of five cases. Transl Res. 2020:1–13. doi: 10.1016/j.trsl.2020.04.007. https://doi.org/10.1016/j.trsl. 04.007 2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Jing-Chun S., Gang W., Wei Z., Yang Z., Wei-Qin L., Zhou Z. People's Liberation Army Professional Committee of Critical Care Medicine CS on T and H Chinese expert consensus on diagnosis and treatment of coagulation dysfunction in COVID-19. Mil Med Res. 2020;7:19. doi: 10.1186/s40779-020-00247-7. https://doi.org/10.1186/s40779-020-7-7 0024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Sanz M., Hernández-Tejedor A., García ÁE, Rivera J.J., de Molina Ortiz F.J., Camps A.S. Recomendaciones de «hacer» y «no hacer» en el tratamiento de los pacientes críticos ante la pandemia por coronavirus causante de COVID-19 de los Grupos de Trabajo de la Sociedad Española de Medicina Intensiva Crítica y Unidades Coronarias (SEMICYUC) Med Intensiva. 2020 doi: 10.1016/j.medin.2020.04.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Vivas D., Roldán V., Esteve-Pastor M.A., Roldán I., Tello-Montoliu A., Ruiz-Nodar J.M. Recomendaciones sobre el tratamiento antitrombótico durante la pandemia COVID-19. Posicionamiento del Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología. Rev Española Cardiol. 2020 doi: 10.1016/j.recesp.2020.04.006. https://doi.org/doi:10.1016/j.recesp. 04.006’. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Tang N., Bai H., Chen X., Gong J., Li D., Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020 doi: 10.1111/jth.14817. https://doi.org/10.1111/jth.14817. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Iba T., Levy J.H., Warkentin T.E., Thachil J., van der Poll T., Levi M. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. J Thromb Haemost. 2019;17:1989–1994. doi: 10.1111/jth.14578. https://doi.org/10.1111/jth.8 1457. [DOI] [PubMed] [Google Scholar]
- 50.Bikdeli B., Madhavan M.V., Jimenez D., Chuich T., Dreyfus I., Driggin E. COVID-19 and thrombotic or thromboembolic disease: Implications for prevention, antithrombotic therapy, and follow-up. J Am Coll Cardiol. 2020 doi: 10.1016/j.jacc.2020.04.031. https://doi.org/10.1016/j.jacc.2020.04.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Witt D.M., Nieuwlaat R., Clark N.P., Ansell J., Holbrook A., Skov J. American Society of Hematology 2018 guidelines for management of venous thromboembolism: Optimal management of anticoagulation therapy. Blood Adv. 2018;2:3257–3291. doi: 10.1182/bloodadvances.2018024893. https://doi.org/10.1182/bloodadvances.2018024893. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Rice T.W., Janz D.R. In defense of evidence-based medicine for the treatment of COVID-19 ARDS. Ann Am Thorac Soc. 2020 doi: 10.1513/AnnalsATS.202004-325IP. 0:AnnalsATS. 202004-325IP. https://doi.org/10.1513/AnnalsATS. 202004-325IP. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.SETH. Recomendaciones de tromboprofilaxis y tratamiento antitrombótico en pacientes. Sociedad Española de Trombosis y Hemostasia. Madrid: Sociedad Española de Trombosis y Hemostasia; 2020 [consultado 22 Abr 2020]. Disponible en: https://www.covid-19.seth.es/recomendaciones-de-tromboprofilaxis-y-tratamiento-antitrombotico-en-pacientes-con-covid-19/.
- 54.World Health Organization. Clinical management of severe acute respiratory infection (SARI) when COVID-19 disease is suspected. Ginebra: WHO. 2020;2019:12 [consultado 11 Abr 2020]. Disponible en: https://www.who.int/publications-detail/clinical-management-of-severe-acute-respiratory-infection-when-novel-coronavirus-(ncov)-infection-is-suspected.
- 55.Kahn S.R., Lim W., Dunn A.S., Cushman M., Dentali F., Akl E.A. Prevention of VTE in nonsurgical patients. Antithrombotic therapy and prevention of thrombosis, 9 th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2012;141:e195S–e226S. doi: 10.1378/chest.11-2296. https://doi.org/10.1378/chest.11-2296. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Thachil J., Tang N., Gando S., Falanga A., Cattaneo M., Levi M. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost. 2020:1–4. doi: 10.1111/jth.14810. https://doi.org/10.1111/jth.14810. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Zhai Z., Li C., Chen Y., Gerotziafas G., Zhang Z., Wan J. Prevention and treatment of venous thromboembolism associated with coronavirus disease 2019 infection: A consensus statement before guidelines. Thromb Haemost. 2020 doi: 10.1055/s-0040-1710019. https://doi.org/10.1055/s-0040-1710019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Kalpatthi R., Kiss J.E. Thrombotic thrombocytopenic purpura heparin-induced thrombocytopenia, and disseminated intravascular coagulation. Crit Care Clin. 2020;36:77–357. doi: 10.1016/j.ccc.2019.12.006. https://doi.org/10.1016/j.ccc.2019.12.006. [DOI] [PubMed] [Google Scholar]