Aufgrund der COVID-19-Pandemie gibt es verschiedene Faktoren, die eine Änderung der therapeutischen und prophylaktischen Supportivmaßnahmen für Krebspatienten erforderlich machen können.
Infektionen durch das neuartige Coronavirus SARS-CoV-2 ("severe acute respiratory syndrome corona virus 2") führen bei 14-19 % der infizierten Patienten zu signifikanten Folgeerkrankungen mit akutem Atemnotsyndrom (ARDS), septischem Schock und Multiorganversagen [1] und etwa 6,23 % werden weltweit an der Krankheit sterben [2]. In Deutschland publiziert das Robert Koch Institut (RKI) die Zahlen täglich. Es werden nur Fälle veröffentlicht, bei denen eine labordiagnostische Bestätigung (unabhängig vom klinischen Bild) vorliegt. Am 15.6. 2020 um 0:00 Uhr waren 186.461 Fälle gemeldet, davon 8.791 Todesfälle, entsprechend einer Sterblichkeitsquote von 4,68 % [www.rki.de].
Bluthochdruck (Odds Ratio [OR] 2,29, p < 0,001), Diabetes (OR 2,47, p < 0,001), chronisch obstruktive Lungenerkrankung (COPD) (OR 5,97, p < 0,001), Herz-Kreislauf-Erkrankungen (OR 2,93, p < 0,001) und zerebrovaskuläre Erkrankungen (OR 3,89, p = 0,002) waren in einer aktuellen Metaanalyse als unabhängige Risikofaktoren bei Patienten mit einer COVID-19-Erkrankung assoziiert [3].
In einer Metaanalyse von 14 Studien aus dem Zeitraum 1.1.-24.4.2020 waren folgende Risikofaktoren signifikant mit einer erhöhten Sterblichkeit an COVID-19 assoziiert: Das Vorliegen von Komorbiditäten wie Hypertonie (Odds Ratio: OR 2,5; 95 %-Konfidenzintervall [95 %-KI] 2,1-3,1; p < 0,00001), koronare Herzkrankheit (OR 3,8; 95 %-KI 2,1-6,9; p < 0,00001) und Diabetes (OR 2,0; 95 %-KI 1,7-2,3; p<0,00001). Personen, mit einer kardiometabolischen Grunderkrankung und die Hinweise auf eine akute Entzündung und Endorganschädigung aufweisen, haben ein höheres Sterblichkeitsrisiko aufgrund einer COVID-19-Infektion [4].
Das RKI gibt für die folgenden Personengruppen ein erhöhtes Risiko für einen schweren Krankheitsverlauf an [http://tiny.cc/rki_corona]:
ältere Personen (mit stetig steigendem Risiko für schweren Verlauf ab etwa 50-60 Jahren; 86 % der in Deutschland an COVID-19-Verstorbenen waren 70 Jahre alt oder älter (Altersmedian: 82 Jahre)
Raucher (schwache Evidenz)
stark adipöse Menschen
-
Personen mit bestimmten Vorerkrankungen (ohne Rangfolge):
- Erkrankungen des Herz-Kreislauf-Systems (z. B. koronare Herzerkrankung und Bluthochdruck)
- chronische Lungenerkrankungen (z. B. COPD)
- chronische Lebererkrankungen
- Patienten mit Diabetes mellitus
- Patienten mit einer Krebserkrankung
- Patienten mit geschwächtem Immunsystem, z. B. aufgrund einer Erkrankung, die mit einer Immunschwäche einhergeht oder durch die regelmäßige Einnahme von Medikamenten, die die Immunabwehr beeinflussen und herabsetzen können, wie z. B. Cortison.
Das Risiko einer Infektion und auch einer Pneumonie durch respiratorische Viren CARV ("community acquired respiratory viruses") ist für Patienten mit maligner Erkrankung im Vergleich zu Gesunden erhöht [5]. Dies gilt mit großer Wahrscheinlichkeit auch für SARS-CoV-2-Infektionen.
Krebspatienten mit schwerem Krankheitsverlauf
Die Datenlage zur SARS-CoV-2-Infektion und COVID-19 bei Patienten mit malignen Erkrankungen ist noch limitiert. Eine Studie aus China zeigte für Krebspatienten ein im Vergleich zu anderen Patienten höheres Risiko für einen schweren Verlauf. Eine frühere Krebserkrankung korrelierte mit dem höchsten Risiko eines schweren Verlaufs [6].
Eine weitere multizentrische Studie ergab, dass Patienten mit hämatologischer Neoplasie, Lungenkrebs oder mit metastasierter Tumorerkrankung (Stadium IV) am häufigsten schwere Ereignisse aufwiesen. Bei Krebsspatienten mit nicht metastasierter Erkrankung war die Häufigkeit schwerer Ereignisse ähnlich hoch wie bei Patienten ohne Krebs. Patienten, die sich einer Operation unterziehen mussten, hatten ein höheres Risiko für schwere Ereignisse, während Patienten, die nur eine Strahlentherapie erhielten, im Vergleich zu Patienten ohne Karzinom, keine signifikanten Unterschiede in der Häufigkeit schwerer Ereignisse aufwiesen. Diese Ergebnisse deuten darauf hin, dass Patienten mit Krebserkrankung anfälliger für den Ausbruch von COVID-19 zu sein scheinen [7].
In einer aktuellen Studie des COVID-19 and Cancer Consortiums (CCC19) wurden 928 von 1.035 Fällen aus den USA, Spanien und Kanada analysiert, die zwischen dem 17. März und 16. April 2020 aufgetreten sind. Primäre Fragestellung war die 30-Tage-Mortalität [8]. Das mittlere Alter lag bei 66 Jahren (Bereich 18-90, Interquartil-Range 57-76 Jahre). Brust- (20 %) und Prostatakrebs (16 %) waren am häufigsten; 43 % der Patienten befanden sich in aktiver Krebsbehandlung. 116 Patienten (13 %) sind gestorben, 14 % wurden auf eine Intensivstation aufgenommen und 12 % wurden mechanisch beatmet. In der multivariaten logistischen Regressionsanalyse waren unabhängige Faktoren, die mit einer erhöhten 30-Tage-Mortalität assoziiert sind: Alter, männliches Geschlecht, früheres Rauchen, höherer ECOG-Performancestatus (ECOG-PS ≥ 2), aktives Malignom und progredientes Malignom. Hingegen waren Tumortyp, Rasse/Ethnizität, Adipositas, Anzahl der Komorbiditäten, kürzliche Operation und Art der aktiven Krebstherapie keine signifikanten Faktoren für ein erhöhtes Mortalitätsrisiko.
Die auf dem virtuellen ASCO-Kongress 2020 von Guiseppe Curigliano präsentierte TERAVOLT-Studie mit thorakalen Malignomen aus Italien zeigte eine Mortalität von 8 % bei Krebspatienten, die bei Patienten über 75 Jahren auf 19 % anstieg [Horn L et al. J Clin Oncol. 2020;38(suppl 18):Abstr LBA111].
Eine prospektive Studie der Universität Birmingham, Großbritannien, an 800 Patienten mit der Diagnose Krebs und symptomatischer COVID-19-Erkrankung ergab im Gegensatz dazu, dass die Mortalität von COVID-19 bei Krebspatienten hauptsächlich durch Alter, Geschlecht und Komorbiditäten bedingt zu sein scheint. Mit der Studie wurden jedoch keine Hinweise darauf gefunden, dass Krebspatienten, die eine zytotoxische Chemotherapie oder eine andere Krebsbehandlung erhalten, ein erhöhtes Mortalitätsrisiko durch COVID-19 haben, verglichen mit denen, die nicht aktiv behandelt werden [9].
Bisher ist jedoch die Einschätzung, dass Patienten mit Tumoren oder einer hämatologischen Neoplasie ein erhöhtes Risiko von Komplikationen oder Tod bei COVID-19 haben [8, 10]. Folgende Risikofaktoren spielen bei Krebspatienten der Onkopedia-Leitline zufolge eine besondere Rolle:
schwere Immunsuppression
Neutropeniephase
Lymphozytopenie < 0,2 × 109/L
Die ESMO (European Society for Medical Oncology) publizierte weitere Risikokonstellationen [11]:
Patienten unter aktueller Chemotherapie oder jene, die in den letzten 3 Monaten immer wieder eine Chemotherapie erhalten haben
Patienten, die eine umfassende Strahlentherapie erhalten
Personen, die in den letzten 6 Monaten Knochenmark- oder Stammzelltransplantationen erhalten haben oder immer noch immunsuppressive Medikamente einnehmen
Personen mit bestimmten Krebsarten des Blut- oder Lymphsystems, die das Immunsystem schädigen, auch wenn sie nicht behandelt werden mussten (z. B. chronische Leukämie, Lymphom oder Myelom)
-
Spezifische Risikogruppen sind Krebspatienten mit einem geschädigten Immunsystem, wie z. B:
- Leukozytopenie
- Niedrige Immunglobulinspiegel
- Langanhaltende Immunsuppression (Steroide, Antikörper)
Krankheitsspezifische Empfehlungen
Die Therapie kann bei vielen Patienten meistens nicht verschoben werden, sodass z. B. die Fachgesellschaften DGHO (Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie) und ESMO Empfehlungen zu einzelnen Krankheitsentitäten oder Krankheitssituationen publizieren:
https://www.onkopedia.com/de/onkopedia/guidelines/coronavirus-infektion-covid-19-bei-patienten-mit-blut-und-krebserkrankungen/@@guideline/html/index.html#ID0EAIAE
https://www.esmo.org/guidelines/cancer-patient-management-during-the-covid-19-pandemic
Angepasste Supportivtherapie
Verständlicherweise liegen kaum Publikationen zu den einzelnen Erkrankungen mit COVID-19 vor. Dies darf jedoch nicht zu dem Trugschluss führen, dass es keine Probleme mit COVID-19 für diese Patientengruppen gibt oder dass es gleichgültig ist, ob man die bisher üblichen Maßnahmen anpassen muss. Es gibt vielmehr die Empfehlungen von Experten, die diese aufgrund ihrer Fachkenntnisse basierend auf Analogieschlüssen formulieren.
Wenn unter Abwägung von Nutzen und Risiko eine Therapie der malignen Erkrankung erforderlich ist, dann kommt der supportiven Therapie eine wichtige Bedeutung zu. Die existierenden Leitlinien wurden von der ESMO und ASCO (American Society of Clinical Oncology) der COVID-19-Pandemie angepasst [11, 12]. Mangels publizierter Daten basieren die Empfehlungen auf Expertenmeinungen und Expertenkonsens. Nachfolgend ist eine Auswahl der ESMO-Empfehlungen dargestellt und erläutert [11].
Blutarmut
Bislang gibt es keinen Hinweis für die Übertragung von COVID-19 über Blutprodukte.
In bestimmten Regionen und zu einem bestimmten Zeitpunkt wird mit einem möglichen Mangel an Blutprodukten gerechnet.
Zur Linderung der symptomatischen Anämie bei Patienten mit bösartigen Erkrankungen, die eine Chemotherapie erhalten, sollte die Epoetin-Therapie als Option in Betracht gezogen werden, um zusätzliche Klinikbesuche zu vermeiden. Das Thromboserisiko sollte berücksichtigt werden und es sollten eher die Symptome als bestimmte Hämoglobin(Hb)-Schwellenwerte in Betracht gezogen werden. Bei einzelnen Patienten sollte ein Hb-Schwellenwert von etwa 7 g/dL (4,35 mmol/L) in in Erwägung gezogen werden.
Eine lang wirkende Epoetin-Formulierung könnte in dieser Situation eine gute Wahl sein.
Es sollte beachtet werden, dass Epoetine im Allgemeinen nicht schnell wirken und in den meisten Studien zu einer Veränderung von 1 bis 1,5 g/dL (0,62 bis 0,93 mmol/L) führen.
Bei Patienten mit schweren Anämie-bedingten Symptomen (selbst bei Hb-Spiegeln über 7 g/dL [4,35 mmol/L]) und der Notwendigkeit einer sofortigen Hb- und Symptomverbesserung ist die Transfusion von Erythrozytenkonzentraten die erste Option.
Febrile Neutropenie
Das Risiko der febrilen Neutropenie basiert einerseits auf der Intensität der Chemotherapie und zusätzlich auf patientenspezifischen Risikofaktoren (Abb. 1) [13]. Therapieprotokolle können z. B. in der Onkopti-Datenbank gefunden werden (www.onkopti.de), sowie in manchen Leitlinien zur G-CSF("granulocyte-colony stimulating factor")-Prophylaxe.
| Allgemein |
Keine Anzeichen einer ZNS-Infektion, einer schweren Lungenentzündung oder einer Venenkatheterinfektion Keine Anzeichen einer Sepsis oder septischen Schocks Keiner der folgenden Punkte: — assoziiertes Organversagen — ausgeprägte Bauchschmerzen (±Diarrhoe) — Dehydrierung — rezidivierendes Erbrechen — intravenöse supportive Therapie — Notwendigkeit einer dauerhaften oder engen Überwachung (z.B. metabolische Dekompensation, Hyperkalzämie) — Keine neuen behandlungsbedürftigen EKG-Anomalien, — Keine neue schwere Organbeeinträchtigung |
| Orale Antibiotika | Keine Fluorchinolon-Prophylaxe oder -Therapie innerhalb der letzten 7 Tage, orale Medikation durchführbar Gute Compliance mit der oralen Medikation erwartet |
| Ambulante Versorgung |
Medizinische Versorgung gewährleistet (verschiedene Optionen) Patient lebt nicht allein; Patient / Helfer haben ein Telefon; Patient kann die Klinik, die für die Behandlung von Neutropen-Patienten qualifiziert ist, innerhalb von 1 h erreichen Patient ist bei Bewusstsein, kennt und versteht die Risiken |
Insbesondere Patienten mit soliden Tumoren, die nicht kurativ behandelt werden, sollten nach Möglichkeit Schemata erhalten, die mit einem geringen Risiko der febrilen Neutropenie assoziiert sind. Es sollte eine gute Evidenz für die Anwendung von Schemata mit einem höheren Neutropenie-Risiko vorliegen, die das heutige erhebliche Risiko, der Notfall-Intervention rechtfertigt.
Die Indikation von G-CSF nach Chemotherapie sollte erweitert werden, um das Risiko einer febrilen Neutropenie zu senken. (Die theoretisch geäußerte Besorgnis über ein akutes respiratorisches Versagen aufgrund von G-CSF-induzierter Leukozytose bei Patienten mit Lungeninfektionen aufgrund einer SARS-CoV-2-Infektion wiegt den Nutzen nicht auf). Zu bedenken ist, dass eventuell mehr Arztbesuche anfallen.
-
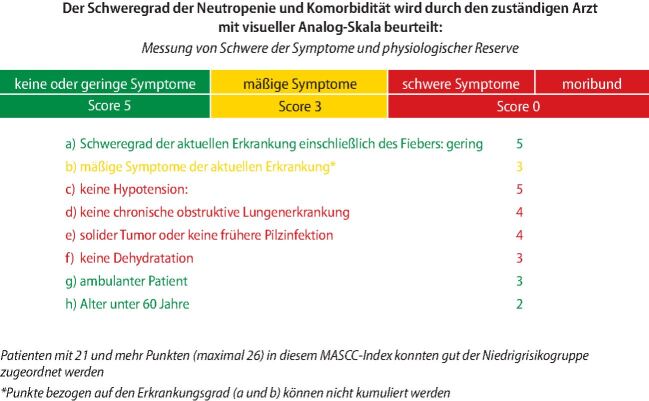
Um Patienten mit febriler Neutropenie und einem geringen Risiko von Komplikationen identifizieren zu können, gibt es den gut verifizierten MASCC FN Risk-Index Score, um entscheiden zu können, ob ein Patient ambulant oder stationär behandelt werden kann (https://www.mascc.org/mascc-fn-risk-index-score), (Abb. 2) . Außerdem sollten die individuellen Kriterien zur Therapieentscheidung herangezogen werden (Tab. 1) [14, 15]. Die Schemata zur ambulanten oralen Antibiotikatherapie sind [14]:
- Wenn orale Therapie möglich und keine Chinolon-Prophylaxe:
- Amoxicillin Clavulansäure 875/125 mg 3-mal täglich plus Ciprofloxacin 500 mg 2-mal täglich
- oder Moxifloxacin 400 mg 1-0-0 (cave: Risiko Clostridioides difficile).
- Gesamttherapiedauer: Fiebertage plus 5 fieberfreie Tage
Der Einsatz von Antibiotikaprophylaxe und/oder die Verschreibung von Bereitschaftsantibiotika (die bei Bedarf eingesetzt werden) sollte in der gegenwärtigen Situation wegen des möglichen Risikos einer Verzögerung von Notfallbesuchen für Patienten, die Fieber entwickeln (neben anderen Risiken), ausgeweitet werden. Natürlich muss man die spezifischen Risiken bezüglich multiresistenter Bakterien in verschiedenen Regionen beachten.
Der Gebrauch von Steroiden sollte kritisch überprüft und wenn möglich, reduziert werden (siehe auch "Übelkeit und Erbrechen").
Gemäß Empfehlung der Europäischen Arzneimittel-Agentur (EMA) vom 13.3.2020 (unabhängig von der Pandemie COVID-19): Es wird empfohlen, bei Patienten wegen der Einnahme eines Fluoropyrimidins einen Gentest durchzuführen, um diejenigen mit DPD-Mangel zu identifizieren (kritische Neutropenie, Diarrhöe, Mukositis usw.).
CDK4/6- oder PARP-Inhibitor-induzierte Neutropenie hat noch keinen wirklichen Anstieg der assoziierten Virusinfektionen gezeigt.
Hypogammaglobulinämie
Derzeit enthält die Immunglobulin-Ersatztherapie keine spezifischen Antikörper gegen SARS-CoV-2. Produkte, die spezifische Antikörper enthalten, werden in einer späteren Phase der Pandemie erwartet.
-
Dennoch kann eine sekundäre Immunschwäche eine Indikation für eine Immunglobulinsubstitution zum Schutz vor Kollateralinfektionen darstellen. Die Indikation sollte nach den bestehenden Leitlinien gestellt werden [16] und der Nutzen für den einzelnen Patienten gegen das Risiko häufiger Klinikbesuche abgewogen werden:
- Pathologische Infektionsanfälligkeit
- Immunglobulinmangel < 4 g/l
- Pathologische Impfantwort
Übelkeit und Erbrechen durch Chemotherapie (CINV)
Eine gute Strategie bestünde darin, bei geringstem Zweifel der Gefahr eines Erbrechens eine großzügige antiemetische Prophylaxe zu verschreiben, um das Risiko zusätzlicher klinischer Besuche aufgrund dieser Symptome zu senken. Dazu kann - je nach emetogenem Potenzial und individuellen Risikofaktoren - die Kombination von 5-HT3-RA plus Neurokinin 1-RA plus Dexamethason (Einzeldosis am Tag der Behandlung) plus Olanzapin gehören. Bei der Wahl des 5-HT3-RA: Man könnte den langwirkenden 5-HT3-RA Palonosetron wegen seiner potenziell besseren Wirksamkeit in der verzögerten Phase von CINV in Betracht ziehen, insbesondere wenn die Dexamethason-Dosis gesenkt/gespart wird. Grundsätzlich sollte die Verwendung von Steroiden kritisch überprüft werden. Eine reduzierte Dosis Dexamethason am Tag 1 ohne zusätzliche Verwendung an den folgenden Tagen sollte auch bei hoch emetogener Chemotherapie in Betracht gezogen werden. Eine vollständig steroidfreie Antiemese sollte nur bei einzelnen Patienten in Betracht gezogen werden, bei denen bereits bei einer einzigen Dexamethason-Dosierung ein erhöhtes Risiko für COVID-19-Komplikationen besteht.
Lungentoxizität
Wegen des Risikos schwerwiegender Komplikationen einer SARS-CoV-2-Infektion bei Patienten mit vorbestehender Lungenschädigung muss eine mögliche antineoplastische therapieinduzierte Lungentoxizität in Betracht gezogen werden (z. B. durch Immuncheckpointinhibitoren, Bleomycin, Bestrahlung, die ausgedehnte Lungenbereiche berührt) und diese mit besonderer Vorsicht verabreicht werden.
Bei respiratorischen Symptomen wird eine frühzeitige CT-Untersuchung zur detaillierten Darstellung von Lungeninfiltraten und zur Abgrenzung von COVID-19 selbst empfohlen.
Thromboembolische Ereignisse
Die Prophylaxe thromboembolischer Ereignisse sollte gemäß den bestehenden Richtlinien fortgesetzt werden. Die Patienten sollten sorgfältig überwacht werden, um mögliche Blutungskomplikationen zu verhindern.
Patienten mit SARS-CoV-2-Infektionen:
-
Mögliche Veränderungen der Gerinnungsparameter und damit verbundene Komplikationen:
- disseminierte intravaskuläre Koagulation (im Zusammenhang mit einer schlechteren Prognose)
- Thrombozytopenie (in den meisten Fällen leicht, aber es wurden auch Fälle mit schwerer Manifestation beschrieben)
- anscheinend höheres Risiko für venöse Thromboembolien
Patienten, die mit einer bestätigten COVID-19-Diagnose hospitalisiert werden, sollten eine Prophylaxe thromboembolischer Ereignisse mit niedermolekularem Heparin (z. B. Fondaparinux) oder auch unfraktioniertem Heparin bei kritisch kranken Patienten mit deutlich reduzierter Nierenfunktion erhalten. Wenn direkte orale Antikoagulanzien verwendet werden, müssen mögliche Wechselwirkungen mit Medikamenten, die gegen COVID-19 eingesetzt werden, in Betracht gezogen werden.
Die Rolle der vollständigen Antikoagulation bei schwerkranken Patienten mit COVID-19 bleibt zum aktuellen Zeitpunkt (Juni 2020) umstritten.
Korrespondenzadresse.
Prof. Dr. med. Hartmut Link
Finkenhain 8
67661 Kaiserslautern
Praxis-Link@kabelmail.de
Literatur
- 1.Guan WJ et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382(18):1708-20 [DOI] [PMC free article] [PubMed]
- 2.Coronavirus disease (COVID-19) Situation Report-131 2020 [updated 30.5.2020 10:00 Uhr]. https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200530-covid-19-sitrep-131.pdf?sfvrsn=d31ba4b3_2
- 3.Wang B et al. Does comorbidity increase the risk of patients with COVID-19: evidence from meta-analysis. Aging. 2020;12(7):6049-57 [DOI] [PMC free article] [PubMed]
- 4.Tian W et al. Predictors of mortality in hospitalized COVID-19 patients: A systematic review and meta-analysis. J Med Virol. 2020; https://doi.org/10.1002/jmv.26050 [DOI] [PMC free article] [PubMed]
- 5.von Lilienfeld-Toal M et al. Community acquired respiratory virus infections in cancer patients-Guideline on diagnosis and management by the Infectious Diseases Working Party of the German Society for haematology and Medical Oncology. Eur J Cancer. 2016;67:200-12 [DOI] [PMC free article] [PubMed]
- 6.Liang W et al. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol. 2020;21(3):335-7 [DOI] [PMC free article] [PubMed]
- 7.Dai M et al. Patients with Cancer Appear More Vulnerable to SARS-COV-2: A Multicenter Study during the COVID-19 Outbreak. Cancer Discov. 2020;10(6):783-91 [DOI] [PMC free article] [PubMed]
- 8.Kuderer NM et al. Clinical impact of COVID-19 on patients with cancer (CCC19): a cohort study. Lancet. 2020; https://doi.org/10.1016/S0140-6736(20)31187-9 [DOI] [PMC free article] [PubMed]
- 9.Lee LYW et al. COVID-19 mortality in patients with cancer on chemotherapy or other anticancer treatments: a prospective cohort study. Lancet. 2020. S0140-6736(20):31173-9 [DOI] [PMC free article] [PubMed]
- 10.He W et al. COVID-19 in persons with haematological cancers. Leukemia. 2020;34(6):1637-45 [DOI] [PMC free article] [PubMed]
- 11.Aapro M. Supportive care strategies during the Covid-19 pandemic: ESMO; 2020 [31.5.2020]. Available from: https://www.esmo.org/guidelines/cancer-patient-management-during-the-covid-19-pandemic/supportive-care-in-the-covid-19-era
- 12.COVID-19 Patient Care Information: ASCO. 2020;https://www.asco.org/asco-coronavirus-information/care-individuals-cancer-during-covid-19
- 13.Jordan K et al. Leitlinienreport zur S3-Leitlinie Supportive Therapie bei onkologischen PatientInnen - Langversion 1.0, 2016, https://www.leitlinienprogramm-onkologie.de/leitlinien/supportive-therapie/
- 14.Heinz WJ et al. Diagnosis and empirical treatment of fever of unknown origin (FUO) in adult neutropenic patients: guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Medical Oncology (DGHO). Ann Hematol. 2017;96(11):1775-92 [DOI] [PMC free article] [PubMed]
- 15.Heinz W et al. Fieber unbekannter Genese (FUO) bei neutropenischen Patienten. Onkopedia. 2018; https://www.onkopedia.com/de/onkopedia/guidelines/fieber-unbekannter-genese-fuo-bei-neutropenischen-patienten/@@guideline/html/index.html
- 16.Na IK et al. Immundefekte, sekundär. Onkopedia. 2019; https://www.onkopedia.com/de/onkopedia/guidelines/immundefekte-sekundaer/@@guideline/html/index.html#ID0EFYAE