慢性髓性白血病(CML)是骨髓造血干细胞克隆性增殖形成的恶性肿瘤,占成人白血病的15%[1],全球年发病率为1.6/10万~2/10万[2]。我国1986至1988年在全国22个省(市、自治区)46个调查点进行的全国白血病发病情况调查显示CML的年发病率为0.36/10万[3]。此后国内几个地区的流行病学调查显示CML的年发病率为0.39/10万~0.55/10万[4]–[7]。中国CML患者较西方更为年轻化,国内几个地区的流行病学调查显示CML中位发病年龄为45~50岁,而西方国家CML的中位发病年龄为67岁。
一代酪氨酸激酶抑制剂(TKI)伊马替尼作为一线治疗药物使CML患者的10年生存率达85%~90%[8],尼洛替尼、达沙替尼等二代TKI一线治疗CML能够获得更快更深的分子学反应,逐步成为CML患者的一线治疗方案之一[9]–[11]。目前愈来愈多的临床研究数据表明,TKI治疗获得持续的深度分子学反应(DMR)超过2年的患者,部分能够获得长期的无治疗缓解(treatment free remission, TFR),即功能性治愈[12]。尽快获得完全细胞遗传学反应(CCyR)以及更深的分子学反应是CML治疗近期目标,改善生活质量和功能性治愈是CML治疗的长期目标。功能性治愈成为越来越多CML患者追求的治疗目标。需要注意的是,停药对DMR水平、停药后监测以及随访具有严格的要求,停药的长期安全性尚不明确,建议在临床研究中进行。有条件的中心在临床实践中应谨慎选择患者,应在充分知情的情况下进行停药,做好定期随访和监测。异基因造血干细胞移植(allo-HSCT)曾经是CML的一线治疗方案,但有无供者、患者年龄、移植相关风险等多种因素限制其应用。目前以伊马替尼为代表的TKI已取代造血干细胞移植成为CML患者首选一线方案。在CML的治疗中应该详细评估患者的全面情况后,向其推荐优势治疗选择,参考患者的治疗意愿,进行下一步治疗。
现参照2020年《慢性髓性白血病NCCN肿瘤学临床实践指南》(NCCN 2020)[13]、2017年欧洲肿瘤内科学会(ESMO 2017)[14]、2013年及2020年欧洲白血病网(ELN 2013、2020)[15]–[16]专家组的治疗推荐,并结合中国的实际情况,经过国内血液学专家研究讨论后制订了本指南,为血液科医师和肿瘤科医师提供最新的临床指导。
一、诊断分期及预后分组
(一)诊断分期
同《中国慢性髓性白血病诊断与治疗指南(2016年版)》[17]。
1. 诊断标准:典型的临床表现,合并Ph染色体和(或)BCR-ABL融合基因阳性即可确定诊断。
2. CML的分期:
(1)慢性期:①外周血或骨髓中原始细胞<10%;②没有达到诊断加速期或急变期的标准。
(2)加速期:①外周血或骨髓中原始细胞占10%~19%;②外周血中嗜碱性粒细胞≥20%;③对治疗无反应或非治疗引起的持续血小板减少(<100×109/L)或增高(>1000×109/L);④治疗过程中出现Ph染色体基础上的克隆演变;⑤进行性脾脏增大或WBC增高。
(3)急变期:①外周血或骨髓中原始细胞≥20%;②骨髓活检原始细胞集聚;③髓外原始细胞浸润。
附注:CML分期的ELN标准[15]:加速期:外周血或骨髓中原始细胞占15%~29%,或原始+早幼粒细胞>30%;外周血中嗜碱性粒细胞≥20%;非治疗引起的持续血小板减少(<100×109/L);治疗过程中出现Ph染色体基础上的主要途径克隆演变。急变期:外周血或骨髓中原始细胞≥30%;髓外原始细胞浸润。
(二)预后评估
许多因素影响着CML的慢性期及生存期。慢性期患者目前常用的评分系统包括Sokal、Euro以及EUTOS(表1),均以临床特点以及血液学指标作为预后评分因素。目前无明确数据判断三种预后积分系统的优劣,无论采取何种预后评估方式,建议对高危的患者采用更为积极的治疗和监测。
表1. 慢性髓性白血病(CML)预后评分系统.
| 评分系统 | 评分计算公式 | 低危 | 中危 | 高危 |
| Sokal[18] | exp[0.0116(年龄−43.4岁)]+0.0345(脾脏大小−7.51)+0.188[(PLT/700)2−0.563]+0.0887(原始细胞−2.1) | <0.8 | 0.8~1.2 | >1.2 |
| Euro[19] | [0.6666(当年龄≥50岁)+(0.0420×脾脏大小)+1.0956(当PLT≥1500 ×109/L)+(0.0584×原始细胞数)+0.2039(当嗜碱性粒细胞≥3%)+(0.0413×嗜酸性粒细胞)]×1000 | ≤780 | 781~1480 | >1480 |
| EUTOS[20] | 脾脏大小×4+嗜碱性粒细胞×7 | ≤87 | >87 |
注:PLT单位为×109/L,年龄单位为岁,脾脏大小指肋下厘米数,原始细胞、嗜酸性粒细胞、嗜碱性粒细胞指外周血分类百分数。所有数据应在任何CML相关治疗开始前获得
二、治疗方案推荐
(一)慢性期患者的初始治疗
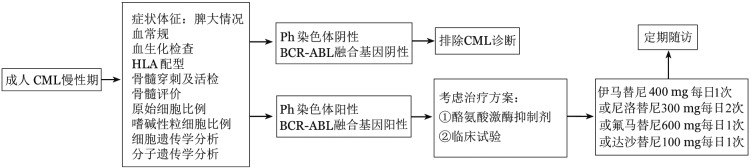
1. TKI治疗:慢性期患者首选治疗为TKI,美国食品药品监督管理局(FDA)批准且NCCN指南、ELN指南推荐慢性期患者一线治疗TKI包括伊马替尼、尼洛替尼、达沙替尼、博苏替尼。我国自主研发的氟马替尼用于新诊断CML慢性期患者一线治疗获得成功,被中国食品药品监督管理局(CFDA)批准用于新诊断CML慢性期患者一线治疗。表2列举上述TKI在一线治疗的疗效数据。参照NCCN、ELN指南,结合药物的可及性,本指南推荐一线治疗包括[8]–[17]:伊马替尼400 mg,每日1次;尼洛替尼300 mg,每日2次;氟马替尼600 mg,每日1次,达沙替尼100 mg,每日1次(图1)。CML基本治疗目标是阻止疾病进展,延长生存期。中高危患者疾病进展风险高于低危组患者。相对于标准伊马替尼一线治疗,二代TKI一线治疗可减少疾病进展,尤其是中高危患者无进展生存得以改善。不同预后分组的患者接受二代TKI一线治疗时,早期治疗反应以及DMR均具有显著优势。因此一线TKI选择应当在明确治疗目标基础上,依据患者初诊预后分层、个体状况、基础疾病、合并用药选择恰当的一线治疗药物[12]–[17],[21]。目前伊马替尼、尼洛替尼及氟马替尼均获得CFDA批准用于慢性期患者一线治疗。由于缺乏中国新诊断CML慢性期患者达沙替尼、博苏替尼一线治疗相关数据,CFDA未批准达沙替尼及博苏替尼用于CML慢性期患者的一线治疗。高剂量伊马替尼不推荐用于新诊断慢性期患者一线治疗,相对于标准剂量伊马替尼,高剂量伊马替尼早期治疗反应具有一定优势,但长期随访生存无获益,长期的DMR无显著优势,且出现更多的治疗相关不良事件,导致治疗中断[22]–[24]。TKI治疗期间应定期监测血液学、细胞遗传学及分子学反应,定期评估患者TKI治疗耐受性,参照中国CML患者治疗反应标准(表3)进行治疗反应评估,结合患者耐受性,随时调整治疗方案(表4)。早期的分子学反应至关重要,特别是TKI治疗3个月的BCR-ABL水平[25]–[26]。临床治疗反应包括最佳反应、治疗失败以及警告。治疗失败以及警告的患者在评价治疗依从性、患者的药物耐受性、合并用药的基础上及时行BCR-ABL激酶区突变检测,适时更换其他TKI(表4)。伊马替尼一线治疗耐药或不耐受患者推荐及时更换二代TKI治疗,二代TKI针对T315I以外的多数伊马替尼耐药的ABL激酶区突变有效。表5列举二代、三代TKI作为慢性期患者二线、三线治疗的情况。高剂量伊马替尼能够克服部分标准剂量伊马替尼耐药,但是往往疗效短暂。与高剂量伊马替尼相比,更换尼洛替尼或达沙替尼可获得更佳的细胞遗传学和分子学反应[27]–[30]。尽管缺乏长期生存获益的相关数据,二代TKI一线治疗反应不佳的患者可依照突变情况更换其他二代TKI或进入临床试验。三代TKI普纳替尼获得FDA批准用于既往TKI治疗耐药或不耐受患者的治疗,尤其是合并T315I突变的患者,但目前并未在中国上市[31]。二线TKI治疗失败的患者可考虑行allo-HSCT[32]–[33]。二线TKI治疗患者反应评估参照表6。频繁、长期的TKI治疗中断以及患者服药依从性差可能导致不良临床结果,一线TKI耐受不佳的患者应及时更换TKI[34]。良好的服药依从性以及严密监测对于获得最佳临床疗效非常重要。
表2. 慢性髓性白血病慢性期患者酪氨酸激酶抑制剂一线治疗疗效(%).
| 临床试验 | 治疗 | 3个月EMR | 随访时间(年) | CCyR | MMR | MR4.5 | EFS | PFS | OS |
| IRIS[8] | 伊马替尼400 mg(可评价) | - | 10 | 91.8(123/134) | 93.1(190/204) | 63.2(129/204) | |||
| 伊马替尼400 mg(553例)(ITT) | - | 10 | 22.2 | 34.4 | 23.3 | 92.1 | 79.6 | 83.3 | |
| ENESTnd[9] | 尼洛替尼600 mg(282例) | 91 | 10 | 87(2年) | 82.6 | 63.8 | 92.0 | 86.2 | 87.6 |
| 尼洛替尼800 mg(281例) | 89 | 85(2年) | 80.4 | 61.6 | 96.2 | 89.9 | 90.3 | ||
| 伊马替尼400 mg(283例) | 67 | 77(2年) | 69.6 | 45.2 | 90.3 | 78.2 | 88.3 | ||
| DASISION[11] | 达沙替尼100 mg(259例) | 84 | 5 | 83(1年) | 76 | 42 | - | 85 | 91 |
| 伊马替尼400 mg(260例) | 64 | 72(1年) | 64 | 33 | - | 86 | 90 | ||
| ENESTchina[10] | 尼洛替尼600 mg(282例) | 82.0 | 2 | 83.6 | 67.9 | - | 91.7 | 95.4 | 98.5 |
| 伊马替尼400 mg(283例) | 66.7 | 86.5 | 52.6 | - | 93.8 | 95.4 | 98.5 | ||
| FESTnda | 氟马替尼600 mg(196例) | 83.4 | 1 | 91 | 57.2 | 10.2 | - | 100 | 99.5 |
| 伊马替尼400 mg(197例) | 54.4 | 79 | 39.2 | 3.6 | - | 98 | 100 | ||
| BEFORE[27] | 博苏替尼400 mg(268例) | 75 | 1 | 77 | 47.2 | - | 96.3 | 98.4 | 99.9 |
| 伊马替尼400 mg(268例) | 57 | 66 | 36.9 | - | 93.6 | 97.5 | 99.7 |
注:EMR:早期分子学反应;CCyR:完全细胞遗传学反应;MMR:主要分子学反应;MR4.5:分子学反应4.5;EFS:无事件生存;PFS:无进展生存;OS:总生存;-:无资料。aNCT02204644
图1. 初诊慢性髓性白血病(CML)慢性期患者的诊断及初始治疗流程.
表3. 一线酪氨酸激酶抑制剂(TKI)治疗慢性髓性白血病慢性期患者治疗反应评价标准.
| 时间 | 最佳反应 | 警告 | 失败 |
| 3个月 | 达到CHR基础上
|
达到CHR基础上
|
|
| 6个月 |
|
|
|
| 12个月 | BCR-ABLIS≤0.1% | BCR-ABLIS>0.1%~1% |
|
| 任何时间 | 稳定或达到MMR | Ph+细胞=0,出现−7或7q−(CCA/Ph−) | 丧失CHR或CCyR或MMRa,出现伊马替尼或其他TKI耐药性突变,出现Ph染色体基础上其他克隆性染色体异常 |
注:CHR:完全血液学缓解;CyR:细胞遗传学反应;PCyR:部分细胞遗传学反应;CCyR:完全细胞遗传学反应;MMR:主要分子学反应;IS:国际标准化;CCA/Ph−:Ph−染色体的克隆性染色体异常;a连续2次检测明确丧失MMR并且其中1次BCR-ABLIS≥1%
表4. 一线酪氨酸激酶抑制剂(TKI)治疗慢性髓性白血病慢性期患者治疗调整策略.
| 治疗反应 | 评估 | 治疗方案调整 |
| 最佳治疗反应 | 继续原方案治疗 | |
| 警告 | ①评价患者依从性 | ①更换其他TKI |
| ②评价药物相互作用 | ②继续原方案 | |
| ③BCR-ABL激酶突变分析 | ③临床试验 | |
| ④一线伊马替尼治疗者可考虑提高伊马替尼剂量 | ||
| 治疗失败 | ①评价患者依从性 | ①更换其他TKI |
| ②评价药物相互作用 | ②造血干细胞移植评估 | |
| ③BCR-ABL激酶突变分析 | ③临床试验 | |
| 不耐受 | ①更换其他TKI | |
| ②造血干细胞移植评估 | ||
| ③临床试验 |
表5. 慢性髓性白血病慢性期患者二三线治疗的长期随访结果(%).
| TKI | 组别(例数) | 中位随访时间 | MCyR | CCyR | MMR | MR4.5 | OS | PFS |
| DAS[27]100 mg每日1次 | IM耐药(124例) | 7年 | - | - | 43 | 20 | 63 | 39 |
| IM不耐受(43例) | - | - | 55 | 70 | 51 | |||
| NIL[28]400 mg每日2次 | IM耐药(226例) | 4年 | 59 | 45 | 78 | 57 | ||
| IM不耐受(95例) | ||||||||
| 博苏替尼[34]500 mg每日1次 | IM、DAS耐药(38例) | 4年 | 39 | 22 | - | 67 | - | |
| IM、DAS不耐受(50例) | 42 | 40 | - | 80 | - | |||
| IM、NIL耐药(26例) | 38 | 31 | - | 87 | - | |||
| 普那替尼[30]45 mg每日1次 | NIL或DAS耐药或不耐受(203例) | 57个月 | 56 | 49 | 35 | 76(5年) | 52 | |
| T315I突变(64例) | 72 | 70 | 58 | 66(5年) | 50 |
注:IM:伊马替尼;DAS:达沙替尼;NIL:尼洛替尼;MCyR:主要细胞遗传学反应;CCyR:完全细胞遗传学反应;MMR:主要分子学反应;MR4.5:分子学反应4.5;PFS:无进展生存;OS:总生存;-:无资料
表6. 尼洛替尼或达沙替尼二线治疗慢性髓性白血病慢性期患者治疗反应评价标准.
| 时间 | 最佳反应 | 警告 | 失败 |
| 3个月 |
|
|
|
| 6个月 |
|
|
|
| 12个月 |
|
|
|
| 任何时间 | 稳定或达到MMR |
|
丧失CHR或CcyR或PCyR或MMRa,新发耐药性突变,出现Ph染色体基础上其他克隆性染色体异常 |
注:CHR:完全血液学缓解;CyR:细胞遗传学反应;mCyR:次要细胞遗传学反应;PCyR:部分细胞遗传学反应;CCyR:完全细胞遗传学反应;MMR主要分子学反应;IS:国际标准化;CCA/Ph−:Ph−染色体的克隆性染色体异常;a连续2次检测明确丧失MMR并且其中1次BCR-ABLIS≥1%
2. 其他治疗:因各种原因无法使用TKI治疗的患者可考虑以下治疗方案。
(1)干扰素为基础的方案[36]–[37]:在CML的TKI治疗时代,曾经的造血干细胞移植以外的最佳治疗选择——干扰素为基础的治疗方案依然是少部分患者的治疗选择。结合中国的实际情况,以下患者可考虑干扰素为基础的方案:①TKI耐药、不耐受且不适合造血干细胞移植的CML慢性期患者。②各种原因暂时无法应用TKI治疗或无法坚持长期使用TKI的慢性期患者。
(2)allo-HSCT:在TKI治疗时代,allo-HSCT作为二线TKI治疗失败后的三线的治疗选择,应当严格掌握适应证。详见后文。
(二)进展期治疗
1. 加速期治疗[12]–[17],[38]–[40]:参照患者既往治疗史、基础疾病以及BCR-ABL激酶突变情况选择适合的TKI,病情回复至慢性期者,可继续TKI治疗,如果患者有合适的造血干细胞供者来源,可考虑行allo-HSCT。存在T315I突变或二代TKI不敏感突变的患者应尽早行allo-HSCT。有条件进行新药临床试验的单位可行新药试验。
2. 急变期治疗[12]–[17],[38]–[40]:参照患者既往治疗史、基础疾病以及突变情况选择TKI单药或联合化疗提高诱导缓解率,缓解后应尽快行allo-HSCT。有条件进行新药临床试验的单位可行新药试验。
三、TKI治疗反应定义以及TKI治疗反应的监测
CML患者接受TKI治疗过程中疾病评价包括血液学、细胞遗传学以及分子生物学分析,及时评价治疗反应以及检测早期复发对于优化CML治疗具有重要而积极的意义。《中国慢性髓性白血病诊疗监测规范(2014年版)》[41]制订了CML治疗中血液学、细胞遗传学、分子学监测的时机和意义,是中国血液科医师日常工作的重要参考。CML慢性期患者的血液学、细胞遗传学以及分子学反应标准见表7,推荐的TKI治疗过程中血液学以及遗传学评估方式和频率见表8。
表7. 慢性髓性白血病慢性期治疗反应的定义[13]–[17],[41]–[44].
| 治疗反应 | 定义 |
| 血液学反应 | |
| 完全血液学反应 | PLT<450×109/L |
| WBC<10×109/L | |
| 外周血中无髓系不成熟细胞,嗜碱性粒细胞<5% | |
| 无疾病的症状、体征,可触及的脾肿大已消失 | |
| 细胞遗传学反应 | |
| 完全细胞遗传学反应(CCyR) | Ph+细胞0% |
| 部分细胞遗传学反应(PCyR) | Ph+细胞1%~35% |
| 次要细胞遗传学反应(mCyR) | Ph+细胞36%~65% |
| 微小细胞遗传学反应(miniCyR) | Ph+细胞66%~95% |
| 无细胞遗传学反应 | Ph+细胞>95% |
| 分子学反应 | |
| 主要分子学反应(MMR) | BCR-ABLIS≤0.1%(ABL转录本>10 000) |
| 分子学反应4(MR4) | BCR-ABLIS≤0.01%(ABL转录本>10 000) |
| 分子学反应4.5(MR4.5) | BCR-ABLIS≤0.0032%(ABL转录本>32 000) |
| 分子学反应5(MR5) | BCR-ABLIS≤0.001%(ABL转录本>100 000) |
| 分子学无法检测 | 在可扩增ABL转录本水平下无法检测到BCR-ABL转录本 |
表8. 慢性髓性白血病治疗反应的监测[13]–[17],[41]–[44].
| 治疗反应 | 监测频率 | 监测方法 |
| 血液学反应 | 每1~2周进行1次,直至确认达到CHR,随后每3个月进行1次,除非有特殊要求 | 全血细胞计数(CBC)和外周血分类 |
| 细胞遗传学反应 |
|
|
| 分子学反应(外周血) |
|
定量聚合酶链反应检测BCR-ABLIS |
| 激酶突变分析 |
|
聚合酶链反应扩增BCR-ABL转录本后测序 |
注:CHR:完全血液学反应;CCyR:完全细胞遗传学反应;MMR:主要分子学反应;TKI:酪氨酸激酶抑制剂
四、二线二代TKI的选择
目前国内可供选择的二代TKI为尼洛替尼和达沙替尼,二者对不同分期CML患者治疗效果相似,但二者具有显著不同的药代动力学、药物相互作用以及毒性,二者的选择可参照如下原则[13]–[17], [27]–[31],[35], [45]。
1. 应综合考虑患者病史、合并症、合并用药、药物不良反应以及药物说明书并结合BCR-ABL激酶突变类型选择。
2. 参照BCR-ABL激酶突变类型:目前以下7种类型突变对于达沙替尼或尼洛替尼选择具有较为明确的指导意义。①T315I:二者均耐药,有条件者可进入临床试验,或选择恰当的治疗方案。②F317L/V/I/C、V299L、T315A:采用尼洛替尼治疗更易获得临床疗效。③Y253H、E255K/V、F359C/V/I:采用达沙替尼治疗更易获得临床疗效。
五、停止TKI治疗
伊马替尼为代表的TKI治疗显著改善了CML的预后,是药物靶向治疗人类恶性肿瘤的成功典范。随着患者生存期的显著延长,越来越多的研究者开始关注长期TKI治疗不良反应对患者生活质量的影响。TFR逐步成为CML治疗的长期目标。近年来一系列的临床研究证实部分获得持续DMR的患者能够实现相对持久的安全停药(表9)。
表9. 具有长期随访结果的酪氨酸激酶抑制剂(TKI)停药临床试验总结.
| 试验 | 治疗 | 例数 | 停药标准 | 复发标准 | 中位复发时间(月) | 中位随访时间(月) | TFR | 再治疗TKI | 再治疗疗效 |
| STIM[46],[47] | 伊马替尼±干扰素 | 100 | MR5≥2年 | 丧失MR5 | 2.5(0.9~22.3) | 79.9(8.9~93.3) | 6个月43% 5年38% |
伊马替尼为主 | 96.5%(55/57)再次获UMRD,无进展 |
| A-STIM[48] | 伊马替尼±干扰素 | 80 | MR5≥2年 | 丧失MMR | 4(2~17) | 31 | 3年61% | 伊马替尼为主 | 2年CMR率84%,1例再次获MMR后急变 |
| Stop 2G-TKI[49] | 一线/二线尼洛替尼/达沙替尼 | 60 | MR4.5≥2年 | 丧失MMR | 4(1~38) | 47 | 1年61% 4年53.5% |
多数为停药前药物(二代TKI) | 均反应良好 中位获MMR时间2个月;中位获MR4.5时间3个月;中位获UMRD时间4个月 |
| ENESTFreedom[50] | 尼洛替尼一线 | 190 | MR4.5≥1年 | 丧失MMR | - | 75.9周 | 96周50.9% | 尼洛替尼 | MMR率(7周)99.8% MR4.5率(13.1周)92% |
| EuroSKI[51] | 伊马替尼/尼洛替尼/达沙替尼(一线/二线) | 758 | MR4≥1年 | 丧失MMR | - | 27 | 6个月60% 2年49% |
MMR率86% MR4率81% 无进展病例 |
|
| 中国[52] | 伊马替尼/尼洛替尼/达沙替尼(一线/二线) | 91 | 伊马替尼获得MR4≥2年,二代TKI获得MR4≥1年 | 丧失MMR | 5(1~36) | 9(1~72) | 12个月61.4%,25个月52.6% | 伊马替尼为主 | 31例复发再治疗全部获MMR |
1. TFR可能性:最早的停药研究是法国的pilot试验。12例长期接受伊马替尼治疗获得至少2年的完全分子学反应(CMR)的患者尝试停药,中位随访7.5(4.4~8.4)年,50%的患者维持持续的分子学反应。法国STIM试验入组100例伊马替尼治疗获得DMR持续2年以上患者,停止伊马替尼治疗12个月无复发生存率达到41%,累积60个月无复发生存率高达39%[46]–[47]。澳大利亚白血病与淋巴瘤协作组的TWISTER试验24个月TFR率为47.1%[53]。目前全球范围进行前瞻或回顾性停药试验数据显示,伊马替尼或二代TKI治疗获得DMR 2年以上患者停止TKI治疗维持分子学反应比例为40%~60%。
2. TFR停药标准:目前的停药试验数据显示获得持续MR4/MR4.5以上分子学反应,并且持续超过2年是目前停药试验的前提条件,仅仅获得CCyR或MMR的患者停药后均迅速分子学复发。更多研究结果显示TKI服药时间与成功停药呈正相关[46]–[53]。
3. 复发并启动再次治疗标准:停药试验数据显
4. 复发后再治疗效果:无论是研究者还是患者均关注TKI治疗停止后复发的再治疗药物选择和疗效。无论是前瞻性的法国STIM系列试验、TWISTER试验、二代TKI停药试验,还是美国、日本的回顾性数据分析,结果均显示TKI治疗获得持续DMR后停药后复发的患者,对停药前TKI再治疗敏感,能够再次获得良好的分子学反应,包括MMR和DMR。不同停药研究显示86%~100%患者能够再次获得MMR,80%以上患者再次获得DMR[46]–[53]。
5. 停药患者筛选:NCCN 2020、ELN 2020 CML指南对于停止TKI治疗提出明确建议。建议临床试验外,满足下列条件尝试停药:>18岁、慢性期患者并且TKI治疗3年以上;可进行国际标准化定量的BCR-ABL(P210)转录本;稳定DMR超过2年;既往无TKI耐药;有条件接受严格规范的国际标准化的分子学监测,分子学结果解读正确迅速;在有经验的临床医师的指导进行TFR尝试;能够获得及时再治疗以及正确的再治疗后分子学监测[13]。
6. 停药后长期随访:停药后长期随访显示,尽管复发患者绝大多数于停药后6个月内复发,但仍有部分患者晚期复发。EUROSKI[51]研究中位随访27(21~34)个月,结果显示停药后复发尚未达到平台期。2019美国血液学年会更新STIM1[55]和ASTIM[56]的长期随访研究。STIM中100例停药患者,随访10.2年,37例保持TFR,1例停药82个月复发。ASTIM试验中128例停药患者,1年TFR率为57.6%,7年TFR率为44.5%。9例患者停药2年后复发,其中4例为停药5年后复发。因此停药后需要长期规律的监测,及时发现复发并再治疗。停药后疾病进展罕见且无法预期。目前报道4例停药后进展患者,3例停药再治疗获得MMR以上反应后突发急变,1例再治疗1个月后突发急变[55]–[57]。
从目前停药的临床试验和实践数据看,长期TKI治疗获得稳定DMR是停药基础,及时准确的分子学检测是及早发现分子学复发患者的保证,因此停药操作中分子学监测需要及时、准确、稳定,建议有条件的中心开展停药研究。
六、allo-HSCT在CML中的应用
allo-HSCT依然是CML治疗的重要手段,尤其是TKI耐药以及进展期患者。在TKI治疗时代移植不再是CML慢性期患者的一线治疗选择,原则上至少二线TKI治疗(两种以上TKI)不耐受或耐药的患者考虑allo-HSCT。因此allo-HSCT作为二线TKI治疗失败后的三线的治疗选择,目标人群包括:①二线TKI治疗失败的慢性期患者。②治疗任何时间出现ABL基因T315I突变的患者。③对多种TKI治疗不耐受的患者。④加速期或急变期的患者,尤其是TKI治疗期间疾病进展的患者[13]–[17],[32]–[33]。
既往研究显示allo-HSCT后6~12个月转录本持续阳性的患者复发率远高于移植后18个月检测阳性的患者,因此移植后应常规进行残留病的监测。allo-HSCT后疾病评价包括血液学、骨髓细胞染色体核型分析或者FISH、分子学分析。①达到CCyR且分子学检测结果为阴性患者:进行骨髓和(或)外周血PCR监测,每3个月1次,共2年,随后每6个月1次,共3年。②获得CCyR但分子学检测结果为阳性患者:检测ABL激酶是否存在突变,依照检测结果挑选TKI治疗;或调整免疫抑制剂、供者淋巴细胞输注(DLI)、干扰素、高三尖杉酯碱等治疗;有条件进行新药临床试验的单位可行新药试验。③未获得CCyR或复发的患者:停止免疫抑制治疗并监测,按照前述分子学监测阳性患者处理;或考虑二次移植。有报道在CML患者移植后3个月起继续使用TKI治疗1年,作为预防复发的措施,取得较好的疗效。因此,对于有条件的患者,尤其是移植前为进展期的患者可以考虑采用预防性TKI治疗。
七、TKI治疗期间的妊娠管理
动物实验证实,伊马替尼、尼洛替尼以及达沙替尼具有生殖毒性,而无遗传毒性。现有的临床资料显示,TKI治疗可能一过性影响雄性激素,但对男性患者生育能力无显著影响,男性CML患者服用TKI期间配偶受孕所生子女无增加先天畸形的风险,女性配偶的流产率亦无明显增加。女性患者妊娠情况较为复杂,女性妊娠期间服用TKI增加流产率和致畸风险。女性患者服用TKI期间意外妊娠者绝大部分在发现怀孕后停药,多数妊娠结果良好,但大宗病例的报道显示,有近10%的畸胎率[58]–[61]。伊马替尼可以通过血胎盘屏障,并分泌入乳汁。羟基脲等细胞毒药物具有潜在的致畸作用。分子量较大(相对分子质量19 300)、不易透过血胎盘屏障的干扰素α已被较多文献确认为各期妊娠患者的安全选择[17],[62]–[64]。
1. 计划妊娠:女性患者不建议在TKI治疗期间计划妊娠,育龄期女性开始TKI治疗前可考虑进行卵子冻存。由于流产率增高和畸形的可能,女性在备孕及妊娠期间应停止TKI的治疗。因此,CML女性患者未获MMR者应避免计划妊娠。分娩后可恢复TKI治疗,TKI治疗期间避免哺乳。GIMEMA CML WP建议部分女性患者可计划妊娠,患者应获得稳定MMR以上反应至少2年,计划妊娠前应停止TKI治疗[65]。
采用伊马替尼、尼洛替尼或达沙替尼治疗的男性患者通常不需要停用TKI,但对博苏替尼或普那替尼经验有限。男性开始TKI治疗前可考虑进行精子冻存。
(1)妊娠期间确诊CML的患者:处于加速期或急变期的患者,建议立即终止妊娠,并立即开始TKI和(或)化疗。对于处于慢性期的患者,尽可能避免应用TKI、羟基脲和白消安等具有致畸可能的药物,可定期采用血细胞分离术维持血液学相对稳定,尤其在妊娠的前3个月;当白细胞分离术不能满意地控制血小板计数时,可予以阿司匹林或低分子肝素抗凝;若上述方法不耐受或疗效不佳,建议在妊娠的后6个月内加用干扰素α。
(2)TKI治疗中女性患者妊娠的处理:多数专家认为,女性患者在TKI治疗期间应该避孕并避免哺乳。在发现意外妊娠后,需要权衡药物对胎儿的潜在风险(特别是在妊娠的前3个月内)和停药对母亲疾病的不利影响。在充分知情下,患者选择保留胎儿应立即中断TKI治疗,严密监测疾病状况,必要时采取白细胞分离术、干扰素α等治疗,直至分娩。生产后依照疾病状态明确何时开始TKI再治疗。TKI再治疗后避免哺乳。
八、TKI不良反应的处理(参考NCCN2020[13])
(一)伊马替尼不良反应的处理
1. 血液学不良反应:
(1)慢性期:中性粒细胞绝对计数(ANC)<1.0×109/L或PLT<50×109/L,暂停用药,直至ANC≥1.5×109/L、PLT≥75×109/L,恢复伊马替尼400 mg/d;若反复发作ANC<1.0×109/L或PLT<50×109/L,停药恢复后予以伊马替尼300 mg/d治疗。如果患者存在持续中性粒细胞减少,可采用生长因子联合伊马替尼治疗。
3~4级贫血尽管EPO治疗有效,但近来各种指南均不支持在髓系恶性肿瘤中使用红系刺激因子,建议输注红细胞。
(2)加速期和急变期:发生3/4级血细胞减少时应行骨髓检查,鉴别疾病进展和药物相关性骨髓抑制。非疾病进展所致的全血细胞减少处理如下:①全血细胞减少持续2周,将伊马替尼减量至400 mg/d或300 mg/d。②如全血细胞减少持续4周,暂停伊马替尼,直至ANC≥1.0×109/L,且PLT≥20×109/L,然后重新以300 mg/d开始伊马替尼治疗。如果患者存在顽固性中性粒细胞减少和血小板减少,可以采用生长因子联合伊马替尼治疗。
建议:第一个月内尽量不要停用伊马替尼,剂量至少300 mg/d,同时加强输注红细胞、血小板和细胞因子等支持治疗。
2. 非血液学不良反应:
(1)3级非血液学不良反应处理:采取相应具体治疗措施,如果对症处理无效,按4级不良反应处理。
(2)4级非血液学不良反应处理:暂停用药直至症状恢复至1级或更好,然后考虑减量25%~33%(不少于300 mg/d)重新开始治疗;亦可考虑换用二代TKI或者参加新药临床试验。
(3)具体措施:①≥2级肝脏不良反应:暂停用药直至症状恢复至≤1级,减量25%~33%(不少于300 mg)重新开始治疗。评价其他可能具有肝毒性的药物,包括对乙酰氨基酚。可以考虑换用尼洛替尼、达沙替尼或者参加临床试验。②腹泻:对症支持治疗。③水肿:利尿剂,支持治疗。④体液潴留:利尿剂,支持治疗,药物减量、中断用药或停药。考虑超声心动图检测左室射血分数(LVEF)。⑤胃肠道反应:餐中服药并饮一大杯水送下。⑥肌肉痉挛:补钙,运动饮料。⑦皮疹:局部或全身应用类固醇激素,药物减量、暂时中断用药或停药。
(二)尼洛替尼不良反应的处理
尼洛替尼初始以及调整剂量参见表10。
表10. 尼洛替尼初始及调整剂量.
| 剂量选择 | 治疗剂量 |
| 慢性期一线选择 | |
| 首选剂量 | 300 mg,每日2次 |
| 减低剂量 | 400 mg,每日1次 |
| 进展期及慢性期二线选择 | |
| 首选剂量 | 400 mg,每日2次 |
| 减低剂量 | 400 mg,每日1次 |
1. 血液学不良反应:ANC<1.0×109/L或PLT<50×109/L,暂停用药,直至ANC≥1×109/L、PLT≥50×109/L恢复用药。如在2周内ANC恢复,以原剂量重新开始治疗。如停药后血细胞减少持续超过2周,剂量需减少至400 mg/d重新开始治疗。如果患者存在持续中性粒细胞减少,可采用生长因子联合尼洛替尼治疗。
3~4级贫血尽管EPO治疗有效,但近来各种指南均不支持在髓系恶性肿瘤中使用红系刺激因子,建议输注红细胞。
2. 非血液学不良反应:
(1)QT间期延长:QT间期大于480 ms,暂停用药,同时保证血钾、镁在正常范围。如在2周内QT间期恢复至450 ms以内且在基线20 ms以内,以原用药剂量重新开始治疗。如在超出2周内QT间期恢复至450~480 ms,剂量需减少至400 mg/d重新开始治疗。恢复用药7 d后应当复查心电图(ECG)以监测QT间期。
(2)肝脏、胰腺毒性:出现3~4级肝脏、胰腺毒性(肝酶、胆红素、脂肪酶、淀粉酶升高),暂停用药,直至症状恢复至≤1级并减量至400 mg/d重新开始治疗。
(3)罕见的外周动脉闭塞性疾病:一旦出现应永久终止尼洛替尼治疗。
(4)其他:3级非血液学不良反应采取相应具体治疗措施,如果对症处理无效,按4级不良反应处理。4级非血液学不良反应暂停用药,直至症状恢复至1级或更好,然后考虑减量至400 mg/d重新开始治疗。①头痛:对症支持。②恶心:对症支持。③腹泻:对症支持。④皮疹:局部或全身应用类固醇激素,药物减量、暂时中断用药或停药。
3. 尼洛替尼用药注意事项:
(1)尼洛替尼导致患者猝死已有报道,对于低血钾、低血镁以及长QT综合征的患者应避免使用尼洛替尼。
(2)尼洛替尼治疗开始前必须纠正血钾及血镁至正常水平,用药期间必须定期检测血钾、血镁水平。
(3)避免联合使用延长QT间期的药物,避免使用强的CYP3A4抑制剂。
(4)尼洛替尼使用前2 h及用药后1 h暂停进食。
(5)合并肝功能损伤的患者应减低剂量。
(6)重视ECG的监测,治疗开始前应当进行ECG监测了解QT间期的基线水平,治疗开始后7 d以及其后的治疗过程中需要定期行ECG监测,及时调整药物治疗。
(三)达沙替尼不良反应的处理
达沙替尼初始以及调整剂量参见表11。
表11. 达沙替尼初始及调整剂量.
| 剂量选择 | 治疗剂量 |
| 首选剂量 | 慢性期100 mg/d |
| 进展期140 mg/d | |
| 减低剂量 | 慢性期70 mg/d,50 mg/d |
| 进展期100 mg/d,80 mg/d |
1. 血液学不良反应:
(1)慢性期:出现ANC<0.5×109/L或PLT<50×109/L暂停用药,直至ANC≥1.0×109/L、PLT≥50×109/L。①如在1周内恢复,以原用药剂量重新开始治疗。②如持续停药超过1周,剂量需减少至下一等级重新开始治疗。③如果患者存在持续中性粒细胞减少,可采用生长因子联合达沙替尼治疗。
(2)进展期:若ANC<0.5×109/L或PLT<10×109/L,首先明确血细胞减少是否疾病所致,若非疾病相关的血细胞减少,暂停达沙替尼,直至ANC≥1.0×109/L、PLT≥20×109/L,恢复原剂量治疗。若反复发作血细胞减少,达沙替尼逐步减低剂量至100 mg/d、75~80 mg/d。
(3)3~4级贫血:尽管EPO治疗有效,但近来各种指南均不支持在髓系恶性肿瘤中使用红系刺激因子。建议输注红细胞。
2. 非血液学不良反应:3级非血液学不良反应采取相应具体治疗措施,如果对症处理无效,按4级不良反应处理。
4级非血液学不良反应暂停用药直至症状恢复至1级或更好,然后考虑减量重新开始治疗。①水钠潴留:渗透性利尿,支持对症治疗。②浆膜腔积液:暂停达沙替尼,渗透性利尿,若患者症状明显可短疗程应用皮质激素,待症状体征好转后减低剂量重新开始治疗。③罕见的肺动脉高压:一旦出现应当立即永久终止达沙替尼的治疗。④头痛:对症支持。⑤胃肠道不适:对症支持。⑥腹泻:对症支持。⑦皮疹:局部或全身应用类固醇激素,药物减量、中断用药或停药。
References
- 1.National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Chronic Myelogenous Leukemia, V.2.2008[DB/OL] NCCN Web Site. 8-28-2007. [2007-10-25] http://www.nccn.org/professionals/physician_gls/f_guidelines.asp#cml.
- 2.Hehlmann R, Hochhaus A, Baccarani M, et al. Chronic myeloid leukaemia[J] Lancet. 2007;370(9584):342–350. doi: 10.1016/S0140-6736(07)61165-9. [DOI] [PubMed] [Google Scholar]
- 3.全国白血病与再生障碍性贫血流行病学调查协作组. 全国白血病发病情况调查[J] 中国医学科学院学报. 1992;14(1):12–18. [Google Scholar]
- 4.贺 其图, 时 风桐, 袁 祖正. 包头市白血病流行病学调查[J] 内蒙古医学杂志. 1993;13(2):3–5. [Google Scholar]
- 5.张 新友, 张 大龙, 孙 璇, et al. 深圳特区白血病与再生障碍性贫血的流行病学调查[J] 中华血液学杂志. 2001;22(7):347. doi: 10.3760/j:issn:0253-2727.2001.07.011. [DOI] [Google Scholar]
- 6.胡 进林, 冒 镇, 董 德平, et al. 海安县15年白血病流行病学调查[J] 中国交通医学杂志. 2004;18(1):114–115. doi: 10.3969/j.issn.1006-2440.2004.01.077. [DOI] [Google Scholar]
- 7.唐 正贤, 孙 秋云, 张 金桃, et al. 上海市金山县11年白血病流行病学调查[J] 中华血液学杂志. 1994;15(8):430. [Google Scholar]
- 8.Hochhaus A, Larson RA, Guilhot F, et al. Long-Term Outcomes of Imatinib Treatment for Chronic Myeloid Leukemia[J] N Engl J Med. 2017;376(10):917–927. doi: 10.1056/NEJMoa1609324. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Larson RA, Hochhaus A, Hughes TP, et al. Nilotinib vs imatinib in patients with newly diagnosed Philadelphia chromosome-positive chronic myeloid leukemia in chronic phase: ENESTnd 3-year follow-up[J] Leukemia. 2012;26(10):2197–2203. doi: 10.1038/leu.2012.134. [DOI] [PubMed] [Google Scholar]
- 10.Wang J, Shen ZX, Saglio G, et al. Phase 3 study of nilotinib vs imatinib in Chinese patients with newly diagnosed chronic myeloid leukemia in chronic phase: ENESTchina[J] Blood. 2015;125(18):2771–2778. doi: 10.1182/blood-2014-09-601674. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Cortes JE, Saglio G, Kantarjian HM, et al. Final 5-Year Study Results of DASISION: The Dasatinib Versus Imatinib Study in Treatment-Naïve Chronic Myeloid Leukemia Patients Trial[J] J Clin Oncol. 2016;34(20):2333–2340. doi: 10.1200/JCO.2015.64.8899. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Hughes TP, Ross DM. Moving treatment-free remission into mainstream clinical practice in CML[J] Blood. 2016;128(1):17–23. doi: 10.1182/blood-2016-01-694265. [DOI] [PubMed] [Google Scholar]
- 13.NCCN Clinical Practice Guidelines in oncology™, Chronic Myelogenous Leukemia, V.1.2020.
- 14.Baccarani M, Pileri S, Steegmann JL, et al. Chronic myeloid leukemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J] Ann Oncol. 2012;23 Suppl 7:vii72–77. doi: 10.1093/annonc/mds228. [DOI] [PubMed] [Google Scholar]
- 15.Baccarani M, Deininger MW. European Leukemia Net recommendations for the management of chronic myeloid leukemia: 2013[J] Blood. 2013;122(6):872–884. doi: 10.1182/blood-2013-05-501569. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia[J] Leukemia. 2020 doi: 10.1038/s41375-020-0776-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.中华医学会血液学分会. 中国慢性髓性白血病诊断与治疗指南(2016年版)[J] 中华血液学杂志. 2016;37(8):633–639. doi: 10.3760/cma.j.issn.0253-2727.2016.08.001. [DOI] [Google Scholar]
- 18.Sokal JE, Cox EB, Baccarani M, et al. Prognostic discrimination in “good-risk” chronic granulocytic leukemia[J] Blood. 1984;63(4):789–799. [PubMed] [Google Scholar]
- 19.Hasford J, Pfirrmann M, Hehlmann R, et al. A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa. Writing Committee for the Collaborative CML Prognostic Factors Project Group[J] J Natl Cancer Inst. 1998;90(11):850–858. doi: 10.1093/jnci/90.11.850. [DOI] [PubMed] [Google Scholar]
- 20.Hasford J, Baccarani M, Hoffmann V, et al. Predicting complete cytogenetic response and subsequent progression-free survival in 2060 patients with CML on imatinib treatment: the EUTOS score[J] Blood. 2011;118(3):686–692. doi: 10.1182/blood-2010-12-319038. [DOI] [PubMed] [Google Scholar]
- 21.Valent P, Hadzijusufovic E, Schernthaner GH, et al. Vascular safety issues in CML patients treated with BCR/ABL1 kinase inhibitors[J] Blood. 2015;125(6):901–906. doi: 10.1182/blood-2014-09-594432. [DOI] [PubMed] [Google Scholar]
- 22.Baccarani M, Druker BJ, Branford S, et al. Long-term response to imatinib is not affected by the initial dose in patients with Philadelphia chromosome-positive chronic myeloid leukemia in chronic phase: final update from the Tyrosine Kinase Inhibitor Optimization and Selectivity (TOPS) study[J] Int J Hematol. 2014;99(5):616–624. doi: 10.1007/s12185-014-1566-2. [DOI] [PubMed] [Google Scholar]
- 23.Deininger MW, Kopecky KJ, Radich JP, et al. Imatinib 800 mg daily induces deeper molecular responses than imatinib 400 mg daily: results of SWOG S0325, an intergroup randomized PHASE II trial in newly diagnosed chronic phase chronic myeloid leukaemia[J] Br J Haematol. 2014;164(2):223–232. doi: 10.1111/bjh.12618. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Hehlmann R, Lauseker M, Saußele S, et al. Assessment of imatinib as first-line treatment of chronic myeloid leukemia: 10-year survival results of the randomized CML study IV and impact of non-CML determinants[J] Leukemia. 2017;31(11):2398–2406. doi: 10.1038/leu.2017.253. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Marin D, Ibrahim AR, Lucas C, et al. Assessment of BCR-ABL1 transcript levels at 3 months is the only requirement for predicting outcome for patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors[J] J Clin Oncol. 2012;30(3):232–238. doi: 10.1200/JCO.2011.38.6565. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Hanfstein B, Müller MC, Hehlmann R, et al. Early molecular and cytogenetic response is predictive for long-term progression-free and overall survival in chronic myeloid leukemia (CML)[J] Leukemia. 2012;26(9):2096–2102. doi: 10.1038/leu.2012.85. [DOI] [PubMed] [Google Scholar]
- 27.Cortes JE, Gambacorti-Passerini C, Deininger MW, et al. Bosutinib Versus Imatinib for Newly Diagnosed Chronic Myeloid Leukemia: Results From the Randomized BFORE Trial[J] J Clin Oncol. 2018;36(3):231–237. doi: 10.1200/JCO.2017.74.7162. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Shah NP, Rousselot P, Schiffer C, et al. Dasatinib in imatinib-resistant or -intolerant chronic-phase, chronic myeloid leukemia patients: 7-year follow-up of study CA180-034[J] Am J Hematol. 2016;91(9):869–874. doi: 10.1002/ajh.24423. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Giles FJ, le CPD, Pinilla-Ibarz J, et al. Nilotinib in imatinib-resistant or imatinib-intolerant patients with chronic myeloid leukemia in chronic phase: 48-month follow-up results of a phase II study[J] Leukemia. 2013;27(1):107–112. doi: 10.1038/leu.2012.181. [DOI] [PubMed] [Google Scholar]
- 30.Garg RJ, Kantarjian H, O'Brien S, et al. The use of nilotinib or dasatinib after failure to 2 prior tyrosine kinase inhibitors: long-term follow-up[J] Blood. 2009;114(20):4361–4368. doi: 10.1182/blood-2009-05-221531. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Cortes JE, Kim DW, Pinilla-Ibarz J, et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial[J] Blood. 2018;132(4):393–404. doi: 10.1182/blood-2016-09-739086. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Jabbour E, Cortes J, Santos FP, et al. Results of allogeneic hematopoietic stem cell transplantation for chronic myelogenous leukemia patients who failed tyrosine kinase inhibitors after developing BCR-ABL1 kinase domain mutations[J] Blood. 2011;117(13):3641–3647. doi: 10.1182/blood-2010-08-302679. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Saussele S, Lauseker M, Gratwohl A, et al. Allogeneic hematopoietic stem cell transplantation (allo SCT) for chronic myeloid leukemia in the imatinib era: evaluation of its impact within a subgroup of the randomized German CML Study IV[J] Blood. 2010;115(10):1880–1885. doi: 10.1182/blood-2009-08-237115. [DOI] [PubMed] [Google Scholar]
- 34.Marin D, Bazeos A, Mahon FX, et al. Adherence is the critical factor for achieving molecular responses in patients with chronic myeloid leukemia who achieve complete cytogenetic responses on imatinib[J] J Clin Oncol. 2010;28(14):2381–2388. doi: 10.1200/JCO.2009.26.3087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Cortes JE, Khoury HJ, Kantarjian HM, et al. Long-term bosutinib for chronic phase chronic myeloid leukemia after failure of imatinib plus dasatinib and/or nilotinib[J] Am J Hematol. 2016;91(12):1206–1214. doi: 10.1002/ajh.24536. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.O'Brien SG, Guilhot F, Larson RA, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia[J] N Engl J Med. 2003;348(11):994–1004. doi: 10.1056/NEJMoa022457. [DOI] [PubMed] [Google Scholar]
- 37.Preudhomme C, Guilhot J, Nicolini FE, et al. Imatinib plus peginterferon alfa-2a in chronic myeloid leukemia[J] N Engl J Med. 2010;363(26):2511–2521. doi: 10.1056/NEJMoa1004095. [DOI] [PubMed] [Google Scholar]
- 38.Ohanian M, Kantarjian HM, Quintas-Cardama A, et al. Tyrosine kinase inhibitors as initial therapy for patients with chronic myeloid leukemia in accelerated phase[J] Clin Lymphoma Myeloma Leuk. 2014;14(2):155–162.e1. doi: 10.1016/j.clml.2013.08.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.de Labarthe A, Rousselot P, Huguet-Rigal F, et al. Imatinib combined with induction or consolidation chemotherapy in patients with de novo Philadelphia chromosome-positive acute lymphoblastic leukemia: results of the GRAAPH-2003 study[J] Blood. 2007;109(4):1408–1413. doi: 10.1182/blood-2006-03-011908. [DOI] [PubMed] [Google Scholar]
- 40.Cortes J, Kim DW, Raffoux E, et al. Efficacy and safety of dasatinib in imatinib-resistant or -intolerant patients with chronic myeloid leukemia in blast phase[J] Leukemia. 2008;22(12):2176–2183. doi: 10.1038/leu.2008.221. [DOI] [PubMed] [Google Scholar]
- 41.中华医学会血液学分会实验诊断学组, 中国慢性髓性白血病联盟专家组. 中国慢性髓性白血病诊疗监测规范(2014年版)[J] 中华血液学杂志. 2014;35(8):781–784. doi: 10.3760/cma.j.issn.0253-2727.2014.08.030. [DOI] [Google Scholar]
- 42.Kantarjian H, Schiffer C, Jones D, et al. Monitoring the response and course of chronic myeloid leukemia in the modern era of BCR-ABL tyrosine kinase inhibitors: practical advice on the use and interpretation of monitoring methods[J] Blood. 2008;111(4):1774–1780. doi: 10.1182/blood-2007-09-110189. [DOI] [PubMed] [Google Scholar]
- 43.Landstrom AP, Tefferi A. Fluorescent in situ hybridization in the diagnosis, prognosis, and treatment monitoring of chronic myeloid leukemia[J] Leuk Lymphoma. 2006;47(3):397–402. doi: 10.1080/10428190500353133. [DOI] [PubMed] [Google Scholar]
- 44.Hughes T, Deininger M, Hochhaus A, et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for expressing results[J] Blood. 2006;108(1):28–37. doi: 10.1182/blood-2006-01-0092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Haouala A, Widmer N, Duchosal MA, et al. Drug interactions with the tyrosine kinase inhibitors imatinib, dasatinib, and nilotinib[J] Blood. 2011;117(8):e75–87. doi: 10.1182/blood-2010-07-294330. [DOI] [PubMed] [Google Scholar]
- 46.Mahon FX, Réa D, Guilhot J, et al. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial[J] Lancet Oncol. 2010;11(11):1029–1035. doi: 10.1016/S1470-2045(10)70233-3. [DOI] [PubMed] [Google Scholar]
- 47.Etienne G, Guilhot J, Rea D, et al. Long-Term Follow-Up of the French Stop Imatinib (STIM1) Study in Patients With Chronic Myeloid Leukemia[J] J Clin Oncol. 2017;35(3):298–305. doi: 10.1200/JCO.2016.68.2914. [DOI] [PubMed] [Google Scholar]
- 48.Rousselot P, Charbonnier A, Cony-Makhoul P, et al. Loss of major molecular response as a trigger for restarting tyrosine kinase inhibitor therapy in patients with chronic-phase chronic myelogenous leukemia who have stopped imatinib after durable undetectable disease[J] J Clin Oncol. 2014;32(5):424–430. doi: 10.1200/JCO.2012.48.5797. [DOI] [PubMed] [Google Scholar]
- 49.Rea D, Nicolini FE, Tulliez M, et al. Discontinuation of dasatinib or nilotinib in chronic myeloid leukemia: interim analysis of the STOP 2G-TKI study[J] Blood. 2017;129(7):846–854. doi: 10.1182/blood-2016-09-742205. [DOI] [PubMed] [Google Scholar]
- 50.Ross DM, Masszi T, Gómez CMT, et al. Durable treatment-free remission in patients with chronic myeloid leukemia in chronic phase following frontline nilotinib: 96-week update of the ENESTfreedom study[J] J Cancer Res Clin Oncol. 2018;144(5):945–954. doi: 10.1007/s00432-018-2604-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Saussele S, Richter J, Guilhot J, et al. Discontinuation of tyrosine kinase inhibitor therapy in chronic myeloid leukaemia (EURO-SKI): a prespecified interim analysis of a prospective, multicentre, non-randomised, trial[J] Lancet Oncol. 2018;19(6):747–757. doi: 10.1016/S1470-2045(18)30192-X. [DOI] [PubMed] [Google Scholar]
- 52.朱 晓健, 游 泳, 段 明辉, et al. 慢性髓性白血病患者酪氨酸激酶抑制剂自动停药的多中心回顾性研究[J] 中华血液学杂志. 2018;39(12):994–997. doi: 10.3760/cma.j.issn.0253-2727.2018.12.005. [DOI] [Google Scholar]
- 53.Ross DM, Branford S, Seymour JF, et al. Safety and efficacy of imatinib cessation for CML patients with stable undetectable minimal residual disease: results from the TWISTER study[J] Blood. 2013;122(4):515–522. doi: 10.1182/blood-2013-02-483750. [DOI] [PubMed] [Google Scholar]
- 54.Rousselot P, Charbonnier A, Cony-Makhoul P, et al. Loss of major molecular response as a trigger for restarting tyrosine kinase inhibitor therapy in patients with chronic-phase chronic myelogenous leukemia who have stopped imatinib after durable undetectable disease[J] J Clin Oncol. 2014;32(5):424–430. doi: 10.1200/JCO.2012.48.5797. [DOI] [PubMed] [Google Scholar]
- 55.Rea D, Nicolini FE, Tulliez M, et al. Prognostication of Molecular Relapses after Dasatinib or Nilotinib Discontinuation in Chronic Myeloid Leukemia (CML): A FI-LMC STOP 2G-TKI Study Update[J] Blood. 2019;134(Suppl_1):30. [Google Scholar]
- 56.Lee SE, Park JS, Kim HJ, et al. Long-Term Outcomes of Chronic Myeloid Leukemia Patients Who Lost Undetectable Molecular Residual Disease (UMRD) after Imatinib Discontinuation: Korean Imatinib Discontinuation Study (KIDS)[J] Blood. 134(Suppl_1):1643. [Google Scholar]
- 57.Papalexandri A, Saloum R, Touloumenidou T, et al. Blast Crisis of CML After TKI Discontinuation in a Patient With Previous Stable Deep Molecular Response: Is It Safe to Stop?[J] Hemasphere. 2018;2(6):e157. doi: 10.1097/HS9.0000000000000157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Ghalaut VS, Prakash G, Bansal P, et al. Effect of imatinib on male reproductive hormones in BCR-ABL positive CML patients: A preliminary report[J] J Oncol Pharm Pract. 2014;20(4):243–248. doi: 10.1177/1078155213500686. [DOI] [PubMed] [Google Scholar]
- 59.Alizadeh H, Jaafar H, Rajnics P, et al. Outcome of pregnancy in chronic myeloid leukaemia patients treated with tyrosine kinase inhibitors: short report from a single centre[J] Leuk Res. 2015;39(1):47–51. doi: 10.1016/j.leukres.2014.10.002. [DOI] [PubMed] [Google Scholar]
- 60.Cortes JE, Abruzzese E, Chelysheva E, et al. The impact of dasatinib on pregnancy outcomes[J] Am J Hematol. 2015;90(12):1111–1115. doi: 10.1002/ajh.24186. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Barkoulas T, Hall PD. Experience with dasatinib and nilotinib use in pregnancy[J] J Oncol Pharm Pract. 2018;24(2):121–128. doi: 10.1177/1078155217692399. [DOI] [PubMed] [Google Scholar]
- 62.Russell MA, Carpenter MW, Akhtar MS, et al. Imatinib mesylate and metabolite concentrations in maternal blood, umbilical cord blood, placenta and breast milk[J] J Perinatol. 2007;27(4):241–243. doi: 10.1038/sj.jp.7211665. [DOI] [PubMed] [Google Scholar]
- 63.Kuroiwa M, Gondo H, Ashida K, et al. Interferon-alpha therapy for chronic myelogenous leukemia during pregnancy[J] Am J Hematol. 1998;59(1):101–102. doi: 10.1002/(sici)1096-8652(199809)59:1<101::aid-ajh23>3.0.co;2-d. [DOI] [PubMed] [Google Scholar]
- 64.Thauvin-Robinet C, Maingueneau C, Robert E, et al. Exposure to hydroxyurea during pregnancy: a case series[J] Leukemia. 2001;15(8):1309–1311. doi: 10.1038/sj.leu.2402168. [DOI] [PubMed] [Google Scholar]
- 65.Kuwabara A, Babb A, Ibrahim A, et al. Poor outcome after reintroduction of imatinib in patients with chronic myeloid leukemia who interrupt therapy on account of pregnancy without having achieved an optimal response[J] Blood. 2010;116(6):1014–1016. doi: 10.1182/blood-2010-04-280206. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Ali R, Ozkalemkaş F, Ozkocaman V, et al. Successful pregnancy and delivery in a patient with chronic myelogenous leukemia (CML), and management of CML with leukapheresis during pregnancy: a case report and review of the literature[J] Jpn J Clin Oncol. 2004;34(4):215–217. doi: 10.1093/jjco/hyh038. [DOI] [PubMed] [Google Scholar]
- 67.Palani R, Milojkovic D, Apperley JF. Managing pregnancy in chronic myeloid leukaemia[J] Ann Hematol. 2015;94 Suppl 2:S167–176. doi: 10.1007/s00277-015-2317-z. [DOI] [PubMed] [Google Scholar]