Abstract
目的
比较自体造血干细胞移植(auto-HSCT)和同胞全相合造血干细胞移植(MSD-HSCT)治疗费城染色体阳性急性淋巴细胞白血病(Ph+ ALL)的疗效,为患者移植方式的选择提供依据。
方法
回顾性总结2008年1月至2017年12月于中国医学科学院血液病医院行auto-HSCT(31例)及MSD-HSCT(47例)的78例Ph+ ALL患者的临床特征,比较不同移植方式患者的总生存(OS)率、无白血病生存(LFS)率、累积复发率(CIR)及非复发死亡率(NRM),并观察是否3个月内实现完全分子学缓解并持续至移植(s3CMR)条件下不同移植方式对预后的影响。
结果
auto-HSCT组、MSD-HSCT组粒细胞植入的中位时间分别为12(10~29)d、14(11~24)d(P=0.006),血小板植入的中位时间分别为17.5(10~62)d、17(10~33)d(P=0.794)。MSD-HSCT组中,Ⅱ~Ⅳ度和Ⅲ~Ⅳ度急性移植物抗宿主病(GVHD)的发生率分别为27.7%(13/47)和8.5%(4/47),局限型和广泛型慢性GVHD的发生率为17.0%(8/47)和12.8%(6/47)。auto-HSCT组、MSD-HSCT组3年CIR、NRM、LFS率差异均无统计学意义(P值均>0.05)。在达到s3CMR的44例患者中,auto-HSCT组和MSD-HSCT组的3年OS率[(84.0±8.6)%对(78.0±8.7)%,P=0.612]、LFS率[(70.3±10.3)%对(68.2±10.1)%,P=0.970]、CIR[(24.9±10.0)%对(14.4±8.0)%,P=0.286]和NRM[(4.7±4.7)%对(17.4±8.1)%,P=0.209]差异均无统计学意义;未达到s3CMR的34例患者中,auto-HSCT组与MSD-HSCT组相比,3年CIR明显升高[(80.0±14.7)%对(39.6±10.9)%,P=0.057]。
结论
对于化疗后达s3CMR的Ph+ ALL患者,auto-HSCT是一种有效的巩固治疗选择,与MSD-HSCT疗效相当;对于未达到s3CMR的患者,MSD-HSCT复发率更低。
Keywords: 费城染色体阳性急性淋巴细胞白血病, 异基因造血干细胞移植, 自体造血干细胞移植, 完全分子学缓解
Abstract
Objective
To compare the efficacy of autologous HSCT(auto-HSCT)with matched sibling donor(MSD)HSCT in Ph+ ALL and provide a basis for the choice of transplantation method.
Methods
We retrospectively investigated the outcomes of 78 adult patients with Ph+ ALL who underwent auto-HSCT(n=31)and MSD-HSCT(n=47)in Institute of Hematology and Blood Diseases Hospital, CAMS & PUMC, from January 2008 to December 2017. The overall survival(OS)rate, leukemia-free survival(LFS)rate, cumulative incidence of relapse(CIR)rate, nonrelapse mortality(NRM)rate, and the impact of achievement of complete molecular response(CMR)within 3 months and sustaining CMR up to transplantation(s3CMR)on transplantation method were explored.
Results
The median time of neutrophil and platelet reconstitution in auto-HSCT and MSD-HSCT groups were 12(10–29)days vs 14(11–24)days(P=0.006)and 17.5(10–62)days vs 7(10–33)days(P=0.794), respectively. In the MSD-HSCT group, the incidence of Ⅱ–Ⅳ and Ⅲ–Ⅳ acute graft-versus-host disease(GVHD)was 27.7%(13/47)and 8.5%(4/47), respectively. The incidence of limited and extensive chronic GVHD was 17.0%(8/47)and 12.8%(6/47), respectively. The estimated CIR, NRM, LFS, and OS at 3 years were not significantly different between auto-HSCT and MSD-HSCT groups(P>0.05). For 44 patients who achieved s3CMR, 3-year OS[(84.0±8.6)% vs(78.0±8.7)%, P=0.612], LFS[(70.3±10.3)% vs(68.2±10.1)%, P=0.970], CIR[(24.9±10.0)% vs(14.4±8.0)%, P=0.286], and NRM[(4.7±4.7)% vs(17.4±8.1)%, P=0.209]of the auto-HSCT and MSD-HSCT groups were not significantly different. However, for 34 patients who did not reach s3CMR, 3-year cumulative relapse rate of patients in the auto-HSCT group was significantly higher than MSD-HSCT group[(80.0±14.7)% vs(39.6±10.9)%, P=0.057].
Conclusion
auto-HSCT with maintenance therapy after HSCT appears to be an attractive treatment option for patients with Ph+ ALL especially for those with s3CMR maintained up to transplantation. For non-s3CMR patients, allogeneic transplantation may be more effective from lower relapse.
Keywords: Philadelphia chromosome-positive acute lymphoblastic leukemia, Allogeneic stem cell transplantation, Autologous stem cell transplatation, Complete molecular response
成人费城染色体阳性急性淋巴细胞白血病(Ph+ ALL)是一组高危白血病亚型[1]–[2]。近年来,得益于酪氨酸激酶抑制剂(TKI)联合化疗的应用,Ph+ ALL患者的完全缓解(CR)率大幅提高[3],目前,异基因造血干细胞移植(allo-HSCT)仍然是此类患者的标准巩固治疗方案[4]–[6]。欧洲血液和骨髓移植学会(EBMT)急性白血病工作组的一项分析表明,对于能够获得首次完全分子学缓解(CMR)的患者,清髓性自体造血干细胞移植(auto-HSCT)和allo-HSCT的疗效相当[7]。此外,法国的一项研究已经建议将auto-HSCT作为低水平微小残留病(MRD)患者的治疗方案[8]。因此,对那些没有合适供者的Ph+ ALL患者来说,auto-HSCT联合TKI不失为一种行之有效的巩固治疗方案。本研究中,我们回顾性分析了我院接受auto-HSCT及同胞全相合造血干细胞移植(MSD-HSCT)Ph+ ALL患者的临床资料,比较两种移植方式的疗效,为此类患者移植方式的选择提供参考。
病例与方法
1. 病例:回顾性分析2008年1月至2017年12月我院行auto-HSCT或MSD-HSCT的78例Ph+ ALL患者临床资料。入选标准:①15~65岁;②根据WHO标准诊断为Ph+ ALL;③造血干细胞移植前均接受TKI治疗;④移植时达到CR状态;⑤行清髓性预处理。
2. 移植前化疗联合TKI治疗:所有78例Ph+ ALL患者均接受VDCP标准诱导方案化疗:长春新碱1.4 mg·m−2·d−1(最大剂量2 mg/d),第1、8、15、22天;柔红霉素45 mg·m−2·d−1,第1~3天和第15~17天;环磷酰胺750 mg·m−2·d−1,第1、8天;泼尼松1 mg·kg−1·d−1,第1~28天[9]。患者一旦检测出费城染色体或BCR/ABL融合基因,立即加用伊马替尼400~600 mg/d或达沙替尼100~120 mg/d或尼洛替尼600~800 mg/d。患者获得血液学缓解后进入巩固治疗阶段,主要包括以下几种方案:①VDCP(同诱导化疗);②大剂量甲氨蝶呤(2 g·m−2·d−1,第1天);③CAM(环磷酰胺750 mg·m−2·d−1,第1、15天;阿糖胞苷200 mg·m−2·d−1,第1~3天、第8~10天;6-巯基嘌呤60 mg·m−2·d−1,第1~7天);④DOAME(地塞米松0.15 mg·kg−1·d−1,第1~5天;长春新碱1.4 mg·m−2·d−1,最大剂量2 mg/d,第1天;阿糖胞苷2 g·m−2·d−1,第1~3天;米托蒽醌8 mg·m−2·d−1,第2、3天;依托泊苷0.1 g/d,第3~5天)。所有患者达到CR后均行鞘内化疗6~8次以预防中枢神经系统白血病。TKI持续应用到移植预处理前2周。
3. 造血干细胞的动员和采集:HLA相合同胞供者G-CSF 5~10 µg·kg−1·d−1动员5~6 d后应用血细胞单采机采集外周血干细胞(PBSC)。27例auto-HSCT组患者在接受DOAME方案化疗后应用G-CSF动员并采集自体外周血干细胞,4例患者在自体外周血干细胞动员采集不足(2个采集日内CD34+细胞低于1×106/kg)后,采集患者骨髓造血干细胞。
4. 移植方式:75例患者采用了包含全身照射(TBI)的清髓性预处理:TBI(7 Gy,−7 d或3.3 Gy,−9 d~−7 d)、环磷酰胺(40 mg·kg−1·d−1,−6、−5 d)、氟达拉滨(30 mg·m−2·d−1,−4 d~−2 d)和阿糖胞苷(2 g·m−2·d−1,−4 d~−2 d)。其余3例接受以白消安为基础的清髓性预处理,其中TBI替换为白消安3.2 mg·kg−1·d−1,−9 d~−7 d,余不变。auto-HSCT组输注单个核细胞、CD34+细胞中位数分别为5.38(1.32~22.00)×108/kg、2.45(1.44~6.09)×106/kg,MSD-HSCT组输注单个核细胞、CD34+细胞中位数分别为8.00(2.00~16.00)×108/kg、2.67(1.30~6.06)×106/kg。
5. 移植物抗宿主病(GVHD)预防(MSD-HSCT患者):环孢素A(1 mg·kg−1·d−1)联合短疗程甲氨蝶呤(MTX,15 mg/m2,+1 d;10 mg·m−2·d−1,+3、+6 d);GVHD分级采用美国西雅图标准[10]–[11],糖皮质激素为GVHD一线治疗方案。
6. 造血干细胞移植后的维持治疗:auto-HSCT患者在造血重建后(WBC≥3×109/L、PLT≥50×109/L)接受以TKI为基础的维持治疗,具体方案为:①TKI联合VP或VDP或VIP(长春新碱1.4 mg/m2第1、8天+泼尼松1 mg·kg−1·d−1第1~14天±柔红霉素20~30 mg·m−2·d−1或去甲氧柔红霉素6 mg·m−2·d−1第1、8天);②TKI联合MM方案(MTX 15~20 mg·m−2·d−1,第1、8天;6-巯基嘌呤50~75 mg·m−2·d−1,第1~14天)。2个方案交替进行,持续1~1.5年。MSD-HSCT患者移植后未进行常规维持治疗,移植后定期监测白血病MRD及供者嵌合度,一旦出现MRD转阳,立即给予TKI治疗;连续2次MRD阳性或出现白血病血液学复发,即按照移植后复发处理:减停免疫抑制剂、加用TKI、供者淋巴细胞输注(联合或不联合化疗)等。
7. 定义:CMR定义为骨髓样本中BCR-ABL定量低于RT-PCR的检测极限(<0.01%,我院能检测到白血病细胞的残留数量为0.003 2%)。s3CMR定义为在治疗后3个月内达到CMR且持续至移植。粒细胞植入:中性粒细胞绝对计数>0.5×109/L连续3 d。血小板植入:血小板计数>20×109/L连续7 d且脱离血小板输注。总生存(OS)时间:从移植日开始至死亡或末次随访时间。无白血病生存(LFS)时间:从移植日开始至白血病复发或末次随访时间。非复发死亡时间:从移植日到非复发死亡时间或末次随访时间。复发:骨髓涂片、形态学检查、白血病细胞>5%或髓外浸润或分子学检测阳性。
8. 随访:随访截止到2018年7月30日,随访资料来源于住院病历、门诊病历及电话随访记录。评价患者移植相关并发症的发生情况,OS、LFS及复发等指标。存活患者的中位随访时间为47(9~105)个月。8例(10.3%)患者失访,生存时间按照末次随访日期计算。
9. 统计学处理:采用SPSS 22.0及R 3.5.1软件进行数据分析。连续变量采用Mann-Whitney U检验进行比较;分类变量采用卡方检验或Fisher精确概率法进行比较。通过Kaplan-Meier法进行生存分析,并采用Log-rank检验比较组间差异。复发、非复发死亡采用竞争风险模型分析,Gray检验比较组间差异。
结果
1. 患者基本临床特征:本研究共纳入78例Ph+ ALL患者,包括31例auto-HSCT患者和47例MSD-HSCT患者(见表1)。与MSD-HSCT组相比,auto-HSCT组移植前达CMR的比例更高(93.5%对70.2%,P=0.027)。auto-HSCT组确诊至移植的中位时间为9(5~20)个月,MSD-HSCT组为7(3~35)个月(P<0.001)。auto-HSCT组的中位巩固化疗疗程数为5(3~10)个而MSD-HSCT组为4(3~18)个(P<0.001)。两组在性别、年龄、移植前状态、WBC、PLT、染色体核型、BCR-ABL类型和s3CMR方面差异均无统计学意义。本研究中74例患者仅服用一种TKI,其余4例相继服用了两种TKI。在仅应用一种TKI的患者中,服用伊马替尼后达CMR的患者比例为76.4%(42/55),服用达沙替尼/尼洛替尼后达CMR的患者比例为89.5%(17/19)(P=0.371);伊马替尼组达s3CMR的比例为50.9%(28/55),达沙替尼/尼洛替尼组达s3CMR的比例为73.7%(14/19)(P=0.084)。
表1. auto-HSCT与MSD-HSCT组费城染色体阳性急性淋巴细胞白血病患者临床特征比较.
| 临床特征 | auto-HSCT组(31例) | MSD-HSCT组(47例) | P值 |
| 性别[例(%)] | 0.091 | ||
| 男 | 23(74.2) | 26(55.3) | |
| 女 | 8(25.8) | 21(44.7) | |
| 年龄[例(%)] | 0.284 | ||
| <40岁 | 19(61.3) | 23(48.9) | |
| ≥40岁 | 12(38.7) | 24(51.1) | |
| 初诊时WBC[×109/L,M(范围)] | 15.70(1.30~370.19) | 36.47(0.59~530.83) | 0.097 |
| 初诊时PLT[×109/L,M(范围)] | 31(10~206) | 36(2~159) | 0.837 |
| 初诊时染色体核型[例(%)]a | 0.887 | ||
| t(9;22) | 22(71.0) | 29(72.5) | |
| 附加染色体核型 | 9(29.0) | 11(27.5) | |
| 初诊时BCR-ABL类型[例(%)] | 0.598 | ||
| P190 | 25(80.7) | 31(65.9) | |
| P210 | 5(16.1) | 13(27.7) | |
| P190+P210 | 1(3.2) | 2(4.3) | |
| 不典型 | 0(0.0) | 1(2.1) | |
| 移植前是否达CMR[例(%)] | 0.027 | ||
| 是 | 29(93.5) | 33(70.2) | |
| 否 | 2(6.5) | 14(29.8) | |
| 是否达s3CMR[例(%)] | 0.101 | ||
| 是 | 21(67.7) | 23(48.9) | |
| 否 | 10(32.3) | 24(51.1) | |
| 干细胞来源[例(%)] | 0.022 | ||
| 外周血 | 27(87.1) | 47(100.0) | |
| 骨髓 | 1(3.2) | 0(0.0) | |
| 外周血+骨髓 | 3(9.7) | 0(0.0) | |
| 移植前状态[例(%)] | 1.000 | ||
| CR1 | 29(93.5) | 44(93.6) | |
| CR2 | 2(6.5) | 3(6.4) | |
| 确诊至移植时间[月,M(范围)] | 9(5~20) | 7(3~35) | <0.001 |
| 移植前化疗疗程[个,M(范围)] | 5(3~10) | 4(3~18) | <0.001 |
注:auto-HSCT:自体造血干细胞移植;MSD-HSCT:同胞全相合造血干细胞移植;CMR:完全分子学缓解;s3CMR:治疗3个月内实现CMR并持续至移植;CR1:第一次完全缓解;CR2:第二次完全缓解;a7例MSD-HSCT无染色体核型资料
2. 造血重建和GVHD:所有患者均获得造血重建。auto-HSCT组、MSD-HSCT组粒细胞植入的中位时间分别为12(10~29)d、14(11~24)d(P=0.006),血小板植入的中位时间分别为17.5(10~62)d、17(10~33)d(P=0.794)。在MSD-HSCT组中,Ⅱ~Ⅳ度和Ⅲ~Ⅳ度急性GVHD的发生率分别为27.7%(13/47)和8.5%(4/47),局限型和广泛型慢性GVHD的发生率为17.0%(8/47)和12.8%(6/47)。auto-HSCT组造血重建后开始维持治疗,总疗程为1~1.5年,共进行12~15个疗程的维持化疗。
3. 随访情况:所有患者的中位随访时间为移植后29(3~105)个月。auto-HSCT组和MSD-HSCT组移植后3年OS率分别为(71.8±8.5)%、(74.1±6.5)%(P=0.919),3年LFS率分别为(51.1±9.7)%、(55.8±7.5)%(P=0.803)。截止随访终点,auto-HSCT组中有41.9%(13/31)的患者在移植后复发,中位复发时间为5(2~31)个月;MSD-HSCT组中25.5%(12/47)患者复发,中位复发时间为6(2~29)个月;两组患者移植后3年累积复发率(CIR)分别为(45.7±9.9)%和(27.2±6.9)%(P=0.127)。全部78例患者中22例(28.2%)死亡,其中auto-HSCT组的死亡率为29%(9/31):8例患者因复发死亡,1例死于感染;MSD-HSCT组死亡率为27.7%(13/47):5例因复发死亡,死于感染5例、死于GVHD 3例。MSD-HSCT组与auto-HSCT组患者3年累积非复发死亡率(NRM)分别为(17.0±5.5)%、(3.2±3.2)%(P=0.072)。
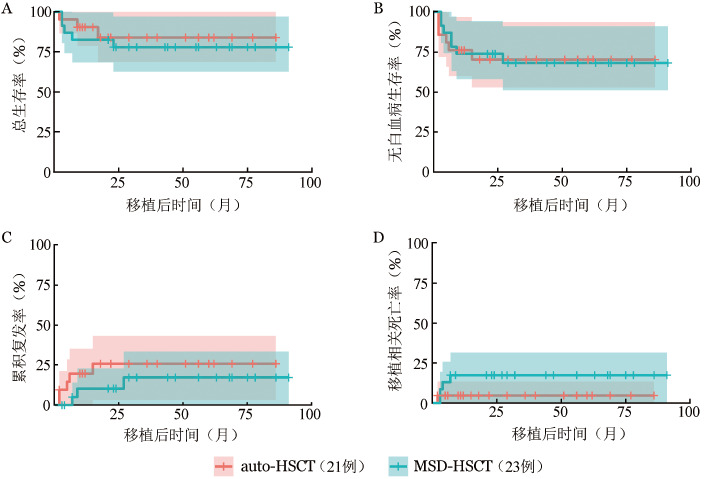
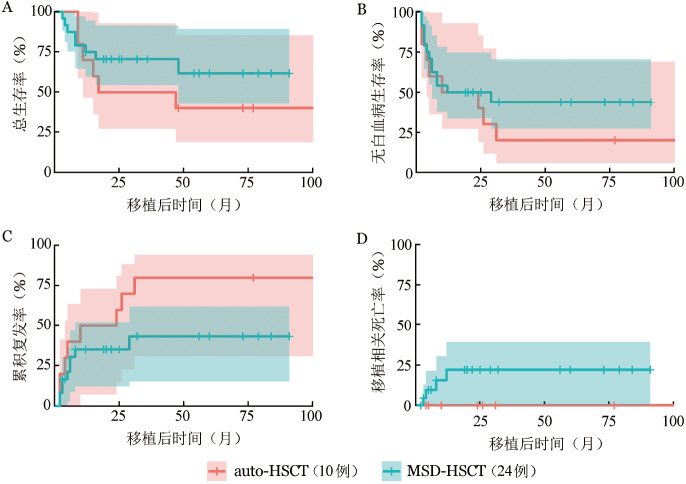
4. 是否达s3CMR对不同移植方式预后的影响:移植前44例患者达到s3CMR,34例未达s3CMR。在达到s3CMR的患者中,auto-HSCT组、MSD-HSCT组的3年OS率[(84.0±8.6)%对(78.0±8.7)%,P=0.612]、LFS率[(70.3±10.3)%对(68.2±10.1)%,P=0.970]、CIR[(24.9±10.0)%对(14.4±8.0)%,P=0.286]和NRM[(4.7±4.7)%对(17.4±8.1)%,P=0.209]差异均无统计学意义(图1);而未达到s3CMR的患者中,auto-HSCT组与MSD-HSCT组相比,3年CIR明显升高[(80.0±14.7)%对(39.6±10.9)%,P=0.057],LFS率[(20.0±12.6)%对(43.7±10.7)%,P=0.344]和OS率[(40.0±15.5)%对(61.8±11.6)%,P=0.338]差异无统计学意义(图2)。
图1. 治疗3个月内实现完全分子学缓解并持续至移植患者auto-HSCT与MSD-HSCT后生存曲线比较.
auto-HSCT:自体造血干细胞移植;MSD-HSCT:同胞全相合造血干细胞移植;A:总生存;B:无白血病生存;C:累积复发;D:移植相关死亡
图2. 未实现治疗3个月内完全分子学缓解并持续至移植患者auto-HSCT与MSD-HSCT后生存曲线比较.
auto-HSCT:自体造血干细胞移植;MSD-HSCT:同胞全相合造血干细胞移植;A:总生存;B:无白血病生存;C:累积复发;D:移植相关死亡
讨论
在过去的十余年中,Ph+ ALL患者的疗效由于TKI的应用而有了重大飞跃[12]–[14]。伊马替尼联合化疗改善了疾病的缓解速度和深度,延长了缓解的持续时间[15]–[17]。El Fakih等[18]报道,伊马替尼的CMR率为28%~50%,达沙替尼的CMR率为45%~65%,普纳替尼的CMR率为78%。然而,目前allo-HSCT仍然是缓解后的标准巩固治疗[19]。由于考虑到寻找合适供者的难度以及allo-HSCT的相关并发症,auto-HSCT有可能是一些患者可采取的替代治疗[20]。Giebel等[7]认为,TKI联合清髓性放化疗的auto-HSCT有潜力治愈Ph+ ALL。随后的研究报告也指出auto-HSCT与同胞全合及无关全合造血干细胞移植疗效相当[7]–[8],[21]。因此,auto-HSCT对某些患者可能行之有效的。
在本组患者中,auto-HSCT组和MSD-HSCT组LFS和OS率差异无统计学意义,与MSD-HSCT组相比,auto-HSCT组NRM低、CIR高。我们将s3CMR定义为患者在治疗3个月内达到CMR且维持至移植。
为了更好地选择移植方式,我们根据s3CMR将患者分为不同的亚组。结果提示,对于达s3CMR患者,auto-HSCT组和MSD-HSCT组患者的3年LFS、OS率和CIR差异无统计学意义。但是,在未达s3CMR患者中,auto-HSCT组患者的3年CIR明显高于MSD-HSCT组。因此,s3CMR对疾病的预后和治疗反应的评估有很大影响。获得s3CMR的患者进行auto-HSCT也可获得与MSD-HSCT相似的疗效;但对于未达到s3CMR的患者,MSD-HSCT则可降低复发。需要强调的是,在我们的研究中,auto-HSCT患者均接受了TKI联合化疗的维持治疗,并持续了1~1.5年,这是提高auto-HSCT的重要保障。
我们研究还提示了不同TKI对Ph+ ALL患者CMR的影响。应用二代TKI,如达沙替尼或尼洛替尼联合化疗的患者,在3个月内和移植前的CMR率都要高于应用伊马替尼联合化疗的患者。因此,二代TKI联合化疗可能会像在慢性髓性白血病中的作用一样[22]–[23],更迅速、更深入地清除白血病克隆,但也要重视二代TKI的不良反应。
综上所述,我们的研究强调了CMR的速度和持续性,在TKI时代,对于那些s3CMR患者,auto-HSCT是一种有效的治疗选择,移植后的维持化疗有利于降低白血病复发;对于未达s3CMR的患者,MSD-HSCT则是更为有利的治疗方法。
References
- 1.Saini L, Brandwein J. New Treatment Strategies for Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia[J] Curr Hematol Malig Rep. 2017;12(2):136–142. doi: 10.1007/s11899-017-0372-3. [DOI] [PubMed] [Google Scholar]
- 2.Tekgündüz E, Göker H, Kaynar L, et al. Adult Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia in Daily Practice: A Multicenter Experience[J] Clin Lymphoma Myeloma Leuk. 2016;16(5):269–274. doi: 10.1016/j.clml.2016.01.007. [DOI] [PubMed] [Google Scholar]
- 3.Short NJ, Kantarjian H, Jabbour E, et al. Which tyrosine kinase inhibitor should we use to treat Philadelphia chromosome-positive acute lymphoblastic leukemia?[J] Best Pract Res Clin Haematol. 2017;30(3):193–200. doi: 10.1016/j.beha.2017.05.001. [DOI] [PubMed] [Google Scholar]
- 4.Ribera JM. Optimal approach to treatment of patients with Philadelphia chromosome-positive acute lymphoblastic leukemia: how to best use all the available tools[J] Leuk Lymphoma. 2013;54(1):21–27. doi: 10.3109/10428194.2012.708753. [DOI] [PubMed] [Google Scholar]
- 5.Ravandi F. Managing Philadelphia chromosome-positive acute lymphoblastic leukemia: role of tyrosine kinase inhibitors[J] Clin Lymphoma Myeloma Leuk. 2011;11(2):198–203. doi: 10.1016/j.clml.2011.03.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Brissot E, Labopin M, Beckers MM, et al. Tyrosine kinase inhibitors improve long-term outcome of allogeneic hematopoietic stem cell transplantation for adult patients with Philadelphia chromosome positive acute lymphoblastic leukemia[J] Haematologica. 2015;100(3):392–399. doi: 10.3324/haematol.2014.116954. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Giebel S, Labopin M, Potter M, et al. Comparable results of autologous and allogeneic haematopoietic stem cell transplantation for adults with Philadelphia-positive acute lymphoblastic leukaemia in first complete molecular remission: An analysis by the Acute Leukemia Working Party of the EBMT[J] Eur J Cancer. 2018;96:73–81. doi: 10.1016/j.ejca.2018.03.018. [DOI] [PubMed] [Google Scholar]
- 8.Giebel S, Labopin M, Gorin NC, et al. Improving results of autologous stem cell transplantation for Philadelphia-positive acute lymphoblastic leukaemia in the era of tyrosine kinase inhibitors: a report from the Acute Leukaemia Working Party of the European Group for Blood and Marrow Transplantation[J] Eur J Cancer. 2014;50(2):411–417. doi: 10.1016/j.ejca.2013.08.027. [DOI] [PubMed] [Google Scholar]
- 9.Ding Z, Han MZ, Chen SL, et al. Outcomes of Adults with Acute Lymphoblastic Leukemia After Autologous Hematopoietic Stem Cell Transplantation and the Significance of Pretransplantation Minimal Residual Disease: Analysis from a Single Center of China[J] Chin Med J (Engl) 2015;128(15):2065–2071. doi: 10.4103/0366-6999.161365. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Lee SJ, Vogelsang G, Flowers ME. Chronic graft-versus-host disease[J] Biol Blood Marrow Transplant. 2003;9(4):215–233. doi: 10.1053/bbmt.2003.50026. [DOI] [PubMed] [Google Scholar]
- 11.Deeg HJ, Storb R. Graft-versus-host disease: pathophysiological and clinical aspects[J] Annu Rev Med. 1984;35:11–24. doi: 10.1146/annurev.me.35.020184.000303. [DOI] [PubMed] [Google Scholar]
- 12.Fielding AK. How I treat Philadelphia chromosome-positive acute lymphoblastic leukemia[J] Blood. 2010;116(18):3409–3417. doi: 10.1182/blood-2010-01-242750. [DOI] [PubMed] [Google Scholar]
- 13.Thomas X, Heiblig M. Diagnostic and treatment of adult Philadelphia chromosome-positive acute lymphoblastic leukemia[J] Int J Hematol Oncol. 2016;5(2):77–90. doi: 10.2217/ijh-2016-0009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Malagola M, Papayannidis C, Baccarani M. Tyrosine kinase inhibitors in Ph + acute lymphoblastic leukaemia: facts and perspectives[J] Ann Hematol. 2016;95(5):681–693. doi: 10.1007/s00277-016-2617-y. [DOI] [PubMed] [Google Scholar]
- 15.Ronson A, Tvito A, Rowe JM. Treatment of Philadelphia Chromosome-Positive Acute Lymphocytic Leukemia[J] Curr Treat Options Oncol. 2017;18(3):20. doi: 10.1007/s11864-017-0455-3. [DOI] [PubMed] [Google Scholar]
- 16.Hatta Y, Mizuta S, Matsuo K, et al. Final analysis of the JALSG Ph+ALL202 study: tyrosine kinase inhibitor-combined chemotherapy for Ph+ALL[J] Ann Hematol. 2018;97(9):1535–1545. doi: 10.1007/s00277-018-3323-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Fujisawa S, Mizuta S, Akiyama H, et al. Phase II study of imatinib-based chemotherapy for newly diagnosed BCR-ABL-positive acute lymphoblastic leukemia[J] Am J Hematol. 2017;92(4):367–374. doi: 10.1002/ajh.24653. [DOI] [PubMed] [Google Scholar]
- 18.El Fakih R, Jabbour E, Ravandi F, et al. Current paradigms in the management of Philadelphia chromosome positive acute lymphoblastic leukemia in adults[J] Am J Hematol. 2018;93(2):286–295. doi: 10.1002/ajh.24926. [DOI] [PubMed] [Google Scholar]
- 19.Doki N, Ohashi K, Oshikawa G, et al. Clinical outcome of hematopoietic stem cell transplantation for Philadelphia chromosome-positive acute lymphoblastic leukemia (Ph + ALL): experience from a single institution[J] Pathol Oncol Res. 2014;20(1):61–66. doi: 10.1007/s12253-013-9658-5. [DOI] [PubMed] [Google Scholar]
- 20.Tanguy-Schmidt A, Rousselot P, Chalandon Y, et al. Long-term follow-up of the imatinib GRAAPH-2003 study in newly diagnosed patients with de novo Philadelphia chromosome-positive acute lymphoblastic leukemia: a GRAALL study[J] Biol Blood Marrow Transplant. 2013;19(1):150–155. doi: 10.1016/j.bbmt.2012.08.021. [DOI] [PubMed] [Google Scholar]
- 21.Wetzler M, Watson D, Stock W, et al. Autologous transplantation for Philadelphia chromosome-positive acute lymphoblastic leukemia achieves outcomes similar to allogeneic transplantation: results of CALGB Study 10001 (Alliance)[J] Haematologica. 2014;99(1):111–115. doi: 10.3324/haematol.2013.085811. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Cortes JE, Saglio G, Kantarjian HM, et al. Final 5-Year Study Results of DASISION: The Dasatinib Versus Imatinib Study in Treatment-Naïve Chronic Myeloid Leukemia Patients Trial[J] J Clin Oncol. 2016;34(20):2333–2340. doi: 10.1200/JCO.2015.64.8899. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Hochhaus A, Saglio G, Hughes TP, et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial[J] Leukemia. 2016;30(5):1044–1054. doi: 10.1038/leu.2016.5. [DOI] [PMC free article] [PubMed] [Google Scholar]