Abstract
目的
研究脾边缘区淋巴瘤(SMZL)患者免疫球蛋白重链可变区(IGHV)基因突变状态及典型模式的分布情况,并与国外报道的数据进行对比,以探讨其差异。
方法
对40例SMZL患者资料进行回顾性分析。采用克隆测序法检测IGHV的VDJ序列并进行比对及聚类分析,明确是否存在B细胞受体的典型模式,分析IGHV突变患者与未突变患者的临床特征。
结果
40例患者中,IGHV突变者30例(75.0%),未突变者10例(25.0%),两者比例与国外报道相当。在V区基因,V2-70的使用频率高于国外报道(10.3%对0.8%,P=0.002),而V3-23明显减低(2.6%对18.0%,P=0.006)。在D区基因中,D2-21和D6-13均高于国外报道(17.9%对2.3%,12.8%对3.8%,P值分别为0.000、0.046)。40例患者中发现1对新的典型模式,同时SMZL特异性的V1-2基因使用频率也最高(25.6%)。与IGHV突变组相比,未突变组患者的IgG、IgA表达水平显著增高[10.70(5.28~15.50)g/L对12.90 (7.71~23.50) g/L,1.06(0.21~3.13) g/L对1.66 (0.81~2.93) g/L,P值分别为0.038、0.040)],2例17p缺失患者的IGHV均呈未突变状态。与IGHV未突变组相比,突变组患者的无进展生存期显著延长(P=0.009),但总生存期差异无统计学意义(P=0.430)。
结论
在SMZL患者中,IGHV突变与未突变患者比例与国外报道相当,但V区和D区基因的使用频率仍存在差异,而且V1-2基因的使用呈现疾病特异性,同时发现1例新的典型模式。IGHV突变可降低患者的IgG、IgA表达水平。
Keywords: 淋巴瘤,B细胞,边缘区, 免疫球蛋白重链, 突变, 受体,抗原,B细胞
Abstract
Objective
To investigate the IGHV mutational status and its differences from Caucasian in splenic marginal zone lymphoma (SMZL).
Methods
A retrospective study on 40 SMZL cases were performed to detect the V-D-J sequence of IGHV by plasmid cloning sequencing, comparing the data with the most homologous germ line V sequence in database, identifying the stereotype of patients through cluster analysis and alignment. The clinical and laboratory characteristics were compared between the patients with IGHV mutation and without mutations.
Results
In SMZL patients, the proportion of IGHV mutations was 75%, consistent with data from Caucasian. In V region, the usage of V3-23 subtype was lower in Chinese patients compared with Caucasian (2.6% vs 18.0%, P=0.006), whereas the V2-70 subtype was used with high proportion (10.3% vs 0.8%, P=0.002). In D region, the D2-21 and D6-13 gene were used frequently (17.9% vs 2.3%, P<0.001; 12.8% vs 3.8%, P=0.046). One new stereotype was found, and the SMZL-biased V1-2 gene was mostly used (25.6%). The levels of IgG and IgA were significantly increased in IGHV without mutations as compared with mutations [10.70 (5.28–15.50) g/L vs 12.90 (7.71–23.50) g/L, 1.06 (0.21–3.13) g/L vs 1.66 (0.81–2.93) g/L, P=0.038, 0.040]. The only two 17p deletion patients were IGHV without mutaions. The progression free survival (PFS) was significantly prolonged in IGHV mutations (P=0.009), and there was no significant difference regarding to the overall survival between the two subgroups (P=0.430).
Conclusion
The proportion of IGHV mutaions was similar to the data in Caucasian. There was disparity in the usage of V and D regions between Chinese and Caucasian, and the SMZL-biased V1-2 gene were used more frequently in Chinese patients. One new stereotype was identified. In the IGHV without mutations group, the levels of IgG and IgA were significantly increased.
Keywords: Lymphoma, B-cell, marginal zone; Immunoglobulin heavy chains; Mutation; Receptors, antigen, B-cell
B细胞受体(B-cell receptors,BCR)通路的活化是B细胞肿瘤发生和克隆演变的始动因素。尽管不同B细胞肿瘤其生物学行为及临床经过具有异质性,但其中大部分疾病对BCR信号通路相关的激酶抑制剂均有很好的反应性,因而针对抑制BCR通路的靶向治疗是B细胞肿瘤患者所遵从的一种治疗模式。BCR是膜结合的免疫球蛋白,后者包括重链和轻链,二者均由可变区和恒定区构成。免疫球蛋白通过可变区来识别和结合抗原,通过恒定区来启动下游效应。免疫球蛋白可变区的多样性是其特异性识别抗原的结构基础。有研究者对免疫球蛋白重链可变区(IGHV)序列进行研究,发现某些慢性淋巴细胞白血病(CLL)患者的BCR具有高度同源性,称为典型模式(stereotyped)[1]。已有研究证实,IGHV基因的突变状态与CLL患者的预后相关[2]。对脾边缘区淋巴瘤(splenic marginal zone lymphoma,SMZL)患者IGHV基因突变状态的研究目前国内尚未见报道。由于东西方人群遗传因素、环境因素等不同,研究不同疾病背景下典型模式的差异有助于我们更深入的理解SMZL的细胞起源及发病机制。本研究旨在探讨SMZL患者IGHV突变状态及典型模式的分布情况,并与国外报道的数据[3]进行对比,探讨其与西方国家的异同。
病例与方法
1.病例:以2008年3月至2013年4月就诊于我院淋巴瘤诊疗中心的40例初治SMZL患者为研究对象,其中男22例,女18例,中位年龄58 (40~79)岁。参照2008年WHO分型诊断标准进行诊断分型[4]。40例患者中,22例患者采用R-CHOP(利妥昔单抗、环磷酰胺、表柔比星、长春新碱、泼尼松)、R-FC(利妥昔单抗、氟达拉滨、环磷酰胺)、R-COP(利妥昔单抗、环磷酰胺、长春新碱、泼尼松)方案化疗,4例患者采用脾切除术及利妥昔单抗单药治疗,5例患者采用CHOP方案化疗,9例患者在我院确诊后回当地治疗,具体治疗方案不详。所有患者的标本收集均经过我院伦理委员会批准,患者签署知情同意书。
2.研究方法:取患者外周血或骨髓标本,提取基因组DNA,按IGHV试剂盒(IGH Somatic Hypermutation Assay v2.0,美国InVivoScribe公司产品)说明书进行IGHV基因片段扩增,后将PCR产物电泳胶回收纯化,连接T载体摇菌进行克隆测序,每份标本送检10份菌液,所有标本送华大基因有限公司进行DNA正反双向序列测定。
3.数据比对:所有测序结果使用IGHV-QUEST软件进行分析,当V区检测序列与胚系V区序列相似性>98%时定义为IGHV未突变序列,当相似性≤ 98%时定义为IGHV突变序列。用ClustalW2软件进行序列比对与聚类分析,并与文献[2]最新报道的国外研究进行比对分析。典型模式的纳入标准必须满足以下5点[1]:①HCDR3氨基酸长度相同。②HCDR3氨基酸相同性≥50%。③HCDR3氨基酸相似性≥70%。④HCDR3区特定的氨基酸排列模式。⑤VH家族属于同一家族。
4.临床特征分析:患者临床特征评价指标包括起病症状、肝脾肿大、浅表淋巴结肿大、血细胞计数(包括WBC、RBC、HGB、PLT、淋巴细胞绝对计数)、免疫球蛋白定量、乳酸脱氢酶、β2微球蛋白、细胞遗传学(17p缺失、RB-1缺失、ATM缺失、IgH易位)、染色体核型等。
5.随访:所有病例随访截止日期为2014年8月1日,通过电话联系加以确认。无进展生存(PFS)时间定义为诊断至疾病进展或随访结束。总生存(OS)时间定义为诊断至死亡或随访结束。
6.统计学处理:所有数据采用SPSS 21.0软件进行统计学分析。计量资料以中位数表示,符合正态分布的计量资料组间比较采用独立样本t检验,偏态分布的计量资料的比较采用非参数Mann-Whitney U检验。计数资料的比较采用四格表资料的χ2检验或Fisher确切概率法,采用Kaplan-Meier方法绘制生存曲线进行生存分析,各组患者生存曲线比较应用Log-rank检验。P<0.05为差异有统计学意义。
结果
1.SMZL患者IGHV突变状态及典型模式的分布情况:40例患者中,IGHV突变者30例(75.0%),未突变者10例(25.0%),两者比例与国外报道的比例相当(70%∶30%)[2]。在V区片段使用中,V1、V4和V3片段的使用频率分别占41.0%、25.6%、20.5%,是最常见的V区片段,这与国外报道一致。但使用V3片段的使用频率明显低于国外报道(20.5%对50.0%,P=0.015),而V2片段的使用频率高于国外报道(10.3%对0.8%,P=0.002),其他V5、V6片段分别占0、2.6%(表1)。
表1. 本研究与国外研究脾边缘区淋巴瘤患者免疫球蛋白重链可变区(IGHV)基因片段使用频率比较(%).
| IGHV基因 | 本研究 | 国外研究 | P值 |
| V区片段使用频率 | |||
| VH1 | 41.0 | 30.0 | 0.557 |
| VH2 | 10.3 | 0.8 | 0.002 |
| VH3 | 20.5 | 50.0 | 0.015 |
| VH4 | 25.6 | 17.0 | 0.278 |
| VH5 | 0 | 2.2 | 0.339 |
| VH6 | 2.6 | 0 | 0.068 |
| V区基因使用频率 | |||
| V1-2 | 25.6 | 19.5 | 0.529 |
| V1-3 | 2.6 | 0.8 | 0.530 |
| V1-8 | 2.5 | 0 | 0.618 |
| V1-69 | 5.1 | 7.5 | 0.232 |
| V2-70 | 10.3 | 0.8 | 0.002 |
| V3-21 | 5.1 | 3.0 | 0.585 |
| V3-23 | 2.6 | 18.0 | 0.006 |
| V3-30 | 7.7 | 6.8 | 0.482 |
| V3-49 | 2.6 | 0.8 | 0.530 |
| V3-66 | 2.6 | 1.5 | 0.697 |
| V3-74 | 2.6 | 4.5 | 0.383 |
| V4-34 | 15.4 | 7.5 | 0.070 |
| V4-39 | 2.6 | 1.5 | 0.697 |
| V4-59 | 5.1 | 3.8 | 0.763 |
| V4-61 | 2.6 | 2.3 | 0.955 |
| D区主要基因使用频率 | |||
| D2-21 | 17.9 | 2.3 | 0.000 |
| D3-3 | 7.7 | 18.0 | 0.196 |
| D3-10 | 12.8 | 4.5 | 0.082 |
| D3-22 | 10.3 | 11.3 | 0.765 |
| D6-13 | 12.8 | 3.8 | 0.046 |
V区基因中,V2-70的使用频率高于意大利报道(P=0.002),V4-34的使用频率也较高(P=0.070),但差异无统计学意义,而V3-23的使用频率明显减低(P=0.006)。国外报道的SMZL特异性的V1-2基因使用率达26.0%,也是我们这部分患者中使用频率最高的V区基因。D区基因中,D2-21和D6-13高于国外报道(P值分别为0.000、0.046)(表1)。而且,国外报道的D2-8、D4-17、D5-5等少见片段使用在我们这部分病例中未见,但D5-18仅在我们的病例中出现。J区最常见的基因为J6*02、J4*03和J3 * 02,分别占28.2%、25.6%及20.5%,与国外报道相似。根据典型模式的定义,在我们这部分患者中出现一例新的未突变的典型模式,其V区基因为IGHV2-70, CDR3氨基酸序列为CARTYSIVAVGT-PAWFDPW。
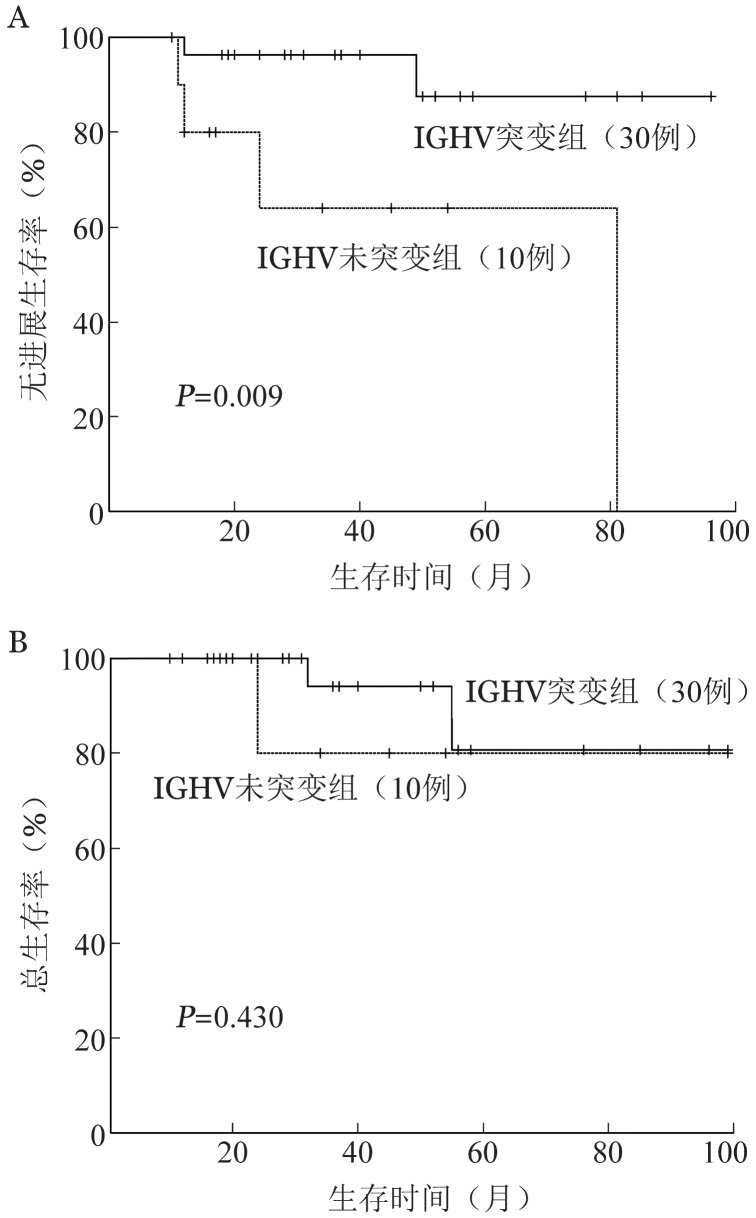
2.IGHV突变状态与SMZL患者临床特征的相关性分析:40例患者中,有30例行FISH细胞遗传学检测。其中RB-1、ATM缺失检测均为阴性;2例(6.7%)为17p缺失阳性,且均为IGHV未突变患者;6例(22.2%)IGH易位检测阳性。与IGHV突变组相比,未突变组患者的IgG、IgA表达水平显著增高[10.70(5.28~15.50)g/L对12.90(7.71~23.50)g/L,1.06 (0.21~3.13) g/L对1.66 (0.81~2.93) g/L,P值分别为0.038、0.040](表2)。40例患者的中位随访时间为34 (10~99)个月。与IGHV未突变组相比,突变组患者的PFS时间显著延长(P=0.009),两组患者OS时间差异无统计学意义(P=0.430)(图1)。
表2. 免疫球蛋白重链可变区(IGHV)突变患者与未突变患者临床特征比较.
| IGHV突变组(30例) | IGHV未突变组(10例) | P值 | |
| 血常规 | |||
| WBC[×109/L,M(范围)] | 16.79(2.42~126.82) | 19.12(2.28~61.68) | 0.749 |
| HGB[g/L,M(范围)] | 107(53~151) | 102(85~142) | 0.753 |
| PLT[×109/L,M(范围)] | 92(34~569) | 125(38~440) | 0.368 |
| ALC[×109/L,M(范围)] | 10.54(0.44~123.00) | 7.08(0.28~45.50) | 0.480 |
| 肿瘤负荷 | |||
| LDH[U/L,M(范围)] | 173(107~515) | 225(118~400) | 0.965 |
| β2微球蛋白[mg/L,M(范围)] | 4.18(1.54~11.90) | 3.50(2.41~9.69) | 0.971 |
| 免疫球蛋白 | |||
| IgG[g/L,M(范围)] | 10.70(5.28~23.50) | 12.90(7.71~23.50) | 0.038 |
| IgA[g/L,M(范围)] | 1.06(0.21~3.13) | 1.66(0.81~2.93) | 0.040 |
| IgM[g/L,M(范围)] | 0.90(0.18~31.10) | 1.22(0.35~16.50) | 0.659 |
| 细胞遗传学 | |||
| RB-1缺失[例(%)] | 0 | 0 | - |
| 17P缺失[例(%)] | 0 | 2(6.67) | 0.060 |
| ATM缺失[例(%)] | 0 | 0 | - |
| IgH易位[例(%)] | 5(16.67) | 1(3.33) | 1.000 |
注:ALC:淋巴细胞绝对计数;-:无法统计
图1. 免疫球蛋白重链可变区(IGHV)突变对脾边缘区淋巴瘤患者无进展生存(A)及总生存(B)的影响.
讨论
B细胞发育经历了体细胞高突变和VDJ重排,从而形成很多种不同的BCR及抗体[5]。在前B细胞晚期阶段,出现IGH基因重排并表达sIgµ(surface Immunoglobulin µ)链,与随后表达的轻链共同组成BCR, BCR转导的活化信号使B细胞进一步发育成熟。IGHV基因编码BCR的抗原结合区域,目前BCR细胞内信号传递过程已经比较明确,而究竟是哪种抗原与BCR结合来触发细胞内的一系列反应仍不十分清楚。在对CLL的研究中已经发现多种抗原与BCR相互作用从而活化下游信号[6]–[7],而且在CLL病程中这种活化信号持续存在[8]。这些现象提示抗原选择在B细胞肿瘤发生机制中具有一定的作用。根据免疫球蛋白BCR的典型模式对CLL患者进行亚组分类可以预测各亚组患者具有相似的抗原激活谱,同时也与患者的预后相关[9],而在对SMZL患者的研究中也发现不同BCR重链可变区CDR3典型模式的存在[3]。上述研究均提示在B细胞肿瘤发生中存在疾病特异性的免疫介导的淋巴细胞恶性转化机制。因此,研究B细胞肿瘤的典型模式有助于我们更深入的了解疾病的发生机制,同时对患者进行更为合理的危险度分层,从而有助于患者的个体化治疗[10]。
我们的研究证实了国外研究所发现的SMZL患者IGHV的异质性。在40例患者中,30例患者为IGHV突变,10例患者未发生IGHV突变。VH1基因的使用存在偏颇性,有10例患者出现国外报道的SMZL疾病特异性的V1-2基因,其中8例患者为IGHV突变状态。国外有研究者认为SMZL的发生与丙肝病毒感染有关[11]–[12],且使用V1-69D3-22JH4基因的患者表现为HCV阳性[13]。但我们在研究中未发现丙肝病毒感染的患者,也未观察到这一特异基因的存在。在具体基因片段使用频率方面,我们的研究结果与国外报道仍有差异,表现在V区的V2、V3片段使用及V2-70、V3-23基因的使用频率,D区D2-21、D6-13及D3-3基因的使用频率等方面。结合患者的临床特征进行分析发现,SMZL患者的遗传学相对稳定,仅有2例患者为17p缺失阳性,且均为IGHV未突变患者。同时免疫球蛋白IgG、IgA的水平在未突变组显著增高,但产生这一现象的原因目前尚不明确,也没有相关基础研究的理论依据报道。
有研究者在对CLL患者的研究中发现,IGHV未突变患者的临床经过更具侵袭性[14]。但也有一些个例,例如使用IGHV3-21基因的患者大部分为IGHV突变者,但与未突变患者的临床结局相似[15]。对于SMZL的研究,目前的结论有相悖之处[16]–[17]。在本研究中我们发现,IGHV突变患者的PFS期较未突变者显著延长,但两组患者的OS差异无统计学意义,有待于延长随访时间进一步观察。
综上,我们的研究结果显示,在SMZL患者中IGHV突变状态及典型模式分布与西方国家明显不同,且IGHV突变患者的PFS明显优于未突变患者,但目前国内外尚缺乏统一的研究结论,可能与疾病的地理人群分布及环境因素有关。通过本研究也给我们带来一些新的思考和启示。从疾病发生机制来讲,有助于我们寻找类似于哺乳动物B-1细胞样的SMZL细胞抗原结合位点,探讨SMZL的细胞起源,从而提高对SMZL发病机制的认识。从临床角度来讲,提高我们对SMZL突变状态及典型模式与疾病起病方式、临床经过及患者结局的认识,因此,更有利于患者的危险度分层及基于典型模式特异性的个体化治疗。但由于疾病的地理人群分布及环境因素的不同导致中西方的疾病特征不完全一样,且国内的研究甚少,我们期待更多的研究者能参与其中,以发现更多的中国SMZL患者IGHV突变状态及典型模式的特征来指导临床疾病的诊治。
Funding Statement
基金项目:国家自然科学基金(81370632)
Fund Program: National Natural Science Foundation of China(81370632)基金项目:国家自然科学基金(81370632)
References
- 1.Murray F, Darzentas N, Hadzidimitriou A, et al. Stereotyped patterns of somatic hypermutation in subsets of patients with chronic lymphocytic leukemia: implications for the role of antigen selection in leukemogenesis[J] Blood. 2008;111(3):1524–1533. doi: 10.1182/blood-2007-07-099564. [DOI] [PubMed] [Google Scholar]
- 2.Damle RN, Wasil T, Fais F, et al. Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia[J] Blood. 1999;94(6):1840–1847. [PubMed] [Google Scholar]
- 3.Zibellini S, Capello D, Forconi F, et al. Stereotyped patterns of B-cell receptor in splenic marginal zone lymphoma[J] Haematologica. 2010;95(10):1792–1796. doi: 10.3324/haematol.2010.025437. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Jaffe ES HN, Stein H, Vardiman J, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissue: Pathology and Genetics [M] 4th ed. Lyon: International Agency for Research on Cancer; 2008. p. 11. [Google Scholar]
- 5.Borghesi L, Milcarek C. From B cell to plasma cell: regulation of V (D) J recombination and antibody secretion[J] Immunol Res. 2006;36(1-3):27–32. doi: 10.1385/IR:36:1:27. [DOI] [PubMed] [Google Scholar]
- 6.Steininger C, Widhopf GF, Ghia EM, et al. Recombinant antibodies encoded by IGHV1-69 react with pUL32, a phosphoprotein of cytomegalovirus and B-cell superantigen[J] Blood. 2012;119(10):2293–2301. doi: 10.1182/blood-2011-08-374058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Hoogeboom R, van Kessel KP, Hochstenbach F, et al. A mutated B cell chronic lymphocytic leukemia subset that recognizes and responds to fungi[J] J Exp Med. 2013;210(1):59–70. doi: 10.1084/jem.20121801. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Herishanu Y, Pérez-Galán P, Liu D, et al. The lymph node microenvironment promotes B-cell receptor signaling, NF-kappaB activation, and tumor proliferation in chronic lymphocytic leukemia[J] Blood. 2011;117(2):563–574. doi: 10.1182/blood-2010-05-284984. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chu CC, Catera R, Zhang L, et al. Many chronic lymphocytic leukemia antibodies recognize apoptotic cells with exposed nonmuscle myosin heavy chain IIA: implications for patient outcome and cell of origin[J] Blood. 2010;115(19):3907–3915. doi: 10.1182/blood-2009-09-244251. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Chiorazzi N, Rai KR, Ferrarini M. Chronic lymphocytic leukemia[J] N Engl J Med. 2005;352(8):804–815. doi: 10.1056/NEJMra041720. [DOI] [PubMed] [Google Scholar]
- 11.Hermine O, Lefrère F, Bronowicki JP, et al. Regression of splenic lymphoma with villous lymphocytes after treatment of hepatitis C virus infection[J] N Engl J Med. 2002;347(2):89–94. doi: 10.1056/NEJMoa013376. [DOI] [PubMed] [Google Scholar]
- 12.Weng WK, Levy S. Hepatitis C virus (HCV) and lymphomagenesis[J] Leuk Lymphoma. 2003;44(7):1113–1120. doi: 10.1080/1042819031000076972. [DOI] [PubMed] [Google Scholar]
- 13.Marasca R, Vaccari P, Luppi M, et al. Immunoglobulin gene mutations and frequent use of VH1-69 and VH4-34 segments in hepatitis C virus-positive and hepatitis C virus-negative nodal marginal zone B-cell lymphoma[J] Am J Pathol. 2001;159(1):253–261. doi: 10.1016/S0002-9440(10)61691-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Hamblin TJ, Davis Z, Gardiner A, et al. Unmutated Ig V (H) genes are associated with a more aggressive form of chronic lymphocytic leukemia[J] Blood. 1999;94(6):1848–1854. [PubMed] [Google Scholar]
- 15.Tobin G, Thunberg U, Johnson A, et al. Somatically mutated Ig V (H) 3-21 genes characterize a new subset of chronic lymphocytic leukemia[J] Blood. 2002;99(6):2262–2264. doi: 10.1182/blood.v99.6.2262. [DOI] [PubMed] [Google Scholar]
- 16.Algara P, Mateo MS, Sanchez-Beato M, et al. Analysis of the IgV (H) somatic mutations in splenic marginal zone lymphoma defines a group of unmutated cases with frequent 7q deletion and adverse clinical course[J] Blood. 2002;99(4):1299–1304. doi: 10.1182/blood.v99.4.1299. [DOI] [PubMed] [Google Scholar]
- 17.Zibellini S, Capello D, Forconi F, et al. Stereotyped patterns of B-cell receptor in splenic marginal zone lymphoma[J] Haematologica. 2010;95(10):1792–1796. doi: 10.3324/haematol.2010.025437. [DOI] [PMC free article] [PubMed] [Google Scholar]