在2008年世界卫生组织(WHO)造血与淋巴组织肿瘤分类中,淋巴瘤被分为霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)两大类,HL又分为结节性淋巴细胞为主型霍奇金淋巴瘤(nodular lymphocyte predominant Hodgkin lymphoma,NLPHL)与经典型霍奇金淋巴瘤(classical Hodgkin lymphoma, CHL)。CHL占HL的95%以上,少数Reed-Sternberg细胞(RS细胞)和(或)其变异细胞散在分布于反应性炎细胞背景中。根据肿瘤细胞形态及背景炎细胞的特征又分为四个亚型:结节硬化型(nodular sclerosis classical Hodgkin lymphoma, NSCHL)、混合细胞型(mixed cellularity classical Hodgkin lymphoma, MCCHL)、淋巴细胞丰富型(lymphocyte-rich classical Hodgkin lymphoma, LRCHL)和淋巴细胞消减型(lymphocyte-depleted classical Hodgkin lymphoma, LDCHL)[1]。CHL较少见,要正确诊断并准确分型并不容易。我们对56例CHL患者临床病理资料进行回顾性分析,探讨皖北地区CHL患者的临床病理学特征,以提高对该肿瘤的诊断水平。
病例与方法
1.病例:我们对蚌埠医学院第一附属医院病理科2005年1月至2009年12月诊断的淋巴造血系统肿瘤病例的临床资料、病理切片进行复习(部分病例增加免疫组化标记检测),1 092例患者符合按照2008年WHO造血与淋巴组织肿瘤分类诊断标准,其中57例(5.22%)为HL(CHL 56例、NLPHL1例)。本研究以56例CHL患者为研究对象。
2.方法:石蜡包埋组织切片,常规HE染色及免疫组化染色。免疫组化主要采用EnVision两步法,所用免疫组化试剂ALK1、Bcl-2、Bcl-6、CD3ε、CD4、CD5、CD7、CD8、CDl0、CD15、CD20、CD21、CD23、CD30、CD43、CD45、CD45RA、CD45RO、CD68、CD79a、EMA、EBV-LMP1及Ki-67购自福州迈新生物技术有限公司,操作按照说明书进行。
3.EBV编码的小RNA (EBER)原位杂交:采用EBER原位杂交试剂盒,对15例诊断疑难患者石蜡切片进行检查(EBER探针为丹麦DAKO公司产品,应用地高辛标记EBERl/2 sRNA探针,检测组织中EBERl与EBER2的表达)。用已知阳性的鼻咽癌样本作为阳性对照,用PBS缓冲液代替探针作为阴性对照。由北京大学基础医学院血液病理研究室协作完成。
4.阳性判断标准:CD30、CD15、EBV-LMP1阳性定位在RS细胞的胞膜及核旁高尔基区(膜点状阳性),有时可仅高尔基区着色或膜阳性;EBER阳性表达于RS细胞的胞核。评判须注意阳性定位在RS细胞上,由于活化的T、B淋巴细胞可表达CD30,而粒细胞及单核巨噬细胞可表达CD15,背景炎细胞免疫标志的表达会对评判造成干扰,应予区别。
5.随访:通过电话和走访进行随访。随访截止日期为2016年6月5日。
结果
1.临床资料:56例CHL患者中男31例,女25例;LRCHL 12例(21.43%),MCCHL 15例(26.79%),NSCHL 28例(50.00%),LDCHL 1例(1.79%);中位年龄37 (5~83)岁,呈现11~40岁(30例)与51~60岁(11例)两个发病高峰年龄段。各亚型平均年龄:LRCHL 37.6岁,MCCHL 37.5岁,NSCHL 38岁,LDCHL 18岁(仅1例)。发病部位:53例(94.6%)以淋巴结肿大就医(其中颈部淋巴结肿大40例),结外3例分别首发于扁桃体、左胸壁与肩胛骨旁。原发于淋巴结者3例累及脾脏,1例累及骨髓。31例患者行B超、CT或PET-CT检查。Ann Arbor分期:Ⅰ/Ⅱ期22例(71%),Ⅲ/Ⅳ期9例(29%)。
2.淋巴结标本肉眼观察:淋巴结体积增大,长径0.5~4.0 cm,切面呈灰红色、质嫩、鱼肉状或灰白质韧。3例首发于结外病变者肿块长径2.5~6.0 cm,切面灰红色、质嫩。
3.病理组织形态学特征:①NSCHL:淋巴结被膜增厚,纤维组织增生并胶原化,宽大的平行排列的胶原带分割肿瘤组织,至少有一个结节被胶原带围绕,肿瘤结节中分布的RS细胞多为特征性的陷窝型细胞,胞质空,多叶核,核仁小而嗜碱(图1A)。诊断型RS细胞及单核RS细胞少见。1级18例,RS细胞少,散布于肿瘤结节中;2级10例,RS细胞多,分布广泛,其中1例RS细胞弥漫成片。②MCCHL:淋巴结结构破坏,淋巴结被膜不增厚,易见典型的诊断型双核及单核RS细胞,散在分布。背景由中性粒细胞、嗜酸粒细胞、组织细胞和浆细胞混合组成(图1B),其成分变异很大,可以其中一种细胞为主。组织细胞多表现出明显的上皮样细胞形态,个别形成肉芽肿。③LRCHL: RS细胞常为单核型与固缩型,诊断型RS细胞少见;背景以小淋巴细胞为主,可形成模糊的结节(图1C),T淋巴细胞、B淋巴细胞及组织细胞混合存在,缺少嗜酸性粒细胞与中性粒细胞。④LDCHL:淋巴结结构破坏,RS细胞显著增多,背景细胞数量减少,RS细胞数量多于背景细胞且形态多样(图1D)。
图1. 经典型霍奇金淋巴瘤各亚型病理组织形态(HE染色).
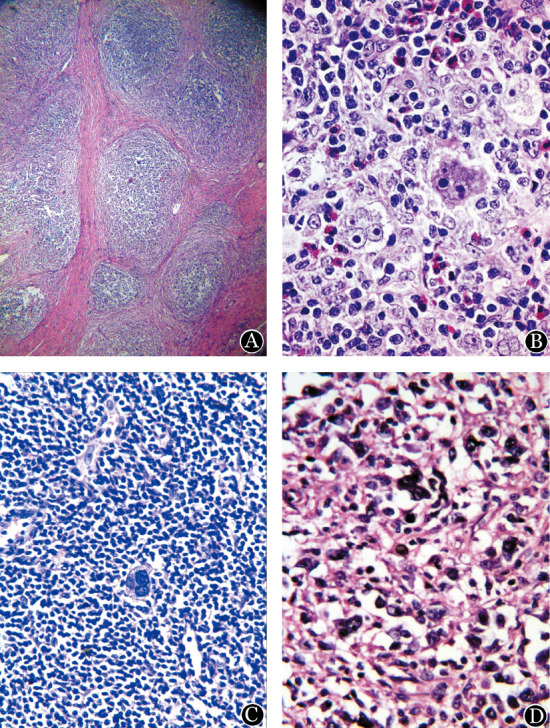
A:结节硬化型(×100);B:混合细胞型(×400);C:淋巴细胞丰富型(×400);D:淋巴细胞消减型(×400)
4.病理组织免疫组化检查:RS细胞CD30、CD15及EBV(LMP1/EBER)的阳性表达率分别为100%(56/56)、64.8%(35/54)与47.8%(22/46)(图2A、B)。EBV在LRCHL、MCCHL的检出率分别为77.8%(7/9)、66.7%(10/15),均高于NSCHL的23.8%(5/21);唯一的1例LDCHL标本EBV-LMP1阴性。RS细胞CD20、CD79a、CD45RA、CD45RO、CD43、LCA、EMA的阳性表达率分别为7.3%(4/55)、6.7%(3/45)、18.2%(2/11)、10.3%(3/29)、12.1%(4/33)、16.7%(2/12)、9.4%(3/32),不表达CD3ε、ALK1、CK、HMB45、AB/PAS、CD21、MPO、CD68、S-100蛋白。1例须与血管免疫母细胞性T细胞淋巴瘤鉴别病例免疫标志CXCL13、PD1、CD10、Bcl6表达均为阴性。
图2. 经典型霍奇金淋巴瘤免疫组化(A)及原位杂交(B)检查.

A:RS细胞膜及高尔基区CD30阳性;B:RS细胞核EBV编码的小RNA阳性
5.治疗:根据临床分期及是否具有预后不良因素采取不同的治疗方案。①早期CHL患者采取化疗联合受累野放疗。病变局限、临床Ⅰ/Ⅱ期、无不良预后因素者选用ABVD方案(阿霉素+博来霉素+长春碱+达卡巴嗪)治疗2~4个周期,然后行受累野照射20~30 Gy(瑞典Elekta Precise加速器);具有不良预后因素(年龄≥50岁、巨大肿块、有B症状、淋巴结受累>3个区域、红细胞沉降率>30 mm/1 h)的患者选用ABVD方案化疗4~6个周期联合受累野照射30~36 Gy。②进展期CHL以ABVD方案为常规治疗选择,或选择MOPP/BEACOPP(氮芥+长春新碱+甲基苄肼+泼尼松/阿霉素+环磷酰胺+依托泊苷+长春新碱+甲基苄肼+泼尼松+博来霉素)或StanfordV方案(阿霉素+氮芥+长春碱+长春新碱+博来霉素+依托泊苷+泼尼松)化疗4~6个周期联合受累野照射30~36 Gy。③复发难治HL使用提高剂量的BEACOPP方案治疗4~8个周期,结合放疗(在全程化疗结束后进行)。少数病例联合利妥昔单抗、造血干细胞移植等治疗。
6.生存情况:截至2016年6月5日,本组病例中22例获得随访,其中17例尚存活,5例死亡。死亡病例中,1例39岁LRCHL患者因意外事故死亡,另外4例均为NSCHL患者(52~83岁),死于疾病进展。
讨论
欧美地区HL占全部淋巴瘤的15%~30%[2],中国多中心性淋巴瘤亚型分布统计结果显示HL占8.54%[3],中国皖南地区HL占9.34%[4]。本研究56例CHL中,NSCHL 28例(50%),与欧美和日本的50%~80%较接近[2],[5]。发病年龄呈11~40岁及51~60岁的双峰特征。发病部位淋巴结占绝对优势,且以颈部淋巴结最多见,结外极少见,这与皖南地区较接近。EBV在小儿及老年MCCHL患者和年轻成人NSCHL患者中阳性率较高[6],欧洲患者中EBV阳性率为30%~40%,南美地区为80%[7]。而本组病例EBV阳性率为47.8%(22/46),在LRCHL、MCCHL分别为77.8%(7/9)、66.7%(10/15),皆高于NSCHL的23.8%(5/21),而三种亚型平均发病年龄接近,因此EBV的阳性率率与年龄没有明显关联,表现出皖北地区淋巴瘤发病的自身特点。
CHL四个亚型的RS细胞免疫标志相同:CD30、CD15、EBER和(或)LMP-1阳性,Pax5弱阳性,CD20多为阴性,肿瘤细胞多为B细胞起源。CHL各亚型的RS细胞类型及炎细胞有所不同,除NSCHL 2级的RS细胞可以成片分布外,其他各型RS细胞均呈散在分布。NSCHL的淋巴结被膜增厚,广泛纤维化,宽大且平行排列的胶原纤维带分割肿瘤组织,至少有一个结节被胶原带围绕,纵隔受累较常见。在肿瘤结节中较特征的陷窝型RS细胞一般散在分布,但2级NSCHL瘤细胞聚集成片。LRCHL少量系列性RS细胞散在分布,为单核型、固缩型,诊断型RS细胞少见;背景T、B及组织细胞混合分布,缺乏嗜酸性与嗜中性粒细胞。MCCHL以诊断型RS细胞多见为特征,约75%的病例RS细胞表达EBER/LMP1,背景小淋巴细胞多为CD3阳性的T细胞,CD20阳性的B细胞呈灶性分布,嗜酸性、嗜中性粒细胞及组织细胞多见,与LRCHL及LDCHL的区别,不宜分入LRCHL与LDCHL,诊断型RS细胞多见是最重要的诊断要点。LDCHL形态高度可变,RS细胞丰富,散在或成片分布,双核、多核、单核RS细胞更多见,背景小淋巴细胞明显减少(可少于RS细胞),一般有两种类型,弥漫纤维化型与肉瘤样型。组织学形态在炎症背景上分布RS细胞,瘤细胞表达CD30、CD15、LMP1、EBER,弱表达Pax5,结合临床表现等,即可做出CHL的诊断。
CHL应与NLPHL、间变性大细胞淋巴瘤(ALCL)、弥漫大B细胞淋巴瘤(DLBCL)及血管免疫母细胞性T细胞淋巴瘤(AITCL)等相鉴别。①与NLPHL鉴别:与LRCHL组织学图像有时较相似。但NLPHL瘤细胞为爆米花细胞,泡状核,呈分叶状,免疫表型瘤细胞表达CD20、CD45,不表达CD30、CD15;而LRCHL瘤细胞为RS细胞,表达CD30、CD15,不表达CD20、CD45[8]。背景小淋巴细胞,NLPHL中CD57阳性细胞明显多于TiA-1阳性细胞,并围绕爆米花细胞呈花环状排列;而LRCHL中CD57阳性细胞明显稀少,而TiA-1阳性细胞丰富。②与ALCL鉴别:ALK-1阳性ALCL的肉瘤样型或HL样型与2级NSCHL组织学形态相似,两者肿瘤细胞CD30均阳性。但ALK-1阳性ALCL是T细胞淋巴瘤,肿瘤细胞表达CD2、ALK-1、EMA、TiA-1等,CD3有时阳性,CD15、Pax5阴性;而NSCHL的RS细胞CD15阳性,Pax5弱阳性,一般不表达T细胞抗原CD2、CD3及EMA、ALK-1、TiA-1。ALK-1阴性的ALCL如果T细胞标志物丢失,则与CHL鉴别较困难,但CHL的RS细胞Pax5弱阳性,如果EBER阳性则强烈提示CHL。有文献报道免疫标志CD83、MDC/CCL22、STAT3、TUBB2B、CAPN2对鉴别CHL与ALK-1阴性ALCL有帮助,CHL的RS细胞CD83、MDC/CCL22、STAT3、TUBB2B阳性,CAPN2阴性;而ALK-1阴性的ALCL细胞CD83、MDC/CCL22、STAT3与TUBB2B阴性,CAPN2阳性[9]。③与DLBCL鉴别:2级NSCHL细胞成片,极少数RS细胞可表达CD20,需与DLBCL鉴别。但NSCHL的CD15可阳性,Pax5弱阳性及CD20的少数细胞表达可协助鉴别,EBER可以阳性;而DLBCL细胞CD15阴性,Pax5多强阳性,EBER常阴性;组织学上DLBCL瘤细胞是免疫母细胞及中心母细胞,核仁不如NSCHL的RS细胞核仁红而大。当然,2级NSCHL细胞分布非常弥漫时,尚要考虑向DLBCL过渡。如果发生在纵隔部位,瘤细胞CD30、CD15、CD20、Pax5、CD45均强表达,还要考虑介于DLBCL与NSCHL之间的灰区淋巴瘤,必要时行基因检测以助诊断。④与AITCL鉴别:AITCL可见散在的RS样细胞及嗜酸性粒细胞且EBER阳性,但AITCL患者为中老年人,肿瘤细胞不是RS样细胞,而是T淋巴细胞,肿瘤细胞表达CXCL13、PD-1、CD10、bcl-6、CD3及CD4等,组织学上有大量增生的高内皮小静脉及滤泡树突网以及较特征的临床表现。⑤与转移癌鉴别:淋巴结转移癌的癌细胞核仁红而大,但转移癌的肿瘤细胞多位于淋巴窦内,核膜不规则,表达CK,不表达CD30、CD15等。
研究发现HL细胞株中NF-κB活性升高,而抑制其活性可使肿瘤细胞发生凋亡,提示NF-κB与HL的发生有关[10]。用激光显微切割技术获得单个CD30阳性的HRS细胞,在大约1/3的病例中可发现IκBα基因突变,主要是IκBα基因外显子的突变,造成IκBα蛋白的降解。进一步的研究发现,在EBV阳性者没有发现IκBα基因突变,而EBV阴性者存在IκBα基因突变[11]。目前的研究还没有发现特征性基因异常,所以,HL的发生可能是多基因、多因素共同调控的结果。
本组患者获得随访22例,死亡的5例患者中4例为52岁至83岁的NSCHL患者,提示年龄较大的NSCHL患者预后较差[12]。另外17例自诊断至随访截止存活7.5至11年。随着治疗方法的改进,CHL的5年生存率有了较大的提高,达到80%~100%,使得国际预后指数(IPS)失去了预后效能[13]。近年关于CHL研究的焦点是肿瘤的微环境及其在治疗效果中的作用。研究显示,CD163阳性巨噬细胞大于25%患者的预后较差,因此肿瘤浸润巨噬细胞定量可以作为额外的预后参数[14]–[15]。
目前CHL总体治愈率较高,已有相对成熟的治疗模式,ABVD、BEACOPP、Standford V等经典方案也在不断优化,研究致力于治愈率、生存率最大化与不良反应最小化的平衡。一些靶向药物也进入了临床试验,CHL治疗将进入靶向治疗、化疗和放疗优化组合的时代[16]。
Funding Statement
基金项目:安徽省自然科学基金青年项目(1608085QH207);安徽省教育厅科研基金(KJ2015B101BY);蚌埠医学院自然科学基金(BYKY1401ZD)
References
- 1.Swerdlow SH, Campo E, Lee Harris N, et al. World Health Organization classification of tumours of haematopoietic and lymphoid tissues [M] Lyon: IARC Press; 2008. pp. 321–334. [Google Scholar]
- 2.Jaffe ES, Harris NL, Vardiman JW, et al. Haematopathology[M] St. Louis: Elsevier; 2011. [Google Scholar]
- 3.李 小秋, 李 甘地, 高 子芬, et al. 中国淋巴瘤亚型分布: 国内多中心性病例10002例分析[J] 诊断学理论与实践. 2012;11(2):111–115. doi: 10.3969/j.issn.1671-2870.2012.02.006. [DOI] [Google Scholar]
- 4.陈 冰, 张 帆, 卢 林明, et al. 中国皖南地区728例恶性淋巴瘤的构成分析[J] 中国临床药理学与治疗学. 2013;18(4):388–393. [Google Scholar]
- 5.Aoki R, Karube K, Sugita Y, et al. Distribution of malignant lymphoma in Japan: analysis of 2260 cases, 2001–2006[J] Pathol Int. 2008;58(3):174–182. doi: 10.1111/j.1440-1827.2007.02207.x. [DOI] [PubMed] [Google Scholar]
- 6.Kushekhar K, van den Berg A, Nolte I, et al. Genetic associations in classical hodgkin lymphoma: a systematic review and insights into susceptibility mechanisms[J] Cancer Epidemiol Biomarkers Prev. 2014;23(12):2737–2747. doi: 10.1158/1055-9965.EPI-14-0683. [DOI] [PubMed] [Google Scholar]
- 7.Sabattini E, Bacci F, Sagramoso C, et al. WHO classification of tumours of haematopoietic and lymphoid tissues in 2008: an overview[J] Pathologica. 2010;102(3):83–87. [PubMed] [Google Scholar]
- 8.谷 从友, 曲 向东, 林 跃辉, et al. 免疫组化结果误判导致淋巴瘤误诊三例分析[J] 中华血液学杂志. 2012;33(1):20–24. doi: 10.3760/cma.j.issn.0253-2727.2012.01.005. [DOI] [PubMed] [Google Scholar]
- 9.Döring C, Hansmann ML, Agostinelli C, et al. A novel immuno-histochemical classifier to distinguish Hodgkin lymphoma from ALK anaplastic large cell lymphoma[J] Mod Pathol. 2014;27(10):1345–1354. doi: 10.1038/modpathol.2014.44. [DOI] [PubMed] [Google Scholar]
- 10.Liu X, Yu H, Yang W, et al. Mutations of NFKBIA in biopsy specimens from Hodgkin lymphoma[J] Cancer Genet Cytogenet. 2010;197(2):152–157. doi: 10.1016/j.cancergencyto.2009.11.005. [DOI] [PubMed] [Google Scholar]
- 11.Lake A, Shield LA, Cordano P, et al. Mutations of NFKBIA, encoding IkappaB alpha, are a recurrent finding in classical Hodgkin lymphoma but are not a unifying feature of non-EBV-associated cases[J] Int J Cancer. 2009;125(6):1334–1342. doi: 10.1002/ijc.24502. [DOI] [PubMed] [Google Scholar]
- 12.平 凌燕, 丁 宁, 时 云飞, et al. EBV感染后LMP-1阳性霍奇金淋巴瘤患者临床特点及预后分析[J] 中国实验血液学杂志. 2014;22(1):78–84. doi: 10.7534/j.issn.1009-2137.2014.01.017. [DOI] [PubMed] [Google Scholar]
- 13.Steidl C, Connors JM, Gascoyne RD. Molecular pathogenesis of Hodgkin lymphoma: increasing evidence of the importance of the microenvironment[J] J Clin Oncol. 2011;29:1812–1826. doi: 10.1200/JCO.2010.32.8401. [DOI] [PubMed] [Google Scholar]
- 14.Klein JL, Nguyen TT, Bien-Willner GA, et al. CD163 immuno-histochemistry is superior to CD68 in predicting outcome in classical Hodgkin lymphoma[J] Am J Clin Pathol. 2014;141(3):381–387. doi: 10.1309/AJCP61TLMXLSLJYS. [DOI] [PubMed] [Google Scholar]
- 15.黄 欣, 高 子芬. 儿童霍奇金淋巴瘤流行病学及病理学特点[J] 中国小儿血液与肿瘤杂志. 2014;19(3):117–119. doi: 10.3969/j.issn.1673-5323.2014.03.002. [DOI] [Google Scholar]
- 16.罗 颖婉, 佟 红艳. 霍奇金淋巴瘤诊治进展[J] 中国实用内科杂志. 2015;35(2):89–95. doi: 10.7504/nk2015010107. [DOI] [Google Scholar]


