Abstract
目的
明确西罗莫司体外对K562细胞系、获得性纯红细胞再生障碍(PRCA)患者骨髓单个核细胞向红细胞分化的影响。
方法
以K562细胞系及治疗前PRCA患者、正常对照的骨髓单个核细胞为研究对象,采用红系甲基纤维素培养基诱导其向红系分化,观察10、100、1 000 nmol/L西罗莫司对红细胞分化的影响。并进一步在PRCA原代细胞的培养体系中加入患者自身血清,观察各组红系爆式集落形成单位(BFU-E)的变化。
结果
不同浓度梯度西罗莫司对K562细胞系血红蛋白生成及红系表面抗原表达无明显影响;无论在正常对照还是PRCA患者骨髓单个核细胞中,西罗莫司处理组与未加药物的对照组比较,BFU-E差异无统计学意义;PRCA患者细胞加入自身血清后,其BFU-E较未加血清者明显减少[(76.40±22.48)个对(136.33±12.58)个,t=−4.329,P=0.001],且患者细胞+自身血清+1 000 nmol/L西罗莫司组BFU-E[(97.14±15.83)个]明显高于患者细胞+自身血清组(P=0.038)。
结论
西罗莫司可能无直接刺激红细胞生长和分化作用,但可以拮抗患者血清对红细胞的抑制作用,可能通过抑制血清中的成分而起作用。
Keywords: 纯红细胞再生障碍, 西罗莫司, K562细胞, 血清, 红系爆式集落形成单位
Abstract
Objective
To understand the effect of sirolimus on the erythropoiesis of K562 cell line and bone marrow cells from pure red cell aplasia (PRCA) patients and normal controls.
Methods
Different concentrations (10, 100, 1 000 nmol/L) of sirolimus were added to the K562 cell line or bone marrow cells from PRCA patients or normal controls and cultured 14 days for BFU-E formation. Meanwhile, sirolimus was also added to the serum treated PRCA bone marrow cells to cultivate for the same priod of time.
Results
Neither K562 cells, bone marrow cells from PRCA patients or normal controls showed any difference when sirolimus was added to the culture system for BFU-E. However, BFU-E formation decreased after serum was added in PRCA patients (76.40±22.48 vs 136.33±12.58, t=−4.329, P=0.001) and this suppression of BFU-E was partly corrected by 1 000 nmol/L sirolimus treatment (97.14±15.83 vs 76.40±22.48, P=0.038).
Conclusion
Sirolimus may modulate the suppression of erythropoiesis by serum instead of directly stimulate the growth of red blood cells in PRCA patients.
Keywords: Pure red cell aplasia, Sirolimus, K562 cells, Serum, Erythroid-burst forming unit
西罗莫司是一种mTOR通路抑制剂,可以抑制抗原诱导的T细胞增殖,用于预防肾移植后的排斥反应[1]–[2]。近年来多个研究显示西罗莫司治疗结节性硬化症及系统性红斑狼疮等自身免疫性疾病取得不错疗效[3]–[4]。在前期的临床工作中,我们发现西罗莫司可有效治疗难治性纯红细胞再生障碍(PRCA),且不良反应可耐受。Kaneko等[5]通过对人慢性髓性白血病细胞系K562细胞的研究发现,西罗莫司可通过红细胞表面肾素受体活化mTOR通路,进而促进血红蛋白表达。提示西罗莫司除了影响免疫功能外,还可促进红系祖细胞增殖及分化。但这一研究结论尚未在原代细胞体系中证实。本研究中,我们拟通过体外实验模拟西罗莫司对PRCA患者骨髓单个核细胞向红细胞分化的影响,初步探讨西罗莫司治疗PRCA的作用机制。
对象与方法
一、主要试剂
红系甲基纤维素培养基(MethoCult H4330)培养基和IMDM培养基(含2%胎牛血清)购自美国Stem Cell公司;人血型糖蛋白a(CD235a)-PE单抗购自美国Abcam公司;Ficoll淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;RPMI 1640细胞培养液、胎牛血清购自美国Gibco公司;PBS缓冲液购自杭州吉诺生物医药技术有限公司;DMSO及氯高铁血红素(Hemin)购自美国Sigma公司,西罗莫司原粉由华北制药有限公司提供。
二、研究对象
以4例PRCA患者及4名年龄性别匹配的健康供者骨髓标本为研究观察。4例患者均为原发PRCA,诊断年龄分别为35、40、52、67岁,男女各2例,诊断时间1~3个月,诊断时HGB分别为34、55、69、71 g/L。Ficoll淋巴细胞分离液分离单个核细胞,PBS洗涤后备用。患者及正常对照均签署知情同意书,本研究通过北京协和医院伦理审核。
K562细胞系由复旦大学上海医学院马端教授惠赠。在含10%胎牛血清的RPMI 1640培养基中,37 °C、5%CO2条件下培养。各细胞培养皿每日换液,每2 d传代1次,取对数生长期细胞用于实验。
三、实验方法
1.西罗莫司的配制:西罗莫司原粉经DMSO溶解、过滤,制备浓度为105 nmol/L母液。应用时以相应细胞培养基稀释为不同浓度梯度(10、100、1 000 nmol/L)。
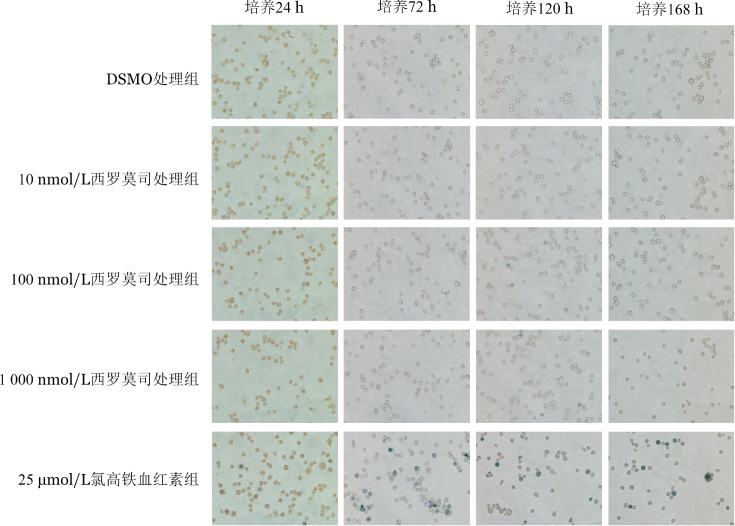
2.西罗莫司对于K562细胞血红蛋白生成的影响:调整K562细胞密度为3×104/ml,接种于96孔板,分别加入10、100、1 000 nmol/L的西罗莫司溶液,并设阴性对照(仅加入DMSO溶液)及阳性对照(仅加入25 µmol/L Hemin溶液)。在含2%胎牛血清的IMDM培养基中培养24、72、120、168 h离心收集各组细胞,无血清培养基洗涤3次,加入20 µl现配含0.5%过氧化氢联苯胺染色液染色,倒置显微镜下计数细胞。蓝色为表达血红蛋白的联苯胺阳性细胞,不着色的为阴性细胞,计算联苯胺阳性细胞率。实验设3个复孔。
3.流式细胞术检测西罗莫司对于K562细胞红系抗原表达的影响:分别取DMSO、不同浓度西罗莫司以及Hemin培养168 h的各组细胞,以1×PBS洗涤2遍;每管加入5 µl CD235a/GPA-PE,避光孵育20 min,未加入CD235a/GPA-PE的K562细胞组作为空白对照;离心,弃上清,PBS洗涤、重悬,上流式细胞仪检测红细胞抗原CD235a表达水平。实验设3个复管。
4.原代细胞红系集落培养:将患者骨髓单个核细胞分别接种于24孔板,每孔8×105个;分别进行如下比较:①患者细胞组与患者细胞+自身血清处理组比较;②患者细胞+DMSO组分别与患者细胞+10、100、1 000 nmol/L西罗莫司处理组比较;③患者细胞+自身血清+DMSO组分别与患者细胞+自身血清+10、100、1 000 nmol/L西罗莫司处理组比较。每组样本设3个复孔,结果取平均数。加入H4330培养基,在37 °C、5% CO2、湿度>95%的培养箱中进行培养。培养14 d将24孔板置于倒置显微镜下,计算红系爆式集落形成单位(BFU-E)并拍照,定义有核红细胞数>40个为BFU-E。实验至少重复3次。
四、统计学处理
采用SPSS 22.0及GraphPad Prism 5.0进行统计分析及统计图绘制。符合正态分布的数据,以均数±标准差表示,两组间采用独立样本的t检验,多组间比较采用单因素方差分析及LSD组间比较。双侧P<0.05为差异有统计学意义。
结果
1.不同浓度西罗莫司作用后对K562细胞血红蛋白生成影响不显著(图1):在不同浓度西罗莫司作用下,K562细胞联苯胺染色阴性,仅100、1 000 nmol/L西罗莫司培养120 h时有极少细胞联苯胺染色阳性(分别为4/108和3/107)。而Hemin作为诱导剂作用下,K562细胞联苯胺染色阳性细胞率逐渐上升,培养24、72、120、168 h阳性细胞率分别达6%、20%、28%、35%。因此,在经典诱导剂Hemin作用下,K562细胞可向红细胞分化,形成联苯胺可染的血红蛋白。而10、100、1 000 nmol/L的西罗莫司培养不同时间,均无促K562细胞向红系分化的作用。
图1. 联苯胺染色法检测不同诱导剂处理不同时间对K562细胞血红蛋白生成的影响(中倍).
2.不同浓度西罗莫司对K562细胞红系表面抗原表达影响不显著:不同诱导剂处理168 h后,相比DMSO组[(25.23±0.90)%],10、100、1 000 nmol/L西罗莫司组中CD235a阳性细胞比例分别为(27.27±3.53)%、(29.00±1.57)%、(29.10±2.85)%,均未见明显增多;而阳性对照Hemin诱导后,CD235a阳性细胞比例[(72.20±5.50)%]明显增多。
3.PRCA患者的骨髓单个核细胞加入自身血清后BFU-E显著下降:PRCA患者中,比较加入自身血清组与患者细胞组(未加入血清)培养14 d的BFU-E,加入自身血清组BFU-E显著少于患者细胞组[(74.0±14.93)个对(136.33±12.58)个,t=5.529,P=0.005]。提示在PRCA患者的培养体系中,加入自身血清可抑制BFU-E的生长。
4.西罗莫司对PRCA患者骨髓单个核细胞BFU-E生长无影响:PRCA患者细胞+DMSO组培养14 d BFU-E为(136.33±12.58)个,而PRCA患者细胞+10、100、1 000 nmol/L西罗莫司培养14 d BFU-E分别为(141.33±10.50)、(140.00±5.57)、(136.70±12.66)个,组间比较差异无统计学意义(F=0.158,P=0.922)。提示在PRCA患者的培养体系中仅加入不同浓度西罗莫司对BFU-E的生长无明显影响。
5.血清+100、1 000 nmol/L西罗莫司能恢复PRCA患者BFU-E生长:PRCA患者细胞+自身血清+DMSO组BFU-E为(76.40±22.48)个。PRCA患者细胞+自身血清+10、100、1 000 nmol/L西罗莫司组BFU-E分别为(86.5±21.66)、(89.71±12.83)、(97.14±15.83)个,均高于自身血清+DMSO组。进一步两两比较显示,自身血清+1 000 nmol/L西罗莫司组与自身血清+DMSO组相比差异有统计学意义(P=0.038);但自身血清+10 nmol/L及100 noml/L西罗莫司组与自身血清+DMSO组相比差异无统计学意义(P值分别为0.253及0.173)(图2)。
图2. 自身血清加不同浓度西罗莫司对纯红细胞再生障碍BFU-E生长的影响.
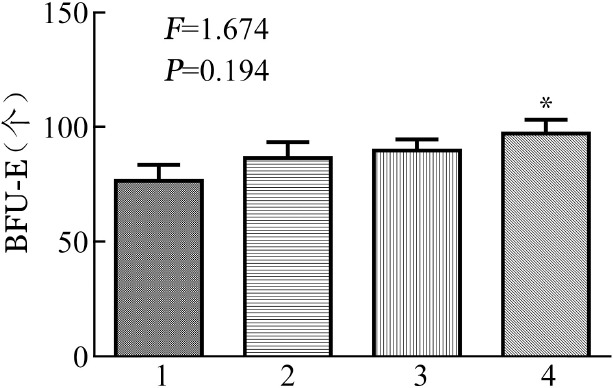
1:DMSO组;2~4分别为10、100、1 000 nmol/L西罗莫司处理组;与DMSO组比较,*P<0.05
讨论
K562细胞是慢性髓性白血病细胞系,具有在Hemin诱导下向红细胞分化、在佛波酯(PMA)诱导下向巨核细胞分化的特点。文献报道西罗莫司可刺激红细胞祖细胞向下阶段分化[5],并在K562细胞实验得到证实。
在本研究中,我们首先将西罗莫司体外作用于K562细胞,观察其对K562细胞血红蛋白生成以及CD235a表达的影响。结果显示,不同浓度西罗莫司作用下,K562细胞血红蛋白生成量并未增加,而经典诱导剂Hemin可明显上调K562细胞血红蛋白的表达量,并随作用时间增加逐渐上升。同时,西罗莫司并未诱导K562细胞CD235a阳性细胞比例增加。提示西罗莫司并不能促进K562细胞向红细胞分化。
在原代细胞中,无论是正常对照还是PRCA患者,体外加入西罗莫司后,对红细胞集落的形成均无显著的影响,这与在K562细胞系中的研究结果一致。Kaneko等[5]研究显示西罗莫司可以通过红系祖细胞表面的肾素原受体[(P)RR]促进血红蛋白生成,研究者认为西罗莫司通过与相应受体结合,对mTOR通路产生抑制,从而使v-ATPase活性下降,该过程会刺激细胞使细胞表面高表达(P)RR,而(P)RR高表达可促进细胞向红系分化,并合成血红素和血红蛋白,最终诱导K562细胞系向红系分化。但这一机制是双相调节,因为(P)RR的表达同时抑制了ALAS2 mRNA的水平,后者同样参与了红细胞生成的调控。因此,(P)RR是红系造血的双相调控因子。故西罗莫司对红细胞造血的作用可能也是双相的。在另一研究中,在西罗莫司处理的镰状红细胞性贫血(SCD)的小鼠中,可以看到红细胞计数、血红蛋白和网织红细胞计数的升高,甚至可以看到脾脏缩小、肝脏铁沉积和血栓事件减少[6]。究竟是西罗莫司直接的刺激作用,还是参与了SCD的免疫调节过程,目前尚未可知。
虽然在原代细胞中,我们并未观察到西罗莫司对红细胞集落直接的刺激作用。然而,在患者培养体系中加入自身血清可以抑制红细胞集落的形成,而这一抑制作用可以被1 000 nmol/L的西罗莫司缓解。提示西罗莫司可能通过抑制患者血清中的某种成分,解除了血清对造血的抑制。Dao等[7]研究显示环孢素A可以解除对Treg的抑制,达到治疗自身免疫性疾病(包括PRCA)的目的。而在原发免疫性血小板减少症、自身免疫性溶血性贫血等疾病的研究中,西罗莫司作为免疫调节剂可以使治疗有效的患者Treg的表达升高[8]–[9],我们推测,西罗莫司可能通过上调PRCA患者的Treg水平达到恢复造血的作用。事实上,我们已经观察到西罗莫司治疗有效的病例中Treg细胞水平上调[10]。
本研究提示,西罗莫司能够治疗PRCA,可能不是通过直接的干细胞刺激,而是通过调节患者的免疫反应,解除免疫因素对干细胞的抑制而实现的。究竟西罗莫司抑制了哪些血清中的成分而终止了PRCA患者的免疫异常,值得进一步研究。
Funding Statement
基金项目:中国医学科学院医学与健康科技创新工程(2016-12M-3-004)
Fund program: The Chinese Academy of Medical Sciences Innovation Fund for Medical Sciences (2016-I2M-3-004)
References
- 1.Collier DS, Calne RY, Pollard SG, et al. Rapamycin in experimental renal allografts in primates[J] Transplant Proc. 1991;23(4):2246–2247. [PubMed] [Google Scholar]
- 2.Calne RY, Collier DS, Lim S, et al. Rapamycin for immunosuppression in organ allografting[J] Lancet. 1989;2(8656):227. doi: 10.1016/s0140-6736(89)90417-0. [DOI] [PubMed] [Google Scholar]
- 3.Cejka D, Hayer S, Niederreiter B, et al. Mammalian target of rapamycin signaling is crucial for joint destruction in experimental arthritis and is activated in osteoclasts from patients with rheumatoid arthritis[J] Arthritis Rheum. 2010;62(8):2294–2302. doi: 10.1002/art.27504. [DOI] [PubMed] [Google Scholar]
- 4.Fernandez D, Bonilla E, Mirza N, et al. Rapamycin reduces disease activity and normalizes T cell activation-induced calcium fluxing in patients with systemic lupus erythematosus[J] Arthritis Rheum. 2006;54(9):2983–2988. doi: 10.1002/art.22085. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Kaneko K, Ohba K, Hirose T, et al. Expression of (pro) renin receptor during rapamycin-induced erythropoiesis in K562 erythroleukemia cells and its possible dual actions on erythropoiesis[J] Tohoku J Exp Med. 2017;241(1):35–43. doi: 10.1620/tjem.241.35. [DOI] [PubMed] [Google Scholar]
- 6.Wang J, Tran J, Wang H, et al. mTOR Inhibition improves anaemia and reduces organ damage in a murine model of sickle cell disease[J] Br J Haematol. 2016;174(3):461–469. doi: 10.1111/bjh.14057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Dao AT, Yamazaki H, Takamatsu H, et al. Cyclosporine restores hematopoietic function by compensating for decreased Tregs in patients with pure red cell aplasia and acquired aplastic anemia[J] Ann Hematol. 2016;95(5):771–781. doi: 10.1007/s00277-016-2629-7. [DOI] [PubMed] [Google Scholar]
- 8.Li J, Wang Z, Dai L, et al. Effects of rapamycin combined with low dose prednisone in patients with chronic immune thrombocytopenia[J] Clin Dev Immunol. 2013;2013:548085. doi: 10.1155/2013/548085. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Bride KL, Vincent T, Smith-Whitley K, et al. Sirolimus is effective in relapsed/refractory autoimmune cytopenias: results of a prospective multi-institutional trial[J] Blood. 2016;127(1):17–28. doi: 10.1182/blood-2015-07-657981. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.杜 亚丽. 西罗莫司治疗难治性纯红细胞再生障碍性贫血的临床疗效及其作用机制的体外探索性研究[D] 北京协和医学院中国医学科学院, 北京协和医学院, 中国医学科学院,清华大学医学部; 2017. [Google Scholar]