Abstract
目的
探讨乌索酸对T细胞淋巴瘤细胞株Hut-78细胞体外增殖的影响及其作用机制。
方法
采用MTT法观察不同浓度(10、20、40、80 µmol/L)乌索酸作用不同时间(4、12、24、48、72 h)对Hut-78细胞增殖的抑制作用,并采用流式细胞术分析其早期凋亡的情况。采用免疫印迹法检测乌索酸作用后Hut-78细胞细胞核因子-κB(NF-κB)p65、p50、p52和p100亚基蛋白,以及caspase-8、3、9蛋白表达变化,采用逆转录PCR法检测血管内皮生长因子(VEGF)和环氧合酶-2(COX-2)mRNA表达水平。
结果
与不加药对照组比较,不同浓度的乌索酸作用组Hut-78细胞的增殖均受抑制(P值均<0.05);Annexin Ⅴ+/PI−细胞比例均升高(P值均<0.05);经10、20、40、80 µmol/L乌索酸处理Hut-78细胞72 h后,Hut-78细胞NF-κB p65、p50蛋白和VEGF、COX-2 mRNA表达水平均下降(P值均<0.05),caspase-8、3、9蛋白表达均增加(P值均<0.05);NF-κB p100、p52蛋白表达差异均无统计学意义(P值均>0.05)。上述作用均呈剂量和(或)时间依赖性(P值均<0.05)。
结论
乌索酸抑制Hut-78细胞增殖,作用可能与促其凋亡有关,经过死亡受体和线粒体途径完成;影响NF-κB经典信号路径可能是其机制之一,VEGF和COX-2可能也参与其中。
Keywords: 淋巴瘤,T细胞,皮肤, NF-κB, 血管内皮生长因子A, 乌索酸
Abstract
Objective
To investigate the effects of ursolic acid on T cell lymphoma cell lines-Hut-78 cells and its mechanism.
Methods
Inhibition of Hut-78 cells proliferation by ursolic acid at different concentration (10, 20, 40 and 80 µmol/L) for different incubation time (4, 12, 24, 48 and 72 h) was examined by MTT method, and early apoptosis by flow cytometry. The protein expressions of p65, p50, p52 and p100, and caspase-8, caspase-3 and caspase-9 were detected by Western blot. VEGF and COX-2 mRNA expressions were measured by reverse transcription polymerase chain reaction (RT-PCR).
Results
It was showed that ursolic acid inhibited proliferation of Hut-78 cells (P<0.05). Apoptosis of Hut-78 cells was induced by 10, 20, 40 and 80 µmol/L ursolic acid treatment (P<0.01). Likewise, expression of p65 and p50 proteins were down-regulated by ursolic acid treatment (10, 20, 40 and 80 µmol/L) (P<0.01), but there was no significant change in the expression of p52 and p100. Moreover, ursolic acid could up-regulate expression of caspase-8, caspase-3 and caspase-9 protein (P<0.01). RT-PCR examination showed that VEGF and COX-2 mRNA expression decreased by ursolic acid treatment.
Conclusion
Inhibition of Hut-78 cells proliferation may be related to ursolic acid induced apoptosis through h death receptors and mitochondrial pathways. NF-κB classical signal pathway may be one of its mechanisms, and VEGF and cox-2 may also be involved.
Keywords: Lymphoma, T-cell, cutaneous; NF-kappa B; Vascular endothelial growth factor A; Ursolic acid
T细胞淋巴瘤是一组异质性淋巴组织肿瘤,占非霍奇金淋巴瘤(NHL)的10%~15%[1]。当前T细胞淋巴瘤的治疗方案主要是以B细胞淋巴瘤治疗方案为基础的高强度化疗和造血干细胞移植,但大部分类型的患者疗效不佳,中危以上患者的5年生存率<20%[2]。因而探索新的药物和治疗机制是改善T细胞淋巴瘤患者疗效和预后的有效途径。乌索酸是多种天然药物的有效成分,具有明显的抗血液系统恶性肿瘤的活性,体外研究发现能抑制白血病和淋巴瘤细胞的增殖,诱导细胞分化,促进凋亡[3]–[4]。Zeng等[5]发现乌索酸有抑制T细胞活性和增殖的作用,包括抑制CD69、CD25和CD71的表达。在本研究中,我们通过观察乌索酸对T细胞淋巴瘤细胞株Hut-78细胞体外增殖及其相关蛋白表达的影响,旨在探索其对T细胞淋巴瘤细胞可能的作用机制。
材料和方法
1.主要材料:T细胞淋巴瘤细胞株Hut-78细胞来源于中国科学院上海生命科学研究院生物化学与细胞生物学研究所。乌索酸、四甲基偶氮唑盐(MTT)、β-actin鼠源单克隆抗体(单抗)购自美国Sigma公司。Annexin Ⅴ-Flous Stain Kit为德国Boehringer Mannheim公司产品。兔抗人caspase-3、8、9单抗为美国Cell Singnalig Technology公司产品。辣根过氧化物酶标记的山羊抗兔IgG和NF-κB p65、p50、p100、p52亚单位鼠源单抗购自美国Santa Cruz公司。cDNA第一链合成试剂盒和PCR扩增用Taq酶均为深圳晶美生物工程有限公司产品。
2.细胞培养:Hut-78细胞在含10%特级胎牛血清的RPMI1 640培养液中,于5% CO2、37 °C、饱和湿度培养箱培养中,细胞悬浮生长。
3.MTT法绘制细胞增殖曲线:将Hut-78细胞密度调整为5×104/ml,接种于96孔培养板。每组加入不同浓度乌索酸,使其终浓度为10、20、40和80 µmol/L),设不加药对照组。培养4、12、24、48、72 h后,分别加入20 µl MTT(5 g/L)和二甲基亚砜(DMSO)。在酶标仪上读取吸光度(A)值,检测波长570 nm,参考波长630 nm。每隔24 h测量一个点,每个点设5个复孔。绘制细胞增殖曲线。
4.流式细胞术检测凋亡早期细胞:收集以上不同浓度乌索酸作用4、24、48和72 h的Hut-78细胞以及同期对照组Hut-78细胞悬液,离心,去上清;调整细胞密度为(2~5)×105/ml;每份加入195 µl缓冲液及5 µl FIFC-Annexin Ⅴ,避光孵育10 min,离心,去上清;加入190 µl缓冲液及10 µl PI,避光孵育10 min,上流式细胞仪(美国BD公司产品)检测Annexin Ⅴ阳性细胞率,计算细胞早期凋亡率。每次实验设5个复孔,实验重复3次。
5.Western blot法检测蛋白表达水平:①检测NF-κB亚单位蛋白:收集对照组及不同浓度乌索酸作用72 h的各组Hut-78细胞,细胞裂解后取40 g蛋白,行SDS-PAGE凝胶电泳后转移至聚偏氟乙烯膜(PVDF),加脱脂奶粉溶液封闭;加入一抗(1∶1 000稀释),4 °C孵育过夜;用缓冲液洗膜后加入辣根过氧化物酶标记的二抗(1∶3 000稀释),37 °C孵育1 h;加入增强化学发光法(ECL)发光试剂,自显影后采用ECL系统(购自上海碧云天生物技术有限公司)进行照相、观察,采用美国BIO-RAD公司的Quantitive one软件对结果进行分析。用积分密度比值表示蛋白的相对含量。②检测caspase-3、8、9蛋白:细胞收集步骤同上,细胞裂解后取15 g蛋白,行SDS-PAGE凝胶电泳后转移至PVDF膜,脱脂奶粉溶液封闭;加入一抗(1∶300稀释),4 °C孵育过夜;用缓冲液洗膜后加入辣根过氧化物酶标记的山羊抗兔IgG(1∶1 000稀释),ECL、显影、照相及结果分析步骤同上。每次实验设5个复孔,实验重复3次。
6.RT-PCR法检测血管内皮生长因子(VEGF)和环氧合酶-2(COX-2)mRNA水平:收集对照组及不同浓度乌索酸作用72 h的各组Hut-78细胞,TRIzol法提取细胞总RNA,按试剂盒说明书进行操作合成cDNA。引物序列:COX-2 (232 bp):上游引物5′-TAGAACCCCACTCAAACACAG-3′,下游引物5′-TCATCAGGCACAGGAGGAAG-3′;VEGF (146 bp):上游引物5′-TTGCTGCTCTACCTC-CACC-3′,下游引物5′-AAGATGTCCACCAGG-GTCTC-3′;β-actin (591 bp):上游引物5′-AAG-TACTCCGTGTGGATCGG-3′,下游引物5′-ATCC-TATCACCTCCCCTGTG-3′。取逆转录产物2 µl,加入10 pmol/ml上、下游产物各2 µl,10 mmol/L dNTP mix 0.8 µl,10 ×Taq缓冲液5 µl,25 U/µl Taq酶0.5 µl和25 mmol/L MgCl2 3 µl。95 °C预变性5 min,95 °C变性45 s、54 °C退火45 s、72 °C延伸90 s,30个循环,最后延伸72 °C 10 min。取PCR产物5 µl加样,行18 g/L琼脂糖凝胶电泳。采用四星图像分析仪(SX-100 WVPB310,上海四星生物技术实业有限公司产品)摄像,PCR条带的密度采用scion image图像分析软件进行半定量分析。以目的基因与β-actin的灰度值比值表示目的基因的相对表达水平。每次实验设3个复孔,实验重复3次。
7.统计学处理:采用Stata 11.0软件进行统计学分析。实验数据以均数±标准差表示,组间采用配对t检验比较,不同时间和浓度数据采用两因素方差分析比较。P<0.05为差异有统计学意义。
结果
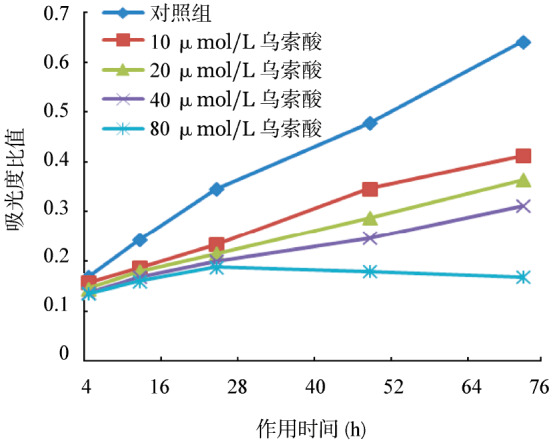
1.乌索酸对Hut-78细胞增殖的影响:与对照组相比,10、20、40、80 µmol/L乌索酸作用不同时间后,Hut-78细胞生长受到不同程度的抑制(P值均< 0.05),且呈剂量和时间依赖性(P值均<0.01)(图1)。
图1. MTT法检测不同浓度乌索酸作用不同时间(4、12、24、48、72 h)对Hut-78细胞增殖的影响(各组和对照组比较,P<0.05;每个点设5个复孔).
2.乌索酸对Hut-78细胞凋亡的影响:流式细胞术检测结果显示,与对照组相比,10、20、40、80 µmol/L乌索酸作用4、24、48、72 h后,Hut-78细胞Annexin Ⅴ+/PI−细胞比例升高(P值均<0.05),呈剂量和时间依赖性(P值均<0.01)(表1)。
表1. Hut-78细胞经不同浓度乌索酸处理不同时间后Annexin Ⅴ+/PI–细胞比例比较(%,x±s).
| 组别 | 作用时间(h) |
|||
| 4 | 24 | 48 | 72 | |
| 对照组 | 9.65±1.87 | 9.82±3.71 | 10.23±4.91 | 11.41±0.81 |
| 乌索酸处理组 | ||||
| 10 µmol/L | 13.25±5.45a | 15.56±4.91a | 18.23±7.81a | 21.68±3.07a |
| 20 µmol/L | 15.34±4.89a | 22.65±4.34a | 26.43±0.98a | 32.71±4.06a |
| 40 µmol/L | 18.45±9.24a | 25.21±5.91a | 29.57±6.21a | 38.90±2.52a |
| 80 µmol/L | 19.56±3.77a | 29.43±5.81a | 32.14±7.65a | 47.91±1.51 a |
注:与对照组比较,aP<0.05;每次实验设5个复孔,实验重复3次
3.乌索酸对Hut-78细胞蛋白表达的影响:Western blot法检测结果显示,与对照组相比,10、20、40、80 µmol/L乌索酸处理72 h后,Hut-78细胞NF-κB p65和p50蛋白表达下降(P值均<0.05),且与剂量有关(P值均<0.05);NF-κB p100蛋白和p52蛋白表达下降不明显(P值均>0.05);caspase-3、8、9蛋白表达增加(P值均<0.01),且与剂量有关(P值均<0.05)(表2,图2、3)。
表2. Hut-78细胞经不同浓度乌索酸处理72 h后蛋白表达水平比较(积分密度比值,x±s).
| 组别 | NF-κB |
caspase-3 | caspase-8 | caspase-9 | |||
| p65 | p50 | p100 | p52 | ||||
| 对照组 | 0.46±0.04 | 0.83±0.06 | 2.31±0.12 | 1.02±0.10 | 0.21±0.13 | 0.11±0.12 | 0.16±0.03 |
| 乌索酸处理组 | |||||||
| 10 µmol/L | 0.34±0.05a | 0.66±0.06a | 2.31±0.10 | 1.07±0.13 | 0.39±0.03b | 0.36±0.03b | 0.33±0.02b |
| 20 µmol/L | 0.21±0.03a | 0.48±0.05a | 2.29±0.18 | 1.11±0.10 | 052±0.05b | 0.53±0.05b | 0.51±0.12b |
| 40 µmol/L | 0.11±0.02a | 0.28±0.04a | 2.41±0.09 | 1.12±0.19 | 0.68±0.03b | 0.69±0.14b | 0.73±0.06b |
| 80 µmol/L | 0.04±0.02a | 0.11±0.03a | 2.38±0.52 | 1.02±0.17 | 0.88±0.06b | 0.86±0.06b | 0.92±0.06b |
注:与对照组比较,aP<0.05,bP<0.01;每次实验设5个复孔,实验重复3次
图2. Western blot法检测乌索酸作用72 h后Hut-78细胞NF-κB蛋白的表达.
1:对照组;2~5:分别为10、20、40、80 µmol/L乌索酸作用组
图3. Western blot法检测乌索酸作用72 h后Hut-78细胞caspase蛋白的表达.
1:对照组;2~5:分别为10、20、40、80 µmol/L乌索酸作用组
4.乌索酸对Hut-78细胞VEGF和COX-2 mRNA表达水平的影响:RT-PCR法检测结果显示,与对照组比较,10、20、40、80 µmol/L乌索酸处理72 h后,Hut-78细胞VEGF和COX-2 mRNA表达水平均下降,差异有统计学意义(P值均<0.01),且与剂量有关(VEGF:P<0.01,COX-2:P<0.05)(表3)。
表3. Hut-78细胞经不同浓度乌索酸处理72 h后VEGF和COX-2 mRNA表达水平比较(灰度值比值,x±s).
| 组别 | VEGF mRNA | COX-2 mRNA |
| 对照组 | 1.14±0.06 | 1.24±0.10 |
| 乌索酸处理组 | ||
| 10 µmol/L | 0.83±0.06a | 0.88±0.06a |
| 20 µmol/L | 0.58±0.03a | 0.56±0.05a |
| 40 µmol/L | 0.39±0.05a | 0.29±0.07a |
| 80 µmol/L | 0.13±0.04a | 0.08±0.04a |
注:VEGF:血管内皮生长因子;COX-2:环氧化酶-2;与对照组比较,aP<0.01;每次实验设3个复孔,实验重复3次
讨论
乌索酸又名熊果酸,属于五环三萜类化合物,广泛存在于山楂、熊果、陆英等多种植物中,有明显的抗血液系统恶性肿瘤的活性,能有效地抑制Burkitt淋巴瘤细胞株P3HR1细胞及慢性髓性白血病细胞株K562细胞的增殖[3]。李杰等[4]研究发现乌索酸能够减弱人淋巴瘤细胞株Jurkat细胞活性,同时还能诱导细胞膜不对称缺失、DNA断裂和核浓缩。另外乌索酸还能诱导单核白血病细胞株THP-1细胞分化,CD11b和CD14表达增多,细胞向成熟巨噬细胞分化[6]。Zeng等[5]发现乌索酸可能主要是通过NF-κB途径抑制T细胞的活力和增生。多项研究提示乌索酸有抑制血液肿瘤的作用,但对T细胞淋巴瘤及其机制研究较少。我们通过观察乌索酸对T细胞淋巴瘤细胞株Hut-78细胞的作用,研究其抑制T细胞淋巴瘤可能的作用机制和途径,尝试为T细胞淋巴瘤患者提供新的治疗方法。
NF-κB是一类具有多向转录调节作用的核蛋白因子,在免疫、炎症、氧化应激、细胞增殖、细胞凋亡等生理、病理过程中发挥作用。其中与细胞凋亡的关系尤为密切,其参与多种凋亡相关基因的转录调控,具有抑制细胞凋亡及促进细胞凋亡的双向作用[7]。而凋亡过程的紊乱,与许多肿瘤的发生有直接或间接的关系[8]。目前,人们已发现细胞内NF-κB家族由多个成员组成,包括p65 (RelA)、p50/p105 (NF-κB1)、p52/p100 (NF-κB2)、RelB和c-Rel,参与经典途径及旁路途经等激活[9]。在研究中我们发现乌索酸下调Hut-78细胞p65和p50表达,p52和p100下降不明显,提示其促凋亡作用机制可能是通过影响NF-κB经典途径完成。这在以往的研究中很少涉及。
NF-κB抗细胞凋亡是一个涉及多个信号通路的复杂过程,也经常通过诱导或上调抗凋亡基因的表达实现,这些抗凋亡基因的表达产物通过抑制细胞凋亡的死亡受体途径或线粒体途径发挥作用[10]。近年来的研究普遍认为caspase-2、8、9和10参与凋亡的起始,其中caspase-8主要参与外源性死亡受体凋亡途径,而caspase-9主要参与内源性线粒体凋亡途径。caspase-3是凋亡最重要的执行者[11]。我们的研究结果显示乌索酸通过死亡受体途径和线粒体途径诱导T细胞淋巴瘤细胞的凋亡。
VEGF对肿瘤血管的生成、增殖和迁移发挥着多方面的作用,下调VEGF会抑制血管新生和协同其他因素促进细胞凋亡[12];COX-2的高表达通过促进新生血管的形成及帮助肿瘤细胞逃逸机体免疫监视等多种作用促进肿瘤的发生及发展,下调COX-2能引起Bcl-2表达减弱和自杀相关因子(Fas)表达增强,促进肿瘤细胞凋亡[13]。我们的研究结果提示乌索酸能降低VEGF和COX-2的表达,可能与T细胞淋巴瘤细胞的凋亡有关。
综上,我们的研究结果提示,乌索酸是通过外源性和内源性两种途径诱导Hut-78细胞凋亡,影响NF-κB经典信号路径可能是其中的机制之一;另外降低VEGF和COX-2的表达可能协同或参与其中。
Funding Statement
基金项目:国家自然科学基金青年基金(81101786);江苏省“六大人才高峰”计划(2011-ws-062)
References
- 1.Vose J, Armitage J, Weisenburger D, et al. International peripheral T-cell and natural killer/T-cell lymphoma study: pathology findings and clinical outcomes[J] J Clin Oncol. 2008;26(25):4124–4130. doi: 10.1200/JCO.2008.16.4558. [DOI] [PubMed] [Google Scholar]
- 2.Weisenburger DD, Savage KJ, Harris NL, et al. Peripheral T-cell lymphoma, not otherwise specified: a report of 340 cases from the International Peripheral T-cell Lymphoma Project[J] Blood. 2011;117(12):3402–3408. doi: 10.1182/blood-2010-09-310342. [DOI] [PubMed] [Google Scholar]
- 3.Chiang LC, Chiang W, Chang MY, et al. Antileukemic activity of selected natural products in Taiwan[J] Am J Chin Med. 2003;31(1):37–46. doi: 10.1142/S0192415X03000825. [DOI] [PubMed] [Google Scholar]
- 4.李 杰, 许 良中, 朱 伟萍, et al. 熊果酸与齐墩果酸体外抗Jurkat淋巴瘤细胞的研究[J] 中国癌症杂志. 1999;9(5-6):395–397. [Google Scholar]
- 5.Zeng G, Chen J, Liang QH, et al. Ursolic acid inhibits T-cell activation through modulating nuclear factor-κ B signaling[J] Chin J Integr Med. 2012;18(1):34–39. doi: 10.1007/s11655-011-0858-0. [DOI] [PubMed] [Google Scholar]
- 6.张 婷, 沈 晶, 任 天年, et al. 乌索酸诱导人单核细胞白血病胞株THP-1分化的研究[J] 中国医科大学学报. 2010;41(6):572–576. [Google Scholar]
- 7.Dutta J, Fan Y, Gupta N, et al. Current insights into the regulation of programmed cell death by NF-kappaB[J] Oncogene. 2006;25(51):6800–6816. doi: 10.1038/sj.onc.1209938. [DOI] [PubMed] [Google Scholar]
- 8.Thompson CB. Apoptosis in the pathogenesis and treatment of disease[J] Science. 1995;267(5203):1456–1462. doi: 10.1126/science.7878464. [DOI] [PubMed] [Google Scholar]
- 9.Luo JL, Kamata H, Karin M. IKK/NF-kappaB signaling: balancing life and death—a new approach to cancer therapy[J] J Clin Invest. 2005;115(10):2625–2632. doi: 10.1172/JCI26322. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kucharczak J, Simmons MJ, Fan Y, et al. To be, or not to be: NF-kappaB is the answer—role of Rel/NF-kappaB in the regulation of apoptosis[J] Oncogene. 2003;22(56):8961–8982. doi: 10.1038/sj.onc.1207230. [DOI] [PubMed] [Google Scholar]
- 11.Mazumder S, Plesca D, Almasan A. Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[J] Methods Mol Biol. 2008;414:13–21. doi: 10.1007/978-1-59745-339-4_2. [DOI] [PubMed] [Google Scholar]
- 12.Lázár-Molnár E, Hegyesi H, Tóth S, et al. Autocrine and paracrine regulation by cytokines and growth factors in melanoma[J] Cytokine. 2000;12(6):547–554. doi: 10.1006/cyto.1999.0614. [DOI] [PubMed] [Google Scholar]
- 13.Taketo MM. Cyclooxygenase-2 inhibitors in tumorigenesis (Part II)[J] J Natl Cancer Inst. 1998;90(21):1609–1620. doi: 10.1093/jnci/90.21.1609. [DOI] [PubMed] [Google Scholar]




