Abstract
目的
评价地西他滨桥接异基因造血干细胞移植(allo-HSCT)治疗骨髓增生异常综合征(MDS)的疗效及安全性。
方法
回顾性分析2010年7月至2013年12月于苏州大学附属第一医院血液科接受allo-HSCT的MDS患者的临床特征及疗效,随机抽取25例接受地西他滨桥接allo-HSCT的MDS患者为桥接组,以同期33例未接受地西他滨行allo-HSCT的MDS患者为对照组,观察患者疗效、总生存(OS)及移植物抗宿主病(GVHD)发生情况。
结果
桥接组患者移植前骨髓完全缓解率为64.0%(25例中16例),明显高于对照组的15.1%(33例中5例),差异有统计学意义(P<0.05);早期移植相关死亡率低于对照组(4.0%对18.2%),但差异无统计学意义(P=0.106)。桥接组移植相关死亡率及2年OS率分别为12.0%及83.0%,与对照组的30.3%及59.0%比较差异均有统计学意义(P值均<0.05)。桥接组14例患者发生急性GVHD(aGVHD),其中Ⅰ度7例、Ⅱ度3例、Ⅲ度4例;对照组16例患者发生aGVHD,其中Ⅰ度7例、Ⅱ度8例、Ⅲ度1例。
结论
地西他滨桥接allo-HSCT治疗MDS安全且有效。
Keywords: 骨髓增生异常综合征, 地西他滨, 造血干细胞移植, 治疗结果
Abstract
Objective
To evaluate the efficacy of decitabine (DAC) bridging therapy followed by allogeneic hematopoietic stem cell transplantation (allo-HSCT) in patients with myelodysplastic syndrome (MDS).
Methods
The clinical characteristics and curative effect of MDS patients who received allo-HSCT from 2010 July to 2013 December were retrospectively analyzed. Of them, 25 MDS patients who received decitabine bridging allo-HSCT were randomly selected (referred to as the bridging group), while at the same time another 33 MDS patients who did not receive decitabine for allo-HSCT in MDS were also randomly selected as control group. The effect of decitabine bridging allo-HSCT on the patients' survival and occurrence of graft versus host disease (GVHD) was analyzed.
Results
With decitabine bridge therapy, 64.0% patients (16/25) achieved marrow complete remission before allo-HSCT, while the control group was only 15.1% (5/33,P<0.05). Decitabine bridging group of early transplant-related mortality was lower than that of the control group (4.0% vs 18.2%), but the difference was not statistically significant (P=0.106). Up to follow-up deadline, the mortality of decitabine bridging group was 12.0%, while that of the control group was 30.3% (P<0.05). The 2-year OS of decitabine bridging group was 83.0%, while that of the control group was 59.0% (P<0.05). Of the 14 patients in decitabine bridging group with aGVHD, 7 was grade Ⅰ aGVHD, 3 grade Ⅱ and 4 grade Ⅲ. Of the 16 patients in control group with aGVHD, 7 was grade Ⅰ aGVHD, 8 grade Ⅱ and 1 grade Ⅲ.
Conclusion
Decitabine bridging therapy followed by allo-HSCT in the treatment of MDS is safe and effective.
Keywords: Myelodysplastic syndrome, Decitabine, Hematopoietic stem cell transplantation, Treatment outcome
骨髓增生异常综合征(MDS)是一种恶性血液系统疾病,接受传统化疗的患者总体生存(OS)率较低[1]。造血干细胞移植(HSCT)作为目前唯一可能治愈恶性血液病的治疗方法,越来越广泛地应用于MDS治疗[2]。异基因HSCT(allo-HSCT)能够提高MDS患者OS率[3]–[4],但其疗效受移植相关死亡(TRF)、移植物抗宿主病(GVHD)影响。地西他滨作为一种去甲基化治疗药物,联合allo-HSCT可同时发挥抗肿瘤效应及免疫调节效应[5]。本研究我们分析地西他滨桥接allo-HSCT治疗MDS的疗效与安全性,现报道如下。
病例和方法
1.病例:2010年7月至2013年12月我院接受地西他滨桥接allo-HSCT治疗的MDS患者(桥接组)25例,其中男16例、女9例,中位年龄43 (17~53)岁。诊断及分型参照文献[6]标准,其中难治性血细胞减少伴多系形态异常(RCMD)4例、难治性贫血伴原始细胞增多(RAEB)-1 6例、RAEB-2 13例、MDS不能分类(MDS-U)2例。根据国际预后积分系统(IPSS)分类,中危-1组7例、中危-2组12例、高危组6例。以同期未接受地西他滨(免疫调节治疗、常规化疗及支持治疗)行allo-HSCT的33例MDS患者为对照组,男19例、女14例,中位年龄36(17~52)岁,性别、年龄与桥接组相匹配。本研究经我院伦理委员会批准,所有病例均签署知情同意书。
2.地西他滨治疗方案:地西他滨为荷兰Pharmachemie B.V.制药公司产品,西安杨森制药有限公司提供。25例患者中,12例采用地西他滨联合化疗桥接治疗,以地西他滨20 mg/m2治疗3~5 d为1个疗程,根据患者病情调整治疗时间,化疗方案包括AAG(阿克拉霉素+阿糖胞苷+G-CSF)、IAG(去甲氧柔红霉素+阿糖胞苷+ G-CSF)、HAG(高三尖杉酯碱+阿糖胞苷+ G-CSF)、IA(去甲氧柔红霉素+阿糖胞苷)等。另13例患者接受地西他滨单药治疗,地西他滨基础方案为20 mg/m2×5 d,根据患者病情及不良反应发生情况缩短或延长治疗时间。
3.allo-HSCT:25例地西他滨桥接组患者中9例行同胞全相合移植,7例行亲缘半相合移植,9例行无关全相合移植。33例对照组患者中,11例行同胞全相合移植,8例行亲缘半相合移植,14例行无关全相合移植。
4.随访及疗效评价:随访截至患者死亡或2014年3月7日,中位随访17 (3~48)个月,住院观察至移植后100 d,随后定期门诊复查。主要观察是否发生急性GVHD(aGVHD)及TRF,并计算患者无病生存(DFS)及OS时间。DFS定义为患者自接受治疗至疾病复发的时间间隔;OS定义为自明确诊断至患者死亡或2014年3月7日的时间间隔。疗效评价参照文献[7]–[8],包括骨髓完全缓解(mCR)、部分缓解(PR)、未缓解(NR)、疾病稳定(SD)和缓解后复发。有效为mCR+PR。
5.统计学处理:采用SPSS 17.0软件进行统计分析。计量资料非正态分布,采用Mann-Whitney U检验;生存曲线采用Kaplan-Meier法绘制,单因素生存比较采用Log-rank检验,多因素生存比较采用COX模型回归分析。P<0.05为差异有统计学意义。
结果
1.地西他滨桥接1个疗程疗效评估:25例桥接组患者接受1个疗程地西他滨治疗后,mCR率为64.0%,总体有效率为76.0%。其中13例单独使用地西他滨桥接患者中mCR 9例(69.2%)、PR 1例、SD 3例;12例接受地西他滨联合化疗桥接治疗患者中mCR 7例(58.3%),PR 2例,NR 3例,两者mCR率比较差异无统计学意义(P=0.857)。
2.植入情况:接受地西他滨桥接allo-HSCT的25例患者中有24例(96%)植入成功,对照组33例中有29例(87.9%)植入成功。地西他滨桥接组患者粒系、巨核系造血重建中位时间分别为12(11~18)、13(10~46)d,对照组分别为12(8~26)、14(12~39)d,差异均无统计学意义(P=0.667)。
3.安全性评价:TRF发生率:地西他滨桥接组移植后100 d TRF发生率为4.0%(25例中1例),对照组为18.2%(33例中6例),差异无统计学意义(P= 0.106)。GVHD发生情况:地西他滨桥接组14例患者发生aGVHD,其中Ⅰ度7例、Ⅱ度3例、Ⅲ度4例;对照组16例患者发生aGVHD,其中Ⅰ度7例、Ⅱ度8例、Ⅲ度1例。
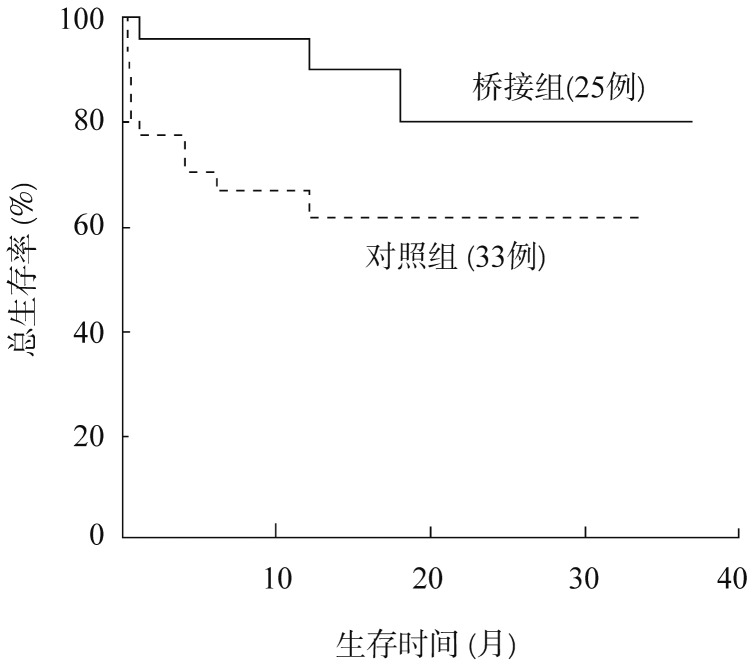
4.生存情况:桥接组2年OS率为80.2%,中位OS时间为14.5 (3~37)个月,对照组2年OS率为61.5%,中位OS时间为8(3~33)个月,差异有统计学意义(P=0.030)(图1)。两组中位DFS时间均未达到,预计2年DFS率为83.0%,对照组为59.0%,差异有统计学意义(P=0.036)。
图1. 地西他滨桥接异基因造血干细胞移植患者生存曲线.
讨论
目前认为,基因的异常甲基化在MDS发生机制中扮演重要角色[9],地西他滨作为去甲基化药物,能够使抑癌基因重新激活,从而达到治疗MDS的目的[10],Kantarjian等[11]的一项临床Ⅲ期随机研究中,入组170例MDS患者,比较地西他滨与对症支持治疗疗效,结果显示地西他滨组获得较好的反应率(17%),其中9%获CR,疗效持续中位时间为10.3个月,进展至急性髓系白血病(AML)或者死亡的时间比对照组明显延长(12.1个月对7.8个月)。我们的研究中,使用地西他滨桥接治疗(包括单药及联合治疗)1个疗程疾病的mCR率达64.0%,总有效率为76.0%,且地西他滨单药与联合化疗患者mCR率比较差异无统计学意义,均高于上述结果,其疗效较好的原因可能为:①采用小剂量地西他滨(20 mg/m2×5 d)方案为基础,根据患者情况酌情调整用量[12]。美国D-0007研究组研究发现,地西他滨20 mg/m2×5 d的给药方案最优。②进行地西他滨桥接的对象均为中高危组,地西他滨治疗中高危MDS患者有着较高的临床反应率(30%~73%)[13]–[14]。
allo-HSCT是目前唯一可能治愈MDS的方法[15],但TRF及疾病复发仍是面临的主要问题。MDS患者接受移植后预后与患者年龄、骨髓原始细胞数目、疾病状态等相关,因此降低移植前肿瘤负荷是移植成功的重要因素之一[16],而去甲基化药物相比于传统化疗,在降低肿瘤负荷同时减少不良反应[11]。Lubbert等[17]报道了15例老年患者在地西他滨一线治疗后进行FBM(氟达拉滨、卡莫司汀、马法兰)方案减低剂量预处理的allo-HSCT,其中10例为MDS患者,5例为AML患者,地西他滨治疗的中位疗程数为5 (1~23)个,有5例患者获得CR,1例获得PR,2例为血液学改善,6例为SD,1例为疾病进展。经FBM方案减低剂量预处理后,4例行同胞移植,11例行无关供者移植。其中1例患者于移植后13 d死于感染,另14例均成功移植并获得CR,中位持续时间为5个月。截至随访结束,6例患者仍存活,其中4例完全嵌合,另8例中有4例死于复发及治疗相关并发症。上述结果表明,地西他滨及FBM预处理后行allo-HSCT的不良反应小于预期,是安全而可行的。地西他滨治疗可在安全的前提下使部分MDS/AML患者获得缓解并能有效控制疾病进展,对于部分复发/难治AML,也可在一定程度上降低肿瘤负荷以提高移植成功率[18]。
Funding Statement
基金项目:江苏省医学重点人才项目(RC2007074);苏州市科技计划(YJS0914);江苏省临床医学科技专项(BL2012005);江苏高校优势学科建设工程
References
- 1.Greenberg P. The myelodysplastic syndromes. In: Hoffman R, Benz E, Shattil S, et al., editors. Hematology: Basic Principles and Practice[M] 3th ed. New York: Churchill Livingstone; 2000. pp. 1106–1129. [Google Scholar]
- 2.叶 丽, 佟 丽艳. 骨髓增生异常综合征的治疗现状及进展[J] 临床荟萃. 2014;29(10):1095–1099. [Google Scholar]
- 3.Witherspoon RP, Deeg HJ. Allogeneic bone marrow transplantation for secondary leukemia or myelodysplasia[J] Haematologica. 1999;84(12):1085–1087. [PubMed] [Google Scholar]
- 4.Platzbecker U, Mufti G. Allogeneic stem cell transplantation in mds: how when[J] Best Pract Res Clin Haematol. 2013;26(4):421–429. doi: 10.1016/j.beha.2013.09.008. [DOI] [PubMed] [Google Scholar]
- 5.Soriano AO, Yang H, Faderl S, et al. Safety and clinical activity of the combination of 5-azacytidine, valproic acid, and all-trans retinoic acid in acute myeloid leukemia and myelodysplastic syndrome[J] Blood. 2007;110(7):2302–2308. doi: 10.1182/blood-2007-03-078576. [DOI] [PubMed] [Google Scholar]
- 6.Greenberg PL, Attar E, Bennett JM, et al. NCCN Clinical Practice Guidelines in Oncology: myelodysplastic syndromes[J] J Natl Compr Canc Netw. 2011;9(1):30–56. doi: 10.6004/jnccn.2011.0005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Engel N, Rank A. Epigenomics in hematopoietic transplantation: novel treatment strategies[J] Epigenomics. 2011;3(5):611–623. doi: 10.2217/epi.11.80. [DOI] [PubMed] [Google Scholar]
- 8.O'Donnell MR, Appelbaum FR, Baer MR, et al. Acute myeloid leukemia clinical practice guidelines in oncology[J] J Natl Compr Canc Netw. 2006;4(1):16–36. doi: 10.6004/jnccn.2006.0004. [DOI] [PubMed] [Google Scholar]
- 9.Mahmud M, Stebbing J. Epigenetic modifications in AML and MDS[J] Leuk Res. 2010;34(2):139–140. doi: 10.1016/j.leukres.2009.07.019. [DOI] [PubMed] [Google Scholar]
- 10.Boultwood J, Wainscoat JS. Gene silencing by DNA methylation in haematological malignancies[J] Br J Haematol. 2007;138(1):3–11. doi: 10.1111/j.1365-2141.2007.06604.x. [DOI] [PubMed] [Google Scholar]
- 11.Kantarjian H, Issa JP, Rosenfeld CS, et al. Decitabine improves patient outcomes in myelodysplastic syndromes: results of a phase III randomized study[J] Cancer. 2006;106(8):1794–1803. doi: 10.1002/cncr.21792. [DOI] [PubMed] [Google Scholar]
- 12.高 苏, 胡 晓慧, 仇 惠英, et al. 地西他滨单药五天方案治疗复杂核型骨髓增生异常综合征和急性髓系白血病疗效观察[J] 中华血液学杂志. 2013;34(6):542–543. [Google Scholar]
- 13.Steensma DP, Baer MR, Slack JL, et al. Multicenter study of decitabine administered daily for 5 days every 4 weeks to adults with myelodysplastic syndromes: the alternative dosing for outpatient treatment (ADOPT) trial[J] J Clin Oncol. 2009;27(23):3842–3848. doi: 10.1200/JCO.2008.19.6550. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Lübbert M, Suciu S, Baila L, et al. Low-dose decitabine versus best supportive care in elderly patients with intermediate-or high-risk myelodysplastic syndrome (MDS) ineligible for intensive chemotherapy: final results of the randomized phase III study of the European Organisation for Research and Treatment of Cancer Leukemia Group and the German MDS Study Group[J] J Clin Oncol. 2011;29(15):1987–1996. doi: 10.1200/JCO.2010.30.9245. [DOI] [PubMed] [Google Scholar]
- 15.De Padua Silva L, de Lima M, Kantarjian H, et al. Feasibility of allo-SCT after hypomethylating therapy with decitabine for myelodysplastic syndrome[J] Bone Marrow Transplant. 2009;43(11):839–843. doi: 10.1038/bmt.2008.400. [DOI] [PubMed] [Google Scholar]
- 16.Alessandrino EP, Della Porta MG, Bacigalupo A, et al. WHO classification and WPSS predict posttransplantation outcome in patients with myelodysplastic syndrome: a study from the Gruppo Italiano Trapianto di Midollo Osseo (GITMO)[J] Blood. 2008;112(3):895–902. doi: 10.1182/blood-2008-03-143735. [DOI] [PubMed] [Google Scholar]
- 17.Lubbert M, Bertz H, Ruter B, et al. Nonintensive treatment with low-dose 5-aza-20-deoxycytidine (DAC) prior to allogeneic blood SCT of older MDS/AML patients[J] Bone Marrow Transplant. 2009;44(9):585–588. doi: 10.1038/bmt.2009.64. [DOI] [PubMed] [Google Scholar]
- 18.吴 倩, 何 广胜, 吴 德沛, et al. 地西他滨桥接异基因造血干细胞移植治疗骨髓增生异常综合征和急性髓样白血病的临床可行性和疗效研究[J] 肿瘤. 2013;33(3):264–270. [Google Scholar]