Abstract
目的
探讨细胞外信号调节激酶1/2(ERK1/2)抑制剂AZD8330对Burkitt淋巴瘤细胞株Raji细胞的作用及其机制。
方法
Raji细胞用不同浓度的AZD8330进行处理;采用CCK-8检测细胞存活率;流式细胞术检测细胞凋亡情况;实时定量PCR法检测Bcl-2、Bcl-xl、caspase-3和血管内皮生长因子(VEGF)mRNA表达;Western blot法检测Bcl-2、Bcl-xl、caspase-3、磷酸化(p)-ERK1/2蛋白表达。
结果
1.00 µmol/L的AZD8330处理24、48和72 h后细胞存活率分别为(62.09±0.86)%、(50.06±1.33)%和(39.13±2.34)%,差异有统计学意义(P值均<0.05);0.10、1.00、10.00 µmol/L的AZD8330分别处理Raji细胞24、48和72 h,Raji细胞发生凋亡,凋亡率呈时间和剂量依赖性,差异有统计学意义(P值均<0.05);随着浓度增加和时间延长,Bcl-2、Bcl-xl、VEGF mRNA表达降低,caspase-3 mRNA表达升高,差异有统计学意义(P值均<0.05);同时,Bcl-2、Bcl-xl、p-ERK1/2蛋白表达明显受抑制,而caspase-3蛋白表达增强。
结论
AZD8330可能通过抑制ERK1/2通路相关基因和蛋白的表达而诱导Burkitt淋巴瘤Raji细胞凋亡,抑制其增殖。
Keywords: 细胞外信号调节MAP激酶类, 伯基特淋巴瘤, 细胞凋亡, AZD8330
Abstract
Objective
To investigate the effect of ERK1/2 inhibitor AZD8330 on human Burkitt's lymphoma cell line Raji cells and its mechanism.
Methods
Raji cells were treated with different concentrations of AZD8330. CCK-8 was used to detect the cell viability. The apoptosis rate of Raji cells was detected by flow cytometry using Annexin Ⅴ/PI-staining. Real-time PCR was used to assess the expression of Bcl-2, Bcl-xl, caspase-3 and VEGF genes. The protein expression level of Bcl-2, Bcl-xl, caspase-3 and p-ERK1/2 was tested with Western blot.
Results
The cell survival rate decreased to (62.09± 0.86)%,(50.06±1.33)% and (39.13±2.34)% respectively after cells were treated with AZD8330 at 1.00 µmol/L in vitro for 24 h, 48 h and 72 h, and statistically significant differences were observed in groups with different time of treatment (P<0.05). Apoptosis of cells treated with AZD8330 at 0.10, 1.00, 10.00 µmol/L in vitro for 24 h, 48 h and 72 h was analyzed, and the statistically significant differences were observed in groups of different time and concentration treatment (P<0.05). AZD8330 induced Raji cell apoptosis and upregulated expression of Bcl-2, Bcl-xl, VEFG and decreased the expression of caspase-3 in a dose and time dependent manner, and statistically significant differences were observed in groups of different time and concentration treatment (P<0.05). At the same time, the Bcl-2, Bcl-xl and p-ERK1/2 proteins expression is suppressed obviously, but the expression of caspase-3 protein increased.
Conclusion
AZD8330 induces cell apoptosis by down-regulating the activation of ERK1/2 signal transduction pathway in Burkitt's lymphoma cell line Raji cells in a dose and time dependent manner.
Keywords: Extracellular signal-regulated MAP kinases, Burkitt lymphoma, Apoptosis, AZD8330
AZD8330是一种新型细胞外信号调节激酶1/2(extracellular-signa1regulated kinase,ERK1/2)抑制剂,可以显著抑制ERK信号通路的活性[1]–[2]。Ramakrishnan等[3]的研究表明多激酶抑制剂索拉非尼能同时抑制多种存在于细胞内和细胞表面的激酶,包括RAF激酶,可以通过抑制RAF/MEK/ERK1/2信号传导通路,直接抑制Burkitt淋巴瘤细胞株Raji细胞生长,因此Raji细胞中存在ERK1/2信号途径的异常表达。ERK1/2特异性抑制剂AZD8330是否对Burkitt淋巴瘤具有杀伤作用,目前尚未见报道。因此,在本研究中我们通过观察ERK1/2激酶特异性抑制剂AZD8330对Burkitt淋巴瘤细胞株Raji细胞的作用,初步探讨其作用机制。
材料和方法
1.试剂和仪器:RPMI1640培养基、胎牛血清为美国Gibco公司产品。反转录试剂盒为美国Promage公司产品。实时定量PCR试剂盒为日本Toyobo公司产品。AZD8330为美国Selleck公司产品。Annexin Ⅴ-FITC/PI双染法细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司。兔抗人磷酸化(p)ERK1/2 (IgG)、兔抗人ERK1/2 (IgG)、兔抗人Bcl-2 (IgG)、兔抗人Bcl-xl (IgG)、兔抗人caspase-3 (IgG)及辣根过氧化物酶(HRP)标记的山羊抗兔IgG为美国Abcam公司产品。荧光定量PCR仪(ABI7300)为美国ABI公司产品。流式细胞仪为美国BD公司产品。680型全自动酶标仪为美国BIO-RAD公司产品。TRIzol试剂盒为美国Invitrogen公司产品,引物由金唯智生物科技(北京)有限公司合成。Raji细胞购自美国ATCC公司。
2.细胞培养:Raji细胞用含有10%热灭活胎牛血清的RPMI 1640培养液培养,放置于37 °C、5% CO2、95%空气湿度培养箱中培养。隔日换液,调整细胞密度为(3~5)×105/ml。用0.4%锥虫蓝1∶1稀释计数计算细胞存活率。取对数生长期的细胞进行相关实验。
3.细胞增殖抑制实验(CCK-8法):AZD8330用二甲基亚砜(DMSO)溶解配制成100 mmol/L的储存液,−20 °C保存,使用前用RPMI 1640培养液稀释。取对数生长期细胞,检测不同浓度的AZD8330对Raji细胞增殖的抑制作用。以每孔2×104个细胞接种于96孔板中,以RPMI 1640培养液代替AZD8330作为对照组,实验组AZD8330终浓度分别为0.01、0.10、1.00、10.00、100.00 µmol/L。72 h后,向每孔中加入CCK-8,在酶标仪450 nm处检测标本吸光度(A)值。每次实验设4个复孔,实验重复4次。
4.流式细胞术检测细胞凋亡:采用Annexin Ⅴ-FITC/PI双染法检测细胞凋亡。收集各组细胞2× 105,用冷PBS洗涤2次,离心去上清;然后用100 µl 1×缓冲液重悬,加入5 µl Annexin Ⅴ-FITC及2 µl PI,轻轻混匀细胞,避光孵育15 min,离心收集细胞,用400 µl 1×缓冲液重悬,上流式细胞仪进行检测分析。每次实验设2个复孔,实验重复3次。
5.实时定量PCR法检测Bcl-2、Bcl-xl、caspase-3和血管内皮生长因子(VEGF)mRNA表达:总RNA采用TRIzol试剂盒进行提取,检测提取到的RNA的浓度和纯度,参照反转录试剂盒说明书进行操作。所用引物见表1。
表1. RT-PCR反应中所使用的引物及序列.
| 基因 | 引物序列(5′-3′) | 片段大小(bp) | 退火温度(°C) |
| Bcl-2 | F:GTTTTGAGTTACTGGGGTTATTT R:TCCTTACCGTATTTTTTATGTGT |
185 | 55 |
| Bcl-xl | F:GAGCTGGTGGTTGACTTTCTC R:TCCATCTCCGATTCAGTCCCT |
119 | 58 |
| VEGF | F:AGGGCAGAATCATCACGAAGT R:AGGGTCTCGATTGGATGGCA |
75 | 60 |
| caspase-3 | F:GACTCTGGAATATCCCTGGACAACA R:AGGTTTGCTGCATCGACATCTG |
140 | 61 |
| GAPDH | F:CTGGGCTACACTGAGCACC R:AAGTGGTCGTTGAGGGCAATG |
101 | 60 |
注:F:上游引物;R:下游引物
按照实时定量PCR试剂盒说明书进行操作,取2 µg总RNA样本,在20 µl体系中扩增。反应条件:95 °C预变性10 min,95 °C变性15 s、60 °C退火/延伸1 min,共40个循环。以2−ΔΔ ct表示mRNA相对表达水平。每次实验设2个复孔,实验重复5次。
6.Western blot法检测Bcl-2、Bcl-xl、caspase-3、p-ERK1/2蛋白表达:收集各组细胞5×106,常规提取蛋白后−80 °C保存备用。取20 µg蛋白在含SDS的10~15 g/L聚丙烯酰胺凝胶中电泳,然后转移至PVDF膜上;PVDF膜用TBS-T缓冲液配制的50 g/L脱脂牛奶溶液室温封闭2 h,与一抗在室温孵育2 h或在4 °C孵育过夜。经TBS-T缓冲液洗涤3次后,在水平摇床上与辣根过氧化物酶偶联的二抗室温孵育1 h。TBS-T洗涤3次后用Chemiluminescent Western检测系统(美国CST公司产品)进行化学发光显影,X线片记录影像。β-actin作为内参调节不同样品的上样量。以条带的灰度值表示蛋白的相对表达水平。
7.统计学处理:采用SPSS17.0软件进行统计学分析。计量资料用均数±标准差表示,多组间均数比较采用单因素方差分析,组间两两比较按照最小显著性差异(LZD)进行。P<0.05为差异有统计学意义。
结果
1.AZD8330对Raji细胞增殖的影响:采用CCK-8法检测浓度为0.01、0.10、1.00、10.00、100.00 µmol/L的AZD8330作用24、48、72 h后Raji细胞的存活情况,结果显示Raji细胞的存活率随着AZD8330浓度增加和作用时间的延长而下降,与对照组比较差异均有统计学意义(P值均<0.05)(表2)。作用24、48和72 h时Raji细胞的半数生长抑制浓度(IC50)分别为8.27、1.05和0.04 µmol/L。
表2. 不同浓度AZD8330作用不同时间对Raji细胞存活率和凋亡率的影响(%,x±s).
| 组别 | 存活率 |
凋亡率 |
||||
| 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | |
| 对照组 | 95.11±1.12 | 93.38±2.33 | 91.08±4.02 | 2.21±1.35 | 4.33±1.59 | 6.52±2.11 |
| AZD8330处理组 | ||||||
| 0.01 µmol/L | 80.05±0.35a | 75.13±0.59ab | 66.19±1.62ab | - | - | - |
| 0.10 µmol/L | 73.91±1.12a | 67.80±0.91ab | 56.10±0.73ab | 12.21±2.16a | 18.03±1.55ab | 23.87±4.31ab |
| 1.00 µmol/L | 62.09±0.86a | 50.06±1.33ab | 39.13±2.34ab | 18.71±2.81a | 23.09±2.56ab | 31.73±4.22ab |
| 10.00 µmol/L | 47.27±2.15a | 36.06±3.57ab | 24.09±2.87ab | 26.22±1.09a | 31.69±2.38ab | 39.99±4.92ab |
| 100.00 µmol/L | 34.11±3.25a | 18.21±4.11ab | 10.22±3.11ab | - | - | - |
注:-:未做实验;与对照组比较aP<0.05;与24 h作用组比较,bP<0.05;存活率检测:每次实验设4个复孔,实验重复4次;凋亡率检测:每次实验设2个复孔,实验重复3次
2.AZD8330对Raji细胞凋亡的影响:采用流式细胞术检测浓度为10.00、1.00和0.10 µmol/L的AZD8330作用24、48、72 h后Raji细胞的凋亡情况。结果显示Raji细胞的凋亡率随着AZD8330浓度增加和药物作用时间的延长而增加,与对照组比较差异均有统计学意义(P值均<0.05)(表2)。
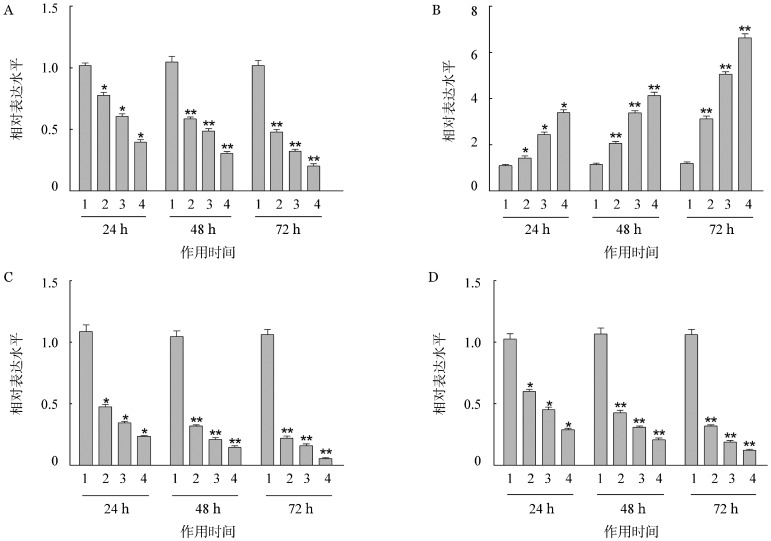
3.AZD8330对Raji细胞Bcl-2、Bcl-xl、caspase-3和VEGF mRNA表达的影响:实时定量PCR法检测结果显示,与空白对照组比较不同浓度AZD8330作用的Raji细胞Bcl-2、Bcl-xl和VEGF mRNA表达降低(P值均<0.05),同时,同一浓度的AZD8330作用Raji细胞的时间不同,其表达水平随着作用时间的延长而降低,具有时间和剂量依赖性(P值均< 0.05);而与空白对照组比较不同浓度AZD8330作用的Raji细胞caspase-3 mRNA表达升高(P值均< 0.05),同一浓度,随着作用时间的延长表达水平增加(P值均<0.05),其中以10 µmol/L AZD8330作用Raji细胞72 h后作用能力最强(图1)。
图1. 实时定量PCR法检测AZD8330对Raji细胞Bcl-2、Bcl-xl、caspase-3和血管内皮生长因子(VEGF)mRNA表达的影响(每次实验设2个复孔,实验重复5次,与对照组比较,*P<0.05;与24 h同浓度作用组比较,**P<0.05).
A:Bcl-2;B:caspase-3;C:Bcl-xl;D:VEGF;1:对照组;2~4:分别为0.10、1.00、10.00 µmol/L AZD8330处理组
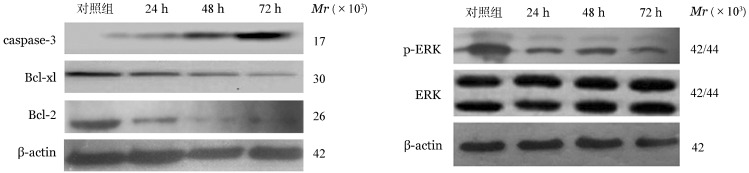
4.AZD8330对Raji细胞Bcl-2、Bcl-xl、caspase-3、p-ERK1/2蛋白表达的影响:Western blot法检测结果显示,与空白对照组比较应用1.00 µmol/L AZD8330处理72 h后Raji细胞的Bcl-2、Bcl-xl及p-ERK1/2蛋白表达下降,caspase-3蛋白表达增加(图2),而对总ERK1/2的表达水平无明显影响。
图2. Western blot法检测1.00 µmol/L AZD8330处理72 h对Raji细胞Bcl-2、Bcl-xl、caspase-3及磷酸化细胞外信号调节激酶(p-ERK)1/2蛋白表达的影响.
讨论
Burkitt淋巴瘤是一种高浸润性和迅速生长的成熟B细胞恶性淋巴瘤,是人类恶性淋巴瘤中最常见的类型之一,其淋巴瘤细胞25 h即可倍增[4]–[5]。研究发现,通过纳入中枢神经系统预防性治疗的强化多药联合化疗,60%~90%的Burkitt淋巴瘤患者经过合理治疗可获得完全缓解,成人患者常累及骨髓以及中枢神经系统,对化疗的反应较儿童差[6]–[7]。因为联合应用利妥昔单抗可获得较高的缓解率,故治疗中常联合应用利妥昔单抗,但Burkitt淋巴瘤患者化疗强度大,且与利妥昔单抗在免疫抑制上有协同作用,患者在治疗过程中容易出现严重感染。多数患者在达到缓解后数月至数年复发,而对于复发患者再治疗效果很差[8]。因此寻找新型、有效、低毒的治疗药物具有十分重要的意义。ERK1/2抑制剂由于作用靶点与传统化疗药物不同,不仅可以替代传统药物减轻化疗不良反应,也可作为复发Burkitt淋巴瘤患者的新型治疗药物。
ERK是丝裂原活化蛋白激酶(MAPK)家族中的一员,受活化的MEK蛋白激酶磷酸化,MEK蛋白是一种少有的双重特异性蛋白激酶,受上游活化的Raf蛋白调控[9]。研究发现,p-ERK蛋白由细胞质转入到细胞核中,可促进Bcl-2家族成员转录以及翻译后表达,包括抑制凋亡蛋白(Bcl-2、Bcl-xl)和促凋亡蛋白(Bad、Bim),还可导致与凋亡相关的信号途径被激活(caspase-3表达上调)[10]–[12]。同时,多种促血管生成因子也能够通过活化MAPK/ERK信号传导通路而上调VEGF的表达[13]。近年来,ERK1/2抑制剂主要应用于非血液实体瘤的研究性治疗,而关于淋巴瘤的研究相对较少。Bhalla等[14]研究发现在弥漫大B细胞淋巴瘤(DLBCL)细胞系和原代细胞中存在MEK/ERK信号传导通路的异常表达,第二代ERK1/2抑制剂AZD6244可通过MEK/ERK信号传导通路下调p-ERK1/2蛋白,进而抑制凋亡抑制基因Bcl-2、Bcl-xl表达,从而导致细胞凋亡的发生,但是目前ERK抑制剂在Burkitt淋巴瘤研究中尚未涉及,Ramakrishnan等[3]研究表明Burkitt淋巴瘤Raji细胞中存在ERK1/2信号途径的异常表达。另一项有关ERK1/2抑制剂AZD8330的最新临床研究结果显示,AZD8330治疗恶性实体瘤晚期患者较现有药物具有剂量低、不良反应少的优势[1]。在本研究中我们的结果显示,AZD8330抑制Raji细胞增殖,诱导淋巴瘤细胞凋亡,且细胞凋亡水平随药物浓度增高、时间延长而逐渐增大;进一步研究提示,AZD8330抑制凋亡抑制基因Bcl-2、Bcl-xl表达,促进促凋亡基因caspase-3表达,从而导致细胞凋亡发生;此外,AZD8330还抑制Raji细胞VEGF表达,提示其阻断肿瘤新生血管的形成,间接抑制肿瘤细胞的生长。同时我们应用Western blot法检测AZD8330对Raji细胞Bcl-2、Bcl-xl、caspase-3及p-ERK1/2蛋白表达的影响,发现抑制凋亡蛋白Bcl-2、Bcl-xl表达降低,促凋亡蛋白caspase-3表达增强,p-ERK的蛋白表达降低。因此我们推测,ERK1/2抑制剂AZD8330可抑制Raji细胞MEK/ERK信号通路,降低p-ERK表达,引起抑制凋亡基因及蛋白表达,促进促凋亡基因蛋白表达,进而导致细胞凋亡效果更显著。
综上,在本研究中我们的研究结果显示AZD8330在体外能抑制Burkitt淋巴瘤Raji细胞增殖,诱导其凋亡,提示ERK1/2信号途径可能成为Burkitt淋巴瘤治疗的一个新的靶点。
Funding Statement
基金项目:国家自然科学基金(81370615)
References
- 1.Cohen RB, Aamdal S, Nyakas M, et al. A phase I dose-finding, safety and tolerability study of AZD8330 in patients with advanced malignancies[J] Eur J Cancer. 2013;49(7):1521–1529. doi: 10.1016/j.ejca.2013.01.013. [DOI] [PubMed] [Google Scholar]
- 2.Miller CR, Oliver KE, Farley JH. MEK1/2 inhibitors in the treatment of gynecologic malignancies[J] Gynecol Oncol. 2014;133(1):128–137. doi: 10.1016/j.ygyno.2014.01.008. [DOI] [PubMed] [Google Scholar]
- 3.Ramakrishnan V, Timm M, Haug JL, et al. Sorafenib, a multikinase inhibitor, is effective in vitro against non-Hodgkin lymphoma and synergizes with the mTOR inhibitor rapamycin[J] Am J Hematol. 2012;87(3):277–283. doi: 10.1002/ajh.22263. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Miles RR, Arnold S, Cairo MS. Risk factors and treatment of childhood and adolescent Burkitt lymphoma/leukaemia[J] Br J Haematol. 2012;156(6):730–743. doi: 10.1111/j.1365-2141.2011.09024.x. [DOI] [PubMed] [Google Scholar]
- 5.Kobayashi H, Ichikawa M, Hangaishi A, et al. Concurrent development of “Burkitt-like” lymphoma and BCL-2-rearranged low-grade B cell lymphoma sharing the same germinal center origin[J] Int J Hematol. 2011;93(1):112–117. doi: 10.1007/s12185-010-0741-3. [DOI] [PubMed] [Google Scholar]
- 6.Perkins AS, Friedberg JW. Burkitt lymphoma in adults[J] Hematology Am Soc Hematol Educ Program. 2008:341–348. doi: 10.1182/asheducation-2008.1.341. [DOI] [PubMed] [Google Scholar]
- 7.Sweetenham JW, Pearce R, Taghipour G, et al. Adult Burkitt's and Burkitt-like non-Hodgkin's lymphoma—outcome for patients treated with high-dose therapy and autologous stem-cell transplantation in first remission or at relapse: results from the European Group for Blood and Marrow Transplantation[J] J Clin Oncol. 1996;14(9):2465–2472. doi: 10.1200/JCO.1996.14.9.2465. [DOI] [PubMed] [Google Scholar]
- 8.God JM, Haque A. Burkitt lymphoma: pathogenesis and immune evasion[J] J Oncol. 2010;2 doi: 10.1155/2010/516047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Alessi DR, Saito Y, Campbell DG, et al. Identification of the sites in MAP kinase kinase-1 phosphorylated by p74raf-1[J] EMBO J. 1994;13(7):1610–1619. doi: 10.1002/j.1460-2075.1994.tb06424.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Jost M, Huggett TM, Kari C, et al. Epidermal growth factor receptor-dependent control of keratinocyte survival and Bcl-xL expression through a MEK-dependent pathway[J] J Biol Chem. 2001;276(9):6320–6326. doi: 10.1074/jbc.M008210200. [DOI] [PubMed] [Google Scholar]
- 11.Pei XY, Dai Y, Tenorio S, et al. MEK1/2 inhibitors potentiate UCN-01 lethality in human multiple myeloma cells through a Bim-dependent mechanism[J] Blood. 2007;110(6):2092–2101. doi: 10.1182/blood-2007-04-083204. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Mrass P, Rendl M, Mildner M, et al. Retinoic acid increases the expression of p53 and proapoptotic caspases and sensitizes keratinocytes to apoptosis: a possible explanation for tumor preventive action of retinoids[J] Cancer Res. 2004;64(18):6542–6548. doi: 10.1158/0008-5472.CAN-04-1129. [DOI] [PubMed] [Google Scholar]
- 13.Komi Y, Sogabe Y, Ishibashi N, et al. Acyclic retinoid inhibits angiogenesis by suppressing the MAPK pathway[J] Lab Invest. 2010;90(1):52–60. doi: 10.1038/labinvest.2009.110. [DOI] [PubMed] [Google Scholar]
- 14.Bhalla S, Evens AM, Dai B, et al. The novel anti-MEK small molecule AZD6244 induces BIM-dependent and AKT-independent apoptosis in diffuse large B-cell lymphoma[J] Blood. 2011;118(4):1051–1061. doi: 10.1182/blood-2011-03-340109. [DOI] [PMC free article] [PubMed] [Google Scholar]