Abstract
目的
评估利用激光显微切割联合质谱蛋白质组学技术对系统性淀粉样变性进行分型的有效性。
方法
以138例病理确诊为淀粉样变性患者的经福尔马林固定石蜡包埋标本为研究对象。利用显微切割收集刚果红染色阳性区域组织并行质谱蛋白质组学分析,以指数修正的蛋白质丰度指标(emPAI)为标准,根据丰度最高的致淀粉样变蛋白判定淀粉样变性亚型。
结果
在138份组织标本中,腹壁脂肪占26%,舌体占19%,齿龈占11%,肾脏占9%,胃肠道占9%,心脏占6%,其余类型样本占20%。总共121例患者获得成功分型,包括轻链型106例(87.6%),遗传性甲状腺转运球蛋白型7例(5.8%),致淀粉样变蛋白A型、重链/重链+轻链型及纤维蛋白原α链型各2例(1.7%),载脂蛋白A-Ⅱ型及溶菌酶型各1例(0.8%)。5例被排除淀粉样变性诊断,12例分型失败。总体诊断准确率为91.3%。在各种组织类型标本中,腹壁脂肪组织的分型成功率最低,仅为83.3%。
结论
激光显微切割联合质谱蛋白质组学方法能有效鉴定出淀粉样变性亚型。
Keywords: 淀粉样变性, 显微切割, 质谱分析法, 蛋白质组学
Abstract
Objective
To establish a novel method to determine specific type of amyloidosis through laser microdissection and mass spectrometry (LMD/MS) based proteomic analysis.
Methods
There were 138 formalin-fixed and paraffin-embedded (FFPE) biopsy samples of patients who were diagnosed as systemic amyloidosis used in this study. For each case, a 10 µm section stained with congored and positive amyloid deposits were identified under fluorescent light, followed by micro-dissection and mass spectrometry analysis. The amyloidosis subtype was confirmed based on the most abundant amyloid protein.
Results
The tissue types of 138 specimens were as following: subcutaneous abdominal fat accounted for 26%, tongue for 19%, gingiva for 11%, kidney for 9%, intestine for 9%, heart for 6% and others for 20%. Specific types of amyloid were accurately detected in 121 cases, including 106 (87.6%) amyloid light chain (AL) type, 7 (5.8%) amyloid trans-thy-retin (ATTR), 2 (1.7%) amyloidogenic protein A (AA), 2 (1.7%) amyloid heavy chain (AH)/AL+AH, 2 (1.7%) fibrinogen alpha chain (AFib), 1(0.8%) amyloid apolipoprotein A-type Ⅱ (AApoA-Ⅱ) and one (0.8%) amyloid lysozyme (ALys). Diagnosis of amyloidosis was excluded in 5 cases. The types of twelve cases were indeterminate by LMD/MS. On the whole, LMD/MS reached 91.3% accuracy rate in amyloid typing. Commonly involved organs (for example, heart, kidney and liver) turned out to be suitable sources of FFPE samples with typing success rate of almost 100%. In contrast, MS analysis was successful in only 83.3% of subcutaneous abdominal fat samples.
Conclusion
LMD/MS method provided a more direct technique for accurate typing of amyloidosis in a single procedure.
Keywords: Amyloidosis, Microdissection, Mass spectrometry, Proteomics
淀粉样变性是一组由各种具有β折叠结构的致淀粉样变蛋白在细胞外异常沉积所致的异质性疾病[1]。目前已知的致淀粉样变蛋白约30种[2],由于不同致淀粉样变蛋白所致系统性淀粉样变性的发病机制、疾病进程、治疗手段及预后均有显著差异,因而准确的分型是治疗淀粉样变性的基础[3]。激光显微切割联合质谱蛋白质组学技术(LMD/MS)是近年来新开展的用于淀粉样变性亚型鉴定的方法,其分型的敏感性和特异性都接近100%[4]–[5]。我们在国内首次建立利用LMD/MS进行系统性淀粉样变性分型的方法,并对我院近10年来的系统性淀粉样变性病例进行亚型鉴定,现报道如下。
病例和方法
1.病例:以2000年1月至2014年6月我院确诊的138例系统性淀粉样变性患者为研究对象。其中男女比为1.38∶1(5例患者无性别信息),中位年龄52 (20~81)岁。入组标准:①有器官肿大和(或)器官功能不全的临床表现;②组织活检显示组织经刚果红染色后光镜下可见粉染无定形物质沉积,且偏振光显微镜下呈现苹果绿色荧光双折射。阳性对照组包括经免疫荧光鉴定为轻链型(AL型)且经抗浆细胞治疗有效(4例)、继发于多发性骨髓瘤(MM)或巨球蛋白血症的AL型(12例)以及有家族史且经基因突变检测证实为遗传性甲状腺转运球蛋白型(ATTR型)(2例)的淀粉样变性患者共18例,用于验证LMD/MS分型方法的特异性及敏感性。所有患者均签署知情同意书。
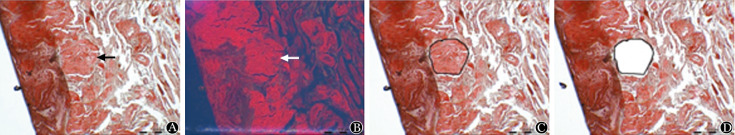
2.激光显微切割:选取患者病理诊断所用的福尔马林固定石蜡包埋(FFPE)组织标本。切取10 µm厚FFPE标本组织,并平铺于微切割专用PET玻片(德国Leica公司产品)上。切片脱蜡后行刚果红染色。应用激光显微切割系统LMD 6500(德国Wetzler公司产品),在荧光视野下选取呈现亮红色的刚果红染色阳性区域,激光切割目标组织,总切割面积至少200 000~300 000 µm2。相应的显微切割流程见图1。
图1. 激光显微切割舌体标本系统性淀粉样变性病变区域流程图(刚果红染色,×150).
A:光镜下可见鳞状上皮下均质粉染物(箭头所示);B:与周边组织相比,病变部位在荧光显微镜下呈现亮红色(箭头所示);C:选取病变区域,开始显微切割;D:切割区域组织已脱落到Eppendorf 管内
3.蛋白提取及酶切:将微切割标本放置于含有10 mmol/L Tris缓冲液、1 mmol/L乙二胺四乙酸及0.2% Zwittergent 3-16蛋白提取液的微量离心管(Eppendorf管)内,100 °C水浴孵育1 h,期间间断涡旋振荡。然后经40 000 Hz超声波处理40 min,加入二硫苏糖醇(DTT)37 °C孵育60 min,加入碘乙酰胺(IAA)避光室温孵育45 min。离心后取上清液,转至10×103微孔滤过膜上,20 °C下14 000×g离心至滤过膜完全干燥,25 mmol/L碳酸氢铵溶液洗膜3次,同条件离心至完全干燥后在滤过膜上加入50 µl 25 mmol/L碳酸氢铵溶液,按照蛋白∶胰蛋白酶质量比为20~50∶1加入适量胰蛋白酶并进行微波辅助酶切。同条件离心滤下多肽溶液并抽干。
4.多肽纯化及液相色谱串联质谱(LC-MS/MS)分析:1 g/L甲酸溶解多肽,通过ZipTipC18微量层析柱(美国Millipore公司产品)去除盐类杂质。抽干后再次以1 g/L甲酸溶解,采用TripleTOF™ 5600质谱仪(美国AB SCIEX公司产品)进行质谱分析。应用蛋白质搜索引擎MASCOT软件(英国Matrix Science公司产品)对强度在1个单位以上、且有10个以上离子信号的谱图进行数据库检索,检索数据库来自于UniProt的人蛋白质数据库,多肽和离子质量误差范围均为5×10−2,半胱氨酸为碘乙酰胺固定修饰,完全酶切,允许有两个误切位点,以鉴定出相关多肽及蛋白种类。利用Scaffold软件(波兰Proteome Software公司产品)对搜索结果进行评估整合。所有质谱检测结果同时应用反向数据库检索方法评估数据假阳性率(FDR),筛选条件与正向数据库检索相同,FDR小于1%、鉴定多肽数≥2的蛋白纳入统计范围。
5.淀粉样变性亚型判定标准:在LC-MS/MS分析结果中有淀粉样变性伴侣蛋白血清淀粉样蛋白P(SAP)表达者方可诊断为淀粉样变性;同时筛选出具有淀粉样变致病性的相关蛋白,以指数修正的蛋白质丰度指标(emPAI)为标准[6],进行相对定量,判定丰度最高者为相应的致淀粉样变蛋白,从而确定出淀粉样变性亚型。
结果
1.系统性淀粉样变性患者LMD/MS标本来源:在138例系统性淀粉样变性患者用于LMD/MS分型的组织标本中,以腹壁脂肪最为常见,占26% (36例);其他来源部位依次为舌体26例(19%)、齿龈15例(11%)、肾脏13例(9%)、胃肠道12例(9%)、心脏8例(6%)、肝脏7例(5%)、骨髓6例(4%)、肺及唇腺各4例(3%)、局部肿物(鼻咽后、喉部、颌下)3例(2%)、皮肤2例(1%)、支气管及胸膜各1例(1%)。
2.阳性对照组的LMD/MS分型结果:18例阳性对照病例的LMD/MS分型结果显示,其与既往分型结果完全符合,表明LMD/MS分型方法的敏感性及特异性均为100%。
3.总体LMD/MS分型结果:138例患者中,121例获得了准确分型,12例未能获得准确分型,5例因组织内无SAP表达且不存在高丰度致淀粉样变性蛋白而被排除淀粉样变性诊断,其中1例被重新诊断为轻链沉积病。因此,LMD/MS诊断系统性淀粉样变性类型的总体准确率为91.3%。
121例获得准确分型患者中,54例(44.6%)为AL-λ型淀粉样变性,52例(43.0%)为AL-κ型淀粉样变性,7例(5.8%)为ATTR型淀粉样变性,致淀粉样变蛋白A(AA)型、重链/重链+轻链(AH/AL+AH)型及纤维蛋白原α链(AFib)型淀粉样变性各2例(1.7%),载脂蛋白A-Ⅱ(AApoA-Ⅱ)型及溶菌酶(ALys)型淀粉样变性各1例(0.8%)。
12例患者无法通过LMD/MS实现分型,其中8例虽有SAP表达,但质谱结果未见明显高丰度致淀粉样变蛋白;其他4例标本因同时表达κ轻链及λ轻链而不能确定类型。标本来源以腹壁脂肪组织最为常见,占50.0%(6例),肾脏及齿龈各2例(16.7%),舌体及骨髓各1例(8.3%)。
4.伴侣蛋白组成:在121例成功鉴定亚型的患者中,100%患者表达SAP,90例(74.4%)患者表达载脂蛋白E (ApoE),87例(71.9%)患者表达载脂蛋白A-Ⅳ(ApoA-Ⅳ)。96例(79.3%)患者表达SAP同时表达APOE或ApoA-Ⅳ中的至少1种,83例(68.6%)患者同时表达SAP、APOE及ApoA-Ⅳ。
讨论
目前淀粉样变性的分型方法主要包括免疫组化(IHC)、免疫荧光和蛋白质组学等[7]。IHC及免疫荧光等基于抗体抗原反应的方法用于鉴定蛋白类型有着以下缺点:①抗体类型有限,一次检验只能检测一种蛋白;②容易受血浆蛋白的污染,导致非特异性的背景染色,使得结果难以判读;③致淀粉样变蛋白在发生结构修饰的过程中可能导致抗原表位的丢失[7]–[8],影响抗原抗体反应。现有的研究结果显示,利用IHC对淀粉样变性进行分型的成功率为38%~87%,免疫荧光检测成功率稍高(65%~87%)[9]。而利用FFPE标本采用显微切割及质谱蛋白质组学技术进行淀粉样变性分型,不仅可以获取更为精确的病变区域,还可以直接鉴定出组织内的致淀粉样变蛋白类型,且容易进行回顾性分析[10]。2008年,梅奥诊所首次提出通过LMD/MS鉴定神经组织内的蛋白沉积物成分,在5例神经淀粉样瘤中,均成功鉴定出SAP及限制性λ轻链的表达[11]。2009年Vrana等[4]对50例已明确淀粉样变性亚型的患者重新应用LMD/MS进行亚型鉴定,结果提示LMD/MS诊断的准确性及特异性均为100%。2012年Sethi等[12]报道了127例肾脏淀粉样变性患者应用LMD/MS的鉴定结果,122例患者成功确定亚型,包括ALet2、AGel、AApoA-Ⅰ及AApoA-Ⅳ型等少见亚型。
本实验是国内首个开展的关于系统性淀粉样变性的LMD/MS分型研究。与梅奥诊所的分型方法相比较,我们在具体流程上做了进一步的优化。首先,我们应用含10×103滤过膜的离心管进行样本膜上酶切,使得分子量较大的杂质在胰蛋白酶切割过滤后留于滤过膜上,避免了对多肽溶液的污染及后续质谱检测的干扰;其次,我们通过微波辅助酶切,将原本需要过夜的酶切过程缩短至数分钟,提高了检测效率。在18例患者构成的阳性对照组中,LMD/MS诊断的敏感性及特异性均为100%。随后对138例患者开展的回顾性分型研究中,LMD/MS诊断准确率也达到91.3%,同时还成功鉴定出了包括AH/AL+AH、AFib、AApoA-Ⅱ和ALys型在内的多种少见类型。
在诊断失败的12例标本中,6例均为腹壁脂肪组织。这是因为腹壁脂肪组织结构疏松,且刚果红染色阳性的结缔组织面积小、分布分散,显微切割过程难以保证取材的准确性以及取得足够量的病灶。Vrana等[13]利用腹壁皮下脂肪穿刺活检标本联合质谱对366例淀粉样变性患者进行分型,其分型敏感性也仅为90%,与我们的结果相似。因此,腹壁脂肪因其组织类型的特殊性,质谱结果易于受到干扰,当难以鉴定或分型结果阴性时,应考虑采用受累脏器的组织标本进行质谱分析。
LMD/MS分型的另一大优势在于可以根据SAP、ApoE和ApoA-Ⅳ等与淀粉样物质沉积相关的伴侣蛋白存在与否,对淀粉样变性进行诊断[14]。Vrana等[13]对比淀粉样变性与非淀粉样变性患者腹壁脂肪组织的质谱结果后发现,组织内的SAP、ApoE以及ApoA-Ⅳ的表达存在显著性差异,并提出如果组织内同时含有这3种蛋白中的2种,可作为淀粉样变性的诊断标准。在我们这121例分型成功的患者中,100%患者的组织内都含有SAP,74.4%组织内含有ApoE,71.9%的组织内含有ApoA-Ⅳ。79.3%的患者同时含有SAP在内的至少2种伴侣蛋白,68.6%的患者同时含有上述3种蛋白。而5例患者因为无伴侣蛋白的表达而最终被排除淀粉样变性的诊断。
综上所述,我们应用优化方法学的LMD/MS技术,对138例患者中的126例进行了准确诊断,成功率达到91.3%。在各类型组织中,腹壁脂肪的诊断成功率相对较低。然而由于腹壁脂肪活检具有操作简便、创伤小的优点[15],未来如何通过流程和方法学改进提高其诊断准确率有待进一步研究。
Funding Statement
基金项目:国家自然科学基金(81370672);首都临床应用特色研究(Z131107002213050)
References
- 1.Merlini G, Bellotti V. Molecular mechanisms of amyloidosis[J] N Engl J Med. 2003;349(6):583–596. doi: 10.1056/NEJMra023144. [DOI] [PubMed] [Google Scholar]
- 2.Sipe JD, Benson MD, Buxbaum JN, et al. Amyloid fibril protein nomenclature: 2010 recommendations from the nomenclature committee of the International Society of Amyloidosis[J] Amyloid. 2010;17(3-4):101–104. doi: 10.3109/13506129.2010.526812. [DOI] [PubMed] [Google Scholar]
- 3.Merlini G, Seldin DC, Gertz MA. Amyloidosis: pathogenesis and new therapeutic options[J] J Clin Oncol. 2011;29(14):1924–1933. doi: 10.1200/JCO.2010.32.2271. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Vrana JA, Gamez JD, Madden BJ, et al. Classification of amyloidosis by laser microdissection and mass spectrometry-based proteomic analysis in clinical biopsy specimens[J] Blood. 2009;114(24):4957–4959. doi: 10.1182/blood-2009-07-230722. [DOI] [PubMed] [Google Scholar]
- 5.Klein CJ, Vrana JA, Theis JD, et al. Mass spectrometric-based proteomic analysis of amyloid neuropathy type in nerve tissue[J] Arch Neurol. 2011;68(2):195–199. doi: 10.1001/archneurol.2010.261. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Arike L, Peil L. Spectral counting label-free proteomics[J] Methods Mol Biol. 2014;1156:213–222. doi: 10.1007/978-1-4939-0685-7_14. [DOI] [PubMed] [Google Scholar]
- 7.Lavatelli F, Vrana JA. Proteomic typing of amyloid deposits in systemic amyloidoses[J] Amyloid. 2011;18(4):177–182. doi: 10.3109/13506129.2011.630762. [DOI] [PubMed] [Google Scholar]
- 8.Brambilla F, Lavatelli F, Merlini G, et al. Clinical proteomics for diagnosis and typing of systemic amyloidoses[J] Proteomics Clin Appl. 2013;7(1-2):136–143. doi: 10.1002/prca.201200097. [DOI] [PubMed] [Google Scholar]
- 9.孙 维绎, 李 剑. 淀粉样变性分型的研究进展[J] 中国实验血液学杂志. 2014;22(1):259–262. doi: 10.7534/j.issn.1009-2137.2014.01.052. [DOI] [PubMed] [Google Scholar]
- 10.Mollee P, Renaut P, Gottlieb D, et al. How to diagnose amyloidosis[J] Intern Med J. 2014;44(1):7–17. doi: 10.1111/imj.12288. [DOI] [PubMed] [Google Scholar]
- 11.Rodriguez FJ, Gamez JD, Vrana JA, et al. Immunoglobulin derived depositions in the nervous system: novel mass spectrometry application for protein characterization in formalinfixed tissues[J] Lab Invest. 2008;88(10):1024–1037. doi: 10.1038/labinvest.2008.72. [DOI] [PubMed] [Google Scholar]
- 12.Sethi S, Vrana JA, Theis JD, et al. Laser microdissection and mass spectrometry-based proteomics aids the diagnosis and typing of renal amyloidosis[J] Kidney Int. 2012;82(2):226–234. doi: 10.1038/ki.2012.108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Vrana JA, Theis JD, Dasari S, et al. Clinical diagnosis and typing of systemic amyloidosis in subcutaneous fat aspirates by mass spectrometry-based proteomics[J] Haematologica. 2014;99(7):1239–1247. doi: 10.3324/haematol.2013.102764. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Sethi S, Fervenza FC, Miller D, et al. Recurrence of amyloidosis in a kidney transplant[J] Am J Kidney Dis. 2010;56(2):394–398. doi: 10.1053/j.ajkd.2009.10.061. [DOI] [PubMed] [Google Scholar]
- 15.vanGameren II, Hazenberg BP, Bijzet J, et al. Diagnostic accuracy of subcutaneous abdominal fat tissue aspiration for detecting systemic amyloidosis and its utility in clinical practice[J] Arthritis Rheum. 2006;54(6):2015–2021. doi: 10.1002/art.21902. [DOI] [PubMed] [Google Scholar]