Abstract
目的
探讨依布替尼克服弥漫大B细胞淋巴瘤(DLBCL)细胞耐药的机制。
方法
①体外实验:以DLBCL细胞系SUDHL10细胞(GCB亚型)、HBL-1(ABC亚型)以及8例DLBCL患者原代细胞为研究对象,与正常人骨髓基质细胞(MSC)共培养后,显微镜下计数向MSC趋化迁移及与MSC黏附的DLBCL细胞数,ELISA法检测MSC的CXCL12表达水平,流式细胞术检测DLBCL细胞的CXCR4表达水平;以携带有CXCR4的慢病毒转染HBL-1细胞,米托蒽醌、依布替尼处理后与MSC共培养,流式细胞术检测细胞凋亡水平;倒置显微镜下观察HBL-1细胞集落形成情况。②体内实验:以HBL-1细胞构建的NOD/SCID肿瘤模型小鼠为研究对象,观察依布替尼治疗后肿瘤体积变化。
结果
①依布替尼处理后,DLBCL细胞向MSC的迁移数和与MSC的黏附比例明显降低(P值均<0.05),并呈剂量依赖性。②与依布替尼处理前比较,处理后MSC的CXCL12表达水平降低(SUDHL10细胞:660 pg/ml对1 400 pg/ml,P=0.004;HBL-1细胞:720 pg/ml对1 490 pg/ml,P=0.018;DLBCL原代细胞:850 pg/ml对1 450 pg/ml,P=0.004),DLBCL细胞的CXCR4表达水平降低(P值均<0.05)。③共培养时,对照组、米托蒽醌组、依布替尼组、米托蒽醌组+依布替尼组的HBL-1细胞凋亡比例分别为15.1%、17.5%、23.5%、58.7%,转染过表达CXCR4后,HBL-1细胞凋亡比例分别为14.2%、16.1%、22.5%、38.3%,共培养联合用药组HBL-1细胞凋亡比例高于单药培养组,差异均有统计学意义(P值均<0.05)。④对照组、MSC组、依布替尼组、MSC组+依布替尼组集落数分别为113±5、205±4、62±9、123±3(每孔2.5×103),模型小鼠皮下肿瘤体积分别为6 500、17 000、4 000、10 000 mm3,依布替尼处理后较处理前集落数和肿瘤体积明显减少,差异均有统计学意义(P值均<0.05)。
结论
依布替尼靶向作用于CXCL12/CXCR4轴,抑制CXCR4表达从而克服MSC介导的耐药作用,并且能够在体内外抑制MSC促淋巴瘤细胞集落形成的作用。为依布替尼治疗复发耐药DLBCL提供了理论依据。
Keywords: 淋巴瘤,大B细胞,弥漫性, 趋化因子CXCL12, 受体,CXCR4, 依布替尼
Abstract
Objective
To explore the mechanism of ibrutinib on drug resistance diffuse large B-cell lymphoma (DLBCL) cells.
Methods
DLBCL cell line was cultured with mesenchymal stem cells (MSC), and DLBCL cells which migrated and adhered to MSC under microscope was counted. The secretion of CXCL12 by MSC were measured by ELISA. The expression of CXCR4 on DLBCL cells were measured by flow cytometry, HBL-1 cells were transfected with a CXCR4-lentivector. An Annexin Ⅴ-binding assay was used to detect the induction of apoptosis. Clonogenic growth of DLBCL cells was evaluated on MethoCult media. Ibrutinib was injected into NOD/SCID mice, tumor growth was assessed via caliper measurements every 3 days.
Results
MSC promoted migration and adhesion of DLBCL cells to MSC. Ibrutinib inhibited migration and adhesion of DLBCL cells to MSC in a dose-dependent manner (P<0.05). CXCL12 secreted by MSC and CXCR4 expressed on DLBCL cells could induce each other, which upgraded the levels of secretion and expression. Ibrutinib could inhibit the secretion of CXCL12 (SUDHL10: 660 pg/ml vs 1 400 pg/ml, P=0.004; HBL-1: 720 pg/ml vs 1 490 pg/ml, P=0.018; DLBCL:850 pg/ml vs 1 450 pg/ml, P=0.004) and expression of CXCR4 (P<0.05). When co-cultured with MSC, the ratio of HBL-1 cells apoptosis in the group of control, mitoxantrone, ibrutinib, mitoxantrone+ibrutinib were respectively 15.1%, 17.5%, 23.5%, 58.7%. After transfected with a CXCR4-lentivector and overexpressed CXCR4, the ratios of HBL-1 cells apoptosis were 14.2%, 16.1%, 22.5%, 38.3% respectively. The ratio of DLBCL cells apoptosis induced by mitoxantrone was lower when co-cultured with MSC (P<0.05). But with the addition of ibrutinib, the ratio of apoptosis was increaed and it was similar to cultivation without MSC, which suggested ibrutinib could inhibit drug-resistance induced by MSC. But after transfected with a CXCR4-lentivector, the overexpression of CXCR4 was detected and the ratio of apoptosis was significantly lower when co-cultured with MSC which demonstrated that ibrutinib inhibited drug-resistance by inhibiting the expression of CXCR4. MSC enhanced lymphoma clonogenicity in vitro and lymphoma cell growth in vivo. The number of colonies of control, MSC, Ibrutinib, MSC+Ibrutinib were 113±5, 205±4, 62±9, 123±3 (2.5×103/well, x±s), respectively. The tumor volume of NOD/SCID mice were respectively 6 500, 17 000, 4 000, 10 000 mm3. Ibrutinib inhibited lymphoma clonogenicity in vitro and lymphoma cell growth in vitro.
Conclusion
Ibrutinib targeted the CXCL12/CXCR4 axis, inhibited the expression of CXCR4 and inhibited MSC-mediated drug resistance. Ibrutinib also inhibited lymphoma clonogenicity in vitro and lymphoma cell growth in vivo. These results provided a scientific rationality for relapsed/refractory DLBCL treatment with ibrutinib.
Keywords: Lymphoma, large B-cell, diffuse; Chemokine CXCL12; Receptors, CXCR4; Ibrutinib
虽然多数弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)患者对初始治疗非常敏感,但仍有约30%的患者死于耐药和疾病进展[1]。DLBCL预后差被认为可能与肿瘤微环境中的细胞因子和趋化因子有关[2]。有研究者发现白血病和淋巴瘤患者骨髓中CXCL12/CXCR4表达持续上调,导致肿瘤细胞持续增长,造成传统化疗药物耐药和疾病复发[3]。近年来,针对BTK的靶向抑制剂依布替尼因其较好的疗效已被FDA批准应用于慢性淋巴细胞白血病(CLL)的一线治疗和套细胞淋巴瘤(MCL)的二线治疗中;同时,针对复发/难治性DLBCL的多个临床试验也在进行中,初步结果令人鼓舞。但该药是否能克服肿瘤微环境介导的DLBCL的耐药目前鲜有研究。本研究旨在探讨骨髓基质细胞(MSC)通过CXCL12/CXCR4轴介导DLBCL细胞耐药以及依布替尼克服该耐药的机制。
对象与方法
1.研究对象:DLBCL细胞系SUDHL10细胞(GCB亚型)由Dr. Jianguo Tao(美国Moffitt癌症中心血液病理科)提供,HBL-1细胞(ABC亚型)购于中国科学院上海生命科学研究院细胞资源中心。所有细胞系均接种于含10%胎牛血清和左旋谷氨酰胺29.2 g/L的RPMI 1640培养基中培养。
DLBCL原代细胞来自我院收治的8例DLBCL患者,已获医院伦理委员会批准及患者的知情同意。收集患者骨髓穿刺液和淋巴组织后,以Ficoll-Hypaque密度梯度离心法分离单个核细胞,再通过CD19标记的磁珠分选法(试剂盒为德国MiltenyiBiotec公司产品)分选淋巴细胞群备用。
正常人MSC来自我院2015年1月到2015年5月6名造血干细胞移植供者,参见文献[2]方法分离和培养MSC。已获医院伦理委员会批准及供者的知情同意。
依布替尼购自美国Selleck公司,米托蒽醌购自美国Sigma-Aldrich公司。
2.细胞趋化和黏附实验:实验分组:①对照组:SUDHL10、HBL-1、原代细胞单纯培养组;②共培养组:SUDHL10、HBL-1、原代细胞分别与MSC共培养;③药物处理组:2.5、5.0 µmol/L依布替尼(美国Selleck公司产品)处理肿瘤细胞组;④共培养药物处理组:2.5、5.0 µmol/L依布替尼处理肿瘤细胞+MSC组。
在趋化实验中,8 µm孔的Transwell微孔隔离室放入培养板内,将4×104/ml的MSC加于下室内包被下室,同时将1.5×105/ml的DLBCL细胞加入依布替尼处理2 h;之后将DLBCL细胞加于上室内,与下室内的MSC共同培养5 h后,经结晶紫液染色,显微镜下拍照计数,细胞迁移率以百分比表示,以不加依布替尼的共培养对照组的迁移率为100%。
在黏附实验中,1.5×105/ml DLBCL细胞加入5.0 µmol/L依布替尼处理6 h,随后以1∶4的比例与MSC共同培养2 h,PBS缓冲液洗去未黏附细胞,黏附细胞以5 g/L结晶紫液染色,570 nm波长下以分光光度计检测吸光度(A)值,Leica DM LB显微镜下拍照计数,Adobe Photoshop(7.0)成像。
黏附率(%)=[(A实验组/A对照组)−1]×100%
3.ELISA法检测依布替尼对MSC CXCL-12表达的影响:实验分组同上。在24孔板中进行MSC与DLBCL细胞共培养48 h或单独培养,加入5.0 µmol/L依布替尼处理,24 h后收集上清液,按Quantikine ELISA试剂盒(试剂盒为美国R&D Systems公司产品)说明书进行操作,检测MSC的CXCL12的表达水平。
4.流式细胞术检测依布替尼对DLBCL细胞CXCR4蛋白表达的影响:实验分组同上。DLBCL细胞与MSC共培养48 h或单独培养,加入5.0 µmol/L依布替尼处理,24 h后以冰冻PBS缓冲液冲洗细胞,以抗CXCR4蛋白抗体(美国R&D Systems公司产品)染色,上流式细胞仪(美国BD公司产品)检测DLBCL细胞CXCR4蛋白表达水平,采用FlowJo 2.7.4软件进行分析。
5.流式细胞术检测CXCR4过表达后依布替尼对HBL-1细胞凋亡的影响:实验分组同上。以携带CXCR4的慢病毒转染HBL-1细胞,24 h后去除病毒媒介,收集转染细胞继续培养,48 h后采用Western blot法检测CXCR4蛋白的表达[3]。确定慢病毒转染成功后,以0.2 µmol/L米托蒽醌和(或)7 µmol/L依布替尼对转染后的细胞进行处理,再与MSC共培养或单独培养,以膜联蛋白Ⅴ/碘化丙锭(美国BD Pharmingen公司产品)双染色后上流式细胞仪分析细胞凋亡率。
6.倒置显微镜下观察依布替尼对HBL-1细胞集落形成的影响:实验分组:①HBL-1细胞组;②HBL-1细胞+MSC组;③HBL-1细胞+依布替尼组;④HBL-1细胞+MSC+依布替尼组。在6孔板中加入MethoCult甲基纤维素培养基(加拿大Stem Cell Technologies公司产品)每孔1.0 ml,HBL-1细胞(每孔2.5×103)与MSC(每孔1×103)共培养或单独培养,以5 µmol/L依布替尼进行处理。2周后,以形成40个细胞以上的克隆为一个集落,在倒置显微镜下观察并计数各组的集落数。
7.体内成瘤实验检测依布替尼对HBL-1细胞体内增殖的影响:实验分组同方法6,每组5只小鼠。将HBL-1细胞和MSC以4∶1的比例皮下共同或HBL-1单独接种于NOD/SCID小鼠,当有明显的瘤块(直径≥ 5 mm)形成后,以依布替尼2.5 mg·kg−1·d−1对小鼠进行腹腔内注射,连续注射14 d,每隔10 d用卡尺测量小鼠皮下瘤块大小。
8.统计学处理:数据资料采用SPSS22.0软件进行统计学分析。体外实验每组设3个复孔,实验至少重复3次,结果以x±s表示。两两比较采用t检验,P<0.05为差异有统计学意义。
结果
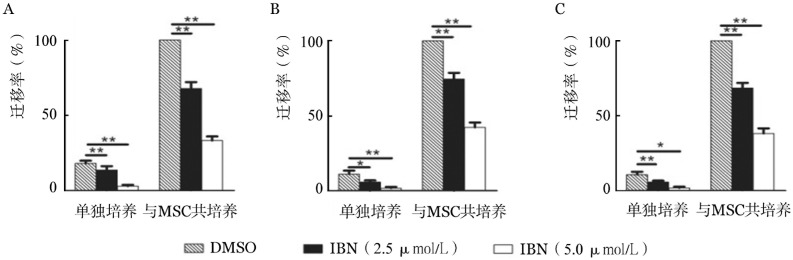
1.依布替尼对DLBCL细胞向MSC趋化和黏附的影响:趋化实验结果显示,DLBCL细胞与MSC共培养时其迁移率均明显高于单独培养;依布替尼处理后,DLBCL细胞迁移率均明显降低,且随着药物浓度增加,迁移率逐渐降低(P值均<0.05,图1)。
图1. 依鲁替尼(IBN)对弥漫大B细胞淋巴瘤(DLBCL)细胞向骨髓基质细胞(MSC)趋化的影响(**P<0.01,*P<0.05).
A:SUDHL10细胞;B:HBL-1细胞;C:DLBCL患者原代细胞
黏附实验结果显示,与未经依布替尼处理组比较,处理后的DLBCL细胞和MSC的黏附比例明显降低,差异有统计学意义(P值均<0.05)(表1)。
表1. 依鲁替尼(5.0 µmol/L)对弥漫大B细胞淋巴瘤细胞与骨髓基质细胞(MSC)黏附的影响(%,x±s).
| 组别 | 处理前 | 处理后 | t值 | P值 |
| SUDHL10细胞+MSC组 | 62.40±3.68 | 30.50±2.56 | 8.89 | 0.035 |
| HBL-1细胞+MSC组 | 56.50±4.92 | 27.68±3.71 | 6.12 | 0.025 |
注:每组设3个复孔,实验重复3次
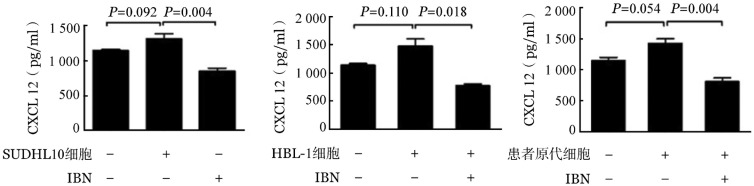
2.依布替尼对MSC CXCL12表达的影响:MSC与DLBCL细胞共培养时,MSC分泌CXCL12的水平明显高于MSC单独培养;依布替尼处理后,CXCL12的分泌水平明显降低(P值均<0.05)(图2)。
图2. ELISA法检测依鲁替尼(IBN,5.0 µmol/L)对共培养时骨髓基质细胞CXCL12表达的影响.
A:SUDHL10细胞;B:HBL-1细胞;C:弥漫大B细胞淋巴瘤患者原代细胞
3.依布替尼对DLBCL细胞CXCR4蛋白表达的影响:MSC与DLBCL细胞共培养时,DLBCL细胞CXCR4的表达水平明显高于DLBCL细胞单独培养;依布替尼处理后,CXCR4的表达水平较处理前明显降低,差异均有统计学意义(P值均<0.05)(表2)。
表2. 流式细胞术检测依鲁替尼(5.0 µmol/L)对弥漫大B细胞淋巴瘤(DLBCL)CXCR4表达的影响(%,x±s).
| 组别 | 处理前 | 处理后 | t值 | P值 |
| SUDHL10细胞组 | 0.40±0.01 | — | — | — |
| SUDHL10细胞+MSC组 | 98.40±2.35a | 61.60±1.20 | 7.68 | 0.005 |
| HBL-1细胞组 | 0.50±0.02 | — | — | — |
| HBL-1细胞+MSC组 | 99.30±4.06a | 58.60±2.13 | 6.98 | 0.013 |
| DLBCL原代细胞组 | 0.40±0.01 | — | — | — |
| DLBCL原代细胞+MSC组 | 97.70±5.21a | 60.20±1.45 | 8.71 | 0.015 |
注:MSC:骨髓基质细胞;—:未做;a与肿瘤细胞单独培养组比较,P<0.001;每组设3个复孔,实验重复3次
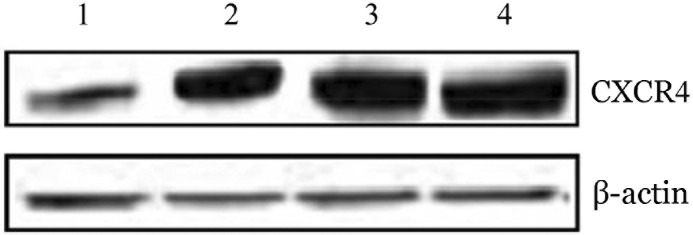
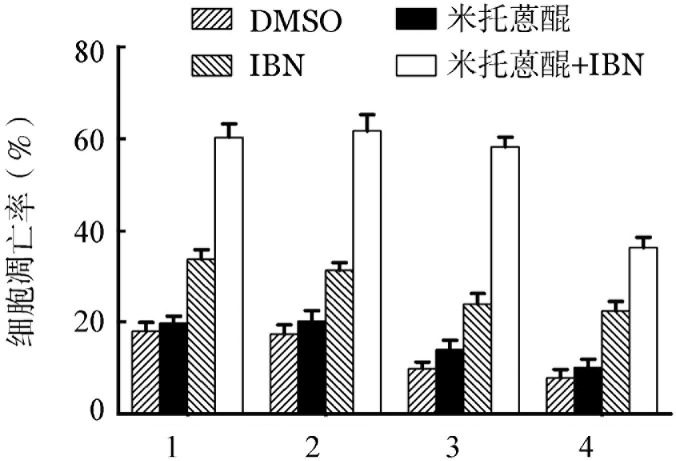
4.CXCR4过表达后依布替尼对HBL-1细胞凋亡的影响:CXCR4的慢病毒和空病毒转染HBL-1细胞后,Western blot法检测结果显示,慢病毒转染的HBL-1细胞出现CXCR4的过表达(图3),说明转染成功。转染后的HBL-1细胞经药物处理后,再与MSC共培养或单独培养。流式细胞术分析结果显示,共培养时米托蒽醌诱导HBL-1细胞凋亡的比例低于单独培养(16.1%对20.0%,P=0.025),加用依布替尼后,米托蒽醌诱导HBL-1细胞凋亡的比例提高(58.7%对38.3%,P=0.013)(图4)。
图3. Western blot法检测慢病毒转染HBL-1组胞后CXCR4的表达.
1:空病毒转染对照组;2:空病毒转染+骨髓基质细胞(MSC)组;3:慢病毒转染对照组;4:慢病毒转染+MSC组
图4. 流式细胞术分析CXCR4过表达后依布替尼(IBN)对HBL-1细胞凋亡的影响.
1:HBL-1细胞单独培养(对照组);2:CXCR4过表达组;3:HBL-1细胞+骨髓基质细胞(MSC)组;4:CXCR4过表达+MSC组
5.依布替尼对HBL-1细胞集落形成的影响:体外集落形成实验结果显示,与MSC共培养时HBL-1细胞形成的集落数明显高于单独培养组(205±4对113±5,t=8.64,P=0.005);依布替尼处理后,共培养组和单独培养组的集落数均较处理前降低,差异均有统计学意义(P值均<0.05)(表3)。
表3. 依布替尼对HBL-1细胞集落形成的影响(每2.5 × 103个细胞中的集落数,x±s).
| 组别 | 处理前 | 处理后 | t值 | P值 |
| HBL-1细胞组 | 113±5 | 62±9 | 8.25 | 0.012 |
| HBL-1细胞+MSC组 | 205±4 | 123±3 | 7.94 | 0.001 |
注:MSC:骨髓基质细胞;每组设3个复孔,实验重复3次
6.依布替尼对HBL-1细胞体内成瘤的影响:在体内皮下成瘤NOD/SCID小鼠模型中,MSC和HBL-1细胞共同接种时小鼠肿瘤团块生长速度高于HBL-1细胞单独接种;依布替尼治疗后,共同接种和单独接种小鼠肿瘤团块均减小(图5)。
图5. 依布替尼(IBN)对HBL-1细胞体内成瘤的影响(MSC:骨髓基质细胞).
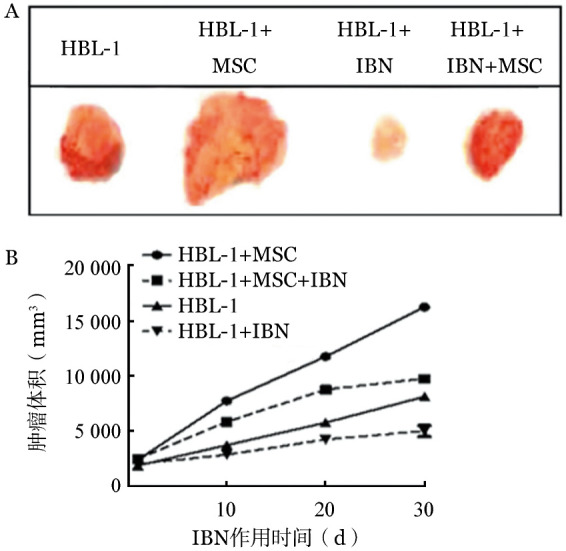
A:实验第30天各组荷瘤NOD/SCID小鼠瘤块比较;B:各组荷瘤NOD/SCID小鼠不同时间点瘤块体积比较
讨论
DLBCL作为一种侵袭性淋巴瘤,尽管以R-CHOP方案作为一线治疗使患者生存率得到了提高,但仍有部分患者存在快速进展和耐药的问题,复发、难治是其治疗的难点[4]。肿瘤微环境由许多类型细胞组成,这些细胞分泌细胞因子和趋化因子来调控肿瘤细胞与免疫细胞的交互作用,以此促进肿瘤的发展[5],而MSC被认为与肿瘤的进展和耐药密切相关[6]。MSC分泌的趋化因子CXCL12促进B细胞迁移,同时对淋巴瘤细胞还有促生存作用[7]。CXCL12与B细胞上的G蛋白偶联受体CXCR4结合,激活促存活信号并保护肿瘤B细胞免受细胞毒药物损伤[5]。肿瘤微环境中的趋化因子与肿瘤微环境相互作用是肿瘤的生存和耐药的重要机制之一[8]–[9]。以往有研究者发现,表达CXCR4的肿瘤细胞可被招募到富于CXCL12的MSC池内,这种招募作用类似于正常干细胞在骨髓中的归巢,被认为可保护肿瘤细胞免受化疗药物攻击[10]。
BCR信号通路在B细胞恶性肿瘤的生存、进展、增殖、运输过程中有重要作用[11]。BTK是非受体蛋白酪氨酸激酶Tec家族成员,参与BCR信号上游通路[12]。BCR信号通路成员,包括BTK,被认为是CXCL12/CXCR4轴作用的靶点[13]。研究发现BCR信号通路相关激酶抑制剂可以抑制由CXCL12介导的淋巴瘤细胞黏附作用和在基质中的迁移[14]。
依布替尼作为第一个不可逆的小分子BTK抑制剂,已在B细胞淋巴瘤的治疗中显示出很好的疗效[15]–[16]。在CLL和MCL中,BCR信号通路对整合素介导的恶性细胞在淋巴器官中的保留有重要的调节作用,而依布替尼可以迅速缩小淋巴瘤的大小并显示出短暂的淋巴细胞毒性[17]。依布替尼已在MCL、华氏巨球蛋白血症(WM)、CLL中取得确切且持久的临床反应,包括del(17p)的高危CLL患者;将依布替尼应用于初治CLL患者及与其他药物联合化疗的试验正在进行中[12]。在一项依布替尼单药治疗DLBCL的Ⅰ期临床试验中,6例患者中有2例获得部分缓解[18]。一项依布替尼联合R-CHOP方案治疗DLBCL的ⅠB期临床试验结果显示,18例患者中70%生发中心型和100%活化B细胞样型患者获得完全缓解(CR)[19],一项依布替尼、苯达莫司汀、利妥昔单抗联合治疗DLBCL的Ⅱ期临床试验中,16例(30%)患者获得CR[20]。
依布替尼的有效性不仅体现在直接作用于恶性B细胞的细胞毒作用,还可以抑制肿瘤微环境促使肿瘤细胞生长和生存的作用[21]。已有研究表明,依布替尼可靶向作用于BCR和趋化因子(CXCL12/CXCR4)调控的、整合素介导的细胞黏附,将肿瘤细胞从淋巴器官受保护区域中动员至外周循环中,从而使淋巴瘤衰退[22]。由此我们推测,依布替尼作为一种BCR信号通路相关激酶抑制剂,可以利用其抑制CXCL12/CXCR4轴的作用,直接抑制淋巴瘤细胞生长并干预肿瘤细胞与肿瘤微环境相互作用,从而成为治疗DLBCL的一项新策略。因此,如果能够明确依布替尼在肿瘤微环境中的作用,将为依布替尼联合其他药物以提高疗效并克服耐药提供科学的理论依据。
我们的趋化和黏附实验结果表明,依布替尼能够显著降低DLBCL细胞的迁移率并抑制DLBCL细胞与MSC的黏附。MSC与DLBCL细胞共培养时,MSC分泌的CXCL12和DLBCL细胞表达的CXCR4能相互诱导,上调表达水平,而依布替尼抑制CXCL12的分泌和CXCR4的表达。以上结果提示依布替尼靶向作用于CXCL12/CXCR4轴,可能是依布替尼抑制DLBCL细胞向骨髓MSC迁移和黏附,克服MSC介导的细胞毒药物耐药性的机制之一。
在本研究中,我们用携带CXCR4的慢病毒转染DLBCL细胞系,发现与MSC共培养时,加用依布替尼后,米托蒽醌诱导凋亡的比例提高,进一步证实依布替尼通过抑制CXCR4的表达进而克服MSC介导的耐药。体内外肿瘤克隆形成的研究结果显示,依布替尼抑制与MSC共培养时DLBCL细胞的体外克隆形成并抑制DLBCL细胞在NOD/SCID小鼠体内的增殖。
综上,我们的研究结果表明依布替尼靶向作用于CXCL12/CXCR4轴,从而克服MSC介导DLBCL细胞的耐药作用,并且依布替尼在体内外均有抑制MSC促DLBCL细胞增殖的作用。此研究结果为依布替尼作为治疗复发、难治的DLBCL提供了科学的理论依据。
Funding Statement
基金项目:国家自然科学基金(81600163、81570201)
Fund program: National Natural Science Foundation of China(81600163, 81570201)
References
- 1.中华医学会血液学分会, 中国抗癌协会淋巴瘤专业委员会. 中国弥漫大B细胞淋巴瘤诊断与治疗指南(2013年版)[J] 中华血液学杂志. 2013;34(9):816–819. doi: 10.3760/cma.j.issn.0253-2727.2013.09.019. [DOI] [Google Scholar]
- 2.Hong JY, Ryu KJ, Lee JY, et al. Serum level of CXCL10 is associated with inflammatory prognostic biomarkers in patients with diffuse large B-cell lymphoma[J] Hematol Oncol. 2016 doi: 10.1002/hon.2374. [DOI] [PubMed] [Google Scholar]
- 3.Barbieri F, Bajetto A, Thellung S, et al. Drug design strategies focusing on the CXCR4/CXCR7/CXCL12 pathway in leukemia and lymphoma[J] Expert Opin Drug Discov. 2016;11(11):1093–1109. doi: 10.1080/17460441.2016.1233176. [DOI] [PubMed] [Google Scholar]
- 4.Zhong W, Xu X, Zhu Z, et al. Increased expression of IRF8 in tumor cells inhi-bits the generation of Th17 cells and predicts unfavorable survival of diffuse large B cell lymphoma patients[J] Oncotarget. 2017 doi: 10.18632/oncotarget.17693. [Epub ahead of print] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Ping L, Ding N, Shi Y, et al. The Bruton's tyrosine kinase inhibitor ibrutinib exerts immunomodulatory effects through regulation of tumor-infiltrating macrophages[J] Oncotarget. 2017;8(24):39218–39229. doi: 10.18632/oncotarget.16836. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.夏 冰, 郭 青, 赵伟 鹏等. c-Myc在骨髓基质细胞介导的急性髓细胞白血病耐药中作用[J] 中华医学杂志. 2013;93(22):1746–1749. doi: 10.3760/cma.j.issn.0376-2491.2013.22.017. [DOI] [PubMed] [Google Scholar]
- 7.Burger JA, Gribben JG. The microenvironment in chronic lymphocytic leukemia (CLL) and other B cell malignancies: insight into disease biology and new targeted therapies[J] Semin Cancer Biol. 2014;24:71–81. doi: 10.1016/j.semcancer.2013.08.011. [DOI] [PubMed] [Google Scholar]
- 8.Nagasawa T, Kikutani H, Kishimoto T. Molecular cloning and structure of a pre-B-cell growth-stimulating factor[J] Proc Natl Acad Sci U S A. 1994;91(6):2305–2309. doi: 10.1073/pnas.91.6.2305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Malaponte G, Hafsi S, Polesel J, et al. Tumor microenvironment in diffuse large B-cell lymphoma: Matrixmetalloproteinases activation is mediated by osteopontin overexpression[J] Biochim Biophys Acta. 2016;1863(3):483–489. doi: 10.1016/j.bbamcr.2015.09.018. [DOI] [PubMed] [Google Scholar]
- 10.Mitteldorf C, Berisha A, Pfaltz MC, et al. Tumor Microenvironment and Checkpoint Molecules in Primary Cutaneous Diffuse Large B-Cell Lymphoma-New The-rapeutic Targets[J] Am J Surg Pathol. 2017 doi: 10.1097/PAS.0000000000000851. [Epubahead of print] [DOI] [PubMed] [Google Scholar]
- 11.Domanska UM, Kruizinga RC, Nagengast WB, et al. A review on CXCR4/CXCL12 axis in oncology: no place to hide[J] Eur J Cancer. 2013;49(1):219–230. doi: 10.1016/j.ejca.2012.05.005. [DOI] [PubMed] [Google Scholar]
- 12.Zhang Y, Zhao X, Tao J. Epigenetics, c-Myc and aggressive B-cell lymphomas[J] Oncotarget. 2012;3(11):1264–1265. doi: 10.18632/oncotarget.748. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Aw A, Brown JR. Current Status of Bruton's Tyrosine Kinase Inhibitor Development and Use in B-Cell Malignancies[J] Drugs Aging. 2017;34(7):509–527. doi: 10.1007/s40266-017-0468-4. [DOI] [PubMed] [Google Scholar]
- 14.Xargay-Torrent S, López-Guerra M, Montraveta A, et al. Sorafenib inhibits cell migration and stroma-mediated bortezomib resistance by interfering B-cell receptor signaling and protein translation in mantle cell lymphoma[J] Clin Cancer Res. 2013;19(3):586–597. doi: 10.1158/1078-0432.CCR-12-1935. [DOI] [PubMed] [Google Scholar]
- 15.Han TT, Fan L, Li JY, et al. Role of chemokines and their receptors in chronic lymphocytic leukemia: function in microenvironment and targeted therapy[J] Cancer Biol Ther. 2014;15(1):3–9. doi: 10.4161/cbt.26607. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Byrd JC, Furman RR, Coutre SE, et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia[J] N Engl J Med. 2013;369(1):32–42. doi: 10.1056/NEJMoa1215637. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Wang ML, Rule S, Martin P, et al. Targeting BTK with ibrutinib in relapsed or refractory mantle-cell lymphoma[J] N Engl J Med. 2013;369(6):507–516. doi: 10.1056/NEJMoa1306220. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.de Rooij MF, Kuil A, Kraan W, et al. Ibrutinib and idelalisib target B cell receptor- but not CXCL12/CXCR4-controlled integrin-mediated adhesion in Waldenström macroglobulinemia[J] Haematologica. 2016;101(3):e111–115. doi: 10.3324/haematol.2015.137265. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Advani RH, Buggy JJ, Sharman JP, et al. Bruton tyrosine kinase inhibitor ibrutinib (PCI-32765) has significant activity in patients with relapsed/refractory B-cell malignancies[J] J Clin Oncol. 2013;31(1):88–94. doi: 10.1200/JCO.2012.42.7906. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Younes A, Thieblemont C, Morschhauser F, et al. Combination of ibrutinib with rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisone (R-CHOP) for treatment-naive patients with CD20-positive B-cell non-Hodgkin lymphoma: a non-randomised, phase 1b study[J] Lancet Oncol. 2014;15(9):1019–1026. doi: 10.1016/S1470-2045(14)70311-0. [DOI] [PubMed] [Google Scholar]
- 21.Maddocks K, Christian B, Jaglowski S, et al. A phase 1/1b study of rituximab, bendamustine, and ibrutinib in patients with untreated and relapsed/refractory non-Hodgkin lymphoma[J] Blood. 2015;125(2):242–248. doi: 10.1182/blood-2014-08-597914. [DOI] [PubMed] [Google Scholar]
- 22.Chang BY, Francesco M, De Rooij MF, et al. Egress of CD19(+) CD5(+) cells into peripheral blood following treatment with the Bruton tyrosine kinase inhibitor ibrutinib in mantle cell lymphoma patients[J] Blood. 2013;122(14):2412–2424. doi: 10.1182/blood-2013-02-482125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.de Rooij MF, Kuil A, Kater AP, et al. Ibrutinib and idelalisib synergistically target BCR-controlled adhesion in MCL and CLL: a rationale for combination therapy[J] Blood. 2015;125(14):2306–2309. doi: 10.1182/blood-2014-12-619163. [DOI] [PMC free article] [PubMed] [Google Scholar]