Abstract
目的
探索中国骨髓增生异常综合征(MDS)患者基因突变特征。
方法
采用包含112个血液肿瘤相关基因的靶向测序技术对511例MDS患者进行基因突变检测,并回顾性分析其临床资料。
结果
全部511例MDS患者中,共检测到83个突变基因,439例(86%)患者伴有至少1个基因突变。对涉及的83个基因依据其功能进行分类,突变频率依次为表观遗传相关基因(50%)、剪接子相关基因(37%)、信号传导相关基因(34%)、转录因子(24%)和细胞周期与凋亡相关基因(17%)。不同亚型患者的平均基因突变数目分别为:难治性血细胞减少伴单系发育异常(RCUD)1.25个,难治性血细胞减少伴多系发育异常(RCMD)1.73个,难治性贫血伴环状铁粒幼红细胞(RARS)2.79个,难治性贫血伴原始细胞增多-1(RAEB-1)2.22个,RAEB-2 2.34个,MDS伴单纯5q− 2.67个,MDS未分类(MDS-U)2.00个。U2AF1突变患者单纯+8核型异常比例显著增高[Q<0.001,OR=4.42(95% CI 2.23~8.68)],复杂核型比例显著减低[Q=0.005,OR=0.22(95% CI 0.04~0.72)]。依据基因突变数目,将患者分为伴有0~1个基因突变组,伴有2个基因突变组和伴有3个及以上基因突变组,三组总生存(OS)差异具有统计学意义(P=0.041)。
结论
近九成的MDS患者伴有至少1个基因突变,表观遗传相关基因和剪接子相关基因是MDS最常受累基因。随着疾病的演进基因突变数增多,基因突变数目多的患者OS较差。
Keywords: 骨髓增生异常综合征, 靶向测序, 突变
Abstract
Objective
To study the characteristics of gene mutations in Chinese myelodysplastic syndromes (MDS) patients.
Methods
A total of 511 Chinese patients with MDS performed 112-gene targeted sequencing were retrospectively analyzed.
Results
Eighty-three distinct mutant genes were found in 511 patients with MDS. Amongst these, the most frequent mutations was associated with epigenetics (50%), followed by spliceosome (37%), signal transduction (34%), transcription factors (24%) and cell cycle/apoptosis (17%). 439 subjects (86%) had at least one gene mutation. The mean number of mutations in refractory anemia with unilineage dysplasia (RCUD) was 1.25, refractory anemia with multilineage dysplasia (RCMD) was 1.73, refractory anemia with ring sideroblasts (RARS) was 2.79, refractory anemia with excess blasts-1 (RAEB-1) was 2.22, RAEB-2 was 2.34, MDS with isolated 5q− was 2.67, MDS, unclassified (MDS-U) was 2.00. U2AF1 mutant subjects were more likely to have isolated+8[Q<0.001, OR=4.42 (95% CI 2.23–8.68)] and less likely to have complex karyotypes[Q=0.005, OR=0.22 (95% CI 0.04–0.72)]. According to the number of gene mutations, all subjects were categorized into three groups, namely group with 0–1 mutation, with 2 mutations and with three or more mutations. There was a significant difference in overall survival (OS) among three groups (P=0.041).
Conclusion
About 90% patients with MDS have at least one gene mutation. Genes associated with epigenetics and spliceosome are most common mutated genes in MDS. The increased numbers of gene mutations accompany with disease evolution and associate with poor prognosis.
Keywords: Myelodysplastic syndromes, Targeted sequencing, Mutation
骨髓增生异常综合征(MDS)是一组起源于造血干细胞的异质性髓系肿瘤。进入21世纪后,随着对MDS相关基因突变的不断认识,单基因分析、靶向基因组合分析和基因组分析相继用于其诊断、预后判断、治疗药物选择等领域,开启了MDS精准诊断和精准治疗的新征程[1]–[2]。我们采用涵盖112个血液肿瘤相关基因的靶向测序技术对511例MDS患者基因突变进行分析,现报道如下。
病例与方法
1.病例:2004年3月至2016年10月于中国医学科学院血液病医院MDS诊疗中心就诊并保存骨髓细胞DNA标本的511例MDS患者纳入研究。男308例,女203例,中位年龄52(14~84)岁。采用WHO(2008)标准[3]进行诊断和分型,其中难治性血细胞减少伴单系发育异常(RCUD)16例(3%),难治性血细胞减少伴多系发育异常(RCMD)279例(55%),难治性贫血伴环状铁粒幼红细胞(RARS)14例(3%),难治性贫血伴原始细胞增多-1(RAEB-1)83例(16%),RAEB-2 104例(20%),MDS伴单纯5q−6例(1%),MDS未分类(MDS-U)9例(2%)。
2.靶向测序检测基因突变:取1 µg DNA制备DNA全基因组文库。使用PCR引物扩增目的基因组(112个血液肿瘤相关基因),将目标区域DNA富集后,采用Ion Torrent测序平台进行测序。测序后原始数据利用CCDS、人基因组数据库(HG19)、dbSNP(v138)、1 000 genomes、COSMIC、PolyPhen、SIFT等数据库进行生物信息学分析,确定致病性基因突变位点。平均基因覆盖率98.1%,平均测序深度1 314×,95%的目标区域测序深度超过20×。
3.染色体核型分析:骨髓细胞经过24 h培养,收集细胞常规制片,G或R显带,根据《人类细胞遗传学国际命名体制(ISCN2013)》描述核型异常[4]。依据修订的国际预后积分系统(IPSS-R)染色体核型分组标准[5]进行染色体核型预后分组。
4.治疗方式:全部511例MDS患者中,82例(16%)接受单纯支持治疗,257例(50%)接受免疫抑制剂或免疫调节剂治疗[6],65例(13%)接受地西他滨治疗[7],39例(8%)接受造血干细胞移植,52例(10%)接受中医中药治疗,16例(3%)接受CAG/HAG(阿克拉霉素/高三尖杉酯碱+阿糖胞苷+G-CSF)方案化疗。
5.预后评估:采用IPSS-R[5]对患者进行预后分组和评估。
6.随访:所有病例随访至2016年12月31日。随访资料来源于住院病历、门诊病历。对随访期间死亡的病例,依病例记录或与患者家属电话联系确认。总生存(OS)期按确诊至死亡的时间或确诊至2016年12月31日计算。失访患者共29例(6%)。中位随访时间为20(1~144)个月。
7.统计学处理:采用Fisher确切概率法对基因突变与MDS亚型和染色体核型关系的四格表资料进行率的比较,并应用R 3.4.2软件,使用qvalue程序包采用Benjamini-Hochberg法对P值进行多重校正,双侧检验Q<0.05为差异有统计学意义。应用SPSS 17.0软件,采用Kaplan-Meier法进行生存分析,采用Log-rank检验进行单因素分析。双侧检验P<0.05为差异有统计学意义。应用GraphPad Prism 7.0及R 3.4.2软件绘制统计图。
结果
1.患者一般临床资料:全部511例MDS患者中位HGB 76(29~173)g/L,中位ANC 1.19(0.04~11.90)×109/L,中位PLT 62(21~561)×109/L。457例患者诊断时具有可供分析的染色体核型结果,其中染色体核型正常224例(49%),异常233例(51%)。依据IPSS-R染色体核型分组:极好核型5例(1%),良好核型270例(59%),中等核型113例(25%),不良核型26例(6%),极差核型43例(9%)。依据IPSS-R预后分组:极低危组12例(3%),低危组115例(25%),中危组152例(33%),高危组92例(20%),极高危组86例(19%)。
2.基因突变谱系:全部511例MDS患者中,共检测到83个突变基因。突变频率最高的10个基因详见表1。对涉及的83个基因依据其功能进行分类,突变频率依次为:表观遗传相关基因(占50%,包括ASXL1、TET2、SETBP1、DNMT3A、IDH1/2、KMT2D、EZH2、EP300、WT1、ARID1A、PRDM1、PAX5、ZMYM3),剪接子相关基因(占37%,包括U2AF1、SF3B1、SRSF2、SF1、SF3A1、U2AF2、ZRSR2),信号传导相关基因(占34%,包括NRAS、CBL、KRAS、NOTCH1、PTPN11、NF1、IL7R、KIT、SH2B3、JAK2、NOTCH2、JAK1、FGFR3、JAK3、ITK、CSF3R、GATA2、BRAF、CALR、EGFR、PDGFRB、MPL、FLT3、RAB27、PTEN、PIK3CA、PRPF40B),转录因子(占24%,包括CEBPA、CREBBP、RUNX1、GATA3、CUX1、BCL6、DDX3X、PHF6)和细胞周期与凋亡相关基因(占17%,包括TP53、NPM1、XPO1、CDKN1、XIAP、CYLD、BIRC3、ABL1、MYD88、TRAF3)。涉及其他功能相关的基因包括FAT1、RELN、UNC13D、LYST、MUM1、ATM、ETV6、PRF1、ABCB1、MYH11、WHSC1、DNM2、ADAMTS13、DIS3、ECT2L、SMC1A、ALAS2。
表1. 中国骨髓增生异常综合征(MDS)患者与西方MDS患者基因突变频率排序比较.
全部511例患者中,不伴有基因突变者72例(14%),伴有1个基因突变者148例(29%),伴有2个基因突变者138例(27%),伴有3个基因突变者80例(16%),伴有3个以上基因突变者73例(14%)。不同亚型患者的平均基因突变数目分别为:RCUD 1.25个,RCMD 1.73个,RARS 2.79个,RAEB-1 2.22个,RAEB-2 2.34个,MDS伴单纯5q−2.67个,MDS-U 2.00个(图1A)。各亚型患者中,伴有3个以上基因突变者比例分别为:RCUD 0,RCMD 10%,RAEB-1 17%,RAEB-2 23%,RARS 29%(4/14)(图1B)。467例(91%)患者伴有基因突变和(或)染色体核型异常。
图1. 不同骨髓增生异常综合征(MDS)亚型患者的平均基因突变数目(A)和不同基因突变数目的比例(B).
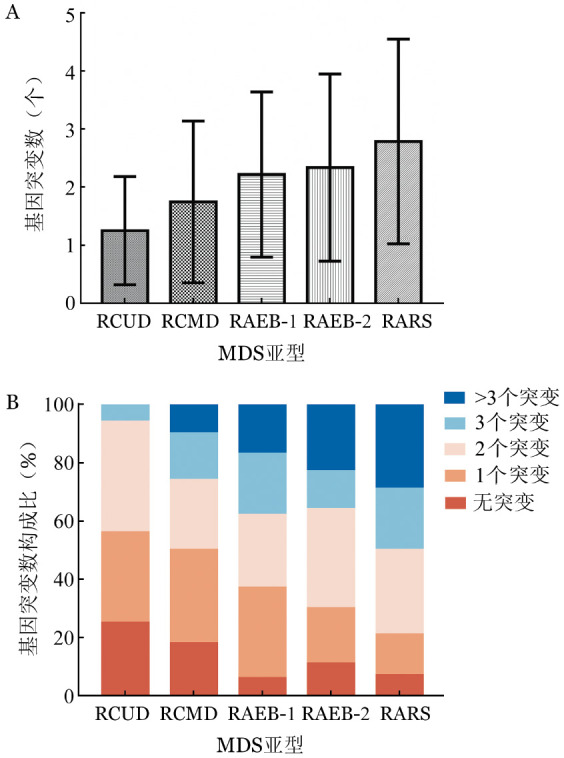
RCUD:难治性血细胞减少伴单系发育异常;RCMD:难治性血细胞减少伴多系发育异常;RAEB:难治性贫血伴原始细胞增多;RARS:难治性贫血伴环状铁粒幼红细胞
3.基因突变与MDS亚型及染色体核型之间的关系:基因突变与MDS亚型和染色体核型之间的关系见图2。RARS患者SF3B1突变比例显著增高[Q<0.001,OR=74.59(95% CI 10.90~3 156.29)]。U2AF1突变患者单纯+8核型异常比例显著增高[Q<0.001,OR=4.42(95% CI 2.23~8.68)],复杂核型比例显著减低[Q=0.005,OR=0.22(95% CI 0.04~0.72)]。TP53突变患者复杂核型比例显著增高[Q<0.001,OR=10.14(95% CI 4.99~20.74)]。NPM1突变常合并单纯20q−[Q=0.030,OR=5.44(95% CI 1.01~22.83)]。SETBP1突变与RAEB-1密切相关[Q=0.021,OR=2.35(95% CI 1.10~4.77)],且SETBP1突变不易合并复杂核型[Q=0.030,OR=0.14(95% CI 0.00~0.87)]。SRSF2突变与RAEB-1密切相关[Q=0.031,OR=3.84(95% CI 1.00~14.47)]。NRAS突变与RAEB-1[Q=0.016,OR=3.14(95% CI 1.10~8.37)]和RAEB-2[Q=0.019,OR=2.90(95% CI 1.31~9.12)]密切相关。
图2. 基因突变与骨髓增生异常综合征(MDS)亚型和染色体核型之间的关系.
RCUD:难治性血细胞减少伴单系发育异常;RCMD:难治性血细胞减少伴多系发育异常;RAEB:难治性贫血伴原始细胞增多;RARS:难治性贫血伴环状铁粒幼红细胞;aP<0.05,bP<0.01
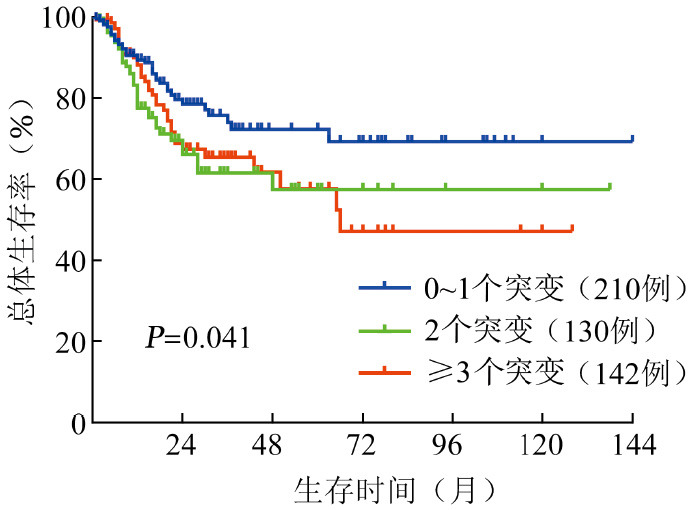
4.基因突变数目与患者生存的关系:依据基因突变数目,将患者分为伴有0~1个基因突变组220例(43%)、2个基因突变组138例(27%)、3个及以上基因突变组153例(30%),三组患者OS差异具有统计学意义(P=0.041)(图3)。
图3. 482例骨髓增生异常综合征(MDS)患者不同基因突变数目分组的生存曲线.
讨论
近年,国外几个大系列MDS患者二代基因测序研究[8]–[10]揭示:①MDS的受累基因约有60个。②突变频率大于10%的基因包括SF3B1、TET2、SRSF2、ASXL1、DNMT3A和RUNX1。③受累基因按功能共分为以下几类:剪接子相关基因,如SF3B1、SRSF2、U2AF1、ZRSR2等;染色质修饰相关基因,如ASXL1、EZH2等;DNA甲基化相关基因,如TET2、DNMT3A、IDH1/2等;转录因子,如RUNX1等;DNA损伤修复,如TP53等;信号转导相关基因,如KRAS、NRAS、CBL等。
本组MDS患者的基因突变谱系与既往研究[8]–[10]相比基本一致:①基因突变总体发生频率为86%,如果基因突变联合染色体核型分析91%的患者存在有克隆性标志;②基因突变数目随着RCUD→RCMD→RAEB-1→RAEB-2疾病演进呈不断增多趋势,RARS患者突变数目相对较多,可能与本组患者中RARS患者例数较少,存在偏倚有关;③剪接子相关基因和表观遗传相关基因突变最常见,提示其可能为MDS克隆的起始基因突变。与既往研究[8]–[10]有所区别的是本组患者基因突变检出频率较高的基因为U2AF1、SETBP1、CEBPA和CREBBP,而SRSF2、EZH2突变率较低,这是否与种族遗传背景或生活环境及习惯等原因有关,尚待全国多中心、更大规模的数据来加以验证。
对常见的基因突变与MDS亚型和染色体核型之间的关系分析结果,进一步证实了SF3B1基因突变与环状铁粒幼红细胞密切相关[11]–[13],TP53基因突变与复杂核型密切相关[9]。与Graubert等[14]和Bacher等[15]发现U2AF1突变常伴发20q−不同,本研究我们发现U2AF1基因突变常与单纯+8核型异常同时出现,这与国内吴凌云等[16]报道相一致。+8核型异常发生率高是我国MDS患者的细胞遗传学特征之一[17]–[18],同时U2AF1发生率也较高,两者之间的关系值得进一步研究。至于U2AF1突变和异常染色体核型内在关系的机制目前尚不明确,可能与U2AF1突变所致的mRNA剪接异常、下游涉及染色体稳定性相关的靶基因表达异常有关。SETBP1和NRAS突变与RAEB密切相关,与既往研究[19]–[21]认为NRAS、SETBP1突变是MDS疾病进程中的晚期事件,预示疾病向急性髓系白血病转化的观点相一致。此外,本研究还证实患者基因突变数目越多,预后越差,这与文献[9]报道相一致。
综上,本研究结果提示:①克隆性造血是MDS诊断的三个关键点之一[22],本组患者染色体核型异常检出率为51%,但染色体核型异常联合基因突变则91%的患者存在克隆性标志,尽管仅SF3B1突变用于MDS伴环状铁粒幼红细胞增多(MDS-RS)诊断,不能单独依据其他基因突变来诊断MDS,但基因突变可提供“克隆”标志支持MDS的确诊,现阶段至少可以将SF3B1、TET2、U2AF1、SRSF2、ASXL1、DNMT3A和RUNX1等高频突变基因列入MDS诊断常规;②与我们既往基于一代测序技术对我国MDS患者基因突变的研究[12]–[13],[23]一致,我国MDS患者基因突变的某些特征不同于西方国家MDS患者,是由于单中心病例选择带来的偏倚,还是我国MDS患者的独有特征,值得下一步全国多中心分子流行病学研究来加以验证;③基因突变数目与MDS疾病演进及预后高度相关,但突变克隆的演变规律及其与预后判断和指导治疗策略制定等迄今尚知之甚少,将是今后探究的主要方向。
Funding Statement
基金项目:国家自然科学基金(81470295、81530008、81370611、81600098、81270585);协和学者与创新团队发展计划;协和青年基金和中央高校基本科研业务费专项(3332016089)
Fund program: National Natural Science Foundation of China(81470295, 81530008, 81370611, 81600098, 81270585); Program for Peking Union Scholars and Innovative Research Team; PUMC Youth Fund and Fundamental Research Funds for the Central Universities(3332016089)
References
- 1.肖 志坚. 骨髓增生异常综合征的精确诊断[J] 中华血液学杂志. 2015;36(5):361–362. doi: 10.3760/cma.j.issn.0253-2727.2015.05.001. [DOI] [Google Scholar]
- 2.肖 志坚. 骨髓增生异常综合征——已开启个体化治疗新时代?[J] 中国医药生物技术. 2016;11(2):114–115. doi: 10.3969/j.issn.1673-713X.2016.02.004. [DOI] [Google Scholar]
- 3.Swerdlow SH, Campo E, Haris NL, et al. WHO classification of tumors of hematopoietic and lymphoid tissues[M] Lyon: IARC; 2008. [Google Scholar]
- 4.Shaffer LG, McGowan-Jordan J, Schmid M, et al. An international system for human cytogenetic nomenclature (2013)[M] Basel: ISCN; 2013. [Google Scholar]
- 5.Greenberg PL, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes[J] Blood. 2012;120(12):2454–2465. doi: 10.1182/blood-2012-03-420489. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Xiao Z, Xu Z, Zhang Y, et al. Cyclosporin A and thalidomide in patients with myelodysplastic syndromes: Results of a pilot study[J] Leuk Res. 2011;35(1):61–65. doi: 10.1016/j.leukres.2010.06.004. [DOI] [PubMed] [Google Scholar]
- 7.雒 雪萍, 徐 泽锋, 秦 铁军, et al. 地西他滨治疗难治性贫血伴有原始细胞过多的疗效和不良反应与治疗疗程数的关系[J] 中华血液学杂志. 2016;37(10):870–875. doi: 10.3760/cma.j.issn.0253-2727.2016.10.011. [DOI] [Google Scholar]
- 8.Haferlach T, Nagata Y, Grossmann V, et al. Landscape of genetic lesions in 944 patients with myelodysplastic syndromes[J] Leukemia. 2014;28(2):241–247. doi: 10.1038/leu.2013.336. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Papaemmanuil E, Gerstung M, Malcovati L, et al. Clinical and biological implications of driver mutations in myelodysplastic syndromes[J] Blood. 2013;122(22):3616–3627; quiz 3699. doi: 10.1182/blood-2013-08-518886. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Makishima H, Yoshizato T, Yoshida K, et al. Dynamics of clonal evolution in myelodysplastic syndromes[J] Nat Genet. 2017;49(2):204–212. doi: 10.1038/ng.3742. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Papaemmanuil E, Cazzola M, Boultwood J, et al. Somatic SF3B1 mutation in myelodysplasia with ring sideroblasts[J] N Engl J Med. 2011;365(15):1384–1395. doi: 10.1056/NEJMoa1103283. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Cui R, Gale RP, Xu Z, et al. Clinical importance of SF3B1 mutations in Chinese with myelodysplastic syndromes with ring sideroblasts[J] Leuk Res. 2012;36(11):1428–1433. doi: 10.1016/j.leukres.2012.08.015. [DOI] [PubMed] [Google Scholar]
- 13.Li Y, Cui R, Qin T, et al. Validation of the WHO 2016 proposals for Myelodysplastic syndromes patients with the presence of ring sideroblasts but without excess blasts[J] Br J Haematol. 2017;178(5):813–816. doi: 10.1111/bjh.14168. [DOI] [PubMed] [Google Scholar]
- 14.Graubert TA, Shen D, Ding L, et al. Recurrent mutations in the U2AF1 splicing factor in myelodysplastic syndromes[J] Nat Genet. 2011;44(1):53–57. doi: 10.1038/ng.1031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Bacher U, Haferlach T, Schnittger S, et al. Investigation of 305 patients with myelodysplastic syndromes and 20q deletion for associated cytogenetic and molecular genetic lesions and their prognostic impact[J] Br J Haematol. 2014;164(6):822–833. doi: 10.1111/bjh.12710. [DOI] [PubMed] [Google Scholar]
- 16.吴 凌云, 祁 岳坤, 许 峰, et al. 349例骨髓增生异常综合征患者U2AF1基因突变的临床研究[J] 中华血液学杂志. 2017;38(1):68–70. doi: 10.3760/cma.j.issn.0253-2727.2017.01.015. [DOI] [Google Scholar]
- 17.曲 士强, 刘 旭平, 徐 泽锋, et al. 不同细胞遗传学预后分组对原发性骨髓增生异常综合征患者预后意义的研究[J] 中华血液学杂志. 2011;32(12):819–824. doi: 10.3760/cma.j.issn.0253-2727.2011.12.004. [DOI] [Google Scholar]
- 18.张 彤彤, 孙 爱宁, 潘 金兰, et al. 单中心550例骨髓增生异常综合征患者临床特点、细胞遗传学特征及预后分析[J] 中华血液学杂志. 2016;37(10):864–869. doi: 10.3760/cma.j.issn.0253-2727.2016.10.009. [DOI] [Google Scholar]
- 19.Takahashi K, Jabbour E, Wang X, et al. Dynamic acquisition of FLT3 or RAS alterations drive a subset of patients with lower risk MDS to secondary AML[J] Leukemia. 2013;27(10):2081–2083. doi: 10.1038/leu.2013.165. [DOI] [PubMed] [Google Scholar]
- 20.Murphy DM, Bejar R, Stevenson K, et al. NRAS mutations with low allele burden have independent prognostic significance for patients with lower risk myelodysplastic syndromes[J] Leukemia. 2013;27(10):2077–2081. doi: 10.1038/leu.2013.160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Hou HA, Kuo YY, Tang JL, et al. Clinical implications of the SETBP1 mutation in patients with primary myelodysplastic syndrome and its stability during disease progression[J] Am J Hematol. 2014;89(2):181–186. doi: 10.1002/ajh.23611. [DOI] [PubMed] [Google Scholar]
- 22.肖 志坚. 骨髓增生异常综合征的诊断[J] 诊断学理论与实践. 2016;15(6):545–549. doi: 10.16150/j.1671-2870.2016.06.001. [DOI] [Google Scholar]
- 23.Wang J, Ai X, Gale RP, et al. TET2, ASXL1 and EZH2 mutations in Chinese with myelodysplastic syndromes[J] Leuk Res. 2013;37(3):305–311. doi: 10.1016/j.leukres.2012.10.004. [DOI] [PubMed] [Google Scholar]



