Abstract
目的
评估程序性细胞死亡受体1(PD-1)抑制剂Nivolumab对CD19-CAR-T细胞体外增殖和杀伤活性的影响。
方法
收集5例外周血PD-1高表达恶性淋巴瘤患者的外周血T细胞制备CD19-CAR-T细胞,在培养第8天加入终浓度分别为72、36、18 µg/ml的Nivolumab,同时设患者T细胞联合72 µg/ml Nivolumab及正常人CD19-CAR-T细胞为对照,采用CCK-8法、LDH细胞毒性检测、ELISA法比较各组的增殖活性、杀伤活性及炎症因子水平。
结果
①PD-1高表达患者CD19-CAR-T细胞转染率与正常人接近[(32.80±7.22)%对(35.10±5.84)%,t=−0.554,P=0.593]。②72 µg/ml Nivolumab联合CD19-CAR-T细胞不影响其增殖,但联合应用24、48 h对Pfeiffer细胞的杀伤率均优于单用患者CD19-CAR-T细胞及患者来源T细胞+72 µg/ml的Nivolumab(P值均<0.001),其中48 h时各组的杀伤率分别为(71.61±9.50)%、(6.77±1.26)%、(15.33±4.11)%。72、36 µg/ml Nivolumab联合来源CD19-CAR-T细胞对Pfeiffer细胞的杀伤率差异无统计学意义(P值分别为0.281、0.267),二者均高于患者来源CD19-CAR-T细胞+18 µg/ml Nivolumab组(P值均<0.001)。③不同剂量Nivolumab联合患者来源CD19-CAR-T细胞,不影响炎症因子IFN-γ、TNF-α水平(P值均>0.05)。
结论
终浓度为36 µg/ml的Nivolumab与CD19-CAR-T细胞联合应用,可在减轻药物毒副作用同时增强CD19-CAR-T细胞的杀伤活性。
Keywords: PD-1抑制剂, 嵌合抗原受体, 淋巴瘤
Abstract
Objective
To Evaluation the effect of PD-1 inhibitor Nivolumab on the proliferation and cytotoxicity of anti-CD19 chimeric antigen receptor T cells (CD19-CAR-T) in vitro.
Methods
Five patients with high PD-1 expression in peripheral blood and five healthy volunteers were selected. These peripheral blood mononuclear cells were used as the source of T cells to prepare CD19-CAR-T cells. Different doses (72, 36, 18 µg/ml) of Nivolumab was added on day 8 to the culture medium. Patient T cells incubated with 72 µg/ml Nivolumab and CD19-CAR-T cells of healthy volunteers were used as controls. CCK-8, lactate dehydrogenase (LDH) cytotoxicity assay and ELASA were used to detect the proliferation capacity, the specific cytotoxicity and the inflammatory factor secretion.
Results
①T cells from patients with high expression of PD-1 as the source of CD19-CAR-T cells did not affect transfection rate compared with that of healthy volunteers [(32.80±7.22)% vs (35.10±5.84)%, t=−0.554, P=0.593]. ②Incubation of CD19-CAR-T cells with 72 µg/ml Nivolumab did not affect CD19-CAR-T cell proliferation, but its cytotoxicity was significantly higher than that of CD19-CAR-T cells alone or patients' T cells +72 µg/ml Nivolumab (all P<0.001), there was no significant difference in the killing activity between the 72 µg/ml and 36 µg/ml Nivolumab treated CD19-CAR-T cells on Pfeiffer cells (P=0.281, 0.267, respectively), and they were all higher than those of 18 µg/ml Nivolumab treated CD19-CAR-T cells (all P<0.001). ③Different doses of PD-1 inhibitor Nivolumab combined with CD19-CAR-T cells does not affect the secretion of IFN-γ and IFN-α (all P>0.05).
Conclusion
Combination of 36 µg/ml PD-1 inhibitor and CD19-CAR-T cells could reduce the drug toxicity and enhance the cytotoxicity.
Keywords: PD-1 inhibitor, Chimeric antigen receptor, Lymphoma
嵌合抗原受体T细胞(chimeric antigen receptor engineered T cell,CAR-T细胞)治疗已成为最具应用前景的肿瘤免疫治疗方法之一,但程序性死亡因子1受体(programmed cell death-1,PD-1)/程序性死亡受体-配体1(programmed cell death-Ligand 1,PD-L1)免疫抑制性途径的存在削弱了其治疗效果,通过PD-1抑制剂进行抗体封闭可增强CAR-T细胞的杀伤活性[1]。PD-1/PD-L1信号通路在削弱抗肿瘤免疫应答方面发挥重要作用[2]–[3],靶向这一途径的检查点治疗如PD-1抗体Nivolumab、Pembrolizumab及PD-L1抗体BMS-936559、MEDI4736已取得突破性进展[4]–[5]。PD-1抑制剂与CAR-T细胞联合应用,可否进一步提高疗效,我们对此开展了相关的体外研究,现报道如下。
材料与方法
1.细胞及主要试剂:人肾上皮细胞系293T细胞、弥漫大B细胞淋巴瘤细胞株Pfeiffer细胞均购自美国模式培养物集存库(ATCC),大肠杆菌感受态细胞株DH5а细胞购自宝生物工程(大连)有限公司。无内毒素质粒提取试剂盒购自天根生化科技(北京)有限公司。Lenti-Pac慢病毒颗粒包装试剂盒购自上海伯易生物科技有限公司。磁珠分选试剂盒购自德国美天旎生物技术有限公司。CARTEST-19检测试剂盒购自上海近岸科技有限公司。LDH细胞毒性检测试剂盒、ELISA检测试剂盒购自上海碧云天生物技术有限公司。CCK-8细胞增殖-毒性检测试剂盒购自日本同仁化学研究所。第三代(共刺激分子为CD28和4-1BB)抗CD19 CAR质粒购自美国Creative Biolabs公司。CD19单克隆抗体购自美国BD公司。PD-1抑制剂Nivolumab购自美国百时美施贵宝公司。
2.质粒转化、扩增、提取:DH5а菌株置于冰上解冻,加入抗CD19 CAR质粒,冰中放置30 min,42 °C放置30~60 s,再次置于冰中2~3 min。加入37 °C预温的SOC培养基,振荡培养1 h。取适量菌液,三区划菌,过夜培养后挑取单个白色菌落扩增培养12~16 h。取500 µl培养后的菌液加入SOC培养基中,37 °C振荡培养12~16 h。采用无内毒素质粒提取试剂盒提取质粒后进行定量。
3.慢病毒包装、转染及滴度测试:转染前2 d在平板上接种(1.3~1.5)×106 293T细胞。采用Lenti-Pac慢病毒颗粒包装试剂盒包装慢病毒并转染至293T细胞,转染48 h后收集病毒颗粒,提取病毒RNA,采用real-time PCR检测病毒滴度。用无血清的DMEM培养基悬浮病毒沉淀、分装,−80 °C保存。
4.T细胞制备及慢病毒感染:收集5例外周血PD-1高表达恶性淋巴瘤患者、5例健康志愿者的外周血标本,作为本实验CAR-T细胞培养的T细胞来源,采用淋巴细胞分离液提取单个核细胞。采用磁珠分选试剂盒从提取的单个核细胞中富集CD3+ T细胞。获得的细胞沉淀用含有IL-2、谷氨酰胺的T细胞专用培养基培养,培养第4天接种慢病毒,培养第8天加入Nivolumab培养第12天收获CAR-T细胞。
5.实验分组:(1)5例PD-1高表达患者来源CD19-CAR-T细胞;(2)5例PD-1高表达患者来源CD19-CAR-T细胞联合终浓度分别为72、36、18 µg/ml Nivolumab;(3)5例PD-1高表达患者来源T细胞联合终浓度为72 mg/L的Nivolumab;(4)5例健康志愿者CD19-CAR-T细胞。
6.CD19-CAR-T细胞转染效率的检测:按CARTEST-19检测试剂盒说明书进行操作,上流式细胞仪检测CD19-CAR-T细胞的转染效率。
7.CD19-CAR-T细胞体外增殖能力的检测:将收获的CD19-CAR-T细胞于含10% FBS的RPMI 1640培养基,37 °C、饱和湿度、5%CO2培养箱中培养。按CCK-8细胞增殖-毒性检测试剂盒说明书进行操作,培养0、24、48 h时采用酶标仪检测450 nm处吸光度(A)值,计算其增殖能力。共5例患者,每组设3个复孔,实验重复3次。
8.体外杀伤活性的检测:以Pfeiffer细胞为靶细胞(细胞计数为2×105),各组T细胞作为效应细胞进行实验,效靶比为4∶1。按LDH细胞毒性检测试剂盒说明书进行操作,共培养0、24、48 h时采用酶标仪检测490 nm处A值,计算其杀伤率。共5例患者,每组设3个复孔,实验重复3次。
9.CD19-CAR-T细胞引起靶细胞炎症因子释放的检测:按ELISA检测试剂盒说明书进行操作,采用酶标仪检测450 nm处A值。共5例患者,每组设3个复孔,实验重复3次。
10.统计学处理:实验数据均采用SPSS 17.0软件进行统计学分析,两组间比较采用独立样本的t检验,各时点的组间比较行单因素方差分析,两两比较采用q检验,双侧P<0.05为差异有统计学意义。
结果
1.CD19-CAR-T细胞的转染效率:5例患者平均外周血T细胞PD-1表达率为(62.3±15.67)%,其中1例患者PD-1表达率达到82.95%。CD19-CAR-T细胞病毒滴度为3×108 TU/ml,5例PD-1高表达患者外周血T来源CD19-CAR-T细胞的转染率为(32.80±7.22)%,与健康供者T细胞来源CD19-CAR-T细胞转染效率[(35.10±5.84)%]相近,差异无统计学意义(t=−0.554,P=0.593)。
2.Nivolumab对CD19-CAR-T细胞增殖能力的影响:加入不同浓度Nivolumab的患者CD19-CAR-T细胞,与不加入Nivolumab的患者和健康志愿者CD19-CAR-T细胞组间比较,在培养0、24、48 h时细胞增殖率差异均无统计学意义(F值分别为1.506、2.143、2.576,P值分别为0.250、0.126、0.080)(图1),PD-1高表达患者CD19-CAR-T细胞中加入终浓度分别为72、36、18 µg/ml的Nivolumab培养48 h时,细胞增殖率分别为(81.20±14.01)%、(93.56±13.85)%、(106.32±14.28)%,未加入Nivolumab患者和健康供者CD19-CAR-T细胞收获后培养48 h时,细胞增殖率分别为(104.84±13.05)%、(106.43±15.72)%。
图1. 不同浓度Nivolumab对PD-1高表达患者CD19嵌合抗原受体T细胞(CD19-CAR-T细胞)增殖的影响(共5份标本,每组设3个复孔,实验重复3次).

3.Nivolumab联合CD19-CAR-T细胞对Pfeiffer细胞体外杀伤活性的影响:分别比较各组效靶细胞共培养0、24、48 h时对Pfeiffer细胞的杀伤率,PD-1高表达患者CD19-CAR-T+72 µg/ml Nivolumab培养48 h时,杀伤率为(71.61±9.50)%;患者T细胞+72 µg/ml Nivolumab培养48 h时,杀伤率为(15.33±4.11)%;单用患者CD19-CAR-T细胞培养48 h时,杀伤率为(6.77±1.26)%;正常人CD19-CAR-T细胞培养48 h时,杀伤率为(79.73±11.01)%。共培养0 h时差异无统计学意义(F=0.811,P=0.512),共培养24、48 h时差异均有统计学意义(F值分别为51.808、28.245,P值均<0.001)。行两两比较,患者CD19-CAR-T细胞+72 µg/ml Nivolumab联合应用与正常人CD19-CAR-T细胞对Pfeiffer细胞的杀伤率在24、48 h时差异均无统计学意义(P值分别为0.347、0.417),联合应用在24、48 h时对Pfeiffer细胞的杀伤率均高于单用患者CD19-CAR-T细胞(P值均<0.001),亦均优于患者T细胞+72 µg/ml Nivolumab(P值均<0.001)(图2)。
图2. 72 µg/ml Nivolumab联合PD-1高表达患者CD19嵌合抗原受体T细胞(CD19-CAR-T细胞)对Pfeiffer细胞杀伤活性的影响(共5份标本,每组设3个复孔,实验重复3次).

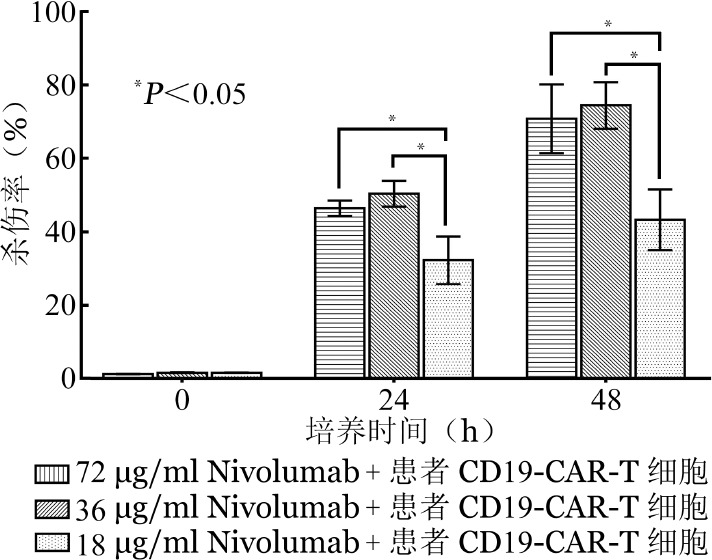
4.联合不同剂量的Nivolumab对Pfeiffer细胞体外杀伤活性的影响:PD-1高表达患者CD19-CAR-T细胞+终浓度分别为72、36、18 µg/ml Nivolumab三组分别比较效靶细胞共培养0、24、48 h时其对Pfeiffer细胞的杀伤率,共培养48 h时,杀伤率分别为(71.61±9.50)%、(75.28±6.41)%、(43.74±8.35)%。共培养0 h时差异无统计学意义(F=0.211,P=0.814),共培养24、48 h时差异均有统计学意义(F值分别为43.059、53.902,P值均<0.001)。行两两比较,患者CD19-CAR-T细胞+72 µg/ml Nivolumab与患者CD19-CAR-T细胞+36 µg/ml Nivolumab联合应用对Pfeiffer细胞的杀伤率在24、48 h时差异均无统计学意义(P值分别为0.281、0.267),二者均高于患者CD19-CAR-T细胞+18 µg/ml Nivolumab(P值均<0.001)(图3)。
图3. 不同浓度Nivolumab联合PD-1高表达患者CD19嵌合抗原受体T细胞(CD19-CAR-T细胞)对Pfeiffer细胞杀伤活性的影响(共5份标本,每组设3个复孔,实验重复3次).
5.Nivolumab对CD19-CAR-T细胞炎症因子分泌水平的影响:PD-1高表达T细胞来源CD19-CAR-T体外培养第8天加入不同浓度Nivolumab,与不加入Nivolumab的患者和正常人CD19-CAR-T相比,共培养0、24、48 h时IFN-γ、TNF-α水平差异均无统计学意义(P值均>0.05)。PD-1高表达患者CD19-CAR-T细胞加入终浓度分别为72、36、18 µg/ml的Nivolumab培养48 h时,IFN-γ水平分别为(247.33±33.25)、(269±28.25)、(273±36.79)pg/ml,TNF-α的分泌水平分别为(656.33±35.23)、(676.67±50.27)、(664.12±82.65)pg/ml,未加入Nivolumab患者和健康供者CD19-CAR-T细胞收获后培养48 h时,IFN-γ水平分别为(256.33±39.24)、(281.67±28.00)pg/ml,TNF-α水平分别为(656.67±44.11)、(660.00±33.11)pg/ml(图4)。
图4. 不同浓度Nivolumab对PD-1高表达患者CD19嵌合抗原受体T细胞(CD19-CAR-T细胞)炎症因子IFN-γ(A)、TNF-α(B)分泌水平的影响(共5份标本,每组设3个复孔,实验重复3次).
讨论
针对于包括淋巴瘤、多发性骨髓瘤(MM)等恶性肿瘤患者PD-1高表达的T细胞,PD-1抑制剂疗效显著[6]–[8],但很快肿瘤复燃,大多数患者无法长期受益[9]。CAR-T细胞作为目前免疫治疗的另一个热门领域,在B细胞恶性肿瘤的治疗上亦获得了令人鼓舞的临床疗效[10]–[13]。在肿瘤的微环境中,肿瘤细胞能够表达PD-L1,与T细胞表面的免疫卡控点PD-1结合后能通过对其的抑制性作用而促进肿瘤的免疫逃逸,并阻止T细胞进入肿瘤区域或诱导进入肿瘤区域的T细胞凋亡,进而削弱其治疗潜能[14]–[15]。本研究我们尝试将抗PD-1抑制剂Nivolumab与CAR-T细胞治疗结合起来,探索进一步提高疗效的可能性。
本研究结果显示Nivolumab不影响CD19-CAR-T细胞的增殖,其联合患者CD19-CAR-T细胞对淋巴瘤细胞株Pfeiffer细胞的杀伤率明显高于Nivolumab或单用患者CD19-CAR-T细胞,提示Nivolumab能显著增强CAR-T细胞对肿瘤细胞的杀伤活性,这与Cherkassky等[16]、Suarez等[17]在胸膜间皮瘤、肾细胞癌方面的研究结论一致。Chong等[18]报道1例CAR-T细胞治疗失败的复发难治弥漫大B细胞淋巴瘤患者,应用PD-1抑制剂Pembrolizumab取得了较好的疗效,提示PD-1通路可能在CAR-T细胞免疫治疗中起关键作用。我们收集PD-1高表达的患者T细胞,作为本实验CAR-T细胞培养的T细胞来源,与健康供者T细胞来源CD19-CAR-T细胞相比,T细胞的PD-1高表达并不影响其转染率。有动物实验报道CAR-T细胞与PD-1抑制剂联合使用可提高CAR-T细胞疗效,其方法为CAR-T细胞输注后给予一次PD-1抑制剂[19],本研究结果与之一致。
PD-1抑制剂虽取得了肯定的临床疗效,但作用难以持久,毒副作用也限制其应用,且对于何时停药仍无定论,我们为了减轻PD-1抑制剂联合CD19-CAR-T细胞治疗的毒副作用,将PD-1高表达患者来源CD19-CAR-T细胞分别联合终浓度为72、36、18 µg/ml的Nivolumab,其中CD19-CAR-T+36 µg/ml Nivolumab与CD19-CAR-T细胞+72 µg/ml Nivolumab以及健康供者来源CD19-CAR-T比较,杀伤率差异无统计学意义。CD19-CAR-T+18 µg/ml Nivolumab组的杀伤活性低于36 µg/ml Nivolumab组,提示36 µg/ml Nivolumab联合CD19-CAR-T细胞治疗,可在减少Nivolumab毒副作用同时保证治疗效果,提高了治疗安全性,但如果进一步降低Nivolumab剂量可能无法保证治疗效果。
另外,CAR-T细胞释放的炎症因子对于CAR-T细胞在体内发挥清除肿瘤细胞的能力尤为重要[20]。为了评估应用Nivolumab后对CAR-T细胞活化的影响,我们检测了炎症因子IFN-γ和TNF-α水平,结果提示不同剂量Nivolumab联合CD19-CAR-T细胞不影响CD19-CAR-T细胞的炎症因子分泌,有良好的效果和安全性。
Funding Statement
基金项目:天津市卫生局科技基金(15KG135);天津市卫计委重点攻关项目(16KG110);天津市应用基础与前沿技术研究计划(15JCQNJC45500)
Fund progran: Science and Technology Fund of Tianjin Municipal Health Bureau (15KG135); Key Projects of Tianjin Municipal Health Planing Commission (16KG110); and Frontier Technology Research Project(15JCQNJC45500)
References
- 1.John LB, Kershaw MH, Darcy PK. Blockade of PD-1 immunosuppression boosts CAR T-cell therapy[J] Oncoimmunology. 2013;2(10):e26286. doi: 10.4161/onci.26286. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Madorsky Rowdo FP, Baron A, Urrutia M, et al. Immunotherapy in Cancer: A Combat between Tumors and the Immune System; You Win Some, You Lose Some[J] Front Immunol. 2015;6:127. doi: 10.3389/fimmu.2015.00127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Taube JM, Anders RA, Young GD, et al. Colocalization of inflammatory response with B7-h1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape[J] Sci Transl Med. 2012;4(127):127ra37. doi: 10.1126/scitranslmed.3003689. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Giri A, Walia SS, Gajra A. Clinical Trials Investigating Immune Checkpoint Inhibitors in Non-Small-Cell Lung Cancer[J] Rev Recent Clin Trials. 2016;11(4):297–305. doi: 10.2174/1574887111666160724181330. [DOI] [PubMed] [Google Scholar]
- 5.de Guillebon E, Roussille P, Frouin E, et al. Anti program death-1/anti program death-ligand 1 in digestive cancers[J] World J Gastrointest Oncol. 2015;7(8):95–101. doi: 10.4251/wjgo.v7.i8.95. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Younes A, Santoro A, Shipp M, et al. Nivolumab for classical Hodgkin's lymphoma after failure of both autologous stem-cell transplantation and brentuximab vedotin: a multicentre, multicohort, single-arm phase 2 trial[J] Lancet Oncol. 2016;17(9):1283–1294. doi: 10.1016/S1470-2045(16)30167-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Armand P, Shipp MA, Ribrag V, et al. Programmed death-1 blockade with pembrolizumab in patients with classical Hodgkin lymphoma after brentuximab vedotin failure[J] J Clin Oncol. 2016;34(31):3733–3739. doi: 10.1200/JCO.2016.67.3467. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kwong YL, Chan TSY, Tan D, et al. PD1 blockade with pembrolizumab is highly effective in relapsed or refractory NK/T-cell lymphoma failing l-asparaginase[J] Blood. 2017;129(17):2437–2442. doi: 10.1182/blood-2016-12-756841. [DOI] [PubMed] [Google Scholar]
- 9.Huang AC, Postow MA, Orlowski RJ, et al. T-cell invigoration to tumour burden ratio associated with anti-PD-1 response[J] Nature. 2017;545(7652):60–65. doi: 10.1038/nature22079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Brentjens RJ, Rivière I, Park JH, et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias[J] Blood. 2011;118(18):4817–4828. doi: 10.1182/blood-2011-04-348540. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Maus MV, Grupp SA, Porter DL, et al. Antibody-modified T cells: CARs take the front seat for hematologic malignancies[J] Blood. 2014;123(17):2625–2635. doi: 10.1182/blood-2013-11-492231. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Maude SL, Frey N, Shaw PA, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia[J] N Engl J Med. 2014;371(16):1507–1517. doi: 10.1056/NEJMoa1407222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Garfall AL, Maus MV, Hwang WT, et al. Chimeric Antigen Receptor T Cells against CD19 for Multiple Myeloma[J] N Engl J Med. 2015;373(11):1040–1047. doi: 10.1056/NEJMoa1504542. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Davila ML, Riviere I, Wang X, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J] Sci Transl Med. 2014;6(224):224 ra25. doi: 10.1126/scitranslmed.3008226. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Jaspers JE, Brentjens RJ. Development of CAR T cells designed to improve antitumor efficacy and safety[J] Pharmacol Ther. 2017;178:83–91. doi: 10.1016/j.pharmthera.2017.03.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Brudno JN, Kochenderfer JN. Toxicities of chimeric antigen receptor T cells: recognition and management[J] Blood. 2016;127(26):3321–3330. doi: 10.1182/blood-2016-04-703751. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Frey NV, Luger SM. How I treat adults with relapsed or refractory Philadelphia chromosome-negative acute lymphoblastic leukemia[J] Blood. 2015;126(5):589–596. doi: 10.1182/blood-2014-09-551937. [DOI] [PubMed] [Google Scholar]
- 18.Chong EA, Melenhorst JJ, Lacey SF, et al. PD-1 blockade modulates chimeric antigen receptor (CAR) -modified T cells: refueling the CAR[J] Blood. 2017;129(8):1039–1041. doi: 10.1182/blood-2016-09-738245. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Cherkassky L, Morello A, Villena-Vargas J, et al. Human CAR T cells with cell-intrinsic PD-1 checkpoint blockade resist tumor-mediated inhibition[J] J Clin Invest. 2016;126(8):3130–3144. doi: 10.1172/JCI83092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cruz CR, Micklethwaite KP, Savoldo B, et al. Infusion of donor-derived CD19-redirected virus-specific T cells for B-cell malignancies relapsed after allogeneic stem cell transplant: a phase 1 study[J] Blood. 2013;122(17):2965–2973. doi: 10.1182/blood-2013-06-506741. [DOI] [PMC free article] [PubMed] [Google Scholar]



