Abstract
目的
探讨血小板计数水平在成人慢性原发免疫性血小板减少症(ITP)患者利妥昔单抗疗效预测中的价值。
方法
回顾性分析2011年1月1日至2014年12月31日期间接受利妥昔单抗治疗(100 mg每周1次,连用4次)慢性ITP患者的临床资料,计算利妥昔单抗治疗后不同随访时间截点血小板计数预测疗效的敏感性、特异性和阳性预测值、阴性预测值,并通过ROC曲线下面积得出最佳截断点。
结果
103例患者纳入研究,男46例,女57例,中位年龄30(18~67)岁。首剂利妥昔单抗后第1、5、7天,成功组(治疗后PLT≥50×109/L且未接受其他药物治疗)与无效组(治疗后PLT<50×109/L)中位血小板计数差异均无统计学意义(P>0.05);利妥昔单抗治疗后第14天,成功组中位血小板计数高于无效组[41(8~384)×109/L对23(0~106)×109/L,P=0.003];在随后的各随访截点,成功组中位血小板计数进一步回升并维持于正常水平,无效组中位血小板计数均低于正常水平。以ROC曲线获得的预测治疗反应的优化界限值血小板计数50×109/L为基础,首剂妥昔单抗治疗后第14、30、60天血小板计数能够组成一个预后评估体系。
结论
利妥昔单抗治疗后第14、30、60天血小板计数能够组成一个疗效预测评估体系,有助于随访和制定治疗计划。
Keywords: 血小板减少, 利妥昔单抗, 血小板计数
Abstract
Objective
To investigate the value of platelet count in predicting the efficacy of rituximab treatment in chronic primary immune thrombocytopenia (ITP).
Methods
A retrospective study was conducted in 103 chronic ITP patients hospitalized in our medical center between January 2011 and December 2014. The sensitivity, specificity, positive predictive value (PPV), negative predictive value (NPV) of platelet count in different time points were analyzed for the predictor of treatment response. Optimal cutoff values were established using ROC analysis.
Results
A total of 103 patients were included in the study. There were 46 males and 57 females, with a median age of 30 (18–67) years. At day 1, 3 and 7 after the first dose of rituximab, there was no significant difference in platelet counts between the success group (PLT≥50×109/L after treatment) and the failure group (PLT≤50×109/L after treatment) (P>0.05). At day 14 after rituximab treatment (PTD 14), platelet counts became significantly different in the success and failure groups[41(8–384)×109/L vs 23(0–106)×109/L, P=0.003], and remained different thereafter, with increasing significance in the subsequent follow-ups. Patients were divided further using an optimal cut-off platelet count of 50×109/L on PTD 14, PTD 30, and PTD 60, and PPV and NPV values were calculated for predicting eventual success and failure.
Conclusion
Response can be predicted by obtaining platelet counts at 14, 30 and 60 days after rituximab treatment. The study proposed a protocol that guides patient monitoring and management planning.
Keywords: Thrombocytopenia, rituximab, Platelet count
原发免疫性血小板减少症(ITP)是由于患者对自身血小板抗原免疫失耐受而导致免疫介导的血小板破坏增多和巨核细胞血小板生成不足,进而出现外周血小板减少的一种出血性疾病[1]。近年来研究发现,B细胞亚群和B细胞稳态失衡导致针对血小板膜糖蛋白的致病性抗体的形成,促进了单核-巨噬细胞系统在脾脏和肝脏破坏血小板,抑制巨核细胞成熟参与了ITP的发生[2]–[3]。因此,针对B细胞的靶向治疗药物利妥昔单抗已广泛应用于ITP的治疗,治疗反应率达60%,但仍有约40%患者无效或复发[4]。ITP是一种异质性很强的自身免疫性疾病,多种异常免疫因素参与了ITP的发生和发展,B细胞异常是否ITP发生的主要原因决定了利妥昔单抗是否获得治疗反应[5]。鉴于利妥昔单抗治疗费用较高,建立利妥昔单抗疗效的早期预测体系能够有效降低患者的经济负担并合理制定下一步治疗计划。血小板计数是直观和简便地反映治疗效果的临床指标之一,本研究利用诊断实验方法建立利妥昔单抗疗效的早期预测体系。
病例与方法
1.病例:2011年1月1日至2014年12月31日就诊于我院的103例慢性ITP患者纳入本研究,男46例,女57例,中位年龄30(18~67)岁,诊断符合文献[6]标准。患者在接受利妥昔单抗治疗前均再次进行诊断评估(骨髓细胞形态学与病理检查、流式细胞术、染色体核型分析、血液肿瘤相关融合基因、自身抗体谱、病毒学等检查)。本研究经医院伦理委员会批准,患者均知情同意。
2.免疫组化染色检测骨髓CD41+巨核细胞:常规进行骨髓涂片(约2.5 cm × 3.0 cm),然后进行常规瑞特-吉姆萨染色和SAP染色,光镜下计数CD41+巨核细胞。
3.治疗方案:利妥昔单抗100 mg静脉滴注每周1次,连用4次。利妥昔单抗治疗前30 min给予甲泼尼龙40 mg静脉滴注,以预防相关不良反应。利妥昔单抗100 mg加入100 ml生理盐水中,滴注速度为50 mg/h。出现不良反应时减慢或停止给药并给予相应处理。利妥昔单抗开始滴注后给予持续心电监护24 h,监测血压和心率的变化。PLT≤10×109/L或有明显出血倾向者,利妥昔单抗治疗前予以血小板悬液输注。
4.疗效判定标准及随访:为判断利妥昔单抗疗效,所有入组患者在利妥昔单抗治疗完成后均随访2年。参照文献[6]标准,将利妥昔单抗治疗后PLT≥50×109/L且未接受其他治疗定义为治疗成功,PLT<50×109/L定义为治疗无效。长期反应:利妥昔单抗治疗结束且未加用其他治疗的情况下2个月血小板计数持续≥50 ×109/L以上且无活动性出血。首剂利妥昔单抗后第1、3、5、7、14、30、60、90、180、270、360天门诊复查血小板计数。以PLT<50×109/L为随访终点。中位随访时间185(0~1 440)d。
5.统计学处理:应用SPSS 21.0软件进行数据分析,计量资料比较采用秩和检验,计数资料比较采用卡方检验,多因素分析采用非条件Logistic回归分析。诊断实验采用描绘受试者工作特征(ROC)曲线,并确定ROC曲线下方面积。绘制Kaplan-Meier生存曲线,各组生存曲线比较应用Log-rank检验。P<0.05为差异有统计学意义。
结果
1.一般资料、诊断情况及疗效分组:本研究纳入103例慢性ITP患者,治疗成功组39例(37.9%),治疗无效组64例。成功组中位病程为24(12~360)个月,无效组为21(12~120)个月。成功组初诊骨髓CD41+巨核细胞计数高于无效组(P<0.001),其他指标比较差异均无统计学意义,详见表1。
表1. 103例慢性原发免疫性血小板减少症患者的基本临床资料.
| 指标 | 无效组(64例) | 成功组(39例) | 统计量 | P值 |
| 中位年龄[岁,M(范围)] | 32(18~67) | 30(19~62) | −1.560(z值) | 0.117 |
| 性别[例(%)] | 0.057(χ2值) | 0.812 | ||
| 男 | 28(43.8) | 18(46.2) | ||
| 女 | 36(56.2) | 21(53.8) | ||
| 病程[月,M(范围)] | 24(12~360) | 21(12~120) | −1.295(z值) | 0.195 |
| 初诊PLT[×109/L,M(范围)] | 12.5(1~70) | 7(0~51) | 1.193(t值) | 0.236 |
| 基线PLT[×109/L,M(范围)] | 9(2~211) | 10(0~173) | −0.706(t值) | 0.482 |
| 用药史[例(%)] | 1.432(z值) | 0.489 | ||
| 一线(糖皮质激素、静脉丙种球蛋白) | 32(50.0) | 24(61.5) | ||
| 二线(rhTPO、环孢素A、达那唑、长春新碱) | 8(12.5) | 3(7.7) | ||
| 多药联合 | 24(37.5) | 12(30.8) | ||
| 初诊骨髓CD41+巨核细胞计数[个,M(范围)] | 136(0~1 816) | 544(62~2 304) | 4.599(z值) | <0.001 |
| 血小板自身抗体[例(%)] | 5.260(z值) | 0.154 | ||
| ⅡbⅢa | 19(29.7) | 18(46.2) | ||
| ⅠbⅨ | 1(1.6) | 3(7.7) | ||
| ⅠaⅡa | 4(6.2) | 2(10.3) | ||
| 阴性 | 43(64.2) | 20(46.5) |
2.慢性ITP患者利妥昔单抗治疗无效的的多因素分析:将相关临床指标(性别、年龄>40岁、病程>2年、初诊PLT<10×109/L、是否联合用药、血小板自身抗体是否阳性、骨髓CD41+巨核细胞计数<150个)进行多因素Logistic回归分析,结果显示骨髓CD41+巨核细胞<150个[P=0.003,OR=5.253(95%CI 1.784~15.471)]是利妥昔单抗治疗无效的独立危险因素。
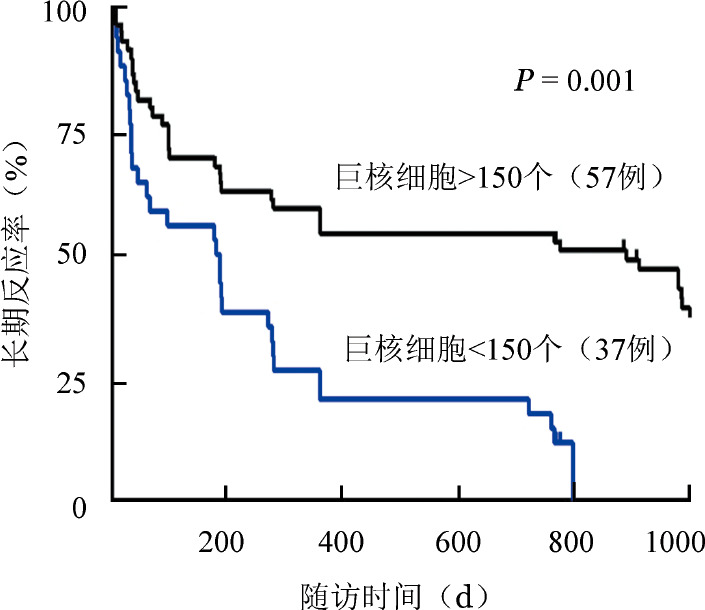
3.初诊骨髓CD41+巨核细胞计数对利妥昔单抗长期反应率的影响:将患者按照初诊骨髓CD41+巨核细胞计数分为<150个、≥150个两组。巨核细胞<150个、>150个组1年长期反应率分别为17.5%(7/40)、50.6%(31/63)(P=0.001),提示骨髓巨核细胞计数与长期反应率显著相关(图1)。
图1. 骨髓巨核细胞计数对慢性原发免疫性血小板减少症患者利妥昔单抗长期反应率的影响.
4.首剂利妥昔单抗治疗后各随访间截点血小板计数变化:首剂利妥昔单抗治疗后第1、5、7天,成功组与无效组中位血小板计数差异均无统计学意义。首剂利妥昔单抗治疗后第3天,成功组中位血小板计数低于无效组[23(1~211)×109/L对41(5~562)×109/L,z=−2.362,P=0.020],可能与无效组患者接受血小板输注以及使用静脉丙种球蛋白(IVIG)有关。利妥昔单抗治疗后第14天,成功组中位血小板计数高于无效组,在随后的各随访截点,成功组中位血小板计数进一步回升并维持正常水平,无效组中位血小板计数则持续低于正常水平,两组比较差异均有统计学意义(P<0.001)。详见表2。
表2. 慢性原发免疫性血小板减少症患者首剂利妥昔单抗治疗后不同随访截点血小板计数[×109/L,M(范围)].
| 组别 | 首剂利妥昔单抗治疗后时间(d) |
|||||||||||
| 1 | 3 | 5 | 7 | 14 | 21 | 30 | 60 | 90 | 180 | 270 | 360 | |
| 成功组 | 22 | 23 | 37 | 44 | 41 | 46 | 58 | 112 | 121 | 124 | 133 | 124 |
| (0~391) | (1~211) | (5~380) | (2~223) | (8~384) | (5~321) | (6~274) | (8~283) | (4~254) | (3~280) | (34~234) | (8~283) | |
| 无效组 | 20 | 41 | 29 | 29 | 23 | 21 | 24 | 20 | 19 | 17 | 16.5 | 17 |
| (2~197) | (5~562) | (1~185) | (1~270) | (0~106) | (3~323) | (2~128) | (0~97) | (0~90) | (2~123) | (0~243) | (2~213) | |
| z值 | −1.214 | −2.362 | −1.660 | −1.846 | −2.989 | −2.813 | −4.050 | −7.104 | −7.457 | −7.815 | −8.155 | −7.795 |
| P值 | 0.225 | 0.020 | 0.097 | 0.065 | 0.003 | 0.005 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
5.不同随访时间点血小板计数预测利妥昔单抗治疗慢性ITP疗效的敏感度、特异度、阳性预测值及阴性预测值:通过对不同随访时间点血小板计数的ROC曲线分析,血小板计数的理想截断点为50×109/L,首剂利妥昔单抗治疗后第14天,ROC曲线下方面积(AUCROC)为0.676(95% CI 0.568~0.784,P=0.003),预测慢性ITP患者利妥昔单抗最终疗效的敏感度、特异度分别为48.7%、87.5%。随着随访时间的推移,血小板计数的预测准确性也越来越高,利妥昔单抗治疗后第30、60天的AUCROC分别为0.739(95%CI 0.640~0.837,P<0.001)和0.918(95%CI 0.855~0.982,P<0.001)(图2)。以血小板计数50×109/L为理想截断点,每个随访时间的血小板计数的敏感度、特异度、阳性预测值(PPV)和阴性预测值(NPV)见表3。
图2. 首剂利妥昔单抗治疗后第14、30、60天预测疗效的ROC曲线.
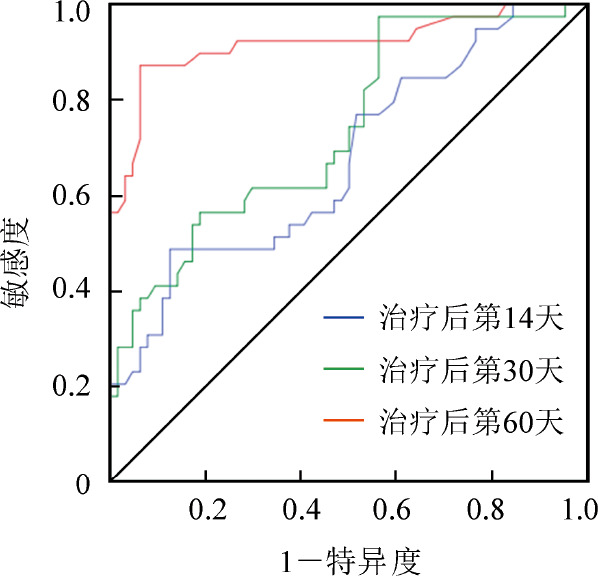
表3. 慢性原发免疫性血小板减少症患者首剂利妥昔单抗治疗后不同随访截点的敏感度、特异度、阳性预测值和阳性预测值.
| 指标 | 首剂利妥昔单抗治疗后时间(d) |
|||||||||||
| 1 | 3 | 5 | 7 | 14 | 21 | 30 | 60 | 90 | 180 | 270 | 360 | |
| 敏感度 | 0.359 | 0.462 | 0.410 | 0.436 | 0.487 | 0.487 | 0.564 | 0.872 | 0.923 | 0.949 | 0.949 | 0.940 |
| 特异度 | 0.828 | 0.750 | 0.734 | 0.564 | 0.875 | 0.781 | 0.812 | 0.937 | 0.937 | 0.953 | 0.969 | 0.970 |
| PPV(%) | 68.2 | 65.9 | 60.7 | 50.0 | 51.3 | 69.0 | 70.4 | 89.4 | 93.6 | 95.2 | 96.8 | 96.9 |
| NPV(%) | 58.2 | 58.2 | 55.4 | 50.0 | 96.5 | 60.4 | 74.7 | 92.3 | 92.4 | 94.9 | 95.0 | 94.1 |
注:PPV:阳性预测值;NPV:阴性预测值。以血小板计数50×109/L为预测疗效的最佳界值
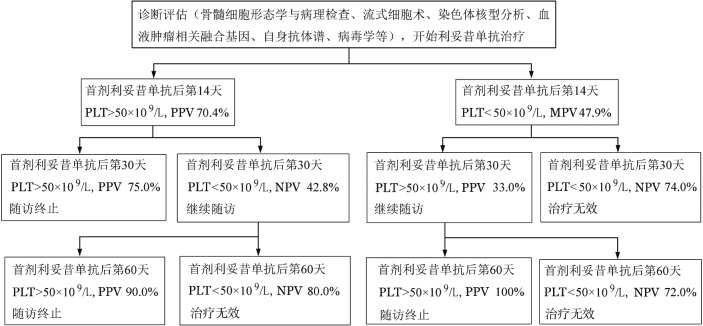
6.联合不同随访截点血小板计数预测利妥昔单抗治疗慢性ITP疗效:基于每个随访截点的AUCROC值以及早期预测的便利性同时避免早期其他治疗方案影响血小板水平而带来的统计误差,以血小板计数50×109为预测截断点,首剂利妥昔单抗治疗后第14、30、60天的血小板计数可构成一个临床实用的疗效评估体系(图3)。当利妥昔单抗治疗后第14天PLT>50×109/L且第30天血小板计数仍>50×109/L、PPV 75.0%,可考虑停止随访。首剂利妥昔单抗治疗后第30天PLT<50×109/L、NPV 42.8%者应继续随访;第60天PLT>50×109/L、PPV90.0%者可终止随访,PLT<50×109/L、NPV 80.0%者提示治疗无效。如果首剂利妥昔单抗治疗后第14天患者PLT<50×109/L且第30天仍<50×109/L、NPV为74.0%提示治疗无效。如果第30天PLT>50×109/L、PPV为33.0%,需要继续随访。首剂利妥昔单抗后第60天如PLT>50×109/L、PPV为100%可考虑终止随访,PLT<50×109/L、NPV100%提示治疗无效。
图3. 利妥昔单抗治疗慢性原发免疫性血小板减少症的疗效预测体系.
PPV:阳性预测值;NPV:阴性预测值
讨论
利妥昔单抗的应用使ITP治疗进入了靶向治疗的新时代[7]。2011年美国血液学协会ITP国际工作组发表的诊治指南将疗效分为5个等级。然而疗效随访定义的繁琐以及未能明确血小板计数监测的时间截点的意义也降低了该标准的临床实用性[8]。为了简化研究方案、避免混杂因素,结合国外相关研究标准,本研究将PLT>50×109定义治疗成功,103例慢性复发难治性ITP患者的治疗成功率为37.9%,低于文献[9]–[10]报道的国内其他相同剂量利妥昔单抗的疗效,考虑与本组病例病程均大于1年且随访时间较长有关。2008年Godeau等[11]报告了利妥昔单抗治疗慢性ITP多中心前瞻性的单臂研究结果,2年的总反应率(PLT>50×109/L)为33.3%。2012年Patel等[12]回顾分析了糖皮质激素治疗无效ITP患者接受利妥昔单抗治疗的16项单臂试验结果,2年总反应率(PLT>50×109/L)为31%,5年总反应率为21%。2014年Khellaf等[13]报告了利妥昔单抗治疗成人ITP多中心的前瞻性研究结果,2年总反应率(PLT>50×109/L)为39%。2015年Miyakawa等[14]应用利妥昔单抗治疗慢性难治性ITP,6个月总反应率(PLT>50×109/L)为30.8%。2016年,一项来自意大利的回顾性研究[15]显示,利妥昔单抗治疗一线治疗无效慢性ITP患者59个月的CR率为30%。上述结果与本研究结果一致,表明利妥昔单抗可使少数慢性ITP患者获得长期CR。因此,寻找简便而实用的利妥昔单抗治疗慢性ITP疗效的预测方法十分重要。
Bussel等[16]研究发现,女性患者和病程<24个月与利妥昔单抗联合地塞米松治疗的长期CR率相关。但是,目前仍缺少明确的预测利妥昔单抗单药治疗慢性ITP疗效的临床指标。Khellaf等[13]研究发现,病程<1年的ITP患者利妥昔单抗单药治疗更易维持长期CR。2016年,Marangon等[15]研究了影响利妥昔单抗单药治疗慢性ITP疗效的临床因素,发现年龄<40岁、女性患者更容易获得长期CR。然而,本研究并未发现年龄、性别、病程以及其他临床指标与利妥昔单抗疗效相关,这可能与治疗不规范、多种药物联用、过度使用免疫抑制剂有关。
本研究中,我们首次发现骨髓巨核细胞计数<150个是利妥昔单抗治疗无效的独立危险因素。2015年,一项来自日本的多中心临床研究发现对血小板生成素受体激动剂(TPORA)反应不佳的患者对利妥昔单抗的治疗反应较差[14],提示利妥昔单抗不能使巨核细胞质和量异常为主要发病因素的患者获得较好的治疗反应。因此,患者在利妥昔单抗治疗前应该进行巨核细胞计数检查,巨核细胞较少的患者应慎重选择利妥昔单抗。同时,ITP患者如何优化TPORA治疗方案值得进一步研究。
目前,血小板计数仍是疗效判断最直观和简便的临床指标。本研究发现治疗成功组与失无效组血小板恢复趋势存在显著的区别。在接受利妥昔单抗治疗的第一周,两组患者中位血小板计数均缓慢回升,成功组和无效组患者中位血小板计数分别在第3天和第7天到达第一次的峰值,这与早期部分出血倾向严重的患者输注血小板以及接受IVIG输注有关。随后成功组中位血小板计数开始下降,在第7天达谷值。此后成功组血小板计数又开始回升第14天达第二个峰值,第60天趋于CR,与文献[17]–[18]报道的ITP患者接受利妥昔单抗治疗后血小板恢复分为快速起效和迟发起效类似。
本研究中,首剂利妥昔单抗治疗后第14天,两组患者血小板计数比较开始出现统计学意义。随着时间的推移,虽然通过每个血小板计数的敏感性和AUCROC值,不同随访截点血小板计数治疗预后准确性逐步增加,但是以某一点的血小板计数来预测最终的疗效仍然存在误差。因此,为了准确预测基于血小板计数评估的患者最终疗效,我们提出建立随访评估体系来增加预测的精准度和减少随访时间。例如,当患者利妥昔单抗治疗后第14和30天血小板计数均<50×109时,治疗可能无效(NPV 74.0%),此时应考虑更换其他治疗方案。而当患者利妥昔单抗治疗后第14和30天PLT>50×109/L时,治疗可能成功(PPV 75.0%),可减少随访次数。
鉴于多数患者在入院时伴有严重的血小板减少和较高的出血风险,在治疗早期大部分患者接受了IVIG、糖皮质激素及血小板输注治疗,从而对血小板计数水平造成影响。为了早期预测疗效且避免其他治疗影响疗效判断,利用ROC曲线分析,我们认为首剂利妥昔单抗治疗后第14、30、60天血小板计数具有疗效预测价值。基于上述结果,我们选择利用首剂利妥昔单抗治疗后第14、30、60天血小板水平构成疗效预测体系。
综上所述,本研究结果显示,利妥昔单抗可使部分慢性ITP患者获得长期缓解,骨髓巨核细胞计数<150个的患者应慎重选择利妥昔单抗治疗,首剂利妥昔单抗治疗后14、30、60天血小板计数构成的疗效预测体系有助于随访和治疗计划的制订。
Funding Statement
基金项目:国际自然科学基金(81470286、81670118)
Fund program: National Natural Science Foundatin of China(81470286,81670118)
References
- 1.Rodeghiero F, Stasi R, Gernsheimer T, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group[J] Blood. 2009;113(11):2386–2393. doi: 10.1182/blood-2008-07-162503. [DOI] [PubMed] [Google Scholar]
- 2.Chen JF, Yang LH, Chang LX, et al. The clinical significance of circulating B cells secreting anti-glycoprotein IIb/IIIa antibody and platelet glycoprotein IIb/IIIa in patients with primary immune thrombocytopenia[J] Hematology. 2012;17(5):283–290. doi: 10.1179/1607845412Y.0000000014. [DOI] [PubMed] [Google Scholar]
- 3.Li X, Zhong H, Bao W, et al. Defective regulatory B-cell compartment in patients with immune thrombocytopenia[J] Blood. 2012;120(16):3318–3325. doi: 10.1182/blood-2012-05-432575. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Arnold DM, Dentali F, Crowther MA, et al. Systematic review: efficacy and safety of rituximab for adults with idiopathic thrombocytopenic purpura[J] Ann Intern Med. 2007;146(1):25–33. doi: 10.7326/0003-4819-146-1-200701020-00006. [DOI] [PubMed] [Google Scholar]
- 5.Godeau B. B-cell depletion in immune thrombocytopenia[J] Semin Hematol. 2013;50 Suppl 1:S75–82. doi: 10.1053/j.seminhematol.2013.03.014. [DOI] [PubMed] [Google Scholar]
- 6.中华医学会血液学分会止血与血栓学组. 成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版)[J] 中华血液学杂志. 2016;37(2):89–93. doi: 10.3760/cma.j.issn.0253-2727.2016.02.001. [DOI] [Google Scholar]
- 7.British Committee for Standards in Haematology General Haematology Task Force. Guidelines for the investigation and management of idiopathic thrombocytopenic purpura in adults, children and in pregnancy[J] Br J Haematol. 2003;120(4):574–596. doi: 10.1046/j.1365-2141.2003.04131.x. [DOI] [PubMed] [Google Scholar]
- 8.Neunert C, Lim W, Crowther M, et al. The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia[J] Blood. 2011;117(16):4190–4207. doi: 10.1182/blood-2010-08-302984. [DOI] [PubMed] [Google Scholar]
- 9.隋 涛, 张 磊, 周 泽平, et al. 两种小剂量利妥昔单抗治疗方案治疗原发免疫性血小板减少症疗效比较[J] 中华血液学杂志. 2011;32(9):583–586. doi: 10.3760/cma.j.issn.0253-2727.2011.09.002. [DOI] [Google Scholar]
- 10.隋 涛, 薛 峰, 赵 海丰, et al. 小剂量利妥昔单抗治疗慢性特发性血小板减少性紫癜疗效分析[J] 中华血液学杂志. 2010;31(3):161–163. doi: 10.3760/cma.j.issn.0253-2727.2010.03.006. [DOI] [PubMed] [Google Scholar]
- 11.Godeau B, Porcher R, Fain O, et al. Rituximab efficacy and safety in adult splenectomy candidates with chronic immune thrombocytopenic purpura: results of a prospective multicenter phase 2 study[J] Blood. 2008;112(4):999–1004. doi: 10.1182/blood-2008-01-131029. [DOI] [PubMed] [Google Scholar]
- 12.Patel VL, Mahévas M, Lee SY, et al. Outcomes 5 years after response to rituximab therapy in children and adults with immune thrombocytopenia[J] Blood. 2012;119(25):5989–5995. doi: 10.1182/blood-2011-11-393975. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Khellaf M, Charles-Nelson A, Fain O, et al. Safety and efficacy of rituximab in adult immune thrombocytopenia: results from a prospective registry including 248 patients[J] Blood. 2014;124(22):3228–3236. doi: 10.1182/blood-2014-06-582346. [DOI] [PubMed] [Google Scholar]
- 14.Miyakawa Y, Katsutani S, Yano T, et al. Efficacy and safety of rituximab in Japanese patients with relapsed chronic immune thrombocytopenia refractory to conventional therapy[J] Int J Hematol. 2015;102(6):654–661. doi: 10.1007/s12185-015-1887-9. [DOI] [PubMed] [Google Scholar]
- 15.Marangon M, Vianelli N, Palandri F, et al. Rituximab in immune thrombocytopenia: gender, age, and response as predictors of long-term response[J] Eur J Haematol. 2017;98(4):371–377. doi: 10.1111/ejh.12839. [DOI] [PubMed] [Google Scholar]
- 16.Bussel JB, Lee CS, Seery C, et al. Rituximab and three dexamethasone cycles provide responses similar to splenectomy in women and those with immune thrombocytopenia of less than two years duration[J] Haematologica. 2014;99(7):1264–1271. doi: 10.3324/haematol.2013.103291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Provan D, Butler T, Evangelista ML, et al. Activity and safety profile of low-dose rituximab for the treatment of autoimmune cytopenias in adults[J] Haematologica. 2007;92(12):1695–1698. doi: 10.3324/haematol.11709. [DOI] [PubMed] [Google Scholar]
- 18.Braendstrup P, Bjerrum OW, Nielsen OJ, et al. Rituximab chimeric anti-CD20 monoclonal antibody treatment for adult refractory idiopathic thrombocytopenic purpura[J] Am J Hematol. 2005;78(4):275–280. doi: 10.1002/ajh.20276. [DOI] [PubMed] [Google Scholar]