Abstract
目的
比较IPI、美国国家综合癌症网络IPI(NCCN-IPI)及年龄调整的IPI(aa-IPI)三种预后分层模型在弥漫大B细胞淋巴瘤(DLBCL)患者中的预后分层能力。
方法
回顾性分析2003年1月至2012年12月311例初治DLBCL患者资料,根据治疗方案将患者分为CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)方案及利妥昔单抗(R)-CHOP方案组,分别采用IPI、NCCN-IPI及aa-IPI对DLBCL患者进行危险度分层。采用Harrell's C统计评价不同模型的预后分层能力。
结果
①311例患者中接受CHOP方案治疗者128例,接受R-CHOP方案治疗者183例。②CHOP方案组患者的5年总生存(OS)率结果显示,aa-IPI(71.0%对25.0%,P<0.001)、NCCN-IPI(59.7%对26.8%,P<0.001)和IPI(47.6%对36.6%,P=0.003)均能区分中低危和中高危组患者,但前两者区分效果似乎更佳;而R-CHOP方案组,NCCN-IPI拥有更好的预后分层能力,其低危、中低危、中高危患者的5年OS率分别为96.0%、83.0%、66.5%(P=0.009)。③Harrell's C分析结果显示,IPI、NCCN-IPI及aa-IPI预测接受CHOP方案者OS的一致性指数(C-index)分别为0.546、0.667、0.698;预测接受R-CHOP方案者OS的C-index分别为0.611、0.654、0.695。④在≤60岁患者中,IPI、NCCN-IPI、aa-IPI预测接受CHOP方案者OS的C-index分别为0.534、0.675、0.698;预测接受R-CHOP方案者OS的C-index分别为0.584、0.648、0.695。
结论
NCCN-IPI对于接受利妥昔单抗联合化疗的DLBCL患者有较好的预后分层能力,而aa-IPI对于较年轻的DLBCL患者预后分层能力可能更佳。
Keywords: 淋巴瘤,大B细胞,弥漫性, 预后指数, 预后
Abstract
Objective
To explore the prognostic value of the international prognostic index (IPI), the national comprehensive cancer network IPI (NCCN-IPI) and the age-adjusted IPI (aa-IPI) in diffuse large B cell lymphoma.
Methods
A total of 311 patients with de novo diffuse large B-cell lymphoma (DLBCL) diagnosed from 2003 to 2012 in Nanfang hospital were included. All patients were divided into CHOP (cyclophosphamide, vincristine, doxorubicin, and prednisone) and R-CHOP (rituximab, CHOP) groups. Survival analysis was compared among IPI, NCCN-IPI and aa-IPI models. Discrimination of three different prognostic models was assessed using the Harrell's C statistic.
Results
A total of 311 patients were analyzed. Among them, 128 patients were treated with CHOP regimen and other 183 patients were treated with R-CHOP regimen. In CHOP groups, both NCCN-IPI (5-year OS: 59.7% vs 26.8%, P<0.001) and aa-IPI (5-year OS: 71.0% vs 25.0%, P<0.001) showed better risk stratification for low-intermediate and high-intermediate group than the IPI (5-year OS: 47.6% vs 36.6%, P=0.003). However, in the patients treated with R-CHOP, NCCN-IPI showed better risk stratification in low, low-intermediate, high-intermediate groups (5-year OS: 96.0% vs 83.0% vs 66.5%, P=0.009). According to the Harrell's C statistic, C-index of IPI, NCCN-IPI and aa-IPI for overall survival (OS) were 0.546, 0.667, 0.698 in CHOP group and 0.611,0.654, 0.695 in R-CHOP group respectively. In patients younger than 60 years old, C-index of IPI, NCCN-IPI and aa-IPI for OS were 0.534, 0.675, 0.698 in CHOP group and 0.584, 0.648, 0.695 in R-CHOP respectively.
Conclusion
The NCCN-IPI is more powerful than IPI and aa-IPI in DLBCL patients receiving R-CHOP. aa-IPI is a preferable model in predicting prognosis than IPI and NCCN-IPI in anthracycline-based chemotherapy without rituximab.
Keywords: Lymphoma, large B-cell, diffuse; Prognostic index; Prognosis
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)中最常见的亚型[1]。我国DLBCL的发病率较国外更高,约占NHL的45.8%,占所有淋巴瘤的40.1%[2]。利妥昔单抗联合化疗的广泛应用在显著改善DLBCL预后的同时,也影响了DLBCL的预后分层指标[3]–[6]。IPI作为DLBCL最常用的预后分层指标,在利妥昔单抗时代,其甄别危险分层的能力明显受限[7]。为此在IPI的基础上,逐渐发展出年龄调整的IPI(Age adjusted IPI,aa-IPI)和美国国家综合癌症网络IPI(National comprehensive cancer network-IPI,NCCN-IPI)用于DLBCL的预后分层。然而对于IPI、aa-IPI和NCCN-IPI三种预后分层模型哪种更适合于我国DLBCL患者尚无报道。在本研究中我们回顾性分析了本院收治的311例初治DLBCL患者的临床资料,评价IPI、aa-IPI及NCCN-IPI的预后分层能力。
病例与方法
1.病例:本研究纳入2003年1月至2012年12月本院诊治的311例初发DLBCL患者,所有患者均经淋巴结或淋巴结外侵犯部位病理组织活检确诊为DLBCL,并依据WHO 2008年淋巴造血系统肿瘤分类标准进行诊断[8],排除HIV感染、特殊类型的DLBCL(包括原发纵隔、中枢神经系统、血管内或睾丸淋巴瘤)、转化的NHL及移植后淋巴细胞增殖性疾病等。
2.方法:收集患者的年龄、性别、生化指标、病理组织学特征、免疫组化、影像学及骨髓检查等资料。根据患者接受的治疗方案分为CHOP和R-CHOP方案组。所有患者均接受6~8个疗程化疗。CHOP方案具体为:环磷酰胺750 mg/m2,第1天;多柔比星40~50 mg/m2或吡柔比星40~50 mg/m2或脂质体多柔比星25~30 mg/m2,第1天;长春新碱1.4 mg/m2(最大剂量2 mg)或长春地辛2.8 mg/m2,第1天;泼尼松100 mg/m2,第1~5天。R-CHOP方案是在CHOP方案基础上联合利妥昔单抗(375 mg/m2,第0天)。
3.预后分层模型:临床分期参照Ann Arbor分期标准[9]。所有患者分别采用IPI、NCCN-IPI、aa-IPI对预后进行判断[10]–[11],其评分下的危险分层详见表1。
表1. IPI、美国国家综合癌症网络IPI(NCCN-IPI)及年龄调整的IPI(aa-IPI)评分下的危险分层.
| 组别 | IPI评分 | NCCN-IPI评分 | aa-IPI评分 |
| 低危组 | 0~1分 | 0~1分 | 0分 |
| 中危组 | 2分 | 2~3分 | 1分 |
| 中高危组 | 3分 | 4~5分 | 2分 |
| 高危组 | 4~5分 | 6~8分 | 3分 |
4.统计学处理:应用SPSS17.0软件进行统计学分析。非正态分布计量资料用中位数表示,组间比较采用Mann-Whitney U检验。生存分析采用Kaplan-Meier曲线法,生存率的比较采用Log-rank检验;总生存(OS)期定义为确诊日至患者死亡或末次随访的间隔时间。无事件生存(EFS)期定义为确诊日至疾病进展、复发、死亡或末次随访的间隔时间。采用Harrell's C统计评价模型的预后分层能力。以P<0.05(双侧)为差异有统计学意义。
结果
1.临床特征:311例患者中,男199例,女112例,男女比例1.77∶1,中位年龄49(13~81)岁。≤60岁者241例(77.5%);Ann Arbor分期Ⅲ~Ⅳ期者191例(61.4%);LDH升高者161例(51.8%);ECOG评分≥2分者94例(30.2%);结外累及>1处者151例(48.6%)。性别、年龄、Ann Arbor分期、ECOG评分、LDH水平及结外累及数在CHOP组及R-CHOP组差异均无统计学意义(P值均>0.05)(表2)。
表2. 311例初治弥漫大B淋巴瘤患者的临床特征[例(%)].
| 临床特征 | 总体(311例) | CHOP组(128例) | R-CHOP组(183例) | Z值 | P值 |
| 性别 | −1.415 | 0.157 | |||
| 男 | 199(64.0) | 76(59.4) | 123(67.2) | ||
| 女 | 112(36.0) | 52(40.6) | 60(33.8) | ||
| 年龄(岁) | −0.499 | 0.618 | |||
| ≤60 | 241(77.5) | 101(78.9) | 140(76.5) | ||
| >60 | 70(22.5) | 27(21.1) | 43(23.5) | ||
| Ann Arbor分期 | −1.799 | 0.072 | |||
| Ⅰ~Ⅱ | 120(38.6) | 57(44.5) | 63(34.4) | ||
| Ⅲ~Ⅳ | 191(61.4) | 71(55.5) | 120(65.6) | ||
| LDH比值 | −0.061 | 0.952 | |||
| ≤1 | 150(48.2) | 62(48.4) | 88(48.1) | ||
| >1 | 161(51.8) | 66(51.6) | 95(51.9) | ||
| ECOG评分 | −0.203 | 0.863 | |||
| <2 | 217(69.8) | 90(70.3) | 127(69.4) | ||
| ≥2 | 94(30.2) | 38(29.7) | 56(30.6) | ||
| 结外累及数 | −1.117 | 0.264 | |||
| <2 | 160(51.4) | 61(47.7) | 99(54.1) | ||
| ≥2 | 151(48.6) | 67(52.3) | 84(45.9) | ||
| IPI评分 | −0.622 | 0.534 | |||
| 低危 | 94(30.2) | 41(32.0) | 53(29.0) | ||
| 中低危 | 96(30.9) | 42(32.8) | 54(29.5) | ||
| 中高危 | 74(23.8) | 23(18.0) | 51(27.9) | ||
| 高危 | 47(15.1) | 22(17.2) | 15(13.7) | ||
| NCCN-IPI评分 | −0.757 | 0.449 | |||
| 低危 | 55(17.7) | 24(18.8) | 31(16.9) | ||
| 中低危 | 139(44.7) | 59(46.1) | 80(43.7) | ||
| 中高危 | 106(34.1) | 41(32.0) | 65(35.5) | ||
| 高危 | 11(3.5) | 4(3.1) | 7(3.8) | ||
| aa-IPI评分 | −1.407 | 0.159 | |||
| 低危 | 52(21.6) | 25(24.8) | 27(19.3) | ||
| 中低危 | 72(29.9) | 34(33.7) | 28(27.1) | ||
| 中高危 | 82(34.9) | 27(26.7) | 55(39.3) | ||
| 高危 | 35(14.5) | 15(14.9) | 20(14.3) |
注:ECOG评分:美国东部肿瘤协作组体力状态评分;NCCN-IPI:美国国家癌症网络IPI;aa-IPI:年龄调整的IPI;CHOP方案:环磷酰胺+多柔比星+长春新碱+泼尼松;R-CHOP方案:利妥昔单抗+CHOP方案
2.治疗与疗效:在311例患者中,128例接受CHOP治疗、183例接受R-CHOP治疗。R-CHOP组中13例患者接受了造血干细胞移植一线巩固治疗。CHOP组和R-CHOP组患者的5年OS率(54.3%对79.3%,χ2=21.604,P<0.001)及EFS率(44.7%对66.9%,χ2=15.105,P<0.001)差异有统计学意义。
3.不同预后分层模型的患者分布:在CHOP、R-CHOP组患者中,根据IPI、NCCN-IPI、aa-IPI评分各危险组患者的分布差异均未见统计学意义(P值均>0.05)(表2)。
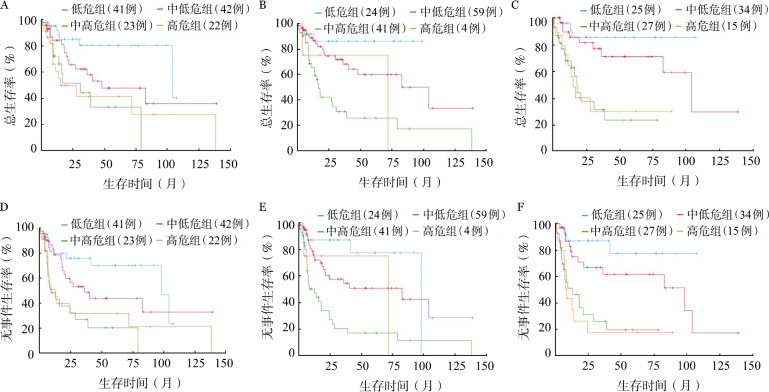
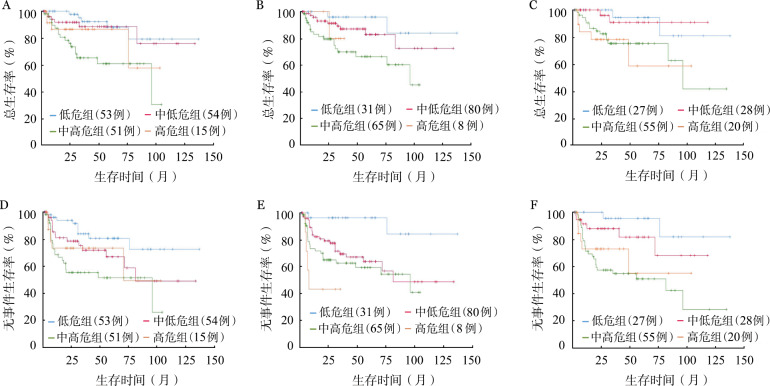
4.预后分析:CHOP方案组患者的5年OS率统计结果显示,aa-IPI(71.0%对25.0%,P<0.001)、NCCN-IPI(59.7%对26.8%,P<0.001)和IPI(0.47.6%对36.6%,P=0.003)均能较好地区分中低危和中高危组患者,但前两者区分效果似乎更佳(图1)。在R-CHOP方案组中,NCCN-IPI较IPI、aa-IPI拥有更好的预后分层能力,其低危组、中低危组、中高危组患者的5年OS率分别为96.0%、83.0%、66.5%(P=0.009)(图2)。
图1. 接受CHOP方案治疗患者不同预后分层模型危险分层后的总生存(A~C)和无事件生存(D~F)曲线.
IPI评分(A、D);美国国家癌症网络IPI评分(B、E);年龄调整的IPI评分(C、F)
图2. 接受R-CHOP方案治疗患者不同预后分层模型危险分层后的总生存(A~C)和无事件生存(D~F)曲线.
IPI评分(A、D);美国国家癌症网络IPI评分(B、E);年龄调整的IPI评分(C、F)
5.不同模型的预后分层能力比较:Harrell's C分析结果显示,在所有患者中,无论是接受CHOP方案还是接受R-CHOP方案,NCCN-IPI预测OS、EFS的一致性指数(C-index)均高于IPI(表3)。在≤60岁患者中,针对接受CHOP方案者,IPI、NCCN-IPI、aa-IPI预测OS的C-index分别为0.534、0.675、0.698,预测EFS的C-index分别为0.678、0.557、0.704;针对接受R-CHOP方案者,预测OS的C-index分别为0.584、0.648、0.695,预测EFS的C-index分别为0.570、667、0.664;aa-IPI的危险评估能力可能较IPI、NCCN-IPI更佳。
表3. 不同预后模型根据Harrell's C统计的生存预测比较.
| 预后模型 | CHOP方案 |
R-CHOP方案 |
||||
| C-index | 95%CI | P值 | C-index | 95%CI | P值 | |
| 总生存 | ||||||
| IPI评分 | 0.546 | 0.457~0.635 | <0.001 | 0.611 | 0.506~0.716 | <0.001 |
| NCCN-IPI评分 | 0.667 | 0.582~0.752 | <0.001 | 0.654 | 0.552~0.755 | <0.001 |
| aa-IPI | 0.698 | 0.598~0.798 | <0.001 | 0.695 | 0.572~0.817 | <0.001 |
| 无事件生存 | ||||||
| IPI评分 | 0.564 | 0.486~0.643 | <0.001 | 0.573 | 0.495~0.652 | <0.001 |
| NCCN-IPI评分 | 0.667 | 0.591~0.742 | <0.001 | 0.648 | 0.572~0.724 | <0.001 |
| aa-IPI评分 | 0.704 | 0.615~0.793 | <0.001 | 0.664 | 0.572~0.756 | <0.001 |
注:C-index:一致性指数;NCCN-IPI:美国国家癌症网络IPI;aa-IPI:年龄调整的IPI;CHOP方案:环磷酰胺+多柔比星+长春新碱+泼尼松;R-CHOP方案:利妥昔单抗+CHOP方案
讨论
利妥昔单抗联合化疗的广泛应用对IPI在DLBCL中的预后分层能力提出了极大的挑战,为此先后发展出aa-IPI及NCCN-IPI。但是目前国内尚无关于三者在DLBCL中预后分析能力的评价。
自1993年正式提出以来,IPI广泛应用于评价DLBCL的危险分层已有20余年。其通过年龄、LDH、ECOG评分、Ann Arbor分期、结外累及数目5个指标将患者分为低危、中低危、中高危及高危4个危险组,5年OS率分别为84.5%、70.1%、53.1%和64.2%[10]。在本研究中我们采用IPI分层方法对R-CHOP方案组患者的预后情况进行分析,低危组与中低危组、中高危组与高危组的5年OS率差异无统计学意义,与Ngo等[12]的研究结果一致。提示利妥昔单抗时代,IPI并不足以将预后不同的DLBCL区分开来。
针对≤60岁的年轻患者,欧美工作组同时还提出了aa-IPI评分系统[10],仅纳入LDH、ECOG评分、Ann Arbor分期三个因素进行危险分层。我们根据aa-IPI评分系统对接受CHOP方案治疗的患者进行危险分层,低危、中低危、中高危及高危患者的5年OS率分别为85.3%、71.0%、25.0%和30.0%,与上述结果大致相同。国内目前尚无aa-IPI评分用于DLBCL预后分层的报道。我们的研究结果显示,对于接受CHOP方案治疗的DLBCL患者,aa-IPI能够很好地区分低危、中低危及中高危患者,结果与Ngo等[12]的报道相似。Harrell's C统计显示,针对接受CHOP方案者,aa-IPI预后分层能力优于IPI及NCCN-IPI,与生存分析结果一致。GELA和MInT试验均证实利妥昔单抗可明显改善老年和年轻低危患者的预后。对于接受R-CHOP方案者,尽管Harrell's C统计显示aa-IPI的危险评估能力可能较IPI、NCCN-IPI更佳,但根据aa-IPI评分的低危、中低危、中高危及高危患者的5年OS率分别为94.1%、88.2%、76.7%和58.5%,提示利妥昔单抗的应用使aa-IPI对危险分层的甄别能力受限。
Zhou等[11]于2014年在原有IPI的基础上,进一步改进提出NCCN-IPI模型,其特点为:①年龄细化。研究显示随着年龄的增长,DLBCL基因变异(例如:MYC、Bcl-2、Bcl-6等)也随之累积。Zhou等[11]的研究数据显示年龄与生存呈一定的线性关系,且以年龄≤40岁为基线,15~20岁为增幅拟合的模型最佳。②LDH标准化。仅将LDH分为正常及升高,无法精确反映患者的肿瘤负荷。有研究结果显示LDH升高倍数与生存明显相关[13]。③结外部位具体化,主要包括骨髓、中枢神经系统、胃肠道及肺等重要器官对生存影响较大。在本研究中我们采用NCCN-IPI评分,各危险组患者的分布比例为17.7%、44.7%、34.1%、3.5%。R-CHOP方案治疗组中,基于NCCN-IPI划分的低危、中低危及中高危组患者5年OS率分别为92.0%、85.0%、67.0%(高危组因例数过少难以得出结果),与Zhou等[11]报道的研究结果相似。
Harrell's C统计由Harrell等[14]于1982年提出,用于有删失情况下比例风险回归模型的风险预测能力评价。该值范围由0到1,其值越大说明模型的预测能力越强。该方法自提出以来,在肿瘤预后、基因等领域被广泛应用[15]–[16]。Harrell's C统计中C-index 0.50~0.70为较低准确度,0.71~0.90为中等准确度,高于0.9为高准确度。本研究中我们使用Harrell's C统计进一步评价IPI、NCCN-IPI、aa-IPI在DLBCL中预后分层能力,尽管在CHOP及R-CHOP方案组NCCN-IPI、IPI的C-index基本均低于0.70,准确度较低,但两组NCCN-IPI及aa-IPI预测OS及EFS的C-index均明显高于IPI,其结果与生存分析结果一致。
综上,NCCN-IPI对于接受利妥昔单抗联合化疗的DLBCL患者具有更好的预后分层能力,而对于单纯化疗的较年轻DLBCL患者,aa-IPI的预后分层能力更佳。但是我们必须注意到,不同IPI分层仅仅基于不同临床特征来评价患者的预后,并不能反应DLBCL的分子生物学特征[12]。综合宿主、肿瘤分子生物学特性及其治疗反应等多种综合指标才能更好的对DLBCL进行预后分层。年轻高危的患者目前尚无标准治疗方案,如何精准地识别这部分群体是指导治疗方案选择的关键。
Funding Statement
基金项目:国家自然科学基金(81600165、81670183)
Fund program: National Natural Science Foundation of China (81600165, 81670183)
References
- 1.Sehn LH, Gascoyne RD. Diff use large B-cell lymphoma: optimizing outcome in the context of clinical and biologic heterogeneity[J] Blood. 2015;125(1):22–32. doi: 10.1182/blood-2014-05-577189. [DOI] [PubMed] [Google Scholar]
- 2.李 小秋, 李 甘地, 高 子芬, et al. 中国淋巴瘤亚型分布:国内多中心性病例10002例分析[J] 诊断学理论与实践. 2012;(2):111–115. doi: 10.3969/j.issn.1671-2870.2012.02.006. [DOI] [Google Scholar]
- 3.Coiffier B, Thieblemont C, Van Den Neste E, et al. Long-term outcome of patients in the LNH-98.5 trial, the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: a study by the Groupe d'Etudes des Lymphomes de l'Adulte[J] Blood. 2010;116(12):2040–2045. doi: 10.1182/blood-2010-03-276246. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Seki R, Ohshima K, Nagafuji K, et al. Rituximab in combination with CHOP chemotherapy for the treatment of diffuse large B cell lymphoma in Japan: a retrospective analysis of 1,057 cases from Kyushu Lymphoma Study Group[J] Int J Hematol. 2010;91(2):258–266. doi: 10.1007/s12185-009-0475-2. [DOI] [PubMed] [Google Scholar]
- 5.Coiffier B, Lepage E, Briere J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma[J] N Engl J Med. 2002;346(4):235–242. doi: 10.1056/NEJMoa011795. [DOI] [PubMed] [Google Scholar]
- 6.Pfreundschuh M, Kuhnt E, Trümper L, et al. CHOP-like chemotherapy with or without rituximab in young patients with good-prognosis diffuse large-B-cell lymphoma: 6-year results of an open-label randomised study of the MabThera International Trial (MInT) Group[J] Lancet Oncol. 2011;12(11):1013–1022. doi: 10.1016/S1470-2045(11)70235-2. [DOI] [PubMed] [Google Scholar]
- 7.Ziepert M, Hasenclever D, Kuhnt E, et al. Standard International prognostic index remains a valid predictor of outcome for patients with aggressive CD20+ B-cell lymphoma in the rituximab era[J] J Clin Oncol. 2010;28(14):2373–2380. doi: 10.1200/JCO.2009.26.2493. [DOI] [PubMed] [Google Scholar]
- 8.Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes[J] Blood. 2009;114(5):937–951. doi: 10.1182/blood-2009-03-209262. [DOI] [PubMed] [Google Scholar]
- 9.Carbone PP, Kaplan HS, Musshoff K, et al. Report of the committee on Hodgkin's disease staging classification[J] Cancer Res. 1971;31(11):1860–1861. [PubMed] [Google Scholar]
- 10.A predictive model for aggressive non-Hodgkin's lymphoma[J] N Engl J Med. 1993;329(14):987–994. doi: 10.1056/NEJM199309303291402. [DOI] [PubMed] [Google Scholar]
- 11.Zhou Z, Sehn LH, Rademaker AW, et al. An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era[J] Blood. 2014;123(6):837–842. doi: 10.1182/blood-2013-09-524108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Ngo L, Hee SW, Lim LC, et al. Prognostic factors in patients with diffuse large B cell lymphoma: Before and after the introduction of rituximab[J] Leuk Lymphoma. 2008;49(3):462–469. doi: 10.1080/10428190701809156. [DOI] [PubMed] [Google Scholar]
- 13.Gordon LI, Andersen J, Colgan J, et al. Advanced diffuse non-Hodgkin's lymphoma. Analysis of prognostic factors by the international index and by lactic dehydrogenase in an intergroup study[J] Cancer. 1995;75(3):865–873. doi: 10.1002/1097-0142(19950201)75:3<865::aid-cncr2820750319>3.0.co;2-z. [DOI] [PubMed] [Google Scholar]
- 14.Harrell FE, Califf RM, Pryor DB, et al. Evaluating the yield of medical tests[J] JAMA. 1982;247(18):2543–2546. [PubMed] [Google Scholar]
- 15.Bollen L, van der Linden YM, Pondaag W, et al. Prognostic factors associated with survival in patients with symptomatic spinal bone metastases: a retrospective cohort study of 1,043 patients[J] Neuro Oncol. 2014;16(7):991–998. doi: 10.1093/neuonc/not318. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Xiao W, Liu S, Tian Y, et al. Prognostic significance of tumor volume in locally recurrent nasopharyngeal carcinoma treated with salvage intensity-modulated radiotherapy[J] PLoS One. 2015;10(4):e0125351. doi: 10.1371/journal.pone.0125351. [DOI] [PMC free article] [PubMed] [Google Scholar]